Priorix Trockensubstanz C Solv Fertigspritzen 10 Stück buy online
Priorix Trockensub c Solv Fertspr 10 Stk
-
380.19 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: GLAXO SMITHKLINE AG
- Product Code: 2114191
- ATC-code J07BD52
- EAN 7680006150027
Ingredients:
Aminosäuren, Mannitol, Masern-Mumps-Röteln-Lebendimpfstoff, Masern-Lebend-Impfstoff , Mumps-Lebend-Impfstoff , Röteln-Lebend-Impfstoff (HDC-Zellen), Stamm Wistar RA 27/3 min. 10^3 , Sorbitol, Trockensubstanz, Lösungsmittel, Neomycin sulfat, Masern-Viren min. 10^3, Mumps-Viren min. 10^3.7, Lactose.

Variants
Description
Zusammensetzung
Wirkstoffe
Schwarz-Masernvirus-, RIT 4385 Mumpsvirus- und Wistar RA 27/3 Rötelnvirusstamm.
Hilfsstoffe
Pulver: Lactose, Sorbitol, Mannitol, Aminosäuren.
Rückstände aus dem Herstellungsprozess: Spuren von Neomycinsulfat.
Lösungsmittel: Aqua ad iniectabilia.
Darreichungsform und Wirkstoffmenge pro Einheit
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung.
Nach Rekonstitution enthält eine Impfdosis (0,5 ml) als Immunogene:
Schwarz-Masernvirusstamm* mind. 103.0 TCID50
RIT 4385 Mumpsvirusstamm* mind. 103.7 TCID50
Wistar RA 27/3 Rötelnvirusstamm** mind. 103.0 TCID50
* hergestellt in embryonalen Hühnerzellen
** hergestellt in humanen diploiden (MRC-5) Zellen
Das Pulver ist weiss bis leicht pinkfarbig. Das Lösungsmittel ist klar und farblos.
Indikationen/Anwendungsmöglichkeiten
Priorix ist indiziert zur aktiven Immunisierung von Kindern ab 12 Monaten und Erwachsenen gegen Masern, Mumps und Röteln.
Gemäss offiziellem Schweizerischem Impfplan wird die erste Impfung mit Priorix im Alter von 12 Monaten empfohlen. Eine MMR-Impfung im Alter von 9-11 Monaten ist in gewissen Fällen bei Säuglingen mit einem erhöhten Risiko einer Masernerkrankung in Betracht zu ziehen. Es ist dann jedoch zu berücksichtigen, dass Säuglinge im ersten Lebensjahr wegen möglichen Interferenzen mit den mütterlichen Antikörpern möglicherweise nicht genügend auf die Bestandteile des Impfstoffes (Masern, Mumps) ansprechen.
Wenn eine epidemiologische Situation die Impfung im ersten Lebensjahr notwendig macht, wird eine zweite Dosis Priorix vorzugsweise 3 Monate nach der ersten Dosis empfohlen.
Die Impfung mit Priorix wird ebenfalls für beruflich exponierte Personen, welche diese Infektionen auf Schwangere und andere Risikopatienten übertragen können (z.B. in Frauenspitälern, Kinderkliniken etc.), empfohlen.
Priorix sollte gemäss den offiziellen Impfempfehlungen angewendet werden.
Dosierung/Anwendung
Übliche Dosierung
Die empfohlene Dosis für Erwachsene und Kinder beträgt 0,5 ml.
Gemäss dem Impfplan für routinemässige Schutzimpfungen wird die erste Impfung mit Priorix im Alter von 12 Monaten empfohlen.
Um den individuellen Schutz zu verbessern, wird die Verabreichung einer 2. Dosis im Alter von 15-24 Monaten (1. Impfung mit 12 Monaten) empfohlen. Die 2. Dosis kann ab einem Monat nach der 1. Dosis verabreicht werden.
Eine Nachholimpfung kann generell in jedem Alter durchgeführt werden.
Art der Anwendung
Priorix wird subkutan injiziert, kann aber auch intramuskulär in die Deltoid-Region des Oberarms oder in den anterolateralen Bereich des Oberschenkels injiziert werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei Personen mit Blutungsstörungen (z.B. Thrombozytopenie oder Blutgerinnungsstörung) soll der Impfstoff subkutan verabreicht werden.
Hinweise zur Rekonstitution des Impfstoffes vor der Anwendung, siehe «Sonstige Hinweise».
Kontraindikationen
Priorix ist kontraindiziert bei bekannter Überempfindlichkeit gegenüber einem der Bestandteile des Impfstoffes oder Neomycin. Eine früher durch Neomycin hervorgerufene Kontaktdermatitis stellt keine Kontraindikation dar. Zu Hühnereiweissallergie siehe «Warnhinweise und Vorsichtsmassnahmen».
Priorix ist kontraindiziert bei Personen, die nach einer früheren Verabreichung von Masern-, Mumps- und/oder Röteln-Impfstoffen Zeichen einer Überempfindlichkeit zeigten.
Wie bei allen anderen Impfstoffen sollte auch bei Priorix die Impfung im Falle einer akuten und mit hohem Fieber einhergehenden Erkrankung auf einen späteren Zeitpunkt verschoben werden. Leichte Infekte stellen hingegen keine Kontraindikation für die Impfung dar.
Priorix ist bei schwangeren Frauen kontraindiziert. Eine Schwangerschaft sollte zudem für 3 Monate nach der Impfung ausgeschlossen werden (siehe «Schwangerschaft/Stillzeit»).
Priorix sollte Personen mit geschwächtem Immunsystem nicht verabreicht werden, miteingeschlossen sind Patienten mit primärer oder sekundärer Immundefizienz. Bei HIV-infizierten Kindern liegt es im Ermessen des behandelnden Arztes, eine MMR-Impfung durchzuführen.
Warnhinweise und Vorsichtsmassnahmen
Priorix darf unter keinen Umständen intravasal injiziert werden!
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmassen begleitet sein. Es ist wichtig, Massnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Wie bei allen injizierbaren Impfstoffen sollte für den Fall einer anaphylaktischen Reaktion nach der Impfung immer eine angemessene medizinische Behandlung zur Verfügung stehen (z.B. Adrenalin-Lösung 1/1000).
Alkohol sowie andere Desinfektionsmittel müssen auf der Haut vor der Injektion vollständig verdunstet sein, da sonst die abgeschwächten Viren im Impfstoff inaktiviert werden.
Die Immunantwort von Kindern kann im ersten Lebensjahr wegen einer möglichen Interferenz mit maternalen Antikörpern nicht ausreichend sein. Wenn eine epidemiologische Situation die Impfung im ersten Lebensjahr notwendig macht, wird eine zweite Dosis Priorix vorzugsweise 3 Monate nach der ersten Dosis empfohlen. Auf keinen Fall sollte der Abstand zwischen den Dosen jedoch weniger als 4 Wochen betragen.
Die Masern- und Mumpskomponenten des Impfstoffs werden in Kulturen embryonaler Hühnerzellen gezüchtet und können daher Spuren von Hühnereiweiss enthalten. Bei Personen mit anaphylaktischen, anaphylaktoiden oder anderen Reaktionen vom Soforttyp (z.B. generalisierte Urtikaria, Schwellung des Mundes und Rachens, Atembeschwerden, Hypotonie oder Schock) nach Verzehr von Eiern ist das Risiko für eine Überempfindlichkeitsreaktion vom Soforttyp nach der Impfung erhöht, obwohl diese Reaktionen nur sehr selten beobachtet wurden. Personen, die schon einmal eine anaphylaktische Reaktion nach dem Verzehr von Eiern gezeigt haben, sollten mit äusserster Vorsicht geimpft werden. Für den Fall einer anaphylaktischen Reaktion sollten geeignete Behandlungsmassnahmen zur Verfügung stehen.
Priorix sollte bei Personen mit einer Vorgeschichte von Allergien und Krämpfen oder bei solchen mit einer positiven Familienanamnese mit Vorsicht angewendet werden.
Bei Personen mit zerebralen Erkrankungen, Neigungen zu Fieberkrämpfen oder Krampfanfällen in der Familienanamnese sollte eine Fieberprophylaxe durchgeführt werden.
Es wird wahrscheinlich nur ein beschränkter Schutz gegen Masern erhalten, wenn innerhalb 72 Stunden nach einer natürlichen Masern-Exposition geimpft wird.
Über Übertragungen von Masern und Mumps vom Impfling auf anfällige Personen wurde nie berichtet. Vom Rötelnvirus ist bekannt, dass eine pharyngeale Exkretion ungefähr 7-28 Tage nach der Impfung, mit einer Exkretionsspitze um den 11. Tag, stattfindet. Dennoch gibt es keinen Beweis einer Übertragung von ausgeschiedenen Impfviren auf empfängliche Personen.
Es wurde über Fälle einer Verschlimmerung und das Wiederauftreten einer Thrombozytopenie nach einer Impfung mit Masern-, Mumps- und Röteln-Lebendimpfstoffen bei Personen berichtet, bei denen bereits nach der ersten Dosis eine Thrombozytopenie aufgetreten war. In diesen Fällen wird eine erneute Impfung mit Priorix nicht empfohlen.
Die aus den klinischen Studien vorliegenden Daten zur intramuskulären Injektion von Priorix zeigen, dass die Serokonversionsraten für die drei Antigene (Masern, Mumps und Röteln) gleich denen nach subkutaner Injektion waren. Die Antikörpertiter gegen Mumps und Röteln können dabei vergleichsweise niedriger liegen.
Wie bei jedem Impfstoff kann es sein, dass nicht bei allen Geimpften eine schützende Immunantwort aufgebaut wird.
Interaktionen
Falls ein Tuberkulin-Test durchgeführt werden muss, sollte dieser vor oder gleichzeitig mit der Impfung gemacht werden, da der Masern-Lebendimpfstoff (möglicherweise auch Mumps) wahrscheinlich eine vorübergehende Unterdrückung der Tuberkulin-Hautreaktion bewirkt. Aus diesem Grund sollte nach der Impfung während 4-6 Wochen mit einem Tuberkulin-Test gewartet werden, um keine falsch negativen Resultate zu erhalten.
Studien haben gezeigt, dass Priorix gleichzeitig mit dem Varizellen-Lebendimpfstoff Varilrix® verabreicht werden kann, wenn verschiedene Injektionsstellen benutzt werden.
Priorix kann gleichzeitig mit dem oralen (OPV) und dem inaktivierten Polio-Impfstoff (IPV), dem kombinierten Diphtherie-, Tetanus- und Pertussis-Impfstoff (DTPw/DTPa), dem Td- und Hepatitis-B-Impfstoff und Haemophilus influenzae Typ b (Hib)-Impfstoff verabreicht werden, wenn verschiedene Injektionsstellen benutzt werden.
Priorix kann ebenfalls gleichzeitig mit anderen attenuierten Lebendimpfstoffen wie BCG, Gelbfieber und oralem Typhus-Impfstoff verabreicht werden.
Kann Priorix nicht gleichzeitig mit anderen attenuierten Lebendimpfstoffen verabreicht werden, sollte ein Zeitabstand von mindestens einem Monat zwischen den Impfungen eingehalten werden.
Bei Personen, die humane Gammaglobuline oder eine Bluttransfusion erhalten haben, sollte eine Impfung mit Priorix erst nach 3 Monaten vorgenommen werden, da die Wahrscheinlichkeit eines Impfversagens besteht, verursacht durch passive Erwerbung von Masern-, Mumps- und Röteln-Antikörpern.
Priorix kann als Booster verabreicht werden, wenn vorgängig mit einem anderen Masern-, Mumps- und Röteln-Impfstoff geimpft wurde.
Schwangerschaft/Stillzeit
Schwangerschaft
Die Anwendung von Priorix ist in der Schwangerschaft kontraindiziert. Eine Schwangerschaft sollte zudem für 3 Monate nach der Impfung ausgeschlossen werden.
Tierexperimentelle Studien zur Reproduktionstoxizität wurden nicht durchgeführt.
Stillzeit
Es gibt nur wenige Daten über die Anwendung von Priorix bei stillenden Müttern. Wenn jedoch der Nutzen das Risiko übersteigt, kann geimpft werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Nicht zutreffend.
Unerwünschte Wirkungen
Daten aus klinischen Studien
Die möglicherweise nach der Anwendung eines MMR-Impfstoffes auftretenden Nebenwirkungen entsprechen denen nach alleiniger oder gemeinsamer Gabe der monovalenten Impfstoffe.
Im Rahmen kontrollierter klinischer Studien wurden während eines 42-tägigen Nachbeobachtungszeitraums Anzeichen und Symptome aktiv überwacht. Darüber hinaus wurden die Impflinge gebeten während der Studiendauer alle klinischen Vorkommnisse zu melden.
Das folgende Verträglichkeitsprofil basiert auf Daten von insgesamt ungefähr 12'000 Personen, bei denen Priorix in klinischen Studien verabreicht wurde.
Häufigkeiten werden wie folgt angegeben: «sehr häufig» (≥1/10), «häufig» (<1/10, ≥1/100), «gelegentlich» (<1/100, ≥1/1000), «selten» (<1/1000, ≥1/10'000), «sehr selten» (<1/10'000).
Infektionen und parasitäre Erkrankungen
Häufig: Infektionen der oberen Atemwege.
Gelegentlich: Mittelohrentzündung.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Lymphadenopathie.
Erkrankungen des Immunsystems
Selten: Allergische Reaktionen.
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Appetitlosigkeit.
Psychiatrische Erkrankungen
Häufig: Nervosität.
Gelegentlich: abnormales Schreien, Schlaflosigkeit.
Erkrankungen des Nervensystems
Selten: Fieberkrämpfe.
Augenerkrankungen
Gelegentlich: Konjunktivitis.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Bronchitis, Husten.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Parotisschwellung, Durchfall, Erbrechen.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Hautausschlag.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Rötung an der Injektionsstelle (12,2%), Fieber ≥38 °C (rektal) oder ≥37,5 °C (axillar/oral) (22,7%).
Häufig: Schmerzen und Schwellung an der Injektionsstelle, Fieber >39,5 °C (rektal) oder ≥39,0 °C (axillar/oral).
Normalerweise waren die Frequenzen der unerwünschten Wirkungen ähnlich für die erste und die zweite Impfdosis. Die Ausnahme waren Schmerzen an der Injektionsstelle, die nach der ersten Impfdosis «häufig», und nach der zweiten Impfdosis «sehr häufig» auftraten.
Unerwünschte Wirkungen nach Markteinführung
Nach der Markteinführung wurden über folgende zusätzliche Reaktionen nach einer Priorix-Impfung berichtet:
Infektionen und parasitäre Erkrankungen
Selten: Meningitis, Masern-ähnliches Syndrom, Mumps-ähnliches Syndrom (einschliesslich Orchitis, Epididymitis und Parotitis).
Erkrankungen des Blutes und des Lymphsystems
Selten: Thrombozytopenie, thrombozytopenische Purpura.
Erkrankungen des Immunsystems
Selten: Allergische Reaktionen, einschliesslich anaphylaktische Reaktionen.
Erkrankungen des Nervensystems
Selten: Enzephalitis*, Zerebellitis, Zerebellitis-ähnliche Symptome (einschliesslich vorübergehende Gangstörung und vorübergehende Ataxie), Guillain-Barré-Syndrom, transverse Myelitis, periphere Neuritis.
Gefässerkrankungen
Selten: Vaskulitis (einschliesslich Purpura Schönlein-Henoch und Kawasaki-Syndrom).
Erkrankungen der Haut und des Unterhautzellgewebes
Selten: Erythema multiforme.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Selten: Arthralgie, Arthritis.
* Über Enzephalitis wurde mit einer Frequenz von weniger als 1 von 10 Millionen Dosen berichtet. Das Risiko einer Enzephalitis nach der Verabreichung der Impfung ist viel tiefer als das Risiko einer Enzephalitis nach einer natürlichen Erkrankung (Masern: 1 von 1000 bis 2000 Fälle; Röteln: ungefähr 1 von 6000 Fälle).
Bei unbeabsichtigter intravasaler Gabe können schwere Reaktionen bis zum Schock auftreten. Sofortmassnahmen müssen in Abhängigkeit vom Schweregrad ergriffen werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Über Fälle von Überdosierung (bis zu 2-mal die empfohlene Dosierung) wurde nach der Markteinführung berichtet. Keine unerwünschten Wirkungen wurden mit der Überdosierung in Verbindung gebracht.
Eigenschaften/Wirkungen
ATC-Code
J07BD52
Priorix ist ein Kombinationsimpfstoff und besteht aus einem Lyophilisat von abgeschwächten Schwarz-Masernviren, RIT 4385 Mumpsviren und Rötelnviren des Wistar RA 27/3-Stammes.
Priorix entspricht den Anforderungen der WHO zur Herstellung biologischer Substanzen und denen für lebende Masern-, Mumps- und Röteln-Kombinationsimpfstoffe.
Die Masern- und Mumpsviren werden getrennt auf Hühnerembryonen-Zellkulturen und die Rötelnviren in Kulturen humaner diploider MRC-5 Zellen gezüchtet, extrahiert und gereinigt.
Wirkungsmechanismus
Nicht zutreffend.
Pharmakodynamik
Priorix bewirkt eine aktive Immunisierung gegen Masern, Mumps und Röteln.
In klinischen Studien zeigte Priorix eine hohe Wirksamkeit. Antikörper gegen Masern wurden bei 98,0%, gegen Mumps bei 96,1% und gegen Röteln bei 99,3% der vorgängig seronegativen Impflinge festgestellt.
In einer Vergleichsstudie zeigten 98,7% vorgängig seronegativer Impflinge Antikörper gegen Masern, 95,5% gegen Mumps und 99,5% gegen Röteln bei Erhalt von Priorix im Vergleich zu 96,9% gegen Masern, 96,9% gegen Mumps und 99,5% gegen Röteln bei Erhalt eines anderen auf dem Markt erhältlichen MMR-Kombinationsimpfstoffes.
12 Monate nach der Impfung waren alle Impflinge bezüglich Antikörper gegen Masern und Röteln seropositiv. Mumps-Antikörper waren noch bei 88,4% nachweisbar. Diese Resultate wurden auch bei einem kommerziell erhältlichen Kombinationsimpfstoff beobachtet (87%).
Klinische Wirksamkeit
Siehe unter «Pharmakodynamik».
Pharmakokinetik
Eine Untersuchung der pharmakokinetischen Eigenschaften ist für Impfstoffe nicht erforderlich.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische Daten
Nicht zutreffend.
Sonstige Hinweise
Inkompatibilitäten
Priorix darf nicht mit anderen Impfstoffen in derselben Spritze vermischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (+2 °C-+8 °C), vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahren. Kühlkettenpflichtig. Nicht einfrieren!
Während eines Transportes sollten die Lagerbedingungen berücksichtigt werden, vor allem in heissen Klimazonen.
Hinweise für die Handhabung
Priorix zeigt sich als weissliche bis leicht pinkfarbige Pellets in einer Durchstechflasche. Das sterile Lösungsmittel ist klar und farblos und befindet sich in einer Fertigspritze. Der rekonstituierte Impfstoff kann, in Abhängigkeit kleiner pH-Verschiebungen, in der Farbe von pfirsichfarben zu fuchsienrosa variieren, ohne Einfluss auf die Wirksamkeit.
Das Lösungsmittel und der rekonstituierte Impfstoff sind vor der Rekonstitution bzw. vor der Verabreichung visuell auf Fremdpartikel und/oder Veränderungen des Aussehens zu untersuchen. Falls irgendwelche Veränderungen beobachtet werden, dürfen das Lösungsmittel bzw. der rekonstituierte Impfstoff nicht verwendet werden.
Hinweise für die Rekonstitution des Impfstoffes mit dem in der Fertigspritze befindlichen Lösungsmittel
Priorix wird rekonstituiert, indem der gesamte Inhalt der Fertigspritze mit Lösungsmittel in die Durchstechflasche mit dem Pulver gegeben wird.
Für das Befestigen der Nadel an der Spritze folgen Sie der nachstehenden Anleitung. Allerdings kann sich die mit Priorix mitgelieferte Spritze leicht von der abgebildeten Spritze unterscheiden (d.h. ohne Schraubgewinde). In diesem Fall muss die Nadel ohne zu schrauben angebracht werden.
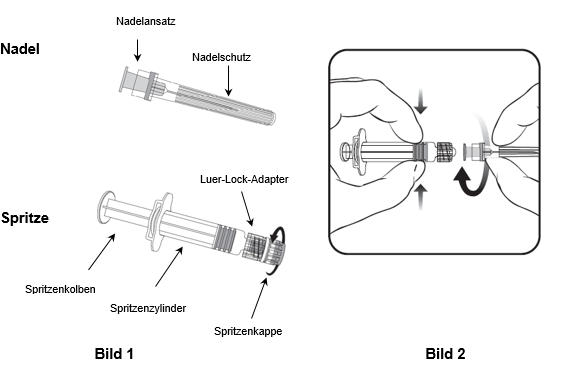
Halten Sie die Spritze immer am Spritzenzylinder fest. Die Spritze nicht am Spritzenkolben oder Luer-Lock-Adapter (LLA) festhalten.
- Halten Sie die Spritze am Spritzenzylinder fest und drehen Sie die Spritzenkappe entgegen dem Uhrzeigersinn ab (wie in Bild 1 gezeigt).
- Um die Nadel an der Spritze anzubringen, führen Sie den Nadelansatz vorsichtig in den LLA und drehen Sie die Nadel im Uhrzeigersinn, bis sie fest sitzt (wie in Bild 2 gezeigt). Achten Sie beim Anbringen darauf, dass sich die Nadel in der Achse der Spritze befindet (wie im Bild 2 gezeigt). Andernfalls könnte sich der LLA verbiegen und undicht werden. Falls sich während des Anbringens der Nadel der LLA löst, ist eine neue Impfstoffdosis (neue Spritze und Durchstechflasche) zu verwenden.
- Entfernen Sie den Nadelschutz, der gelegentlich fest sitzen kann.
- Fügen Sie das Lösungsmittel dem Pulver zu. Schütteln Sie danach die Mischung gründlich, bis sich das Pulver vollständig im Lösungsmittel gelöst hat.
Nach der Rekonstitution sollte der Impfstoff sofort verabreicht werden. - Ziehen Sie den gesamten Inhalt der Durchstechflasche in die Spritze auf.
- Zur Verabreichung des Impfstoffs soll eine neue Nadel verwendet werden. Drehen Sie die Nadel von der Spritze ab und bringen Sie eine Injektionsnadel an, indem Sie Schritt 2 wiederholen.
Nach Rekonstitution sollte der Impfstoff so bald als möglich, aber nicht später als nach 8 Stunden injiziert werden.
Nicht verwendeter Impfstoff und Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Zulassungsnummer
00615 (Swissmedic).
Zulassungsinhaberin
GlaxoSmithKline AG, 3053 Münchenbuchsee.
Stand der Information
Mai 2019.
Composition
Principes actifs
Virus de la rougeole souche Schwarz, virus des oreillons souche RIT 4385 et virus de la rubéole souche Wistar RA 27/3.
Excipients
Poudre: lactose, sorbitol, mannitol, acides aminés.
Résidus provenant du procédé de fabrication: traces de sulfate de néomycine.
Solvant: aqua ad iniectabilia.
Forme pharmaceutique et quantité de principe actif par unité
Poudre et solvant pour la préparation d'une solution injectable.
Après reconstitution, une dose de vaccin (0,5 ml) contient en immunogènes:
virus de la rougeole, souche Schwarz* au minimum 103.0 TCID50
virus des oreillons, souche RIT 4385* au minimum 103.7 TCID50
virus de la rubéole, souche Wistar RA 27/3** au minimum 103.0 TCID50
* produite sur cellules d'embryon de poulet
** produite sur cellules diploïdes humaines (MRC-5)
La poudre est blanche à rose pâle. Le solvant est limpide et incolore.
Indications/Possibilités d’emploi
Priorix est indiqué pour l'immunisation active contre la rougeole, les oreillons et la rubéole chez les enfants à partir de 12 mois et les adultes.
La première vaccination par Priorix est recommandée à l'âge de 12 mois conformément au plan de vaccination suisse officiel. Une vaccination ROR à l'âge de 9-11 mois doit être envisagée dans certains cas chez les nourrissons présentant un risque accru de rougeole. Il faut cependant tenir compte du fait que les nourrissons durant la première année de vie peuvent ne pas répondre suffisamment aux composants du vaccin (rougeole, oreillons) en raison d'éventuelles interférences avec les anticorps maternels.
Lorsqu'une situation épidémiologique requiert la vaccination durant la première année de vie, une deuxième dose de Priorix est recommandée de préférence 3 mois après la première dose.
La vaccination par Priorix est également recommandée chez les personnes exposées professionnellement qui peuvent transmettre ces infections à des femmes enceintes ou à d'autres patients à risques (par exemple dans des maternités, hôpitaux pour enfants, etc.).
Priorix doit être administré selon les recommandations officielles de vaccination.
Posologie/Mode d’emploi
Posologie usuelle
La dose recommandée pour les adultes et les enfants est de 0,5 ml.
La première vaccination par Priorix est recommandée à l'âge de 12 mois conformément au plan de vaccination de routine.
Pour améliorer la protection individuelle, il est recommandé d'administrer une 2ème dose à l'âge de 15-24 mois (1ère vaccination à l'âge de 12 mois). La 2ème dose peut être administrée à partir d'un mois après la 1ère dose.
Une vaccination de rattrapage peut être administrée de façon générale à tout âge.
Mode d'administration
Priorix est à injecter par voie sous-cutanée, mais peut aussi être injecté par voie intramusculaire, dans la région deltoïde de la partie supérieure du bras ou dans la région antérolatérale de la cuisse (voir «Mises en garde et précautions»).
Le vaccin doit être administré par voie sous-cutanée chez les personnes présentant des troubles hémorragiques (par ex. une thrombocytopénie ou un trouble de la coagulation).
Pour les instructions concernant la reconstitution du vaccin avant administration, voir «Remarques particulières».
Contre-indications
Priorix est contre-indiqué en cas d'hypersensibilité connue à l'un des composants du vaccin ou à la néomycine. Un antécédent de dermatite de contact provoquée par la néomycine ne constitue pas une contre-indication à la vaccination. Pour l'allergie aux protéines de l'œuf de poule, voir «Mises en garde et précautions».
Priorix est contre-indiqué chez les personnes qui ont développé une réaction d'hypersensibilité lors d'une administration antérieure de vaccins contre la rougeole, les oreillons et/ou la rubéole.
Comme lors de l'utilisation de tous les autres vaccins, il faudra différer la vaccination par Priorix en cas de maladie aiguë s'accompagnant d'une fièvre élevée. En revanche, les infections légères ne constituent pas une contre-indication à la vaccination.
Priorix est contre-indiqué chez la femme enceinte. De plus, toute grossesse doit être évitée dans les trois mois qui suivent la vaccination (voir «Grossesse/Allaitement»).
Priorix ne doit pas être administré aux sujets présentant une faiblesse du système immunitaire, y compris les patients présentant une immunodéficience primaire ou secondaire. Chez les enfants VIH-positifs, il incombera au médecin traitant de décider ou non de réaliser la vaccination ROR.
Mises en garde et précautions
Priorix ne doit en aucun cas être injecté par voie intravasculaire!
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l'injection. Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Comme pour tous les vaccins injectables, il est nécessaire de toujours disposer d'un traitement médical adapté pour le cas où surviendrait une réaction anaphylactique après la vaccination (p.ex. solution d'adrénaline 1/1000).
Attendre l'évaporation complète de l'alcool ou d'autres agents désinfectants appliqués sur la peau avant l'injection, afin d'éviter une inactivation des virus atténués du vaccin.
La réponse immunitaire des enfants peut être insuffisante durant la première année de vie en raison d'une éventuelle interférence avec les anticorps maternels. Lorsqu'une situation épidémiologique requiert la vaccination durant la première année de vie, une deuxième dose de Priorix est recommandée de préférence 3 mois après la première dose. L'intervalle entre les doses ne doit en aucun cas être inférieur à 4 semaines.
Les composants rougeole et oreillons du vaccin sont produits sur cultures cellulaires d'embryon de poulet et peuvent donc contenir des traces de protéines de l'œuf de poule. Chez les personnes présentant des réactions anaphylactiques, anaphylactoïdes ou autres de type immédiat (p.ex. urticaire généralisée, œdème bucco-pharyngé, difficultés respiratoires, hypotension ou choc) après l'ingestion d'œufs, le risque d'une réaction d'hypersensibilité de type immédiat est augmenté après la vaccination, bien que ces réactions n'aient été observées que très rarement. Les personnes qui ont déjà présenté une réaction anaphylactique après l'ingestion d'œufs, doivent être vaccinées avec une prudence extrême. Il est nécessaire de disposer de mesures thérapeutiques appropriées pour le cas où surviendrait une réaction anaphylactique.
Priorix doit être administré avec prudence chez les sujets ayant des antécédents d'allergies ou de convulsions ou chez les sujets ayant des antécédents familiaux positifs.
Un traitement antipyrétique prophylactique doit être administré chez les personnes présentant des affections cérébrales, une prédisposition aux convulsions fébriles ou des antécédents familiaux de convulsions.
Si la vaccination est effectuée dans les 72 heures après une exposition naturelle à la rougeole, il est vraisemblable que la protection obtenue sera diminuée.
Aucune transmission de la rougeole et des oreillons de sujets vaccinés à des personnes prédisposées n'a été rapportée. On sait que le virus de la rubéole est excrété par voie pharyngée environ 7-28 jours après la vaccination, avec un pic d'excrétion aux alentours du 11ème jour. Une transmission des virus excrétés à des personnes prédisposées n'a toutefois pas été prouvée.
Des cas d'aggravation de thrombocytopénie et des cas de récidives de thrombocytopénie chez des sujets ayant souffert d'une thrombocytopénie après la première dose ont été rapportés après une vaccination par des vaccins vivants contre la rougeole, les oreillons et la rubéole. Dans de telles situations, une nouvelle vaccination par Priorix n'est pas recommandée.
Les données issues des études cliniques sur l'injection intramusculaire de Priorix montrent que les taux de séroconversion pour les trois antigènes (rougeole, oreillons, rubéole) ont été identiques à ceux observés après injection sous-cutanée. Les titres d'anticorps contre les oreillons et la rubéole peuvent être comparativement plus faibles.
Comme pour tout vaccin, il est possible qu'une réponse immunitaire protectrice ne soit pas atteinte chez tous les sujets vaccinés.
Interactions
Si un test tuberculinique doit être effectué, celui-ci doit être effectué avant ou en même temps que la vaccination. Le vaccin vivant contre la rougeole (vraisemblablement aussi celui contre les oreillons) provoque probablement une inhibition transitoire de la réaction cutanée à la tuberculine. C'est pourquoi il faudra attendre 4 à 6 semaines après la vaccination pour effectuer un test tuberculinique, afin de ne pas obtenir de résultats faux négatifs.
Des études ont montré que Priorix peut être administré en même temps que le vaccin vivant Varilrix contre la varicelle, si des sites d'injection différents sont utilisés.
Priorix peut être administré en même temps que le vaccin oral contre la polio (VOP), le vaccin inactivé contre la polio (IPV), le vaccin combiné contre la diphtérie, le tétanos et la coqueluche (DTPw/DTPa), le vaccin contre le Td, l'hépatite B et l'Haemophilus influenzae de type b (Hib) si des sites d'injection différents sont utilisés.
Priorix peut également être administré en même temps que d'autres vaccins vivants atténués comme le BCG, le vaccin contre la fièvre jaune, le vaccin oral contre le typhus.
Lorsque Priorix ne peut pas être administré en même temps que d'autres vaccins vivants atténués, un écart d'au moins un mois entre les vaccinations devra être respecté.
Chez les sujets ayant reçu des gammaglobulines humaines ou une transfusion sanguine, la vaccination par Priorix ne devra être effectuée que trois mois plus tard, en raison de la possibilité d'un échec vaccinal provoqué par l'acquisition passive d'anticorps contre la rougeole, les oreillons et la rubéole.
Priorix peut être administré comme rappel si la primo-vaccination a été faite avec un autre vaccin contre la rougeole, les oreillons et la rubéole.
Grossesse/Allaitement
Grossesse
L'administration de Priorix est contre-indiquée pendant la grossesse. De plus, toute grossesse doit être exclue dans les 3 mois suivant la vaccination.
Des études sur la toxicité de reproduction n'ont pas été effectuées en expérimentation animale.
Allaitement
Il n'existe que peu de données sur l'administration de Priorix pendant l'allaitement. La vaccination peut être pratiquée si toutefois le bénéfice l'emporte sur le risque.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Non pertinent.
Effets indésirables
Données d'études cliniques
Les effets indésirables susceptibles de survenir après l'administration d'un vaccin ROR correspondent à ceux observés après l'administration des vaccins monovalents isolés ou associés.
Dans le cadre d'études cliniques contrôlées, les signes et les symptômes ont été surveillés de manière active pendant une période de suivi de 42 jours. De plus, on a demandé aux sujets vaccinés de signaler tous les événements cliniques pendant la durée de l'étude.
Le profil de tolérance suivant repose sur les données d'environ 12'000 personnes au total ayant reçu Priorix dans des études cliniques.
Les fréquences sont indiquées comme suit: «très fréquent» (≥1/10), «fréquent» (<1/10, ≥1/100), «occasionnel» (<1/100, ≥1/1000), «rare» (<1/1000, ≥1/10'000), «très rare» (<1/10'000).
Infections et infestations
Fréquents: Infections des voies respiratoires supérieures.
Occasionnels: Otite moyenne.
Affections hématologiques et du système lymphatique
Occasionnels: Lymphadénopathie.
Affections du système immunitaire
Rares: Réactions allergiques.
Troubles du métabolisme et de la nutrition
Occasionnels: Anorexie.
Affections psychiatriques
Fréquents: Nervosité.
Occasionnels: Cris anormaux, insomnie.
Affections du système nerveux
Rares: Convulsions fébriles.
Affections oculaires
Occasionnels: Conjonctivite.
Affections respiratoires, thoraciques et médiastinales
Occasionnels: Bronchite, toux.
Affections gastro-intestinales
Occasionnels: Gonflement des parotides, diarrhée, vomissements.
Affections de la peau et du tissu sous-cutané
Fréquents: Eruption cutanée.
Troubles généraux et anomalies au site d'administration
Très fréquents: Rougeur au site d'injection (12,2%), fièvre ≥38 °C (rectale) ou ≥37,5 °C (axillaire/orale) (22,7%).
Fréquents: Douleurs et gonflement au site d'injection, fièvre >39,5 °C (rectale) ou ≥39,0 °C (axillaire/orale).
Les fréquences des effets indésirables ont habituellement été semblables pour la première et la deuxième dose de vaccin. Les douleurs au site d'injection ont fait exception, elles ont été «fréquentes» après la première dose et «très fréquentes» après la deuxième dose.
Effets indésirables après commercialisation
Depuis la commercialisation, les réactions supplémentaires suivantes ont été rapportées suite à une vaccination par Priorix:
Infections et infestations
Rares: Méningite, syndrome semblable à la rougeole, syndrome semblable aux oreillons (y compris orchite, épididymite et parotidite).
Affections hématologiques et du système lymphatique
Rares: Thrombocytopénie, purpura thrombocytopénique.
Affections du système immunitaire
Rares: Réactions allergiques, y compris réactions anaphylactiques.
Affections du système nerveux
Rares: encéphalite*, cérébellite, symptômes de type cérébellite (y compris des troubles transitoires de la locomotion et une ataxie transitoire), syndrome de Guillain-Barré, myélite transverse, névrite périphérique.
Affections vasculaires
Rares: vascularite (y compris purpura Schönlein-Henoch et syndrome de Kawasaki).
Affections de la peau et du tissu sous-cutané
Rares: érythème exsudatif multiforme.
Affections musculo-squelettiques et du tissu conjonctif
Rares: arthralgie, arthrite.
* Une encéphalite a été rapportée avec une fréquence inférieure à 1 dose sur 10 millions. Le risque d'encéphalite après l'administration de la vaccination est beaucoup plus faible que le risque d'encéphalite après une maladie naturelle (rougeole: 1 cas sur 1000 à 2000; rubéole: environ 1 cas sur 6000).
L'administration intravasculaire accidentelle peut provoquer des réactions sévères, pouvant aller jusqu'à un choc. Des mesures immédiates adaptées au degré de sévérité devront être prises (voir «Mises en garde et précautions»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Des cas de surdosage (jusqu'à 2 fois la posologie recommandée) ont été rapportés depuis la commercialisation. Aucun effet indésirable n'a été mis en rapport avec le surdosage.
Propriétés/Effets
Code ATC
J07BD52
Priorix est un vaccin combiné composé d'un lyophilisat de virus atténués de la rougeole Schwarz, de virus des oreillons RIT 4385 et de virus de la rubéole de souche Wistar RA 27/3.
Priorix satisfait aux exigences de l'OMS pour la fabrication de substances biologiques ainsi qu'aux exigences relatives aux vaccins combinés produits à partir de virus vivants contre la rougeole, les oreillons et la rubéole.
Les virus de la rougeole et des oreillons sont cultivés, extraits et purifiés séparément sur des cultures cellulaires d'embryons de poulet et les virus de la rubéole dans des cultures de cellules diploïdes MRC-5 humaines.
Mécanisme d'action
Non pertinent.
Pharmacodynamique
Priorix confère une immunisation active contre la rougeole, les oreillons et la rubéole.
Des études cliniques ont montré une efficacité élevée de Priorix. Des anticorps contre la rougeole, les oreillons et la rubéole ont été décelés respectivement chez 98,0%, 96,1% et 99,3% des sujets vaccinés séronégatifs antérieurement.
Dans une étude comparative, 98,7% des sujets vaccinés séronégatifs antérieurement présentaient des anticorps contre la rougeole, 95,5% des anticorps contre les oreillons et 99,5% des anticorps contre la rubéole après vaccination par Priorix, comparativement à 96,9% contre la rougeole, 96,9% contre les oreillons et 99,5% contre la rubéole après vaccination par un autre vaccin combiné ROR commercialisé.
12 mois après la vaccination, tous les sujets vaccinés étaient séropositifs pour les anticorps contre la rougeole et la rubéole. Les anticorps contre les oreillons étaient encore décelables dans 88,4% des cas. Ces résultats ont également été observés avec un autre vaccin combiné disponible sur le marché (87%).
Efficacité clinique
Voir sous «Pharmacodynamique».
Pharmacocinétique
L'évaluation des propriétés pharmacocinétiques n'est pas requise pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniques
Non pertinent.
Remarques particulières
Incompatibilités
Priorix ne doit pas être mélangé avec d'autres vaccins dans la même seringue.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (+2 °C-+8 °C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants. Respecter la chaîne du froid. Ne pas congeler!
En cas de transport, tenir compte des conditions de stockage, en particulier dans les zones climatiques chaudes.
Remarques concernant la manipulation
Priorix se présente sous la forme de pellets blanchâtres à légèrement rosés dans un flacon-ampoule. Le solvant stérile est limpide et incolore et se trouve dans une seringue prête à l'emploi. En raison de légers écarts de pH, la couleur du vaccin reconstitué peut varier de pêche à rose fuchsia, sans que cela n'ait d'influence sur son efficacité.
Le solvant et le vaccin reconstitué doivent être soumis avant la reconstitution ou l'administration à un contrôle visuel pour s'assurer de l'absence de particules étrangères et/ou de modifications de l'aspect physique. Si l'on observe de quelconques modifications, le solvant ou le vaccin reconstitué ne doivent pas être utilisés.
Instructions pour la reconstitution du vaccin avec le solvant contenu dans la seringue préremplie
Priorix est reconstitué en ajoutant la totalité du contenu de la seringue préremplie de solvant dans le flacon-ampoule contenant la poudre.
Pour fixer l'aiguille à la seringue, suivez les instructions ci-dessous. La seringue fournie avec Priorix peut toutefois légèrement différer de la seringue illustrée (c.-à-d. sans filetage). Dans ce cas, l'aiguille ne doit pas être vissée pour être connectée à la seringue.
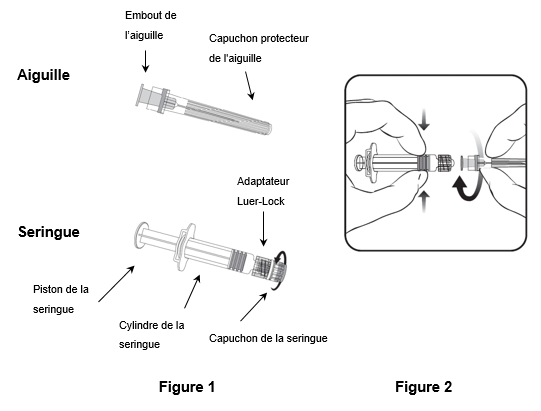
Tenez toujours la seringue par le cylindre. Ne tenez pas la seringue par le piston ou l'adaptateur Luer-Lock (ALL).
- Tenez la seringue par le cylindre et retirez le capuchon de la seringue en le tournant dans le sens inverse des aiguilles d'une montre (comme illustré dans la figure 1).
- Pour fixer l'aiguille à la seringue, introduisez prudemment l'embout de l'aiguille dans l'ALL et tournez l'aiguille dans le sens des aiguilles d'une montre jusqu'à ce qu'elle soit solidement fixée (comme illustré dans la figure 2). Veillez pendant cette opération à ce que l'aiguille soit dans l'axe de la seringue (comme illustré dans la figure 2). L'ALL risquerait sinon de se tordre et de ne plus être étanche. Si l'ALL se détache pendant la fixation de l'aiguille, il faut utiliser une nouvelle dose de vaccin (nouvelle seringue et nouveau flacon-ampoule).
- Retirez le capuchon protecteur de l'aiguille, qui peut parfois résister.
- Ajoutez le solvant à la poudre. Puis agitez soigneusement le mélange jusqu'à ce que la poudre soit entièrement dissoute dans le solvant.
Le vaccin doit être administré immédiatement après la reconstitution. - Prélevez la totalité du contenu du flacon-ampoule dans la seringue.
- Une nouvelle aiguille doit être utilisée pour l'administration du vaccin. Retirez l'aiguille de la seringue en la dévissant et fixez une aiguille d'injection en répétant l'étape 2.
Le vaccin doit être injecté dès que possible après reconstitution, et pas plus de 8 heures après sa reconstitution.
Les résidus de vaccin non utilisés et les déchets doivent être éliminés conformément à la règlementation nationale.
Numéro d’autorisation
00615 (Swissmedic).
Titulaire de l’autorisation
GlaxoSmithKline AG, 3053 Münchenbuchsee.
Mise à jour de l’information
Mai 2019.
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


 Deutsch
Deutsch French
French







