Palonosetron Teva 0.25mg/5ml Durchstechflasche 5ml buy online
PALONOSETRON Teva 0.25 mg/5ml
-
75.74 CHF
- Price in reward points: 3131

- Availability: Not available
- Product Code: 7093884
- ATC-code A04AA05
- EAN
Ingredients:
Mannitol, Dinatrium edetat, Citronensäure-Monohydrat, Palonosetron 0.25 mg , Palonosetron hydrochlorid, Natriumcitrat-2-Wasser.

Description
AMZV
Zusammensetzung
Wirkstoff: Palonosetronum 0,05 mg ut palonosetroni hydrochloridum.
Hilfsstoffe: Mannitolum, natrii edetas, natrii citras dihydricus, acidum citricum monohydricum, aqua ad iniectabilia q.s. ad solutionem pro 1 ml.
Galenische Form und Wirkstoffmenge pro Einheit
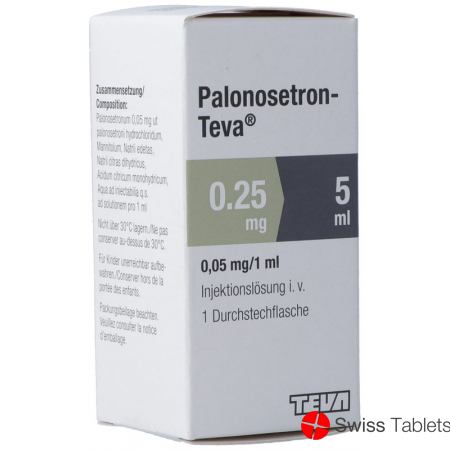
1 Durchstechflasche der Injektionslösung enthält: 0,25 mg Palonosetron in 5 ml Lösung (0,05 mg/ml).
Indikationen/Anwendungsmöglichkeiten
Palonosetron-Teva zur Injektion ist indiziert bei Erwachsenen:
- zur Prävention von akuter Übelkeit und Erbrechen bei stark emetogener Chemotherapie aufgrund einer Krebserkrankung;
- zur Prävention von Übelkeit und Erbrechen bei mässig emetogener Chemotherapie aufgrund einer Krebserkrankung.
Dosierung/Anwendung
Erwachsene
0,25 mg als einmaliger intravenöser Bolus etwa 30 Minuten vor Beginn jeder antikanzerogenen Chemotherapie. Palonosetron-Teva muss während einer Zeitdauer von 30 Sekunden injiziert werden.
Palonosetron-Teva soll ausschliesslich vor Beginn der Chemotherapie angewendet werden.
Die Prävention von Übelkeit und Erbrechen, induziert durch eine stark emetogene Chemotherapie, kann durch Hinzufügen eines vor der Chemotherapie verabreichten Corticosteroids (z.B. Dexamethason) verbessert werden.
Ältere Patienten
Es ist keine Dosisanpassung erforderlich.
Kinder und Jugendliche
Palonosetron-Teva darf bei Kindern und Jugendlichen nicht angewendet werden bis weitere Daten zur Verfügung stehen.
Spezielle Patientengruppen
Bei Patienten mit Nieren- oder Leberfunktionsstörungen ist keine Dosisanpassung erforderlich.
Kontraindikationen
Palonosetron-Teva ist kontraindiziert bei Patienten mit Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe.
Warnhinweise und Vorsichtsmassnahmen
Da Palonosetron die Dickdarmpassage verlängern kann, sollten Patienten mit anamnestischer Obstipation oder Anzeichen eines subakuten Ileus nach der Gabe von nPalonosetron-Teva überwacht werden. Zwei Fälle von Obstipation mit Stuhlverhaltung, die eine stationäre Einweisung erforderlich machten, wurden nach der Gabe von 0,75 mg Palonosetron während klinischen Studien berichtet.
In allen untersuchten Dosierungen führte Palonosetron nicht zu einer klinisch relevanten Verlängerung des QTc-Intervalls.
Wie mit anderen 5HT3-Antagonisten ist jedoch Vorsicht geboten bei der Gabe von Palonosetron bei Patienten, bei denen das QT-Intervall verlängert ist oder die zu einer solchen Verlängerung neigen.
Hiermit ist unter anderem zu rechnen bei Patienten mit eigen- oder familienanamnestisch bekannter Verlängerung des QT-Intervalls, Elektrolytstörungen, dekompensierter Herzinsuffizienz, Bradyarrhythmien, Reizleitungsstörungen sowie bei Patienten, die Antiarrhythmika oder andere Arzneimittel einnehmen, welche zu QT-Verlängerung oder Elektrolytstörungen führen.
Eine Hypokaliämie und Hypomagnesiämie sollten vor der Anwendung eines 5HT3-Antagonisten korrigiert werden.
Unter der Anwendung von 5HT3-Antagonisten allein oder in Kombination mit anderen serotonergen Wirkstoffen (darunter selektive Serotonin-Wiederaufnahme-Hemmer [SSRI] und Serotonin-Noradrenalin-Wiederaufnahme-Hemmer [SNRI]) liegen Meldungen über ein Serotonin-Syndrom vor. Es empfiehlt sich eine entsprechende Beobachtung der Patienten auf Serotonin-Syndrom-ähnliche Symptome.
Palonosetron-Teva darf nicht zusammen mit anderen 5-HT3-Antagonisten verabreicht werden, da diese Kombination noch nicht ausreichend untersucht worden ist.
Die Wirksamkeit gegen verzögerte Übelkeit und Erbrechen bei stark emetogenen Chemotherapien aufgrund einer Krebserkrankung ist nicht erwiesen. Ausser im Zusammenhang mit einer weiteren Chemotherapeutika-Gabe soll Palonosetron-Teva in den Tagen nach der Chemotherapie weder zur Vorbeugung noch zur Behandlung von Übelkeit und Erbrechen eingesetzt werden.
Es dürfen keine anderen 5-HT3-Antagonisten als Notfallmedikation verabreicht werden, da die entsprechende klinische Erfahrung sehr beschränkt ist.
Dexamethason oder Metoclopramid können als Notfallmedikation verabreicht werden.
Interaktionen
Palonosetron wird hauptsächlich über CYP2D6 metabolisiert, mit geringfügigem Beitrag der Isoenzyme CYP3A4 und CYP1A2. Auf Basis von in vitro-Studien ist Palonosetron in klinischen Konzentrationen weder Induktor noch Inhibitor von Cytochrom P450-Isoenzymen.
In präklinischen Studien hemmte Palonosetron die antitumorale Aktivität von fünf untersuchten Chemotherapeutika nicht (Cisplatin, Cyclophosphamid, Cytarabin, Doxorubicin und Mitomycin C).
In klinischen Studien wurde keine signifikante pharmakokinetische Interaktion zwischen einer einmaligen intravenösen Dosis von Palonosetron und von oralem Metoclopramid im Steady-state beobachtet.
In einer auf einer Population basierenden pharmakokinetischen Analyse wurde bei gleichzeitiger Gabe von CYP2D6-Induktoren sowie von CYP2D6-Inhibitoren keine signifikante Wirkung auf die Clearance von Palonosetron beobachtet.
Die gleichzeitige Gabe von Palonosetron und Corticosteroiden, Analgetika, Antiemetika/Antivertiginosa, Spasmolytika und Anticholinergika war unbedenklich.
Serotonerge Wirkstoffe (z.B. SSRI und SNRI)
Nach gleichzeitiger Anwendung von 5HT3-Antagonisten und anderen serotonergen Wirkstoffen (darunter selektive Serotonin-Wiederaufnahme-Hemmer [SSRI] und Serotonin-Noradrenalin-Wiederaufnahme-Hemmer [SNRI]) liegen Meldungen über ein Serotonin-Syndrom vor.
Schwangerschaft/Stillzeit
Für Palonosetron liegen keine klinischen Daten im Falle von exponierten Schwangerschaften vor.
Tierexperimentelle Studien lassen nicht auf direkte oder indirekte schädliche Auswirkungen auf Schwangerschaft, embryonale/fetale Entwicklung, Geburt oder postnatale Entwicklung schliessen. Beim Verschreiben von Palonosetron-Teva an schwangere Frauen ist höchste Vorsicht geboten.
Es ist nicht bekannt, ob Palonosetron mit der Muttermilch ausgeschieden wird. Deshalb soll es bei stillenden Frauen nicht angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Da Palonosetron Schwindel, Schläfrigkeit oder Müdigkeit hervorrufen kann, sollten die Patienten davor gewarnt werden, ein Fahrzeug zu führen oder Maschinen zu bedienen.
Unerwünschte Wirkungen
In klinischen Studien erwiesen sich bei einer Dosis von 0,25 mg (insgesamt 633 Patienten) die häufigsten unerwünschten Ereignisse, die zumindest möglicherweise mit Palonosetron im Zusammenhang standen, als Kopfschmerzen (9%) und Obstipation (5%).
In den klinischen Studien wurden folgende unerwünschte Ereignisse beobachtet, die möglicherweise oder wahrscheinlich mit Palonosetron im Zusammenhang standen.
Erkrankungen des Immunsystems
Sehr selten 1/10'000: Überempfindlichkeit, Anaphylaxie, anaphylaktische/anaphylaktoide Reaktionen und anaphylaktischer/anaphylaktoider Schock.
Stoffwechsel- und Ernährungsstörungen
Gelegentlich ≥0,1%, <1%: Hyperkaliämie, Stoffwechselstörungen, Hypokalzämie, Anorexie, Hyperglykämie, Appetitverlust.
Psychiatrische Störungen
Gelegentlich ≥0,1%, <1%: Angst, euphorische Stimmung.
Störungen des Nervensystems
Häufig ≥1%, <10%: Kopfschmerzen, Schwindel.
Gelegentlich ≥0,1%, <1%: Schläfrigkeit, Schlaflosigkeit, Parästhesie, Hypersomnie, periphere sensorische Neuropathie.
Augenleiden
Gelegentlich ≥0,1%, <1%: Augenreizung, Amblyopie.
Hörstörungen und Störungen des Labyrinths
Gelegentlich ≥0,1%, <1%: Reisekrankheit, Tinnitus.
Störungen des Herzens
Gelegentlich ≥0,1%, <1%: Tachykardie, Bradykardie, Extrasystolen, Myokardischämie, Sinustachykardie, Sinusarrhythmie, supraventrikuläre Extrasystolen, Verlängerung des QT-Intervalls.
Vaskuläre Störungen
Gelegentlich ≥0,1%, <1%: Hypotonie, Hypertonie, Venenverfärbung, Venendehnung.
Gastrointestinale Störungen
Häufig ≥1%, <10%: Obstipation, Diarrhö.
Gelegentlich ≥0,1%, <1%: Dyspepsie, Schmerzen im Oberbauch, Mundtrockenheit, Bauchschmerzen, Schluckauf, Blähungen.
Hepato-biliäre Störungen
Gelegentlich ≥0,1%, <1%: Hyperbilirubinämie.
Störungen der Haut und des Unterhautzellgewebes
Gelegentlich ≥0,1%, <1%: Allergische Dermatitis, juckender Ausschlag.
Störungen der Skelettmuskulatur und des Bindegewebes
Gelegentlich ≥0,1%, <1%: Arthralgie.
Erkrankungen der Nieren und Harnwege
Gelegentlich ≥0,1%, <1%: Harnverhaltung, Glykosurie.
Allgemeine Störungen und Beschwerden am Verabreichungsort
Gelegentlich ≥0,1%, <1%: Asthenie, Pyrexie, Müdigkeit, Schwäche, Hitzegefühl, grippeähnliche Erkrankung.
Untersuchungen
Gelegentlich ≥0,1%, <1%: Erhöhte Transaminase-Werte, verminderter Blutkaliumspiegel.
Sehr seltene Fälle (<1/10’000) von Überempfindlichkeitsreaktionen und Reaktionen am Injektionsort (Brennen, Verhärtung, Beschwerden und Schmerzen) wurden im Rahmen der Pharmacovigilance angegeben.
Überdosierung
Es wurden bisher keine Fälle von Überdosierung gemeldet. In klinischen Studien wurden Dosen von bis zu 6 mg angewendet. Die dabei beobachtete Inzidenz unerwünschter Ereignisse war mit jener bei der Dosierung von 0,25 mg vergleichbar. Es waren keine Dosis-Wirkungs-Beziehungen zu beobachten. Sollte der unwahrscheinliche Fall einer Überdosierung mit Palonosetron-Teva eintreten, sollte diese mit unterstützenden Massnahmen behandelt werden. Es wurden keine Dialyse-Studien durchgeführt; aufgrund des grossen Verteilungsvolumens ist eine Dialyse jedoch vermutlich keine effektive Therapie bei einer Überdosierung mit Palonosetron.
Eigenschaften/Wirkungen
ATC-Code: A04AA05
Wirkungsmechanismus/Pharmakodynamik
Palonosetron ist ein hoch selektiver 5HT3-Rezeptor-Antagonist mit einer hohen Bindungsaffinität zu diesem Rezeptor und einer geringen bzw. inexistenten Affinität zu anderen Rezeptoren, einschliesslich der anderen serotonergen Rezeptoren.
Klinische Wirksamkeit
Die Wirksamkeit der Injektion einer Einzeldosis Palonosetron zur Prävention von akuter Übelkeit und Erbrechen bei mässig und stark emetogener Chemotherapie ist in drei Phase-III-Studien untersucht worden. In diesen Doppelblindstudien wurden die komplette Ansprechrate (keine Emesis und keine Notfallmedikation) sowie andere sekundäre Wirksamkeitsendpunkte während 120 Stunden nach Gabe der Chemotherapie bewertet.
Zwei doppelblinde Phase-III-Studien mit 1132 Patienten verglichen Palonosetron in i.v.-Einzeldosis mit Ondansetron (32 mg) in i.v.-Einzeldosis (Studie 1) oder mit Dolasetron (100 mg) (Studie 2) in i.v.-Gabe 30 Minuten vor einer mässig emetogenen Chemotherapie mit Carboplatin, Cisplatin ≤50 mg/m², Cyclophosphamid <1500 mg/m², Doxorubicin >25 mg/m², Epirubicin, Irinotecan und Methotrexat >250 mg/m². In Studie 1 erfolgte keine gleichzeitige Verabreichung von Corticosteroiden (Dexamethason) zur Prophylaxe, in Studie 2 erhielten nur 4–6% der Patienten eine solche Medikation.
Eine doppelblinde Phase-III-Studie mit 667 Patienten verglich Palonosetron in i.v.-Einzeldosis mit Ondansetron (32 mg) in i.v.-Einzeldosis (Studie 3) 30 Minuten vor einer hoch emetogenen Chemotherapie mit Cisplatin ≥60 mg/m², Cyclophosphamid >1500 mg/m² und Dacarbazin. 67% der Patienten erhielten vor der Einleitung der Chemotherapie Corticosteroide (Dexamethason) zur Prophylaxe.
Diese Studien zeigen, dass akute Übelkeit und Erbrechen (0–24 h) in Zusammenhang mit den anfänglichen Zyklen mässig und hoch emetogener Chemotherapie aufgrund von Krebserkrankungen mit Palonosetron wirksam verhindert werden konnten. In Studie 3 war die Wirksamkeit höher, wenn gleichzeitig prophylaktisch Corticosteroide verabreicht wurden. Diese Studien belegen weiter, dass Übelkeit und Erbrechen in Verbindung mit Chemotherapiezyklen mit mässigem Emesisrisiko mit Palonosetron während 120 Stunden (5 Tage) nach diesen Zyklen vorgebeugt werden kann.
Die pivotalen Studien waren nicht darauf ausgerichtet, die Wirksamkeit von Palonosetron für verzögerte Übelkeit und Erbrechen zu beurteilen.
Die Ergebnisse der Studien zur mässig emetogenen Chemotherapie und der Studie zur hoch emetogenen Chemotherapie sind in den folgenden Tabellen zusammengefasst.
Die Verträglichkeit von Palonosetron bei wiederholten Chemotherapiezyklen (bis zu 9 Zyklen) wurde in einer offenen Studie beurteilt. Palonosetron wurde während allen Zyklen gut vertragen.
Tabelle 1: Prozentsatz der ansprechenden Patienten¹ nach Therapiegruppe und Phase (in den Studien mit mässig emetogener Chemotherapie im Vergleich zu Ondansetron)
Palonosetron 250 µg | Ondansetron | Delta | ||
% | % | % | ||
Komplettes Ansprechen (keine Emesis und keine Notfallmedikation) | 97,5% KI² | |||
0–24 h | 81,0 | 68,6 | 12,4 | [1,8%, 22,8%] |
24–120 h | 74,0 | 55,1 | 19,0 | [7,5%, 30,3%] |
0–120 h | 69,3 | 50,3 | 19,0 | [7,4%, 30,7%] |
Komplette Kontrolle (komplettes Ansprechen und lediglich mässige Übelkeit) | p-Wert³ | |||
0–24 h | 76,2 | 65,4 | 10,8 | ns |
24–120 h | 66,7 | 50,3 | 16,4 | 0,001 |
0–120 h | 63,0 | 44,9 | 18,1 | 0,001 |
Keine Übelkeit (Likert-Skala) | p-Wert³ | |||
0–24 h | 60,3 | 56,8 | 3,5 | ns |
24–120 h | 51,9 | 39,5 | 12,4 | ns |
0–120 h | 45,0 | 36,2 | 8,8 | ns |
¹ Intent-to-treat-Kohorte.
² Die Studie war dazu konzipiert, die Nicht-Unterlegenheit zu zeigen. Eine untere Grenze über –15% zeigt die Nicht-Unterlegenheit von Palonosetron gegenüber der Vergleichssubstanz.
³ Chi-Quadrat-Test. Signifikanzniveau α = 0,05.
Tabelle 2: Prozentsatz der ansprechenden Patienten¹ nach Therapiegruppe und Phase (in der Studie mit mässig emetogener Chemotherapie im Vergleich zu Dolasetron)
Palonosetron 250 µg (n= 189) | Dolasetron 100 mg (n= 191) | Delta | ||
| % | % | % | |
Komplettes Ansprechen (keine Emesis und keine Notfallmedikation) | 97,5% KI² | |||
0–24 h | 63,0 | 52,9 | 10,1 | [–1,7%, 21,9%] |
24–120 h | 54,0 | 38,7 | 15,3 | [3,4%, 27,1%] |
0–120 h | 46,0 | 34,0 | 12,0 | [0,3%, 23,7%] |
Komplette Kontrolle (komplettes Ansprechen und lediglich mässige Übelkeit) | p-Wert³ | |||
0–24 h | 57,1 | 47,6 | 9,5 | ns |
24–120 h | 48,1 | 36,1 | 12,0 | 0,018 |
0–120 h | 41,8 | 30,9 | 10,9 | 0,027 |
Keine Übelkeit (Likert-Skala) | p-Wert³ | |||
0–24 h | 48,7 | 41,4 | 7,3 | ns |
24–120 h | 41,8 | 26,2 | 15,6 | 0,001 |
0–120 h | 33,9 | 22,5 | 11,4 | 0,014 |
¹ Intent-to-treat-Kohorte.
² Die Studien waren dazu konzipiert, die Nicht-Unterlegenheit zu zeigen. Eine untere Grenze über –15% zeigt die Nicht-Unterlegenheit von Palonosetron gegenüber der Vergleichssubstanz.
³ Chi-Quadrat-Test. Signifikanzniveau α = 0,05.
Tabelle 3: Prozentsatz der ansprechenden Patienten¹ nach Therapiegruppe und Phase (in der Studie mit hoch emetogener Chemotherapie im Vergleich zu Ondansetron)
Palonosetron | Ondansetron | Delta | ||
% | % | % | ||
Komplettes Ansprechen (keine Emesis und keine Notfallmedikation) | 97,5% KI² | |||
0–24 h | 59,2 | 57,0 | 2,2 | [–8,8%, 13,1%] |
24–120 h | 45,3 | 38,9 | 6,4 | [–4,6%, 17,3%] |
0–120 h | 40,8 | 33,0 | 7,8 | [–2,9%, 18,5%] |
Komplette Kontrolle (komplettes Ansprechen und lediglich mässige Übelkeit) | p-Wert³ | |||
0–24 h | 56,5 | 51,6 | 4,9 | ns |
24–120 h | 40,8 | 35,3 | 5,5 | ns |
0–120 h | 37,7 | 29,0 | 8,7 | ns |
Keine Übelkeit (Likert-Skala) | p-Wert³ | |||
0–24 h | 53,8 | 49,3 | 4,5 | ns |
24–120 h | 35,4 | 32,1 | 3,3 | ns |
0–120 h | 33,6 | 32,1 | 1,5 | ns |
¹ Intent-to-treat-Kohorte.
² Die Studien waren dazu konzipiert, die Nicht-Unterlegenheit zu zeigen. Eine untere Grenze über –15% zeigt die Nicht-Unterlegenheit von Palonosetron gegenüber der Vergleichssubstanz.
³ Chi-Quadrat-Test. Signifikanzniveau α = 0,05.
Pharmakokinetik
Absorption
Nach intravenöser Gabe ist die maximale Plasmakonzentration (Cmax) und die Fläche unter der Konzentrations-Zeit-Kurve (AUC0–unendlich) im Allgemeinen im Dosisbereich von 0,3–90 µg/kg bei Gesunden und Krebspatienten dosisproportional.
Distribution
Das Verteilungsvolumen von Palonosetron beträgt in der empfohlenen Dosierung etwa 6,9 bis 7,9 l/kg. Etwa 62% des Palonosetrons sind an Plasmaproteine gebunden.
Nach intravenöser Gabe folgt auf eine anfängliche Abnahme der Plasmakonzentrationen eine langsame Elimination aus dem Organismus.
Metabolismus
Palonosetron wird etwa zu 50% in zwei primäre Metaboliten umgewandelt, die im Vergleich zu Palonosetron über weniger als 1% der antagonistischen Wirkung am 5HT3-Rezeptor verfügen. In-vitro-Studien zur Metabolisierung haben gezeigt, dass CYP2D6 und, in geringerem Masse, CYP3A4 und CYP1A2 am Metabolismus von Palonosetron beteiligt sind. Die klinisch-pharmakokinetischen Parameter differieren jedoch zwischen schwachen und starken Induktoren des Metabolismus von CYP2D6-Substraten nicht signifikant. In klinisch relevanten Konzentrationen hemmt Palonosetron weder die Cytochrom P450-Isoenzyme noch induziert es sie.
Elimination
Nach einer intravenösen Einzeldosis von 10 µg/kg [14C]-Palonosetron wurden etwa 80% der Dosis innerhalb von 144 Stunden im Urin wiedergefunden, Palonosetron als unveränderter Wirkstoff machte etwa 40% der gegebenen Dosis aus. Die terminale Eliminationshalbwertzeit beträgt etwa 40 Stunden. Zehn Prozent der Patienten haben eine terminale Halbwertszeit von über 100 Stunden. Nach einer einmaligen Bolus-Gabe bei Gesunden betrug die Gesamtkörperclearance von Palonosetron 173 ± 73 ml/min und die renale Clearance 53 ± 29 ml/min.
Kinetik spezieller Patientengruppen
Ältere Patienten: Das Alter beeinflusst die Pharmakokinetik von Palonosetron nicht. Bei älteren Patienten ist keine Dosisanpassung erforderlich.
Geschlecht: Das Geschlecht beeinflusst die Pharmakokinetik von Palonosetron nicht. Aufgrund des Geschlechts ist keine Dosisanpassung erforderlich.
Pädiatrische Patienten: Für Patienten unter 18 Jahren stehen keine pharmakokinetischen Daten zur Verfügung.
Nierenfunktionsstörung
Eine geringe bis mässige Nierenfunktionsstörung beeinflusst die pharmakokinetischen Parameter von Palonosetron nicht signifikant. Bei einer schweren Nierenfunktionsstörung ist die renale Clearance verringert, die Gesamtkörperclearance ist bei diesen Patienten jedoch der bei Gesunden ähnlich. Bei Patienten mit Niereninsuffizienz ist keine Dosisanpassung erforderlich.
Für Hämodialysepatienten stehen keine pharmakokinetischen Daten zur Verfügung.
Leberfunktionsstörung
Die Leberfunktionsstörung beeinflusst die Gesamtkörperclearance von Palonosetron im Vergleich zu Gesunden nicht signifikant. Bei Patienten mit Leberfunktionsstörung ist keine Dosisanpassung erforderlich.
Genetischer Polymorphismus
Der genetische Polymorphismus CYP2D6 beeinflusst die Gesamtkörper-Clearance von Palonosetron im Vergleich zu Gesunden nicht signifikant. Aus diesem Grund ist eine Dosisanpassung nicht erforderlich.
Präklinische Daten
Präklinische Effekte wurden in den Tests zur Untersuchung der Reproduktionstoxizität und der Karzinogenität nur bei Expositionen beobachtet, die wesentlich über der Dosis lagen, die als maximale humane Dosis gilt, und haben somit keine grosse Relevanz für den klinischen Gebrauch. Palonosetron erwies sich in den Standard-Mutagenitätstests als nicht mutagen.
In Studien ausserhalb des klinischen Rahmens ergaben sich Hinweise darauf, dass Palonosetron nur in sehr hohen Konzentrationen Ionenkanäle blockieren kann, die an der ventrikulären De- und Repolarisation beteiligt sind und die Aktionspotentialdauer verlängern kann.
Sonstige Hinweise
Inkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden. Den Infusionsschlauch vor und nach der Gabe von Palonosetron mit einer normalen physiologischen Lösung spülen.
Haltbarkeit
Jegliche nicht verbrauchte Lösung muss nach dem Öffnen der Durchstechflasche entsorgt werden.
Aus mikrobiologischen Gründen ist die Lösung unmittelbar nach Anbruch der Durchstechflasche zu verwenden.
Besondere Lagerungshinweise
Nicht über 30 °C lagern.
Zulassungsnummer
66407 (Swissmedic).
Zulassungsinhaberin
Teva Pharma AG, Basel.
Stand der Information
August 2016.
Interne Versionsnummer: 2.1
OEMéd
Composition
Principe actif: Palonosetronum 0,05 mg ut palonosetroni hydrochloridum.
Excipients: Mannitolum, natrii edetas, natrii citras dihydricus, acidum citricum monohydricum, aqua ad iniectabilia q.s. ad solutionem pro 1 ml.
Forme galénique et quantité de principe actif par unité
1 flacon de la solution injectable contient: 0,25 mg palonosétron dans 5 ml de solution (0,05 mg/ml).
Indications/Possibilités d’emploi
Palonosetron-Teva pour injection est indiqué chez l'adulte dans:
- la prévention des nausées et vomissements aigus associés à la chimiothérapie anticancéreuse hautement émétisante;
- la prévention des nausées et vomissements associés à la chimiothérapie anticancéreuse modérément émétisante.
Posologie/Mode d’emploi
Adultes
0,25 mg administrés en bolus intraveineux unique environ 30 minutes avant le début de la chimiothérapie anticancéreuse. Palonosetron-Teva doit être injecté sur une durée de 30 secondes.
Palonosetron-Teva doit seulement être utilisé avant l'administration de la chimiothérapie.
Dans la prévention des nausées et vomissements induits par une chimiothérapie hautement émétisante, la co-administration d'un corticoïde (p.ex. dexaméthasone) avant la chimiothérapie peut améliorer l'efficacité.
Patients âgés
Aucun ajustement de la posologie n'est nécessaire.
Enfants et adolescents
Palonosetron-Teva ne doit pas être utilisé chez les enfants et les adolescents jusqu'à ce que de plus amples données soient disponibles.
Populations spécifiques
Aucun ajustement de la posologie n'est nécessaire chez les patients présentant une altération de la fonction rénale ou hépatique.
Contre-indications
Palonosetron-Teva est contre-indiqué chez les patients présentant une hypersensibilité au principe actif ou à l'un de ses excipients.
Mises en garde et précautions
Comme le palonosétron peut augmenter le temps de transit colique, les patients ayant des antécédents de constipation ou des signes d'occlusion intestinale subaiguë doivent faire l'objet d'une surveillance après l'administration de Palonosetron-Teva. Deux cas de constipation avec fécalome nécessitant une hospitalisation ont été rapportés après l'administration de 0,75 milligrammes de palonosétron, au cours d'études cliniques.
Quelle que soit la posologie étudiée, le palonosétron n'a pas entraîné de prolongation cliniquement significative de l'intervalle QTc.
Cependant, comme pour d'autres antagonistes des récepteurs 5-HT3, il est recommandé d'être prudent en cas d'utilisation de palonosétron chez des patients présentant ou susceptibles de présenter un allongement de l'intervalle QT.
Les facteurs de risque sont notamment des antécédents personnels ou familiaux d'allongement de l'intervalle QT, les déséquilibres électrolytiques, l'insuffisance cardiaque congestive, les bradyarythmies, les troubles de la conduction et l'administration d'antiarythmiques ou d'autres médicaments entraînant un allongement de l'intervalle QT ou des troubles électrolytiques.
L'hypokaliémie et l'hypomagnésémie doivent être corrigées avant l'administration d'un antagoniste des récepteurs 5-HT3.
Des cas de syndrome sérotoninergique ont été rapportés lors de l'utilisation d'antagonistes des récepteurs 5-HT3, soit seuls soit en association avec d'autres médicaments sérotoninergiques (y compris les inhibiteurs sélectifs de la recapture de la sérotonine [ISRS] et les inhibiteurs de la recapture de la sérotonine et de la noradrénaline [IRSN]). Une surveillance appropriée des patients est recommandée afin de détecter des symptômes de type syndrome sérotoninergique.
Palonosetron-Teva ne doit pas être administré en combinaison avec d'autres antagonistes 5-HT3, car cette combinaison n'a pas été encore suffisamment étudiée.
L'efficacité pour les nausées et les vomissements à apparition retardée associés à la chimiothérapie anticancéreuse hautement émétisante n'est pas démontrée. Palonosetron-Teva ne doit pas être utilisé pour la prévention ou le traitement des nausées et vomissements au cours des jours suivants la chimiothérapie, si une autre chimiothérapie n'est pas prévue.
D'autres antagonistes 5-HT3 ne doivent pas être administrés comme traitement en urgence car l'expérience clinique est très limitée.
La dexaméthasone ou le métoclopramide peuvent être administrés comme traitement d'urgence.
Interactions
Le palonosétron est métabolisé essentiellement par le CYP2D6, avec une contribution mineure des isoenzymes CYP3A4 et CYP1A2. Sur la base des études in vitro, le palonosétron n'est ni inducteur ni inhibiteur de l'isoenzyme du cytochrome P450 aux concentrations cliniques.
Dans les études précliniques, le palonosétron n'a pas inhibé l'activité anti-tumorale des cinq agents chimiothérapeutiques testés (cisplatine, cyclophosphamide, cytarabine, doxorubicine et mitomycine C).
Dans les études cliniques, aucune interaction pharmacocinétique significative n'a été observée entre une dose intraveineuse unique de palonosétron et le métoclopramide oral à l'état d'équilibre.
Dans le cadre d'une analyse de pharmacocinétique de population des données des études cliniques, aucun effet significatif sur la clairance du palonosétron n'est observé en cas de médication concomitante avec les inducteurs CYP2D6 et les inhibiteurs CYP2D6.
Le palonosétron a été administré en toute sécurité avec des corticostéroïdes, analgésiques, anti-émétiques/anti-nauséeux, antispasmodiques et anti-cholinergiques.
Principes actifs sérotoninergiques (p.ex. ISRS et IRSN)
Des cas de syndrome sérotoninergique ont été rapportés après l'utilisation concomitante d'antagonistes 5-HT3 et d'autres médicaments sérotoninergiques dont des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et des inhibiteurs de la recapture de la sérotonine-noradrénaline (IRSN).
Grossesse/Allaitement
On ne dispose pas de données cliniques concernant le palonosétron en cas de grossesses exposées.
Les études réalisées sur l'animal n'ont pas révélé d'effets nocifs directs ou indirects relatifs à la grossesse, le développement embryonnaire/foetal, l'accouchement ou le développement postnatal. La précaution est de rigueur lorsque l'on prescrit Palonosetron-Teva à des femmes enceintes.
On ne sait pas si le palonosétron est excrété dans le lait maternel. Par conséquent, il ne doit pas être utilisé chez les femmes allaitantes.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée.
Comme le palonosétron peut provoquer des vertiges, de la somnolence ou une fatigue, les patients doivent être avertis s'ils doivent conduire un véhicule ou utiliser des machines.
Effets indésirables
Dans les études cliniques à une dose de 0,25 mg (sur un total de 633 patients), la majorité des événements indésirables, au moins éventuellement liés au palonosétron, s'est révélée être des céphalées (9%) et de la constipation (5%).
Dans les études cliniques, les événements indésirables suivants ont été rapportés comme éventuellement ou probablement liés au palonosétron.
Affections du système immunitaire
Très rares 1/10'000: Hypersensibilité, anaphylaxie, réactions et chocs anaphylactiques et anaphylactoïdes.
Troubles du métabolisme et de la nutrition
Occasionnels ≥0,1%, <1%: Hyperkaliémie, troubles métaboliques, hypocalcémie, anorexie, hyperglycémie, perte d'appétit.
Troubles psychiatriques
Occasionnels ≥0,1%, <1%: Anxiété, humeur euphorique.
Troubles du système nerveux
Fréquents ≥1%, <10%: Céphalées, vertiges.
Occasionnels ≥0,1%, <1%: Somnolence, insomnie, paresthésie, hypersomnie, neuropathie sensorielle périphérique.
Troubles oculaires
Occasionnels ≥0,1%, <1%: Irritation oculaire, amblyopie.
Troubles de l’oreille et du conduit auditif
Occasionnels ≥0,1%, <1%: Mal des transports, bourdonnement d'oreilles.
Troubles cardiaques
Occasionnels ≥0,1%, <1%: Tachycardie, bradycardie, extrasystoles, ischémie myocardique, tachycardie sinusale, arythmie sinusale, extrasystoles supra-ventriculaires, prolongation de l'intervalle QT.
Troubles vasculaires
Occasionnels ≥0,1%, <1%: Hypotension, hypertension, décoloration des veines, distension des veines.
Troubles gastro-intestinaux
Fréquents ≥1%, <10%: Constipation, diarrhées.
Occasionnels ≥0,1%, <1%: Dyspepsie, douleurs abdominales hautes, bouche sèche, douleurs abdominales, hoquet, flatulence.
Troubles hépato-biliaires
Occasionnels ≥0,1%, <1%: Hyperbilirubinémie.
Troubles cutanés et des tissus sous-cutanés
Occasionnels ≥0,1%, <1%: Dermatite allergique, exanthème prurigineux.
Troubles musculosquelettiques, du tissu conjonctif et des os
Occasionnels ≥0,1%, <1%: Arthralgie.
Affections du rein et des voies urinaires
Occasionnels ≥0,1%, <1%: Rétention urinaire, glycosurie.
Troubles généraux et accidents liés au site d’administration
Occasionnels ≥0,1%, <1%: Asthénie, pyrexie, fatigue, faiblesse, sensation de chaleur, affection de type grippal.
Investigations
Occasionnels ≥0,1%, <1%: Augmentation des valeurs des transaminases, réduction du taux de potassium sanguin.
De très rares cas (<1/10'000) de réactions d'hypersensibilité et de réactions au site d'injection (sensations de brûlure, induration, gêne et douleur) ont été notifiés dans le cadre de la pharmacovigilance.
Surdosage
Aucun cas de surdosage n'a été rapporté à ce jour. Des doses jusqu'à 6 mg ont été utilisées dans les essais cliniques, une incidence similaire des événements indésirables étant observée par rapport à la dose de 0,25 mg. Aucun effet dose réponse n'a été observé. L'éventualité improbable de surdosage avec Palonosetron-Teva doit être gérée par l'administration des soins de soutien. Des études sur la dialyse n'ont pas été réalisées, toutefois, en raison du large volume de distribution, il est improbable que la dialyse constitue un traitement efficace d'un surdosage de palonosétron.
Propriétés/Effets
Code ATC: A04AA05
Mécanisme d'action/pharmacodynamie
Le palonosétron est un antagoniste du récepteur 5-HT3 hautement sélectif présentant une affinité de liaison élevée pour ce récepteur et une faible affinité voire une affinité nulle pour d'autres récepteurs, y compris les autres récepteurs sérotoninergiques.
Efficacité clinique
L'efficacité de l'injection du palonosétron en dose unique dans la prévention des nausées et des vomissements aigus induits par la chimiothérapie à risque émétique moyen et élevé a été étudiée dans trois études de phase III. Dans ces études en double-aveugle, des taux de réponse complète (pas d'épisode émétique et pas de médicament de secours) et d'autres paramètres d'efficacité secondaires ont été évalués pendant 120 heures après administration de la chimiothérapie.
Deux études de phase III, en double aveugle portant sur 1132 patients, ont comparé le palonosétron en dose unique pour voie i.v. avec soit l'ondansétron (32 mg) en dose unique pour voie i.v. (étude 1) soit le dolasétron (100 mg) (étude 2) administré 30 minutes, pour voie i.v., avant une chimiothérapie à risque émétique moyen comprenant le carboplatine, le cisplatine ≤50 mg/m², le cyclophosphamide <1500 mg/m², la doxorubicine >25 mg/m², l'épirubicine, l'irinotécan, et le méthotrexate >250 mg/m². Des corticostéroïdes (dexaméthasone) concomitants n'ont pas été administrés en prophylaxie dans l'étude 1 et n'ont été utilisés que chez 4–6% des patients dans l'étude 2.
Une étude de phase III, en double aveugle, comprenant 667 patients a comparé le palonosétron pour voie i.v. en dose unique avec l'ondansétron i.v. (32 mg) en dose unique (étude 3) administré 30 minutes avant une chimiothérapie à risque émétique élevé comprenant le cisplatine ≥60 mg/m², le cyclophosphamide >1500 mg/m², et la dacarbazine. Des corticostéroïdes (dexaméthasone) ont été administrés de manière concomitante en prophylaxie avant d'instaurer la chimiothérapie chez 67% des patients.
Ces études montrent que le palonosétron a permis d'éviter efficacement les nausées et vomissements aigus (0–24 h) associés à des cycles initiaux de chimiothérapie anticancéreuse à risque émétique moyen et élevé. Dans l'étude 3, l'efficacité était plus importante lorsque les corticostéroïdes prophylactiques ont été administrés de manière concomitante. Ces études montrent également que le palonosétron a permis de prévenir les nausées et vomissements associés à des cycles de chimiothérapie à risque émétique moyen dans les 120 heures (5 jours) suivant ces cycles.
Les études pivots n'ont pas été conçues pour évaluer l'efficacité du palonosétron pour les nausées et les vomissements à apparition retardée.
Les résultats des études sur la chimiothérapie modérément émétisante et de l'étude sur la chimiothérapie hautement émétisante sont récapitulés dans les tableaux ci-dessous.
La tolérance du palonosétron dans des cycles répétés (jusqu'à 9 cycles) de chimiothérapie a été également étudiée dans une étude en ouvert, où le palonosétron a été bien toléré pendant tous les cycles.
Tableau 1: Pourcentage de patients¹ répondeurs par groupe de traitement et par phase (dans les études de chimiothérapie modérément émétisante versus ondansétron)
Palonosétron 250 µg | Ondansétron 32 mg | Delta | ||
|---|---|---|---|---|
| % | % | % |
|
Réponse complète (absence de vomissements et pas de médicament de secours) | IC à 97,5%² | |||
0–24 h | 81,0 | 68,6 | 12,4 | [1,8%, 22,8%] |
24–120 h | 74,0 | 55,1 | 19,0 | [7,5%, 30,3%] |
0–120 h | 69,3 | 50,3 | 19,0 | [7,4%, 30,7%] |
Contrôle complet (réponse complète et seulement quelques nausées modérées) | valeur p³ | |||
0–24 h | 76,2 | 65,4 | 10,8 | ns |
24–120 h | 66,7 | 50,3 | 16,4 | 0,001 |
0–120 h | 63,0 | 44,9 | 18,1 | 0,001 |
Absence de nausées (échelle de Likert) | valeur p³ | |||
0–24 h | 60,3 | 56,8 | 3,5 | ns |
24–120 h | 51,9 | 39,5 | 12,4 | ns |
0–120 h | 45,0 | 36,2 | 8,8 | ns |
¹ Cohorte Intention de traiter.
² L'étude visait à démontrer la non-infériorité. Une limite inférieure supérieure à –15% démontre la non-infériorité entre le palonosétron et le comparateur.
³ Test du chi2. Niveau de significativité à α = 0,05.
Tableau 2: Pourcentage de patients¹ répondeurs par groupe de traitement et par phase (dans l'étude de chimiothérapie modérément émétisante versus dolasétron)
Palonosétron | Dolasétron | Delta | |||
|---|---|---|---|---|---|
% | % | % | |||
Réponse complète (absence de vomissements et pas de médicament de secours) | IC à 97,5%² | ||||
0–24 h | 63,0 | 52,9 | 10,1 | [–1,7%, 21,9%] | |
24–120 h | 54,0 | 38,7 | 15,3 | [3,4%, 27,1%] | |
0–120 h | 46,0 | 34,0 | 12,0 | [0,3%, 23,7%] | |
Contrôle complet (réponse complète et seulement quelques nausées modérées) | valeur p³ | ||||
0–24 h | 57,1 | 47,6 | 9,5 | ns | |
24–120 h | 48,1 | 36,1 | 12,0 | 0,018 | |
0–120 h | 41,8 | 30,9 | 10,9 | 0,027 | |
Absence de nausées (échelle de Likert) | valeur p³ | ||||
0–24 h | 48,7 | 41,4 | 7,3 | ns | |
24–120 h | 41,8 | 26,2 | 15,6 | 0,001 | |
0–120 h | 33,9 | 22,5 | 11,4 | 0,014 | |
¹ Cohorte Intention de traiter.
² Les études visaient à démontrer la non-infériorité. Une limite inférieure supérieure à –15% démontre la non-infériorité entre le palonosétron et le comparateur.
³ Test du chi2. Niveau de significativité à α = 0,05.
Tableau 3: Pourcentage de patients¹ répondeurs par groupe de traitement et par phase (dans l'étude de chimiothérapie fortement émétisante versus ondansétron)
Palonosétron | Ondansétron | Delta | |||
|---|---|---|---|---|---|
| % | % | % | ||
Réponse complète (absence de vomissements et pas de médicament de secours) | IC à 97,5%² | ||||
0–24 h | 59,2 | 57,0 | 2,2 | [–8,8%, 13,1%] | |
24–120 h | 45,3 | 38,9 | 6,4 | [–4,6%, 17,3%] | |
0–120 h | 40,8 | 33,0 | 7,8 | [–2,9%, 18,5%] | |
Contrôle complet (réponse complète et seulement quelques nausées modérées) | valeur p³ | ||||
0–24 h | 56,5 | 51,6 | 4,9 | ns | |
24–120 h | 40,8 | 35,3 | 5,5 | ns | |
0–120 h | 37,7 | 29,0 | 8,7 | ns | |
Absence de nausées (échelle de Likert) | valeur p³ | ||||
0–24 h | 53,8 | 49,3 | 4,5 | ns | |
24–120 h | 35,4 | 32,1 | 3,3 | ns | |
0–120 h | 33,6 | 32,1 | 1,5 | ns | |
¹ Cohorte Intention de traiter.
² Les études visaient à démontrer la non-infériorité. Une limite inférieure supérieure à –15% démontre la non-infériorité entre le palonosétron et le comparateur.
³ Test du chi2. Niveau de significativité à α = 0,05.
Pharmacocinétique
Absorption
Après administration intraveineuse, la concentration plasmatique maximale (Cmax) et l'aire sous la courbe de concentration – durée (AUC0–infini) sont généralement proportionnelles à la dose sur l'intervalle posologique de 0,3–90 µg/kg chez les sujets sains et chez les patients atteints de cancer.
Distribution
Le palonosétron à la posologie recommandée a un volume de distribution d'environ 6,9 à 7,9 l/kg. Environ 62% du palonosétron est lié aux protéines plasmatiques.
Après l'administration par voie intraveineuse, un déclin initial des concentrations plasmatiques est suivi d'une lente élimination hors de l'organisme.
Métabolisme
Près de 50% du palonosétron administré est métabolisé pour former deux métabolites primaires qui présentent moins de 1% d'activité d'antagoniste du récepteur 5-HT3 du palonosétron. In vitro, les études sur le métabolisme ont montré que le CYP2D6 et, dans une moindre mesure, les CYP3A4 et CYP1A2 sont impliqués dans le métabolisme du palonosétron. Toutefois, les paramètres pharmacocinétiques cliniques ne sont pas significativement différents entre les substances induisant un métabolisme faible et complet des substrats de CYP2D6. Le palonosétron ni inhibe ni induit les isoenzymes du cytochrome P450 à des concentrations cliniquement pertinentes.
Elimination
Après une dose intraveineuse unique de 10 µg/kg [14C]-palonosétron, environ 80% de la dose a été récupéré dans les 144 heures dans l'urine, le palonosétron représentant environ 40% de la dose administrée, sous forme inchangée. La demi-vie d'élimination terminale moyenne est d'environ 40 heures. 10% des patients ont une demi-vie d'élimination de plus de 100 heures. Après une administration en bolus unique chez les sujets sains, la clairance corporelle totale du palonosétron était de 173 ± 73 ml/min et la clairance rénale était de 53 ± 29 ml/min.
Cinétique pour certains groupes de patients
Personnes âgées: L'âge n'a pas d'effet sur la pharmacocinétique du palonosétron. Aucun ajustement de la posologie n'est nécessaire chez les personnes âgées.
Sexe: Le sexe n'a pas d'effet sur la pharmacocinétique du palonosétron. Aucun ajustement de la posologie n'est nécessaire en fonction du sexe.
Patients pédiatriques: Les données pharmacocinétiques pour les patients de moins de 18 ans ne sont pas disponibles.
Insuffisance rénale
Une insuffisance rénale légère à modérée n'influe pas significativement sur les paramètres pharmacocinétiques du palonosétron. Une insuffisance rénale sévère réduit la clairance rénale, toutefois, la clairance corporelle totale chez ces patients est similaire à celle des sujets sains. Aucun ajustement de la posologie n'est nécessaire chez les personnes avec insuffisance rénale.
Des données pharmacocinétique chez des patients sous hémodialyse ne sont pas disponibles.
Insuffisance hépatique
L'insuffisance hépatique n'influe pas significativement sur la clairance corporelle totale du palonosétron par rapport à celle des sujets sains. Aucun ajustement de la posologie n'est nécessaire chez les personnes avec insuffisance hépatique.
Polymorphismes génétique
Le polymorphisme génétique CYP2D6 n'influe pas significativement sur la clairance corporelle totale du palonosétron par rapport à celle des sujets sains. Pour cette raison un ajustement de la posologie n'est pas nécessaire.
Données précliniques
Des effets précliniques ont été observés, dans les tests examinant la toxicité de reproduction et la carcinogenèse, uniquement en cas d'expositions considérées comme dépassant suffisamment l'exposition maximale chez l'être humain, ce qui est d'une faible pertinence pour l'utilisation clinique. Le palonosétron s'est démontré sans effet mutagène dans les tests standardisés de mutagénicité.
Des études effectuées en dehors des conditions cliniques indiquent que le palonosétron, seulement à de très fortes concentrations, peut bloquer les canaux ioniques qui interviennent dans la dépolarisation et la repolarisation ventriculaires, et prolonger la durée du potentiel d'action.
Remarques particulières
Incompatibilités
Aucune étude de compatibilité n'ayant été effectuée, ce médicament ne doit pas être mélangé à d'autres médicaments. Rincer le tuyau de perfusion avec une solution physiologique normale avant et après l'administration du palonosétron.
Stabilité
Après l'ouverture du flacon, toute la solution inutilisée doit être éliminée.
Après l'ouverture du flacon, pour des raisons microbiologiques, la solution doit être utilisée immédiatement.
Remarques concernant le stockage
Ne pas conserver au-dessus de 30 °C.
Numéro d’autorisation
66407 (Swissmedic).
Titulaire de l’autorisation
Teva Pharma AG, Basel.
Mise à jour de l’information
Août 2016.
Numéro de la version interne: 2.1
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French





