Urapidil Stragen Injektionslösung 25mg/5ml 5 Ampullen 5ml buy online
Urapidil Stragen i.v. Inj Lös 25 mg/5ml 5 Amp 5 ml
-
70.65 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: ORPHA SWISS GMBH
- Product Code: 6660826
- ATC-code C02CA06
- EAN 7680660120015
Ingredients:
Urapidil 25 mg , Natriumhydroxid, Propylenglycol 500 mg, Salzsäure, konzentriert, Natrium 2.18 mg, Dinatrium-hydrogenphosphat-2-Wasser, Natrium dihydrogenphosphat-2-Wasser.

Description
Zusammensetzung
Wirkstoffe
Urapidilum.
Hilfsstoffe
1 Ampulle Urapidil Stragen i.v. 25 mg enthält:
Acidum hydrochloridum concentratum, Natrii dihydrogenophosphas dihydricus*, dinatrii phosphas dihydricus*, Propylenglycolum*, Natrii hydroxidum*, Aqua ad injectabilia q.s. ad solutionem pro 5 ml.
*Hilfsstoffe von besonderem Interesse: 500 mg Propylenglycolum und 2,18 mg Natrium.
1 Ampulle Urapidil Stragen i.v. 50 mg enthält:
Acidum hydrochloridum concentratum, Natrii dihydrogenophosphas dihydricus*, dinatrii phosphas dihydricus*, Propylenglycolum*, Natrii hydroxidum*, Aqua ad injectabilia q.s. ad. solutionem pro 10 ml.
*Hilfsstoffe von besonderem Interesse: 1000 mg Propylenglycolum und 4.36 mg Natrium.
Darreichungsform und Wirkstoffmenge pro Einheit
Injektionslösung i.v:
1 Ampulle Urapidil Stragen i.v. 25 mg enthält:
Wirkstoff: Urapidilum 25 mg.
1 Ampulle Urapidil Stragen i.v. 50 mg enthält:
Wirkstoff: Urapidilum 50 mg.
Indikationen/Anwendungsmöglichkeiten
Bluthochdruck.
Hypertensive Notfälle (z.B. krisenhafter Blutdruckanstieg), schwere bzw. schwerste Formen der Hochdruckkrankheit, therapieresistenter Hochdruck. Die Behandlung des krisenhaften Blutdruckanstiegs bei Vorliegen eines Phäochromozytoms ist möglich. Blutdrucksenkung bei Hochdruckpatienten während und/oder nach Operationen. Blutdrucksenkung bei krisenhaftem Blutdruckanstieg von Normotonikern während und/oder nach Operationen.
Dosierung/Anwendung
Erwachsene
Übliche Dosierung
Urapidil Stragen i.v. wird intravenös als Injektion oder Infusion am liegenden Patienten verabreicht.
Sowohl ein- oder mehrmalige Injektion als auch intravenöse Langzeitinfusion sind möglich. Injektionen lassen sich mit anschliessender Langzeitinfusion kombinieren. Überlappend mit der parenteralen Akuttherapie ist der Übergang auf eine Dauertherapie mit oral zu verabreichenden Blutdrucksenkern möglich.
Hypertensive Notfälle, schwere und schwerste Formen der Hypertonie sowie therapieresistente Hypertonie
Als Injektion werden 10-50 mg Urapidil Stragen i.v. intravenös injiziert. Innerhalb von 5 Minuten ist eine blutdrucksenkende Wirkung zu erwarten. Abhängig vom Blutdruckverhalten kann die Injektion von Urapidil Stragen i.v. wiederholt werden.
Für eine intravenöse Dauertropfinfusion verdünnt man 250 mg Urapidil Stragen i.v. (5 Ampullen Urapidil Stragen i.v. 50 mg oder 10 Ampullen Urapidil Stragen i.v. 25 mg) in 500 ml einer kompatiblen Infusionslösung, z.B. physiologische Kochsalzlösung, 5- oder 10%ige Glukoselösung, 5%ige Lävuloselösung oder Dextran-40-Lösung mit 0,9% Natriumchlorid. Die kompatible Höchstmenge beträgt 4 mg Urapidil Stragen i.v. pro ml Infusionslösung. Wegen physikalisch-chemischer Inkompatibilitäten sollte Urapidil Stragen i.v. nicht mit alkalischen Injektions- und Infusionslösungen gemischt werden: aufgrund der sauren Eigenschaften der Injektionslösung kann es zu einer Trübung oder Ausflockung kommen.
Bei Verwendung eines Perfusors zur Gabe der Erhaltungsdosis werden 20 ml Urapidil Stragen i.v.-Injektionslösung (= 100 mg Urapidil Stragen i.v.) in einer Perfusorspritze aufgezogen und bis zu einem Volumen von 50 ml mit einer kompatiblen Infusionslösung (siehe oben) verdünnt.
Für die Anfangsdosis kommt eine Infusionsgeschwindigkeit von bis 2 mg/min in Frage. Die Erhaltungsdosis (im Mittel 9 mg/h) und die Dauer der Infusion (nicht länger als 48 Stunden) sind dem Blutdruck anzupassen.
Das Ausmass der Blutdrucksenkung wird von der in den ersten 15 Minuten infundierten Dosis bestimmt. Nachfolgend kann der eingestellte Blutdruck mit wesentlich kleineren Dosen aufrechterhalten werden.
Kontrollierte Blutdrucksenkung bei Hochdruckpatienten während und/oder nach Operationen:
Dosierungsschema:
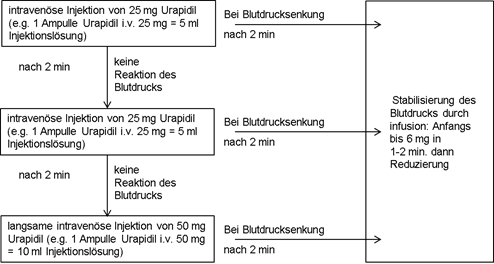
Zur Aufrechterhaltung des durch die Injektion erreichten Blutdruckniveaus kommen kontinuierliche Infusion per Perfusor oder Dauertropfinfusion zur Anwendung.
Spezielle Dosierungsanweisungen
Wird Urapidil Stragen i.v. nicht als erstes blutdrucksenkendes Medikament gegeben, so kann es nach intravenöser Verabreichung zu einem ausgeprägten Blutdruckabfall mit Bradykardie und/oder Herzstillstand kommen. Daher ist ausreichend lange auf den Wirkungseintritt des/der zuvor gegebenen blutdrucksenkenden Mittel(s) zu warten. Die Dosierung von Urapidil Stragen i.v. ist entsprechend niedriger zu wählen.
Ältere Patienten
Bei älteren Patienten müssen blutdrucksenkende Mittel mit entsprechender Vorsicht und zu Beginn in kleineren Dosen verabreicht werden, da bei diesen Patienten die Empfindlichkeit gegenüber derartigen Präparaten oftmals verändert ist.
Nieren- und Leberfunktionsstörungen
Bei Patienten mit leichter bis mittlerer Nieren- und/oder Leberfunktionsstörung kann eine mässige Dosisverringerung von Urapidil Stragen i.v. erforderlich sein.
Kinder und Jugendliche
Die für dieses Präparat in Frage kommenden Indikationen sind in der Pädiatrie ausserordentlich selten. Die Anwendung und Sicherheit von Urapidil Stragen i.v. Injektionslösung bei Kindern und Jugendlichen ist bisher nicht geprüft worden.
Therapiedauer
Nicht länger als 48 Stunden.
Kontraindikationen
Urapidil Stragen i.v. soll nicht angewendet werden bei Aortenisthmusstenose, arteriovenösem Shunt, ausgenommen: hämodynamisch nicht wirksamer Dialyse-Shunt, sowie bei Überempfindlichkeit gegenüber einem der Inhaltsstoffe.
Warnhinweise und Vorsichtsmassnahmen
Wurden vor Urapidil Stragen i.v. bereits andere blutdrucksenkende Substanzen angewendet, so ist besondere Vorsicht hinsichtlich Dosierung und Wartezeit geboten (siehe auch «Dosierung/Anwendung»).
Zu rascher Blutdruckabfall kann zu Bradykardie oder Herzstillstand führen.
Besondere Vorsicht bei der Anwendung von Urapidil Stragen i.v., ist erforderlich bei:
- Herzinsuffizienz, deren Ursache in einer mechanischen Funktionsbehinderung liegt (z.B. Aortenklappen- oder Mitralklappenstenose), bei Lungenembolie oder bei durch Perikarderkrankungen bedingter Einschränkung der Herzaktion;
- Kindern und Jugendlichen, da keine Untersuchungen hierzu vorliegen;
- Patienten mit Leberfunktionsstörungen;
- Patienten mit mässiger bis schwerer Nierenfunktionsstörung;
- älteren Patienten;
- Patienten, die gleichzeitig Cimetidin erhalten (vgl. Rubrik «Interaktionen»).
Überempfindlichkeit/Urtikaria/Angioödem
Bei mit Urapidil behandelten Patienten sind Urtikaria und Angioödeme des Gesichts, der Lippen, Zunge, Glottis und/oder des Larynx beobachtet worden (siehe auch «Unerwünschte Wirkungen»). Urapidil Stragen i.v. sollte in diesen Fällen sofort abgesetzt und der Patient sorgfältig überwacht werden, bis die Schwellung verschwunden ist. Sogar Patienten, bei denen die Schwellungen nur die Zunge involviert, ohne Atemnot, benötigen unter Umständen eine verlängerte Beobachtung, da die Behandlung mit Antihistaminika und Kortikosteroiden ungenügend sein kann.
Bei Patienten, bei denen Zunge, Glottis oder Larynx betroffen sind, ist es möglich, dass die Atemwege blockiert werden. Sind Zunge, Larynx und Glottis betroffen, so sollten sofort adäquate therapeutische Massnahmen ergriffen werden, welche die subkutane Injektion einer Lösung von Adrenalin 1:1000 (0,3 ml bis 0,5 ml) und/oder Massnahmen zur Sicherstellung eines offenen Atemwegs einschliessen können. Der Patient sollte medizinisch streng überwacht werden.
Hilfsstoffe von besonderem Interesse:
Dieses Arzneimittel enthält weniger als 1 mmol (23 mg) Natrium pro Ampulle, d.h. es ist nahezu «natriumfrei».
Das in diesem Arzneimittel enthaltene Propylenglycol kann die gleichen Wirkungen haben wie der Genuss von Alkohol und kann die Wahrscheinlichkeit für das Auftreten von Nebenwirkungen erhöhen.
Unter hohen Dosen oder bei längerer Anwendung von Propylenglycol wurde über verschiedene unerwünschte Ereignisse berichtet, wie: Hyperosmolalität, Lactatacidose, Nierenfunktionsstörung (akute Tubulusnekrose), akutes Nierenversagen, Kardiotoxizität (Arrhythmie,Hypotonie), Erkrankungen des Zentralnervensystems (Depression, Koma, Krampfanfälle), Atemdepression, Dyspnoe, Leberfunktionsstörung, hämolytische Reaktionen (intravaskuläre Hämolyse) und Hämoglobinurie, Multiorganversagen. Daher können Dosen über 500 mg/kg/Tag bei Kindern über 5 Jahren angewendet werden, müssen jedoch im Einzelfall bewertet werden. Unerwünschte Wirkungen sind normalerweise nach Absetzen von Propylenglycol reversibel; in schwereren Fällen kann eine Hämodialyse erforderlich sein. Eine medizinische Überwachung ist erforderlich. Wenden sie dieses Arzneimittel nicht bei Kindern unter 5 Jahren an. Wenden Sie dieses Arzneimittel nur auf Empfehlung eines Arztes an. Ihr Arzt führt möglicherwiese zusätzliche Untersuchungen durch, während Sie dieses Arzneimittel einnehmen.
Interaktionen
Pharmakokinetische und Pharmakodynamische Interaktionen
Urapidil verändert weder die Aktivität noch die individuelle Reaktionsweise des Plasmarenins.
Wirkung anderer Arzneimittel auf Urapidil Stragen i.v.
Alpha-Rezeptorenblocker, Vasodilatatoren und andere Arzneimittel zur Behandlung der Hochdruckkrankheit (auch Diuretika), Zustände mit Volumenmangel (Durchfall, Erbrechen) oder Alkoholgenuss können die blutdrucksenkende Wirkung von Urapidil verstärken. Bei gleichzeitiger Gabe von Cimetidin ist mit einer Erhöhung der Urapidil-Serumspiegelmaxima zu rechnen.
Sonstige Interaktionen
Wechselwirkungen mit gleichzeitig verabreichten Narkose-, Herz- und Beruhigungsmitteln sowie gerinnungshemmenden, harnsäuresenkenden, blutzucker- und blutfettsenkenden Mitteln sind bislang nicht beschrieben.
Enzymatische Inhibitoren
Wegen mangelnder klinischer Erfahrung wird die Kombination mit ACE-Hemmern nicht empfohlen.
Schwangerschaft/Stillzeit
Schwangerschaft
Es gibt nur begrenzte Daten zur Anwendung bei Schwangeren.
Urapidil ist bei Tieren nicht teratogen, tierexperimentelle Studien haben jedoch eine Reproduktionstoxizität, bei Dosierungen gezeigt, die als ausreichend über der maximalen menschlichen Dosis liegend angesehen werden (siehe «Präklinische Daten»). Urapidil wird während der Schwangerschaft nicht empfohlen, es sei denn, der potenzielle Nutzen für die Mutter überwiegt das potenzielle Risiko für den Fötus. Urapidil wird nicht bei Frauen im gebärfähigen Alter empfohlen, die keine wirksame Verhütung anwenden.
Stillzeit
Es ist nicht bekannt, ob Urapidil in die menschliche Muttermilch ausgeschieden wird, daher sollten Mütter während der Behandlung mit Urapidil nicht stillen.
Fertilität
Es wurden keine klinischen Studien über die Auswirkungen auf die männliche und weibliche Fruchtbarkeit durchgeführt. Tierversuche haben gezeigt, dass Urapidil die Fruchtbarkeit beeinflusst (siehe «Präklinische Daten»), aber die Relevanz für den Menschen ist nicht bekannt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Durch individuell auftretende unterschiedliche Reaktionen kann das Reaktionsvermögen soweit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Strassenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Masse bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenhang mit Alkohol. Urapidil Stragen i.v. hat einen geringen Einfluss auf die Fahrtüchtigkeit oder das Bedienen von Maschinen.
Unerwünschte Wirkungen
Im Folgenden sind die unerwünschten Wirkungen aufgelistet, die nach Anwendung von Urapidil auftreten können. Die Häufigkeiten sind folgendermassen definiert: sehr häufig: ≥1/10; häufig: ≥1/100 bis <1/10; gelegentlich: ≥1/1000 bis <1/100; selten: ≥1/10'000 bis <1/1000; sehr selten: <1/10'000.
Erkrankungen des Nervensystems
Häufig: Schwindel*, Kopfschmerzen*.
Sehr selten: Unruhe*.
Herzerkrankungen
Gelegentlich: Herzklopfen*, Tachykardie*, Bradykardie*, Druckgefühl hinter dem Brustbein*, Atemnot*, unregelmässige Herzschlagfolge*.
Sehr selten: kollapsähnliche Zustände (Orthostasen).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Selten: verstopfte Nase.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit*.
Gelegentlich: Erbrechen*.
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Schweissausbruch*.
Selten: Allergische Erscheinungen (Juckreiz, Hautrötung, Exantheme).
Einzelfälle: Angioödem und Urtikaria.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Selten: Priapismus.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Müdigkeit*.
*) Diese unerwünschten Wirkungen sind in der Regel auf eine zu rasche Blutdrucksenkung durch Urapidil zurückzuführen. Erfahrungsgemäss verschwinden diese Nebenwirkungen jedoch innerhalb von Minuten, auch während Langzeitinfusion, so dass eine Unterbrechung der Behandlung nicht erforderlich ist.
Eine Natriumretention wurde bislang unter Urapidiltherapie nicht beobachtet.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Anzeichen und Symptome
- seitens des Kreislaufs: Schwindel, Orthostasesyndrom und Kollaps
- seitens des Zentralnervensystems: Müdigkeit und verminderte Reaktionsfähigkeit.
Therapie bei Überdosierung
Eine übermässige Blutdrucksenkung kann durch Hochlagern der Beine und Volumensubstitution gebessert werden. Falls diese Massnahmen nicht ausreichen, können gefässverengende Präparate langsam und unter Blutdruckkontrolle i.v. injiziert werden. In seltenen Fällen ist die Gabe von Adrenalin in der üblichen Verdünnung und Dosis (100-1000 μg) notwendig.
Eigenschaften/Wirkungen
ATC-Code
C02CA06
Wirkungsmechanismus
Der blutdrucksenkende Effekt von Urapidil beruht auf einer gleichzeitigen Beeinflussung zentraler und peripherer Funktionen des sympathischen Nervensystems. Urapidil hemmt bevorzugt periphere postsynaptische α1-adrenerge Rezeptoren, mindert die Neurotransmission an den peripheren sympathischen Nervenendigungen und bewirkt zentral eine Abnahme des Sympathikotonus.
Eine beabsichtigte oder versehentliche Unterbrechung der Urapidil-Therapie hat keine abrupte Blutdrucksteigerung zur Folge.
Belastungsbedingte Blutdruckspitzen bei Hochdruckkranken werden durch Urapidil gedämpft.
Die Herzfrequenz bleibt weitgehend konstant.
Das Herzzeitvolumen wird nicht verändert; ein infolge erhöhter Nachlast vermindertes Herzzeitvolumen kann ansteigen.
Nach Injektion von Urapidil tritt kein initialer Blutdruckanstieg auf.
Eine Normalisierung des Lungenkapillardruckes wurde beobachtet.
Unter Urapidil bleibt die physiologische Blutdruckregulation erhalten. Daher ist eine Senkung des Blutdrucks in hypotone Bereiche nicht zu befürchten.
Urapidil zeichnet sich durch eine grosse therapeutische Breite aus. Seine Wirkung ist gut steuerbar.
Nach den bisherigen Erkenntnissen liegen keinerlei Hinweise auf einen Ausschluss von Patienten mit verminderter Herzmuskelleistung und eingeschränkter Atemfunktion vor.
Pharmakodynamik
Siehe auch «Wirkungsmechanismus».
Klinische Wirksamkeit
Klinische Langzeitstudien haben die Eignung von Urapidil als Monotherapeutikum für die Langzeitbehandlung des Bluthochdrucks erwiesen. Nach intravenöser Applikation erfolgt die Reduktion sowohl systolischer als auch diastolischer Blutdruckwerte schnell, aber nicht drastisch. Nach Absetzen der intravenösen Therapie steigt der Blutdruck langsam innerhalb von 2-3 Std. wieder an. Das ist besonders vorteilhaft in der postoperativen Phase nach intraoperativer Blutdrucksenkung von Hochdruckpatienten.
Pharmakokinetik
Absorption
Nach intravenöser Gabe wird eine Eliminationshalbwertszeit für Urapidil aus dem Serum von im Mittel 2,5 Std. gemessen. Das Verteilungsvolumen errechnet sich zu 0,59 l/kg, ein mittlerer Clearance-Wert wird zu 0,17 l/Std./kg bestimmt.
Distribution
Siehe auch «Absorption».
Metabolismus
Im Urin des Menschen findet man ausser der Muttersubstanz (10-15%) den biologisch inaktiven Hauptmetaboliten M1 (= 6-{3-[4-(2-Methoxy-4-hydroxyphenyl)-piperazin-1-yl]-propyl-amino}-1,3 dimethyluracil) zu ca. 30% der verabreichten Dosis, daneben noch geringe Mengen der Metaboliten M2 und M3.
Elimination
Die Ausscheidung von Urapidil erfolgt zu etwa 76% über die Niere, zu ca. 20% über den Stuhl. Die Plasmaeiweissbindung von Urapidil (Humanserum) beträgt in vitro 94%.
Präklinische Daten
Sicherheitspharmakologie
Präklinische Daten zeigen keine besondere Gefährdung des Menschen aufgrund der durchgeführten Studien zur Sicherheitspharmakologie.
Toxizität bei wiederholter Verabreichung
Wiederholte intravenöse Verabreichungen an Tieren zeigten keine Letalität bis zur höchsten getesteten Dosis (bei der Ratte 300 mg/kg über 7 Tage und 40 mg/kg für 4 Wochen; beim Hund 75 mg/kg über 7 Tage und 50 mg/kg über 4 Wochen). Befunde wie Sedierung, verminderte Motorik, Dyspnoe, erhöhte Herzfrequenz, Blutdruckabfall und muskuläre Hypertonie waren bei den Ratten innerhalb weniger Stunden nach der Verabreichung reversibel und bei Hunden innerhalb 24 Stunden.
Studien zur chronischen Toxizität in denen bei Ratten Dosen von bis zu 266 mg/kg und bei Hunden Dosen von 64 mg/kg über einen Zeitraum von 12 Monaten oral verabreicht wurden, zeigten Befunde wie Sedierung, Verlängerung des Östrogenzyklus, Hypersalivation und Zittern in hohen Dosen.
Mutagenes und tumorerzeugendes Potential
Urapidil zeigte in Untersuchungen an Bakterien (AMES-Test, Host Mediated Assay), an Humanlymphozyten und im Knochenmark-Metaphasetest an der Maus keine mutagenen Eigenschaften. Ein Test auf DNS-Reparatur an Rattenhepatozyten verlief ebenfalls negativ.
Aus Kanzerogenitätsuntersuchungen an Mäusen und Ratten über 18 und 24 Monate haben sich keine für den Menschen relevanten Hinweise auf ein tumorerzeugendes Potential ergeben.
In speziellen Untersuchungen an Ratten und Mäusen zeigte sich, dass Urapidil den Prolaktinspiegel erhöht. Beim Nager führt ein erhöhter Prolaktinspiegel zur Stimulation des Wachstums von Mammagewebe. Aufgrund der Kenntnisse über den Wirkungsmechanismus ist diese Wirkung für den Menschen bei therapeutischer Dosierung nicht zu erwarten und konnte in klinischen Studien nicht nachgewiesen werden.
Reproduktionstoxizität
Urapidil war bei Mäusen, Ratten und Kaninchen nicht teratogen. Darüber hinaus hatte Urapidil keinen Einfluss auf laktierende Ratten oder auf die Nachkommen während der Laktation und später nach der Entwöhnung, gemessen an Überleben, Verhalten, Aussehen, Körpergewicht und Anzeichen der Reifung. Urapidil hat das Potenzial, die Fruchtbarkeit von Männchen und Weibchen zu verringern und embryonal-fötale Sterblichkeit zu induzieren. Eine Verlängerung des Östruszyklus bei weiblichen Ratten und Mäusen wurde in Reproduktionsstudien und Studien zur chronischen Toxizität beobachtet, aber die Relevanz für den Menschen ist nicht bekannt.
Sonstige Hinweise
Inkompatibilitäten
Urapidil Stragen i.v. soll nicht mit alkalischen Injektions- und Infusionslösungen gemischt werden, da es aufgrund der sauren Eigenschaften der Injektionslösung zur Trübung oder Ausflockung kommen kann.
Haltbarkeit
Das Präparat darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 30°C lagern und ausser Reichweite von Kindern aufbewahren.
Stabilität nach der Öffnung
Nach der Verdünnung darf die zu injizierende oder zu infundierende Zubereitung nicht aufbewahrt werden. Chemische und physikalische in-use Stabilität wurde für 50 Stunden bei 15-25°C gezeigt.. Aus mikrobiologischen Gründen sollte die gebrauchsfertige Zubereitung unmittelbar nach Verdünnung verwendet werden. Falls dies nicht möglich ist, liegen Aufbrauchsfristen und Lagerbedingungen in der Verantwortung des Anwenders und sollten normalerweise nicht länger als 24 Std. bei 2 - 8°C betragen, ausser wenn die Verdünnung unter kontrollierten und validierten aseptischen Bedingungen erfolgte.
Weitere Informationen: vgl. Rubrik «Dosierung/Anwendung».
Zulassungsnummer
66012 (Swissmedic).
Zulassungsinhaberin
Stragen Pharma SA, 1228 Plan-les-Ouates.
Auslieferung
OrPha Swiss GmbH, 8700 Küsnacht.
Stand der Information
März 2020.
Composition
Principes actifs
Urapidilum.
Excipients
1 ampoule Urapidil Stragen i.v. 25 mg contient:
Acidum hydrochloridum concentratum, Natrii dihydrogenophosphas dihydricus*, dinatrii phosphas dihydricus*, Propylenglycolum*, Natrii hydroxidum*, Aqua ad injectabilia q.s. ad solutionem pro 5 ml.
*Excipients revêtant un intérêt particulier: 500 mg de propylenglycolum et 2.18 mg de natrium.
1 ampoule Urapidil Stragen i.v. 50 mg contient:
Acidum hydrochloridum concentratum, Natrii dihydrogenophosphas dihydricus*, dinatrii phosphas dihydricus*, Propylenglycolum*, Natrii hydroxidum*, Aqua ad injectabilia q.s. ad solutionem pro 10 ml.
*Excipients revêtant un intérêt particulier: 1000 mg de propylenglycolum et 4.36 mg de natrium.
Forme pharmaceutique et quantité de principe actif par unité
Solution injectable i.v.
1 ampoule Urapidil Stragen i.v. 25 mg contient:
Principe actif: Urapidilum 25 mg.
1 ampoule Urapidil Stragen i.v. 50 mg contient:
Principe actif: Urapidilum 50 mg.
Indications/Possibilités d’emploi
Hypertension.
Formes urgentes d'hypertension (p.ex. poussées tensionnelles), formes graves et très graves de la maladie hypertensive, hypertension artérielle résistant au traitement. Le traitement d'une ascension tensionnelle paroxystique en cas de phéochromocytome est possible. Hypotension contrôlée chez des hypertendus pendant et/ou après une intervention. Abaissement tensionnel en cas d'ascension paroxystique de la pression artérielle chez un sujet normotendu, pendant et/ou après l'intervention.
Posologie/Mode d’emploi
Adultes
Posologie usuelle
L'Urapidil Stragen i.v. s'administre par voie intraveineuse en injection ou en perfusion, le malade étant en position couchée.
On peut pratiquer une ou plusieurs injections ou une perfusion prolongée par voie intraveineuse. Des injections peuvent être associées à une perfusion prolongée consécutive. On peut progressivement passer du traitement parentéral en aigu à un traitement prolongé par des médicaments d'administration orale.
Urgences au cours de l'hypertension artérielle, formes graves et très graves de l'hypertension et hypertension résistant au traitement
En injection intraveineuse on injecte 10 mg à 50 mg d'Urapidil Stragen i.v. On peut escompter une chute tensionnelle en l'espace de 5 minutes. Suivant l'évolution de la tension, on peut répéter l'injection d'Urapidil Stragen i.v.
Pour une perfusion prolongée par voie intraveineuse, le mieux est de diluer 250 mg d'Urapidil Stragen i.v. (5 ampoules d'Urapidil Stragen i.v. 50 mg ou 10 ampoules d'Urapidil Stragen i.v. 25 mg) dans 500 ml d'un soluté compatible pour perfusion, p.ex. soluté salé physiologique, soluté glucosé à 5 ou à 10% ou solution de lévulose à 5% ou solution de dextran-40 avec chlorure de sodium à 0,9%. La concentration maximale compatible est de 4 mg d'Urapidil Stragen i.v. par ml de soluté pour perfusion. En raison d'incompatibilités physico-chimiques, Urapidil Stragen i.v. ne doit pas être mélangé avec des solutés alcalins à injecter ou à perfuser. Etant donné l'acidité de la solution injectable, une opalescence et une précipitation peuvent apparaître.
Lorsqu'on utilise un perfuseur pour administrer la dose d'entretien, on aspire 20 ml de solution d'Urapidil Stragen i.v. à perfuser, soit 100 mg d'Urapidil Stragen i.v., dans la seringue du perfuseur et l'on dilue jusqu'à 50 ml avec un soluté compatible pour perfusion (voir ci-dessus).
A titre de posologie initiale, on peut régler la vitesse de perfusion à 2 mg/minute. La dose d'entretien, en moyenne 9 mg/h, et la durée de la perfusion, de 48 heures au maximum, doivent être adaptées à l'évolution tensionnelle.
L'importance de la chute tensionnelle est fonction de la dose perfusée au cours des 15 premières minutes. Ensuite, les chiffres tensionnels peuvent être maintenus grâce à des doses nettement plus faibles.
Abaissement tensionnel contrôlé chez des hypertendus pendant et/ou après interventions
Schéma d'administration
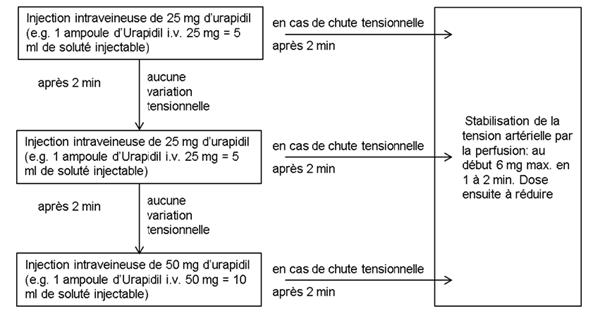
Pour maintenir le niveau tensionel atteint avec l'injection, on recourt à une perfusion continue à la pompe ou au goutte-à-goutte.
Instructions posologiques particulières
Si Urapidil Stragen i.v. n'est pas l'unique hypotenseur à prendre il peut se produire une chute de tension importante accompagnée de bradycardie et/ou d'asystole. Dans ce cas il faut attendre assez longtemps de sorte que l'autre hypotenseur prescrit ait produit son effet. En conséquence il faut choisir une posologie de l'Urapidil Stragen i.v. plus faible et correspondante.
Patients âgés
Chez les malades âgés, les antihypertenseurs doivent être administrés avec les précautions qui conviennent et, initialement, à plus faibles doses, de tels malades s'avérant souvent très sensibles aux antihypertenseurs.
Patients présentant des troubles de la fonction rénale et/ou de la fonction hépatique
Chez les patients présentant des troubles de la fonction rénale et/ou de la fonction hépatique légère à modérée, une réduction posologique moyenne d'Urapidil Stragen i.v. peut s'avérer nécessaire.
Enfants et adolescents
Les indications de ce médicament sont extrêmement rares en pédiatrie. L'application et la sécurité d'emploi de la solution injectable d'Urapidil Stragen i.v. n'ont pas été étudiées à ce jour chez les enfants et les adolescents.
Durée du traitement
Au maximum 48 heures.
Contre-indications
L'Urapidil Stragen i.v. injectable ne doit pas être utilisé en cas de sténose isthmique de l'aorte, de shunts artério-veineux à l'exception d'un shunt par dialyse inefficace du point de vue hémodynamique, et d'hypersensibilité à l'une des substances contenue dans le produit.
Mises en garde et précautions
Si d'autres hypotenseurs ont été prescrits avant l'Urapidil Stragen i.v. il faut prendre des précautions particulières en ce qui concerne la posologie et le temps d'attente (voir sous «Posologie/Mode d'emploi»).
Une chute tensionnelle trop brusque peut provoquer une bradycardie ou un arrêt cardiaque.
Lors de l'administration d'Urapidil Stragen i.v., une prudence particulière s'impose en cas de:
- insuffisance cardiaque due à un dysfonctionnement mécanique (p.ex. sténose de valve aortique ou mitrale), en cas d'embolie pulmonaire ou d'insuffisance de la fonction cardiaque liée à une affection péricardique;
- chez les enfants et les adolescents, car aucune étude n'est disponible;
- chez les patients présentant une insuffisance hépatique;
- chez les patients présentant une insuffisance rénale modérée à sévère;
- chez les patients âgés;
- chez les patients traités simultanément par la cimétidine (cf. rubrique «Interactions»).
Hypersensibilité/urticaire/angio-œdème
On a observé chez des patients traités par urapidil des cas d'urticaire et d'angio-œdème du visage, des lèvres, de la langue, de la glotte et/ou du larynx (voir aussi «Effets indésirables»).
Urapidil Stragen i.v. doit dans ces cas être interrompu immédiatement et le patient doit être attentivement surveillé jusqu'à ce que le gonflement ait disparu. Même les patients dont seule la langue est enflée et qui ne souffrent pas de détresse respiratoire ont besoin, selon les circonstances, d'être mis sous surveillance prolongée, car le traitement par antihistaminiques et corticostéroïdes peut s'avérer insuffisant.
Pour les patients chez qui la langue, la glotte ou le larynx sont touchés, il est possible que les voies respiratoires soient bloquées. Si la langue, le larynx et la glotte sont touchés, il faut immédiatement prendre des mesures thérapeutiques adéquates, par exemple l'injection sous-cutanée d'une solution d'adrénaline 1:1000 (de 0,3 ml à 0,5 ml) et/ou des mesures pour garantir que les voies respiratoires soient ouvertes. Le patient doit faire l'objet d'une surveillance médicale étroite.
Excipients revêtant un intérêt particulier:
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule, c'est à dire qu'il est essentiellement «sans sodium».
Le propylène glycol contenu dans ce médicament peut avoir les mêmes effets que l'absorption d'alcool et augmenter la probabilité d'effets indésirables. Divers effets indésirables, tels que l'hyperosmolalité, l'acidose lactique, la dysfonction rénale (nécrose tubulaire aiguë), l'insuffisance rénale aiguë, la cardiotoxicité (arythmie, hypotension); les troubles du système nerveux central (dépression, coma, convulsions), la dépression respiratoire, la dyspnée, la dysfonction hépatique, la réaction hémolytique (hémolyse intravasculaire) et l'hémoglobinurie ou le dysfonctionnement organique multisystémique, ont été signalés à des doses élevées ou lors de l'utilisation prolongée du propylène glycol. Par conséquent, des doses supérieures à 500 mg/kg/jour peuvent être administrées chez les enfants de plus de 5 ans, mais elles devront être considérées au cas par cas. Les effets indésirables s'inversent généralement après sevrage du propylène glycol et, dans des cas plus sévères suite à une hémodialyse. Une surveillance médicale est nécessaire. Ne pas utiliser ce médicament chez l'enfant de moins de 5 ans.
N'utilisez ce médicament que sur recommandation de votre médecin. Votre médecin pourra procéder à des examens complémentaires pendant que vous prenez ce médicament.
Interactions
Interactions pharmacocinétiques et pharmacodynamiques
L'urapidil ne modifie ni l'activité, ni la réactivité individuelle de la rénine plasmatique.
Effet d'autres médicaments sur Urapidil Stragen i.v.
Les antagonistes du récepteur alpha, les vasodilatateurs et d'autres médicaments utilisés pour traiter la maladie hypertensive (y compris les diurétiques), des états de déficit volumique (diarrhée, vomissements) ou la consommation d'alcool peuvent renforcer l'effet hypotenseur de l'urapidil. En cas d'administration simultanée de cimétidine, il faut escompter une élévation des pics sériques d'urapidil.
Autres interactions
On n'a pas rapporté d'interactions lors de l'administration simultanée d'anesthésiques, de sédatifs et de produits cardio-vasculaires, d'anticoagulants, d'hypo-uricémiants, d'antidiabétiques ou d'hypolipémiants.
Inhibiteurs enzymatiques
En l'absence d'une expérience clinique suffisante, l'association avec des inhibiteurs de l'ECA n'est pas recommandée.
Grossesse/Allaitement
Grossesse
Il n'existe que des données limitées sur l'utilisation chez les femmes enceintes.
L'urapidil n'est pas tératogène chez les animaux, mais des études chez l'animal ont montré une toxicité sur la reproduction à des doses considérées comme bien supérieures à la dose humaine maximale (voir «Données précliniques»). Urapidil n'est pas recommandé pendant la grossesse à moins que le bénéfice attendu ne justifie le risque potentiel pour le foetus. Urapidil n'est pas recommandé pour les femmes en âge de procréer qui n'utilisent pas de contraception efficace.
Allaitement
On ne sait pas si l'urapidil est excrété dans le lait maternel, les mères ne doivent donc pas allaiter pendant qu'elles reçoivent de l'urapidil.
Fertilité
Aucune étude clinique sur les effets sur la fertilité masculine et féminine n'a été réalisée. Des études animales ont montré que l'urapidil affecte la fertilité (voir «Données précliniques»), mais sa pertinence pour l'homme est inconnue.
Effet sur l’aptitude à la conduite et l’utilisation de machines
En raison de réactions individuelles variées, la vigilance peut être affectée au point de compromettre l'aptitude à conduire des véhicules et à utiliser des machines ou à travailler dans des conditions manquant d'appuis stables. Ceci est valable en particulier au début du traitement, lors d'une augmentation posologique et de changement de traitement ainsi qu'en association avec l'alcool.
Urapidil Stragen i.v. a une légère influence sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirables
Les effets indésirables susceptibles de survenir après l'administration d'urapidil sont énumérés ci-après. Les fréquences sont définies comme suit: très fréquents: ≥1/10; fréquents: ≥1/100 à <1/10; occasionnels: ≥1/1000 à <1/100; rares ≥1/10'000 à <1/1000; très rares: <1/10'000.
Affections du système nerveux
Fréquents: vertiges*, céphalées*.
Très rares: inquiétude*.
Affections cardiaques
Occasionnels: palpitations*, tachycardie*, bradycardie*, sténocardie*, dyspnée*, arythmies*.
Très rares: états de type collapsus (orthostase).
Affections respiratoires, thoraciques et médiastinales
Rares: nez bouché.
Affections gastro-intestinales
Fréquents: nausée*.
Occasionnels: vomissement*.
Affections de la peau et du tissu sous-cutané
Occasionnels: transpiration*.
Rares: réactions allergiques (démangeaisons, rougeurs, exanthèmes).
Cas isolés: angio-œdème et urticaire.
Affections des organes de reproduction et du sein
Rares: priapisme.
Troubles généraux et anomalies au site d'application
Occasionnels: fatigue*.
*) Ces effets indésirables sont généralement dus à une chute tensionnelle trop brusque induite par l'urapidil. Selon les expériences, ces effets secondaires disparaissent cependant en l'espace de quelques minutes même sous perfusion prolongée; une interruption du traitement n'étant donc pas nécessaire.
A ce jour, une rétention de sodium n'a pas été observée sous traitement par l'urapidil.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Signes et symptômes
- concernant la circulation: vertiges, orthostase et collapsus
- concernant le système nerveux central: fatigue et diminution de la vigilance.
Traitement en cas de surdosage
Un abaissement exagéré de la pression artérielle peut être pallié par une mise en position haute des jambes et par une substitution de volume. Si ces mesures sont insuffisantes, des vasoconstricteurs peuvent être injectés lentement par voie i.v. sous contrôle de la pression artérielle. Dans de rares cas, il est nécessaire d'administrer de l'adrénaline à la dilution et à la dose habituelle (100 à 1000 μg).
Propriétés/Effets
Code ATC
C02CA06
Mécanisme d'action
L'effet hypotenseur de l'urapidil est dû à un abaissement d'origine centrale et périphérique des résistances vasculaires. L'urapidil exerce une action inhibitrice préférentielle sur les récepteurs alpha1-adrénergiques périphériques post-synaptiques, atténue la transmission nerveuse au niveau des terminaisons neuronales sympathiques périphériques et entraîne une diminution du tonus sympathique central.
L'avantage est qu'une interruption, soit volontaire, soit par inadvertance, du traitement par urapidil n'entraîne aucune remontée tensionnelle brutale.
Les poussées tensionnelles dues à l'effort chez l'hypertendu sont atténuées par urapidil.
La fréquence cardiaque est généralement stable.
Le débit cardiaque n'est pas modifié; un débit cardiaque diminué en raison d'une post-charge plus élevée peut augmenter.
L'injection d'urapidil n'est suivie d'aucune ascension tensionnelle initiale.
On note une normalisation de la pression au niveau des capillaires pulmonaires.
Sous urapidil, la régulation normale de la tension artérielle est maintenue. Aussi n'a-t-on pas à redouter de chute tensionnelle conduisant à une hypotension artérielle.
L'urapidil se distingue par sa grande marge de sécurité. Son effet est parfaitement contrôlable.
D'après les constatations faites jusqu'à présent, il n'y a aucune raison d'exclure les malades ayant une insuffisance cardiaque ou une atteinte de la fonction respiratoire.
Pharmacodynamique
Voir «Mécanisme d'action».
Efficacité clinique
Des études cliniques ont prouvé que l'urapidil peut être utilisé comme mono-thérapie pour le traitement à long terme de l'hypertension artérielle. Après application intraveineuse, la réduction des chiffres tensionnels, tant systoliques que diastoliques, est certes rapide mais n'a rien de spectaculaire. Lorsqu'on arrête le traitement par voie intraveineuse, la tension artérielle ne tarde pas à remonter lentement en 2 à 3 heures. C'est là un avantage net en post-opératoire à la suite d'une hypotension contrôlée per-opératoire chez un hypertendu.
Pharmacocinétique
Absorption
En administration intraveineuse, l'urapidil a une demi-vie d'élimination du sérum de 2,5 heures en moyenne. Le volume de distribution est de 0,59 l/kg et la valeur moyenne de la clairance de 0,17 l/h/kg.
Distribution
Voir «Absorption».
Métabolisme
En dehors de la substance mère (10 à 15%), on trouve, dans les urines chez l'homme, le métabolite principal, biologiquement inactif M1 (=6-{3-[4-(2-méthoxy-4-hydroxyphényl)-pipérazine-1-yl]-propylamino}- 1,3-diméthyluracil), qui représente environ 30% de la dose administrée et, en outre, de petites quantités des métabolites M2 et M3.
Élimination
L'élimination de l'urapidil se fait par voie rénale, à raison de 76% environ et, par voie fécale, à raison de 20% environ. La liaison aux protéines plasmatiques de l'urapidil dans le sérum humain est, in vitro, de 94%.
Données précliniques
Pharmacologie de sécurité
Les données précliniques ne montrent aucun risque particulier pour l'homme en raison des études menées sur la pharmacologie de sécurité.
Toxicité à long terme
L'administration intraveineuse répétée aux animaux n'a montré aucune létalité jusqu'à la dose la plus élevée testée (chez le rat 300 mg/kg pendant 7 jours et 40 mg/kg pendant 4 semaines; chez le chien 75 mg/kg sur 7 jours et 50 mg/kg sur 4 semaines). Les résultats tels que la sédation, la diminution de la motricité, la dyspnée, l'augmentation du rythme cardiaque, la baisse de la pression artérielle et l'hypertension musculaire étaient réversibles en quelques heures après l'administration chez le rat et en 24 heures chez le chien.
Des études de toxicité chronique, dans lesquelles des doses allant jusqu'à 266 mg/kg chez le rat et des doses de 64 mg/kg chez le chien ont été administrées par voie orale sur une période de 12 mois, ont montré des signes tels que sédation, allongement du cycle oestrogénique, hypersalivation et tremblements à fortes doses.
Mutagénicité et carcinogénicité
Dans des essais sur des bactéries (test d'AMES, Host Mediated Assay), sur des lymphocytes humains et dans le test de moelle osseuse à la métaphase sur la souris, l'urapidil n'a montré aucune propriété mutagène. Un test de réparation de l'ADN sur des hépatocytes de rats était également négatif. Des études de carcinogénicité menées sur des souris et des rats pendant 18 et 24 mois n'ont fourni aucun indice d'un potentiel carcinogène pour l'être humain. Dans des études spéciales menées sur des rats et des souris, il a été démontré que l'urapidil augmente le taux de prolactine. Chez le rongeur, un taux de prolactine élevé stimule la croissance du tissu mammaire. Compte tenu des connaissances relatives au mécanisme d'action, cet effet est improbable chez l'humain traité par des doses thérapeutiques et n'a pas été démontré dans des études cliniques.
Toxicité sur la reproduction
Urapidil n'était pas tératogène chez des souris, des rats et des lapins. De plus, l'urapidil n'a eu aucun effet sur les rates allaitantes ou sur la progéniture pendant la lactation et plus tard après le sevrage, tel que mesuré par la survie, le comportement, l'apparence, le poids corporel et les signes de maturation. L'urapidil a le potentiel de diminuer la fertilité masculine et féminine et d'induire une mortalité embryo-foetale. Une prolongation du cycle oestral chez les rats et les souris femelles a été observée dans les études de toxicité de reproduction et la toxicité chronique, mais sa pertinence pour l'homme est inconnue.
Remarques particulières
Incompatibilités
Urapidil Stragen i.v. ne doit pas être mélangé avec des solutés alcalins à injecter ou à perfuser. Etant donné l'acidité de la solution injectable, une opalescence et une précipitation peuvent apparaître.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30 °C et tenir hors de portée des enfants.
Stabilité après ouverture
Une fois diluée, la préparation injectable ou pour perfusion ne doit pas être conservée. Sa stabilité chimique et physique « in use » a été démontrée pendant 50 heures à 15-25 °C. Pour des raisons microbiologiques, la préparation prête à l'emploi devrait être utilisée immédiatement après la dilution. Si cela n'est pas possible, le délai d'utilisation et les conditions de stockage relèvent de la responsabilité de l'utilisateur mais, de manière générale, l'entreposage ne devrait pas dépasser 24 heures à une température comprise entre 2 et 8 °C, sauf si la dilution/reconstitution se déroule dans des conditions aseptiques contrôlées et validées.
De plus amples informations: cf. rubrique «Posologie/Mode d'emploi».
Numéro d’autorisation
66012 (Swissmedic).
Titulaire de l’autorisation
Stragen Pharma SA, 1228 Plan-les-Ouates.
Livraison
OrPha Swiss GmbH, 8700 Küsnacht.
Mise à jour de l’information
Mars 2020.
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French







