Bocouture Trockensubstanz 50 E Durchstechflasche buy online
BOCOUTURE Trockensub 50 E
-
308.96 CHF
- Price in reward points: 3131

- Availability: Not available
- Product Code: 6243040
- ATC-code M03AX01
- EAN 7680632220019
Ingredients:
Saccharose, Albumin human, Trockensubstanz, Botulinumtoxin Typ A 50 U.

Description
Zusammensetzung
Wirkstoffe
Toxinum botulinicum A.
Hilfsstoffe
Albuminum humanum, Saccharum.
Darreichungsform und Wirkstoffmenge pro Einheit
Pulver zur Herstellung einer Injektionslösung.
Eine Durchstechflasche enthält:
Wirkstoff: 50 bzw. 100 LD50-Einheiten* Botulinum Neurotoxin Typ A (150 kD), frei von Komplexproteinen
* Eine Einheit entspricht der mittleren letalen Dosis (LD50) nach der unter definierten Bedingungen erfolgten intraperitonealen Injektion der rekonstituierten Lösung in Mäuse. Aufgrund der unterschiedlichen LD50-Testmethoden sind diese Einheiten spezifisch für Bocouture und daher nicht auf andere Botulinumtoxin Typ A-Präparate übertragbar.
Zur intramuskulären Anwendung.
Indikationen/Anwendungsmöglichkeiten
Bocouture wird angewendet zur vorübergehenden Verbesserung des Aussehens bei mittelstarken bis starken
- vertikalen Falten zwischen den Augenbrauen beim Stirnrunzeln (Glabellafalten) und/oder
- seitlichen Kanthalfalten sichtbar bei maximalem Lächeln (Krähenfüsse)
bei Erwachsenen im Alter unter 65 Jahren, wenn das Ausmass dieser Falten eine erhebliche psychologische Belastung für den Patienten darstellt.
Dosierung/Anwendung
Allgemeine Hinweise
Bocouture darf nur von Ärzten mit entsprechender Fachkenntnis in der Behandlung mit Botulinumtoxin Typ A angewendet werden.
Die nachfolgend empfohlenen Dosierungen sind aufgrund der unterschiedlichen LD50-Testmethoden spezifisch für Bocouture und nicht auf andere Botulinumtoxin Typ A-Präparate übertragbar.
Rekonstituiertes Bocouture ist zur intramuskulären Injektion bestimmt. Zu Hinweisen zur Rekonstitution und Verdünnung der Durchstechflaschen, siehe «Sonstige Hinweise, Hinweise für die Handhabung».
Rekonstituiertes Bocouture wird unter Verwendung einer dünnen sterilen Nadel (z.B. 30-33 G/0,20-0,30 mm Durchmesser/13 mm Länge) injiziert.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Übliche Dosierung
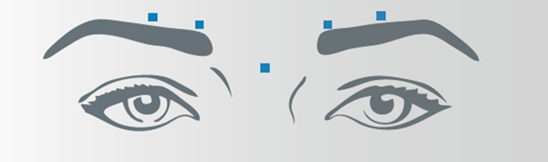
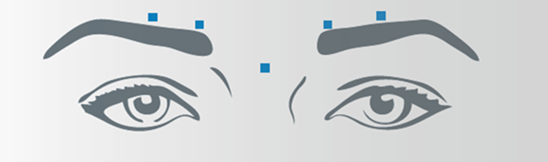
Vertikale Falten zwischen den Augenbrauen (Glabellafalten)
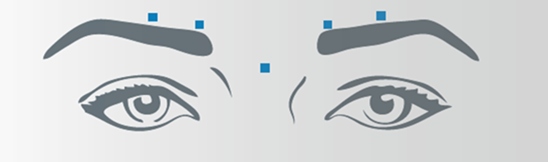
Nach der Rekonstitution von Bocouture wird das empfohlene Injektionsvolumen von 0,1 ml (4 Einheiten) in jede der 5 Injektionsstellen verabreicht: zwei Injektionen in jeden M. corrugator und eine Injektion in den M. procerus. Dies entspricht einer Standarddosis von 20 Einheiten. Aufgrund der individuellen Erfordernisse der Patienten kann die Dosis durch den Arzt auf bis zu 30 Einheiten erhöht werden.
Eine Verbesserung der vertikalen Falten zwischen den Augenbrauen (Glabellafalten) tritt im Allgemeinen innerhalb von 2 bis 3 Tagen ein, wobei die maximale Wirkung an Tag 30 beobachtet wurde. Die Wirkung hält bis zu 4 Monate nach der Injektion an.
Vor und während der Injektion sollte mit Daumen und Zeigefinger fest unter den Augenhöhlenrand gedrückt werden, um eine Diffusion der Lösung in diesem Gebiet zu verhindern. Die Nadel sollte während der Injektion superior und medial ausgerichtet bleiben. Um das Risiko einer Blepharoptosis zu reduzieren, müssen Injektionen in der Nähe des M. levator palpebrae superioris und in den kraniellen Anteil des M. orbicularis oculi vermieden werden. Injektionen in den M. corrugator sollten im medialen Anteil des Muskels sowie im zentralen Anteil des Muskelbauches mindestens 1 cm über dem knöchernen Rand der Augenhöhle erfolgen.
Seitliche Kanthalfalten sichtbar bei maximalem Lächeln (Krähenfüsse)
Nach der Rekonstitution von Bocouture wird das empfohlene Injektionsvolumen von 0,1 ml (4 Einheiten) beidseitig in jeweils 3 Injektionsstellen verabreicht. Eine Injektion wird dabei ca. 1 cm lateral des knöchernen Augenhöhlenrandes platziert. Die anderen zwei Injektionen werden ca. 1 cm oberhalb und unterhalb der ersten Injektionsstelle verabreicht.

Die empfohlene Standarddosis beträgt 12 Einheiten pro Seite und Behandlung (Gesamtdosis: 24 Einheiten).
Eine Verbesserung der seitlichen Kanthalfalten sichtbar bei maximalem Lächeln (Krähenfüsse) - tritt im Allgemeinen innerhalb der ersten 6 Tage ein, wobei die maximale Wirkung an Tag 30 beobachtet wurde. Die Wirkung hält bis zu 4 Monate nach der Injektion an.
Für die Behandlung von seitlichen Kanthalfalten, sichtbar bei maximalem Lächeln, die über zwei Injektionszyklen im Abstand von 4 Monaten hinausgeht, liegen derzeit keine Wirksamkeits- und Sicherheitsdaten vor.
Die Injektion sollte intramuskulär in den M. orbicularis oculi erfolgen, direkt unter der Dermis, um eine Diffusion von Bocouture zu vermeiden. Injektionen in der Nähe des M. zygomaticus major sollten unterlassen werden, um eine Ptosis der Lippe zu vermeiden.
Alle Indikationen
Die Behandlungsintervalle sollten nicht kürzer als 3 Monate sein.
Sollte nach durchgeführter Erstapplikation auch nach einem Monat kein therapeutischer Effekt eingetreten sein, sollten folgende Massnahmen durchgeführt werden:
- Analyse der Gründe für das Therapieversagen, z.B. unzureichende Dosierung, schlechte Injektionstechnik, mögliche Bildung Neurotoxin-neutralisierender Antikörper
- Überprüfung der Behandlung mit Botulinum Neurotoxin Typ A als angemessene Therapieform
- Sofern im Rahmen der Initialbehandlung keine unerwünschten Wirkungen aufgetreten sind, kann eine Wiederholungsbehandlung unter folgenden Voraussetzungen vorgenommen werden:
- Dosisanpassung unter Berücksichtigung der Analyse des vorausgegangenen Therapieversagens,
- Einhaltung des Mindestintervalls zwischen der Initial- und der Wiederholungsbehandlung.
Bei Therapieversagen sind alternative Behandlungsmethoden in Betracht zu ziehen.
Spezielle Dosierungsanweisungen
Ältere Patienten
Es liegen nur begrenzte klinische Daten aus Phase-III-Studien mit Bocouture bei Patienten vor, die über 65 Jahre alt sind. Die Anwendung von Bocouture bei Patienten über 65 Jahren kann daher, bis weitere Daten vorliegen, nicht empfohlen werden.
Kinder und Jugendliche
Bocouture wurde nicht in pädiatrischen Studien untersucht und kann daher, bis weitere Daten vorliegen, nicht für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren empfohlen werden.
Kontraindikationen
- Überempfindlichkeit gegenüber dem Wirkstoff Botulinum Neurotoxin Typ A (150 kD) oder einem der Inhaltsstoffe.
- Generalisierte Störungen der Muskelaktivität (z.B. Myasthenia gravis, Lambert-Eaton-Syndrom).
- Infektion oder Entzündung an der vorgesehenen Injektionsstelle.
Warnhinweise und Vorsichtsmassnahmen
Allgemein
Bevor der Arzt Bocouture verabreicht, muss er sich mit der Anatomie des Patienten sowie irgendwelcher aufgrund chirurgischer Eingriffe entstandenen anatomischen Veränderungen vertraut machen.
Wenn vorgeschlagene Injektionsstellen mit einem Stift markiert werden, darf das Produkt nicht durch die markierten Stellen injiziert werden, da sonst ein permanenter Tätowierungseffekt auftreten könnte.
Es ist sicherzustellen, dass Bocouture nicht in ein Blutgefäss injiziert wird.
Bocouture sollte nur mit Vorsicht angewendet werden:
- beim Vorhandensein von Gerinnungsstörungen aller Arten
- bei Patienten, die mit Antikoagulantien oder anderen Wirkstoffen mit antikoagulierender Wirkung behandelt werden
- bei Patienten mit amyotropher Lateralsklerose
- bei Patienten mit anderen Erkrankungen, die zu peripheren neuromuskulären Dysfunktionen führen
- bei ausgeprägter Schwäche oder Atrophie des zu injizierenden Muskels.
Lokale und entfernte Ausbreitung der Toxinwirkung
Unerwünschte Wirkungen können insbesondere auch durch falsch platzierte Injektionen von Botulinum Neurotoxin Typ A hervorgerufen werden, die vorübergehend auch benachbarte Muskelgruppen lähmen.
Es wurden Nebenwirkungen berichtet, die möglicherweise mit der Ausbreitung des Botulinumtoxins Typ A an vom Applikationsort entfernte Stellen in Zusammenhang stehen (siehe «Unerwünschte Wirkungen»).
Bereits bestehende neuromuskuläre Erkrankungen
Bei mit therapeutischen Dosen behandelten Patienten kann eine übermässige Muskelschwäche auftreten. Bei Patienten mit neurologischen Grunderkrankungen wie Schluckstörungen besteht ein erhöhtes Risiko für diese Nebenwirkungen. Das Arzneimittel sollte bei diesen Patienten nur unter Aufsicht eines Spezialisten angewendet werden und die Anwendung darf nur dann erfolgen, wenn der Nutzen der Behandlung das Risiko überwiegt.
Patienten bzw. Betreuungspersonen sind darauf hinzuweisen, dass der ärztliche Notdienst sofort zu verständigen ist, wenn Schluck-, Sprech- oder Atemstörungen auftreten.
Die Injektion von Bocouture wird bei Patienten mit einer Vorgeschichte von Dysphagie und Aspiration nicht empfohlen.
Überempfindlichkeitsreaktionen
Überempfindlichkeitsreaktionen wurden nach der Gabe von Botulinum Neurotoxin Typ A berichtet. Bei schwerwiegenden Überempfindlichkeitsreaktionen (z.B. Anaphylaxie) und/oder Überempfindlichkeitsreaktionen vom Soforttyp, sollte eine angemessene medizinische Therapie erfolgen.
Antikörperbildung
Zu häufige Injektionen mit Botulinum Neurotoxin Typ A können das Risiko einer Bildung von Antikörpern erhöhen, so dass es auch bei der Behandlung von anderen Indikationen zu einem Therapieversagen kommen kann.
Interaktionen
Es wurden keine Interaktionsstudien durchgeführt.
Theoretisch kann die Wirkung von Botulinum Neurotoxin Typ A durch Aminoglykosidantibiotika oder andere Arzneimittel, die auf die neuromuskuläre Reizleitung wirken, z.B. Muskelrelaxantien des Tubocurarin-Typs, potenziert werden. Die gleichzeitige Anwendung von Bocouture mit diesen Substanzen erfordert deshalb besondere Vorsicht.
Periphere Muskelrelaxantien sollten mit Vorsicht eingesetzt werden, gegebenenfalls sollte die Initialdosis des Relaxans verringert oder eine mittellangwirksame Substanz, wie Vercuronium oder Atracurium, anstelle von einer langwirksamen Substanz eingesetzt werden.
4-Aminochinoline können die Wirkung von Bocouture abschwächen.
Schwangerschaft/Stillzeit
Schwangerschaft
Es gibt keine hinreichenden Daten zur Anwendung bei Schwangeren.
In tierexperimentellen Studien fand sich eine Reproduktionstoxizität (nähere Angaben unter dem Kapitel «Präklinische Daten»).
Das potentielle Risiko für den Menschen ist nicht bekannt.
Bocouture darf daher während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich und der potentielle Nutzen rechtfertigt das Risiko.
Stillzeit
Es ist nicht bekannt, ob Botulinum Neurotoxin Typ A in die Muttermilch übergeht. Daher sollte Bocouture in der Stillzeit nicht angewendet werden.
Fertilität
Daten aus klinischen Studien mit Botulinum Neurotoxin Typ A liegen nicht vor. In tierexperimentellen Studien wurden keine nachteiligen Wirkungen auf die männliche oder weibliche Fertilität festgestellt (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt. Patienten sollten darauf hingewiesen werden, dass bei Symptomen wie Müdigkeit, Schwindel, Sehstörungen, Blepharoptosis, Verlust der Muskelkraft oder Muskelschwäche die Verkehrstüchtigkeit und die Fähigkeit zur Durchführung von potentiell gefährlichen Tätigkeiten eingeschränkt sein könnten und solche Tätigkeiten daher vermieden werden sollten.
Unerwünschte Wirkungen
Allgemein
Gewöhnlich treten Nebenwirkungen innerhalb der ersten Woche nach der Injektion auf und sind vorübergehend. Nebenwirkungen können mit dem Wirkstoff, dem Injektionsverfahren oder mit beidem zusammenhängen.
Wie bei jeder Injektion können im Zusammenhang mit der Injektion lokale Schmerzen, Entzündungen, Parästhesien, Hypoästhesien, Druckempfindlichkeit, Schwellungen/Ödeme, Erytheme, Juckreiz, lokale Infektionen, Hämatome, Blutungen und/oder Blutergüsse auftreten.
Durch den Injektionsprozess verursachter Schmerz und/oder Angst vor der Injektion können zu vasovagalen Reaktionen führen wie z.B. vorübergehende symptomatische Hypotonie, Übelkeit, Tinnitus und Synkopen.
Lokale Muskelschwäche stellt eine erwartete pharmakologische Wirkung von Botulinumtoxin Typ A dar.
Nach der Behandlung von neurologischen Erkrankungen mit Botulinumtoxin wurden in sehr seltenen Fällen unerwünschte Wirkungen im Zusammenhang mit der Ausbreitung des Toxins an vom Injektionsort entfernten Stellen berichtet, bei denen die Symptome der Wirkung von Botulinumtoxin Typ A gleichen (übermässige Muskelschwäche, Dysphagie, Aspirationspneumonie mit bisweilen tödlichem Ausgang). Derartige Nebenwirkungen sind auch bei der Anwendung von Bocouture nicht gänzlich auszuschliessen.
Selten wurden unter der Anwendung von Botulinumtoxin-Präparaten schwerwiegende Überempfindlichkeitsreaktionen und/oder Überempfindlichkeitsreaktionen vom Soforttyp berichtet, einschliesslich Anaphylaxie, Serumkrankheit, Dyspnoe, Weichteilödem und Urtikaria. Einige dieser Reaktionen wurden nach alleiniger Anwendung von herkömmlichen Präparaten mit dem Botulinum Neurotoxin Typ A-Komplex oder in Kombination mit anderen Wirkstoffen berichtet, die dafür bekannt sind, ähnliche Reaktionen auszulösen.
Unerwünschte Wirkungen nach Markteinführung
Die folgenden Nebenwirkungen wurden mit unbekannter Häufigkeit bei der Verwendung von Bocouture seit Markteintritt unabhängig von der Indikation berichtet:
Systemorganklasse | Nebenwirkung |
|---|---|
Erkrankungen des Immunsystems | Überempfindlichkeitsreaktionen wie Schwellungen, Ödeme (auch entfernt von der Injektionsstelle), Erytheme, Pruritus, Hautausschlag (lokal oder generalisiert) und Atemnot |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | Muskelatrophie |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Grippeähnliche Symptome |
Unerwünschte Wirkungen aus klinischen Studien
Die Häufigkeiten sind folgendermassen definiert: sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1000, <1/100); selten (≥1/10'000, <1/1000); sehr selten (<1/10'000), Einzelfälle basierend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann nicht angegeben werden.
Vertikale Falten zwischen den Augenbrauen (Glabellafalten)
Systemorganklasse | Nebenwirkung | Häufigkeit |
|---|---|---|
Infektionen und parasitäre Erkrankungen | Nasopharyngitis | Selten |
Erkrankungen des Nervensystems | Kopfschmerzen | Häufig |
Augenerkrankungen | Lidödem, Verschwommensehen, Blepharoptosis | Gelegentlich |
Gefäßerkrankungen | Bluterguss | Gelegentlich |
Erkrankungen der Haut und des Unterhautzellgewebes | Pruritus, Ptosis der Augenbraue | Gelegentlich |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | Mephisto-Zeichen (seitliche Erhöhung der Augenbrauen) | Häufig |
Gesichtsasymmetrie (Augenbrauenasymmetrie) Muskelkrämpfe (oberhalb der Augenbraue) | Gelegentlich | |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Bluterguss an der Injektionsstelle, Schmerzen an der Injektionsstelle, Grippeähnliche Erkrankung, Druckschmerz, Müdigkeit, Schweregefühl von Augenlid/Augenbraue | Gelegentlich |
Seitliche Kanthalfalten (Krähenfüsse) sichtbar bei maximalem Lächeln
Systemorganklasse | Nebenwirkung | Häufigkeit |
|---|---|---|
Augenerkrankungen | Lidödem, trockenes Auge | Häufig |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Bluterguss an der Injektionsstelle | Häufig |
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Erhöhte Dosen von Botulinum Neurotoxin Typ A können entfernt von der Injektionsstelle ausgeprägte neuromuskuläre Lähmungen erzeugen. Mögliche Symptome einer Überdosierung sind allgemeine Muskelschwäche, Ptosis, Diplopie, Atem-, und Sprechstörungen, Paralyse der Atemmuskulatur oder Schluckstörungen. In deren Folge kann es auch zu einer Aspirationspneumonie kommen.
Die Symptome treten üblicherweise nicht unmittelbar nach der Injektion auf.
Im Falle einer Überdosierung muss der Patient daher mehrere Tage (bis zu mehreren Wochen) lang medizinisch auf Symptome wie übermässige Muskelschwäche und Muskellähmung überwacht werden. Symptomatische Behandlungen können notwendig sein, ggf. einschliesslich Hospitalisierung. Wenn es zur Paralyse der Atemmuskulatur kommt, können Intubation und assistierte Beatmung erforderlich sein.
Eigenschaften/Wirkungen
ATC-Code
M03AX01
Wirkungsmechanismus
Botulinum Neurotoxin Typ A blockiert die cholinerge Signalübertragung an den neuromuskulären Verbindungen, indem es die Freisetzung von Acetylcholin hemmt. Die Nervenendigungen der neuromuskulären Verbindungen reagieren nicht länger auf Nervenimpulse, und die Sekretion des Neurotransmitters an den motorischen Endplatten wird verhindert (chemische Denervation). Die vollständige Wiederherstellung der Endplattenfunktion/Impulsübertragung nach einer Injektion erfolgt normalerweise innerhalb von 3-4 Monaten durch neugebildete Nervenendigungen und deren Wiederverbindung mit den motorischen Endplatten.
Das Botulinum Neurotoxin Typ A blockiert durch Spaltung von SNAP-25 («synaptosomal-associated protein of 25 kDa») die periphere Acetylcholin-Freisetzung an den präsynaptischen Nervenendigungen. SNAP-25 ist ein Protein, das wesentlich für die erfolgreiche Bindung und Freisetzung von Acetylcholin aus den Vesikeln ist, die sich in den Nervenendigungen befinden.
Nach der Injektion erfolgt initial eine hoch-affine Bindung des Toxins an spezifische zelluläre Oberflächenrezeptoren. Durch einen Rezeptor-vermittelten Endozytose Prozess wird das Toxin durch die Plasmamembran transportiert und anschliessend die leichte Kette des Toxins im Cytosol freigesetzt. Diese spaltet SNAP-25 und hemmt damit die Acetylcholin-Freisetzung aus den Neurotransmittervesikeln.
Pharmakodynamik
Siehe Rubrik «Wirkungsmechanismus».
Klinische Wirksamkeit
Vertikale Falten zwischen den Augenbrauen (Glabellafalten)
Zwei identische randomisierte, doppelblinde, multizentrische, Placebo-kontrollierte Phase-III-Studien wurden durchgeführt, um Bocouture für den Einsatz in der temporären Verbesserung der mittelschweren bis schweren Glabellafalten zu bewerten. Die Studien umfassten insgesamt 547 Patienten, von denen 193 Patienten >50 Jahre alt waren. 55 Probanden waren männlich. Es wurde der Behandlungserfolg als 2-Punkt-Verbesserung bei maximalem Stirnrunzeln an Tag 30 auf einer 4-Punkte-Skala (Facial Wrinkle Scale, FWS, 0 = keine, 1 = leicht, 2 = mässig, 3 = schwer) im Vergleich zum Ausgangswert definiert sowohl für den Prüfarzt als auch für den Patienten (zusammengesetzter Endpunkt). An Tag 30 war die Ansprechrate unter 20 Einheiten Bocouture hier im Vergleich zu Placebo statistisch signifikant höher. Die Erfolgsrate betrug 54.1% in der Bocouture Gruppe, wohingegen kein Patient in der Placebo Gruppe eine Verbesserung zeigte. Sekundäre Endpunkte stützen die Ergebnisse des primären Endpunkts.
In einer dritten Studie wurden 169 Patienten (≥18 Jahre) mit Bocouture in der Placebo-kontrollierten Phase der zulassungsrelevanten, doppelblinden Phase-III-Studie und 236 Patienten in der nicht-kontrollierten Phase dieser Studie behandelt. Die Studie zeigte im Vergleich zu Placebo eine statistisch signifikante und klinisch relevante Wirksamkeit von 20 Einheiten Bocouture. Dies wurde durch die Anzahl der Patienten belegt, die bei maximalem Stirnrunzeln am Tag 30 bei Beurteilung entsprechend der Skala für Gesichtsfalten durch den Prüfarzt bzw. durch den Patienten auf die Behandlung ansprachen. Die Ansprechrate unter 20 Einheiten Bocouture war hier im Vergleich zu Placebo signifikant höher.
Subgruppenanalysen zeigten im Vergleich zu jüngeren Patienten eine geringere Wirksamkeit bei Patienten, die 50 Jahre oder älter waren. Dabei waren 113 Patienten 50 Jahre oder jünger und 56 Patienten über 50 Jahre alt. Die Wirksamkeit bei Männern war geringer im Vergleich zu Frauen. Dabei waren 33 Patienten Männer und 136 Patienten Frauen.
In einer Open-Label-Studie zur Beurteilung der langfristigen Sicherheit von Bocouture wurden Patienten, die zuvor an Placebo-kontrollierten Studien zur Behandlung der Glabellafalten teilgenommen hatten, bis zu 8 Mal wiederholt behandelt. Eine Gesamtzahl von 694, 322, 309, 291, 261, 191 und 48 Probanden wurden in den Behandlungszyklen 2, 3, 4, 5, 6, 7 bzw. 8 behandelt. Es war kein Anstieg der Häufigkeit von unerwünschten Ereignissen nach wiederholter Gabe zu sehen. Keine neuen unerwarteten Ereignisse traten auf und das Sicherheitsprofil stimmte mit dem, welches in anderen Studien beobachtet wurde, überein.
Nichtunterlegenheit der Wirksamkeit von Bocouture zu einem Vergleichsprodukt, welches den Botulinumtoxin Typ A Komplex (Onabotulinumtoxin A 900kD) enthält, wurde in zwei prospektiven, multizentrischen, randomisierten, doppelblinden Vergleichsstudien (n=631) nach Einmalgabe (20 bzw. 24 Einheiten) gezeigt. Die Studienergebnisse weisen auch darauf hin, dass Bocouture und das Vergleichspräparat ein vergleichbares Wirksamkeits- und Sicherheitsprofil bei Patienten mit mittelstarken bis starken Glabellafalten haben, wenn sie in einem Umrechnungsverhältnis von 1:1 angewendet werden.
Seitliche Kanthalfalten sichtbar bei maximalem Lächeln (Krähenfüsse)
In einer klinischen Phase-III-Studie wurden 111 Patienten mit mittelstarken bis starken seitlichen Kanthalfalten sichtbar bei maximalem Lächeln (Krähenfüsse), mit 12 Einheiten Bocouture oder Placebo pro Seite (rechter/linker Augenbereich) während eines Injektionszyklus behandelt. Dabei wurde ein 3-Punkt und 4-Punkt Injektionsschema verglichen. Der Behandlungserfolg wurde als Verbesserung um mindestens 1 Punkt auf einer 4-Punkte Skala definiert. Bei maximalem Lächeln wurde die Bewertung für beide Augenbereiche durch ein unabhängiges Expertenkomitee anhand von standardisierten Digitalfotos vorgenommen und mit der Ausgangssituation verglichen. Das 3-Punkte sowie das 4-Punkte Injektionsschema zeigten beide Überlegenheit im Vergleich zur Placebobehandlung. Unter Anwendung des 3-Punkte Injektionsschemas war die Erfolgsrate 69,9% in der Bocouture Gruppe versus 21,4% in der Placebogruppe, während es unter Verwendung des 4-Punkte Injektionsverfahrens 68,7% versus 14,3% waren. Eine Verschlechterung wurde bei keinem der mit Bocouture behandelten Patienten beobachtet. Bestätigt wurde dies durch die hohe Anzahl an Patienten, die an Tag 30 ein erfolgreiches Ergebnis basierend auf einer Bewertung durch den Experten und den Patienten selbst auf der 4-Punkte Skala aufwiesen. Patienten, die 12 Einheiten Bocouture pro Augenbereich erhielten, zeigten im Vergleich zur Placebobehandlung einen signifikant höheren Anteil mit erfolgreichem Ergebnis.
Bei der kombinierten Behandlung von Glabellafalten und seitlichen Kanthalfalten mit Bocouture waren Wirksamkeit und Sicherheit ähnlich zur separaten Behandlung dieser Regionen.
Pharmakokinetik
Absorption
Klassische Kinetik- und Verteilungsstudien können mit Botulinum Neurotoxin Typ A nicht durchgeführt werden, da der Wirkstoff in äusserst geringen Dosen (Picogramm pro Injektion) appliziert wird und schnell und irreversibel an die cholinergen Nervenendigungen bindet.
Natives Botulinumtoxin vom Serotyp A stellt einen hochmolekularen Komplex dar (Botulinumtoxin Komplex Typ A), der zusätzlich zu dem Neurotoxin (150 kD) auch andere nicht-toxische Proteine wie Hämagglutinine und Non-Hämagglutinine enthält. Im Gegensatz zu Botulinumtoxin Typ A-Komplex enthält Bocouture das reine Neurotoxin und ist frei von Komplexproteinen.
Für Botulinum Neurotoxin Typ A wurde gezeigt, dass es nach intramuskulärer Injektion einem retrograden axonalen Transport unterliegt. Eine retrograde transsynaptische Passage des aktiven Botulinum Neurotoxins Typ A in das zentrale Nervensystem wurde bei therapeutisch relevanten Dosen dagegen nicht gefunden.
Rezeptor-gebundenes Botulinum Neurotoxin Typ A wird durch Endozytose in die Nervenendigung aufgenommen, bevor es sein Ziel (SNAP-25) erreicht. Es wird schliesslich intrazellulär abgebaut. Frei zirkulierende Botulinum Neurotoxin Typ A-Moleküle, die nicht an präsynaptische Rezeptoren auf den cholinergen Nervenendigungen gebunden haben, werden durch Phagozytose oder Pinocytose aufgenommen und wie andere frei zirkulierende Proteine abgebaut.
Distribution
Siehe Rubrik «Absorption»
Metabolismus
Siehe Rubrik «Absorption»
Elimination
Siehe Rubrik «Absorption»
Präklinische Daten
Sicherheitspharmakologie
Präklinische, sicherheitspharmakologische Studien zur Untersuchung der Einflüsse von Bocouture auf das kardiovaskuläre und intestinale System zeigten kein erhöhtes Risiko für den Menschen.
Mutagenität und Karzinogenität
Es wurden keine Studien zum genotoxischen oder kanzerogenen Potential von Bocouture durchgeführt.
Reproduktionstoxizität
Reproduktionstoxikologische Studien mit Bocouture zeigten weder eine Beeinträchtigung der männlichen oder weiblichen Fertilität in Kaninchen, noch eine direkte Beeinflussung der embryofötalen oder der prä- und postnatalen Entwicklung in Ratten und/oder Kaninchen. Allerdings führte die Gabe von Bocouture in unterschiedlichen Intervallen (täglich oder weniger häufig) in Embryotoxizitätsstudien in Dosen, welche eine maternale Körpergewichtsreduktion verursachten, zu einer erhöhten Abortrate bei Kaninchen und zu einem geringfügig verringerten fötalen Körpergewicht bei Ratten.
Weitere Daten (Lokale Toxizität, Phototoxizität, Immunotoxizität)
Die Befunde in Studien zur systemischen Toxizität von Bocouture nach wiederholter Gabe waren überwiegend eine Folge der pharmakodynamischen Eigenschaften, d.h. Erschlaffung, Lähmung und Atrophie des injizierten Muskels.
Es wurden keine Hinweise auf lokale Unverträglichkeit beobachtet.
Sonstige Hinweise
Inkompatibilitäten
Das Arzneimittel darf nur mit den unter Hinweise für die Handhabung aufgeführten Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Die rekonstituierte Injektionslösung ist nicht konserviert. Chemische und physikalische in-use Stabilität wurde für 24 Stunden bei 2-8 °C gezeigt. Aus mikrobiologischen Gründen sollte die gebrauchsfertige Zubereitung unmittelbar nach Verdünnung/Rekonstitution verwendet werden. Falls dies nicht möglich ist, liegen Aufbrauchsfristen und Lagerbedingungen in der Verantwortung des Anwenders und sollten normalerweise nicht länger als 24 Std. bei 2-8 °C betragen, ausser wenn die Verdünnung/Rekonstitution unter kontrollierten und validierten aseptischen Bedingungen erfolgte.
Besondere Lagerungshinweise
Das Arzneimittel bei Raumtemperatur (15-25 °C) oder im Kühlschrank (2-8 °C) lagern.
In der Originalverpackung aufbewahren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Bocouture wird vor dem Gebrauch mit steriler, physiologischer Kochsalzlösung rekonstituiert. Die Rekonstitution und die Verdünnung sollten unter Einhaltung der Standardbedingungen erfolgen, insbesondere im Hinblick auf die aseptische Handhabung.
Das Rekonstituieren des Flascheninhalts und das Aufziehen der Spritze sollten über plastikbeschichteten Papiertüchern erfolgen, um eventuelle Spritzer aufzufangen.
Die folgende Tabelle gibt die Verdünnung für Bocouture 50 Einheiten und 100 Einheiten an:
Erhaltene Dosis (in Einheiten pro 0,1 ml) | Zugegebene Menge Lösungsmittel (Natriumchlorid 9 mg/ml (0,9%) Injektionslösung) | |
|---|---|---|
Durchstechflasche mit 50 Einheiten | Durchstechflasche mit 100 Einheiten | |
4 Einheiten | 1,25 ml | 2,5 ml |
Eine entsprechende Menge 0.9%ige (9mg/ml) Natriumchlorid-Lösung (siehe Verdünnungstabelle) wird mit einer Spritze aufgezogen. Es wird empfohlen eine 20-27 G Kurzschliffkanüle für die Rekonstitution zu verwenden. Der freigelegte Teil des Gummistopfens der Durchstechflasche wird vor dem Einstechen der Nadel mit Alkohol (70%) gereinigt. Nach senkrechtem Einstechen der Nadel durch den Gummistopfen der Durchstechflasche sollte die Rekonstitution vorsichtig erfolgen, um eine Blasenbildung zu vermeiden. Die Durchstechflasche ist zu verwerfen, wenn in der Flasche kein Unterdruck vorhanden ist, der das Lösungsmittel aus der Spritze ansaugt.
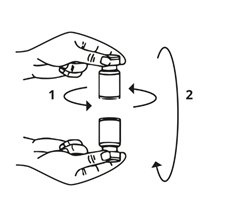
Die Spritze wird von der Flasche entfernt und Bocouture mit dem Lösungsmittel vermischt, indem die Flasche vorsichtig im Kreis gedreht wird und gekippt wird (von rechts nach links und über Kopf) – nicht kräftig schütteln. Falls nötig, sollte die Kanüle, mit welcher die Rekonstitution durchgeführt wurde, in der Flasche verbleiben.
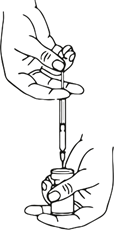
Die benötigte Menge an Lösung sollte mit einer neuen sterilen Injektionsspritze aufgezogen werden.
Die rekonstituierte Bocouture-Lösung ist klar, farblos und frei von Partikeln.
Bocouture darf nicht verwendet werden, wenn die rekonstituierte Lösung, die entsprechend der oben genannten Anweisungen hergestellt wurde, eine Trübung zeigt oder Ausflockungen oder Partikel enthält.
Injektionslösung, die länger als 24 Stunden aufbewahrt wurde, sollte verworfen werden.
VORGEHENSWEISE ZUR SICHEREN ENTSORGUNG DER DURCHSTECHFLASCHEN, SPRITZEN UND VERWENDETEN MATERIALIEN
Unbenutzte Durchstechflaschen oder Restlösung in Durchstechflaschen und/oder Spritzen sollten autoklaviert werden. Alternativ kann das restliche Bocouture durch Zusatz einer der folgenden Lösungsmittel inaktiviert werden: 70%iges Ethanol, 50%iges Isopropanol, verdünnte Natriumhydroxid-Lösung (0,1 N NaOH) oder verdünnte Natriumhypochlorit-Lösung (mindestens 0,1%ige NaOCl).
Verwendete Durchstechflaschen, Spritzen und Materialien sollten nicht entleert, sondern in geeigneten Behältern und entsprechend den lokalen Vorschriften entsorgt werden.
- Jegliches verschüttetes Arzneimittel muss aufgewischt werden: entweder - im Fall des Pulvers - mit einem saugfähigen Material, das mit einem der oben genannten Lösungsmittel getränkt wurde oder - im Fall der rekonstituierten Lösung - mit einem trockenen saugfähigen Material.
- Kontaminierte Oberflächen müssen mit einem saugfähigen Material gereinigt werden, das mit einer der oben genannten Lösung getränkt wurde. Anschliessend trocknen lassen.
- Wenn eine Durchstechflasche zerbricht, wie oben beschrieben vorgehen, Glassplitter vorsichtig aufsammeln und das Arzneimittel aufwischen, dabei Schnittverletzungen der Haut vermeiden.
- Wenn das Arzneimittel in Kontakt mit der Haut gelangt, den betroffenen Bezirk mit reichlich Wasser abspülen.
- Wenn das Arzneimittel in Kontakt mit einer Wunde, Schnittverletzung oder nicht-intakter Haut gelangt, gründlich mit reichlich Wasser spülen und die entsprechenden medizinischen Massnahmen entsprechend der injizierten Dosis ergreifen.
- Wenn das Arzneimittel in Kontakt mit den Augen gelangt, gründlich mit reichlich Wasser oder einer Augenspüllösung ausspülen.
Zulassungsnummer
63222 (Swissmedic)
Zulassungsinhaberin
Merz Pharma (Schweiz) AG, 4123 Allschwil
Stand der Information
Juni 2020
Composizione
Principi attivi
Tossina botulinica di tipo A.
Sostanze ausiliarie
Albumina umana, saccarosio.
Forma farmaceutica e quantità di principio attivo per unità
Polvere per la preparazione di una soluzione iniettabile.
Un flaconcino contiene:
Principio attivo: 50 o 100 unità DL50* di neurotossina botulinica di tipo A (150 kD), priva di proteine complessanti.
* Una unità corrisponde alla dose letale media (DL50) in seguito a iniezione intraperitoneale della soluzione ricostituita nei topi e alle condizioni definite di seguito.
A causa dei diversi metodi di prova DL50, queste unità sono specifiche per Bocouture e non possono essere trasferite ad altri preparati a base di tossina botulinica di tipo A.
Per uso intramuscolare.
Indicazioni/Possibilità d'impiego
Bocouture è indicato per migliorare temporaneamente l'aspetto della parte superiore del volto in caso di
- rughe verticali da moderate a gravi tra le sopracciglia (rughe glabellari) e/o
- rughe periorbitali laterali da moderate a gravi osservate al massimo sorriso (rughe a zampe di gallina)
in adulti di età inferiore ai 65 anni, nei casi in cui la gravità di queste rughe abbia un impatto psicologico rilevante per il paziente.
Posologia/Impiego
Avvertenze generali
Bocouture può essere somministrato solo da medici con apposite conoscenze specialistiche nel trattamento con tossina botulinica di tipo A.
In virtù dei diversi metodi di prova DL50, le dosi raccomandate di seguito sono specifiche per Bocouture e non possono essere trasferite ad altri preparati a base di tossina botulinica di tipo A.
Bocouture ricostituito è destinato ad iniezione intramuscolare. Per le istruzioni sulla ricostituzione e la diluizione del medicinale, consultare il paragrafo «Precauzioni particolari, precauzioni per la manipolazione».
Bocouture ricostituito viene iniettato usando un ago sottile sterile (ad esempio ago da 30-33 G/0,20-0,30 mm di diametro/13 mm di lunghezza).
Al fine di garantire la tracciabilità dei medicinali prodotti biotecnologicamente, si raccomanda di documentare il nome commerciale e il numero di lotto per ciascun trattamento.
Posologia abituale
Rughe verticali da moderate a gravi tra le sopracciglia (rughe glabellari)
Dopo la ricostituzione di Bocouture, iniettare una dose di 0,1 ml (4 unità) in ognuno dei 5 siti di iniezione: due iniezioni in ogni muscolo corrugatore e un'iniezione nel muscolo procero, che corrisponde alla dose standard di 20 unità. In base alle necessità dei pazienti, la dose può all'occorrenza essere aumentata dal medico fino a 30 unità.
Solitamente, un miglioramento delle rughe verticali tra le sopracciglia (rughe glabellari) inizia a manifestarsi dopo 2 o 3 giorni con il massimo effetto osservato nel trentesimo giorno. L'effetto dura fino a 4 mesi dopo l'iniezione.
Prima e durante l'iniezione, usare il pollice o l'indice per esercitare una decisa pressione sotto il bordo dell'orbita per evitare la diffusione della soluzione in questa regione. Durante l'iniezione, mantenere l'allineamento superiore e mediale dell'ago. Al fine di ridurre il rischio di blefaroptosi, evitare le iniezioni in prossimità del muscolo elevatore superiore della palpebra e nella porzione craniale del muscolo orbicolare dell'occhio. Le iniezioni nel muscolo corrugatore devono essere praticate nella porzione mediale del muscolo e nella porzione centrale del ventre muscolare almeno 1 cm sopra il bordo osseo dell'orbita.
Rughe periorbitali laterali osservate al massimo sorriso (rughe a zampe di gallina)
Dopo la ricostituzione di Bocouture, iniettare il volume raccomandato pari a 0,1 ml (4 unità bilateralmente in ognuno dei 3 siti di iniezione). Effettuare un'iniezione a 1 cm circa lateralmente rispetto al bordo orbitale osseo. Le altre due iniezioni devono essere effettuate 1 cm circa al di sopra e al di sotto dell'area della prima iniezione.

La dose standard totale raccomandata per trattamento è di 12 unità per lato (dose totale: 24 unità).
Un miglioramento delle rughe periorbitali laterali osservate al massimo sorriso (rughe a zampe di gallina) avviene generalmente entro i primi 6 giorni con l'effetto massimo osservato al giorno 30. L'effetto dura fino a 4 mesi dopo l'iniezione.
Attualmente non sono disponibili dati sull'efficacia e sulla sicurezza relativi al trattamento di rughe periorbitali laterali osservate al massimo sorriso che superino due cicli di iniezioni a distanza di 4 mesi.
Le iniezioni devono essere eseguite per via intramuscolare nel muscolo orbicolare dell'occhio, direttamente sotto il derma per evitare la diffusione di Bocouture. Non praticare iniezioni troppo vicine al muscolo zigomatico maggiore per evitare la ptosi delle labbra.
Tutte le indicazioni
Gli intervalli tra i trattamenti non devono essere inferiori ai 3 mesi.
Se il trattamento non mostra efficacia entro un mese dopo l'iniezione iniziale, prendere le seguenti misure:
- Analisi delle ragioni per la mancata risposta, ad es. dose insufficiente, errata tecnica d'iniezione, possibile sviluppo di anticorpi che neutralizzano le neurotossine
- Verifica del trattamento con la neurotossina botulinica di tipo A come terapia adeguata.
- Nel caso non si siano verificate reazioni avverse durante il trattamento iniziale, può essere eseguito un trattamento aggiuntivo alle seguenti condizioni:
- Aggiustamento della dose con riguardo all'analisi del fallimento della terapia più recente,
- Rispetto dell'intervallo minimo tra il trattamento iniziale e quello aggiuntivo.
Se la terapia fallisce, utilizzare metodi di trattamento alternativi.
Istruzioni posologiche speciali
Pazienti anziani
Sono disponibili dati clinici limitati provenienti dagli studi di fase III sull'utilizzo di Bocouture nei pazienti di oltre 65 anni di età. Finché non saranno disponibili ulteriori dati su questo gruppo anagrafico, Bocouture non è raccomandato per l'uso in pazienti di età superiore ai 65 anni.
Popolazione pediatrica
La sicurezza e l'efficacia di Bocouture nei bambini e negli adolescenti al di sotto dei 18 anni non sono state studiate. Bocouture non è dunque raccomandato nella popolazione pediatrica fin quando non saranno disponibili ulteriori dati.
Controindicazioni
- Ipersensibilità al principio attivo neurotossina botulinica di tipo A (150 kD) o ad uno dei componenti.
- Disturbi generalizzati dell'attività muscolare (ad es. miastenia grave, sindrome di Lambert-Eaton).
- Infezioni o infiammazioni nel sito di iniezione proposto.
Avvertenze e misure precauzionali
Avvertenze generali
Prima di somministrare Bocouture, il medico deve familiarizzare con l'anatomia del paziente e con qualsiasi alterazione dell'anatomia dovuta a precedenti procedure chirurgiche.
Se il sito di iniezione proposto presenta un segno fatto a penna, la soluzione non deve essere iniettata in tale sito onde evitare la possibile comparsa di un effetto tatuaggio permanente.
Prestare attenzione assicurandosi che Bocouture non sia iniettato in un vaso sanguigno.
Bocouture deve essere usato con cautela:
- in presenza di disturbi di coagulazione di qualsiasi tipo
- in pazienti trattati con anticoagulanti o altri principi attivi con azione anticoagulante
- in pazienti affetti da sclerosi laterale amiotrofica
- in pazienti affetti da altre patologie responsabili di disfunzioni neuromuscolari periferiche
- in caso di significativo indebolimento o atrofia del muscolo su cui deve essere effettuata l'iniezione.
Diffusione locale e a distanza dell'effetto della tossina
In seguito a iniezioni di neurotossina botulinica di tipo A effettuate in siti d'iniezione diversi da quelli proposti possono verificarsi effetti indesiderati che possono paralizzare temporaneamente gruppi di muscoli limitrofi.
Sono stati riferiti casi di effetti indesiderati che possono essere collegati alla diffusione della tossina botulinica di tipo A in siti distanti dal sito di iniezione (vedi «Effetti indesiderati»).
Disturbi neuromuscolari pre-esistenti
I pazienti trattati a dosi terapeutiche possono sviluppare eccessiva debolezza muscolare. Nei pazienti con patologie neurologiche croniche, come disturbi della deglutizione, sussiste un maggiore rischio di questi effetti collaterali. Il medicinale può essere assunto da questi pazienti solo sotto controllo di uno specialista e il suo impiego deve avvenire solo qualora il potenziale beneficio giustifichi il rischio.
I pazienti o chi li assiste devono essere informati sulla necessità di rivolgersi immediatamente ad un medico in caso di disturbi di deglutizione, parola o respirazione.
L'iniezione di Bocouture non è raccomandata in pazienti con anamnesi di aspirazione o disfagia.
Reazioni di ipersensibilità
Con i medicinali a base di neurotossina botulinica di tipo A sono state segnalate reazioni di ipersensibilità. Se si verificano reazioni di ipersensibilità gravi (ad es. reazioni anafilattiche) e/o immediate, istituire un'adeguata terapia medica.
Formazione di anticorpi
Iniezioni troppo frequenti di neurotossina botulinica di tipo A potrebbero aumentare il rischio di formazione di anticorpi, che possono causare il fallimento della terapia anche nel trattamento di altre indicazioni.
Interazioni
Non sono stati eseguiti studi di interazione tra farmaci.
Teoricamente, l'effetto della neurotossina botulinica di tipo A può essere potenziato da antibiotici aminoglicosidici o altri medicinali che interferiscono con la trasmissione neuromuscolare, ad es. miorilassanti del tipo della tubocurarina. Pertanto l'uso concomitante di Bocouture con queste sostanze richiede particolare cautela.
Usare con cautela i miorilassanti periferici, se necessario riducendo la dose iniziale del rilassante o utilizzando una sostanza ad azione intermedia come vecuronio o atracurio al posto di sostanze con effetto di maggior durata.
Le 4-aminochinoline possono attenuare l'effetto di Bocouture.
Gravidanza/Allattamento
Gravidanza
Non sono disponibili dati sufficienti sull'utilizzo in gravidanza.
Negli studi sugli animali è stata riscontrata una tossicità per la riproduzione (per maggiori informazioni cfr. il capitolo «Dati preclinici»).
Non è noto il potenziale rischio per l'uomo.
Pertanto, non usare Bocouture durante la gravidanza a meno che non sia evidentemente necessario e che il potenziale beneficio giustifichi il rischio.
Allattamento
Non è noto se la neurotossina botulinica di tipo A venga escreta nel latte materno. Pertanto, Bocouture non deve essere usato durante l'allattamento.
Fertilità
Non ci sono dati clinici sull'uso della neurotossina botulinica di tipo A. In studi sugli animali non sono stati rilevati effetti avversi sulla fertilità maschile e femminile (vedi «Dati preclinici»).
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono stati effettuati studi in merito. Informare i pazienti sulla necessità di evitare di mettersi alla guida o di svolgere attività potenzialmente pericolose se si verificano sintomi quali astenia, capogiri, disturbi della visione, palpebre cadenti, perdita di forza muscolare o debolezza muscolare.
Effetti indesiderati
Avvertenze generali
Solitamente si osservano effetti indesiderati entro la prima settimana dopo il trattamento e sono di natura temporanea. Gli effetti indesiderati possono essere collegati al principio attivo, alla procedura di iniezione o entrambi.
Dolore localizzato, infiammazione, parestesia, ipoestesia, debolezza, gonfiore, edema, eritema, prurito, infezione localizzata, ematoma, sanguinamento e/o lividi possono essere associati all'iniezione.
Dolore correlato all'ago e/o ansia pre-iniezione possono dar luogo a reazioni vasovagali, inclusi ipotensione sintomatica transitoria, nausea, tinnito, sincope.
La debolezza localizzata del muscolo è un effetto farmacologico atteso della tossina botulinica di tipo A.
In seguito al trattamento di malattie neurologiche con tossine botuliniche, gli effetti indesiderati correlati alla diffusione della tossina a distanza dal sito di somministrazione (debolezza muscolare eccessiva, disfagia e polmonite da aspirazione con esito fatale in alcuni casi) sono stati osservati molto raramente con sintomi coerenti con gli effetti della tossina botulinica di tipo A. Tali effetti indesiderati legati all'uso di Bocouture non si possono completamente escludere.
In seguito all'utilizzo di preparati con tossina botulinica, sono state raramente riferite reazioni di ipersensibilità gravi e/o immediate, inclusa anafilassi, malattia da siero, dispnea, edema dei tessuti molli e orticaria. Alcune di queste reazioni sono state riferite in seguito all'uso di un complesso tradizionale di neurotossina botulinica di tipo A sia in monoterapia sia in associazione con altri principi attivi che notoriamente causano reazioni simili.
Effetti indesiderati dopo l'introduzione sul mercato
Con l'uso di Bocouture a partire dal suo lancio sul mercato, sono state segnalate le seguenti reazioni con frequenza non nota indipendentemente dall'indicazione:
Classificazione per sistemi e organi | Reazione avversa |
|---|---|
Disturbi del sistema immunitario | Reazioni di ipersensibilità quali gonfiore, edema (anche a distanza dal sito di iniezione), eritema, prurito, eruzione cutanea (locale e generalizzata) e dispnea |
Patologie del sistema muscoloscheletrico e del tessuto connettivo | Atrofia muscolare |
Patologie sistemiche e condizioni relative al sito di somministrazione | Sintomi simil-influenzali |
Effetti indesiderati provenienti dall'esperienza clinica
Le categorie di frequenze sono definite come segue: molto comune (≥1/10); comune (≥1/100, <1/10); non comune (≥1/1000, <1/100); raro (≥1/10'000, <1/1000); molto raro (<1/10'000), sconosciuto in base alle segnalazioni spontanee della sorveglianza del mercato, non è possibile indicare la frequenza esatta.
Rughe verticali da moderate a gravi tra le sopracciglia (rughe glabellari)
Classificazione per sistemi e organi | Reazione avversa | Frequenza |
|---|---|---|
Infezioni e infestazioni | Rinofaringite | Raro |
Patologie del sistema nervoso | Cefalea | Comune |
Patologie dell'occhio | Edema palpebrale, visione offuscata, ptosi palpebrale | Non comune |
Patologie vascolari | Ematoma | Non comune |
Patologie della cute e del tessuto sottocutaneo | Prurito, ptosi delle sopracciglia | Non comune |
Patologie del sistema muscoloscheletrico e del tessuto connettivo | Segno di Mefisto (sollevamento laterale delle sopracciglia) | Comune |
Asimmetria facciale (asimmetria delle sopracciglia), spasmi muscolari (sopra le sopracciglia) | Non comune | |
Patologie sistemiche e condizioni relative alla sede di somministrazione | Ematoma nel sito di iniezione, dolore al sito di iniezione, sindrome influenzale, debolezza, affaticamento, sensazione di pesantezza delle palpebre/sopracciglia | Non comune |
Rughe periorbitali laterali osservate al massimo sorriso (rughe a zampe di gallina)
Classificazione per sistemi e organi | Reazione avversa | Frequenza |
|---|---|---|
Patologie dell'occhio | Edema delle palpebre, secchezza oculare | Comune |
Patologie sistemiche e condizioni relative alla sede di somministrazione | Ematoma nel sito di iniezione | Comune |
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-benefico del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Dosi superiori di neurotossina botulinica di tipo A possono causare una paralisi neuromuscolare pronunciata lontano dal sito di iniezione con una varietà di sintomi. I possibili sintomi del sovradosaggio possono includere debolezza generale, ptosi, diplopia, difficoltà respiratorie e di parola, paralisi dei muscoli della respirazione o difficoltà di deglutizione che possono provocare polmonite da aspirazione.
I sintomi di solito non si manifestano immediatamente dopo l'iniezione.
In caso di sovradosaggio, il paziente deve essere monitorato dal punto di vista medico per diversi giorni (fino a diverse settimane) per sintomi di eccessiva debolezza muscolare o paralisi muscolare. Può rendersi necessario il trattamento sintomatico, compreso eventuale ricovero in ospedale. Può essere necessaria assistenza respiratoria e intubazione se si verifica la paralisi dei muscoli della respirazione.
Proprietà/Effetti
Codice ATC
M03AX01
Meccanismo d'azione
La neurotossina botulinica di tipo A blocca la trasmissione colinergica alla giunzione neuromuscolare inibendo il rilascio di acetilcolina. I terminali nervosi della giunzione neuromuscolare non rispondono più agli impulsi nervosi e viene impedita la secrezione del neurotrasmettitore nelle placche motorie (denervazione chimica). Il completo recupero della funzione delle placche/trasmissione dell'impulso dopo l'iniezione intramuscolare avviene normalmente entro 3-4 mesi poiché ricrescono i terminali nervosi e si riconnettono alla placca motoria.
La neurotossina botulinica di tipo A blocca il rilascio periferico di acetilcolina alle terminazioni nervose presinaptiche per scissione di SNAP-25 («synaptosomal-associated protein of 25 kDa»). SNAP-25 è una proteina essenziale per legare e rilasciare correttamente l'acetilcolina dalle vescicole situate nelle terminazioni nervose.
Dopo l'iniezione, si verifica inizialmente un legame altamente affine della tossina a recettori specifici della superficie cellulare. Attraverso un processo di endocitosi mediata dai recettori, la tossina viene trasportata attraverso la membrana plasmatica e quindi la catena leggera della tossina viene rilasciata nel citosol. Ciò scinde SNAP-25 e quindi inibisce il rilascio di acetilcolina dalle vescicole dei neurotrasmettitori.
Farmacodinamica
Vedi la sezione «Meccanismo d'azione»
Efficacia clinica
Rughe verticali tra le sopracciglia (rughe glabellari)
Sono stati condotti due studi identici randomizzati, in doppio cieco, multicentrici, controllati con placebo di fase III per valutare l'efficacia di Bocouture nel miglioramento temporaneo delle rughe glabellari da moderate a gravi. Agli studi ha preso parte un totale di 547 pazienti, di cui 193 erano di età superiore ai 50 anni. 55 soggetti erano maschi. Il successo del trattamento è stato definito come miglioramento di 2 punti alla contrazione massima al giorno 30 su una scala Facial Wrinkle a 4 punti (0 = nessuno, 1 = lieve, 2 = moderato, 3 = grave) rispetto al valore basale sia per lo sperimentatore sia per il paziente (end-point composito). Al giorno 30 è stata mostrata una percentuale significativamente più elevata di responder tra i pazienti che ricevono 20 U Bocouture rispetto al placebo. La percentuale di successo è stata di 54,1% nel gruppo Bocouture, mentre non è stato riscontrato alcun miglioramento nei pazienti del gruppo placebo. Gli end-point secondari supportano i risultati degli end-point primari.
In un terzo studio, 169 pazienti (≥18 anni) sono stati trattati con Bocouture nel periodo principale dello studio principale di fase III controllato con placebo in doppio cieco e 236 sono stati trattati nella fase non controllata dello stesso studio. Lo studio ha dimostrato un'efficacia statisticamente significativa e clinicamente rilevante di 20 U Bocouture rispetto al placebo. Questo risultato è stato validato da un numero maggiore di responder al giorno 30 secondo la scala Facial Wrinkle alla contrazione massima nella valutazione sia dello sperimentatore sia del paziente mostrando una percentuale significativamente più elevata di responder tra i pazienti che ricevono 20 U Bocouture rispetto al placebo.
L'analisi dei sottogruppi ha mostrato che l'efficacia nei pazienti al di sopra dei 50 anni è inferiore rispetto ai pazienti più giovani. Di questi, 113 soggetti erano di età pari o inferiore a 50 anni e 56 soggetti avevano più di 50 anni. Negli uomini l'efficacia è minore rispetto alle donne. Di questi, 33 soggetti erano uomini e 136 soggetti erano donne.
In uno studio open-label che valuta la sicurezza a lungo termine di Bocouture, i pazienti che in precedenza avevano partecipato a studi controllati con placebo per il trattamento delle rughe glabellari sono stati trattati con fino a 8 cicli consecutivi. Un totale di 694, 322, 309, 291, 261, 191 e 48 soggetti sono stati trattati nei cicli 2, 3, 4, 5, 6, 7 e 8 rispettivamente. Non è stato riscontrato un aumento della frequenza degli eventi avversi dopo ripetute somministrazioni. Non si sono verificati nuovi eventi inattesi e il profilo di sicurezza era coerente con quello osservato in altri studi.
La non inferiorità di Bocouture rispetto al prodotto di comparazione contenente il complesso di tossina botulinica di tipo A (Onabotulinumtoxin A 900 kD) è stata dimostrata in due studi comparativi, prospettici, multicentrici, randomizzati, in doppio cieco (n=631). I risultati dello studio hanno dimostrato che Bocouture e il prodotto di comparazione hanno simile profilo di efficacia e sicurezza nei pazienti con rughe glabellari da moderate a gravi, quando usato in un rapporto di conversione di dose di 1:1.
Rughe periorbitali laterali osservate al massimo sorriso (rughe a zampe di gallina)
In uno studio di fase III, 111 soggetti con rughe periorbitali laterali da moderate a gravi (rughe a zampe di gallina) osservate al massimo sorriso sono stati trattati durante un ciclo con 12 unità di Bocouture o placebo per lato (area oculare destra/sinistra) confrontando uno schema a 3 punti d'iniezione con uno schema a 4 punti di iniezione. Il successo del trattamento è stato definito come un miglioramento a 4 settimane rispetto al basale, di almeno 1 punto su una scala a 4 punti valutata da un rilevatore indipendente esperto che utilizzava fotografie digitali standardizzate scattate al massimo sorriso per ciascuna area oculare. Sia lo schema a 3 iniezioni sia quello a 4 iniezioni hanno dimostrato una superiorità rispetto al placebo. La percentuale di successo è stata del 69,9% nel gruppo Bocouture rispetto al 21,4% nel gruppo placebo per lo schema a 3 iniezioni e, rispettivamente, del 68,7% rispetto al 14,3% per lo schema a 4 iniezioni. In nessuno dei pazienti trattati con Bocouture è stato osservato un peggioramento. Questo risultato è stato validato dal più elevato numero di responder al giorno 30 secondo la scala a 4 punti al massimo sorriso in base alla valutazione sia del ricercatore sia del paziente, dimostrando una percentuale significativamente più elevata di responder tra i pazienti che avevano ricevuto 12 unità di Bocouture per zona oculare rispetto al placebo.
Nel trattamento combinato delle rughe glabellari e delle rughe periorbitali laterali con Bocouture, l'efficacia e la sicurezza erano simili a quelle del trattamento separato di queste regioni.
Farmacocinetica
Assorbimento
Non è possibile condurre studi di cinetica classica e di distribuzione con la neurotossina botulinica di tipo A poiché la sostanza attiva viene applicata in quantità minime (picogrammi per iniezione) e si lega rapidamente e irreversibilmente ai terminali nervosi colinergici.
La tossina botulinica di sierotipo A naturale è un complesso ad elevato peso molecolare che, oltre alla neurotossina (150 kD), contiene altre proteine non tossiche, come emoaglutinine e non-emoaglutinine. Al contrario delle preparazioni convenzionali che contengono il complesso della tossina botulinica di tipo A, Bocouture contiene la neurotossina pura ed è priva di proteine complessanti.
È stato dimostrato che la neurotossina botulinica di tipo A subisce un trasporto assonale retrogrado dopo iniezione intramuscolare. Tuttavia, non è stato individuato il passaggio transinaptico retrogrado della neurotossina botulinica di tipo A attiva nel sistema nervoso centrale a dosi rilevanti dal punto di vista terapeutico.
La neurotossina botulinica di tipo A che si lega al recettore viene captata per endocitosi nel terminale nervoso prima di raggiungere il suo bersaglio (SNAP 25) e viene poi degradata a livello intracellulare. Le molecole di neurotossina botulinica di tipo A che circolano liberamente e che non si sono legate ai recettori del terminale nervoso colinergico presinaptico, sono fagocitate o pinocitate e degradate come qualunque altra proteina libera circolante.
Distribuzione
Vedi la sezione «Assorbimento»
Metabolismo
Vedi la sezione «Assorbimento»
Eliminazione
Vedi la sezione «Assorbimento»
Dati preclinici
Farmacologia di sicurezza
I dati preclinici non rivelano rischi particolari per l'uomo sulla base di studi convenzionali di farmacologia di sicurezza cardiovascolare e intestinale.
Mutagenicità e Cancerogenicità
Su Bocouture non sono stati eseguiti studi di genotossicità o potenziale cancerogeno.
Tossicità per la riproduzione
Studi sulla tossicità riproduttiva con Bocouture non hanno mostrato né effetti avversi sulla fertilità maschile o femminile nel coniglio né effetti diretti sullo sviluppo embrio-fetale o pre- e post-natale nel ratto e/o nel coniglio. Tuttavia, la somministrazione di Bocouture a intervalli diversi (giornalieri o meno frequenti) in studi di embriotossicità a livelli di dose che comportano riduzioni di peso corporeo per la madre ha aumentato il numero di aborti nei conigli e ha lievemente ridotto il peso corporeo fetale nei ratti.
Altri dati (tossicità locale, fototossicità, immunotossicità)
I risultati degli studi di tossicità a dosi ripetute sulla tossicità sistemica di Bocouture negli animali sono stati principalmente correlati alla sua azione farmacodinamica, ad es. atonia, paresi e atrofia del muscolo iniettato.
Non è stata osservata alcuna evidenza di intollerabilità locale.
Altre indicazioni
Incompatibilità
Il presente medicamento può essere somministrato soltanto in combinazione con i medicamenti riportati alla voce «Indicazioni per la manipolazione».
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Stabilità dopo apertura
La soluzione iniettabile ricostituita non contiene conservanti. La stabilità chimico-fisica in uso è stata dimostrata per 24 ore a una temperatura di 2 °C - 8 °C. Per ragioni microbiologiche, il preparato pronto all'uso deve essere utilizzato immediatamente dopo la diluizione/ricostituzione. Qualora ciò non sia possibile, i tempi e le condizioni di conservazione prima dell'uso sono di responsabilità dell'utilizzatore e generalmente non devono superare le 24 ore a una temperatura di 2-8 °C, a meno che la diluizione/ricostituzione non sia avvenuta in condizioni asettiche controllate e validate.
Indicazioni particolari concernenti l'immagazzinamento
Conservare il medicinale a temperatura ambiente (15-25 °C) o in frigorifero (2-8 °C).
Conservare nella confezione originale.
Tenere fuori dalla portata dei bambini.
Indicazioni per la manipolazione
Prima dell'uso, Bocouture viene ricostituito con soluzione fisiologica sterile. Eseguire la ricostituzione e la diluizione nel rispetto delle linee guida per la buona pratica clinica, con particolare riguardo alla asepsi.
È buona pratica ricostituire il contenuto dei flaconcini e preparare la siringa su salviettine di carta plastificate per trattenere qualunque perdita.
Nella tabella seguente sono indicate le possibili diluizioni di Bocouture 50 e 100 unità:
Dose risultante (in unità per 0,1 ml) | Solvente aggiunto (sodio cloruro 9 mg/ml (0,9%) soluzione iniettabile) | |
|---|---|---|
Flaconcino da 50 unità | Flaconcino da 100 unità | |
4 unità | 1,25 ml | 2,5 ml |
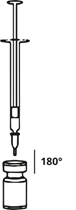
Aspirare una quantità corrispondente allo 0,9% (9 mg/ml) di soluzione di cloruro di sodio (vedi tabella di diluizione) con una siringa. Per la ricostituzione si raccomanda un ago corto smussato di 20-27 G. Detergere la parte esposta del tappo in gomma del flaconcino con alcool (70%) prima dell'inserimento dell'ago. Dopo l'inserimento verticale dell'ago attraverso il tappo di gomma, iniettare il solvente nel flaconcino per evitare la formazione di schiuma. Gettare il flaconcino qualora il vuoto non aspiri il solvente nel flaconcino.
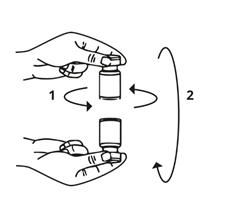
Rimuovere la siringa dal flaconcino e miscelare Bocouture con il solvente ruotando il flaconcino in orizzontale e in verticale con attenzione senza agitarlo con forza. Se necessario, lasciare l'ago utilizzato per la ricostituzione nel flaconcino
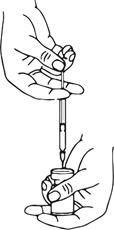
e aspirare la quantità necessaria di soluzione con una nuova siringa sterile adatta alle iniezioni.
Bocouture ricostituito è una soluzione chiara, incolore e priva di particelle.
Non utilizzare Bocouture se la soluzione ricostituita preparata secondo le istruzioni di cui sopra presenta un aspetto torbido o contiene sostanza flocculante o particelle.
Qualunque soluzione iniettabile che è stata conservata per più di 24 ore deve essere gettata via.
PROCEDURA DA SEGUIRE PER UNO SMALTIMENTO SICURO DI FLACONCINI, SIRINGHE E MATERIALI UTILIZZATI
Trattare in autoclave i flaconcini inutilizzati o la soluzione rimanente nel flaconcino e/o le siringhe. In alternativa, Bocouture rimanente può essere inattivato aggiungendo una delle seguenti soluzioni: etanolo al 70%, isopropanolo al 50%, soluzione diluita di sodio idrossido (0,1 N NaOH) o soluzione diluita di sodio ipoclorito (almeno 0,1% NaOCl).
Dopo l'inattivazione, non svuotare i flaconcini, le siringhe e i materiali utilizzati, gettarli in appositi contenitori e smaltirli secondo la normativa locale.
- Raccogliere qualunque fuoriuscita di medicinale: nel caso della polvere usando materiale assorbente impregnato con una qualsiasi delle soluzioni elencate sopra, oppure nel caso di prodotto ricostituito con materiale assorbente asciutto.
- Pulire le superfici contaminate usando materiale assorbente impregnato con una qualsiasi delle soluzioni elencate sopra, e successivamente lasciar asciugare.
- Qualora un flaconcino sia rotto, procedere come sopra raccogliendo con cura le schegge di vetro e pulendo il prodotto, evitando ferite da taglio sulla pelle.
- Qualora il prodotto entri in contatto con la pelle, risciacquare l'area colpita abbondantemente con acqua.
- Qualora il prodotto entri in contatto con una lesione, una ferita da taglio o abrasioni, lavare accuratamente con acqua abbondante e prendere le necessarie misure mediche a seconda della quantità iniettata.
- Qualora il prodotto venga a contatto con gli occhi, sciacquare accuratamente con acqua abbondante o con una soluzione oftalmica per lavaggio oculare.
Numero dell'omologazione
63222 (Swissmedic)
Titolare dell’omologazione
Merz Pharma (Svizzera) SA, 4123 Allschwil
Stato dell'informazione
Giugno 2020
Composition
Principes actifs
Toxine botulique A.
Excipients
Albumine humaine, saccharose.
Forme pharmaceutique et quantité de principe actif par unité
Poudre pour solution injectable.
Un flacon contient:
Principe actif: 50 ou 100 unités DL50* de neurotoxine botulique de type A (150 kD), sans protéines complexantes.
* Une unité correspond à la dose létale médiane (DL50) après injection intrapéritonéale de la solution reconstituée à des souris dans des conditions définies. En raison de différences entre les méthodes de test de la DL50, ces unités sont spécifiques à Bocouture et ne s'appliquent pas à d'autres préparations à base de toxine botulique de type A.
Administration par voie intramusculaire.
Indications/Possibilités d’emploi
Bocouture est utilisé pour améliorer temporairement l'apparence
- des rides verticales intersourcilières modérées à profondes (rides glabellaires) observées lors du froncement des sourcils et/ou
- des rides latérales périorbitaires modérées à profondes (pattes d'oie) visibles lors d'un sourire forcé
chez l'adulte de moins de 65 ans, lorsque la sévérité de ces rides entraîne un retentissement psychologique important chez le patient.
Posologie/Mode d’emploi
Remarques générales
Bocouture ne doit être administré que par des médecins formés au traitement à base de toxine botulique de type A.
En raison de différences entre les méthodes de test de la DL50, les dosages recommandés ci-après sont spécifiques à Bocouture et ne s'appliquent pas à d'autres préparations à base de toxine botulique de type A.
Bocouture est exclusivement destiné à une injection par voie intramusculaire après reconstitution. Pour plus d'informations sur la reconstitution et la dilution des flacons, voir «Remarques particulières, remarques concernant la manipulation».
Après reconstitution, Bocouture est injecté à l'aide d'une aiguille stérile fine (par exemple 30-33G/0,20-0,30 mm de diamètre/13 mm de long).
Afin d'assurer la traçabilité des médicaments biotechnologiques, il est recommandé de documenter le nom commercial et le numéro de lot à chaque traitement.
Posologie usuelle
Rides verticales entre les sourcils (rides glabellaires)
Après la reconstitution de Bocouture, le volume d'injection recommandé de 0,1 ml (4 unités) est administré dans chacun des 5 sites d'injection: deux injections dans chaque muscle corrugator et une injection dans le muscle procerus. Cela correspond à une dose standard de 20 unités. Le médecin peut augmenter la dose jusqu'à 30 unités en fonction des besoins de chaque patient.
Une amélioration des rides verticales intersoucilières (rides glabellaires) survient généralement dans les 2 à 3 jours, l'effet maximal étant observé le 30e jour. L'effet peut persister jusqu'à 4 mois après l'injection.
Avant et pendant l'injection, appuyer le pouce et l'index fermement sous le rebord orbitaire afin d'éviter une diffusion de la solution dans cette zone. Pendant l'injection, l'aiguille doit être orientée vers le haut et vers la ligne médiane. Afin de réduire le risque de blépharoptôse, les injections à proximité du muscle releveur de la paupière supérieure et dans la portion crânienne du muscle orbiculaire des paupières doivent être évitées. Les injections dans le muscle corrugator doivent être effectuées dans la partie médiane de ce muscle, ainsi que dans la partie centrale du ventre musculaire, à au moins 1 cm au-dessus du bord osseux de l'arcade sourcilière.
Rides latérales périorbitaires (pattes d'oie) visibles lors d'un sourire forcé
Après la reconstitution de Bocouture, le volume d'injection recommandé de 0,1 ml (4 unités) est administré dans chacun des 3 sites d'injection de chaque côté. Une injection est réalisée à environ 1 cm sur le bord latéral de la cavité orbitaire. Les deux autres injections sont réalisées à env. 1 cm au-dessus et 1 cm en-dessous du premier point d'injection.

La dose totale habituellement recommandée par séance d'injection est de 12 unités par côté (soit une dose normale totale de 24 unités).
Une amélioration des rides latérales périorbitaires (pattes d'oie) visibles lors d'un sourire forcé est généralement observée au cours des 6 premiers jours, avec un effet maximal au 30e jour. L'effet persiste jusqu'à 4 mois après l'injection.
Aucune donnée d'efficacité ou de sécurité du traitement des rides latérales périorbitaires observées lors d'un sourire forcé n'est actuellement disponible au-delà de deux cycles d'injection espacés de 4 mois.
Pour éviter la diffusion de Bocouture, les injections doivent être réalisées par voie intramusculaire au niveau des muscles orbiculaires, directement sous le derme. Les injections trop proches du muscle grand zygomatique doivent être évitées de manière à prévenir une ptôse de la lèvre.
Toutes les indications
Les intervalles entre deux séances de traitement ne doivent pas être inférieurs à 3 mois.
En cas d'absence d'amélioration un mois après la première séance d'injections, il y a lieu:
- d'analyser les causes de non-réponse, par exemple: dose insuffisante, mauvaise technique d'injection, formation éventuelle d'anticorps qui neutralisent la toxine botulique;
- de réévaluer la pertinence du traitement par la toxine botulique de type A;
- en l'absence d'effets indésirables lors de la première séance d'injections, de pratiquer une deuxième séance d'injections dans les conditions suivantes:
- ajuster la dose en tenant compte de l'échec du traitement précédent;
- respecter un intervalle minimal de 3 mois entre les 2 séances d'injections.
En cas d'échec du traitement, il y a lieu d'envisager d'autres méthodes de traitement.
Instructions posologiques particulières
Patients âgés
Les données des études cliniques de phase III chez des sujets de plus de 65 ans sont limitées. Jusqu'à ce que des études soient conduites dans ce groupe d'âge, l'utilisation de Bocouture chez des patients de plus de 65 ans n'est pas recommandée.
Enfants et adolescents
Bocouture n'ayant pas fait l'objet d'études pédiatriques, son utilisation est déconseillée chez les enfants et adolescents de moins de 18 ans, jusqu'à ce que des données supplémentaires soient disponibles.
Contre-indications
- Hypersensibilité à la neurotoxine botulique de type A (150 kD) ou à l'un des composants du produit.
- Troubles généralisés de l'activité musculaire (p.ex. myasthénie grave, syndrome de Lambert-Eaton).
- Infection ou inflammation au point d'injection prévu.
Mises en garde et précautions
Généralités
Avant toute administration de Bocouture, le médecin doit se familiariser avec l'anatomie du patient et avec toute modification anatomique consécutive à des traitements chirurgicaux antérieurs.
Si les points d'injection prévus sont marqués au stylo, le produit ne doit pas être injecté à travers les points marqués car ceci peut entraîner un effet de tatouage permanent.
Des précautions doivent être prises afin de s'assurer que Bocouture ne soit pas injecté dans un vaisseau sanguin.
Bocouture doit être utilisé avec précaution dans les cas suivants:
- en cas de troubles de la coagulation, de quelque sorte qu'ils soient
- chez les patients traités avec des anticoagulants ou d'autres substances ayant un effet anticoagulant
- chez les patients souffrant de sclérose latérale amyotrophique
- chez les patients présentant d'autres maladies provoquant des dysfonctions neuromusculaires périphériques
- en cas de faiblesse prononcée ou d'atrophie des muscles cibles.
Diffusion locale et à distance de l'effet de la toxine
Des effets indésirables liés à une injection mal placée de toxine botulique de type A peuvent temporairement paralyser les muscles situés à proximité.
On a signalé des effets indésirables qui pourraient être associés à la propagation de la toxine botulique de type A vers des sites éloignés du site d'application (voir chapitre «Effets indésirables»).
Maladies neuromusculaires préexistantes
Une faiblesse musculaire excessive peut apparaître, même chez les patients traités à des doses thérapeutiques. Chez les patients atteints de troubles neurologiques sous-jacents tels que des troubles de la déglutition, le risque d'apparition de ces effets indésirables est accru. Chez ces patients, le médicament doit être utilisé exclusivement sous la surveillance d'un spécialiste et uniquement si les bénéfices du traitement sont plus importants que ses risques.
Les patients ou leurs soignants doivent être informés de la nécessité de prévenir immédiatement les services d'urgence en cas de troubles de la déglutition, de la parole ou respiratoires.
L'injection de Bocouture est déconseillée chez les patients ayant des antécédents de dysphagie et de pneumopathie d'inhalation.
Réactions d'hypersensibilité
Des réactions d'hypersensibilité ont été signalées après l'administration de neurotoxine botulique de type A. En cas de réactions d'hypersensibilité graves (p.ex. anaphylaxie) et/ou immédiates, il convient de mettre en place un traitement médical approprié.
Formation d'anticorps
Des injections de neurotoxine botulique de type A trop fréquentes peuvent augmenter le risque de formation d'anticorps, susceptible d'induire un échec thérapeutique quand le produit est utilisé pour d'autres indications.
Interactions
Aucune étude d'interaction n'a été menée.
En théorie, l'effet de la neurotoxine botulique de type A peut être potentialisé par l'utilisation d'antibiotiques aminoglycosides ou d'autres médicaments agissant sur la transmission neuromusculaire, tels que les myorelaxants de type tubocurarine. L'utilisation simultanée de Bocouture avec ces substances requiert donc des précautions particulières.
Les myorelaxants périphériques sont à utiliser avec précaution, au besoin en diminuant leur dose de départ ou en utilisant une substance à durée d'action moyenne comme le vécuronium ou l'atracurium plutôt que des substances ayant des effets prolongés.
Les amino-4-quinoléines peuvent atténuer l'effet de Bocouture.
Grossesse/Allaitement
Grossesse
Il n'existe pas de données suffisantes concernant l'emploi chez la femme enceinte.
Les expérimentations animales ont révélé une toxicité de reproduction (données plus précises sous la rubrique «Données précliniques»).
Le risque potentiel pour l'être humain n'est pas connu.
Bocouture ne doit donc pas être administré pendant la grossesse, à moins d'une nécessité absolue et si le bénéfice potentiel en justifie le risque.
Allaitement
On ignore à l'heure actuelle si la neurotoxine botulique de type A est excrétée dans le lait maternel. Bocouture ne doit donc pas être utilisé pendant l'allaitement.
Fécondité
Il n'existe pas de données cliniques concernant les effets de l'utilisation de Bocouture sur la fertilité. Aucun effet indésirable sur la fertilité mâle ou femelle n'a été observé dans les études sur les animaux (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée. Les patients doivent être informés qu'en cas de symptômes tels que fatigue, étourdissements, troubles de la vision, blépharoptôse, perte de tonus musculaire ou faiblesse musculaire, la capacité à conduire et à exécuter des tâches potentiellement dangereuses peut être limitée et qu'il convient donc d'éviter ce type d'activités.
Effets indésirables
Généralités
Les effets indésirables surviennent généralement au cours de la première semaine suivant l'injection et sont transitoires. Ils peuvent être liés au principe actif, à la technique de l'injection ou aux deux.
Comme pour toute autre injection, des douleurs locales, inflammations, paresthésies, une hypoesthésie, une sensibilité à la pression, des gonflements/œdèmes, érythèmes, démangeaisons, infections locales, hématomes, saignements et/ou ecchymoses dus à l'injection peuvent survenir.
La douleur liée à l'injection et/ou la peur de l'injection peut induire une réponse vasovagale, y compris une hypotension symptomatique transitoire, des nausées, des acouphènes et des syncopes.
Une faiblesse musculaire localisée est un effet pharmacologique attendu de la toxine botulique type A.
Après le traitement de maladies neurologiques avec de la toxine botulinique, dans de très rares cas, des effets indésirables associés à la propagation de la toxine vers des sites éloignés du site d'injection ont été signalés, où les symptômes de l'effet de la toxine botulinique de type A sont les mêmes (faiblesse musculaire excessive, dysphagie, pneumopathie d'inhalation d'issue parfois fatale). Ces effets indésirables ne peuvent pas non plus être complètement exclus lors de l'administration de Bocouture.
Dans de rares cas, des réactions d'hypersensibilité graves et/ou immédiates aux préparations à base de toxine botulique ont été signalées, incluant anaphylaxie, maladie sérique, dyspnée, œdème des tissus mous et urticaire. Certaines de ces réactions ont été signalées après l'utilisation de préparations conventionnelles à base de complexe de neurotoxine botulique de type A uniquement ou en association avec d'autres substances connues pour déclencher des réactions similaires.
Effets indésirables après commercialisation
Depuis la mise sur le marché de Bocoutre, les effets indésirables suivants independament de l'indictaion ont été rapportés à une fréquence inconnue:
Classes de systèmes d'organes | Réactions indésirables |
|---|---|
Affection du système immunitaire | Réactions d'hypersensibilité telles que gonflement, œdème (y compris à distance du site d'injection), érythème, prurit, rash cutané (localisé ou généralisé) et des difficultés respiratoires |
Affections musculo-squelettiques et du tissu conjonctif | Atrophie musculaire |
Troubles généraux et anomalies au site d'administration | Syndromes pseudo-grippaux |
Effets indésirables rapportés dans les études cliniques
La fréquence est définie comme suit: très fréquents (≥1/10); fréquents (≥1/100, <1/10); occasionnels (≥1/1000, <1/100); rares (≥1/10'000, <1/1000); très rares (<1/10'000), cas isolés basés sur des signalements spontanés après la mise sur le marché, détermination exacte de la fréquence impossible.
Rides verticales entre les sourcils (rides glabellaires)
Classes de systèmes d'organes | Réaction indésirable | Fréquence |
|---|---|---|
Infections et infestations | Rhinopharyngite | Rares |
Affections du système nerveux | Céphalées | Fréquents |
Affections oculaires | Oedème palpébral, vision trouble, blépharoptôse | Occasionnels |
Affections vasculaires | Hématome | Occasionnels |
Affections de la peau et du tissu sous-cutané | Prurit, ptôse des sourcils | Occasionnels |
Affections musculo-squelettiques et du tissu conjonctif | Effet Méphisto (soulèvement latéral des sourcils) | Fréquents |
Asymétrie faciale (asymétrie des sourcils), crampes musculaires (au-dessus des sourcils) | Occasionnels | |
Troubles généraux et anomalies au site d'administration | Hématome au site d'injection, douleur au site d'injection, syndrome grippal, douleur de pression, fatigue, sensation de lourdeur de la paupière et/ou des sourcils | Occasionnels |
Rides latérales périorbitaires (pattes d'oie) visibles lors d'un sourire forcé
Classes de systèmes d'organes | Réaction indésirable | Fréquence |
|---|---|---|
Affections oculaires | Oedème palpébral, sécheresse oculaire | Fréquents |
Troubles généraux et anomalies au site d'administration | Hématome au site d'injection | Fréquents |
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Des doses élevées de neurotoxine botulique de type A peuvent déclencher à distance du site d'injection des paralysies neuromusculaires marquées. Les symptômes possibles d'un surdosage sont une faiblesse musculaire générale, une ptôse, une diplopie, des troubles respiratoires et d'élocution, une paralysie des muscles respiratoires ou des troubles de la déglutition. Il peut s'ensuivre une pneumopathie d'inhalation.
Les symptômes n'apparaissent généralement pas immédiatement après l'injection.
En cas de surdosage, le patient doit être placé sous surveillance médicale pendant plusieurs jours (voire plusieurs semaines) afin de détecter l'apparition de symptômes tels qu'une faiblesse musculaire excessive et une paralysie musculaire. Un traitement symptomatique, pouvant aller jusqu'à l'hospitalisation, peut s'avérer nécessaire. En cas de paralysie des muscles respiratoires, une intubation et une assistance respiratoire peuvent être requises.
Propriétés/Effets
Code ATC
M03AX01
Mécanisme d'action
La neurotoxine botulique de type A bloque la transmission cholinergique au niveau de la jonction neuromusculaire en inhibant la libération d'acétylcholine. Les terminaisons nerveuses des connexions neuromusculaires ne réagissent plus aux influx nerveux, empêchant ainsi la sécrétion du neurotransmetteur aux plaques terminales motrices (dénervation chimique). Le rétablissement complet de la fonction motrice/conduction nerveuse survient dans les 3 à 4 mois suivant l'injection grâce à la formation de nouvelles terminaisons nerveuses et à leur reconnexion avec les plaques terminales motrices.
La neurotoxine botulique de type A bloque la libération périphérique d'acétylcholine au niveau des terminaisons présynaptiques par le clivage de la protéine SNAP-25 («synaptosomal-associated protein of 25 kDa»). SNAP-25 est une protéine importante pour assurer la liaison et la libération de l'acétylcholine par les vésicules qui se trouvent dans les terminaisons nerveuses.
L'injection est d'abord suivie d'une liaison à forte affinité de la toxine avec des récepteurs spécifiques présents à la surface des cellules. Un processus d'endocytose déclenché par les récepteurs permet à la toxine de traverser la membrane cellulaire et libère la chaîne légère de la toxine dans le cytosol, induisant le clivage de la protéine SNAP-25 et inhibant ainsi la libération d'acétylcholine par les vésicules de neurotransmetteurs.
Pharmacodynamique
Voir rubrique «Mécanisme d'action»
Efficacité clinique
Rides verticales entre les sourcils (rides glabellaires)
Deux études de phase III identiques randomisées, en double aveugle, multicentriques, contrôlées versus placebo ont été menées afin d'évaluer l'utilisation de Bocouture pour l'atténuation temporaire des rides glabellaires modérées à prononcées. Au total, les études incluaient 547 patients, dont 193 patients >50 ans. 55 sujets étaient des hommes. La réussite du traitement a été définie comme l'amélioration de 2 points lorsque les sourcils sont froncés au maximum le 30e jour, sur une échelle de 4 points (Facial Wrinkle Scale, FWS, 0 = aucun, 1 = léger, 2 = moyen, 3 = prononcé) par rapport à la situation initiale, à la fois pour le médecin investigateur et le patient (critère principal combiné). Au jour 30, la réponse sous 20 unités de Bocouture était, d'un point de vue statistique, significativement supérieure au placebo. Le taux de réussite était de 54,1% dans le groupe sous Bocouture, alors qu'aucun patient n'a manifesté d'amélioration dans le groupe sous placebo. Les critères secondaires étayent les résultats du critère principal.
Dans une troisième étude, 169 patients (≥18 ans) ont été traités avec Bocouture dans la phase contrôlée contre placebo de l'étude de phase III en double aveugle pour l'autorisation, ainsi que 236 patients dans la phase non contrôlée de cette étude. En comparaison avec le placebo, l'étude a montré une efficacité statistiquement significative et cliniquement pertinente de 20 unités de Bocouture. Ceci a été étayé par le nombre de patients ayant répondu au traitement avec les sourcils froncés au maximum le 30e jour lors de l'évaluation, conformément à l'échelle des rides du visage (Facial Wrinkle Scale), par le médecin investigateur respectivement par le patient.
La réponse sous 20 unités de Bocouture était significativement plus élevée par rapport au placebo. Des analyses des sous-groupes ont indiqué une efficacité plus faible chez les patients âgés de 50 ans ou plus par rapport aux patients plus jeunes. 113 patients avaient 50 ans ou moins et 56 patients avaient plus de 50 ans. L'efficacité chez les hommes était plus faible que chez les femmes. 33 patients étaient des hommes et 136 des femmes.
Dans une étude open-label pour l'évaluation de la sécurité à long terme de Bocouture, des patients ayant participé auparavant à des études contrôlées par placebo sur le traitement des rides glabellaires ont été traités de manière répétée jusqu'à 8 fois. Un nombre total de 694, 322, 309, 291, 261, 191 et 48 sujets ont été traités dans les cycles de traitement 2, 3, 4, 5, 6, 7 et 8. Aucune hausse de la fréquence des effets indésirables n'a été constatée après une administration répétée. Aucun effet indésirable nouveau ou inattendu n'est apparu et le profil de sécurité correspondait à celui observé dans les autres études.
La non-infériorité de Bocouture, par rapport à un produit comparatif contenant le complexe de toxine botulique de type A (l'onabotulinumtoxine A 900 kD), a été démontrée dans deux études comparatives, prospectives, multicentriques, randomisées réalisées en double aveugle (n=631) après une administration unique (20 et 24 unités). Les résultats de l'étude indiquent aussi que Bocouture et ce produit de comparaison avaient un profil d'efficacité et de sécurité comparable chez les patients avec des rides glabellaires modérées à sévères, s'ils sont administrés dans un rapport de dose de 1:1.
Rides latérales périorbitaires (pattes d'oie) visibles lors d'un sourire forcé
Dans une étude clinique de phase III, 111 patients présentant des rides latérales périorbitaires (pattes d'oie) moyennes à profondes visibles lors d'un sourire forcé, ont été traités avec 12 unités de Bocouture ou de placebo par côté (région de l'œil droit/gauche) pendant un cycle d'injection. On a comparé un schéma d'injection en 3 points avec un schéma en 4 points. On a considéré que le traitement avait réussi lorsqu'on observait une amélioration d'au moins 1 point sur une échelle de 4 points. L'évaluation a été effectuée pour les deux yeux lors d'un sourire forcé par un comité d'experts indépendant, en s'appuyant sur des photos numériques standardisées en comparaison avec la situation de départ. Les schémas d'injection en 3 et en 4 points se sont tous les deux révélés supérieurs au traitement par le placebo. Avec le schéma d'injection à 3 points, le taux de réussite était de 69,9% dans le groupe Bocouture contre 21,4% dans le groupe placebo, tandis qu'avec le schéma à 4 points, il était de 68,7% contre 14,3%. Aucune détérioration n'a été observée chez les patients traités avec Bocouture. Cela a été confirmé par le grand nombre de patients qui présentaient un résultat positif au bout de 30 jours en se basant sur une évaluation par les experts et les patients eux-mêmes sur une échelle de 4 points. On a observé une proportion de réussite bien plus importante chez les patients ayant reçu 12 unités de Bocouture par région oculaire que chez ceux qui avaient été traités avec le placebo.
Lors du traitement combiné des rides glabellaires et des rides latérales périorbitaires avec Bocouture, l'efficacité et l'innocuité étaient les mêmes que lors du traitement séparé de ces régions.
Pharmacocinétique
Absorption
Les études cinétiques et de distribution classiques ne peuvent être réalisées avec la neurotoxine botulique de type A car le principe actif est appliqué en quantités infimes (picogramme par injection) et se lie rapidement et de manière irréversible aux terminaisons nerveuses cholinergiques.
La toxine botulique native de sérotype A est un complexe de masse moléculaire élevée (complexe de toxine botulique de type A) qui contient, outre la neurotoxine (150 kD), d'autres protéines non toxiques hémagglutinantes et non hémagglutinantes. Contrairement au complexe de toxine botulique de type A, Bocouture ne contient que la neurotoxine à l'état pur et aucune protéine complexante.
Il a été démontré que la neurotoxine botulique de type A suivait un transport axonal rétrograde après l'injection intramusculaire. Par contre, on n'a pas observé de passage transsynaptique rétrograde de la neurotoxine botulique active de type A dans le système nerveux central à des doses significatives sur le plan thérapeutique.
La neurotoxine botulique de type A liée au récepteur pénètre par endocytose dans la terminaison nerveuse avant d'atteindre sa cible (SNAP-25). Elle est finalement décomposée au niveau intracellulaire. Les molécules de neurotoxine botulique de type A circulant librement et qui ne se sont pas liées aux récepteurs présynaptiques au niveau des terminaisons nerveuses cholinergiques sont capturées par phagocytose ou pinocytose et décomposées à l'instar des autres protéines circulant librement.
Distribution
Voir rubrique «Absorption»
Métabolisme
Voir rubrique «Absorption»
Élimination
Voir rubrique «Absorption»
Données précliniques
Pharmacologie de sécurité
Des études précliniques de sécurité pharmacologique portant sur l'effet de Bocouture sur le système cardiovasculaire et intestinal n'ont démontré aucun accroissement du risque chez l'homme.
Mutagénicité et Carcinogénicité
Aucune étude n'a été menée sur le potentiel génotoxique ou cancérigène de Bocouture.
Toxicité sur la reproduction
Dans des études de toxicité pour la reproduction chez le rat et le lapin, aucune atteinte de la fécondité du mâle ou de la femelle ni influence directe sur le développement embryonnaire ou sur le développement pré- et post-natal n'a été observée sous Bocouture. Toutefois, l'administration de Bocouture à différents intervalles (tous les jours ou moins souvent) dans des études d'embryotoxicité, à des doses entraînant une réduction du poids corporel maternel, a entraîné une augmentation du taux d'avortement chez le lapin et une légère réduction du poids corporel fœtal chez le rat.
Autres données (toxicité locale, phototoxicité, immunotoxicité)
Les résultats d'études de toxicité systémique après administration répétée de Bocouture ont été essentiellement conformes aux propriétés pharmacodynamiques, c'est-à-dire relâchement, paralysie et atrophie du muscle injecté.
Aucun cas d'intolérance locale n'a été signalé.
Remarques particulières
Incompatibilités
Ce médicament ne peut être mélangé qu'aux médicaments mentionnés sous Remarques concernant la manipulation.
Stabilité
Le médicament ne doit pas être utilisé après la date figurant après la mention «EXP» sur l'emballage.
Stabilité après ouverture
La solution injectable reconstituée ne contient pas de conservateur. Sa stabilité chimique et physique «in use» a été démontrée pendant 24 heures à 2-8 °C. Pour des raisons microbiologiques, la préparation prête à l'emploi doit être utilisée immédiatement après dilution/reconstitution. Si cela n'est pas possible, le délai d'utilisation et les conditions de stockage relèvent de la responsabilité de l'utilisateur mais, de manière générale, l'entreposage ne devrait pas dépasser 24 heures à une température comprise entre 2 et 8 °C, sauf si la dilution/reconstitution se déroule dans des conditions aseptiques contrôlées et validées.
Remarques particulières concernant le stockage
Conserver le médicament à température ambiante (15-25 °C) ou au réfrigérateur (2-8 °C).
Conserver dans l'emballage d'origine.
Tenir hors de portée des enfants.
Remarques concernant la manipulation
Avant utilisation, Bocouture est reconstitué à l'aide de sérum physiologique stérile. La reconstitution et la dilution doivent s'effectuer en respectant les mesures standard, notamment en termes de manipulation aseptique.
La reconstitution du contenu du flacon et son aspiration dans la seringue doivent être effectuées sur des tissus en papier recouverts de plastique, pour recueillir le produit éventuellement dispersé.
Le tableau suivant indique la dilution pour Bocouture 50 unités et 100 unités:
Dose reçue (en unités pour 0,1 ml) | Quantité de solvant ajoutée (chlorure de sodium 9 mg/ml (0,9%) en solution injectable) | |
|---|---|---|
Bouteille de 50 unités à bouchon perçable pour seringue | Bouteille de 100 unités à bouchon perçable pour seringue | |
4 unités | 1,25 ml | 2,5 ml |
On aspire la quantité requise de solution de chlorure de sodium à 0,9% (9 mg/ml) (voir tableau de dilution) avec une seringue. Il est recommandé d'utiliser une canule courte de 20-27 G pour la reconstitution. Nettoyer à l'alcool (70%) la partie exposée du bouchon en caoutchouc du flacon avant d'y enfoncer l'aiguille. Après avoir introduit verticalement l'aiguille à travers le bouchon en caoutchouc du flacon, la reconstitution doit être effectuée lentement afin d'éviter la formation de bulles. Ne pas utiliser le flacon s'il n'y a pas à l'intérieur une dépression qui aspire la solution contenue dans la seringue.
Sortir la seringue du flacon et mélanger lentement Bocouture avec le solvant en faisant tourner le flacon de façon circulaire et en l'inclinant (de droite à gauche et à l'envers) – ne pas secouer fortement. Si nécessaire, la canule avec laquelle la reconstitution a été effectuée doit rester dans le flacon.
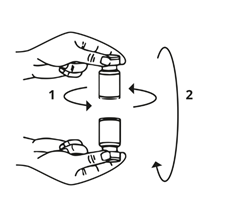
La quantité de solution nécessaire doit être prélevée avec une nouvelle seringue stérile.
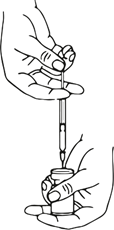
La solution reconstituée de Bocouture est limpide, incolore et exempte de particules.
Ne pas utiliser Bocouture si la solution reconstituée conformément aux instructions ci-dessus paraît trouble, contient des particules ou présente une floculation.
Les solutions injectables conservées plus de 24 heures doivent être jetées.
PROCEDURE D'ELIMINATION EN TOUTE SECURITE DES FLACONS, SERINGUES ET MATERIAUX UTILISES
Les flacons non utilisés ou les restes de solution dans les flacons et/ou les seringues doivent être stérilisés à l'autoclave. On peut aussi désactiver le Bocouture restant en y ajoutant l'un des solvants suivants: éthanol à 70%, isopropanol à 50%, solution d'hydroxyde de sodium diluée (0,1 N NaOH) ou solution d'hypochlorite de sodium diluée (au moins 0,1% de NaOCl).
Les flacons, seringues et consommables usagés ne doivent pas être vidés, mais mis au rebut dans des conteneurs appropriés et conformément aux règlements locaux.
- Tous les médicaments renversés doivent être nettoyés: s'il s'agit de la poudre, à l'aide d'un matériau absorbant imbibé de l'une des solutions mentionnées ci-dessus ou, s'il s'agit de la solution reconstituée, d'un matériau absorbant sec.
- Les surfaces contaminées doivent être nettoyées avec une matière absorbante imbibée de l'une des solutions mentionnées ci-dessus. Laisser ensuite sécher.
- En cas de bris d'un flacon, procéder comme indiqué précédemment, les éclats de verre doivent être rassemblés et le médicament essuyé avec prudence afin d'éviter les coupures.
- Si le médicament entre en contact avec la peau, rincer abondamment la zone de peau touchée avec de l'eau.
- Si le médicament entre contact avec une plaie, une coupure ou une zone cutanée non intacte, bien rincer avec de l'eau et prendre les mesures médicales qui s'imposent en fonction de la dose injectée.
- Si le médicament entre en contact avec les yeux, rincer abondamment à l'eau ou à l'aide d'une solution prévue à cet effet.
Numéro d’autorisation
63222 (Swissmedic)
Titulaire de l’autorisation
Merz Pharma (Schweiz) AG, 4123 Allschwil
Mise à jour de l’information
Juin 2020
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French Italian
Italian















