Varilrix Trockensub with solvent Fertspr 0.5 ml
Varilrix Trockensub mit Solvens Fertspr 0.5 ml
-
116.57 CHF
- Price in reward points: 3131

- Availability: Not available
- Product Code: 7766692
- ATC-code J07BK01
- EAN 7680005850034
Ingredients:
Aminosäuren, Mannitol, Sorbitol 6 mg, Lösungsmittel, Varizellen-Lebend-Impfstoff attenuiert (Stamm OKA) 10^3.3 U , Neomycin sulfat, Lactose, pro vitro, Vaccinum attenuatum:.

Description
Zusammensetzung
Wirkstoffe
OKA-Stamm des Varicella-Zoster-Virus.
Hilfsstoffe
Pulver: Aminosäuren, Lactose, Mannitol (E 421), Sorbitol (E 420) 6 mg.
Lösungsmittel: Wasser für Injektionszwecke.
Rückstände
Neomycinsulfat.
Darreichungsform und Wirkstoffmenge pro Einheit
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung.
Eine Dosis (0,5 mL) des rekonstituierten Impfstoffes enthält mindestens 103.3 PBE (Plaque-bildende Einheiten) des Varicella-Zoster-Virus, Stamm OKA.
Das Pulver ist hell-cremefarben bis gelblich oder blassrosa. Das Lösungsmittel ist klar und farblos.
Indikationen/Anwendungsmöglichkeiten
Gesunde Personen
Varilrix ist indiziert für die aktive Immunisierung von gesunden Kindern ab dem vollendeten 12. Lebensmonat, Jugendlichen und Erwachsenen gegen Varizellen (Windpocken).
Es liegt im Ermessen des Arztes, Varilrix in speziellen Indikationen/Situationen bereits ab dem vollendeten 9. Lebensmonat anzuwenden, z.B. wenn für das Kind ein hohes Risiko besteht, an einer schweren Varizella zu erkranken, oder wenn es in einem nahen Kontakt zu einem Risikopatienten steht.
Risikopatienten und gesunde Kontaktpersonen
Varilrix ist indiziert für die aktive Immunisierung von Risikopatienten sowie von nicht-immunen Personen, welche in engem Kontakt mit diesen leben.
Patienten mit akuter Leukämie
Patienten mit akuter Leukämie sind bei einer Varizelleninfektion besonders gefährdet und sollten, wenn sie noch nie an Varizellen erkrankt, beziehungsweise seronegativ sind, geimpft werden.
Wenn die Patienten in der akuten Phase der Leukämie immunisiert werden, sollte die Chemotherapie während einer Woche vor und einer Woche nach der Impfung unterbrochen werden. Patienten unter Strahlentherapie sollten normalerweise nicht während der Behandlungsphase geimpft werden.
Patienten werden in der Regel dann geimpft, wenn sie sich in einer kompletten hämatologischen Remission befinden. Es soll geimpft werden, wenn die totale Lymphozytenzahl mindestens 1'200 pro mm3 beträgt oder kein Hinweis für das Fehlen der zellulären Immunkompetenz besteht.
Patienten unter immunsuppressiver Therapie
Für einen schweren Verlauf der Varizelleninfektion besonders empfindlich sind Patienten mit immunsuppressiver Therapie (Kortikosteroid-Therapie eingeschlossen), bei bösartigen Tumoren oder bei schwerwiegenden chronischen Erkrankungen (wie z.B. chronische Niereninsuffizienz, Autoimmunerkrankungen, Kollagenosen, schweres Bronchialasthma).
Es soll geimpft werden, wenn die totale Lymphozytenzahl mindestens 1'200 pro mm3 beträgt oder kein anderer Mangel an zellulärer Immunkompetenz besteht.
Patienten mit geplanter Organtransplantation
Wenn eine Organtransplantation in Betracht gezogen wird (z.B. Nierentransplantation), sollte die Impfung ca. 6 – 8 Wochen vor der Verabreichung der immunsupprimierenden Therapie durchgeführt werden.
Patienten mit chronischer Erkrankung
Andere chronische Erkrankungen wie Störungen des Metabolismus oder des endokrinen Systems, chronische Lungenerkrankungen und kardiovaskuläre Erkrankungen, Mukoviszidose und neuromuskuläre Anomalien können ebenfalls prädisponierende Faktoren für einen schweren Verlauf einer Varizelleninfektion sein. In solchen Fällen kann die Varizellen-Impfung schwere Komplikationen verhindern.
Gesunde Kontaktpersonen
Empfindliche gesunde Kontaktpersonen sollten geimpft werden, um das Risiko einer Übertragung des Virus auf die Risikopatienten zu reduzieren. Dabei sind die Eltern und Geschwister von Risikopatienten, das medizinische und paramedizinische Personal sowie andere Personen, welche in nahem Kontakt zu Varizellen- oder Risikopatienten stehen, miteingeschlossen.
Varilrix sollte gemäss den offiziellen Impfempfehlungen angewendet werden.
Dosierung/Anwendung
Übliche Dosierung
Gesunde Personen
Eine Impfdosis beträgt 0,5 ml des rekonstituierten Impfstoffes.
Um den optimalen Schutz gegen Varizellen zu gewährleisten, werden für Kinder ab dem vollendeten 9. Lebensmonat, Jugendliche und Erwachsene 2 Impfdosen empfohlen (vgl. «Eigenschaften/Wirkungen»).
Die beiden Dosen sollten vorzugsweise in einem Abstand von 6 Wochen verabreicht werden. Unter keinen Umständen darf der Abstand weniger als 4 Wochen betragen.
Um den Impfschutz zu gewährleisten, muss die ganze empfohlene Dosis verabreicht werden.
Risikopatienten
Bei Risikopatienten kann eine periodische Bestimmung der Varizellen-Antikörper sinnvoll sein, um denjenigen Patienten, deren Antikörpertiter stark gesunken ist, eine Auffrischimpfung zu verabreichen.
Austauschbarkeit der Impfstoffe
Eine Impfdosis Varilrix kann an Impflinge verabreicht werden, die bereits vorgängig eine Einzeldosis eines anderen Varizellen-Impfstoffes erhalten haben und umgekehrt.
Art der Anwendung
Varilrix wird subkutan in die Deltoid-Region des Oberarms oder in den anterolateralen Bereich des Oberschenkels injiziert.
Hinweise zur Rekonstitution des Impfstoffes vor der Anwendung, siehe «Sonstige Hinweise».
Kontraindikationen
Varilrix ist kontraindiziert bei:
- Personen mit primären oder erworbenen Immunschwächezuständen mit einer totalen Lymphozytenzahl von weniger als 1'200 pro mm3, oder
- Personen mit anderen Symptomen einer zellulären Immuninkompetenz, beispielsweise bei Personen mit Leukämien, Lymphomen, Blutdyskrasie, klinischer Manifestation einer HIV-Infektion, oder
- Personen, die eine immunsuppressive Therapie erhalten, einschliesslich Kortikosteroide in hoher Dosierung (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Varilrix ist kontraindiziert bei Patienten mit einer bekannten Überempfindlichkeit gegenüber Neomycin oder einem der sonstigen Bestandteile des Impfstoffs. Die positive Anamnese einer Kontaktdermatitis, welche auf Neomycin zurückzuführen ist, stellt hingegen keine Kontraindikation dar.
Varilrix ist kontraindiziert bei Personen, die nach früherer Verabreichung eines Varizellen-Impfstoffs Zeichen einer Überempfindlichkeit zeigten.
Varilrix ist bei schwangeren Frauen kontraindiziert. Drei Monate nach der Impfung sollte eine Schwangerschaft sicher vermieden werden (siehe «Schwangerschaft, Stillzeit»).
Warnhinweise und Vorsichtsmassnahmen
Varilrix soll nicht intradermal und darf unter keinen Umständen intravasal injiziert werden!
Vor der Impfung von Frauen im gebärfähigen Alter muss eine Schwangerschaft ausgeschlossen werden. Nach der Impfung muss über einen Zeitraum von 3 Monaten sicher verhütet werden (siehe «Schwangerschaft, Stillzeit»).
Wie auch bei anderen Impfstoffen sollte die Verabreichung von Varilrix an Personen mit akuter Erkrankung, die von hohem Fieber begleitet ist, auf einen späteren Zeitpunkt verschoben werden. Bei gesunden Personen stellt eine leichte Infektion hingegen keine Kontraindikation dar.
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmassen begleitet sein. Es ist wichtig, Massnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Wie generell bei der Verabreichung von injizierbaren Impfstoffen ist es ratsam, für den seltenen Fall einer anaphylaktischen Reaktion eine angemessene medizinische Behandlung bereitzuhalten (z.B. Adrenalin-Lösung 1/1'000).
Alkohol oder andere Desinfektionsmittel müssen vollständig von der Hautoberfläche verdunstet sein, ehe der Impfstoff injiziert wird, da diese Mittel die attenuierten Viren im Impfstoff inaktivieren können.
Varizellenerkrankungen können auch bei Personen auftreten, die vorher mit einem Varizellen-Lebendimpfstoff geimpft worden sind. Diese sogenannten Durchbruchserkrankungen verliefen jedoch meist leicht. Im Vergleich zu ungeimpften Personen trat Fieber seltener auf, die Hauterscheinungen waren in Anzahl und Ausmass weniger ausgeprägt.
Es wurde gezeigt, dass es bei geimpften Personen, die einen Hautausschlag entwickeln, in sehr seltenen Fällen zu einer Übertragung des OKA-Impfvirus auf seronegative Kontaktpersonen kommt. In diesen Fällen war der Krankheitsverlauf bei der Kontaktperson leicht. Es wurde ebenfalls gezeigt, dass das OKA-Impfvirus auch von einer geimpften Person, die keinen Hautausschlag entwickelt, auf seronegative Kontaktpersonen übertragen werden kann.
Im Gegensatz zu gesunden Geimpften kommt es bei Leukämiepatienten häufiger zum Auftreten eines papulo-vesikulären Exanthems (siehe «Unerwünschte Wirkungen»), eine Übertragung auf empfängliche Risikopatienten ist möglich. Auch in diesen Fällen war der Verlauf der Erkrankung bei den Kontaktpersonen leicht.
Immungeschwächte Personen, bei denen keine Kontraindikation für die Impfung vorliegt (siehe «Kontraindikationen»), sprechen unter Umständen nicht so gut an wie immunkompetente Personen; solche Personen können daher trotz ordnungsgemässer Impfung an Varizellen erkranken.
Sehr wenige Berichte liegen vor über disseminierte Varizellenerkrankungen mit Beteiligung innerer Organe nach Impfung mit dem OKA-Impfstamm; diese betrafen insbesondere, aber nicht nur, immungeschwächte Personen. In Einzelfällen wurden auch fatale Verläufe trotz Therapie mit Aciclovir berichtet.
Das Auftreten eines Herpes zoster, eine bekannte Späterscheinung nach natürlicher Varizellen-Infektion, kann auch nach der Impfung nicht ausgeschlossen werden (siehe «Unerwünschte Wirkungen»).
Langzeitdaten zur Inzidenz des Herpes zosters über mehrere Jahrzehnte liegen noch nicht vor, so dass die Häufigkeit von Herpes zoster nach Impfung im Vergleich zur natürlichen Infektion noch nicht beurteilt werden kann.
Wie bei jedem Impfstoff kann es sein, dass nicht bei allen Geimpften eine schützende Immunantwort aufgebaut wird.
Das Arzneimittel enthält 6 mg Sorbitol pro Impfdosis.
Interaktionen
Ein eventuell erforderlicher Tuberkulintest muss entweder vor oder gleichzeitig mit der Impfung vorgenommen werden, da berichtet wurde, dass Lebendimpfstoffe die Tuberkulinempfindlichkeit der Haut zeitweise herabsetzen können. Da diese verminderte Reaktion bis zu maximal 6 Wochen anhalten kann, sollte zur Vermeidung falsch negativer Ergebnisse ein Tuberkulintest nicht innerhalb dieses Zeitraumes nach der Impfung durchgeführt werden. Die Verwendung alternativer und exakterer Methoden (z.B. Zytokin basiert) zum Tuberkulose Nachweis sollte überlegt werden.
Patienten, welche Immunglobuline oder Bluttransfusionen erhalten haben, sollte die Impfung frühestens nach drei Monaten verabreicht werden, da durch zugeführte Antikörper eine Immunisierung möglicherweise ausbleibt.
Die Einnahme von Salicylaten sollte während 6 Wochen nach der Varizellen-Impfung vermieden werden, da über Reye-Syndrome nach dem Gebrauch von Salicylaten während einer natürlichen Varizellen-Infektion berichtet wurde.
Gesunde Personen
Varilrix kann gleichzeitig mit anderen Impfstoffen verabreicht werden. Verschiedene Impfstoffe sollten immer an unterschiedlichen Injektionsstellen appliziert werden. Inaktivierte Impfstoffe können unabhängig vom Zeitpunkt der Varizellen-Impfung appliziert werden.
Falls ein Masernimpfstoff nicht zur gleichen Zeit wie Varilrix gegeben wird, muss ein Intervall von mindestens einem Monat zwischen den beiden Impfungen eingehalten werden, da die Masernimpfung zu einer kurzdauernden Unterdrückung der zellulären Immunantwort führen kann.
Risikopatienten
Varilrix sollte nicht gleichzeitig mit anderen abgeschwächten Lebendimpfstoffen verabreicht werden. Inaktivierte Impfstoffe können unter der Voraussetzung, dass keine spezifischen Kontraindikationen bestehen, unabhängig vom Zeitpunkt der Varizellen-Impfung appliziert werden.
Verschiedene Impfstoffe sollten immer an unterschiedlichen Injektionsstellen appliziert werden.
Schwangerschaft/Stillzeit
Schwangerschaft
Adäquate Daten zur Anwendung von Varilrix während der Schwangerschaft beim Menschen liegen nicht vor. Tierexperimentelle Studien zur Reproduktionstoxizität wurden nicht durchgeführt.
Schwangere dürfen nicht mit Varilrix geimpft werden. Vor der Impfung von Frauen im gebärfähigen Alter muss eine Schwangerschaft ausgeschlossen werden. Nach der Impfung mit Varilrix muss über einen Zeitraum von 3 Monaten sicher verhütet werden.
Stillzeit
Studien mit Daten über die Anwendung bei stillenden Müttern liegen nicht vor. Übertragungen des OKA Stammes von geimpften Müttern im Wochenbett auf das Neugeborene wurden in Einzelfällen publiziert (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es liegen keine Studien mit Varilrix vor, die den Einfluss von Varilrix bezüglich Fahrtüchtigkeit und das Bedienen von Maschinen untersucht haben. Nebenwirkungen wie Fieber, Kopfschmerzen oder Müdigkeit können einen negativen Einfluss bezüglich Fahrtüchtigkeit und das Bedienen von Maschinen haben (siehe auch «Unerwünschte Wirkungen»).
Unerwünschte Wirkungen
Daten aus klinischen Studien
Gesunde Personen
Mehr als 7'900 Personen haben an den klinischen Studien zur Evaluierung des Reaktogenitätsprofils des Impfstoffs bei alleiniger Gabe oder gemeinsamer Verabreichung mit anderen Impfstoffen teilgenommen.
Das nachfolgend dargestellte Sicherheitsprofil stützt sich auf die Erfahrungen mit der Verabreichung von insgesamt 5'369 Dosen Varilrix als Monotherapie bei Kindern, Jugendlichen und Erwachsenen.
Häufigkeiten sind aufgeführt als: «sehr häufig» (≥1/10), «häufig» (< 1/10, ≥1/100), «gelegentlich» (< 1/100, ≥1/1000), «selten» (< 1/1000, ≥1/10'000), «sehr selten» (< 1/10'000).
Infektionen und parasitäre Erkrankungen
Gelegentlich: Infektion der oberen Atemwege, Pharyngitis.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Lymphadenopathie.
Psychiatrische Erkrankungen
Gelegentlich: Reizbarkeit.
Erkrankungen des Nervensystems
Gelegentlich: Kopfschmerz, Somnolenz.
Augenerkrankungen
Selten: Konjunktivitis.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Husten, Rhinitis.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Übelkeit, Erbrechen.
Selten: Bauchschmerzen, Durchfall.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Hautausschlag.
Gelegentlich: Hautausschlag wie bei Varizelleninfektion, Juckreiz.
Selten: Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Arthralgie, Myalgie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Schmerz, Rötung (17,0% bei Kindern und 19,9% bei Jugendlichen und Erwachsenen), Fieber (10,1%) (Oral-/Achseltemperatur ≥37,5°C oder Rektaltemperatur ≥38,0°C)*.
Häufig: Schwellung an der Injektionsstelle*.
Gelegentlich: Fieber (Oral-/Achseltemperatur > 39,0°C oder Rektaltemperatur > 39,5°C), Müdigkeit, Unwohlsein.
* Schwellung an der Injektionsstelle und Fieber wurden in Studien mit Jugendlichen und Erwachsenen sehr häufig gemeldet. Schwellungen wurden ebenfalls sehr häufig nach der zweiten Dosis bei Kindern unter 13 Jahren beobachtet.
Es wurde ein Trend zu einer erhöhten Inzidenz an Schmerzen, Rötung und Schwellung nach der zweiten Impfdosis beobachtet verglichen mit der ersten Dosis.
Bezüglich Reaktogenität zwischen vorgängig seropositiven und seronegativen Personen wurde kein Unterschied festgestellt.
Risikopatienten
Aus klinischen Studien in Patienten mit hohem Risiko, an schwerwiegender Varicella zu erkranken, sind nur limitierte Daten verfügbar. Impfstoff-bezogene Reaktionen, vorwiegend papulo-vesikuläre Hauteruptionen und Fieber, sind gewöhnlich mild. Im Gegensatz zu gesunden Geimpften kommt es bei Leukämiepatienten häufiger zum Auftreten eines papulo-vesikulären Exanthems. Diese Varizellen-ähnlichen Symptome wurden bei ca. einem Viertel der Leukämiepatienten beobachtet. Wie bei gesunden Personen sind Rötung, Schwellung und Schmerz an der Injektionsstelle mild und vorübergehend.
Unerwünschte Wirkungen nach Markteinführung
Nach der Markteinführung wurde über folgende zusätzliche Reaktionen nach einer Varizellen-Impfung berichtet:
Infektionen und parasitäre Erkrankungen
Selten: Herpes zoster.
Erkrankungen des Blutes und des Lymphsystems
Selten: Thrombozytopenie.
Erkrankungen des Immunsystems
Selten: Überempfindlichkeit, anaphylaktische Reaktionen.
Erkrankungen des Nervensystems
Selten: Enzephalitis, Schlaganfall (in Einzelfällen mit Impfvirusnachweis im betroffenen Gefäss), Zerebellitis, Zerebellitis-ähnliche Symptome (einschliesslich vorübergehende Gangstörung und vorübergehende Ataxie), Konvulsionen.
Gefässerkrankungen
Selten: Vaskulitis (einschliesslich Purpura Schönlein-Henoch und Kawasaki-Syndrom).
Erkrankungen der Haut und des Unterhautgewebes
Selten: Erythema exsudativum multiforme.
Bei unbeabsichtigter intravasaler Gabe können schwere Reaktionen bis zum Schock auftreten. Sofortmassnahmen in Abhängigkeit vom Schweregrad, siehe «Warnhinweise und Vorsichtsmassnahmen».
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es sind Fälle mit einer unbeabsichtigten Verabreichung einer grösseren als der empfohlenen Dosis Varilrix gemeldet worden. Im Rahmen dieser Fälle wurden die folgenden unerwünschten Wirkungen gemeldet: Lethargie und Konvulsionen. Keiner der anderen Überdosis-Meldefälle war mit unerwünschten Wirkungen verbunden.
Eigenschaften/Wirkungen
ATC-Code
J07BK01
Varilrix ist ein Lyophilisat des abgeschwächten Varicella-zoster-Virus, Stamm OKA, hergestellt durch Vermehrung des Virus auf humanen, diploiden Zellkulturen (MRC-5). Varilrix erfüllt die Anforderungen der WHO für biologische Substanzen und für Varizellen-Impfstoffe.
Wirkungsmechanismus
Varilrix produziert eine abgeschwächte, klinisch inapparente Varizellen-Infektion in empfänglichen Personen.
Eine gewisse Schutzwirkung kann bei Patienten, die innerhalb von 72 Stunden nach dem Kontakt mit dem natürlichen Varizellenvirus den Impfstoff erhalten, erreicht werden.
Nachweisbare Antikörper bestätigen den Impfschutz gegen Varizellen.
Pharmakodynamik
Klinische Wirksamkeit
Die Wirksamkeit der Oka-Varizellenimpfstoffe von GlaxoSmithKline (1 Dosis Varilrix bzw. 2 Dosen tetravalenter Masern-Mumps-Röteln-Varizellenimpfstoff Priorix-Tetra im Abstand von 42 Tagen) wurde in der grossen, in mehreren Ländern durchgeführten, verumkontrollierten klinischen Studie OKA-H-179 (Follow-up OKAH-182 EXT 179:Y4-Y6-Y8-Y10) im Vergleich zu 2 Dosen Masern-Mumps-Röteln-Impfstoff ohne Varizellenkomponente im Abstand von 42 Tagen untersucht. Dabei wurden verschiedene Wirksamkeitskriterien zur Diagnose einer manifesten Varizelleninfektion verwendet. In der Phase A (Impfung im Alter von 12-24 Monaten) nahmen 5803 Kinder teil. In den Langzeit Follow-up Phase B wurden 4580 Kinder eingeschlossen. 3298 Kinder (56,8%) schlossen die Studie OKAH-182 EXT 179:Y4-Y6-Y8-Y10 vollständig über 10 Jahre ab. Es gab für Phase B der Studie keine statistische Hypothese sondern nur deskriptive Beschreibungen. Die primäre Diagnose beruhte auf der Meldung einer Varizella artigen Erkrankung durch die Eltern, welche im Falle einer geplanten Bestätigung durch den Investigator mittels PCR weiter untersucht wurde. Telefonische Kontakte fanden alle 6 Monate statt. Es fand zuerst eine Beurteilung der aufgetretenen klinisch vermuteten Varizelleninfektionen durch den Prüfarzt statt. Vermutete Varizellenfälle wurden dann durch ein Expertenpanel weiter beurteilt. Ausserdem wurde ein direkter Virusnachweis durch PCR (Polymerasekettenreaktion) durchgeführt und es fand eine anamnestische Abklärung einer möglichen Windpockenexposition statt.
Bei der ersten Analyse (bestätigte Varizellenfälle) war ein definitiver Virusnachweis in der PCR und/oder eine sichere Exposition gegenüber Varizellen Bedingung für die Beurteilung des Impferfolgs gegen Varizellenerkrankungen aller Schweregrade und gegen mässiggradige bis schwere Varizellenerkrankungen. In einer zweiten weniger strengen Analyse (klinische Varizellenfälle) wurden für die Beurteilung des Impferfolgs alle bestätigten Varizellenfälle aber auch alle Varizellenfälle, die vom Expertenpanel identifiziert wurden, unabhängig von einer Bestätigung durch PCR oder Expositionsanamnese, berücksichtigt.
Die Wirksamkeit des Impfstoffs im Hinblick auf die Prävention bestätigter Varizellenfälle aller Schweregrade sowie mässiger bis schwerer bestätigter Varizellenfälle wurde nach einem Hauptbeobachtungszeitraum von 2 Jahren mit geimpften 5803 Kindern (mediane Dauer: 3,2 Jahre) belegt. In den Langzeit-Nachbeobachtungsphasen von 6 Jahren (mediane Dauer: 6,4 Jahre) und 10 Jahren (mediane Dauer: 9,8 Jahre, 3298 Kinder mit vollständiger Teilnahme in allen 3 Armen) derselben Studie OKAH-182 EXT 179:Y4-Y6-Y8-Y10 wurde eine anhaltende Wirksamkeit beobachtet. Die Ergebnisse sind in der nachfolgenden Tabelle dargestellt.
Gruppe | Zeitpunkt | Wirksamkeit gegen bestätigte Varizellenerkrankungen aller Schweregrade | Wirksamkeit gegen mässiggradige bis schwere, bestätigte Varizellenerkrankungen |
Varilrix (1 Dosis) N=2'487 | Jahr 2 | 65,4% (97,5% KI: 57,2;72,1) | 90,7% (97,5% KI: 85,9;93,9) |
Jahr 6(1) | 67,0% (95% KI: 61,8;71,4) | 90,3% (95% KI: 86,9;92,8) | |
Jahr 10(1) | 67,2% (95% KI: 62,3;71,5) | 89,5% (95% KI: 86,1;92,1) | |
Kombinierter Impfstoff gegen Masern, Mumps, Röteln und Varizellen (2 Dosen) N=2'489 | Jahr 2 | 94,9% (97,5% KI: 92,4;96,6) | 99,5% (97,5% KI: 97,5;99,9) |
Jahr 6(1) | 95,0% (95% KI: 93,6;96,2) | 99,0% (95% KI: 97,7;99,6) | |
Jahr 10(1) | 95,4% (95% KI: 94,0;96,4) | 99,1% (95% KI: 97,9;99,6) |
N=Anzahl Probanden, die in die Studie eingeschlossen und geimpft wurden. Der Follow-up über 10 Jahre wurde bei insgesamt 3298 Kindern in allen 3 Armen zusammen (Priorix-Tetra, Varilrix, Priorix) durchgeführt.
(1) Deskriptive Analyse
In der nachfolgenden Tabelle sind die Wirksamkeitsdaten, bezogen auf klinische Varizellenfälle aller Schweregrade sowie auf mässige bis schwere klinische Varizellenfälle nach einem Hauptbeobachtungszeitraum von 2 Jahren sowie nach den Nachbeobachtungsphasen von 6 Jahren und 10 Jahren dargestellt.
Gruppe | Zeitpunkt | Wirksamkeit gegen klinische Varizellenerkrankungen aller Schweregrade | Wirksamkeit gegen mässiggradige bis schwere klinische Varizellenerkrankungen |
Varilrix (1 Dosis) N=2'266 | Jahr 2 | 64,6% (95% KI: 57,5;70,5) | 90,2% (95%KI: 85,9;93,1) |
Jahr 6(1) | 66,2% (95% KI: 61,0;70,7) | 89,8% (95%KI: 86,4;92,4) | |
Jahr 10(1) | 66,3% (95% KI: 61,4;70,6) | 89,0% (95% CI: 85,5;91,6) | |
Kombinierter Impfstoff gegen Masern, Mumps, Röteln und Varizellen (2 Dosen) N=2'279 | Jahr 2 | 92,5% (95% KI: 89,9;94,4) | 99,3% (95% KI: 94,7;99,8) |
Jahr 6(1) | 93,4% (95% KI: 91,7;94,7) | 98,7% (95%KI: 97,4;99,4) | |
Jahr 10(1) | 93,6% (95% KI: 92,1;94.9) | 98,5% (95% KI: 97,1;99,2) |
N=Anzahl Probanden, die in jede Gruppe eingeschlossen wurden. Der Follow-up über 10 Jahre wurde bei insgesamt 3298 Kindern in allen 3 Armen zusammen (Priorix-Tetra, Varilrix, Priorix) durchgeführt.
(1) Deskriptive Analyse
In einer früheren Wirksamkeitsstudie (OKA-H-024) über ca. 2,5 Jahre bei 10 - 30 Monate alten Kleinkindern betrug die Schutzwirkung nach einer Dosis Varilrix 100% gegen klinisch manifeste Varizellen (mehr als 30 Vesikel). Die Schutzwirkung gegen jegliche Art von serologisch bestätigten Varizellen (inkl. leichte Fälle mit wenigstens einem Vesikel oder einem Bläschen) betrug 88% (95% KI: 71,0;95,2). Alle Fälle verliefen mild mit einer mittleren Vesikelzahl von 1. Über Fieber wurde nicht berichtet.
Die Effektivität einer Dosis Varilrix bzw. 2 Dosen MMR-Varizellen Kombinationsimpfstoff wurde in verschiedenen Zusammenhängen beurteilt (Durchbrüche, Case-Control-Studien und Studien anhand von Datenbanken) und lag bei 20%-92% gegen Varizellenerkrankungen aller Art und bei 86%-100% gegen mässiggradige oder schwere Erkrankungen.
In einer in Uruguay durchgeführten Studie betrug die Abnahme der Spitalaufenthalte bzw. der ambulanten Arztbesuche bei Kindern nach der Verabreichung einer Dosis Varilrix insgesamt 81% bzw. 87%.
Die Wirksamkeitsdaten deuten auf eine höhere Schutzwirkung und eine geringere Häufigkeit von Varizellendurchbrüchen nach 2 Impfdosen hin als nach einer einzigen Impfdosis.
Immunantwort
Gesunde Personen
Bei Kindern von 11 bis 21 Monaten betrug die Serokonversionsrate gemessen mit ELISA (50 mIU/ml) 6 Wochen nach der ersten Impfung 89,6% und 6 Wochen nach der zweiten Impfung 100%.
Bei Kindern im Alter von 9 Monaten bis 12 Jahren betrug 6 Wochen nach der ersten Impfung die durchschnittliche Serokonversionsrate, gemessen im Immunofluoreszenz Assay (IFA), mehr als 98%.
Die Serokonversionsrate gemessen mit IFA bei Jugendlichen von 13 Jahren und darüber betrug 6 Wochen nach der 2. Dosis 100%. Ein Jahr nach der Impfung waren alle getesteten Jugendlichen noch seropositiv.
Es existieren ungenügende Daten, um die Schutzrate gegen Komplikationen von Varizellen wie Enzephalitis, Hepatitis oder Pneumonie bestimmen zu können.
Risikopatienten
Bei Risikopatienten wurde eine durchschnittliche Serokonversionsrate von 80% erreicht, wobei diese bei Leukämiepatienten etwa 90% betrug. Nach der Immunisierung können periodische Messungen der Varizellen-Antikörper angezeigt sein, um diejenigen Patienten zu erkennen, die von einer erneuten Immunisierung profitieren können.
In einer Studie war die Inzidenz von Herpes zoster bei immunsupprimierten Leukämiepatienten tiefer als bei natürlich infizierten Leukämiepatienten.
Bei stark immunsupprimierten Patienten sind nach der Impfung mit Varilrix klinisch bedeutsame Varizellen-Infektionen aufgetreten und es konnten Impfstoffviren aus den Bläschen isoliert werden.
Klinische Wirksamkeit
Siehe unter «Pharmakodynamik».
Pharmakokinetik
Eine Untersuchung der pharmakokinetischen Eigenschaften ist für Impfstoffe nicht erforderlich.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische Daten
Nicht zutreffend.
Sonstige Hinweise
Inkompatibilitäten
Varilrix darf nicht mit anderen Impfstoffen in der gleichen Spritze gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8°C), vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahren. Kühlkettenpflichtig.
Die Wirksamkeit von Varilrix (Pulver) wird durch Gefrieren nicht beeinflusst.
Hinweise für die Handhabung
Das Lösungsmittel und der rekonstituierte Impfstoff sind vor der Rekonstitution bzw. vor der Verabreichung visuell auf Fremdpartikel und/oder Veränderungen des Aussehens zu untersuchen. Falls irgendwelche Veränderungen beobachtet werden, darf das Lösungsmittel bzw. der rekonstituierte Impfstoff nicht verwendet werden.
Aufgrund von kleinen Unterschieden im pH-Wert kann die Farbe des rekonstituierten Impfstoffes von klar-pfirsichfarben bis pinkfarben variieren.
Hinweise für die Rekonstitution des Impfstoffes mit dem in der Fertigspritze befindlichen Lösungsmittel
Varilrix wird rekonstituiert, indem der gesamte Inhalt der Fertigspritze mit Lösungsmittel in die Durchstechflasche mit dem Pulver gegeben wird.
Für das Befestigen der Nadel an der Spritze folgen Sie der nachstehenden Anleitung. Allerdings kann sich die mit Varilrix mitgelieferte Spritze leicht von der abgebildeten Spritze unterscheiden (d.h. ohne Schraubgewinde). In diesem Fall muss die Nadel ohne zu schrauben angebracht werden.
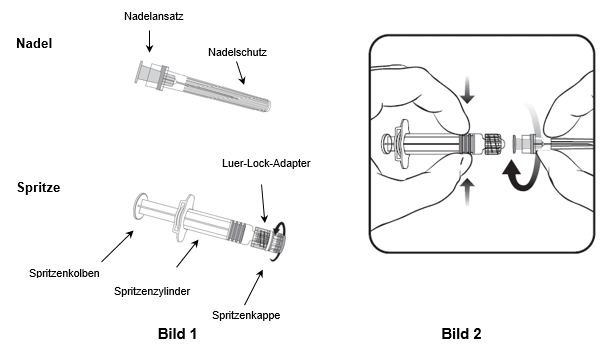
Halten Sie die Spritze immer am Spritzenzylinder fest. Die Spritze nicht am Spritzenkolben oder Luer-Lock-Adapter (LLA) festhalten.
- Halten Sie die Spritze am Spritzenzylinder fest und drehen Sie die Spritzenkappe entgegen dem Uhrzeigersinn ab (wie in Bild 1 gezeigt).
- Um die Nadel an der Spritze anzubringen, führen Sie den Nadelansatz vorsichtig in den LLA und drehen Sie die Nadel im Uhrzeigersinn, bis sie fest sitzt (wie in Bild 2 gezeigt). Achten Sie beim Anbringen darauf, dass sich die Nadel in der Achse der Spritze befindet (wie im Bild 2 gezeigt). Andernfalls könnte sich der LLA verbiegen und undicht werden. Falls sich während des Anbringens der Nadel der LLA löst, ist eine neue Impfstoffdosis (neue Spritze und Durchstechflasche) zu verwenden.
- Entfernen Sie den Nadelschutz, der gelegentlich festsitzen kann.
- Fügen Sie das Lösungsmittel dem Pulver zu. Schütteln Sie danach die Mischung gründlich, bis sich das Pulver vollständig im Lösungsmittel gelöst hat.
Nach der Rekonstitution sollte der Impfstoff sofort verabreicht werden.
5. Ziehen Sie den gesamten Inhalt der Durchstechflasche in die Spritze auf.
6. Zur Verabreichung des Impfstoffs soll eine neue Nadel verwendet werden. Drehen Sie die Nadel von der Spritze ab und bringen Sie eine Injektionsnadel an, indem Sie Schritt 2 wiederholen.
Es wird empfohlen, den Impfstoff nach der Rekonstitution möglichst schnell für die Injektion zu verwenden. Allerdings konnte nachgewiesen werden, dass der rekonstituierte Impfstoff für bis zu 90 Minuten bei Raumtemperatur (25°C) und bis zu 8 Stunden im Kühlschrank (2-8°C) aufbewahrt werden kann. Bei Überschreitung dieser Fristen darf der rekonstituierte Impfstoff nicht mehr verwendet werden.
Alkohol und andere Desinfektionsmittel müssen vor der Injektion vollständig von der Haut verdunstet sein, da sie das Virus inaktivieren können.
Nicht verwendeter Impfstoff und Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Zulassungsnummer
00585 (Swissmedic).
Zulassungsinhaberin
GlaxoSmithKline AG, 3053 Münchenbuchsee.
Stand der Information
August 2020.
Composizione
Principi attivi
Ceppo OKA del virus varicella-zoster
Sostanze ausiliarie
Polvere: aminoacidi, lattosio, mannitolo (E 421), sorbitolo (E 420) 6 mg.
Solvente: acqua per preparazioni iniettabili.
Residui
Neomicina solfato.
Forma farmaceutica e quantità di principio attivo per unità
Polvere e solvente per soluzione iniettabile.
Una dose (0,5 mL) di vaccino ricostituito contiene almeno 103.3 PFU (unità formanti placca) del virus varicella-zoster, ceppo OKA.
La polvere ha un colore dal crema chiaro al giallognolo o rosa tenue. Il solvente è chiaro e incolore.
Indicazioni/Possibilità d'impiego
Persone sane
Varilrix è indicato per l'immunizzazione attiva contro la varicella di bambini sani a partire dal 12° mese di vita compiuto, di adolescenti e di adulti.
L'uso di Varilrix in situazioni/indicazioni speciali già a partire dal 9° mese di vita compiuto è a discrezione del medico, ad es. nel caso in cui il bambino sia ad alto rischio di contrarre una grave varicella o se si trova a stretto contatto con un paziente a rischio.
Pazienti a rischio e contatti sani
Varilrix è indicato per l'immunizzazione attiva di pazienti a rischio e di persone non immuni che vivono a stretto contatto con loro.
Pazienti con leucemia acuta
I pazienti con leucemia acuta sono considerati particolarmente a rischio in caso di infezione da varicella e devono essere vaccinati qualora non abbiano ancora mai contratto la varicella o siano sieronegativi.
Se i pazienti vengono immunizzati nella fase acuta della leucemia, la chemioterapia deve essere sospesa nella settimana precedente e in quella successiva alla vaccinazione. I pazienti sottoposti a radioterapia non devono di norma essere vaccinati durante il trattamento.
Generalmente la vaccinazione viene effettuata quando i pazienti si trovano in remissione ematologica completa. La vaccinazione deve essere effettuata quando la conta linfocitaria totale è almeno di 1200/mm3 o in assenza di evidenze di deficit di competenza immunocellulare.
Pazienti in terapia immunosoppressiva
I pazienti in terapia immunosoppressiva (inclusa la terapia con corticosteroidi), con tumori maligni o malattie croniche gravi (ad es. insufficienza renale cronica, patologie autoimmuni, collagenosi, asma bronchiale grave) sono particolarmente a rischio di un decorso grave della varicella.
La vaccinazione deve essere effettuata quando la conta linfocitaria totale è di almeno 1200/mm3 o in assenza di altri deficit di competenza immunocellulare.
Pazienti per i quali è previsto un trapianto d'organo
Se viene considerato un trapianto d'organo (ad es. trapianto di rene), la vaccinazione deve essere eseguita circa 6-8 settimane prima della somministrazione della terapia immunosoppressiva.
Pazienti con malattia cronica
Anche altre malattie croniche quali malattie metaboliche o del sistema endocrino, malattie polmonari e cardiovascolari croniche, mucoviscidosi e anomalie neuromuscolari possono rappresentare fattori che predispongono a un decorso grave della varicella. In tali casi la vaccinazione contro la varicella può evitare gravi complicanze.
Contatti sani
I contatti sani suscettibili devono essere vaccinati per ridurre il rischio di trasmissione del virus ai pazienti a rischio. Sono inclusi in questa categoria i genitori e i fratelle e le sorelle dei pazienti a rischio, il personale medico e paramedico e altre persone a stretto contatto con pazienti a rischio o che hanno contratto la varicella.
Varilrix deve essere utilizzato secondo le raccomandazioni vaccinali ufficiali.
Posologia/Impiego
Posologia abituale
Persone sane
Una dose di vaccino è pari a 0,5 mL del vaccino ricostituito.
Per garantire la copertura ottimale contro la varicella si consiglia la somministrazione di 2 dosi di vaccino ai bambini dal 9° mese di vita compiuto, agli adolescenti e agli adulti (vedere «Proprietà/effetti»).
Le due dosi devono essere somministrate preferibilmente a distanza di 6 settimane. In nessun caso l'intervallo fra le due dosi deve essere inferiore a 4 settimane.
La copertura vaccinale è garantita solo se viene somministrata l'intera dose consigliata.
Pazienti a rischio
Nei pazienti a rischio può essere utile determinare periodicamente gli anticorpi della varicella in modo da somministrare un vaccino di richiamo a quei pazienti i cui titoli anticorpali si sono ridotti notevolmente.
Intercambiabilità dei vaccini
È possibile somministrare una dose di vaccino Varilrix a individui che in precedenza hanno già ricevuto una singola dose di un altro vaccino antivaricella e viceversa.
Modo di somministrazione
Varilrix viene iniettato per via sottocutanea nella regione deltoide della parte alta del braccio o nella zona anterolaterale della coscia.
Per indicazioni sulla ricostituzione del vaccino prima dell'utilizzo cfr. «Altre indicazioni».
Controindicazioni
Varilrix è controindicato nei seguenti casi:
- soggetti con stati di immunodeficienza primaria o acquisita con conta linfocitaria totale inferiore a 1200/mm3 o
- soggetti con altri sintomi di deficit di competenza immunocellulare, ad es. soggetti affetti da leucemia, linfomi, discrasie ematiche, infezione da HIV clinicamente manifesta o
- pazienti che ricevono una terapia immunosoppressiva (inclusi corticosteroidi ad alto dosaggio) (cfr. anche «Avvertenze e misure precauzionali»).
Varilrix è controindicato nei pazienti con ipersensibilità nota alla neomicina o a uno degli altri componenti del vaccino. Un'anamnesi positiva di dermatite da contatto riconducibile alla neomicina non costituisce invece alcuna controindicazione.
Varilrix è controindicato nei soggetti che hanno mostrato segni di ipersensibilità dopo precedente somministrazione di un vaccino antivaricella.
Varilrix è controindicato nelle donne in gravidanza. Una gravidanza deve essere evitata nei tre mesi successivi alla vaccinazione (cfr. «Gravidanza, allattamento»).
Avvertenze e misure precauzionali
Varilrix non deve essere iniettato per via intradermica e in nessun caso per via intravascolare!
Prima di procedere alla vaccinazione di donne in età fertile occorre escludere una gravidanza. Dopo la vaccinazione è necessario usare una contraccezione sicura per un periodo di 3 mesi (cfr. «Gravidanza, allattamento»).
Come anche con altri vaccini, la somministrazione di Varilrix a soggetti con malattia acuta accompagnata da febbre alta deve essere rimandata a un momento successivo. Nei soggetti sani, invece, la presenza di un'infezione lieve non costituisce controindicazione.
Soprattutto negli adolescenti può verificarsi una sincope (svenimento) come reazione psicogena all'iniezione con l'ago, dopo o addirittura prima della vaccinazione. Questa può essere accompagnata durante la fase di recupero da diversi sintomi neurologici quali disturbo visivo transitorio, parestesia e movimenti tonico-clonici degli arti. È importante adottare misure per evitare lesioni conseguenti allo svenimento.
Come generalmente valido per la somministrazione di vaccini iniettabili, è consigliabile avere a disposizione un trattamento medico adeguato per la rara eventualità di una reazione anafilattica (ad es. soluzione di adrenalina 1/1000).
Prima di iniettare il vaccino, occorre lasciare evaporare completamente dalla superficie cutanea l'alcol o altri disinfettanti in quanto queste sostanze possono inattivare i virus attenuati presenti nel vaccino.
La varicella può manifestarsi anche in soggetti precedentemente vaccinati con un vaccino vivo antivaricella. Questi casi, cosiddetti di varicella breakthrough, hanno avuto tuttavia un decorso perlopiù lieve. Rispetto a soggetti non vaccinati la febbre è comparsa più raramente , e le manifestazioni cutanee sono risultate meno pronunciate per numero ed entità.
È stato dimostrato che in casi molto rari si verifica una trasmissione del virus vaccinale OKA da soggetti vaccinati che sviluppano un'eruzione cutanea a contatti sieronegativi. In questi casi la malattia ha avuto un decorso lieve nei contatti. È stato dimostrato altresì che il virus vaccinale OKA può essere trasmesso a contatti sieronegativi anche da un soggetto vaccinato che non ha sviluppato un'eruzione cutanea.
Contrariamente ai vaccinati sani, nei pazienti leucemici compare più frequentemente un esantema papulo-vescicolare (cfr. «Effetti indesiderati»), è possibile la trasmissione a pazienti a rischio suscettibili. Anche in questi casi la malattia ha avuto un decorso lieve nei contatti.
Rispetto a soggetti immunocompetenti, i soggetti immunocompromessi per i quali non vi sono controindicazioni alla vaccinazione (cfr. «Controindicazioni») possono rispondere alla vaccinazione meno bene e pertanto, nonostante una vaccinazione corretta, possono ammalarsi di varicella.
Le segnalazioni sulla varicella disseminata con interessamento degli organi interni dopo vaccinazione con vaccino del ceppo OKA sono in numero troppo limitato; queste hanno interessato soprattutto, ma non esclusivamente, persone immunodepresse. In singoli casi sono stati riportati anche decorsi fatali nonostante la terapia con aciclovir.
Dopo la vaccinazione non è possibile escludere nemmeno la comparsa di un herpes zoster quale manifestazione tardiva nota di una varicella naturale (cfr. «Effetti indesiderati»).
Non è possibile al momento valutare la frequenza dell'herpes zoster post-vaccinazione rispetto all'infezione naturale, in quanto non sono ancora disponibili dati a lungo termine sull'incidenza dell'herpes zoster registrati in un arco temporale di diversi decenni.
Come per qualsiasi vaccino, è possibile che non tutte le persone vaccinate sviluppino una risposta immunitaria protettiva.
Il medicamento contiene 6 mg di sorbitolo per ogni dose di vaccino.
Interazioni
Se eventualmente necessario, test della tubercolina deve essere eseguito prima della vaccinazione o concomitanza, in quanto è stato riportato che i vaccini vivi possono ridurre in via temporanea la sensibilità cutanea alla tubercolina. Poiché tale reazione attenuata può perdurare per un massimo di 6 settimane, al fine di evitare risultati falsi negativi, il test della tubercolina non deve essere eseguito in questo lasso di tempo dopo la vaccinazione. Si deve ponderare l'uso di metodi alternativi e più esatti (ad es. basati sulla citochina) per attestare la presenza di tubercolosi.
Nei pazienti che hanno ricevuto immunoglobuline o trasfusioni di sangue, la vaccinazione deve essere somministrata dopo almeno tre mesi, poiché gli anticorpi introdotti possono impedire l'immunizzazione.
L'assunzione di salicilati nelle 6 settimane successive alla vaccinazione deve essere evitata poiché, durante l'infezione naturale da varicella, è stata segnalata sindrome di Reye dopo l'uso di salicilati.
Persone sane
Varilrix può essere somministrato in concomitanza con altri vaccini. Vaccini diversi devono essere sempre somministrati in sedi di iniezione diverse. I vaccini inattivati possono essere somministrati indipendentemente dal momento in cui viene effettuata la vaccinazione antivaricella.
Se in concomitanza con Varilrix non viene somministrato un vaccino contro il morbillo, occorre rispettare un intervallo di almeno un mese fra le due vaccinazioni, in quanto il vaccino contro il morbillo può comportare una temporanea soppressione della risposta immunitaria cellulare.
Pazienti a rischio
Varilrix non deve essere somministrato in concomitanza con altri vaccini vivi attenuati. I vaccini inattivati possono essere somministrati indipendentemente dal momento della vaccinazione antivaricella a condizione che non vi siano controindicazioni specifiche.
Vaccini diversi devono essere sempre somministrati in sedi di iniezione diverse.
Gravidanza/Allattamento
Gravidanza
Non sono disponibili dati adeguati sull'utilizzo di Varilrix in gravidanza. Non sono stati eseguiti studi sperimentali sugli animali sulla tossicità per la riproduzione.
Le donne in gravidanza non devono essere vaccinate con Varilrix. Prima di procedere alla vaccinazione di donne in età fertile occorre escludere una gravidanza. Dopo la vaccinazione con Varilrix è necessario usare una contraccezione sicura per un periodo di 3 mesi.
Allattamento
Non sono disponibili studi con dati relativi all'utilizzo del vaccino durante l'allattamento. Sono stati pubblicati singoli casi di trasmissione del ceppo OKA dalla madre vaccinata in puerperio al neonato (cfr. anche «Avvertenze e misure precauzionali»).
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono disponibili studi che abbiano esaminato l'effetto di Varilrix sulla capacità di guidare veicoli e di utilizzare macchine. Effetti collaterali quali febbre, cefalea o stanchezza possono avere un effetto negativo sulla capacità di guidare veicoli e di utilizzare macchine (cfr. anche «Effetti indesiderati»).
Effetti indesiderati
Dati di studi clinici
Persone sane
Più di 7900 soggetti hanno partecipato agli studi clinici intrapresi al fine di valutare il profilo di reattogenicità del vaccino somministrato da solo o insieme ad altri vaccini.
Il profilo di sicurezza presentato di seguito si basa sulle esperienze con la somministrazione di un totale di 5369 dosi di Varilrix somministrate in monoterapia a bambini, adolescenti e adulti.
Le frequenze sono indicate come segue: «molto comune» (≥1/10), «comune» (<1/10, ≥1/100), «non comune» (<1/100, ≥1/1000), «raro» (<1/1000, ≥1/10'000), «molto raro» (<1/10'000).
Infezioni ed infestazioni
Non comune: infezioni delle vie respiratorie superiori, faringite.
Patologie del sistema emolinfopoietico
Non comune: linfoadenopatia.
Disturbi psichiatrici
Non comune: irritabilità.
Patologie del sistema nervoso
Non comune: cefalea, sonnolenza.
Patologie dell'occhio
Raro: congiuntivite.
Patologie respiratorie, toraciche e mediastiniche
Non comune: tosse, rinite.
Patologie gastrointestinali
Non comune: nausea, vomito.
Raro: dolori addominali, diarrea.
Patologie della cute e del tessuto sottocutaneo
Comune: eruzione cutanea.
Non comune: eruzione cutanea simile a quella osservata nella varicella, prurito.
Raro: orticaria.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Non comune: artralgia, mialgia.
Patologie generali e condizioni relative alla sede di somministrazione
Molto comune: dolore, arrossamento (17,0% nei bambini e 19,9% negli adolescenti e negli adulti), febbre (10,1%) (temperatura orale/ascellare ≥37,5°C o rettale ≥38,0°C)*.
Comune: tumefazione in sede di iniezione*.
Non comune: febbre (temperatura orale/ascellare > 39,0°C o rettale > 39,5°C), stanchezza, malessere
* Tumefazione in sede di iniezione e febbre sono state riportate molto frequentemente in studi condotti con adolescenti e adulti. Tumefazioni sono state osservate molto frequentemente dopo la seconda dose anche in bambini sotto i 13 anni.
È stata osservata una tendenza ad una maggiore incidenza di dolore, arrossamento e tumefazione dopo la seconda dose di vaccino rispetto alla prima.
Non sono state riscontrate differenze in termini di reattogenicità tra soggetti inizialmente sieropositivi e quelli inizialmente sieronegativi.
Pazienti a rischio
Sono disponibili solo dati limitati provenienti da studi clinici condotti su pazienti ad alto rischio di varicella grave. Le reazioni associate al vaccino, principalmente eruzioni cutanee papulo-vescicolari e febbre, sono normalmente lievi. Rispetto ai vaccinati sani, nei pazienti affetti da leucemia la comparsa di un esantema papulo-vescicolare è più frequente. Questi sintomi simili alla varicella sono stati osservati in circa un quarto dei pazienti affetti da leucemia. Come nei soggetti sani, l'arrossamento, la tumefazione e il dolore in sede di iniezione sono di grado lieve e a carattere transitorio.
Effetti indesiderati provenienti dalla fase di post-marketing
In seguito all'introduzione sul mercato, dopo una vaccinazione antivaricella sono state riportate le seguenti altre reazioni.
Infezioni ed infestazioni
Raro: herpes zoster.
Patologie del sistema emolinfopoietico
Raro: trombocitopenia.
Disturbi del sistema immunitario
Raro: ipersensibilità, reazioni anafilattiche.
Patologie del sistema nervoso
Raro: encefalite, ictus (in singoli casi è stata accertata la presenza del virus vaccinale nel vaso interessato), cerebellite, sintomi simili alla cerebellite (inclusa alterazione dell'andatura transitoria e atassia transitoria), convulsioni.
Patologie vascolari
Raro: vasculite (incluse porpora di Schönlein-Henoch e sindrome di Kawasaki).
Patologie della cute e del tessuto sottocutaneo
Raro: eritema essudativo multiforme.
In caso di accidentale somministrazione intravascolare possono comparire reazioni gravi fino allo shock. Per le misure immediate da intraprendere in funzione del grado di severità cfr. «Avvertenze e misure precauzionali».
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-benefico del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi effetto indesiderato sospetto, nuovo o serio, attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Sono stati riportati casi di somministrazione accidentale di una dose di Varilrix superiore a quella raccomandata. Nell'ambito di questi casi sono stati riportati i seguenti effetti indesiderati: letargia e convulsioni. Nessuno degli altri casi riportati di sovradosaggio è stato associato a effetti indesiderati.
Proprietà/Effetti
Codice ATC
J07BK01
Varilrix è un liofilizzato del virus della varicella-zoster attenuato, ceppo OKA, ottenuto per replicazione del virus in colture di cellule diploidi umane (MRC-5). Varilrix soddisfa i requisiti dell'OMS per le sostanze biologiche e i vaccini antivaricella.
Meccanismo d'azione
Nei soggetti suscettibili, Varilrix produce una varicella in forma attenuata, clinicamente non apparente.
Nei pazienti che ricevono il vaccino entro 72 ore dal contatto con il virus naturale della varicella è possibile ottenere una certa efficacia protettiva.
Anticorpi rilevabili confermano la copertura vaccinale contro la varicella.
Farmacodinamica
Efficacia clinica
L'efficacia dei vaccini antivaricella Oka di GlaxoSmithKline (1 dose di Varilrix o 2 dosi di vaccino tetravalente morbillo/parotite/rosolia/varicella Priorix-Tetra a distanza di 42 giorni) è stata esaminata nell'ambito del vasto studio clinico con controllo attivo, effettuato in diversi Paesi, OKA-H-179 (follow-up OKAH-182 EXT 179:Y4-Y6-Y8-Y10) rispetto a 2 dosi del vaccino morbillo/parotite/rosolia senza il componente della varicella a distanza di 42 giorni. A tale scopo sono stati utilizzati diversi criteri di efficacia per diagnosticare una varicella manifesta. Alla fase A (vaccinazione all'età di 12-24 mesi) hanno partecipato 5803 bambini. Nella fase B di follow-up a lungo termine sono stati inclusi 4580 bambini. Nell'arco di 10 anni, 3298 bambini (56,8%) hanno completato lo studio OKAH-182 EXT 179:Y4-Y6-Y8-Y10. La fase B dello studio non contemplava ipotesi statistiche ma solo analisi descrittive. La diagnosi primaria si basava sulla segnalazione da parte dei genitori di una malattia simile alla varicella che, se confermata dallo sperimentatore per mezzo di PCR, veniva ulteriormente esaminata. I contatti telefonici avevano luogo ogni 6 mesi. Era prevista inizialmente una valutazione del sospetto clinico di varicella da parte del medico sperimentatore. I casi sospetti di varicella venivano poi sottoposti all'ulteriore valutazione di un gruppo di esperti. Inoltre veniva eseguito un accertamento diretto della presenza del virus tramite PCR (reazione a catena della polimerasi) e veniva effettuato un accertamento anamnestico di una possibile esposizione alla varicella.
Alla prima analisi (casi confermati di varicella), la conferma definitiva alla PCR della presenza del virus e/o un'esposizione certa alla varicella erano la condizione per la valutazione del successo del vaccino contro la varicella di qualunque grado e contro la varicella di grado da moderato a grave. In una seconda analisi meno rigida (casi clinici di varicella), per la valutazione del successo del vaccino sono stati considerati tutti i casi confermati di varicella ma anche tutti i casi di varicella identificati dal gruppo di esperti, indipendentemente dalla conferma tramite PCR o anamnesi dell'esposizione.
L'efficacia del vaccino in termini di prevenzione di casi di varicella confermati di qualunque grado e di casi confermati di varicella da moderata a grave è stata dimostrata al termine di un periodo di osservazione di 2 anni con 5803 bambini vaccinati (durata mediana: 3,2 anni). Nelle fasi di follow-up a lungo termine di 6 anni (durata mediana: 6,4 anni) e 10 anni (durata mediana: 9,8 anni, 3298 bambini che hanno completato la partecipazione a tutti i 3 bracci) dello stesso studio OKAH-182 EXT 179:Y4-Y6-Y8-Y10 è stata osservata un'efficacia duratura. I risultati sono riportati nella tabella seguente.
Gruppo | Momento temporale | Efficacia contro la varicella confermata di qualunque grado | Efficacia contro la varicella confermata, da moderata a grave |
Varilrix (1 dose) N=2487 | Anno 2 | 65,4% (IC 97,5%: 57,2;72,1) | 90,7% (IC 97,5%: 85,9;93,9) |
Anno 6(1) | 67,0% (IC 95%: 61,8;71,4) | 90,3% (IC 95%: 86,9;92,8) | |
Anno 10(1) | 67,2% (IC 95%: 62,3;71,5) | 89,5% (IC 95%: 86,1;92,1) | |
Vaccino combinato contro morbillo, parotite, rosolia e varicella (2 dosi) N=2489 | Anno 2 | 94,9% (IC 97,5%: 92,4;96,6) | 99,5% (IC 97,5%: 97,5;99,9) |
Anno 6(1) | 95,0% (IC 95%: 93,6;96,2) | 99,0% (IC 95%: 97,7;99,6) | |
Anno 10(1) | 95,4% (IC 95%: 94,0;96,4) | 99,1% (IC 95%: 97,9;99,6) |
N=numero di soggetti inclusi nello studio e vaccinati. Il follow-up a 10 anni ha interessato 3298 bambini in totale in tutti i 3 bracci (Priorix-Tetra, Varilrix, Priorix).
(1) Analisi descrittiva
La tabella seguente riporta i dati relativi all'efficacia, riferiti a casi clinici di varicella di qualunque grado di severità e a casi clinici di varicella da moderata a grave dopo un periodo di osservazione principale di 2 anni e le successive fasi di follow-up di 6 e 10 anni.
Gruppo | Momento temporale | Efficacia contro la varicella clinica di qualunque grado | Efficacia contro la varicella clinica da moderata a grave |
Varilrix (1 dose) N=2266 | Anno 2 | 64,6% (IC 95%: 57,5;70,5) | 90,2% (IC 95%: 85,9;93,1) |
Anno 6(1) | 66,2% (IC 95%: 61,0;70,7) | 89,8% (IC 95%: 86,4;92,4) | |
Anno 10(1) | 66,3% (IC 95%: 61,4;70,6) | 89,0% (IC 95%: 85,5;91,6) | |
Vaccino combinato contro morbillo, parotite, rosolia e varicella (2 dosi) N=2279 | Anno 2 | 92,5% (IC 95%: 89,9;94,4) | 99,3% (IC 95%: 94,7;99,8) |
Anno 6(1) | 93,4% (IC 95%: 91,7;94,7) | 98,7% (IC 95%: 97,4;99,4) | |
Anno 10(1) | 93,6% (IC 95%: 92,1;94,9) | 98,5% (IC 95%: 97,1;99,2) |
N=numero dei soggetti inclusi in ogni gruppo. Il follow-up a 10 anni ha interessato 3298 bambini in totale in tutti i 3 bracci (Priorix-Tetra, Varilrix, Priorix).
(1) Analisi descrittiva
In uno studio precedente sull'efficacia (OKA-H-024) condotto per circa 2,5 anni su bambini piccoli di età compresa fra 10 e 30 mesi, l'efficacia protettiva contro la varicella clinicamente manifesta (oltre 30 vescicole) dopo una dose di Varilrix è risultata del 100%. L'efficacia protettiva contro ogni forma di varicella confermata da test sierologico (inclusi casi leggeri con almeno una vescicola o una papula) è risultata dell'88% (IC 95%: 71,0; 95,2). In tutti i casi il decorso è stato lieve con un numero medio di vescicole pari a 1. Non è stata segnalata febbre.
L'efficacia di una dose di Varilrix o di 2 dosi di vaccino combinato MPR + varicella è stata valutata in diversi contesti (breakthrough, studi caso-controllo e studi su banche dati) e si è attestata fra il 20% e il 92% rispetto a tutte le forme di varicella e fra l'86% e il 100% rispetto alle forme di varicella moderata o grave.
In uno studio condotto in Uruguay, a seguito della somministrazione di una dose di Varilrix il numero totale di degenze ospedaliere o di visite ambulatoriali di bambini è diminuito rispettivamente dell'81% e 87%.
I dati relativi all'efficacia dimostrano che l'efficacia protettiva è maggiore e la frequenza di varicella breakthrough è minore dopo 2 dosi di vaccino rispetto a una singola dose.
Risposta immunitaria
Persone sane
Il tasso di sieroconversione misurato con ELISA (50 mUI/ml) in bambini di età compresa fra 11 e 21 mesi è risultato dell'89,6% dopo 6 settimane dalla prima vaccinazione e del 100% dopo 6 settimane dalla seconda vaccinazione.
In bambini di età compresa tra i 9 mesi e i 12 anni il tasso medio di sieroconversione, misurato mediante test di immunofluorescenza (IFA), è risultato superiore al 98% a 6 settimane dalla prima vaccinazione.
Negli adolescenti di età pari e superiore a 13 anni, il tasso di sieroconversione misurato con IFA a 6 settimane dalla seconda dose, è risultato pari al 100%. A un anno dalla vaccinazione, tutti gli adolescenti testati erano ancora sieropositivi.
Non ci sono dati sufficienti per valutare il tasso di protezione contro complicazioni della varicella quali encefalite, epatite o polmonite.
Pazienti a rischio
Nei pazienti a rischio è stato raggiunto un tasso medio di sieroconversione dell'80%, che nei pazienti con leucemia è stato di quasi il 90%. Dopo l'immunizzazione possono essere indicate misurazioni periodiche degli anticorpi della varicella per identificare i pazienti che possono beneficiare di una re-immunizzazione.
In uno studio, l'incidenza di herpes zoster in pazienti affetti da leucemia e immunodepressi è risultata inferiore a quella rilevata in pazienti affetti da leucemia che avevano contratto l'infezione naturalmente.
Nei pazienti fortemente immunodepressi è stata osservata varicella clinicamente importante a seguito della vaccinazione con Varilrix ed è stato possibile isolare virus vaccinali dalle vescicole.
Efficacia clinica
Vedere «Farmacodinamica».
Farmacocinetica
La valutazione delle proprietà farmacocinetiche non è richiesta per i vaccini.
Assorbimento
Non applicabile.
Distribuzione
Non applicabile.
Metabolismo
Non applicabile.
Eliminazione
Non applicabile.
Dati preclinici
Non applicabile.
Altre indicazioni
Incompatibilità
Varilrix non deve essere miscelato con altri vaccini nella stessa siringa.
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Precauzioni particolari per la conservazione
Conservare in frigorifero (2-8°C), al riparo dalla luce nella confezione originale e fuori dalla portata dei bambini. Rispettare la catena del freddo.
L'efficacia di Varilrix (polvere) non è influenzata dal congelamento.
Indicazioni per la manipolazione
Il solvente e il vaccino ricostituito vanno ispezionati visivamente prima della ricostituzione o della somministrazione per rilevare la presenza di eventuali particelle estranee e/o alterazioni dell'aspetto. Qualora si osservino alterazioni, il solvente o il vaccino ricostituito non deve essere utilizzato.
A causa di piccole differenze di pH, il colore del vaccino ricostituito può variare da pesca chiaro a rosa.
Indicazioni per la ricostituzione del vaccino con il solvente contenuto nella siringa preriempita
Varilrix deve essere ricostituito aggiungendo l'intero contenuto della siringa preriempita con il solvente al flaconcino contenente la polvere.
Per fissare l'ago alla siringa, seguire le istruzioni riportate di seguito. La siringa fornita con Varilrix può tuttavia differire leggermente (ovvero non presentare filettatura) rispetto alla siringa mostrata in figura. In questo caso, l'ago deve essere inserito senza avvitarlo.
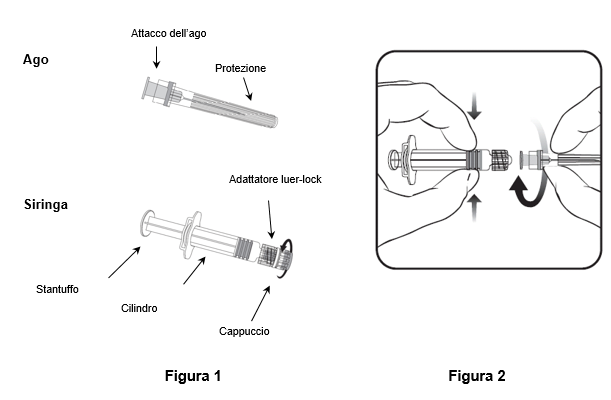
Tenere sempre la siringa per il cilindro, e non per lo stantuffo o l'adattatore luer-lock (LLA).
- Tenere la siringa per il cilindro e ruotare il cappuccio in senso antiorario (come illustrato nella figura 1).
- Per applicare l'ago alla siringa, inserire con cautela l'attacco dell'ago nel LLA e ruotare l'ago in senso orario fino a fissarlo completamente (come mostrato nella figura 2). Durante l'operazione, assicurarsi che l'ago sia sullo stesso asse della siringa (come mostrato nella figura 2). In caso contrario il LLA potrebbe piegarsi e non essere più ermetico. Se durante l'applicazione dell'ago il LLA si stacca, occorre utilizzare una nuova dose di vaccino (nuova siringa e nuovo flacone).
- Rimuovere la protezione dell'ago, che talvolta può essere ben fissa.
- Aggiungere il solvente alla polvere. Quindi agitare bene la miscela finché la polvere non si è completamente sciolta nel solvente.
Dopo la ricostituzione, il vaccino deve essere somministrato immediatamente. - Aspirare l'intero contenuto del flaconcino nella siringa.
- Utilizzare un ago nuovo per la somministrazione del vaccino. Svitare l'ago dalla siringa e applicare un ago per iniezioni, ripetendo il passaggio 2.
Si raccomanda di usare il vaccino per l'iniezione il prima possibile dopo la ricostituzione. Tuttavia è stato dimostrato che il vaccino ricostituito può essere conservato a temperatura ambiente (25°C) per un massimo di 90 minuti e in frigorifero (2°C-8°C) fino a 8 ore. Trascorsi questi intervalli, il vaccino ricostituito non deve essere più utilizzato.
Prima dell'iniezione, occorre lasciare evaporare completamente dalla cute l'alcol e altri disinfettanti in quanto possono inattivare il virus.
Il vaccino non utilizzato e i rifiuti devono essere smaltiti in conformità ai requisiti nazionali.
Numero dell'omologazione
00585 (Swissmedic).
Titolare dell’omologazione
GlaxoSmithKline AG, 3053 Münchenbuchsee.
Stato dell'informazione
Agosto 2020.
Composition
Principes actifs
Souche OKA du virus de la varicelle.
Excipients
Poudre: acides aminés, lactose, mannitol (E 421), sorbitol (E 420) 6 mg.
Solvant: eau pour préparations injectables.
Résidus
Sulfate de néomycine.
Forme pharmaceutique et quantité de principe actif par unité
Poudre et solvant pour la préparation d'une solution injectable.
Une dose (0,5 mL) du vaccin reconstitué contient au moins 103.3 UFP (unités formant des plaques) du virus de la varicelle, souche OKA.
La poudre est de couleur claire, crème à jaunâtre ou rose pâle. Le solvant est limpide et incolore.
Indications/Possibilités d’emploi
Sujets sains
Varilrix est indiqué pour l'immunisation active contre la varicelle des enfants dès l'âge de 12 mois révolus, des adolescents et des adultes en bonne santé.
Dans des indications ou situations particulières, il relève de la responsabilité du médecin d'utiliser déjà Varilrix dès l'âge de 9 mois révolus, p.ex. si un enfant est exposé à un haut risque de contracter une varicelle sévère ou s'il se trouve en contact étroit avec un patient à risque.
Patients à risque et personnes de contact en bonne santé
Varilrix est indiqué pour l'immunisation active des patients à risque et des personnes non immunisées qui vivent en contact étroit avec ces patients.
Patients souffrant d'une leucémie aiguë
Les patients ayant une leucémie aiguë ont un risque accru en cas de varicelle; ces patients doivent donc être vaccinés s'ils n'ont encore jamais eu la varicelle ou s'ils sont séronégatifs.
En cas de vaccination dans la phase aiguë de la leucémie, il faut suspendre la chimiothérapie pendant une semaine avant et une semaine après la vaccination. En principe, les patients traités par radiothérapie ne doivent pas être vaccinés pendant la phase de traitement.
Généralement, les patients sont vaccinés lorsqu'ils sont en rémission hématologique complète. Une vaccination doit être effectuée quand le nombre total de lymphocytes est au moins de 1'200 par mm3 ou qu'il n'y a pas d'indice de déficience de l'immunité cellulaire.
Patients sous traitement immunosuppresseur
Les patients recevant un traitement immunosuppresseur (corticothérapie incluse) et atteints de tumeurs malignes ou de maladies chroniques graves (p.ex. insuffisance rénale chronique, maladies auto-immunes, collagénoses, asthme bronchique grave) sont particulièrement exposés à une forme sévère de varicelle.
Il faut vacciner quand le nombre total de lymphocytes est d'au moins 1'200 par mm3 ou qu'il n'y a pas d'autre déficience de l'immunité cellulaire.
Patients en attente d'une transplantation d'organe
Lorsqu'une transplantation d'organe est envisagée (p.ex. greffe de rein), il faut vacciner env. 6 à 8 semaines avant l'administration du traitement immunosuppresseur.
Patients atteints de maladies chroniques
D'autres maladies chroniques telles que les troubles métaboliques ou endocriniens, les maladies pulmonaires chroniques et cardiovasculaires, la mucoviscidose et les anomalies neuromusculaires peuvent également prédisposer aux formes graves de varicelle. Dans de tels cas, une vaccination contre la varicelle permet d'éviter des complications sévères.
Personnes de contact en bonne santé
Les personnes de contact en bonne santé sensibles doivent être vaccinées, afin de diminuer le risque de transmission du virus aux patients à risque. Cette catégorie englobe les parents et frères et sœurs des patients à risque, le personnel médical et paramédical, de même que les autres personnes qui sont en contact étroit avec des patients atteints de varicelle ou des patients à risque.
Varilrix doit être administré selon les recommandations officielles de vaccination.
Posologie/Mode d’emploi
Posologie usuelle
Sujets sains
Une dose se compose de 0,5 ml de vaccin reconstitué.
Pour garantir une protection optimale contre la varicelle, 2 doses de vaccin sont recommandées pour les enfants à partir de 9 mois révolus, les adolescents et les adultes (voir «Propriétés/Effets»).
Les deux doses doivent de préférence être administrées à 6 semaines d'intervalle. Cet intervalle ne doit en aucun cas être inférieur à 4 semaines.
Pour assurer un effet protecteur du vaccin, il faut administrer la dose recommandée entièrement.
Patients à risque:
Chez les patients à risque, il peut être utile de titrer périodiquement les anticorps anti-varicelle, de façon à réaliser une injection de rappel chez les patients dont le titre d'anticorps a fortement diminué.
Interchangeabilité des vaccins
Il est possible d'administrer une dose de vaccin Varilrix à des sujets ayant déjà reçu auparavant une dose unique d'un autre vaccin contre la varicelle et inversement.
Mode d'administration
Varilrix est à injecter par voie sous-cutanée dans la région deltoïde de la partie supérieure du bras ou dans la région antérolatérale de la cuisse.
Pour les instructions concernant la reconstitution du vaccin avant administration, voir «Remarques particulières».
Contre-indications
Varilrix est contre-indiqué:
- chez les personnes présentant des déficits immunitaires primaires ou acquis, avec un nombre total de lymphocytes inférieur à 1'200 par mm3, ou
- chez les personnes présentant d'autres signes d'anomalie de l'immunité cellulaire, comme par exemple chez les personnes présentant une leucémie, un lymphome, une dyscrasie sanguine ou des manifestations cliniques d'une infection à VIH, ou
- chez les personnes recevant un traitement immunosuppresseur, y compris des corticostéroïdes à posologie élevée (voir «Mises en garde et précautions»).
Varilrix est contre-indiqué chez les patients ayant une hypersensibilité connue à la néomycine ou à un autre composant du vaccin. Un antécédent de dermatite de contact à la néomycine n'est par contre pas une contre-indication.
Varilrix est contre-indiqué chez les personnes qui ont présenté des signes de réaction d'hypersensibilité lors d'une administration précédente d'un vaccin contre la varicelle.
Varilrix est contre-indiqué chez les femmes enceintes. Une grossesse doit être évitée pendant les trois mois suivant la vaccination (voir «Grossesse, allaitement»).
Mises en garde et précautions
Varilrix ne doit pas être administré par voie intradermique et ne doit en aucun cas être injecté par voie intravasculaire!
Avant la vaccination d'une femme en âge de procréer, une grossesse doit être exclue. Après la vaccination, une contraception fiable doit être pratiquée pendant une période de 3 mois (voir «Grossesse, allaitement»).
Comme pour d'autres vaccins, il faut différer l'injection de Varilrix en cas de maladie aiguë s'accompagnant d'une fièvre élevée. Chez les sujets sains, une infection légère ne constitue par contre pas une contre-indication.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l'injection. Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Comme pour tous les vaccins injectables, il est recommandé de disposer d'un traitement médical approprié (p.ex. solution d'adrénaline à 1/1'000) pour le rare cas où surviendrait une réaction anaphylactique.
Avant d'injecter le vaccin, laisser entièrement s'évaporer l'alcool et les autres désinfectants de la peau, car ces substances peuvent inactiver les virus atténués.
Des varicelles peuvent aussi apparaître chez des personnes qui ont été précédemment vaccinées avec un vaccin vivant contre la varicelle. Cependant, l'évolution de ces maladies a le plus souvent été bénigne. Par comparaison aux sujets non vaccinés, la fièvre est apparue plus rarement et les manifestations cutanées étaient moins fréquentes et moins marquées.
Il a été montré que dans de très rares cas, une transmission du virus vaccinal OKA de personnes vaccinées qui développent une réaction cutanée, à des personnes de contact séronégatives peut se produire. Dans ces cas, l'évolution de la maladie chez la personne de contact était bénigne. Il a également été montré qu'une transmission du virus vaccinal OKA par une personne vaccinée exempte d'éruption cutanée à des personnes de contact séronégatives est possible.
Contrairement aux sujets vaccinés sains, un exanthème papulo-vésiculaire apparaît plus fréquemment chez les patients leucémiques (voir «Effets indésirables»), sa transmission à des patients à risque vulnérables étant possible. Dans ces cas également, l'évolution de la maladie chez les personnes de contact était bénigne.
Les personnes immunosupprimées, pour lesquelles aucune contre-indication à la vaccination n'existe (voir «Contre-indications»), ne répondent éventuellement pas aussi bien que des personnes immunocompétentes; ces personnes peuvent, malgré une vaccination correcte contre la varicelle, développer la maladie.
Très peu de rapports sont disponibles en ce qui concerne la varicelle disséminée avec une implication des organes internes après la vaccination avec la souche OKA; ceux-ci concernaient en particulier, mais pas exclusivement, des personnes immunosupprimées. Dans des cas isolés, une issue fatale a été rapportée, malgré un traitement à base d'aciclovir.
L'apparition d'un zona, manifestation tardive connue survenant après une infection naturelle par le virus de la varicelle, ne peut pas être non plus exclue après la vaccination (voir «Effets indésirables»).
Des données à long terme relatives à l'incidence du zona sur plusieurs décennies ne sont pas encore disponibles; il n'est donc pas encore possible d'évaluer la fréquence d'apparition du zona après la vaccination en comparaison à celle observée suite à une infection naturelle.
Comme pour tout vaccin, il est possible qu'une réponse immunitaire protectrice ne soit pas obtenue chez tous les sujets vaccinés.
Le médicament contient 6 mg de sorbitol par dose vaccinale.
Interactions
Si un test tuberculinique doit être fait, il est impératif de le faire avant ou en même temps que la vaccination, car il a été rapporté que les vaccins vivants peuvent entraîner une diminution temporaire de la sensibilité tuberculinique de la peau. Cette diminution de la sensibilité cutanée pouvant persister jusqu'à six semaines au maximum, le test à la tuberculine ne doit pas être effectué pendant cette période post-vaccinale, afin d'éviter des résultats faussement négatifs. L'utilisation de méthodes alternatives et plus précises (par exemple basées sur les cytokines) pour la détermination de la tuberculose doit être envisagée.
Chez les patients ayant reçu des immunoglobulines ou des transfusions sanguines, il faut attendre au moins trois mois avant de vacciner, étant donné que les anticorps apportés par ces traitements risquent d'empêcher une immunisation.
Il faut éviter la prise de salicylés dans les 6 semaines qui suivent une vaccination contre la varicelle, des cas de syndrome de Reye ayant été signalés après l'utilisation de salicylés pendant une infection naturelle de varicelle.
Sujets sains
Varilrix peut être administré en même temps que d'autres vaccins. Plusieurs vaccins doivent toujours être administrés à des sites d'injection différents. Les vaccins inactivés peuvent être administrés indépendamment de la date de la vaccination contre la varicelle.
Si une vaccination contre la rougeole n'est pas réalisée en même temps que celle par Varilrix, un intervalle d'au moins un mois entre les deux vaccinations doit être respecté, car la vaccination contre la rougeole peut entraîner une brève suppression de la réponse de l'immunité cellulaire.
Patients à risque
Varilrix ne doit pas être administré en même temps que d'autres vaccins à virus vivants atténués. Les vaccins inactivés peuvent être administrés indépendamment de la date de la vaccination contre la varicelle, à condition qu'il n'y ait pas de contre-indication spécifique.
Plusieurs vaccins doivent toujours être administrés à des sites d'injection différents.
Grossesse/Allaitement
Grossesse
Il n'existe pas de données adéquates concernant l'emploi de Varilrix pendant la grossesse. Des études sur la toxicité de reproduction n'ont pas été effectuées en expérimentation animale.
Les femmes enceintes ne doivent pas être vaccinés avec Varilrix. Avant la vaccination d'une femme en âge de procréer, une grossesse doit être exclue. Après la vaccination par Varilrix, une contraception fiable doit être effectuée sur une période de trois mois.
Allaitement
Des études avec des données sur l'utilisation chez les femmes qui allaitent ne sont pas disponibles. La transmission post-partum de la souche OKA de mères vaccinées aux nouveau-nés a été publiée dans des cas isolés (voir «Mises en garde et précautions»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude n'est disponible quant à l'influence de Varilrix sur l'aptitude à la conduite et l'utilisation de machines. Des effets secondaires tels que de la fièvre, des maux de tête ou de la fatigue peuvent avoir une influence négative sur l'aptitude à la conduite et l'utilisation de machines (voir aussi «Effets indésirables»).
Effets indésirables
Données des études cliniques
Sujets sains
Plus de 7'900 personnes ont participé aux études cliniques pour évaluer le profil de réactogénicité du vaccin administré seul ou en association avec d'autres vaccins.
Le profil de sécurité présenté ci-après repose sur l'expérience acquise lors de l'administration de 5'369 doses de Varilrix au total, en monothérapie à des enfants, des adolescents et des adultes.
Les fréquences sont indiquées comme suit: «très fréquent» (≥1/10), «fréquent» (< 1/10, ≥1/100), «occasionnel» (< 1/100, ≥1/1000), «rare» (< 1/1000, ≥1/10'000), «très rare» (< 1/10'000).
Infections et infestations
Occasionnels: infections des voies respiratoires supérieures, pharyngite.
Affections hématologiques et du système lymphatique
Occasionnels: lymphadénopathie.
Affections psychiatriques
Occasionnels: irritabilité.
Affections du système nerveux
Occasionnels: céphalée, somnolence.
Affections oculaires
Rares: conjonctivite.
Affections respiratoires, thoraciques et médiastinales
Occasionnels: toux, rhinite.
Affections gastro-intestinales
Occasionnels: nausées, vomissements.
Rares: douleur abdominale, diarrhée.
Affections de la peau et du tissu sous-cutané
Fréquents: éruption cutanée.
Occasionnels: éruption cutanée comme dans la varicelle, démangeaisons.
Rares: urticaire.
Affections musculosquelettiques et du tissu conjonctif
Occasionnels: arthralgie, myalgie.
Troubles généraux et anomalies au site d'administration
Très fréquents: douleur, rougeur (17,0% chez l'enfant et 19,9% chez l'adolescent et l'adulte), fièvre (10,1%) (température orale/axillaire ≥37,5°C ou température rectale ≥38,0°C)*.
Fréquents: gonflement au site d'injection*.
Occasionnels: fièvre (température orale/axillaire > 39,0°C ou température rectale > 39,5°C), fatigue, malaise.
* Dans les études réalisées chez l'adolescent et l'adulte, un gonflement au site d'injection et une fièvre ont été très fréquemment signalés. Chez les enfants de moins de 13 ans, des gonflements ont également été très fréquemment observés après la deuxième dose.
L'incidence des douleurs, rougeurs et gonflements observés a eu tendance à être plus élevée après la deuxième dose qu'après la première dose.
En ce qui concerne la réactogénicité, aucune différence n'a été observée entre les patients initialement séropositifs et séronégatifs.
Patients à risque
Les données obtenues à partir d'études cliniques chez des patients exposés à un haut risque de développer une forme sévère de varicelle ne sont que limitées. Les réactions liées au vaccin, essentiellement des éruptions cutanées papulo-vésiculaires et une fièvre, sont généralement légères. Contrairement aux sujets vaccinés sains, l'apparition d'un exanthème papulo-vésiculaire est plus fréquente chez les patients leucémiques. Ces symptômes varicelliformes ont été observés chez environ un quart des patients leucémiques. Comme chez les sujets sains, les rougeurs, les gonflements et les douleurs au site d'injection sont légers et de nature passagère.
Effets indésirables après commercialisation
Après la mise sur le marché, les réactions suivantes ont été rapportées après une vaccination contre la varicelle:
Infections et infestations
Rares: zona.
Affections hématologiques et du système lymphatique
Rares: thrombocytopénie.
Affections du système immunitaire
Rares: hypersensibilité, réactions anaphylactiques.
Affections du système nerveux
Rares: encéphalite, accident vasculaire cérébral (dans certains cas avec la mise en évidence du virus vaccinal dans le vaisseau atteint), cérébellite, symptômes de type cérébellite (y compris des troubles transitoires de la marche et une ataxie transitoire), convulsions.
Affections vasculaires
Rares: vascularite (y compris purpura de Schönlein-Henoch et syndrome de Kawasaki).
Affections de la peau et du tissu sous-cutané
Rares: érythème exsudatif multiforme.
Une administration intravasculaire accidentelle peut provoquer des réactions sévères pouvant aller jusqu'à un choc. Prendre les mesures immédiates en fonction du degré de gravité, voir «Mises en garde et précautions».
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Des cas d'administration accidentelle d'une dose supérieure à la dose recommandée de Varilrix ont été signalés. Dans ces cas, les effets indésirables suivants ont été signalés: léthargie et convulsions. Aucun des autres cas de surdosage rapportés n'a été associé à des effets indésirables.
Propriétés/Effets
Code ATC
J07BK01
Varilrix est un lyophilisat de virus atténué de la varicelle, souche OKA, fabriqué par multiplication du virus dans des cultures cellulaires diploïdes humaines (MRC-5). Varilrix répond aux exigences de l'OMS relatives aux substances biologiques et aux vaccins contre la varicelle.
Mécanisme d'action
Varilrix produit une infection à varicelle atténuée, cliniquement inapparente, chez les personnes réceptives.
Un certain effet protecteur peut être atteint chez les patients qui reçoivent le vaccin dans les 72 heures suivant leur exposition au virus naturel de la varicelle.
Un taux d'anticorps mesurable confirme la protection contre la varicelle.
Pharmacodynamique
Efficacité clinique
L'efficacité des vaccins OKA contre la varicelle de GlaxoSmithKline (1 dose de Varilrix ou 2 doses de vaccin tétravalent rougeole-oreillons-rubéole-varicelle Priorix-Tetra administrées à un intervalle de 42 jours) a été évaluée dans la grande étude clinique OKA-H-179 (suivi OKAH-182 EXT 179:Y4-Y6-Y8-Y10), contrôlée contre traitement actif et réalisée dans plusieurs pays, en comparaison avec 2 doses de vaccin rougeole-oreillons-rubéole sans composante varicelle données à un intervalle de 42 jours. Différents critères d'efficacité ont été utilisés pour le diagnostic d'une varicelle manifeste. 5803 enfants ont participé à la phase A (vaccination à l'âge de 12-24 mois). 4580 enfants ont été inclus dans la phase B de suivi au long terme. 3298 enfants (56,8%) ont terminé la totalité de l'étude OKAH-182 EXT 179:Y4-Y6-Y8-Y10 d'une durée de 10 ans. Il n'était prévu aucune hypothèse statistique pour la phase B de l'étude, mais seulement des observations descriptives. Le diagnostic primaire reposait sur la déclaration d'une affection de type varicelle par les parents qui, en cas de confirmation prévue par l'investigateur, était suivie d'un examen par PCR. Des contacts téléphoniques avaient lieu tous les 6 mois. L'investigateur a tout d'abord évalué les varicelles supposées au niveau clinique. Les cas de varicelle supposés ont ensuite encore été évalués par un panel d'experts. De plus, une mise en évidence directe du virus par PCR (Polymerase Chain Reaction) a été réalisée ainsi qu'une vérification de l'anamnèse quant à une exposition possible à la varicelle.
Dans la première analyse (cas confirmés de varicelle), la condition pour évaluer le succès de la vaccination contre la varicelle quelle que soit la sévérité et contre les cas de varicelle modérés à sévères était la mise en évidence définitive du virus par PCR et/ou la confirmation de l'exposition à la varicelle. Dans une deuxième analyse moins stricte (cas cliniques de varicelle), ont été considérés pour l'évaluation du succès de la vaccination tous les cas confirmés de varicelle mais aussi tous les cas de varicelle identifiés par le panel d'experts, indépendamment d'une confirmation par PCR ou d'une exposition dans l'anamnèse.
L'efficacité du vaccin pour prévenir les cas de varicelle confirmée quelle que soit la sévérité de la varicelle ainsi que les cas de varicelle confirmée modérée ou sévère a été démontrée après une période de suivi principale de 2 ans chez 5803 enfants vaccinés (durée médiane de 3,2 ans). Une efficacité durable a été observée durant les périodes de suivi au long terme de 6 ans (durée médiane de 6,4 ans) et de 10 ans (durée médiane de 9,8 ans, 3298 enfants ont participé entièrement à l'étude dans les 3 bras) de la même étude OKAH-182 EXT 179:Y4-Y6-Y8-Y10. Les résultats sont présentés dans le tableau ci-dessous.
Groupe | Période de suivi | Efficacité contre une varicelle confirmée, quelle que soit la sévérité | Efficacité contre une varicelle confirmée modérée ou sévère |
Varilrix (1 dose) N=2'487 | à 2 ans | 65,4% (IC à 97,5%: 57,2;72,1) | 90,7% (IC à 97,5%: 85,9;93,9) |
à 6 ans(1) | 67,0% (IC à 95%: 61,8;71,4) | 90,3% (IC à 95%: 86,9;92,8) | |
à 10 ans(1) | 67,2% (IC à 95%: 62,3;71,5) | 89,5% (IC à 95%: 86,1;92,1) | |
Vaccin combiné contre la rougeole, les oreillons, la rubéole et la varicelle (2 doses) N=2'489 | à 2 ans | 94,9% (IC à 97,5%: 92,4;96,6) | 99,5% (IC à 97,5%: 97,5;99,9) |
à 6 ans(1) | 95,0% (IC à 95%: 93,6;96,2) | 99,0% (IC à 95%: 97,7;99,6) | |
à 10 ans(1) | 95,4% (IC à 95%: 94,0;96,4) | 99,1% (IC à 95%: 97,9;99,6) |
N=nombre de sujets inclus dans l'étude et vaccinés. Le suivi sur 10 ans a été réalisé chez 3298 enfants au total inclus dans les 3 bras (Priorix-Tetra, Varilrix, Priorix).
(1) analyse descriptive
Les données d'efficacité contre les cas cliniques de varicelle quelle que soit la sévérité de la varicelle ainsi que contre les cas cliniques de varicelle modérée ou sévère observés après une période de suivi principale de 2 ans et après les périodes de suivi de 6 ans et de 10 ans sont présentées dans le tableau ci-dessous.
Groupe | Période de suivi | Efficacité contre une varicelle clinique, quelle que soit la sévérité | Efficacité contre une varicelle clinique modérée ou sévère |
Varilrix (1 dose) N=2'266 | à 2 ans | 64,6% (IC à 95%: 57,5;70,5) | 90,2% (IC à 95%: 85,9;93,1) |
à 6 ans(1) | 66,2% (IC à 95%: 61,0;70,7) | 89,8% (IC à 95%: 86,4;92,4) | |
à 10 ans(1) | 66,3% (IC à 95%: 61,4;70,6) | 89,0% (IC à 95%: 85,5;91,6) | |
Vaccin combiné contre la rougeole, les oreillons, la rubéole et la varicelle (2 doses) N=2'279 | à 2 ans | 92,5% (IC à 95%: 89,9;94,4) | 99,3% (IC à 95%: 94,7;99,8) |
à 6 ans(1) | 93,4% (IC à 95%: 91,7;94,7) | 98,7% (IC à 95%: 97,4;99,4) | |
à 10 ans(1) | 93,6% (IC à 95%: 92,1;94,9) | 98,5% (IC à 95%: 97,1;99,2) |
N=nombre de sujets inclus dans chaque groupe. Le suivi sur 10 ans a été réalisé chez 3298 enfants au total inclus dans les 3 bras (Priorix-Tetra, Varilrix, Priorix).
(1) analyse descriptive
Dans une étude d'efficacité précédente (OKA-H-024) sur env. 2,5 ans chez des enfants âgés de 10 à 30 mois, l'effet protecteur contre une varicelle cliniquement avérée (plus de 30 vésicules) après une dose de Varilrix était de 100%. La protection contre toutes les formes de varicelle confirmées sérologiquement (y compris les cas légers avec au moins une vésicule) était de 88% (IC à 95%: 71,0;95,1). L'évolution de tous les cas a été bénigne avec un nombre moyen de vésicules égal à un. De la fièvre n'a pas été rapportée.
L'efficacité d'une dose de Varilrix ou de 2 doses du vaccin combiné ROR-varicelle a été évaluée dans différents contextes (épidémies, études cas-témoins, études sur la base de banques de données) et était de 20% - 92% contre tous les cas de varicelle et de 86% - 100% contre les cas de maladie modérés ou sévères.
Dans une étude réalisée en Uruguay, la diminution des séjours hospitaliers et des visites médicales en ambulatoire était de 81% et 87% chez des enfants après l'administration d'une dose de Varilrix.
Les données d'efficacité indiquent une plus grande protection et une fréquence moins élevée de cas de varicelle après 2 doses de vaccin qu'après une seule dose de vaccin.
Réponse immunitaire
Personnes en bonne santé
Chez les enfants âgés de 11 à 21 mois, le taux de séroconversion mesuré par ELISA (50 mUI/ml) était de 89,6% 6 semaines après la première dose et de 100% 6 semaines après la deuxième dose.
Chez des enfants âgés de 9 mois à 12 ans, le taux moyen de séroconversion mesuré par immunofluorescence (IFA) était supérieur à 98% 6 semaines après la première vaccination.
Le taux de séroconversion mesuré par IFA chez des adolescents de 13 ans et plus était de 100% 6 semaines après la 2ème dose. Une année après la vaccination, tous les adolescents testés étaient encore séropositifs.
Les données disponibles sont insuffisantes pour établir le taux de protection contre les complications de la varicelle telles qu'encéphalite, hépatite ou pneumonie.
Patients à risque
Chez les patients à risque, le taux moyen de séroconversion était de 80%, atteignant environ 90% chez les patients leucémiques. Après l'immunisation, des mesures périodiques des anticorps contre la varicelle peuvent être indiquées pour dépister les patients pouvant bénéficier d'une nouvelle immunisation.
Dans une étude, l'incidence du zona était plus faible chez les patients leucémiques immunodéprimés que chez les patients leucémiques infectés par le virus naturel.
Chez des patients très immunodéprimés, des cas de varicelle significatifs sur le plan clinique sont apparus après la vaccination par Varilrix et des virus vaccinaux ont pu être isolés à partir des vésicules.
Efficacité clinique
Voir sous «Pharmacodynamique».
Pharmacocinétique
L'évaluation des propriétés pharmacocinétiques n'est pas requise pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniques
Non pertinent.
Remarques particulières
Incompatibilités
Varilrix ne doit pas être mélangé avec d'autres vaccins dans la même seringue.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants. La chaîne du froid doit être respectée.
La congélation ne modifie pas l'efficacité de Varilrix (poudre).
Remarques concernant la manipulation
Le solvant et le vaccin reconstitué doivent être soumis avant la reconstitution ou l'administration à un contrôle visuel pour s'assurer de l'absence de particules étrangères et/ou de modifications de l'aspect physique. Si l'on observe de quelconques modifications, le solvant ou le vaccin reconstitué ne doivent pas être utilisés.
En raison de petites variations du pH, la couleur du vaccin reconstitué peut varier de pêche clair à rose vif.
Instructions pour la reconstitution du vaccin avec le solvant contenu dans la seringue préremplie:
Varilrix est reconstitué en ajoutant la totalité du contenu de la seringue préremplie de solvant dans le flacon-ampoule contenant la poudre.
Pour fixer l'aiguille à la seringue, suivez les instructions ci-dessous. La seringue fournie avec Varilrix peut toutefois légèrement différer de la seringue illustrée (c.-à-d- sans filetage). Dans ce cas, l'aiguille ne doit pas être vissée pour être connectée à la seringue.
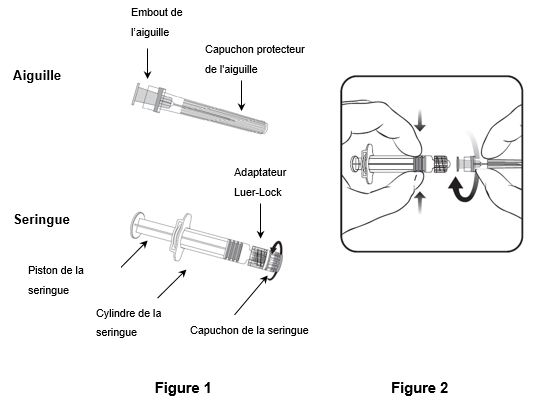
Tenez toujours la seringue par le cylindre. Ne tenez pas la seringue par le piston ou l'adaptateur Luer-Lock (ALL).
- Tenez la seringue par le cylindre et retirez le capuchon de la seringue en le tournant dans le sens inverse des aiguilles d'une montre (comme illustré dans la figure 1).
- Pour fixer l'aiguille à la seringue, introduisez prudemment l'embout de l'aiguille dans l'ALL et tournez l'aiguille dans le sens des aiguilles d'une montre jusqu'à ce qu'elle soit solidement fixée (comme illustré dans la figure 2). Veillez pendant cette opération à ce que l'aiguille soit dans l'axe de la seringue (comme illustré dans la figure 2). L'ALL risquerait sinon de se tordre et de ne plus être étanche. Si l'ALL se détache pendant la fixation de l'aiguille, il faut utiliser une nouvelle dose de vaccin (nouvelle seringue et nouveau flacon-ampoule).
- Retirez le capuchon protecteur de l'aiguille, qui peut parfois résister.
- Ajoutez le solvant à la poudre. Puis agitez soigneusement le mélange jusqu'à ce que la poudre soit entièrement dissoute dans le solvant.
Le vaccin doit être administré immédiatement après la reconstitution. - Prélevez la totalité du contenu du flacon-ampoule dans la seringue.
- Une nouvelle aiguille doit être utilisée pour l'administration du vaccin. Retirez l'aiguille de la seringue en la dévissant et fixez une aiguille d'injection en répétant l'étape 2.
Il est recommandé d'injecter le vaccin aussi rapidement que possible après sa reconstitution. Cependant, il a été démontré que le vaccin reconstitué peut être conservé jusqu'à 90 minutes à température ambiante (25°C) et jusqu'à 8 heures au réfrigérateur (2-8°C). Une fois ces délais dépassés, le vaccin reconstitué ne doit plus être utilisé.
Avant l'injection, laisser s'évaporer complètement l'alcool et autres désinfectants de la peau, car ces substances peuvent inactiver le virus.
Les résidus de vaccin non utilisés et les déchets doivent être éliminés conformément à la règlementation nationale.
Numéro d’autorisation
00585 (Swissmedic).
Titulaire de l’autorisation
GlaxoSmithKline AG, 3053 Münchenbuchsee.
Mise à jour de l’information
Août 2020.
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French Italian
Italian







