Spiriva Respimat Inhal Lös 2.5 mcg / stroke reusable 60 Dos
Spiriva Respimat Inhal Lös 2.5 mcg/Hub wiederverwendbar 60 Dos
-
83.16 CHF
- Price in reward points: 3131

- Availability: Not available
- Product Code: 7752257
- ATC-code R03BB04
- EAN 7680673960011
Ingredients:
Benzalkonium chlorid 1.105 mcg, Dinatrium edetat, Tiotropium 2.5 mcg, Tiotropium bromid-1-Wasser 3.124 mcg, Salzsäure zur pH-Wert-Einstellung.

Variants
Description
Was ist Spiriva Respimat und wann wird es angewendet?
Spiriva Respimat erleichtert Patienten ab 18 Jahren mit chronisch obstruktiver Lungenerkrankung (COPD) das Atmen. Bei COPD handelt es sich um eine dauerhafte Lungenerkrankung, die Atemnot und Husten verursacht. Der Begriff COPD wird übergeordnet auch als Bezeichnung für die Symptome der chronischen obstruktiven Bronchitis und des Emphysems (Überdehnung und Erweiterung der Lungenbläschen) benutzt.
COPD ist eine chronische Erkrankung, deshalb sollte Spiriva Respimat täglich angewendet werden und nicht nur, wenn Atemprobleme oder andere Symptome auftreten.
Spiriva Respimat ist ein langwirkender Bronchodilatator, der die Atemwege erweitert und dadurch die Atemtätigkeit der Lungen erleichtert. Die regelmässige Anwendung von Spiriva Respimat kann die bei diesen Erkrankungen auftretende Atemnot lindern.
Spiriva Respimat wird auf Verschreibung des Arztes oder der Ärztin angewendet.
Wann darf Spiriva Respimat nicht angewendet werden?
Sie dürfen Spiriva Respimat nicht anwenden
- wenn Sie allergisch (überempfindlich) gegen den Wirkstoff Tiotropium oder einen Inhaltsstoff (siehe Was ist in Spiriva Respimat enthalten?) sind.
- wenn Sie allergisch (überempfindlich) gegen Atropin oder atropinähnlichen Substanzen sind.
Wann ist bei der Anwendung von Spiriva Respimat Vorsicht geboten?
Spiriva Respimat enthält Benzalkoniumchlorid, dieser Bestandteil kann keuchende Atmung und Atemschwierigkeiten (Bronchospasmen - krampfartige Verengungen der Atemwege) hervorrufen, insbesondere, wenn Sie an Asthma leiden.
Achten Sie bei der Anwendung von Spiriva Respimat darauf, dass keine Substanz in die Augen gesprüht wird. Dies kann zu Augenschmerzen oder Missempfinden, verschwommenem Sehen, Augenhalos (Farbringe um Lichtquellen) oder unwirklichem Farbempfinden in Verbindung mit geröteten Augen führen (d.h. zum Engwinkelglaukom). Die Augensymptome können von Kopfschmerzen, Übelkeit oder Erbrechen begleitet sein. Waschen Sie die Augen mit warmem Wasser, brechen Sie die Behandlung mit Spiriva Respimat ab und konsultieren Sie zur weiteren Beratung sofort einen Arzt / eine Ärztin, wenn möglich einen Augenarzt / eine Augenärztin.
Wenn sich unmittelbar nach der Inhalation Ihre Atmung verschlechtert oder Hautausschlag, Schwellung oder Juckreiz auftreten, wenden Sie Spiriva Respimat kein weiteres Mal an, sondern kontaktieren Sie bitte unverzüglich Ihren Arzt / Ihre Ärztin.
Spiriva Respimat ist für die Dauerbehandlung Ihrer chronisch obstruktiven Lungenerkrankung bestimmt.
Wenden Sie dieses Arzneimittel nicht an, um plötzliche Atemnotanfälle oder Giemen (keuchende Atmung) zu behandeln. Für solche Fälle wird Ihr Arzt / Ihre Ärztin Ihnen ein anderes Mittel («Notfall-Medikament») verschrieben haben. Bitte befolgen Sie die Anweisungen Ihres Arztes / Ihrer Ärztin.
Sie sollten sich an Ihren Arzt wenden, wenn Sie das Gefühl haben, dass sich Ihre Atmung verschlechtert.
Informieren Sie Ihren Arzt/Ihre Ärztin falls Sei an einer der folgenden Erkrankungen leiden oder litten:
- Herzinfarkt (in den letzten 6 Monaten) oder instabile oder lebensbedrohliche Herzrhythmusstörungen oder eine schwere Herzleistungsschwäche (Herzinsuffizienz) in den letzten 12 Monaten.
- zystischer Fibrose (Mukoviszidose)
- Grüner Star (Glaukom)
- Prostatavergrösserung
- Harnverhalten
- Eingeschränkte Nieren- oder Leberfunktion
Mundtrockenheit könnte bei längerem Anhalten zu Karies führen. Deshalb ist auf eine gründliche Zahnhygiene zu achten.
Kinder und Jugendliche
Spiriva Respimat wird für Kinder und Jugendliche unter 18 Jahren nicht empfohlen.
Sollten Schwindel oder verschwommenes Sehen auftreten, kann die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigt sein.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie an anderen Krankheiten leiden, Allergien haben oder andere Arzneimittel (auch selbstgekaufte!) einnehmen oder äusserlich anwenden; insbesondere, falls Sie Anticholinergika wie z.B. Ipratropium oder Oxitropium anwenden oder bis vor kurzem angewendet haben.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Darf Spiriva Respimat während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Wenn Sie schwanger sind oder wenn Sie vermuten schwanger zu sein oder beabsichtigen, schwanger zu werden oder stillen, dürfen Sie dieses Arzneimittel nur anwenden, wenn es ausdrücklich von Ihrem Arzt / Ihrer Ärztin empfohlen wurde.
Wie verwenden Sie Spiriva Respimat?
Die Lösung in der Patrone des Spiriva Respimats darf nur inhaliert werden.
Die empfohlene Dosis für Erwachsene bei COPD ist 2 Hübe einmal täglich.
Spiriva Respimat wirkt 24 Stunden. Wenden Sie daher den Spiriva Respimat nur EINMAL TÄGLICH an, möglichst immer zur gleichen Tageszeit.
Da es sich bei COPD um eine chronische Erkrankung handelt, sollten Sie Spiriva Respimat täglich anwenden und nicht nur, wenn Atemprobleme auftreten. Halten Sie sie sich an die vom Arzt resp. Ärztin empfohlenen Dosierung. Inhalieren Sie nicht mehr als die empfohlene Dosis.
Spiriva Respimat sollte nicht bei Kindern und Jugendlichen unter 18 Jahren angewendet werden.
Bitte beachten Sie die genaue Gebrauchsanweisung für den Spiriva Respimat Inhalator am Schluss der Patienteninformation. Vergewissern Sie sich, dass Sie den Spiriva Respimat Inhalator richtig anwenden können.
Wenn Sie eine grössere Menge von Spiriva Respimat angewendet haben, als Sie sollten
Wenn Sie mehr als 2 Hübe Spiriva Respimat an einem Tag genommen haben, wenden Sie sich unverzüglich an Ihren Arzt / Ihre Ärztin. Sie könnten ein höheres Risiko haben, Nebenwirkungen wie trockener Mund, Verstopfung, Beschwerden beim Wasserlassen, oder verstärkten bzw. beschleunigten Herzschlag oder verschwommenes Sehen zu erleiden.
Wenn Sie die Anwendung von Spiriva Respimat vergessen haben
Sollten Sie die rechtzeitige Inhalation vergessen haben, holen Sie diese baldmöglichst nach. Sie dürfen jedoch nicht die doppelte Dosis auf einmal oder am selben Tag inhalieren. Fahren Sie danach wie gewohnt mit der Anwendung fort.
Sie dürfen die Anwendung von Spiriva Respimat nicht ohne Rücksprache mit Ihrem Arzt / Ihrer Ärztin oder Apotheker / Apothekerin abbrechen. Wenn Sie die Anwendung von Spiriva Respimat abbrechen, können die Symptome und Beschwerden Ihrer Krankheit zunehmen.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Spiriva Respimat haben?
Folgende Nebenwirkungen können auftreten:
Sehr häufig (betrifft mehr als einen von 10 Anwendern)
- Mundtrockenheit
Gelegentlich (betrifft 1 bis 10 von 1000 Anwendern)
- Schwindel
- Kopfschmerzen
- Schlaflosigkeit (Insomnie)
- Herzklopfen (Palpitationen)
- Husten
- Rachenentzündung (Pharyngitis)
- Heiserkeit
- Engegefühl in der Brust in Verbindung mit Husten, keuchender Atmung (Giemen) oder Atemlosigkeit unmittelbar nach Inhalation (Bronchospasmus)
- Verstopfung
- Pilzinfektionen im Mund- und Rachenraum
- Hautausschlag
- Juckreiz (Pruritus)
- Schwierigkeiten beim Wasserlassen (Harnverhalt)
- Schmerzen beim Wasserlassen
Selten (betrifft 1 bis 10 von 10'000 Anwendern)
- Unregelmässiger Herzschlag (Vorhofflimmern)
- Beschleunigter Herzschlag (Tachykardie)
- Nasenbluten
- Schluckbeschwerden
- Augenhalos mit Farbringen um Lichtquellen oder unwirkliches Farbsehen in Verbindung mit geröteten Augen (Glaukom)
- Erhöhter Augeninnendruck
- Verschwommenes Sehen
- Kehlkopfentzündung (Laryngitis)
- Sodbrennen (gastroösophagealer Reflux)
- Karies
- Zahnfleischentzündung (Gingivitis)
- Entzündung der Zunge
- Entzündung der Mundschleimhaut
- Schwerwiegende allergische Reaktionen, die ein Anschwellen des Mundes und Gesichts oder des Rachens verursachen (angioneurotisches Ödem)
- Nesselsucht (Urtikaria)
- Infektionen oder Geschwürbildungen der Haut
- Hauttrockenheit
- Überempfindlichkeitsreaktionen, einschliesslich allergischer Reaktionen vom Soforttyp
- Harnwegsinfektionen
Einzelfälle
- Abnahme des Körperwassers (Dehydrierung)
- Entzündung der Nasennebenhöhlen (Sinusitis)
- Darmverschluss oder Darmlähmung
- Übelkeit
- Schwere allergische Reaktion (anaphylaktische Reaktion)
- Gelenkschwellung
Bei allergischen Reaktionen wie Hautausschlag, Nesselsucht (Urtikaria), Mund- und Gesichtsschwellung oder plötzliche Atemschwierigkeiten (angioneurotisches Ödem) oder andere Überempfindlichkeitsreaktionen (z.B. plötzlicher Blutdruckabfall oder Schwindel) können nach Anwendung von Spiriva Respimat auftreten, entweder einzeln oder im Rahmen einer schweren allergischen Reaktion (anaphylaktische Reaktion).
Informieren Sie in solchen Fällen sofort einen Arzt / eine Ärztin.
Unmittelbar nach der Inhalation kann bei einigen Patienten unerwartet Brustenge, Husten, Giemen oder Atemnot (Bronchospasmus) auftreten.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Aufbrauchfrist nach Anbruch
Innerhalb von 3 Monaten nach Einsetzen der Patrone verwenden
Lagerungshinweis
Nicht über 25 °C lagern.
Nicht einfrieren.
Arzneimittel ausser Reichweite von Kindern lagern.
Was ist in Spiriva Respimat enthalten?
1 Hub enthält 2,5 Mikrogramm Tiotropium (entsprechend 3,124 Mikrogramm Tiotropiumbromid-Monohydrat)
Wirkstoffe
Tiotropium
Hilfsstoffe
Benzalkoniumchlorid (0.0011 mg bei jedem Hub), Natriumedetat, Salzsäure zur pH-Wert-Einstellung, Wasser gereinigtes
Zulassungsnummer
67396 (Swissmedic)
Wo erhalten Sie Spiriva Respimat? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Einzelpackung: 1 wiederverwendbarer Respimat Inhalator und 1 Patrone mit 60 Hüben (30 therapeutische Dosen)
Dreifachpackung: 1 wiederverwendbarer Respimat Inhalator und 3 Patronen mit 60 Hüben (90 therapeutische Dosen)
Zulassungsinhaberin
Boehringer Ingelheim (Schweiz) GmbH, Basel
Diese Packungsbeilage wurde im März 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Gebrauchsanweisung
Spiriva® Respimat® Inhalator wiederverwendbar (Tiotropium)
Einführung
Bitte lesen Sie die Gebrauchsanweisung, bevor Sie den Spiriva Respimat benutzen.
Sie brauchen den Inhalator nur EINMAL TÄGLICH (jeweils 2 Hübe) anzuwenden.

- Wenn Sie den Inhalator länger als 7 Tage nicht benutzt haben, müssen Sie zunächst einen Sprühstoss in Richtung Boden abgeben.
- Wenn Sie ihn länger als 21 Tage nicht benutzt haben, müssen Sie die unter «Vorbereitung für die erste Anwendung» beschriebenen Schritte 4 bis 6 erneut ausführen, bis eine sichtbare Sprühwolke austritt. Wiederholen Sie dann die Schritte 4 bis 6 noch drei weitere Male.
Wie ist Ihr Spiriva Respimat zu pflegen?
Reinigen Sie das Mundstück einschliesslich des Metallteils im Inneren des Mundstücks mindestens einmal wöchentlich. Verwenden Sie dazu nur ein feuchtes Tuch oder Papiertuch.
Eine leichte Verfärbung des Mundstücks hat keine Auswirkungen auf die Funktionsfähigkeit des Spiriva Respimat Inhalators.
Falls erforderlich, kann die Aussenseite des Spiriva Respimat Inhalator mit einem feuchten Tuch abgewischt werden.
Ersatz des Inhalators
Besorgen Sie eine neue Packung Spiriva Respimat mit Inhalator, wenn Sie einen Inhalator für 3 Patronen verwendet haben.


Vorbereitung für die erste Anwendung
1. Durchsichtiges Gehäuseunterteil entfernen
|
|
2. Patrone einsetzen
|
|
3. Patronen nachverfolgen
|
|
4. Drehen
|
|
5. Öffnen
|
|
6. Auslösen
Der Inhalator ist nun für die Anwendung bereit und wird 60 Hübe (30 Dosen) abgeben. |
|
Tägliche Anwendung
DREHEN
|
|
ÖFFNEN
|
|
AUSLÖSEN
|
|
Wann ist die SPIRIVA RESPIMAT Patrone zu ersetzen?
Der Dosisindikator zeigt an, wie viele Hübe noch in der Patrone sind.
| Noch 60 Hübe |
| Weniger als 10 Hübe. Besorgen Sie eine neue Patrone. |
| Ihre Patrone ist leer. Drehen Sie das durchsichtige Gehäuseunterteil, um es abzunehmen. Der Inhalator befindet sich nun in einer Sperrstellung. Ziehen Sie die Patrone aus dem Inhalator. Setzen Sie eine neue Patrone ein (weiter mit Schritt 2). |
Antworten auf häufige Fragen
Die Patrone lässt sich nicht tief genug in das Gehäuse einsetzen.
Haben Sie vor dem Einsetzen der Patrone aus Versehen das durchsichtige Gehäuseunterteil gedreht?
Öffnen Sie die Schutzkappe, drücken Sie den Auslöser und setzen Sie dann die Patrone ein.
Wechseln Sie gerade die Patrone? Die neue Patrone wird weiter herausragen als die erste Patrone. Schieben Sie die Patrone in das Gehäuse bis sie einrastet und stecken Sie anschliessend das durchsichtige Gehäuseunterteil wieder auf.
Der Auslöser lässt sich nicht drücken.
Haben Sie das durchsichtige Gehäuseunterteil gedreht? Falls nicht, drehen Sie das durchsichtige Gehäuseunterteil in einer gleichmässigen Bewegung bis es einrastet (eine halbe Drehung).
Zeigt der Dosisanzeiger auf der Patrone einen weissen Pfeil auf rotem Hintergrund? Ihre Patrone ist leer. Setzen Sie eine neue Patrone ein.
Die leere Patrone lässt sich nicht entfernen.
Ziehen Sie an der Patrone und drehen Sie gleichzeitig.
Das durchsichtige Gehäuseunterteil lässt sich weder drehen noch abnehmen.
Haben Sie das durchsichtige Gehäuseunterteil schon gedreht?
Wenn Sie das durchsichtige Gehäuseunterteil schon gedreht haben, folgen Sie den Anweisungen «ÖFFNEN» und «AUSLÖSEN» unter der Überschrift «Tägliche Anwendung», um Ihr Medikament einzunehmen.
Ist das durchsichtige Gehäuseunterteil locker und zeigt der Dosisanzeiger auf der Patrone einen weissen Pfeil auf rotem Hintergrund? Ihre Patrone ist leer. Setzen Sie eine neue Patrone ein.
Mein SPIRIVA RESPIMAT Inhalator war zu schnell leer.
Haben Sie den Respimat wie vorgesehen angewendet (zwei Hübe einmal täglich)? Bei zwei Hüben einmal täglich reicht der Respimat 30 Tage lang.
Haben Sie öfter in die Luft gesprüht, um die Funktionsfähigkeit des Respimat zu testen? Sobald Sie den Respimat für die erste Anwendung vorbereitet haben, ist bei täglicher Anwendung kein weiterer Sprühtest nötig.
Mein SPIRIVA RESPIMAT sprüht nicht.
Haben Sie eine Patrone eingesetzt? Falls nicht, setzen Sie eine Patrone ein. Nach dem Zusammensetzen des Respimat dürfen das durchsichtige Gehäuseunterteil und die Patrone nicht mehr entfernt werden, bis die Patrone leer ist.
Haben Sie nach dem Einsetzen der Patrone die Schritte DREHEN, ÖFFEN, AUSLÖSEN weniger als drei Mal wiederholt? Wiederholen Sie die Schritte DREHEN, ÖFFEN, AUSLÖSEN nach dem Einsetzen der Patrone drei Mal, wie oben in den Schritten 4 bis 6 unter der Überschrift «Vorbereitung für die erste Anwendung» angegeben.
Zeigt der Dosisanzeiger auf der Patrone einen weissen Pfeil auf rotem Hintergrund? Ihre Patrone ist leer. Setzen Sie eine neue Patrone ein.
Mein SPIRIVA RESPIMAT sprüht von allein.
War die Schutzkappe offen, als Sie das durchsichtige Gehäuseunterteil gedreht haben? Schliessen Sie erst die Schutzkappe und drehen Sie dann das durchsichtige Gehäuseunterteil.
Haben Sie auf den Auslöser gedrückt, während Sie das durchsichtige Gehäuseunterteil gedreht haben? Schliessen Sie die Schutzkappe, sodass der Auslöser verdeckt ist, und drehen Sie dann das durchsichtige Gehäuseunterteil.
Haben Sie das durchsichtige Gehäuseunterteil nicht bis zum Einrasten gedreht? Drehen Sie das durchsichtige Gehäuseunterteil in einer gleichmässigen Bewegung bis es einrastet (eine halbe Drehung).
War die Schutzkappe offen, als Sie die Patrone ausgetauscht haben? Schliessen Sie erst die Schutzkappe und tauschen Sie dann die Patrone aus.
Boehringer Ingelheim (Schweiz) GmbH, Basel

Qu’est-ce que le Spiriva Respimat et quand doit-il être utilisé?
Spiriva Respimat est destiné à faciliter la respiration des patients à partir de 18 ans souffrant de bronchopneumopathie chronique obstructive (BPCO). La BPCO est une maladie pulmonaire à long terme qui entraîne essoufflement et toux. Le terme générique de BPCO désigne également les symptômes de bronchite chronique obstructive et d'emphysème (distension et dilatation des alvéoles pulmonaires).
La BPCO est une maladie chronique, c'est pourquoi Spiriva Respimat doit être utilisé tous les jours et pas seulement lorsque les problèmes respiratoires ou d'autres symptômes de la BPCO apparaissent.
Spiriva Respimat est un bronchodilatateur à longue durée d'action qui élargit les voies respiratoires et facilite ainsi l'activité respiratoire des poumons. L'utilisation régulière de Spiriva Respimat peut soulager l'essoufflement associé à cette maladie.
Spiriva Respimat est utilisé sur prescription médicale.
Quand Spiriva Respimat ne doit-il pas être utilisé?
Vous ne devez pas utiliser Spiriva Respimat
- si vous êtes allergique (hypersensible) au tiotropium ou à l'un des autres composants (voir Que contient Spiriva Respimat?).
- si vous êtes allergique (hypersensible) à l'atropine ou à des substances apparentées.
Quelles sont les précautions à observer lors de l’utilisation de Spiriva Respimat?
Spiriva Respimat contient du chlorure de benzalconium, ce composant peut provoquer une respiration sifflante et des difficultés respiratoires (bronchospasmes – rétrécissements spasmodiques des voies respiratoires), en particulier lorsque vous souffrez d'asthme.
Lors de l'utilisation de Spiriva Respimat, veillez à ce que le produit ne soit pas pulvérisé dans les yeux. Cela pourrait provoquer une douleur ou une gêne oculaire, une vision floue, des halos visuels (zones circulaires colorées autour d'une source de lumière) ou une perception modifiée des couleurs associés à des yeux rougis (pouvant correspondre à un glaucome à angle fermé). Ces troubles oculaires peuvent s'accompagner de maux de tête, de nausées et de vomissements. Lavez-vous les yeux à l'eau chaude, arrêtez le traitement par Spiriva Respimat et consultez immédiatement un médecin, si possible un ophtalmologue, pour avis complémentaire.
Si votre respiration se détériore ou si vous présentez une éruption, un gonflement ou des démangeaisons immédiatement après l'inhalation, n'utilisez plus Spiriva Respimat et contactez votre médecin au plus vite.
Spiriva Respimat est indiqué dans le traitement continu de la bronchopneumopathie chronique obstructive.
N'utilisez pas ce médicament pour traiter des épisodes soudains d'essoufflement ou une sibilance (respiration sifflante). Votre médecin vous a probablement prescrit un autre produit («médicament de secours») pour ce type de situation. Veuillez suivre les instructions que vous a données votre médecin.
Consultez votre médecin si vous avez l'impression que votre respiration se détériore.
Veuillez informer votre médecin si vous souffrez ou avez souffert de l'une des maladies mentionnées ci-dessous:
- Infarctus du myocarde (au cours des 6 derniers mois), troubles du rythme cardiaque instables ou menaçant le pronostic vital, faiblesse cardiaque grave (insuffisance cardiaque) au cours des 12 derniers mois.
- Mucoviscidose
- Glaucome
- Hyperplasie de la prostate
- Rétention urinaire
- Insuffisance de la fonction rénale ou hépatique
La sécheresse de la bouche peut être associée à long terme à des caries. Vous devez donc veiller particulièrement à votre hygiène buccale.
Enfants et adolescents
L'utilisation de Spiriva Respimat chez les enfants et les adolescents de moins de 18 ans n'est pas recommandée.
Si vous ressentez des vertiges ou une vision trouble, la capacité à conduire des véhicules et à utiliser des machines peut être altérée.
Veuillez informer votre médecin ou votre pharmacien si vous souffrez d'une autre maladie, si vous êtes allergique, si vous prenez déjà d'autres médicaments en usage interne ou externe (même en automédication!), en particulier si vous prenez ou si vous avez pris récemment des anticholinergiques, par exemple de l'ipratropium ou de l'oxitropium.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Spiriva Respimat peut-il être utilisé pendant la grossesse ou l’allaitement?
Si vous êtes enceinte ou pensez l'être ou planifiez une grossesse ou si vous allaitez, vous devez utiliser ce médicament uniquement s'il vous a été spécifiquement recommandé par votre médecin.
Comment utiliser Spiriva Respima?
La solution contenue dans la cartouche de Spiriva Respimat est destinée à être administré uniquement par inhalation.
La dose recommandée pour les adultes dans le traitement de la BPCO est de 2 bouffées une fois par jour.
Spiriva Respimat est efficace pendant 24 heures. Utilisez Spiriva Respimat, par conséquent, uniquement UNE FOIS PAR JOUR, si possible toujours à la même heure.
Dans la mesure où la BPCO est une maladie chronique, Spiriva Respimat doit être utilisé tous les jours et pas seulement lorsque les problèmes respiratoires apparaissent. Respectez la dose recommandée par le médecin. Ne pas inhaler plus que la dose recommandée.
Spiriva Respimat ne doit pas être utilisé chez les enfants et adolescents de moins de 18 ans.
Respectez les instructions d'utilisation exactes de l'inhalateur Spiriva Respimat figurant à la fin de cette information destinée au patient. Assurez-vous de bien connaître le mode d'utilisation de l'inhalateur Spiriva Respimat.
Si vous avez pris plus de Spiriva Respimat que vous n'auriez dû
Si vous avez pris plus de 2 bouffées de Spiriva Respimat en une journée, consultez votre médecin au plus vite. En effet, vous risquez alors davantage de présenter des effets secondaires comme une sécheresse de la bouche, une constipation, des difficultés à uriner, une augmentation de la fréquence cardiaque ou une vision floue.
Si vous avez oublié de prendre Spiriva Respimat
Si vous avez oublié d'inhaler une dose, prenez-la dès que vous vous en rendez compte. Mais ne prenez pas deux doses en même temps ou au cours de la même journée. Poursuivez le traitement en inhalant la dose suivante au moment habituel.
Vous ne devez pas arrêter l'utilisation de Spiriva Respimat sans consulter votre médecin ou votre pharmacien. Si vous arrêtez de prendre Spiriva Respimat, les symptômes et troubles liés à votre maladie pourraient s'aggraver.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Spiriva Respimat peut-il provoquer?
Les effets secondaires suivants peuvent survenir:
Très fréquents (concerne plus d'un utilisateur sur 10)
- Sécheresse de la bouche
Occasionnels (concerne 1 à 10 utilisateurs sur 1 000)
- Vertiges
- Maux de tête
- Insomnie
- Palpitations cardiaques
- Toux
- Inflammation de la gorge (pharyngite)
- Enrouement
- Sensation d'oppression dans la poitrine associée à une toux, une respiration sifflante (sibilance) ou essoufflement directement après l'inhalation (bronchospasme)
- Constipation
- Infections fongiques (champignons) dans la bouche et la gorge
- Éruption cutanée
- Démangeaisons (prurit)
- Difficultés à uriner (rétention d'urine)
- Douleurs en urinant
Rares (concerne 1 à 10 utilisateurs sur 10 000)
- Battements cardiaques irréguliers (fibrillation auriculaire)
- Battements cardiaques accélérés (tachycardie)
- Saignement du nez
- Troubles de déglutition
- Halos visuels avec des cercles colorés autour de sources de lumière ou vision de couleurs irréelles associés à des yeux rougis (glaucome)
- Augmentation de la pression oculaire interne
- Vision trouble
- Inflammation du larynx (laryngite)
- Brûlures d'estomac (reflux gastro-œsophagien)
- Caries
- Inflammation des gencives (gingivite)
- Inflammation de la langue
- Inflammation de la muqueuse buccale
- Graves réactions allergiques provoquant un gonflement de la bouche et du visage ou de la gorge (œdème angioneurotique)
- Urticaire
- Infections ou ulcères de la peau
- Sécheresse de la peau
- Réactions d'hypersensibilité, notamment des réactions allergiques de type immédiat
- Infections des voies urinaires
Cas isolés
- Perte d'eau corporelle (déshydratation)
- Inflammation des sinus (sinusite)
- Occlusion intestinale ou paralysie intestinale
- Nausées
- Grave réaction allergique (réaction anaphylactique)
- Gonflement des articulations
En cas de réactions allergiques comme une éruption cutanée, une urticaire, un gonflement de la bouche et du visage ou des problèmes respiratoires soudains (œdème angioneurotique) ou d'autres réactions d'hypersensibilité (p.ex. une chute de tension soudaine ou des vertiges) peuvent apparaître après l'utilisation de Spiriva Respimat soit de manière isolée ou dans le cadre d'une réaction allergique grave (réaction anaphylactique).
Dans ces cas contactez immédiatement un médecin.
Chez certains patients, une sensation d'oppression dans la poitrine, une toux, une respiration sifflante (sibilance) ou un essoufflement (bronchospasme) peuvent apparaître de manière inattendue directement après l'inhalation.
Si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention?
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Durée de conservation après ouverture
Utiliser dans les 3 mois suivant l'insertion de la cartouche
Remarque concernant le stockage
Ne pas conserver au-dessus de 25 °C.
Ne pas congeler.
Spiriva Respimat doit être conservé hors de la portée des enfants.
Que contient Spiriva Respimat?
1 dose contient 2,5 microgrammes de tiotropium (correspondant à 3,124 microgrammes de bromure de tiotropium monohydraté).
Principes actifs
Tiotropium.
Excipients
Chlorure de benzalconium (0,0011 mg à chaque bouffée), édétate de sodium, acide chlorhydrique pour l'ajustement du pH, eau purifiée.
Numéro d’autorisation
67396 (Swissmedic)
Où obtenez-vous Spiriva Respimat? Quels sont les emballages à disposition sur le marché?
En pharmacies seulement sur prescription médicale.
Emballage unique: 1 inhalateur Respimat réutilisable et 1 cartouche avec 60 bouffées (30 doses thérapeutiques)
Emballage triple: 1 inhalateur Respimat réutilisable et 3 cartouche avec 60 bouffées (90 doses thérapeutiques)
Titulaire de l’autorisation
Boehringer Ingelheim (Suisse) GmbH, Bâle.
Cette notice d'emballage a été vérifiée pour la dernière fois en mars 2020 par l'autorité de contrôle des médicaments (Swissmedic).
Mode d’emploi
Inhalateur Spiriva® Respimat® réutilisable (tiotropium)
Introduction
Veuillez lire le mode d’emploi avant d’utiliser l’inhalateur Spiriva Respimat.
Vous devez utiliser l’inhalateur seulement UNE FOIS PAR JOUR (2 bouffées).

- Si l’inhalateur Spiriva Respimat n’a pas été utilisé pendant plus de 7 jours, pulvériser une bouffée en direction du sol.
- Si l’inhalateur Spiriva Respimat n’a pas été utilisé pendant plus de 21 jours, répéter les étapes 4 à 6 décrites à la rubrique «Préparation pour la première utilisation» jusqu’à ce qu’un nuage soit visible. Puis, répéter les étapes 4 à 6, trois autres fois.
Comment entretenir votre inhalateur Spiriva Respimat?
Nettoyez l’embout buccal, y compris la partie métallique à l’intérieur, au moins une fois par semaine. Utilisez à cet effet uniquement un linge humide ou un mouchoir en papier.
Une légère décoloration de l’embout buccal n’a pas d’incidence sur le bon fonctionnement de l’inhalateur Spiriva Respimat.
Si nécessaire, la face extérieure du Spiriva Respimat Inhalator peut être essuyée avec un linge humide.
Remplacement de l’inhalateur
Procurez-vous un nouvel emballage de Spiriva Respimat avec inhalateur lorsque vous avez utilisé un inhalateur pour 3 cartouches.


Préparation pour la première utilisation
1. Retrait de la base transparente
|
|
2. Insertion de la cartouche
|
|
3. Assurer le suivi des cartouches
|
|
4. Rotation
|
|
5. Ouverture
|
|
6. Libération de la dose
L’inhalateur est maintenant prêt pour l’utilisation et fournira 60 bouffées (30 doses). |
|
Utilisation quotidienne
ROTATION
|
|
OUVERTURE
|
|
LIBÉRATION DE LA DOSE
|
|
Quand la cartouche de SPIRIVA RESPIMAT doit-elle être remplacée?
L’indicateur de doses affiche le nombre de bouffées encore disponibles dans la cartouche.
| Encore 60 bouffées |
| Moins de 10 bouffées. Procurez-vous une nouvelle cartouche. |
| Votre cartouche est vide. Tourner la base transparente pour la retirer. L’inhalateur se trouve en position verrouillée. Retirer la cartouche de l’inhalateur. Insérer une nouvelle cartouche (continuer à l’étape 2). |
Réponses à des questions fréquemment posées
Il est difficile d’insérer la cartouche assez profondément.
La base transparente a-t-elle été tournée par inadvertance avant l’insertion de la cartouche?
Ouvrir le capuchon, appuyer sur le bouton de libération de la dose puis insérer la cartouche.
Êtes-vous en train de changer de cartouche? La nouvelle cartouche fera davantage saillie que la première cartouche. Insérer la cartouche dans le boîtier jusqu’à ce qu’elle s’enclenche puis enfoncer à nouveau la base transparente.
Il n’est pas possible d’appuyer sur le bouton de libération de la dose.
La base transparente a-t-elle été tournée?
Si ce n’est pas le cas, tourner la base transparente d’un mouvement continu jusqu’à entendre un déclic (un demi-tour).
L’indicateur de doses sur la cartouche affiche-t-il une flèche blanche sur fond rouge? Votre cartouche est vide. Insérer une nouvelle cartouche.
La cartouche vide ne s’enlève pas.
Tirer sur la cartouche tout en effectuant une rotation.
Il n’est pas possible de tourner ou de retirer la base transparente.
La base transparente a-t-elle déjà été tournée?
Si la base transparente a déjà été tournée, procéder aux étapes «OUVERTURE» et «LIBÉRATION DE LA DOSE» décrites à la rubrique «Utilisation quotidienne» afin d’administrer le médicament.
La base transparente n’est pas bien fixée et l’indicateur de doses de la cartouche affiche une flèche blanche sur fond rouge? Votre cartouche est vide. Insérer une nouvelle cartouche.
L’indicateur de doses de l’inhalateur Spiriva Respimat a atteint zéro trop tôt.
L’inhalateur SPIRIVA RESPIMAT a-t-il été utilisé conformément aux instructions (deux bouffées/une fois par jour)? L’inhalateur Spiriva Respimat suffit pour un traitement de 30 jours si deux bouffées sont administrées une fois par jour.
Le médicament a-t-il été souvent pulvérisé dans le vide afin de vérifier que l’inhalateur Spiriva Respimat fonctionne?
Après la préparation de l’inhalateur Spiriva Respimat, il n’est plus nécessaire lors de l’utilisation quotidienne de tester l’inhalateur en libérant des bouffées.
L’inhalateur Spiriva Respimat ne vaporise pas.
Une cartouche a-t-elle été insérée?
Si ce n’est pas le cas, insérer une cartouche. Après l’assemblage du Respimat, la base transparente et la cartouche ne doivent plus être retirées avant que la cartouche soit vide.
Les étapes ROTATION, OUVERTURE et LIBÉRATION DE LA DOSE effectuées après l’insertion de la cartouche ont-elles été répétées moins de trois fois?
Répéter trois fois les étapes ROTATION, OUVERTURE et LIBÉRATION DE LA DOSE après l’insertion de la cartouche comme il l’est décrit aux étapes 4 à 6 de la rubrique «Préparation pour l’utilisation quotidienne».
L’indicateur de doses de la cartouche affiche une flèche blanche sur fond rouge? Votre cartouche est vide. Insérer une nouvelle cartouche.
L’inhalateur Spiriva Respimat vaporise automatiquement.
Le capuchon était-il ouvert lors de la rotation de la base transparente? Fermer le capuchon avant de tourner la base transparente.
Lors de la rotation de la base transparente, le bouton de libération de la dose a-t-il été actionné? Fermer le capuchon de sorte que le bouton de libération de la dose soit recouvert puis tourner la base transparente.
La base transparente n’a-t-elle pas été tournée jusqu’au déclic? Tourner la base transparente en un mouvement continu jusqu’à entendre un déclic (un demi-tour).
Le capuchon était-il ouvert lorsque vous avez changé la cartouche? Fermer d’abord le capuchon puis changer la cartouche.
Boehringer Ingelheim (Suisse) GmbH, Bâle

Che cos’è Spiriva Respimat e quando si usa?
Spiriva Respimat facilita la respirazione dei pazienti con broncopneumopatia cronica ostruttiva (BPCO) a partire dai 18 anni di età. La BPCO è una malattia polmonare permanente che causa difficoltà respiratoria e tosse. Il termine BPCO è un concetto generale utilizzato per designare i sintomi della bronchite ostruttiva cronica e dell'enfisema (dilatazione eccessiva degli alveoli polmonari).
La BPCO è una malattia cronica, pertanto si raccomanda di utilizzare Spiriva Respimat ogni giorno, non solo quando si manifestano problemi respiratori o altri sintomi.
Spiriva Respimat è un broncodilatatore a lunga durata d'azione, che dilata le vie aeree e facilita in tal modo l'attività respiratoria polmonare. L'utilizzo regolare di Spiriva Respimat può ridurre la difficoltà respiratoria che si manifesta in presenza delle malattie sopra menzionate.
Spiriva Respimat deve essere utilizzato su prescrizione medica.
Quando non si può usare Spiriva Respimat?
Non deve usare Spiriva Respimat
- se è allergico (ipersensibile) al principio attivo tiotropio o ad uno dei costituenti (vedere Cosa contiene Spiriva Respimat?).
- se è allergico (ipersensibile) all'atropina o a sostanze simili all'atropina.
Quando è richiesta prudenza nell’uso di Spiriva Respimat?
Spiriva Respimat contiene benzalconio cloruro, che può causare sibilo e difficoltà respiratorie (broncospasmo – restringimento spasmodico delle respiratorie), specialmente se soffre di asma.
Durante l'uso di Spiriva Respimat, prestare attenzione che il medicamento non venga spruzzato direttamente negli occhi. In caso contrario, possono verificarsi dolori agli occhi o disturbi della sensibilità, offuscamento della vista, aloni (anelli colorati intorno alle sorgenti luminose) o percezione irreale dei colori in associazione ad occhi arrossati (ossia glaucoma ad angolo stretto). I sintomi oculari possono essere accompagnati da mal di testa, nausea o vomito. Lavare gli occhi con acqua calda, interrompere il trattamento con Spiriva Respimat e consultare immediatamente un medico, possibilmente un oculista, per un'ulteriore consulenza.
Se osserva un peggioramento della respirazione subito dopo l'inalazione oppure se manifesta forme di eruzione cutanea, gonfiore o prurito, non esegua ulteriori inalazioni con Spiriva Respimat, ma contatti immediatamente il suo medico.
Spiriva Respimat è destinato al trattamento continuativo della sua broncopneumopatia cronica ostruttiva.
Non utilizzi questo medicamento per trattare casi improvvisi di difficoltà respiratoria o stridore (respirazione affannosa). Per questi casi il suo medico provvederà a prescriverle un altro rimedio («medicamento d'emergenza»). Segua le istruzioni del suo medico.
Si rivolga al suo medico se ha la sensazione che la sua respirazione stia peggiorando.
Informi il suo medico se soffre o ha sofferto di una delle seguenti malattie:
- Infarto del miocardio (negli ultimi 6 mesi) o disturbi del ritmo cardiaco instabili o potenzialmente letali oppure scompenso cardiaco grave (insufficienza cardiaca) negli ultimi 12 mesi.
- Fibrosi cistica (mucoviscidosi)
- Glaucoma
- Ingrossamento della prostata
- Ritenzione urinaria
- Funzionalità dei reni o del fegato ridotta
La secchezza della bocca persistente potrebbe portare alla formazione di carie. Si raccomanda pertanto di osservare un'accurata igiene orale.
Bambini e adolescenti
Spiriva Respimat non è consigliato per i bambini e gli adolescenti sotto i 18 anni.
Qualora fosse soggetto a vertigini o offuscamento della vista, la sua capacità di guidare e usare macchinari potrebbe essere compromessa.
Informi il suo medico o il suo farmacista nel caso in cui soffre di altre malattie, soffre di allergie o assume altri medicamenti (anche se acquistati di sua iniziativa) o li applica esternamente, in particolare se utilizza o ha recentemente utilizzato anticolinergici, ad es. ipratropio o ossitropio.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Si può usare Spiriva Respimat durante la gravidanza o l’allattamento?
Se è incinta, sospetta di esserlo o ha in programma una gravidanza oppure se sta allattando, deve usare questo medicamento solo se espressamente raccomandato dal suo medico.
Come usare Spiriva Respimat?
La soluzione contenuta nella cartuccia di Spiriva Respimat può essere solo inalata.
La dose raccomandata per gli adulti affetti da BPCO è di 2 nebulizzazioni una volta al giorno.
Spiriva Respimat ha una durata di azione di 24 ore. Utilizzi quindi Spiriva Respimat UNA SOLA VOLTA AL GIORNO, possibilmente sempre alla stessa ora.
Poiché la BPCO è una malattia cronica, si raccomanda di utilizzare Spiriva Respimat ogni giorno, non solo quando si manifestano problemi respiratori. Si attenga alla posologia raccomandata dal suo medico. Non inali una quantità superiore alla dose raccomandata.
Spiriva Respimat non deve essere usato dai bambini e dagli adolescenti sotto i 18 anni.
Si prega di rispettare le istruzioni per l'uso dell'inalatore Spiriva Respimat riportate alla fine dell'Informazione destinata ai pazienti. Accertarsi di poter utilizzare correttamente l'inalatore Spiriva Respimat.
Se prende più Spiriva Respimat di quanto deve
Se ha inalato più di 2 nebulizzazioni di Spiriva Respimat nello stesso giorno, si rivolga immediatamente al suo medico. Potrebbe essere esposto ad un aumentato rischio di manifestare effetti collaterali, quali bocca secca, stitichezza, disturbi di minzione, battito cardiaco aumentato e/o accelerato oppure offuscamento della vista.
Se ha dimenticato di prendere Spiriva Respimat
Se ha dimenticato di effettuare puntualmente l'inalazione, la recuperi non appena possibile. Tuttavia, non inali una dose doppia in una sola volta o nello stesso giorno. Prosegua poi con l'uso come di consueto.
Non deve interrompere l'uso di Spiriva Respimat senza aver consultato il suo medico o farmacista. Se interrompe l'uso di Spiriva Respimat, i sintomi e i disturbi della sua malattia potrebbero aumentare.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere Spiriva Respimat?
Possono manifestarsi i seguenti effetti collaterali:
Molto comune (riguarda più di 1 utilizzatore su 10)
- Secchezza della bocca
Non comune (riguarda da 1 a 10 utilizzatori su 1000)
- Vertigini
- Mal di testa (cefalea)
- Difficoltà o incapacità ad addormentarsi (insonnia)
- Palpitazioni (cardiopalma)
- Tosse
- Infiammazione della faringe (faringite)
- Raucedine
- Sensazione di pressione al torace, associata a tosse, respirazione affannosa (stridore) o respiro ansimante subito dopo l'inalazione (broncospasmo)
- Stitichezza
- Infezioni fungine nella cavità oro-faringea
- Eruzione cutanea
- Prurito
- Difficoltà ad urinare (ritenzione urinaria)
- Dolore nell'urinare
Raro (riguarda da 1 a 10 utilizzatori su 10'000)
- Battito cardiaco irregolare (fibrillazione atriale)
- Battito cardiaco accelerato (tachicardia)
- Sangue dal naso
- Difficoltà di deglutizione
- Aloni con anelli colorati visibili intorno alle sorgenti luminose oppure visione dei colori alterata associata ad occhi arrossati (glaucoma)
- Aumentata pressione intraoculare
- Offuscamento della vista
- Infiammazione della laringe (laringite)
- Bruciore di stomaco (reflusso gastroesofageo)
- Carie
- Infiammazione delle gengive (gengivite)
- Infiammazione della lingua
- Infiammazione della mucosa orale
- Reazioni allergiche gravi che causano gonfiore della bocca e del viso o della faringe (edema angioneurotico)
- Orticaria
- Infezioni o ulcere cutanee
- Secchezza della pelle
- Reazioni di ipersensibilità, incluse reazioni allergiche immediate
- Infezioni delle vie urinarie
Singoli casi
- Riduzione della quantità di liquidi corporei (disidratazione)
- Infiammazione delle cavità paranasali (sinusite)
- Occlusione o paralisi intestinale
- Nausea
- Grave reazione allergica (shock anafilattico)
- Gonfiore articolare
Dopo l'uso di Spiriva Respimat possono manifestarsi reazioni allergiche, quali eruzione cutanea, orticaria, gonfiore della bocca e del viso o difficoltà respiratorie improvvise (edema angioneurotico) oppure altre reazioni di ipersensibilità (ad es. improvviso calo della pressione arteriosa o vertigini), sia isolate che associate ad una reazione allergica grave (shock anafilattico).
In questi casi, informi immediatamente il suo medico.
Subito dopo l'inalazione, alcuni pazienti potrebbero manifestare inaspettatamente una sensazione di pressione al torace, tosse, stridore o difficoltà respiratoria (broncospasmo).
Se osserva effetti collaterali, si rivolga al suo medico o farmacista, soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Termine di consumo dopo l'apertura
Utilizzare entro 3 mesi dall'inserimento della cartuccia.
Indicazione di stoccaggio
Non conservare a temperatura superiore a 25 °C.
Non congelare.
Conservare fuori dalla portata dei bambini.
Cosa contiene Spiriva Respimat?
1 nebulizzazione contiene 2,5 microgrammi di tiotropio (equivalenti a 3,124 microgrammi di tiotropio bromuro monoidrato).
Principi attivi
Tiotropio
Sostanze ausiliarie
Benzalconio cloruro (0,0011 mg in ogni nebulizzazione), sodio edetato, acido cloridrico per l'aggiustamento del pH, acqua purificata
Numero dell’omologazione
67396 (Swissmedic)
Dove è ottenibile Spiriva Respimat? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Confezione singola: 1 inalatore Respimat riutilizzabile e 1 cartuccia con 60 nebulizzazioni (30 dosi terapeutiche)
Confezione tripla: 1 inalatore Respimat e 3 cartucce con 60 nebulizzazioni (90 dosi terapeutiche)
Titolare dell’omologazione
Boehringer Ingelheim (Schweiz) GmbH, Basilea
Questo foglietto illustrativo è stato controllato l'ultima volta nel marzo 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
Istruzioni per l’uso
Inalatore Spiriva® Respimat® riutilizzabile (tiotropio)
Introduzione
Legga le istruzioni per l’uso prima di utilizzare l’inalatore Spiriva Respimat.
È necessario che utilizzi l’inalatore UNA SOLA VOLTA AL GIORNO (2 nebulizzazioni per volta).

- Se l’inalatore non viene utilizzato da più di 7 giorni, erogare innanzitutto una nebulizzazione verso terra.
- Se l’inalatore non viene utilizzato da più di 21 giorni, ripetere le fasi da 4 a 6 descritte nella sezione «Preparazione per il primo utilizzo», finché non è visibile una nebulizzazione. Ripetere quindi ancora tre volte le fasi da 4 a 6.
Come si pulisce l’inalatore Spiriva Respimat?
Pulire il boccaglio e la parte in metallo al suo interno almeno una volta alla settimana utilizzando esclusivamente un panno o un panno carta umido.
Un lieve cambiamento di colore del boccaglio non influisce sulla funzionalità dell’inalatore Spiriva Respimat.
Se necessario, è possibile frizionare la parte esterna dell’inalatore Spiriva Respimat con un panno umido.
Sostituzione dell’inalatore
Dopo aver utilizzato un inalatore per 3 cartucce, occorre procurarsi una nuova confezione di Spiriva Respimat.

Preparazione per il primo utilizzo
1. Rimozione della base trasparente
|
|
2. Inserimento della cartuccia
|
|
3. Tracciamento delle cartucce utilizzate
|
|
4. Rotazione
|
|
5. Apertura
|
|
6. Erogazione
L’inalatore è ora pronto per l’uso e può erogare 60 nebulizzazioni (30 dosi). |
|
Utilizzo quotidiano
ROTAZIONE
|
|
APERTURA
|
|
EROGAZIONE
|
|
Quando è necessario sostituire la cartuccia SPIRIVA RESPIMAT?
L’indicatore della dose mostra quante nebulizzazioni sono ancora presenti nella cartuccia.
| Sono presenti ancora 60 nebulizzazioni |
| Sono presenti meno di 10 nebulizzazioni. Procurarsi una nuova cartuccia. |
| La cartuccia è vuota. Ruotare la base trasparente per staccarla. L’inalatore è ora in posizione bloccata. Estrarre la cartuccia dall’inalatore. Inserire una cartuccia nuova (procedere con la fase 2). |
Risposte a domande frequenti
L’inserimento in profondità della cartuccia incontra resistenza.
È stata inavvertitamente ruotata la base trasparente prima di inserire la cartuccia? Aprire il cappuccio, premere il bottone di erogazione, poi inserire la cartuccia.
Si sta sostituendo la cartuccia? La nuova cartuccia sporgerà più della prima. Spingere la cartuccia finché non scatta in posizione, quindi reinserire la base trasparente.
Non si riesce a premere il bottone di erogazione.
È stata ruotata la base trasparente? Se non è così, ruotare la base trasparente con un movimento continuo finché non scatta in posizione (mezzo giro).
L’indicatore della dose sulla cartuccia mostra una freccia bianca su sfondo rosso? La cartuccia è vuota. Sostituirla con una cartuccia nuova.
La cartuccia vuota non si estrae.
Tirare e contemporaneamente ruotare la cartuccia.
La base trasparente non ruota e non si stacca.
È già stata ruotata la base trasparente?
Se la base trasparente è già stata ruotata, eseguire le fasi «APERTURA» e «EROGAZIONE» descritte nella sezione «Utilizzo quotidiano» per somministrare il medicamento.
La base trasparente è allentata e l’indicatore della dose sulla cartuccia mostra una freccia bianca su sfondo rosso? La cartuccia è vuota. Sostituirla con una cartuccia nuova.
L’inalatore SPIRIVA RESPIMAT si svuota troppo rapidamente.
L’inalatore Spiriva Respimat è stato utilizzato come indicato (due nebulizzazioni/una volta al giorno)? L’inalatore Spiriva Respimat ha una durata di 30 giorni se si somministrano due nebulizzazioni una volta al giorno.
Si è spruzzato spesso a vuoto per verificare se l’inalatore Spiriva Respimat funziona? Dopo aver preparato l’inalatore Spiriva Respimat per il primo utilizzo, non è più necessario effettuare prove di nebulizzazione nell’uso quotidiano.
L’inalatore Spiriva Respimat non esegue l’erogazione.
È stata inserita una cartuccia? In caso negativo, inserire una cartuccia. Dopo aver inserito la cartuccia, non rimuovere più la base trasparente e la cartuccia finché la cartuccia non è vuota.
Dopo l’inserimento della cartuccia, le fasi ROTAZIONE, APERTURA ed EROGAZIONE sono state ripetute meno di tre volte? Ripetere tre volte le fasi ROTAZIONE, APERTURA ed EROGAZIONE dopo l’inserimento della cartuccia, come descritto nei punti da 4 a 6 nella sezione «Preparazione per il primo utilizzo».
L’indicatore della dose sulla cartuccia mostra una freccia bianca su sfondo rosso? La cartuccia è vuota. Sostituirla con una cartuccia nuova.
L’inalatore Spiriva Respimat esegue l’erogazione in automatico.
Il cappuccio era aperto quando è stata ruotata la base trasparente? Chiudere il cappuccio prima di ruotare la base trasparente.
È stato premuto il bottone di erogazione durante la rotazione della base trasparente? Chiudere il cappuccio in modo che il bottone di erogazione sia coperto, poi ruotare la base trasparente.
La base trasparente non è stata ruotata fino alla posizione di scatto? Ruotare la base trasparente con un movimento continuo finché non scatta in posizione (mezzo giro).
Il cappuccio era aperto quando è stata sostituita la cartuccia? Chiudere innanzitutto il cappuccio prima di sostituire la cartuccia.
Boehringer Ingelheim (Schweiz) GmbH, Basilea

Zusammensetzung
Wirkstoffe
Tiotropium.
Hilfsstoffe
Benzalkoniumchlorid (0.0011 mg bei jedem Hub), Natriumedetat, Salzsäure zur pH-Wert-Einstellung, Wasser gereinigtes.
Darreichungsform und Wirkstoffmenge pro Einheit
Die abgegebene Dosis beträgt 2,5 Mikrogramm Tiotropium pro Hub, entsprechend 3,124 Mikrogramm Tiotropiumbromid-Monohydrat.
Die abgegebene Dosis ist die Menge, die für den Patienten nach Passieren des Mundstücks verfügbar ist.
Klare, farblose Inhalationslösung.
Indikationen/Anwendungsmöglichkeiten
Spiriva Respimat ist indiziert als dauerhaft einzusetzender Bronchodilatator bei chronischer obstruktiver Lungenerkrankung (COPD).
Dosierung/Anwendung
Das Arzneimittel ist nur zur Inhalation bestimmt. Die Patrone kann nur in den Spiriva Respimat Inhalator eingeführt und mit diesem verwendet werden (siehe unten: Art der Anwendung).
Übliche Dosierung
Die empfohlene Tagesdosis für Erwachsene beträgt 5 mcg Tiotropium entsprechend der Inhalation von 2 Hüben aus dem Respimat Inhalator, einmal täglich zur gleichen Tageszeit.
Die empfohlene Dosis soll nicht überschritten werden.
Patienten mit Leberfunktionsstörungen
Die Sicherheit und Wirksamkeit wurde bei Patienten mit einer Leberfunktionsstörung nicht untersucht. Tiotropium sollte deshalb bei Patienten mit schwerer Leberfunktionsstörung nicht angewendet werden.
Patienten mit Nierenfunktionsstörungen
Patienten mit eingeschränkter Nierenfunktion können Tiotropiumbromid in der empfohlenen Dosis anwenden.
Für Patienten mit mittlerer bis schwerer Nierenfunktionsstörung (Creatinin-Clearance ≤50 ml/min) siehe «Warnhinweise und Vorsichtsmassnahmen» und «Pharmakokinetik».
Ältere Patienten
Ältere Patienten können Tiotropiumbromid in der empfohlenen Dosis anwenden.
Kinder und Jugendliche
Spiriva Respimat wurde bei Kindern und Jugendlichen unter 18 Jahren nicht untersucht.
Art der Anwendung
Um die richtige Anwendung des Arzneimittels zu gewährleisten, sollte dem Patienten der Gebrauch des Inhalators durch einen Arzt oder medizinisch-pharmazeutisches Fachpersonal gezeigt werden. In der Patienteninformation wird die genaue Gebrauchsanweisung für den Spiriva Respimat Inhalator abgebildet.
Kontraindikationen
Spiriva Respimat ist kontraindiziert bei Patienten mit Überempfindlichkeit gegenüber Tiotropiumbromid, Atropin oder einem seiner Derivate, wie z.B. Ipratropium oder Oxitropium, oder gegenüber einem der sonstigen Bestandteile (siehe Zusammensetzung: Hilfsstoffe).
Warnhinweise und Vorsichtsmassnahmen
Spiriva Respimat enthält Benzalkoniumchlorid, dieser Bestandteil kann keuchende Atmung und Atemschwierigkeiten (Bronchospasmen - krampfartige Verengungen der Atemwege) hervorrufen, insbesondere, wenn Sie an Asthma leiden. |
Als Bronchodilatator zur Dauerbehandlung mit einmal täglicher Anwendung sollte Tiotropiumbromid weder zur Erstbehandlung akuter Bronchospasmen noch zur Linderung akuter Symptome eingesetzt werden. Bei einem akuten Anfall sollte ein schnell wirkender Beta2-Agonist verwendet werden.
Nach der Anwendung von Tiotropiumbromid Inhalationslösung sind Immunreaktionen vom Soforttyp möglich.
Aufgrund seiner anticholinergen Aktivität sollte Tiotropiumbromid bei Patienten mit Engwinkelglaukom, Prostatahyperplasie oder Harnblasenhalsverengung nur mit Vorsicht angewendet werden.
Inhalative Arzneimittel können zu inhalationsbedingten Bronchospasmen führen.
In folgenden Situationen liegt für Tiotropium nur begrenzte klinische Erfahrung vor: Engwinkelglaukom, symptomatische Prostatahyperplasie, Harnblasenhalsverengung, Nierenfunktionsstörung mit Kreatininwerten >176 µmol/L und/oder einer Clearance ≤50 ml/Min., Hepatopathie mit ASAT oder ALAT >80 IU/L, kürzlicher Myokardinfarkt, behandlungsbedürftige Herzrhythmusstörung und Herzinsuffizienz, die stationärer Behandlung bedurfte.
Solche Patienten waren von den klinischen Prüfungen ausgeschlossen, und die genannten Erkrankungen können von der anticholinergen Wirkungsweise betroffen sein.
Da die Plasmakonzentration mit nachlassender Nierenfunktion bei Patienten mit mittlerer bis schwerer Nierenfunktionsstörung (Creatinin-Clearance ≤50 ml/min) ansteigt, sollte Tiotropiumbromid nur dann angewendet werden, wenn der zu erwartende Nutzen ein potenzielles Risiko überwiegt. Langzeiterfahrungen bei Patienten mit schwerer Nierenfunktionsstörung liegen nicht vor (siehe «Pharmakokinetik»).
Patienten sollten angewiesen werden, darauf zu achten, dass die Inhalationslösung nicht in die Augen gelangt. Sie sind darüber zu informieren, dass dies zum Auftreten oder zur Verschlimmerung eines Engwinkelglaukoms, Augenschmerzen oder Missempfinden, vorübergehend verschwommenem Sehen, Augenhalos oder unwirklichem Farbempfinden in Verbindung mit geröteten Augen durch Blutstauungen in der Bindehaut und Hornhautödem führen kann. Wenn zwei oder mehrere dieser Symptome gleichzeitig auftreten, sollte die Anwendung von Tiotropiumbromid abgebrochen und unverzüglich ein Augenarzt aufgesucht werden.
Mundtrockenheit, wie sie unter Therapie mit Anticholinergika beobachtet wurde, könnte bei längerer Dauer zum Auftreten von Karies führen.
Tiotropiumbromid sollte nicht häufiger als einmal täglich angewendet werden (siehe «Überdosierung»).
Bei zystischer Fibrose (Mukoviszidose) wird die Anwendung von Spiriva Respimat nicht empfohlen. Wenn Spiriva Respimat bei Patienten mit zystischer Fibrose angewendet wird, kann dies die Symptome der zystischen Fibrose verstärken (z.B. schwerwiegende unerwünschte Ereignisse, pulmonale Exazerbationen, Atemwegsinfekte).
Interaktionen
Obwohl keine gezielten Untersuchungen zu Wechselwirkungen mit Arzneimitteln durchgeführt wurden, wurde Tiotropiumbromid zusammen mit anderen Arzneimitteln ohne Anzeichen von Arzneimittel-Wechselwirkungen angewendet. Bei diesen Arzneimitteln handelt es sich u.a. um sympathomimetische Bronchodilatatoren, Methylxanthine, orale und inhalative Steroide die üblicherweise bei der Behandlung von COPD angewendet werden.
In einer Studie zur Untersuchung der systemischen Verfügbarkeit wurde bei COPD-Patienten im «steady state» unter einer Mono-Behandlung mit Tiotriopum18 mcg beziehungsweise Salmeterol DPI 2x50 mcg eine praktisch gleiche Exposition für die involvierten Wirkstoffe gefunden, wie bei einer Behandlung mit der freien Kombination.
Pharmakokinetische Interaktionen
Die gleichzeitige Anwendung von Tiotropiumbromid und anderen Anticholinergika wurde nicht untersucht und wird daher nicht empfohlen.
Pharmakodynamische Interaktionen
Es wird angenommen, dass Tiotropium aktiv durch bisher nicht identifizierte Kationen-Transporter ausgeschieden wird. Interaktionen mit Kationen-Transportern werden allgemein vor allem bei Cimetidin, Trimethoprim und Protease-Inhibitoren beschrieben. Für Tiotropium liegt eine Interaktionsstudie mit Cimetidin (therapeutische steady state Konzentrationen) vor. Darunter nahm die Tiotropium-Clearance (einmalige i.v. Verabreichung in quasi supratherapeutischer Dosis) um rund 20% ab und die Exposition (AUC0-4h) um rund 20% zu. Unter Ranitidin wurde dagegen keine Interaktion beobachtet.
Schwangerschaft/Stillzeit
Schwangerschaft
Bisher liegen nur sehr begrenzte Erfahrungen in der Anwendung von Tiotropium bei Schwangeren vor. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität in klinisch relevanten Dosen (siehe «Präklinische Daten»). Vorsichtshalber soll eine Anwendung von Spiriva Respimat während der Schwangerschaft vermieden werden.
Stillzeit
Es ist nicht bekannt, ob Tiotropiumbromid beim Menschen in die Muttermilch ausgeschieden wird. Studien mit Nagetieren haben gezeigt, dass Tiotropiumbromid nur in geringer Menge in die Muttermilch ausgeschieden wird. Spiriva Respimat sollte während der Stillzeit nicht angewendet werden. Tiotropiumbromid ist eine langwirksame Substanz. Die Entscheidung, ob das Stillen oder die Behandlung mit Spiriva Respimat beendet oder beides fortgeführt werden soll, sollte unter Berücksichtigung der Vorteile des Stillens für das Kind und der Behandlung mit Spiriva Respimat für die Stillende getroffen werden.
Fertilität
Klinische Daten zur Fertilität liegen für Tiotropium nicht vor. Eine nicht-klinische Studie mit Tiotropium zeigte keinen Hinweis auf negative Auswirkungen auf die Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Untersuchungen über die Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Beim Auftreten von Schwindel oder verschwommenem Sehen kann die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigt sein.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Viele der aufgeführten Nebenwirkungen können auf die anticholinergen Eigenschaften von Tiotropiumbromid zurückgeführt werden.
Tabellarische Zusammenfassung der Nebenwirkungen
Die Häufigkeiten der unten aufgelisteten Nebenwirkungen basieren auf dem Vorkommen dieser unerwünschten Arzneimittelwirkungen (Ereignisse, die Tiotropium zugeordnet werden), die in den gepoolten Tiotropiumgruppen von 7 Placebo-kontrollierten klinischen Studien bei COPD (3'282 Patienten) mit einer Behandlungsdauer von 4 Wochen bis zu einem Jahr, beobachtet wurden.
Bei den Häufigkeitsangaben zu den in den Studien beobachteten Ereignissen, die Tiotropium zugeordnet wurden, werden folgende Kategorien zugrunde gelegt:
Sehr häufig (≥1/10); Häufig (≥1/100 bis <1/10); Gelegentlich (≥1/1'000 bis <1/100); Selten (≥1/10'000 bis <1/1'000); Sehr selten (<1/10'000); Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Unerwünschte Wirkungen nach Markteinführung
Systemorganklasse / | Häufigkeit bei COPD |
|---|---|
Stoffwechsel- und Ernährungsstörungen | |
Dehydrierung | nicht bekannt |
Störungen des Nervensystems | |
Schwindel | gelegentlich |
Kopfschmerzen | gelegentlich |
Insomnie | selten |
Augenerkrankungen | |
Glaukom | selten |
Erhöhter Augeninnendruck | selten |
Verschwommenes Sehen | selten |
Herzerkrankungen | |
Vorhofflimmern | selten |
Palpitationen | selten |
Supraventrikuläre Tachykardien | selten |
Tachykardie | selten |
Respiratorische, thorakale und mediastinale Funktionsstörungen | |
Husten | gelegentlich |
Pharyngitis | gelegentlich |
Dysphonie | gelegentlich |
Epistaxis | selten |
Bronchospasmus | selten |
Laryngitis | selten |
Sinusitis | nicht bekannt |
Gastro-intestinale Störungen | |
Mundtrockenheit | häufig |
Obstipation | gelegentlich |
Oropharyngeale Candidose | gelegentlich |
Dysphagie | selten |
Gastro-ösophagialer Reflux | selten |
Karies | selten |
Gingivitis | selten |
Glossitis | selten |
Stomatitis | nicht bekannt |
Intestinale Obstruktion, einschliesslich paralytischem Ileus | nicht bekannt |
Übelkeit | nicht bekannt |
Störungen der Haut und des Unterhautgewebes, Störungen des Immunsystems | |
Hautausschlag (Rash) | gelegentlich |
Pruritus | gelegentlich |
Angioneurotisches Ödem | selten |
Urtikaria | selten |
Hautinfektionen, Hautulkus | selten |
Trockene Haut | selten |
Überempfindlichkeitsreaktionen (einschliesslich Reaktionen vom Soforttyp) | nicht bekannt |
Anaphylaktische Reaktion | nicht bekannt |
Muskelskelettsystem | |
Gelenkschwellung | nicht bekannt |
Störungen der Nieren und der ableitenden Harnwege | |
Harnverhalt | gelegentlich |
Dysurie | gelegentlich |
Harnwegsinfekte | selten |
Angaben zu ausgewählten Nebenwirkungen
In kontrollierten klinischen Prüfungen mit COPD-Patienten wurden unter den Nebenwirkungen am häufigsten anticholinerge Effekte beobachtet, wie z.B. Mundtrockenheit (bei ca. 2,9% der Patienten).
In 7 klinischen Prüfungen mit COPD-Patienten brachen 3 von 3'282 mit Tiotropium behandelten Patienten (0,1%) die Studie wegen Mundtrockenheit ab.
Zu schwerwiegenden Nebenwirkungen aufgrund des anticholinergen Effektes gehören Glaukom, Verstopfung und Darmobstruktion einschliesslich paralytischem Ileus, sowie Harnverhalt.
Besondere Patientengruppen
Mit fortgeschrittenem Alter ist eine Zunahme der anticholinergen Effekte möglich.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
In hohen Dosen kann Tiotropiumbromid zu anticholinergen Symptomen führen.
Bei gesunden Probanden traten jedoch keine systemischen anticholinergen Nebenwirkungen nach der Inhalation einer Einzeldosis von bis zu 340 Mikrogramm Tiotropiumbromid auf. Bei einer Dosierung von bis zu 40 Mikrogramm Tiotropium Inhalationslösung über 14 Tage wurden bei den gesunden Probanden ausser Mund- und Rachentrockenheit sowie trockener Nasenschleimhaut (deutliche Reduzierung des Speichelflusses ab dem 7. Tag) keine relevanten Nebenwirkungen beobachtet.
Eigenschaften/Wirkungen
ATC-Code
R03BB04
Wirkungsmechanismus
Tiotropium ist ein langwirksamer, spezifischer Muskarinrezeptor-Antagonist. Es weist eine ähnliche Affinität zu den Muskarinrezeptor-Subtypen M1 bis M5 auf. In den Atemwegen bindet Tiotropiumbromid kompetitiv und antagonistisch reversibel an den M3-Rezeptoren der glatten Bronchialmuskulatur; antagonisiert dort die cholinerge (bronchokonstriktive) Wirkung von Acetylcholin, was zu einer Relaxation der glatten Bronchialmuskulatur führt. Die Wirkung war dosisabhängig und hielt länger als 24 Stunden an. Bei der Bronchodilatation nach Inhalation von Tiotropium handelt es sich primär um eine direkte Wirkung am Wirkungsort und nicht um eine systemische Wirkung.
Pharmakodynamik
Tiotropium dissoziiert insbesondere von M3-Rezeptoren langsam und weist eine signifikant längere Dissoziationshalbwertszeit als Ipratropium auf. Die Dissoziation von M2-Rezeptoren ist schneller als die von M3-Rezeptoren, was sich in in-vitro-Studien funktionell als kinetisch kontrollierte Rezeptorsubtypenselektivität von M3 gegenüber M2 zeigte.
Klinische Wirksamkeit
Das klinische Phase-III-Entwicklungsprogramm umfasste zwei 1-jährige, zwei 12-wöchige und zwei 4-wöchige randomisierte, doppelblinde Studien an 2'901 COPD-Patienten (von denen 1'038 eine Dosis von 5 Mikrogramm Tiotropium erhielten). Die 1-Jahres-Programme bestanden aus zwei Placebo-kontrollierten Prüfungen. Die beiden 12-Wochen-Studien waren sowohl aktiv (Ipratropium-) als auch Placebo-kontrolliert. In allen sechs Studien wurde die Lungenfunktion untersucht. Zusätzlich wurden in den beiden 1-jährigen Studien die Entwicklung von Dyspnoe, gesundheitsbezogener Lebensqualität und der Einfluss auf Exazerbationen untersucht.
Langzeitdaten
Dyspnoe
Spiriva Respimat verbesserte signifikant die Dyspnoe (ausgewertet mittels Transition Dyspnoea Index) im Vergleich zu Placebo (durchschnittliche Verbesserung 1,05 Einheiten; 95% KI: 0,73‑1,38 Einheiten, p <0,0001). Die Verbesserung blieb während des gesamten Behandlungszeitraumes bestehen.
COPD-Exazerbationen
In drei randomisierten, doppelblinden, Placebo-kontrollierten 1‑Jahres-Studien führte die Behandlung mit Spiriva Respimat zu einem signifikant reduzierten Risiko einer COPD-Exazerbation im Vergleich zu Placebo. COPD-Exazerbationen wurden definiert als «ein Komplex bestehend aus mindestens zwei respiratorischen Ereignissen/Symptomen über eine Dauer von drei Tagen oder mehr, mit der Notwendigkeit einer Änderung der Behandlung (Verschreibung von Antibiotika und/oder systemischen Kortikosteroiden und/oder eine bedeutende Änderung der verschriebenen Atemwegsmedikamente)».
Die Behandlung mit Spiriva Respimat führte zu einem reduzierten Risiko einer Hospitalisierung aufgrund einer COPD-Exazerbation (signifikant in einer entsprechend gepowerten grossen Exazerbationsstudie).
Die gepoolte Analyse von zwei Phase‑III-Studien und die separate Analyse einer zusätzlichen Exazerbationsstudie werden in Tabelle 1 gezeigt. Alle Atemwegsmedikamente ausser Anticholinergika und langwirksamen Beta‑Agonisten waren als Begleitmedikation erlaubt, d.h. schnell wirksame Beta‑Agonisten, inhalative Kortikosteroide und Xanthine. Langwirksame Beta‑Agonisten waren in der Exazerbationsstudie zusätzlich erlaubt.
Tabelle 1: Statistische Analyse der COPD-Exazerbationen und der Hospitalisierungen aufgrund von COPD-Exazerbationen bei Patienten mit mittelgradiger bis sehr schwerer COPD
Studie | Endpunkt | Spiriva Respimat | Placebo | % Risikoreduktion (95% KI)a | p-Wert |
|---|---|---|---|---|---|
1-jährige Phase-III-Studien, gepoolte Analysed | Tage bis zur ersten COPD-Exazerbation | 160a | 86a | 29 | <0,0001b |
Mittlere Inzidenzrate der Exazerbationen pro Patientenjahr | 0,78c | 1,00c | 22 | 0,002c | |
Zeit bis zur ersten Hospitalisierung aufgrund einer COPD-Exazerbation | 25 | 0,20b | |||
Mittlere Inzidenzrate der Hospitalisierungen aufgrund von Exazerbationen pro Patientenjahr | 0,09c | 0,11c | 20 | 0,096c | |
1-jährige Phase-IIIb-Exazerbationsstudie | Tage bis zur ersten COPD-Exazerbation | 169a | 119a | 31 | <0,0001b |
Mittlere Inzidenzrate der Exazerbationen pro Patientenjahr | 0,69c | 0,87c | 21 | <0,0001c | |
Zeit bis zur ersten Hospitalisierung aufgrund einer COPD-Exazerbation | 27 | 0,003b | |||
Mittlere Inzidenzrate der Hospitalisierungen aufgrund von Exazerbationen pro Patientenjahr | 0,12c | 0,15c | 19 | 0,004c |
a Zeit bis zum ersten Ereignis: Behandlungstage, nach denen bei 25% der Patienten mindestens eine COPD-Exazerbation/Hospitalisierung aufgrund einer Exazerbation auftrat.
In Studie A trat bei 25% der Placebo-Patienten eine Exazerbation bis zum Tag 112 auf, während unter Spiriva Respimat bei 25% der Patienten eine Exazerbation bis zum Tag 173 auftrat (p = 0,09).
In der Studie B trat bei 25% der Placebo-Patienten eine Exazerbation bis zum Tag 74 auf, während unter Spiriva Respimat bei 25% der Patienten eine Exazerbation bis zum Tag 149 auftrat (p <0,0001).
b Hazard Ratios wurden anhand eines Cox Proportional Hazard Modell geschätzt. Der Prozentsatz der Risikoreduktion beträgt 100 x (1 - Hazard Ratio).
c Poisson Regression. Risikoreduktion beträgt 100 x (1 ‑ Rate Ratio).
d Das Poolen wurde beim Studiendesign spezifiziert. Die Exazerbationsendpunkte wurden in Einzelanalysen der beiden 1-Jahres-Studien signifikant verbessert.
Aktiv-kontrollierte Tiotropium-Langzeitstudie
Zum Vergleich der Wirksamkeit und Sicherheit von Spiriva Respimat und Spiriva HandiHaler wurde eine grosse randomisierte, doppelblinde, aktiv-kontrollierte Langzeitstudie mit einer Beobachtungsdauer bis zu 3 Jahren durchgeführt. 5'711 Patienten erhielten Spiriva Respimat, 5'694 Patienten erhielten Spiriva HandiHaler. Die primären Endpunkte waren: Zeit bis zur ersten COPD-Exazerbation, Zeit bis zum Tod (beliebiger Ursache), sowie in einer Substudie mit 906 Patienten die FEV1‑Tiefstwerte vor der nächsten Anwendung.
Die Zeit bis zur ersten COPD-Exazerbation war unter Spiriva Respimat und unter Spiriva HandiHaler numerisch vergleichbar (Hazard Ratio Spiriva Respimat/Spiriva HandiHaler: 0,98; 95% KI: 0,93‑1,03). Die mediane Anzahl der Tage bis zur ersten COPD-Exazerbation betrug bei Spiriva Respimat 756 Tage und bei Spiriva HandiHaler 719 Tage.
Die bronchodilatatorische Wirkung von Spiriva Respimat hielt über 120 Wochen an, vergleichbar zum Spiriva HandiHaler. Der mittlere Unterschied im FEV1‑Tiefstwert von Spiriva Respimat versus Spiriva HandiHaler betrug ‑0,010 l (95% KI: ‑0,038 bis +0,018 l).
In der Post-Marketing-Studie TIOSPIR zum Vergleich von Spiriva Respimat und Spiriva HandiHaler war die Gesamtmortalität, einschliesslich Nachverfolgung des Vitalstatus, vergleichbar (Hazard Ratio Spiriva Respimat/Spiriva HandiHaler: 0,96; 95% KI: 0,84‑1,09), bei einer Behandlungsdauer von 13'135 bzw. 13'050 Patientenjahren.
In den Placebo-kontrollierten Studien mit Nachverfolgung des Vitalstatus bis zum Ende der vorgesehenen Behandlungsperiode ergab sich unter der Therapie mit Spiriva Respimat eine numerische Zunahme der Gesamtmortalität im Vergleich zu Placebo (Rate Ratio: 1,33; 95% KI: 0,93‑1,92), bei einer Behandlungsdauer mit Spiriva Respimat von 2'574 Patientenjahren. Die erhöhte Mortalität wurde bei Patienten mit bekannter Herzrhythmusstörung beobachtet. Unter der Therapie mit Spiriva HandiHaler ergab sich eine Reduktion des Mortalitätsrisikos um 13% (Hazard Ratio Tiotropium/Placebo, einschliesslich Nachverfolgung des Vitalstatus: 0,87; 95% KI: 0,76‑0,99), bei einer Behandlungsdauer mit Spiriva HandiHaler von 10'927 Patientenjahren. Weder in der Placebo-kontrollierten Studie mit Spiriva HandiHaler noch in der TIOSPIR-Studie zum Vergleich von Spiriva Respimat und Spiriva HandiHaler wurde in der Subgruppe der Patienten mit bekannter Herzrhythmusstörung ein erhöhtes Mortalitätsrisiko beobachtet.
Kinder und Jugendliche
Spririva Respimat wurde bei Jugendliche unter 18 Jahren nicht untersucht.
Weitere Informationen
Placebo-kontrollierte Studien.
Lungenfunktion
Die einmal tägliche Anwendung von Tiotropium Inhalationslösung führte innerhalb von 30 Minuten nach der ersten Dosis zu einer signifikanten Verbesserung der Lungenfunktion (forcierte exspiratorische Einsekundenkapazität (FEV1) und forcierte Vitalkapazität (FVC) im Vergleich zu Placebo (durchschnittliche FEV1‑Verbesserung nach 30 Minuten: 0,113 l; 95% Konfidenzintervall (KI): 0,102‑0,125 l; p <0,0001). Diese hielt im Steady State für die Dauer von 24 Stunden an: durchschnittliche FEV1‑Verbesserung im Vergleich zu Placebo 0,122 l; 95% KI: 0,106‑0,138 l; p <0,0001.
Der pharmakodynamische Steady State wurde innerhalb von einer Woche erreicht.
Spiriva Respimat verbesserte signifikant den morgendlichen und abendlichen PEFR (Peak Flow Wert) gemäss den täglichen Aufzeichnungen der Patienten im Vergleich zu Placebo (durchschnittliche PEFR-Verbesserung: durchschnittliche Verbesserung am Morgen 22 L/min; 95% KI: 18 bis 55 L/min, p <0,0001; abends 26 L/min; 95% KI: 23 bis 30 L/min, p <0,0001). Die Anwendung von Spiriva Respimat führte im Vergleich zu Placebo zu einer Reduktion an bronchodilatatorischer Notfallmedikation (durchschnittliche Verbesserung in der Anwendung nach Bedarf um 0,66 Anwendungen pro Tag, 95% KI: 0,51 bis 0,81 Anwendungen pro Tag, p <0,0001).
Die bronchodilatatorische Wirkung von Spiriva Respimat blieb ohne Anzeichen einer Toleranzentwicklung über ein Jahr Anwendungsdauer bestehen.
Pharmakokinetik
Absorption
Tiotropiumbromid ist eine nicht chirale quartäre Ammonium-Verbindung und in Wasser nur schwer löslich. Tiotropiumbromid wird als Inhalationslösung mittels Respimat Inhalator angewendet. Annähernd 40% der inhalierten Dosis wird in der Lunge, dem Zielorgan, deponiert. Die verbleibende Dosis gelangt in den Gastrointestinaltrakt. Ein Teil der unten beschriebenen pharmakokinetischen Ergebnisse wurde mit Dosen erzielt, die über der empfohlenen therapeutischen Dosis liegen.
Nach Inhalation durch junge gesunde Probanden zeigten Daten zur Urinausscheidung, dass annähernd 33% der mit dem Respimat inhalierten Dosis den systemischen Blutkreislauf erreichen. Orale Tiotropiumbromid-Lösungen weisen eine absolute Bioverfügbarkeit von 2-3% auf. Ein Einfluss von Nahrungsmitteln auf die Resorption dieser quartären Ammonium-Verbindung ist nicht zu erwarten. Die maximale Tiotropium-Plasmakonzentration wurde 5-7 Minuten nach Inhalation beobachtet. Vergleichende Daten zur sytemischen Tiotropium-Exposition nach Inhalation mit dem Respimat oder dem HandiHaler ergaben widersprüchliche Resultate und sind daher nur bedingt konklusiv: Im Steady State wurde bei COPD-Patienten unter Behandlung mit 2 Hüben Respimat (5 mcg) ein Spitzen-Plasmaspiegel von Tiotropium von 10,5 pg/ml erreicht. Dieser Wert fiel einem Multikompartimentmodell folgend schnell ab. Die tiefste Plasmakonzentration im Steady State betrug 1,60 pg/ml. Nach der Inhalation mit dem HandiHaler (18 mcg) betrug die Plasma-Spitzenkonzentration von Tiotropium im Steady State 12.9 pg/ml, und die niedrigste Plasmakonzentration lag bei 1.71 pg/ml.
Diese Tiotropium-Expositionswerte, die in einer aktuelleren Bioäquivalenzstudie bei COPD-Patienten gemessen wurden, deuten auf eine geringere Exposition nach der Inhalation mit dem Respimat-Inhalator hin, als bei einer Inhalation mit dem HandiHaler, während frühere Studien auf eine höhere Exposition hindeuten (Studie 205.249: Ohne Korrektur für Nachweisgrenze 35% höhere Exposition für Respimat betreffend die maximal gemessene Konzentration im Steady State (C0.167,ss) und 31% höhere Urinausscheidung (Ae0-12,ss); Studie 205.250: 18% höhere C0.167,ss und 17% höhere Ae0-12,ss).
Distribution
Die Plasmaproteinbindung des Wirkstoffes beträgt 72%, das Verteilungsvolumen 32 l/kg. Örtliche Konzentrationen in der Lunge sind nicht bekannt, jedoch lässt die Anwendungsart wesentlich höhere Werte in der Lunge erwarten. Untersuchungen an Ratten zeigten, dass Tiotropium die Blut-Hirn-Schranke nicht in einem bedeutenden Masse passiert.
Metabolismus
Das Ausmass der Metabolisierung ist gering. Dies zeigt sich in der Tatsache, dass 74% einer intravenösen Dosis bei jungen gesunden Probanden unverändert renal ausgeschieden wird. Der Ester Tiotropiumbromid wird nicht-enzymatisch zu Alkohol (N-Methylscopin) und Säureverbindung (Dithienylglycolsäure) gespalten, die beide an den Muskarinrezeptoren inaktiv sind.
In vitro-Untersuchungen an humanen Lebermikrosomen und humanen Hepatozyten weisen darauf hin, dass ein weiterer Teil des Arzneimittels (<20% der Dosis nach intravenöser Anwendung) durch Cytochrom-P450 (CYP)-abhängige Oxidation und anschliessende Glutathion-Konjugation zu einer Reihe von Phase II-Metaboliten metabolisiert wird.
In vitro-Untersuchungen an Lebermikrosomen zeigen, dass sich der enzymatische Abbauweg durch die CYP-2D6 (und 3A4)-Inhibitoren Chinidin, Ketoconazol und Gestoden hemmen lässt. Somit sind CYP 2D6 und 3A4 an einem Metabolisierungsweg beteiligt, der für die Eliminierung eines geringeren Teils der Dosis verantwortlich ist. Tiotropiumbromid hemmt auch in übertherapeutischen Dosen CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 oder 3A in humanen Lebermikrosomen nicht.
Elimination
Die effektive Halbwertszeit von Tiotropium liegt bei gesunden Probanden und COPD-Patienten zwischen 27 und 45 Stunden nach Inhalation. Die Gesamt-Clearance betrug nach intravenöser Anwendung bei jungen gesunden Probanden 880 ml/min. Nach intravenöser Anwendung wird Tiotropium hauptsächlich unverändert mit dem Urin ausgeschieden (74%). Nach Inhalation der Lösung bis zum Steady State liegt die Urinausscheidung bei COPD-Patienten bei 18,6% der Dosis (0,93 μg), der Rest besteht hauptsächlich aus nicht resorbiertem Arzneimittel im Darm und wird fäkal ausgeschieden. Nach Inhalation der Lösung durch gesunde Probanden liegt die Urinausscheidung bei 20,1‑29,4% der Dosis, der Rest besteht hauptsächlich aus nicht resorbiertem Arzneimittel im Darm und wird fäkal ausgeschieden. Die Nierenclearance von Tiotropium liegt über der Creatinin-Clearance, was auf eine Ausscheidung in den Urin hinweist.
Nach chronischer einmal täglicher Anwendung bei COPD-Patienten wurde der pharmakokinetische Steady State spätestens nach 7 Tagen erreicht, ohne dass es danach zur Akkumulation kam.
Linearität/Nicht Linearität
Unabhängig von der Darreichungsform zeigt Tiotropium im therapeutischen Bereich eine lineare Pharmakokinetik.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Ein relevanter Einfluss auf die Pharmakokinetik von Tiotropium im Fall einer Leberfunktionsstörung ist nicht zu erwarten. Tiotropium wird hauptsächlich renal ausgeschieden (74% bei jungen gesunden Probanden) und durch eine einfache nicht-enzymatische Esterspaltung zu pharmakologisch inaktiven Produkten abgebaut.
Nierenfunktionsstörungen
Die einmal tägliche Inhalation von Tiotropium bis zum Steady State führte bei COPD-Patienten mit leichter Nierenfunktionsstörung (Creatinin-Clearance 50-80 ml/min) zu leicht erhöhten AUC0-6,ss-Werten (1,8-30% höher) und ähnlichen Cmax,ss-Werten, verglichen mit COPD-Patienten mit normaler Nierenfunktion (Creatinin-Clearance >80 ml/min).
Bei COPD-Patienten mit mittlerer bis schwerer Nierenfunktionsstörung (Creatinin-Clearance <50 ml/min) verdoppelte sich die Gesamtexposition nach intravenöser Applikation einer Einzeldosis von Tiotropium (82% höhere AUC0-4h und 52% höhere Cmax), verglichen mit COPD-Patienten mit normaler Nierenfunktion. Dies wurde durch die Plasmakonzentrationen nach Pulverinhalation bestätigt.
Ältere Patienten
Wie für alle überwiegend renal ausgeschiedenen Arzneimittel zu erwarten, ging ein fortschreitendes Alter mit einer Abnahme der renalen Tiotropium-Clearance (347 ml/min bei COPD-Patienten <65 Jahre bis 275 ml/min bei COPD-Patienten ≥65 Jahre) einher. Dies führte jedoch nicht zu einem entsprechenden Anstieg der AUC0-6,ss oder Cmax,ss-Werte.
Genetische Polymorphismen
In einem Studienquervergleich war die mittlere Spitzen-Plasmakonzentration von Tiotropium, 10 Minuten nach Inhalation, im Steady State bei japanischen COPD-Patienten 20-70% höher als bei weissen COPD-Patienten. Für andere Ethnizitäten oder Rassen sind die pharmakokinetischen Daten unzureichend
Pharmakokinetische/pharmakodynamische Zusammenhänge
Es gibt keinen direkten Zusammenhang zwischen Pharmakokinetik und Pharmakodynamik.
Präklinische Daten
Viele der in den üblichen Studien zur pharmakologischen Sicherheit, zur Toxizität bei wiederholter Anwendung und zur Reproduktionstoxizität beobachteten Wirkungen lassen sich durch die anticholinergen Eigenschaften von Tiotropiumbromid erklären. Bei Tieren wurden typischerweise reduzierte Futteraufnahme, Hemmung der Gewichtszunahme, trockener Mund und Nase, verminderte Tränen- und Speichelsekretion, Mydriasis und Zunahme der Herzfrequenz beobachtet. Weitere wichtige Wirkungen, die in Toxizitätsstudien mit Mehrfachgabe beobachtet wurden, waren: leichte Reizung der Atemwege bei Ratten und Mäusen, die sich in Rhinitis und Epitheländerungen der Nasenhöhle und des Kehlkopfes zeigten, sowie Prostatitis mit proteinreichen Ablagerungen und Lithiasis in der Blase bei Ratten.
Bei jungen Ratten wurden nach Exposition vom 7. Lebenstag bis zur Geschlechtsreife die gleichen direkten und indirekten pharmakologischen Veränderungen beobachtet wie in den Studien zur Toxizität bei wiederholter Anwendung, sowie auch Rhinitis. Es wurde keine systemische Toxizität festgestellt. Es gab keine toxikologisch relevanten Auswirkungen auf die Hauptentwicklungsparameter, auf die Entwicklung der Trachea und der Hauptorgane.
Schädigungen hinsichtlich Schwangerschaft, embryonaler/fetaler Entwicklung, Geburt oder postnataler Entwicklung wurden nur mit maternal toxischen Dosen nachgewiesen. Tiotropiumbromid zeigte bei Ratten oder Kaninchen keine teratogenen Wirkungen.
Reproduktionstoxizität
In einer Studie zur allgemeinen Reproduktion und Fertilität an Ratten ergaben sich bei keiner Dosierung Hinweise auf unerwünschte Effekte auf die Fertilität oder das Paarungsverhalten, weder bei den behandelten Elterntieren noch bei ihren Nachkommen.
Die respiratorischen (Reizungen) und urogenitalen (Prostatitis) Veränderungen sowie reproduktionstoxischen Effekte wurden nach lokalen oder systemischen Dosen beobachtet, die mehr als das 5-fache der therapeutischen Dosis betrugen. Untersuchungen zur Genotoxizität und zum kanzerogenen Potenzial zeigten keine besonderen Gefahren für den Menschen.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nach dem Anbruch 3 Monate haltbar.
Besondere Lagerungshinweise
Nicht über 25 °C lagern.
Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Siehe Patienteninformation
Zulassungsnummer
67396 (Swissmedic)
Zulassungsinhaberin
Boehringer Ingelheim (Schweiz) GmbH, Basel
Stand der Information
März 2020
Composition
Principes actifs
Tiotropium.
Excipients
Chlorure de benzalconium (0,0011 mg à chaque pulvérisation), édétate de sodium, acide chlorhydrique pour l'ajustement du pH, eau purifiée.
Forme galénique et quantité de principe actif par unité
La dose délivrée à chaque pulvérisation est de 2,5 microgrammes de tiotropium correspondant à 3,124 microgrammes de bromure de tiotropium monohydraté.
La dose délivrée correspond à la quantité de tiotropium délivré après le passage à travers l'embout buccal.
Solution à inhaler limpide et incolore.
Indications/Possibilités d’emploi
Spiriva Respimat est indiqué en traitement bronchodilatateur continu des bronchopneumopathies chroniques obstructives (BPCO).
Posologie/Mode d’emploi
Le médicament est uniquement destiné à une administration par voie inhalée. La cartouche ne peut être mise en place et utilisée qu'avec l'inhalateur Spiriva Respimat (voir ci-dessous: Mode d'administration).
Dose usuelle
La dose recommandée chez l'adulte est de 5 microgrammes de tiotropium correspondant à l'inhalation de 2 pulvérisations par l'inhalateur Respimat, devant être administrées une fois par jour, à la même heure.
La dose recommandée ne doit pas être dépassée.
Patients présentant des troubles de la fonction hépatique
La tolérance et l'efficacité n'ont pas été étudiées chez les patients présentant des troubles de la fonction hépatique. Par conséquent, le tiotropium ne devrait pas être utilisé chez les patients ayant des troubles sévères de la fonction hépatique.
Patients présentant des troubles de la fonction rénale
Les patients présentant une insuffisance rénale peuvent utiliser le tiotropium à la posologie recommandée.
En cas d'insuffisance rénale modérée à sévère (clairance de la créatinine ≤50 ml/min), voir «Mises en garde et précautions» et «Pharmacocinétique».
Patients âgés
Les patients âgés peuvent prendre le bromure de tiotropium à la dose recommandée.
Enfants et adolescents
Spiriva Respimat n'a pas été étudié chez les enfants et les adolescents de moins de 18 ans.
Mode d'administration
Pour une administration correcte du médicament, le médecin ou un autre professionnel de santé devra s'assurer du bon usage de l'appareil par le patient. Le mode d'emploi exact de l'inhalateur Spiriva Respimat assorti d'illustrations figure dans l'information destinée au patient.
Contre-indications
Spiriva Respimat est contre-indiqué en cas d'hypersensibilité au bromure de tiotropium, à l'atropine ou à l'un de ses dérivés, tels que p.ex. l'ipratropium ou l'oxitropium, ou à l'un des autres composants du médicament (voir Composition: Excipients).
Mises en garde et précautions
Spiriva Respimat contient du chlorure de benzalconium, ce composant peut provoquer une respiration sifflante et des difficultés respiratoires (bronchospasmes – rétrécissements spasmodiques des voies respiratoires), en particulier lorsque vous souffrez d'asthme. |
Le bromure de tiotropium, un bronchodilatateur pour le traitement continu, administré en une prise par jour, ne doit pas être utilisé comme traitement initial des épisodes aigus de bronchospasme ou pour le soulagement des symptômes aigus. En cas de crise aiguë, un bêta-2-agoniste à action rapide doit être utilisé.
Des réactions immunitaires de type immédiat sont possibles après l'administration du bromure de tiotropium sous forme de solution à inhaler.
En raison de son activité anticholinergique, le bromure de tiotropium doit être utilisé uniquement avec prudence chez les patients atteints de glaucome à angle fermé, d'hyperplasie de la prostate ou d'un rétrécissement du col vésical.
Les médicaments administrés par voie inhalée sont susceptibles de déclencher un bronchospasme induit par l'inhalation.
L'expérience clinique avec le tiotropium est limitée dans les situations suivantes: glaucome à angle fermé, hyperplasie symptomatique de la prostate, rétrécissement du col vésical, insuffisance de la fonction rénale avec des valeurs de la créatinine >176 µmol/l et/ou une clairance ≤50 ml/min, hépatopathie avec ASAT ou ALAT >80 UI/l, infarctus du myocarde récent, troubles du rythme cardiaque nécessitant un traitement et insuffisance cardiaque nécessitant un traitement hospitalier.
Les patients présentant ces troubles ont été exclus des essais cliniques et les pathologies mentionnées peuvent être concernées par le mécanisme d'action anticholinergique.
La concentration plasmatique augmentant avec la diminution de la fonction rénale chez les patients présentant une insuffisance rénale modérée à sévère (clairance de la créatinine ≤50 ml/min.), le bromure de tiotropium ne devrait être utilisé que si le bénéfice attendu dépasse le risque potentiel. Il n'existe pas d'expérience à long terme chez des patients présentant des troubles sévères de la fonction rénale (voir «Pharmacocinétique»).
Les patients devront être mis en garde d'éviter la projection intraoculaire de solution à inhaler. Ils doivent être informés du fait que celle-ci peut provoquer ou aggraver un glaucome à angle fermé, une douleur ou une gêne oculaire, une vision floue transitoire, des halos visuels ou une perception modifiée des couleurs associés à une rougeur oculaire due à une congestion de la conjonctive ou à un œdème de la cornée. En cas d'apparition simultanée de deux ou plus des symptômes mentionnés, le traitement par le bromure de tiotropium doit être arrêté et un ophtalmologue doit être consulté au plus vite.
La sécheresse buccale observée avec les traitements anticholinergiques en général, peut à long terme favoriser la survenue de caries.
Le bromure de tiotropium ne doit pas être administré plus d'une fois par jour (voir «Surdosage»).
L'administration de Spiriva Respimat n'est pas recommandée dans le traitement de la fibrose kystique (mucoviscidose). En cas d'utilisation chez des patients atteints de fibrose kystique, Spiriva Respimat peut potentialiser les symptômes de la fibrose kystique (p.ex. événements indésirables graves, exacerbations pulmonaires, infections des voies respiratoires).
Interactions
Bien qu'aucune étude spécifique d'interactions médicamenteuses n'ait été effectuée, le bromure de tiotropium a été utilisé en association avec d'autres médicaments sans que des preuves cliniques d'interactions médicamenteuses n'aient été observées. Il s'agissait notamment de bronchodilatateurs sympathomimétiques, de méthylxanthines, de stéroïdes oraux et inhalés qui sont habituellement utilisés dans le traitement de la BPCO.
Dans une étude portant sur la disponibilité systémique, l'exposition au tiotropium et au salmétérol à l'état d'équilibre était pratiquement identique chez les patients atteints de BPCO après administration en monothérapie de 18 mcg de tiotropium ou de 2 fois 50 mcg de salmétérol, sous forme de poudre sèche inhalée, et après un traitement par l'association libre.
Interactions pharmacocinétiques
L'utilisation concomitante de bromure de tiotropium avec d'autres anticholinergiques n'a pas été étudiée et n'est par conséquent pas recommandée.
Interactions pharmacodynamiques
On suppose que le tiotropium est éliminé activement par des transporteurs de cations non identifiés jusqu'ici. Des interactions avec des transporteurs de cations sont généralement décrites surtout avec la cimétidine, le triméthoprime et les inhibiteurs de protéase. Pour le tiotropium, il existe une étude d'interaction avec la cimétidine (concentrations thérapeutiques à l'état d'équilibre). La clairance du tiotropium (administration IV unique avec une dose quasi suprathérapeutique) a diminué d'environ 20% et l'exposition (ASC0-4h) a augmenté d'environ 20%. En revanche, aucune interaction n'a été observée avec la ranitidine.
Grossesse/Allaitement
Grossesse
Les expériences sont très limitées jusqu'ici concernant l'utilisation du tiotropium chez les femmes enceintes. Les études effectuées chez l'animal avec le tiotropium n'ont pas fourni d'indices suggérant des effets néfastes directs ou indirects sur la santé en termes de toxicité sur la reproduction aux doses pertinentes du point de vue clinique (voir «Données précliniques»). Par mesure de précaution, l'utilisation de Spiriva Respimat doit être évitée pendant la grossesse.
Allaitement
On ignore si le bromure de tiotropium est excrété dans le lait maternel chez la femme. Les études réalisées chez les rongeurs ont montré que seule une faible quantité de bromure de tiotropium est excrétée dans le lait maternel. Par conséquent, Spiriva Respimat ne doit pas être utilisé pendant l'allaitement. Le bromure de tiotropium est un composé à longue durée d'action. La décision de poursuivre ou d'interrompre l'allaitement ou le traitement par Spiriva Respimat doit être prise en tenant compte du bénéfice de l'allaitement chez l'enfant et du bénéfice du traitement par Spiriva Respimat chez la mère allaitante.
Fertilité
Aucune donnée clinique sur la fertilité n'est disponible avec le tiotropium. Une étude non clinique effectuée avec du tiotropium n'a pas révélé d'effets négatifs sur la fertilité (voir paragraphe «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude sur les effets du médicament sur la capacité à conduire des véhicules ou à utiliser des machines n'a été menée. La survenue de vertiges et d'une vision trouble peut avoir des répercussions sur l'aptitude à conduire des véhicules ou à utiliser des machines.
Effets indésirables
Résumé du profil de sécurité
Parmi les effets secondaires mentionnés, nombreux sont ceux qui peuvent être dus aux propriétés anticholinergiques du bromure de tiotropium.
Tableau résumé des effets secondaires
Les fréquences des effets secondaires mentionnés ci-dessous sont basées sur la survenue de ces effets indésirables observés dans les groupes traités par le tiotropium (c'est-à-dire les événements imputables au tiotropium), regroupés à partir des données de 7 études cliniques dans la BPCO (3 282 patients) contrôlées contre placebo, dont les durées de traitement étaient comprises entre 4 semaines et 1 an.
Les indications de fréquence des événements attribués au tiotropium observés pendant les études cliniques reposent sur les catégories suivantes:
très fréquents (≥1/10); fréquents (≥1/100 à <1/10); occasionnels (≥1/1 000 à <1/100); rares (≥1/10 000 à <1/1 000); très rares (<1/10 000); fréquence inconnue (la fréquence exacte ne peut pas être estimée sur la base des données disponibles).
Effets indésirables après commercialisation
Classe de systèmes d'organes / Terminologie MedDRA | Fréquence dans la BPCO |
|---|---|
Troubles du métabolisme et de la nutrition | |
Déshydratation | Fréquence inconnue |
Troubles du système nerveux | |
Vertiges | Occasionnels |
Céphalées | Occasionnels |
Insomnie | Rares |
Affections oculaires | |
Glaucome | Rares |
Augmentation de la pression intraoculaire | Rares |
Vision trouble | Rares |
Affections cardiaques | |
Fibrillation auriculaire | Rares |
Palpitations | Rares |
Tachycardies supraventriculaires | Rares |
Tachycardie | Rares |
Troubles respiratoires, thoraciques et médiastinaux | |
Toux | Occasionnels |
Pharyngite | Occasionnels |
Dysphonie | Occasionnels |
Épistaxis | Rares |
Bronchospasme | Rares |
Laryngite | Rares |
Sinusite | Fréquence inconnue |
Troubles gastro-intestinaux | |
Sécheresse buccale | Fréquents |
Constipation | Occasionnels |
Candidose oropharyngée | Occasionnels |
Dysphagie | Rares |
Reflux gastro-œsophagien | Rares |
Caries | Rares |
Gingivite | Rares |
Glossite | Rares |
Stomatite | Fréquence inconnue |
Occlusion intestinale, y compris iléus paralytique | Fréquence inconnue |
Nausées | Fréquence inconnue |
Troubles cutanés et du tissu sous-cutané, troubles du système immunitaire | |
Éruption cutanée (rash) | Occasionnels |
Prurit | Occasionnels |
Œdème angioneurotique | Rares |
Urticaire | Rares |
Infections cutanées, ulcères cutanés | Rares |
Sécheresse cutanée | Rares |
Réactions d'hypersensibilité (y compris réactions de type immédiate) | Fréquence inconnue |
Réaction anaphylactique | Fréquence inconnue |
Système musculo-squelettique | |
Gonflement articulaire | Fréquence inconnue |
Troubles rénaux et urinaires | |
Rétention urinaire | Occasionnels |
Dysurie | Occasionnels |
Infections urinaires | Rares |
Description de certains effets secondaires
Dans les essais cliniques contrôlés menés dans la BPCO, les effets secondaires les plus fréquemment observés étaient les effets de type anticholinergique tels que la sécheresse buccale (survenue chez env. 2,9% des patients).
Dans 7 essais cliniques menés chez des patients atteints de BPCO, la sécheresse buccale a été à l'origine de 3 arrêts de traitement parmi 3 282 patients traités par le tiotropium (0,1% des patients traités).
Les effets secondaires graves liés aux effets anticholinergiques incluent glaucome, constipation et occlusion intestinale, y compris iléus paralytique et rétention urinaire.
Populations particulières
L'incidence des effets anticholinergiques peut augmenter avec l'âge.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
L'administration de doses élevées de bromure de tiotropium peut déclencher l'apparition de symptômes anticholinergiques.
Cependant, aucun effet secondaire anticholinergique systémique n'a été observé chez des volontaires sains après inhalation d'une dose unique de bromure de tiotropium allant jusqu'à 340 microgrammes. Aucun effet secondaire significatif, hormis une sécheresse buccale, pharyngée et de la muqueuse nasale (réduction prononcée de la production de salive à partir du 7e jour), n'a été observé après 14 jours d'administration de doses atteignant au maximum 40 microgrammes de tiotropium solution à inhaler chez des volontaires sains.
Propriétés/Effets
Code ATC
R03BB04
Mécanisme d'action
Le tiotropium est un antagoniste spécifique des récepteurs muscariniques à action longue montrant la même affinité pour les récepteurs muscariniques de sous-types M1 à M5. Dans les voies aériennes, le bromure de tiotropium se fixe de façon compétitive et réversible sur les récepteurs M3 des muscles lisses bronchiques, et inhibe les effets cholinergiques (bronchonconstriction) de l'acétylcholine, entraînant ainsi une relaxation des muscles lisses bronchiques. L'effet était dose-dépendant et persistait plus de 24 heures. La bronchodilatation consécutive à l'inhalation de tiotropium est principalement due à un effet direct localisé et non pas à un effet systémique.
Effets pharmacodynamiques
La dissociation du tiotropium des récepteurs M3 notamment est très lente, lui conférant une demi-vie de dissociation significativement plus longue que l'ipratropium. La dissociation des récepteurs M2 est plus rapide que celle des récepteurs M3, montrant ainsi dans les études fonctionnelles in vitro une sélectivité cinétiquement contrôlée supérieure pour les sous-types de récepteurs M3 par rapport à M2.
Efficacité clinique
Le programme de développement clinique de phase III comprenait plusieurs études randomisées et en double aveugle (2 études d'un an, 2 études de 12 semaines et 2 études de 4 semaines) portant sur 2 901 patients atteints de BPCO (dont 1 038 recevant une dose de 5 microgrammes de tiotropium). Le programme sur un an comprenait deux essais contrôlés contre placebo. Les 2 études de 12 semaines étaient contrôlées contre témoin actif (ipratropium) et contre placebo. L'ensemble des six études comportait des mesures de la fonction pulmonaire. Les deux études d'1 an incluaient, en outre, les mesures de la dyspnée, de la qualité de vie relative à l'état de santé et l'effet sur les exacerbations.
Données au long cours
Dyspnée
Spiriva Respimat a significativement amélioré la dyspnée (mesurée d'après l'indice de dyspnée transitionnel) comparativement au placebo (amélioration moyenne de 1,05 unités; IC à 95%: 0,73 à 1,38 unités, p <0,0001). Cette amélioration a été maintenue pendant toute la durée du traitement.
Exacerbations de BPCO
Dans trois études cliniques randomisées d'une durée d'un an, en double aveugle, contrôlées contre placebo, le traitement par Spiriva Respimat a entraîné une réduction significative du risque d'exacerbations de BPCO par rapport au placebo. Les exacerbations de BPCO ont été définies comme «l'association d'au moins deux événements/symptômes respiratoires persistants pendant au moins trois jours et ayant conduit à une modification du traitement (prescription d'antibiotiques et/ou de corticostéroïdes systémiques et/ou modification significative du traitement à visée respiratoire)».
Le traitement par Spiriva Respimat a entraîné une réduction du risque d'hospitalisation en lien avec une exacerbation de BPCO (statistiquement significatif dans l'étude qui présente la puissance appropriée).
L'analyse combinée de deux études de phase III et l'analyse distincte d'une étude supplémentaire sur les exacerbations sont présentées dans le Tableau 1. Tous les traitements à visée respiratoire, à l'exception des anticholinergiques et des bêta-agonistes à action longue, étaient autorisés en traitements concomitants, consistant en bêta-agonistes à action rapide, corticostéroïdes inhalés et xanthines. Les bêta-agonistes à action longue étaient autorisés en traitement complémentaire dans l'étude sur les exacerbations.
Tableau 1: Analyse statistique des exacerbations de BPCO et des exacerbations de BPCO ayant nécessité une hospitalisation chez les patients présentant une BPCO modérée à très sévère
Étude | Critère d'évaluation | Spiriva Respimat | Placebo | % de réduction du risque (IC à 95%)a | Valeur p |
|---|---|---|---|---|---|
Analyse combinée d'études de phase III d'un and | Nombre de jours avant la première exacerbation de BPCO | 160a | 86a | 29 | <0,0001b |
Incidence moyenne d'exacerbations par patient-année | 0,78c | 1,00c | 22 | 0,002c | |
Délai avant la première exacerbation de BPCO ayant nécessité une hospitalisation | 25 | 0,20b | |||
Incidence moyenne d'exacerbations ayant nécessité une hospitalisation par patient-année | 0,09c | 0,11c | 20 | 0,096c | |
Etude sur les exacerbations de phase III b d'un an | Nombre de jours avant la première exacerbation de BPCO | 169a | 119a | 31 | <0,0001b |
Incidence moyenne d'exacerbations par patient-année | 0,69c | 0,87c | 21 | <0,0001c | |
Délai avant la première exacerbation de BPCO ayant nécessité une hospitalisation | 27 | 0,003b | |||
Incidence moyenne d'exacerbations ayant nécessité une hospitalisation par patient-année | 0,12c | 0,15c | 19 | 0,004c |
a Délai avant le premier événement: nombre de jours sous traitement écoulés avant que 25% des patients présentent au moins une exacerbation de BPCO/soient hospitalisés pour exacerbation de BPCO.
Dans l'étude A, 25% des patients sous placebo ont présenté une exacerbation au jour 112 alors que 25% des patients traités par Spiriva Respimat ont présenté une exacerbation au jour 173 (p = 0,09).
Dans l'étude B, 25% des patients sous placebo ont présenté une exacerbation au jour 74 alors que 25% des patients traités par Spiriva Respimat ont présenté une exacerbation au jour 149 (p <0,0001).
b Les risques relatifs ont été estimés avec un modèle aléatoire proportionnel de Cox. La réduction du risque exprimé en pourcentage est calculée avec la formule suivante: 100 x (1 - risque relatif).
c Régression de Poisson. La réduction du risque est calculée avec la formule suivante: 100 x (1 ‑ rapport des taux).
d Le regroupement pour l'analyse des données a été spécifié dans le plan de l'étude. Les paramètres mesurant les exacerbations ont été significativement améliorés dans l'analyse séparée des deux études de 1 an.
Etude au long cours avec le tiotropium contrôlée contre témoin actif
Afin de comparer l'efficacité et la sécurité d'emploi de Spiriva Respimat et Spiriva HandiHaler, une vaste étude au long cours randomisée, en double-aveugle, contrôlée contre témoin actif avec une durée d'observation maximale de 3 ans a été réalisée. 5 711 patients ont reçu Spiriva Respimat, 5 694 patients ont reçu Spiriva HandiHaler. Les critères d'évaluation principaux étaient: le délai jusqu'à la première exacerbation de BPCO, le délai jusqu'au décès (toutes causes confondues) et dans la sous-étude incluant 906 patients les valeurs minimales du VEMS avant l'administration suivante.
Les délais jusqu'à la première exacerbation de BPCO étaient avec Spiriva Respimat et Spiriva HandiHaler comparables du point de vue numérique (rapport de risque Spiriva Respimat/Spiriva HandiHaler: 0,98; IC à 95%: 0,93 à 1,03). Le nombre médian de jours jusqu'à la première exacerbation de BPCO était avec Spiriva Respimat de 756 jours et avec Spiriva HandiHaler de 719 jours.
L'effet bronchodilatateur de Spiriva Respimat a persisté pendant 120 semaines, effet comparable à celui obtenu avec Spiriva HandiHaler. La différence moyenne de la valeur minimale du VEMS avec Spiriva Respimat versus Spiriva HandiHaler était de ‑0,010 l (IC à 95%: ‑0,038 à +0,018 l).
Dans l'étude post-commercialisation TIOSPIR comparant Spiriva Respimat et Spiriva HandiHaler, la mortalité globale, y compris le suivi du statut vital, était comparable (rapport de risque Spiriva Respimat/Spiriva HandiHaler: 0,96; IC à 95%: 0,84 à 1,09) pour une durée de traitement de 13 135 et 13 050 patients-années.
Dans les études contrôlées contre placebo comportant un suivi du statut vital jusqu'à la fin de la période de traitement prévue avec le traitement par Spiriva Respimat, une augmentation numérique de la mortalité globale a été mise en évidence, par comparaison avec le placebo (ratio de taux: 1,33; IC à 95%: 0,93 à 1,92), pour une durée de traitement avec Spiriva Respimat de 2 574 années-patients. L'augmentation de la mortalité a été observée chez des patients présentant des troubles du rythme cardiaque avérés. Sous traitement par Spiriva HandiHaler, une diminution du risque de mortalité de 13% a été mise en évidence (rapport de risque tiotropium/placebo, y compris le suivi du statut vital: 0,87; IC à 95%: 0,76 à 0,99) pour une durée de traitement par Spiriva HandiHaler de 10 927 années-patients. Ni dans l'étude contrôlée contre placebo réalisée avec Spiriva HandiHaler ni dans l'étude TIOSPIR comparant Spiriva Respimat et Spiriva HandiHaler, une augmentation du risque de mortalité n'a été observée dans le sous-groupe des patients présentant des troubles du rythme cardiaque avérés.
Enfants et adolescents
Spiriva Respimat n'a pas été étudié chez les adolescents de moins de 18 ans.
Autres informations
Etudes contrôlées contre placebo
Fonction pulmonaire
L'administration de tiotropium solution à inhaler en dose unique journalière a permis d'obtenir une amélioration significative de la fonction pulmonaire (volume expiratoire maximal en une seconde (VEMS) et de la capacité vitale forcée (CVF) dans les 30 minutes suivant la première dose par rapport au placebo (amélioration moyenne du VEMS après 30 minutes: 0,113 l; intervalle de confiance (IC) à 95%: 0,102 à 0,125 l, p <0,0001). À l'état d'équilibre, l'amélioration de la fonction pulmonaire a été maintenue pendant 24 heures: amélioration moyenne du VEMS par rapport au placebo: 0,122 l; IC à 95%: 0,106 à 0,138 l, p <0,0001.
L'état d'équilibre pharmacodynamique a été atteint en une semaine.
Spiriva Respimat a significativement amélioré, comparativement au placebo, le DEP (débit expiratoire de pointe) mesuré quotidiennement par les patients (amélioration moyenne du DEP le matin: 22 l/min; IC à 95%: 18 à 55 l/min, p <0,0001; le soir 26 l/min; IC à 95%: 23 à 30 l/min, p <0,0001). L'utilisation de Spiriva Respimat a entraîné une réduction de l'utilisation du traitement bronchodilatateur de secours par rapport au placebo (réduction moyenne de 0,66 prise par jour, IC à 95%: 0,51 à 0,81 prise par jour, p <0,0001).
L'effet bronchodilatateur de Spiriva Respimat s'est maintenu pendant l'année complète d'administration sans signe de développement d'une tolérance.
Pharmacocinétique
Absorption
Le bromure de tiotropium est un dérivé d'ammonium quaternaire non chiral, peu soluble dans l'eau. Le bromure de tiotropium se présente sous forme de solution à inhaler administrée par l'intermédiaire de l'inhalateur Respimat. Approximativement 40% de la dose inhalée sont déposés dans les poumons, l'organe cible. Le reste de la dose délivrée se dépose dans le tractus gastro-intestinal. Une partie des données pharmacocinétiques décrites ci-dessous ont été obtenues avec des doses supérieures à la dose thérapeutique recommandée.
Les données obtenues chez les sujets jeunes et sains sur l'excrétion urinaire mettent en évidence qu'environ 33% de la dose absorbée via l'inhalateur Respimat atteignent la circulation systémique. Les solutions de bromure de tiotropium administrées oralement montrent une biodisponibilité absolue de 2 à 3%. L'ingestion d'aliments ne semble pas influencer la résorption de cet ammonium quaternaire. Les concentrations plasmatiques maximales de tiotropium sont atteintes 5 à 7 minutes après inhalation. Les données de comparaison sur l'exposition systémique au tiotropium après l'inhalation via Respimat ou HandiHaler ont donné des résultats contradictoires et ne permettent donc que des conclusions partielles: chez des patients atteints de BPCO, des concentrations plasmatiques maximales à l'état d'équilibre de 10,5 pg/ml ont été observées après l'inhalation de 2 pulvérisations par Respimat (5 mcg) et ont diminué rapidement selon un modèle multicompartimental. La concentration plasmatique minimale à l'état d'équilibre était de 1,60 pg/ml. Après l'inhalation via HandiHaler (18 mcg), la concentration plasmatique maximale de tiotropium à l'état d'équilibre était de 12,9 pg/ml et la concentration plasmatique minimale de 1,71 pg/ml.
Ces données d'exposition au tiotropium, mesurées au cours d'une étude de bioéquivalence actuelle, indiquent une exposition plus faible après l'inhalation via l'inhalateur Respimat qu'après une inhalation avec HandiHaler, alors que des études antérieures indiquent une exposition plus élevée (étude 205.249: sans correction pour les limites de détection, exposition de 35% plus élevée pour Respimat sur la base de la concentration maximale mesurée à l'état d'équilibre (C0.167,ss) et élimination urinaire de 31% plus élevée (Ae0-12,ss); étude 205.250: C0.167,ss 18% plus élevée et Ae0-12,ss 17% plus élevée).
Distribution
La liaison du principe actif aux protéines plasmatiques est de 72% et son volume de distribution est de 32 l/kg. Les concentrations pulmonaires locales ne sont pas connues, mais le mode d'administration suggère une concentration beaucoup plus élevée dans les poumons. Les études chez le rat ont montré que le tiotropium ne traverse pas la barrière hémato-encéphalique de façon significative.
Métabolisme
Le métabolisme est faible puisque 74% d'une dose administrée par voie intraveineuse chez de jeunes volontaires sains sont éliminés sous forme inchangée par voie rénale. L'ester de bromure de tiotropium est clivé de manière non enzymatique en alcool (N-méthylscopine) et en acide (acide dithiénylglycolique) qui sont inactifs sur les récepteurs muscariniques.
Des études réalisées in vitro sur des microsomes hépatiques et des hépatocytes d'origine humaine suggèrent qu'une autre partie du médicament (<20% de la dose administrée par voie intraveineuse) est métabolisée par oxydation dépendante du cytochrome P450 suivie d'une conjugaison avec le glutathion, donnant naissance à plusieurs métabolites de phase II.
Les études in vitro effectuées sur les microsomes hépatiques révèlent une inhibition du métabolisme enzymatique par les inhibiteurs du CYP 2D6 (et 3A4), la quinidine, le kétoconazole et le gestodène. Les CYP 2D6 et 3A4 sont, par conséquent, impliqués dans la voie métabolique responsable d'une petite partie de l'élimination de la dose. Le bromure de tiotropium, même à des concentrations suprathérapeutiques, n'inhibe pas les isoenzymes CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ou 3A sur les microsomes hépatiques d'origine humaine.
Élimination
Chez les volontaires sains et chez les patients atteints de BPCO, la demi-vie effective du tiotropium est de 27 et 45 heures après inhalation. La clairance totale était de 880 ml/min après une dose intraveineuse chez de jeunes volontaires sains. Le tiotropium, administré par voie intraveineuse, est principalement excrété par voie urinaire sous forme inchangée (74%). Après inhalation de la solution par les patients atteints de BPCO jusqu'à l'état d'équilibre, l'excrétion urinaire est de 18,6% de la dose (0,93 μg), le reste étant principalement constitué de médicament non absorbé dans l'intestin, puis éliminé dans les fèces. Après inhalation de la solution par des volontaires sains, l'excrétion urinaire est comprise entre 20,1 et 29,4% de la dose, le reste étant principalement constitué de médicament non absorbé dans l'intestin, puis éliminé dans les fèces. La clairance rénale du tiotropium est supérieure à la clairance de la créatinine, ce qui indique une élimination rénale.
Après inhalation chronique d'une dose par jour chez des patients atteints de BPCO, l'état d'équilibre pharmacocinétique est atteint après 7 jours, sans accumulation par la suite.
Linéarité / non-linéarité
La pharmacocinétique du tiotropium est linéaire aux doses thérapeutiques, quelle que soit la voie d'administration.
Cinétique pour certains groupes de patients
Patients insuffisants hépatiques
Il n'est pas attendu de modification significative de la pharmacocinétique du tiotropium en cas d'insuffisance hépatique. Le tiotropium est principalement excrété par voie rénale (74% chez les sujets jeunes et sains) et dégradé en produits pharmacologiquement inactifs via un clivage simple et non enzymatique de l'ester.
Patients insuffisants rénaux
Chez des patients atteints de BPCO présentant une insuffisance rénale légère (clairance de la créatinine 50 à 80 ml/min), l'inhalation de tiotropium une fois par jour jusqu'à l'état d'équilibre a entraîné une ASC0-6,ss plus élevée (de 1,8% à 30% plus élevée) et une Cmax,ss comparable par rapport aux patients présentant une fonction rénale normale (clairance de la créatinine >80 ml/min).
Chez des patients atteints de BPCO et présentant une insuffisance rénale modérée à sévère (clairance de la créatinine <50 ml/min), l'exposition totale a doublé après administration intraveineuse de tiotropium (82% d'augmentation de l'ASC0‑4h et Cmax de 52% plus élevée) par rapport aux patients atteints de BPCO présentant une fonction rénale normale, ce qui a également été confirmé après inhalation de poudre.
Patients âgés
Comme cela est attendu avec tous les médicaments principalement excrétés par voie rénale, la clairance rénale du tiotropium diminue avec l'âge (347 ml/min chez des patients atteints de BPCO de moins de 65 ans, jusqu'à 275 ml/min chez des patients atteints de BPCO de 65 ans et plus). Ceci n'a cependant pas entraîné d'augmentation correspondante de l'ASC0-6,ss ou de la Cmax,ss.
Polymorphismes génétiques
Dans une étude comparative chez des patients atteints de BPCO, les concentrations plasmatiques maximales moyennes de tiotropium étaient, 10 minutes après inhalation, à l'état d'équilibre, 20 à 70% plus élevées chez les japonais que chez les caucasiens. On ne dispose pas de données pharmacocinétiques suffisantes pour d'autres groupes ethniques ou races.
Relations entre les paramètres pharmacocinétiques et les paramètres pharmacodynamiques
Il n'y a pas de lien direct entre la pharmacocinétique et la pharmacodynamie du produit.
Données précliniques
De nombreux effets observés dans les études conventionnelles de pharmacologie de sécurité, de toxicité en administration répétée et de toxicité des fonctions de reproduction, peuvent s'expliquer par les propriétés anticholinergiques du bromure de tiotropium. Une diminution de l'ingestion de nourriture, une réduction de la prise de poids, une sécheresse buccale et nasale, une réduction de la sécrétion lacrymale et salivaire, une mydriase ainsi qu'une accélération du rythme cardiaque ont été observées de manière typique chez l'animal. D'autres effets notables ont été observés lors des études de toxicité en administration répétée: irritation légère des voies respiratoires chez le rat et la souris, se manifestant par des rhinites et des altérations épithéliales des fosses nasales et du larynx ainsi que prostatites liées à des dépôts riches en protéines et lithiases vésicales chez le rat.
Les mêmes modifications pharmacologiques directes et indirectes ainsi que des rhinites ont été observées dans les études de toxicité en doses répétées chez les jeunes rats exposés du 7e jour après la naissance jusqu'à leur maturité sexuelle. Aucune toxicité systémique et aucun effet toxicologique significatif sur les paramètres principaux du développement de la trachée ou des organes vitaux n'ont été constatés.
Des effets délétères sur la gestation, le développement embryonnaire/fœtal, la parturition ou le développement post-natal n'ont pu être mis en évidence qu'à des doses toxiques pour les mères. Le bromure de tiotropium n'a pas montré d'activité tératogène chez le rat ou le lapin.
Toxicité pour la reproduction
Dans une étude générale sur les effets du tiotropium sur la reproduction et la fertilité chez le rat, aucune des posologies examinées n'a mis en évidence d'effets négatifs sur la fertilité ou le comportement d'accouplement chez les deux parents traités ou leur progéniture.
Les altérations respiratoires (irritations) et urogénitales (prostatites) ainsi que les effets délétères sur la reproduction ont été observés après administration locale ou systémique de doses plus de 5 fois supérieures aux doses thérapeutiques. Des études de génotoxicité et de carcinogenèse n'ont pas montré de risque particulier pour l'être humain.
Remarques particulières
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Durée de conservation après ouverture
Conservation après ouverture: 3 mois
Remarques concernant le stockage
Ne pas conserver à une température supérieure à 25 °C.
Ne pas congeler.
Conserver les médicaments hors de portée des enfants.
Remarques concernant la manipulation
Voir l'information destinée au patient
Numéro d’autorisation
67396 (Swissmedic)
Titulaire de l’autorisation
Boehringer Ingelheim (Schweiz) GmbH, Bâle
Mise à jour de l’information
Mars 2020
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


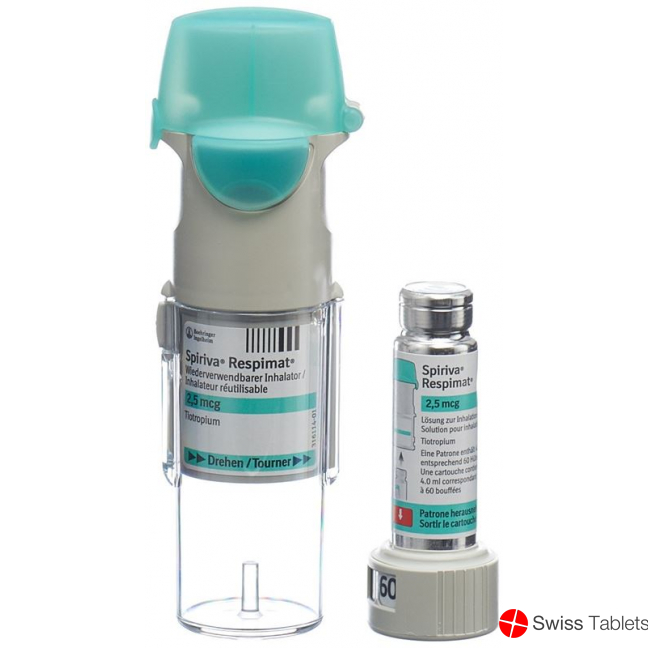
 Deutsch
Deutsch French
French Italian
Italian











































