Striverdi Respimat Inhal Lös 2.5 mcg / stroke reusable 60 Dos
Striverdi Respimat Inhal Lös 2.5 mcg/Hub wiederverwendbar 60 Dos
-
98.33 CHF
- Price in reward points: 3131

- Availability: Not available
- Product Code: 7752255
- ATC-code R03AC19
- EAN 7680673990018
Ingredients:
Citronensäure, Benzalkonium chlorid 1.1 mcg, Dinatrium edetat, Benzalkoniumchlorid-Lösung, Olodaterol 2.5 mcg , Olodaterol hydrochlorid.

Variants
Description
Was ist Striverdi Respimat und wann wird es angewendet?
Striverdi Respimat enthält den Wirkstoff Olodaterol und gehört zu einer Gruppe von Arzneimitteln, die als Bronchodilatatoren bezeichnet werden.
Striverdi Respimat wird einmal täglich bei Patienten mit der chronisch-obstruktiven Lungenerkrankung (COPD) angewendet. Striverdi Respimat erleichtert die Atmung.
Die Anwendung erfolgt mit dem in dieser Packung enthaltenen Respimat-Inhalator.
Auf Verschreibung des Arztes oder der Ärztin.
Wann darf Striverdi Respimat nicht angewendet werden?
Striverdi Respimat darf bei Überempfindlichkeit gegenüber Olodaterol oder eines Hilfsstoffs nicht inhaliert werden.
Kinder und Jugendliche
Striverdi Respimat darf nicht an Kinder und Jugendliche (unter 18 Jahren) verabreicht werden.
Wann ist bei der Anwendung von Striverdi Respimat Vorsicht geboten?
Befolgen Sie alle Anweisungen Ihres Arztes oder Ihrer Ärztin genau.
Striverdi Respimat enthält Benzalkoniumchlorid, dieser Bestandteil kann keuchende Atmung und Atemschwierigkeiten (Bronchospasmen - krampfartige Verengungen der Atemwege) hervorrufen.
Informieren Sie unbedingt Ihren Arzt bzw. Ihre Ärztin vor der Anwendung von Striverdi Respimat, wenn einer der folgenden Punkte auf Sie zutrifft:
- wenn Sie Asthmatiker oder Asthmatikerin sind (in diesem Fall dürfen Sie nicht mit Striverdi Respimat behandelt werden);
- wenn Sie Herzprobleme haben;
- wenn Sie hohen Blutdruck haben;
- wenn Sie an Epilepsie leiden;
- wenn Sie Probleme mit der Schilddrüse haben;
- wenn Sie an Diabetes leiden;
- wenn Sie an anderen Krankheiten leiden, Allergien haben oder andere Arzneimittel (auch selbst gekaufte!) einnehmen oder äusserlich anwenden.
Informieren Sie sofort Ihren Arzt bzw. Ihre Ärztin während der Behandlung mit Striverdi Respimat, wenn Sie eines der folgenden Symptome feststellen:
- wenn Sie unmittelbar nach dem Inhalieren ein Engegefühl in der Brust, Husten, keuchende Atmung oder Atemnot bekommen. Die genannten Beschwerden können Zeichen einer Verkrampfung der Muskulatur in den Bronchien sein, die als Bronchospasmus bezeichnet wird;
- wenn sich Ihre Krankheits-Symptome (Atemlosigkeit, Keuchatmung, Husten) während Ihrer Behandlung nicht bessern bzw. sich verschlimmern;
- wenn Sie unmittelbar nach der Anwendung des Inhalators einen Hautausschlag, Schwellungen oder Juckreiz bekommen;
- wenn Sie irgendwelche Nebenwirkungen bemerken, die Ihr Herz betreffen (Beschleunigung des Herzschlags, Anstieg des Blutdrucks und/oder Verstärkung von Symptomen wie Brustschmerzen);
- wenn bei Ihnen Muskelkrämpfe, Muskelschwäche oder Herzrhythmusstörungen auftreten (diese Beschwerden können durch einen niedrigen Kaliumspiegel im Blut bedingt sein).
Anwendung von Striverdi Respimat zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie andere (auch selbst gekaufte!) Arzneimittel anwenden bzw. vor kurzem angewendet haben. Dazu zählen insbesondere folgende Arzneimittel:
- Arzneimittel zur Behandlung von Depressionen (z.B. sogenannte trizyklische Antidepressiva, Monoaminoxidase-Hemmer).
- Andere Arzneimittel, die zur Behandlung Ihrer Lungenkrankheit angewendet werden (deren Anwendung könnte dadurch das Risiko möglicher Nebenwirkungen erhöhen).
- Arzneimittel, welche den Kaliumspiegel in Ihrem Blut senken. Dazu gehören «Wassertabletten» (auch verwendet zur Behandlung von Bluthochdruck).
- Betablocker zur Behandlung von Bluthochdruck oder anderer Herzprobleme oder zur Behandlung des grünen Stars (Glaukom).
- Arzneimittel zur Behandlung von Herzrhythmusstörungen
- gewisse Arzneimittel zur Behandlung von Infektion (Antibiotika)
- gewisse Arzneimittel gegen Allergien und Heuschnupfen.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Wenn Sie sich während der Behandlung mit Striverdi Respimat schwindelig fühlen, dürfen Sie kein Fahrzeug lenken und keine Geräte oder Maschinen bedienen.
Darf Striverdi Respimat während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Wenn Sie schwanger sind oder glauben, dass Sie schwanger sein könnten, oder wenn Sie stillen, dürfen Sie Striverdi Respimat nur nach Rücksprache mit Ihrem Arzt resp. Ihrer Ärztin anwenden.
Wie verwenden Sie Striverdi Respimat?
Befolgen Sie die Anweisungen des Arztes bzw. der Ärztin genau.
Üblicherweise werden einmal täglich zwei Hübe möglichst immer zur gleichen Tageszeit inhaliert.
Striverdi Respimat ist nur zur Inhalation bestimmt.
Die COPD ist eine chronische Krankheit. Wenden Sie Striverdi Respimat daher jeden Tag an, d.h. nicht nur, wenn Sie Atemprobleme haben. Inhalieren Sie nicht mehr als die empfohlene Dosis.
Lesen Sie die Gebrauchsanleitung vor der ersten Anwendung von Striverdi Respimat Inhalator genau durch, damit Sie den Respimat korrekt anwenden. (siehe Gebrauchsanweisung für den Respimat Inhalator).
Wenn Sie eine grössere Menge Striverdi Respimat angewendet haben, als Sie sollten
Wenn Sie zu viel Striverdi Respimat inhaliert haben, oder wenn eine andere Person aus Versehen Ihr Arzneimittel inhaliert hat, wenden Sie sich umgehend an einen Arzt resp. Ärztin oder ein Spital. Zeigen Sie die Striverdi Respimat-Packung. Möglicherweise ist ärztliche Hilfe erforderlich.
Wenn Sie die Anwendung von Striverdi Respimat vergessen haben
Wenn Sie das Inhalieren einer Dosis vergessen haben, setzen Sie die Behandlung einfach mit der Inhalation der nächsten Dosis zur gewohnten Zeit am nächsten Tag fort. Inhalieren Sie nicht die doppelte Dosis, um die vergessene Dosis nachzuholen.
Die Dauer Ihrer Behandlung mit Striverdi Respimat wird von Ihrem Arzt resp. Ärztin festgelegt. Sie dürfen die Anwendung von Striverdi Respimat nicht ohne Rücksprache mit Ihrem Arzt resp. Ärztin abbrechen, da sich die Zeichen und Symptome Ihrer Krankheit verschlimmern können.
Die Anwendung und Sicherheit von Striverdi Respimat bei Kindern und Jugendlichen unter 18 Jahren ist bisher nicht geprüft worden und darf von diesen nicht angewendet werden.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Striverdi Respimat haben?
Striverdi Respimat kann folgende Nebenwirkungen verursachen:
Gelegentlich (betrifft 1 bis 10 von 1000 Anwendern)
- Laufende Nase
- Schwindel
- Hautausschlag
Selten (betrifft 1 bis 10 von 10‘000 Anwendern)
- Gelenkschmerzen
Sehr selten (betrifft weniger als 1 von 10‘000 Anwendern)
Einzelfälle
- Hoher Blutdruck
Weitere mögliche Nebenwirkungen sind:
Pulsbeschleunigung, Herzrhythmusstörungen, Herzklopfen oder evtl. andere Herzbeschwerden, Blutdruckveränderungen, Zittern, Kopfschmerzen, Nervosität, Schlaflosigkeit, Mundtrockenheit, Übelkeit, Muskelkrämpfe, Müdigkeit, allgemeines Krankheitsgefühl.
Wenn Sie dennoch Nebenwirkungen beobachten, informieren Sie Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit „EXP“ bezeichneten Datum verwendet werden.
Aufbrauchfrist nach Anbruch
Der Striverdi Respimat Inhalator innerhalb von 3 Monaten nach Einsetzen der Patrone verwenden.
Lagerungshinweis
Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Weitere Auskünfte erteilt Ihnen Ihr Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin.
Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Striverdi Respimat enthalten?
Ein Hub Striverdi Respimat Inhalator enthält 2,5 µg Olodaterol.
Wirkstoffe
Olodaterol.
Hilfsstoffe
Benzalkonium chlorid (0.0011 mg bei jedem Hub), Natriumedetat, Zitronensäure, Wasser.
Zulassungsnummer
67399 (Swissmedic).
Wo erhalten Sie Striverdi Respimat? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Einzelpackung: 1 wiederverwendbarer Respimat Inhalator und 1 Patrone; entspricht 60 Hüben (30 therapeutische Dosen).
Dreifachpackung: 1 wiederverwendbarer Respimat Inhalator und 3 Patronen mit 60 Hüben (90 therapeutische Dosen).
Zulassungsinhaberin
Boehringer Ingelheim (Schweiz) GmbH, Basel
Diese Packungsbeilage wurde im März 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Gebrauchsanweisung
Striverdi® Respimat® Inhalator, wiederverwendbar (Olodaterol)
Einführung
Bitte lesen Sie die Gebrauchsanweisung, bevor Sie den Striverdi Respimat benutzen.
Sie brauchen den Inhalator nur EINMAL TÄGLICH (jeweils 2 Hübe) anzuwenden.

- Wenn Sie den Inhalator länger als 7 Tage nicht benutzt haben, müssen Sie zunächst einen Sprühstoss in Richtung Boden abgeben.
- Wenn Sie ihn länger als 21 Tage nicht benutzt haben, müssen Sie die unter «Vorbereitung für die erste Anwendung» beschriebenen Schritte 4 bis 6 erneut ausführen, bis eine sichtbare Sprühwolke austritt. Wiederholen Sie dann die Schritte 4 bis 6 noch drei weitere Male.
Wie ist Ihr Striverdi Respimat zu pflegen?
Reinigen Sie das Mundstück einschliesslich des Metallteils im Inneren des Mundstücks mindestens einmal wöchentlich. Verwenden Sie dazu nur ein feuchtes Tuch oder Papiertuch.
Eine leichte Verfärbung des Mundstücks hat keine Auswirkungen auf die Funktionsfähigkeit des Striverdi Respimat Inhalators.
Falls erforderlich, kann die Aussenseite des Striverdi Respimat Inhalator mit einem feuchten Tuch abgewischt werden.
Ersatz des Inhalators
Besorgen Sie eine neue Packung Striverdi Respimat mit Inhalator, wenn Sie einen Inhalator für 3 Patronen verwendet haben

Vorbereitung für die erste Anwendung
1. Durchsichtiges Gehäuseunterteil entfernen
|
|
2. Patrone einsetzen
|
|
3. Patronen nachverfolgen
|
|
4. Drehen
|
|
5. Öffnen
|
|
6. Auslösen
Der Inhalator ist nun für die Anwendung bereit |
|
Tägliche Anwendung
DREHEN
|
|
ÖFFNEN
|
|
AUSLÖSEN
|
|
Wann ist die STRIVERDI RESPIMAT Patrone zu ersetzen?
Der Dosisindikator zeigt an, wie viele Hübe noch in der Patrone sind.
| Noch 60 Hübe |
| Weniger als 10 Hübe. Besorgen Sie eine neue Patrone. |
| Ihre Patrone ist leer. Drehen Sie das durchsichtige Gehäuseunterteil, um es abzunehmen. Der Inhalator befindet sich nun in einer Sperrstellung. Ziehen Sie die Patrone aus dem Inhalator. Setzen Sie eine neue Patrone ein (weiter mit Schritt 2 der Vorbereitung zur ersten Anwendung). |
Antworten auf häufige Fragen
Die Patrone lässt sich nicht tief genug in das Gehäuse einsetzen.
Haben Sie vor dem Einsetzen der Patrone aus Versehen das durchsichtige Gehäuseunterteil gedreht? Öffnen Sie die Schutzkappe, drücken Sie den Auslöser und setzen Sie dann die Patrone ein.
Wechseln Sie gerade die Patrone? Die neue Patrone wird weiter herausragen als die erste Patrone. Schieben Sie die Patrone in das Gehäuse bis sie einrastet und stecken Sie anschliessend das durchsichtige Gehäuseunterteil wieder auf.
Der Auslöser lässt sich nicht drücken.
Haben Sie das durchsichtige Gehäuseunterteil gedreht? Falls nicht, drehen Sie das durchsichtige Gehäuseunterteil in einer gleichmässigen Bewegung bis es einrastet (eine halbe Drehung).
Zeigt der Dosisanzeiger auf der Patrone einen weissen Pfeil auf rotem Hintergrund? Ihre Patrone ist leer. Setzen Sie eine neue Patrone ein.
Die leere Patrone lässt sich nicht entfernen.
Ziehen Sie an der Patrone und drehen Sie gleichzeitig.
Das durchsichtige Gehäuseunterteil lässt sich weder drehen noch abnehmen.
Haben Sie das durchsichtige Gehäuseunterteil schon gedreht?
Wenn Sie das durchsichtige Gehäuseunterteil schon gedreht haben, folgen Sie den Anweisungen «ÖFFNEN» und «AUSLÖSEN» unter der Überschrift «Tägliche Anwendung», um Ihr Medikament einzunehmen.
Ist das durchsichtige Gehäuseunterteil locker und zeigt der Dosisanzeiger auf der Patrone einen weissen Pfeil auf rotem Hintergrund? Ihre Patrone ist leer. Setzen Sie eine neue Patrone ein.
Mein STRIVERDI RESPIMAT Inhalator war zu schnell leer.
Haben Sie den Respimat wie vorgesehen angewendet (zwei Hübe einmal täglich)? Bei zwei Hüben einmal täglich reicht der Respimat 30 Tage lang.
Haben Sie öfter in die Luft gesprüht, um die Funktionsfähigkeit des Respimat zu testen? Sobald Sie den Respimat für die erste Anwendung vorbereitet haben, ist bei täglicher Anwendung kein weiterer Sprühtest nötig.
Mein STRIVERDI RESPIMAT sprüht nicht.
Haben Sie eine Patrone eingesetzt? Falls nicht, setzen Sie eine Patrone ein. Nach dem Zusammensetzen des Respimat dürfen das durchsichtige Gehäuseunterteil und die Patrone nicht mehr entfernt werden, bis die Patrone leer ist.
Haben Sie nach dem Einsetzen der Patrone die Schritte DREHEN, ÖFFEN, AUSLÖSEN weniger als drei Mal wiederholt? Wiederholen Sie die Schritte DREHEN, ÖFFEN, AUSLÖSEN nach dem Einsetzen der Patrone drei Mal, wie oben in den Schritten 4 bis 6 unter der Überschrift «Vorbereitung für die erste Anwendung» angegeben.
Zeigt der Dosisanzeiger auf der Patrone einen weissen Pfeil auf rotem Hintergrund? Ihre Patrone ist leer. Setzen Sie eine neue Patrone ein.
Mein STRIVERDI Respimat sprüht von allein.
War die Schutzkappe offen, als Sie das durchsichtige Gehäuseunterteil gedreht haben? Schliessen Sie erst die Schutzkappe und drehen Sie dann das durchsichtige Gehäuseunterteil.
Haben Sie auf den Auslöser gedrückt, während Sie das durchsichtige Gehäuseunterteil gedreht haben? Schliessen Sie die Schutzkappe, sodass der Auslöser verdeckt ist, und drehen Sie dann das durchsichtige Gehäuseunterteil.
Haben Sie das durchsichtige Gehäuseunterteil nicht bis zum Einrasten gedreht? Drehen Sie das durchsichtige Gehäuseunterteil in einer gleichmässigen Bewegung bis es einrastet (eine halbe Drehung).
War die Schutzkappe offen, als Sie die Patrone ausgetauscht haben? Schliessen Sie erst die Schutzkappe und tauschen Sie dann die Patrone aus.
Boehringer Ingelheim (Schweiz) GmbH, Basel

Qu’est-ce que Striverdi Respimat et quand doit-il être utilisé?
Striverdi Respimat contient le principe actif oladotérol et appartient au groupe de médicaments appelés bronchodilatateurs.
Striverdi Respimat est utilisé une fois par jour chez les patients atteints de maladie pulmonaire obstructive chronique (BPCO). Striverdi Respimat facilite la respiration.
Il est utilisé avec l'inhalateur Respimat contenu dans cet emballage.
Il est utilisé sur prescription médicale.
Quand Striverdi Respimat ne doit-il pas être utilisé?
Striverdi Respimat ne doit pas être utilisé en cas d'hypersensibilité à l'olodatérol ou à l'un des constituants.
Enfants et adolescents
Striverdi Respimat ne doit pas être administré à des enfants et adolescents (moins de 18 ans).
Quelles sont les précautions à observer lors de l’utilisation de Striverdi Respimat?
Veuillez respecter scrupuleusement toutes les instructions de votre médecin.
Striverdi Respimat contient du chlorhure de benzalkonium, ce composant peut provoquer une respiration haletante et des difficultés respiratoires (bronchospasme – rétrécissement spasmodique des voies respiratoires).
Informez impérativement votre médecin avant d'utiliser Striverdi Respimat, si l'un des points suivants vous concerne:
- si vous êtes asmathique (si tel est le cas, vous ne pouvez pas être traité par Striverdi Respimat);
- si vous avez des problèmes cardiaques;
- si vous avez une tension élevée;
- si vous souffrez d'épilepsie;
- si vous avez des problèmes de glande thyroïde;
- si vous souffrez de diabète;
- si vous souffrez d'une autre maladie, si vous êtes allergique, si vous prenez déjà d'autres médicaments en usage interne ou externe (même en automédication!).
Informez immédiatement votre médecin si vous constatez l'apparition de l'un des symptômes suivants lors de l'utilisation de Striverdi Respimat:
- si vous ressentez une oppression, si vous toussez, avez une respiration sifflante ou une détresse respiratoire. Les troubles cités peuvent être un signe de contraction des muscles bronchiques, appelée bronchospasme;
- si les symptômes de votre maladie (essoufflement, respiration sifflante, toux) ne s'améliorent pas ou s'aggravent pendant votre traitement;
- si vous constatez une éruption cutanée, des gonflements ou irritations immédiatement après l'utilisation de l'inhalateur;
- si vous constatez n'importe quel effet indésirable cardiaque (accélération du rythme cardiaque, augmentation de la tension et/ou aggravation des symptômes tels que douleurs thoraciques);
- si vous ressentez des crampes musculaires, de la faiblesse musculaire ou des troubles du rythme cardiaque (ces troubles peuvent être causés par un taux de potassium trop bas dans le sang).
Utilisation de Striverdi Respimat avec d'autres médicaments
Informez votre médecin ou votre pharmacien si vous utilisez ou avez utilisé récemment d'autres médicaments (même en automédication!). Les médicaments suivants sont particulièrement concernés:
- Médicaments utilisés pour traiter la dépression (antidépresseurs tricycliques, inhibiteurs de monoamine-oxydase, p. ex.).
- Autres médicaments pour le traitement de votre maladie pulmonaire (leur utilisation pourrait accroître le risque d'effets secondaires éventuels).
- Médicaments qui réduisent le taux de potassium dans le sang. Les «diurétiques» en font partie (utilisés également pour le traitement de l'hypertension).
- Bêtabloquants pour le traitement de l'hypertension ou d'autres problèmes cardiaques ou du glaucome.
- Médicaments utilisés pour le traitement des troubles du rythme cardiaque.
- Certains médicaments utilisés pour le traitement des infections (antibiotiques).
- Certains médicaments contre l'allergie et le rhume des foins.
Capacité à conduire et à utiliser des machines
Si vous ressentez des vertiges pendant votre traitement par Striverdi Respimat, vous ne devez pas conduire ou utiliser des machines.
Striverdi Respimat peut-il être utilisé pendant la grossesse ou l’allaitement?
Si vous êtes enceinte ou pensez l'être, ou bien si vous allaitez, vous ne devez pas utiliser ce médicament sauf s'il vous a été spécifiquement recommandé par votre médecin.
Comment utiliser Striverdi Respimat?
Veuillez respecter scrupuleusement les instructions de votre médecin.
Généralement, on inhale deux bouffées une fois par jour, si possible toujours à la même heure.
Striverdi Respimat est destiné à être administré uniquement par inhalation.
La BPCO est une maladie chronique. Utilisez par conséquent Striverdi Respimat tous les jours, c'est-à-dire pas seulement si vous souffrez de difficultés respiratoires. N'inhalez pas plus que la dose recommandée.
Lisez attentivement le mode d'emploi avant d'utiliser pour la première fois l'inhalateur Striverdi Respimat de sorte à utiliser correctement le Respimat. (Voir mode d'emploi de l'inhalateur Respimat).
Si vous avez utilisé plus de Striverdi Respimat que vous n'auriez dû:
Si vous avez inhalé trop de Striverdi Respimat, ou si une autre personne a inhalé votre médicament par mégarde, consultez immédiatement votre médecin ou un hôpital. Montrez l'emballage de Striverdi Respimat. Une aide médicale est probablement nécessaire.
Si vous oubliez d'utiliser Striverdi Respimat
Si vous avez oublié d'inhaler une dose, poursuivez le traitement par l'inhalation de la dose suivante le lendemain à l'heure habituelle, mais n'inhalez pas deux doses en même temps ou au cours de la même journée pour compenser la dose oubliée.
La durée du traitement par Striverdi Respimat est fixée par votre médecin. N'arrêtez pas d'utiliser Striverdi Respimat sans l'avis de votre médecin, étant donné que les signes et symptômes de votre maladie peuvent s'aggraver.
L'utilisation et la sécurité de Striverdi Respimat chez les enfants et les adolescents de moins de 18 ans n'ont pas été étudiées jusqu'à présent. Par conséquent, ce médicament ne doit pas être utilisé par ces personnes.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Striverdi Respimat peut-il provoquer?
L’utilisation de Striverdi Respimat peut provoquer les effets secondaires suivants:
Occasionnellement (peuvent survenir chez 1 à 10 patients sur 1 000)
- Écoulement nasal
- Vertiges
- Éruption cutanée
Rarement (peuvent survenir chez 1 à 10 patients sur 10'000)
- Douleurs articulaires
Très rares (peuvent survenir chez moins de 1 patient sur 10'000)
Cas isolés
- Tension élevée
Autres effets secondaires possibles:
Accélération du pouls, troubles du rythme cardiaque, palpitations ou éventuellement autres troubles cardiaques, modifications de la tension artérielle, tremblements, maux de tête, nervosité, insomnie, sécheresse buccale, nausées, crampes musculaires, fatigue, malaise.
Si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention?
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Délai d’utlisation après ouverture
Une fois entamé, l’inhalateur Striverdi Respimat doit être utilisé dans un délai de 3 mois.
Recommandation d’entreposage
Ne pas congeler.
Conserver hors de portée des enfants.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui dispose d’une information détaillée destinée aux professionnels.
Que contient Striverdi Respimat?
1 bouffée contient 2,5 microgrammes d’olodatérol.
Principe actif
Olodatérol.
Excipients
Chlorure de benzalkonium (0,0011 mg par bouffée), édétate disodique, acide citrique, eau.
Numéro d'autorisation
67399 (Swissmedic).
Où obtenez-vous Striverdi Respimat ? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Emballage individuel: 1 inhalateur Respimat réutilisable et 1 cartouche; correspond à 60 bouffées (30 doses thérapeutiques).
Emballage triple: 1 inhalateur Respimat réutilisable et 3 cartouches avec 60 bouffées (90 doses thérapeutiques).
Titulaire de l’autorisation
Boehringer Ingelheim (Suisse) GmbH, Bâle.
Cette notice d'emballage a été vérifiée pour la dernière fois en mars 2020 par l'autorité de contrôle des médicaments (Swissmedic).
Mode d’emploi
Inhalateur Striverdi® Respimat® réutilisable (olodatérol)
Introduction
Veuillez lire le mode d’emploi avant d’utiliser Striverdi Respimat.
Cet inhalateur ne doit être utilisé qu’UNE FOIS PAR JOUR (2 bouffées d’aérosol à chaque fois).

- Si l’inhalateur n’a pas été utilisé depuis plus de 7 jours, vous devez d’abord vaporiser une bouffée contre le sol.
- Si vous ne l’avez pas utilisé depuis plus de 21 jours, vous devez répéter les étapes 4 à 6 décrites sous «Préparation de la première utilisation» jusqu’à la vaporisation d’un nuage visible. Répétez ensuite à trois reprises les étapes 4 à 6.
Comment entretenir le Striverdi Respimat?
Nettoyez l’embout buccal, y compris la partie métallique interne, au moins une fois par semaine et uniquement avec un chiffon humide ou un mouchoir en papier.
Une légère décoloration de l’embout buccal n’a pas d’incidence sur le bon fonctionnement de l’inhalateur Striverdi Respimat.
Si nécessaire, la face extérieure de l’inhalateur Striverdi Respimat peut être essuyée avec un chiffon humide.
Remplacement de l’inhalateur
Procurez-vous un nouvel emballage Striverdi Respimat avec inhalateur quand vous avez utilisé un inhalateur pour 3 cartouches.

Préparation de la première utilisation
1. Retirer la base transparente
|
|
2. Introduire la cartouche
|
|
3. Assurer le suivi des cartouches
|
|
4. Tourner
|
|
5. Ouvrir
|
|
6. Déclencher
L’inhalateur est maintenant prêt à être utilisé. |
|
Utilisation quotidienne
TOURNER
|
|
OUVRIR
|
|
DÉCLENCHER
|
|
Quand la cartouche du STRIVERDI RESPIMAT doit-elle être remplacée?
L’indicateur de doses montre le nombre de bouffées que la cartouche contient encore.
| Encore 60 bouffées |
| Moins de 10 bouffées. Procurez-vous une nouvelle cartouche. |
| Votre cartouche est vide. Tournez la base transparente pour la retirer. L’inhalateur est maintenant en position de blocage. Retirez la cartouche de l’inhalateur. Introduisez une nouvelle cartouche (continuez en passant à l’étape 2 de la préparation de la première utilisation). |
Réponses aux questions fréquentes
Il n’est pas possible d’enfoncer la cartouche assez profondément.
Avez-vous tourné la base transparente accidentellement avant d’introduire la cartouche? Ouvrez le capuchon de protection, appuyez sur le bouton de libération de la dose et introduisez ensuite la cartouche.
Est-ce que vous êtes en train de changer la cartouche? La nouvelle cartouche va dépasser davantage que la première. Enfoncez la cartouche dans le boîtier jusqu’à l’enclenchement et enfichez ensuite la base transparente de nouveau.
Le bouton de libération de la dose ne peut pas être enfoncé.
Avez-vous tourné la base transparente? Si tel n’est pas le cas, faites tourner la base transparente d’un mouvement continu jusqu’à entendre le déclic (un demi-tour).
Est-ce que l’indicateur de doses de la cartouche est dirigé sur une flèche blanche sur fond rouge? Votre cartouche est vide. Introduisez une nouvelle cartouche.
Il n’est pas possible de retirer la cartouche vide.
Tirez sur la cartouche en tournant en même temps.
La base transparente ne tourne pas et il n’est pas possible de la retirer.
Avez-vous déjà tourné la base transparente?
Si la base transparente a déjà été tournée, suivez les étapes «OUVRIR» et «DÉCLENCHER» décrites sous «Utilisation quotidienne» pour administrer le médicament.
La base transparente est-elle desserrée et l’indicateur de doses de la cartouche est-il dirigé sur une flèche blanche sur fond rouge? Votre cartouche est vide. Introduisez une nouvelle cartouche.
Mon inhalateur STRIVERDI RESPIMAT se vide trop rapidement.
Est-ce que le Respimat a été utilisé comme indiqué (deux bouffées une fois par jour)? Le Respimat contient une quantité suffisante pour 30 jours à raison de deux bouffées une fois par jour.
Est-ce que vous avez fréquemment vaporisé dans l’air pour vérifier si le Respimat fonctionne? En cas d’utilisation quotidienne, des vaporisations de bouffées-tests ne sont plus nécessaires après la préparation du Respimat pour la première utilisation.
Mon STRIVERDI RESPIMAT ne vaporise pas.
Est-ce que vous avez introduit une cartouche? Si tel n’est pas le cas, introduisez une cartouche. Après l’assemblage du Respimat, ne retirez plus la base transparente ni la cartouche jusqu’à ce qu’elle soit vide.
Avez-vous répété les étapes TOURNER, OUVRIR et DÉCLENCHER moins de trois fois après l’introduction de la cartouche? Répétez trois fois les étapes TOURNER, OUVRIR et DÉCLENCHER après l’introduction de la cartouche tel qu’il est indiqué plus haut aux étapes 4 à 6 sous «Préparation de la première utilisation».
Est-ce que l’indicateur de doses de la cartouche est dirigé sur une flèche blanche sur fond rouge? Votre cartouche est vide. Introduisez une nouvelle cartouche.
Mon STRIVERDI RESPIMAT vaporise automatiquement.
Est-ce que le capuchon de protection était ouvert lorsque vous avez tourné la base transparente? Refermez le capuchon de protection avant de tourner la base transparente.
Est-ce que vous avez appuyé sur le bouton de libération de la dose en tournant la base transparente? Refermez d’abord le capuchon de protection de telle sorte que le bouton de libération de la dose soit recouvert, puis tournez la base transparente.
Est-ce que la base transparente n’a pas été tournée jusqu’à la position d’enclenchement? Faites tourner la base transparente d’un mouvement continu jusqu’à entendre le déclic (un demi-tour).
Est-ce que le capuchon de protection était ouvert quand vous avez remplacé la cartouche? Fermez d’abord le capuchon de protection et remplacez ensuite la cartouche.
Boehringer Ingelheim (Schweiz) GmbH, Basel
CE0123
Che cos’è Striverdi Respimat e quando si usa?
Striverdi Respimat contiene il principio attivo olodaterolo e appartiene a un gruppo di medicamenti chiamati broncodilatatori.
Striverdi Respimat viene utilizzato una volta al giorno nei pazienti affetti da broncopneumopatia cronica ostruttiva (BPCO). Striverdi Respimat facilita la respirazione.
Si usa con l'inalatore Respimat contenuto in questa confezione.
Su prescrizione medica.
Quando non si può usare Striverdi Respimat?
Non si può inalare Striverdi Respimat in caso di ipersensibilità all'olodaterolo o ad una delle sostanze ausiliarie.
Bambini e adolescenti
Striverdi Respimat non deve essere somministrato a bambini o adolescenti di età inferiore a 18 anni.
Quando è richiesta prudenza nell’uso di Striverdi Respimat?
Segua scrupolosamente le indicazioni del suo medico.
Striverdi Respimat contiene bezalconio cloruro. Questo componente può causare respiro affannoso e difficoltà respiratorie (broncospasmi – restringimenti delle vie respiratorie dovuti a spasmo muscolare).
Informi assolutamente il suo medico prima di usare Striverdi Respimat, nel caso in cui:
- è asmatico (in questo caso non deve essere sottoposto a trattamento con Striverdi Respimat);
- ha problemi di cuore;
- ha la pressione arteriosa alta;
- soffre di epilessia;
- ha problemi alla tiroide;
- soffre di diabete;
- soffre di altre patologie, ha allergie o assume altri medicamenti (anche se acquistati di sua iniziativa) o li applica esternamente.
Informi subito il suo medico se durante il trattamento con Striverdi Respimat osserva uno dei seguenti sintomi:
- se immediatamente dopo l'inalazione avverte una sensazione di oppressione al petto, se tossisce, se ha il respiro affannoso o il fiato corto. Questi disturbi possono essere segni di uno spasmo della muscolatura dei bronchi, chiamato broncospasmo;
- se i sintomi della malattia (fiato corto, respiro affannoso, tosse) non migliorano o peggiorano durante il trattamento;
- se subito dopo l'utilizzo dell'inalatore si manifestano eruzione cutanea, gonfiori o prurito;
- se osserva un qualsiasi effetto collaterale che interessa il cuore (accelerazione del battito cardiaco, aumento della pressione arteriosa e/o peggioramento dei sintomi come i dolori al petto);
- se si manifestano crampi o debolezza muscolare oppure disturbi del ritmo cardiaco (questi disturbi possono essere causati da un livello basso di potassio nel sangue).
Uso di Striverdi Respimat insieme ad altri medicamenti
Informi il suo medico o il suo farmacista se sta assumendo o ha recentemente assunto altri medicamenti (anche se acquistati di sua iniziativa) . In particolare i seguenti medicamenti:
- medicamenti per il trattamento delle depressioni (per es. i cosiddetti antidepressivi triciclici, gli inibitori delle monoaminossidasi).
- altri medicamenti, che sta assumendo per il trattamento della sua malattia polmonare (il cui uso potrebbe aumentare il rischio di possibili effetti collaterali).
- medicamenti che abbassano il livello di potassio nel sangue. Tra questi vi sono i diuretici (usati anche per il trattamento della pressione arteriosa alta).
- i betabloccanti per il trattamento della pressione arteriosa alta o altri problemi di cuore o per il trattamento del glaucoma.
- medicamenti per il trattamento dei disturbi del ritmo cardiaco.
- alcuni medicamenti per il trattamento delle infezioni (antibiotici).
- alcuni medicamenti per le allergie e il raffreddore da fieno.
Capacità di guidare veicoli e usare macchinari
Se avverte dei capogiri durante il trattamento con Striverdi Respimat, non deve guidare veicoli oppure usare apparecchi o macchinari.
Si può assumere Striverdi Respimat durante la gravidanza o l’allattamento?
Se è incinta o sospetta didi essere incinta o se allatta, chieda consiglio al suo medico prima di usare Striverdi Respimat.
Come usare Striverdi Respimat?
Segua scrupolosamente le indicazioni del medico.
Di solito si inalano due nebulizzazioni una volta al giorno, possibilmente sempre alla stessa ora.
Si usa Striverdi Respimat esclusivamente per via inalatoria.
La BPCO è una malattia cronica. Usi quindi Striverdi Respimat tutti i giorni, cioè non solo quando ha problemi di respirazione. Non inali una dose maggiore di quella consigliata.
Legga attentamente le istruzioni prima del primo uso dell'inalatore Striverdi Respimat per utilizzare correttamente Respimat. (Leggere le istruzioni per l'uso dell'inalatore Respimat).
Se ha usato più Striverdi Respimat di quanto deve
Se ha inalato troppo Striverdi Respimat o se un'altra persona per sbaglio ha usato il suo medicamento, si rivolga subito a un medico o a un ospedale. Mostri la confezione di Striverdi Respimat. È possibile che sia necessario l'intervento di un medico.
Se dimentica di usare Striverdi Respimat
Se ha dimenticato di inalare una dose, prosegua il trattamento semplicemente con l'inalazione della dose successiva all'ora consueta il giorno successivo. Non inali una dose doppia per compensare la dose dimenticata.
Spetta al suo medico stabilire la durata del trattamento con Striverdi Respimat. Non interrompa l'uso di Striverdi Respimat senza aver consultato il suo medico, poiché i segni e i sintomi della sua malattia possono peggiorare.
L'uso e la sicurezza di Striverdi Respimat nei bambini e negli adolescenti sotto i 18 anni finora non sono stati esaminati, quindi il medicamento non deve essere utilizzato in questa fascia di età.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte, ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere Striverdi Respimat?
Striverdi Respimat può causare i seguenti effetti collaterali:
Non comune (riguarda da 1 a 10 utilizzatori su 1'000)
- naso che cola
- vertigini
- eruzione cutanea
Raro (riguarda da 1 a 10 utilizzatori su 10'000)
- dolori articolari
Molto raro (riguarda meno di 1 utilizzatore su 10'000)
Casi isolati
- pressione arteriosa alta
Altri possibili effetti collaterali sono:
accelerazione del polso, disturbi del ritmo cardiaco, batticuore o eventualmente altri disturbi cardiaci, variazioni della pressione arteriosa, tremore, mal di testa, nervosismo, insonnia, secchezza della bocca, nausea, crampi muscolari, stanchezza, sensazione di malessere generalizzato.
Se ciononostante osserva effetti collaterali, dovrebbe informare il suo medico o il suo farmacista.
Di che altro occorre tener conto?
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Termine di consumo dopo l'apertura
Utilizzare l'inalatore Striverdi Respimat entro 3 mesi dall'inserimento della cartuccia
Indicazione di stoccaggio
Non congelare.
Conservare fuori dalla portata dei bambini.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Striverdi Respimat?
La dose rilasciata è di 2,5 microgrammi di olodaterolo per erogazione.
Principi attivi
Olodaterolo.
Sostanze ausiliarie
benzalconio cloruro (0,0011 mg per erogazione) disosio edetato, acido citrico e acqua.
Numero dell’omologazione
67399 (Swissmedic).
Dove è ottenibile Striverdi Respimat? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Confezioni singole: 1 inalatore Respimat riutilizzabile e 1 cartuccia da 60 nebulizzazioni (30 dosi terapeutiche)
Confezione tripla: 1 inalatore Respimat riutilizzabile e 3 cartucce da 60 nebulizzazioni (90 dosi terapeutiche)
Titolare dell’omologazione
Boehringer Ingelheim (Svizzera) GmbH, Basel
Questo foglietto illustrativo è stato controllato l'ultima volta nel marzo 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
Istruzioni per l’uso
Inalatore Striverdi ® Respimat® riutilizzabile (olodaterolo)
Introduzione
Legga le istruzioni per l’uso prima di utilizzare Striverdi Respimat.
L’inalatore deve essere utilizzato solo UNA VOLTA AL GIORNO (due nebulizzazioni per volta).

- Se l’inalatore non viene utilizzato da più di 7 giorni, erogare innanzitutto una nebulizzazione verso terra.
- Se l’inalatore non viene utilizzato da più di 21 giorni, ripetere di nuovo le fasi da 4 a 6 descritte in “Preparazione per l’utilizzo” finché non è visibile una nebulizzazione. Ripetere quindi ancora tre volte le fasi da 4 a 6.
Pulizia dell’inalatore Striverdi Respimat
Pulire il boccaglio e la parte in metallo al suo interno almeno una volta alla settimana utilizzando esclusivamente un panno o un panno carta umido.
Un lieve cambiamento di colore del boccaglio non influisce sulla funzionalità dell’inalatore Striverdi Respimat.
Se necessario, è possibile pulire la superficie esterna dell’inalatore Striverdi Respimat passandovi un panno umido.
Sostituzione dell'inalatore
Procurarsi una nuova confezione di Striverdi Respimat con inalatore dopo avere utilizzato un inalatore con 3 cartucce.


Preparazione per l’utilizzo
1. Rimozione della base trasparente
|
|
2. Inserimento della cartuccia
|
|
3. Controllo delle cartucce utilizzate
|
|
4. Rotazione
|
|
5. Apertura
|
|
6. Erogazione
L’inalatore è ora pronto per l’applicazione. |
|
Utilizzo quotidiano
ROTAZIONE
|
|
APERTURA
|
|
EROGAZIONE
|
|
Quando si deve sostituire la cartuccia STRIVERDI RESPIMAT?
L'indicatore della dose mostra quante nebulizzazioni erogazioni sono ancora presenti nella cartuccia.
 | Ancora 60 erogazioni |
 | Meno di 10 erogazioni. Procurarsi una nuova cartuccia. |
 | La cartuccia è vuota. Ruotare la base trasparente per estrarla. L'inalatore è ora bloccato. Estrarre la cartuccia dall'inalatore e inserire una nuova cartuccia (continuare con il punto 2 della sezione «Preparazione per il primo utilizzo»). |
Risposte a domande frequenti
L'inserimento in profondità della cartuccia incontra resistenza.
È stata inavvertitamente ruotata la base trasparente prima di inserire la cartuccia? Aprire il cappuccio, premere il bottone di erogazione della dose, poi inserire la cartuccia.
Si sta sostituendo la cartuccia? La nuova cartuccia sporge oltre la prima cartuccia. Inserire la cartuccia nell'alloggiamento fino allo scatto, quindi applicare di nuovo la base trasparente.
Il bottone di erogazione della dose non si preme.
È stata ruotata la base trasparente? Se non è così, ruotare la base trasparente con un movimento continuo finché non scatta in posizione (mezzo giro).
L'indicatore della dose presente sulla cartuccia mostra una freccia bianca su sfondo rosso? La cartuccia è vuota. Inserire una nuova cartuccia.
Non è possibile estrarre la cartuccia vuota.
Tirare e ruotare contemporaneamente la cartuccia.
Non è possibile estrarre la base trasparente neppure dopo la rotazione. È già stata ruotata la base trasparente?Se la base trasparente è già stata ruotata, eseguire le fasi «APERTURA» e «EROGAZIONE» descritte nella sezione «Utilizzo quotidiano» per somministrare il medicamento.
La base trasparente è allentata e l'indicatore della dose presente sulla cartuccia mostra una freccia bianca su sfondo rosso? La cartuccia è vuota. Inserire una nuova cartuccia.
L'inalatore STRIVERDI RESPIMAT si svuota troppo rapidamente.
L'inalatore Respimat è stato utilizzato come indicato (due nebulizzazioni/una volta al giorno)? L'inalatore Respimat ha una durata di 30 giorni se si somministrano due nebulizzazioni una volta al giorno.
Si è spruzzato spesso a vuoto per verificare se l'inalatore Respimat funziona?
Dopo aver preparato l'inalatore Respimat non è più necessario effettuare prove di nebulizzazione nell'uso quotidiano.
L'inalatore STRIVERDI RESPIMAT non esegue l'erogazione. È stata inserita una cartuccia?Se non è così, inserire una cartuccia. Dopo avere montato il Respimat, non rimuovere più la base trasparente e la cartuccia fino a quando la cartuccia è vuota.
Dopo l'inserimento della cartuccia, le fasi ROTAZIONE, APERTURA ed EROGAZIONE sono state ripetute meno di tre volte?
Ripetere tre volte le fasi ROTAZIONE, APERTURA ed EROGAZIONE dopo l'inserimento della cartuccia, come descritto nei punti da 4 a 6 nella sezione «Utilizzo quotidiano».
L'indicatore della dose presente sulla cartuccia mostra una freccia bianca su sfondo rosso? La cartuccia è vuota. Inserire una nuova cartuccia.
L'inalatore Striverdi Respimat esegue l'erogazione in automatico.
Il cappuccio era aperto quando è stata ruotata la base trasparente? Chiudere il cappuccio prima di ruotare la base trasparente.
È stato premuto il bottone di erogazione della dose durante la rotazione della base trasparente? Chiudere il cappuccio in modo che il bottone di erogazione della dose sia coperto, poi ruotare la base trasparente.
La base trasparente non è stata ruotata fino alla posizione di scatto? Ruotare la base trasparente con un movimento continuo finché non scatta in posizione (mezzo giro).
Il cappuccio era aperto quando è stata sostituita la cartuccia? Chiudere il cappuccio prima di sostituire la cartuccia.
Boehringer Ingelheim (Schweiz) GmbH, Basel

Zusammensetzung
Wirkstoffe
Olodaterolum (ut Olodateroli hydrochloridum).
Hilfsstoffe
Benzalkonium chlorid (0.0011 mg bei jedem Hub), Calciumdinatriumedetat, Zitronensäure, Wasser.
Darreichungsform und Wirkstoffmenge pro Einheit
Lösung zur Inhalation.
Pro Hub werden 2,5 Mikrogramm Olodaterol abgegeben; eine Dosis umfasst zwei Hübe.
Indikationen/Anwendungsmöglichkeiten
Striverdi Respimat ist ein Bronchodilator für die symptomatische Dauertherapie bei Patienten mit COPD (chronisch obstruktive Atemwegserkrankung).
Dosierung/Anwendung
Übliche Dosierung
Die empfohlene Dosis für Erwachsene beträgt 5 mcg Olodaterol. Dies entspricht zwei Sprühstössen aus dem Respimat-Inhalator, die einmal täglich jeweils zur gleichen Tageszeit verabreicht werden.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Patienten mit leichter und mittelgradiger Einschränkung der Leberfunktion können Striverdi Respimat in der empfohlenen Dosierung anwenden.
Zur Anwendung von Striverdi Respimat bei Patienten mit stark eingeschränkter Leberfunktion liegen keine Daten vor.
Patienten mit Nierenfunktionsstörungen
Patienten mit eingeschränkter Nierenfunktion können Striverdi Respimat in der empfohlenen Dosierung anwenden.
Eine genaue Gebrauchsanweisung zur Handhabung des Respimats liegt der Packung bei.
Ältere Patienten
Ältere Patienten können Striverdi Respimat in der empfohlenen Dosierung anwenden.
Kinder und Jugendliche
COPD ist eine Krankheit, die Kinder normalerweise nicht betrifft. Sicherheit und Wirksamkeit von Striverdi Respimat bei pädiatrischen Patienten wurden nicht untersucht.
Kontraindikationen
Die Anwendung von Striverdi Respimat ist bei Patienten mit Überempfindlichkeit gegen Olodaterol oder einen der sonstigen Bestandteile des Arzneimittels kontraindiziert.
Warnhinweise und Vorsichtsmassnahmen
Striverdi Respimat enthält Benzalkoniumchlorid, dieser Bestandteil kann keuchende Atmung und Atemschwierigkeiten (Bronchospasmen - krampfartige Verengungen der Atemwege) hervorrufen, insbesondere, wenn Sie an Asthma leiden. |
Asthma
Bei Asthma darf Striverdi Respimat nicht angewendet werden. Die langfristige Wirksamkeit und Sicherheit von Olodaterol bei Asthma wurde nicht untersucht.
Akuter Bronchospasmus
Striverdi Respimat ist zur Behandlung akuter Bronchospasmus-Episoden, d.h. als Notfalltherapie, nicht angezeigt.
Überempfindlichkeit
Wie bei allen Arzneimitteln können nach der Anwendung von Striverdi Respimat Überempfindlichkeitsreaktionen vom Soforttyp auftreten.
Paradoxer Bronchospasmus
Wie bei anderen inhalierten Arzneimitteln kann es auch bei Striverdi Respimat zu einem paradoxen Bronchospasmus kommen, der lebensbedrohlich sein kann. Im Falle eines paradoxen Bronchospasmus muss Striverdi Respimat sofort abgesetzt und durch eine alternative Therapie ersetzt werden.
Systemische Wirkungen
Bei der Behandlung von Patienten mit kardiovaskulären Erkrankungen mit langwirkenden Beta2-Agonisten ist Vorsicht geboten. Dies gilt besonders für Patienten mit Koronarinsuffizienz, Herzrhythmusstörungen, hypertropher obstruktiver Kardiomyopathie und Hypertonie sowie für Patienten mit Anfallsleiden oder Thyreotoxikose, Patienten mit bekannter oder vermuteter Verlängerung des QT-Intervalls sowie für Patienten, die aussergewöhnlich stark auf sympathomimetisch wirkende Amine ansprechen.
Patienten mit anamnetisch bekanntem Myokardinfarkt während des vorangegangenen Jahres, instabilen oder lebensbedrohlichen Herzrhythmusstörungen, stationärer Behandlung wegen Herzinsuffizienz während des vorangegangenen Jahres oder mit einer Diagnose für paroxysmale Tachykardie (>100 Schläge pro Minute) waren von der Teilnahme an den klinischen Studien ausgeschlossen. Daher sind die Erfahrungswerte für diese Patientengruppen begrenzt. Striverdi Respimat ist bei diesen Patientengruppen mit Vorsicht anzuwenden.
Kardiovaskuläre Wirkungen
Wie andere Beta2-Agonisten hat auch Olodaterol bei manchen Patienten eine klinisch relevante kardiovaskuläre Wirkung, die sich in einer erhöhten Pulsrate, einem Blutdruckanstieg und/oder entsprechenden Symptomen ausdrücken kann. Beim Auftreten derartiger Wirkungen muss die Behandlung möglicherweise abgebrochen werden. Zudem wurde über EKG-Veränderungen als Folge einer Behandlung mit Beta-Agonisten berichtet, z.B. in Form einer Abflachung der T-Welle und einer Senkung der ST-Strecke.
Vor der Verschreibung einer Dauerbehandlung mit einem Betaagonisten wie Striverdi Respimat sollten COPD-Patienten hinsichtlich kardiovaskulärer Begleiterkrankungen abgeklärt werden. Dabei empfiehlt sich auch die Durchführung einer EKG-Untersuchung mit Frage nach QTc-Verlängerung.
Hypokaliämie
Beta2-Agonisten führen bei manchen Patienten zu einer erheblichen Hypokaliämie, die unerwünschte kardiovaskuläre Wirkungen nach sich ziehen kann. Der Abfall des Kaliumspiegels im Serum ist in der Regel vorübergehend und macht keine Supplementierung erforderlich. Bei Patienten mit schwerer COPD kann die Hypokaliämie durch eine Hypoxie und eine Begleittherapie verstärkt werden (siehe «Interaktionen»), wodurch die Anfälligkeit für Herzrhythmusstörungen zunimmt.
Hyperglykämie
Als Folge der Inhalation von Beta2-Agonisten in hoher Dosierung kann der Blutzuckerspiegel ansteigen.
Striverdi Respimat darf nicht zusammen mit anderen Arzneimitteln angewendet werden, die langwirkende Beta2-Agonisten enthalten.
Patienten, die regelmässig kurzwirkende Beta2-Agonisten inhalieren (z.B. 4 x täglich), müssen darauf hingewiesen werden, dass sie diese nur zur Symptomlinderung bei akuten Atembeschwerden anwenden dürfen.
Bei Umstellung der Therapie auf eine andere Darreichungsform und/oder ein anderes Arzneimittel mit gleichem Wirkstoff ist Vorsicht geboten. Der Patient sollte adäquat kontrolliert werden.
Interaktionen
QTc-Intervall verlängernde Arzneimittel
Bei Patienten die mit Substanzen mit bekannter verlängernder Wirkung auf das QTc Intervall behandelt werden, kann Olodaterol wie auch andere Beta2-Agonisten das Risiko für ventrikuläre Arrhythmien erhöhen. Beispiele solcher Arzneimittel sind bestimmte Antihistaminika (z.B. Terfenadin, Mizolastin), gewissen Antiarrhythmika (z.B. Chinidin), Phenothiazine, Erythromycin, Ritonavir und trizyklische Antidepressiva. Die zusätzliche Verabreichung sympathikomimetischer Substanzen kann unerwünschte kardiovaskuläre Wirkungen verstärken. Wird Striverdi Respimat Patienten verabreicht, die unter Behandlung mit MAO-Hemmern oder trizyklischen Antidepressiva stehen, dann sollte dies mit Vorsicht geschehen, da die Wirkung von β2-Stimulatoren auf das kardiovaskuläre System verstärkt werden kann.
Sympathomimetika
Die gleichzeitige Verabreichung anderer adrenerger Wirkstoffe kann die unerwünschten Wirkungen von Striverdi Respimat verstärken.
Xanthin-Derivate, Steroide und Diuretika
Durch gleichzeitige Verabreichung von Xanthin-Derivaten, Steroiden oder nicht kaliumsparenden Diuretika kann eine etwaige hypokalämische Wirkung von adrenergen Agonisten verstärkt werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Betablocker
Betablocker schwächen die Wirkung von Striverdi Respimat ab oder heben sie auf. Striverdi Respimat sollte deshalb nur dann zusammen mit Betablockern (einschliesslich Augentropfen) verabreicht werden, wenn zwingende Gründe dafür vorliegen. In derartigen Fällen können kardioselektive Betablocker in Erwägung gezogen werden, bei deren Anwendung allerdings Vorsicht geboten ist.
MAO-Inhibitoren, trizyklische Antidepressiva, QTc-Intervall verlängernde Substanzen
Monoaminoxidase-Inhibitoren oder trizyklische Antidepressiva oder andere Substanzen mit bekannter, das QTc-Intervall verlängernder Wirkung verstärken die Wirkungen von Striverdi Respimat auf das Herz-Kreislauf-System.
Pharmakokinetische Interaktionen
In einer Arzneimittelinteraktionsstudie mit Anwendung des starken dualen CYP- und P-gp-Inhibitors Ketoconazol wurde eine Zunahme der systemischen Exposition um das 1,7-Fache beobachtet (siehe «Pharmakokinetik»). In klinischen Studien, in denen Striverdi Respimat über einen Zeitraum von bis zu einem Jahr in Dosen bis zur doppelten Höhe der empfohlenen therapeutischen Dosis verabreicht wurde, waren keine Sicherheitsprobleme zu erkennen. Eine Dosisanpassung ist nicht erforderlich.
Wirkung anderer Arzneimittel auf Striverdi Respimat
Striverdi Respimat führt bei COPD-Patienten zu einer Bronchodilatation und kann so die pulmonale Aufnahme und systemische Verfügbarkeit eines nachfolgend inhalierten Wirkstoffes erhöhen. Wegen dieses potentiellen Effektes sollte die gleichzeitige Verabreichung mit anderen inhalativ verabreichten Wirkstoffen mit Vorsicht erfolgen und jeweils die tiefste effektive Dosis gewählt werden.
Schwangerschaft/Stillzeit
Schwangerschaft
Klinische Daten von schwangeren Frauen mit Exposition gegenüber Striverdi Respimat liegen nicht vor.
In präklinischen Untersuchungen zeigten sich bei Dosen, die um ein Vielfaches über der therapeutischen Dosis lagen, die typischen Wirkungen von Beta-Agonisten (siehe «Präklinische Daten»). Striverdi Respimat darf während der Schwangerschaft nicht angewendet werden, es sei denn dies ist klar notwendig.
Die hemmende Wirkung von Beta-Agonisten auf die Uteruskontraktion muss berücksichtigt werden.
Stillzeit
Klinische Daten von stillenden Frauen mit Exposition gegenüber Olodaterol liegen nicht vor.
Bei laktierenden Ratten wurden der Wirkstoff und/oder seine Metaboliten in der Milch nachgewiesen. Es ist jedoch unbekannt, ob Olodaterol auch in die menschliche Muttermilch übertritt. Eine Anwendung während der Stillzeit wird daher nicht empfohlen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen des Arzneimittels auf die Fähigkeit zum Lenken von Fahrzeugen und zum Bedienen von Maschinen durchgeführt.
Die Patienten sollten jedoch darauf hingewiesen werden, dass in klinischen Studien über das Auftreten von Schwindel berichtet wurde. Es wird daher zu Vorsicht beim Lenken eines Fahrzeugs und beim Bedienen von Maschinen geraten. Patienten, bei denen Schwindel auftritt, sollten potenziell gefährliche Tätigkeiten wie Lenken eines Fahrzeugs oder Bedienen von Maschinen meiden.
Unerwünschte Wirkungen
Die Sicherheit von Striverdi Respimat wurde in placebo- und aktiv-kontrollierten klinischen Studien mit Parallelgruppen- oder Crossover-Design bei insgesamt 4167 Patienten mit COPD geprüft. Insgesamt 1927 Patienten mit COPD erhielten die Zieldosis von 5 mcg Olodaterol.
Die vorliegenden Erkenntnisse über die Nebenwirkungen von Striverdi Respimat stammen hauptsächlich von COPD-Patienten, die an 4 placebokontrollierten klinischen Langzeitstudien (48 Wochen) mit parallelen Gruppen teilnahmen. Zwei dieser Studien führten auch eine aktive Vergleichsgruppe mit.
Infektionen
Gelegentlich: Nasopharyngitis.
Störungen des Nervensystems
Gelegentlich: Schwindel.
Gefässe
Nicht bekannt*: Hypertonie.
Haut
Gelegentlich: Hautausschlag.
Muskelskelettsystem
Selten: Arthralgie.
* Häufigkeit nicht bekannt, da die unerwünschte Arzneimittelwirkung in dem Datenmaterial von klinischen Studien mit 1035 Patienten nicht vorkam.
Unerwünschte Wirkungen nach Markteinführung
Das Auftreten eines Hautausschlages kann als Überempfindlichkeitsreaktion gegen Striverdi Respimat gedeutet werden; wie bei allen resorbierten topischen Wirkstoffen sind auch andere Überempfindlichkeitsreaktionen möglich.
Olodaterol gehört zur Arzneimittelklasse der langwirkenden Beta2-Agonisten. Es muss daher mit der Möglichkeit gerechnet werden, dass die für diese Arzneimittelklasse typischen unerwünschten Wirkungen auftreten; dazu gehören: Tachykardie, Arrhythmien, Palpitationen, Myokardischämie, Angina pectoris, Hypertonie oder Hypotonie, Tremor, Kopfschmerzen, Nervosität, Insomnie, Schwindel, Mundtrockenheit, Übelkeit, Muskelspasmen, Müdigkeit, allgemeines Krankheitsgefühl, Hypokaliämie, Hyperglykämie und metabolische Azidose.
Beschreibung ausgewählter Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Anzeichen und Symptome
Eine Überdosis Olodaterol führt wahrscheinlich zu verstärktem Auftreten der typischen Wirkungen von Beta2-Agonisten: Myokardischämie, Hypertonie oder Hypotonie, Tachykardie, Arrhythmien, Palpitationen, Schwindel, Nervosität, Insomnie, Angst, Kopfschmerzen, Tremor, Mundtrockenheit, Muskelspasmen, Übelkeit, Müdigkeit, allgemeines Krankheitsgefühl, Hypokaliämie, Hyperglykämie und metabolische Azidose.
Behandlung
Die Behandlung mit Striverdi Respimat muss beendet und eine supportive und symptomatische Therapie eingeleitet werden. Schwere Fälle bedürfen einer stationären Behandlung. Die Anwendung kardioselektiver Betablocker kann in Erwägung gezogen werden, dabei ist aber äusserste Vorsicht geboten, da durch Betablocker Bronchospasmen ausgelöst werden können.
Eigenschaften/Wirkungen
ATC-Code
R03AC19
Wirkungsmechanismus
Pharmakodynamik
Olodaterol hat eine starke Affinität und eine hohe Selektivität für den menschlichen Beta2-Adrenozeptor.
In-vitro-Studien belegen, dass die agonistische Aktivität von Olodaterol an den Beta2-Adrenozeptoren mehr als 219-mal grösser als an den Beta1-Adrenozeptoren und 1622-mal grösser als an den Beta3-Adrenozeptoren ist.
Nach topischer Verabreichung mittels Inhalation übt die Substanz ihre pharmakologischen Wirkungen aus, indem sie an Beta2-Adrenozeptoren bindet und diese aktiviert.
Die Aktivierung dieser Rezeptoren in den Atemwegen führt zur Stimulation des intrazellulären Enzyms Adenylzyklase, das die Synthese von zyklischem 3',5'-Adenosinmonophosphat (cAMP) vermittelt. Erhöhte cAMP-Spiegel induzieren eine Bronchodilatation, da sie die glatten Muskelzellen in den Atemwegen relaxieren.
In präklinischen Studien zeigte Olodaterol das Profil eines selektiven langwirkenden Beta2-Agonisten (LABA) mit schnellem Wirkungseintritt und einer Wirkdauer von mindestens 24 Stunden.
Die Beta-Adrenozeptoren werden in drei Subtypen unterteilt: Beta1-Adrenozeptoren werden vorwiegend auf den glatten Herzmuskelzellen, Beta2-Adrenozeptoren vorwiegend auf den Muskelzellen der Atemwege und Beta3-Adrenozeptoren vorwiegend auf Fettgewebszellen exprimiert. Die Beta2-Agonisten bewirken eine Bronchodilatation. Zwar stellen die Beta2-Adrenozeptoren den vorherrschenden Adrenozeptortyp in der glatten Muskulatur der Atemwege dar, doch findet sich dieser Typ auch auf der Oberfläche verschiedener anderer Zellen, darunter die Epithel- und Endothelzellen der Lungen und Zellen im Herzen. Die genaue Funktion der Beta2-Rezeptoren im Herzen ist nicht bekannt, doch bedeutet die Tatsache, dass sie dort vorhanden sind, dass selbst hochgradig selektive beta2-adrenerge Agonisten Wirkungen am Herzen haben können.
Klinische Wirksamkeit
Wirkungen auf die Elektrophysiologie des Herzens
In einer randomisierten, placebo- und aktiv- (Moxifloxacin) kontrollierten Studie wurde bei 24 gesunden männlichen und weiblichen Probanden untersucht, wie sich Olodaterol auf das QT/QTc-Intervall im EKG auswirkt. Es wurde nachgewiesen, dass sich das QT-Intervall in den ersten 20 Minuten bis 2 Stunden nach Verabreichung einer Einmaldosis Olodaterol (10, 20, 30 und 50 mcg) im Mittel um 1,6 Millisekunden (unter 10 mcg Olodaterol) bis 6,5 Millisekunden (unter 50 mcg Olodaterol) stärker gegenüber dem Ausgangswert verändert als unter Placebo; diese Wirkung ist dosisabhängig, wobei die obere Grenze des zweiseitigen 90%-Konfidenzintervalls für alle Dosierungsstufen unter 10 Millisekunden lag.
In den 48-wöchigen, placebokontrollierten Phase-3-Studien wurde bei einer Untergruppe von 772 Patienten die Wirkung von 5 mcg und 10 mcg Striverdi Respimat auf Herzfrequenz und Herzrhythmus mittels kontinuierlichem 24-Stunden-EKG (Holter-Monitoring) untersucht. Dabei wurden keine dosis- oder zeitabhängigen Trends oder Muster bezüglich der Grössenordnungen der mittleren Veränderungen hinsichtlich Herzfrequenz oder Auftreten von Extrasystolen beobachtet. Die Veränderungen zwischen Baseline und Behandlungsende hinsichtlich Extrasystolen liessen keine bedeutsamen Unterschiede zwischen Olodaterol 5 mcg, Olodaterol 10 mcg und Placebo erkennen.
Das klinische Entwicklungsprogramm der Phase III zu Striverdi Respimat bestand aus acht randomisierten, placebokontrollierten Doppelblindstudien. von denen jeweils zwei ein identisches Design hatten. Von den insgesamt 3533 Teilnehmern mit COPD erhielten 1281 die Dosis von 5 mcg und 1284 die Dosis von 10 mcg.
Durchgeführt wurden:
- zwei identisch angelegte, placebokontrollierte, 48-wöchige Studien mit parallelen Gruppen [Studien 1 und 2]
- zwei identisch angelegte, placebo- und aktiv-kontrollierte, 48-wöchige Studien mit parallelen Gruppen und Formoterol 12 mcg zweimal täglich als aktive Vergleichstherapie [Studien 3 und 4]
- zwei identisch angelegte, placebo- und aktiv-kontrollierte, 6-wöchige Studien mit Crossover-Design und Formoterol 12 mcg zweimal täglich als aktive Vergleichstherapie [Studien 5 und 6]
- zwei identisch angelegte, placebo- und aktiv-kontrollierte, 6-wöchige Studien mit Crossover-Design und Tiotropium HandiHaler 18 mcg einmal täglich als aktive Vergleichstherapie [Studien 7 und 8].
In allen Studien wurde die Lungenfunktion (forciertes exspiratorisches Volumen in einer Sekunde, FEV1), in den 48-wöchigen Studien ausserdem das Ansprechen der Lungenfunktion in der Peak-Phase (AUC0-3) und in der Talphase gemessen. Die 6-wöchigen Studien hingegen beinhalteten die kontinuierliche Ermittlung des Lungenfunktionsprofils während eines Dosierungsintervalls von 24 Stunden. In den beiden identisch angelegten placebo- und aktiv-kontrollierten, 48-wöchigen Studien wurden auch der Transition Dyspnea Index (TDI) zur Bewertung der Dyspnoe und der St. George's Respiratory Questionnaire (SGRQ) zur Bewertung der gesundheitsbezogenen Lebensqualität eingesetzt.
An dem Entwicklungsprogramm der Phase III nahmen Patienten im Alter von 40 Jahren oder älter mit der klinischen Diagnose einer COPD, einer Raucheranamnese von mindestens 10 Packungsjahren und einer mittelgradigen bis sehr schweren Einschränkung der Lungenfunktion (FEV1 nach Anwendung eines Bronchodilatators <80% des Normwertes [GOLD-Stadium II-IV]; FEV1/FVC-Quotient nach Anwendung eines Bronchodilatators <70%) teil.
Merkmale der Patienten
Die 3104 Patienten, die für die weltweiten, 48-wöchigen Studien [Studien 1 und 2, Studien 3 und 4] rekrutiert wurden, waren überwiegend männlich (77%) und europäischstämmig (66%) bzw. Asiaten (32%) mit einem Durchschnittsalter von 64 Jahren. Das mittlere FEV1 nach Anwendung eines Bronchodilatators betrug 1,38 Liter (GOLD II [50%], GOLD III [40%], GOLD IV [10%]). Im Mittel führte die Gabe eines Beta2-Agonisten zu einer Veränderung um 15% des Ausgangsbefundes (0,160 Liter). Mit Ausnahme anderer langwirkender Beta2-Agonisten waren als Begleittherapie alle Lungenmedikamente erlaubt (so z.B. Tiotropium [24%], Ipratropium [25%], inhalative Steroide [45%], Xanthine [16%]). Die Aufnahme der Patienten erfolgte stratifiziert nach der Anwendung von Tiotropium. In allen vier Studien wurden die folgenden primären Wirksamkeitsendpunkte zur Beurteilung der Wirkung auf die Lungenfunktion erfasst: Veränderung des forcierten Einsekundenvolumens im Zeitraum 0-3 Stunden (FEV1 AUC0-3h) und in der Talphase (vor der nächsten Dosis), jeweils gegenüber dem Ausgangswert vor Behandlungsbeginn (nach 12 Wochen in den Studien 1 und 2; nach 24 Wochen in den Studien 3 und 4).
Die 6-wöchigen Studien [Studien 5 und 6, Studien 7 und 8] wurden in Europa und Nordamerika durchgeführt. Für die Studien 5 und 6 wurden 199 Patienten – mehrheitlich Männer (53%) und Europäischstämmige (93%) – mit einem Durchschnittsalter von 63 Jahren rekrutiert. Der mittlere FEV1-Wert nach Anwendung eines Bronchodilatators betrug 1,43 Liter (GOLD II [54%], GOLD III [39%], GOLD IV [7%]). Die durch die Gabe eines Beta2-Agonisten erzielte Veränderung betrug im Mittel 17% des Ausgangswertes (0,187 Liter). Mit Ausnahme anderer langwirkender Beta2-Agonisten waren als Begleittherapie alle Lungenmedikamente erlaubt (so z.B. Tiotropium [24%], Ipratropium [16%], inhalative Steroide [31%], Xanthine [0,5%]). Tiotropium musste allerdings jeweils 48 h vor den Messungen spirometrischer Endpunkte pausiert werden. Die 230 für die Studien 7 und 8 rekrutierten Patienten waren ebenfalls mehrheitlich männlich (69%) und europäischstämmig (99,6%); das Durchschnittsalter betrug bei diesen Studien 62 Jahre. Der mittlere FEV1-Wert nach Anwendung eines Bronchodilatators betrug 1,55 Liter (GOLD II [57%], GOLD III [35%], GOLD IV [7%]), die mittlere Veränderung durch die Gabe eines Beta2-Agonisten 18% des Ausgangswertes (0,203 Liter). Mit Ausnahme anderer langwirkender Beta2-Agonisten und Anticholinergika waren als Begleittherapie alle Lungenmedikamente erlaubt (z.B. inhalative Steroide [49%], Xanthine [7%]).
Lungenfunktion
In den 48-wöchigen Studien führte die Verabreichung von 5 mcg Striverdi Respimat einmal täglich morgens innerhalb von 5 Minuten nach der ersten Dosis zu einer signifikanten (p<0,0001) Verbesserung der Lungenfunktion (mittlere Zunahme des FEV1 0,130 Liter bei einem Ausgangswert von 1,18 Litern vor der Behandlung). Die signifikante Verbesserung der Lungenfunktion hielt 24 Stunden an (mittlere Zunahme des FEV1 AUC0-3h 0,162 Liter versus Placebo, p<0,0001; mittlere Zunahme des FEV1-Talwertes nach 24 Stunden 0,071 Liter versus Placebo, p<0,0001); die Verbesserung der Lungenfunktionswerte war sowohl bei Anwendern als auch bei Nichtanwendern von Tiotropium evident. Die Verbesserung von FEV1 AUC0-3h und FEV1-Talwert war mit den Ergebnissen unter Formoterol zweimal täglich vergleichbar. Die bronchodilatatorischen Wirkungen von Striverdi Respimat hielten bis zum Ende der 48-wöchigen Behandlung an. Striverdi Respimat verbesserte auch die morgendlichen und abendlichen PEFR-Werte (maximale exspiratorische Atemflussrate) im Vergleich zu Placebo, was anhand der täglichen Aufzeichnungen der Patienten ermittelt wurde.
In den 6-wöchigen Studien sprachen die FEV1-Werte der mit Striverdi Respimat behandelten Patienten während des gesamten 24-stündigen Dosierungsintervalls signifikant stärker auf die Behandlung an als die Werte der Patienten unter Placebo (p<0,0001) (Abbildung 1, Abbildung 2, Tabelle 1).
Abbildung 1: FEV1-Profil unter Striverdi Respimat 5 mcg und unter Placebo, kontinuierlich gemessen während des gesamten 24-stündigen Dosierungsintervalls (Studien 5 und 6; kombiniertes Datenmaterial; Anticholinergika als Begleitbehandlung waren erlaubt)
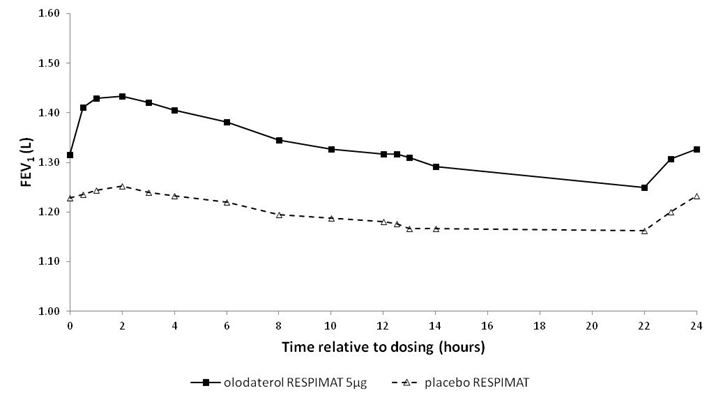
Abbildung 2: FEV1-Profil unter Striverdi Respimat 5 mcg und unter Placebo, kontinuierlich gemessen während des gesamten 24-stündigen Dosierungsintervalls (Studien 7 und 8; kombiniertes Datenmaterial; Anticholinergika als Begleitbehandlung waren nicht erlaubt)
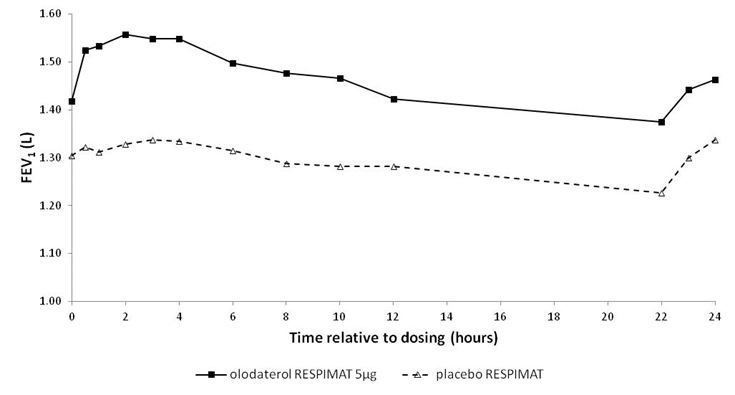
Tabelle 1: Differenzen zwischen den FEV1-Werten unter Striverdi Respimat 5 mcg und unter Placebo bei kontinuierlicher Messung während eines 24-stündigen Dosierungsintervalls nach 6-wöchiger Behandlung in den Studien 5 und 6 (kombinierte Daten) und den Studien 7 und 8 (kombinierte Daten)
FEV1: Differenz vs. Placebo (Liter)1 | ||||
Durchschnitt nach 3 Std. | Durchschnitt nach 12 Std. | Durchschnitt nach 24 Std. | Talwert | |
Studien 5 und 6 | 0,175 | 0,160 | 0,137 | 0,102 |
Studien 7 und 8 | 0,211 | 0,193 | 0,168 | 0,134 |
1 Ausgangswerte vor Behandlungsbeginn: FEV1 = 1,26 Liter (Studien 5 und 6) bzw. 1,33 Liter (Studien 7 und 8)
Der Transition Dyspnea Index (TDI) und der St. George's Respiratory Questionnaire (SGRQ) wurden auch im Rahmen der placebo- und aktiv kontrollierten, 48-wöchigen Wiederholungsstudien [Studien 1 und 2] eingesetzt.
Nach 24 Wochen wurde bei der primären Analyse in der Placebo-Gruppe in einer Studie (Tabelle 1) kein signifikanter Unterschied zwischen Striverdi Respimat, Formoterol und Placebo in Bezug auf den Punktwert des TDI nachgewiesen; in einer post-hoc-Analyse, in der die Studienabbrüche von Patienten berücksichtigt wurden, wies der Unterschied zwischen Striverdi Respimat und Placebo einen p-Wert von 0,027 auf.
Tabelle 2: Punktwert des TDI nach 24 Behandlungswochen
Mittelwert der Behandlung | Unterschied zu Placebo | ||
Primäre Analyse | Placebo | 1,5 (0,2) | |
Olodaterol 5 μg einmal täglich | 1,9 (0,2) | 0,3 (p=0,1704) | |
Formoterol 12 μg zweimal täglich | 1,8 (0,2) | 0,2 (p=0,3718) | |
Post-hoc-Analyse | Placebo | 1,5 (0,2) | |
Olodaterol 5 μg einmal täglich | 2,0 (0,2) | 0,5 (p=0,0270) | |
Formoterol 12 μg zweimal täglich | 1,8 (0,2) | 0,4 (p=0,1166) |
Exazerbationen, Lebensqualität, Bedarf an Notfallmedikamenten, PGR-Skala.
In den identisch angelegten, placebo- und aktiv-kontrollierten, 48-wöchigen Studien [Studien 3 und 4] wurden als sekundäre Endpunkte Exazerbationen und mithilfe des SGRQ-Fragebogens (St. George's Respiratory Questionnaire) auch die gesundheitsbezogene Lebensqualität erfasst.
Betreffend Exazerbationshäufigkeit zeigte weder Olodaterol noch Formoterol konsistente Unterschiede gegenüber Placebo. Nach 24 Wochen waren die mittleren SGRQ-Gesamtscores der Patienten, die mit Striverdi Respimat behandelt wurden, signifikant besser als die der Patienten unter Placebo (Tabelle 2); eine Verbesserung war in allen 3 SGRQ-Domänen (Beschwerden, Tätigkeiten, Auswirkungen) zu beobachten. Verglichen mit Placebo zeigten mehr Patienten unter Striverdi Respimat eine Verbesserung des SGRQ-Gesamtscores über der minimalen klinisch bedeutsamen Differenz (MCID: 4 Punkte) (50,2% vs. 36,4%, p<0,0001).
Tabelle 3: SGRQ-Gesamtscores und Einzelscores für die Domänen nach 24-wöchiger Therapie
Mittelwert der Behandlung | Differenz vs. Placebo | ||
Gesamtscore | Baseline | 44,4 | |
Placebo | 41,6 (-2,8) | ||
Olodaterol 5 μg 1x täglich | 38,8 (-5,6) | -2,8 (p=0,0034) | |
Formoterol 12 μg 2x täglich | 40,4 (-4,0) | -1,2 (p=0,2009) | |
Beschwerden | Placebo | 46,0 | |
Olodaterol 5 μg 1x täglich | 41,1 | -4,8 (p=0,0004) | |
Formoterol 12 μg 2x täglich | 43,7 | -2,3 (p=0,0924) | |
Tätigkeiten | Placebo | 55,3 | |
Olodaterol 5 μg 1x täglich | 52,9 | -2,4 (p=0,0455) | |
Formoterol 12 μg 2x täglich | 55,0 | -0,3 (p=0,7797) | |
Auswirkungen | Placebo | 32,3 | |
Olodaterol 5 μg 1x täglich | 29,7 | -2,6 (p=0,0157) | |
Formoterol 12 μg 2x täglich | 30,8 | -1,5 (p=0,1605) |
Die Patienten, die mit Striverdi Respimat behandelt wurden, benötigten tagsüber ebenso wie nachts weniger Salbutamol als Notfallmedikament als die Patienten, die Placebo erhielten.
In jeder der 48-wöchigen Studien erzielten die Patienten, die mit Striverdi Respimat behandelt wurden, eine stärkere Verbesserung ihrer Atemfunktion als die Patienten der Placebogruppe. Gemessen wurde dies mithilfe einer PGR-Skala (Patient's Global Rating Scale); dieses Ergebnis ist ein weiterer Beleg für die positive Wirkung auf die Symptome.
Belastungstoleranz
Die Wirkung von Striverdi Respimat auf die durch das Auftreten von Symptomen limitierte Belastungstoleranz bei COPD-Patienten wurde in zwei identischen, randomisierten, placebokontrollierten, 6-wöchigen Doppelblindstudien mit Crossover-Design untersucht. In diesen Studien verbesserte Striverdi Respimat die tolerierte Belastungsdauer signifikant um 14,0% (p=0,0002) bzw. 11,8% (p=0,0018) versus Placebo. Striverdi Respimat reduzierte auch die Überblähung der Lungen (verminderte funktionelle Residualkapazität, FRC) mit dem Ergebnis, dass die inspiratorische Kapazität in Ruhe und bei Belastung im Vergleich zu Placebo zunahm.
Pharmakokinetik
Die vorliegenden Informationen über die Pharmakokinetik von Olodaterol stammen von gesunden Probanden, COPD-Patienten und Asthma-Patienten, die mittels oraler Inhalation Dosen in Höhe der therapeutischen Dosis und darüber verabreicht bekamen.
Olodaterol wies eine lineare Pharmakokinetik mit dosisproportionaler Zunahme der systemischen Exposition nach einmaliger Inhalation von Dosen in Höhe von 5 bis 70 mcg und bei wiederholter einmal täglicher Inhalation von 2 bis 20 mcg auf.
Bei wiederholter einmal täglicher Inhalation wurden die Steady-State-Plasmakonzentrationen von Olodaterol nach 8 Tagen erreicht; die Exposition stieg dabei bis auf das 1,8-Fache der Exposition nach Verabreichung einer Einmaldosis.
Absorption
Olodaterol wird inhalativ verabreicht schnell resorbiert. Die maximalen Plasmakonzentrationen werden nach dem Inhalieren des Arzneimittels im Allgemeinen innerhalb von 10 bis 20 Minuten erreicht. Bei gesunden Probanden wurde die absolute Bioverfügbarkeit von Olodaterol nach Inhalation auf rund 30% geschätzt, während die absolute Bioverfügbarkeit nach Verabreichung als orale Lösung nicht einmal 1% betrug. Somit ist für die systemische Verfügbarkeit von Olodaterol nach Verabreichung mittels Inhalation hauptsächlich die Resorption in den Lungen ausschlaggebend, während ein möglicherweise geschluckter Anteil der Dosis nicht in nennenswertem Umfang zur systemischen Exposition beiträgt.
Distribution
Olodaterol weist sowohl nach Inhalation als auch nach intravenöser Verabreichung eine Verteilungskinetik mit mehreren Kompartimenten auf. Das Verteilungsvolumen ist mit 1110 Litern sehr gross, dies spricht für eine umfangreiche Verteilung im Gewebe. In vitro beträgt die Bindung von 14C-markiertem Olodaterol an Proteine des menschlichen Plasmas unabhängig von der Konzentration ca. 60%.
Metabolismus
Olodaterol wird zum grossen Teil durch direkte Glukuronierung und durch O-Demethylierung an der Methoxy-Gruppe mit anschliessender Konjugation abgebaut. Von den 6 bekannten Metaboliten bindet nur das unkonjugierte Demethylierungsprodukt (SOM 1522) an die Beta2-Rezeptoren; dieser Metabolit ist jedoch nach langfristiger Inhalation der empfohlenen therapeutischen Dosis oder von Dosen, die bis zum Vierfachen darüber liegen, im Plasma nicht nachweisbar.
Olodaterol gilt daher als allein verantwortlich für die pharmakologische Wirkung.
An der O-Demethylierung von Olodaterol sind die Zytochrom-P450-Isoenzyme CYP2C9 und CYP2C8 beteiligt, während CYP3A4 keinen nennenswerten Beitrag leistet. Die Bildung von Olodaterol-Glukuroniden erfolgt dagegen unter Mitwirkung der Isoformen der Uridindiphosphatglycosyltransferase (UGT2B7, UGT1A1, 1A7 und 1A9).
Elimination
Bei gesunden Probanden beträgt die Gesamt-Clearance von Olodaterol 872 ml/min und die renale Clearance 173 ml/min.
Die terminale Halbwertszeit liegt nach intravenöser Verabreichung bei 22 Stunden, nach Inhalation dagegen bei ca. 45 Stunden; dies weist darauf hin, dass der Wert in letzterem Fall nicht durch die Eliminations-, sondern durch die Resorptionsprozesse bestimmt wird.
Nach intravenöser Verabreichung von 14C-markiertem Olodaterol wurden im Urin 38% und im Stuhl 53% der radioaktiven Dosis wiedergefunden. Der Anteil des unverändert mit dem Urin ausgeschiedenen Olodaterol betrug nach intravenöser Verabreichung 19%. Nach oraler Verabreichung wurden nur 9% der Radioaktivität im Urin, der Hauptteil (84%) dagegen im Stuhl wiedergefunden. Nach intravenöser ebenso wie nach oraler Applikation wurden mehr als 90% der verabreichten Dosis innerhalb von 6 bzw. 5 Tagen ausgeschieden. Nach Inhalation betrug der Olodaterol-Anteil, der von gesunden Probanden innerhalb des Dosierungsintervalls unverändert mit dem Urin ausgeschieden wurde, im Steady-State 5 bis 7% der verabreichten Dosis.
Kinetik spezieller Patientengruppen
In eine pharmakokinetische Metaanalyse wurden die Daten von 2 kontrollierten klinischen Studien mit insgesamt 405 COPD-Patienten und 296 Asthma-Patienten einbezogen, die mit Striverdi Respimat behandelt wurden.
Der Analyse zufolge ist bei COPD-Patienten eine Dosisanpassung aufgrund der Auswirkungen von Alter, Geschlecht und Körpergewicht auf die systemische Exposition nach Inhalation von Striverdi Respimat nicht erforderlich.
Ethnische Abstammung
Ein Vergleich der pharmakokinetischen Daten von Teilnehmern derselben Studien und verschiedener Studien ergab eine tendenziell höhere systemische Exposition bei Japanern und anderen Asiaten als bei Europäischstämmigen.
Sicherheitsprobleme waren in den klinischen Studien, in denen Europäischstämmige und Asiaten über einen Zeitraum von bis zu einem Jahr mit Striverdi Respimat in Dosen bis zum Doppelten der empfohlenen therapeutischen Dosis behandelt wurden, nicht zu erkennen.
Leberfunktionsstörungen
Eine leichte oder mittelgradige Einschränkung der Leberfunktion hatte keinen eindeutigen Einfluss auf die systemische Exposition. Die Auswirkungen einer starken Einschränkung der Leberfunktion auf die systemische Exposition gegenüber Olodaterol wurde nicht untersucht.
Nierenfunktionsstörungen
Bei Patienten mit stark eingeschränkter Nierenfunktion (CLCR <30 ml/min) war die systemische Exposition gegenüber Olodaterol im Durchschnitt um das 1,4-Fache erhöht.
Ausgehend von den Ergebnissen klinischer Studien zur Sicherheit von Striverdi Respimat, in denen die Teilnehmer über einen Zeitraum von bis zu einem Jahr Dosen erhielten, die bis doppelt so hoch waren wie die empfohlene therapeutische Dosis, besteht bei einem Anstieg dieser Grössenordnung kein Anlass zu Sicherheitsbedenken.
Wechselwirkungen
Untersuchungen zu Arzneimittelinteraktionen wurden mit Fluconazol als Modell eines CYP2C9-Inhibitors und Ketoconazol als starkem P-gp- und CYP-Inhibitor durchgeführt.
Fluconazol: Die gleichzeitige Verabreichung von 400 mg Fluconazol einmal täglich über 14 Tage hatte keine nennenswerten Auswirkungen auf die systemische Exposition gegenüber Olodaterol.
Ketoconazol: Die gleichzeitige Verabreichung von 400 mg Ketoconazol einmal täglich über 14 Tage führte zu einem Anstieg der Cmax von Olodaterol um 66% und der AUC0‑1 um 68%.
Tiotropium: Die gleichzeitige Verabreichung von 5 mcg Tiotropiumbromid (als Fixed-Dose-Kombination mit 10 mcg Olodaterol mittels Respimat) über 21 Tage hatte keine nennenswerten Auswirkungen auf die systemische Exposition gegenüber Olodaterol oder umgekehrt.
Präklinische Daten
Bei Mäusen und Ratten wurde nach einmaliger Verabreichung mittels Inhalation, intravenöser oder oraler Applikation nur eine geringe akute Toxizität beobachtet.
In den pharmakologischen Studien zur Sicherheit nach einmaliger Anwendung wurden die Wirkungen beobachtet, die nach Gabe eines Beta2-Agonisten zu erwarten sind, darunter Blutdruckabfall, Beschleunigung der Herzfrequenz und Zunahme der Kontraktionskraft des Herzens.
Die Wirkungen, die in den Studien mit wiederholter Inhalation bei Mäusen, Ratten und Hunden beobachtet wurden, waren hauptsächlich auf die beta2-adrenergen Eigenschaften des Arzneimittels zurückzuführen; sie bestanden u.a. in einer Zunahme von Körpergewicht und Nahrungsaufnahme (Nager), einer Beschleunigung der Herzfrequenz sowie Veränderungen der Glykogenverteilung in der Leber und einer Papillarmuskelnekrose (Hund).
In einer Studie zu den Wirkungen wiederholter Inhalation bei jungen Hunden wurden Dosen bis zu 1046 mcg/kg/Tag gut vertragen. Es waren keine Zeichen einer Beeinträchtigung der Entwicklung von Lungen oder Herz festzustellen.
Bei Ratten traten nach Inhalation von Dosen bis zu 1054 mcg/kg/Tag (das ca. 1600-Fache der für erwachsene Menschen maximal zur Inhalation empfohlenen Tagesdosis [Maximum Recommended Human Daily Inhalation Dose, MRHDID] von 5 mcg bei Berechnung auf mg/m²-Basis) keine teratogenen Wirkungen auf.
Bei Ratten wurde eine Affinität von Olodaterol und / oder seinen Metaboliten zu Melanin enthaltenden Teilen der Netzhaut und auch zur pigmentierten Haut beobachtet.
In klinischen Humanstudien zu Olodaterol gab es jedoch keinen Hinweis auf eine erhöhte dermale oder okulare Phototoxizität.
Mutagenität
Nach Inhalation von Olodaterol (Exposition bis zum ca. 2000-Fachen der MRHDID für Erwachsene bei Berechnung auf m2-Basis) erwies sich die Substanz bis in sehr hohe Dosierungsstufen sowohl in vivo (Mikronukleus-Test an Knochenmark der Ratte) als auch in vitro (Mutagenitätstests: Ames-Test, Maus-Lymphoma-Assay) als frei von jeglichem genotoxischen Potenzial. Die erhöhte Häufigkeit von Mikronuklei bei Ratten nach intravenöser Verabreichung von Dosen in Höhe des 3500-Fachen der MRHDID und darüber war wahrscheinlich durch eine durch das Arzneimittel verstärkte (kompensatorische) Erythropoese bedingt.
Karzinogenität
Studien zur Kanzerogenität von inhaliertem Olodaterol bei Mäusen und Ratten liessen keinerlei kanzerogenes Potenzial erkennen.
Die lebenslange Behandlung von Ratten induzierte klassen- und nagerspezifische Leiomyome des Mesovars bei Expositionen in Höhe des ca. 2235-Fachen bzw. des ca. 715-Fachen der Exposition bei Verabreichung der humantherapeutischen Dosis von 5 mcg einmal täglich (bezogen auf die systemische Exposition). Bei Mäusen induzierte die lebenslange Behandlung klassen- und nagerspezifische Tumoren der glatten Muskulatur (Leiomyome, Leiomyosarkome) des Uterus sowie Fälle von fokaler Hyperplasie des Keimstrangstromas und der Corpora lutea in den Ovarien bei Expositionen in Höhe des ca. 477- bis 3596-Fachen der Exposition bei der Dosis von 5 mcg einmal täglich beim Menschen (bezogen auf die systemische Exposition); auch in diesem Fall werden die Veränderungen als klassen- und nagerspezifisch betrachtet (vielfache Exposition).
Reproduktionstoxizität
Bei Verabreichung von Olodaterol an trächtige NZW-Kaninchen mittels Inhalation von 2489 mcg/kg/Tag (was einer Exposition entsprach, die um ein Mehrfaches über der durch die MRHDID von >3500 erzielten Exposition [AUC0-24h] lag) wurden bei den Feten toxische Wirkungen beobachtet, wie sie typischerweise durch Stimulation der Beta-Adrenozeptoren hervorgerufen werden: fleckige Ossifikationen, kurze/gekrümmte Knochen, partiell offene Augen, Gaumenspalte, kardiovaskuläre Fehlbildungen. Keine signifikanten Wirkungen waren dagegen bei Inhalation einer Dosis von 974 mcg/kg (das ca. 1580-Fache der MRHDID für Erwachsene bei Berechnung auf m²-Basis) zu beobachten.
Eine Beeinträchtigung der männlichen oder weiblichen Fertilität oder der frühen Embryonalentwicklung war bei Ratten nach Inhalation von Dosen bis zu 3068 mcg/kg (das ca. 3000-Fache der MRHDID für Erwachsene bei Berechnung auf m²-Basis) nicht zu beobachten.
Auch Wirkungen auf das Paarungsverhalten, die Fertilität oder die Zahl der lebenden Implantationen bis Tag 14/15/16 der Trächtigkeit wurden bei Ratten der F1-Generation bei inhalierten Dosen von 3665 mcg/kg/Tag (das ca. 2970-Fache der MRHDID für Erwachsene bei Berechnung auf m²-Basis) nicht festgestellt.
Sonstige Hinweise
Inkompatibilitäten
Nicht zutreffend.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Der Striverdi Respimat Inhalator innerhalb von 3 Monaten nach Einsetzen der Patrone verwenden.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Siehe der Packung beigelegte Gebrauchsanweisung des Respimat Inhalator (wiederverwendbar).
Zulassungsnummer
67399 (Swissmedic).
Zulassungsinhaberin
Boehringer Ingelheim (Schweiz) GmbH, Basel.
Stand der Information
März 2020.
Composizione
Principi attivi
Olodaterolum (ut Olodateroli hydrochloridum).
Sostanze ausiliarie
Benzalconio cloruro (0,0011 mg per ogni nebulizzazione), edetato sodico calcico, acido citrico, acqua.
Forma farmaceutica e quantità di principio attivo per unità
Soluzione per inalazione.
Per ogni nebulizzazione vengono rilasciati 2,5 microgrammi di olodaterolo; una dose include due nebulizzazioni.
Indicazioni/Possibilità d'impiego
Striverdi Respimat è un broncodilatatore per la terapia di mantenimento sintomatica in pazienti affetti da BPCO (broncopneumopatia cronica ostruttiva).
Posologia/Impiego
Posologia abituale
La dose raccomandata per gli adulti è di 5 mcg di olodaterolo, somministrati tramite due erogazioni per mezzo dell'inalatore Respimat una volta al giorno, alla stessa ora.
Istruzioni posologiche speciali
Pazienti con disturbi della funzionalità epatica
I pazienti con compromissione epatica lieve e moderata possono utilizzare Striverdi Respimat alla posologia raccomandata.
Non sono disponibili dati sull'uso di Striverdi Respimat in pazienti con compromissione epatica grave.
Pazienti con disturbi della funzionalità renale
I pazienti con insufficienza renale possono utilizzare Striverdi Respimat alla posologia raccomandata.
Le istruzioni per l'uso precise riguardanti l'impiego dell'inalatore Respimat sono allegate alla confezione.
Pazienti anziani
I pazienti anziani possono utilizzare Striverdi Respimat alla posologia raccomandata.
Bambini e adolescenti
La BPCO è una malattia che non colpisce normalmente i bambini. La sicurezza e l'efficacia di Striverdi Respimat nei pazienti pediatrici non sono state studiate.
Controindicazioni
L'impiego di Striverdi Respimat è controindicato in pazienti con ipersensibilità a olodaterolo o ad uno degli altri componenti del medicamento.
Avvertenze e misure precauzionali
Striverdi Respimat contiene benzalconio cloruro, che può causare sibilo e difficoltà respiratorie (broncospasmo – restringimento spasmodico delle vie aeree), specialmente se soffre di asma. |
Asma
Striverdi Respimat non deve essere utilizzato in caso di asma. L'efficacia e la sicurezza a lungo termine di olodaterolo nell'asma non sono state studiate.
Broncospasmo acuto
Striverdi Respimat non è indicato per il trattamento di episodi acuti di broncospasmo, come per esempio la terapia di emergenza.
Ipersensibilità
Come con tutti i medicamenti, dopo la somministrazione di Striverdi Respimat possono verificarsi reazioni di ipersensibilità immediata.
Broncospasmo paradosso
Come altri medicamenti inalatori, Striverdi Respimat può provocare anche un broncospasmo paradosso potenzialmente letale. Se si verifica un broncospasmo paradosso, il trattamento con Striverdi Respimat deve essere interrotto immediatamente e sostituito con una terapia alternativa.
Effetti sistemici
Gli agonisti beta2-adrenergici a lunga durata d'azione devono essere somministrati con cautela in pazienti con disturbi cardiovascolari, in particolare con insufficienza coronarica, aritmie cardiache, cardiomiopatia ipertrofica ostruttiva e ipertensione, nonché in pazienti con disturbi convulsivi o tireotossicosi, pazienti con prolungamento dell'intervallo QT noto o sospetto e pazienti che sono particolarmente responsivi alle amine simpaticomimetiche.
I pazienti con anamnesi di infarto miocardico durante l'anno precedente, aritmie cardiache instabili o potenzialmente letali, trattamento in ricovero ospedaliero per insufficienza cardiaca durante l'anno precedente o con una diagnosi di tachicardia parossistica (>100 battiti al minuto) sono stati esclusi dagli studi clinici. Pertanto l'esperienza in questi gruppi di pazienti è limitata. Striverdi Respimat deve essere usato con cautela in questi gruppi di pazienti.
Effetti cardiovascolari
Come altri agonisti beta2-adrenergici, anche olodaterolo può provocare un effetto cardiovascolare clinicamente significativo in alcuni pazienti, che si manifesta con aumenti di frequenza cardiaca, pressione arteriosa e/o sintomi corrispondenti. Nel caso si verificassero tali effetti, potrebbe essere necessario interrompere il trattamento. Inoltre, a seguito di un trattamento con agonisti beta-adrenergici sono state riportate modificazioni dell'elettrocardiogramma (ECG), quali appiattimento dell'onda T e depressione del segmento ST.
Prima di prescrivere una terapia di mantenimento con un agonista beta-adrenergico come Striverdi Respimat a pazienti con BPCO, si raccomanda di accertare l'eventuale presenza di comorbilità cardiovascolari. In tale contesto si consiglia anche l'esecuzione di un ECG, valutando un eventuale prolungamento dell'intervallo QTc.
Ipokaliemia
Gli agonisti beta2-adrenergici possono causare una significativa ipokaliemia in alcuni pazienti, con potenziali effetti cardiovascolari avversi. La diminuzione del potassio sierico è solitamente transitoria e non richiede una supplementazione. In pazienti con BPCO grave, l'ipokaliemia può essere potenziata dall'ipossia e da una terapia concomitante (vedere «Interazioni»), predisponendo i pazienti ad un aumento delle aritmie cardiache.
Iperglicemia
L'inalazione di alte dosi di agonisti beta2-adrenergici può provocare aumenti del glucosio plasmatico.
Striverdi Respimat non deve essere usato con altri medicamenti contenenti agonisti beta2-adrenergici a lunga durata d'azione.
I pazienti che assumono agonisti beta2-adrenergici a breve durata d'azione per via inalatoria su base regolare (ad es. 4 volte al giorno) devono essere istruiti ad usarli solo per ottenere un sollievo da sintomi respiratori acuti.
È richiesta cautela in caso di passaggio ad una diversa forma farmaceutica della terapia e/o ad un diverso medicamento con lo stesso principio attivo. Il paziente deve essere sottoposto ad un adeguato monitoraggio.
Interazioni
Medicamenti che prolungano il QTc
Nei pazienti trattati con medicamenti noti per prolungare l'intervallo QTc, olodaterolo, come altri agonisti beta2-adrenergici, può aumentare il rischio di aritmie ventricolari. Determinati antistaminici (ad es. terfenadina, mizolastina), certi antiaritmici (ad es. chinidina), fenotiazina, eritromicina, ritonavir e antidepressivi triciclici sono esempi di questi medicamenti. La co-somministrazione di agenti simpaticomimetici può potenziare gli effetti cardiovascolari avversi. È richiesta cautela in caso di somministrazione di Striverdi Respimat a pazienti in trattamento con MAO-inibitori o antidepressivi triciclici, poiché può verificarsi un potenziamento dell'effetto dei β2-stimolanti sul sistema cardiovascolare.
Agenti simpaticomimetici
La somministrazione concomitante di altri principi attivi adrenergici può potenziare gli effetti indesiderati di Striverdi Respimat.
Derivati xantinici, steroidi o diuretici
Il trattamento concomitante con derivati xantinici, steroidi o diuretici non risparmiatori di potassio può potenziare un eventuale effetto ipokaliemico degli agonisti adrenergici (vedere «Avvertenze e misure precauzionali»).
Beta-bloccanti
I bloccanti beta-adrenergici possono indebolire o antagonizzare l'effetto di Striverdi Respimat. Pertanto Striverdi Respimat deve essere somministrato con beta-bloccanti (inclusi colliri) solo se strettamente necessario. In questi casi, possono essere presi in considerazione beta-bloccanti cardioselettivi, che devono essere comunque somministrati con cautela.
MAO-inibitori, antidepressivi triciclici, medicamenti che prolungano l'intervallo QTc
Gli inibitori delle monoaminossidasi o gli antidepressivi triciclici o altri medicamenti noti per prolungare l'intervallo QTc possono potenziare gli effetti di Striverdi Respimat sul sistema cardiovascolare.
Interazioni farmacocinetiche
In uno studio di interazione tra medicamenti, in cui è stato utilizzato ketoconazolo, un potente inibitore duale del CYP e della P-gp, è stato osservato un incremento dell'esposizione sistemica pari a 1,7 volte (vedere «Farmacocinetica»). In studi clinici, in cui Striverdi Respimat è stato somministrato per una durata totale di un anno a dosaggi pari al doppio della dose terapeutica raccomandata, non sono stati riscontrati problemi di sicurezza. Non è necessario un aggiustamento della dose.
Effetti di altri medicamenti su Striverdi Respimat
Striverdi Respimat induce una broncodilatazione nei pazienti con BPCO, quindi può aumentare l'assorbimento polmonare e la disponibilità sistemica di un principio attivo inalato successivamente. Dato questo effetto potenziale, è richiesta cautela durante la co-somministrazione con altri principi attivi somministrati per via inalatoria e si raccomanda di selezionare caso per caso la dose efficace più bassa.
Gravidanza/Allattamento
Gravidanza
Non sono disponibili dati clinici relativi a donne in gravidanza esposte a Striverdi Respimat.
Gli studi preclinici condotti a dosi multiple rispetto alla dose terapeutica hanno mostrato i tipici effetti degli agonisti beta-adrenergici (vedere «Dati preclinici»). Striverdi Respimat non deve essere utilizzato durante la gravidanza, se non nei casi di assoluta necessità.
Deve essere considerato l'effetto inibitorio degli agonisti beta-adrenergici sulla contrazione uterina.
Allattamento
Non sono disponibili dati clinici relativi alle donne in allattamento esposte a olodaterolo.
Nei ratti in allattamento è stata rilevata la presenza del principio attivo e/o dei suoi metaboliti nel latte. Non è noto se olodaterolo venga escreto anche nel latte materno umano. Si sconsiglia pertanto l'uso durante l'allattamento.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono stati effettuati studi in merito agli effetti del medicamento sulla capacità di guidare veicoli e sulla capacità di utilizzare macchine.
Tuttavia, i pazienti devono essere avvisati che durante gli studi clinici è stata segnalata la comparsa di capogiri. Pertanto si deve raccomandare cautela quando si guida un veicolo o si utilizzano macchine. Se i pazienti avvertono capogiri, devono evitare attività potenzialmente pericolose come guidare veicoli o utilizzare macchine.
Effetti indesiderati
La sicurezza di Striverdi Respimat è stata valutata in studi clinici controllati verso placebo e comparatore attivo, con disegno crossover o a gruppi paralleli, su un totale di 4167 pazienti con BPCO. Complessivamente 1927 pazienti con BPCO hanno ricevuto la dose target di 5 mcg di olodaterolo.
I dati attualmente disponibili sugli effetti collaterali di Striverdi Respimat derivano principalmente da pazienti con BPCO, che hanno partecipato a 4 studi clinici a lungo termine (48 settimane) controllati verso placebo, a gruppi paralleli. Due di questi studi hanno incluso anche un gruppo con comparatore attivo.
Infezioni
Non comune: Nasofaringite.
Patologie del sistema nervoso
Non comune: Capogiri.
Patologie vascolari
Non nota*: Ipertensione.
Patologie della cute e del tessuto sottocutaneo
Non comune: Eruzione cutanea.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Raro: Artralgia.
* Frequenza non nota, poiché l'effetto indesiderato del medicamento non compare tra i dati degli studi clinici condotti con 1035 pazienti.
Effetti indesiderati dopo l'introduzione sul mercato
Il verificarsi di un'eruzione cutanea può essere considerato una reazione di ipersensibilità a Striverdi Respimat; come con tutti i principi attivi assorbiti per via topica, si possono verificare anche altre reazioni di ipersensibilità.
Olodaterolo appartiene alla classe terapeutica degli agonisti beta2-adrenergici. Pertanto deve essere considerata la possibilità che si verifichino effetti indesiderati tipici di questa classe terapeutica, quali tachicardia, aritmie, palpitazioni, ischemia miocardica, angina pectoris, ipertensione o ipotensione, tremore, cefalea, nervosismo, insonnia, capogiri, secchezza della bocca, nausea, spasmi muscolari, affaticamento, sensazione generale di malessere, ipokaliemia, iperglicemia e acidosi metabolica.
Descrizione di alcuni effetti collaterali
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Segni e sintomi
È probabile che un sovradosaggio di olodaterolo provochi un potenziamento degli effetti tipici degli agonisti beta2-adrenergici, quali ischemia miocardica, ipertensione o ipotensione, tachicardia, aritmie, palpitazioni, capogiri, nervosismo, insonnia, stati d'angoscia, cefalea, tremore, secchezza della bocca, spasmi muscolari, nausea, affaticamento, sensazione generale di malessere, ipokaliemia, iperglicemia e acidosi metabolica.
Trattamento
Il trattamento con Striverdi Respimat deve essere interrotto e deve essere avviato un trattamento di supporto e sintomatico. I casi gravi richiedono un trattamento in ricovero ospedaliero. Si può prendere in considerazione l'uso di beta-bloccanti cardioselettivi, ma solo con estrema cautela poiché i beta-bloccanti possono provocare broncospasmo.
Proprietà/Effetti
Codice ATC
R03AC19
Meccanismo d'azione
Farmacodinamica
Olodaterolo possiede un'alta affinità e un'elevata selettività per il beta2-adrenorecettore.
Studi in vitro dimostrano che olodaterolo possiede un'attività agonista a livello dei beta2-adrenorecettori 219 volte superiore rispetto a quella a livello dei beta1-adrenorecettori e 1622 volte superiore rispetto a quella a livello dei beta3-adrenorecettori.
Dopo somministrazione topica per via inalatoria, olodaterolo esercita i suoi effetti farmacologici legandosi ed attivando i beta2-adrenorecettori.
L'attivazione di questi recettori nelle vie aeree ha come effetto la stimolazione dell'adenil ciclasi intracellulare, un enzima mediatore della sintesi di 3',5'-adenosina monofosfato ciclico (cAMP). Livelli elevati di cAMP inducono una broncodilatazione tramite il rilassamento delle cellule della muscolatura liscia delle vie aeree.
Negli studi preclinici, olodaterolo ha mostrato il profilo di un agonista beta2-adrenergico selettivo a lunga durata d'azione (LABA) con una rapida insorgenza d'azione e una durata d'azione di almeno 24 ore.
I beta-adrenorecettori sono divisi in tre sottotipi: i beta1-adrenorecettori espressi in prevalenza sul muscolo liscio cardiaco, i beta2-adrenorecettori espressi in prevalenza sulla muscolatura liscia delle vie aeree e i beta3-adrenorecettori espressi in prevalenza sul tessuto adiposo. Gli agonisti beta2-adrenergici inducono una broncodilatazione. I beta2-adrenorecettori sono i recettori adrenergici predominanti nella muscolatura liscia delle vie aeree, ma sono presenti anche sulla superficie di altre cellule, ad esempio le cellule epiteliali ed endoteliali polmonari e le cellule cardiache. L'esatta funzione dei beta2-adrenorecettori nel cuore non è nota, ma la loro presenza fa ipotizzare che gli agonisti beta2-adrenergici altamente selettivi possano avere anche effetti cardiaci.
Efficacia clinica
Effetti sulla elettrofisiologia cardiaca
L'effetto di olodaterolo sull'intervallo QT/QTc dell'ECG è stato analizzato in 24 volontari sani di sesso maschile e femminile in uno studio randomizzato, controllato verso placebo e comparatore attivo (moxifloxacina). È stato dimostrato che olodaterolo induce, rispetto al placebo, un incremento medio dell'intervallo QT da 1,6 millisecondi (10 mcg di olodaterolo) a 6,5 millisecondi (50 mcg di olodaterolo) in un intervallo da 20 minuti a 2 ore dopo la somministrazione di dosi singole (10, 20, 30 e 50 mcg); questo effetto è dose-dipendente, con il limite superiore dell'intervallo di confidenza a due code del 90% inferiore a 10 ms per tutti i livelli posologici.
In un sottogruppo di 772 pazienti negli studi di fase III controllati verso placebo della durata di 48 settimane, è stato valutato l'effetto di 5 mcg e 10 mcg di Striverdi Respimat sulla frequenza ed il ritmo cardiaco mediante una registrazione dell'ECG continua nelle 24 ore (monitoraggio Holter). Non sono stati osservati andamenti o schemi dose-dipendenti o tempo-dipendenti per l'entità delle variazioni medie in relazione alla frequenza cardiaca o alla comparsa di extrasistoli. Le variazioni riguardanti le extrasistoli tra il basale e la fine del trattamento non hanno indicato differenze significative tra olodaterolo 5 mcg, 10 mcg e placebo.
Il programma di sviluppo clinico di fase III per Striverdi Respimat ha compreso otto studi randomizzati, in doppio cieco, controllati verso placebo, con disegno identico due a due. Su un totale di 3533 pazienti con BPCO, 1281 hanno ricevuto la dose di 5 mcg e 1284 la dose di 10 mcg.
Sono stati condotti:
- due studi replicati, controllati verso placebo e comparatore attivo, a gruppi paralleli, della durata di 48 settimane [studi 1 e 2]
- due studi replicati, controllati verso placebo e comparatore attivo, a gruppi paralleli, della durata di 48 settimane, con formoterolo 12 mcg due volte al giorno come comparatore attivo [studi 3 e 4]
- due studi replicati, controllati verso placebo e comparatore attivo, con disegno crossover, della durata di 6 settimane, con formoterolo 12 mcg due volte al giorno come comparatore attivo [studi 5 e 6]
- due studi replicati, controllati verso placebo e comparatore attivo, con disegno crossover, della durata di 6 settimane, con tiotropio HandiHaler 18 mcg una volta al giorno come comparatore attivo [studi 7 e 8].
Tutti gli studi includevano misurazioni della funzionalità polmonare (volume espiratorio forzato in un secondo, FEV1); gli studi della durata di 48 settimane valutavano inoltre la risposta della funzionalità polmonare di picco (AUC0-3) e di valle. Gli studi della durata di 6 settimane, invece, valutavano il profilo della funzionalità polmonare in un intervallo di somministrazione di 24 ore. I due studi replicati, controllati verso placebo e comparatore attivo, della durata di 48 settimane includevano anche l'indice di dispnea transitorio (TDI), come misura della dispnea, e il St. George's Respiratory Questionnaire (SGRQ), come misura della qualità della vita correlata allo stato di salute.
Nel programma di fase III sono stati arruolati pazienti con età pari o superiore a 40 anni e diagnosi clinica di BPCO, storia di tabagismo con almeno 10 pacchetti/anno e compromissione della funzionalità polmonare da moderata a molto grave (FEV1 post-broncodilatatore <80% del valore normale [stadi II-IV GOLD]; rapporto FEV1/FVC post-broncodilatatore <70%).
Caratteristiche dei pazienti
I 3104 pazienti arruolati negli studi globali della durata di 48 settimane [studi 1 e 2, studi 3 e 4] erano in gran parte di sesso maschile (77%), di etnia europea (66%) o asiatica (32%), e avevano un'età media di 64 anni. Il FEV1 medio post-broncodilatatore era di 1,38 litri (GOLD II [50%], GOLD III [40%], GOLD IV [10%]). La somministrazione di un agonista beta2-adrenergico ha prodotto una variazione in media del 15% rispetto al valore al basale (0,160 litri). Ad eccezione di altri agonisti beta2-adrenergici a lunga durata d'azione, erano consentiti tutti i medicamenti respiratori come terapia concomitante (ad es. tiotropio [24%], ipratropio [25%], steroidi inalatori [45%], xantine [16%]). L'arruolamento dei pazienti è stato stratificato in funzione dell'utilizzo di tiotropio. In tutti e quattro gli studi sono stati valutati i seguenti endpoint primari dell'efficacia sulla funzionalità polmonare: variazione del volume espiratorio forzato in un secondo nell'intervallo 0–3 ore (FEV1 AUC0-3h) e in fase di valle (prima della dose successiva) rispetto al basale pre-trattamento (dopo 12 settimane negli studi 1 e 2; dopo 24 settimane negli studi 3 e 4).
Gli studi della durata di 6 settimane [studi 5 e 6, studi 7 e 8] sono stati condotti in Europa e Nord America. Negli studi 5 e 6 sono stati arruolati 199 pazienti, in gran parte uomini (53%) e di etnia europea (93%), con un'età media di 63 anni. Il FEV1 medio post-broncodilatatore era di 1,43 litri (GOLD II [54%], GOLD III [39%], GOLD IV [7%]). La somministrazione di un agonista beta2-adrenergico ha prodotto una variazione in media del 17% rispetto al valore al basale (0,187 litri). Ad eccezione di altri agonisti beta2-adrenergici a lunga durata d'azione, erano consentiti tutti i medicamenti respiratori come terapia concomitante (ad es. tiotropio [24%], ipratropio [16%], steroidi inalatori [31%], xantine [0,5%]). Tiotropio doveva tuttavia essere sospeso 48 ore prima delle misurazioni spirometriche previste dagli endpoint. Anche i 230 pazienti arruolati negli studi 7 e 8 erano in gran parte di sesso maschile (69%) e di etnia europea (99,6%); l'età media in questi studi era di 62 anni. Il FEV1 medio post-broncodilatatore era di 1,55 litri (GOLD II [57%], GOLD III [35%], GOLD IV [7%]); la variazione media dopo la somministrazione di un agonista beta2-adrenergico era del 18% rispetto al valore al basale (0,203 litri). Ad eccezione di altri agonisti beta2-adrenergici a lunga durata d'azione e anticolinergici, erano consentiti tutti i medicamenti respiratori come terapia concomitante (ad es. steroidi inalatori [49%], xantine [7%]).
Funzionalità polmonare
Negli studi della durata di 48 settimane, la somministrazione di 5 mcg di Striverdi Respimat una volta al giorno al mattino ha prodotto un miglioramento significativo (p<0,0001) della funzionalità polmonare entro 5 minuti dalla prima dose (incremento medio del FEV1 di 0,130 litri rispetto ad un valore al basale pre-trattamento di 1,18 litri). Il miglioramento significativo della funzionalità polmonare è stato mantenuto per 24 ore (incremento medio del FEV1 AUC0-3h di 0,162 litri rispetto al placebo, p<0,0001; incremento medio del FEV1 di valle dopo 24 ore di 0,071 litri rispetto al placebo, p<0,0001); il miglioramento della funzionalità polmonare è stato evidente sia negli utilizzatori che nei non utilizzatori di tiotropio. Il miglioramento del FEV1 AUC0-3h e del FEV1 di valle è stato paragonabile a quello ottenuto nel trattamento con formoterolo due volte al giorno. Gli effetti broncodilatatori di Striverdi Respimat sono stati mantenuti durante tutto il periodo di trattamento di 48 settimane. Striverdi Respimat ha migliorato anche il PEFR (picco di flusso espiratorio) al mattino e alla sera, misurato con registrazioni quotidiane dei pazienti, rispetto al placebo.
Negli studi di 6 settimane, i valori del FEV1 ottenuti per i pazienti trattati con Striverdi Respimat durante l'intero intervallo di somministrazione di 24 ore hanno dimostrato una risposta significativamente migliore rispetto ai valori ottenuti per i pazienti trattati con placebo (p<0,0001) (Figura 1, Figura 2, Tabella 1).
Figura 1: Profilo FEV1 nel trattamento con Striverdi Respimat 5 mcg e con placebo, misurato continuamente durante l'intero intervallo di somministrazione di 24 ore (studi 5 e 6; dati aggregati; anticolinergici consentiti come terapia concomitante)
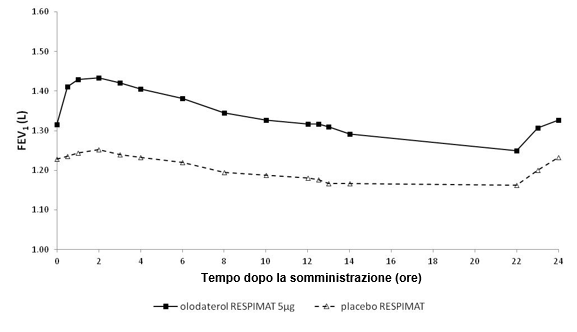
Figura 2: Profilo FEV1 nel trattamento con Striverdi Respimat 5 mcg e con placebo, misurato continuamente durante l'intero intervallo di somministrazione di 24 ore (studi 7 e 8; dati aggregati; anticolinergici non consentiti come terapia concomitante)
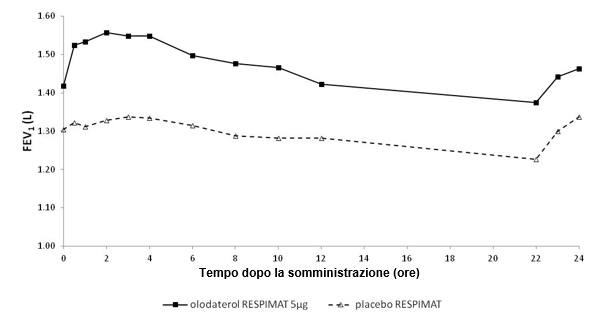
Tabella 1: Differenze tra i valori FEV1 rilevati nel trattamento con Striverdi Respimat 5 mcg e con placebo mediante misurazione continua durante un intervallo di somministrazione di 24 ore dopo trattamento della durata di 6 settimane negli studi 5 e 6 (dati aggregati) e negli studi 7 e 8 (dati aggregati)
FEV1: Differenza vs. placebo (in litri)1 | ||||
Media dopo 3 ore | Media dopo 12 ore | Media dopo 24 ore | Valore di valle | |
Studi 5 e 6 | 0,175 | 0,160 | 0,137 | 0,102 |
Studi 7 e 8 | 0,211 | 0,193 | 0,168 | 0,134 |
1 Valori al basale pre-trattamento: FEV1 = 1,26 litri (studi 5 e 6) e 1,33 litri (studi 7 e 8)
L'indice di dispnea transitorio (TDI) e il St. George's Respiratory Questionnaire (SGRQ) sono stati utilizzati anche negli studi replicati controllati verso placebo e comparatore attivo, della durata di 48 settimane [studi 1 e 2].
Dopo 24 settimane, un'analisi primaria nel gruppo placebo in uno studio (Tabella 1) non ha dimostrato una differenza significativa tra Striverdi Respimat, formoterolo e placebo in relazione al punteggio del TDI; in un'analisi post-hoc, che ha considerato le interruzioni degli studi da parte dei pazienti, la differenza tra Striverdi Respimat e placebo ha evidenziato un valore p pari a 0,027.
Tabella 2: Punteggio del TDI dopo 24 settimane di trattamento
Media del trattamento | Differenza rispetto al placebo | ||
Analisi primaria | Placebo | 1,5 (0,2) | |
Olodaterolo 5 μg una volta/die | 1,9 (0,2) | 0,3 (p=0,1704) | |
Formoterolo 12 μg due volte/die | 1,8 (0,2) | 0,2 (p=0,3718) | |
Analisi post-hoc | Placebo | 1,5 (0,2) | |
Olodaterolo 5 μg una volta/die | 2,0 (0,2) | 0,5 (p=0,0270) | |
Formoterolo 12 μg due volte/die | 1,8 (0,2) | 0,4 (p=0,1166) |
Riacutizzazioni, qualità della vita, utilizzo di medicamenti di emergenza, scala PGR.
Negli studi replicati, controllati verso placebo e comparatore attivo, della durata di 48 settimane [studi 3 e 4] sono state valutate come endpoint secondari, mediante il questionario SGRQ (St. George's Respiratory Questionnaire), anche le riacutizzazioni e la qualità della vita correlata allo stato di salute.
Per quanto riguarda la frequenza delle riacutizzazioni, né olodaterolo né formoterolo hanno evidenziato differenze uniformi rispetto al placebo. Dopo 24 settimane, la media del punteggio totale del SGRQ dei pazienti trattati con Striverdi Respimat era significativamente migliore rispetto a quella dei pazienti trattati con placebo (Tabella 2); è stato osservato un miglioramento in tutti e 3 i domini SGRQ (sintomi, attività, impatto). Un maggior numero di pazienti trattati con Striverdi Respimat ha mostrato un miglioramento del punteggio totale del SGRQ superiore alla differenza minima clinicamente rilevante (MCID: 4 punti) (50,2% vs. 36,4%, p<0,0001).
Tabella 3: Punteggio totale del SGRQ e punteggi singoli per i domini dopo 24 settimane di trattamento
Media del trattamento | Differenza vs. placebo | ||
Punteggio totale | Basale | 44,4 | |
Placebo | 41,6 (-2,8) | ||
Olodaterolo 5 μg 1 volta/die | 38,8 (-5,6) | -2,8 (p=0,0034) | |
Formoterolo 12 μg 2 volte/die | 40,4 (-4,0) | -1,2 (p=0,2009) | |
Sintomi | Placebo | 46,0 | |
Olodaterolo 5 μg 1 volta/die | 41,1 | -4,8 (p=0,0004) | |
Formoterolo 12 μg 2 volte/die | 43,7 | -2,3 (p=0,0924) | |
Attività | Placebo | 55,3 | |
Olodaterolo 5 μg 1 volta/die | 52,9 | -2,4 (p=0,0455) | |
Formoterolo 12 μg 2 volte/die | 55,0 | -0,3 (p=0,7797) | |
Impatto | Placebo | 32,3 | |
Olodaterolo 5 μg 1 volta/die | 29,7 | -2,6 (p=0,0157) | |
Formoterolo 12 μg 2 volte/die | 30,8 | -1,5 (p=0,1605) |
I pazienti trattati con Striverdi Respimat hanno utilizzato meno salbutamolo in emergenza, sia di giorno che di notte, rispetto ai pazienti trattati con placebo.
In ciascuno degli studi di 48 settimane, i pazienti trattati con Striverdi Respimat hanno raggiunto un miglioramento della loro funzione respiratoria maggiore rispetto ai pazienti trattati con placebo, come misurato dalla scala di valutazione globale del paziente (Patient's Global Rating, PGR); questo risultato è un'ulteriore dimostrazione dell'effetto positivo sui sintomi.
Tolleranza allo sforzo
L'effetto di Striverdi Respimat sulla tolleranza allo sforzo limitata dall'insorgenza dei sintomi in pazienti con BPCO è stata valutata in due studi replicati, randomizzati, controllati verso placebo, della durata di 6 settimane, con disegno crossover. In questi studi, Striverdi Respimat ha migliorato in misura significativa la durata dello sforzo tollerata del 14,0% (p=0,0002) o 11,8% (p=0,0018) rispetto al placebo. Striverdi Respimat ha ridotto anche l'iperinflazione polmonare (capacità residua funzionale, FRC, ridotta), aumentando di conseguenza la capacità inspiratoria sia a riposo che sotto sforzo rispetto al placebo.
Farmacocinetica
Le informazioni sulla farmacocinetica di olodaterolo sono state ottenute da volontari sani, pazienti con BPCO e asma in seguito a inalazione orale di dosi uguali e superiori alla dose terapeutica.
Olodaterolo ha mostrato una farmacocinetica lineare con un incremento dell'esposizione sistemica proporzionale alla dose dopo dosi singole inalate di 5–70 mcg e dosi multiple inalate una volta al giorno di 2–20 mcg.
Con un'inalazione ripetuta una volta al giorno, lo stato stazionario delle concentrazioni plasmatiche di olodaterolo è stato raggiunto dopo 8 giorni; l'entità dell'esposizione è aumentata fino a 1,8 volte rispetto all'esposizione dopo somministrazione di una dose singola.
Assorbimento
Olodaterolo somministrato per via inalatoria viene rapidamente assorbito. Le concentrazioni plasmatiche massime vengono raggiunte generalmente entro 10–20 minuti dopo l'inalazione del medicamento. In volontari sani la biodisponibilità assoluta di olodaterolo dopo inalazione è stata stimata in circa il 30%, mentre la biodisponibilità assoluta è risultata inferiore all'1% dopo somministrazione come soluzione orale. Pertanto la disponibilità sistemica di olodaterolo dopo inalazione è determinata principalmente dall'assorbimento polmonare, mentre una parte della dose probabilmente deglutita non concorre in misura rilevante all'esposizione sistemica.
Distribuzione
Olodaterolo mostra una cinetica di natura multi-compartimentale sia dopo inalazione che dopo somministrazione endovenosa. Il volume di distribuzione è molto elevato (1110 litri), suggerendo una distribuzione estesa nei tessuti. In vitro, il legame di olodaterolo marcato 14C alle proteine plasmatiche umane è indipendente dalla concentrazione ed è pari a circa il 60%.
Metabolismo
Olodaterolo è metabolizzato in modo sostanziale mediante glucuronazione diretta e O-demetilazione al gruppo metossi, seguite da coniugazione. Dei 6 metaboliti identificati, solo il prodotto di demetilazione non coniugato (SOM 1522) si lega ai beta2-recettori. Tuttavia, questo metabolita non è rilevabile nel plasma dopo inalazione a lungo termine della dose terapeutica raccomandata o di dosi fino a quattro volte superiori alla stessa.
Pertanto olodaterolo è considerato l'unico composto rilevante per l'azione farmacologica.
Gli isoenzimi CYP2C9 e CYP2C8 del citocromo P450 sono coinvolti nella O-demetilazione di olodaterolo, mentre il CYP3A4 lo è in misura trascurabile. Le isoforme UGT2B7, UGT1A1, 1A7 e 1A9 della uridina difosfato glicosiltransferasi concorrono invece alla formazione dei glucuronidi di olodaterolo.
Eliminazione
La clearance totale di olodaterolo nei volontari sani è pari a 872 ml/min e la clearance renale a 173 ml/min.
L'emivita terminale dopo somministrazione endovenosa è di 22 ore, mentre dopo inalazione si aggira intorno a 45 ore, il che sta ad indicare che nell'ultimo caso il valore è determinato non tanto dal processo di eliminazione, quanto da quello di assorbimento.
Dopo somministrazione endovenosa di olodaterolo marcato 14C, il 38% della dose radioattiva è stato ritrovato nelle urine e il 53% nelle feci. La quantità di olodaterolo non modificato ritrovato nelle urine dopo somministrazione endovenosa è stata pari al 19%. Dopo somministrazione orale, solo il 9% della radioattività è stato ritrovato nelle urine, mentre la porzione maggiore (84%) è stata ritrovata nelle feci. Più del 90% della dose somministrata è stato eliminato entro 6 e 5 giorni, rispettivamente dopo somministrazione endovenosa e orale. Dopo inalazione, l'eliminazione di olodaterolo non modificato nelle urine di volontari sani entro l'intervallo di somministrazione ha rappresentato il 5–7% della dose allo stato stazionario.
Cinetica di gruppi di pazienti speciali
Una meta-analisi farmacocinetica è stata condotta utilizzando i dati di 2 studi clinici controllati che includevano complessivamente 405 pazienti con BPCO e 296 pazienti con asma sottoposti a trattamento con Striverdi Respimat.
L'analisi ha mostrato che non è necessario alcun aggiustamento della dose in base all'effetto di età, genere e peso corporeo sull'esposizione sistemica in pazienti con BPCO dopo inalazione di Striverdi Respimat.
Etnia
Il confronto dei dati farmacocinetici all'interno e tra gli studi ha rivelato la tendenza ad un'esposizione sistemica maggiore nei giapponesi e in altri asiatici rispetto agli europei.
Non sono stati identificati problemi di sicurezza in studi clinici in cui Striverdi Respimat è stato somministrato a europei e asiatici per una durata totale di un anno a dosi fino al doppio della dose terapeutica raccomandata.
Disturbi della funzionalità epatica
Una compromissione epatica lieve o moderata non ha influenzato in modo evidente l'esposizione sistemica. Non sono stati studiati gli effetti di una compromissione epatica grave sull'esposizione sistemica a olodaterolo.
Disturbi della funzionalità renale
Nei pazienti con compromissione renale grave (CLCR <30 ml/min), l'esposizione sistemica a olodaterolo è aumentata mediamente di 1,4 volte.
In base ai risultati di studi clinici sulla sicurezza di Striverdi Respimat, in cui i pazienti hanno ricevuto dosi pari al doppio della dose terapeutica raccomandata per un periodo fino a un anno, non ci sono motivi per ipotizzare problemi di sicurezza in caso di aumento di quest'ordine di grandezza.
Interazioni
Gli studi di interazione tra medicamenti sono stati condotti con fluconazolo come inibitore modello del CYP2C9 e ketoconazolo come potente inibitore della P-gp e del CYP.
Fluconazolo: la co-somministrazione di 400 mg di fluconazolo una volta al giorno per 14 giorni non ha avuto alcun effetto rilevante sull'esposizione sistemica a olodaterolo.
Ketoconazolo: la co-somministrazione di 400 mg di ketoconazolo una volta al giorno per 14 giorni ha aumentato la Cmax di olodaterolo del 66% e l'AUC0‑1 del 68%.
Tiotropio: la co-somministrazione di 5 mcg di tiotropio bromuro (come combinazione a dose fissa con 10 mcg di olodaterolo mediante l'inalatore Respimat) per 21 giorni non ha avuto alcun effetto rilevante sull'esposizione sistemica a olodaterolo o viceversa.
Dati preclinici
Nei topi e nei ratti è stata osservata solo una tossicità acuta ridotta dopo inalazione o somministrazione endovenosa o orale di dosi singole.
Negli studi farmacologici sulla sicurezza dopo somministrazione di dosi singole sono stati osservati gli effetti che si attendono dopo la somministrazione di un agonista beta2-adrenergico, tra cui calo della pressione arteriosa, accelerazione della frequenza cardiaca e aumento della forza contrattile del cuore.
Gli effetti osservati negli studi con inalazione di dosi ripetute nei topi, ratti e cani erano riconducibili principalmente alle proprietà beta2-adrenergiche del medicamento e includevano, tra l'altro, aumento del peso corporeo e dell'assunzione di cibo (roditori), accelerazione della frequenza cardiaca, variazioni della distribuzione del glicogeno nel fegato e necrosi del muscolo papillare (cane).
In uno studio sugli effetti dell'inalazione di dosi ripetute in cani giovani sono state ben tollerate dosi fino a 1046 mcg/kg/die. Non sono stati accertati segni di compromissione dello sviluppo dei polmoni o del cuore.
Nei ratti non si sono verificati effetti teratogeni dopo inalazione di dosi fino a 1054 mcg/kg/die (corrispondenti a circa 1600 volte la dose inalatoria giornaliera massima raccomandata nell'uomo [Maximum Recommended Human Daily Inhalation Dose, MRHDID] pari a 5 mcg calcolata su base mg/m²).
Nei ratti è stata osservata un'affinità di olodaterolo e/o dei suoi metaboliti per le parti della retina contenenti melanina e anche per la pelle pigmentata.
Studi clinici sull'uomo con olodaterolo non hanno mostrato segni di aumentata fototossicità cutanea o oculare.
Mutagenicità
Dopo inalazione di olodaterolo (esposizione fino a circa 2000 volte la MRHDID negli adulti calcolata su base m2), la sostanza si è dimostrata priva di qualsiasi potenziale genotossico fino a livelli posologici molto elevati sia in vivo (test del micronucleo nel midollo osseo del ratto) che in vitro (test di mutagenicità: test di Ames, test del mouse lymphoma). L'aumentata frequenza di micronuclei nei ratti dopo somministrazione endovenosa di dosi pari e superiori a 3500 volte la MRHDID era dovuta verosimilmente ad un incremento (compensatorio) dell'eritropoiesi indotto dal medicamento.
Cancerogenicità
Gli studi sulla cancerogenicità di olodaterolo per via inalatoria nei topi e ratti non hanno mostrato alcun potenziale cancerogenico.
Il trattamento a vita nei ratti ha indotto leiomiomi del mesovario specifici della classe e dei roditori con esposizioni nell'ordine di circa 2235 volte o di circa 715 volte l'esposizione dopo somministrazione della dose terapeutica per l'uomo di 5 mcg una volta/die (in riferimento all'esposizione sistemica). Il trattamento a vita nei topi ha indotto tumori specifici della classe e dei roditori a carico della muscolatura liscia (leiomiomi, leiomiosarcomi) dell'utero, nonché casi di iperplasia focale dello stroma/dei cordoni sessuali e dei corpi lutei nelle ovaie con esposizioni nell'ordine di circa 477–3596 volte l'esposizione con la dose per l'uomo di 5 mcg una volta/die (in riferimento all'esposizione sistemica); anche in questo caso le variazioni sono considerate specifiche della classe e dei roditori (esposizione multipla).
Tossicità per la riproduzione
In conigli bianchi di Nuova Zelanda (NZW) gravidi, la somministrazione per via inalatoria di 2489 mcg/kg/die di olodaterolo (corrispondente a un'esposizione multipla rispetto alla MRHDID di >3500 volte l'esposizione raggiunta [AUC0-24h]) ha mostrato tossicità fetale, dovuta in modo caratteristico alla stimolazione dei beta-adrenorecettori, che si è manifestata sotto forma di ossificazioni frammentarie, ossa corte/curve, occhi parzialmente aperti, palatoschisi, malformazioni cardiovascolari. Non sono stati osservati effetti significativi con la dose inalatoria di 974 mcg/kg/die (circa 1580 volte la MRHDID in adulti calcolata su base m²).
Non è stata osservata una compromissione della fertilità maschile o femminile o dello sviluppo fetale iniziale nei ratti dopo inalazione di dosi fino a 3068 mcg/kg (circa 3000 volte la MRHDID in adulti calcolata su base m²).
Non sono stati osservati neppure effetti sulla capacità di accoppiamento, sulla fertilità o sul numero di impianti vivi fino al giorno 14/15/16 di gestazione nei ratti della generazione F1 con dosi inalatorie di 3665 mcg/kg/die (circa 2970 volte la MRHDID in adulti calcolata su base m²).
Altre indicazioni
Incompatibilità
Non applicabile.
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Stabilità dopo apertura:
Utilizzare l'inalatore Striverdi Respimat entro 3 mesi dall'inserimento della cartuccia.
Indicazioni particolari concernenti l'immagazzinamento
Conservare fuori dalla portata dei bambini.
Indicazioni per la manipolazione
Consultare le istruzioni per l'uso dell'inalatore Respimat (riutilizzabile) allegate alla confezione.
Numero dell'omologazione
67399 (Swissmedic).
Titolare dell’omologazione
Boehringer Ingelheim (Schweiz) GmbH, Basilea.
Stato dell'informazione
Marzo 2020.
Composition
Principe actif
Olodaterolum (ut Olodateroli hydrochloridum).
Excipients
Chlorure de benzalkonium (0,0011 mg à chaque bouffée), édétate disodique de calcium, acide citrique, eau.
Forme pharmaceutique et quantité de principe actif par unité
Solution pour inhalation.
2,5 microgrammes d'olodatérol sont délivrés par bouffée; une dose est composée de deux bouffées.
Indications/Possibilités d’emploi
Striverdi Respimat est un bronchodilatateur destiné au traitement symptomatique à long terme des patients atteints de BPCO (bronchopneumopathie chronique obstructive).
Posologie/Mode d’emploi
Posologie usuelle
La dose recommandée chez l'adulte est de 5 microgrammes d'olodatérol. Ceci correspond à deux bouffées au moyen de l'inhalateur Respimat une fois par jour, au même moment de la journée.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
Les patients souffrant d'une altération légère à modérée de la fonction hépatique peuvent utiliser Striverdi Respimat à la dose recommandée.
Aucune donnée relative à l'utilisation de Striverdi Respimat chez les patients souffrant d'une altération importante de la fonction hépatique n'est disponible.
Patients présentant des troubles de la fonction rénale
Les patients souffrant d'une altération de la fonction rénale peuvent utiliser Striverdi Respimat à la dose recommandée.
Un mode d'emploi précis relatif à la manipulation du Respimat est joint à l'emballage.
Personnes âgées
Les patients âgés peuvent utiliser Striverdi Respimat à la dose recommandée.
Enfants et adolescents
La BPCO est une maladie qui n'affecte généralement pas les enfants. L'innocuité et l'efficacité de Striverdi Respimat n'ont pas été étudiées chez les patients pédiatriques.
Contre-indications
L'utilisation de Striverdi Respimat est déconseillée chez les patients souffrant d'hypersensibilité à l'olodatérol ou à un autre composant de ce médicament.
Mises en garde et précautions
Striverdi Respimat contient du chlorure de benzalkonium, ce composant est susceptible de provoquer une respiration sifflante ainsi que des difficultés respiratoires (bronchospasmes – contractions convulsives des voies respiratoires), notamment si vous souffrez d'asthme. |
Asthme
Striverdi Respimat ne doit pas être administré en cas d'asthme. L'efficacité à long terme et l'innocuité de l'olodatérol n'ont pas été établies chez les patients asthmatiques.
Bronchospasme aigu
Striverdi Respimat n'est pas indiqué pour le traitement des épisodes aigus de bronchospasme, c'est-à-dire en traitement de secours.
Hypersensibilité
Comme tous les médicaments, des réactions d'hypersensibilité immédiate peuvent apparaître après l'utilisation de Striverdi Respimat.
Bronchospasme paradoxal
A l'instar d'autres traitements en inhalation, Striverdi Respimat peut déclencher un bronchospasme paradoxal susceptible de mettre en danger la vie du patient. Si un tel bronchospasme se produit, il convient de mettre fin immédiatement au traitement par Striverdi Respimat et de le remplacer par un autre traitement.
Actions systémiques
Les bêta2-agonistes à longue durée d'action doivent être administrés avec prudence aux patients atteints d'affections cardiovasculaires. Ceci s'applique en particulier aux patients souffrant d'insuffisance coronarienne, d'arythmie cardiaque, de myocardiopathie obstructive hypertrophique et d'hypertension, aux patients atteints de troubles convulsifs ou de thyrotoxicose, aux patients chez qui un allongement de l'intervalle QT est connu ou soupçonné et aux patients qui répondent de manière particulièrement marquée aux amines sympathomimétiques.
Les patients ayant des antécédents d'infarctus du myocarde anamnétique au cours de la dernière année, souffrant d'arythmie cardiaque instable ou menaçant la vie, ayant été hospitalisés pour une insuffisance cardiaque au cours de la dernière année ou ayant reçu un diagnostic de tachycardie paroxystique (>100 battements par minute) étaient exclus des études cliniques. Par conséquent, l'expérience chez ces groupes de patients est limitée. Striverdi Respimat doit être administré avec prudence chez ces groupes de patients.
Effets cardiovasculaires
L'olodatérol peut, comme d'autres bêta2-agonistes, provoquer chez certains patients des effets cardiovasculaires ayant une portée clinique, à savoir une augmentation de la fréquence cardiaque, une augmentation de la tension artérielle et/ou des symptômes correspondants. Ces manifestations peuvent imposer l'arrêt du traitement. En outre, on sait que les bêta-agonistes peuvent altérer le tracé de l'électrocardiogramme (ECG), p. ex., sous la forme d'un aplatissement de l'onde T et d'un sous-décalage du segment ST.
Avant de prescrire un traitement chronique à base de bêta-agonistes comme Striverdi Respimat, il convient d'examiner les patients souffrants de BPCO afin de détecter toute affection cardiovasculaire concomitante. Il convient également de réaliser un ECG portant sur l'allongement de l'intervalle QTc.
Hypokaliémie
Les bêta2-agonistes peuvent entraîner une hypokaliémie marquée chez certains patients, laquelle peut provoquer des effets cardiovasculaires indésirables. La diminution du taux de potassium sérique est généralement temporaire et ne nécessite pas l'administration de suppléments. En cas de BPCO grave, l'hypoxie et les traitements concomitants peuvent accentuer l'hypokaliémie (voir «Interactions») et, de ce fait, rendre le patient plus à risque d'arythmie cardiaque.
Hyperglycémie
L'inhalation de fortes doses de bêta2-agonistes peut provoquer une hausse de la glycémie.
Striverdi Respimat ne peut être utilisé concomitamment avec d'autres médicaments qui contiennent des bêta2-agonistes à longue durée d'action.
Les patients qui inhalent régulièrement des bêta2-agonistes à longue durée d'action (4 fois par jour p. ex.) doivent être informés qu'ils ne doivent les utiliser que pour atténuer les symptômes en cas de difficulté respiratoire importante.
Faire preuve de prudence en cas de changement du traitement et de passage à une autre forme posologique et/ou un autre médicament contenant le même principe actif. Il convient de contrôler le patient de manière adéquate.
Interactions
Médicaments connus pour allonger l'intervalle QTc
L'olodatérol, tout comme les autres bêta2-agonistes, peut augmenter le risque d'arythmie ventriculaire chez les patients traités par des médicaments connus pour allonger l'intervalle QTc. De tels médicaments sont par exemple certains antihistaminiques (terfénadine, mizolastine p. ex.), certains antiarythmiques (chinidine p. ex.), la phénothiazine, l'érythromycine, le ritonavir et les antidépresseurs tricycliques. L'administration supplémentaire de sympathomimétiques peut renforcer des effets cardiovasculaires indésirables. Striverdi Respimat doit être administré avec prudence aux patients traités par des inhibiteurs de la monoamine-oxydase ou des antidépresseurs tricycliques, étant donné que l'effet des β2 stimulants sur le système cardiovasculaire peut être renforcé.
Sympathomimétiques
L'administration concomitante d'autres principes actifs adrénergiques peut potentialiser les effets indésirables de Striverdi Respimat.
Dérivés de la xanthine, stéroïdes et diurétiques
L'administration concomitante de dérivés de la xanthine, de stéroïdes ou de diurétiques non épargneurs de potassium peut potentialiser les éventuels effets hypokaliémiants des agonistes des récepteurs adrénergiques (voir «Mises en garde et précautions»).
Bêtabloquants
Les bêtabloquants peuvent affaiblir ou annuler l'effet de Striverdi Respimat. Par conséquent, Striverdi Respimat ne doit pas être administré en concomitance avec des bêtabloquants (y compris le collyre en solution), à moins que leur utilisation soit absolument nécessaire. Dans ce contexte, les bêtabloquants cardiosélectifs pourraient être envisagés, bien qu'ils doivent être administrés avec prudence.
Inhibiteurs de la monoamine-oxydase, antidépresseurs tricycliques, médicaments allongeant l'intervalle QTc
Les inhibiteurs de la monoamine-oxydase, les antidépresseurs tricycliques ou les autres substances connues pour allonger l'intervalle QTc renforcent les effets de Striverdi Respimat sur le système cardiovasculaire.
Interactions pharmacocinétiques
Dans une étude sur les interactions médicamenteuses utilisant le kétoconazole, un puissant inhibiteur à la fois du CYP et de la glycoprotéine P (P-gp), une augmentation de l'exposition systémique à l'olodatérol de 1,7 fois a été observée (voir «Pharmacocinétique»). Aucun problème relatif à l'innocuité n'a été mis en évidence dans des études cliniques d'une durée allant jusqu'à un an sur Striverdi Respimat à des doses pouvant atteindre le double de la dose thérapeutique recommandée. Aucun ajustement posologique n'est nécessaire.
Interactions en cas d'utilisation d'autres préparations administrées par voie inhalée
L'administration de Striverdi Respimat entraîne une bronchodilatation chez les patients souffrant de BPCO et peut ainsi accroître l'absorption pulmonaire et la disponibilité systémique d'une substance inhalée consécutivement. En raison de cet effet potentiel, l'administration concomitante d'autres substances par voie inhalée doit être considérée avec prudence et il convient de choisir précisément la dose efficace la plus faible.
Grossesse/Allaitement
Grossesse
Il n'existe aucune donnée clinique sur l'exposition à Striverdi Respimat pendant la grossesse.
Les données précliniques ont révélé des effets typiques des bêta-agonistes à des multiples élevés des doses thérapeutiques (voir «Données précliniques»).
Striverdi Respimat ne doit pas être administré pendant la grossesse, à moins que son utilisation soit absolument nécessaire.
Il convient de prendre en compte l'effet inhibiteur des contractions de l'utérus des bêta-agonistes.
Allaitement
Il n'existe aucune donnée clinique sur l'exposition à l'olodatérol pendant l'allaitement.
Le principe actif et/ou ses métabolites ont été détectés dans le lait de rates en lactation. On ignore toutefois si l'olodatérol passe dans le lait maternel chez l'humain. Par conséquent, l'administration chez des femmes qui allaitent n'est pas recommandée.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Les effets sur la capacité de conduire un véhicule ou de faire fonctionner des machines n'ont pas été étudiés.
Toutefois, les patients doivent être avisés que des vertiges ont été rapportés au cours des études cliniques. Par conséquent, la prudence est recommandée pour les utilisateurs de véhicules ou de machines. Si les patients ressentent des vertiges, ils devraient éviter les tâches potentiellement dangereuses, telles que conduire un véhicule ou utiliser des machines.
Effets indésirables
L'innocuité de Striverdi Respimat a été étudiée dans des études cliniques contrôlées contre agent actif et contre placebo, avec groupes parallèles ou croisés portant sur 4167 patients atteints de BPCO en tout. Au total, 1927 patients souffrant de BPCO ont reçu la dose cible de 5 microgrammes d'olodatérol.
Les données disponibles sur les effets secondaires de Striverdi Respimat proviennent essentiellement de patients atteints de BPCO ayant participé à 4 études cliniques à long terme (48 semaines) contrôlées contre placebo avec groupes parallèles. Deux de ces études comportaient un groupe de contrôle contre agent actif.
Infections
Occasionnels: rhinopharyngite.
Troubles du système nerveux
Occasionnels: vertiges.
Troubles vasculaires
Fréquence indéterminée*: hypertension.
Troubles cutanés
Occasionnels: éruption cutanée.
Troubles musculosquelettiques
Rares: arthralgie.
* Fréquence indéterminée, étant donné que l'effet indésirable n'apparaît pas dans les données relatives aux études cliniques sur 1035 patients.
Effets indésirables après commercialisation
La survenue d'une éruption cutanée peut être considérée comme une réaction d'hypersensibilité à Striverdi Respimat. Comme c'est le cas pour tous les médicaments topiques qui sont résorbés, d'autres réactions d'hypersensibilité peuvent survenir.
L'olodatérol fait partie de la classe des bêta2-agonistes à longue durée d'action. Il faut par conséquent s'attendre à ce que les effets indésirables de ce médicament soient semblables aux effets indésirables typiques des médicaments de cette classe, ils comprennent entre autres: la tachycardie, l'arythmie, les palpitations, l'ischémie myocardique, l'angine de poitrine, l'hypertension ou l'hypotension, les tremblements, les céphalées, la nervosité, l'insomnie, les vertiges, la sécheresse buccale, les nausées, les spasmes musculaires, la fatigue, les malaises, l'hypokaliémie, l'hyperglycémie et l'acidose métabolique.
Description de certains effets indésirables
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Signes et symptômes
Une surdose d'olodatérol risque d'amplifier les effets typiques des bêta2-agonistes: ischémie myocardique, hypertension ou hypotension, tachycardie, arythmie, palpitations, vertiges, nervosité, insomnie, anxiété, céphalées, tremblements, sécheresse buccale, spasmes musculaires, nausées, fatigue, malaises, hypokaliémie, hyperglycémie et acidose métabolique.
Traitement
Le traitement par Striverdi Respimat doit être arrêté, un traitement supportif et symptomatique doit être instauré. Les cas graves nécessitent une hospitalisation. Le recours à un bêtabloquant cardiosélectif peut être envisagé, mais seulement avec une extrême prudence, étant donné que les bêtabloquants peuvent déclencher un bronchospasme.
Propriétés/Effets
Code ATC
R03AC19
Mécanisme d'action/Pharmacodynamique
L'olodatérol est doté d'une forte affinité et d'une sélectivité élevée pour les récepteurs bêta2-adrénergiques humains.
Des études in vitro ont montré que l'activité agoniste de l'olodatérol aux récepteurs bêta2-adrénergiques est plus de 219 fois plus élevée qu'aux récepteurs bêta1-adrénergiques et 1622 fois plus élevée qu'aux récepteurs bêta3-adrénergiques.
La substance exerce ses effets pharmacologiques par fixation et activation des récepteurs bêta2-adrénergiques après l'administration topique par inhalation.
L'activation de ces récepteurs dans les voies respiratoires se traduit par une stimulation de l'adénylcyclase intracellulaire, une enzyme qui intervient dans la synthèse de l'AMP cyclique (adénosine monophosphate 3',5' cyclique; AMPc). Des taux élevés d'AMPc induisent une bronchodilatation par relaxation des cellules musculaires lisses des voies respiratoires.
Des études précliniques ont montré que l'olodatérol a le profil d'un bêta2-agoniste sélectif à longue durée d'action (BALA) doté d'un début d'action rapide et d'une durée d'action d'au moins 24 heures.
Les récepteurs bêta-adrénergiques se divisent en trois sous-types: les récepteurs bêta1-adrénergiques principalement exprimés sur les cellules du muscle lisse cardiaque, les récepteurs bêta2-adrénergiques principalement exprimés sur les cellules musculaires des voies respiratoires et les récepteurs bêta3-adrénergiques principalement exprimés sur les cellules du tissu adipeux. Les bêta2-agonistes provoquent une bronchodilatation. Bien que le récepteur bêta2-adrénergique soit le principal récepteur adrénergique du muscle lisse des voies respiratoires, il est également présent à la surface de divers autres types de cellules, dont les cellules épithéliales et endothéliales pulmonaires et les cellules du cœur. La fonction précise des récepteurs bêta2-adrénergiques dans le cœur est inconnue, mais leur présence laisse supposer que même les bêta2-agonistes hautement sélectifs puissent avoir des effets cardiaques.
Efficacité clinique
Effets sur l'électrophysiologie cardiaque
L'effet de l'olodatérol sur l'intervalle QT/QTc de l'ECG a été évalué chez 24 volontaires hommes et femmes sains dans une étude randomisée, contrôlée contre placebo et contre agent actif (moxifloxacine). Il a été démontré que l'intervalle QT était plus fort en moyenne de 1,6 milliseconde (avec 10 microgrammes d'olodatérol) à 6,5 millisecondes (avec 50 microgrammes d'oladotérol) par rapport à la valeur initiale et au placebo entre 20 minutes et 2 heures suivant la première administration d'une seule dose d'olodatérol (10, 20, 30 et 50 microgrammes); cet effet est dose-dépendant, la limite supérieure de l'intervalle de confiance double à 90% pour tous les dosages était inférieure à 10 millisecondes.
Dans les études de phase 3 contrôlées contre placebo, sur 48 semaines, l'effet de 5 microgrammes et de 10 microgrammes de Striverdi Respimat sur la fréquence et le rythme cardiaque a été étudié à l'aide d'un monitorage par ECG continu de 24h (monitorage Holter) dans un sous-groupe de 772 patients. Aucune tendance dans l'ampleur des variations moyennes de la fréquence cardiaque ou des extrasystoles dose-dépendante ou dépendante du temps n'a été observée. Les variations des extrasystoles entre le début et la fin du traitement n'ont révélé aucune différence significative entre l'olodatérol à 5 microgrammes, l'olodatérol à 10 microgrammes et le placebo.
Le programme de développement clinique de phase III de Striverdi Respimat était composé de huit études en double aveugle, randomisées, contrôlées contre placebo. Ces huit études étaient identiques deux par deux. Parmi les 3533 participants atteints de BPCO, 1281 ont reçu la dose de 5 microgrammes et 1284 la dose de 10 microgrammes.
Ont été réalisées:
- Deux études de 48 semaines contrôlées contre placebo et conçues de façon identique présentant des groupes parallèles [études 1 et 2]
- Deux études de 48 semaines contrôlées contre placebo et contre agent actif conçues de façon identique présentant des groupes parallèles avec du formotérol 12 microgrammes deux fois par jour en thérapie comparative active [études 3 et 4]
- Deux études de 6 semaines croisées contrôlées contre placebo et contre agent actif conçues de façon identique avec du formotérol 12 microgrammes deux fois par jour en thérapie comparative active [études 5 et 6]
- Deux études de 6 semaines croisées contrôlées contre placebo et contre agent actif conçues de façon identique avec du tiotropium HandiHaler 18 microgrammes une fois par jour en thérapie comparative active [études 7 et 8].
Dans toutes les études, la fonction pulmonaire a été mesurée (volume expiratoire maximal par seconde, VEMS). En outre, les études de 48 semaines ont pmeris de mesurer la réponse de la fonction pulmonaire en phase de pointe (ASC0-3) et en phase de creux. En revanche, les études de 6 semaines comportaient la définition continue du profil de la fonction pulmonaire avec un intervalle posologique de 24 heures. Dans les deux études identiques de 48 semaines contrôlées contre placebo et contre agent actif, l'indice de dyspnée de transition (IDT) visant à évaluer la dyspnée et le questionnaire respiratoire du St George's Hospital (SGRQ) pour l'évaluation de la qualité de vie en considérant l'état de santé, ont été utilisés.
Des patients âgés de 40 ans ou plus présentant un diagnostique clinique d'une BPCO, des antécédents médicaux de fumeur d'au moins 10 paquets-années consécutives et une limitation modérée à très grave de la fonction pulmonaire (VEMS après utilisation d'un bronchodilatateur <80% de la valeur normale [stade GOLD II-IV]; quotient VEMS/CVF après utilisation d'un bronchodilatateur <70%) ont participé au programme de développement de la phase III.
Caractéristiques des patients
Les 3104 patients recrutés pour les études internationales de 48 semaines [études 1 et 2, études 3 et 4] étaient en grande partie des hommes (77%) et d'origine européenne (66%) ou asiatique (32%) d'un âge moyen de 64 ans. La VEMS moyenne après utilisation d'un bronchodilatateur s'élevait à 1,38 litre (GOLD II [50%], GOLD III [40%], GOLD IV [10%]). L'administration d'un bêta2-agoniste a conduit en moyenne à une modification de 15% de la valeur initiale (0,160 litre). Tous les médicaments de traitement pulmonaires (p.ex. tiotropium [24%], ipratropium [25%], stéroïdes par voie inhalée [45%], xanthines [16%]) étaient autorisés en traitement adjuvant, à l'exception des autres bêta2-agonistes à longue durée d'action. L'inclusion des patients a été réalisée par stratification après l'utilisation de tiotropium. Dans les quatre études, les critères d'efficacité principaux suivants ont été considérés pour évaluer l'effet sur la fonction pulmonaire: modification du volume forcé par seconde dans une période de 0 à 3 heures (VEMS ASC0-3 h) et dans la phase de creux (avant la dose suivante), respectivement par rapport à la valeur initiale avant le début du traitement (après 12 semaines pour les études 1 et 2, après 24 semaines pour les études 3 et 4).
Les études de 6 semaines [études 5 et 6, études 7 et 8] ont été réalisées en Europe et en Amérique du Nord. Les 199 patients recrutés pour les études 5 et 6 étaient en grande partie des hommes (53%) et d'origine européenne (93%) d'un âge moyen de 63 ans. Le VEMS moyen après utilisation d'un bronchodilatateur s'élevait à 1,43 litre (GOLD II [54%], GOLD III [39%], GOLD IV [7%]). L'administration d'un bêta2-agoniste a conduit en moyenne à une modification de 17% de la valeur initiale (0,187 litre). Tous les médicaments de traitement pulmonaires (p.ex. tiotropium [24%], ipratropium [16%], stéroïdes par voie inhalée [31%], xanthines [0,5%]) étaient autorisés en traitement adjuvant, à l'exception des autres bêta2-agonistes à longue durée d'action. Le titropium devait toutefois être arrêté respectivement 48 h avant les mesures des critères d'efficacité spirométriques. Les 230 patients recrutés pour les études 7 et 8 étaient également en grande partie des hommes (69%) et d'origine européenne (99,6%) d'un âge moyen de 62 ans. Le VEMS moyen après utilisation d'un bronchodilatateur s'élevait à 1,55 litre (GOLD II [57%], GOLD III [35%], GOLD IV [7%]), la modification moyenne par l'administration d'un bêta2-agoniste atteignant 18% de la valeur initiale (0,203 litre). Tous les médicaments de traitement pulmonaires (p.ex. stéroïdes par voie inhalée [49%], xanthines [7%]) étaient autorisés en traitement adjuvant, à l'exception des autres bêta2-agonistes à longue durée d'action et des anticholinergiques.
Fonction pulmonaire
Dans les études de 48 semaines, l'administration de 5 microgrammes de Striverdi Respimat une fois par jour le matin dans les 5 minutes suivant la première dose a démontré une amélioration significative (p<0,0001) de la fonction pulmonaire (augmentation moyenne du VEMS 0,130 litre avec une valeur initiale de 1,18 litre avant le traitement). L'amélioration significative de la fonction pulmonaire s'est maintenue 24 heures (augmentation moyenne de la VEMS ASC0-3h 0,162 litre par rapport au placebo, p<0,0001; augmentation moyenne de la valeur minimale du VEMS après 24 heures 0,071 par rapport au placebo, p<0,0001); l'amélioration des valeurs de la fonction pulmonaire était évidente à la fois pour les utilisateurs et pour les non-utilisateurs du tiotropium. L'amélioration de la VEMS ASC0-3 h et de la valeur minimale du VEMS était comparable à celle obtenue avec le formotérol deux fois par jour. Les effets bronchodilatateurs de Striverdi Respimat se sont maintenus jusqu'à la fin des 48 semaines de traitement. Striverdi Respimat a également amélioré les valeurs du DEP (débit expiratoire de pointe) mesurées le matin et le soir par rapport au placebo, ce qui fut constaté grâce aux notes quotidiennes des patients.
Dans les études de 6 semaines des valeurs VEMS, les patients traités par Striverdi Respimat ont répondu plus favorablement au traitement pendant la totalité de l'intervalle posologique de 24 heures par rapport aux patients sous placebo (p<0,0001) (illustration 1, illustration 2, tableau 1).
Illustration 1: Profil VEMS sous Striverdi Respimat 5 microgrammes et sous placebo mesuré de façon continue pendant l'intégralité de l'intervalle posologique de 24 heures (études 5 et 6; données combinées; les anticholinergiques étaient autorisés en traitement adjuvant)
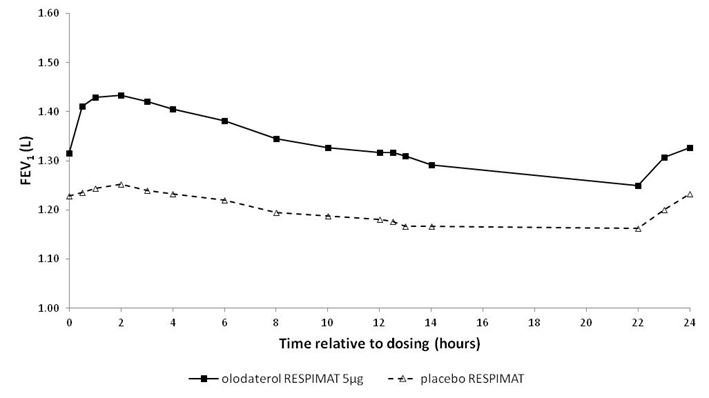
Illustration 2: Profil VEMS sous Striverdi Respimat 5 microgrammes et sous placebo mesuré de façon continue pendant l'intégralité de l'intervalle posologique de 24 heures (études 7 et 8; données combinées; les anticholinergiques n'étaient pas autorisés en traitement adjuvant)
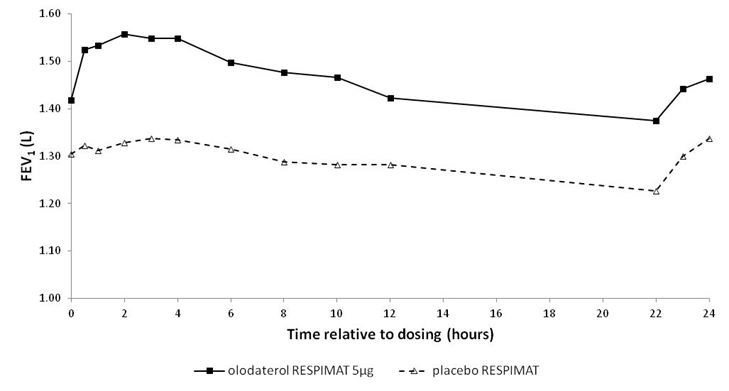
Tableau 1: Différences entre les valeurs de VEMS sous Striverdi Respimat 5 microgrammes et sous placebo mesurées de façon continue pendant l'intégralité de l'intervalle posologique de 24 heures après 6 semaines de traitement dans les études 5 et 6 (données combinées) et dans les études 7 et 8 (données combinées)
VEMS: différence vs placebo (litre)1 | ||||
Moyenne après 3 h | Moyenne après 12 h | Moyenne après 24 h | Valeur minimale | |
Etudes 5 et 6 | 0,175 | 0,160 | 0,137 | 0,102 |
Etudes 7 et 8 | 0,211 | 0,193 | 0,168 | 0,134 |
1 Valeurs initiales avant le début du traitement: VEMS = 1,26 litre (études 5 et 6) et 1,33 litre (études 7 et 8).
L'indice de dyspnée de transition (IDT) et le questionnaire respiratoire du St George's Hospital (SGRQ) ont également été utilisés dans les études de confirmation de 48 semaines contrôlées contre placebo et agent actif (études 1 et 2).
Après 24 semaines, l'analyse primaire du groupe placebo d'une étude (tableau 1) n'a démontré aucune différence significative entre Striverdi Respimat, le formotérol et le placebo en ce qui concerne la valeur de l'IDT; dans une analyse post-hoc, dans laquelle les abandons de l'étude par le patient étaient prises en compte, la différence entre Striverdi Respimat et le placebo était de p=0,027.
Tableau 2: Valeur de l'IDT après 24 semaines de traitement
Valeur moyenne du traitement | Différence par rapport au placebo | ||
Analyse primaire | Placebo | 1,5 (0,2) | |
Olodatérol 5 µg une fois par jour | 1,9 (0,2) | 0,3 (p=0,1704) | |
Formotérol 12 μg deux fois par jour | 1,8 (0,2) | 0,2 (p=0,3718) | |
Analyse post-hoc | Placebo | 1,5 (0,2) | |
Olodatérol 5 μg une fois par jour | 2,0 (0,2) | 0,5 (p=0,0270) | |
Formotérol 12 μg deux fois par jour | 1,8 (0,2) | 0,4 (p=0,1166) |
Exacerbations, qualité de vie, besoin de médicaments de secours, échelle PGR.
Dans les études identiques de 48 semaines contrôlées contre placebo et contre agent actif [études 3 et 4], les exacerbations et la qualité de vie évaluée à l'aide du questionnaire SGRQ (questionnaire respiratoire du St George's Hospital) furent considérées comme critères d'évaluation de l'efficacité secondaires.
L'olodatérol et le formotérol ont tous deux démontré des différences cohérentes par rapport au placebo en ce qui concerne la fréquence des exacerbations. Après 24 semaines, le score SGRQ total moyen des patients traités par Striverdi Respimat était significativement meilleur que celui des patients sous placebo (tableau 2); on peut observer une amélioration dans les 3 domaines SGRQ (troubles, activités, conséquences). Les patients sous Striverdi Respimat ont démontré une amélioration du score SGRQ global au-delà de la différence minimale cliniquement pertinente par rapport au placebo (MCID: 4 points) (50,2% vs 36,4%, p<0,0001).
Tableau 3: Scores globaux et scores SGRQ pour les différents domaines après un traitement de 24 semaines
Valeur moyenne du traitement | Différence vs placebo | ||
Score total | Valeur initiale | 44,4 | |
Placebo | 41,6 (-2,8) | ||
Olodatérol 5 µg une fois par jour | 38,8 (-5,6) | -2,8 (p=0,0034) | |
Formotérol 12 μg deux fois par jour | 40,4 (-4,0) | -1,2 (p=0,2009) | |
Troubles | Placebo | 46,0 | |
Olodatérol 5 µg une fois par jour | 41,1 | -4,8 (p=0,0004) | |
Formotérol 12 μg deux fois par jour | 43,7 | -2,3 (p=0,0924) | |
Activités | Placebo | 55,3 | |
Olodatérol 5 µg une fois par jour | 52,9 | -2,4 (p=0,0455) | |
Formotérol 12 μg deux fois par jour | 55,0 | -0,3 (p=0,7797) | |
Répercussions | Placebo | 32,3 | |
Olodatérol 5 µg une fois par jour | 29,7 | -2,6 (p=0,0157) | |
Formotérol 12 μg deux fois par jour | 30,8 | -1,5 (p=0,1605) |
Les patients traités par Striverdi Respimat avaient besoin de moins de salbutamol en médicament de secours aussi bien de jour que de nuit par rapport aux patients recevant le placebo.
Dans chaque étude de 48 semaines, les patients qui furent traités par Striverdi Respimat ont atteint une amélioration supérieure de leur fonction respiratoire par rapport aux patients du groupe placebo. Ceci a été mesuré grâce à l'échelle PGR (Patient's Global Rating Scale); ce résultat est un élément supplémentaire pour étayer l'effet positif sur les symptômes.
Tolérance à l'effort
L'effet de Striverdi Respimat sur la tolérance à l'effort limitée par la survenue de symptômes chez les patients atteints de BPCO a été étudié dans deux études croisées en double aveugle, identiques, randomisées, contrôlées contre placebo d'une durée de 6 semaines. Dans ces études, Striverdi Respimat a amélioré significativement la durée de tolérance à l'effort de 14,0% (p=0,0002) et de 11,8% (p=0,0018) par rapport au placebo. Striverdi Respimat a également réduit l'hyperinflation pulmonaire (capacité résiduelle fonctionnelle réduite, CRF) avec pour conséquence une augmentation de la capacité inspiratoire au repos et à l'effort par rapport au placebo.
Pharmacocinétique
Les informations disponibles sur les paramètres pharmacocinétiques de l'olodatérol ont été obtenues auprès de sujets sains, de patients atteints de BPCO et de patients asthmatiques après inhalation orale de doses égales ou supérieures à la dose thérapeutique.
L'olodatérol a affiché une pharmacocinétique linéaire et une augmentation proportionnelle à la dose de l'exposition systémique après des doses inhalées uniques de 5 à 70 microgrammes et des doses multiples de 2 à 20 microgrammes inhalées une fois par jour.
Avec l'inhalation répétée du médicament une fois par jour, les concentrations plasmatiques d'olodatérol avaient atteint l'état d'équilibre après 8 jours, et le degré d'exposition avait augmenté de 1,8 fois par rapport à une dose unique.
Absorption
L'olodatérol est rapidement résorbé sous inhalation. Les concentrations plasmatiques maximales sont généralement atteintes 10 à 20 minutes après l'inhalation du médicament. Chez des volontaires sains, la biodisponibilité absolue de l'olodatérol après inhalation a été estimée à environ 30%, tandis que la biodisponibilité absolue était inférieure à 1% lorsque le médicament était administré sous forme de solution orale. Ainsi, pour la disponibilité systémique de l'olodatérol après administration par inhalation, c'est la résorption dans les poumons qui est déterminante avant tout, alors qu'une partie de la dose probablement avalée ne contribue pas de façon significative à l'exposition systémique.
Distribution
L'olodatérol affiche une cinétique de distribution à multiples compartiments après l'inhalation ainsi qu'après l'administration par voie intraveineuse. Son volume de distribution est très élevé (1110 litres), ce qui semble indiquer une distribution importante dans les tissus. La liaison in vitro de l'olodatérol marqué au 14C avec les protéines plasmatiques humaines est indépendante de la concentration et est d'environ 60%.
Métabolisme
L'olodatérol est substantiellement métabolisé par glucoconjugaison et par O-déméthylation du groupe méthoxy suivie de conjugaison. Des six métabolites identifiés, seul le produit de déméthylation non conjugué (SOM 1522) se lie aux récepteurs bêta2; toutefois, ce métabolite n'est pas détectable dans le plasma après l'inhalation à long terme de la dose thérapeutique recommandée ou de doses jusqu'à 4 fois supérieures.
C'est pourquoi l'odolatérol est considéré comme étant seul à l'origine de l'effet pharmacologique.
Les isoenzymes du cytochrome P450 CYP2C9 et CYP2C8, et dans une très faible mesure le CYP3A4, interviennent dans l'O-déméthylation de l'olodatérol. En revanche, les isoformes de l'uridine diphospho-glycosyltransférase (UGT2B7, UGT1A1, 1A7 et 1A9) interviennent dans la formation des glucoconjugués d'olodatérol.
Elimination
La clairance totale de l'olodatérol est de 872 ml/min chez des volontaires sains, et la clairance rénale est de 173 ml/min.
La demi-vie terminale est de 22 heures suivant l'administration par voie intraveineuse. En revanche, la demi-vie terminale suivant l'inhalation est d'environ 45 heures, ce qui indique que cette dernière est déterminée par la résorption plutôt que par l'élimination.
Après administration par voie intraveineuse d'olodatérol marqué au 14C, 38% de la dose radioactive ont été récupérés dans l'urine et 53% dans les fèces. La quantité d'olodatérol inchangé récupérée dans l'urine après administration par voie intraveineuse était de 19%. Après administration par voie orale, seulement 9% de la radioactivité ont été récupérés dans l'urine, tandis que la majeure partie a été récupérée dans les fèces (84%). Plus de 90% de la dose ont été excrétés dans les 6 jours suivant l'administration par voie intraveineuse et dans les 5 jours suivant l'administration par voie orale. Après inhalation, l'olodatérol inchangé excrété dans l'urine à l'intérieur de l'intervalle posologique chez des volontaires sains à l'état d'équilibre représentait 5 à 7% de la dose.
Cinétique pour certains groupes de patients
Les données de deux études cliniques regroupant un total de 405 patients atteints de BPCO et 296 patients souffrants d'asthme traités par Striverdi Respimat ont été étudiées dans le cadre d'une méta-analyse pharmacocinétique.
Selon cette analyse, aucun ajustement posologique n'est nécessaire en fonction de l'âge, du sexe et du poids corporel en raison de l'exposition systémique suite à l'inhalation de Striverdi Respimat.
Origine ethnique
La comparaison des données pharmacocinétiques tant d'une même étude que d'une étude à l'autre a révélé une tendance à une exposition systémique plus élevée chez les Japonais et les autres Asiatiques que chez les sujets d'origine européenne.
Aucun problème de sécurité n'a été mis en évidence dans des études cliniques d'une durée allant jusqu'à un an sur des sujets d'origine européenne et asiatique sur Striverdi Respimat à des doses pouvant atteindre le double de la dose thérapeutique recommandée.
Troubles de la fonction hépatique
Chez les patients atteints de troubles de la fonction hépatique légers ou modérés, l'exposition systémique à l'olodatérol n'a pas été altérée. Les répercussions de troubles de la fonction hépatique graves sur l'exposition systémique à l'olodatérol n'ont pas été étudiées.
Troubles de la fonction rénale
Chez les sujets atteints d'insuffisance rénale grave (CLCR <30 ml/min), l'exposition systémique à l'olodatérol a augmenté en moyenne de 1,4 fois.
Sur base des résultats d'études cliniques sur la sécurité de Striverdi Respimat, au cours desquelles les participants ont reçu sur une période d'un an maximum des doses qui pouvaient être jusqu'à deux fois supérieures à la dose thérapeutique conseillée, il apparaît qu'une augmentation posologique de cet ordre de grandeur n'a aucune influence sur la sécurité.
Interactions médicamenteuses
Des études sur les interactions médicamenteuses ont été menées à l'aide du fluconazole comme modèle d'inhibiteur du CYP 2C9 et du kétoconazole comme puissant inhibiteur de la P-gp et du CYP.
Fluconazole: l'administration concomitante de 400 mg de fluconazole une fois par jour pendant 14 jours n'a eu aucune répercussion pertinente sur l'exposition systémique à l'olodatérol.
Kétoconazole: l'administration concomitante de 400 mg de kétoconazole une fois par jour pendant 14 jours a augmenté la Cmax de l'olodatérol de 66% et son ASC0-1 de 68%.
Tiotropium: l'administration concomitante de 5 microgrammes de bromure de tiotropium (comme combinaison posologique fixe avec 10 microgrammes d'olodatérol à l'aide de Respimat) pendant 21 jours n'a eu aucune répercussion pertinente sur l'exposition systémique à l'olodatérol ou inversement.
Données précliniques
La toxicité aiguë après administration d'une dose unique par inhalation, par voie orale et par voie intraveineuse à des souris et des rats était faible.
Dans les études pharmacologiques sur l'innocuité après administration d'une dose unique, les effets observés sont ceux auxquels on peut s'attendre après la prise de bêta2-agonistes, à savoir entre autres une chute de la tension artérielle, une augmentation de la fréquence cardiaque et une augmentation de la force de contraction cardiaque.
Dans les études sur l'inhalation de doses répétées chez la souris, le rat et le chien, les effets étaient principalement liés aux propriétés bêta2-adrénergiques de l'olodatérol; il s'agissait entre autres de l'augmentation du poids corporel, de la masse musculaire et de l'ingestion de nourriture (rongeurs), d'une augmentation de la fréquence cardiaque, de variations de la distribution du glycogène dans le foie et la nécrose des muscles papillaires (chien).
Dans une étude sur les effets d'une inhalation répétée chez les jeunes chiens, des doses allant jusqu'à 1046 microgrammes/kg/jour ont été bien tolérées. Aucun signe d'entrave au développement pulmonaire ou cardiaque n'a été observé.
Chez le rat, après l'inhalation de doses allant jusqu'à 1054 microgrammes/kg/jour (ce qui correspond à environ 1600 fois la dose journalière maximale recommandée chez l'homme [Maximum Recommended Human Daily Inhalation Dose, MRHDID] de 5 microgrammes sur base du calcul mg/m²), aucun effet tératogène n'a été observé.
Une affinité de liaison de l'olodatérol et/ou de ses métabolites aux composants rétiniens contenant de la mélanine et également à la pigmentation cutanée a été observée chez le rat.
Les études cliniques menées sur l'humain et portant sur l'olodatérol n'ont toutefois montré aucun signe d'augmentation de la phototoxicité dermique ou oculaire.
Mutagénicité
Dans le test in vivo (test du micronoyau sur la moelle osseuse chez le rat) réalisé après inhalation (à des doses allant jusqu'à 2000 fois la dose journalière maximale recommandée chez l'homme sur base m2) ainsi que dans des tests in vitro (tests de mutagénicité: test d'Ames, analyse des mutations du lymphome de la souris), l'olodatérol s'est révélé dénué de tout pouvoir génotoxique jusqu'à des doses très élevées. Une augmentation de la fréquence des micro-noyaux observée chez le rat après une exposition intraveineuse à au moins 3500 fois la dose journalière maximale recommandée chez l'homme pourrait être liée à une érythropoïèse (compensatrice) potentialisée par le médicament.
Carcinogénicité
Les études sur la carcinogénicité de l'olodatérol inhalé chez la souris et le rat n'ont pas permis de déceler un quelconque potentiel cancérogène.
Le traitement à vie chez le rat à des expositions environ 2235 fois et environ 715 fois supérieures à celles obtenues à l'administration de la dose thérapeutique recommandée chez l'humain de 5 microgrammes une fois par jour (selon l'exposition systémique) a provoqué des léiomyomes du mésovarium propres à la classe et aux rongeurs. Le traitement à vie chez la souris à des expositions d'environ 477 à 3596 fois supérieures à celles obtenues à l'administration de la dose thérapeutique recommandée chez l'humain de 5 microgrammes une fois par jour (selon l'exposition systémique) a provoqué des tumeurs du muscle lisse (léiomyomes, léiomyosarcomes) de l'utérus et des foyers d'hyperplasie des cordons sexuels et du stroma gonadique, ainsi que des foyers d'hyperplasie lutéinique; dans ce cas également, les modifications observées étaient propres à la classe et aux rongeurs (exposition multiple).
Toxicité sur la reproduction
Chez des lapines blanches de Nouvelle-Zélande gestantes, une dose inhalée de 2489 microgrammes/kg/jour d'olodatérol (ce qui correspond à plus de 3500 fois la dose journalière maximale recommandée chez l'homme selon l'ASC0-24 h) a entraîné une toxicité fœtale résultant en une stimulation caractéristique des récepteurs bêta-adrénergiques; ces effets toxiques comprenaient des ossifications irrégulières, des os courts ou courbés, une ouverture partielle de l'œil, une fente palatine et des anomalies cardiovasculaires. Aucune conséquence significative n'a été observée en outre suite à l'inhalation de 974 microgrammes/kg (ce qui correspond à environ 1580 fois la dose journalière maximale recommandée chez l'adulte sur base du calcul m2).
Aucun trouble de la fertilité mâle ou femelle ou du développement embryonnaire précoce n'a été observé chez le rat à des doses pouvant atteindre 3068 microgrammes/kg (ce qui correspond à environ 3000 fois la dose journalière maximale recommandée chez l'adulte sur base du calcul m2).
Aucun effet n'a été observé sur l'accouplement, la fertilité ou le nombre d'implants vivants jusqu'au jour de gestation 14/15/16 chez la génération F1 chez le rat à des doses inhalées pouvant atteindre 3665 microgrammes/kg/jour (ce qui correspond à environ 2970 fois la dose journalière maximale recommandée chez l'adulte sur base du calcul m2).
Remarques particulières
Incompatibilités
Non pertinent.
Stabilité
Le médicament doit être impérativement utilisé avant la date «EXP» indiquée sur l'emballage.
L'inhalateur Striverdi Respimat doit être jeté au plus tard 3 mois après insertion de la cartouche.
Remarques particulières concernant le stockage
Médicament à conserver hors de portée des enfants.
Remarques concernant la manipulation
Voir le mode d'emploi de l'inhalateur Respimat (réutilisable) joint à l'emballage.
Numéro d’autorisation
67399 (Swissmedic).
Titulaire de l’autorisation
Boehringer Ingelheim (Schweiz) GmbH, Bâle.
Mise à jour de l’information
Mars 2020.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.



 Deutsch
Deutsch French
French Italian
Italian