Spiolto Respimat Inhal Lös 2.5 mcg / stroke reusable 60 Dos
Spiolto Respimat Inhal Lös 2.5 mcg/Hub wiederverwendbar 60 Dos
-
127.97 CHF
- Price in reward points: 3131

- Availability: In stock
- Product Code: 7752253
- ATC-code R03AL06
- EAN 7680673520017
Ingredients:
Benzalkonium chlorid 1.1 mcg, Salzsäure, konzentriert, Stickstoff, Dinatrium edetat, Tiotropium 2.5 mcg, Tiotropium bromid-1-Wasser, Benzalkoniumchlorid-Lösung, Olodaterol 2.5 mcg , Olodaterol hydrochlorid.

Variants
Description
Was ist SPIOLTO RESPIMAT und wann wird es angewendet?
Spiolto Respimat erleichtert Patienten mit chronisch obstruktiver Lungenerkrankung (COPD) das Atmen. Bei COPD handelt es sich um eine chronische Lungenerkrankung, die Atemnot und Husten verursacht. COPD ist eine chronische Erkrankung, deshalb sollte Spiolto Respimat täglich angewendet werden und nicht nur, wenn Atemprobleme oder andere Symptome der COPD auftreten.
Spiolto Respimat die zwei Wirkstoffe Tiotropium und Olodaterol enthält, welche die Atemwege erweitern und dadurch die Atemtätigkeit der Lungen erleichtern (sogenannte langwirksame Bronchodilatatoren). Die regelmässige Anwendung von Spiolto Respimat kann die bei dieser Erkrankung auftretende Atemnot lindern und hilft Ihnen, die Auswirkungen der Krankheit auf das Alltagsleben zu minimieren.
Die Anwendung erfolgt mit dem in dieser Packung enthaltenen Respimat-Inhalator.
Auf Verschreibung des Arztes oder der Ärztin.
Wann darf SPIOLTO RESPIMAT nicht angewendet werden?
Spiolto Respimat darf bei Überempfindlichkeit gegenüber Olodaterol oder Tiotropium oder eines Hilfsstoffs nicht inhaliert werden oder wenn Sie allergisch gegen Atropin und atropinähnlichen Substanzen oder wenn Sie Asthmatiker oder Asthmatikerin sind.
Kinder und Jugendliche
Spiolto Respimat darf nicht an Kinder und Jugendliche (unter 18 Jahren) verabreicht werden.
Wann ist bei der Anwendung von SPIOLTO RESPIMAT Vorsicht geboten?
Befolgen Sie alle Anweisungen Ihres Arztes oder Ihrer Ärztin genau.
Informieren Sie unbedingt Ihren Arzt bzw. Ihre Ärztin vor der Anwendung von Spiolto Respimat, wenn einer der folgenden Punkte auf Sie zutrifft:
- wenn Sie Herzprobleme haben;
- wenn Sie hohen Blutdruck haben;
- wenn Sie an Epilepsie leiden;
- wenn Sie Probleme mit der Schilddrüse haben;
- wenn Sie an Diabetes leiden;
- wenn Ihre Leberfunktion oder Nierenfunktion stark eingeschränkt ist;
- wenn bei Ihnen eine Operation geplant ist;
- wenn Sie an Engwinkelglaukom (einer Augenerkrankung) leiden;
- wenn Sie unter Prostatabeschwerden leiden oder Schwierigkeiten beim Wasserlassen haben;
- wenn Sie an anderen Krankheiten leiden, Allergien haben oder andere Arzneimittel (auch selbst gekaufte!) einnehmen oder äusserlich anwenden.
Informieren Sie sofort Ihren Arzt bzw. Ihre Ärztin während der Behandlung mit Spiolto Respimat, wenn Sie eines der folgenden Symptome feststellen:
- Spiolto Respimat enthält Benzalkoniumchlorid, dieser Bestandteil kann keuchende Atmung und Atemschwierigkeiten (Bronchospasmen - krampfartige Verengungen der Atemwege) hervorrufen, insbesondere wenn Sie an Asthma leiden.
- wenn Sie unmittelbar nach dem Inhalieren ein Engegefühl in der Brust, Husten, keuchende Atmung oder Atemnot bekommen. Die genannten Beschwerden können Zeichen einer Verkrampfung der Muskulatur in den Bronchien sein, die als Bronchospasmus bezeichnet wird;
- wenn Sie unmittelbar nach der Anwendung des Inhalators ihre Atmung verschlechtert oder Hautausschlag, Schwellungen oder Juckreiz auftreten;
- wenn Sie irgendwelche Nebenwirkungen bemerken, die Ihr Herz betreffen (Beschleunigung des Herzschlags, Anstieg des Blutdrucks und/oder Verstärkung von Symptomen wie Brustschmerzen);
- wenn bei Ihnen Muskelkrämpfe, Muskelschwäche oder Herzrhythmusstörungen auftreten (diese Beschwerden können durch einen niedrigen Kaliumspiegel im Blut bedingt sein).
Anwendung von Spiolto Respimat zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie andere (auch selbst gekaufte!) Arzneimittel anwenden bzw. vor kurzem angewendet haben. Dazu zählen insbesondere folgende Arzneimittel:
- Arzneimittel zur Behandlung von Parkinson oder Depressionen (z.B. sogenannte trizyklische Antidepressiva, Monoaminoxidase-Hemmer).
- Andere Arzneimittel, die zur Behandlung Ihrer Lungenkrankheit angewendet werden (deren Anwendung könnte dadurch das Risiko möglicher Nebenwirkungen erhöhen).
- Arzneimittel, welche den Kaliumspiegel in Ihrem Blut senken. Dazu gehören «Entwässerungsmittel» (Diuretika), Steroide (z.B. Prednisolon) oder Arzneimittel gegen Atembeschwerden (z.B. Theophyllin).
- Betablocker zur Behandlung von Bluthochdruck oder anderer Herzprobleme oder zur Behandlung des grünen Stars (Glaukom).
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Sollte bei Ihnen während der Behandlung mit Spiolto Respimat Schwindel auftreten, dürfen Sie sich nicht ans Steuer setzen und keine Werkzeuge oder Maschinen bedienen.
Dieses Arzneimittel kann die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge oder Maschinen zu bedienen, beeinträchtigen!
Informieren Sie Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbst gekaufte!) einnehmen oder äusserlich anwenden!
Darf SPIOLTO RESPIMAT während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Wenn Sie schwanger sind oder glauben, dass Sie schwanger sein könnten, oder wenn Sie stillen, dürfen Sie Spiolto Respimat nur nach Rücksprache mit Ihrem Arzt resp. Ihrer Ärztin anwenden.
Wie verwenden Sie SPIOLTO RESPIMAT?
Befolgen Sie die Anweisungen des Arztes resp. der Ärztin genau. Üblicherweise werden einmal täglich 2 Hübe möglichst immer zur gleichen Tageszeit inhaliert.
Die COPD ist eine chronische Krankheit. Wenden Sie Spiolto Respimat daher jeden Tag an, d.h. nicht nur, wenn Sie Atemprobleme haben. Inhalieren Sie nicht mehr als die empfohlene Dosis.
Lesen Sie die Gebrauchsanleitung vor der ersten Anwendung von Spiolto Respimat Inhalator genau durch, damit Sie den Respimat korrekt anwenden (siehe Gebrauchsanweisung für den Respimat Inhalator).
Wenn Sie eine grössere Menge Spiolto Respimat angewendet haben, als Sie sollten
Wenn Sie zu viel Spiolto Respimat inhaliert haben, oder wenn eine andere Person aus Versehen Ihr Arzneimittel inhaliert hat, wenden Sie sich umgehend an einen Arzt resp. Ärztin oder ein Spital. Zeigen Sie die Spiolto Respimat-Packung. Möglicherweise ist ärztliche Hilfe erforderlich.
Wenn Sie die Anwendung von Spiolto Respimat vergessen haben
Wenn Sie das Inhalieren einer Dosis vergessen haben, setzen Sie die Behandlung einfach mit der Inhalation der nächsten Dosis zur gewohnten Zeit am nächsten Tag fort. Inhalieren Sie nicht die doppelte Dosis, um die vergessene Dosis nachzuholen.
Die Dauer Ihrer Behandlung mit Spiolto Respimat wird von Ihrem Arzt resp. Ärztin festgelegt. Sie dürfen die Anwendung von Spiolto Respimat nicht ohne Rücksprache mit Ihrem Arzt resp. Ärztin abbrechen, da sich die Zeichen und Symptome Ihrer Krankheit verschlimmern können.
Die Anwendung und Sicherheit von Spiolto Respimat bei Kindern und Jugendlichen unter 18 Jahren ist bisher nicht geprüft worden und darf von diesen nicht angewendet werden.
Welche Nebenwirkungen kann SPIOLTO RESPIMAT haben?
Spiolto Respimat kann folgende Nebenwirkungen verursachen:
Gelegentlich (betrifft 1 bis 10 von 1000 Anwendern)
- Schwindel
- beschleunigter Herzschlag (Tachykardie)
- Husten
- Stimmstörung
- Mundtrockenheit
Selten (betrifft 1 bis 10 von 10'000 Anwendern)
- Schlaflosigkeit (Insomnie)
- unregelmässiger Herzschlag (Vorhofflimmern und weitere Arrhythmien)
- Herzklopfen (Palpitationen)
- erhöhter Blutdruck (Hypertonie)
- Engegefühl in der Brust in Verbindung mit Husten, keuchender Atmung oder Atemnot unmittelbar nach Inhalation (Bronchospasmus)
- Verstopfung
- Kehlkopfentzündung
- Entzündung des Nasen-Rachenraums
- Zahnfleischentzündung
- Heiserkeit
- Nasenbluten
- Pilzinfektion im Mund- und Rachenbereich
- Entzündung der Mundschleimhaut
- Verschwommensehen
- Übelkeit
- Gelenkschmerzen
- Gelenkschwellungen
- Rückenschmerzen
- Schwierigkeiten beim Wasserlassen (Harnverhalten)
- Schmerzen beim Wasserlassen (Dysurie)
- Harnwegsinfektionen
- Überempfindlichkeitsreaktionen, einschliesslich allergischer Reaktionen vom Soforttyp
- Schwerwiegende allergische Reaktionen, die ein Anschwellen des Rachens und des Gesichts verursachen
- Juckreiz
- Nesselsucht
- Hautausschlag
Einzelfälle
- Halos mit Farbringen um Lichtquellen oder unwirkliches Farbsehen in Verbindung mit geröteten Augen (grüner Star [Glaukom])
- erhöhter Augeninnendruck
- Entzündung der Zunge
- Entzündung der Nasennebenhöhlen
- Schluckbeschwerden
- Sodbrennen (gastroösophagealer Reflux)
- Darmverschluss oder Darmlähmung
- trockene Haut
- Hautinfektionen oder -geschwüre
- Abnahme des Körperwassers (Dehydrierung)
Es können auch Nebenwirkungen auftreten, die für Arzneimittelwirkstoffe gegen Atembeschwerden bekannt sind, die ähnlich wirken wie ein Wirkstoff im Spiolto Respimat (sogenannte beta-adrenerge Wirkstoffe).
Dazu gehören: Schmerzen im Brustraum, erniedrigter Blutdruck, Zittern (Tremor), Nervosität, erhöhter Blutzuckergehalt, Übersäuerung des Blutes (kann sich in Beschwerden wie Übelkeit, Erbrechen, Schwäche, Muskelkrämpfen und beschleunigter Atmung äussern).
Bei allergischen Reaktionen wie Hautausschlag, Nesselsucht, Mund- und Gesichtsschwellung oder plötzliche Atemprobleme, plötzlicher Blutdruckabfall oder Schwindel nach Anwendung von Spiolto Respimat suchen Sie sofort einen Arzt resp. Ärztin auf.
Unmittelbar nach der Inhalation könnte bei einigen Patienten unerwartet Engegefühl in der Brust, Husten, keuchende Atmung (Giemen) oder Atemnot auftreten (sogenannter Bronchospasmus). Informieren Sie in diesem Fall Ihren Arzt resp. Ärztin.
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin (oder Drogistin*). Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Aufbrauchfrist nach Anbruch
Der Spiolto Respimat Inhalator darf nach der ersten Anwendung höchstens 3 Monate verwendet werden
Lagerungshinweis
Nicht über 30 °C lagern.
Nicht einfrieren.
Ausser Reichweite von Kindern aufzubewahren
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in SPIOLTO RESPIMAT enthalten?
Lösung zur Inhalation.
Pro Hub werden 2,5 Mikrogramm Olodaterol und 2,5 Mikrogramm Tiotropium abgegeben; eine Dosis umfasst zwei Hübe.
Wirkstoffe
2,5 Mikrogramm Olodaterol und 2,5 Mikrogramm Tiotropium
Hilfsstoffe
Benzalkoniumchlorid (0.0011 mg bei jedem Hub), Natriumedetat, Salzsäure zur pH-Wert-Einstellung
Zulassungsnummer
67352 (Swissmedic).
Wo erhalten Sie SPIOLTO RESPIMAT? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Spiolto Respimat besteht aus einer Patrone mit Lösung zur Inhalation und einem Respimat Inhalator. Die Patrone muss vor der ersten Anwendung in den Inhalator eingesetzt werden.
Einzelpackungen: 1 wiederverwendbarer Respimat Inhalator und 1 Patrone mit
60 Hüben (30 therapeutische Dosen)
Dreifachpackung: 1 wiederverwendbarer Respimat Inhalator und 3 Patronen mit
je 60 Hüben (90 therapeutische Dosen)
Zulassungsinhaberin
Boehringer Ingelheim (Schweiz) GmbH, Basel
Diese Packungsbeilage wurde im Mai 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Gebrauchsanweisung
Spiolto® Respimat® Inhalator wiederverwendbar (Tiotropium und Olodaterol)
Einführung
Bitte lesen Sie die Gebrauchsanweisung, bevor Sie den Spiolto Respimat benutzen.
Sie brauchen den Inhalator nur EINMAL TÄGLICH (jeweils 2 Hübe) anzuwenden.

- Wenn Sie den Inhalator länger als 7 Tage nicht benutzt haben, müssen Sie zunächst einen Sprühstoss in Richtung Boden abgeben.
- Wenn Sie ihn länger als 21 Tage nicht benutzt haben, müssen Sie die unter «Vorbereitung für die erste Anwendung» beschriebenen Schritte 4 bis 6 erneut ausführen, bis eine sichtbare Sprühwolke austritt. Wiederholen Sie dann die Schritte 4 bis 6 noch drei weitere Male.
Wie ist Ihr Spiolto Respimat zu pflegen?
Reinigen Sie das Mundstück einschliesslich des Metallteils im Inneren des Mundstücks mindestens einmal wöchentlich. Verwenden Sie dazu nur ein feuchtes Tuch oder Papiertuch.
Eine leichte Verfärbung des Mundstücks hat keine Auswirkungen auf die Funktionsfähigkeit des Spiolto Respimat Inhalators.
Falls erforderlich, kann die Aussenseite des Spiolto Respimat Inhalators mit einem feuchten Tuch abgewischt werden.
Ersatz des Inhalators
Besorgen Sie eine neue Packung Spiolto Respimat mit Inhalator, wenn Sie einen Inhalator für 3 Patronen verwendet haben.

Vorbereitung für die erste Anwendung
1. Durchsichtiges Gehäuseunterteil entfernen
|  |
2. Patrone einsetzen
|  |
3. Patronen nachverfolgen
|  |
4. Drehen
|  |
5. Öffnen
|  |
6. Auslösen
|  |
Tägliche Anwendung
DREHEN
|  |
ÖFFNEN
|  |
AUSLÖSEN
| 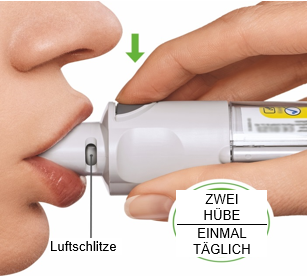 |
Wann ist die SPIOLTO RESPIMAT Patrone zu ersetzen?
Der Dosisindikator zeigt an, wie viele Hübe noch in der Patrone sind.
 | Noch 60 Hübe |
 | Weniger als 10 Hübe. Besorgen Sie eine neue Patrone. |
 | Ihre Patrone ist leer. Drehen Sie das durchsichtige Gehäuseunterteil, um es abzunehmen. Der Inhalator befindet sich nun in einer Sperrstellung. Ziehen Sie die Patrone aus dem Inhalator. Setzen Sie eine neue Patrone ein (weiter mit Schritt 2 der Vorbereitung zur ersten Anwendung). |
Antworten auf häufige Fragen
Die Patrone lässt sich nicht tief genug in das Gehäuse einsetzen.
Haben Sie vor dem Einsetzen der Patrone aus Versehen das durchsichtige Gehäuseunterteil gedreht? Öffnen Sie die Schutzkappe, drücken Sie den Auslöser und setzen Sie dann die Patrone ein.
Wechseln Sie gerade die Patrone? Die neue Patrone wird weiter herausragen als die erste Patrone. Schieben Sie die Patrone in das Gehäuse bis sie einrastet und stecken Sie anschliessend das durchsichtige Gehäuseunterteil wieder auf.
Der Auslöser lässt sich nicht drücken.
Haben Sie das durchsichtige Gehäuseunterteil gedreht? Falls nicht, drehen Sie das durchsichtige Gehäuseunterteil in einer gleichmässigen Bewegung bis es einrastet (eine halbe Drehung).
Zeigt der Dosisanzeiger auf der Patrone einen weissen Pfeil auf rotem Hintergrund? Ihre Patrone ist leer. Setzen Sie eine neue Patrone ein.
Die leere Patrone lässt sich nicht entfernen.
Ziehen Sie an der Patrone und drehen Sie gleichzeitig.
Das durchsichtige Gehäuseunterteil lässt sich weder drehen noch abnehmen.
Haben Sie das durchsichtige Gehäuseunterteil schon gedreht?
Wenn Sie das durchsichtige Gehäuseunterteil schon gedreht haben, folgen Sie den Anweisungen «ÖFFNEN» und «AUSLÖSEN» unter der Überschrift «Tägliche Anwendung», um Ihr Medikament einzunehmen.
Ist das durchsichtige Gehäuseunterteil locker und zeigt der Dosisanzeiger auf der Patrone einen weissen Pfeil auf rotem Hintergrund? Ihre Patrone ist leer. Setzen Sie eine neue Patrone ein.
Mein SPIOLTO RESPIMAT Inhalator war zu schnell leer.
Haben Sie den Respimat wie vorgesehen angewendet (zwei Hübe einmal täglich)? Bei zwei Hüben einmal täglich reicht der Respimat 30 Tage lang.
Haben Sie öfter in die Luft gesprüht, um die Funktionsfähigkeit des Respimat zu testen? Sobald Sie den Respimat für die erste Anwendung vorbereitet haben, ist bei täglicher Anwendung kein weiterer Sprühtest nötig.
Mein SPIOLTO RESPIMAT sprüht nicht.
Haben Sie eine Patrone eingesetzt? Falls nicht, setzen Sie eine Patrone ein. Nach dem Zusammensetzen des Respimat dürfen das durchsichtige Gehäuseunterteil und die Patrone nicht mehr entfernt werden, bis die Patrone leer ist.
Haben Sie nach dem Einsetzen der Patrone die Schritte DREHEN, ÖFFEN, AUSLÖSEN weniger als drei Mal wiederholt? Wiederholen Sie die Schritte DREHEN, ÖFFEN, AUSLÖSEN nach dem Einsetzen der Patrone drei Mal, wie oben in den Schritten 4 bis 6 unter der Überschrift «Vorbereitung für die erste Anwendung» angegeben.
Zeigt der Dosisanzeiger auf der Patrone einen weissen Pfeil auf rotem Hintergrund? Ihre Patrone ist leer. Setzen Sie eine neue Patrone ein.
Mein SPIOLTO RESPIMAT sprüht von allein.
War die Schutzkappe offen, als Sie das durchsichtige Gehäuseunterteil gedreht haben? Schliessen Sie erst die Schutzkappe und drehen Sie dann das durchsichtige Gehäuseunterteil.
Haben Sie auf den Auslöser gedrückt, während Sie das durchsichtige Gehäuseunterteil gedreht haben? Schliessen Sie die Schutzkappe, sodass der Auslöser verdeckt ist, und drehen Sie dann das durchsichtige Gehäuseunterteil.
Haben Sie das durchsichtige Gehäuseunterteil nicht bis zum Einrasten gedreht? Drehen Sie das durchsichtige Gehäuseunterteil in einer gleichmässigen Bewegung bis es einrastet (eine halbe Drehung).
War die Schutzkappe offen, als Sie die Patrone ausgetauscht haben? Schliessen Sie erst die Schutzkappe und tauschen Sie dann die Patrone aus.
Boehringer Ingelheim (Schweiz) GmbH, Basel

Qu’est-ce que le Spiolto Respimat et quand doit-il être utilisé?
Spiolto Respimat est destiné à faciliter la respiration des patients souffrant de bronchopneumopathie chronique obstructive (BPCO). La BPCO est une maladie pulmonaire chronique qui entraîne essoufflement et toux. La BPCO est une maladie chronique, c'est pourquoi Spiolto Respimat doit être utilisé tous les jours et pas seulement lorsque les problèmes respiratoires ou d'autres symptômes de la BPCO apparaissent.
Spiolto Respimat contient les deux principes actifs tiotropium et olodatérol (appelés bronchodilatateurs à action prolongée) qui élargissent les voies respiratoires et facilitent ainsi l'activité respiratoire des poumons. L'utilisation régulière de Spiolto Respimat peut soulager l'essoufflement associé à cette maladie et vous aider à réduire son impact sur votre vie quotidienne.
Le produit doit être utilisé avec l'inhalateur Respimat joint à cet emballage.
Selon prescription du médecin.
Quand Spiolto Respimat ne doit-il pas être utilisé?
Spiolto Respimat ne doit pas être inhalé en cas d'hypersensibilité à l'olodatérol ou au tiotropium ou à un des composants ou encore en cas d'allergie à l'atropine et aux dérivés de l'atropine ou si vous souffrez d'asthme.
Enfants et adolescents
Spiolto Respimat ne doit pas être administré aux enfants et adolescents (de moins de 18 ans).
Quelles sont les précautions à observer lors de l’utilisation de Spiolto Respimat?
Veuillez suivre exactement toutes les indications de votre médecin.
Si l'un des points suivants vous concerne, vous devez absolument informer votre médecin à ce sujet avant d'utiliser Spiolto Respimat:
- si vous souffrez de problèmes cardiaques;
- si vous souffrez d'hypertension;
- si vous souffrez d'épilepsie;
- si vous avez des problèmes de thyroïde;
- si vous souffrez de diabète;
- si votre fonction hépatique ou votre fonction rénale est fortement limitée;
- si vous devez être opéré;
- si vous souffrez d'un glaucome à angle fermé (une maladie de l'œil);
- si vous souffrez de troubles de la prostate ou avez des difficultés en urinant;
- si vous souffrez d'une autre maladie, êtes allergique ou prenez déjà d'autres médicaments (même en automédication!) ou utilisez déjà d'autres médicaments en usage externe.
Informez immédiatement votre médecin si vous constatez un des symptômes suivants au cours du traitement par Spiolto Respimat:
- Spiolto Respimat contient du chlorure de benzalkonium qui peut provoquer une respiration haletante et des problèmes respiratoires (bronchospasmes – des contractions spasmodiques des voies respiratoires), notamment si vous souffrez d'asthme.
- si vous souffrez d'une sensation d'oppression dans la poitrine, de toux, d'une respiration sifflante ou d'essoufflement directement après l'inhalation. Ces troubles peuvent être des signes d'une contraction des muscles dans les bronches, appelée bronchospasme;
- si votre respiration se détériore directement après l'utilisation de l'inhalateur ou qu'une éruption cutanée, des gonflements ou des démangeaisons apparaissent;
- si vous remarquez un effet secondaire quelconque concernant votre cœur (accélération de la fréquence cardiaque, élévation de la tension et/ou renforcement des symptômes comme les douleurs thoraciques);
- si des crampes musculaires, une faiblesse musculaire ou des troubles du rythme cardiaque (arythmies) apparaissent (ces troubles peuvent être provoqués par un taux trop faible du potassium sanguin).
Utilisation de Spiolto Respimat avec d'autres médicaments
Veuillez informer votre médecin ou pharmacien(ne) si vous prenez/utilisez déjà ou avez pris/utilisé récemment d'autres médicaments (même en automédication!). Ceci concerne particulièrement les médicaments suivants:
- Médicaments pour le traitement de la maladie de Parkinson ou de la dépression (p.ex. des antidépresseurs tricycliques, des inhibiteurs de la monooxydase).
- Autres médicaments utilisés pour traiter votre maladie pulmonaire (et dont l'utilisation pourrait augmenter le risque d'effets secondaires possibles).
- Médicaments abaissant le taux de potassium dans votre sang, notamment les diurétiques, les stéroïdes (p.ex. prednisolone) ou les médicaments contre les difficultés respiratoires (p.ex. théophylline).
- Bêtabloquants pour le traitement de votre hypertension ou d'autres problèmes cardiaques ou pour le traitement de votre glaucome.
Aptitude à la conduite et capacité à utiliser des machines
Aucune étude n'a été réalisée concernant les effets sur l'aptitude à la conduite et la capacité à utiliser des machines.
Si des vertiges surviennent pendant votre traitement par Spiolto Respimat, vous ne devez pas conduire ni utiliser des outils ou des machines.
Ce médicament peut affecter les réactions, l'aptitude à conduire et la capacité à utiliser des outils ou des machines !
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie
- vous êtes allergique
- vous prenez déjà d'autres médicaments en usage interne ou externe (même en automédication!)
Spiolto Respimat peut-il être pris/utilisé pendant la grossesse ou l’allaitement?
Si vous êtes enceinte ou pensez l'être ou si vous allaitez, vous ne devez utiliser Spiolto Respimat qu'après avoir consulté votre médecin.
Comment utiliser Spiolto Respimat?
Veuillez suivre exactement toutes les indications de votre médecin. Généralement, vous devez inhaler 2 bouffées une fois par jour, si possible toujours à la même heure.
La BPCO est une maladie chronique. C'est pourquoi vous devez utiliser Spiolto Respimat tous les jours et pas seulement les jours où vous avez des problèmes respiratoires. Ne pas inhaler plus que la dose recommandée.
Avant la première utilisation, veuillez lire attentivement le mode d'emploi de l'inhalateur Spiolto Respimat afin de l'utiliser correctement. (Voir mode d'emploi de l'inhalateur Respimat.)
Si vous avez utilisé plus de Spiolto Respimat que vous n'auriez dû
Adressez-vous immédiatement à un médecin ou un hôpital si vous avez inhalé trop de Spiolto Respimat ou qu'une autre personne a accidentellement inhalé votre médicament. Montrez-leur l'emballage de Spiolto Respimat. Une prise en charge médicale sera peut-être nécessaire.
Si vous avez oublié d'utiliser Spiolto Respimat
Si vous avez oublié d'inhaler une dose, poursuivez le traitement en inhalant la dose suivante au moment habituel. N'inhalez pas une double dose pour compenser la dose oubliée.
Votre médecin fixera la durée du traitement par Spiolto Respimat. Vous ne devez pas arrêter l'utilisation de Spiolto Respimat sans consulter votre médecin parce que les signes et symptômes de votre maladie pourraient s'aggraver.
L'utilisation et la sécurité de Spiolto Respimat n'ont pas été établies à ce jour pour les enfants et adolescents de moins de 18 ans et ceux-ci ne doivent pas l'utiliser.
Quels effets secondaires Spiolto Respimat peut-il provoquer?
Spiolto Respimat peut provoquer les effets secondaires suivants:
Occasionnels (concerne 1 à 10 utilisateurs sur 1'000)
- Vertiges
- Battements cardiaques irréguliers (fibrillation auriculaire et autres arythmies)
- Toux
- Trouble de la voix
- Sécheresse buccale
Rares (concerne 1 à 10 utilisateurs sur 10'000)
- Insomnie
- Battements cardiaques accélérés (tachycardie)
- Palpitations
- Tension artérielle accrue (hypertension)
- Sensation d'oppression dans la poitrine associée à une toux, une respiration haletante ou essoufflement directement après l'inhalation (bronchospasme)
- Constipation
- Inflammation du larynx
- Inflammation rhino-pharyngée (du nez et de la gorge)
- Inflammation des gencives
- Enrouement
- Épistaxis (saignement du nez)
- Infection fongique (champignons) dans la bouche et la gorge
- Inflammation de la muqueuse buccale
- Vision trouble
- Nausées
- Douleurs articulaires
- Gonflement des articulations
- Douleurs dorsales
- Troubles de la miction (rétention d'urine)
- Douleur en urinant (dysurie)
- Infections des voies urinaires
- Réactions d'hypersensibilité, notamment des réactions allergiques de type immédiat
- Graves réactions allergiques provoquant un gonflement de la gorge et du visage
- Prurit (démangeaisons)
- Urticaire
- Éruption cutanée
Fréquence indéterminée
- Halos avec cercles colorés autour de sources de lumière ou vision de couleurs irréelles associée à des yeux rougis (glaucome)
- Augmentation de la pression oculaire interne
- Inflammation de la langue
- Inflammation des sinus
- Troubles de la déglutition
- Pyrosis (brûlures d'estomac) (reflux gastro-œsophagien)
- Occlusion intestinale ou paralysie intestinale
- Peau sèche
- Infections de la peau ou ulcères
- Déshydratation (perte d'eau corporelle)
Des effets secondaires connus liés aux principes actifs des médicaments contre les troubles respiratoires (principes actifs bêta-adrénergiques) dont l'action est similaire à celle d'un principe actif contenu dans Spiolto Respimat peuvent également survenir.
Notamment: douleurs thoraciques, baisse de tension, tremblements (tremor), nervosité, élévation de la glycémie, acidification du sang (pouvant se manifester par des troubles comme nausées, vomissements, faiblesse, crampes musculaires et accélération de la respiration).
Contactez directement un médecin en cas de réactions allergiques comme une éruption cutanée, une urticaire, un gonflement de la bouche et du visage ou des problèmes respiratoires soudains, une chute de tension soudaine ou des vertiges après l'utilisation de Spiolto Respimat.
Chez certains patients, une sensation d'oppression dans la poitrine associée à une toux, une respiration sifflante (sibilance) ou un essoufflement (bronchospasme) peuvent apparaître de manière inattendue directement après l'inhalation. Veuillez informer votre médecin dans ce cas.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
À quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Stabilité après ouverture
Après sa première utilisation, la durée d'utilisation de l'inhalateur Spiolto Respimat est de 3 mois maximum.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30 °C.
Ne pas congeler.
Conserver hors de la portée des enfants.
Pour de plus amples renseignements, consultez votre médecin ou pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Spiolto Respimat?
Solution à inhaler
À chaque bouffée, 2,5 microgrammes d'olodatérol et 2,5 microgrammes de tiotropium son administrés; une dose comprend deux bouffées.
Principes actifs
2,5 microgrammes d'olodatérol et 2,5 microgrammes de tiotropium par bouffée
Excipients
Chlorure de benzalkonium (0,0011 mg par bouffée), édétate disodique, acide chlorhydrique pour le réglage du pH.
Numéro d'autorisation
67352 (Swissmedic).
Où obtenez-vous Spiolto Respimat? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Spiolto Respimat est composé d'une cartouche avec une solution à inhaler et d'un inhalateur Respimat. La cartouche doit être insérée dans l'inhalateur avant la première utilisation.
Emballage unique: 1 inhalateur Respimat réutilisable et 1 cartouche avec 60 bouffées (30 doses thérapeutiques)
Emballage triple: 1 inhalateur Respimat réutilisable et 3 cartouches contenant chacune 60 bouffées (90 doses thérapeutiques)
Titulaire de l’autorisation
Boehringer Ingelheim (Suisse) GmbH, Bâle
Cette notice d'emballage a été vérifiée pour la dernière fois en mai 2020 par l'autorité de contrôle des médicaments (Swissmedic).
Mode d’emploi
Inhalateur Spiolto® Respimat® réutilisable (tiotropium et olodatérol)
Introduction
Cet inhalateur ne doit être utilisé qu’UNE FOIS PAR JOUR. Inhalez 2 bouffées d’aérosol à chaque fois.

- Si l’inhalateur n’a pas été utilisé depuis plus de 7 jours, vous devez d’abord vaporiser une bouffée contre le sol.
- Si vous ne l’avez pas utilisé depuis plus de 21 jours, vous devez répéter les étapes 4 à 6 décrites sous «Préparation de la première utilisation» jusqu’à la vaporisation d’un nuage visible. Répétez ensuite à trois reprises les étapes 4 à 6.
Comment entretenir le Spiolto Respimat?
Nettoyez l’embout buccal, y compris la partie métallique interne, au moins une fois par semaine et uniquement avec un linge ou une lingette papier humide.
Une légère décoloration de l’embout buccal n’a pas d’incidence sur le bon fonctionnement de l’inhalateur Spiolto Respimat.
Si nécessaire, la face extérieure de l’inhalateur Spiolto Respimat peut être essuyée avec un chiffon humide.
Remplacement de l’inhalateur
Procurez-vous un nouvel emballage Spiolto Respimat avec inhalateur lorsque vous avez utilisé un inhalateur pour 3 cartouches.

Préparation de la première utilisation
1. Retirer la base transparente
|  |
2. Introduire la cartouche
|  |
3. Assurer le suivi des cartouches
|  |
4. Tourner
|  |
5. Ouvrir
|  |
6. Déclencher
|  |
Utilisation quotidienne
TOURNER
|  |
OUVRIR
|  |
DÉCLENCHER
| 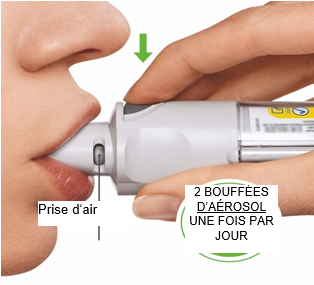 |
Quand faut-il remplacer la cartouche du SPIOLTO RESPIMAT?
L’indicateur de doses montre le nombre de bouffées que la cartouche contient encore.
 | Encore 60 bouffées |
 | Moins de 10 bouffées. Procurez-vous une nouvelle cartouche. |
 | Votre cartouche est vide. Tournez la base transparente pour la retirer. L’inhalateur est maintenant en position de blocage. Retirez la cartouche de l’inhalateur. Introduisez une nouvelle cartouche (continuez en passant à l’étape 2 de la préparation de la première utilisation). |
Réponses aux questions fréquentes
Il n’est pas possible d’enfoncer la cartouche assez profondément.
Avez-vous tourné la base transparente accidentellement avant d’introduire la cartouche? Ouvrez le capuchon de protection, appuyez sur le bouton de libération de la dose et introduisez ensuite la cartouche.
Est-ce que vous êtes en train de changer la cartouche? La nouvelle cartouche va dépasser davantage que la première. Enfoncez la cartouche dans le boîtier jusqu’à l’enclenchement et enfichez ensuite de nouveau la base transparente.
Le bouton de libération de la dose ne peut pas être enfoncé.
Avez-vous tourné la base transparente? Si tel n’est pas le cas, faites tourner la base transparente d’un mouvement continu jusqu’à entendre le déclic (un demi-tour).
Est-ce que l’indicateur de doses de la cartouche présente une flèche blanche sur fond rouge?
Votre cartouche est vide. Introduisez une nouvelle cartouche.
Il n’est pas possible de retirer la cartouche vide.
Tirez sur la cartouche tout en la tournant en même temps.
La base transparente ne tourne pas et il n’est pas possible de la retirer.
Avez-vous déjà tourné la base transparente?
Si la base transparente a déjà été tournée, suivez les étapes «OUVRIR» et «DÉCLENCHER» décrites sous «Utilisation quotidienne» pour administrer le médicament.
La base transparente est-elle desserrée et l’indicateur de doses de la cartouche présente-t-il une flèche blanche sur fond rouge? Votre cartouche est vide. Introduisez une nouvelle cartouche.
Mon SPIOLTO RESPIMAT se vide trop rapidement.
Est-ce que le Respimat a été utilisé comme indiqué (deux bouffées une fois par jour)? Le Respimat contient une quantité suffisante pour 30 jours à raison de deux bouffées une fois par jour.
Est-ce que vous avez fréquemment vaporisé dans l’air pour vérifier si le Respimat fonctionne? En cas d’utilisation quotidienne, des vaporisations de bouffées-tests ne sont plus nécessaires après la préparation du Respimat pour la première utilisation.
Mon SPIOLTO RESPIMAT ne vaporise pas.
Est-ce que vous avez introduit une cartouche? Si tel n’est pas le cas, introduisez une cartouche. Après l’assemblage du Respimat, ne retirez plus la base transparente ni la cartouche jusqu’à ce qu’elle soit vide.
Avez-vous répété les étapes TOURNER, OUVRIR et DÉCLENCHER moins de trois fois après l’introduction de la cartouche? Répétez trois fois les étapes TOURNER, OUVRIR et DÉCLENCHER après l’introduction de la cartouche comme indiqué plus haut aux étapes 4 à 6 sous «Préparation de la première utilisation».
Est-ce que l’indicateur de doses de la cartouche présente une flèche blanche sur fond rouge? Votre cartouche est vide. Introduisez une nouvelle cartouche.
Mon SPIOLTO RESPIMAT vaporise automatiquement.
Est-ce que le capuchon de protection était ouvert lorsque vous avez tourné la base transparente? Refermez d'abord le capuchon de protection avant de tourner la base transparente.
Est-ce que vous avez appuyé sur le bouton de libération de la dose en tournant la base transparente? Refermez d’abord le capuchon de protection afin de recouvrir le bouton de libération de la dose, puis tournez la base transparente.
Est-ce que la base transparente n’a pas été tournée jusqu’à la position d’enclenchement? Faites tourner la base transparente d’un mouvement continu jusqu’à entendre le déclic (un demi-tour).
Est-ce que le capuchon de protection était ouvert quand vous avez remplacé la cartouche? Refermez d’abord le capuchon de protection et remplacez ensuite la cartouche.
Boehringer Ingelheim (Suisse) GmbH, Bâle
CE0123
Che cos’è Spiolto Respimat e quando si usa?
Spiolto Respimat facilita la respirazione dei pazienti con broncopneumopatia cronica ostruttiva (BPCO). La BPCO è una malattia polmonare cronica che causa difficoltà respiratoria e tosse. La BPCO è una malattia cronica, pertanto si raccomanda di utilizzare Spiolto Respimat ogni giorno e non solo quando si manifestano problemi respiratori o altri sintomi associati alla BPCO.
Spiolto Respimat contiene i due principi attivi tiotropio e olodaterolo, che dilatano le vie aeree, facilitando l'attività respiratoria dei polmoni (sono definiti broncodilatatori a lunga durata d'azione). Il regolare utilizzo di Spiolto Respimat può ridurre la difficoltà respiratoria associata a questa malattia e aiutarla a limitare al minimo gli effetti della malattia sulla sua vita quotidiana.
Spiolto Respimat va utilizzato con l'inalatore Respimat incluso in questa confezione.
Su prescrizione medica.
Quando non si può usare Spiolto Respimat?
Non deve inalare Spiolto Respimat se è ipersensibile all'olodaterolo o al tiotropio o ad una delle sostanze ausiliarie oppure se è allergico all'atropina e alle sostanze simili all'atropina e neppure se è asmatico.
Bambini e adolescenti
Spiolto Respimat non deve essere somministrato a bambini e adolescenti (sotto i 18 anni).
Quando è richiesta prudenza nell’uso di Spiolto Respimat?
Segua esattamente tutte le istruzioni del suo medico.
Prima di utilizzare Spiolto Respimat informi assolutamente il suo medico nel caso in cui:
- ha problemi cardiaci;
- soffre di pressione arteriosa elevata;
- soffre di epilessia;
- ha problemi di tiroide;
- soffre di diabete;
- la sua funzione epatica o renale è gravemente compromessa;
- le è stato programmato un intervento chirurgico;
- soffre di glaucoma ad angolo stretto (malattia degli occhi);
- soffre di disturbi alla prostata o difficoltà ad urinare;
- soffre di altre malattie, soffre di allergie o assume altri medicamenti (anche se acquistati di sua iniziativa) o li applica esternamente.
Durante il trattamento con Spiolto Respimat informi immediatamente il suo medico se manifesta uno dei seguenti sintomi:
- Spiolto Respimat contiene benzalconio cloruro, che può causare sibilo e difficoltà respiratorie (broncospasmo – restringimento spasmodico delle vie respiratorie), specialmente se soffre di asma.
- se avverte una sensazione di pressione al torace, tosse, respirazione affannosa o difficoltà respiratoria subito dopo l'inalazione. I suddetti disturbi possono essere segni di una contrazione della muscolatura bronchiale, definita broncospasmo;
- se la sua respirazione peggiora oppure se manifesta eruzione cutanea, gonfiori o prurito subito dopo l'uso dell'inalatore;
- se osserva qualsiasi effetto collaterale relativo al cuore (accelerazione del battito cardiaco, aumento della pressione arteriosa e/o acutizzazione dei sintomi come dolore al torace);
- se manifesta crampi muscolari, debolezza muscolare o alterazioni del ritmo cardiaco (questi disturbi possono essere dovuti ad un ridotto livello di potassio nel sangue).
Uso di Spiolto Respimat insieme ad altri medicamenti
Informi il suo medico o il suo farmacista nel caso in cui assume o ha recentemente assunto altri medicamenti (anche se acquistati di sua iniziativa!). Ne fanno parte in particolare i seguenti medicamenti:
- Medicamenti per il trattamento del Parkinson o di stati depressivi (ad es. cosiddetti antidepressivi triciclici, inibitori della monoaminossidasi).
- Altri medicamenti utilizzati per il trattamento della sua malattia (il cui uso potrebbe aumentare il rischio di possibili effetti collaterali).
- Medicamenti che riducono il livello di potassio nel sangue. Ne fanno parte i «medicamenti che favoriscono l'eliminazione dei liquidi» (diuretici), gli steroidi (ad es. prednisolone) o i medicamenti contro i disturbi respiratori (ad es. teofillina).
- Beta-bloccanti per il trattamento della pressione arteriosa elevata o di altri problemi cardiaci o per il trattamento del glaucoma.
Capacità di guidare veicoli e capacità di utilizzare macchine
Non sono stati condotti studi relativi agli effetti sulla capacità di guidare veicoli e sulla capacità di utilizzare macchine.
Qualora durante il trattamento con Spiolto Respimat dovesse manifestare vertigini, non si metta alla guida di veicoli e non usi macchine.
Questo medicamento può ridurre la capacità di reazione, la capacità di condurre un veicolo e la capacità di utilizzare attrezzi o macchine!
Informi il suo medico o il suo farmacista nel caso in cui
- soffre di altre malattie,
- soffre di allergie o
- assume altri medicamenti (anche se acquistati di sua iniziativa) o li applica esternamente!
Si può usare Spiolto Respimat durante la gravidanza o l’allattamento?
Se è incinta o ritiene di poter essere incinta oppure se allatta, deve usare Spiolto Respimat solo dopo aver consultato il suo medico.
Come usare Spiolto Respimat?
Segua esattamente le istruzioni del suo medico. Solitamente si eseguono 2 nebulizzazioni una volta al giorno, possibilmente sempre alla stessa ora.
La BPCO è una malattia cronica. Utilizzi quindi Spiolto Respimat ogni giorno, non solo quando ha problemi respiratori. Non inali una quantità superiore alla dose raccomandata.
Prima di utilizzare l'inalatore Spiolto Respimat per la prima volta legga attentamente le istruzioni per l'uso per un uso corretto di Respimat (vedere le istruzioni per l'uso dell'inalatore Respimat).
Se prende più Spiolto Respimat di quanto deve
Se ha inalato un'eccessiva quantità di Spiolto Respimat oppure se un'altra persona ha inalato inavvertitamente il suo medicamento, si rivolga immediatamente ad un medico o all'ospedale. Mostri la confezione di Spiolto Respimat. Potrebbe essere necessaria assistenza medica.
Se ha dimenticato di prendere Spiolto Respimat
Se ha dimenticato di inalare una dose, prosegua semplicemente il trattamento con l'inalazione della dose successiva all'ora consueta del giorno successivo. Non inali una dose doppia per compensare la dose dimenticata.
La durata del suo trattamento con Spiolto Respimat è a discrezione del suo medico. Non deve interrompere l'uso di Spiolto Respimat senza aver consultato il suo medico, perché i segni e i sintomi della sua malattia potrebbero peggiorare.
L'uso e la sicurezza di Spiolto Respimat nei bambini e negli adolescenti sotto i 18 anni finora non sono stati esaminati. Il medicamento non sarà quindi somministrato a bambini e adolescenti in queste fasce di età.
Quali effetti collaterali può avere Spiolto Respimat?
Spiolto Respimat può causare i seguenti effetti collaterali:
Comune (riguarda da 1 a 10 utilizzatori su 100)
- Secchezza della bocca
Non comune (riguarda da 1 a 10 utilizzatori su 1'000)
- Vertigini
- Insonnia
- Mal di testa
- Pressione arteriosa elevata (ipertensione)
- Battito cardiaco irregolare (fibrillazione atriale e altre aritmie)
- Palpitazioni (cardiopalma)
- Battito cardiaco accelerato (tachicardia)
- Tosse
- Stitichezza
Raro (riguarda da 1 a 10 utilizzatori su 10'000)
- Infiammazione del nasofaringe
- Infiammazione della laringe
- Infiammazione delle gengive
- Raucedine
- Sangue dal naso
- Infezione fungina nell'area nasofaringea
- Visione sfuocata
- Nausea
- Dolore articolare
- Dolore dorsale
- Difficoltà ad urinare (ritenzione urinaria)
- Dolore nell'urinare (disuria)
- Reazioni di ipersensibilità, incluse reazioni allergiche di tipo immediato
- Reazioni allergiche gravi che causano gonfiore della faringe e del viso
- Prurito
- Orticaria
Singoli casi:
- Aloni con anelli colorati visibili intorno alle sorgenti di luce oppure visione dei colori alterata associata ad occhi arrossati (glaucoma)
- Aumentata pressione intraoculare
- Sensazione di pressione al torace, associata a tosse, respirazione affannosa o difficoltà respiratoria subito dopo l'inalazione (broncospasmo)
- Infiammazione della lingua
- Carie
- Infiammazione delle cavità paranasali
- Infiammazione della mucosa orale
- Difficoltà di deglutizione
- Bruciore di stomaco (reflusso gastroesofageo)
- Occlusione o paralisi intestinale
- Eruzione cutanea
- Pelle secca
- Infezioni o ulcerazioni cutanee
- Riduzione della quantità di liquidi corporei (disidratazione)
- Infezioni delle vie urinarie
- Gonfiori articolari
Possono comparire anche degli effetti collaterali, noti per alcuni principi attivi di medicamenti contro i disturbi respiratori che agiscono similmente a un principio attivo contenuto in Spiolto Respimat (cosiddetti principi attivi beta-adrenergici).
Tali effetti collaterali includono dolori all'area toracica, ridotta pressione arteriosa, tremori, nervosismo, aumentato livello di zucchero nel sangue, iperacidificazione del sangue (può manifestarsi in disturbi come nausea, vomito, debolezza, crampi muscolari e respirazione accelerata).
Consultare immediatamente un medico in caso di reazioni allergiche, quali eruzione cutanea, orticaria, gonfiore della bocca e del viso o improvvisi problemi respiratori, improvvisa riduzione della pressione arteriosa o vertigini dopo l'uso di Spiolto Respimat.
Subito dopo l'inalazione, alcuni pazienti potrebbero manifestare inaspettatamente una sensazione di pressione al torace, tosse, respirazione affannosa (stridore) o difficoltà respiratoria (cosiddetto broncospasmo). In questi casi informi il suo medico.
Se osserva effetti collaterali, si rivolga al suo medico, farmacista, soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Termine di consumo dopo l'apertura
Dopo il primo uso, utilizzare l'inalatore Spiolto Respimat al massimo per 3 mesi.
Indicazione di stoccaggio
Non conservare a temperature superiori a 30 °C.
Non congelare.
Conservare fuori dalla portata dei bambini.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Spiolto Respimat?
Soluzione per inalazione.
Ogni nebulizzazione contiene 2,5 microgrammi di olodaterolo e 2,5 microgrammi di tiotropio;unadose include due nebulizzazioni.
Principi attivi
2,5 microgrammi di olodaterolo e 2,5 microgrammi di tiotropio
Numero dell’omologazione
67352 (Swissmedic).
Dove è ottenibile Spiolto Respimat? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Spiolto Respimat è costituito da una cartuccia con soluzione per inalazione e un inalatore Respimat. Inserire la cartuccia nell'inalatore prima del primo utilizzo.
Confezioni singole: 1 inalatore Respimat riutilizzabile e 1 cartuccia da 60 nebulizzazioni (30 dosi terapeutiche)
Confezione tripla: 1 inalatore Respimat riutilizzabile e 3 cartucce da 60 nebulizzazioni (90 dosi terapeutiche)
Titolare dell’omologazione
Boehringer Ingelheim (Schweiz) GmbH, Basel
Questo foglietto illustrativo è stato controllato l'ultima volta nel maggio 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
Istruzioni per l’uso
Inalatore Spiolto® Respimat® riutilizzabile (tiotropio e olodaterolo)
Introduzione
Legga le istruzioni per l’uso prima di utilizzare Spiolto Respimat.
L’inalatore deve essere utilizzato solo UNA VOLTA AL GIORNO (due nebulizzazioni per volta).

- Se l’inalatore non viene utilizzato da più di 7 giorni, erogare innanzitutto una nebulizzazione verso terra.
- Se l’inalatore non viene utilizzato da più di 21 giorni, ripetere di nuovo le fasi da 4 a 6 descritte in «Preparazione per il primo utilizzo» finché non è visibile una nebulizzazione. Ripetere quindi ancora tre volte le fasi da 4 a 6.
Pulizia dell’inalatore Spiolto Respimat
Pulire il boccaglio e la parte in metallo al suo interno almeno una volta alla settimana utilizzando esclusivamente un panno o un panno carta umido.
Un lieve cambiamento di colore del boccaglio non influisce sulla funzionalità dell’inalatore Spiolto Respimat.
Se necessario, è possibile pulire la superficie esterna dell’inalatore Spiolto Respimat passandovi un panno umido.
Sostituzione dell'inalatore
Procurarsi una nuova confezione di Spiolto Respimat con inalatore dopo avere utilizzato un inalatore con 3 cartucce.

Preparazione per il primo utilizzo
1. Rimozione della base trasparente
|  |
2. Inserimento della cartuccia
|  |
3. Controllo delle cartucce utilizzate
|  |
4. Rotazione
|  |
5. Apertura
|  |
6. Erogazione
|  |
Utilizzo quotidiano
ROTAZIONE
|  |
APERTURA
|  |
EROGAZIONE
|  |
Quando si deve sostituire la cartuccia SPIOLTO RESPIMAT?
L'indicatore della dose mostra quante nebulizzazioni sono ancora presenti nella cartuccia.
 | Ancora 60 nebulizzazioni |
 | Meno di 10 nebulizzazioni. Procurarsi una nuova cartuccia. |
 | La cartuccia è vuota. Ruotare la base trasparente per estrarla. L'inalatore è bloccato. Estrarre la cartuccia dall'inalatore e inserire una nuova cartuccia (avanti al passo 2 di «Preparazione per l'utilizzo»). |
Risposte a domande frequenti
L'inserimento in profondità della cartuccia incontra resistenza.
È stata inavvertitamente ruotata la base trasparente prima di inserire la cartuccia? Aprire il cappuccio, premere il bottone di erogazione della dose, poi inserire la cartuccia.
Si sta sostituendo la cartuccia? La nuova cartuccia sporge oltre la prima cartuccia. Inserire la cartuccia nell'alloggiamento fino allo scatto, quindi applicare di nuovo la base trasparente.
Il bottone di erogazione della dose non si preme.
È stata ruotata la base trasparente? Se non è così, ruotare la base trasparente con un movimento continuo finché non scatta in posizione (mezzo giro).
L'indicatore della dose presente sulla cartuccia mostra una freccia bianca su sfondo rosso? La cartuccia è vuota. Inserire una nuova cartuccia.
Non è possibile estrarre la cartuccia vuota.
Tirare e ruotare contemporaneamente la cartuccia.
Non è possibile estrarre la base trasparente anche dopo la rotazione.
È già stata ruotata la base trasparente?
Se la base trasparente è già stata ruotata, eseguire le fasi «APERTURA» e «EROGAZIONE» descritte nella sezione «Utilizzo quotidiano» per somministrare il medicamento.
La base trasparente è allentata e l'indicatore della dose presente sulla cartuccia mostra una freccia bianca su sfondo rosso? La cartuccia è vuota. Inserire una nuova cartuccia.
L'inalatore SPIOLTO RESPIMAT si svuota troppo rapidamente.
L'inalatore Respimat è stato utilizzato come indicato (due nebulizzazioni/una volta al giorno)? L'inalatore Respimat ha una durata di 30 giorni se si somministrano due nebulizzazioni una volta al giorno.
Si è spruzzato spesso a vuoto per verificare se l'inalatore Respimat funziona? Dopo aver preparato l'inalatore Respimat non è più necessario effettuare prove di nebulizzazione nell'uso quotidiano.
L'inalatore SPIOLTO RESPIMAT non esegue l'erogazione.
È stata inserita una cartuccia? In caso negativo, inserire una cartuccia. Dopo avere montato il Respimat, non rimuovere più la base trasparente e la cartuccia fino a quando la cartuccia è vuota.
Dopo l'inserimento della cartuccia, le fasi ROTAZIONE, APERTURA ed EROGAZIONE sono state ripetute meno di tre volte? Ripetere 3 volte le fasi ROTAZIONE, APERTURA ed EROGAZIONE dopo l'inserimento della cartuccia, come descritto nei punti da 4 a 6 nella sezione «Utilizzo quotidiano».
L'indicatore della dose presente sulla cartuccia mostra una freccia bianca su sfondo rosso? La cartuccia è vuota. Inserire una nuova cartuccia.
L'inalatore Spiolto Respimat esegue l'erogazione in automatico.
Il cappuccio era aperto quando è stata ruotata la base trasparente? Chiudere il cappuccio prima di ruotare la base trasparente.
È stato premuto il bottone di erogazione della dose durante la rotazione della base trasparente? Chiudere il cappuccio in modo che il bottone di erogazione della dose sia coperto, poi ruotare la base trasparente.
La base trasparente non è stata ruotata fino alla posizione di scatto? Ruotare la base trasparente con un movimento continuo finché non scatta in posizione (mezzo giro).
Il cappuccio era aperto quando è stata sostituita la cartuccia? Chiudere il cappuccio prima di sostituire la cartuccia.
Boehringer Ingelheim (Schweiz) GmbH, Basel
Zusammensetzung
Wirkstoffe
Olodaterolum (ut Olodateroli hydrochloridum) und Tiotropium (ut Tiotropii bromidum monohydricum).
Hilfsstoffe
Benzalkonii chloridi solutio corresp. Benzalkonii chloridum 1.1 µg dinatrii edetas, acidum hydrochloridum, aqua purificata, nitrogenium.
Darreichungsform und Wirkstoffmenge pro Einheit
Lösung zur Inhalation.
Pro Hub werden 2,5 Mikrogramm Olodaterol und 2,5 Mikrogramm Tiotropium abgegeben
Indikationen/Anwendungsmöglichkeiten
Spiolto Respimat ist für die bronchienerweiternde Erhaltungstherapie von symptomatischen Patienten mit COPD indiziert, bei welchen eine tief dosierte LAMA oder LABA-Monobehandlung allein nicht genügend ist.
Dosierung/Anwendung
Die empfohlene Dosis für Erwachsene beträgt 5 Mikrogramm Olodaterol und 5 Mikrogramm Tiotropium. Dies entspricht zwei Sprühstössen aus dem Respimat-Inhalator, die einmal täglich jeweils zur gleichen Tageszeit verabreicht werden.
Die empfohlene Dosis darf nicht überschritten werden.
Patienten mit Leberfunktionsstörungen
Spiolto Respimat enthält Olodaterol, das überwiegend in der Leber metabolisiert wird.
Patienten mit leichter bis mittelgradiger Leberfunktionsstörung können Spiolto Respimat in der empfohlenen Dosis anwenden. Zur Anwendung von Olodaterol bei Patienten mit schwerer Leberfunktionsstörung liegen keine Daten vor.
Patienten mit Nierenfunktionsstörungen
Patienten mit Nierenfunktionsstörung können Spiolto Respimat in der empfohlenen Dosis anwenden.
Spiolto Respimat enthält Tiotropium, das vorwiegend renal ausgeschieden wird. Daher sollte die Anwendung von Spiolto Respimat bei Patienten mit mittelgradiger bis schwerer Nierenfunktionsstörung engmaschig überwacht werden
Ältere Patienten
Ältere Patienten können Spiolto Respimat in der empfohlenen Dosierung anwenden.
Kinder und Jugendliche
Es gibt keinen relevanten Nutzen von Spiolto Respimat als COPD-Therapie bei Kindern und Jugendlichen unter 18 Jahren. Die Sicherheit und Wirksamkeit von Spiolto Respimat bei Kindern und Jugendlichen ist nicht erwiesen.
Kontraindikationen
Die Anwendung von Spiolto Respimat ist bei Patienten mit Überempfindlichkeit gegen Olodaterol oder Tiotropium sowie einen der sonstigen Bestandteile des Arzneimittels kontraindiziert.
Spiolto Respimat ist auch kontraindiziert bei Patienten mit anamnestisch bekannter Überempfindlichkeit gegen Atropin oder eines seiner Derivate, z.B. Ipratropium oder Oxitropium.
Warnhinweise und Vorsichtsmassnahmen
Spiolto Respimat enthält Benzalkoniumchlorid, dieser Bestandteil kann keuchende Atmung und Atemschwierigkeiten (Bronchospasmen - krampfartige Verengungen der Atemwege) hervorrufen, insbesondere, wenn Sie an Asthma leiden.
Asthma
Bei Asthma darf Spiolto Respimat nicht angewendet werden. Die Wirksamkeit und Sicherheit von Olodaterol und Tiotropium bei Asthma wurde bisher nicht untersucht.
Akuter Bronchospasmus
Spiolto Respimat darf nicht als Notfallmedikation zur Behandlung akuter Bronchospasmen eingesetzt werden.
Überempfindlichkeit
Nach Anwendung von Spiolto Respimat sind allergische Reaktionen vom Soforttyp möglich.
Paradoxer Bronchospasmus
Wie andere Inhalativa kann auch Spiolto Respimat paradoxe Bronchospasmen auslösen, die lebensbedrohend sein können. Sollte ein paradoxer Bronchospasmus auftreten, muss Spiolto Respimat sofort abgesetzt und durch eine alternative Therapie ersetzt werden.
Engwinkelglaukom, Prostatahyperplasie, Blasenhalsobstruktion
Entsprechend der anticholinergen Eigenschaften von Tiotropium muss Spiolto Respimat bei Patienten mit Engwinkelglaukom, Prostatahyperplasie oder Blasenhalsobstruktion mit Vorsicht angewendet werden.
Eingeschränkte Nierenfunktion
Da Tiotropium vorwiegend renal ausgeschieden wird, ist die Anwendung von Spiolto Respimat bei Patienten mit mittelgradiger bis schwerer Nierenfunktionsstörung (Kreatinin-Clearance <50 ml/min) engmaschig zu überwachen (siehe Abschnitt «Dosierung/Anwendung»).
Augensymptome
Die Patienten sind im korrekten Gebrauch des Spiolto Respimat zu schulen. Die Lösung oder die Sprühwolke darf nicht in die Augen gelangen. Augenschmerzen oder Augenbeschwerden, Verschwommensehen, visuelle Halos oder verändertes Farbempfinden, verbunden mit geröteten Augen durch Bindehautinjektion und Hornhautödem, können Anzeichen eines Engwinkelglaukoms sein. Beim Auftreten der genannten Symptome in jeglicher Kombination muss unverzüglich ein Augenarzt aufgesucht werden.
Miotische Augentropfen werden nicht als wirksame Behandlung erachtet.
Systemische Wirkungen
Spiolto Respimat enthält einen langwirksamen Beta2-Adrenozeptor-Agonisten. Langwirksame Beta2-Adrenozeptor-Agonisten dürfen bei Patienten mit kardiovaskulären Erkrankungen, insbesondere Koronarinsuffizienz, Herzrhythmusstörungen, hypertroph-obstruktive Kardiomyopathie und Hypertonie, bei Patienten mit Krampfleiden oder Hyperthyreose, bei Patienten mit bekannter oder vermuteter Verlängerung des QT-Intervalls sowie bei Patienten, die ungewöhnlich empfindlich auf sympathomimetische Amine ansprechen, nur mit Vorsicht angewendet werden.
Kardiovaskuläre Wirkungen
Wie andere Beta2-Adrenozeptor-Agonisten kann Olodaterol bei manchen Patienten klinisch relevante kardiovaskuläre Wirkungen zeigen, die sich in einem Anstieg der Pulsfrequenz, des Blutdrucks und/oder anderen Symptomen äussern. Sollten derartige Wirkungen auftreten, muss die Behandlung möglicherweise abgebrochen werden. Darüber hinaus wurden unter der Behandlung mit Beta-Adrenozeptor-Agonisten EKG-Veränderungen beobachtet, z.B. Abflachung der T-Welle und Senkung der ST-Strecke. Die klinische Relevanz dieser Beobachtung ist jedoch nicht bekannt.
Vor der Verschreibung einer Dauerbehandlung mit einem Betaagonisten wie Spiolto Respimat sollten COPD-Patienten hinsichtlich kardiovaskulärer Begleiterkrankungen abgeklärt werden. Dabei empfiehlt sich auch die Durchführung einer EKG-Untersuchung mit Frage nach QTc-Verlängerung.
In klinischen Studien wurde Patienten mit Myokardinfarkt oder Hospitalisation wegen Herzinsuffizienz im letzten Jahr vor Behandlungsbeginn ausgeschlossen.
Hypokaliämie
Beta2-Adrenozeptor-Agonisten können bei manchen Patienten eine erhebliche Hypokaliämie auslösen, die zu unerwünschten kardiovaskulären Wirkungen führen kann. Der Abfall der Serumkaliumspiegel ist normalerweise vorübergehend und erfordert keine Supplementierung. Bei Patienten mit schwerer COPD kann die Hypokaliämie durch Hypoxie und die Begleittherapie verstärkt werden (siehe Abschnitt «Interaktionen»). Dies kann die Neigung zu Herzrhythmusstörungen erhöhen.
Hyperglykämie
Die Inhalation hoher Dosen von Beta2-Adrenozeptor-Agonisten kann zu einem erhöhten Blutzuckerspiegel führen.
Spiolto Respimat sollte nicht zusammen mit anderen langwirksamen Beta2-Adrenozeptor-Agonisten angewendet werden. Patienten, die bisher regelmässig (z.B. viermal täglich) kurzwirksame Beta2-Adrenozeptor-Agonisten inhaliert haben, sind anzuweisen, diese nur noch zur Linderung bei akuten respiratorischen Symptomen anzuwenden.
Spiolto Respimat darf nicht häufiger als einmal täglich angewendet werden.
Interaktionen
Es liegen keine gezielten Studien über Wechselwirkungen mit anderen Arzneimitteln vor.
Die Angaben in Bezug auf das mögliche Auftreten von Interaktionen bei Anwendung von Spiolto Respimat beruhen auf der Möglichkeit des Auftretens von Interaktionen bei Anwendung seiner beiden Bestandteile.
Tiotropiumbromid wurde gleichzeitig mit anderen üblicherweise in der Behandlung von COPD eingesetzten Arzneimitteln – wie Methylxanthinen sowie oralen und inhalativen Steroiden – ohne klinische Anzeichen für Wechselwirkungen angewendet.
Die Langzeitanwendung von Tiotropiumbromid zusammen mit anderen Anticholinergika wurde nicht untersucht. Daher wird die Langzeitanwendung von anderen Anticholinergika zusammen mit Spiolto Respimat nicht empfohlen.
Adrenergika
Bei gleichzeitiger Anwendung anderer Adrenergika können die Nebenwirkungen von Spiolto Respimat verstärkt werden.
Xanthinderivate, Steroide und Diuretika
Eine Begleittherapie mit Xanthinderivaten, Steroiden oder nicht kaliumsparenden Diuretika kann zu einer Verstärkung der hypokaliämischen Wirkung von Adrenozeptor-Agonisten führen (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Betablocker
Beta-Rezeptorenblocker können die Wirkung von Olodaterol abschwächen oder antagonisieren. Unter solchen Umständen können kardioselektive Beta-Blocker in Erwägung gezogen werden, doch sind diese mit Vorsicht anzuwenden.
MAO-Hemmer und trizyklische Antidepressiva, QTc-verlängernde Arzneimittel
Monoaminoxidasehemmer, trizyklische Antidepressiva oder andere Arzneimittel, die bekanntermassen das QTc-Intervall verlängern, können die Wirkung von Spiolto Respimat auf das kardiovaskuläre System verstärken.
Pharmakokinetische Interaktionen
In einer Olodaterol-Wechselwirkungsstudie mit dem starken dualen CYP- und P-Gp-Hemmer Ketoconazol stieg die systemische Exposition um das etwa 1,7-fache (siehe Abschnitt «Pharmakokinetik»). In klinischen Olodaterol-Studien mit einer Dauer von bis zu einem Jahr mit Dosen, die bis zum 2-fachen der empfohlenen therapeutischen Dosis betrugen, ergaben sich keine Bedenken bezüglich der Sicherheit. Eine Dosisanpassung von Spiolto Respimat ist nicht erforderlich.
Schwangerschaft/Stillzeit
Schwangerschaft
Bisher liegen nur sehr begrenzte Erfahrungen mit der Anwendung von Tiotropium bei Schwangeren vor. Für Olodaterol liegen keine klinischen Daten über exponierte Schwangere vor.
Präklinische Studien mit Tiotropium ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität in klinisch relevanten Dosen.
In präklinischen Untersuchungen zeigte Olodaterol in Dosierungen, die um ein Vielfaches über der therapeutischen Dosis lagen, die für Beta-Adrenozeptor-Agonisten typischen Wirkungen (siehe «Präklinische Daten»).
Aus Vorsichtsgründen soll eine Anwendung von Spiolto Respimat während der Schwangerschaft vermieden werden.
Der hemmende Effekt von Beta-Adrenozeptor-Agonisten wie Olodaterol (ein Bestandteil von Spiolto Respimat) auf die Uteruskontraktionen sollte berücksichtigt werden.
Stillzeit
Klinische Daten von stillenden Frauen mit Exposition gegenüber Tiotropium und/oder Olodaterol liegen nicht vor.
In präklinischen Studien mit Tiotropium und Olodaterol wurde die Substanz und/oder ihre Metabolite in der Milch laktierender Ratten nachgewiesen, es ist jedoch nicht bekannt, ob Tiotropium und/oder Olodaterol in die Muttermilch übergehen.
Daher sollte Spiolto Respimat bei stillenden Frauen nur angewendet werden, wenn der erwartete Nutzen das mögliche Risiko für das Kind überwiegt.
Fertilität
Für Tiotropium, Olodaterol und die Kombination der beiden Bestandteile liegen keine klinischen Daten zur Fertilität vor. In präklinischen Studien mit den Einzelsubstanzen Tiotropium und Olodaterol zeigten sich keine schädlichen Auswirkungen auf die Fertilität (siehe Präklinische Daten).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen des Arzneimittels auf die Fähigkeit zum Lenken von Fahrzeugen und zum Bedienen von Maschinen durchgeführt.
Allerdings sollten die Patienten darauf hingewiesen werden, dass nach Anwendung von Spiolto Respimat über Schwindel und Verschwommensehen berichtet wurde. Daher sollte beim Lenken eines Fahrzeugs oder Bedienen von Maschinen zu Vorsicht geraten werden. Beim Auftreten der genannten Symptome sollten die Patienten potenziell gefährliche Tätigkeiten wie das Lenken eines Fahrzeugs oder das Bedienen von Maschinen vermeiden
Unerwünschte Wirkungen
Das klinische Entwicklungsprogramm von Spiolto Respimat umfasste mehr als 19000 COPD-Patienten. Von diesen erhielten über 5900 eine Dosis von 5 μg Tiotropium und 5 μg Olodaterol.
Die Nebenwirkungen von Spiolto Respimat wurden vorwiegend anhand der Daten aus 2 wirkstoffkontrollierten klinischen Langzeitstudien im Parallelgruppen-Design (52 Wochen) an COPD Patienten ermittelt, welche Spiolto Respimat mit Tiotropium und Olodaterol verglichen. Zusätzlich wurde eine weitere aktivkontrollierte Parallelgruppen-Langzeitbehandlungstudie (52 Wochen) mit COPD Patienten durchgeführt, die Spiolto Respimat mit Tiotropium verglichen (Studie 9).
In den zwei Zulassungsstudien (Studie 1 und 2) war die Gesamtinzidenz von Nebenwirkungen bei mit Spiolto Respimat behandelten Patienten mit der bei Patienten vergleichbar, die nur mit dem Einzelwirkstoff Olodaterol in einer Dosis von 5 μg behandelt wurden (74% bzw. 76,6%).
In der gepoolten Analyse aller drei klinischen Langzeitstudien (Studien 1,2 und 9) war die Gesamtinzidenz der Nebenwirkungen für die mit Spiolto Respimat und die mit den Einzelsubstanzen Tiotropium (Dosierung von 5 μg) bzw. Olodaterol (Dosierung von 5 μg) behandelten Patienten vergleichbar (74,1% bzw. 74,3%). Alle Nebenwirkungen, die bereits für die jeweiligen Einzelbestandteile beschrieben wurden, werden auch als Nebenwirkungen von Spiolto Respimat angesehen und sind in der nachstehenden Liste enthalten.
In Studie 9, an der über 3900 COPD-Patienten teilnahmen, welche mit Spiolto Respimat behandelt wurden, wurden keine neuen Nebenwirkungen ermittelt; darüber hinaus war das Sicherheitsprofil mit dem in den Zulassungsstudien dokumentierten Profil konsistent.
Zusätzlich sind Nebenwirkungen angegeben, die unter Spiolto Respimat, jedoch nicht unter den Einzelbestandteilen aufgetreten sind.
Nachfolgend sind die unerwünschten Wirkungen nach Organsystem und Häufigkeit, welche in klinischen Studien und während der Marktüberwachung unter Spiolto Respimat angegeben wurden. Die Häufigkeiten sind dabei wie folgt definiert:
Häufig: ≥1%-<10%; gelegentlich; ≥0.1%-<1%; selten: ≥0.01%-<0.1%; sehr selten: <0.01%; nicht bekannt: basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann nicht abgeschätzt werden).
Infektionen und parasitäre Erkrankungen
Nicht bekannt: Nasopharyngitis.
Stoffwechsel- und Ernährungsstörungen
Nicht bekannt: Dehydrierung.
Erkrankungen des Nervensystems
Gelegentlich: Schwindel.
Selten: Insomnie.
Augenerkrankungen
Selten: Verschwommensehen.
Nicht bekannt: Glaukom, erhöhter Augeninnendruck.
Herzerkrankungen:
Gelegentlich: Tachykardie.
Selten: Supraventrikuläre Tachykardie, Vorhofflimmern, Palpitationen.
Gefässerkrankungen:
Selten: Hypertonie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Husten, Dysphonie.
Selten: Epistaxis, Laryngitis, Pharyngitis, Bronchospasmen.
Nicht bekannt: Sinusitis.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Mundtrockenheit.
Selten: Gingivitis, Oropharyngeale Candidose, Stomatitis, Obstipation.
Nicht bekannt: Darmobstruktion einschliesslich paralytischer Ileus, Dysphagie, Gastroösophagealer Reflux, Glossitis.
Erkrankungen der Haut und des Unterhautzellgewebes
Selten: Angioödem, Urtikaria, Pruritus, Überempfindlichkeitsreaktionen (einschliesslich allergischer Reaktionen vom Soforttyp), Hautausschlag.
Nicht bekannt: Trockene Haut, Hautinfektionen und -geschwüre.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Selten: Rückenschmerzen1, Arthralgie, Gelenkschwellungen.
Erkrankungen der Nieren und Harnwege
Selten: Harnretention (für gewöhnlich bei prädisponierten Männern), Dysurie, Harnwegsinfekte.
1 Nebenwirkungen, die unter Spiolto Respimat, jedoch nicht unter den Einzelbestandteilen aufgetreten sind
Viele der aufgeführten Nebenwirkungen können den anticholinergen Eigenschaften von Tiotropium oder den beta-adrenergen Eigenschaften von Olodaterol – den Bestandteilen von Spiolto Respimat – zugeschrieben werden.
Ferner ist auf Anzeichen anderer beta-adrenerger Nebenwirkungen, die nicht oben aufgelistet sind, zu achten; hierzu zählen Arrhythmie, Myokardischämie, Angina pectoris, Hypotonie, Tremor, Kopfschmerzen, Nervosität, Übelkeit, Muskelkrämpfe, Erschöpfung, Unwohlsein, Hypokaliämie, Hyperglykämie und metabolische Azidose.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Anzeichen und Symptome
In hohen Dosen kann Tiotropium zu anticholinergen Zeichen und Symptomen führen.
Auch nach Dosierungen von bis zu 40 µg Tiotropium-Inhalationslösung über 14 Tage wurden bei gesunden Probanden, abgesehen von einer deutlichen Reduzierung des Speichelflusses ab dem 7. Tag, keine relevanten Nebenwirkungen beobachtet, die über Mund- und Rachentrockenheit und trockene Nasenschleimhaut mit dosisabhängiger [10 - 40 μg pro Tag] Inzidenz hinausgingen.
In sechs Langzeitstudien an COPD-Patienten wurden bei einer Tagesdosis von 10 μg Tiotropium-Inhalationslösung über 4 bis 48 Wochen keine signifikanten Nebenwirkungen beobachtet.
Eine Überdosierung von Olodaterol führt voraussichtlich zu den für Beta2-Adrenozeptor-Agonisten typischen Symptomen wie Myokardischämie, Hypertonie oder Hypotonie, Tachykardie, Arrhythmien, Palpitationen, Schwindel, Nervosität, Schlaflosigkeit, Angstzustände, Kopfschmerzen, Zittern, Mundtrockenheit, Muskelkrämpfe, Übelkeit, Erschöpfung, Unwohlsein, Hypokaliämie, Hyperglykämie und metabolische Azidose.
Behandlung
Die Behandlung mit Spiolto Respimat ist abzubrechen. Eine unterstützende und symptomatische Behandlung ist angezeigt, in schweren Fällen eine Hospitalisierung. Die Gabe kardioselektiver Betablocker kann erwogen werden, sollte aber mit grösster Vorsicht erfolgen, da Betablocker Bronchospasmen auslösen können.
Eigenschaften/Wirkungen
ATC-Code
R03AL06
Wirkungsmechanismus
Pharmakodynamik
Spiolto Respimat:
Tiotropium, ein langwirksamer, spezifischer Muskarin-Rezeptor-Antagonist und Olodaterol, ein langwirksamer Beta2-Agonist, werden zusammen im Spiolto Respimat Inhalator angewendet. Diese beiden Wirkstoffe führen aufgrund ihrer unterschiedlichen Wirkmechanismen und Zielrezeptoren in der Lunge zu einer additiven Bronchodilatation.
Tiotropium: Tiotropiumbromid ist ein langwirksamer, spezifischer Muskarin-Rezeptor-Antagonist (LAMA), der in der klinischen Medizin häufig als Anticholinergikum bezeichnet wird und die gleiche Affinität zu den Muskarin-Rezeptor-Subtypen M1 bis M5 aufweist. In den Atemwegen führt die Hemmung der M3-Rezeptoren der glatten Muskulatur zur Relaxation. Der kompetitive und reversible Charakter des Antagonismus wurde an menschlichen und tierischen Rezeptoren sowie an isolierten Organpräparaten nachgewiesen. In präklinischen in‑vitro‑ und in‑vivo-Studien war der bronchoprotektive Effekt dosisabhängig und hielt länger als 24 Stunden an. Die lange Wirkungsdauer ist wahrscheinlich auf die sehr langsame Dissoziation von den M3‑Rezeptoren zurückzuführen. Sie zeigen eine signifikant längere Dissoziationshalbwertzeit als bei Ipratropium. Als N-quaternäres Anticholinergikum ist Tiotropium bei inhalativer Verabreichung topisch (broncho-)selektiv und zeigt eine ausreichende therapeutische Breite, ehe systemische anticholinerge Wirkungen auftreten können. Die Dissoziation vom M2-Rezeptor ist schneller als die vom M3-Rezeptor, was sich in in‑vitro-Studien funktionell als kinetisch kontrollierte Rezeptorselektivität von M3 gegenüber M2 zeigte.
Die hohe Wirkstärke und langsame Rezeptordissoziation korreliert klinisch mit einer signifikanten und langwirksamen Bronchodilatation bei COPD-Patienten.
Bei der Bronchodilatation handelt es sich primär um eine lokale Wirkung (in den Atemwegen) und nicht um eine systemische Wirkung.
Olodaterol: Weist eine hohe Affinität und Selektivität für den humanen Beta2-Adrenozeptor auf. In-vitro-Studien haben gezeigt, dass Olodaterol an Beta2‑Adrenozeptoren eine 241‑fach stärkere agonistische Wirkung als an Beta1-Adrenozeptoren und eine 2299-fach stärkere agonistische Wirkung als an Beta3-Adrenozeptoren ausübt. Die pharmakologischen Wirkungen dieses Wirkstoffes beruhen auf der Bindung und Aktivierung von Beta2-Adrenozeptoren nach topischer Verabreichung durch Inhalation.
Die Aktivierung dieser Rezeptoren in den Atemwegen führt zu einer Stimulierung der intrazellulären Adenylatzyklase, eines Enzyms, das die Synthese von zyklischem Adenosin-3',5'-monophosphat (cAMP) vermittelt. Ein erhöhter cAMP-Spiegel löst über die Relaxation der glatten Muskulatur in den Atemwegen eine Bronchodilatation aus.
Olodaterol besitzt das präklinische Profil eines langwirksamen selektiven Beta2-Adrenozeptor-Agonisten (LABA) mit schnellem Wirkungseintritt und einer Wirkdauer von mindestens 24 Stunden.
Beta-Adrenozeptoren werden in drei Subtypen eingeteilt, wobei Beta1-Adrenozeptoren vorwiegend in der Herzmuskulatur, Beta2-Adrenozeptoren vorwiegend auf der glatten Muskulatur der Atemwege und Beta3-Adrenozeptoren überwiegend in Fettgewebe exprimiert werden. Beta2-Agonisten führen zur Bronchodilatation. Der Beta2-Adrenozeptor ist zwar der vorherrschende adrenerge Rezeptor in der glatten Muskulatur der Atemwege, doch findet er sich auch auf der Oberfläche verschiedener anderer Zellen, z.B. auf Lungenepithel, Endothelzellen und im Herzen. Die genaue Funktion der Beta2-Rezeptoren im Herzen ist nicht bekannt, doch lässt ihr Vorhandensein darauf schliessen, dass selbst hochselektive Beta2-Adrenozeptor-Agonisten kardiale Wirkungen ausüben könnten.
Klinische Studien
Wirkung auf die Elektrophysiologie des Herzens
Tiotropium: Die Wirkung von Tiotropium Pulver zur Inhalation auf das QT‑Intervall wurde in einer randomisierten, placebo- und wirkstoffkontrollierten Crossover-Studie an 53 gesunden Probanden untersucht. Die Patienten erhielten 12 Tage lang Tiotropium Pulver zur Inhalation 18 μg, 54 μg (das Dreifache der empfohlenen Dosis) oder Placebo. Die EKG-Untersuchungen erfolgten zu Baseline und im Dosierungsintervall nach der ersten und der letzten Gabe des Prüfpräparats. Tiotropium Pulver zur Inhalation 18 bzw. 54 μg führte im Vergleich zu Placebo zu einer maximalen mittleren Veränderung des studienspezifischen QTc-Intervalls um 3,2 ms bzw. 0,8 ms gegenüber Baseline. Bei keinem Probanden kam es zu einem erneuten Anstieg des QTc-Intervalls auf >500 ms oder einer Veränderung des QTc-Intervalls um ≥60 ms gegenüber Baseline.
Olodaterol: Die Wirkung von Olodaterol auf das QT/QTc-Intervall im EKG wurde in einer doppelblinden, randomisierten, placebo- und wirkstoff (Moxifloxacin)-kontrollierten Studie an 24 gesunden männlichen und weiblichen Probanden untersucht. Olodaterol in Einzeldosen von 10, 20, 30 und 50 μg führte über einen Zeitraum von 20 Minuten bis 2 Stunden nach der Verabreichung im Vergleich zu Placebo zu einer dosisabhängigen Zunahme der mittleren Veränderung des QT-Intervalls von 1,6 ms (10 μg Olodaterol) bis 6,5 ms (50 μg Olodaterol) gegenüber Baseline. Die Obergrenze des zweiseitigen 90%-Konfidenzintervalls lag auf allen Dosisstufen unter 10 ms.
Die Wirkung von 5 μg und 10 μg Olodaterol auf die Herzfrequenz und den Herzrhythmus wurden im Rahmen der 48‑wöchigen placebokontrollierten Phase‑III-Studien anhand einer kontinuierlichen EKG-Aufzeichnung über 24 Stunden (Langzeit-EKG) in einer Untergruppe von 772 Patienten untersucht. Dabei wurden hinsichtlich der Grössenordnung der mittleren Veränderungen von Herzfrequenz oder Extrasystolen keine dosis- oder zeitbedingten Tendenzen oder Muster beobachtet. Veränderungen der Extrasystolie zwischen Baseline und Behandlungsende ergaben keinen Hinweis auf bedeutsame Unterschiede zwischen 5 μg bzw. 10 μg Olodaterol und Placebo.
Spiolto Respimat
In zwei 52-wöchigen, randomisierten, doppelblinden Studien mit Spiolto Respimat, an welchen 5162 COPD-Patienten teilnahmen, wurden EKG-Untersuchungen nach der Verabreichung an den Tagen 1, 85, 169 und 365 durchgeführt. In einer gepoolten Analyse der Anzahl der Patienten mit Veränderungen des Baseline-korrigierten QT‑Intervalls >30 ms nach Bazett (QTcB) und Fridericia (QTcF) betrugen die Herzfrequenzkorrekturen des QT-Intervalls im Rahmen der durchgeführten Untersuchungen 4,9‑6,4% (QTcB) und 3,3‑4,7% (QTcF) für die Spiolto Respimat-Gruppe gegenüber 5,0‑6,0% (QTcB) und 3,4‑4,4% (QTcF) für Olodaterol 5 μg sowie 5,3‑6,5% (QTcB) und 3,0‑4,7% (QTcF) für Tiotropium 5 μg.
Klinische Wirksamkeit und Sicherheit
Das klinische Phase-III-Entwicklungsprogramm für Spiolto Respimat umfasste drei randomisierte, doppelblinde Studien:
(i) zwei replizierte, placebokontrollierte Parallelgruppenstudien über 52 Wochen zum Vergleich von Spiolto Respimat mit Tiotropium 5 μg und Olodaterol 5 μg (1029 Patienten erhielten Spiolto Respimat) [Studien 1 und 2]
(ii) eine 6‑wöchige Crossover-Studie zum Vergleich von Spiolto Respimat mit Tiotropium 5 μg, Olodaterol 5 μg und Placebo (139 Patienten erhielten Spiolto Respimat) [Studie 3]
In diesen Studien wurden die Vergleichssubstanzen Tiotropium 5 μg, Olodaterol 5 μg und Placebo über den Respimat Inhalator verabreicht.
In allen Studien wurde die Lungenfunktion untersucht (Einsekundenkapazität, FEV1). In den 52‑wöchigen Studien wurde die Lungenfunktion bis zu 3 Stunden nach Verabreichung (in einer Untergruppe von Patienten 12 Stunden nach Verabreichung) sowie 23-24 Stunden nach Verabreichung gemessen; die primären Wirksamkeitsendpunkte in Bezug auf die Lungenfunktion waren die Veränderung der FEV1 AUC0‑3h gegenüber dem Ausgangswert vor Therapiebeginn (Ansprechen), sowie die Veränderung des FEV1-Tiefstwertes gegenüber dem Ausgangswert vor Therapiebeginn nach 24 Wochen. In der 6‑wöchigen Studie wurde die Lungenfunktion bis zu 12 Stunden nach Verabreichung sowie 22-24 Stunden nach Verabreichung gemessen; der primäre Wirksamkeitsendpunkt war die FEV1 AUC0‑24h nach 6 Wochen. In den 52‑wöchigen Studien wurden ausserdem das St. George's Respiratory Questionnaire (SGRQ) als Mass der gesundheitsbezogenen Lebensqualität (primärer Endpunkt) und der Mahler Transition Dyspnea Index (TDI) als Mass der Dyspnoe (wichtiger sekundärer Endpunkt) verwendet.
In das Phase‑III-Programm wurden Patienten im Alter von mindestens 40 Jahren mit klinisch diagnostizierter COPD, einer Raucheranamnese von mehr als 10 Packungsjahren und einer mittelgradigen bis schweren Beeinträchtigung der Lungenfunktion (postbronchodilatatorische FEV1 <80% des Sollwerts [GOLD-Stadien II‑IV); postbronchodilatatorische FEV1/FVC-Ratio <70%]) aufgenommen.
Patientenmerkmale
Die Mehrzahl der 5162 Patienten, die für die globalen 52‑wöchigen Studien (Studien 1 und 2) rekrutiert wurden, war männlich (73%), «weiss» (71%) oder «asiatisch» (25%) und im Mittel 64 Jahre alt. Die mittlere postbronchodilatatorische FEV1 betrug 1,37 l (GOLD II [50%], GOLD III [39%], GOLD IV [11%]). Die mittlere Ansprechbarkeit für Beta2-Agonisten lag bei 16,6% des Ausgangswerts (0,171 l). Als Begleittherapie waren alle Atemwegstherapeutika (z.B. inhalative Steroide [47%] und Xanthine [10%]) zulässig.
Die 6-wöchige Studie (Studie 3) wurde in Europa und Nordamerika durchgeführt. Die Mehrzahl der 219 rekrutierten Patienten war männlich (59%), «weiss» (99%) und im Mittel 61,1 Jahre alt. Die mittlere postbronchodilatatorische FEV1 betrug 1,55 l (GOLD II [64%], GOLD III [34%], GOLD IV [2%]). Die mittlere Ansprechbarkeit für Beta2-Agonisten lag bei 15,9% des Ausgangswerts (0,193 l). Als Begleittherapie waren alle Atemwegstherapeutika (z.B. inhalative Steroide [41%] und Xanthine [4%]) zulässig.
Lungenfunktion
In den 52‑wöchigen Studien bewirkte Spiolto Respimat (einmal täglich morgens) innerhalb von 5 Minuten nach der ersten Dosis eine eindeutige Verbesserung der Lungenfunktion (mittlere Zunahme der FEV1 um 0,137 l) im Vergleich zu Tiotropium 5 μg (0,058 l, p<0,0001) und Olodaterol 5 μg (0,125 l, p=0,16). In beiden Studien wurde eine signifikante Verbesserung der FEV1 AUC0-3h und des FEV1-Tiefstwertes nach 24 Wochen (primäre Endpunkte der Lungenfunktion) für Spiolto Respimat gegenüber Tiotropium 5 μg und Olodaterol 5 μg festgestellt (Tabelle 1).
Tabelle 1: Differenz der FEV1 AUC0-3h-Werte und FEV1-Tiefstwerte für Spiolto Respimat zu Tiotropium 5 μg und Olodaterol 5 μg nach 24 Wochen (Studien 1 und 2).
| FEV1 AUC0-3 h | FEV1-Tiefstwert | |||||||
| Studie 1 | Studie 2 | Studie 1 | Studie 2 | |||||
| n | Mittelwert | n | Mittelwert | n | Mittelwert | n | Mittelwert | |
| Spiolto Respimat versus | 522 | -- | 502 | -- | 521 | -- | 497 | -- |
| Tiotropium 5 μg | 526 | 0,117 l | 500 | 0,103 l | 520 | 0,071 l | 498 | 0,050 l |
| Olodaterol 5 μg | 525 | 0,123 l | 507 | 0,132 l | 519 | 0,082 l | 503 | 0,088 l |
FEV1-Ausgangswert vor Therapiebeginn: Studie 1 = 1,16 l;
Studie 2 = 1,15 l
p≤0,0001 für alle Vergleiche
Die im Vergleich zu Tiotropium 5 μg und Olodaterol 5 μg stärkere bronchodilatatorische Wirkung von Spiolto Respimat hielt über die gesamte 52‑wöchige Behandlungsphase hinweg an. Spiolto Respimat führte im Vergleich zu Tiotropium 5 μg und Olodaterol 5 μg ausserdem zu einer Verbesserung der morgendlichen und abendlichen maximalen exspiratorischen Atemflussrate (PEFR), die anhand der täglichen Aufzeichnungen der Patienten ermittelt wurde.
In der Untergruppe von Patienten, an welchen bis zu 12 Stunden nach Verabreichung erweiterte Lungenfunktionsmessungen vorgenommen wurden, zeigte Spiolto Respimat über das gesamte 24‑Stunden-Dosierintervall eine signifikant stärkere Wirkung auf die FEV1 als Tiotropium 5 μg und Olodaterol 5 μg (Abbildung 1, Tabelle 2).
Abbildung 1: FEV1-Profil für Spiolto Respimat, Tiotropium 5 μg und Olodaterol 5 μg über das gesamte 24‑stündige Dosierintervall nach 24 Wochen (Untergruppe aus den Studien 1 und 2 mit 12‑stündigen PFT; kombinierter Datensatz)
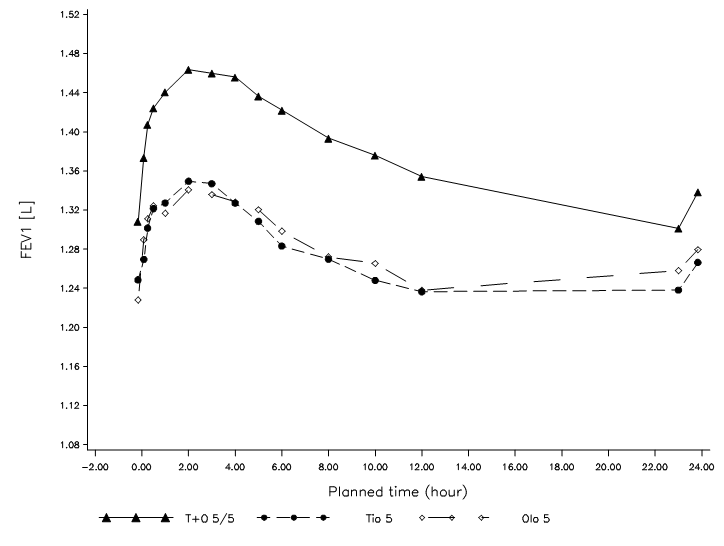
Tabelle 2: Differenz der FEV1 für Spiolto Respimat zu Tiotropium 5 μg und Olodaterol 5 μg über das gesamte 24‑stündige Dosierintervall nach 24 Wochen ((Untergruppe aus den Studien 1 und 2 mit 12‑stündigen PFT; kombinierter Datensatz)
| n | 12 h Durchschnitt | 24 h Durchschnitt | |
| Spiolto Respimat versus | 167 | ||
| Tiotropium 5 μg | 160 | 0,123 | 0,106 |
| Olodaterol 5 μg | 194 | 0,118 | 0,098 |
FEV1-Ausgangswert vor Therapiebeginn = 1,17 l
p<0,0001 für alle Vergleiche
In der 6‑wöchigen Studie zeigte Spiolto Respimat über das gesamte 24‑Stunden-Dosierintervall eine signifikant stärkere Wirkung auf die FEV1 als Tiotropium 5 μg, Olodaterol 5 μg und Placebo (Abbildung 2, Tabelle 3).
Abbildung 2: FEV1-Profil für Spiolto Respimat, Tiotropium 5 μg, Olodaterol 5 μg und Placebo über ein vollständiges 24‑stündiges Dosierintervall nach 6 Wochen (Studie 3)
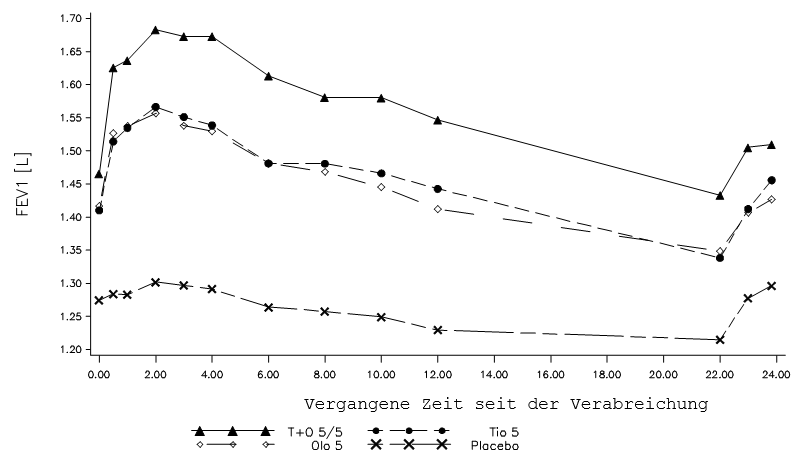
Tabelle 3: Differenz der FEV1 (l) für Spiolto Respimat zu Tiotropium 5 μg, Olodaterol 5 μg und Placebo über das gesamte 24‑stündige Dosierintervall nach 6 Wochen (Studie 3).
| n | 3 h Durchschnitt | n | 12 h Durchschnitt | 24 h Durchschnitt1 | Tiefstwert | |
| Spiolto Respimat versus | 138 | 138 | ||||
| Tiotropium 5 μg | 137 | 0,109 | 135 | 0,119 | 0,110 | 0,079 |
| Olodaterol 5 μg | 138 | 0,109 | 136 | 0,126 | 0,115 | 0,092 |
| Placebo | 135 | 0,325 | 132 | 0,319 | 0,280 | 0,207 |
FEV1-Ausgangswert vor Therapiebeginn = 1,30 l
1 Primärer Endpunkt
p<0,0001 für alle Vergleiche
Gesundheitsbezogene Lebensqualität
Nach 24 Wochen war der mittlere SGRQ-Gesamtscore unter Spiolto Respimat gegenüber Tiotropium 5 μg und Olodaterol 5 μg signifikant verbessert (Tabelle 4), wobei in allen SGRQ-Domänen Verbesserungen festgestellt wurden. Eine grössere Anzahl der mit Spiolto Respimat behandelten Patienten zeigte eine klinisch relevante Verbesserung des SGRQ-Gesamtscores (geringster klinisch relevanter Unterschied [MCID], definiert als Abnahme von mindestens 4 Einheiten im Vergleich zum Ausgangswert) als Patienten unter Tiotropium 5 μg (57,5% versus 48,7%, p=0,0001) bzw. Olodaterol 5 μg (57,5% versus 44,8%, p<0,0001).
Tabelle 4: SGRQ (Gesamt- und Domain-Scores) nach 24 Behandlungswochen
(Studie 1 (TOnado™ 1) und Studie 2 (TOnado™ 2)
| n | Mittelwert nach Behandlungsgruppe (Veränderung gegenüber dem Ausgangswert | Differenz zu Spiolto Respimat | ||
| Mittel-wert (p-Wert) | ||||
| Gesamtscore | Ausgangswert | 43,5 | ||
| Spiolto Respimat | 979 | 36,7 (‑6,8) | ||
| Tiotropium 5 μg | 954 | 37,9 (‑5,6) | ‑1,23 (p=0,025) | |
| Olodaterol 5 μg | 954 | 38,4 (‑5,1) | ‑1,69 (p=0,002) | |
| Symptome | Ausgangswert | 51,9 | ||
| Spiolto Respimat | 982 | 42,6 | ||
| Tiotropium 5 μg | 957 | 45,5 | ‑2,94 (p=0,0008) | |
| Olodaterol 5 μg | 958 | 45,0 | ‑2,48 (p=0,0046) | |
| Aktivität | Ausgangswert | 58,0 | ||
| Spiolto Respimat | 981 | 51,9 | ||
| Tiotropium 5 μg | 959 | 53,2 | ‑1,34 (p=0,052) | |
| Olodaterol 5 μg | 958 | 54,0 | ‑2,11 (p=0,002) | |
| Auswirkungen | Ausgangswert | 32,6 | ||
| Spiolto Respimat | 983 | 26,1 | ||
| Tiotropium 5 μg | 960 | 26,8 | ‑0,67 (p=0,283) | |
| Olodaterol 5 μg | 959 | 27,2 | ‑1,11 (p=0,075) | |
In zwei zusätzlichen 12-wöchigen, placebokontrollierten klinischen Studien (Studie 7 (OTEMTO™1 ) und Studie 8 (OTEMTO™2) wurde ausserdem der SGRQ-Gesamt-Score nach 12 Wochen, der ein Mass für die gesundheitsbezogene Lebensqualität darstellt, als primärer Endpunkt einbezogen.
In den 12-wöchigen Studien bewirkte Spiolto Respimat im Vergleich zu Placebo in Woche 12 eine Verbesserung des mittleren SGRQ-Gesamt-Scores (primärer Endpunkt) um −4,9 (95%-KI: −6,9, −2,9; p <0,0001) bzw. −4,6 (95%-KI: −6,5, −2,6; p <0,0001). In einer gepoolten supportiven Analyse der 12-wöchigen Studien war der prozentuale Anteil der Patienten mit einer klinisch bedeutsamen Besserung des SGRQ-Gesamt-Scores (definiert als Rückgang um mindestens 4 Einheiten gegenüber dem Ausgangswert) in Woche 12 in der mit Spiolto Respimat behandelten Gruppe höher (52%) als in der mit Tiotropium 5 Mikrogramm behandelten Gruppe (41%; Odds Ratio: 1,56 (95%-KI: 1,17, 2,07), p = 0,0022) und der Placebo-Gruppe (32%; Odds Ratio: 2,35 (95%-KI: 1,75, 3,16), p <0,0001).
Dyspnoe
Nach 24 Wochen war der mittlere TDI Focal Score unter Spiolto Respimat gegenüber Tiotropium 5 μg und Olodaterol 5 μg signifikant verbessert (Tabelle 5). Eine grössere Anzahl der mit Spiolto Respimat behandelten Patienten zeigte eine klinisch relevante Verbesserung des TDI Focal Score (MCID, definiert als Verbesserung um mindestens einen Punkt) als Patienten unter Tiotropium 5 μg (54,9% versus 50,6%, p=0,0546) bzw. Olodaterol 5 μg (54,9% versus 48,2%, p 0,0026).
Tabelle 5: TDI Focal Score nach 24 Behandlungswochen
(Studie 1 (TOnado™ 1) und Studie 2 (TOnado™ 2)
| n | Mittelwert nach Behandlungsgruppe | Differenz zu Spiolto Respimat | |
| Mittelwert (p-Wert) | |||
| Spiolto Respimat | 992 | 1,98 | |
| Tiotropium 5 μg | 978 | 1,63 | 0,36 (p=0,008) |
| Olodaterol 5 μg | 984 | 1,56 | 0,42 (p=0,002) |
Anwendung von Notfallmedikation
Die mit Spiolto Respimat behandelten Patienten wendeten sowohl tagsüber als auch nachts weniger Salbutamol als Notfallmedikation an als die Patienten, die Tiotropium 5 μg bzw. Olodaterol 5 μg erhielten.
PGR (Patient Global Rating)
Die mit Spiolto Respimat behandelten Patienten nahmen eine deutlichere Besserung ihrer Atemwegserkrankung wahr als die Patienten, die Tiotropium 5 μg bzw. Olodaterol 5 μg Placebo erhielten, wie anhand der PGR-Skala (Patient Global Rating) ermittelt wurde.
Exazerbationen
Gegenüber Tiotropium 5 μg wurde keine statistisch signifikante Reduktion des Risikos einer COPD-Exazerbation nachgewiesen. In dem kombinierten Datensatz von den 52-wöchigen Pivot-Studien betrug der Anteil der Patienten mit einer mittelgradigen/schweren COPD-Exazerbation 27,7% für Spiolto Respimat und 28,8% für Tiotropium 5 μg. Diese Studie war nicht speziell darauf ausgerichtet, die Therapiewirkungen auf COPD-Exazerbationen zu erfassen.
In Studie 9 wurde bei Patienten mit schwerer bis sehr schwerer COPD unter Spiolto Respimat eine numerisch tiefere Jahres-Rate mittelschwerer-schwerer COPD Exazerbationen gefunden, als unter Tiotropium 5 mcg allein (0.90 versus 0.97). Der Unterschied war aber statistisch nicht signifikant.
Inspiratorische Kapazität, Atembeschwerden und körperliche Ausdauer
Die Wirkung von Spiolto Respimat auf die inspiratorische Kapazität, Atembeschwerden und die symptomlimitierte körperliche Ausdauer wurde in drei randomisierten, doppelblinden Studien an COPD-Patienten untersucht:
(i) zwei replizierte 6‑wöchige Cross-Over-Studien zum Vergleich von Spiolto Respimat mit Tiotropium 5 μg, Olodaterol 5 μg und Placebo bei konstanter Belastung auf dem Fahrradergometer (450 Patienten erhielten Spiolto Respimat) [Studien 4 und 5]
(ii) eine 12‑wöchige Parallelgruppenstudie zum Vergleich von Spiolto Respimat mit Placebo bei jeweils konstanter Belastung auf dem Fahrradergometer (139 Patienten erhielten Spiolto Respimat) und dem Laufbandergometer (Untergruppe von Patienten) [Studie 6]
Spiolto Respimat verbesserte signifikant die inspiratorische Kapazität im Vergleich zu Tiotropium 5 μg, Olodaterol 5 μg und Placebo nach 6 Wochen (Studien 4 und 5; Tabelle 6) sowie zu Placebo nach 12 Wochen (0,234 l, p<0,0001; Studie 6).
Tabelle 6: Differenz der inspiratorischen Kapazität in Ruhe (IC) (l) für Spiolto Respimat zu Tiotropium 5 μg, Olodaterol 5 μg und Placebo nach 6 Wochen (Studien 4 und 5)
| n | Studie 41 | n | Studie 52 | |
| Spiolto Respimat versus | 219 | 218 | ||
| Tiotropium 5 μg | 213 | 0,114 (p<0,0001) | 208 | 0,088 (p=0,0005) |
| Olodaterol 5 μg | 214 | 0,119 (p<0,0001) | 208 | 0,080 (p=0,0015) |
| Placebo | 211 | 0,244 (p<0,0001) | 202 | 0,265 (p<0,0001) |
1 Ausgangswert vor Therapiebeginn: 2,53 l
2 Ausgangswert vor Therapiebeginn: 2,59 l
In den Studien 4 und 5 verlängerte Spiolto Respimat die Ausdauerzeit bei konstanter Belastung auf dem Fahrradergometer im Vergleich zu Placebo um 20,9% bzw. 13% (Tabelle 7). In Studie 6 verlängerte Spiolto Respimat die Ausdauerzeit bei konstanter Belastung auf dem Fahrradergometer nach der ersten Dosis um 12,6% (in einer Untergruppe von Patienten), nach 6 Wochen um 22,9% und nach 12 Wochen um 13,8% im Vergleich zu Placebo sowie die Ausdauerzeit bei konstanter Belastung auf dem Laufbandergometer (in einer Untergruppe von Patienten) nach 6 Wochen um 20,6% und nach 12 Wochen um 20,9% im Vergleich zu Placebo (Tabelle 8).
Tabelle 7: Geometrisches Mittel der Ausdauerzeit (s) bei konstanter Belastung auf dem Fahrradergometer für Spiolto Respimat im Vergleich zu Placebo nach 6 Wochen (Studien 4 und 5).
| n | Studie 41 | n | Studie 52 | |
| Spiolto Respimat | 212 | 454,1 | 216 | 465,7 |
| Placebo | 209 | 375,5 | 205 | 410,8 |
| Ratio | 1,209 (p<0,0001) | 1,134 (p<0,0001) |
1 Ausgangswert vor Therapiebeginn: 460,0 s
2 Ausgangswert vor Therapiebeginn: 434,3 s
Tabelle 8: Geometrisches Mittel der Ausdauerzeit (s) bei konstanter Belastung auf dem Fahrrad- bzw. Laufbandergometer für Spiolto Respimat im Vergleich zu Placebo nach 12 Wochen (Studie 6).
| Radfahren | Gehen | |||
| n | 12 Wochen 1,2 | n | 12 Wochen 3,4 | |
| Spiolto Respimat | 80 | 527,5 | 59 | 376,4 |
| Placebo | 77 | 463,6 | 50 | 311,4 |
| Ratio | 1,138 (p=0,021) | 1,209 (p=0,055) | ||
1 Ausgangswert vor Therapiebeginn: 443,0 s;
2 primärer Endpunkt
3 Ausgangswert vor Therapiebeginn: 311,2 s;
4 wichtiger sekundärer Endpunkt
Pharmakokinetik
Bei gleichzeitiger Inhalation von Tiotropium und Olodaterol waren die pharmakokinetischen Parameter für jeden Wirkstoff mit den Werten bei separater Inhalation vergleichbar.
Tiotropium und Olodaterol zeigen im therapeutischen Bereich eine lineare Pharmakokinetik. Bei wiederholter einmal täglicher Inhalation wird am Tag 7 der Steady State der Tiotropium-Plasmakonzentration erreicht. Der Steady State der Olodaterol-Plasmakonzentration wird bei wiederholter einmal täglicher Inhalation nach 8 Tagen erreicht. Die Akkumulation nahm im Vergleich zu einer Einzeldosis bis auf das 1,8‑fache zu.
Absorption
Tiotropium: Die bei jungen gesunden Probanden gemessenen Daten zur Ausscheidung im Urin lassen erwarten, dass ungefähr 33% der über den RespimatInhalator aufgenommenen Dosis in den systemischen Kreislauf gelangen. Oral verabreichte Lösungen weisen eine absolute Bioverfügbarkeit von 2 ‑ 3% auf. Die maximale Plasmakonzentration von Tiotropium wird 5-7 Minuten nach Inhalation über den Respimatgemessen.
Vergleichende Daten zur systemischen Tiotropium-Exposition nach Inhalation mit dem Respimat oder HandiHaler® ergaben widersprüchliche Resultate und sind daher nur bedingt konklusiv: Bei COPD-Patienten wurden nach Inhalation von 2 Hüben Respimat (insgesamt 5 mcg) Plasma-Spitzenkonzentrationen im Steady State von 10,5 pg/ml beobachtet und nahmen rasch entsprechend einem Multikompartiment-Modell ab. Die niedrigste Plasmakonzentration im Steady State lag bei 1,60 pg/ml. Nach der Inhalation mit dem HandiHaler® (18 mcg) betrug die Plasma-Spitzenkonzentration von Tiotropium im Steady State 12,9 pg/ml, und die niedrigste Plasmakonzentration lag bei 1,71 pg/ml.
Diese Tiotropium-Expositionswerte, die in einer aktuelleren Bioäquivalenzstudie gemessen wurden, deuten auf eine geringere Exposition nach der Inhalation mit dem Respimat-Inhalator hin, als bei einer Inhalation mit dem HandiHaler; während frühere Studien auf eine höhere Exposition hindeuten (Studie 205.249: Ohne Korrektur für Nachweisgrenze 35% höhere Exposition für Respimat betreffend die maximal gemessene Konzentration im Steady State (C0.167,ss) und 31% höhere Urinausscheidung (Ae0-12,ss); Studie 205.250: 18% höhere C0.167,ss und 17% höhere Ae0-12,ss)).
Olodaterol: Bei gesunden Probanden wurde die absolute Bioverfügbarkeit von Olodaterol nach Inhalation auf etwa 30% geschätzt, wohingegen die absolute Bioverfügbarkeit bei Verabreichung als Lösung zum Einnehmen weniger als 1% betrug. Die maximale Plasmakonzentration von Olodaterol wird normalerweise innerhalb von 10 bis 20 Minuten nach Inhalation des Arzneimittels über den Respimaterreicht.
Distribution
Tiotropium: Ist zu 72% an Plasmaproteine gebunden und hat ein Verteilungsvolumen von 32 l/kg. Studien an Ratten haben gezeigt, dass Tiotropium die Blut-Hirn-Schranke nicht in relevantem Ausmass passiert.
Olodaterol: Ist zu etwa 60% an Plasmaproteine gebunden und hat ein Verteilungsvolumen von 1110 l.
Metabolismus
Tiotropium: Das Ausmass der Metabolisierung ist gering, was daraus hervorgeht, dass 74% einer intravenösen Dosis unverändert im Urin ausgeschieden werden. Der Ester Tiotropium wird nichtenzymatisch in eine Alkohol- und eine Säurekomponente (N‑Methylscopin bzw. Dithienylglycolsäure) gespalten, die beide nicht an Muskarin-Rezeptoren binden.
In-vitro-Untersuchungen an humanen Lebermikrosomen und humanen Hepatozyten weisen darauf hin, dass ein weiterer Anteil des Wirkstoffes (<20% der Dosis nach intravenöser Gabe) durch Cytochrom‑P450(CYP)2D6 und CYP3A4-abhängige Oxidation und nachfolgende Glutathion-Konjugation zu verschiedenen Phase‑II-Metaboliten metabolisiert wird.
Olodaterol: Wird im Wesentlichen durch direkte Glucuronidierung sowie durch O‑Demethylierung an der Methoxygruppe und nachfolgende Konjugation metabolisiert. Von den sechs bekannten Metaboliten bindet nur das unkonjugierte Demethylierungsprodukt (SOM 1522) an Beta2-Rezeptoren; dieser Metabolit ist jedoch nach langfristiger Inhalation der empfohlenen therapeutischen Dosis oder in bis zu 4‑fach höherer Dosierung im Plasma nicht nachweisbar. An der O‑Demethylierung von Olodaterol sind die Cytochrom-P450-Isoenzyme CYP2C9 und CYP2C8 beteiligt, während CYP3A4 unbedeutend ist. An der Bildung von Olodaterol-Glucuroniden sind nachweislich die Isoformen UGT2B7, UGT1A1, UGT1A7 und UGT1A9 der Uridindiphosphat-Glycosyltransferase beteiligt.
Elimination
Tiotropium: Nach intravenöser Gabe wird Tiotropium hauptsächlich unverändert im Urin ausgeschieden (74%). Die Gesamtclearance bei jungen Probanden beträgt 880 ml/min. Bei COPD-Patienten liegt die Ausscheidung im Urin nach Inhalation bis zum Steady State bei 18,6% der Dosis, der Rest besteht hauptsächlich aus im Darm nicht resorbierter Substanz und wird mit den Fäzes ausgeschieden. Die renale Clearance von Tiotropium liegt über der glomerulären Filtrationsrate, was auf eine aktive Ausscheidung in den Urin hinweist. Die effektive Halbwertszeit von Tiotropium nach Inhalation liegt bei COPD Patienten zwischen 27 und 45 Stunden.
Olodaterol: Die Gesamtclearance von Olodaterol bei gesunden Probanden liegt bei 872 ml/min, die renale Clearance bei 173 ml/min. Die terminale Halbwertszeit nach intravenöser Gabe beträgt 22 Stunden. Nach Inhalation beträgt die terminale Halbwertszeit hingegen etwa 45 Stunden, was darauf hinweist, dass bei letzterer eher Resorptions- als Eliminationsprozesse eine Rolle spielen.
Nach intravenöser Gabe von 14C‑markiertem Olodaterol wurden 38% der radioaktiven Dosis im Urin und 53% in den Fäzes nachgewiesen. Der nach intravenöser Gabe im Urin nachgewiesene Anteil an unverändertem Olodaterol betrug 19%. Nach oraler Anwendung wurden nur 9% der Radioaktivität im Urin nachgewiesen, der Hauptanteil (84%) hingegen in den Fäzes gefunden. Über 90% der Dosis wurden innerhalb von 6 Tagen nach intravenöser bzw. 5 Tagen nach oraler Verabreichung ausgeschieden. Nach Inhalation belief sich die Ausscheidung von unverändertem Olodaterol im Urin innerhalb des Dosierintervalls bei gesunden Probanden im Steady State auf 5‑7% der Dosis.
Kinetik spezieller Patientengruppen
Tiotropium: Wie für alle überwiegend renal ausgeschiedenen Arzneimittel zu erwarten, war ein höheres Alter mit der Abnahme der renalen Tiotropium-Clearance (von 347 ml/min bei COPD-Patienten <65 Jahren bis zu 275 ml/min bei COPD-Patienten ≥65 Jahre) assoziiert. Dies führte nicht zu einem entsprechenden Anstieg der AUC0‑6,ss oder der Cmax,ss.
Olodaterol: Eine pharmakokinetische Metaanalyse mit Daten aus 2 kontrollierten klinischen Studien mit 405 COPD-Patienten und 296 Asthma-Patienten zeigte, dass keine Dosisanpassung auf Grundlage der Auswirkung des Alters, des Geschlechts und des Körpergewichts auf die systemische Exposition gegenüber Olodaterol erforderlich ist.
Der Vergleich pharmakokinetischer Daten innerhalb und zwischen Olodaterol-Studien zeigte eine Tendenz zu einer höheren systemischen Exposition bei Japanern und anderen Asiaten gegenüber Kaukasiern.
In klinischen Olodaterol-Studien mit einer Dauer von bis zu einem Jahr, in denen Kaukasier und Asiaten Olodaterol in Dosen bis zum 2-fachen der empfohlenen therapeutischen Dosis erhielten, ergaben sich keine Bedenken bezüglich der Sicherheit.
Leberfunktionsstörungen
Tiotropium: Bei Patienten mit Leberfunktionsstörung ist kein Einfluss auf die Pharmakokinetik von Tiotropium zu erwarten. Tiotropium wird überwiegend renal ausgeschieden (74% bei jungen gesunden Probanden und durch eine einfache, nichtenzymatische Esterspaltung zu pharmakologisch inaktiven Produkten abgebaut.
Olodaterol: Bei Patienten mit leichter bis mittelgradiger Leberfunktionsstörung war die systemische Exposition gegenüber Olodaterol nicht beeinträchtigt. Die Auswirkung einer schweren Leberfunktionsstörung auf die systemische Exposition gegenüber Olodaterol wurde nicht untersucht.
Wechselwirkungen von Olodaterol:
Wechselwirkungsstudien wurden mit Fluconazol als Beispiel eines CYP2C9-Hemmers und Ketoconazol als starkem P‑Gp- und CYP-Hemmer durchgeführt.
Fluconazol: Bei gleichzeitiger Gabe von 400 mg Fluconazol einmal täglich über 14 Tage wurde kein relevanter Effekt auf die systemische Exposition gegenüber Olodaterol festgestellt.
Ketoconazol: Bei gleichzeitiger Gabe von 400 mg Ketoconazol einmal täglich über 14 Tage erhöhte sich die Cmax von Olodaterol um 66% und die AUC0‑1 um 68%.
Nierenfunktionsstörungen
Tiotropium: Bei COPD-Patienten mit geringgradiger Nierenfunktionsstörung (CLcr 50‑80 ml/min) führte die einmal tägliche Inhalation von Tiotropium bis zum Steady State im Vergleich zu Patienten mit normaler Nierenfunktion (CLcr >80 ml/min) zu einem leichten Anstieg der AUC0,ss (zwischen 1,8% und 30% erhöht). Ähnliches wurde auch für die Cmax,ss beobachtet. Bei Patienten mit mittelgradiger bis schwerer Nierenfunktionsstörung (CLcr <50 ml/min) verdoppelte sich die Gesamtexposition nach intravenöser Gabe von Tiotropium im Vergleich zu Patienten mit normaler Nierenfunktion (Anstieg der AUC0-4h um 82% und der Cmax um 52%. Dies wurde durch Messungen nach Inhalation des Trockenpulvers bestätigt.
Olodaterol: Bei Patienten mit schwerer Nierenfunktionsstörung (CLcr <30 ml/min) war die systemische Exposition gegenüber Olodaterol im Durchschnitt um das 1,4‑fache erhöht. Angesichts der Sicherheitsdaten zur Olodaterol-Therapie aus klinischen Studien mit einer Dauer von bis zu einem Jahr mit Dosen, die bis zum 2‑fachen der empfohlenen therapeutischen Dosis betrugen, gab dieses Ausmass des Expositionsanstiegs keinen Anlass für Sicherheitsbedenken.
Präklinische Daten
Toxizität bei einmaliger Verabreichung
In den für die Kombination Tiotropium + Olodaterol an Mäusen und Ratten durchgeführten Studien zur Toxizität bei einmaliger Inhalation mit drei Dosisverhältnissen wurde eine geringe akute Toxizität nachgewiesen. Bei Mäusen betrug die ungefähre letale Dosis (ALD) 34,8+36,6 mg/kg für Tiotropium+Olodaterol im Verhältnis 1:1. Bei Ratten traten keine Todesfälle auf, daher betrugen die ALD >17,9+18,8 mg/kg für Tiotropium/Olodaterol im Verhältnis 1:1.
Langzeittoxizität (bzw. Toxizität bei wiederholter Verabreichung)
Zur Toxizität bei wiederholter Inhalation für die Kombination Tiotropium + Olodaterol wurden Studien an Ratten (4 Wochen) und Hunden (bis zu 13 Wochen) mit unterschiedlichen Dosisverhältnissen durchgeführt. In den 13‑wöchigen Studien an Hunden waren die Entwicklung des Körpergewichts, klinische Zeichen, Veränderungen im kardiovaskulären System und der entsprechenden Enzymaktivitäten sowie makroskopische und mikroskopische Pathologiebefunde charakteristisch für beta2-agonistische und anticholinerge Effekte. In den 13‑wöchigen Toxizitätsstudien mit dem Dosisverhältnis 1:1 für Tiotropium/Olodaterol betrugen die NOAEL 14+16 μg/kg/Tag.
Genotoxizität
Untersuchungen zur in‑vitro-Mutagenität der Einzelsubstanzen Tiotropium bzw. Olodaterol ergaben keine Hinweise auf ein genotoxisches Potential. In einem in-vivo-Mikronukleus-Test am Knochenmark von Ratten war die Kombination Tiotropium+Olodaterol nach Inhalation von Dosen bis zu 2266+2174 μg/kg/Tag über 4 Wochen (Dosisverhältnis 1:1) frei von genotoxischem Potential.
Kanzerogenität
Für die Kombination wurden keine Kanzerogenitätsstudien durchgeführt.
Tiotropium: zeigte in entsprechenden Studien an Mäusen und Ratten keinerlei kanzerogenes Potential.
Olodaterol: die lebenslange Behandlung von Ratten induzierte bei Expositionen, die etwa das 2235‑fache bzw. 715‑fache der Exposition für die 5 μg-Dosis (systemische Exposition) betrugen, klassen- und nagetierspezifische Leiomyome im Mesovarium. Die lebenslange Behandlung von Mäusen induzierte bei Expositionen, die etwa das 477‑fache bis 3596‑fache der Exposition für die 5 μg-Dosis (systemische Exposition) betrugen, Tumore in der glatten Uterusmuskulatur (Leiomyome, Leiomyosarkome) sowie fokale Keimstrang-Stromahyperplasien und fokale luteale Hyperplasien im Ovar. Auch dies gilt als Klasseneffekt bei Nagetieren nach Mehrfachgabe. Beide Studien lassen hinsichtlich Kanzerogenität und chronischer Toxizität keine besonderen Gefahren von Olodaterol für den Menschen erkennen.
Im in-vivo-Mikronukleus-Test am Knochenmark von Ratten nach Inhalation (bis zum ca. 1092‑fachen der 5 μg-Dosis, bezogen auf die AUC(0-24h)) und den in‑vitro-Tests zur Mutagenität (Ames-Test, Test an Lymphomzellen der Maus) war Olodaterol auch in sehr hohen Dosen frei von genotoxischem Potential. Bei Ratten wurde nach intravenöser Gabe von Dosen, die mindestens das 5500‑fache der 5 μg-Dosis (bezogen auf die AUC(0-24h)) betrugen, ein vermehrtes Auftreten von Mikronuklei beobachtet, was möglicherweise auf eine arzneimittelbedingte (kompensatorische) Erythropoese zurückzuführen ist.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Der Spiolto Respimat Inhalator ist spätestens 3 Monate nach der ersten Anwendung zu verwerfen.
Besondere Lagerungshinweise
Nicht über 30 °C lagern.
Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Siehe der Packung beigelegte Gebrauchsanweisung des Respimat Inhalator wiederverwendbar
Zulassungsnummer
67352 (Swissmedic).
Zulassungsinhaberin
Boehringer Ingelheim (Schweiz) GmbH, Basel.
Stand der Information
Mai 2020.
Composition
Principes actifs
Olodaterolum (ut Olodateroli hydrochloridum) et tiotropium (ut Tiotropii bromidum monohydricum).
Excipients
Benzalkonii chloridi solutio corresp. Benzalkonii chloridum 1,1 µg dinatrii edetas, acidum hydrochloridum, aqua purificata, nitrogenium.
Forme pharmaceutique et quantité de principe actif par unité
Solution à inhaler.
À chaque bouffée, 2,5 microgrammes d'olodatérol et 2,5 microgrammes de tiotropium sont administrés.
Indications/Possibilités d’emploi
Spiolto Respimat est indiqué pour le traitement bronchodilatateur d'entretien chez les patients avec BPCO symptomatique chez lesquels un monotraitement par faibles doses de LAMA ou de LABA seul est insuffisant.
Posologie/Mode d’emploi
La dose recommandée chez l'adulte est de 5 microgrammes d'olodatérol et de 5 microgrammes de tiotropium. Cette dose correspond à deux pulvérisations par l'inhalateur Respimat, devant être administrées une fois par jour, à la même heure.
La dose recommandée ne doit pas être dépassée.
Patients présentant des troubles de la fonction hépatique
Spiolto Respimat contient de l'olodatérol, qui est principalement métabolisé par le foie.
Les patients présentant des troubles de la fonction hépatique légers à modérés peuvent utiliser Spiolto Respimat à la dose recommandée. On ne dispose d'aucune donnée sur l'utilisation de l'olodatérol chez les patients avec une insuffisance hépatique sévère.
Patients présentant des troubles de la fonction rénale
Les patients présentant des troubles de la fonction rénale peuvent utiliser Spiolto Respimat à la dose recommandée.
Spiolto Respimat contient du tiotropium, qui est principalement éliminé par voie rénale. C'est pourquoi les patients présentant des troubles de la fonction rénale modérés à sévères sous Spiolto Respimat doivent être étroitement surveillés.
Patients âgés
Les patients âgés peuvent utiliser Spiolto Respimat à la dose recommandée.
Enfants et adolescents
Il n'existe pas de bénéfices pertinents associés à l'utilisation de Spiolto Respimat pour traiter la BPCO chez les enfants et les adolescents de moins de 18 ans. L'efficacité et la sécurité de Spiolto Respimat chez les enfants et les adolescents n'ont pas été prouvées.
Contre-indications
L'utilisation de Spiolto Respimat est contre-indiquée chez les patients hypersensibles à l'olodatérol ou au tiotropium ainsi qu'à d'autres composants du médicament.
Spiolto Respimat est également contre-indiqué chez les patients avec une hypersensibilité anamnétique connue à l'atropine ou ses dérivés, p.ex. l'ipratropium ou l'oxitropium.
Mises en garde et précautions
Spiolto Respimat contient du chlorure de benzalconium, ce composant peut provoquer une respiration sifflante et des difficultés respiratoires (bronchospasmes – rétrécissements spasmodiques des voies respiratoires), en particulier lorsque vous souffrez d’asthme.
Asthme
Spiolto Respimat ne doit pas être utilisé en cas d'asthme. L'efficacité et la sécurité de l'olodatérol et du tiotropium en cas d'asthme n'ont pas été examinées jusqu'ici.
Bronchospasme aigu
Spiolto Respimat ne doit pas être utilisé en tant que médicament d'urgence pour traiter les bronchospasmes aigus.
Hypersensibilité
Des réactions allergiques immédiates sont possibles après l'utilisation de Spiolto Respimat.
Bronchospasme paradoxal
Comme les autres médicaments inhalés, Spiolto Respimat peut causer des bronchospasmes paradoxaux, pouvant mettre en péril la vie du patient. En cas d'apparition d'un bronchospasme paradoxal, Spiolto Respimat doit être arrêté immédiatement et remplacé par un traitement alternatif.
Glaucome à angle étroit, hyperplasie de la prostate, obstruction du col vésical
En raison des propriétés anticholinergiques du tiotropium, Spiolto Respimat doit être utilisé avec prudence chez les patients avec glaucome à angle étroit, hyperplasie de la prostate ou obstruction du col vésical.
Altération de la fonction rénale
Le tiotropium étant principalement éliminé par voie rénale, l'utilisation de Spiolto Respimat chez les patients présentant des troubles de la fonction rénale modérés à sévères (clairance de la créatinine <50 ml/min) doit s'accompagner d'une surveillance étroite des patients (voir rubrique «Posologie/Mode d'emploi»).
Symptômes oculaires
Les patients doivent être instruits sur la manière correcte d'utiliser Spiolto Respimat. La solution ou le nuage de pulvérisation ne doit pas entrer en contact avec les yeux. Des douleurs/troubles oculaires, une vision trouble, des halos visuels ou une perception modifiée des couleurs, associés à une rougeur oculaire due à une injection de la conjonctive et un œdème cornéen peuvent être des signes d'un glaucome à angle fermé. En cas d'apparition des symptômes mentionnés dans une combinaison quelconque, un ophtalmologue doit être consulté au plus vite.
Les collyres myotiques sont considérés comme inefficaces.
Effets systémiques
Spiolto Respimat contient un agoniste à action longue des adrénorécepteurs bêta2. Les agonistes à action longue des adrénorécepteurs bêta2 doivent être utilisés avec prudence chez les patients avec des affections cardiovasculaires, en particulier la coronaropathie, les arythmies, la cardiomyopathie hypertrophique obstructive et l'hypertension, chez les patients souffrant de troubles convulsifs ou d'hyperthyroïdie, chez les patients avec allongement connu ou supposé de l'intervalle QT ainsi que chez les patients présentant une sensibilité inhabituelle aux amines sympathomimétiques.
Effets cardiovasculaires
Comme les autres agonistes des adrénorécepteurs bêta2, l'olodatérol peut entraîner chez certains patients des effets cardiovasculaires cliniquement pertinents se manifestant par une augmentation de la fréquence cardiaque, de la tension artérielle et/ou d'autres symptômes. Si de telles manifestations surviennent, le traitement doit être éventuellement arrêté. En outre, des modifications sur l'ECG ont été observées sous traitement par des agonistes des adrénorécepteurs bêta, p.ex. aplatissement des ondes T et abaissement du segment ST. La pertinence clinique de ces observations est cependant inconnue.
Avant la prescription d'un traitement chronique par un agoniste bêta comme Spiolto Respimat, il faut informer les patients souffrant de BPCO sur les maladies cardiovasculaires secondaires. Il est donc conseillé de réaliser également un examen par ECG avec recherche d'un allongement du QTc.
Au cours des études cliniques, les patients avec infarctus du myocarde ou hospitalisés à cause d'une insuffisance cardiaque l'année précédant le début du traitement ont été exclus.
Hypokaliémie
Les agonistes des adrénorécepteurs bêta2 peuvent, chez certains patients, causer une hypokaliémie marquée pouvant entraîner des effets cardiovasculaires indésirables. La chute de la concentration sérique en potassium est habituellement passagère et ne nécessite pas de supplémentation. Chez les patients avec BPCO sévère, l'hypokaliémie peut être renforcée par l'hypoxie et le traitement secondaire (voir rubrique «Interactions»). Cette situation peut augmenter la tendance aux troubles du rythme cardiaque.
Hyperglycémie
L'inhalation de fortes doses d'agonistes des adrénorécepteurs bêta2 peut conduire à une élévation de la glycémie.
Spiolto Respimat ne doit pas être utilisé avec d'autres agonistes des adrénorécepteurs bêta2 à action longue. Les patients ayant inhalé jusqu'ici régulièrement (p.ex. quatre fois par jour) des agonistes des adrénorécepteurs bêta2 à action brève doivent être informés de la nécessité de n'utiliser ces produits que pour le soulagement des symptômes respiratoires aigus.
Spiolto Respimat ne doit pas être utilisé plus fréquemment qu'une fois par jour.
Interactions
Aucune étude spécifique sur les interactions avec d'autres médicaments n'a été effectuée.
Les informations concernant l'apparition possible d'interactions en cas d'utilisation de Spiolto Respimat sont basées sur la possibilité d'apparition d'interactions en cas d'utilisation de ses deux composants individuels.
Le bromure de tiotropium a été utilisé en concomitance avec d'autres médicaments habituellement utilisés pour le traitement de la BPCO, comme les méthylxanthines ainsi que les corticoïdes administrés par voie orale ou en inhalation, sans signe clinique d'interaction.
L'utilisation au long cours du bromure de tiotropium avec d'autres anticholinergiques n'a pas été étudiée. C'est pourquoi l'utilisation au long cours d'autres anticholinergiques avec Spiolto Respimat n'est pas recommandée.
Adrénergiques
En cas d'utilisation concomitante d'autres produits adrénergiques, les effets secondaires de Spiolto Respimat peuvent être renforcés.
Dérivés de la xanthine, corticoïdes et diurétiques
Un traitement adjuvant par des dérivés de la xanthine, des corticoïdes ou des diurétiques épargneurs de potassium peut conduire à un renforcement de l'effet hypokaliémique des agonistes des adrénorécepteurs (voir rubrique «Mises en garde et précautions»).
Bêta-bloquants
Les bloqueurs des bêta-récepteurs peuvent affaiblir ou antagoniser l'effet de l'olodatérol. Dans ce cas, les bêta-bloquants cardiosélectifs peuvent être envisagés, mais ils doivent être utilisés avec prudence.
Inhibiteurs de la MAO et antidépresseurs tricycliques, médicaments allongeant l'intervalle QTc
Les inhibiteurs de la monoamine oxydase, les antidépresseurs tricycliques ou d'autres médicaments connus pour allonger l'intervalle QTc peuvent renforcer l'effet de Spiolto Respimat sur le système cardiovasculaire.
Interactions pharmacocinétiques
Au cours d'une étude sur les interactions entre l'olodatérol et le kétoconazole, un inhibiteur double et puissant des CYP et de la Pgp, l'exposition systémique a augmenté d'environ 1,7 fois (voir rubrique «Pharmacocinétique»). Au cours d'études cliniques sur l'olodatérol menées pendant une durée allant jusqu'à un an avec des doses allant jusqu'à deux fois la dose thérapeutique recommandée, aucun risque n'a été détecté en termes de sécurité. Aucune adaptation posologique de Spiolto Respimat n'est nécessaire.
Grossesse/Allaitement
Grossesse
Les expériences sont très limitées jusqu'ici concernant l'utilisation du tiotropium chez les femmes enceintes. Aucune donnée clinique n'est disponible concernant l'exposition des femmes enceintes à l'olodatérol.
Des études précliniques avec le tiotropium n'ont pas révélé d'indices suggérant des effets néfastes directs ou indirects sur la santé en termes de toxicité sur la reproduction aux doses pertinentes du point de vue clinique.
Au cours des études précliniques, l'olodatérol à une posologie largement supérieure à la dose thérapeutique a montré les effets typiques des agonistes des adrénorécepteurs bêta (voir la rubrique «Données précliniques»).
Par mesure de précaution, l'utilisation de Spiolto Respimat doit être évitée pendant la grossesse.
L'effet inhibiteur des agonistes des adrénorécepteurs bêta comme l'olodatérol (l'un des composants de Spiolto Respimat) sur les contractions utérines doit être pris en compte.
Allaitement
Des données cliniques issues de femmes allaitantes et exposées au tiotropium et/ou à l'olodatérol ne sont pas disponibles.
Au cours d'expérimentations précliniques avec le tiotropium et l'olodatérol, la substance et/ou ses métabolites ont été détectés dans le lait de rattes allaitantes, mais on ne sait pas si le tiotropium et/ou l'olodatérol passent dans le lait maternel humain.
C'est pourquoi Spiolto Respimat ne doit être utilisé chez la femme allaitante que si les bénéfices attendus dépassent le risque possible pour l'enfant.
Fertilité
Aucune donnée clinique n'est disponible sur l'effet du tiotropium, de l'olodatérol et de l'association des deux composants sur la fertilité. Au cours d'études précliniques avec les substances seules (tiotropium ou olodatérol), aucun effet néfaste n'a été noté sur la fertilité (voir données précliniques).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude sur les effets du médicament sur la capacité à conduire des véhicules ou à utiliser des machines n'a été menée.
Toutefois, les patients doivent être informés que des vertiges et une vue trouble ont été rapportés après l'utilisation de Spiolto Respimat. La prudence est donc conseillée lors de la conduite de véhicules ou l'utilisation de machines. En cas d'apparition des symptômes mentionnés, les patients doivent éviter les activités potentiellement dangereuses comme la conduite d'un véhicule ou l'utilisation de machines.
Effets indésirables
Le programme de développement clinique de Spiolto Respimat englobe plus de 19'000 patients atteints de BPCO. Parmi ces patients, plus de 5'900 ont reçu une dose de 5 µg de tiotropium et 5 µg d'olodatérol.
Les effets secondaires de Spiolto Respimat ont été identifiés surtout au moyen des données de deux études cliniques au long cours, contrôlées contre des principes actifs en groupes parallèles (52 semaines) et menées auprès de patients avec BPCO. De plus, une autre étude au long cours, contrôlée contre des principes actifs en groupes parallèles (52 semaines) a été menée auprès de patients avec BPCO dans laquelle on a comparé Spiolto Respimat et le tiotropium (étude 9).
À l'issue de l'analyse combinée de ces trois études cliniques au long cours (études 1, 2 et 9), l'incidence globale des effets secondaires a été comparable dans le groupe sous Spiolto Respimat et le groupe sous tiotropium à 5 μg ou sous olodatérol à 5 μg (74,1% et 74,3%). Tous les effets secondaires déjà décrits pour les composants seuls sont également considérés comme des effets secondaires de Spiolto Respimat et sont mentionnés dans la liste ci-dessous.
Dans l'étude 9, à laquelle ont participé plus de 3'900 patients avec BPCO ayant reçu Spiolto Respimat, aucun nouvel effet indésirable n'a été signalé. De plus, le profil de sécurité concordait avec celui des études d'homologation.
En outre, des effets secondaires apparaissant sous Spiolto Respimat, mais pas sous les composants individuels, sont également indiqués.
Les effets secondaires rapportés sous Spiolto Respimat pendant les études cliniques et lors de la surveillance postmarketing sont listés ci-dessous en fonction du système d'organes et de leur fréquence. Les fréquences sont définies comme suit:
Fréquents: ≥1%-<10%; occasionnels; ≥0,1%-<1%; rares: ≥0,01%-<0,1%; très rares: <0,01%; fréquence inconnue: la fréquence exacte ne peut pas être estimée sur la base des données disponibles issues des rapports spontanés lors de la surveillance postmarketing.
Infections et infestations
Rares: rhinopharyngite.
Troubles du métabolisme et de la nutrition
Fréquence inconnue: déshydratation.
Affections du système nerveux
Occasionnels: vertiges.
Rares: insomnies.
Affections oculaires
Rares: vision trouble.
Fréquence inconnue: glaucome, augmentation de la pression intraoculaire.
Affections cardiaques
Occasionnels: tachycardie.
Rares: tachycardie supraventriculaire, fibrillation auriculaire, palpitations.
Affections vasculaires
Occasionnels: hypertension.
Affections respiratoires, thoraciques et médiastinales
Occasionnels: toux, dysphonie.
Rares: épistaxis, laryngite, pharyngite, bronchospasme.
Fréquence inconnue: sinusite.
Affections gastro-intestinales
Occasionnels: sécheresse buccale.
Rares: gingivite, candidose oropharyngée, stomatite, constipation.
Fréquence inconnue: occlusion intestinale, y compris iléus paralytique, dysphagie, reflux gastro-œsophagien, glossite.
Affections de la peau et du tissu sous-cutané
Rares: angio-œdème, urticaire, prurit, réactions d'hypersensibilité (y compris réactions allergiques de type immédiat), éruption cutanée.
Fréquence inconnue: peau sèche, infections cutanées et ulcères cutanés.
Affections musculosquelettiques et systémiques
Rares: dorsalgies1, arthralgie, gonflements articulaires.
Affections du rein et des voies urinaires
Rares: rétention urinaire (habituellement chez les hommes prédisposés), dysurie, infections urinaires.
1 Effets secondaires survenus sous Spiolto Respimat, mais pas sous les composants individuels
Parmi les effets secondaires mentionnés, nombreux sont ceux qui peuvent être dus aux propriétés anticholinergiques du tiotropium ou aux propriétés bêta-adrénergiques de l'olodatérol (composants de Spiolto Respimat).
Il faut en outre prendre en compte les signes d'autres effets secondaires bêta‑adrénergiques qui ne sont pas listés ci-dessus; on compte parmi ces derniers l'arythmie, l'ischémie myocardique, l'angine de poitrine, l'hypotension, les tremblements, les céphalées, la nervosité, les nausées, les crampes musculaires, l'épuisement, la sensation de malaise, l'hypokaliémie, l'hyperglycémie et l'acidose métabolique.
La déclaration des effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Signes et symptômes
À fortes doses, le tiotropium peut conduire à des signes et symptômes anticholinergiques.
Après l'administration d'une solution à inhaler à une dose allant jusqu'à 40 µg de tiotropium pendant 14 jours à des sujets sains, aucun effet secondaire pertinent dont l'incidence dépassait celle de la sécheresse dose-dépendante (10‑40 μg par jour) de la bouche, de la gorge et du nez n'a été observé, à part une réduction claire du flux salivaire à partir du 7e jour.
Au cours de six études au long cours menées auprès de patients avec BPCO, aucun effet indésirable significatif n'a été noté à une dose journalière de 10 μg de tiotropium en solution à inhaler pendant 4 à 48 semaines.
Un surdosage de l'olodatérol entraîne vraisemblablement des symptômes typiques des agonistes des adrénorécepteurs bêta2 comme l'ischémie myocardique, l'hypertension ou l'hypotension, la tachycardie, les arythmies, les palpitations, les vertiges, la nervosité, l'insomnie, les états anxieux, les céphalées, les tremblements, la sécheresse buccale, les crampes musculaires, les nausées, l'épuisement, la sensation de malaise, l'hypokaliémie, l'hyperglycémie et l'acidose métabolique.
Traitement
Le traitement par Spiolto Respimat doit être arrêté. Un traitement symptomatique de soutien est indiqué ainsi que, dans les cas graves, une hospitalisation. L'administration de bêtabloquants cardiosélectifs peut être envisagée, mais avec une prudence extrême car les bêtabloquants peuvent induire des bronchospasmes.
Propriétés/Effets
Code ATC
R03AL06
Mécanisme d'action
Pharmacodynamique
Spiolto Respimat:
Le tiotropium, un antagoniste spécifique des récepteurs muscariniques à action longue, et l'olodatérol, un agoniste bêta2 à action longue, sont utilisés ensemble dans l'inhalateur Spiolto Respimat. Ces deux principes actifs conduisent à une bronchodilatation additive en raison de leurs mécanismes d'action et récepteurs cibles différents dans les poumons.
Tiotropium: Le bromure de tiotropium est un antagoniste spécifique des récepteurs muscariniques à action longue (LAMA), souvent considéré en médecine clinique comme un anticholinergique et montrant la même affinité pour les récepteurs muscariniques de sous-types M1 à M5. Dans les voies respiratoires, l'inhibition des récepteurs M3 dans la musculature lisse conduit à une relaxation. Le caractère compétitif et réversible de l'antagonisme a été prouvé sur les récepteurs humains et animaux ainsi que sur des préparations d'organes isolés. Au cours d'études précliniques in vitro et in vivo, l'effet bronchoprotecteur a été dose-dépendant et a persisté plus de 24 heures. La longue durée d'action est probablement due à la dissociation très lente des récepteurs M3. La demi-vie de la dissociation est significativement plus longue que pour l'ipratropium. En tant qu'anticholinergique N-quaternaire, le tiotropium est, en inhalation, un (broncho-) sélectif topique et montre une fenêtre thérapeutique suffisante avant d'induire des effets anticholinergiques systémiques. La dissociation du récepteur M2 est plus rapide que celle du récepteur M3, ce qui se manifeste au niveau fonctionnel au cours des études in vitro par une sélectivité contrôlée cinétiquement envers M3 par rapport à M2.
La puissance élevée et la lente dissociation des récepteurs est cliniquement corrélée à une bronchodilatation significative et de longue durée d'action chez les patients avec BPCO.
Pour la bronchodilatation, il s'agit en premier lieu d'une action locale (dans les voies respiratoires) et non systémique.
Olodatérol: Montre une forte affinité et une sélectivité élevée pour les adrénorécepteurs bêta2 humains. Des études in vitro ont montré que l'olodatérol induit un effet agoniste 241 fois plus fort sur les adrénorécepteurs bêta2 que sur les adrénorécepteurs bêta1 et un effet agoniste 2 299 fois plus élevé que sur les adrénorécepteurs bêta3. Les effets pharmacologiques de ce principe actif sont basés sur la liaison et l'activation des adrénorécepteurs bêta2 après administration topique par inhalation.
L'activation de ces récepteurs dans les voies respiratoires conduit à une stimulation de l'adénylate cyclase intracellulaire, une enzyme impliquée dans la synthèse de l'adénosine-3',5'-monophosphate cyclique (cAMP). Une augmentation de la concentration en cAMP induit une bronchodilatation via une relaxation de la musculature lisse des voies respiratoires.
L'olodatérol présente le profil préclinique d'un agoniste sélectif des adrénorécepteurs bêta2 (LABA) à action longue, effet rapide et durée d'action d'au moins 24 heures.
Les adrénorécepteurs bêta sont classés en trois sous-types: les adrénorécepteurs bêta1 sont exprimés principalement dans la musculature cardiaque, les adrénorécepteurs bêta2 principalement dans la musculature lisse des voies respiratoires et les adrénorécepteurs bêta3 dans les tissus adipeux. Les bêta2-agonistes conduisent à une bronchodilatation. Les adrénorécepteurs bêta2 sont les principaux récepteurs adrénergiques dans la musculature lisse des voies respiratoires, mais on les trouve également sur d'autres cellules comme l'épithélium pulmonaire, les cellules endothéliales et dans le cœur. La fonction exacte des récepteurs bêta2 dans le cœur est inconnue, mais leur présence laisse supposer que même les agonistes hautement sélectifs des adrénorécepteurs bêta2 pourraient induire des effets cardiaques.
Efficacité clinique
Effet sur l'électrophysiologie cardiaque
Tiotropium: L'effet du tiotropium en poudre pour inhalation sur l'intervalle QT a été examiné au cours d'une étude randomisée, contrôlée contre placebo et principes actifs avec cross-over et menée auprès de 53 sujets sains. Les patients ont reçu pendant 12 jours du tiotropium en poudre pour inhalation à 18 μg et 54 μg (trois fois la dose recommandée) ou un placebo. Les examens par ECG ont été menés au début de l'étude et aux intervalles d'administration après la première et la dernière dose du médicament à l'étude. Le tiotropium en poudre pour inhalation à 18 ou à 54 μg a conduit, par rapport au placebo, à une modification moyenne maximale de l'intervalle QTc spécifique à l'étude de 3,2 ms et 0,8 ms, respectivement, par rapport à la valeur initiale. Une nouvelle augmentation de l'intervalle QTc >500 ms ou une modification de l'intervalle QTc ≥60 ms par rapport à la valeur initiale n'ont été notées chez aucun sujet.
Olodatérol: L'effet de l'olodatérol sur l'intervalle QT/QTc visible sur l'ECG a été examiné au cours d'une étude en double aveugle, randomisée et contrôlée contre placebo et principe actif (moxifloxacine), menée auprès de 24 sujets masculins et féminins sains. L'olodatérol à des doses uniques de 10, 20, 30 et 50 μg a conduit, par rapport au placebo et pendant une période située entre 20 minutes et 2 heures après l'administration, à une augmentation dose-dépendante de la modification moyenne de l'intervalle QT de 1,6 ms (10 μg d'olodatérol) à 6,5 ms (50 μg d'olodatérol) par rapport à la valeur initiale. La limite supérieure de l'intervalle de confiance bilatéral à 90% a été inférieure à 10 ms à toutes les doses.
L'effet de 5 μg et de 10 μg d'olodatérol sur la fréquence cardiaque et le rythme cardiaque a été examiné dans le cadre d'une étude de phase III contrôlée contre placebo de 48 semaines sur la base d'un ECG continu pendant 24 heures (ECG de longue durée) dans un sous-groupe de 772 patients. Aucune tendance ou schéma dose-dépendant(e) ou temporel(le) n'a été observé(e) concernant l'intensité des modifications moyennes de la fréquence cardiaque ou des extrasystoles. Les modifications de l'extrasystole entre la valeur initiale et la fin du traitement n'ont pas permis de mettre en évidence des différences pertinentes entre 5 μg ou 10 μg d'olodatérol et le placebo.
Spiolto Respimat
Au cours de deux études en double aveugle et randomisées de 52 semaines avec Spiolto Respimat auxquelles 5 162 patients avec BPCO ont participé, des examens par ECG ont été menés après administration aux jours 1, 85, 169 et 365. Au cours de l'analyse combinée du nombre de patients présentant des modifications de l'intervalle QT corrigées en fonction des valeurs initiales >30 ms selon Bazett (QTcB) et Fredericia (QTcF), les corrections de la fréquence cardiaque au niveau de l'intervalle QT dans le cadre des examens réalisés ont été de 4,9‑6,4% (QTcB) et 3,3‑4,7% (QTcF) dans le groupe sous Spiolto Respimat contre 5,0‑6,0% (QTcB) et 3,4‑4,4% (QTcF) pour l'olodatérol à 5 μg ainsi que 5,3‑6,5% (QTcB) et 3,0‑4,7% (QTcF) pour le tiotropium à 5 μg.
Efficacité clinique et sécurité
Le programme de développement clinique de phase III de Spiolto Respimat comprenait trois études randomisées en double aveugle:
(i) Deux études répliquées, contrôlées contre placebo et en groupes parallèles menées pendant 52 semaines pour comparer Spiolto Respimat avec le tiotropium à 5 μg et l'olodatérol à 5 μg (1 029 patients ont reçu Spiolto Respimat) [études 1 et 2]
(ii) Une étude en crossover de 6 semaines sur la comparaison de Spiolto Respimat avec le tiotropium à 5 μg, l'olodatérol à 5 μg et un placebo (139 patients ont reçu Spiolto Respimat) [étude 3]
Au cours de ces études, les substances de comparaison tiotropium 5 μg et olodatérol 5 μg ainsi que le placebo ont été administrés avec l'inhalateur Respimat.
La fonction pulmonaire a été examinée au cours de toutes les études (volume expiré en 1 seconde, VEMS). Au cours des études de 52 semaines, la fonction pulmonaire a été mesurée 3 heures après administration (dans un sous-groupe de patients: 12 heures après administration) ainsi que 23-24 heures après administration; les critères d'évaluation primaire de l'efficacité sur la fonction pulmonaire ont été la modification de l'ASC0‑3h du VEMS par rapport à la valeur initiale avant le début du traitement (réponse) ainsi que la modification de la valeur minimale du VEMS après 24 semaines par rapport à la valeur initiale avant le début du traitement. Au cours de l'étude de 6 semaines, la fonction pulmonaire a été mesurée jusqu'à 12 semaines après l'administration et 22-24 heures après l'administration; le critère d'évaluation primaire de l'efficacité était l'ASC0‑24h du VEMS après 6 semaines. Au cours des études de 52 semaines, le St. George's Respiratory Questionnaire (SGRQ) a été utilisé pour mesurer la qualité de vie en relation avec la santé (critère primaire) ainsi que le Mahler Transition Dyspnea Index (TDI) pour mesurer la dyspnée (critère secondaire important).
Au cours du programme de phase III, des patients âgés d'au moins 40 ans, souffrant d'une BPCO cliniquement diagnostiquée, présentant une anamnèse de tabagisme de plus de 10 paquets-années et une altération modérée à sévère de la fonction pulmonaire (VEMS après dilatation bronchique <80% de la valeur théorique [stades GOLD II‑IV; rapport VEMS/CVF après dilatation bronchique <70%]) ont été recrutés.
Caractéristiques des patients
La majorité des 5 162 patients recrutés pour les études globales de 52 semaines (études 1 et 2) étaient de sexe masculin (73%), «blancs» (71%) ou «asiatiques» (25%) et âgés de 64 ans en moyenne. Le VEMS postbronchodilatation moyen a été de 1,37 l (GOLD II [50%], GOLD III [39%], GOLD IV [11%]). La capacité de réponse moyenne aux agonistes bêta2 était de 16,6% de la valeur initiale (0,171 l). En traitement d'appoint, tous les médicaments respiratoires (p.ex. corticoïdes en inhalation [47%] et xanthine [10%]) étaient autorisés.
L'étude de 6 semaines (étude 3) a été menée en Europe et en Amérique du Nord. Les 219 patients recrutés étaient pour la plupart de sexe masculin (59%), «blancs» (99%) et âgés de 61,1 ans en moyenne. Le VEMS postbronchodilatation moyen a été de 1,55 l (GOLD II [64%], GOLD III [34%], GOLD IV [2%]). La capacité de réponse moyenne aux agonistes bêta2 était de 15,9% de la valeur initiale (0,193 l). En traitement adjuvant, tous les médicaments respiratoires (p.ex. corticoïdes en inhalation [41%] et xanthine [4%]) étaient autorisés.
Fonction pulmonaire
Au cours des études de 52 semaines, Spiolto Respimat (une fois par jour le matin) a induit dans les 5 minutes qui suivent la première dose une amélioration nette de la fonction pulmonaire (augmentation moyenne du VEMS de 0,137 l) par rapport au tiotropium à 5 μg (0,058 l, p <0,0001) et l'olodatérol à 5 μg (0,125 l, p = 0,16). Dans les deux études, une amélioration significative de l'ASC0-3h du VEMS et de la valeur minimale du VEMS après 24 semaines (critères primaires de la fonction pulmonaire) a été notée sous Spiolto Respimat par rapport au tiotropium à 5 μg et l'olodatérol à 5 μg (tableau 1).
Tableau 1: Différences au niveau des valeurs de l'ASC0-3h du VEMS et des valeurs minimales du VEMS entre Spiolto Respimat et le tiotropium à 5 μg et l'olodatérol à 5 μg après 24 semaines (études 1 et 2).
ASC0-3h du VEMS | Valeurs minimales du VEMS | |||||||
Étude 1 | Étude 2 | Étude 1 | Étude 2 | |||||
n | Moyenne | n | Moyenne | n | Moyenne | n | Moyenne | |
Spiolto Respimat contre | 522 | -- | 502 | -- | 521 | -- | 497 | -- |
Tiotropium à 5 μg | 526 | 0,117 l | 500 | 0,103 l | 520 | 0,071 l | 498 | 0,050 l |
Olodatérol à 5 μg | 525 | 0,123 l | 507 | 0,132 l | 519 | 0,082 l | 503 | 0,088 l |
Valeurs initiales du VEMS avant le début du traitement: étude 1 = 1,16 l;
étude 2 = 1,15 l;
p ≤0,0001 pour toutes les comparaisons
L'effet bronchodilatateur de Spiolto Respimat, supérieur à celui du tiotropium à 5 μg et de l'olodatérol à 5 μg, a persisté pendant toute la durée de la phase de traitement de 52 semaines. En outre, par rapport au tiotropium à 5 μg et à l'olodatérol à 5 μg, Spiolto Respimat a permis une amélioration du débit expiratoire de pointe (DEP) le matin et le soir, calculé à partir des mesures quotidiennes des patients.
Dans le sous-groupe de patients chez lesquels une mesure élargie de la fonction pulmonaire avait été effectuée jusqu'à 12 heures après l'administration, Spiolto Respimat a montré un effet significativement plus important sur le VEMS que le tiotropium 5 μg et l'olodatérol 5 μg pendant l'ensemble de l'intervalle d'administration de 24 heures (figure 1, tableau 2).
Figure 1: Profil du VEMS sous Spiolto Respimat, tiotropium 5 μg et olodatérol 5 μg pendant l'ensemble de l'intervalle d'administration de 24 h après 24 semaines (sous-groupe issu des études 1 et 2 avec PFT de 12 h; données combinées)
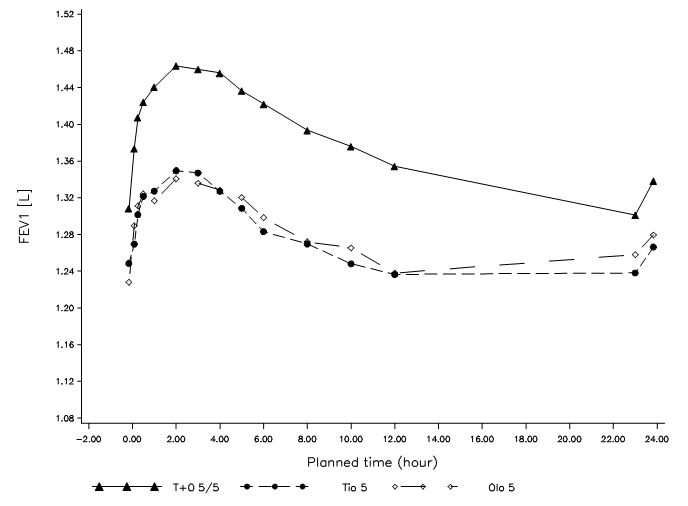
Tableau 2: Différences au niveau du VEMS entre Spiolto Respimat, le tiotropium à 5 μg et l'olodatérol à 5 μg pendant l'ensemble de l'intervalle d'administration de 24 h après 24 semaines (sous-groupe issu des études 1 et 2 avec PFT de 12 h; données combinées)
n | Moyenne sur 12 h | Moyenne sur 24 h | |
Spiolto Respimat contre | 167 | ||
Tiotropium à 5 μg | 160 | 0,123 | 0,106 |
Olodatérol à 5 μg | 194 | 0,118 | 0,098 |
Valeurs initiales du VEMS avant le début du traitement = 1,17 l
p<0,0001 pour toutes les comparaisons
Au cours de l'étude de 6 semaines, Spiolto Respimat a montré un effet significativement plus fort sur le VEMS que le tiotropium à 5 μg, l'olodatérol à 5 μg et le placebo (figure 2, tableau 3) pendant tout l'intervalle d'administration.
Figure 2: Profil du VEMS sous Spiolto Respimat, tiotropium 5 μg, olodatérol 5 μg et placebo pendant l'ensemble d'un intervalle d'administration de 24 h après 6 semaines (étude 3)
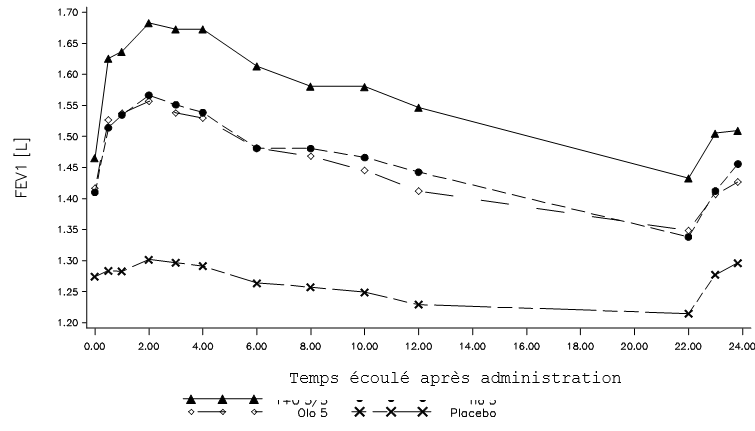
Tableau 3: Différences au niveau du VEMS sous Spiolto Respimat, tiotropium 5 μg, olodatérol 5 μg et placebo pendant l'ensemble de l'intervalle d'administration de 24 h après 6 semaines (étude 3)
n | Moyenne sur 3 h | n | Moyenne sur 12 h | Moyenne sur 24 h 1 | Valeur minimale | |
Spiolto Respimat contre | 138 | 138 | ||||
Tiotropium à 5 μg | 137 | 0,109 | 135 | 0,119 | 0,110 | 0,079 |
Olodatérol à 5 μg | 138 | 0,109 | 136 | 0,126 | 0,115 | 0,092 |
Placebo | 135 | 0,325 | 132 | 0,319 | 0,280 | 0,207 |
Valeurs initiales du VEMS avant le début du traitement = 1,30 l
1 Critère d'évaluation primaire
p <0,0001 pour toutes les comparaisons
Qualité de vie en relation avec la santé
Après 24 semaines, le score SGRQ global moyen sous Spiolto Respimat était significativement amélioré par rapport au tiotropium 5 μg et l'olodatérol 5 μg (tableau 4) et les améliorations ont été notées dans tous les domaines du SGRQ. Le nombre de patients avec une amélioration cliniquement pertinente du score SGRQ global (plus petite différence cliniquement pertinente [MCID], définie comme la diminution d'au moins 4 unités par rapport à la valeur initiale) a été plus important sous Spiolto Respimat que sous tiotropium 5 μg (57,5% contre 48,7%, p=0,0001) ou sous olodatérol 5 μg (57,5% contre 44,8%, p <0,0001).
Tableau 4: SGRQ (scores globaux et par domaine) après 24 semaines de traitement
(étude 1 [TOnado™] et étude 2 [TOnado™ 2)
n | Valeur moyenne en fonction des groupes de traitement (changement par rapport à la valeur initiale) | Différence par rapport à Spiolto Respimat | ||
Valeur moyenne (valeur p) | ||||
Score global | Valeur initiale | 43,5 | ||
Spiolto Respimat | 979 | 36,7 (‑6,8) | ||
Tiotropium à 5 μg | 954 | 37,9 (‑5,6) | ‑1,23 (p = 0,025) | |
Olodatérol à 5 μg | 954 | 38,4 (‑5,1) | ‑1,69 (p = 0,002) | |
Symptômes | Valeur initiale | 51,9 | ||
Spiolto Respimat | 982 | 42,6 | ||
Tiotropium 5 μg | 957 | 45,5 | ‑2,94 (p = 0,0008) | |
Olodatérol 5 μg | 958 | 45,0 | ‑2,48 (p = 0,0046) | |
Activité | Valeur initiale | 58,0 | ||
Spiolto Respimat | 981 | 51,9 | ||
Tiotropium 5 μg | 959 | 53,2 | ‑1,34 (p = 0,052) | |
Olodatérol 5 μg | 958 | 54,0 | ‑2,11 (p = 0,002) | |
Effets | Valeur initiale | 32,6 | ||
Spiolto Respimat | 983 | 26,1 | ||
Tiotropium 5 μg | 960 | 26,8 | ‑0,67 (p = 0,283) | |
Olodatérol 5 μg | 959 | 27,2 | ‑1,11 (p = 0,075) | |
Dans deux études cliniques supplémentaires de 12 semaines contrôlées contre placebo (étude 7 [OTEMTO™ 1] et étude 8 [OTEMTO™ 2]), en outre, le score global SGRQ au bout de 12 semaines, qui mesure la qualité de vie en termes de santé, a été inclus comme critère d'évaluation primaire.
Dans les études de 12 semaines, Spiolto Respimat a provoqué, par rapport au placebo, à la semaine 12, une amélioration du score global SGRQ moyen (critère d'évaluation primaire) de −4,9 (IC à 95%: −6,9, −2,9; p <0,0001) resp. −4,6 (IC à 95%: −6,5, −2,6; p <0,0001). Dans une analyse auxiliaire en pool des études de 12 semaines, le pourcentage de patients affichant une amélioration cliniquement significative du score global SGRQ (définie comme un recul d'au moins 4 unités par rapport à la valeur initiale) à la semaine 12 était plus élevé, dans le groupe traité par Spiolto Respimat (52%), que dans le groupe traité par le tiotropium 5 microgrammes (41%; Odds Ratio: 1,56 (IC à 95%: 1,17, 2,07), p = 0,0022) et le groupe placebo (32%; Odds Ratio: 2,35 (IC à 95%: 1,75, 3,16), p <0,0001).
Dyspnée
Après 24 semaines, le TDI Focal Score moyen était significativement amélioré sous Spiolto Respimat par rapport au tiotropium 5 μg et à l'olodatérol 5 μg (tableau 5). Le nombre de patients montrant une amélioration cliniquement pertinente du TDI Focal Score (MCID, définie comme une amélioration d'au moins un point) a été plus élevé sous Spiolto Respimat que sous tiotropium 5 μg (54,9% contre 50,6%, p = 0,0546) ou sous olodatérol 5 μg (54,9% contre 48,2%, p = 0,0026).
Tableau 5: TDI Focal Score après 24 semaines de traitement
(étude 1 [TOnado™] et étude 2 [TOnado™ 2)
n | Valeur moyenne en fonction du groupe de traitement | Différence par rapport à Spiolto Respimat | |
Valeur moyenne (valeur p) | |||
Spiolto Respimat | 992 | 1,98 | |
Tiotropium à 5 μg | 978 | 1,63 | 0,36 (p = 0,008) |
Olodatérol à 5 μg | 984 | 1,56 | 0,42 (p = 0,002) |
Utilisation de la médication d'urgence
Les patients traités par Spiolto Respimat ont utilisé moins de salbutamol en médication d'urgence (pendant la nuit et la journée) que ceux traités par le tiotropium 5 μg ou l'olodatérol 5 μg.
PGR (Patient Global Rating)
Les patients traités par Spiolto Respimat ont perçu une amélioration plus nette de leur maladie respiratoire que les patients sous tiotropium 5 μg ou olodatérol 5 μg ou le placebo, comme le montrent les résultats sur l'échelle PGR (Patient Global Rating).
Exacerbations
Aucune réduction statistiquement significative du risque d'exacerbation de la BPCO n'a été mise en évidence par rapport au tiotropium 5 μg. Dans le jeu de données combinées des études pivots de 52 semaines, la proportion de patients avec une exacerbation modérée à sévère de la BPCO est de 27,7% sous Spiolto Respimat et de 28,8% sous tiotropium 5 μg. Cette étude n'était pas conçue spécialement pour appréhender les effets du traitement sur les exacerbations de la BPCO.
Dans l'étude 9, on a observé un taux annuel numériquement inférieur d'exacerbations modérées à sévères de la BPCO chez les patients atteints de BPCO sévère à très sévère sous Spiolto Respimat, comparativement au tiotropium à 5 µg seul (0,90 contre 0,97). La différence n'était toutefois pas statistiquement significative.
Capacité inspiratoire, troubles respiratoires et endurance physique
L'effet de Spiolto Respimat sur la capacité inspiratoire, les troubles respiratoires et l'endurance physique limitée par les symptômes a été examiné au cours de trois études randomisées, en double aveugle et menées auprès de patients avec BPCO:
(i) Deux études répliquées de 6 semaines en cross-over visant à comparer Spiolto Respimat au le tiotropium 5 μg, à l'olodatérol 5 μg et à un placebo sous effort constant sur vélo ergométrique (450 patients ont reçu Spiolto Respimat) [études 4 et 5]
(ii) Une étude de 12 semaines en groupes parallèles visant à comparer Spiolto Respimat à un placebo sous effort constant sur vélo ergométrique (139 patients ont reçu Spiolto Respimat) et tapis roulant ergométrique (sous-groupe de patients) [étude 6]
Spiolto Respimat a significativement amélioré la capacité inspiratoire par rapport au tiotropium 5 μg, à l'olodatérol 5 μg et au placebo après 6 semaines (études 4 et 5; tableau 6) ainsi qu'au placebo après 12 semaines (0,234 l, p <0,0001; étude 6).
Tableau 6: Différence au niveau de la capacité inspiratoire au repos (IC) (l) sous Spiolto Respimat par rapport au tiotropium 5 μg, à l'olodatérol 5 μg et au placebo après 6 semaines (études 4 et 5)
n | Étude 41 | n | Étude 52 | |
Spiolto Respimat contre | 219 | 218 | ||
Tiotropium à 5 μg | 213 | 0,114 (p <0,0001) | 208 | 0,088 (p = 0,0005) |
Olodatérol à 5 μg | 214 | 0,119 (p <0,0001) | 208 | 0,080 (p = 0,0015) |
Placebo | 211 | 0,244 (p <0,0001) | 202 | 0,265 (p <0,0001) |
1 Valeur initiale avant le début du traitement: 2,53 l
2 Valeur initiale avant le début du traitement: 2,59 l
Au cours des études 4 et 5, Spiolto Respimat a prolongé l'endurance sous effort constant sur vélo ergométrique de 20,9% et de 13% par rapport au placebo (tableau 7). Au cours de l'étude 6, Spiolto Respimat a prolongé l'endurance sous effort constant sur vélo ergométrique de 12,6% après la première dose (dans un sous-groupe de patients), de 22,9% après 6 semaines et de 13,8% après 12 semaines par rapport au placebo ainsi que l'endurance sous effort constant sur tapis roulant ergométrique (dans un sous-groupe de patients) de 20,6% après 6 semaines et de 20,9% après 12 semaines par rapport au placebo (tableau 8).
Tableau 7: Moyenne géométrique de la durée de l'endurance (s) sous effort constant sur vélo ergométrique pour Spiolto Respimat par rapport au placebo après 6 semaines (études 4 et 5).
n | Étude 41 | n | Étude 52 | |
Spiolto Respimat | 212 | 454,1 | 216 | 465,7 |
Placebo | 209 | 375,5 | 205 | 410,8 |
Rapport | 1,209 | 1,134 |
1 Valeur initiale avant le début du traitement: 460,0 s
2 Valeur initiale avant le début du traitement: 434,3 s
Tableau 8: Moyenne géométrique de la durée de l'endurance (s) sous effort constant sur vélo ergométrique ou tapis roulant ergométrique pour Spiolto Respimat par rapport au placebo après 12 semaines (étude 6).
Vélo | Tapis roulant | |||
n | 12 semaines 1,2 | n | 12 semaines 3,4 | |
Spiolto Respimat | 80 | 527,5 | 59 | 376,4 |
Placebo | 77 | 463,6 | 50 | 311,4 |
Rapport | 1,138 | 1,209 | ||
1 Valeur initiale avant le début du traitement: 443,0 s
2 Critère d'évaluation primaire
3 Valeur initiale avant le début du traitement: 311,2 s
4 Critère d'évaluation secondaire important
Pharmacocinétique
En cas d'inhalation simultanée de tiotropium et d'olodatérol, les paramètres pharmacocinétiques de chaque principe actif ont été comparables avec les valeurs obtenues lors de l'inhalation séparée.
Le tiotropium et l'olodatérol montrent une pharmacocinétique linéaire dans l'intervalle thérapeutique. En cas d'inhalation quotidienne unique répétée, la concentration plasmatique du tiotropium atteint l'état d'équilibre au jour 7. En cas d'inhalation quotidienne unique répétée, la concentration plasmatique de l'olodatérol atteint l'état d'équilibre après 8 jours. L'accumulation a été augmentée de 1,8 fois par rapport à une dose unique.
Absorption
Tiotropium: Les données obtenues chez les sujets jeunes et sains sur l'élimination dans les urines laissent penser qu'environ 33% de la dose absorbée via l'inhalateur Respimat parviennent dans la circulation systémique. Les solutions administrées oralement montrent une biodisponibilité absolue de 2‑3%. La concentration plasmatique maximale du tiotropium est mesurée 5‑7 minutes après l'inhalation via Respimat.
Les données de comparaison sur l'exposition systémique au tiotropium après l'inhalation via Respimat ou HandiHaler® ont donné des résultats contradictoires et ne permettent donc que des conclusions partielles: chez des patients avec BPCO, des concentrations plasmatiques maximales à l'état d'équilibre de 10,5 pg/ml ont été observées après l'inhalation de deux pulvérisations par Respimat (5 µg au total) et ont diminué rapidement selon un modèle multicompartimental. La concentration plasmatique minimale à l'état d'équilibre a été de 1,60 pg/ml. Après l'inhalation via HandiHaler® (18 µg), la concentration plasmatique maximale de tiotropium à l'état d'équilibre a été de 12,9 pg/ml et la concentration plasmatique minimale de 1,71 pg/ml.
Ces données d'exposition au tiotropium mesurées au cours d'une étude de bioéquivalence plus actuelle indiquent une exposition plus faible après l'inhalation via l'inhalateur Respimat qu'après une inhalation avec HandiHaler, alors que des études antérieures indiquent une exposition plus élevée (étude 205.249: sans correction pour les limites de détection, exposition de 35% plus élevée pour Respimat sur la base de la concentration maximale mesurée à l'état d'équilibre [C0.167,ss] et élimination urinaire de 31% plus élevée [Ae0-12,ss]; étude 205.250: C0.167,ss 18% plus élevée et Ae0-12,ss 17% plus élevée).
Olodatérol: Chez des sujets sains, la biodisponibilité absolue de l'olodatérol après inhalation a été estimée à environ 30% et la biodisponibilité absolue après administration sous forme de solution buvable a été inférieure à 1%. La concentration plasmatique maximale de l'olodatérol est normalement atteinte dans les 10 à 20 minutes après inhalation via Respimat.
Distribution
Tiotropium: Lié à 72% aux protéines plasmatiques et présente un volume de distribution de 32 l/kg. Des études menées chez le rat ont montré que le tiotropium ne passait pas la barrière hémato-encéphalique dans des proportions pertinentes.
Olodatérol: Lié à environ 60% aux protéines plasmatiques et présente un volume de distribution de 1110 l.
Métabolisme
Tiotropium: La métabolisation est faible, comme l'indique une élimination sous forme inchangée dans les urines de 74% de la dose intraveineuse. L'ester tiotropium est clivé par voie non enzymatique en alcool et en acide (N méthylscopine et acide dithiénylglycolique) qui ne se lient pas au récepteur muscarinique.
Des études in vitro menées sur des microsomes hépatiques humains et des hépatocytes humains indiquent qu'une autre partie du principe actif (<20% de la dose après administration intraveineuse) est métabolisée par oxydation par les isozymes à cytochrome P450 CYP2D6 et CYP3A4, suivie d'une conjugaison avec le glutathion pour donner différents métabolites de phase II.
Olodatérol: Largement métabolisé par glucurono-conjugaison directe et O-déméthylation du groupe méthoxy, suivies d'une conjugaison. Parmi les six métabolites connus, seul le produit de déméthylation non conjugué (SOM 1522) se lie aux récepteurs bêta2; ce métabolite n'est néanmoins pas détectable dans le plasma après inhalation de longue durée de la dose thérapeutique recommandée ou d'une dose 4 fois supérieure. Les isozymes à cytochrome P450 CYP2C9 et CYP2C8 sont impliqués dans la O-déméthylation de l'olodatérol et le CYP3A4 ne joue aucun rôle. Il a été prouvé que les isoformes UGT2B7, UGT1A1, UGT1A7 et UGT1A9 de l'uridine diphosphate gycosyltransférase sont impliquées dans la formation des glucuronides d'olodatérol.
Élimination
Tiotropium: Après administration intraveineuse, le tiotropium est éliminé dans les urines, principalement sous forme inchangée (74%). La clairance globale chez les sujets jeunes est de 880 ml/min. Chez les patients avec BPCO, l'élimination dans les urines après inhalation jusqu'à l'état d'équilibre est égale à 18,6% de la dose; le reste, composé principalement de la substance non résorbée par les intestins, est éliminé dans les selles. La clairance rénale du tiotropium est supérieure au débit de filtration glomérulaire, ce qui indique une élimination active dans les urines. La demi-vie effective du tiotropium après inhalation se situe entre 27 et 45 heures chez les patients avec BPCO.
Olodatérol: La clairance globale de l'olodatérol chez les sujets sains est de 872 ml/min et la clairance rénale est de 173 ml/min. La demi-vie terminale après administration intraveineuse est de 22 heures. Après inhalation, la demi-vie terminale est de 45 heures, ce qui indique que dans ce cas, des processus d'absorption et d'élimination jouent un rôle.
Après administration intraveineuse d'olodatérol marqué au C14, 38% de la dose radioactive ont été retrouvés dans les urines et 53% dans les selles. Après administration intraveineuse, la proportion d'olodatérol inchangé détectée dans les urines a été de 19%. Après administration orale, seulement 9% de la radioactivité ont été détectés dans les urines et la quantité principale (84%) a été retrouvée dans les selles. Plus de 90% de la dose ont été éliminés dans les 6 jours après administration intraveineuse et dans les 5 jours après administration orale. Après inhalation, l'élimination de l'olodatérol sous forme inchangée dans les urines dans l'intervalle d'administration chez les sujets sains à l'état d'équilibre a été de 5‑7% de la dose.
Cinétique pour certains groupes de patients
Tiotropium: Comme attendu avec tous les médicaments éliminés principalement par voie rénale, un âge avancé a été associé à une diminution de la clairance rénale du tiotropium (de 347 ml/min chez les patients avec BPCO <65 ans jusqu'à 275 ml/min chez les patients avec BPCO ≥65 ans). Ce phénomène n'a pas conduit à une augmentation correspondante de l'ASC0‑6,ss ou de la Cmax,ss.
Olodatérol: Une méta-analyse pharmacocinétique des données issues de 2 études cliniques contrôlées menées auprès de 405 patients avec BPCO et 296 patients avec asthme a montré qu'un ajustement de la dose en fonction des effets de l'âge, du sexe et du poids corporel sur l'exposition systémique à l'olodatérol n'est pas nécessaire.
Une comparaison des données pharmacocinétiques intra-études et inter-études sur l'olodatérol a montré une tendance à une exposition systémique plus élevée chez les Japonais et les autres populations asiatiques que chez les Caucasiens.
Au cours d'études cliniques sur l'olodatérol d'une durée allant jusqu'à un an, au cours desquelles des Caucasiens et des Asiatiques ont reçu des doses d'olodatérol allant jusqu'à deux fois la dose thérapeutique recommandée, des problèmes relatifs à la sécurité n'ont pas été constatés.
Troubles de la fonction hépatique
Tiotropium: Chez les patients présentant des troubles de la fonction hépatique, aucune influence sur la pharmacocinétique du tiotropium n'est à craindre. Le tiotropium est principalement éliminé par voie rénale (74% chez les sujets jeunes et sains) et dégradé en produits pharmacologiquement inactifs via un clivage simple et non enzymatique de l'ester.
Olodatérol: Chez les patients présentant des troubles de la fonction hépatique légers à modérés, l'exposition systémique à l'olodatérol n'a pas été modifiée. Les effets des troubles de la fonction hépatique sévères sur l'exposition systémique à l'olodatérol n'ont pas été étudiés.
Interactions avec l'olodatérol:
Des études sur les interactions ont été menées avec le fluconazole comme exemple d'un inhibiteur de CYP2C9 et le kétoconazole en tant qu'inhibiteur puissant de la Pgp et des CYP.
Fluconazole: Lors de l'administration concomitante de 400 mg de fluconazole une fois par jour pendant 14 jours, aucun effet pertinent sur l'exposition systémique à l'olodatérol n'a été constaté.
Kétoconazole: Lors de l'administration concomitante de 400 mg de kétoconazole une fois par jour pendant 14 jours, la Cmax de l'olodatérol a été augmentée de 66% et l'ASC0‑1 de 68%.
Troubles de la fonction rénale
Tiotropium: Chez les patients avec BPCO et présentant des troubles de la fonction rénale légers (ClCr 50 ‑ 80 ml/min), l'inhalation unique de tiotropium jusqu'à l'état d'équilibre a conduit à une légère augmentation de l'ASC0,ss (augmentation entre 1,8% et 30%) par rapport aux patients avec une fonction rénale normale (ClCr >80 ml/min). Un phénomène similaire a été observé pour la Cmax,ss. Chez les patients présentant des troubles de la fonction rénale modérés à sévères (ClCr <50 ml/min), l'exposition globale après administration intraveineuse de tiotropium a été deux fois plus élevée que celle notée chez les patients avec une fonction rénale normale (augmentation de l'ASC0-4h de 82% et de la Cmax de 52%). Ce phénomène a été confirmé par des mesures après inhalation de la poudre sèche.
Olodatérol: Chez les patients présentant des troubles de la fonction rénale sévères (ClCr <30 ml/min), l'exposition systémique à l'olodatérol a été augmentée en moyenne de 1,4 fois. Au vu des données de sécurité concernant le traitement par olodatérol issues des études cliniques d'une durée allant jusqu'à un an avec des doses allant jusqu'à deux fois la dose thérapeutique recommandée, ce degré d'augmentation de l'exposition ne pose pas de problème de sécurité.
Données précliniques
Toxicité en cas d'administration unique
Au cours des études menées sur l'association tiotropium + olodatérol chez la souris et le rat examinant la toxicité après inhalation unique des principes actifs en trois proportions différentes, une faible toxicité aiguë a été constatée. Chez la souris, la dose létale approximative (ALD) a été de 34,8 + 36,6 mg/kg pour le tiotropium+olodatérol dans une proportion de 1:1. Chez le rat, aucune mortalité n'a été enregistrée, c'est pourquoi l'ALD a été de >17,9+18,8 mg/kg pour le tiotropium/olodatérol dans une proportion de 1:1.
Toxicité à long terme (ou toxicité en cas d'administration répétée)
Des études ont été menées chez le rat (jusqu'à 4 semaines) et le chien (jusqu'à 13 semaines) pour étudier la toxicité de l'inhalation répétée de l'association tiotropium + olodatérol dans des proportions variées. Au cours des études de 13 semaines chez le chien, l'évolution du poids corporel, les signes cliniques, les modifications cardiovasculaires et les activités enzymatiques correspondantes ainsi que les observations pathologiques au niveau macroscopique et microscopique ont été caractéristiques des effets bêta2-agonistes et anticholinergiques. Au cours des études de toxicité de 13 semaines dans une proportion de 1:1 pour le tiotropium/olodatérol, la NOAEL a été de 14+16 μg/kg/jour.
Génotoxicité
Les études sur la mutagénicité in vitro des principes actifs individuels (tiotropium et olodatérol) n'ont pas mis en évidence de potentiel génotoxique. Au cours d'un test in vivo de micronoyau sur moelle osseuse de rat, l'association tiotropium + olodatérol n'a pas entraîné d'effet génotoxique après inhalation de doses allant jusqu'à 2266 + 2174 μg/kg/jour pendant 4 semaines (rapport de doses 1:1).
Carcinogénicité
Aucune étude sur la carcinogénicité de l'association n'a été menée.
Tiotropium: Il n'a montré aucun potentiel carcinogène au cours des études correspondantes chez le rat et la souris.
Olodatérol: Le traitement à vie chez le rat a induit des léiomyomes mésovariens, spécifiques de la classe et des rongeurs, à des expositions correspondant environ à 2235 ou 715 fois l'exposition à la dose de 5 μg (exposition systémique). Le traitement à vie chez la souris a induit des tumeurs dans la musculature utérine lisse (léiomyomes, léiomyosarcomes) ainsi que des hyperplasies focales du stroma et des cordons sexuels et des hyperplasies lutéales focales dans les ovaires, à des expositions correspondant environ à 477 à 3596 fois l'exposition à une dose de 5 μg (exposition systémique). Ces phénomènes sont également considérés comme des effets de classe chez les rongeurs après administrations répétées. Les deux études ne laissent pas craindre de risque particulier au niveau de la carcinogénicité et de la toxicité chronique chez l'être humain suite à l'exposition à l'olodatérol.
Au cours du test in vivo des micronoyaux sur moelle osseuse de rat après inhalation (jusqu'à env. 1092 fois la dose de 5 μg selon l'ASC(0-24h)) et du test in vitro de mutagénicité (test de Ames, test sur les cellules de lymphome murin), aucun effet génotoxique n'a été noté pour l'olodatérol, même à très hautes doses. Chez le rat, après l'administration intraveineuse de doses correspondant au moins à 5 500 fois la dose de 5 μg (selon l'ASC(0-24h)), une augmentation des micronoyaux a été constatée, effet éventuellement dû à une érythropoïèse médicamenteuse (compensatoire).
Remarques particulières
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Stabilité après ouverture
L'inhalateur Spiolto Respimat doit être jeté au plus tard trois mois après la première utilisation.
Remarques particulières concernant le stockage
Ne pas conserver à une température au-dessus de 30 °C.
Ne pas congeler.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Voir les instructions d'utilisation de l'inhalateur Respimat réutilisable jointes à l'emballage.
Numéro d’autorisation
67352 (Swissmedic).
Titulaire de l’autorisation
Boehringer Ingelheim (Schweiz) GmbH, Bâle.
Mise à jour de l’information
Mai 2020.
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.



 Deutsch
Deutsch French
French Italian
Italian







