Fluimucil 10% solution for injection 300 mg / 3 ml 5 x 3 ml
Fluimucil 10% Inj Lös 300 mg/3ml 5 Amp 3 ml
-
28.75 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: ZAMBON SCHWEIZ AG
- Product Code: 7331906
- ATC-code R05CB01
- EAN 7680668600106
Ingredients:
Acetylcystein 300 mg , Natrium 43 mg, Dinatrium edetat, Natronlauge zur pH-Wert-Einstellung.

Description
Was ist Fluimucil 10% und wann wird es angewendet?
Fluimucil 10% enthält den Wirkstoff Acetylcystein. Dieser Wirkstoff verflüssigt und löst den zähen festsitzenden Schleim in den Luftwegen und fördert den Auswurf.
Das auf der Schleimhaut der Atemwege vorhandene Sekret spielt eine wichtige Rolle bei der Abwehr von eingeatmeten Schadstoffen, wie Bakterien, Staub und chemischen Verunreinigungen. Diese Reizstoffe werden im Sekret festgehalten, wo sie unschädlich gemacht und mit dem Auswurf ausgeschieden werden.
Bei durch Bakterien und Viren verursachten Infektionen (Erkältungen, Grippe, Bronchitis) und bei chronischen, durch Schadstoffe hervorgerufenen Reizungen nimmt die Schleimproduktion zu. Durch die Verdickung des Schleims können die Atemwege blockiert werden, was Atembeschwerden und Auswurfschwierigkeiten zur Folge hat.
Durch die schleimlösende Wirkung von Fluimucil 10% verflüssigt sich der zähe Schleim und kann besser abgehustet werden. Dadurch wird die Gefahr einer Infektion vermindert. Bei freien Atemwegen lässt der Husten nach und die Atmung wird erleichtert.
Fluimucil 10% eignet sich zur Behandlung aller Atemwegserkrankungen, die zu zäher Schleimproduktion führen, wie z.B. Erkältungen oder Grippeerkrankungen mit Husten und Katarrh sowie bei akuter und chronischer Bronchitis, Nasennebenhöhlenentzündungen, Hals- und Rachenentzündungen, Bronchialasthma und (als Zusatzbehandlung) bei Mukoviszidose (zystische Fibrose).
Fluimucil 10% ist zur inhalativen, lokalen (durch Instillationen, das heisst als Tropfen) oder intravenösen Anwendung bestimmt. Die Injektion oder Instillation von Fluimucil 10% wird von einer medizinischen Fachperson durchgeführt.
Auf Verschreibung des Arztes bzw. der Ärztin zu verwenden.
Was sollte dazu beachtet werden?
Die Wirkung von Fluimucil 10% wird durch reichliches Trinken verbessert.
Rauchen trägt zur übermässigen Bildung von Bronchialschleim bei. Durch Verzicht auf das Rauchen können Sie die Wirkung von Fluimucil 10% unterstützen.
Wann darf Fluimucil 10% nicht angewendet werden?
Fluimucil 10% darf bei bekannter Überempfindlichkeit gegenüber dem Wirkstoff Acetylcystein nicht angewendet werden.
Fluimucil 10% sollte auch nicht zusammen mit hustenstillenden Mitteln (Antitussiva) verwendet werden, da durch diese Mittel der Husten und die natürliche Selbstreinigung der Atemwege unterdrückt werden, wodurch das Abhusten des verflüssigten Schleims beeinträchtigt wird und es zu einem Stau des Bronchialschleims mit Gefahr von Bronchialkrämpfen und Infektionen der Atemwege kommen kann.
Fluimucil 10% darf nicht bei Kleinkindern unter 2 Jahren angewendet werden.
Wann ist bei der Anwendung von Fluimucil 10% Vorsicht geboten?
Falls Sie Asthmapatient sind und sich in Aerosoltherapie mit Fluimucil 10% befinden, ist es ratsam, das Arzneimittel gleichzeitig mit Bronchodilatatoren zu nehmen. Ihr Arzt bzw. Ihre Ärztin wird Sie darüber unterrichten.
Falls Sie bei einer früheren Einnahme eines Arzneimittels mit dem gleichen Wirkstoff, wie ihn Fluimucil 10% enthält, Ausschläge oder Atembeschwerden beobachtet haben, sollten Sie unbedingt Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin darüber informieren, bevor Sie mit der Anwendung des Präparates beginnen.
Die gleichzeitige Verwendung gewisser anderer Arzneimittel kann zu einer gegenseitigen Beeinflussung der Wirkung führen. So kann die Wirksamkeit gewisser Mittel gegen Durchblutungsstörungen der Herzkranzgefässe (z.B. Nitroglycerin bei Angina pectoris) verstärkt werden. Wenn Ihr Arzt eine gemeinsame Behandlung mit intravenös verabreichtem Nitroglycerin und Fluimucil für notwendig erachtet, wird er Sie auf eine möglicherweise auftretende Blutdrucksenkung (Hypotonie) hin überwachen, die schwerwiegend sein kann und sich durch möglicherweise auftretende Kopfschmerzen andeuten kann. Die gleichzeitige Verabreichung von hustenstillenden Mitteln (Antitussiva) kann die Wirkung von Fluimucil 10% beeinträchtigen (siehe oben: «Wann darf Fluimucil 10% nicht angewendet werden?»). Des Weiteren sollten Sie Antibiotika nicht gleichzeitig mit der Anwendung von Fluimucil 10% einnehmen, sondern in einem zeitlichen Abstand von mindestens 2 Stunden.
Hilfsstoffe von besonderem Interesse
Fluimucil 10% enthält 43 mg Natrium (Hauptbestandteil von Kochsalz/Speisesalz) pro 3 ml-Ampulle. Dies entspricht 2.15% der für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbstgekaufte!) einnehmen oder äusserlich anwenden!
Darf Fluimucil 10% während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Auf Grund der bisherigen Erfahrungen ist bei bestimmungsgemässer Anwendung kein Risiko für das Kind bekannt. Systematische wissenschaftliche Untersuchungen wurden aber nie durchgeführt. Vorsichtshalber sollten Sie während der Schwangerschaft und Stillzeit möglichst auf Arzneimittel verzichten oder den Arzt oder den Apotheker bzw. die Ärztin oder die Apothekerin um Rat fragen.
Wie verwenden Sie Fluimucil 10%?
Fluimucil 10% verwenden Sie zur Inhalation.
Falls vom Arzt bzw. von der Ärztin nicht anders verordnet:
Erwachsene: inhalieren 1 Ampulle 1–2-mal täglich.
Kinder im Alter, in dem eine aktive Mitarbeit gewährleistet ist: inhalieren ½ Ampulle 1–2-mal täglich.
Bei der Aerosolanwendung ist die Inhalation mittels eines Inhalationsgeräts zu verabreichen. Eine Verdünnung der Ampulle ist nicht notwendig, aber dennoch möglich (z.B. 1 Ampulle Fluimucil 10% (3 ml) + 7 ml 0,9%ige NaCl-Lösung, um ein Endvolumen von 10 ml zu erhalten).
Inhalationsgeräte mit Glas- oder Kunststoffteilen sind vorzuziehen. Falls Geräte mit Metall- oder Gummiteilen verwendet werden, müssen diese nach Gebrauch sofort mit Wasser ausgespült werden.
Anweisung zum Öffnen der Ampulle:
- Ampulle in der korrekten Position halten (d.h. mit dem markierten Punkt nach oben). (Abbildung 1)
- Mit dem Daumen oberhalb des Punkts Druck ausüben und Ampullenkopf abbrechen (Abbildung 2)
Der Arzt bzw. die Ärztin kann Ihnen Fluimucil 10% auch spritzen oder als Tropfen verabreichen (Instillation).
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Fluimucil 10% haben?
Folgende Nebenwirkungen können bei der Anwendung von Fluimucil 10% auftreten: bei empfindlichen Patienten (z.B. Asthmatiker oder ältere Patienten) können durch das Inhalieren in seltenen Fällen Atembeschwerden mit Engegefühl hervorgerufen werden. Durch den gleichzeitigen Einsatz eines Bronchodilatators (Arzneimittel zur Erweiterung der Bronchien) kann diese Gefahr vermindert werden. Selten verursacht die Inhalationstherapie eine Entzündung der Mundschleimhaut (Stomatitis), Übelkeit, Erbrechen, Schläfrigkeit, starker Nasenfluss und Fieber.
Bei empfindlichen Patienten können ebenfalls allergische Erscheinungen allgemeiner Natur (wie z.B. Hautausschläge oder Juckreiz) auftreten. Sollten die Überempfindlichkeitsreaktionen auch Atembeschwerden und Bronchialkrämpfe auslösen, was in seltenen Fällen geschehen kann, so müssen Sie die Behandlung mit Fluimucil 10% sofort abbrechen und einen Arzt bzw. eine Ärztin aufsuchen.
Der Atem kann vorübergehend einen unangenehmen Geruch bekommen.
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Aufbrauchfrist nach Anbruch
Nach Anbruch der Ampulle ist die nicht verwendete Lösung wegzuwerfen.
Lagerungshinweis
Bei Raumtemperatur (15–25 °C), in der Originalverpackung, um den Inhalt vor Licht zu schützen, und für Kinder unzugänglich aufbewahren.
Weitere Hinweise
Der leichte Schwefelgeruch, der beim Öffnen der Ampulle entsteht, verflüchtigt sich schnell und hat keinen Einfluss auf die Wirksamkeit des Arzneimittels.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker, bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Fluimucil 10% enthalten?
Wirkstoffe:
1 Ampulle enthält 300 mg Acetylcystein.
Hilfsstoffe: Dinatriumedetat, Natriumhydroxid und Wasser für Injektionszwecke für 3 ml-Lösung (10%-ige Lösung).
Zulassungsnummer
66860 (Swissmedic).
Wo erhalten Sie Fluimucil 10%? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Eine Packung Fluimucil 10% enthält 5 Ampullen.
Zulassungsinhaberin
Zambon Schweiz AG, 6814 Cadempino.
Diese Packungsbeilage wurde im November 2019 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu’est-ce que le Fluimucil 10% et quand doit-il être utilisé?
Fluimucil 10% contient le principe actif acétylcystéine. Ce principe actif fluidifie et dissout les sécrétions denses retenues dans les voies respiratoires et favorise l'expectoration.
Le mucus qui recouvre la muqueuse de l'appareil respiratoire joue un rôle important dans la défense contre les substances agressives contenues dans l'air, telles que les bactéries, la poussière et les impuretés chimiques. Ces substances irritantes se collent sur le mucus où elles sont inactivées, puis éliminées avec l'expectoration.
Lors d'infections bactériennes ou virales (refroidissements, grippe, bronchite) et lors d'irritations chroniques causées par des substances nuisibles, la production de mucus est augmentée. Si le mucus devient très dense et visqueux, les voies respiratoires peuvent être encombrées. Il en résulte des troubles respiratoires et des difficultés d'expectoration.
Grâce à l'effet mucolytique de Fluimucil 10%, les sécrétions denses se fluidifient et peuvent être mieux expectorées. Ainsi le risque d'une infection diminue. Une fois les voies respiratoires libérées, la toux se calme et la respiration est ainsi facilitée.
Fluimucil 10% est indiqué pour le traitement de toutes les maladies respiratoires qui entraînent une production de sécrétions denses, comme p.ex. toutes formes de refroidissements ou grippe, associées à toux et catarrhe, ainsi que bronchite aiguë et chronique, lors de sinusite, laryngite, pharyngite, asthme bronchique et (comme traitement supplémentaire) lors de mucoviscidose (fibrose kystique).
Fluimucil 10% est indiqué pour l'application par inhalation, locale (par instillation, c'est-à-dire en gouttes) ou intraveineuse. L'injection ou l'instillation de Fluimucil 10% doit être effectuée par un professionnel de la santé.
À utiliser sur prescription médicale.
De quoi faut-il tenir compte en dehors du traitement?
Boire beaucoup peut améliorer l'effet de Fluimucil 10%.
La fumée contribue à la formation excessive de mucus bronchique. En renonçant à la fumée, vous pouvez renforcer l'effet de Fluimucil 10%.
Quand Fluimucil 10% ne doit-il pas être utilisé?
Fluimucil 10% ne doit pas être utilisé en cas d'hypersensibilité connue au principe actif acétylcystéine.
Vous ne devriez pas prendre Fluimucil 10% avec des antitussifs, étant donné qu'ils suppriment le stimulus de la toux et le mécanisme naturel de l'auto-nettoyage des voies respiratoires, inhibant ainsi l'expectoration du mucus fluidifié. Il peut s'ensuivre un encombrement du mucus bronchique avec danger de spasmes bronchiques et infections des voies respiratoires.
Fluimucil 10% ne doit pas être utilisé chez les petits enfants de moins de 2 ans.
Quelles sont les précautions à observer lors de l’utilisation de Fluimucil 10%?
Si vous êtes asthmatique et vous suivez une thérapie par inhalation avec Fluimucil 10%, il est conseillé de prendre le médicament en même temps que les bronchodilatateurs. Votre médecin vous en informera.
Si vous avez observé des éruptions cutanées ou des troubles respiratoires lors d'une prise précédente d'un médicament contenant le même principe actif que celui contenu dans Fluimucil 10%, vous devriez absolument en informer votre médecin ou pharmacien avant de commencer l'utilisation du médicament.
L'administration simultanée de certains autres médicaments peut influencer réciproquement l'effet. L'efficacité de certains médicaments pour le traitement de l'insuffisance coronarienne (p.ex. la nitroglycérine lors d'angine de poitrine) peut ainsi être renforcée. Si votre médecin devait juger nécessaire un co-traitement avec la nitroglycérine administrée par voie intraveineuse et Fluimucil, il devra vous surveiller en raison d'une possible réduction de la pression artérielle (hypotension), qui peut être grave et se manifester par des maux de tête. L'administration simultanée d'antitussifs peut influencer l'effet de Fluimucil 10% (voir ci-dessus: «Quand Fluimucil 10% ne doit-il pas être utilisé?»). En outre, les antibiotiques ne devraient pas être pris en même temps que Fluimucil 10%, mais après un intervalle d'au moins 2 heures.
Excipients revêtant un intérêt particulier
Fluimucil 10% contient 43 mg de sodium (composant principal du sel de cuisine/table) par ampoule de 3 ml. Cela équivaut à 2,15% de l'apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
Veuillez informer votre médecin ou votre pharmacien, si
- vous souffrez d'une autre maladie,
- vous êtes allergique ou
- vous prenez déjà d'autres médicaments en usage interne ou externe (même en automédication!).
Fluimucil 10% peut-il être utilisé pendant la grossesse ou l’allaitement?
Sur la base des expériences faites à ce jour, aucun risque pour l'enfant n'est connu si le médicament est utilisé conformément à l'usage auquel il est destiné. Toutefois, aucune étude scientifique systématique n'a été effectuée. Par mesure de précaution, vous devriez renoncer si possible, à prendre des médicaments durant la grossesse et l'allaitement, ou demander l'avis du médecin ou du pharmacien.
Comment utiliser Fluimucil 10%?
Utilisez Fluimucil 10% pour les inhalations.
Sauf prescription différente de votre médecin:
Adultes: inhaler 1 ampoule 1–2 fois par jour.
Enfants dès l'âge où une collaboration active peut être requise: inhaler ½ ampoule 1–2 fois par jour.
Lors d'usage en aérosol, l'administration doit être effectuée au moyen d'un appareil pour inhalations. Une dilution de l'ampoule n'est pas nécessaire, mais toutefois possible (par ex. 1 ampoule de Fluimucil 10% (3 ml) + 7 ml de solution NaCl à 0,9% pour obtenir un volume final de 10 ml).
Il est conseillé d'utiliser des appareils pour inhalations en verre ou en plastique; si vous utilisez des appareils avec des pièces en métal ou en gomme, il faut les laver avec de l'eau immédiatement après l'usage.
Instructions pour l'ouverture de l'ampoule:
- Tenir l'ampoule en position correcte (c.-à-d. avec le point marqué vers le haut) (figure 1).
- Exercer une pression avec le pouce positionné au-dessus du point et détacher la partie supérieure de l'ampoule (figure 2).
Le médecin peut aussi vous administrer Fluimucil 10% par injection ou comme gouttes (instillation).
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou, au contraire, trop forte.
Quels effets secondaires Fluimucil 10% peut-il provoquer?
L'utilisation de Fluimucil 10% peut provoquer les effets secondaires suivants: chez les patients particulièrement sensibles (par ex. asthmatiques ou personnes âgées), des difficultés respiratoires avec sensation de restriction peuvent rarement être provoquées en faisant les inhalations. Ce risque peut être réduit si l'on administre en même temps qu'un bronchodilatateur (médicament pour l'expansion des bronches). La thérapie par inhalation cause rarement une inflammation des muqueuses buccales (stomatites), des nausées, des vomissements, de la somnolence, des écoulements nasaux sévères et de la fièvre.
Chez des patients sensibles, des réactions d'hypersensibilité de nature générale peuvent apparaître (p.ex. éruptions cutanées ou prurit). Si les réactions d'hypersensibilité provoquent également des troubles respiratoires ou des spasmes bronchiques, ce qui peut arriver dans de rares cas, vous devez tout de suite interrompre le traitement avec Fluimucil 10% et consulter un médecin.
L'haleine peut avoir provisoirement une odeur désagréable.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
À quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Délai d'utilisation après ouverture
Une fois les ampoules ouvertes, la solution non utilisée doit être jetée.
Remarques concernant le stockage
Conserver à température ambiante (15-25 °C), dans son carton pour le protéger de la lumière et hors de portée des enfants.
Remarques complémentaires
À l'ouverture de l'ampoule, une légère odeur de soufre due au principe actif se dégage et s'en va rapidement. Elle n'a pas d'influence sur l'efficacité du médicament.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien qui disposent d'une information détaillée destinée aux professionnels.
Que contient Fluimucil 10%?
Principes actifs:
1 ampoule contient 300 mg d'acétylcystéine.
Excipients: édétate disodique, hydroxyde de sodium et eau pour préparations injectables pour 3 ml de solution (solution à 10%).
Numéro d’autorisation
66860 (Swissmedic).
Où obtenez-vous Fluimucil 10%? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Un emballage de Fluimucil 10% contient 5 ampoules.
Titulaire de l’autorisation
Zambon Suisse SA, 6814 Cadempino.
Cette notice d'emballage a été vérifiée pour la dernière fois en novembre 2019 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos’è Fluimucil 10% e quando si usa?
Fluimucil 10% contiene il principio attivo acetilcisteina. Questo principio attivo fluidifica e scioglie le dense secrezioni che ristagnano nelle vie respiratorie e ne favorisce l'espettorazione.
Il muco che ricopre la mucosa delle vie respiratorie svolge un importante ruolo nella protezione dell'organismo da sostanze nocive presenti nell'aria come batteri, polvere e impurità chimiche. Queste sostanze irritanti vengono catturate dal muco che le rende inoffensive e poi eliminate con l'espettorato.
In caso di infezioni batteriche o virali (raffreddore, influenza, bronchite) e di irritazioni croniche indotte da sostanze nocive, la produzione di muco aumenta. Se il muco diventa molto denso e viscoso, può portare ad un'ostruzione delle vie respiratorie con conseguente difficoltà di respirazione e di espettorazione.
Grazie all'effetto mucolitico, Fluimucil 10% fluidifica le secrezioni dense che possono quindi essere eliminate meglio con l'espettorato. In questo modo il rischio di un'infezione diminuisce. Liberando le vie respiratorie, la tosse si calma e la respirazione diventa più facile.
Fluimucil 10% è indicato per il trattamento di tutte le malattie delle vie respiratorie che provocano una produzione di secrezioni dense, quali ad es. raffreddore o influenza, associati a tosse e catarro, come pure bronchite acuta e cronica, sinusite, laringite, faringite, asma bronchiale e (come terapia complementare) nella mucoviscidosi (fibrosi cistica).
Fluimucil 10% è indicato per un'applicazione per inalazione, locale (mediante instillazione, cioè in gocce) o endovenosa. L'iniezione o l'instillazione di Fluimucil 10% deve essere eseguita da un professionista della salute.
Da utilizzare su prescrizione medica.
Di che cosa occorre inoltre tener conto durante il trattamento?
Bere molto può migliorare l'effetto di Fluimucil 10%.
Il fumo contribuisce all'eccessiva formazione di muco bronchiale. Rinunciando al fumo può rafforzare l'effetto di Fluimucil 10%.
Quando non si può usare Fluimucil 10%?
Fluimucil 10% non deve essere utilizzato in caso di ipersensibilità conosciuta al principio attivo acetilcisteina.
Fluimucil 10% non dovrebbe inoltre essere utilizzato assieme ad antitussivi in quanto questi sopprimono lo stimolo della tosse e il naturale meccanismo di autopulizia delle vie respiratorie, impedendo quindi l'espettorazione del muco fluidificato. Ne può conseguire un ristagno di muco nei bronchi con il rischio di causare crampi bronchiali e infezioni delle vie respiratorie.
Fluimucil 10% non deve essere usato nei bambini piccoli sotto i 2 anni.
Quando è richiesta prudenza nell’uso di Fluimucil 10%?
Se soffre d'asma e segue una terapia inalatoria con Fluimucil 10%, è consigliato utilizzare il medicamento contemporaneamente ai broncodilatatori. Il suo medico le darà ulteriori informazioni.
Se in passato ha avuto eruzioni cutanee o disturbi respiratori dopo l'assunzione di un medicamento contenente lo stesso principio attivo di Fluimucil 10%, dovrebbe assolutamente informare il suo medico o farmacista prima di iniziare l'uso del medicamento.
L'utilizzo simultaneo di altri medicamenti può influenzarne reciprocamente l'effetto. Infatti, l'efficacia di alcuni medicamenti per il trattamento dell'insufficienza coronarica (ad es. la nitroglicerina nell'angina pectoris) può essere aumentata. Se il suo medico dovesse giudicare necessario un trattamento concomitante con la nitroglicerina somministrata per via endovenosa e Fluimucil, dovrà tenerla sotto controllo per una possibile riduzione della pressione arteriosa (ipotensione) che può essere grave e manifestarsi con mal di testa. La somministrazione simultanea di antitussivi può pregiudicare l'effetto di Fluimucil 10% (vedi sopra: «Quando non si può usare Fluimucil 10%?»). Inoltre, gli antibiotici non dovrebbero essere presi contemporaneamente a Fluimucil 10% ma soltanto dopo un intervallo di almeno due ore.
Sostanze ausiliarie di particolare interesse
Fluimucil 10% contiene 43 mg di sodio (componente principale del sale da cucina) per fiala da 3 ml. Questo equivale a 2,15% dell'assunzione massima giornaliera raccomandata con la dieta di un adulto.
Informi il suo medico o il suo farmacista, nel caso in cui
- soffre di altre malattie,
- soffre di allergie o
- assume o applica esternamente altri medicamenti (anche se acquistati di sua iniziativa!).
Si può usare Fluimucil 10% durante la gravidanza o l’allattamento?
In base alle esperienze fatte finora, non sono noti rischi per il bambino se il medicamento è usato correttamente. Tuttavia, non sono state compiute indagini scientifiche sistematiche. Per precauzione dovrebbe rinunciare, nella misura del possibile, ad assumere medicamenti durante la gravidanza e il periodo d'allattamento o chiedere consiglio al suo medico o al suo farmacista.
Come usare Fluimucil 10%?
Utilizzare Fluimucil 10% per le inalazioni.
Salvo diversa prescrizione medica:
Adulti: inalare 1 fiala, 1–2 volte al giorno.
Bambini a partire dall'età in cui può essere ottenuta una collaborazione attiva: inalare ½ fiala, 1–2 volte al giorno.
Nell'uso mediante aerosol, l'inalazione deve essere fatta tramite un apparecchio per inalazioni. Una diluizione della fiala non è necessaria, ma ugualmente possibile (ad es. 1 fiala di Fluimucil 10% (3 ml) + 7 ml di soluzione NaCl allo 0,9% per ottenere un volume finale di 10 ml).
Si consiglia di utilizzare apparecchi per inalazioni in vetro o plastica; se si usano apparecchi con pezzi di metallo o gomma, bisogna lavarli con acqua immediatamente dopo l'uso.
Istruzioni per l'apertura della fiala:
- Tenere la fiala in posizione corretta (cioè, con il punto contrassegnato verso l'alto) (figura 1).
- Esercitare una pressione con il pollice posizionato sopra il punto e staccare la parte superiore della fiala (figura 2).
Il medico può anche somministrarle Fluimucil 10% tramite iniezione o in gocce (instillazione).
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere Fluimucil 10%?
Con l'applicazione di Fluimucil 10% possono manifestarsi i seguenti effetti collaterali: nei pazienti particolarmente sensibili (ad es. asmatici o pazienti anziani) le inalazioni possono raramente dar luogo a delle difficoltà respiratorie con sensazione di soffocamento. Si può ridurre tale rischio associando Fluimucil 10% a dei broncodilatatori (medicamenti per l'espansione dei bronchi). Raramente la terapia inalatoria può causare un'infiammazione della mucosa della bocca (stomatite), nausea, vomito, sonnolenza, forte flusso nasale e febbre.
Nei pazienti sensibili possono manifestarsi reazioni allergiche di natura generale (ad es. eruzioni cutanee o prurito). Qualora le reazioni d'ipersensibilità dovessero provocare anche disturbi respiratori e crampi bronchiali, cosa che può succedere in casi molto rari, dovrebbe interrompere immediatamente il trattamento con Fluimucil 10% e consultare subito un medico.
L'alito può temporaneamente avere un odore sgradevole.
Se osserva effetti collaterali, si rivolga al suo medico o farmacista, soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Termine di utilizzo dopo l'apertura
Dopo l'apertura della fiala, la soluzione non utilizzata va gettata.
Indicazione di stoccaggio
Conservare a temperatura ambiente (15–25 °C), nella scatola originale per proteggere il contenuto dalla luce e fuori della portata dei bambini.
Ulteriori indicazioni
Il leggero odore di zolfo che si sente all'apertura della fiala si volatilizza velocemente e non ha alcun influsso sull'efficacia del medicamento.
Il medico o il farmacista, che sono in possesso di un informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Fluimucil 10%?
Principi attivi:
1 fiala contiene 300 mg di acetilcisteina.
Sostanze ausiliarie: sodio edetato, sodio idrossido, acqua per preparazioni iniettabili per una soluzione di 3 ml (soluzione al 10%).
Numero dell’omologazione
66860 (Swissmedic).
Dove è ottenibile Fluimucil 10%? Quali confezioni sono disponibili?
In farmacia dietro presentazione della prescrizione medica.
Una confezione contiene 5 fiale di Fluimucil 10%.
Titolare dell’omologazione
Zambon Svizzera SA, 6814 Cadempino.
Questo foglietto illustrativo è stato controllato l'ultima volta nel novembre 2019 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoff: Acetylcysteinum.
Hilfsstoffe: Dinatrii edetas, Natrii hydroxidum, Aqua ad iniectabilia.
Fluimucil 10% enthält 43 mg Natrium (1,9 mmol) pro 3 ml-Ampulle.
Darreichungsform und Wirkstoffmenge pro Einheit
Injektionslösung zur i.v., lokalen Anwendung.
Ampulle: 300 mg Acetylcystein pro 3 ml (100 mg/ml).
Indikationen/Anwendungsmöglichkeiten
Zur lokalen inhalativen/instillativen oder systemischen intravenösen mukolytischen Therapie bei Atemwegserkrankungen, die zur Bildung von zähem Sekret führen, welches nicht oder nur ungenügend expektoriert werden kann.
- Pneumologie: alle Formen von Bronchitis, Emphysem, Atelektase, Bronchiektasie, Mukoviszidose.
- ORL-Krankheiten: Laryngitis, Sinusitis, Pharyngitis sowie bei laryngektomisierten Patienten.
- Chirurgie: Prophylaxe von bronchopulmonalen Komplikationen mit Mukostase.
- Pädiatrie: Bronchitis, Mukoviszidose.
Zur intravenösen Therapie als Antidot bei Paracetamol-Vergiftungen.
Dosierung/Anwendung
Als Mukolytikum
Inhalative Anwendung
Erwachsene:
1 Ampulle 1–2-mal täglich inhalieren.
Kinder in dem Alter, in dem eine aktive Mitarbeit gewährleistet ist: ½ Ampulle 1–2-mal täglich inhalieren.
Instillationen
Erwachsene:
Intraaurikulär und intranasal: 2–3 Tropfen 2–3-mal täglich;
Endotracheal: 10–20 Tropfen bis 1 Ampulle 1–2-mal täglich;
Spülungen anderer Körperhöhlen: ½ Ampulle pro Spülung.
Kinder:
Intraaurikulär und intranasal: 1–2 Tropfen 1–2-mal täglich;
Endotracheal: 10 Tropfen bis ½ Ampulle 1–2-mal täglich.
Intravenöse Anwendung
Als Mukolytikum in der Intensivtherapie
Erwachsene:
2–3 Ampullen 2–3-mal täglich.
Kinder 6-12 Jahre:
1–1½ Ampullen 2–3-mal täglich.
Es empfiehlt sich, die Ampullen mit einer 0,9%igen NaCl-Lösung oder mit einer 5%igen Glukose-Lösung zu verdünnen und die Lösung als langsame Kurzinfusion (über ca. 5 Min.) zu verabreichen.
Kinder 2-6 Jahre:
Bei Kindern unter 6 Jahren ist womöglich eine orale Behandlung mit geeigneten Darreichungsformen einer parenteralen Therapie vorzuziehen.
Falls die Indikation zur parenteralen Behandlung dennoch gestellt wird, beträgt die übliche Tagesdosis für Kinder unter 6 Jahren 10 mg Acetylcystein pro kg Körpergewicht.
Als Antidot bei Paracetamol-Vergiftungen
Intravenöse Anwendung
Bei Verdacht auf eine schwere Paracetamol-Vergiftung sollte eine unverzügliche vorsorgliche Behandlung und Abklärung des Schweregrades durch Bestimmung des Paracetamol-Serumspiegels erfolgen. Detaillierte Informationen zur Indikationsstellung, Abklärung und Durchführung der Therapie können bei Tox Info Suisse erfragt werden.
Dosierungsschema intravenös nach Prescott
Gesamtdosis: 300 mg/kg Acetylcystein, Gesamtdauer 21 h.
Folgendes Behandlungsschema wird empfohlen:
Patienten mit einem Körpergewicht ≥20 kg
Für diese spezielle Anwendung sind die 20%-igen Stechampullen (Fluimucil 20%) besser geeignet.
Patienten mit einem Körpergewicht von weniger als 20 kg
Initial Bolus 150 mg/kg in 3 ml/kg Lösung (über 60 Min.) gefolgt von 50 mg/kg in 7 ml/kg (über 4 h), gefolgt von 100 mg/kg in 14 ml/kg (über 16 h).
Je nach Körpergewicht sind die 20%-igen Stechampullen (Fluimucil 20%) besser geeignet.
Ein schnellerer initial Bolus über 15 Minuten kann auch verabreicht werden aber die langsame Bolusgabe (über 60 Min.) verringert die Wahrscheinlichkeit anaphylaktoider Reaktionen.
Kontraindikationen
Als Mukolytikum
Überempfindlichkeit gegenüber dem Wirkstoff Acetylcystein oder einem der Hilfsstoffe gemäss Zusammensetzung;
Kleinkinder unter 2 Jahren.
Als Antidot
Bei bedrohlicher Paracetamol-Vergiftung kann eine Antidot-Behandlung mit Acetylcystein auch bei anamnestischer Überempfindlichkeit oder Kleinkindern unter entsprechender(n) Überwachung/Begleitmassnahmen erfolgen.
Warnhinweise und Vorsichtsmassnahmen
Allgemeiner Hinweis
Der leichte Schwefelgeruch weist nicht auf eine Veränderung des Produkts hin, sondern gehört zur spezifischen Natur des Wirkstoffs.
Topische Verabreichung als Mukolytikum
Bei der Aerosoltherapie von Asthmapatienten ist es ratsam, Fluimucil 10% gleichzeitig mit Bronchodilatatoren zu verabreichen.
Die gleichzeitige Verabreichung eines Antitussivums kann über die Hemmung des Hustenreflexes und der physiologischen Selbstreinigung der Atemwege zu einem Sekretstau mit dem Risiko eines Bronchospasmus und einer Atemwegsinfektion führen.
Patienten mit Bronchialasthma müssen während der Therapie engmaschig überwacht werden. Sollte ein Bronchospasmus auftreten, muss Acetylcystein abgesetzt werden und es müssen adäquate therapeutische Massnahmen ergriffen werden.
Systemische Verabreichung als Mukolytikum
Die intravenöse Verabreichung von Acetylcystein muss unter strikter medizinischer Überwachung erfolgen. Unerwünschte Wirkungen einer Acetylcystein-Therapie treten mit einer grösseren Wahrscheinlichkeit auf, wenn die Verabreichung zu schnell oder in einem Übermass erfolgt. Es wird deshalb empfohlen, die Dosierungsanweisungen strikt zu beachten.
Es gibt Hinweise darauf, dass Patienten mit Atopie und Asthma in der Anamnese ein erhöhtes Risiko für die Entwicklung einer anaphylaktischen/anaphylaktoiden Reaktion haben.
Histamin-Intoleranz
Acetylcystein führt in vitro zu einer Hemmung der Diaminoxidase (DAO) um 20-50%. Daher ist bei Patienten mit Histamin-Intoleranz Vorsicht geboten.
Hinweis für natriumarme Diät (Hilfsstoffe von besonderem Interesse)
Fluimucil 10% enthält 43 mg Natrium (1,9 mmol) pro 3 ml-Ampulle, entsprechend 2,15% der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
Hautreaktionen
Sehr selten ist über das Auftreten von schweren Hautreaktionen wie Stevens-Johnson-Syndrom und Lyell-Syndrom in zeitlichem Zusammenhang mit der Anwendung von Acetylcystein berichtet worden.
Bei Neuauftreten von Haut- und Schleimhautveränderungen sollte daher unverzüglich ärztlicher Rat eingeholt und die Anwendung von Acetylcystein beendet werden.
Gastrointestinale Blutungen
Vorsicht ist bei Patienten mit einem Risiko für gastrointestinale Blutungen (wie z.B. aktives peptisches Ulkus in der Anamnese) geboten, insbesondere bei gleichzeitiger Verabreichung mit anderen Arzneimitteln, die eine irritierende Wirkung auf die Magenschleimhaut ausüben.
Als Antidot
Anaphylaktische/Anaphylaktoide Reaktionen
Anaphylaktische/Anaphylaktoide Reaktionen treten bei Acetylcystein auf, insbesondere bei der Anfangsdosis. Der Patient sollte während dieser Zeit sorgfältig auf Anzeichen einer anaphylaktoiden Reaktion überwacht werden. Asthma und Hypervolämie (Fluid Overload) sind Risikofaktoren für die Entwicklung dieser unerwünschten Wirkungen. Sehr selten wurde über Fälle mit tödlichem Ausgang für intravenöses Acetylcystein als Antidot bei Paracetamol-Vergiftungen in Zusammenhang mit anaphylaktischen/anaphylaktoiden Reaktionen berichtet.
Diese Reaktionen gegen Acetylcystein treten normalerweise 15 bis 60 Minuten nach Infusionsbeginn auf. In vielen Fällen werden bei anaphylaktoiden Reaktionen die Symptome durch vorübergehendes Stoppen der Infusion und durch Antihistaminika ausreichend gelindert. Bei höhergradigen Systemreaktionen können aber auch inhalative Bronchodilatoren, Adrenalin und Corticosteroide erforderlich werden.
Wenn eine Reaktion durch die Gabe von Antihistaminika unter Kontrolle gebracht wird, kann die Infusion unter sorgfältiger Überwachung mit einer Infusionsrate von 50 mg/kg über 4 Stunden versuchsweise wieder aufgenommen werden; bei guter Verträglichkeit gefolgt von der letzten 16-Stunden-Infusion (100 mg/kg über 16 Stunden).
Körperflüssigkeit und Elektrolyte
Bei Patienten mit einem Körpergewicht unter 40 kg sind wegen des möglichen Risikos einer Hypervolämie (Fluid Overload) mit folgender Hyponatriämie, Krampfanfällen und Tod, die (Antidot)gaben vorsichtig zu dosieren. Es wird deshalb empfohlen, die Dosierungsanweisungen strikt zu beachten.
Gerinnung
Die Verabreichung von Acetylcystein kann die Prothrombinzeit zusätzlich zur Paracetamoltoxizität verlängern.
Interaktionen
Es liegen keine in vivo Interaktionsstudien mit Arzneimittel vor.
Berichte über eine Inaktivierung von Antibiotika durch Acetylcystein betreffen bisher ausschliesslich in-vitro Versuche, bei denen die betreffenden Substanzen direkt gemischt wurden. Deshalb darf Fluimucil 10% nicht mit anderen Arzneimitteln gemeinsam in einer gleichen Lösung verabreicht werden (siehe «Sonstige Hinweise, Inkompatibilitäten»).
Da Thiolverbindungen mit Naphthochinonen Additionsverbindungen bilden können, besteht theoretisch auch die Möglichkeit, dass es mit Vitamin K zu einer Reaktion kommt. Obwohl nicht nachgewiesen ist, ob dies in vivo eintreten kann, sollte die Verabreichung von Vitamin K zur Behandlung einer Hypoprothrombinämie bei Leberversagen einige Stunden nach der Beendigung der Acetylcysteingabe begonnen werden.
Bei gleichzeitiger Verabreichung von Glyceroltrinitrat (Nitroglycerin) kann die vasodilatatorische und thrombozytenaggregationshemmende Wirkung verstärkt und eine Hypotonie verursacht werden.
Wenn eine gemeinsame Behandlung mit parenteralem Nitroglycerin und Acetylcystein als notwendig erachtet wird, sollte der Patient auf eine möglicherweise auftretende Hypotonie hin überwacht werden, die schwerwiegend sein kann und sich durch möglicherweise auftretende Kopfschmerzen andeuten kann.
Schwangerschaft/Stillzeit
Schwangerschaft
Daten bei einer begrenzten Anzahl von exponierten Schwangeren zeigten keine unerwünschten Wirkungen auf die Schwangerschaft oder die Gesundheit des Föten oder Neugeborenen.
Erfahrungen aus epidemiologischen Studien sind nicht vorhanden.
Tierexperimentelle Studien zeigten keine direkte oder indirekte Toxizität mit Auswirkung auf Schwangerschaft, Embryonalentwicklung, Entwicklung des Föten und/oder die postnatale Entwicklung.
Bei der Anwendung in der Schwangerschaft ist Vorsicht geboten.
Stillzeit
Es liegen keine Studien vor, welche aufzeigen, ob Acetylcystein in die Muttermilch übergeht oder nicht. Fluimucil 10% sollte während der Stillzeit nicht angewendet werden, es sei denn es ist klar notwendig.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Die Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen wurde nicht untersucht.
Unerwünschte Wirkungen
Die häufigsten in der Literatur beschriebenen unerwünschten Wirkungen von intravenös verabreichtem Acetylcystein sind Hautausschlag, Urtikaria und Pruritus und sie treten am häufigsten während der Verabreichung des initialen Bolus auf.
In einer randomisierten, offenen Multi-Zenter-Studie sind während der ersten 2 Stunden nach i.v. Applikation von Acetylcystein die folgenden unerwünschten Wirkungen aufgetreten:
Häufigkeiten: Sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10'000, <1/1000,), sehr selten (<1/10'000).
Erkrankungen des Immunsystems
Sehr häufig: Anaphylaktoide Reaktion (17%).
Herzerkrankungen
Häufig: Tachykardie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Pharyngitis, Rhinorrhoe, Rasselgeräusche, Bronchospasmus.
Erkrankungen des Gastrointestinaltrakts
Häufig: Erbrechen (11%), Übelkeit.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Pruritus, Hautausschlag.
Gefässerkrankungen
Häufig: Gesichtsrötung.
Die folgenden unerwünschten Wirkungen sind aus langjähriger Post-Marketing-Erfahrung bekannt geworden, die Häufigkeit kann aus den verfügbaren Daten nicht abgeschätzt werden.
Lokale Verabreichung
Erkrankungen des Immunsystems: Anaphylaktische/Anaphylaktoide Reaktionen.
Erkrankungen der Atemwege, des Brustraums und Mediastinums: Bronchospasmus, Rhinorrhoe.
Erkrankungen des Gastrointestinaltrakts: Stomatitis, Erbrechen, Übelkeit.
Erkrankungen der Haut und des Unterhautgewebes: Angioödem, Urtikaria, Ausschlag, Pruritus.
Systemische Verabreichung (bei hochdosierter i.v. Verabreichung)
Erkrankungen des Immunsystems: Anaphylaktischer Schock, anaphylaktische/anaphylaktoide Reaktion, Überempfindlichkeit.
Herzerkrankungen: Tachykardie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums: Bronchospasmus, Dyspnoe.
Erkrankungen des Gastrointestinaltrakts: Erbrechen, Übelkeit.
Erkrankungen der Haut und des Unterhautgewebes: Angioödem, Urtikaria, Gesichtsrötung, Ausschlag, Pruritus.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort: Gesichtsödem.
Untersuchungen: Blutdruck erniedrigt, Prothrombinzeit verlängert.
Sehr selten ist über das Auftreten von schweren Hautreaktionen wie Stevens-Johnson-Syndrom und Lyell-Syndrom in zeitlichem Zusammenhang mit der Anwendung von Acetylcystein berichtet worden. Bei Neuauftreten von Haut- und Schleimhautveränderungen sollte daher unverzüglich ärztlicher Rat eingeholt und die Anwendung von Acetylcystein beendet werden. In den meisten dieser berichteten Fälle war mindestens ein weiterer Arzneistoff beteiligt, durch den möglicherweise die beschriebenen mukokutanen Wirkungen verstärkt werden könnten.
Verschiedene Studien bestätigten eine Abnahme der Thrombozytenaggregation während der Anwendung von Acetylcystein. Die klinische Signifikanz dessen ist bisher unklar.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Intravenöse Verabreichung
Symptome einer Überdosierung bei intravenöser Verabreichung sind ähnlich den unerwünschten Wirkungen, aber ausgeprägter.
Bei einer Überdosierung ist die Infusion zu unterbrechen und eine symptomatische Behandlung einzuleiten.
Es gibt keine spezifische Antidot-Behandlung. Acetylcystein ist dialysierbar.
Lokale Verabreichung
Es wurden keine Fälle von Überdosierung bei lokaler Verabreichung berichtet.
Eigenschaften/Wirkungen
ATC-Code: R05CB01
Wirkungsmechanismus und Pharmakodynamik
Fluimucil 10% enthält den Wirkstoff Acetylcystein, ein Cysteinderivat mit einer freien SH-Gruppe, das sowohl mukolytische als auch antioxidative Eigenschaften besitzt.
Die mukolytische Wirkung von Acetylcystein beruht auf der Eigenschaft der SH-Gruppe, die Disulfidbrücken der Mukoproteine des Schleims zu reduzieren.
Die antioxidative Eigenschaft von Fluimucil 10% beruht darauf, dass elektrophile und oxidierende Verbindungen durch Acetylcystein direkt und über Glutathion indirekt inaktiviert werden. Elektrophile Verbindungen werden durch Konjugation inaktiviert, oxidierende Verbindungen durch Reduktion neutralisiert.
Acetylcystein stellt durch Cystein einen essentiellen Vorläufer der Glutathion-Synthese zur Verfügung und erhöht somit die endogenen Glutathion-Vorräte.
Glutathion ist ein wichtiges nukleophiles und antioxidatives Wirkprinzip des Organismus und ist deshalb für den Schutz desselben von hoher Bedeutung. Glutathion kann ausserdem die bei bestimmten Vergiftungen (z.B. Paracetamol-Intoxikation) entstehenden toxischen, reaktiven, elektrophilen Metaboliten durch Bildung von inerten Komplexen inaktivieren.
Fluimucil 10% beeinflusst weder die körperlichen Abwehrkräfte noch die Zilienfunktion der Schleimhaut der Atemwege und verursacht keine Auflösung der Fibrin- oder Blutgerinnsel.
Klinische Wirksamkeit
Fluimucil 10% löst den zähen Schleim in den Luftwegen, fördert den Auswurf und hilft, den Hustenreiz zu stillen. Hierdurch wird die Atmung erleichtert.
Weitere klinische Parameter, welche unter Umständen positiv von Fluimucil 10% beeinflusst werden können, sind die Dyspnoe und die Lungenfunktion.
Als Antidot bei Paracetamol-Vergiftungen wirkt Fluimucil 10%, indem es den Glutathion-Gehalt der Hepatozyten vermehrt oder indem es das Glutathion in Form eines Alternativsubstrates, welches für die Konjugation der toxischen Metaboliten des Paracetamols benötigt wird, ersetzt.
Pharmakokinetik
Nach i.v. Gabe, verteilt sich Acetylcystein rasch im Organismus, überwiegend im wässrigen Milieu des Extrazellulärraumes und erreicht die höchsten Konzentrationen in der Leber, den Nieren, der Lungen sowie im Bronchialschleim.
Im Körper findet sich Acetylcystein teils in freier Form, teils reversibel an Plasmaproteine über Disulfidbrücken gebunden.
Nach i.v. Dosierung von 200 mg von Acetylcystein zeigten sich folgende pharmakokinetische Daten:
Die maximale Plasmakonzentration des totalen Acetylcysteins (frei und gebunden) betrug 120 µmol/l, für die freie Form betrug 75 µmol/l.
Das Verteilungsvolumen betrug 0,47 l/kg (frei und gebunden), bzw. 0,59 l/kg (freie Form). Die Gesamtclearance wurde mit 0,11 l/h/kg (total) sowie 0,84 l/h/kg (frei) ermittelt. Die Eliminationshalbwertszeit betrug ca. 5,6 h, für die freie Form ca. 2 h.
Bei Neugeborenen oder Patienten mit schwerer Leberinsuffizienz ist mit einer verlängerten Eliminationshalbwertszeit zu rechnen.
Elimination
Etwa 30% der verabreichten Dosis werden direkt renal ausgeschieden. Die Hauptmetaboliten sind Cystin und Cystein. Ausserdem werden kleine Mengen an Taurin und Sulfaten ausgeschieden.
Über die Ausscheidung des nicht renal eliminierten Anteils liegen bisher keine Untersuchungen vor.
Präklinische Daten
In akuten Toxizitätsstudien wurden orale LD50-Werte bei 8 und >10 g/kg Körpergewicht bei Mäusen und Ratten ermittelt. Basierend auf den Ergebnissen von in vitro und in vivo-Tests wurde Acetylcystein als nicht genotoxisch beurteilt. Untersuchungen auf ein tumorerzeugendes Potential von Acetylcystein wurden nicht durchgeführt.
Embryo/Fötotoxizitätsstudien wurden bei trächtigen Kaninchen und Ratten mittels oraler Gabe von Acetylcystein während der Organogenese-Periode durchgeführt. Bei keiner der beiden experimentellen Studien wurden missgebildete Föten beobachtet.
Fertilitätsstudien wurden mit oral appliziertem Acetylcystein bei der Ratte durchgeführt. Die Behandlung von weiblichen Ratten mit oralen Dosen von bis zu 1000 mg/kg/Tag ergab keine Hinweise auf Beeinträchtigung der weiblichen Fertilität.
Die Behandlung von männlichen Ratten mit Acetylcystein in einer oralen Dosis von 250 mg/kg/Tag für 16 Wochen hatte keinen Einfluss auf die Fertilität oder die allgemeine Reproduktionsleistung der Tiere. Hingegen wurden bei einer Dosis ab 500 mg/kg/Tag (entsprechend etwa dem 40-Fachen der therapeutischen Maximaldosis) eine Abnahme der männlichen Fertilität und eine Beeinträchtigung der Spermienparameter beobachtet.
Sonstige Hinweise
Inkompatibilitäten
Acetylcystein ist mit den meisten Metallen inkompatibel und wird von oxidierenden Substanzen inaktiviert. Für die Verabreichung sollte deshalb nach Möglichkeit ein Besteck aus Glas oder Plastik (nicht aber Kautschuk) benutzt werden.
Fluimucil 10% darf mit anderen Arzneimitteln, insbesondere mit Antibiotika, nicht gemeinsam in einer gleichen Lösung oder durch dasselbe Besteck verabreicht werden.
Beeinflussung diagnostischer Methoden
Acetylcystein kann die kolorimetrische Gehaltsbestimmung von Salicylaten beeinflussen.
Bei Harnuntersuchungen kann Acetylcystein die Ergebnisse der Bestimmung von Ketonkörpern beeinflussen.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nach Anbruch der Ampulle ist die nicht verwendete Lösung wegzuwerfen.
Besondere Lagerungshinweise
Bei Raumtemperatur (15–25 °C), in der Originalverpackung, um den Inhalt vor Licht zu schützen, und für Kinder unzugänglich aufbewahren.
Hinweise für die Handhabung
Anweisung zum Öffnen der Ampulle:
- Ampulle in der korrekten Position halten (d.h. mit dem markierten Punkt nach oben) (Abbildung 1).
- Mit dem Daumen oberhalb des Punkts Druck ausüben und Ampullenkopf abbrechen (Abbildung 2).
i.v.-Verabreichung
Fluimucil 10% ist mit folgenden Infusionslösungen kompatibel: 5%ige Glukoselösung und 0,9%ige NaCl-Lösung. Die verdünnte Infusionszubereitung ist nicht konserviert. Sie ist während 24 Stunden bei Raumtemperatur chemisch und physikalisch stabil.
Aus mikrobiologischen Gründen ist die gebrauchsfertige Zubereitung jedoch unmittelbar nach der Verdünnung zu verwenden. Die verbleibende Restlösung ist wegzuwerfen.
Aerosoltherapie
Bei der Aerosolanwendung ist die Inhalation mittels eines Inhalationsgeräts zu verabreichen. Eine Verdünnung der Ampulle ist nicht nötig, dennoch möglich (z.B. 1 Ampulle Fluimucil 10% (3 ml) + 7 ml 0,9%igen NaCl-Lösung, um ein Endvolumen von 10 ml zu erreichen).
Der Gebrauch von Geräten mit Glas- oder Kunststoffteilen ist vorzuziehen.
Falls Geräte mit Metall- oder Gummiteilen verwendet werden, sind diese nach Gebrauch sofort mit Wasser auszuspülen.
Zulassungsnummer
66860 (Swissmedic).
Zulassungsinhaberin
Zambon Schweiz AG, 6814 Cadempino.
Stand der Information
November 2019.
Composizione
Principio attivo: Acetylcysteinum.
Sostanze ausiliarie: Dinatrii edetas, Natrii hydroxidum, Aqua ad iniectabilia.
Fluimucil 10% contiene 43 mg di sodio (1,9 mmol) per fiala da 3 ml.
Forma farmaceutica e quantità di principio attivo per unità
Soluzione iniettabile per uso i.v., locale.
Fiala: 300 mg d'acetilcisteina ogni 3 ml (100 mg/ml).
Indicazioni/Possibilità d'impiego
Per la terapia mucolitica inalatoria/instillativa locale o endovenosa sistemica delle patologie delle vie respiratorie che causano la formazione di secrezioni viscose molto difficili o impossibili da espettorare.
- Pneumologia: tutte le forme di bronchite, enfisema, atelettasia, bronchiectasia, mucoviscidosi.
- Patologie otorinolaringoiatriche: laringite, sinusite, faringite e in pazienti laringectomizzati.
- Chirurgia: profilassi di complicanze broncopolmonari con mucostasi.
- Pediatria: bronchite, mucoviscidosi.
Per la terapia endovenosa come antidoto nelle intossicazioni da paracetamolo.
Posologia/Impiego
Come mucolitico
Uso inalatorio
Adulti:
Inalare 1 fiala 1-2 volte al giorno.
Bambini in età nella quale è data una collaborazione attiva: inalare ½ fiala 1-2 volte al giorno.
Instillazioni
Adulti:
Endoauricolare e intranasale: 2-3 gocce 2-3 volte al giorno;
Endotracheale: 10-20 gocce fino a 1 fiala 1-2 volte al giorno;
Lavaggi di altre cavità corporee: ½ fiala per lavaggio.
Bambini:
Endoauricolare e intranasale: 1-2 gocce 1-2 volte al giorno;
Endotracheale: 10 gocce fino a ½ fiala 1-2 volte al giorno.
Uso endovenoso
Come mucolitico in terapia intensiva
Adulti:
2-3 fiale 2-3 volte al giorno.
Bambini 6-12 anni:
1-1½ fiala 2-3 volte al giorno.
Si raccomanda di diluire le fiale con una soluzione di NaCl allo 0,9% o con una soluzione di glucosio al 5% e di somministrare la soluzione mediante infusione breve lenta (durante ca. 5 min.).
Bambini 2-6 anni:
Nei bambini sotto i 6 anni è preferibile, ove possibile, un trattamento orale con forme farmaceutiche appropriate rispetto a una terapia parenterale.
Se tuttavia viene posta l'indicazione al trattamento parenterale, la dose giornaliera abituale per i bambini sotto i 6 anni è di 10 mg d'acetilcisteina per kg di peso corporeo.
Come antidoto nelle intossicazioni da paracetamolo
Uso endovenoso
In caso di sospetta intossicazione grave da paracetamolo, si dovrebbe in via precauzionale procedere con un trattamento immediato e accertare la gravità mediante determinazione del livello sierico di paracetamolo. Informazioni dettagliate sull' indicazione, sull'accertamento e sull'esecuzione della terapia possono essere richieste a Tox Info Suisse.
Schema di posologia endovenosa secondo Prescott
Dose totale: 300 mg/kg d'acetilcisteina, durata totale 21 h.
Lo schema di trattamento seguente è raccomandato:
Pazienti con peso corporeo ≥20 kg
Per questa speciale uso sono più adatti i flaconi al 20% (Fluimucil 20%).
Pazienti con peso corporeo inferiore a 20 kg
Bolo iniziale di 150 mg/kg in una soluzione di 3 ml/kg (durante 60 min.), seguito da 50 mg/kg in 7 ml/kg (durante 4 h) e successivamente da 100 mg/kg in 14 ml/kg (durante 16 h).
A dipendenza del peso corporeo, i flaconi al 20% (Fluimucil 20%) sono più adatti.
Un bolo iniziale più rapido durante 15 minuti può altresì essere somministrato, ma la somministrazione lenta del bolo (durante 60 min.) riduce la probabilità d'insorgenza di reazioni anafilattoidi.
Controindicazioni
Come mucolitico
Ipersensibilità al principio attivo acetilcisteina o a una delle sostanze ausiliarie secondo la composizione.
Bambini piccoli sotto i 2 anni.
Come antidoto
In caso di intossicazione pericolosa da paracetamolo, il trattamento con l'antidoto acetilcisteina può essere effettuato anche in presenza d'ipersensibilità all'anamnesi o nei bambini piccoli, con un opportuno monitoraggio/opportune misure d'accompagnamento.
Avvertenze e misure precauzionali
Indicazione generale
Il lieve odore di zolfo non è dovuto ad una alterazione del prodotto, ma alla natura specifica del principio attivo.
Somministrazione topica come mucolitico
Nell'aerosolterapia di pazienti asmatici è consigliabile somministrare Fluimucil 10% in concomitanza con broncodilatatori.
La somministrazione concomitante di un antitussivo può, per inibizione del riflesso della tosse e del meccanismo fisiologico di autopulizia delle vie respiratorie, causare un accumulo di secrezioni con il rischio di broncospasmo e di infezione delle vie respiratorie.
I pazienti con asma bronchiale devono essere monitorati attentamente nel corso della terapia. Qualora dovesse subentrare un broncospasmo, occorre interrompere l'acetilcisteina e intraprendere misure terapeutiche adeguate.
Somministrazione sistemica come mucolitico
La somministrazione endovenosa d'acetilcisteina deve aver luogo sotto stretto monitoraggio medico. Gli effetti indesiderati associati a un trattamento con l'acetilcisteina si manifestano con una più forte probabilità quando la somministrazione è troppo rapida o eccessiva. È dunque raccomandato di rispettare strettamente le indicazioni di posologia.
Esistono dati che indicano che pazienti con atopia e asma nell'anamnesi sono maggiormente a rischio di sviluppare una reazione anafilattica/anafilattoide.
Intolleranza all'istamina
L'acetilcisteina conduce in vitro a un'inibizione della diammina ossidasi (DAO) del 20-50%. Pertanto, è raccomandata cautela in pazienti che soffrono di intolleranza all'istamina.
Indicazione in caso di dieta a basso contenuto di sodio (sostanze ausiliarie di particolare interesse)
Fluimucil 10% contiene 43 mg di sodio (1,9 mmol) per fiala da 3 ml, equivalente al 2,15% dell'assunzione massima giornaliera raccomandata dall'OMS che corrisponde a 2 g di sodio per un adulto.
Reazioni cutanee
In casi molto rari si è verificata la comparsa di gravi reazioni cutanee in concomitanza temporale con l'assunzione d'acetilcisteina, come la sindrome di Stevens-Johnson e la sindrome di Lyell.
In caso di nuova insorgenza d'alterazioni cutanee o delle mucose, è opportuno consultare immediatamente un medico ed interrompere l'uso d'acetilcisteina.
Sanguinamenti gastrointestinali
È richiesta cautela in pazienti a rischio di sanguinamenti gastrointestinali (come ad es. ulcera peptica attiva nell'anamnesi), in particolare in caso di somministrazione concomitante con altri medicamenti che esercitano un effetto irritante sulla mucosa gastrica.
Come antidoto
Reazioni anafilattiche/anafilattoidi
Le reazioni anafilattiche/anafilattoidi con l'acetilcisteina si verificano, in particolare con la dose iniziale. In questa fase, il paziente deve essere attentamente monitorato in merito ai segni d'una reazione anafilattoide. Asma e ipervolemia (fluid overload) sono fattori di rischio per lo sviluppo di questi effetti indesiderati. Casi con esito fatale con la somministrazione endovenosa d'acetilcisteina come antidoto per l'intossicazione da paracetamolo in associazione a reazioni anafilattiche/anafilattoidi sono stati segnalati molto raramente.
Queste reazioni all'acetilcisteina si manifestano in genere da 15 a 60 minuti dopo l'inizio dell'infusione. In molti casi, i sintomi delle reazioni anafilattoidi possono essere sufficientemente alleviati con l'interruzione temporanea dell'infusione e la somministrazione d'antistaminici. In caso di reazioni sistemiche più importanti possono però essere necessari anche broncodilatatori per inalazione, adrenalina e corticosteroidi.
Quando una reazione è sotto controllo tramite la somministrazione d'antistaminici, l'infusione può essere ripresa sotto attento monitoraggio con una velocità d'infusione di 50 mg/kg in 4 ore, se ben tollerata, seguita dall'ultima infusione di 16 ore (100 mg/kg in 16 ore).
Liquidi corporei ed elettroliti
Nei pazienti con peso corporeo inferiore a 40 kg, l'antidoto va dosato con cautela a causa del possibile rischio d'ipervolemia (fluid overload) con conseguente iponatriemia, convulsioni e morte. Si raccomanda pertanto di attenersi rigorosamente alle indicazioni posologiche.
Coagulazione
La somministrazione d'acetilcisteina può prolungare il tempo di protrombina, in aggiunta alla tossicità del paracetamolo.
Interazioni
Non è disponibile alcun studio in vivo sulle interazioni medicamentose.
Fino ad ora, i rapporti che menzionano un'inattivazione degli antibiotici tramite l'acetilcisteina concernono esclusivamente studi in vitro nei quali le sostanze coinvolte erano state direttamente miscelate. È il motivo per il quale Fluimucil 10% non deve essere somministrato assieme ad altri medicamenti nella stessa soluzione (vedasi «Altre indicazioni, Incompatibilità»).
Poiché i gruppi tiolici possono formare dei legami d'addizione con i naftochinoni, esiste teoricamente anche la possibilità d'una reazione con la vitamina K. Nonostante non sia stato dimostrato se questo possa verificarsi in vivo, la somministrazione della vitamina K per il trattamento della ipoprotrombinemia in caso d'insufficienza epatica dovrebbe cominciare qualche ora dopo la conclusione della somministrazione dell'acetilcisteina.
In caso di somministrazione simultanea di trinitrato di glicerina (nitroglicerina), l'effetto vasodilatatore e inibitore dell'aggregazione dei trombociti può aumentare e indurre un'ipotensione.
Qualora fosse necessaria la somministrazione contemporanea di nitroglicerina parenterale e acetilcisteina, il paziente dovrebbe essere sorvegliato in ragione dei rischi eventuali d'ipotensione, che può essere severa e manifestarsi con l'insorgenza di cefalea.
Gravidanza/Allattamento
Gravidanza
Dai dati rilevati presso un numero limitato di gestanti esposte non sono emersi effetti indesiderati sulla gravidanza o sulla salute del feto o del neonato.
Non sono disponibili esperienze risultanti da studi epidemiologici.
Gli studi sugli animali non hanno mostrato una tossicità diretta o indiretta sulla gravidanza, sullo sviluppo embrionale, sullo sviluppo del feto e/o sullo sviluppo postnatale.
Per l'assunzione in gravidanza si raccomanda cautela.
Allattamento
Non è disponibile alcuno studio concernente il passaggio o meno dell'acetilcisteina nel latte materno. Fluimucil 10% non deve essere somministrato durante l'allattamento, a meno che non ciò non sia inequivocabilmente necessario.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
L'effetto sulla capacità di guidare veicoli e di usare macchinari non è stato esaminato.
Effetti indesiderati
Gli effetti indesiderati più frequenti descritti in letteratura concernenti l'acetilcisteina somministrata per via endovenosa sono eruzione cutanea, orticaria e prurito e appaiono il più soventemente durante la somministrazione del bolo iniziale.
In uno studio randomizzato, aperto e multicentrico, gli effetti indesiderati seguenti sono apparsi durante le prime 2 ore dopo la somministrazione i.v. dell'acetilcisteina:
Frequenze: molto comune (≥1/10), comune (≥1/100, <1/10), non comune (≥1/1000, <1/100), raro (≥1/10'000, <1/1000), molto raro (<1/10'000).
Disturbi del sistema immunitario
Molto comune: reazione anafilattoide (17%).
Patologie cardiache
Comune: tachicardia.
Patologie respiratorie, toraciche e mediastiniche
Non comune: faringite, rinorrea, ronco, broncospasmo.
Patologie gastrointestinali
Comune: vomito (11%), nausea.
Patologie della cute e del tessuto sottocutaneo
Comune: prurito, eruzione cutanea.
Patologie vascolari
Comune: vampate alla faccia.
Gli effetti indesiderati seguenti son diventati noti nei molti anni dopo l'introduzione sul mercato, la loro frequenza non può essere valutata sulla base dei dati disponibili.
Somministrazione locale
Disturbi del sistema immunitario: reazioni anafilattiche/anafilattoidi.
Patologie respiratorie, toraciche e mediastiniche: broncospasmo, rinorrea.
Patologie gastrointestinali: stomatite, vomito, nausea.
Patologie della cute e del tessuto sottocutaneo: angioedema, orticaria, eruzione, prurito.
Somministrazione sistemica (in caso di somministrazione i.v. ad alto dosaggio)
Disturbi del sistema immunitario: shock anafilattico, reazione anafilattica/anafilattoide, ipersensibilità.
Patologie cardiache: tachicardia.
Patologie respiratorie, toraciche e mediastiniche: broncospasmo, dispnea.
Patologie gastrointestinali: vomito, nausea.
Patologie della cute e del tessuto sottocutaneo: angioedema, orticaria, vampate alla faccia, eruzione, prurito.
Patologie sistemiche e condizioni relative alla sede di somministrazione: edema della faccia.
Esami diagnostici: pressione arteriosa ridotta, tempo di protrombina prolungato.
In casi molto rari si è verificata la comparsa di gravi reazioni cutanee in concomitanza temporale con l'assunzione d'acetilcisteina, come la sindrome di Stevens-Johnson e la sindrome di Lyell. In caso di nuova insorgenza d'alterazioni cutanee o delle mucose, è opportuno consultare immediatamente un medico ed interrompere l'uso d'acetilcisteina. Nella maggior parte di questi casi segnalati era utilizzato simultaneamente almeno un ulteriore medicamento, che ha potuto eventualmente rafforzare gli effetti mucocutanei osservati.
Diversi studi confermano la diminuzione dell'aggregazione delle piastrine durante l'uso di acetilcisteina. La rilevanza clinica di questo effetto non è finora stata chiarita.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Somministrazione endovenosa
I sintomi d'un sovradosaggio in caso di somministrazione endovenosa sono simili agli effetti indesiderati, ma più pronunciati.
In caso di sovradosaggio bisogna interrompere l'infusione e cominciare un trattamento sintomatico.
Non esistono specifici trattamenti antidotici. L'acetilcisteina è dializzabile.
Somministrazione locale
Non sono stati riportati casi di sovradosaggio con la somministrazione locale.
Proprietà/Effetti
Codice ATC: R05CB01
Meccanismo d'azione e farmacodinamica
Fluimucil 10% contiene il principio attivo acetilcisteina, un derivato della cisteina con un gruppo SH libero che possiede delle proprietà mucolitiche e antiossidanti.
L'azione mucolitica dell'acetilcisteina si basa sulla proprietà del gruppo SH di ridurre i ponti disolfuro delle mucoproteine del muco.
La proprietà antiossidante di Fluimucil 10% proviene dal fatto che i composti elettrofili e ossidanti sono inattivati direttamente dall'acetilcisteina e indirettamente dal glutatione. I composti elettrofili sono inattivati tramite coniugazione, i composti ossidanti sono neutralizzati tramite riduzione.
Attraverso la cisteina, l'acetilcisteina mette a disposizione un precursore essenziale della sintesi del glutatione e di conseguenza aumenta le riserve endogene di glutatione.
Il glutatione è un'importante principio attivo nucleofilo e antiossidante dell'organismo e ha, per questa ragione, una grande importanza nella protezione dello stesso. Inoltre, nel caso di certe intossicazioni (per esempio intossicazione da paracetamolo), il glutatione può inattivare i risultanti metaboliti tossici, reattivi ed elettrofili tramite la formazione di complessi inerti.
Fluimucil 10% non influenza né le difese immunitarie dell'organismo né la funzione ciliare della mucosa delle vie respiratorie e non causa la dissoluzione di coaguli di fibrina o di sangue.
Efficacia clinica
Fluimucil 10% scioglie le secrezioni dense delle vie respiratorie, ne favorisce l'espettorazione e aiuta a calmare lo stimolo della tosse. In questo modo la respirazione è facilitata.
Ulteriori parametri clinici che in alcune circostanze possono essere influenzati favorevolmente da Fluimucil 10% sono la dispnea e la funzionalità polmonare.
Nel suo impiego quale antidoto nel caso d'intossicazioni da paracetamolo, Fluimucil 10% agisce aumentando il tasso di glutatione negli epatociti o rimpiazzando il glutatione stesso sottoforma d'un substrato alternativo, il quale è necessario per la coniugazione dei metaboliti tossici del paracetamolo.
Farmacocinetica
Dopo somministrazione i.v., l'acetilcisteina si diffonde rapidamente nell'organismo, prevalentemente nell'ambiente acquoso dello spazio extracellulare, e raggiunge le concentrazioni più elevate nel fegato, nei reni, nei polmoni e nel muco bronchiale.
L'acetilcisteina si trova nel corpo parzialmente in forma libera, parzialmente legata in maniera reversibile alle proteine plasmatiche tramite ponti disolfuro.
Dopo una dose i.v. di 200 mg d'acetilcisteina si sono presentati i seguenti dati farmacocinetici:
La concentrazione plasmatica massima dell'acetilcisteina totale (libera e legata) era di 120 µmol/l, per la forma libera era di 75 µmol/l.
Il volume di distribuzione era di 0,47 l/kg (libera e legata) rispettivamente di 0,59 l/kg (forma libera). La clearance totale era risultata pari a 0,11 l/h/kg (totale) e a 0,84 l/h/kg (libera). L'emivita di eliminazione era risultata di ca. 5,6 h, per la forma libera di ca. 2 h.
Nei neonati o nei pazienti con insufficienza epatica grave occorre prevedere un'emivita di eliminazione più lunga.
Eliminazione
Circa il 30% della dose somministrata è eliminato direttamente per via renale. I metaboliti principali sono la cistina e la cisteina. Sono inoltre secrete delle piccole quantità di taurina e di solfati.
Per quanto riguarda l'eliminazione della parte non secreta tramite via renale, non è a disposizione, ad oggi, alcuno studio.
Dati preclinici
In studi di tossicità acuta sono stati determinati valori LD50 orali di 8 e >10 g/kg di peso corporeo nel topo e nel ratto. Sulla base dei risultati dei test in vitro e in vivo, l'acetilcisteina è stata valutata come non genotossica. Non sono state eseguite delle sperimentazioni sul potenziale cancerogeno dell'acetilcisteina.
Degli studi sull'embrio/fetotossicità sono stati eseguiti su conigli e ratti femmina gravide, ai quali è stata somministrata una dose d'acetilcisteina per via orale durante il periodo di organogenesi. I due studi sperimentali non hanno rivelato malformazioni fetali.
Degli studi sulla fertilità sono stati eseguiti sui ratti con l'acetilcisteina orale. Il trattamento di ratti femmina con dosi orali fino a 1000 mg/kg/die non ha evidenziato segni di compromissione della fertilità femminile.
Il trattamento di ratti maschi con dosi orali di acetilcisteina di 250 mg/kg/die per 16 settimane non ha avuto effetti sulla fertilità o sulla performance riproduttiva generale degli animali. Al contrario, a dosi a partire da 500 mg/kg/die (equivalenti a circa 40 volte la dose terapeutica massima), sono state osservate una diminuzione della fertilità maschile e una compromissione dei parametri degli spermatozoi.
Altre indicazioni
Incompatibilità
L'acetilcisteina è incompatibile con la maggior parte dei metalli e viene inattivata dalle sostanze ossidanti. Per la somministrazione è dunque consigliato utilizzare, nel limite del possibile, strumenti in vetro o in plastica (ma non in caucciù).
Fluimucil 10% non deve essere somministrato con altri medicamenti, specialmente antibiotici, nella stessa soluzione o con gli stessi strumenti.
Influenza sui metodi diagnostici
L'acetilcisteina può influenzare la determinazione colorimetrica della concentrazione dei salicilati.
Nelle analisi dell'urina l'acetilcisteina può influenzare i risultati della determinazione dei corpi chetonici.
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Stabilità dopo apertura
La soluzione non utilizzata delle fiale aperte deve essere gettata.
Indicazioni particolari concernenti l'immagazzinamento
Conservare a temperatura ambiente (15–25 °C), nella confezione originale per proteggere il contenuto dalla luce, e fuori dalla portata dei bambini.
Indicazioni per la manipolazione
Istruzione per l'apertura della fiala:
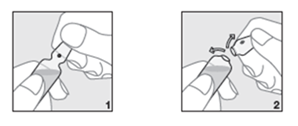
- Tenere la fiala nella posizione corretta (ovvero con il punto marcato rivolto verso l'alto) (Figura 1).
- Con il pollice esercitare pressione al di sopra del punto e rompere la parte superiore della fiala (Figura 2).
Somministrazione i.v.
Fluimucil 10% è compatibile con le seguenti soluzioni per infusione: soluzione di glucosio al 5% e soluzione di NaCl allo 0,9%. La preparazione per infusione diluita non contiene alcun conservante. A temperatura ambiente quest'ultima è fisicamente e chimicamente stabile per 24 ore.
Per ragioni microbiologiche la soluzione pronta all'uso deve tuttavia essere utilizzata subito dopo la diluizione. La soluzione restante deve essere gettata.
Aerosolterapia
Nell'uso in aerosol, l'inalazione deve essere somministrata mediante un inalatore. Una diluizione della fiala non è necessaria, ma è comunque possibile (ad es. 1 fiala di Fluimucil 10% (3 ml) + 7 ml di soluzione di NaCl allo 0,9% per ottenere un volume finale di 10 ml).
È da preferire l'utilizzo di strumenti con parti in vetro o in plastica.
Qualora vengano utilizzate parti in metallo o in gomma, queste devono essere sciacquate con acqua subito dopo l'utilizzo.
Numero dell'omologazione
66860 (Swissmedic).
Titolare dell’omologazione
Zambon Svizzera SA, 6814 Cadempino.
Stato dell'informazione
Novembre 2019.
Composition
Principe actif: Acetylcysteinum.
Excipients: Dinatrii edetas, Natrii hydroxidum, Aqua ad iniectabilia.
Fluimucil 10% contient 43 mg de sodium (1,9 mmol) par ampoule de 3 ml.
Forme pharmaceutique et quantité de principe actif par unité
Solution injectable pour utilisation i.v., locale.
Ampoule: 300 mg acétylcystéine pro 3 ml (100 mg/ml).
Indications/Possibilités d’emploi
Pour la thérapie mucolytique par inhalation/instillation locale ou par voie intraveineuse systémique lors d'affections des voies respiratoires, qui mènent à la formation d'une sécrétion dense difficile à expectorer.
- Pneumologie: toutes les formes de bronchite, emphysème, atélectasie, bronchectasie, mucoviscidose.
- ORL: laryngites, sinusites, pharyngites, ainsi que chez les patients laryngectomisés.
- Chirurgie: prophylaxie des complications broncho-pulmonaires avec mucostase.
- Pédiatrie: bronchites, mucoviscidose.
Pour la thérapie intraveineuse en tant qu'antidote lors d'intoxications au paracétamol.
Posologie/Mode d’emploi
En tant que mucolytique
Utilisation par inhalation
Adultes:
Inhaler 1 ampoule 1–2 fois/jour.
Enfants dès l'âge où une collaboration active est donnée: inhaler ½ ampoule 1–2 fois/jour.
Instillations
Adultes:
Intra-auriculaire et intranasale: 2–3 gouttes 2–3 fois/jour;
Endotrachéale: 10–20 gouttes jusqu'à 1 ampoule 1–2 fois/jour.
Lavages d'autres cavités corporelles: ½ ampoule par lavage.
Enfants:
Intra-auriculaire et intranasale: 1–2 gouttes 1–2 fois/jour;
Endotrachéale: 10 gouttes jusqu'à ½ ampoule 1–2 fois/jour.
Utilisation par voie intraveineuse
En tant que mucolytique en thérapie intensive
Adultes:
2–3 ampoules 2–3 fois/jour.
Enfants 6-12 ans:
1–1½ ampoule 2–3 fois/jour.
Il est recommandé de diluer les ampoules avec une solution de NaCl à 0,9% ou une solution de glucose à 5% et d'administrer lentement (pendant env. 5 min) par infusion brève.
Enfants 2-6 ans:
Chez les enfants de moins de 6 ans, un traitement par voie orale avec des formes pharmaceutiques appropriées est à préférer à un traitement parentéral.
Si l'indication d'un traitement parentéral est néanmoins donnée, la dose quotidienne habituelle pour les enfants de moins de 6 ans est de 10 mg d'acétylcystéine par kg de poids corporel.
En tant qu'antidote lors d'intoxications au paracétamol
Utilisation par voie intraveineuse
Lors d'un suspect d'intoxication grave au paracétamol, un traitement de précaution immédiat et une définition de la gravité par détermination du taux sérique de paracétamol devraient être effectués. Des informations détaillées sur l'indication, la clarification et l'exécution de la thérapie peuvent être demandées auprès Tox Info Suisse.
Schéma de posologie intraveineuse selon Prescott
Dose totale: 300 mg/kg d'acétylcystéine. Durée totale 21 h.
Le schéma de traitement suivant est recommandé:
Patients avec un poids corporel ≥20 kg
Pour cette utilisation spéciale, les flacons à 20% (Fluimucil 20%) sont plus appropriés.
Patients avec un poids corporel inférieur à 20 kg
Bolus initial de 150 mg/kg dans une solution à 3 ml/kg (pendant 60 min), suivi par 50 mg/kg dans 7 ml/kg (pendant 4 h), suivi par 100 mg/kg dans 14 ml/kg (pendant 16 h).
Selon le poids corporel les flacons à 20% (Fluimucil 20%) sont plus appropriés.
Un bolus initial plus rapide sur 15 minutes peut également être administré, mais l'administration lente du bolus (pendant 60 min) réduit la probabilité d'apparition de réactions anaphylactoïdes.
Contre-indications
En tant que mucolytique
Hypersensibilité au principe actif acétylcystéine ou à l'un des excipients selon la composition;
Petits enfants de moins de 2 ans.
En tant qu'antidote
En cas d'intoxication dangereuse au paracétamol, le traitement antidote avec l'acétylcystéine peut être effectué sous une surveillance appropriée/des mesures d'accompagnement appropriées même en présence d'une hypersensibilité dans l'anamnèse ou chez les petits enfants.
Mises en garde et précautions
Remarque générale
La légère odeur de soufre n'est pas due à une altération du produit, mais à la nature spécifique de principe actif.
Administration topique en tant que mucolytique
Lors de thérapie par aérosol chez les patients asthmatiques, il est conseillé d'utiliser Fluimucil 10% simultanément avec des bronchodilatateurs.
L'administration simultanée d'un antitussif peut, en supprimant le réflexe de la toux et l'autonettoyage physiologique des voies respiratoires, entraîner un encombrement du mucus avec risque de bronchospasme et d'infection des voies respiratoires.
Les patients avec asthme bronchique doivent être étroitement surveillés pendant le traitement. Si un bronchospasme survient, l'acétylcystéine doit être arrêtée et des mesures thérapeutiques adéquates doivent être prises.
Administration systémique en tant que mucolytique
L'administration intraveineuse d'acétylcystéine doit avoir lieu sous surveillance médicale stricte. Les effets indésirables associés à un traitement par l'acétylcystéine surviennent avec une plus forte probabilité lorsque l'administration est trop rapide ou excessive. Il est donc recommandé de respecter strictement les instructions de posologie.
Des données indiquent que les patients avec atopie et asthme dans l'anamnèse ont un risque accru de développer une réaction anaphylactique/anaphylactoïde.
Intolérance à l'histamine
L'acétylcystéine amène in vitro à une inhibition de la diamine oxydase (DAO) de 20-50%. La prudence est donc de mise chez les patients souffrant d'une intolérance à l'histamine.
Information en cas de régime pauvre en sodium (excipients revêtant un intérêt particulier)
Fluimucil 10% contient 43 mg de sodium (1,9 mmol) par ampoule de 3 ml, ce qui équivaut à 2,15% de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
Réactions cutanées
L'apparition de réactions cutanées sévères comme le syndrome de Stevens-Johnson et le syndrome de Lyell a été très rarement rapportée en relation temporelle avec l'utilisation d'acétylcystéine.
En cas d'apparition nouvelle de manifestations cutanées et au niveau des muqueuses, il convient de consulter immédiatement un médecin et d'arrêter l'utilisation de l'acétylcystéine.
Saignements gastro-intestinaux
La prudence est recommandée chez les patients avec risque de saignements gastro-intestinaux (par ex. lors d'ulcère peptique dans l'anamnèse), tout particulièrement en cas d'administration concomitante d'autres médicaments qui exercent un effet irritant sur la muqueuse gastrique.
En tant qu'antidote
Réactions anaphylactiques/anaphylactoïdes
Avec l'acétylcystéine surviennent des réactions anaphylactiques/anaphylactoïdes, en particulier avec la dose initiale. Dans cette phase, le patient doit être surveillé attentivement par rapport aux signes d'une réaction anaphylactoïde. Asthme et hypervolémie (fluid overload) sont des facteurs de risque pour le développement de ces effets indésirables. Des cas avec issue fatale sous l'administration intraveineuse d'acétylcystéine en tant qu'antidote à l'intoxication au paracétamol en association avec des réactions anaphylactiques/anaphylactoïdes ont été rapportés très rarement.
Ces réactions à l'acétylcystéine se manifestent généralement 15 jusqu'à 60 minutes après le début de la perfusion. Dans de nombreux cas, les symptômes des réactions anaphylactoïdes peuvent être suffisamment atténués avec l'interruption temporaire de la perfusion et l'administration d'antihistaminiques. Cependant, en cas de réactions systémiques majeures, des bronchodilatateurs par inhalation, de l'adrénaline et des corticostéroïdes peuvent également être nécessaires.
Lorsqu'une réaction est maîtrisée à la suite de l'administration d'antihistaminiques, la perfusion peut être reprise, sous surveillance attentive, avec une vitesse de perfusion de 50 mg/kg en 4 heures suivi, si bien tolérée, de la dernière perfusion de 16 heures (100 mg/kg en 16 heures).
Liquides corporels et électrolytes
Chez les patients avec un poids corporel inférieur à 40 kg, les administrations d'antidote doivent être dosées avec prudence en raison du risque éventuel d'une hypervolémie (fluid overload) pouvant entraîner hyponatrémie, convulsions et décès. Il est donc recommandé de respecter strictement les indications de posologie.
Coagulation
L'administration d'acétylcystéine peut prolonger le temps de prothrombine, en plus de la toxicité du paracétamol.
Interactions
On ne dispose pas d'étude sur les interactions médicamenteuses in vivo.
Jusqu'à présent, les rapports sur une inactivation des antibiotiques par l'acétylcystéine concernent exclusivement des tests in vitro au cours desquels les substances concernées avaient été directement mélangées. C'est pour cette raison que Fluimucil 10% ne doit pas être administré avec d'autres médicaments dans la même solution (voir «Remarques particulières, Incompatibilités»).
Étant donné que les groupes thiols avec des naphtoquinones peuvent former des liaisons d'addition, théoriquement il existe aussi la possibilité qu'une réaction avec la vitamine K puisse se produire. Bien qu'il n'ait pas été démontré que cela peut arriver in vivo, l'administration de la vitamine K pour le traitement de l'hypotrombinémie en cas d'insuffisance hépatique devrait commencer quelques heures après cessation de l'administration de l'acétylcystéine.
Lors d'administration simultanée de trinitrate de glycéryle (nitroglycérine), l'effet vasodilatateur et inhibant l'agrégation des thrombocytes peut augmenter et induire une hypotension.
Si un co-traitement avec la nitroglycérine parentérale et l'acétylcystéine s'avère indispensable, le patient doit être surveillé en raison des risques éventuels d'hypotension, qui peut être grave et se manifester par des céphalées.
Grossesse/Allaitement
Grossesse
Les données pour un nombre limité de femmes enceintes exposées n'ont révélé aucun effet indésirable sur la grossesse ou la santé du fœtus ou du nouveau-né.
Il n'existe pas d'expériences d'études épidémiologiques.
Les expérimentations animales n'ont révélé aucune toxicité directe ni indirecte ayant une incidence sur la grossesse, le développement embryonnaire, le développement fœtal et/ou le développement post-natal.
La prudence est de mise en cas d'emploi pendant la grossesse.
Allaitement
On ne dispose pas d'études concernant le passage de l'acétylcystéine dans le lait maternel. Fluimucil 10% ne doit pas être utilisé pendant l'allaitement, sauf si clairement nécessaire.
Effet sur l’aptitude à la conduite et l’utilisation de machines
L'effet sur l'aptitude à la conduite et l'utilisation de machines n'a pas été testé.
Effets indésirables
Les effets indésirables les plus fréquemment décrits dans la littérature concernant l'acétylcystéine administrée par voie intraveineuse sont les suivants: rash cutané, urticaire et prurit. Ils surviennent le plus souvent pendant l'administration du bolus initial.
Au cours d'une étude randomisée, ouverte et multicentrique, les effets indésirables suivants sont apparus pendant les 2 premières heures après l'utilisation i.v. d'acétylcystéine:
Fréquences: «très fréquents» (≥1/10), «fréquents» (<1/10, ≥1/100), «occasionnels» (<1/100, ≥1/1000), «rares» (<1/1000, ≥1/10'000), «très rares» (<1/10'000).
Affections du système immunitaire
Très fréquent: réaction anaphylactoïde (17%).
Affections cardiaques
Fréquent: tachycardie.
Affections respiratoires, thoraciques et médiastinales
Occasionnel: pharyngite, rhinorrhée, rhoncus, bronchospasme.
Affections gastro-intestinales
Fréquent: vomissement (11%), nausée.
Affections de la peau et du tissu sous-cutané
Fréquent: prurit, rash cutané.
Affections vasculaires
Fréquent: bouffées vasomotrices au visage.
Les expériences post-commercialisation à long terme ont mis en évidence les effets indésirables suivants; la fréquence ne peut pas être estimée sur la base des données disponibles.
Administration locale
Affections du système immunitaire: réactions anaphylactiques/anaphylactoïdes.
Affections respiratoires, thoraciques et médiastinales: bronchospasme, rhinorrhée.
Affections gastro-intestinales: stomatite, vomissement, nausée.
Affections de la peau et du tissu sous-cutané: angiœdème, urticaire, rash, prurit.
Administration systémique (administration i.v. de fortes doses)
Affections du système immunitaire: choc anaphylactique, réactions anaphylactiques/anaphylactoïdes, hypersensibilité.
Affections cardiaques: tachycardie
Affections respiratoires, thoraciques et médiastinales: bronchospasme, dyspnée.
Affections gastro-intestinales: vomissement, nausée.
Affections de la peau et du tissu sous-cutané: angiœdème, urticaire, bouffées vasomotrices au visage, rash, prurit.
Troubles généraux et anomalies au site d'administration: œdème de la face.
Investigations: pression artérielle diminuée, TP allongé.
L'apparition de réactions cutanées sévères comme le syndrome de Stevens-Johnson et le syndrome de Lyell a été très rarement rapportée en relation temporelle avec l'utilisation d'acétylcystéine. En cas d'apparition nouvelle de manifestations cutanées et au niveau des muqueuses, il convient de consulter immédiatement un médecin et d'arrêter l'utilisation de l'acétylcystéine. Dans la plupart de ces cas rapportés, au moins un autre médicament avait été utilisé simultanément et a pu éventuellement renforcer les effets cutanéo-muqueux observés.
Différentes études confirment la diminution de l'agrégation des plaquettes lors de l'utilisation de l'acétylcystéine. L'importance clinique de cet effet n'est pas clarifiée jusqu'à présent.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Administration intraveineuse
Les symptômes d'un surdosage en cas d'administration intraveineuse sont similaires aux effets indésirables, mais plus marqués.
En cas de surdosage, il convient d'arrêter la perfusion et de commencer un traitement symptomatique.
Il n'existe pas de traitement antidote spécifique. L'acétylcystéine est dialysable.
Administration locale
Aucun cas de surdosage n'a été signalé lors d'administration locale.
Propriétés/Effets
Code ATC: R05CB01
Mécanisme d'action et pharmacodynamie
Fluimucil 10% contient le principe actif acétylcystéine, un dérivé de la cystéine avec un groupe thiol libre qui possède des propriétés mucolytiques et antioxydantes.
L'effet mucolytique de l'acétylcystéine se base sur la capacité du groupe thiol de réduire les ponts disulfures des mucoprotéines du mucus.
La propriété antioxydante de Fluimucil 10% provient du fait que les composés électrophiles et oxydants sont inactivés directement par l'acétylcystéine et indirectement par le glutathion. Les composés électrophiles sont inactivés par conjugaison, les composés oxydants neutralisés par réduction.
À travers la cystéine, l'acétylcystéine met à disposition un précurseur essentiel de la synthèse du glutathion et par conséquent, augmente les réservoirs endogènes de glutathion.
Le glutathion est un important principe actif nucléophile et antioxydant de l'organisme et, pour cela, revêt une grande importance pour sa protection. En outre, dans certaines intoxications (par ex. au paracétamol), le glutathion peut inactiver les métabolites toxiques, réactifs et électrophiles par formation de complexes inertes.
Fluimucil 10% ne gêne ni les défenses immunitaires de l'organisme, ni la fonction ciliaire de la muqueuse des voies respiratoires et ne provoque pas la dissolution de la fibrine ou des caillots sanguins.
Efficacité clinique
Fluimucil 10% fluidifie les sécrétions denses des voies respiratoires, favorise l'expectoration et calme le réflexe de la toux. De cette manière, la respiration est facilitée.
Il peut également influencer, de manière positive, d'autres paramètres cliniques, tels que la dyspnée et la fonction pulmonaire.
Lors de son emploi en tant qu'antidote dans les intoxications au paracétamol, Fluimucil 10% agit en augmentant le taux de glutathion dans les hépatocytes ou, en remplaçant le glutathion, en tant que substrat alternatif qui est nécessaire pour la conjugaison des métabolites toxiques du paracétamol.
Pharmacocinétique
Après administration i.v. l'acétylcystéine se diffuse rapidement dans l'organisme, principalement dans le milieu aqueux de l'espace extracellulaire et atteint les concentrations les plus élevées au niveau du foie, des reins, des poumons et dans le mucus bronchique.
Dans l'organisme, l'acétylcystéine se trouve soit sous forme libre, soit liée aux protéines plasmatiques de manière réversible par des ponts disulfures.
Après une dose par i.v. de 200 mg d'acétylcystéine, les données pharmacocinétiques suivantes se présentent.
La concentration plasmatique maximale de l'acétylcystéine totale (libre et liée) est de 120 µmol/l, de la forme libre est de 75 µmol/l.
Le volume de distribution est de 0,47 l/kg (libre et lié), respectivement de 0,59 l/kg (forme libre). La clairance complète est déterminée avec 0,11 l/h/kg (totale) et 0,84 l/h/kg (libre). La demi-vie d'élimination est d'env. 5,6 h, pour la forme libre d'env. 2 h.
Chez les nouveau-nés ou les patients avec insuffisance hépatique grave, il faut s'attendre à une demi-vie d'élimination plus longue.
Élimination
Environ 30% de la dose administrée est éliminée directement par voie rénale. Les métabolites principaux sont la cystine et la cystéine. En outre, de petites quantités de taurine et sulfates sont excrétées.
En ce qui concerne l'élimination de la partie non excrétée par voie rénale, on ne dispose, jusqu'à présent, pas d'études.
Données précliniques
Des études de toxicité aiguë ont permis de déterminer une LD50 orale de 8 et >10 g/kg poids corporel chez des souris et des rats. En s'appuyant sur les résultats d'essais in vitro et in vivo, l'acétylcystéine a été considérée comme non génotoxique. Des expérimentations sur le potentiel tumorigène de l'acétylcystéine n'ont pas été réalisées.
Des études sur l'embryo/fœtotoxicité ont été effectuées sur la lapine et la rate gravides, auxquelles a été administrée une dose d'acétylcystéine par voie orale durant la période d'organogenèse. Aucun de ces essais expérimentaux n'a révélé des malformations fœtales.
Des études de fertilité ont été effectuées sur des rats avec l'acétylcystéine orale. Le traitement de rates femelles par des doses orales jusqu'à 1000 mg/kg/jour n'a pas permis d'observer de signes d'atteinte sur la fertilité des femelles.
Le traitement de rats mâles avec l'acétylcystéine par des doses orales de 250 mg/kg/jour pendant 16 semaines n'a pas d'influence sur la fertilité ou la capacité de reproduction générale des animaux. En revanche, une baisse de la fertilité masculine et une atteinte des paramètres spermatiques ont été observées à partir d'une dose de 500 mg/kg/jour (équivalent à environ 40 fois la dose journalière maximale thérapeutique).
Remarques particulières
Incompatibilités
L'acétylcystéine est incompatible avec la plupart des métaux et est inactivée par des substances oxydantes. Pour l'administration, il est conseillé d'utiliser des appareils en verre ou en plastique (pas en caoutchouc).
Fluimucil 10% ne doit pas être administré avec d'autres médicaments, surtout avec des antibiotiques, dans la même solution ou avec le même appareil.
Influence sur les méthodes de diagnostic
L'acétylcystéine peut influencer la détermination colorimétrique de la concentration en salicylates.
En cas d'analyses d'urine, l'acétylcystéine peut influencer les résultats de la détermination des corps cétoniques.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Stabilité après ouverture
La solution non utilisée des ampoules ouvertes doit être jetée.
Remarques concernant le stockage
Conserver à température ambiante (15–25 °C), dans l'emballage original, afin de protéger le contenu de la lumière et tenir hors de portée des enfants.
Remarques concernant la manipulation
Instructions pour l'ouverture de l'ampoule:
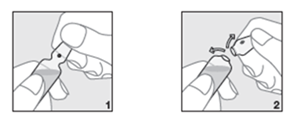
- Tenir l'ampoule en position correcte (c.-à-d. avec le point marqué vers le haut) (figure 1).
- Exercer une pression avec le pouce positionné au-dessus du point et détacher la partie supérieure de l'ampoule (figure 2).
Administration i.v.
Fluimucil 10% est compatible avec les solutions à perfusion suivantes: solution de glucose à 5% et solution de NaCl à 0,9%. La préparation à perfusion diluée ne contient aucun agent conservateur. À température ambiante, elle est physiquement et chimiquement stable pendant 24 heures.
Pour des raisons microbiologiques, la solution prête à l'emploi doit être utilisée toute de suite après sa dilution. La solution restante doit être jetée.
Thérapie par aérosol
Lors d'utilisation en tant qu'aérosol, l'administration doit être effectuée au moyen d'un appareil à inhalations. Une dilution de l'ampoule n'est pas nécessaire, mais toutefois possible (par ex. 1 ampoule de Fluimucil 10% (3 ml) + 7 ml de solution NaCl à 0,9% pour arriver à un volume final de 10 ml).
Il est conseillé d'utiliser des appareils pour inhalations en verre ou en plastique.
En cas d'utilisation d'appareils avec des pièces en métal ou en gomme, il faut les laver avec de l'eau immédiatement après l'usage.
Numéro d’autorisation
66860 (Swissmedic).
Titulaire de l’autorisation
Zambon Suisse SA, 6814 Cadempino.
Mise à jour de l’information
Novembre 2019.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


 Deutsch
Deutsch French
French Italian
Italian








