Carivalan Filmtabletten 6.25mg/7.5mg 56 Stück buy online
Carivalan Filmtabl 6.25mg/7.5mg 56 Stk
-
117.13 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: SERVIER SUISSE SA
- Product Code: 7332567
- ATC-code C07FX06
- EAN 7680662130036
Ingredients:
Glycerol, Magnesium stearat, Lactose-1-Wasser, Hypromellose, Maltodextrin, Eisen(III)-oxid (E172), Siliciumdioxid anhydrat, Croscarmellose natrium, Carvedilol 6.25 mg , Ivabradin 7.5 mg , Ivabradin hydrochlorid 8.085 mg, Macrogol 6000, Cellulose, mikrokristalline, Stärke vorverkleistert.

Description
AMZV
Was ist Carivalan und wann wird es angewendet?
Carivalan ist ein Medikament für das Herz und wird bei erwachsenen Patienten auf Verschreibung des Arztes bzw. der Ärztin angewendet:
- Zur Behandlung von symptomatischer stabiler Angina pectoris oder «Brustenge» (eine Krankheit, die Brustschmerzen verursacht),
- Zur Behandlung von chronischer Herzinsuffizienz.
Statt Carvedilol und Ivabradin als separate Tabletten einzunehmen, erhalten Sie eine Filmtablette Carivalan, die beide Wirkstoffe in der gleichen Wirkstärke enthält.
Bei Carivalan handelt es sich um eine Kombination der beiden Wirkstoffe Carvedilol und Ivabradin. Carvedilol ist eine Substanz die den arteriellen Blutdruck durch zwei Mechanismen senkt: Einerseits wirkt es als Betablocker indem er das Herz und den Blutkreislauf von den Auswirkungen von übermässigem Stress schützt; andererseits hat es eine gefässerweiternde Wirkung auf die kleinen Gefässe in der Peripherie. Ivabradin wirkt hauptsächlich über die Senkung der Herzfrequenz. Dies reduziert den Sauerstoffbedarf des Herzens, vor allem in Situationen, in denen es zu Angina-pectoris-Anfällen kommen kann. Auf diese Weise tragen Carvedilol und Ivabradin dazu bei, die Anzahl der Angina-pectoris-Anfälle unter Kontrolle zu halten und zu verringern.
Wann darf Carivalan nicht eingenommen werden?
Carivalan darf nicht eingenommen werden,
- wenn Sie allergisch sind gegen Carvedilol, Ivabradin, einen der im Abschnitt «Was ist in Carivalan enthalten?» genannten sonstigen Bestandteile dieses Arzneimittels oder gegen andere Betablocker,
- wenn Sie an einer schweren Lebererkrankung leiden,
- wenn Sie an einer Herzinsuffizienz leiden, die nicht stabil eingestellt oder vor Kurzem schlimmer geworden ist; wenn Sie eine Behandlung mit einem β-Rezeptoren-Agonisten (z.B. Dobutamin) gegen Herzinsuffizienz erhalten haben,
- wenn Sie an instabiler Angina pectoris leiden (eine schwere Form der Angina pectoris, bei der Brustschmerzen sehr häufig auftreten, sowohl unter als auch ohne Belastung),
- wenn Sie an Prinzmetal-Angina leiden (Brustschmerzen, die in Ruhe und in Zyklen immer wieder auftreten),
- wenn Sie an einer Herzrhythmusstörung leiden, an einem unregelmässigen Herzrhythmus leiden,
- wenn Ihre Herzfrequenz im Ruhezustand vor der Behandlung zu langsam ist. Die Behandlung mit Ivabradin darf nicht begonnen werden, wenn Ihre Herzfrequenz im Ruhezustand unter 70 Schlägen pro Minute liegt,
- wenn Sie sich schwach fühlen, Ihr Bewusstseinszustand getrübt ist, Sie unter Kurzatmigkeit leiden, Ihr Blutdruck niedrig ist oder Sie Brustschmerzen haben (aufgrund von symptomatischer oder schwerer Bradykardie),
- wenn Sie vor Kurzem einen Herzinfarkt hatten,
- wenn Sie an einem kardiogenen Schock leiden (ein schwerwiegendes Herzleiden, das durch sehr niedrigen Blutdruck verursacht wird und im Spital behandelt werden muss),
- wenn Ihr Herzschlag ausschliesslich von einem Herzschrittmacher gesteuert wird,
- wenn Sie eine schwere Blutgefässerkrankung haben (zum Beispiel Raynaud-Syndrom),
- wenn Sie einen sehr niedrigen Blutdruck haben,
- wenn Sie an einer chronisch-obstruktiven Lungenerkrankung oder COPD (Lungenerkrankung mit Symptomen wie Pfeifatmung, Atemnot und chronischem Husten), leiden,
- wenn Sie schon früher einmal Atembeschwerden wie Asthma, Heuschnupfen oder Bronchospasmen (Atemnot aufgrund einer Verengung der Atemwege) hatten,
- wenn der Säuregehalt in Ihrem Blut zu hoch ist (metabolische Azidose),
- wenn Sie aufgrund eines Tumors der Nebennieren (unbehandeltes Phäochromozytom) unter hohem Blutdruck leiden,
- wenn Sie einen MAO-Hemmer (Antidepressivum) einnehmen,
- wenn Sie bereits Arzneimittel zur Behandlung von Pilzinfektionen (wie Ketoconazol oder Itraconazol), Makrolidantibiotika (wie Josamycin, Clarithromycin, Telithromycin oder oral verabreichtes Erythromycin), Arzneimittel zur Behandlung einer HIV-Infektion (wie Nelfinavir oder Ritonavir), Nefazodon (Antidepressivum), Diltiazem oder Verapamil (beide zur Behandlung eines erhöhten Blutdrucks oder einer Angina pectoris verwendet) einnehmen,
- während einer Desensibilisierungstherapie zur Behandlung einer Allergie,
- wenn Sie eine Frau im gebärfähigen Alter sind und keine zuverlässige Verhütungsmethode anwenden,
- wenn Sie schwanger sind oder beabsichtigen, schwanger zu werden,
- wenn Sie stillen.
Bei bestimmten Patienten kann ein langsamer Abbau von Carvedilol zu höheren Konzentrationen dieses Wirkstoffs führen. Da diesbezüglich keine Erfahrungen bestehen, dürfen diese Patienten Carivalan nicht einnehmen.
Wann ist bei der Einnahme von Carivalan Vorsicht geboten?
Dieses Arzneimittel kann die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge oder Maschinen zu bedienen, beeinträchtigen! Carivalan kann vorübergehend visuelle Lichtphänomene verursachen (siehe Abschnitte «Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen» und «Welche Nebenwirkungen kann Carivalan haben?»).
Informieren Sie vor der Einnahme von Carivalan Ihren Arzt bzw. Ihre Ärztin, wenn:
- Sie an Herzrhythmusstörungen (wie ein unregelmässiger Herzschlag, Herzklopfen, zunehmende Brustschmerzen), anhaltendem Vorhofflimmern (eine Art von unregelmässigem Herzschlag) oder an einer Abweichung im Elektrokardiogramm (EKG), einem sogenannten «Long-QT-Syndrom», leiden,
- Sie an einer schweren Herzinsuffizienz oder Herzinsuffizienz mit Abweichungen im EKG, einem sogenannten «Schenkelblock», leiden,
- Sie an einer Herzinsuffizienz leiden, bei der es bei der geringsten körperlichen Aktivität zu Beschwerden kommt (Symptome können selbst bei Ruhe vorhanden sein und die Beschwerden nehmen bei körperlicher Aktivität zu),
- Sie an Symptomen eines Vorhofflimmerns leiden (wie z.B. Ruhepuls ohne ersichtlichen Grund ungewöhnlich hoch oder unregelmässig, sodass er schwer messbar ist),
- Sie an einem gering oder mässig ausgeprägten niedrigen Blutdruck oder einem nicht einstellbaren Blutdruck leiden, vor allem nach einer Veränderung Ihrer blutdrucksenkenden Behandlung,
- Sie an einer bereits langfristig bestehenden Herzinsuffizienz sowie einer der folgenden Beschwerden leiden: niedrigem Blutdruck (<100 mmHg), oder einer Herzerkrankung, die durch einen verringerten Blutfluss in den Blutgefässen des Herzmuskels verursacht wird, oder einer Erkrankung mit Schädigungen der grossen und/oder kleinen Blutgefässe, oder Nierenproblemen,
- Sie an Symptomen leiden wie Müdigkeit, Schwindelgefühl oder Kurzatmigkeit (das könnte darauf hinweisen, dass Ihre Herzfrequenz zu niedrig ist),
- Sie planen, sich einer Kardioversion zu unterziehen (ein medizinisches Verfahren, um einen schnellen oder unregelmässigen Herzschlag wieder in einen normalen Rhythmus zu überführen),
- Sie vor Kurzem einen Schlaganfall hatten (Gehirnschlag),
- Ihr Blutdruck aufgrund einer anderen Erkrankung erhöht ist,
- Ihr Blutdruck sich beim Aufrichten senkt,
- Ihre Herzklappen beeinträchtigt sind, Sie an einer aktiven Myokarditis leiden (Herzmuskelentzündung), seit der Geburt einen Herzfehler aufweisen oder an einer Kreislauf-Erkrankung im Endstadium leiden, bei der verengte Arterien den Blutfluss zu den Gliedmassen verringern,
- Sie zur Behandlung einer Herzrhythmusstörung oder einer anderen Störung bereits ein Arzneimittel einnehmen, welches das QT-Intervall verlängert (siehe die im nachfolgenden Abschnitt aufgeführten Produkte),
- Sie bereits einen α1-Rezeptorantagonisten oder α2-Rezeptoragonisten einnehmen,
- Sie an einer chronischen Erkrankung der Augennetzhaut leiden oder sich Ihr Sehvermögen zusehends verschlechtert,
- Sie an Diabetes leiden,
- Sie an einer mässigen Leberfunktionsstörung leiden,
- Sie an einer schweren Nierenfunktionsstörung leiden,
- Sie an Durchblutungsstörungen leiden, wie z.B. Raynaud-Syndrom (betrifft normalerweise die Finger) oder an einer Erkrankung der peripheren Gefässe, bei denen es zu einem Kältegefühl in Händen und Füssen oder einem kribbelnden Gefühl kommt,
- Sie sich einer Operation mit Vollnarkose unterziehen müssen,
- Sie eine Schilddrüsenüberfunktion aufweisen (Symptome sind Zittern, schnelle Herzfrequenz, Schwitzen und Gewichtsverlust),
- Sie Kontaktlinsen tragen (die verminderte Produktion von Tränenflüssigkeit wirkt sich möglicherweise negativ auf den Tragekomfort aus),
- Sie früher bereits Überempfindlichkeitsreaktionen hatten, eine Desensibilisierungstherapie erhalten oder ein hohes Allergierisiko aufweisen,
- Sie unter schweren Nebenwirkungen an der Haut leiden,
- Sie an Psoriasis leiden (schwere Hautausschläge),
- bei Ihnen ein Tumor der Nebenniere (Phäochromozytom) oder der Verdacht darauf besteht.
Wenn einer der oben genannten Umstände auf Sie zutrifft, sprechen Sie umgehend mit Ihrem Arzt bzw. Ihrer Ärztin vor oder während der Behandlung mit Carivalan.
Beenden Sie die Einnahme von Carivalan nie plötzlich, weil dies starke Veränderungen Ihrer Herzfrequenz oder Ihres Herzrhythmus verursachen und das Risiko für einen Herzanfall erhöhen kann.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie:
- an einer anderen Krankheit leiden,
- eine Allergie haben oder
- andere Arzneimittel (auch selbst gekaufte) einnehmen oder äusserlich anwenden!
Kinder und Jugendliche
Carivalan ist nicht für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren bestimmt.
Einnahme von Carivalan zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie andere Arzneimittel einnehmen oder kürzlich andere Arzneimittel eingenommen haben (auch Rezeptfreie Medikamente!).
Bestimmte Arzneimittel können die Wirkung von Carivalan beeinflussen oder können in ihrer Wirkung von Carivalan beeinflusst werden. Die Wirksamkeit eines der beiden oder beider Arzneimittel könnte durch dieser Art von Wechselwirkung verändert werden. Ausserdem ist möglicherweise das Risiko oder der Schweregrad unerwünschter Wirkungen erhöht.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie eines dieser Arzneimittel einnehmen:
- Fluconazol, Ketoconazol, Itraconazol (Arzneimittel zur Behandlung von Pilzinfektionen),
- Rifampicin (Antibiotikum),
- QT-verlängernde Arzneimittel, mit denen entweder Herzrhythmusstörungen oder andere Erkrankungen behandelt werden, z.B.:
- Chinidin, Disopyramid, Sotalol, Ibutilid, Amiodaron (Arzneimittel zur Behandlung von Herzrhythmusstörungen),
- Bepridil (Arzneimittel zur Behandlung von Angina pectoris),
- Pimozid, Ziprasidon, Sertindol (Arzneimittel zur Behandlung von Angstzuständen, Schizophrenie oder anderen Psychosen),
- Mefloquin, Halofantrin, Chinin (Arzneimittel zur Behandlung von Malaria),
- intravenös verabreichtes Erythromycin (Antibiotikum),
- Pentamidin (Arzneimittel zur Behandlung parasitärer Infektionen),
- Cisaprid (Arzneimittel zur Behandlung von Sodbrennen)
- Clonidin (Arzneimittel zur Behandlung von Bluthochdruck),
- Dihydropyridine (z.B. Nifedipin, Amlodipin, usw., die zur Behandlung von Bluthochdruck, Brustschmerzen aufgrund von Angina pectoris oder Raynaud-Syndrom verwendet werden),
- bestimmte harntreibende Arzneimittel, die eine Senkung des Kaliumspiegels im Blut verursachen können, wie z.B. Furosemid, Hydrochlorothiazid, Indapamid (angewandt zur Behandlung von Ödemen, Bluthochdruck und Herzinsuffizienz),
- andere Arzneimittel zur Behandlung von Bluthochdruck,
- Nitro-derivate (Arzneimittel zur Behandlung von Brustschmerzen aufgrund von Angina pectoris),
- Sympathomimetika (z.B. Arzneimittel zur Erhöhung des Blutdrucks und der Herzfrequenz oder zur Erweiterung der Atemwege, wie Adrenalin zur Behandlung schwerer allergischer Reaktionen oder β-2-Rezeptoragonisten zur Behandlung von Asthma),
- intravenös verabreichte Antiarrhythmika der Klassen IA und IC (Arzneimittel zur Behandlung von Herzrhythmusstörungen),
- Antiarrhythmika (z.B. Verapamil, Diltazem oder Amiodaron),
- Barbiturate (Arzneimittel zur Behandlung von Schlafstörungen oder Epilepsie),
- Phenytoin (Arzneimittel zur Behandlung von Epilepsie),
- Haloperidol (Arzneimittel zur Behandlung von Psychosen),
- Cimetidin (Arzneimittel zur Behandlung von Sodbrennen oder Magengeschwüren),
- Fluoxetin (Arzneimittel zur Behandlung von Depressionen),
- Hypericum perforatum oder Johanniskraut (pflanzliches Mittel zur Behandlung von Depressionen, unter anderem in Form von Kapseln, Tropfen und Tee),
- Reserpin, Guanethidin, Methyldopa, Guanfacin und Monoaminoxidase-Hemmer (Arzneimittel zur Behandlung von Depressionen und der Parkinson-Krankheit),
- Digoxin und Digitoxin (Arzneimittel zur Behandlung bestimmter Herzerkrankungen),
- Ciclosporin (wird nach einer Organtransplantation angewandt),
- Erythromycin (Antibiotikum)
- Insulin und Antidiabetika (Arzneimittel zur Behandlung des Diabetes),
- muskelentspannende Mittel, die während einer Narkose angewandt werden oder in Narkosemitteln enthalten sind (informieren Sie Ihren Arzt vor jeder Operation),
- β-agonistische Bronchodilatatoren (Arzneimittel zur Behandlung von Asthma),
- nichtsteroidale Antirheumatika (NSAR) (Arzneimittel zur Minderung von Entzündungen, Fieber und Schmerzen, z.B. Acetylsalicylsäure oder Ibuprofen),
- Östrogene (weibliche Geschlechtshormone, die zur Empfängnisverhütung oder bei einer Hormonersatztherapie angewandt werden),
- Kortikosteroide (Arzneimittel zur Behandlung unterschiedlicher Krankheiten wie Asthma, Hautentzündungen usw.),
- Ergotamin (Arzneimittel zur Behandlung von Migräne),
- andere Betablocker (z.B. in Form von Augentropfen).
Informieren Sie Ihren Arzt bzw. Ihre Ärztin darüber, dass Sie Carivalan einnehmen, wenn Sie operiert werden sollen und ein Narkosemittel benötigen.
Nehmen Sie aus eigener Initiative keine anderen Arzneimittel, denn bestimmte Kombinationen müssen vermieden werden.
Einnahme von Carivalan zusammen mit Nahrungsmitteln, Getränken und Alkohol
Vermeiden Sie Grapefruitsaft während der Behandlung mit Carivalan. Schränken Sie den Alkoholkonsum während der Behandlung mit dem Arzneimittel ein.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Carivalan kann vorübergehend visuelle Lichtphänomene (eine zeitweilige Helligkeit im Sichtfeld) verursachen (siehe Abschnitt «Welche Nebenwirkungen kann Carivalan haben?»). Falls Sie davon betroffen sind, seien Sie im Verkehr und beim Bedienen von Maschinen dann vorsichtig, wenn plötzliche Veränderungen der Lichtstärke auftreten können, besonders wenn Sie während der Nacht fahren.
Seien Sie auch vorsichtig, wenn Sie Carivalan zusammen mit Alkohol einnehmen, oder wenn Sie auf ein anderes Arzneimittel umstellen, da dies Ihre Fahrtüchtigkeit oder Fähigkeit zum Bedienen von Maschinen beeinflussen kann.
Falls Sie sich nach Einnahme der Tabletten schwindlig fühlen, müde sind oder Kopfschmerzen haben, führen Sie kein Fahrzeug und bedienen Sie keine Maschinen.
Carivalan enthält Laktose
Bitte nehmen Sie Carivalan erst nach Rücksprache mit Ihrem Arzt bzw. Ihrer Ärztin ein, wenn Ihnen bekannt ist, dass Sie unter einer Zuckerunverträglichkeit leiden.
Wenn Sie an einer Galaktose-Unverträglichkeit, einem Lapp-Laktase-Mangel oder einer Glukose- oder Galaktose-Malabsorption (seltene Erbkrankheiten) leiden, sollten Sie dieses Arzneimittel nicht einnehmen.
Darf Carivalan während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Nehmen Sie Carivalan nicht ein, wenn Sie schwanger sind, oder wenn Sie vermuten, schwanger zu sein, oder beabsichtigen, schwanger zu werden oder wenn Sie stillen (siehe Abschnitt «Wann darf Carivalan nicht eingenommen werden?»).
Dieses Arzneimittel darf während einer Schwangerschaft nicht eingenommen werden. Wenn Sie schwanger werden möchten oder eine Schwangerschaft festgestellt wurde, muss Ihr Arzt bzw. Ihre Ärztin die Behandlung so bald wie möglich umstellen. Wenn Sie schwanger sind und Carivalan eingenommen haben, wenden Sie sich an Ihren Arzt bzw. Ihre Ärztin.
Nehmen Sie Carivalan nicht ein, wenn Sie schwanger werden könnten, es sei denn, Sie wenden eine zuverlässige Verhütungsmethode an (siehe Abschnitt «Wann darf Carivalan nicht eingenommen werden?»).
Nehmen Sie Carivalan nicht ein, wenn Sie stillen. Sprechen Sie umgehend mit Ihrem Arzt bzw. Ihrer Ärztin, wenn Sie stillen oder beabsichtigen zu stillen.
Wie verwenden Sie Carivalan?
Nehmen Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin ein. Fragen Sie bei Ihrem Arzt oder Apotheker bzw. Ihrer Ärztin oder Apothekerin nach, wenn Sie sich nicht sicher sind.
Erwachsene
Die Tablette muss zweimal täglich eingenommen werden, einmal am Morgen und einmal am Abend.
Carivalan muss mit den Mahlzeiten eingenommen werden.
Kinder und Jugendliche
Carivalan ist nicht für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren bestimmt.
Ändern Sie die verschriebene Dosierung nicht von sich aus. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Wenn Sie eine grössere Menge von Carivalan eingenommen haben, als Sie sollten:
Wenn Sie mehr Tabletten als verordnet eingenommen haben, wenden Sie sich umgehend an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Die wahrscheinlichsten Auswirkungen sind Schwindelgefühl, Ohnmachtsgefühl, Müdigkeit und Atemnot aufgrund einer langsameren Herzfrequenz.
Wenn Sie die Einnahme von Carivalan vergessen haben:
Wenn Sie die Einnahme von Carivalan vergessen haben, nehmen Sie die nächste Dosis zur üblichen Zeit ein. Nehmen Sie nicht die doppelte Menge ein, wenn Sie die vorherige Einnahme vergessen haben.
Wenn Sie die Einnahme von Carivalan abbrechen:
Da die Behandlung einer Angina pectoris oder einer chronischen Herzinsuffizienz üblicherweise lebenslang erfolgt, wenden Sie sich an Ihren Arzt bzw. Ihre Ärztin, bevor Sie die Behandlung mit diesem Arzneimittel abbrechen.
Beenden Sie die Einnahme von Carivalan nicht plötzlich. Dies kann starke Veränderungen Ihrer Herzfrequenz oder Ihres Herzrhythmus verursachen und das Risiko für einen Herzanfall erhöhen. Eine Dosisänderung oder das Absetzen der Behandlung darf nur in Absprache mit Ihrem Arzt bzw. Ihrer Ärztin erfolgen.
Wenn Sie weitere Fragen zur Einnahme dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Carivalan haben?
Bei der Einnahme von Carivalan können Nebenwirkungen auftreten.
Falls Sie Schwellungen im Gesicht, an den Lippen, der Zunge oder im Rachen, Atem- oder Schluckbeschwerden bemerken (Angioödem, kann bis zu 1 von 100 Personen betreffen), wenden Sie sich umgehend an Ihren Arzt bzw. Ihre Ärztin oder an die Notaufnahme des nächstgelegenen Spitals.
Suchen Sie Ihren Arzt bzw. Ihre Ärztin auf, falls folgende Umstände auftreten: schnelle, unregelmässige Kontraktionen des Herzens, eine ungewöhnliche Wahrnehmung des Herzschlags, abnormal schnelle Herzschläge, eine ungewöhnlich langsame Herzkontraktion, ein nicht einstellbarer Blutdruck, Kopfschmerzen, Schwindelgefühl, verschwommene Sicht (undeutliches Sehen), ein ungewöhnliches Absinken des Blutzuckerspiegels.
Nach absteigender Häufigkeit geordnet, können folgende Nebenwirkungen auftreten:
Sehr häufig (kann mehr als 1 von 10 Personen betreffen): visuelle Lichtphänomene (kurze Momente erhöhter Helligkeit, meist verursacht durch plötzlichen Wechsel der Lichtstärke). Diese können auch als Lichtkranz um eine Lichtquelle, farbige Blitze, Bildauflösung oder Mehrfachbilder beschrieben werden. Kopfschmerzen, Schwindelgefühl, Herzproblem, das zu Kurzatmigkeit oder Anschwellen der Füsse oder Beine aufgrund von Flüssigkeitsansammlung führen kann (Herzinsuffizienz), niedriger Blutdruck (Anzeichen sind unter anderem vorübergehender Schwindel oder Benommenheit), allgemeine Schwäche, Müdigkeitsgefühl.
Häufig (kann bis zu 1 von 10 Personen betreffen): Infektionen in Lunge oder Brust, wie Bronchitis oder Lungenentzündung und Infektionen der oberen Atemwege, Harnwegsinfektionen, verringerte Anzahl roter Blutkörperchen (Anzeichen sind unter anderem Müdigkeit, blasse Haut, Herzklopfen und Kurzatmigkeit bei Anstrengung), erhöhter Cholesterinspiegel im Blut, erhöhter Blutzuckerspiegel (Diabetes), Verlust der Blutzuckerkontrolle bei Diabetikern, Gewichtszunahme, Depressionen oder depressive Stimmung, verringerter Tränenfluss (trockene Augen), Sehstörungen, Augenreizung, verschwommene Sicht (undeutliches Sehen), Ansammlung von Flüssigkeit im Körper (Anzeichen sind unter anderem Schwellungen am ganzen Körper, Schwellungen an vereinzelten Körperstellen wie z.B. Händen, Füssen, Knöcheln und Beinen sowie Anstieg des Blutvolumens in Ihrem Körper), Ansammlung von Flüssigkeit in den Lungen, Veränderung der Herzfunktion (Symptome sind eine Verlangsamung der Herzfrequenz), Herzblock (unregelmässiger Herzschlag), unregelmässige, schnelle Kontraktion des Herzens, abnormal schnelle Herzschläge, Gefühl von Schwindel, Benommenheit oder Ohnmacht beim schnellen Aufstehen oder Aufsetzen, Probleme mit dem Blutkreislauf wie kalte Hände und Füsse, Verstopfung der grossen Arterien in Armen und Beinen, Verschlechterung der Symptome bei Patienten mit Raynaud-Syndrom (Kribbeln und Farbveränderungen [weiss, blau, dann rot] an den Fingern und Zehen bei Kälte) oder Claudicatio intermittens (Beinschmerzen, die sich beim Gehen verschlimmern), unkontrollierter Blutdruck, Kurzatmigkeit, Asthma, Übelkeit, Bauchschmerzen, Verdauungsstörungen, Durchfall, Erbrechen, Gliederschmerzen, Erkrankung mit schmerzhaft geschwollenen Gelenken, verursacht durch Harnsäurekristalle (Gicht), Störungen bei der Harnausscheidung: verzögerter Beginn des Harnstrahls, unregelmässiger Harnstrahl oder Harninkontinenz sowie veränderte Häufigkeit des Wasserlassens, Nierenversagen, Schmerzen.
Gelegentlich (kann bis zu 1 von 100 Personen betreffen): Anstieg des Anteils einiger Arten weisser Blutkörperchen, erhöhter Harnsäurespiegel im Blut, Schlafstörungen mit Albträumen, Verwirrtheit, Ohnmacht (Synkope), Muskelschwäche, verschwommene Sicht und Ohnmachtsgefühl (Präsynkope), Kribbeln oder Taubheitsgefühl in Händen oder Füssen, Doppelsehen, verringerte Sehschärfe, Schmerzen oder unangenehmes Gefühl im Brustkorb, Herzklopfen, Veränderungen der Herzfrequenz (schnell, langsam), unregelmässige Herzschläge, die lebensbedrohlich sein können, Verstopfung, bestimmte Hautreaktionen (Hautausschlag, Nesselsucht, Juckreiz, vermehrtes Schwitzen, schuppen- oder knötchenförmige Hautläsionen), Haarausfall, Schwellung des Gesichts, der Lippen, der Zunge oder des Rachens, was zu Atem- oder Schluckbeschwerden führen kann (Angioödem), Muskelkrämpfe, erhöhte Kreatininwerte (ein Abbauprodukt der Muskeln) im Blut, ungewöhnliche EKG-Aufzeichnungen, sexuelle Funktionsstörung, Impotenz (Unfähigkeit, eine Erektion zu bekommen oder aufrechtzuerhalten).
Selten (kann bis zu 1 von 1'000 Personen betreffen): Anfälligkeit für Blutungen oder Blutergüssen grösser als normal (geringe Anzahl an Blutplättchen), verstopfte Nase, (Pfeifatmung), Mundtrockenheit, Rötung der Haut, Unwohlsein.
Sehr selten (kann bis zu 1 von 10'000 Personen betreffen): niedrige Zahl weisser Blutkörperchen, auffällige Werte bei Leberfunktionstests, Herzrhythmusstörungen (atrioventrikulärer Block zweiten oder dritten Grades, Sick-Sinus-Syndrom), schwere Hautreaktionen, runde, unregelmässig geformte rote Hautflecken an Händen und Armen (Erythema multiforme), schwere Form von Hautausschlag mit Hautrötung, Fieber, Blasen oder Geschwüren (Stevens-Johnson-Syndrom), schwerer Ausschlag mit Rötung, Schälung und Schwellung der Haut wie nach einem schweren Verbrennen (toxische epidermale Nekrolyse), Unfähigkeit bei Frauen, den Harnfluss zu kontrollieren.
Wenn eine der aufgeführten unerwünschten Wirkungen Sie erheblich beeinträchtigt, informieren Sie bitte Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Ausser Reichweite von Kindern aufbewahren.
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Nicht über 30 °C lagern.
Arzneimittel dürfen nicht im Abwasser oder Haushaltsabfall entsorgt werden. Fragen Sie Ihren Apotheker bzw. Ihre Apothekerin, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Carivalan enthalten?
Wirkstoffe:
Die Wirkstoffe sind: Carvedilol und Ivabradin (als Ivabradinhydrochlorid).
Hilfsstoffe:
Die sonstigen Bestandteile sind: Tablettenkern: vorverkleisterte Stärke (Mais), Laktose-Monohydrat, mikrokristalline Zellulose, Natrium-Croscarmellose, Maltodextrin, hochdisperses Siliziumdioxid und Magnesiumstearat. Filmüberzug: Glyzerin, Hypromellose, Magnesiumstearat, Macrogol 6000, Titandioxid (E171 [weisse Filmtablette]) oder gelbes Eisenoxid (E172 [gelbe Filmtablette]).
Carivalan 6,25 mg/5 mg:
Jede Filmtablette enthält 6,25 mg Carvedilol und 5 mg Ivabradin (als Ivabradinhydrochlorid) sowie Hilfsstoffe.
(Weisse, hexagonale Filmtablette [längste Diagonale 7,3 mm], auf einer Seite «CI2» und auf der anderen Seite « » eingraviert.)
» eingraviert.)
Carivalan 6,25 mg/7,5 mg:
Jede Filmtablette enthält 6,25 mg Carvedilol und 7,5 mg Ivabradin (als Ivabradinhydrochlorid) sowie Hilfsstoffe.
(Gelbe, hexagonale Filmtablette [längste Diagonale 7,3 mm], auf einer Seite «CI3» und auf der anderen Seite « » eingraviert.)
» eingraviert.)
Carivalan 12,5 mg/5 mg:
Jede Filmtablette enthält 12,5 mg Carvedilol und 5 mg Ivabradin (als Ivabradinhydrochlorid) sowie Hilfsstoffe.
(Weisse, elliptische Filmtablette [10,6 mm × 5,3 mm], auf einer Seite «CI4» und auf der anderen Seite « » eingraviert.)
» eingraviert.)
Carivalan 12,5 mg/7,5 mg:
Jede Filmtablette enthält 12,5 mg Carvedilol und 7,5 mg Ivabradin (als Ivabradinhydrochlorid) sowie Hilfsstoffe.
(Gelbe, elliptische Filmtablette [10,6 mm × 5,3 mm], auf einer Seite «CI5» und auf der anderen Seite « » eingraviert.)
» eingraviert.)
Carivalan 25 mg/5 mg:
Jede Filmtablette enthält 25 mg Carvedilol und 5 mg Ivabradin (als Ivabradinhydrochlorid) sowie Hilfsstoffe.
(Weisse, oktogonale Filmtablette [7,8 mm Durchmesser], auf einer Seite «CI6» und auf der anderen Seite « » eingraviert.)
» eingraviert.)
Carivalan 25 mg/7,5 mg:
Jede Filmtablette enthält 25 mg Carvedilol und 7,5 mg Ivabradin (als Ivabradinhydrochlorid) sowie Hilfsstoffe.
(Gelbe, oktogonale Filmtablette [7,8 mm Durchmesser], auf einer Seite «CI7» und auf der anderen Seite « » eingraviert.)
» eingraviert.)
Zulassungsnummer
66213 (Swissmedic).
Wo erhalten Sie Carivalan? Welche Packungen sind erhältlich?
In Apotheken gegen ärztliche Verschreibung.
Carivalan 6,25 mg/5 mg, Filmtabletten in Blisterpackungen: Packungen mit 56 oder 112 Filmtabletten
Carivalan 6,25 mg/7,5 mg, Filmtabletten in Blisterpackungen: Packungen mit 56 oder 112 Filmtabletten
Carivalan 12,5 mg/5 mg, Filmtabletten in Blisterpackungen: Packungen mit 56 oder 112 Filmtabletten
Carivalan 12,5 mg/7,5 mg, Filmtabletten in Blisterpackungen: Packungen mit 56 oder 112 Filmtabletten
Carivalan 25 mg/5 mg, Filmtabletten in Blisterpackungen: Packungen mit 56 oder 112 Filmtabletten
Carivalan 25 mg/7,5 mg, Filmtabletten in Blisterpackungen: Packungen mit 56 oder 112 Filmtabletten
Zulassungsinhaberin
Servier (Suisse) S.A., 1242 Satigny.
Diese Packungsbeilage wurde im Oktober 2018 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
OEMéd
Qu’est-ce que Carivalan et quand doit-il être utilisé?
Carivalan est un médicament pour le cœur utilisé chez les patients adultes selon prescription du médecin:
- Dans le traitement symptomatique de l'angor stable ou «angine de poitrine» (une maladie qui provoque des douleurs thoraciques),
- Dans le traitement de l'insuffisance cardiaque chronique.
Au lieu de prendre les comprimés d'ivabradine et de carvédilol séparément vous recevrez à la place un comprimé de Carivalan qui contient les deux principes actifs aux mêmes doses.
Carivalan est une association de deux principes actifs: le carvédilol et l'ivabradine. Le carvédilol est une substance qui fait baisser la pression artérielle grâce à deux mécanismes: d'une part, il agit comme bêtabloquant en protégeant le cœur et la circulation des effets d'un stress excessif; d'autre part, il dilate les petits vaisseaux situés à la périphérie. L'ivabradine agit principalement en réduisant la fréquence cardiaque. Il en résulte une diminution des besoins du cœur en oxygène, particulièrement dans les situations au cours desquelles une crise d'angine de poitrine est susceptible de se produire. De cette façon, le carvédilol et l'ivabradine aident à contrôler et à réduire le nombre de crises d'angine de poitrine.
Quand Carivalan ne doit-il pas être utilisé?
Ne prenez jamais Carivalan:
- si vous êtes hypersensible (allergique) à carvédilol, ivabradine ou à l'un des autres composants de ce médicament (mentionnés dans la rubrique «Que contient Carivalan?»), ou à un autre bêtabloquant,
- si vous souffrez d'une maladie grave du foie,
- si vous souffrez d'une insuffisance cardiaque mal contrôlée ou qui s'est récemment aggravée; si vous avez reçu un traitement avec des agonistes des bêta-récepteurs tels que la dobutamine pour l'insuffisance cardiaque,
- si vous souffrez d'un angor instable (une forme sévère d'angine de poitrine dans laquelle la douleur dans la poitrine est très fréquente, avec ou sans effort),
- si vous souffrez d'angor de Prinzmetal (douleur thoracique qui survient au repos et par cycles),
- si vous souffrez d'un trouble du rythme cardiaque, d'un rythme cardiaque irrégulier,
- si votre fréquence cardiaque au repos avant le traitement est trop lente. Le traitement par ivabradine ne doit pas être initié si votre fréquence cardiaque au repos est inférieure à 70 pulsations par minute,
- si vous vous sentez faible, si vous présentez un niveau de conscience abaissé, un essoufflement, une hypotension ou des douleurs dans la poitrine (en raison d'une bradycardie symptomatique ou sévère),
- si vous venez de subir une attaque cardiaque,
- si vous souffrez d'un choc cardiogénique (affection cardiaque grave due à une pression artérielle très basse, nécessitant une hospitalisation),
- si votre fréquence cardiaque est exclusivement imposée par un pacemaker,
- si vous êtes atteint d'une maladie sévère des vaisseaux sanguins (par exemple maladie de Raynaud),
- si votre tension artérielle est très basse,
- si vous souffrez de bronchopneumopathie chronique obstructive ou BPCO (affection pulmonaire caractérisée par une respiration sifflante, des difficultés à respirer et une toux chronique),
- si vous avez déjà eu des troubles respiratoires tels qu'un asthme, une rhinite allergique ou un bronchospasme (difficulté à respirer due au rétrécissement des voies aériennes),
- si la teneur en acide de votre sang est trop élevée (acidose métabolique),
- si vous souffrez d'hypertension liée à une tumeur des glandes surrénales (phéochromocytome non traité),
- si vous prenez un inhibiteur de la MAO (médicament contre la dépression),
- si vous prenez déjà des médicaments pour le traitement de mycoses (comme kétoconazole ou itraconazole), des antibiotiques de la famille des macrolides (comme josamycine, clarithromycine, télithromycine ou érythromycine administrée par voie orale), des médicaments pour traiter une infection par le VIH (comme nelfinavir ou ritonavir), de néfazodone (traitement de la dépression), de diltiazem ou de vérapamil (utilisés tous les deux dans le traitement de l'hypertension artérielle ou de l'angine de poitrine), pendant une désensibilisation en raison d'une allergie,
- si vous êtes une femme en âge de procréer et n'utilisant pas une contraception efficace,
- si vous êtes enceinte ou essayez de l'être,
- si vous allaitez.
Chez certains patients, une métabolisation lente peut entraîner des concentrations accrues de carvédilol. Carivalan ne doit donc pas être administré chez ces patients, faute d'expérience en la matière.
Quelles sont les précautions à observer lors de la prise de Carivalan?
Ce médicament peut affecter les réactions, l'aptitude à la conduite et l'aptitude à utiliser des outils ou des machines ! En effet, Carivalan peut provoquer des symptômes visuels passagers (voir «Conduite de véhicules et utilisation de machines» et «Quels effets secondaires Carivalan peut-il provoquer?»).
Si vous êtes dans les cas suivants, prévenez votre médecin avant de prendre Carivalan:
- si vous souffrez de troubles du rythme cardiaque (tels que des battements du cœur irréguliers, des palpitations, une augmentation de la douleur dans la poitrine), d'une fibrillation auriculaire chronique (un type de battements cardiaques irréguliers) ou en cas d'anomalie de l'électrocardiogramme (ECG) appelée «syndrome du QT long»,
- si vous êtes atteint d'insuffisance cardiaque sévère ou d'insuffisance cardiaque accompagnée d'une anomalie de l'ECG appelée «bloc de branche»,
- si vous souffrez d'insuffisance cardiaque avec incapacité d'effectuer une activité physique sans gêne (les symptômes peuvent être présents même au repos et l'activité physique augmente la gêne),
- si vous présentez des symptômes de fibrillation auriculaire (comme une fréquence cardiaque de repos anormalement élevée ou irrégulière, sans raison apparente et rendant sa mesure difficile),
- si vous souffrez d'hypotension légère à modérée ou si vous présentez une pression artérielle non contrôlée, particulièrement après une modification de votre traitement antihypertenseur,
- si vous souffrez d'une insuffisance cardiaque ancienne associée à: une pression artérielle basse (<100 mmHg) ou une cardiopathie due à une diminution du flux sanguin dans les vaisseaux sanguins du muscle cardiaque ou une maladie endommageant les vaisseaux sanguins de gros et/ou de petit calibre ou des troubles rénaux,
- si vous présentez des symptômes tels que fatigue, étourdissement ou essoufflement (qui peuvent signifier que votre cœur bat trop lentement),
- si vous allez subir une cardioversion (procédure médicale permettant de ramener une fréquence cardiaque excessive ou irrégulière à un rythme normal),
- si vous avez fait récemment un accident vasculaire cérébral (attaque cérébrale),
- si vous souffrez d'hypertension secondaire à une autre affection,
- si vous présentez une chute de votre pression artérielle en vous mettant debout, si vous souffrez d'anomalies des valves cardiaques, de myocardite active (inflammation du cœur), d'anomalies cardiaques congénitales (depuis la naissance) ou d'une affection circulatoire au stade terminal dans laquelle le rétrécissement de vos artères diminue la circulation du sang dans vos membres,
- si vous prenez un médicament qui allonge l'intervalle QT pour traiter un trouble du rythme ou d'autres troubles (voir les produits listés dans la rubrique ci-dessous),
- si vous prenez déjà un antagoniste α1-adrénergique ou un agoniste α2-adrénergique,
- si vous souffrez d'une maladie chronique de la rétine de l'œil ou si votre vue se dégrade,
- si vous avez du diabète,
- si vous souffrez de troubles hépatiques modérés,
- si vous souffrez de troubles rénaux sévères,
- si vous avez des troubles de la circulation sanguine (par exemple maladie de Raynaud qui affecte généralement les doigts) ou une maladie vasculaire périphérique responsable d'une froideur des mains et des pieds ou de picotements/fourmillements,
- si vous devez subir une intervention chirurgicale nécessitant une anesthésie générale,
- si votre glande thyroïde est hyperactive (les symptômes sont des tremblements, une fréquence cardiaque rapide, des sueurs abondantes et un amaigrissement),
- si vous portez des lentilles de contact. La diminution de la production de larmes peut avoir une influence négative sur le confort lié au port des lentilles.
- si vous avez des antécédents de réactions d'hypersensibilité, si vous suivez un traitement de désensibilisation ou si vous avez un risque d'allergie important,
- si vous souffrez de réactions secondaires graves de la peau,
- si vous êtes atteint de psoriasis (éruption cutanée sévère),
- si vous avez ou êtes suspect d'avoir une tumeur des glandes surrénales (phéochromocytome).
Si vous êtes concernés par l'un des cas précités, parlez-en immédiatement à votre médecin avant ou pendant le traitement par Carivalan.
N'interrompez jamais brutalement votre traitement par Carivalan, cela peut entraîner des troubles graves du rythme ou de la fréquence cardiaques et augmenter le risque de crise cardiaque.
Veuillez informer votre médecin ou votre pharmacien si:
- vous souffrez d'une autre maladie,
- vous êtes allergique,
- vous prenez déjà d'autres médicaments en usage interne ou externe (même en automédication) !
Enfants et adolescents
Carivalan n'est pas destiné aux enfants, ni aux adolescents de moins de 18 ans.
Autres médicaments et Carivalan
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin ou à votre pharmacien.
Certains médicaments peuvent modifier l'effet de Carivalan ou leur effet peut être modifié par Carivalan. L'efficacité de l'un ou l'autre des médicaments ou des deux pourrait être altérée par ce type d'interaction. Par ailleurs, le risque ou la sévérité des effets indésirables pourrait être augmenté.
Informez votre médecin si vous prenez l'un des médicaments suivants:
- fluconazole, kétoconazole, itraconazole (antifongiques utilisés pour traiter les mycoses),
- rifampicine (un antibiotique),
- médicaments allongeant l'intervalle QT, utilisés pour traiter soit des troubles du rythme cardiaque soit d'autres pathologies, tels que:
- quinidine, disopyramide, sotalol, ibutilide, amiodarone (pour traiter les troubles du rythme cardiaque),
- bépridil (pour traiter l'angine de poitrine),
- pimozide, ziprasidone, sertindole (pour traiter l’anxiété, la schizophrénie ou d’autres psychoses),
- méfloquine, halofantrine et quinine (utilisées pour traiter le paludisme),
- érythromycine intraveineuse (un antibiotique),
- pentamidine (un anti-parasitaire),
- cisapride (pour traiter le reflux gastro-œsophagien).
- clonidine (utilisée pour traiter l'hypertension),
- dihydropyridines (p.ex. nifédipine, amlodipine, etc. utilisées pour traiter l'hypertension, la douleur thoracique associée à l'angine de poitrine ou le syndrome de Raynaud),
- certains types de diurétiques qui peuvent entraîner une diminution du taux de potassium dans le sang, tels que furosémide, hydrochlorothiazide, indapamide (utilisés pour traiter les œdèmes, l'hypertension artérielle et l'insuffisance cardiaque),
- d'autres médicaments utilisés pour traiter l'hypertension,
- dérivés nitrés (utilisés pour traiter la douleur thoracique associée à l'angine de poitrine),
- sympathomimétiques (par exemple, médicaments servant à augmenter la pression artérielle ou la fréquence cardiaque ou dilater les voies respiratoires, comme adrénaline utilisée dans le traitement des réactions allergiques sévères ou les bêta-2-agonistes utilisés dans le traitement de l'asthme),
- antiarythmiques intraveineux de classe IA ou IC (utilisés pour traiter des troubles du rythme cardiaque),
- antiarythmiques (p.ex. vérapamil, diltiazem ou amiodarone)
- barbituriques (pour traiter l'insomnie ou l'épilepsie),
- phénytoïne (pour traiter l'épilepsie),
- halopéridol (neuroleptique)
- cimétidine (utilisée pour traiter le reflux gastro-œsophagien et l'ulcère d'estomac),
- fluoxétine (un antidépresseur),
- Hypericum perforatum ou millepertuis (gélules, gouttes, tisanes, … pour traiter la dépression),
- réserpine, guanéthidine, méthyldopa, guanfacine et inhibiteurs de la monoamine oxydase (utilisés pour traiter des maladies telles que la dépression ou la maladie de Parkinson),
- digoxine et digitoxine (utilisées pour traiter certaines pathologies cardiaques),
- ciclosporine (utilisée après une greffe d'organe),
- érythromycine (antibiotique),
- insuline et antidiabétiques (utilisés pour traiter le diabète),
- relaxants musculaires utilisés en anesthésie ou agents anesthésiques (vous devez informer votre médecin avant toute intervention chirurgicale),
- bronchodilatateurs bêta-agonistes (utilisés pour traiter l'asthme),
- anti-inflammatoires non stéroïdiens (AINS) (utilisés pour atténuer l'inflammation, la fièvre et la douleur, p.ex. acide acétylsalicylique ou ibuprofène),
- œstrogènes (hormones féminines utilisées pour la contraception ou comme hormonothérapie substitutive),
- corticostéroïdes (utilisés pour traiter différents types de maladies telles que l'asthme, la dermatite, etc.),
- ergotamine (un antimigraineux),
- autres bêtabloquants (par exemple certaines gouttes pour les yeux).
Informez votre médecin que vous prenez Carivalan si vous devez subir une intervention chirurgicale nécessitant l'emploi d'un anesthésique.
Ne prenez pas de votre propre initiative d'autres médicaments, car certaines associations doivent être évitées.
Carivalan avec des aliments, boissons et alcool
Évitez le jus de pamplemousse pendant le traitement par Carivalan. Limitez la consommation d'alcool pendant le traitement par ce médicament.
Conduite de véhicules et utilisation de machines
Carivalan peut provoquer des phénomènes lumineux passagers (une luminosité temporaire dans le champ de vision) (voir «Quels effets secondaires Carivalan peut-il provoquer?»). Si cela se produit, soyez prudent lorsque vous conduisez ou lorsque vous utilisez des machines au moment où il y a un risque de brusque changement de luminosité, en particulier lors de la conduite de nuit.
Vous devez également être prudent en prenant Carivalan en même temps que de l'alcool ou en passant à un autre médicament car cela peut affecter votre aptitude à conduire des véhicules ou à utiliser des machines.
Si les comprimés provoquent chez vous des étourdissements, une fatigue ou des céphalées, ne conduisez pas et n'utilisez pas de machines.
Carivalan contient du lactose
Si votre médecin vous a informé d'une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
L'utilisation de ce médicament est déconseillée chez les patients présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares).
Carivalan peut-il être pris pendant la grossesse ou l’allaitement?
Ne prenez pas Carivalan si vous êtes enceinte, pensez l'être, envisagez une grossesse ou si vous allaitez (voir «Quand Carivalan ne doit-il pas être utilisé?»).
Ce médicament ne doit pas être pris durant la grossesse. Lorsqu'une grossesse est planifiée ou confirmée, le passage à un autre traitement doit être initié le plus tôt possible par votre médecin. Demandez conseil à votre médecin si vous êtes enceinte et avez pris Carivalan.
Ne prenez pas Carivalan si vous êtes en âge de procréer, sauf si vous utilisez des moyens de contraception efficaces (voir «Quand Carivalan ne doit-il pas être utilisé?»).
Ne prenez pas Carivalan si vous allaitez. Prévenez immédiatement votre médecin si vous allaitez ou si vous avez l'intention de commencer à allaiter.
Comment utiliser Carivalan?
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Adultes
La posologie recommandée est de deux comprimés de Carivalan par jour; un comprimé le matin et un comprimé le soir.
Carivalan doit être pris pendant les repas.
Enfants et adolescents
Carivalan n'est pas destiné aux enfants, ni aux adolescents de moins de 18 ans.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Si vous avez pris plus de Carivalan que vous n'auriez dû:
Si vous avez pris plus de comprimés que prévu, contactez immédiatement votre médecin ou votre pharmacien. Les effets les plus probables, dus au ralentissement de votre fréquence cardiaque, sont des étourdissements, une sensation d'évanouissement, une fatigue et des difficultés à respirer.
Si vous oubliez de prendre Carivalan:
Si vous avez oublié de prendre une dose de Carivalan, prenez la dose suivante au moment habituel. Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre.
Si vous arrêtez de prendre Carivalan:
Le traitement de l'angine de poitrine et de l'insuffisance cardiaque chronique étant généralement un traitement à vie, ne l'interrompez pas avant d'en avoir parlé à votre médecin.
N'arrêtez pas brutalement de prendre les comprimés de Carivalan car il peut en résulter des modifications sévères de votre rythme ou de votre fréquence cardiaque et une augmentation du risque de crise cardiaque. Ne modifiez la dose ou n'arrêtez le traitement qu'en accord avec votre médecin.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
Quels effets secondaires Carivalan peut-il provoquer?
La prise ou l'utilisation de Carivalan peut provoquer des effets indésirables.
Si vous remarquez un gonflement du visage, des lèvres, de la bouche, de la langue ou de la gorge, des difficultés à respirer ou à déglutir (angio-œdème, peut affecter jusqu'à 1 personne sur 100) contactez immédiatement votre médecin ou les urgences.
Consultez votre médecin en cas de contraction rapide et irrégulière du cœur, perception anormale des battements cardiaques, battements cardiaques anormalement rapides, de contraction anormalement lente du cœur, de pression artérielle non contrôlée, maux de tête, sensations vertigineuses, vision trouble (vision floue), de baisse anormale du taux de sucre dans le sang.
Par ordre décroissant de fréquence, les effets secondaires peuvent inclure:
Très fréquent (peut affecter plus d'1 personne sur 10): phénomènes visuels lumineux (courts moment de luminosité accrue, le plus souvent provoqués par des changements brusques de la lumière). Ils peuvent également être décrits comme un halo, des flashs colorés, une décomposition de l'image ou des images multiples. Maux de tête, vertiges, trouble cardiaque pouvant être responsable d'un essoufflement ou d'un gonflement des pieds ou des jambes en raison d'une accumulation de liquide (insuffisance cardiaque), hypotension (les signes en sont des étourdissements ou des lipothymies (malaises passagers sans perte de connaissance)), une faiblesse généralisée et une sensation de fatigue.
Fréquent (peut affecter jusqu'à 1 personne sur 10): infections pulmonaires ou thoraciques: bronchite, pneumonie ou infection des voies aériennes supérieures, infections urinaires, diminution du nombre des globules rouges (qui se traduit par une sensation de fatigue, une pâleur de la peau, des palpitations et un essoufflement à l'effort), augmentation du taux sanguin de cholestérol, augmentation du taux sanguin de sucre (diabète), perte de contrôle de la glycémie chez les diabétiques, prise de poids, dépression ou humeur dépressive, diminution de la sécrétion lacrymale (œil sec), troubles de la vue, irritation oculaire, vision trouble (nuageuse), rétention liquidienne (qui se traduit par un gonflement global du corps, un gonflement de certaines parties du corps, par exemple les mains, les pieds, les chevilles ou les jambes, et une augmentation de votre volume sanguin total), accumulation de liquide dans les poumons, modification du fonctionnement du cœur (les symptômes sont un ralentissement de la fréquence cardiaque), pauses cardiaques (battements cardiaques irréguliers), contraction irrégulière et rapide du cœur, battements cardiaques anormalement rapides, sensation d'étourdissements, de lipothymies (malaises passagers sans perte de connaissance) ou de syncope en se mettant debout ou en se levant rapidement, troubles de la circulation sanguine tels qu'une froideur des mains ou des pieds, oblitération des grosses artères des bras ou des jambes, aggravation des symptômes chez les patients souffrant d'une maladie de Raynaud (picotements et changement de couleur des doigts et des orteils (blancs, bleus puis rouges) lors d'une exposition au froid) ou claudication intermittente (douleur des membres inférieurs aggravée par la marche), pression artérielle non contrôlée, essoufflement, asthme, sensation de mal-être (nausées), douleurs abdominale, digestion difficile, diarrhée, vomissements, douleurs des membres, maladie caractérisée par des articulations tuméfiées et douloureuses, due à des cristaux d'acide urique (goutte), troubles urinaires: retard de l'émission du jet, jet irrégulier ou incontinence d'urine ou troubles de la fréquence mictionnelle, défaillance rénale, douleur.
Occasionnel (peut affecter jusqu'à 1 personne sur 100): augmentation du pourcentage de certains globules blancs, augmentation du taux d'acide urique dans le sang, troubles du sommeil avec cauchemars et confusion mentale, évanouissement (syncope), faiblesse musculaire, vision trouble et sensation d'évanouissement (pré-syncope), fourmillements ou engourdissement des mains ou des pieds, vision double, diminution de l'acuité visuelle, douleur ou sensation de gêne dans la poitrine, palpitations, variations de la fréquence cardiaque (rapide, lente), battements cardiaques irréguliers pouvant mettre en jeu le pronostic vital, constipation, certaines réactions cutanées (éruption cutanée, urticaire, démangeaisons, transpiration abondante, lésions cutanées psoriasiformes ou lichénoïdes), chute des cheveux, gonflement de la face, des lèvres, de la langue ou de la gorge, pouvant entraîner des difficultés à respirer ou à déglutir (angio-œdème), crampes musculaires, élévation de la créatinine dans le sang (produit de dégradation des muscles), anomalies des tracés ECG, dysfonction sexuelle, impuissance (impossibilité d'avoir ou de maintenir une érection).
Rare (peut affecter jusqu'à 1 personne sur 1000): susceptibilité aux saignements ou aux contusions supérieure à la normale (nombre de plaquettes sanguines bas), nez bouché, respiration sifflante, bouche sèche, rougeur de la peau, sensation de malaise.
Très rares (peuvent affecter jusqu'à 1 patient sur 10'000): faible nombre de globules blancs, anomalies des tests hépatiques, troubles du rythme cardiaque (bloc atrio-ventriculaire du deuxième ou du troisième degré, maladie du sinus), réactions cutanées sévères, plaques rouges, irrégulières et circulaires sur la peau des mains et des bras (érythème polymorphe), forme sévère d'éruption cutanée avec bouffées vasomotrices, fièvre, ampoules ou ulcérations (syndrome de Stevens-Johnson); éruption cutanée sévère avec rougeur, desquamation et gonflement de la peau comparables à des brûlures sévères (nécrose épidermique toxique), incapacité à contrôler l'émission d'urine chez la femme.
Si vous ressentez l'un des effets mentionnés comme grave veuillez en informer votre médecin ou votre pharmacien.
Si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
A quoi faut-il encore faire attention?
Tenir ce médicament hors de portée des enfants.
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur la boîte.
Ne pas conserver au-dessus de 30 °C.
Les médicaments ne doivent pas être jetés au tout à l'égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu'il faut faire des médicaments inutilisés.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien qui disposent d'une information détaillée destinée aux professionnels.
Que contient Carivalan?
Principes actifs:
Les substances actives sont le carvédilol et l'ivabradine (sous forme de chlorhydrate d'ivabradine).
Excipients:
Les autres composants (excipients) sont: Noyau: amidon prégélatinisé, lactose monohydraté, cellulose microcristalline, croscarmellose sodique, maltodextrine, silice colloïdale, stéarate de magnésium, Pelliculage: glycérol, hypromellose, stéarate de magnésium, macrogol 6000, dioxyde de titane (E171 (comprimé pelliculé de couleur blanche)) ou oxyde de fer jaune (E172 (comprimé pelliculé de couleur jaune)).
Comprimés pelliculés Carivalan 6,25 mg/5 mg:
Un comprimé pelliculé contient 6,25 mg de carvédilol et 5 mg d'ivabradine (sous forme de chlorhydrate d'ivrabadine) et des excipients.
(Comprimé pelliculé de couleur blanche, de forme hexagonale (plus grande diagonale 7,3 mm), gravé «CI2» sur une face et « » sur l'autre face.)
» sur l'autre face.)
Comprimés pelliculés Carivalan 6,25 mg/7,5 mg:
Un comprimé pelliculé contient 6,25 mg de carvédilol et 7,5 mg d'ivabradine (sous forme de chlorhydrate d'ivrabadine) et des excipients.
(Comprimé pelliculé de couleur jaune, de forme hexagonale (plus grande diagonale 7,3 mm), gravé «CI3» sur une face et « » sur l'autre face.)
» sur l'autre face.)
Comprimés pelliculés Carivalan 12,5 mg/5 mg:
Un comprimé pelliculé contient 12,5 mg de carvédilol et 5 mg d'ivabradine (sous forme de chlorhydrate d'ivrabadine) et des excipients.
(Comprimé pelliculé de couleur blanche, de forme elliptique (10,6 mm × 5,3 mm), gravé «CI4» sur une face et « » sur l'autre face.)
» sur l'autre face.)
Comprimés pelliculés Carivalan 12,5 mg/7,5 mg:
Un comprimé pelliculé contient 12,5 mg de carvédilol et 7,5 mg d'ivabradine (sous forme de chlorhydrate d'ivrabadine) et des excipients.
(Comprimé pelliculé de couleur jaune, de forme elliptique (10,6 mm × 5,3 mm), gravé «CI5» sur une face et « » sur l'autre face.)
» sur l'autre face.)
Comprimés pelliculés Carivalan 25 mg/5 mg:
Un comprimé pelliculé contient 25 mg de carvédilol et 5 mg d'ivabradine (sous forme de chlorhydrate d'ivrabadine) et des excipients.
(Comprimé pelliculé de couleur blanche, de forme octogonale (diamètre 7,8 mm), gravé «CI6» sur une face et « » sur l'autre face.)
» sur l'autre face.)
Comprimés pelliculés Carivalan 25 mg/7,5 mg:
Un comprimé pelliculé contient 25 mg de carvédilol et 7,5 mg d'ivabradine (sous forme de chlorhydrate d'ivrabadine) et des excipients.
(Comprimé pelliculé de couleur jaune, de forme octogonale (diamètre 7,8 mm), gravé «CI7» sur une face et « » sur l'autre face.)
» sur l'autre face.)
Numéro d’autorisation
66213 (Swissmedic).
Où obtenez-vous Carivalan? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Carivalan 6,25 mg/5 mg, comprimés pelliculés en blister: boîtes de 56 ou 112 comprimés
Carivalan 6,25 mg/7,5 mg, comprimés pelliculés en blister: boîtes de 56 ou 112 comprimés
Carivalan 12,5 mg/5 mg, comprimés pelliculés en blister: boîtes de 56 ou 112 comprimés
Carivalan 12,5 mg/7,5 mg, comprimés pelliculés en blister: boîtes de 56 ou 112 comprimés
Carivalan 25 mg/5 mg, comprimés pelliculés en blister: boîtes de 56 ou 112 comprimés
Carivalan 25 mg/7,5 mg, comprimés pelliculés en blister: boîtes de 56 ou 112 comprimés
Titulaire de l’autorisation
Servier (Suisse) S.A., 1242 Satigny.
Cette notice d'emballage a été vérifiée pour la dernière fois en Octobre 2018 par l'autorité de contrôle des médicaments (Swissmedic).
OOMed
Che cos’è Carivalan e quando si usa?
Carivalan è un medicamento per il cuore utilizzato nei pazienti adulti secondo prescrizione medica:
- Per il trattamento sintomatico dell'angina stabile o «angina pectoris» (una malattia che provoca dolori toracici);
- Per il trattamento dell'insufficienza cardiaca cronica.
Invece di assumere le compresse di ivabradina e di carvedilolo separatamente, riceverà in sostituzione una compressa di Carivalan che contiene i due principi attivi ai medesimi dosaggi.
Carivalan contiene una associazione di due principi attivi: il carvedilolo e l'ivabradina. Il carvedilolo è una sostanza che fa abbassare la pressione arteriosa mediante due meccanismi: da una parte, agisce come betabloccante proteggendo il cuore e la circolazione dagli effetti di uno stress eccessivo; dall'altra, dilata i piccoli vasi periferici. L'ivabradina agisce principalmente riducendo la frequenza cardiaca. Ne risulta una diminuzione delle necessità di ossigeno del cuore, particolarmente nelle situazioni in cui è probabile che si verifichi una crisi di angina pectoris. In questo modo, il carvedilolo e l'ivabradina aiutano a controllare e a ridurre il numero di crisi di angina pectoris.
Quando non si può assumere Carivalan?
Non assuma mai Carivalan:
- in caso di ipersensibilità (allergia) a carvedilolo, ivabradina o uno degli altri componenti di questo medicamento (indicati nella sezione «Cosa contiene Carivalan?») o a un altro betabloccante;
- se è affetto da una malattia grave del fegato;
- se è affetto da insufficienza cardiaca mal controllata o recentemente aggravata; se ha ricevuto un trattamento con agonisti dei beta-recettori quali la dobutamina per l'insufficienza cardiaca;
- se è affetto da angina instabile (una grave forma di angina pectoris in cui il dolore al petto è molto frequente, con o senza sforzo);
- se è affetto da angina di Prinzmetal (dolore toracico che si presenta a riposo e a cicli);
- se è affetto da un problema del ritmo cardiaco, da un ritmo cardiaco irregolare;
- se la sua frequenza cardiaca a riposo prima del trattamento è troppo lenta. Il trattamento con ivabradina non deve essere iniziato se la sua frequenza cardiaca a riposo è inferiore a 70 pulsazioni al minuto;
- se si sente debole, se presenta un stato di coscienza ridotto, fiato corto, ipotensione o dolori al petto (a causa di una bradicardia sintomatica o grave);
- se ha da poco subito un attacco cardiaco;
- se è affetto da uno shock cardiogeno (grave malattia cardiaca con pressione arteriosa molto bassa, che richiede il ricovero ospedaliero);
- se la sua frequenza cardiaca è imposta esclusivamente da un pacemaker;
- se è affetto da una malattia grave dei vasi sanguigni (ad esempio, malattia di Raynaud);
- se presenta una tensione arteriosa molto bassa;
- se soffre di broncopneumopatia cronica ostruttiva (BPCO), affezione polmonare caratterizzata da una respirazione sibilante, difficoltà respiratorie e tosse cronica;
- se è già stato affetto da problemi respiratori quali asma, rinite allergica o broncospasmo (difficoltà respiratorie da restringimento delle vie aeree);
- se il tenore in acido del suo sangue è troppo elevato (acidosi metabolica);
- se è affetto da ipertensione provocata da un tumore delle ghiandole surrenali (feocromocitoma non trattato);
- se assume un inibitore della MAO (medicamento contro la depressione);
- se già assume medicamenti per il trattamento di micosi (quali ketoconazolo o itraconazolo), antibiotici della famiglia dei macrolidi (quali josamicina, claritromicina, telitromicina o eritromicina somministrata per via orale), medicamenti per il trattamento di un'infezione da HIV (quali nelfinavir o ritonavir), nefazodone (trattamento della depressione), diltiazem o verapamil (utilizzati entrambi nel trattamento dell'ipertensione arteriosa o dell'angina pectoris);
- durante una desensibilizzazione a causa di un'allergia;
- se è una donna in età fertile e non utilizza misure contraccettive efficaci;
- se è incinta o sta programmando una gravidanza;
- se sta allattando.
In alcuni pazienti, un metabolismo lento può portare a concentrazioni aumentate di carvedilolo. Carivalan non deve dunque essere somministrato in tali pazienti, per la mancanza di esperienza in questo campo.
Quando è richiesta prudenza nell’uso di Carivalan?
Questo medicamento può interferire con le reazioni, l'attitudine alla guida e l'attitudine all'utilizzo di strumenti o macchine! In effetti, Carivalan può provocare sintomi visivi transitori (vedere «Conduzione di veicoli e uso di macchine» e «Quali effetti collaterali può avere Carivalan?»).
Informi il suo medico se lei è in una delle seguenti condizioni, prima di assumere Carivalan:
- se è affetto da problemi del ritmo cardiaco (quali battiti cardiaci irregolari, palpitazioni, aumento del dolore al petto), da una fibrillazione atriale cronica (un tipo di battiti cardiaci irregolari) o in caso di anomalia dell'elettrocardiogramma (ECG) denominata «sindrome del QT lungo»;
- se è affetto da insufficienza cardiaca grave o da insufficienza cardiaca accompagnata da un'anomalia dell'ECG denominata «blocco di branca»;
- se è affetto da insufficienza cardiaca con incapacità a eseguire un'attività fisica con facilità (i sintomi possono essere presenti anche a riposo e l'attività fisica aumenta il disagio);
- se presenta sintomi di fibrillazione atriale (quali una frequenza cardiaca a riposo elevata in modo anomalo o irregolare, senza motivi apparenti e di difficile misurazione);
- se è affetto da ipotensione da leggera a moderata o se presenta una pressione arteriosa non controllata, particolarmente dopo una modifica del suo trattamento antipertensivo;
- se è affetto da molto tempo da insufficienza cardiaca associata a: una pressione arteriosa bassa (<100 mmHg) o una cardiopatia dovuta a diminuzione del flusso sanguigno nei vasi sanguigni del muscolo cardiaco o una malattia che danneggia i vasi sanguigni di grosso e/o piccolo calibro o da problemi renali;
- se presenta sintomi quali affaticamento, stordimento o fiato corto (che possono significare che il suo cuore batte troppo lentamente);
- se deve sottoporsi a una cardioversione (procedura medicale che consente di riportare una frequenza cardiaca eccessiva o irregolare a un ritmo normale);
- se ha subito di recente un incidente vascolare cerebrale (attacco cerebrale);
- se è affetto da ipertensione secondaria a un'altra affezione;
- se manifesta un calo della pressione arteriosa quando si alza dal letto,
- se è affetto da anomalie delle valvole cardiache, miocardite attiva (infiammazione del cuore), difetti cardiaci congeniti (dalla nascita) o una malattia circolatoria in stadio finale nella quale il restringimento delle sue arterie riduce la circolazione del sangue negli arti;
- se assume un medicamento che allunga l'intervallo QT per trattare un problema del ritmo o altri problemi (vedere i prodotti elencati nella rubrica qui di seguito);
- se già assume un antagonista α1-adrenergico o un agonista α2-adrenergico;
- se è affetto da una malattia cronica della retina dell'occhio o se la sua vista è calata;
- se è affetto da diabete;
- se è affetto da problemi epatici di moderata entità;
- se è affetto da problemi renali gravi;
- se è affetto da problemi di circolazione (ad esempio, malattia di Raynaud che interessa generalmente le dita) o una malattia vascolare periferica responsabile di freddezza delle mani e dei piedi o di pizzicore/formicolio;
- se deve sottoporsi a un intervento chirurgico che necessita di anestesia generale;
- se la sua ghiandola tiroide è iperattiva (i sintomi sono tremori, frequenza cardiaca rapida, sudorazione abbondante e dimagrimento);
- se porta lenti a contatto. La diminuzione della produzione di lacrime può avere un'influenza negativa sulla comodità legata all'uso delle lenti;
- se ha precedenti di reazioni di ipersensibilità, se ha seguito un trattamento di desensibilizzazione o se è a rischio di reazioni allergiche imponenti;
- se è affetto da reazioni secondarie gravi della pelle;
- se è affetto da psoriasi (eruzione cutanea grave);
- se è affetto o probabilmente affetto da un tumore delle ghiandole surrenali (feocromocitoma).
Se uno dei casi su indicati la riguarda, consulti il suo medico immediatamente prima o durante il trattamento con Carivalan.
Mai interrompere bruscamente il trattamento con Carivalan, in quanto potrebbero verificarsi gravi disturbi del ritmo o della frequenza cardiaca, con un incremento del rischio di crisi cardiaca.
Informi il suo medico o il suo farmacista nel caso in cui:
- soffre di altre malattie,
- soffre di allergie o
- assume o applica internamente o esternamente altri medicamenti (anche se acquistati di sua iniziativa)!
Bambini e adolescenti
Carivalan non è destinato a bambini e adolescenti di età inferiore a 18 anni.
Altri medicamenti e Carivalan
Se assume o ha assunto di recente un altro medicamento, anche se si tratta di un medicamento che non necessita di prescrizione medica, ne discuta con il suo medico o con il suo farmacista.
Alcuni medicamenti possono modificare l'effetto di Carivalan o il loro effetto può essere modificato da Carivalan. L'efficacia di uno o di entrambi i medicamenti può essere alterata da questo tipo di interazione. Inoltre, il rischio o la gravità degli effetti indesiderati possono aumentare.
Informi il suo medico se sta assumendo uno dei seguenti medicamenti:
- fluconazolo, ketoconazolo, itraconazolo (antimicotici utilizzati per il trattamento delle micosi);
- rifampicina (un antibiotico);
- medicamenti che allungano l'intervallo QT, utilizzati per trattare sia disturbi del ritmo cardiaco sia altre patologie, quali:
- chinidina, disopiramide, sotalolo, ibutilide, amiodarone (per il trattamento dei problemi del ritmo cardiaco);
- bepridil (per il trattamento dell’angina pectoris);
- pimozide, ziprasidone, sertindolo (per il trattamento dell’ansia, della schizofrenia o di altre psicosi);
- meflochina, alofantrina e chinina (utilizzati per il trattamento della malaria);
- eritromicina endovenosa (un antibiotico);
- pentamidina (un antiparassitario);
- cisapride (per il trattamento del reflusso gastro-esofageo);
- clonidina (utilizzata per il trattamento dell'ipertensione);
- diidropiridine (p. es. nifedipina, amlodipina, ecc. utilizzate per il trattamento di ipertensione, dolore toracico associato all'angina pectoris o sindrome di Raynaud);
- alcuni tipi di diuretici che possono portare a una diminuzione del tasso di potassio nel sangue, quali furosemide, idroclorotiazide, indapamide (utilizzati per trattare gli edemi, l'ipertensione arteriosa e l'insufficienza cardiaca);
- altri medicamenti utilizzati per il trattamento dell'ipertensione,
- nitrati (utilizzati per il trattamento del dolore toracico associato ad angina pectoris);
- simpaticomimetici (ad esempio, medicamenti che servono ad aumentare la pressione arteriosa o la frequenza cardiaca o a dilatare le vie respiratorie, quali l'adrenalina utilizzata nel trattamento delle reazioni allergiche gravi o i beta-2 agonisti utilizzati nel trattamento dell'asma);
- antiaritmici endovenosi di classe IA o IC (utilizzati per il trattamento dei problemi del ritmo cardiaco);
- antiaritmici (p. es. verapamil, diltiazem o amiodarone);
- barbiturici (per il trattamento dell'insonnia o dell'epilessia);
- fenitoina (per il trattamento dell'epilessia);
- aloperidolo (neurolettico):
- cimetidina (utilizzata per il trattamento del reflusso gastro-esofageo e dell'ulcera gastrica);
- fluoxetina (un antidepressivo);
- Hypericum perforatum o erba di San Giovanni (capsule, gocce, tisane, … per il trattamento della depressione);
- reserpina, guanetidina, metildopa, guanfacina e inibitori della monoamino ossidasi (utilizzati per il trattamento di malattie quali la depressione o il morbo di Parkinson);
- digossina e digitossina (utilizzate per il trattamento di determinate patologie cardiache);
- ciclosporina (utilizzata dopo un trapianto di organo);
- eritromicina (antibiotico);
- insulina e antidiabetici (utilizzati per il trattamento del diabete);
- miorilassanti utilizzati in anestesia o agenti anestetici (deve informare il suo medico prima di ogni eventuale intervento chirurgico);
- broncodilatatori beta-agonisti (utilizzati per il trattamento dell'asma);
- antinfiammatori non steroidei (FANS) (utilizzati per attenuare l'infiammazione, la febbre e il dolore, ad es. acido acetilsalicilico o ibuprofene);
- estrogeni (ormoni femminili utilizzati per la contraccezione o come ormonoterapia sostitutiva);
- corticosteroidi (utilizzati per il trattamento di diversi tipi di malattie quali l'asma, la dermatite, ecc.);
- ergotamina (un farmaco contro l'emicrania);
- altri betabloccanti (ad esempio, alcune gocce per gli occhi).
Informi il suo medico che lei assume Carivalan se deve sottoporsi a un intervento chirurgico che richiede l'impiego di un anestetico.
Non assuma di sua iniziativa altri medicamenti, in quanto determinate associazioni devono essere evitate.
Carivalan con alimenti, bevande e alcol
Eviti di assumere succo di pompelmo durante il trattamento con Carivalan. Limiti il consumo di alcol durante il trattamento con questo medicamento.
Conduzione di veicoli e uso di macchine
Carivalan può provocare fenomeni luminosi transitori (una luminosità temporanea nel campo di visione) (vedere «Quali effetti collaterali può avere Carivalan?»). In questo caso, faccia attenzione quando guida o quando utilizza macchine, in situazioni in cui si verifica un improvviso cambiamento di luminosità, in particolare durante la guida notturna.
Faccia anche attenzione quando assume Carivalan insieme con alcol o quando passa a un altro medicamento, perché anche in questo caso può essere influenzata la sua capacità di guidare o di utilizzare macchinari.
Se le compresse provocano in lei vertigini, affaticamento o mal di testa, non guidi e non utilizzi macchinari.
Carivalan contiene lattosio
Se il suo medico l'ha informata di una intolleranza a determinati zuccheri, lo contatti prima di assumere questo medicamento.
L'uso di questo medicamento è sconsigliato nei pazienti che presentano un'intolleranza al galattosio, un deficit di lattasi di Lapp o una sindrome da malassorbimento di glucosio o di galattosio (malattie ereditarie rare).
Si può usare Carivalan durante la gravidanza o l’allattamento?
Non assuma Carivalan se è in stato di gravidanza, pensa di esserlo, sta pianificando una gravidanza o se sta allattando (vedere «Quando non si può usare Carivalan?»).
Questo medicamento non deve essere assunto durante la gravidanza. Qualora sia pianificata o confermata una gravidanza, attui il passaggio a un altro trattamento il più presto possibile con il suo medico. Si consulti con il suo medico qualora si trovi in stato di gravidanza e abbia assunto Carivalan.
Non assuma Carivalan se è in età fertile, a meno che non utilizzi metodi di contraccezione efficaci (vedere «Quando non si può usare Carivalan?»).
Non assuma Carivalan se è in allattamento. Contatti immediatamente il suo medico se sta allattando o se ha intenzione di iniziare ad allattare.
Come usare Carivalan?
Assuma sempre questo medicamento seguendo esattamente le indicazioni del suo medico o del suo farmacista. Si consulti con il suo medico o con il suo farmacista in caso di dubbi.
Adulti
La posologia raccomandata è di due compresse di Carivalan al giorno; una compressa al mattino e una compressa alla sera.
Carivalan va assunto durante i pasti.
Bambini e adolescenti
Carivalan non è destinato a bambini e adolescenti di età inferiore a 18 anni.
Non modifichi di sua iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Se ha assunto una quantità maggiore di Carivalan di quanto avrebbe dovuto:
Se ha assunto più compresse rispetto a quanto previsto, contatti immediatamente il suo medico o il suo farmacista. Gli effetti più probabili, dovuti al rallentamento della sua frequenza cardiaca, sono stordimento, sensazione di svenimento, debolezza e difficoltà respiratorie.
Se ha dimenticato di assumere Carivalan:
Sa ha dimenticato di assumere una dose di Carivalan, assuma la dose successiva nel modo abituale. Non assuma la dose doppia per compensare la dose che ha dimenticato di prendere.
Se interrompe l'assunzione di Carivalan:
Il trattamento dell'angina pectoris e dell'insufficienza cardiaca cronica è generalmente un trattamento a vita, dunque non lo interrompa prima di averne parlato con il suo medico.
Non interrompa improvvisamente l'assunzione delle compresse di Carivalan perché potrebbero verificarsi gravi cambiamenti del suo ritmo o della sua frequenza cardiaca con un conseguente aumento del rischio di crisi cardiaca. Non modifichi la dose e non sospenda il trattamento se non in accordo con il suo medico.
Se ha ulteriori domande sull'uso di questo medicamento, chieda maggiori informazioni al suo medico o al suo farmacista.
Quali effetti collaterali può avere Carivalan?
L'assunzione o l'uso di Carivalan può provocare effetti indesiderati.
Se nota gonfiore del viso, delle labbra, della bocca, della lingua o della gola, difficoltà a respirare o deglutire (angioedema, può interessare fino a 1 persona su 100), contatti immediatamente il suo medico o il pronto soccorso.
Consulti il suo medico in caso di contrazione rapida e irregolare del cuore, percezione anomala dei battiti cardiaci, battiti cardiaci anormalmente veloci, anomala contrazione lenta del cuore, pressione arteriosa non controllata, mal di testa, vertigini, vista offuscata (vista sfocata), abbassamento anomalo dei livelli di zucchero nel sangue.
In ordine decrescente di frequenza, gli effetti indesiderati possono comprendere:
Molto frequenti (possono riguardare più di 1 persona su 10): fenomeni visivi luminosi (pochi istanti di maggiore luminosità, più spesso provocati da cambiamenti di luce improvvisi). Possono anche essere descritti come un alone, lampi colorati, una scomposizione dell'immagine o immagini multiple; mal di testa; vertigini; disturbo cardiaco che può essere responsabile di fiato corto o gonfiore dei piedi o delle gambe a causa di accumulo di liquidi (insufficienza cardiaca); ipotensione (i segni sono stordimenti o lipotimie (malesseri passeggeri senza perdita di coscienza)), debolezza generalizzata e sensazione di fatica.
Frequenti (possono riguardare fino a 1 persona su 10): infezioni polmonari o toraciche: bronchite, polmonite o infezione delle vie aeree superiori; infezioni urinarie; diminuzione del numero di globuli rossi (che si traduce in una sensazione di affaticamento, pallore della pelle, palpitazioni e fiato corto durante lo sforzo); aumento del tasso ematico di colesterolo; aumento del tasso ematico di zucchero (diabete), perdita del controllo della glicemia nei diabetici; aumento di peso; depressione o umore depresso; diminuzione della secrezione lacrimale (occhio secco), disturbi della vista, irritazione oculare, vista offuscata (vista sfocata); ritenzione di liquidi (che si traduce in un gonfiore globale del corpo, gonfiore di alcune parti del corpo, ad es. le mani, i piedi, le caviglie o le gambe, e in un aumento del suo volume di sangue totale); accumulo di liquido nei polmoni; modifica del funzionamento del cuore (i sintomi sono rappresentati da un rallentamento della frequenza cardiaca); pause cardiache (battiti cardiaci irregolari); contrazione irregolare e rapida del cuore; battiti cardiaci anormalmente veloci; sensazione di stordimenti, di lipotimie (malesseri passeggeri senza perdita di coscienza) o di sincope al momento di alzarsi dal letto o quando ci si alza in piedi in fretta; disturbi della circolazione sanguigna quali il raffreddamento delle mani o dei piedi, obliterazione delle grandi arterie delle braccia o delle gambe, peggioramento dei sintomi nei pazienti affetti dalla malattia di Raynaud (pizzicore e cambiamento di colore delle dita delle mani e dei piedi (bianco, blu e rosso) durante esposizione al freddo) o zoppia intermittente (dolore agli arti inferiori aggravato durante la deambulazione); pressione arteriosa non controllata; fiato corto, asma; sensazione di malessere (nausee), dolori addominali, problemi di digestione, diarrea, vomito; dolore agli arti; malattia caratterizzata da articolazioni tumefatte e dolenti, dovute a cristalli di acido urico (gotta); disturbi urinari: ritardo nell'emissione del getto, getto irregolare o incontinenza urinaria o disturbi della frequenza minzionale; insufficienza renale; dolore.
Occasionali (possono riguardare fino a 1 persona su 100): aumento della percentuale di determinati tipi di globuli bianchi; aumento del tasso di acido urico nel sangue; disturbi del sonno con incubi e confusione mentale; svenimento (sincope), debolezza muscolare, vista offuscata e sensazione di svenimento (pre-sincope), formicolio o intorpidimento di mani o piedi; visione doppia, diminuzione dell'acuità visiva; dolore o sensazione di disagio nel petto, palpitazioni, variazioni della frequenza cardiaca (rapida, lenta) battiti irregolari che possono mettere in pericolo di vita; costipazione; determinate reazioni cutanee (eruzione cutanea, orticaria, pruriti, abbondante sudorazione, lesioni cutanee psoriasiformi o lichenoidi); caduta dei capelli; gonfiore della faccia, delle labbra, della lingua o della gola, che possono portare a difficoltà respiratorie o di deglutizione (angioedema); crampi muscolari; innalzamento della creatinina nel sangue (prodotto della degradazione dei muscoli); anomalie dei tracciati ECG; disfunzione sessuale, impotenza (impossibilità di avere o di mantenere un'erezione).
Rari (possono riguardare fino a 1 persona su 1000): suscettibilità a sanguinamenti o a contusioni superiore alla norma (riduzione del numero di piastrine nel sangue); naso chiuso, respirazione sibilante; secchezza della bocca; arrossamento della pelle; sensazione di malessere.
Molto rari (possono riguardare fino a 1 paziente su 10'000): numero basso di globuli bianchi; anomalie dei test epatici; disturbi del ritmo cardiaco (blocco atrio-ventricolare di secondo o di terzo grado, malattia del seno); reazioni cutanee gravi; placche rosse, irregolari e circolari sulla pelle delle mani e delle braccia (eritema polimorfo); forma grave di eruzione cutanea con vampate di calore, febbre, vesciche o ulcerazioni (sindrome di Stevens-Johnson); eruzione cutanea grave con arrossamento, desquamazione e gonfiore della pelle paragonabili a ustioni gravi (necrosi epidermica tossica); incapacità a controllare l'emissione di urine nella donna.
In presenza di uno degli effetti indicati come gravi, informi quanto prima il suo medico o il suo farmacista.
Se osserva effetti secondari qui non menzionati dovrebbe informare il suo medico o il suo farmacista.
Di che altro occorre tener conto?
Tenere questo medicamento fuori dalla portata dei bambini.
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Non conservare a temperatura superiore ai 30 °C.
I medicamenti non devono essere smaltiti nelle acque di scarico né con i rifiuti domestici. Consulti il suo farmacista sullo smaltimento dei medicamenti non utilizzati.
Il medico o il farmacista che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Carivalan?
Principi attivi:
Le sostanze attive sono il carvedilolo e l'ivabradina (sotto forma di ivabradina cloridrato).
Eccipienti:
Gli altri componenti (eccipienti) sono: Nucleo della compressa: amido pregelatinizzato, lattosio monoidrato, cellulosa microcristallina, sodio croscarmellosa, maltodestrina, silice colloidale, magnesio stearato; Rivestimento: glicerolo, ipromellosa, magnesio stearato, macrogol 6000, titanio diossido (E171 (compressa rivestita di colore bianco)) o ferro ossido giallo (E172 (compressa rivestita di colore giallo)).
Compresse rivestite Carivalan 6,25 mg/5 mg:
Una compressa rivestita contiene 6,25 mg di carvedilolo e 5 mg di ivabradina (sotto forma di ivabradina cloridrato) ed eccipienti.
(Compressa rivestita di colore bianco, di forma esagonale (diagonale maggiore 7,3 mm), con inciso «CI2» su un lato e « » sull'altro.)
» sull'altro.)
Compresse rivestite Carivalan 6,25 mg/7,5 mg:
Una compressa rivestita contiene 6,25 mg di carvedilolo e 7,5 mg di ivabradina (sotto forma di ivabradina cloridrato) ed eccipienti.
(Compressa rivestita di colore giallo, di forma esagonale (diagonale maggiore 7,3 mm), con inciso «CI3» su un lato e « » sull'altro.)
» sull'altro.)
Compresse rivestite Carivalan 12,5 mg/5 mg:
Una compressa rivestita contiene 12,5 mg di carvedilolo e 5 mg di ivabradina (sotto forma di ivabradina cloridrato) ed eccipienti.
(Compressa rivestita di colore bianco, di forma ellittica (10,6 mm × 5,3 mm), con inciso «CI4» su un lato e « » sull'altro.)
» sull'altro.)
Compresse rivestite Carivalan 12,5 mg/7,5 mg:
Una compressa rivestita contiene 12,5 mg di carvedilolo e 7,5 mg di ivabradina (sotto forma di ivabradina cloridrato) ed eccipienti.
(Compressa rivestita di colore giallo, di forma ellittica (10,6 mm × 5,3 mm), con inciso «CI5» su un lato e « » sull'altro.)
» sull'altro.)
Compresse rivestite Carivalan 25 mg/5 mg:
Una compressa rivestita contiene 25 mg di carvedilolo e 5 mg di ivabradina (sotto forma di ivabradina cloridrato) ed eccipienti.
(Compressa rivestita di colore bianco, di forma ottagonale (diametro 7,8 mm), con inciso «CI6» su un lato e « » sull'altro.)
» sull'altro.)
Compresse rivestite Carivalan 25 mg/7,5 mg:
Una compressa rivestita contiene 25 mg di carvedilolo e 7,5 mg di ivabradina (sotto forma di ivabradina cloridrato) ed eccipienti.
(Compressa rivestita di colore giallo, di forma ottagonale (diametro 7,8 mm), con inciso «CI7» su un lato e « » sull'altro.)
» sull'altro.)
Numero dell’omologazione
66213 (Swissmedic).
Dove è ottenibile Carivalan? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Carivalan 6,25 mg/5 mg, compresse rivestite in blister: confezioni da 56 o 112 compresse
Carivalan 6,25 mg/7,5 mg, compresse rivestite in blister: confezioni da 56 o 112 compresse
Carivalan 12,5 mg/5 mg, compresse rivestite in blister: confezioni da 56 o 112 compresse
Carivalan 12,5 mg/7,5 mg, compresse rivestite in blister: confezioni da 56 o 112 compresse
Carivalan 25 mg/5 mg, compresse rivestite in blister: confezioni da 56 o 112 compresse
Carivalan 25 mg/7,5 mg, compresse rivestite in blister: confezioni da 56 o 112 compresse
Titolare dell’omologazione
Servier (Suisse) S.A., 1242 Satigny.
Questo foglietto illustrativo è stato controllato l'ultima volta nel Ottobre 2018 dall'autorità competente in materia di medicamenti (Swissmedic).
AMZV
Zusammensetzung
Wirkstoffe:
Carvedilol und Ivabradin (in Form von Ivabradin Chlorhydrat).
Hilfsstoffe:
Tablettenkern: vorverkleisterte Stärke, Laktose-Monohydrat, mikrokristalline Zellulose, Croscarmellose-Natrium, Maltodextrin, hochdisperses Siliziumdioxid, Magnesiumstearat.
Tablettenfilm: Glyzerin, Hypromellose, Magnesiumstearat, Macrogol 6000, Titandioxid (E171 [weisse Filmtabletten]) oder Eisenoxidgelb (E172 [gelbe Filmtabletten]).
Galenische Form und Wirkstoffmenge pro Einheit
Filmtabletten Carivalan 6,25 mg/5 mg:
Jede Filmtablette enthält 6,25 mg Carvedilol und 5 mg Ivabradin (in Form von 5,390 mg Ivabradin Chlorhydrat).
(Weisse, hexagonale Filmtablette [längste Diagonale 7,3 mm], auf einer Seite «CI2» und auf der anderen Seite « » eingraviert.)
» eingraviert.)
Filmtabletten Carivalan 6,25 mg/7,5 mg:
Jede Filmtablette enthält 6,25 mg Carvedilol und 7,5 mg Ivabradin (in Form von 8,085 mg Ivabradin Chlorhydrat).
(Gelbe, hexagonale Filmtablette [längste Diagonale 7,3 mm], auf einer Seite «CI3» und auf der anderen Seite « » eingraviert.)
» eingraviert.)
Filmtabletten Carivalan 12,5 mg/5 mg:
Jede Filmtablette enthält 12,5 mg Carvedilol und 5 mg Ivabradin (in Form von 5,390 mg Ivabradin Chlorhydrat).
(Weisse, elliptische Filmtablette [10,6 mm × 5,3 mm], auf einer Seite «CI4» und auf der anderen Seite « » eingraviert.)
» eingraviert.)
Filmtabletten Carivalan 12,5 mg/7,5 mg:
Jede Filmtablette enthält 12,5 mg Carvedilol und 7,5 mg Ivabradin (in Form von 8,085 mg Ivabradin Chlorhydrat).
(Gelbe, elliptische Filmtablette [10,6 mm × 5,3 mm], auf einer Seite «CI5» und auf der anderen Seite « » eingraviert.)
» eingraviert.)
Filmtabletten Carivalan 25 mg/5 mg:
Jede Filmtablette enthält 25 mg Carvedilol und 5 mg Ivabradin (in Form von 5,390 mg Ivabradin Chlorhydrat).
(Weisse, oktogonale Filmtablette [7,8 mm Durchmesser], auf einer Seite «CI6» und auf der anderen Seite « » eingraviert.)
» eingraviert.)
Filmtabletten Carivalan 25 mg/7,5 mg:
Jede Filmtablette enthält 25 mg Carvedilol und 7,5 mg Ivabradin (in Form von 8,085 mg Ivabradin Chlorhydrat).
(Gelbe, oktogonale Filmtablette [7,8 mm Durchmesser], auf einer Seite «CI7» und auf der anderen Seite « » eingraviert.)
» eingraviert.)
Indikationen/Anwendungsmöglichkeiten
Carivalan ist indiziert zur symptomatischen Behandlung der chronischen stabilen Angina pectoris bei Patienten mit koronarer Herzkrankheit oder zur Behandlung der chronischen Herzinsuffizienz (NYHA-Klasse II bis IV) mit systolischer Dysfunktion als Substitutionstherapie bei erwachsenen Patienten mit normalem Sinusrhythmus, die bereits mit einer Kombination aus Carvedilol und Ivabradin in der gleichen Dosierung gut eingestellt sind.
Dosierung/Anwendung
Die empfohlene Dosis ist zweimal täglich eine Filmtablette, einmal am Morgen und einmal am Abend zu den Mahlzeiten.
Carivalan ist nur bei Patienten anzuwenden, die mit einer kombinierten Gabe der Einzelwirkstoffe bei stabiler Dosierung und optimaler Carvedilol-Dosis gut eingestellt sind.
Falls die Dosierung geändert werden muss, wird empfohlen, dass zuvor wiederholte Messungen der Herzfrequenz, ein EKG oder eine ambulante 24-Stunden-Überwachung durch ein Holter-EKG durchgeführt werden. Die Dosistitration muss für jeden Einzelwirkstoff erfolgen, um sicherzustellen, dass der Patient weiterhin Carvedilol und Ivabradin in optimaler Dosierung erhält.
Die Anfangsdosierung von Ivabradin darf bei Patienten unter 75 Jahren 5 mg zweimal täglich nicht überschreiten.
Die Behandlung mit Ivabradin muss abgebrochen werden, wenn sich die Angina-pectoris-Symptome nach dreimonatiger Therapie nicht verbessern.
Im Falle einer begrenzten Verbesserung der Symptome und einer klinisch nicht signifikanten Verringerung der Ruhefrequenz nach dreimonatiger Behandlung sollte ebenfalls in Betracht gezogen werden, die Ivabradin-Therapie abzusetzen.
Falls die Herzfrequenz während der Behandlung unter 50 Schläge pro Minute (bpm) sinkt oder der Patient bradykarde Symptome wie Schwindelgefühl, Müdigkeit oder Hypotonie zeigt, ist die Dosierung der Einzelkomponenten Carvedilol und Ivabradin zu reduzieren, und sicherstellen, dass der Patient weiterhin Carvedilol in optimaler Dosierung erhält. Nach der Dosierungsreduktion muss die Herzfrequenz kontrolliert werden (siehe «Warnhinweise und Vorsichtsmassnahmen»). Die Behandlung muss unterbrochen werden, wenn trotz Dosisreduktion die Herzfrequenz weiterhin unter 50 bpm bleibt oder die Symptome einer Bradykardie anhalten.
Spezielle Dosierungsanweisungen
Patienten mit Niereninsuffizienz
Keine Dosierungsanpassung bei Patienten mit Niereninsuffizienz und einer Kreatinin-Clearance über 15 ml/min (siehe «Pharmakokinetik») und einem systolischen Blutdruck von über 100 mmHg ist erforderlich.
Es liegen keine Daten bei Patienten mit einer Kreatinin-Clearance unter 15 ml/min vor. Carivalan muss deshalb mit Vorsicht bei Patienten mit einer Kreatinin-Clearance unter 15 ml/min angewendet werden.
Die Überwachung der Nierenfunktion ist bei Patienten mit chronischer Herzinsuffizienz und einem systolischen Blutdruck niedriger als 100 mmHg empfohlen.
Patienten mit Leberinsuffizienz
Bei Patienten mit leichter bis mässiger Leberinsuffizienz kann eine Dosierungsanpassung erforderlich sein.
Carivalan muss mit Vorsicht bei Patienten mit mässiger Leberinsuffizienz (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Pharmakokinetik») angewendet werden.
Carivalan ist bei Patienten mit schwerer Leberinsuffizienz kontraindiziert (siehe «Kontraindikationen» und «Pharmakokinetik»).
Anwendung bei älteren Patienten
Carivalan kann bei älteren Patienten mit Vorsicht verabreicht werden (siehe «Pharmakokinetik»).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Carivalan bei Kindern und Jugendlichen unter 18 Jahren wurden nicht erwiesen. Es liegen keine Daten zu Carivalan vor.
Kontraindikationen
- Überempfindlichkeit gegen die Wirkstoffe, oder einen der im Abschnitt «Zusammensetzung» genannten sonstigen Bestandteile des Arzneimittels oder gegen andere Betablocker
- Schwere Leberinsuffizienz und klinisch manifeste Leberinsuffizienz
- Akute Herzinsuffizienz und chronische dekompensierte Herzinsuffizienz (NYHA-Klasse II bis IV) sowie Episoden dekompensierter Herzinsuffizienz, die eine intravenöse inotrope Therapie erfordern
- Instabile Angina pectoris
- Prinzmetal-Angina
- AV-Block 2. und 3. Grades
- Sinusknotensyndrom («Sick-Sinus-Syndrom»)
- Sinuatrialer Block
- Symptomatische oder schwere Bradykardie (<50 bpm).
- Akuter Myokardinfarkt oder Myokardinfarkt mit Komplikationen
- Kardiogener Schock
- Herzschrittmacher-Abhängigkeit (Herzfrequenz wird ausschliesslich durch den Schrittmacher erzeugt).
- Schwere periphere Gefässerkrankung (z.B. Raynaud-Syndrom)
- Schwere Hypotonie (<90/50 mmHg)
- Chronisch-obstruktive Lungenerkrankung
- Bronchospasmen oder Asthma in der Vorgeschichte (Todesfälle infolge eines Status asthmaticus nach Einnahme einer Einzeldosis Carvedilol wurden berichtet)
- Allergische Rhinitis
- Glottisödem
- Lungenherz
- Metabolische Azidose
- Unbehandeltes Phäochromozytom
- Kombination mit MAO-Hemmern (mit Ausnahme von MAO-B-Hemmern)
- Langsam-Metabolisierer vom Debrisoquin- und Mephenytoin-Typ
- Kombination mit starken Cytochrom-P450-3A4-Hemmern (wie z.B. Antimykotika vom Azol-Typ [Ketoconazol, Itraconazol], Makrolidantibiotika [Clarithromycin, Erythromycin per os, Josamycin, Telithromycin], Proteaseinhibitoren [Nelfinavir, Ritonavir] oder Nefazodon) (siehe «Interaktionen» und «Pharmakokinetik»)
- Kombination mit Verapamil oder Diltiazem, die mässig starke CYP3A4-Hemmer mit herzfrequenzsenkenden Eigenschaften sind (siehe «Interaktionen»)
- Schwangerschaft, Stillzeit und Frauen im gebärfähigen Alter, die keine angemessenen Verhütungsmethoden anwenden (siehe «Schwangerschaft/Stillzeit»)
Aufgrund der Wirkung von Ivabradin auf die Herzfrequenz darf eine Therapie mit diesem Wirkstoff nur bei Patienten mit einer Ruheherzfrequenz grösser oder gleich 70 Schläge pro Minute begonnen werden.
Warnhinweise und Vorsichtsmassnahmen
Sämtliche Warnhinweise und Vorsichtsmassnahmen im Zusammenhang mit den Einzelkomponenten sind auch auf Carivalan anzuwenden.
Besondere Warnhinweise
Mangelnder Nutzen hinsichtlich Morbidität und Mortalität bei chronischer stabiler Angina pectoris
In seiner Indikation in chronischer stabiler Angina pectoris ist Carivalan nur eine symptomatische Behandlung, wegen des Mangels an erwiesenem Nutzen auf kardiovaskuläre Ereignisse (z.B. Myokardinfarkt oder kardiovaskulärer Tod) (siehe «Eigenschaften/Wirkungen»).
Messung der Herzfrequenz
Da die Herzfrequenz im Laufe der Zeit erheblich schwanken kann, sind wiederholte Messungen der Herzfrequenz, ein EKG oder eine ambulante 24-Stunden-Überwachung durch ein Holter-EKG in Betracht zu ziehen zur Ermittlung der Ruheherzfrequenz:
- bevor eine Ivabradin-Therapie begonnen wird;
- wenn eine Erhöhung der Ivabradin-Dosis geplant ist.
Dieser Warnhinweis gilt auch für Patienten mit niedriger Herzfrequenz, besonders wenn sie unter 50 Schläge pro Minute sinkt oder nach einer Dosierungsreduktion (siehe «Dosierung/Anwendung»).
Herzrhythmusstörungen
Ivabradin ist nicht wirksam bei der Behandlung oder Vorbeugung von Herzrhythmusstörungen und verliert wahrscheinlich seine Wirksamkeit bei Auftreten einer Tachyarrhythmie (z.B. ventrikuläre oder supraventrikuläre Tachykardie). Carivalan wird deshalb bei Patienten mit Vorhofflimmern oder anderen Herzrhythmusstörungen, welche die Funktion des Sinusknotens stören, nicht empfohlen.
Bei Patienten, die mit Ivabradin behandelt werden, ist das Risiko, Vorhofflimmern zu entwickeln, erhöht (siehe «Unerwünschte Wirkungen»). Vorhofflimmern trat bei Patienten, die gleichzeitig Amiodaron oder starke Klasse-I-Antiarrhythmika einnahmen, häufiger auf.
Es wird empfohlen, die mit Ivabradin behandelten Patienten regelmässig hinsichtlich des Auftretens von Vorhofflimmern (anhaltend oder paroxysmal) klinisch zu überprüfen. Dies schliesst gegebenenfalls eine EKG-Kontrolle ein im Falle klinischer Anzeichen wie exazerbierter Angina, Palpitationen oder unregelmässigem Puls.
Die Patienten müssen über die Anzeichen und Symptome von Vorhofflimmern informiert sein und aufgefordert werden, ihre Ärztin bzw. ihren Arzt zu kontaktieren, wenn diese auftreten.
Falls während der Behandlung Vorhofflimmern auftritt, ist das Nutzen-Risiko-Verhältnis einer fortgesetzten Behandlung mit Carivalan sorgfältig zu überdenken.
Patienten mit chronischer Herzinsuffizienz, bei denen eine intraventrikuläre Überleitungsstörung (Linksschenkelblock, Rechtsschenkelblock) und ventrikuläre Dyssynchronie bestehen, müssen engmaschig überwacht werden.
Anwendung bei Patienten mit niedriger Herzfrequenz
Ivabradin darf nicht bei Patienten eingesetzt werden, die vor der Behandlung eine Ruheherzfrequenz von unter 70 bpm aufweisen (siehe «Kontraindikationen»).
Falls die Ruheherzfrequenz während der Behandlung mit Carivalan unter 50 bpm sinkt oder der Patient bradykarde Symptome wie Schwindelgefühl, Müdigkeit oder Hypotonie zeigt, ist die Dosis der Einzelkomponenten zu reduzieren und sicherstellen, dass der Patient weiterhin Carvedilol in optimaler Dosierung erhält oder die Behandlung absetzt. falls die Herzfrequenz unter 50 bpm bleibt oder die bradykarden Symptome anhalten (siehe «Dosierung/Anwendung»).
Kombination mit Kalziumkanalblockern
Die gleichzeitige Anwendung von Carivalan mit herzfrequenzsenkenden Kalziumkanalblockern wie Verapamil oder Diltiazem ist kontraindiziert (siehe «Kontraindikationen» und «Interaktionen»). Es gibt keine Verträglichkeitsprobleme zur Kombination von Ivabradin mit Nitraten und Kalziumkanalblockern vom Dihydropyridin-Typ wie Amlodipin. Die Kombination von Ivabradin n mit Kalziumkanalblockern vom Dihydropyridin-Typ hat keine additive Wirksamkeit erwiesen.
Chronische Herzinsuffizienz
Eine Herzinsuffizienz muss stabilisiert sein, bevor eine Behandlung mit Carivalan in Betracht gezogen werden kann. Carivalan wird bei Patienten mit Herzinsuffizienz der NYHA-Klasse IV nicht empfohlen, da nur begrenzte Daten für Ivabradin bei dieser Patientengruppe zur Verfügung stehen.
Carivalan ist in Kombination mit Herzglykosiden mit Vorsicht anzuwenden, da diese Wirkstoffe, wie auch Carvedilol, die AV-Überleitung verlangsamen können und Carvedilol die Plasmakonzentration der Herzglykoside erhöhen kann (siehe «Interaktionen»).
Herzklappenfehler, akute Myokarditis, angeborene Herzfehler
Aufgrund der Abwesenheit von Daten wird die Anwendung von Ivabradin bei einer schweren Aorten- oder Mitralklappenstenose, schweren primären Mitralregurgitation, akuten Myokarditis oder einem angeborenen Herzfehler nicht empfohlen.
Schlaganfall
Aufgrund der Abwesenheit von Daten ist die Anwendung von Carivalan unmittelbar nach einem Schlaganfall nicht empfohlen.
Visuelle Funktion
Ivabradin beeinflusst die Funktion der Retina. Es liegt kein Beweis einer toxischen Wirkung auf die Retina bei einer Langzeitbehandlung mit Ivabradin vor (siehe «Eigenschaften/Wirkungen»). Ein Behandlungsabbruch ist zu erwägen, falls eine unerwartete Verschlechterung der visuellen Funktion auftritt. Bei Patienten mit Retinitis pigmentosa ist bei der Anwendung von Ivabradin Vorsicht angezeigt.
Besondere Vorsichtsmassnahmen für die Anwendung
Beenden der Behandlung
Die Einnahme von Ivabradin kann bei Bedarf ausgesetzt werden, ein abruptes Absetzen der Therapie mit einem Betablocker ist jedoch zu vermeiden, besonders bei Patienten mit ischämischer Herzerkrankung. Nach Absetzen einer Therapie mit Carivalan ist Carvedilol sofort als Einzelsubstanz zu verabreichen und zu gewährleisten, dass der Patient weiterhin Carvedilol in optimaler Dosierung erhält. Die Dosierung von Carvedilol ist schrittweise zu reduzieren, etwa durch Verringerung der Tagesdosis um die Hälfte alle drei Tage. Falls erforderlich kann gleichzeitig eine andere Ersatztherapie begonnen werden, um eine Verschlechterung der Angina pectoris zu verhindern. Wenn der Patient in irgendeiner Form Symptome entwickelt, muss die Dosisreduktion langsamer erfolgen.
Nierenfunktion bei kongestiver Herzinsuffizienz
Eine reversible Verschlechterung der Nierenfunktion wurde im Rahmen einer Carvedilol-Therapie bei Patienten mit chronischer Herzinsuffizienz beobachtet, die einen niedrigen arteriellen Blutdruck (systolischer Blutdruck unter 100 mmHg), eine ischämische Herzerkrankung und diffuse Gefässerkrankung und/oder eine zugrunde liegende Niereninsuffizienz aufwiesen. Bei Herzinsuffizienzpatienten mit diesen Risikofaktoren sollte die Nierenfunktion überwacht werden.
Patienten mit Hypotonie
Da für Patienten mit leichter bis mässiger Hypotonie nur begrenzt Daten zur Verfügung stehen, ist Ivabradin bei diesen Patienten mit Vorsicht anzuwenden. Carivalan ist bei Patienten mit schwerer Hypotonie kontraindiziert (arterieller Blutdruck unter 90/50 mmHg) (siehe «Kontraindikationen»).
Vorhofflimmern – Herzrhythmusstörungen
Wenn bei Patienten, die mit Ivabradin behandelt werden, eine pharmakologische Kardioversion eingeleitet wird, gibt es bei Rückkehr zum Sinusrhythmus keine Anzeichen, dass das Risiko einer (ausgeprägten) Bradykardie besteht. Da jedoch keine ausführlichen Daten verfügbar sind, ist eine nicht dringende elektrische Kardioversion frühestens 24 Stunden nach der letzten Carivalan-Einnahme in Betracht zu ziehen.
Patienten, die ein angeborenes Long-QT-Syndrom aufweisen oder mit QT-verlängernden Arzneimitteln behandelt werden
Die Anwendung von Carivalan bei Patienten mit angeborenem Long-QT-Syndrom oder die mit QT-verlängernden Arzneimitteln behandelt werden, sollte vermieden werden (siehe «Interaktionen»). Wenn die Kombination notwendig erscheint, ist eine engmaschige kardiale Überwachung erforderlich. Eine Reduktion der Herzfrequenz durch Ivabradin kann die QT-Verlängerung verstärken, was schwere Arrhythmien, insbesondere Torsades de pointes, zur Folge haben kann.
Hypertensive Patienten, die eine Änderung der Blutdruckbehandlung benötigen
In der SHIFT-Studie traten bei Patienten der Ivabradingruppe häufiger Episoden von erhöhtem Blutdruck auf (7,1%) als bei Patienten der Placebogruppe (6,1%). Diese Episoden traten am häufigsten kurz nach einer Änderung der Blutdruckbehandlung auf, waren vorübergehend und beeinflussten den Behandlungseffekt von Ivabradin nicht. Wird bei mit Ivabradin behandelten Patienten mit chronischer Herzinsuffizienz die Blutdruckbehandlung geändert, ist der Blutdruck in angemessenen Abständen zu kontrollieren (siehe «Unerwünschte Wirkungen»).
Anwendung bei Patienten mit mässiger Leberinsuffizienz
Bei Patienten mit mässiger Leberinsuffizienz sollte Carivalan mit Vorsicht angewandt werden (siehe «Dosierung/Anwendung»).
Während der Behandlung mit Carvedilol wurden gelegentlich leichte Leberzellschäden beobachtet. Bei den ersten Symptomen und Anzeichen einer Leberfunktionsstörung (z.B. Juckreiz, dunkler Urin, anhaltender Appetitmangel, Ikterus, Druckschmerzen im rechten oberen Quadranten oder unerklärliche grippeähnliche Symptome) sollten Labortests durchgeführt werden. Falls die Ergebnisse eine Leberschädigung oder einen Ikterus bestätigen, sollte Carvedilol abgesetzt und nicht wieder verabreicht werden.
Anwendung bei Patienten mit schwerer Niereninsuffizienz
Bei Patienten mit schwerer Niereninsuffizienz (Kreatinin-Clearance <15 ml/min.) sollte Carivalan mit Vorsicht angewandt werden (siehe «Dosierung/Anwendung»).
Diabetiker
Carvedilol kann Anzeichen und Symptome einer akuten Hypoglykämie maskieren. Bei Patienten mit Diabetes mellitus und Herzinsuffizienz kann bei Anwendung von Carvedilol gelegentlich eine Glukoseintoleranz auftreten. Daher müssen Diabetiker, die Carivalan erhalten, engmaschig überwacht werden, indem der Blutzucker regelmässig gemessen und die Antidiabetikum-Therapie je nach Bedarf angepasst wird (siehe «Interaktionen»).
Periphere Gefässerkrankung
Carivalan ist bei Patienten mit peripherer Gefässerkrankung mit Vorsicht anzuwenden, da Betablocker Symptome der Erkrankung auslösen oder verschlimmern können. Gleiches gilt für Patienten mit Raynaud-Syndrom, da es zu einer Exazerbation oder Verschlimmerung der Symptome kommen kann. Im Falle einer schweren peripheren Gefässerkrankung ist Carivalan kontraindiziert (siehe «Kontraindikationen»).
Anästhesie und grosse chirurgische Eingriffe
Betablocker verringern das Risiko von Arrhythmien während einer Anästhesie, das Hypotonie-Risiko kann hingegen erhöht sein. Aufgrund der Synergie der negativ inotropen Wirkungen von Carvedilol und Anästhetika sind bestimmte Anästhetika daher mit Vorsicht anzuwenden (siehe «Interaktionen»).
Thyreotoxikose/Hyperthyreose
Betablocker wie Carvedilol können die Anzeichen einer Hyperthyreose und die Symptome einer Thyreotoxikose maskieren. Das abrupte Absetzen der Betablockade kann eine Exazerbation der Symptome einer Hyperthyreose zur Folge haben.
Kontaktlinsen
Patienten, die Kontaktlinsen tragen und mit Carivalan behandelt werden, sind darauf hinzuweisen, dass Carvedilol zu einer verringerten Sekretion von Tränenflüssigkeit führen kann.
Überempfindlichkeit
Carivalan ist mit Vorsicht bei Patienten anzuwenden, bei denen es in der Vorgeschichte zu schweren Überempfindlichkeitsreaktionen kam, sowie bei Patienten, die eine Desensibilisierungstherapie erhalten, da Betablocker wie Carvedilol sowohl die Empfindlichkeit gegenüber Allergenen als auch den Schweregrad anaphylaktischer Reaktionen erhöhen können.
Schwere unerwünschte Hautreaktionen (SCAR)
Sehr seltene Fälle schwerer unerwünschter Hautreaktionen wie toxische epidermale Nekrolyse (TEN) und Stevens-Johnson-Syndrom (SJS) wurden während der Behandlung mit Carvedilol gemeldet (siehe «Unerwünschte Wirkungen»). Carvedilol sollte bei Patienten, die schwere unerwünschte Hautreaktionen erleiden, welche möglicherweise auf Carvedilol zurückzuführen sind, nicht mehr verwendet werden.
Psoriasis
Patienten mit Psoriasis oder Psoriasis in der persönlichen oder familiären Anamnese sollten Betablocker, das heisst auch Carivalan, nur nach sorgfältigem Abwägen des Nutzen-Risiko-Verhältnisses erhalten, da Betablocker die Hautreaktionen verschlimmern können.
Phäochromozytom
Patienten mit einem Phäochromozytom sind zuerst mit einem Alphablocker zu behandeln, bevor ein Betablocker eingesetzt wird. Obwohl Carvedilol sowohl eine alpha- als auch betablockierende pharmakologische Aktivität aufweist, liegen zur Anwendung von Carvedilol bei dieser Erkrankung keine Daten vor. Deshalb ist bei der Anwendung von Carivalan bei Patienten mit Phäochromozytom oder mit Verdacht darauf Vorsicht geboten.
Weitere Vorsichtsmassnahmen
Aufgrund unzureichender klinischer Daten darf Carvedilol nicht verabreicht werden bei Patienten mit labiler oder sekundärer Hypertonie, orthostatische Hypotonie, akuter Myokarditis, hämodynamisch relevanten Stenosen der Herzklappen oder der ventrikulären Ausflusstrakte oder peripherer Arterienerkrankung im Endstadium sowie bei Patienten, die gleichzeitig einen α1-Rezeptorantagonisten oder α2-Rezeptoragonisten erhalten.
Hilfsstoffe
Da die Filmtabletten Laktose enthalten, sollten Patienten mit hereditärer Galaktosämie, Lapp-Laktase-Mangel oder Glukose-Galaktose-Malabsorption dieses Arzneimittel nicht einnehmen.
Dopingkontrollen
Die Einnahme von Carivalan kann zu positiven Ergebnissen bei Dopingkontrollen führen, da Carvedilol enthalten ist. Die Verwendung von Carivalan zu Dopingzwecken kann zu einem Gesundheitsrisiko führen.
Interaktionen
Es wurden keine Interaktionen zwischen Carvedilol und Ivabradin in einer Studie zur Erfassung von Wechselwirkungen mit gesunden Freiwilligen beobachtet. Nachfolgend sind nur die Informationen zu Interaktionen mit anderen Arzneimitteln angeführt, die für den jeweiligen Einzelwirkstoff bekannt sind.
Ivabradin wird ausschliesslich durch CYP3A4 metabolisiert und ist ein sehr schwacher Hemmer dieses Cytochroms.
Es wurde gezeigt, dass Ivabradin keinen Einfluss auf die Metabolisierung und die Plasmakonzentration anderer CYP3A4-Substrate hat (unabhängig davon, ob es sich um schwache, mässige oder starke Hemmerhandelt). CYP3A4-Hemmer und -Induktoren können dagegen mit Ivabradin interagieren und dessen Metabolisierung und Pharmakokinetik in klinisch signifikantem Ausmass beeinflussen.
Studien zur Erfassung von Arzneimittelinteraktionen haben gezeigt, dass CYP3A4-Hemmer die Ivabradin-Plasmakonzentrationen erhöhen, während Induktoren sie senken. Erhöhte Ivabradin-Plasmakonzentrationen können von dem Risiko übermässiger Bradykardie begleitet sein (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Carvedilol ist sowohl ein Substrat als auch ein Inhibitor des P-Glykoproteins. Es ist daher möglich, dass die Bioverfügbarkeit von Arzneimitteln, die durch das P-Glykoprotein transportiert werden, bei gleichzeitiger Anwendung von Carvedilol ansteigt. Darüber hinaus kann die Bioverfügbarkeit von Carvedilol durch Induktoren oder Hemmer des P-Glykoproteins verändert werden.
Sowohl Hemmer als auch Induktoren der Isoenzyme CYP1A2, CYP2D6 und CYP2C9 können die systemische und präsystemische Metabolisierung von Carvedilol auf stereoselektive Weise verändern und somit zu einer verringerten oder erhöhten Plasmakonzentration von R- und S-Carvedilol führen (siehe «Pharmakokinetik»).
Die Interaktionen, die bei Patienten oder gesunden Probanden beobachtet wurden, sind nachfolgend aufgelistet ohne jedoch dass diese Liste begrenzend sei.
Kontraindizierte Kombinationen
In Verbindung mit Ivabradin und Carvedilol
Starke CYP3A4-Hemmer
Pharmakokinetische Interaktionen: Die gleichzeitige Anwendung von Ivabradin mit starken CYP3A4-Hemmer wie Azol-Antimykotika (Ketoconazol, Itraconazol), Makrolid-Antibiotika (Clarithromycin, Erythromycin per os, Josamycin, Telithromycin), HIV-Protease Hemmer (Nelfinavir, Ritonavir) und Nefazodon ist kontraindiziert. Die starken CYP3A4-Hemmer wie Ketoconazol (200 mg einmal täglich) und Josamycin (1 g zweimal täglich) bewirken eine 7-8-fach erhöhte durchschnittliche Ivabradin-Plasmaexposition (siehe «Kontraindikationen»).
Patienten, die Arzneimittel erhalten, welche Cytochrom-P450-Enzyme hemmen (z.B. Cimetidin, Fluoxetin, Verapamil, Ketoconazol, Haloperidol, Erythromycin), sind bei einer gleichzeitigen Behandlung mit Carvedilol engmaschig zu überwachen.
Mässige CYP3A4-Hemmer (Diltiazem, Verapamil)
Pharmakokinetische und pharmakodynamische Interaktionen: Spezifische Studien zur Erfassung von Interaktionen bei gesunden Freiwilligen und bei Patienten haben gezeigt, dass die Kombination von Ivabradin mit herzfrequenzsenkenden Wirkstoffen wie Diltiazem oder Verapamil zu einer Erhöhung der Ivabradin-Exposition (2-3-fache Erhöhung der AUC) und einer zusätzlichen Herzfrequenzsenkung von 5 bpm führte. Die gleichzeitige Einnahme von Ivabradin mit diesen Arzneimitteln ist kontraindiziert (siehe «Kontraindikationen»).
Vereinzelt wurden Fälle von Überleitungsstörungen (selten mit hämodynamischer Wirkung) beobachtet, wenn Carvedilol mit Diltiazem oder Verapamil angewandt wurde. Wie bei anderen Betablockern wird auch bei Carvedilol, wenn es gleichzeitig mit Kalziumkanalblockern vom Verapamil- oder Diltiazem-Typ eingenommen wird, eine Überwachung des EKG und des Blutdrucks empfohlen, da die gleichzeitige Anwendung von Carvedilol mit diesen Wirkstoffen das Risiko von AV-Überleitungsstörungen erhöhen kann.
Nicht empfohlene Kombinationen
In Verbindung mit Ivabradin und Carvedilol
QT-verlängernde Arzneimittel
- QT-verlängernde Arzneimittel gegen kardiovaskuläre Erkrankungen (z.B. Chinidin, Disopyramid, Bepridil, Sotalol, Ibutilid, Amiodaron).
- QT-verlängernde Arzneimittel, die nicht zur Behandlung kardiovaskulärer Erkrankungen eingesetzt werden (z.B. Pimozid, Ziprasidon, Sertindol, Mefloquin, Halofantrin, Pentamidin, Cisaprid, intravenös verabreichtes Erythromycin).
Die gleichzeitige Anwendung von Ivabradin mit kardiovaskulären und nicht kardiovaskulären QT-verlängernden Arzneimitteln ist zu vermeiden, da die QT-Verlängerung durch die Herzfrequenzsenkung verstärkt werden kann. Wenn die Kombination notwendig erscheint, ist eine engmaschige kardiale Überwachung erforderlich (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei Herzinsuffizienzpatienten verringert Amiodaron die Clearance von S-Carvedilol, was sehr wahrscheinlich auf eine Hemmung von CYP2C9 zurückzuführen ist. Die durchschnittliche Plasmakonzentration von R-Carvedilol blieb unverändert. Daher besteht das potenzielle Risiko einer erhöhten Betablockade infolge eines Anstiegs der Plasmakonzentration von S-Carvedilol. Vereinzelt wurden Fälle von Erregungsleitungsstörungen (selten mit hämodynamischer Wirkung) beobachtet, wenn Carvedilol mit Amiodaron angewandt wurde. Die gleichzeitige orale Verabreichung von Carvedilol und Amiodaron (muss sorgfältig überwacht werden, da bei der gleichzeitigen Anwendung von Betablockern (wie Carvedilol) kurz nach Behandlungsbeginn mit Amiodaron über Bradykardie, Herzstillstand und Kammerflimmern berichtet wurde.
Grapefruitsaft
Die Ivabradin-Exposition erhöht sich auf das Doppelte, bei Einnahme von Grapefruitsaft. Daher ist der Genuss von Grapefruitsaft zu vermeiden.
In Verbindung mit Carvedilol
Intravenöse Antiarrhythmika (ausser Verapamil und Diltiazem)
Im Falle einer gemeinsamen intravenösen Anwendung von Klasse-Ia- oder Klasse-Ic- Antiarrhythmika mit Carvedilol besteht das Risiko einer Herzinsuffizienz. Kalziumkanalblocker und Antiarrhythmika sollen während einer Behandlung mit Carvedilol nicht intravenös verabreicht werden.
Kombinationen, bei denen Vorsichtsmassnahmen erforderlich sind
In Verbindung mit von Ivabradin und Carvedilol
Cytochrom-P450-Enzyminduktoren
CYP3A4-Induktoren (z.B. Rifampicin, Barbiturate, Phenytoin und Hypericum perforatum [Johanniskraut]) können die Ivabradin-Exposition und Wirkung herabsetzen. Die gleichzeitige Anwendung von CYP3A4-induzierenden Arzneimitteln erfordert eine Anpassung der Ivabradin-Dosis. Die Kombination von 10 mg Ivabradin zweimal täglich mit Johanniskraut bewirkte eine Reduktion der Ivabradin-AUC um die Hälfte. Die Einnahme von Johanniskraut ist während der Behandlung mit Ivabradin deshalb einzuschränken.
In einer Studie mit 12 gesunden Freiwilligen verringerte sich bei einer gemeinsamen Verabreichung von Rifampicin und Carvedilol die Plasmakonzentration von Carvedilol um etwa 60% und wurde eine Abschwächung der Wirkung von Carvedilol auf den systolischen Blutdruck beobachtet. Der Mechanismus dieser Interaktion ist nicht bekannt, könnte jedoch auf einer Induktion von intestinalem P-Glykoprotein durch Rifampicin beruhen. Bei Patienten, die gleichzeitig Carvedilol und Rifampicin erhalten, ist eine engmaschige Überwachung der betablockierenden Aktivität angebracht.
In Verbindung mit Ivabradin
Mässige CYP3A4-Hemmer (ausser Verapamil oder Diltiazem ) wie z.B. Fluconazol
Die gleichzeitige Anwendung von Ivabradin mit mässigen CYP3A4-Hemmern (z.B. Fluconazol) kann bei einer Anfangsdosierung von 2,5 mg zweimal täglich und wenn die Ruhefrequenz über 70 bpm ist, in Betracht gezogen werden (unter Überwachung der Herzfrequenz).
Kaliumvermindernde Diuretika (Thiazid- und Schleifendiuretika)
Eine Hypokaliämie kann das Risiko von Arrhythmien erhöhen. Da Ivabradin Bradykardie verursachen kann, begünstigt die Kombination aus Hypokaliämie und Bradykardie das Auftreten schwerer Arrhythmien, vor allem bei Patienten mit angeborenem oder arzneimittelinduziertem Long-QT-Syndrom.
In Verbindung mit Carvedilol
Cimetidin
Cimetidin erhöhte die AUC von Carvedilol um etwa 30%, Cmax bleibt jedoch unverändert. Gegebenenfalls ist bei Patienten, die Inhibitoren für mischfunktionelle Oxidasen erhalten (z.B. Cimetidin), Sorgfalt geboten, da die Serumspiegel von Carvedilol erhöht werden können. Allerdings ist aufgrund der verhältnismässig geringen Wirkung von Cimetidin auf den Carvedilol-Spiegel die Wahrscheinlichkeit einer klinisch bedeutsamen Interaktion minimal.
Fluoxetin
In einer randomisierten Crossover-Studie mit 10 Herzinsuffizienzpatienten führte die gleichzeitige Anwendung von Carvedilol und Fluoxetin, einem starken CYP2D6-Hemmer, zu einer stereoselektiven Inhibition der Carvedilol-Metabolisierung. Dabei wurde im Vergleich zur Placebogruppe eine Zunahme der mittleren AUC des R(+) Enantiomers um 77% und eine statistisch nicht signifikante Zunahme der AUC des S(–) Enantiomers um 35% verzeichnet. Es wurde kein Unterschied zwischen den beiden Gruppen beobachtet, in Bezug auf den unerwünschten Ereignissen, dem arteriellen Blutdruck und der Herzfrequenz.
Herzglykoside (Digoxin, Digitoxin)
Bei gleichzeitiger Anwendung von Digoxin mit Carvedilol sind die Konzentrationen von Digoxin und Digitoxin erhöht. Digoxin, Digitoxin und Carvedilol verlängern alle die AV-Überleitungszeit und daher wird eine verstärkte Überwachung der Digoxinwerte empfohlen bei Einleitung, Anpassung oder Absetzen der Carivalan-Behandlung.
Ciclosporin
Zwei Studien mit Nieren- und Herztransplantationspatienten, die orales Ciclosporin erhielten, zeigten einen Anstieg der Ciclosporin-Plasmakonzentration nach Beginn einer Carvedilol-Behandlung. Es scheint, dass Carvedilol die Exposition gegenüber oral verabreichtem Ciclosporin um ungefähr 10 bis 20% erhöht. Um die therapeutische Ciclosporinkonzentration aufrechtzuerhalten, war eine Reduktion der Ciclosporindosis von 10 bis 20% notwendig. Der Mechanismus dieser Interaktion ist nicht bekannt, jedoch ist möglicherweise eine Hemmung von intestinalem P-Glykoprotein beteiligt. Wegen der breiten interindividuellen Variabilität der Ciclosporinkonzentration wird empfohlen, diese nach Beginn der Carivalan-Behandlung engmaschig zu überwachen und die Dosis von Ciclosporin entsprechend anzupassen. Bei intravenöser Verabreichung von Ciclosporin sollte keine Interaktion mit Carvedilol auftreten.
Insulin und orale blutzuckersenkende Mittel
Arzneimittel mit betablockierender Wirkung können die blutzuckersenkende Wirkung von Insulin und oralen Antidiabetika verstärken. Hypoglykämische Symptome (insbesondere Tachykardie und Palpitationen) können maskiert oder abgeschwächt werden. Daher muss der Blutzucker bei Patienten, die Insulin oder orale Antidiabetika erhalten, engmaschig überwacht werden.
Katecholaminvermindernde Substanzen
Patienten, die sowohl einen Betablocker (wie Carvedilol) als auch katecholaminvermindernde Arzneimittel (z.B. Reserpin, Guanethidin, Methyldopa, Guanfacin und Monoaminoxidase-Hemmer [mit Ausnahme von MAO-B-Hemmern]) einnehmen, sind sorgfältig auf Anzeichen von Hypotonie und/oder schwerer Bradykardie zu überwachen.
Clonidin
Die gleichzeitige Anwendung von Clonidin und Betablockern (wie Carvedilol) kann die blutdruck- und herzfrequenzsenkende Wirkung verstärken. Wenn die gemeinsame Behandlung mit Betablockern und Clonidin beendet werden soll, ist der Betablocker zuerst abzusetzen. Clonidin kann einige Tage später nach einer schrittweisen Verringerung der Dosierung gestoppt werden.
Dihydropyridin
Die gleichzeitige Anwendung von Dihydropyridinen und Carvedilol ist engmaschig zu überwachen, da für diese Situation Fälle von schwerer Hypotonie und Herzinsuffizienz wurden in diesem Zusammenhang beschrieben.
Anästhetika
Eine sorgfältige Überwachung der Vitalzeichen während der Anästhesie wird aufgrund der Synergie der negativ inotropen und hypotensiven Wirkung von Carvedilol und Anästhetika empfohlen.
Beta-agonistische Bronchodilatatoren
Nicht kardioselektive Betablocker heben die bronchodilatatorische Wirkung von Beta-Agonisten auf. Diese Patienten sind engmaschig zu überwachen.
Kombinationen, die berücksichtigt werden müssen
In Verbindung mit Carvedilol
Antihypertensiva
Wie andere Arzneimittel mit betablockierender Aktivität kann Carvedilol die Wirkung anderer gleichzeitig angewandter Arzneimittel, die blutdrucksenkend wirken (z.B. alpha-1-Adrenorezeptorantagonisten) oder deren Nebenwirkungsprofil Hypotonie beinhaltet, verstärken.
Nichtsteroidale Antirheumatika (NSAR)
Die gleichzeitige Anwendung von NSAR und Betablockern kann zu einem Anstieg des Blutdrucks und zu einer verringerten Fähigkeit zur Blutdruckregulierung führen. Die antihypertensive Wirkung von Carvedilol wird aufgrund der Wasser- und Natriumretention verringert.
Östrogene und Kortikosteroide
Die antihypertensive Wirkung von Carvedilol kann aufgrund der Wasser- und Natriumretention bei Patienten mit stabilisiertem Blutdruck, die eine zusätzliche Behandlung wie Östrogenen oder Kortikosteroiden erhalten, verringert sein.
Nitratderivaten
Nitratderivaten verstärken die hypotensive Wirkung.
Sympathomimetika mit alpha- und betamimetischen Wirkungen
Sympathomimetika mit alpha- und betamimetischen Wirkungen erhöhen das Risiko für Hypotonie und ausgeprägte Bradykardie.
Ergotamin
Verstärkung der Vasokonstriktion.
Neuromuskuläre Blocker
Verstärkung der neuromuskulären Blockade.
Betablocker in Form von Augentropfen
Die gleichzeitige Anwendung von Carvedilol mit anderen Betablockern in Form von Augentropfen kann zu einer Zunahme von Nebenwirkungen führen, mit Betablocker mit besonderes Risiko für übermässige Bradykardie.
Barbiturate
Die gleichzeitige Anwendung von Carvedilol und Barbituraten kann aufgrund einer Enzyminduktion zur verminderten Wirksamkeit von Carvedilol führen.
Spezifische Studien zur Erfassung von Interaktionen haben keine klinisch signifikanten pharmakokinetischen oder pharmakodynamischen Interaktionen zwischen Ivabradin und folgender Arzneimittel gezeigt: Protonenpumpenhemmer (Omeprazol, Lansoprazol), Sildenafil, HMG-CoA-Reduktasehemmer (Simvastatin), Kalziumkanalblocker vom Dihydropyridin-Typ (Amlodipin, Lacidipin), Digoxin und Warfarin. Zudem zeigte sich keine klinisch signifikante Wirkung von Ivabradin auf die Pharmakokinetik von Simvastatin, Amlodipin und Lacidipin, weder auf die Pharmakokinetik und Pharmakodynamik von Digoxin und Warfarin und weder noch auf die Pharmakodynamik von Aspirin.
In klinischen Pivot-Studien der Phase III wurden folgende Arzneimittel regelmässig mit Ivabradin ohne Hinweise auf Sicherheitsbedenken kombiniert: ACE-Hemmer, Angiotensin-II-Antagonisten, Betablocker, Diuretika, Aldosteron-Rezeptorantagonisten, kurz- und langwirksame Nitratderivate, HMG-CoA-Reduktasehemmer, Fibrate, Protonenpumpenhemmer, orale Antidiabetika, Aspirin und sonstige Thrombozyten-Aggregationshemmer.
Schwangerschaft/Stillzeit
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter müssen während der Behandlung eine angemessene Verhütungsmethode anwenden (siehe «Kontraindikationen»).
Schwangerschaft
Aufgrund der vorliegenden Daten mit den Einzelwirkstoffen ist die Anwendung von Carivalan während der Schwangerschaft kontraindiziert (siehe «Kontraindikationen»).
Es liegen keine ausreichenden Daten mit der Anwendung von Carvedilol bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt «Präklinische Daten»). Das potenzielle Risiko beim Menschen ist unbekannt. Betablocker verringern die Perfusion der Plazenta, was zum Tod des Fetus im Uterus oder zu unreifen Neugeborenen oder Frühgeburten führen kann. Zusätzlich können Nebenwirkungen bei Föten und Neugeborenen auftreten (insbesondere Hypoglykämie und Bradykardie, Hypotonie, Atemdepression und Hypothermie). Das Risiko kardialer und pulmonaler Komplikationen bei Neugeborenen kann in der postnatalen Phase erhöht sein.
Es liegen keine ausreichenden Daten mit der Anwendung von Ivabradin bei Schwangeren vor.
In tierexperimentellen Reproduktionstoxizitätsstudien mit Ivabradin wurden embryotoxische und teratogene Wirkungen festgestellt (siehe «Präklinische Daten»). Das mögliche Risiko ist klinisch nicht bekannt.
Stillzeit
Carivalan ist während der Stillzeit kontraindiziert (siehe «Kontraindikationen»).
Tierexperimentelle Studien haben gezeigt, dass Carvedilol oder seine Metaboliten in die Muttermilch übergehen. Es ist nicht bekannt, ob Carvedilol bei Frauen in die Muttermilch übergeht.
Tierexperimentelle Studien deuten darauf hin, dass Ivabradin in die Muttermilch übergeht. Frauen, bei denen eine Behandlung mit Ivabradin erforderlich ist, müssen abstillen und eine alternative Ernährungsmethode für ihr Kind wählen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Aufgrund der vorliegenden Daten der Einzelwirkstoffe kann die Anwendung von Carivalan die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen.
Aufgrund der Variabilität der individuellen Reaktionen auf Carvedilol (wie Schwindelgefühl, Müdigkeit oder verminderte Aufmerksamkeit) können die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigt sein. Dies ist vor allem zu Beginn der Behandlung der Fall, sowie nach einer Erhöhung der Dosierung, während eines Wechsels auf ein neues Präparat oder bei gleichzeitigem Alkoholkonsum.
Ivabradin kann die Verkehrstüchtigkeit des Patienten beeinträchtigen. Die Patienten sind darauf hinzuweisen, dass Ivabradin vorübergehende Lichtbedingte visuelle Symptome verursachen kann (hauptsächlich Phosphene). Diese Phänomene können bei plötzlicher Veränderung der Lichtintensität auftreten, insbesondere bei Nachtfahrten. Nach der Markteinführung wurden Fälle beeinträchtigter Verkehrstüchtigkeit aufgrund visueller Symptome berichtet.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Die Häufigkeit unerwünschter Wirkungen von Carvedilol ist nicht dosisabhängig, mit Ausnahme von Schwindelgefühl, Sehstörungen und Bradykardie.
Die häufigsten unerwünschten Wirkungen von Ivabradin (lichtbedingte visuelle Symptome [Phosphene] und Bradykardie) sind dosisabhängig und auf die pharmakologische Wirkung des Arzneimittels zurückzuführen.
Liste der unerwünschten Wirkungen
Die folgenden unerwünschten Wirkungen wurden im Rahmen klinischer Studien und/oder während der Anwendung von Carvedilol und Ivabradin (einzeln gegeben) nach Markteinführung beobachtet und sind nach der MedDRA-Klassifikation nach Systemorganklasse und nachfolgenden Häufigkeiten geordnet:
Sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1'000, <1/100); selten (≥1/10'000, <1/1'000); sehr selten (<1/10'000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Carvedilol
Infektionen und parasitäre Erkrankungen
Häufig: Bronchitis, Pneumonie, Infektionen der oberen Atemwege, Harnwegsinfektionen
Erkrankungen des Blutes und des Lymphsystems
Häufig: Anämie
Selten: Thrombozytopenie
Sehr selten: Leukopenie
Erkrankungen des Immunsystems
Sehr selten: allergische Reaktionen (Überempfindlichkeit)
Stoffwechsel- und Ernährungsstörungen
Häufig: Hypercholesterinämie, Verschlechterung der glykämischen Kontrolle (Hyper- oder Hypoglykämie) bei Patienten mit bestehendem Diabetes, Diabetes mellitus.
Psychiatrische Erkrankungen
Häufig: depressive Stimmung, Depression
Gelegentlich: Schlafstörungen, Albträume, Verwirrtheit
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen, Schwindelgefühl
Gelegentlich: Synkope, Präsynkope, Parästhesien
Augenerkrankungen
Häufig: verminderte Tränensekretion, Sehstörungen, Augenreizung.
Herzerkrankungen
Sehr häufig: Herzinsuffizienz
Häufig: Bradykardie, Lungenödem, Ödeme (einschliesslich generalisierte und periphere Ödeme sowie Schwellungen im Genitalbereich und der Füsse, Hypervolämie und Flüssigkeitsretention)
Gelegentlich: AV-Block, Angina pectoris.
Gefässerkrankungen
Sehr häufig: Hypotonie
Häufig: orthostatische Hypotonie, Störungen der peripheren Zirkulation (kalte Gliedmassen, periphere Gefässerkrankungen, Verschlechterung einer Claudicatio intermittens und Raynaud-Syndrom).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Dyspnoe, Asthma bei prädisponierten Patienten
Selten: Nasenverstopfung, pfeifende Atmung
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Durchfall, Abdominalschmerz, Erbrechen, Dyspepsie.
Gelegentlich: Verstopfung
Selten: Mundtrockenheit
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Hautreaktionen (allergisches Exanthem, Dermatitis, Urtikaria, Pruritus und vermehrtes Schwitzen), mit Lichen planus, Psoriasis oder psoriasiformem Exanthem vergleichbare Reaktionen (treten mehrere Wochen oder Jahre nach Behandlungsbeginn auf), bestehende Läsionen können sich verschlimmern), Alopezie
Sehr selten: schwere Hautreaktionen (wie Erythema multiforme, Stevens-Johnson-Syndrom oder toxische epidermale Nekrolyse).
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Schmerzen in den Extremitäten, Gicht
Erkrankungen der Nieren und Harnwege
Häufig: Niereninsuffizienz und Nierenfunktionsstörungen bei Patienten mit diffuser Gefässerkrankung und/oder einer zugrunde liegenden Niereninsuffizienz, Miktionsstörungen
Sehr selten: Harninkontinenz bei Frauen
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Asthenie, Müdigkeit
Häufig: Schmerzen
Untersuchungen
Häufig: Gewichtszunahme
Sehr selten: erhöhte Transaminasenwerte (ALT, AST und GGT)
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Impotenz, erektile Dysfunktion
Ivabradin
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Eosinophilie
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Hyperurikämie
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen (in der Regel während des ersten Behandlungsmonats), Schwindel (möglicherweise im Zusammenhang mit Bradykardie)
Gelegentlich: Synkope (möglicherweise im Zusammenhang mit Bradykardie)*
Augenerkrankungen
Sehr häufig: lichtbedingte visuelle Phänomene (Phosphene): Diese von 14,5% der Patienten beobachtete Störung wird als eine vorübergehend erhöhte Lichtintensität in einem begrenzten Bereich des Gesichtsfeldes beschrieben. Sie werden gewöhnlich durch plötzliche Lichtstärkenveränderungen ausgelöst. Phosphene können auch als Lichtkranz um eine Lichtquelle, Bildauflösung (stroboskopische oder kaleidoskopische Effekte), farbige, helle Lichter oder Mehrfachbilder (retinale Persistenz) beschrieben werden. Phosphene treten in der Regel in den ersten beiden Behandlungsmonaten auf. Danach können sie wiederholt auftreten. In der Regel sind Phosphene leicht bis mässig stark ausgeprägt. In den meisten Fällen verschwinden sie im Laufe der Behandlung (77,5% der Fälle) oder nach dem Absetzen der Behandlung. Weniger als 1% der Patienten änderte aufgrund von Phosphenen die alltäglichen Gewohnheiten oder brach die Behandlung ab.
Häufig: verschwommenes Sehen
Gelegentlich: Diplopie, vermindertes Sehvermögen
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Schwindel
Herzerkrankungen
Häufig: Bradykardie: bei 3,3% der Patienten insbesondere innerhalb der ersten zwei bis drei Monate nach Behandlungsbeginn; 0,5% der Patienten erlitten eine schwere Bradykardie mit nicht mehr als 40 Herzschlägen pro Minute, AV-Block 1. Grades (AVB I – Verlängerung des PQ-Intervalls im EKG), ventrikuläre Extrasystolen, Vorhofflimmern, ventrikuläre Tachykardie*
Gelegentlich: Palpitationen, supraventrikuläre Extrasystolen, Kammerflimmern*
Selten*: Torsades de pointes
Sehr selten: AV-Block 2. und 3. Grades, Sick-Sinus-Syndrom
Die folgenden Ereignisse wurden in klinischen Studien in ähnlicher Häufigkeit wie bei Vergleichspräparaten berichtet und/oder standen in möglichem Zusammenhang mit der Grunderkrankung: Sinusarrhythmien, instabile Angina pectoris, Verschlechterung der Angina pectoris, Vorhofflimmern, myokardiale Ischämie, Myokardinfarkt und ventrikuläre Tachykardie.
Gefässerkrankungen
Häufig: Unkontrollierter Blutdruck
Gelegentlich: Hypotonie (möglicherweise im Zusammenhang mit Bradykardie)
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Dyspnoe
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Übelkeit, Verstopfung, Durchfall, Bauchschmerzen*
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Angioödem*, Hautausschlag*
Selten: Erythem*, Pruritus*, Urtikaria*
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Muskelkrämpfe.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Müdigkeit (möglicherweise im Zusammenhang mit Bradykardie)*, Asthenie (möglicherweise im Zusammenhang mit Bradykardie)*
Selten: Unwohlsein (möglicherweise im Zusammenhang mit Bradykardie)*
Untersuchungen
Gelegentlich: Erhöhung der Kreatininwerte im Blut, Verlängerung des QT-Intervalls im EKG
* Die Häufigkeit für unerwünschte Ereignisse, die nach der Markteinführung gemeldet wurden (Spontanberichte), wurde anhand von Daten aus klinischen Studien berechnet.
Beschreibung ausgewählter Nebenwirkungen
Carvedilol
Schwindel, Synkope, Kopfschmerzen und Schwächegefühl sind üblicherweise von leichtem Schweregrad und treten mit höherer Wahrscheinlichkeit zu Beginn der Behandlung auf.
Herzinsuffizienz ist ein häufig gemeldetes unerwünschtes Ereignis sowohl bei mit Placebo als auch mit Carvedilol behandelten Patienten (14,5% bzw. 15.4% bei Patienten mit linksventrikulärer Dysfunktion nach akutem Myokardinfarkt).
Im Rahmen einer Therapie mit Carvedilol wurden bei Patienten mit chronischer Herzinsuffizienz und niedrigem Blutdruck, ischämischer Herzkrankheit und/oder zugrunde liegender Niereninsuffizienz reversible Verschlechterungen der Nierenfunktion beobachtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Vor allem nicht selektive Betablocker können für die Progression vom latenten Diabetes zum offenen Diabetes, für die Verschlechterung eines manifesten Diabetes und zur Beeinträchtigung der Blutzuckerregulierung verantwortlich sein. In seltenen Fällen kann während der Behandlung mit Carvedilol der Kohlenhydratstoffwechsel ebenfalls geringfügig gestört sein.
Carvedilol kann bei Frauen Harninkontinenz verursachen. Diese Störung verschwindet, wenn die Behandlung beendet wird.
Ivabradin
Ivabradin in Kombination mit einem Betablocker
In einer randomisierten, placebokontrollierten Studie mit Patienten, bereits unter Betablockern ist das Profil der gemeldeten Nebenwirkungen ähnlich wie das vorherige. Allerdings betrug die Häufigkeit der Nebenwirkungen bei der Kombination Ivabradin-Betablocker 9,1% im Vergleich zu 2,7% für die Kombination Placebo-Betablocker. Dieser Unterschied ist vor allem auf eine erhöhte Inzidenz von Bradykardie zurückzuführen (4,2% gegenüber 0,5%), die am häufigsten asymptomatisch verläuft (3,1% gegenüber 0,5%).
In der SIGNIFY-Studie wurde Vorhofflimmern bei 5,3% der Patienten, die Ivabradin einnahmen, beobachtet (im Vergleich zu 3,8% in der Placebogruppe). In einer gepoolten Analyse aller doppelblinden Studien der Phasen II und III mit einer Mindestdauer von drei Monaten, die insgesamt mehr als 40'000 Patienten einschloss, betrug die Inzidenz von Vorhofflimmern 4,86% bei Patienten, die mit Ivabradin behandelt wurden, und 4,08% in den Kontrollgruppen (RR 1,26, 95% KI [1,15–1,39]).
In der SHIFT-Studie wurde die ventrikuläre Tachykardie als häufige unerwünschte Wirkung mit einer Inzidenz von 1,86% in der ivabradine Gruppe gegenüber 2,15% in der Placebogruppe berichtet.
Überdosierung
Es liegen keine Informationen über eine Überdosierung mit Carivalan beim Menschen vor.
Symptome
In Verbindung mit Carvedilol
Im Falle einer Überdosierung kann es zu schwerer Hypotonie, Bradykardie, Herzinsuffizienz, kardiogenem Schock und Herzstillstand kommen. Atemnot, Bronchospasmen, Erbrechen, veränderter Bewusstseinszustand und generalisierte Krampfanfälle können ebenfalls auftreten.
In Verbindung mit Ivabradin
Eine Überdosierung kann zu einer schweren und protrahierten Bradykardie führen (siehe «Unerwünschte Wirkungen»).
Behandlung
Neben allgemeinen Massnahmen muss gegebenenfalls unter intensivmedizinischen Bedingungen die Überwachung und Korrektur der Vitalzeichen erfolgen. Innerhalb von vier Stunden nach Einnahme können eine Magenspülung, Aktivkohle und induziertes Erbrechen die gastro-intestinale Absorption von Carvedilol verringern.
Die Patienten sind in Rückenlage zu bringen. Bei schwerer Bradykardie, die symptomatisch in einer spezialisierten Umgebung zu behandeln ist, können 0,5 bis 2 mg Atropin intravenös (i.v.) und/oder 1 bis 10 mg Glucagon i.v. (gefolgt von einer langsamen i.v.-Infusion von 2 bis 5 mg/Stunde, falls erforderlich) gegeben werden. Zur Unterstützung der Ventrikelfunktion wird die intravenöse Gabe von Glucagon oder Sympathomimetika (z.B. Dobutamin, Isoprenalin, Orciprenalin, Adrenalin, abhängig von Körpergewicht und Wirkung) empfohlen. Im Falle einer hämodynamisch schlecht vertragenen Bradykardie ist eine symptomatische Behandlung mit intravenösen betastimulierenden Wirkstoffen wie Isoprenalin in Betracht zu ziehen. Vorübergehend kann bei Bedarf ein kardialer elektrischer Schrittmacher verwendet werden. Eine ausgeprägte Hypotonie kann durch intravenöse Flüssigkeitszufuhr behandelt werden.
Ist ein positiv inotroper Effekt erforderlich, ist die Gabe eines Phosphodiesterase-Hemmers wie Milrinon in Erwägung zu ziehen. Bei arzneimittelresistenter Bradykardie kann die Einleitung einer Herzschrittmacher-Therapie erforderlich sein. Sofern im Intoxikationsbild eine periphere Vasodilatation überwiegt, ist Norfenefrin oder Noradrenalin unter ständiger Kreislaufüberwachung zu verabreichen, entweder 5 bis 10 Mikrogramm i.v., mit wiederholter Gabe je nach Ansprechen des arteriellen Blutdrucks, oder 5 Mikrogramm pro Minute als Infusion und entsprechend dem arteriellen Blutdruck.
Bei Bronchospasmen können β-Sympathomimetika (als Aerosol oder intravenös) oder Aminophyllin i.v. als langsame Injektion oder Infusion gegeben werden.
Bei Konvulsionen wird die langsame intravenöse Injektion von Diazepam oder Clonazepam empfohlen.
Bei einer schweren Überdosierung mit Schocksymptome muss die symptomatische Behandlung ausreichend lange fortgesetzt werden, da eine Verlängerung der Eliminationshalbwertszeit und Umverteilung von Carvedilol aus tieferen Kompartimenten zu erwarten sind. Daher ist die symptomatische Behandlung fortzusetzen, bis sich der Zustand des Patienten stabilisiert. Die Behandlungsdauer ist abhängig vom Schweregrad der Überdosierung.
Carvedilol wird nicht durch Dialyse eliminiert, da der Wirkstoff, wahrscheinlich aufgrund seiner hohen Plasmaproteinbindung, nicht dialysierbar ist.
Eigenschaften/Wirkungen
ATC-Code: C07FX06
Wirkungsmechanismus
Carvedilol
Carvedilol ist ein vasodilatierender, nicht selektiver Betablocker, der den peripheren Gefässwiderstand durch selektive alpha-1-Rezeptorblockade verringert und das Renin-Angiotensin-System durch nicht selektive beta-Rezeptorblockade unterdrückt.
Die Plasma-Renin-Aktivität wird verringert und eine Flüssigkeitsretention tritt selten auf.
Carvedilol besitzt keine intrinsische sympathomimetische Aktivität. Wie Propranolol hat es membranstabilisierende Eigenschaften.
Carvedilol ist ein Razemat aus zwei Stereoisomeren. In Tierversuchen zeigten beide Enantiomere alpha-Adrenozeptor-blockierende Merkmale. Die nicht selektive beta-1- und beta-2-Adrenozeptor-Blockade wird hauptsächlich dem S(–) Enantiomer zugeschrieben.
Die antioxidativen Eigenschaften von Carvedilol und dessen Metaboliten wurden in in vitro Studien und in vivo tierexperimentellen Studien sowie bei einer Reihe von humanen Zelltypen in vitro nachgewiesen.
Ivabradin
Ivabradin ist ein rein herzfrequenzsenkender Wirkstoff, der eine selektive und spezifische Hemmung des If-Stromes bewirkt, welcher die spontane diastolische Depolarisation im Sinusknoten kontrolliert und die Herzfrequenz reguliert.
Die kardialen Wirkungen sind spezifisch für den Sinusknoten und haben weder Einfluss auf intraatriale, atrioventrikuläre oder intraventrikuläre Überleitungszeiten noch auf die myokardiale Kontraktilität oder die ventrikuläre Repolarisation. In experimentellen Modellen bleibt die Anpassung der myokardialen Kontraktilität, des Herzzeitvolumens, der durchschnittlichen Koronarperfusion und der unter Belastung beobachteten Gefässwiderstände erhalten.
In Tierversuchsmodellen der Belastungsischämie (Ursache für Angina pectoris beim Menschen) verringert Ivabradin signifikant die Myokardischämie sowie die auf der «Betäubung» des Myokards beruhende Störung der myokardialen Kontraktilität («Stunning»). Die myokardiale Kontraktilität wird mit Ivabradin schneller wieder hergestellt als bei der Behandlung mit Betablockern.
Ivabradin kann auch Effekte auf den Netzhautstrom Ih haben, der dem If-Strom des Herzens ähnelt. Er ist beteiligt an der temporären Auflösung des visuellen Systems, indem er die Antwort der Netzhaut auf helle Lichtreize verkürzt. Unter Trigger-Bedingungen (so wie schnelle Lichtstärkenänderungen) ist die teilweise Hemmung des Ih-Stroms durch Ivabradin Ursache der lichtbedingten Symptome, die gelegentlich von Patienten wahrgenommen werden. Lichtbedingte Symptome (Phosphene) werden als vorübergehend erhöhte Lichtintensität in einem begrenzten Bereich des Gesichtsfeldes beschrieben (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Pharmakodynamik
Carvedilol
Bei hypertensiven Patienten geht eine Blutdrucksenkung nicht mit einem gleichzeitigen Anstieg des peripheren Gefässwiderstands einher, wie dies bei reinen Betablockern beobachtet wurde. Die Herzfrequenz wird geringfügig verringert. Das Schlagvolumen bleibt unverändert. Der renale Blutfluss und die Nierenfunktion bleiben ebenso wie der periphere Blutfluss im normalen Bereich. Daher kommt es selten zu kalten Extremitäten, die bei Betablockern häufig auftreten. Bei hypertensiven Patienten erhöht Carvedilol die Noradrenalinkonzentration im Plasma.
Bei der langfristigen Behandlung von Patienten mit Angina pectoris zeigte Carvedilol eine antiischämische und schmerzlindernde Wirkung. In hämodynamischen Studien senkte Carvedilol die ventrikuläre Vor- und Nachlast.
Bei Patienten mit linksventrikulärer Dysfunktion oder kongestiver Herzinsuffizienz wirkt sich Carvedilol auf die Hämodynamik sowie die Ejektionsfraktion und die Grösse der linken Herzkammer günstig aus. Bei Herzinsuffizienzpatienten verringert Carvedilol die Mortalität und die Notwendigkeit einer kardiovaskulär bedingten Hospitalisierung.
Carvedilol wirkt sich weder auf das Serumlipidprofil noch auf die Elektrolyte ungünstig aus. Das Verhältnis von High-Density- zu Low-Density-Lipoproteinen bleibt normal.
Ivabradin
Die hauptsächliche pharmakodynamische Eigenschaft von Ivabradin beim Menschen ist eine spezifische und dosisabhängige Herzfrequenzsenkung.
Bei den gewöhnlich empfohlenen Dosierungen sinkt die Herzfrequenz sowohl in der Ruhestellung als auch unter Belastung um etwa 10 Schläge pro Minute (bpm). Dies führt zu einer Verringerung der Herzarbeit und des myokardialen Sauerstoffverbrauchs.
Eine durchschnittliche Reduzierung der Herzfrequenz um 20 bpm wurde mit einer Dosierung von 20 mg zweimal täglich erzielt, ohne dass dabei Verträglichkeitsprobleme beobachtet wurden. Die Analyse der Herzfrequenzsenkung zeigt eine Tendenz zum Plateaueffekt bei hohen Dosierungen. Das Risiko einer schweren oder schlecht tolerierten Bradykardie ist somit sehr gering. Ivabradin hat keinen Einfluss auf die intrakardiale Erregungsleitung, die Kontraktilität (keine negativ inotrope Wirkung) oder die ventrikuläre Repolarisation:
- In klinischen elektrophysiologischen Studien hatte Ivabradin keinen Einfluss auf atrioventrikuläre oder intraventrikuläre Erregungsleitungszeiten oder korrigierte QT-Intervalle.
- Spezifische Studien an über 100 Patienten mit linksventrikulärer Dysfunktion ergaben, dass während einer Ivabradin-Therapie die myokardiale Kontraktilität aufrecht erhalten bleibt.
Klinische Wirksamkeit und Sicherheit
Carvedilol
Klinische Studien haben gezeigt, dass das Gleichgewicht zwischen Vasodilatation und der betablockierenden Wirkung von Carvedilol zu folgenden hämodynamischen und metabolischen Wirkungen führt:
- Bei hypertensiven Patienten geht eine Blutdrucksenkung nicht mit einem Anstieg des totalen peripheren Gefässwiderstandes einher.
- Die Herzfrequenz bleibt unverändert oder kann geringfügig sinken.
- Die renale Durchblutung und die glomeruläre Filtration sind nicht modifiziert.
- Carvedilol erhält die periphere Durchblutung aufrecht, sodass die Extremitäten nur in Ausnahmefällen kalt werden.
- Das Verhältnis zwischen HDL und LDL bleibt normal.
- Die Serumelektrolytwerte sind nicht modifiziert.
- Carvedilol stimuliert nicht das Renin-Angiotensin-System, sondern senkt die Plasmakonzentration von Renin. Wasserretention wird selten beobachtet.
- Bei Herzinsuffizienzpatienten wirkte sich Carvedilol günstig auf die Hämodynamik aus und führte zu einer Verbesserung der Grösse und Auswurffraktion der linken Herzkammer. Bei Patienten mit ischämischer Herzkrankheit zeigte Carvedilol antiischämische und antianginöse Eigenschaften. Carvedilol senkt die ventrikuläre Vor- und Nachlast.
In einer gross angelegten, multizentrischen, placebokontrollierten Doppelblindstudie zur Mortalität (COPERNICUS) wurden 2'289 Patienten mit stabiler, schwerer chronischer Herzinsuffizienz ischämischer oder nicht ischämischer Ursache, die eine Standard-Therapie erhielten, randomisiert und erhielten entweder eine Behandlung mit Carvedilol (1'156 Patienten) oder einem Placebo (1'133 Patienten). Die Patienten litten an einer systolischen Funktionsstörung des linken Ventrikels und wiesen eine durchschnittliche Auswurffraktion von weniger als 20% auf. Die Gesamtmortalität war um 35% verringert und betrug 19,7% in der Placebogruppe und 12,8% in der Carvedilolgruppe (Proportional-Hazards-Modell nach Cox, p = 0,00013). Die positive Wirkung von Carvedilol auf die Mortalität war in allen untersuchten Untergruppen konstant. Das Auftreten von plötzlichem Herztod war in der Carvedilolgruppe um 41% reduziert (4,2% gegenüber 7,8%). Die kombinierten sekundären Endpunkte (Mortalität oder Hospitalisierungen wegen Herzinsuffizienz, Mortalität oder Hospitalisierungen wegen Herz-Kreislauf-Krankheiten sowie Mortalität und Hospitalisierungen ohne Rücksicht auf die Ursache) waren in der Carvedilolgruppe im Vergleich zur Placebogruppe ausnahmslos signifikant verbessert (Reduktion um 31%, 27% bzw. 24%, p = 0,00004). Die Inzidenz schwerer unerwünschter Wirkungen während der Studie war in der Carvedilolgruppe geringer (39,0% gegenüber 45,4%). Zu Behandlungsbeginn war die Inzidenz einer sich verschlechternden Herzinsuffizienz in beiden Gruppen vergleichbar. Die Häufigkeit einer sich verschlechternden Herzinsuffizienz während der Studie war in der Carvedilolgruppe geringer (14,5% gegenüber 21,1%).
Ivabradin
Die antianginöse und antiischämische Wirksamkeit von Ivabradin wurde in fünf doppelblinden, randomisierten Studien untersucht (drei Studien im Vergleich zu einem Placebo und jeweils eine im Vergleich zu Atenolol und Amlodipin). An diesen Studien nahmen insgesamt 4'111 Patienten mit chronischer stabiler Angina pectoris teil. Davon wurden 2'617 mit Ivabradin behandelt.
Die Wirksamkeit von Ivabradin (5 mg zweimal täglich) wurde bei allen Belastungstestparametern innerhalb von drei bis vier Wochen nach Behandlungsbeginn gezeigt. Diese Wirksamkeit bestätigte sich auch bei einer Dosierung von 7,5 mg zweimal täglich. Der zusätzliche Effekt gegenüber einer Dosierung von 5 mg zweimal täglich wurde insbesondere in einer referenzkontrollierten Studie (im Vergleich zu Atenolol) festgestellt: Die gesamte Belastungsdauer bei den niedrigsten Plasmaspiegeln stieg nach einer einmonatigen Behandlung mit Ivabradin 5 mg zweimal täglich um etwa eine Minute an und verlängerte sich um rund 25 Sekunden nach einer zusätzlichen dreimonatigen Behandlung mit Ivabradin bei einer Dosierung von 7,5 mg zweimal täglich. In dieser Studie wurde die antianginöse und antiischämische Wirkung von Ivabradin bei Patienten im Alter von 65 Jahren und darüber bestätigt. Die Wirksamkeitsergebnisse der Dosierungen zu 5 und 7,5 mg Ivabradin zweimal täglich waren konsistent in allen Studien und im Hinblick auf alle Parameter der Belastungstests (gesamte Belastungsdauer, Zeit bis zu limitierender Angina, Zeit bis zum Beginn der Angina und Zeit bis zur ST-Streckensenkung um 1 mm) und gingen mit einer Senkung der Häufigkeit von Angina-Pectoris-Anfällen um etwa 70% einher. Indem Ivabradin zweimal täglich verabreicht wurde, konnte die Wirksamkeit über 24 Stunden konstant aufrechterhalten werden.
In einer randomisierten, placebokontrollierten Studie mit 889 Patienten zeigte Ivabradin in Kombination mit Atenolol (einmal täglich 50 mg) zusätzliche Wirksamkeit bei allen Belastungstestparametern zum Zeitpunkt der Talspiegelkonzentration (12 Stunden nach der Einnahme).
Die Wirksamkeit von Ivabradin hielt im gesamten Verlauf der drei- oder viermonatigen Behandlungsperioden der Wirksamkeitsstudien an. Es gab keinen Hinweis auf eine pharmakologische Toleranzentwicklung (Wirksamkeit Senkung) während der Behandlung oder auf einen Rebound-Effekt nach abruptem Absetzen der Behandlung. Die langfristige Wirksamkeit von Ivabradin zur Behandlung von Angina-pectoris-Symptomen hat sich in einer einjährigen Studie mit über 1'000 Patienten bestätigt, die mit 5 oder 7,5 mg Ivabradin zweimal täglich behandelt wurden. Die antianginöse und antiischämische Wirkung von Ivabradin stand in Zusammenhang mit einer dosisabhängigen Herzfrequenzsenkung und einer signifikanten Senkung des «Rate Pressure Product» (Herzfrequenz x systolischer Blutdruck) in Ruhe und unter Belastung. Keine Auswirkungen auf den Blutdruck wurden beobachtet.
Die gross angelegte Studie BEAUTIFUL wurde mit 10'917 Patienten durchgeführt, die an koronarer Herzkrankheit und linksventrikulärer Dysfunktion (LVEF <40%) litten und bereits eine optimale Basistherapie erhielten (86,9% der Patienten erhielten Betablocker). Hauptwirksamkeitskriterium war der kombinierte Endpunkt aus kardiovaskulärem Tod, Hospitalisierung wegen akuten Myokardinfarktes und Hospitalisierung wegen neu auftretender oder sich verschlechternder Herzinsuffizienz. Die Studie zeigte im Hinblick auf den primären kombinierten Endpunkt keinen Unterschied zwischen der Ivabradin- und der Placebogruppe (relatives Risiko Ivabradin zu Placebo 1,00, p = 0,945).
In einer Post-hoc-Studie einer Subgruppe von Patienten mit symptomatischer Angina pectoris zum Zeitpunkt der Randomisierung (n = 1'507) wurde kein Sicherheitsproblem in Bezug auf kardiovaskulären Tod, Hospitalisierung wegen akuten Myokardinfarktes oder Herzinsuffizienz identifiziert (Ivabradin 12,0% gegenüber Placebo 15,5%, p = 0,05).
19'102 Patienten mit koronarer Herzerkrankung und ohne klinische Herzinsuffizienz (LVEF >40%), die bereits eine optimale Therapie erhielten, nahmen an der gross angelegten Studie SIGNIFY teil. Es wurde ein Therapieschema gewählt, das höher als die zugelassene Dosierung war: Die Startdosierung betrug 7,5 mg zweimal täglich (5 mg zweimal täglich bei Patienten im Alter von mindestens 75 Jahre) und wurde dann auf bis zu 10 mg zweimal täglich gesteigert. Das Hauptwirksamkeitskriterium war der kombinierte Endpunkt aus kardiovaskulärem Tod und nicht tödlichem Myokardinfarkt. Die Studie zeigte keinen Unterschied zwischen der Ivabradin- und der Placebogruppe bei der Häufigkeit des primären kombinierten Endpunkts (relatives Risiko Ivabradin zu Placebo 1,08, p = 0,197). Bradykardie wurde bei 17,9% der Patienten in der Ivabradingruppe berichtet (2,1% in der Placebogruppe). 7,1% der Patienten erhielten während der Studie zusätzlich Verapamil, Diltiazem oder starke CYP3A4-Inhibitoren.
Es wurde ein kleiner, doch statistisch signifikanter Anstieg des primären zusammengesetzten Endpunkts in einer zuvor festgelegten Subgruppe von Patienten mit symptomatischer Angina pectoris beobachtet, deren Erkrankung zu Behandlungsbeginn den CCS-Grad II oder darüber aufwies (n = 12'049) (jährliche Inzidenzrate 3,4% gegenüber 2,9%, relatives Risiko Ivabradin zu Placebo 1,18, p = 0,018). In der Subgruppe der Patienten mit symptomatischer Angina pectoris mit CCS-Grad ≥ I (n = 14'286) war dieser signifikante Unterschied jedoch nicht festzustellen (relatives Risiko Ivabradin zu Placebo 1,11, p = 0,110). Diese Ergebnisse sind nicht vollständig auf die in der Studie verwendete höhere Dosierung zurückzuführen, die über der zugelassenen Dosierung liegt.
An einer Studie zur Morbidität und Mortalität (SHIFT) nahmen 6'505 Erwachsene mit mässigen bis schweren Symptomen chronischer Herzinsuffizienz und reduzierter linksventrikulärer Ejektionsfraktion (LVEF ≤35%) teil.
SHIFT war eine multizentrische, internationale, randomisierte, doppelblinde, placebokontrollierte Studie.
Die Teilnehmer dieser Studie litten unter einer systolischen, chronischen Herzinsuffizienz der NYHA-Klassen II (48,7% der Population), III (49,5%) und IV (1,7%), die seit mindestens vier Wochen stabil war, waren innert der letzten 12 Monate aufgrund der Verschlimmerung der Herzinsuffizienz hospitalisiert worden und wiesen bei der Inklusion einen Sinusrhythmus mit einer Ruhefrequenz von ≥70 bpm auf. Die Patienten erhielten eine Standardtherapie, inklusive Betablocker (89%), ACE-Hemmer und/oder Angiotensin-II-Antagonisten (91%), Diuretika (83%), Aldosteron-Antagonisten (60%) und Digitalis-Präparate (22%). In der Ivabradingruppe lag die durchschnittliche Dosis bei 6,4 ± 1,4 mg zweimal täglich. Der mediane Beobachtungszeitraum betrug 22,9 Monate.
Der primäre Endpunkt war ein kombinierter Endpunkt aus kardiovaskulärer Mortalität (inklusive unbekannte Todesursache) und Hospitalisierung wegen Verschlimmerung der Herzinsuffizienz. Die Studie zeigte eine klinisch und statistisch signifikante Reduktion des relativen Risikos um 18% im Hinblick auf den primären kombinierten Endpunkt (Hazard Ratio Ivabradin zu Placebo: 0,82, 95% KI [0,75; 0,90], p <0,0001). Die Reduktion des absoluten Risikos betrug 4,2%. Die Wirkung trat innerhalb von 3 Monaten nach Behandlungsbeginn ein und war in den 6 Monaten nach Behandlungsbeginn signifikant.
Die Reduktion des Auftretens des primären Endpunktes wurde gleichermassen beobachtet, unabhängig von Geschlecht, der NYHA-Klasse, der Einnahme oder nicht von Betablockern, der ischämischer Ätiologie oder nicht, der Herzinsuffizienz und der vorgeschichtlichen Diabetes oder Hypertonie.
Behandlungseffekt auf den primären kombinierten Endpunkt, seine Komponenten und die sekundären Endpunkte.
Ivabradin | Placebo | Hazard Ratio | p-Wert | |
|---|---|---|---|---|
Primärer, kombinierter Endpunkt | 793 (24,47) | 937 (28,71) | 0,82 [0,75; 0,90] | <0,0001 |
Komponenten des kombinierten Endpunkts: | ||||
| 449 (13,85) | 491 (15,04) | 0,91 [0,80; 1,03] | 0,128 |
| 514 (15,86) | 672 (20,59) | 0,74 [0,66; 0,83] | <0,0001 |
Andere sekundäre Endpunkte: | ||||
| 503 (15,52) | 552 (16,91) | 0,90 [0,80; 1,02] | 0,092 |
| 113 (3,49) | 151 (4,63) | 0,74 [0,58; 0,94] | 0,014 |
| 1'231 (37,98) | 1'356 (41,54) | 0,89 [0,82; 0,96] | 0,003 |
| 977 (30,15) | 1'122 (34,38) | 0,85 [0,78; 0,92] | 0,0002 |
Eine Verbesserung der NYHA-Klasse wurde in der letzten Beurteilung beobachtet: 887 Patienten (28%) der Ivabradingruppe wiesen eine Verbesserung auf (gegenüber 776 [24%] der Placebogruppe [p = 0,001]).
Die Behandlung mit Ivabradin war mit einer durchschnittlichen Verringerung der Herzfrequenz um 11 bpm im Vergleich zur Placebogruppe verbunden (Referenzwert 80 bpm); diese blieb während der gesamten Dauer der Studie erhalten.
In einer randomisierten, placebokontrollierten Studie mit 725 Patienten zeigte Ivabradin in Kombination mit Amlodipin zum Zeitpunkt des Wirkminimums (12 Stunden nach der Einnahme) keine zusätzliche Wirksamkeit, wohingegen zum Zeitpunkt des Wirkmaximums (3-4 Stunden nach der Einnahme) eine zusätzliche Wirkung nachgewiesen werden konnte.
In einer randomisierten, placebokontrollierten Studie mit 97 Patienten wurden mithilfe spezifischer ophthalmologischer Untersuchungen (insbesondere Elektroretinogramm, statische und kinetische Perimetrie, Farbsehvermögen, Sehschärfe) Daten erhoben, um die Funktion des Zapfen- und Stäbchensystems und des aufsteigenden visuellen Signalwegs zu dokumentieren. Dabei wurde bei den Patienten mit chronischer stabiler Angina pectoris, die seit über 3 Jahren mit Ivabradin behandelt wurden, keine retinale Toxizität festgestellt.
Pharmakokinetik
Die Geschwindigkeit und das Ausmass der Absorption von Ivabradin und Carvedilol aus Carivalan unterscheiden sich nicht signifikant von der Geschwindigkeit und dem Ausmass der Absorption bei der Einnahme von Ivabradin und Carvedilol als Einzelsubstanzen.
Carvedilol
Absorption
Die absolute Bioverfügbarkeit von oral verabreichtem Carvedilol beträgt etwa 25%. Die maximale Plasmakonzentration wird ungefähr eine Stunde nach der Einnahme erreicht. Zwischen Dosis und Plasmakonzentration besteht eine lineare Beziehung. Bei Patienten mit langsamer Debrisoquin-Hydroxylierung erhöhte sich die Plasmakonzentration von Carvedilol auf das Zwei- bis Dreifache im Vergleich zu schnellen Debrisoquin-Metabolisierern. Die Bioverfügbarkeit wird durch Nahrungsaufnahme nicht beeinflusst, allerdings wird die maximale Plasmakonzentration später erreicht.
Distribution
Carvedilol ist hoch lipophil. Die Plasmaproteinbindung liegt bei etwa 98 bis 99%. Das Verteilungsvolumen beträgt etwa 2 l/kg.
Metabolismus
Carvedilol wird umfassend zu verschiedenen Metaboliten abgebaut, die hauptsächlich biliär ausgeschieden werden. Der First-Pass-Effekt nach oraler Anwendung liegt bei etwa 60 bis 75%. Der enterohepatische Kreislauf der Ausgangssubstanz wurde in Tierstudien nachgewiesen.
Carvedilol wird in der Leber hauptsächlich durch Oxidierung des aromatischen Rings und Glucuronidierung metabolisiert. Durch Demethylierung und Hydroxylierung am Phenolring entstehen drei aktive Metaboliten mit betablockierender Aktivität. Die vasodilatierende Wirkung dieser drei aktiven Metaboliten ist im Vergleich zu Carvedilol schwach. Präklinische Studien haben gezeigt, dass die betablockierende Aktivität des 4‑Hydroxyphenol-Metaboliten ungefähr 13-mal höher ist als jene von Carvedilol. Allerdings sind die Konzentrationen des Metaboliten beim Menschen etwa 10-mal geringer als jene von Carvedilol. Zwei der Hydroxycarbazol-Metaboliten von Carvedilol sind hochwirksame Antioxidanzien mit einer 30- bis 80-fach höheren Wirkstärke als jene von Carvedilol.
Die oxidative Metabolisierung von Carvedilol ist stereoselektiv. Das R-Enantiomer wird hauptsächlich durch CYP2D6 und CYP1A2 metabolisiert, während das S-Enantiomer überwiegend durch CYP2C9 und in einem geringeren Ausmass durch CYP2D6 metabolisiert wird. Andere an der Metabolisierung von Carvedilol beteiligte CYP450-Isoenzyme sind CYP3A4, CYP2E1 und CYP2C19. Die maximale Plasmakonzentration von R‑Carvedilol ist ungefähr doppelt so hoch wie die Plasmakonzentration von S‑Carvedilol. Das R-Enantiomer wird überwiegend mittels Hydroxylierung metabolisiert. Bei langsamen CYP2D6-Metabolisierern kann die Plasmakonzentration von Carvedilol (hauptsächlich des R-Enantiomers) ansteigen, wodurch eine Verstärkung der alphablockierenden Aktivität erfolgt.
Elimination
Die durchschnittliche Eliminationshalbwertszeit von Carvedilol schwankt zwischen 6 und 10 Stunden. Die Plasma-Clearance liegt bei ungefähr 590 ml/min. Die Elimination erfolgt überwiegend biliär. Die Ausscheidung erfolgt hauptsächlich über den Stuhl. Ein geringer Teil wird renal in Form von Metaboliten ausgeschieden.
Spezielle Patientengruppen
- Ältere Patienten: Die Pharmakokinetik von Carvedilol wird vom Alter beeinflusst. Bei älteren Patienten sind die Plasmaspiegel von Carvedilol etwa 50% höher als bei jungen Patienten.
- Leberinsuffizienz: In einer Studie bei Patienten mit Leberzirrhose war die Bioverfügbarkeit von Carvedilol viermal, die maximale Plasmakonzentration fünfmal und das Verteilungsvolumen dreimal höher als bei gesunden Probanden.
- Niereninsuffizienz: Bei einigen hypertensiven Patienten mit mässiger (Kreatinin-Clearance 20 bis 30 ml/min) oder schwerer (Kreatinin-Clearance <20 ml/min) Niereninsuffizienz war im Vergleich zu Patienten mit normaler Nierenfunktion ein Anstieg der Plasmakonzentration von Carvedilol um ungefähr 40 bis 55% zu beobachten. Die Ergebnisse wiesen jedoch erhebliche Schwankungen auf.
Ivabradin
Unter physiologischen Bedingungen wird Ivabradin schnell aus den Tabletten freigesetzt und ist gut wasserlöslich (>10 mg/ml). Ivabradin ist das S-Enantiomer und zeigte in vivo keine Biokonversion. Das N-demethylierte Derivat von Ivabradin wurde als aktiver Hauptmetabolit beim Menschen identifiziert.
Absorption und Bioverfügbarkeit
Ivabradin wird nach oraler Anwendung schnell und fast vollständig absorbiert, der maximale Plasmaspiegel wird in nüchternem Zustand nach etwa 1,5 Stunden erreicht. Die absolute Bioverfügbarkeit der Filmtabletten liegt aufgrund des First-Pass-Effekts im Darm und in der Leber bei etwa 40%.
Durch Nahrung wird die Absorption um etwa eine Stunde verzögert und die Plasmaexposition um 20 bis 30% erhöht. Es wird empfohlen, die Tablette zu den Mahlzeiten einzunehmen, um intraindividuelle Unterschiede der Plasmaexposition zu verringern (siehe «Dosierung/Anwendung»).
Distribution
Ivabradin wird zu etwa 70% an Plasmaproteine gebunden und hat bei Patienten im Steady-State ein Verteilungsvolumen von annähernd 100 l. Die maximale Plasmakonzentration nach einer chronischen Anwendung der empfohlenen Dosis von 5 mg zweimal täglich beträgt etwa 20 ng/ml. Die durchschnittliche Plasmakonzentration beträgt im Steady-State 10 ng/ml.
Metabolismus
Ivabradin wird weitgehend in der Leber und im Darm ausschliesslich durch Oxidation über das Cytochrom P450 3A4 (CYP3A4) metabolisiert. Der aktive Hauptmetabolit ist das N-demethylierte (S18982) Derivat, dessen Plasmaspiegel bei rund 40% bezogen auf den Hauptbestandteil bei ähnlichen pharmakokinetischen und pharmakodynamischen Eigenschaften liegt. Die Metabolisierung dieses aktiven Metaboliten erfolgt ebenfalls über CYP3A4. Ivabradin hat nur eine geringe Affinität zu CYP3A4 und zeigt keine klinisch signifikante Hemmung oder Induktion dieses Cytochroms. Daher ist eine Veränderung des Metabolismus oder der Plasmakonzentration von CYP3A4-Substraten unwahrscheinlich. Umgekehrt können starke Hemmer und Induktoren von CYP3A4 die Ivabradin-Plasmakonzentration erheblich beeinflussen (siehe «Interaktionen»).
Elimination
Ivabradin wird mit einer Haupt-Halbwertszeit von 2 Stunden (70 bis 75% der AUC) im Plasma und einer effektiven Halbwertszeit von 11 Stunden eliminiert. Die Gesamtclearance beträgt etwa 400 ml/min und die renale Clearance etwa 70 ml/min. Die Ausscheidung der Metaboliten erfolgt in gleichem Masse über den Stuhl und den Urin. Etwa 4% einer oralen Dosis werden unverändert über den Urin ausgeschieden.
Linearität/Nichtlinearität
Die Kinetik von Ivabradin ist linear und zeitunabhängig.
Spezielle Patientengruppen
- Ältere Patienten: Zwischen älteren (≥65 Jahre) oder sehr alten Patienten (≥75 Jahre) und der Gesamtpopulation wurden keine pharmakokinetischen Unterschiede (AUC und Cmax) festgestellt (siehe «Dosierung/Anwendung»).
- Niereninsuffizienz: Die Auswirkung einer Niereninsuffizienz (Kreatinin-Clearance zwischen 15 und 60 ml/min) auf die Pharmakokinetik von Ivabradin ist minimal, da die renale Clearance einen geringen Anteil (etwa 20%) an der kompletten Elimination von Ivabradin und dessen Hauptmetaboliten S18982 hat (siehe «Dosierung/Anwendung»).
- Leberinsuffizienz: Bei Patienten mit einer leichten Leberinsuffizienz (Child-Pugh-Score bis zu 7) ist die Konzentration von ungebundenem Ivabradin und dem aktiven Hauptmetaboliten um etwa 20% höher als bei Patienten mit normaler Leberfunktion. Es stehen nicht ausreichend Daten zur Verfügung, um Rückschlüsse bei Patienten mit mässiger Leberinsuffizienz zu ziehen. Es stehen keine Daten zur Verfügung bei Patienten mit schwerer Leberinsuffizienz (siehe «Dosierung/Anwendung» und «Kontraindikationen»).
Pharmakokinetisch-pharmakodynamische Zusammenhänge (PK/PD)
Eine Analyse des Zusammenhangs zwischen PK und PD ergab, dass bei Dosen von bis zu 15 bis 20 mg zweimal täglich die Herzfrequenzsenkung nahezu linear zur steigenden Ivabradin- und S18982-Plasmakonzentration ist. Bei höheren Dosierungen ist die Herzfrequenzsenkung nicht mehr proportional zur Ivabradin-Plasmakonzentration und scheint ein Plateau zu erreichen. Eine hohe Ivabradin-Exposition, die im Zusammenhang mit einer Gabe in Kombination mit starken CYP3A4-Hemmern auftreten kann, könnte zu einer übermässigen Herzfrequenzsenkung führen; dieses Risiko ist in Kombination mit mässigen CYP3A4-Hemmern geringer (siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen», «Interaktionen»).
Präklinische Daten
Carvedilol
Carvedilol erwies sich in In-vitro- und In-vivo-Tests an Säugern und Nichtsäugern nicht als mutagen.
In an Ratten und Mäusen durchgeführten Karzinogenitätsstudien zeigte Carvedilol keine karzinogene Wirkung. Dabei wurden Dosierungen von bis zu 75 mg/kg bzw. 200 mg/kg verwendet (das 38- bis 100-Fache der beim Menschen empfohlenen Höchstdosis [MRHD]; diese beträgt 100 mg Carvedilol pro Tag und somit das Doppelte der in Carivalan enthaltenen Tagesmaximaldosis von Carvedilol [25 mg zweimal täglich]).
In Tierversuchen wurden keine teratogenen Eigenschaften festgestellt. Dosen von über 60 mg/kg (>30-Fache der MRHD) führten zu einer Verlangsamung des Wachstums und der Entwicklung der Jungtiere. Bei Ratten und Kaninchen wurden bei Dosen von 200 mg/kg bzw. 75 mg/kg (das 38- bis 100-Fache der MRHD von 100 mg/Tag) embryotoxische Wirkungen (erhöhte Todesrate nach der Implantation), jedoch keine Missbildungen beobachtet. Betablocker verringern die Perfusion der Plazenta, was zum Tod des Fötus im Uterus und zu unreifen Neugeborenen und Frühgeburten führen kann. Zudem wurde in Tierversuchen gezeigt, dass Carvedilol die Plazentaschranke passiert; die Möglichkeit einer Alpha- oder Betablockade beim menschlichen Fötus oder Neugeborenen muss darum in Betracht gezogen werden. Bei anderen Alpha- und Betablockern gingen diese Effekte mit peri- und neonatalen Störungen einher (Bradykardie, Hypotonie, Atembeschwerden, Hypoglykämie, Hypothermie). Das Risiko kardialer und pulmonaler Komplikationen bei Neugeborenen kann in der postnatalen Phase erhöht sein. Die Verabreichung von Carvedilol an erwachsene weibliche Ratten in toxischen Dosen (>200 mg/kg, >100-Fache der MRHD von 100 mg/Tag) führte zu Fertilitätsstörungen (keine oder seltene Paarung, weniger Corpus luteum und Implantationen).
Untersuchungen an Ratten haben gezeigt, dass Carvedilol und dessen Metaboliten (ebenso wie andere Betablocker) in die Muttermilch übergehen. Die Mortalität eine Woche nach der Geburt junger Ratten die im ersten Schwangerschaftsdrittel bis zum 22. Tag der Stillperiode Dosen von 60 mg/kg/Tag erhielten (das 30-Fache der MRHD von 100 mg/Tag), war erhöht.
Ivabradin
Reproduktionstoxizitätsstudien zeigten keinen Effekt von Ivabradin auf die Fertilität von Ratten beider Geschlechter. Bei der Behandlung trächtiger Tiere während der Organogenese mit Expositionswerten, die der therapeutischen Dosis weitgehend entsprechen, wurde eine erhöhte Inzidenz von Föten mit Herzfehlern bei der Ratte und eine geringe Anzahl von Föten mit Ektrodaktylie beim Kaninchen beobachtet.
Bei Hunden, die ein Jahr lang Ivabradin erhielten (Dosen von 2, 7 oder 24 mg/kg/Tag), wurden reversible Veränderungen der Netzhautfunktion beobachtet, die aber nicht mit einer Schädigung der okulären Strukturen zusammenhingen. Diese Daten entsprechen der pharmakologischen Wirkung von Ivabradin auf den durch Hyperpolarisation aktivierten Ih-Strom in der Netzhaut, der weitgehend dem Herzschrittmacherstrom If ähnelt.
Sonstige Langzeitstudien mit wiederholter Gabe und Studien zur Karzinogenität zeigten keine klinisch relevanten Veränderungen.
Nach eingehender Überprüfung und Analyse von Daten aus einer Reihe von In-vivo- und In-vitro- Genotoxizitätstests wurden keine Anzeichen von Mutagenität oder signifikanter klastogener Wirkung beobachtet, entsprechend den Zulassungsanforderungen.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweise
Nicht über 30 °C lagern.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer
66213 Swissmedic.
Zulassungsinhaberin
Servier (Suisse) SA, 1242 Satigny.
Stand der Information
Oktober 2018.
OEMéd
Composition
Principes actifs:
Carvédilol et Ivabradine (sous forme de chlorhydrate d'ivabradine).
Excipients:
Noyau: amidon prégélatinisé, lactose monohydraté, cellulose microcristalline, croscarmellose sodique, maltodextrine, silice colloïdale, stéarate de magnésium.
Pelliculage: Glycérol, hypromellose, stéarate de magnésium, macrogol 6000, dioxyde de titane (E171 (comprimé pelliculé de couleur blanche)) ou oxyde de fer jaune (E172 (comprimé pelliculé de couleur jaune)).
Forme galénique et quantité de principe actif par unité
Comprimés pelliculés Carivalan 6,25 mg/5 mg:
Un comprimé pelliculé contient 6,25 mg de carvédilol et 5 mg d'ivabradine (sous forme de 5,390 mg de chlorhydrate d'ivabradine).
(Comprimé pelliculé de couleur blanche, de forme hexagonale (plus grande diagonale 7,3 mm), gravé «CI2» sur une face et « » sur l'autre face.)
» sur l'autre face.)
Comprimés pelliculés Carivalan 6,25 mg/7,5 mg:
Un comprimé pelliculé contient 6,25 mg de carvédilol et 7,5 mg d'ivabradine (sous forme de 8,085 mg de chlorhydrate d'ivabradine).
(Comprimé pelliculé de couleur jaune, de forme hexagonale (plus grande diagonale 7,3 mm), gravé «CI3» sur une face et « » sur l'autre face.)
» sur l'autre face.)
Comprimés pelliculés Carivalan 12,5 mg/5 mg:
Un comprimé pelliculé contient 12,5 mg de carvédilol et 5 mg d'ivabradine (sous forme de 5,390 mg de chlorhydrate d'ivabradine).
(Comprimé pelliculé de couleur blanche, de forme elliptique (10,6 mm × 5,3 mm), gravé «CI4» sur une face et « » sur l'autre face.)
» sur l'autre face.)
Comprimés pelliculés Carivalan 12,5 mg/7,5 mg:
Un comprimé pelliculé contient 12,5 mg de carvédilol et 7,5 mg d'ivabradine (sous forme de 8,085 mg de chlorhydrate d'ivabradine).
(Comprimé pelliculé de couleur jaune, de forme elliptique (10,6 mm × 5,3 mm), gravé «CI5» sur une face et « » sur l'autre face.)
» sur l'autre face.)
Comprimés pelliculés Carivalan 25 mg/5 mg:
Un comprimé pelliculé contient 25 mg de carvédilol et 5 mg d'ivabradine (sous forme de 5,390 mg de chlorhydrate d'ivabradine).
(Comprimé pelliculé de couleur blanche, de forme octogonale (diamètre 7,8 mm), gravé «CI6» sur une face et « » sur l'autre face.)
» sur l'autre face.)
Comprimés pelliculés Carivalan 25 mg/7,5 mg:
Un comprimé pelliculé contient 25 mg de carvédilol et 7,5 mg d'ivabradine (sous forme de 8,085 mg de chlorhydrate d'ivabradine).
(Comprimé pelliculé de couleur jaune, de forme oblongue, de forme octogonale (diamètre 7,8 mm), gravé «CI7» sur une face et « » sur l'autre face.)
» sur l'autre face.)
Indications/Possibilités d’emploi
Carivalan est indiqué dans le traitement symptomatique de l'angor stable chronique chez des patients coronariens ou dans le traitement de l'insuffisance cardiaque chronique (classes II à IV de la NYHA), avec dysfonction systolique, en substitution, chez les patients adultes en rythme sinusal déjà contrôlés par carvédilol et ivabradine pris simultanément à la même posologie.
Posologie/Mode d’emploi
La posologie usuelle est d'un comprimé deux fois par jour, un le matin et un autre le soir au cours d'un repas.
Carivalan ne doit être utilisé que chez les patients contrôlés avec des doses stables des monocomposants administrés de façon concomitante lorsque carvédilol est à la dose optimale.
Si la posologie doit être modifiée, il est recommandé de disposer de plusieurs mesures de la fréquence cardiaque, de réaliser un ECG ou un enregistrement sur 24 heures de la fréquence cardiaque par Holter ECG. Un dosage doit être réalisé pour chaque composant, en s'assurant que la dose de carvédilol et d'ivabradine reste optimale.
La posologie initiale d'ivabradine ne doit pas dépasser 5 mg deux fois par jour chez les patients de moins de 75 ans.
Le traitement par ivabradine doit être arrêté si les symptômes de l'angor ne s'améliorent pas après trois mois de traitement.
En cas d'amélioration limitée des symptômes et de baisse non cliniquement significative de la fréquence cardiaque de repos après trois mois de traitement, l'arrêt du traitement par ivabradine doit également être envisagé.
Si, durant le traitement, la fréquence cardiaque descend en dessous de 50 battements par minute (bpm) ou si le patient présente des symptômes liés à la bradycardie, tels que sensations vertigineuses, fatigue ou hypotension, la dose de chaque mono-composant, carvédilol et ivabradine, doit être diminuée, en s'assurant que la dose de carvédilol reste optimale. Après diminution de la posologie, la fréquence cardiaque doit être surveillée (voir rubrique «Mises en garde et précautions»). Le traitement doit être interrompu si la fréquence cardiaque reste inférieure à 50 bpm ou si les symptômes liés à la bradycardie persistent malgré la diminution de la dose.
Posologies spéciales
Utilisation chez les patients atteints d'insuffisance rénale
Aucune adaptation posologique n'est nécessaire chez les patients avec une insuffisance rénale et une clairance de la créatinine supérieure à 15 ml/min (voir rubrique «Pharmacocinétique») et une pression artérielle systolique supérieure à 100 mmHg.
Aucune donnée n'est disponible chez les patients avec une clairance de la créatinine inférieure à 15 ml/min. Carivalan doit donc être utilisé avec précaution chez les patients dont la clairance de la créatinine est inférieure à 15 ml/min.
La surveillance de la fonction rénale est recommandée chez les patients atteints d'insuffisance cardiaque chronique avec une pression artérielle systolique inférieure à 100 mmHg.
Utilisation chez les patients atteints d'insuffisance hépatique
Il peut être nécessaire d'ajuster la posologie chez les patients atteints d'insuffisance hépatique légère à modérée.
Carivalan doit être utilisé avec précaution chez les patients ayant une insuffisance hépatique modérée (voir rubriques «Mises en garde et précautions» et «Pharmacocinétique»).
Carivalan est contre-indiqué chez les patients souffrant d'insuffisance hépatique sévère (voir rubriques «Contre-indications» et «Pharmacocinétique»).
Utilisation chez le sujet âgé
Carivalan peut être administré avec précaution aux patients âgés (voir rubrique «Pharmacocinétique»).
Enfants et adolescents
La sécurité d'emploi et l'efficacité de Carivalan n'ont pas été établies chez les enfants et les adolescents de moins 18 ans. Aucune donnée n'est disponible avec Carivalan.
Contre-indications
- Hypersensibilité aux substances actives, ou à l'un des excipients mentionnés à la rubrique «Composition», ou à tout autre bêtabloquant.
- Insuffisance hépatique sévère et insuffisance hépatique cliniquement manifeste.
- Insuffisance cardiaque aigüe et insuffisance cardiaque chronique décompensée de classe NYHA II-IV ainsi qu'épisodes d'insuffisance cardiaque décompensée requérant un traitement inotrope i.v.
- Angor instable.
- Angor de Prinzmetal.
- Bloc auriculo-ventriculaire du deuxième ou troisième degré.
- Maladie du sinus («sick sinus syndrome»).
- Bloc sino-auriculaire.
- Bradycardie symptomatique ou sévère (<50 bpm).
- Infarctus aigu du myocarde et infarctus du myocarde avec complications.
- Choc cardiogénique.
- Patient pacemaker-dépendant (fréquence cardiaque exclusivement imposée par le pacemaker).
- Angiopathie périphérique sévère (par ex. syndrome de Raynaud).
- Hypotension sévère (<90/50 mmHg).
- Bronchopneumopathie chronique obstructive.
- Antécédents de bronchospasme ou d'asthme (des cas de décès ont été rapportés après un état de mal asthmatique, à la suite d'une dose unique de carvédilol).
- Rhinite allergique.
- Œdème de la glotte.
- Cœur pulmonaire.
- Acidose métabolique.
- Phéochromocytome non traité.
- Association à des inhibiteurs de MAO (à l'exception des substances inhibitrices de MAO-B).
- Métaboliseurs lents de type débrisoquine et méphénytoïne.
- Association à des inhibiteurs puissants du cytochrome P450 3A4, tels que les antifongiques azolés (kétoconazole, itraconazole), les antibiotiques de la famille des macrolides (clarithromycine, érythromycine per os, josamycine, télithromycine), les inhibiteurs de protéases (nelfinavir, ritonavir) ou néfazodone (voir rubriques «Interactions» et «Pharmacocinétique»).
- Association à vérapamil ou diltiazem, inhibiteurs modérés du CYP3A4 ayant des effets bradycardisants (voir rubrique «Interactions»).
- Grossesse, allaitement et femmes en âge de procréer n'utilisant pas de contraception efficace (voir rubrique «Grossesse/Allaitement»).
Compte tenu de l'effet d'ivabradine sur la fréquence cardiaque, ivabradine doit être initiée que chez les patients pour lesquels la fréquence cardiaque de repos est supérieure ou égale à 70 battements par minute.
Mises en garde et précautions
Toutes les mises en garde et précautions en rapport avec chacun des composants doivent également s'appliquer à Carivalan.
Mises en garde spéciales
Absence de bénéfice sur la morbimortalité dans l'angor stable chronique
Dans son indication dans l'angor stable chronique, Carivalan est uniquement un traitement symptomatique en raison de l'absence de bénéfice démontré sur les évènements cardiovasculaires (ex: infarctus du myocarde ou mortalité cardiovasculaire) (voir rubrique «Propriétés/Effets»).
Mesures de la fréquence cardiaque
Étant donné que la fréquence cardiaque peut considérablement fluctuer au cours du temps, des mesures répétées de la fréquence cardiaque, un ECG ou un suivi par Holter ECG sur 24 heures doivent être considérés pour déterminer la fréquence cardiaque de repos:
- avant d'initier un traitement par ivabradine,
- lorsqu'une augmentation de la posologie d'ivabradine est envisagée.
Cette mise en garde s'applique aussi aux patients ayant une fréquence cardiaque basse, en particulier lorsque celle-ci descend en dessous de 50 battements par minute, ou après une diminution de posologie (voir rubrique «Posologie/Mode d'emploi»).
Arythmies cardiaques
Ivabradine n'est pas efficace dans le traitement ou la prévention des arythmies cardiaques et est susceptible de perdre son efficacité en cas de survenue d'une tachyarythmie (ex: tachycardie ventriculaire ou supraventriculaire). Carivalan n'est donc pas conseillé chez les patients présentant une fibrillation auriculaire ou d'autres arythmies cardiaques interférant avec le fonctionnement du nœud sinusal.
Le risque de fibrillation auriculaire est augmenté chez les patients traités par ivabradine (voir rubrique «Effets indésirables»). La fibrillation auriculaire a été plus fréquente chez les patients utilisant de façon concomitante l'amiodarone ou un puissant anti-arythmique de classe I.
Une surveillance clinique régulière des patients traités par ivabradine est recommandée en vue du dépistage d'une fibrillation auriculaire (permanente ou paroxystique). Cette surveillance inclura éventuellement un ECG en cas de signes cliniques tels qu'exacerbation de l'angor, palpitations, ou pouls irrégulier.
Les patients doivent être informés des signes et symptômes de fibrillation auriculaire et être encouragés à contacter leur médecin traitant s'ils surviennent.
En cas de survenue d'une fibrillation auriculaire en cours de traitement, le rapport bénéfice-risque relatif à la poursuite du traitement par Carivalan doit être attentivement reconsidéré.
Les patients insuffisants cardiaques chroniques ayant un trouble de la conduction intra-ventriculaire (bloc de branche gauche, bloc de branche droit) et une désynchronisation ventriculaire doivent être surveillés attentivement.
Utilisation chez les patients présentant une bradycardie
Ivabradine ne doit pas être administré chez les patients ayant une fréquence cardiaque de repos inférieure à 70 bpm avant le début du traitement (voir rubrique «Contre-indications»).
Si pendant le traitement par Carivalan, la fréquence cardiaque au repos descend en dessous de 50 bpm ou si le patient présente des symptômes liés à la bradycardie, tels que sensations vertigineuses, fatigue ou hypotension, la posologie des composants individuels doit être réduite, en s'assurant que la dose de carvédilol reste optimale, ou le traitement arrêté si la fréquence cardiaque se maintient en dessous de 50 bpm ou si les symptômes liés à la bradycardie persistent(voir rubrique «Posologie/Mode d'emploi»).
Association avec les inhibiteurs calciques
L'utilisation concomitante de Carivalan avec des inhibiteurs calciques réduisant la fréquence cardiaque comme vérapamil ou diltiazem est contre-indiquée (voir rubriques «Contre-indications» et «Interactions»). L'association d'ivabradine aux dérivés nitrés et aux inhibiteurs calciques dérivés de dihydropyridine, tel que l'amlodipine n'a pas posé de problème de tolérance. L'association d'ivabradine aux inhibiteurs calciques dérivés de dihydropyridine n'a pas montré de bénéfice supplémentaire.
Insuffisance cardiaque chronique
L'insuffisance cardiaque doit être stabilisée avant d'envisager le traitement par Carivalan. Carivalan est déconseillé chez les insuffisants cardiaques de classe NYHA IV du fait du nombre limité de données pour ivabradine dans cette population.
Carivalan doit être utilisé avec prudence en cas d'association avec des glucosides cardiotoniques étant donné que ces produits et carvédilol peuvent ralentir la conduction atrio-ventriculaire et que carvédilol peut augmenter les taux plasmatiques des digitaliques (voir rubrique «Interactions»).
Anomalies des valves cardiaques, myocardite active, anomalies cardiaques congénitales
En l'absence de données, l'utilisation d'ivabradine n'est pas recommandée en cas de sténose aortique sévère ou mitrale sévère, de régurgitation mitrale primaire sévère ou de myocardite active ou d'anomalie cardiaque congénitale.
Accident vasculaire cérébral (AVC)
En l'absence de données, la prise de Carivalan est déconseillée dans les suites immédiates d'un AVC.
Fonction visuelle
Ivabradine a une influence sur la fonction rétinienne. Il n'existe pas d'élément en faveur d'un effet toxique du traitement par ivabradine au long cours sur la rétine (voir rubrique «Propriétés/Effets»). L'arrêt du traitement doit être envisagé s'il survient une détérioration inattendue de la fonction visuelle. L'administration d'ivabradine sera prudente chez les patients avec une rétinite pigmentaire.
Précautions particulières d'emploi
Arrêt du traitement
La prise d'ivabradine peut être interrompue si nécessaire, mais l'arrêt de manière abrupte d'un traitement par bêtabloquant doit être évité; ceci est particulièrement valable chez les patients souffrant d'une cardiopathie ischémique. L'arrêt du traitement par Carivalan doit être suivi par l'instauration immédiate du traitement par carvédilol, en s'assurant que la dose de carvédilol reste optimale. La posologie de carvédilol doit être diminuée progressivement, par exemple en réduisant la dose quotidienne de moitié tous les trois jours. Si nécessaire, un autre traitement de remplacement destiné à prévenir une exacerbation de l'angor pourra être initié simultanément. En cas de survenue de tout symptôme, la dose doit être diminuée plus lentement.
Fonction rénale au cours de l'insuffisance cardiaque congestive
Une détérioration réversible de la fonction rénale a été observée avec le traitement par carvédilol chez des patients insuffisants cardiaques chroniques avec pression artérielle basse (pression artérielle systolique <100 mmHg), cardiopathie ischémique et atteinte vasculaire diffuse et/ou insuffisance rénale sous-jacente. Chez les insuffisants cardiaques présentant ces facteurs de risque, il convient de surveiller la fonction rénale.
Patients hypotendus
Chez les patients avec une hypotension légère ou modérée les données disponibles sont limitées. Par conséquent, ivabradine doit être utilisée avec précaution chez ces patients. Carivalan est contre-indiqué chez les patients avec une hypotension sévère (pression artérielle <90/50 mmHg) (voir rubrique «Contre-indications»).
Fibrillation auriculaire – Arythmies cardiaques
Lors du rétablissement d'un rythme sinusal par une cardioversion pharmacologique, il n'a pas été mis en évidence de risque de bradycardie (excessive) chez les patients traités par ivabradine. Cependant, en raison du nombre limité de cas documentés, une cardioversion DC non urgente ne doit être envisagée que 24 heures après la dernière prise de Carivalan.
Patients présentant un QT long congénital ou traités par des médicaments allongeant le QT
L'utilisation de Carivalan doit être évitée chez les patients présentant un QT long congénital ou traités par des médicaments allongeant l'intervalle QT (voir rubrique «Interactions»). Si l'association se révèle nécessaire, une surveillance cardiaque attentive doit être mise en place. La diminution de la fréquence cardiaque induite par ivabradine peut exacerber l'allongement de l'intervalle QT, ce qui peut provoquer des arythmies sévères, en particulier des torsades de pointes.
Patients hypertendus nécessitant une modification de leur traitement antihypertenseur
Dans l'étude SHIFT davantage de patients ont présenté des épisodes d'augmentation de la pression artérielle dans le groupe ivabradine (7,1%) par rapport au groupe placebo (6,1%). Ces épisodes sont apparus le plus souvent peu de temps après la modification du traitement antihypertenseur, étaient transitoires, et n'ont pas influencé l'effet du traitement par ivabradine. Lorsque le traitement antihypertenseur est modifié chez des patients atteints d'insuffisance cardiaque chronique traités par ivabradine, la pression artérielle doit être surveillée à intervalles appropriés (voir rubrique «Effets indésirables»).
Utilisation chez les patients avec une insuffisance hépatique modérée
Carivalan doit être utilisé avec précaution chez les patients présentant une insuffisance hépatique modérée (voir rubrique «Posologie/Mode d'emploi»).
Durant le traitement par carvédilol, de légères lésions des cellules hépatiques ont parfois été observées. Dès les premiers symptômes/signes d'un trouble de la fonction hépatique (par ex. prurit, urine foncée, manque d'appétit prolongé, ictère, douleurs à la pression dans le quadrant supérieur droit ou symptômes pseudo-grippaux inexpliqués), il convient de procéder à des analyses biologiques. Si les résultats confirment une atteinte hépatique ou un ictère, il faut arrêter carvédilol et ne pas l'administrer de nouveau.
Utilisation chez les patients avec une insuffisance rénale sévère
Carivalan doit être utilisé avec précaution chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine <15 ml/min) (voir rubrique «Posologie/Mode d'emploi»).
Patients diabétiques
Carvédilol peut masquer les signes et symptômes d'une hypoglycémie aiguë. Une intolérance au glucose, liée à la prise de carvédilol, peut parfois être observée chez les patients diabétiques et insuffisants cardiaques. Une surveillance étroite des patients diabétiques recevant Carivalan est donc nécessaire, avec des mesures régulières de la glycémie et un ajustement éventuel du traitement antidiabétique (voir rubrique «Interactions»).
Affection vasculaire périphérique
Carivalan doit être utilisé avec précaution chez les patients atteints d'affections vasculaires périphériques, car les bêtabloquants peuvent provoquer ou aggraver les symptômes de la maladie. Il en est de même pour les patients atteints d'un syndrome de Raynaud, dont les symptômes peuvent être exacerbés ou aggravés. Carivalan est contre-indiqué en cas d'affection vasculaire périphérique sévère (voir rubrique «Contre-indications»).
Anesthésie et interventions chirurgicales importantes
Les bêtabloquants diminuent le risque d'arythmie sous anesthésie, mais le risque d'hypotension peut être accru. Il convient donc d'être prudent lors de l'utilisation de certains anesthésiques en raison de la synergie des effets inotropes négatifs de carvédilol et des agents anesthésiques (voir rubrique «Interactions»).
Thyrotoxicose/hyperthyroïdie
Les bêtabloquants, comme carvédilol, peuvent masquer les signes d'hyperthyroïdie et les symptômes de thyrotoxicose. Une interruption brutale du blocage bêta-adrénergique peut entrainer une exacerbation des symptômes d'hyperthyroïdie.
Lentilles de contact
Les patients qui portent des lentilles de contact et qui sont traités par Carivalan doivent être informés d'une diminution possible de la sécrétion lacrymale provoquée par carvédilol.
Hypersensibilité
Carivalan doit être utilisé avec précaution chez les patients ayant des antécédents d'hypersensibilité grave et chez ceux suivant une désensibilisation car les bêtabloquants, comme carvédilol, peuvent augmenter la sensibilité aux allergènes et la gravité des réactions anaphylactiques.
Réactions indésirables cutanées sévères (SCAR)
De très rares cas de réactions indésirables cutanées sévères telles que nécrolyse épidermique toxique (NET) et syndrome de Stevens-Jonson (SSJ) ont été rapportés au cours du traitement par carvédilol (voir rubrique «Effets indésirables»). Carvédilol ne doit pas être utilisé chez les patients souffrant de réactions indésirables cutanées sévères éventuellement dues à carvédilol.
Psoriasis
Les patients psoriasiques ou ayant des antécédents personnels ou familiaux de psoriasis ne doivent recevoir des bêtabloquants, Carivalan y compris, qu'après une évaluation soigneuse des bénéfices et des risques, car les bêtabloquants peuvent aggraver les réactions cutanées.
Phéochromocytome
Chez les patients présentant un phéochromocytome, l'administration d'un agent alpha-bloquant doit précéder la prise de tout produit bêtabloquant. Bien que carvédilol exerce une activité pharmacologique à la fois alpha- et bêtabloquante, il n'existe pas de donnée relative à l'utilisation de carvédilol dans cette pathologie. Il convient donc d'être prudent en cas d'administration de Carivalan à des patients présentant un phéochromocytome avéré ou suspecté.
Autres précautions
En raison de l'insuffisance des données cliniques, carvédilol ne doit pas être administré aux patients atteints d'hypertension labile ou secondaire, d'hypotension orthostatique, de myocardite aiguë, de sténose des valves cardiaques ou des voies d'éjection ventriculaire ayant un retentissement hémodynamique, d'artériopathie périphérique terminale ou à ceux qui reçoivent en parallèle un antagoniste α1-adrénergique ou un agoniste α2-adrénergique.
Excipients
Les comprimés contenant du lactose, ce médicament ne doit pas être administré aux patients présentant une galactosémie congénitale, un déficit en lactase de Lapp ou une malabsorption du glucose et du galactose.
Contrôles antidopage
La prise de Carivalan peut donner des résultats positifs aux contrôles antidopage en raison de la présence de carvédilol. L'utilisation de Carivalan comme agent dopant peut entraîner un risque pour la santé.
Interactions
Aucune interaction entre carvédilol et ivabradine n'a été observée dans une étude d'interaction conduite chez des volontaires sains. Seule l'information sur les interactions connues de chacun des principes actifs avec d'autres produits est présentée ci-après.
Ivabradine est exclusivement métabolisée par le CYP3A4 et est un très faible inhibiteur de ce cytochrome.
Il a été démontré qu'ivabradine n'influence pas le métabolisme et les concentrations plasmatiques des autres substrats du CYP3A4 (qu'ils soient des inhibiteurs faibles, modérés ou puissants). En revanche, les inhibiteurs et les inducteurs du CYP3A4 risquent d'interagir avec ivabradine en influant sur son métabolisme et sa pharmacocinétique de façon cliniquement significative.
Les études d'interactions médicamenteuses ont établi que les inhibiteurs du CYP3A4 augmentent les concentrations plasmatiques d'ivabradine, alors que les inducteurs les diminuent. L'augmentation des concentrations plasmatiques d'ivabradine peut être associée à un risque de bradycardie excessive (voir rubrique «Mises en garde et précautions»).
Carvédilol est aussi bien un substrat qu'un inhibiteur de la glycoprotéine P. Par conséquent, la biodisponibilité des médicaments qui sont transportés par la glycoprotéine P peut être augmentée lors de l'administration simultanée de carvédilol. En outre, la biodisponibilité de carvédilol peut être modifiée par les inducteurs ou les inhibiteurs de la glycoprotéine P.
Les inhibiteurs et les inducteurs des isoenzymes CYP1A2, CYP2D6 et CYP2C9 peuvent modifier le métabolisme systémique et présystémique de carvédilol de façon stéréosélective et peuvent ainsi entraîner une diminution ou une augmentation de la concentration plasmatique du R- et du S-carvédilol (voir rubrique «Pharmacocinétique»).
Les interactions observées chez des patients ou des sujets sains sont présentés ci-dessous, sans que cette liste soit limitative.
Associations contre-indiquées
Liées à ivabradine et à carvédilol
Inhibiteurs puissants du CYP3A4
Interaction pharmacocinétique: l'utilisation concomitante d'inhibiteurs puissants du CYP3A4 comme les antifongiques azolés (kétoconazole, itraconazole), les antibiotiques de la famille des macrolides (clarithromycine, érythromycine per os, josamycine, télithromycine), les inhibiteurs de protéase du VIH (nelfinavir, ritonavir) et néfazodone et d'ivabradine est contre-indiquée. Les inhibiteurs puissants du CYP3A4 comme kétoconazole (200 mg une fois par jour) et josamycine (1 g deux fois par jour) augmentent l'exposition plasmatique moyenne à ivabradine de 7 à 8 fois (voir rubrique «Contre-indications»).
Les patients recevant des médicaments qui inhibent les enzymes du cytochrome P450 (comme cimétidine, fluoxétine, vérapamil, kétoconazole, halopéridol, érythromycine) doivent être surveillés attentivement en cas d'administration concomitante de carvédilol.
Inhibiteurs modérés du CYP3A4 (diltiazem, vérapamil)
Interactions pharmacocinétique et pharmacodynamique: des études spécifiques d'interactions chez des volontaires sains et chez des patients ont montré que l'association d'ivabradine avec les médicaments diminuant la fréquence cardiaque, tels que diltiazem ou vérapamil, entraînent un accroissement de l'exposition à ivabradine (augmentation de 2 à 3 fois de l'ASC) et une réduction supplémentaire de la fréquence cardiaque de 5 bpm. L'utilisation concomitante d'ivabradine avec ces médicaments est contre-indiquée (voir rubrique «Contre-indications»).
Des cas isolés de troubles de la conduction (rarement avec effets hémodynamiques) ont été observés en cas d'association de carvédilol avec diltiazem ou vérapamil. Comme pour les autres bêtabloquants, en cas d'administration orale concomitante de carvédilol et d'inhibiteurs calciques de type vérapamil ou diltiazem, il est recommandé de surveiller l'ECG et la pression artérielle car l'administration conjointe de carvédilol et de ces substances peut augmenter le risque de troubles de la conduction AV.
Associations déconseillées
Liées à ivabradine et à carvédilol
Médicaments allongeant l'intervalle QT
- Médicaments à visée cardiovasculaire allongeant l'intervalle QT (par ex. quinidine, disopyramide, bépridil, sotalol, ibutilide, amiodarone).
- Médicaments non cardiovasculaire allongeant l'intervalle QT (par ex. pimozide, ziprasidone, sertindole, méfloquine, halofantrine, pentamidine, cisapride, érythromycine IV).
L'utilisation concomitante d'ivabradine avec des médicaments à visée cardiovasculaire et non cardiovasculaire allongeant l'intervalle QT doit être évitée, car l'allongement de l'intervalle QT peut être exacerbé par la réduction de la fréquence cardiaque. Si l'association apparaît nécessaire, une surveillance cardiaque attentive sera mise en place (voir rubrique «Mises en garde et précautions»).
Chez les patients insuffisants cardiaques, l'amiodarone diminue la clairance de S-carvédilol, très probablement par inhibition du CYP2C9. La concentration plasmatique moyenne de R-carvédilol reste inchangée. En conséquence, il existe un risque potentiel d'augmentation du blocage bêta due à une augmentation de la concentration plasmatique de S-carvédilol. Des cas isolés de troubles de la conduction (rarement accompagnés d'un retentissement hémodynamique) ont été observés lors d'association de carvédilol et d'amiodarone. L'association de carvédilol et d'amiodarone (par voie orale) doit être soigneusement surveillée car une bradycardie, un arrêt cardiaque et une fibrillation ventriculaire ont été décrits peu après l'initiation d'un traitement concomitant par bêtabloquants (comme carvédilol) et amiodarone.
Jus de pamplemousse
L'exposition à ivabradine double lors de la consommation de jus de pamplemousse. La prise de jus de pamplemousse doit donc être évitée.
Liées à carvédilol
Antiarythmique intraveineux (autre que vérapamil ou diltiazem)
Il existe un risque d'insuffisance cardiaque en cas d'administration intraveineuse concomitante d'antiarythmiques de classe Ia ou Ic et de carvédilol. Les antagonistes calciques et les antiarythmiques ne doivent pas être administrés par voie intraveineuse durant un traitement par carvédilol.
Associations nécessitant des précautions d'emploi
Liées à carvédilol et à ivabradine.
Inducteurs des enzymes du cytochrome P450
Les inducteurs du CYP3A4 (tels que rifampicine, barbituriques, phénytoïne, Hypericum perforatum [millepertuis]) peuvent diminuer l'exposition à ivabradine et son efficacité. La prise concomitante de médicaments inducteurs du CYP3A4 nécessite un ajustement de la posologie d'ivabradine. Il a été démontré que l'association de 10 mg d'ivabradine deux fois par jour à du millepertuis réduit de moitié l'ASC d'ivabradine. La prise de millepertuis doit donc être réduite pendant le traitement par ivabradine.
Dans une étude chez 12 volontaires sains, l'administration de rifampicine et de carvédilol a diminué la concentration plasmatique du carvédilol d'environ 60% et un affaiblissement de l'effet du carvédilol sur la pression systolique a été observé. Le mécanisme de cette interaction est inconnu, mais il pourrait reposer sur une induction de la glycoprotéine P intestinale par rifampicine. Il convient de surveiller étroitement l'activité bêtabloquante chez les patients qui reçoivent simultanément du carvédilol et de la rifampicine.
Liées à ivabradine
Inhibiteurs modérés du CYP3A4 (autres que le vérapamil ou le diltiazem), par ex. fluconazole
L'utilisation concomitante d'ivabradine et d'inhibiteurs modérés du CYP3A4 (par ex., fluconazole) peut être envisagée à la posologie initiale de 2,5 mg deux fois par jour et si la fréquence cardiaque de repos est supérieure à 70 bpm, avec une surveillance de la fréquence cardiaque.
Diurétiques hypokaliémiants (thiazidiques et diurétiques de l'anse)
Une hypokaliémie peut augmenter le risque d'arythmie. Ivabradine pouvant induire une bradycardie, l'association d'une hypokaliémie et d'une bradycardie constitue un facteur prédisposant à la survenue d'arythmies sévères, surtout chez les patients présentant un syndrome du QT long congénital ou iatrogène.
Liées à carvédilol
Cimétidine
Cimétidine a augmenté l'ASC de carvédilol de 30% environ, mais pas de modification de la Cmax. Il convient d'être prudent chez les patients recevant des inhibiteurs de l'oxydase à fonction mixte, par ex. cimétidine, car les concentrations sériques de carvédilol peuvent être augmentées. Compte tenu de l'effet relativement faible de cimétidine sur les concentrations de carvédilol, le risque d'interaction cliniquement importante est cependant minime.
Fluoxétine
Au cours d'une étude randomisée croisée portant sur 10 patients atteints d'insuffisance cardiaque, l'administration de carvédilol avec fluoxétine, un inhibiteur puissant du CYP2D6, a entraîné une inhibition stéréosélective du métabolisme de carvédilol avec une augmentation de 77% de l'ASC moyenne de l'énantiomère R(+) ainsi qu'une augmentation statistiquement non significative de 35% de l'ASC de l'énantiomère S(-) par rapport à celle obtenue dans le groupe placebo. Aucune différence n'a par contre été constatée entre les deux groupes de traitement en ce qui concerne les effets indésirables, la pression artérielle et la fréquence cardiaque.
Glycosides cardiotoniques (digoxine, digitoxine)
Les concentrations de la digoxine et de la digitoxine sont augmentées en cas d'administration concomitante de carvédilol et de digoxine. Digoxine, digitoxine et carvédilol allongent tous le temps de conduction AV et une surveillance accrue des taux de digoxine est donc recommandée en cas d'instauration, d'ajustement ou d'arrêt du traitement par Carivalan.
Ciclosporine
Deux études conduites chez des patients ayant subi une transplantation rénale ou cardiaque et recevant de la ciclosporine par voie orale ont montré une augmentation de la concentration plasmatique de ciclosporine après l'instauration du traitement par carvédilol. Il semble que carvédilol augmente de 10 à 20% environ l'exposition à la ciclosporine administrée par voie orale. Pour maintenir une concentration thérapeutique, une diminution de la dose de ciclosporine de 10-20% s'est avérée nécessaire. Le mécanisme de cette interaction est inconnu, il est toutefois possible qu'une inhibition de la glycoprotéine P intestinale soit impliquée. En raison de la forte variabilité interindividuelle des taux de ciclosporine, il est recommandé de surveiller attentivement la concentration de ciclosporine après l'initiation de Carivalan et d'ajuster la dose de ciclosporine en conséquence. Aucune interaction avec carvédilol ne devrait se produire lors d'administration intraveineuse de ciclosporine.
Insuline et hypoglycémiants oraux
Les médicaments ayant des effets bêtabloquants peuvent potentialiser les effets hypoglycémiants de l'insuline et des antidiabétiques oraux. Les symptômes d'hypoglycémie (en particulier la tachycardie et les palpitations) peuvent être masqués ou atténués. La glycémie doit donc être attentivement surveillée chez les patients recevant de l'insuline ou des antidiabétiques oraux.
Agents provoquant une déplétion des catécholamines
Les patients prenant à la fois un bêtabloquant (comme carvédilol) et un médicament entraînant une déplétion des catécholamines (par ex. réserpine, guanéthidine, méthyldopa, guanfacine et inhibiteurs de monoamine oxydase [à l'exception des IMAO-B]) doivent être soigneusement surveillés à la recherche de signes d'hypotension et/ou de bradycardie sévère.
Clonidine
L'administration concomitante de clonidine et de bêtabloquants (comme carvédilol) peut potentialiser les effets hypotenseurs et bradycardisants. Si un traitement associant un bêtabloquant et la clonidine doit être interrompu, il faut d'abord arrêter le bêtabloquant. Clonidine peut être arrêtée plusieurs jours après en diminuant progressivement la posologie.
Dihydropyridine
L'administration concomitante de dihydropyridines et de carvédilol doit être attentivement surveillée car des cas d'hypotension sévère et d'insuffisance cardiaque ont été décrits dans ce contexte.
Anesthésiques
Il est recommandé de surveiller soigneusement les signes vitaux au cours d'une anesthésie en raison de la synergie des effets inotropes négatifs et hypotenseurs du carvédilol et des anesthésiques.
Bronchodilatateurs bêta-agonistes
Les bêtabloquants non cardiosélectifs antagonisent les effets bronchodilatateurs des agents bêta-agonistes. Ces patients doivent être surveillés attentivement.
Associations à prendre en compte
Liées à carvédilol
Antihypertenseurs
Comme d'autres agents dotés d'une activité bêtabloquante, carvédilol peut potentialiser l'effet d'autres médicaments administrés en même temps exerçant un effet antihypertenseur (par ex. antagonistes alpha1-adrénergiques) ou dont le profil d'effets indésirables inclut l'hypotension.
Anti-inflammatoires non stéroïdiens (AINS)
L'administration concomitante d'AINS et de bêtabloquants peut entraîner une élévation de la pression artérielle et diminuer la capacité de contrôler la pression artérielle. L'effet antihypertenseur de carvédilol est diminué en raison de la rétention hydrosodée.
Œstrogènes et corticoïdes
L'activité antihypertensive de carvédilol peut être diminuée en raison d'une rétention hydrosodée chez les patients ayant une pression artérielle stabilisée et recevant un traitement supplémentaire tel que des œstrogènes ou des corticoïdes.
Dérivés nitrés
Les dérivés nitrés augmentent l'effet hypotenseur.
Sympathomimétiques à effets alpha- et bêta-agonistes
Les sympathomimétiques à effets alpha- et bêta-agonistes augmentent le risque d'hypotension et de bradycardie excessive.
Ergotamine
Augmentation de la vasoconstriction.
Bloqueurs neuromusculaires
Augmentation du bloc neuromusculaire.
Bêtabloquants sous forme de collyre
L'administration concomitante de carvédilol et d'autres bêtabloquants sous forme de collyres peut induire une augmentation des effets indésirables avec les bêtabloquants présentant un risque particulier de bradycardie excessive.
Barbituriques
L'administration concomitante de carvédilol et de barbituriques peut entraîner une diminution de l'efficacité de carvédilol en raison d'une inhibition enzymatique.
Des études spécifiques d'interactions n'ont révélé aucune interaction pharmacocinétique ou pharmacodynamique cliniquement significative entre ivabradine et les médicaments suivants: inhibiteurs de la pompe à protons (oméprazole, lansoprazole), sildénafil, inhibiteurs de l'HMG CoA réductase (simvastatine), inhibiteurs calciques dérivés de dihydropyridine (amlodipine, lacidipine), digoxine et warfarine. De plus, aucun effet cliniquement significatif d'ivabradine n'a été observé sur la pharmacocinétique de simvastatine, d'amlodipine, de lacidipine, ni sur la pharmacocinétique et la pharmacodynamie de digoxine et de warfarine, et ni sur la pharmacodynamie d'aspirine.
Dans des études pivots de phase III, les médicaments suivants ont été régulièrement associés à ivabradine sans manifestation de problèmes de sécurité d'emploi: inhibiteurs de l'enzyme de conversion de l'angiotensine, antagonistes de l'angiotensine II, bêtabloquants, diurétiques, anti-aldostérone, dérivés nitrés d'action courte et prolongée, inhibiteurs de l'HMG CoA réductase, fibrates, inhibiteurs de la pompe à protons, antidiabétiques oraux, aspirine et autres médicaments antiplaquettaires.
Grossesse/Allaitement
Femmes en âge de procréer
Les femmes en âge de procréer doivent utiliser des mesures de contraception appropriées pendant le traitement (voir rubrique «Contre-indications»).
Grossesse
Au vu des données existantes sur les composants individuels, Carivalan est contre-indiqué pendant la grossesse (voir rubrique «Contre-indications»).
Les données concernant l'utilisation de carvédilol chez la femme enceinte sont insuffisantes. Les études expérimentales chez l'animal ont montré la toxicité pour la reproduction (voir rubrique «Données précliniques»). Le risque potentiel chez l'homme est inconnu. Les bêtabloquants diminuent la perfusion placentaire, ce qui peut provoquer une mort fœtale intra-utérine ou une naissance immature ou prématurée. De plus, des effets indésirables (en particulier hypoglycémie et bradycardie, hypotension, dépression respiratoire et hypothermie) peuvent se produire chez le fœtus et le nouveau-né. Il peut y avoir un risque accru de complications cardiaques et pulmonaires chez le nouveau-né pendant la période post-natale.
Il n'existe pas de données adéquates concernant l'utilisation d'ivabradine chez la femme enceinte.
Des études de toxicité sur la reproduction effectuées chez l'animal avec ivabradine ont mis en évidence des effets embryotoxiques et tératogènes (voir rubrique «Données précliniques»). Le risque potentiel en clinique n'est pas connu.
Allaitement
Carivalan est contre-indiqué pendant l'allaitement (voir rubrique «Contre-indications»).
Les études chez l'animal ont montré que le carvédilol ou ses métabolites sont excrétés dans le lait maternel. Chez la femme, on ignore si le carvédilol est excrété dans le lait maternel.
Des études chez l'animal montrent qu'ivabradine est excrétée dans le lait maternel. Les femmes nécessitant un traitement avec ivabradine doivent arrêter d'allaiter et choisir un autre moyen de nourrir leur enfant.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Au vu des données existantes sur les composants individuels, l'utilisation de Carivalan peut affecter l'aptitude à conduire des véhicules ou à utiliser des machines.
Compte tenu de la variabilité des réactions individuelles sous carvédilol (telles que sensations vertigineuses, fatigue ou diminution de la vigilance), l'aptitude à conduire des véhicules ou à utiliser des machines peut être altérée, surtout en début de traitement, lors des augmentations de posologie, au cours du passage à une nouvelle préparation ou en cas de consommation concomitante d'alcool.
Ivabradine peut affecter l'aptitude du patient à conduire des véhicules. Les patients doivent être avertis qu'ivabradine peut être responsable de phénomènes lumineux transitoires (principalement à type de phosphènes). Ces phénomènes lumineux peuvent apparaître lorsqu'il existe des modifications soudaines de luminosité et peuvent se produire, spécialement lors de la conduite de nuit. Néanmoins, sur la base des données de l'utilisation depuis la mise sur le marché, des cas d'altération de l'aptitude à conduire des véhicules due à des symptômes visuels ont été rapportés.
Effets indésirables
Résumé du profil de sécurité
La fréquence des effets indésirables de carvédilol n'est pas dose-dépendante, à l'exception des étourdissements, des troubles visuels et de la bradycardie.
En ce qui concerne l'ivabradine, les effets indésirables les plus fréquents, phénomènes lumineux (phosphènes) et bradycardie, sont dose-dépendants et liés à l'effet pharmacologique du médicament.
Liste des effets indésirables
Les effets indésirables suivants ont été observés lors des essais cliniques et/ou de l'utilisation depuis la mise sur le marché de carvédilol et ivabradine administrés séparément et sont classés, conformément à la classification MedDRA, par système d'organe et par fréquence en suivant les conventions ci-dessous:
Très fréquent (≥1/10); fréquent (≥1/100, <1/10); occasionnel (≥1/1000, <1/100); rare (≥1/10 000, <1/1000); très rare (<1/10 000); inconnu (ne pouvant être estimé à partir des données disponibles).
Carvédilol
Infections et infestations
Fréquent: bronchite, pneumonie, infection des voies aériennes supérieures, infection urinaire.
Affections hématologiques et du système lymphatique
Fréquent: anémie.
Rare: thrombopénie.
Très rare: leucopénie.
Affections du système immunitaire
Très rare: réactions allergiques (hypersensibilité).
Troubles du métabolisme et de la nutrition
Fréquent: hypercholestérolémie, détérioration du contrôle glycémique (hyperglycémie et hypoglycémie) chez les patients atteints d'un diabète préexistant, diabète sucré.
Affections psychiatriques
Fréquent: humeur dépressive, dépression.
Occasionnel: troubles du sommeil, cauchemars, confusion.
Affections du système nerveux
Très fréquent: céphalées, vertiges.
Occasionnel: syncope, pré-syncope, paresthésies.
Affections oculaires
Fréquent: diminution de la sécrétion lacrymale, troubles de la vision, irritation oculaire.
Affections cardiaques
Très fréquent: insuffisance cardiaque.
Fréquent: bradycardie, œdème pulmonaire, œdèmes (y compris œdèmes généralisés et périphériques et tuméfaction de la région génitale et des pieds, hypervolémie et rétention hydrique).
Occasionnel: bloc auriculo-ventriculaire, angor.
Affections vasculaires
Très fréquent: hypotension.
Fréquent: hypotension orthostatique, troubles de la circulation périphérique (extrémités froides, affection vasculaire périphérique, exacerbation d'une claudication intermittente et syndrome de Raynaud).
Affections respiratoires, thoraciques et médiastinales
Fréquent: dyspnée, asthme chez les patients prédisposés.
Rare: congestion nasale, respiration sifflante.
Affections gastro-intestinales
Fréquent: nausées, diarrhée, douleur abdominale, vomissement, dyspepsie.
Occasionnel: constipation.
Rare: bouche sèche.
Affections de la peau et du tissu sous-cutané
Occasionnel: réactions cutanées (exanthème allergique, dermatite, urticaire, prurit ou sueurs abondantes), réactions comparables au lichen plan, au psoriasis ou à l'exanthème psoriasiforme (survenant plusieurs semaines à plusieurs années après le début du traitement), les lésions existantes peuvent s'aggraver, alopécie.
Très rare: réactions cutanées sévères (telles que érythème polymorphe, syndrome de Stevens-Johnson ou nécrose épidermique toxique).
Affections musculo-squelettiques et du tissu conjonctif
Fréquent: douleurs des membres, goutte.
Affections du rein et des voies urinaires
Fréquent: insuffisance rénale et altération fonctionnelle rénale chez les patients atteints d'une pathologie vasculaire diffuse et/ou d'une insuffisance rénale sous-jacente), troubles mictionnels.
Très rare: incontinence urinaire féminine.
Troubles généraux et anomalies au site d'administration
Très fréquent: asthénie, fatigue.
Fréquent: douleur.
Investigations
Fréquent: prise de poids.
Très rare: élévation des transaminases ALAT, ASAT et GGT.
Affections des organes de reproduction et du sein
Occasionnel: impuissance, dysfonction érectile.
Ivabradine
Affections hématologiques et du système lymphatique
Occasionnel: éosinophilie.
Troubles du métabolisme et de la nutrition
Occasionnel: hyperuricémie.
Affections du système nerveux
Fréquents: céphalées généralement pendant le premier mois de traitement, sensations vertigineuses probablement liées à la bradycardie.
Occasionnel: syncope pouvant être liée à une bradycardie*.
Affections oculaires
Très fréquents: phénomènes lumineux (phosphènes): rapportés par 14,5% des patients, décrits comme une luminosité transitoirement augmentée dans une zone limitée du champ visuel. Ils sont habituellement provoqués par de brusques variations de l'intensité lumineuse. Les phosphènes peuvent également être décrits comme un halo, une décomposition des images (effet stroboscopique ou kaléidoscopique), des lumières vives colorées ou plusieurs images (persistance rétinienne). Les phosphènes apparaissent en général dans les deux premiers mois de traitement. Après quoi, ils peuvent survenir de manière répétitive. Les phosphènes sont généralement décrits comme étant d'intensité légère à modérée. Ils disparaissent le plus souvent au cours du traitement (77,5% des cas) ou à l'arrêt du traitement. Moins de 1% des patients ont changé leurs habitudes quotidiennes ou ont interrompu le traitement à cause des phosphènes.
Fréquent: vision trouble.
Occasionnels: diplopie, diminution de l'acuité visuelle.
Affections de l'oreille et du labyrinthe
Occasionnels: vertiges.
Affections cardiaques
Fréquents: bradycardie: 3,3% des patients, en particulier pendant les 2 ou 3 premiers mois du traitement. 0,5% des patients ont présenté une bradycardie sévère avec une fréquence cardiaque inférieure ou égale à 40 bpm, bloc auriculo-ventriculaire du 1er degré (BAV I) (prolongation de l'intervalle PQ à l'ECG), extrasystoles ventriculaires, fibrillation auriculaire, tachycardie ventriculaire*.
Occasionnels: palpitations, extrasystoles supra-ventriculaires, fibrillation ventriculaire*.
Rares*: Torsades de pointes.
Très rares: bloc auriculo-ventriculaire du 2ème et du 3ème degré, maladie du sinus.
Les événements suivants rapportés au cours des essais cliniques l'ont été avec une incidence similaire à celle observée avec des comparateurs et/ou peuvent être liés à la pathologie sous-jacente: arythmie sinusale, angor instable, aggravation de l'angor, fibrillation auriculaire, ischémie myocardique, infarctus du myocarde et tachycardie ventriculaire.
Affections vasculaires
Fréquents: pression artérielle non contrôlée.
Occasionnels: hypotension, pouvant être liée à une bradycardie.
Affections respiratoires, thoraciques et médiastinales
Occasionnels: dyspnée.
Affections gastro-intestinales
Occasionnels: nausées, constipation, diarrhée, douleur abdominale*
Affections de la peau et du tissu sous-cutané
Occasionnels: angio-œdème*, éruption cutanée*.
Rares: érythème*, prurit*, urticaire*.
Affections musculo-squelettiques et systémiques
Occasionnels: crampes musculaires.
Troubles généraux et anomalies au site d'administration
Occasionnels: fatigue, pouvant être liée à une bradycardie*, asthénie, pouvant être liée à une bradycardie*.
Rares: malaise, pouvant être lié à une bradycardie*.
Investigations
Occasionnels: élévation de la créatinémie, allongement de l'intervalle QT à l'ECG.
* Fréquence estimée à partir des données des essais cliniques pour les effets indésirables rapportés après la commercialisation (notifications spontanées).
Description de certains effets indésirables
Carvédilol
Les étourdissements, syncopes, céphalées et sensation de faiblesse sont généralement d'intensité légère et surviennent plutôt en début de traitement.
L'insuffisance cardiaque est un événement fréquemment décrit tant chez les patients recevant un placebo que chez ceux traités par carvédilol (14,5% et 15,4% respectivement chez des patients présentant une dysfonction ventriculaire gauche à la suite d'un infarctus aigu du myocarde).
Une dégradation réversible de la fonction rénale a été observée en cours de traitement par carvédilol chez des patients atteints d'insuffisance cardiaque chronique avec pression artérielle basse, de cardiopathie ischémique et/ou d'insuffisance rénale basale (voir rubrique «Mises en garde et précautions»).
Les bêtabloquants non sélectifs en particulier peuvent être responsables du passage d'un diabète latent à un diabète manifeste, de l'aggravation d'un diabète manifeste et d'une dégradation du contrôle glycémique. L'équilibre glucidique peut également être modérément altéré au cours du traitement par carvédilol, mais cette éventualité n'est pas très fréquente.
Carvédilol peut entraîner une incontinence urinaire chez la femme. Ce trouble disparaît à l'arrêt du traitement.
Ivabradine
Ivabradine en association avec un bêtabloquant
Dans une étude randomisée contrôlée versus placebo menée chez des patients déjà traités par un bêtabloquant, le profil d'effets indésirables rapportés est similaire à celui qui a été décrit précédemment. Néanmoins, la fréquence d'effets indésirables liés au traitement pour l'association d'ivabradine à un bêtabloquant a été de 9,1% versus 2,7% pour le bêtabloquant associé au placebo, différence essentiellement due à une incidence augmentée des bradycardies (de 4,2% versus 0,5%) le plus souvent asymptomatiques (3,1% versus 0,5%).
Au cours de l'étude SIGNIFY, une fibrillation auriculaire a été observée chez 5,3% des patients traités par ivabradine versus 3,8% des patients dans le groupe placebo. Dans une analyse regroupant les données issues de toutes les études de phases II et III menées en double aveugle, d'une durée d'au moins trois mois et incluant plus de 40 000 patients, une incidence de 4,86% a été observée pour la survenue de la fibrillation auriculaire chez les patients traités par ivabradine comparativement à une incidence de 4,08% chez les sujets des groupes contrôle (RR 1,26 95% CI [1.15-1.39]).
Au cours de l'étude SHIFT, une tachycardie ventriculaire a été reportée comme un effet indésirable fréquent avec une incidence de 1,86% dans le groupe ivabradine comparativement à 2,15% dans le groupe placebo.
Surdosage
Il n'existe aucune information sur le surdosage par Carivalan chez l'homme.
Symptômes
En rapport avec carvédilol
Le surdosage peut induire une hypotension sévère, une bradycardie, une insuffisance cardiaque, un choc cardiogénique ou un arrêt cardiaque. Une détresse respiratoire, un bronchospasme, des vomissements, des troubles de conscience et des convulsions généralisées sont également possibles.
En rapport avec ivabradine
Un surdosage peut provoquer une bradycardie sévère et prolongée (voir rubrique «Effets indésirables»).
Prise en charge
Outre les mesures générales, les signes vitaux doivent être surveillés et corrigés, si besoin en service de réanimation. Dans les 4 heures après l'ingestion l'absorption gastro-intestinale de carvédilol peut être diminuée par un lavage gastrique, l'administration de charbon actif et des vomissements provoqués.
Les patients doivent être placés en décubitus dorsal. De l'atropine, 0,5 à 2 mg par voie intraveineuse (i.v.), et/ou du glucagon, 1 à 10 mg i.v. (suivi d'une perfusion i.v. lente de 2 à 5 mg/heure si nécessaire) peuvent être administrés en cas de bradycardie sévère, qu'il convient de traiter symptomatiquement en milieu spécialisé. Pour soutenir la fonction ventriculaire, l'administration intraveineuse de glucagon ou de sympathomimétiques (par ex. dobutamine, isoprénaline, orciprénaline ou adrénaline, en fonction du poids corporel et de l'effet) est recommandée. Dans le cas d'une bradycardie mal tolérée hémodynamiquement, un traitement symptomatique par bêta-stimulant par voie intraveineuse, tel que isoprénaline, pourra être envisagé; une sonde d'entraînement électrosystolique cardiaque temporaire pourra être mise en place si besoin. Une hypotension marquée peut être traitée par l'administration de solutés intraveineux.
Si un effet inotrope positif s'avère nécessaire, les inhibiteurs de la phosphodiestérase (par ex., milrone) doivent être envisagés. En cas de bradycardie résistant au traitement, il peut être nécessaire d'instaurer un traitement par stimulateur cardiaque. Si le tableau de l'intoxication est dominé par une vasodilatation périphérique, il convient alors d'administrer de la norfénéfrine ou de la noradrénaline sous surveillance continue de la circulation sanguine, à la dose de 5 à 10 microgrammes i.v., répétée en fonction de la réponse de la pression artérielle, ou de 5 microgrammes par minute en perfusion ajustée à la pression artérielle.
La présence d'un bronchospasme requiert l'administration de β-sympathomimétiques (en aérosol ou par voie intraveineuse) ou d'aminophylline en injection intraveineuse lente ou en perfusion.
En cas de convulsions, une injection intraveineuse lente de diazépam ou de clonazépam est recommandée.
Dans les cas de surdosage sévère avec symptômes de choc, un traitement symptomatique doit être poursuivi suffisamment longtemps, car on peut s'attendre à un allongement de la demi-vie d'élimination et à une redistribution de carvédilol à partir des compartiments profonds. Le traitement symptomatique doit donc être poursuivi jusqu'à la stabilisation de l'état du patient. La durée du traitement dépend de la sévérité du surdosage.
Carvédilol n'est pas éliminé par dialyse, la substance active n'étant pas dialysable, probablement en raison de l'importance de sa liaison avec les protéines du plasma.
Propriétés/Effets
Code ATC: C07FX06
Mécanisme d'action
Carvedilol
Carvédilol est un bêtabloquant vasodilatateur non sélectif, qui diminue les résistances vasculaires périphériques via un blocage sélectif alpha1-adrénergique et inhibe le système rénine-angiotensine via un blocage bêta-adrénergique non sélectif.
L'activité rénine plasmatique est diminuée et la rétention hydrique est rare.
Carvédilol n'a pas d'activité sympathomimétique intrinsèque. Comme le propranolol, il possède des propriétés de stabilisation membranaire.
Carvédilol est un mélange racémique de deux stéréo-isomères. Les études chez l'animal ont montré que ces deux énantiomères présentent des caractéristiques de blocage alpha-adrénergique. Le blocage non sélectif bêta1- et bêta2-adrénergique est imputable principalement à l'énantiomère S(-).
Les propriétés anti-oxydantes de carvédilol et de ses métabolites ont été démontrées dans des études in vitro et in vivo chez l'animal, ainsi que dans des études in vitro réalisées sur un certain nombre de types cellulaires humains.
Ivabradine
Ivabradine agit en réduisant uniquement la fréquence cardiaque, par inhibition sélective et spécifique du courant pacemaker If qui contrôle la dépolarisation diastolique spontanée au niveau du nœud sinusal et régule la fréquence cardiaque.
Les effets cardiaques sont spécifiques du nœud sinusal, sans effet sur les temps de conduction intra-auriculaires, auriculo-ventriculaires ou intra-ventriculaires, sur la contractilité myocardique ou sur la repolarisation ventriculaire. Dans les modèles expérimentaux, l'adaptation de la contractilité myocardique, du débit cardiaque, du débit moyen coronaire et des résistances vasculaires observées à l'exercice est conservée.
Chez l'animal, dans des modèles d'ischémie à l'effort, qui est la cause de l'angor chez l'homme, l'ivabradine réduit de façon significative l'ischémie myocardique ainsi que les troubles de contractilité myocardique induits par sidération myocardique. La contractilité myocardique est restaurée plus rapidement avec l'ivabradine qu'avec les bêtabloquants.
Ivabradine peut également interagir avec le courant rétinien Ih qui s'apparente au courant cardiaque If. Celui-ci intervient dans la résolution temporelle du système visuel, par le raccourcissement de la réponse rétinienne à des stimuli lumineux intenses. Lors de circonstances déclenchantes (telles que des changements rapides de la luminosité), l'inhibition partielle du courant Ih par l'ivabradine est à l'origine des phénomènes lumineux que peuvent percevoir occasionnellement des patients. Les phénomènes lumineux (phosphènes) sont décrits comme une augmentation transitoire de la luminosité dans une zone limitée du champ visuel (voir rubrique «Mises en garde et précautions»).
Pharmacodynamique
Carvedilol
Chez le patient hypertendu, la diminution de la pression artérielle n'est pas associée à une augmentation concomitante des résistances périphériques, comme on le voit avec des bêtabloquants purs. La fréquence cardiaque est légèrement diminuée. Le volume d'éjection reste inchangé. Le flux sanguin rénal et la fonction rénale restent normaux, tout comme le flux sanguin périphérique. C'est pourquoi la froideur des extrémités, fréquente avec les bêtabloquants, est rarement observée. Chez les patients hypertendus, carvédilol augmente la concentration plasmatique de la noradrénaline.
Au cours du traitement prolongé de patients atteints d'angor, carvédilol a exercé un effet anti-ischémique et s'est avéré capable d'atténuer la douleur. Des études hémodynamiques ont démontré que carvédilol diminue la pré- et la post-charge ventriculaire.
Chez les patients ayant une dysfonction ventriculaire gauche ou une insuffisance cardiaque congestive, carvédilol exerce un effet favorable sur l'hémodynamique, ainsi que sur la fraction d'éjection et les dimensions du ventricule gauche. Carvédilol diminue la mortalité et le besoin d'hospitalisation pour motif cardiovasculaire chez les patients insuffisants cardiaques.
Carvédilol n'exerce pas d'effet négatif sur le profil lipidique sérique ou sur les électrolytes. Le rapport HDL/LDL reste normal.
Ivabradine
La propriété pharmacodynamique principale d'ivabradine chez l'homme consiste en une réduction spécifique et dose-dépendante de la fréquence cardiaque.
Aux posologies habituellement recommandées, la fréquence cardiaque diminue d'environ 10 pulsations par minutes (ppm) au repos et à l'effort. Cela se traduit par une réduction du travail cardiaque et de la consommation en oxygène du myocarde.
Une réduction moyenne d'environ 20 ppm a été obtenue avec 20 mg deux fois par jour, sans problème de tolérance apparent. L'analyse de la baisse de fréquence cardiaque indique une tendance vers un effet plateau à hautes doses. Le risque d'une bradycardie sévère ou mal tolérée est par conséquent très faible. L'ivabradine ne modifie pas la conduction intracardiaque, la contractilité (pas d'effet inotrope négatif) ou la repolarisation ventriculaire:
- Les études cliniques d'électrophysiologie n'ont pas révélé d'influence de l'ivabradine sur les temps de conduction auriculo-ventriculaires et intra-ventriculaires ou sur l'intervalle QT corrigé;
- Des études spécifiques menées sur plus de 100 patients atteints d'anomalie ventriculaire gauche ont montré que l'ivabradine préservait la contractilité myocardique.
Efficacité et sécurité clinique
Carvedilol
Les études cliniques ont montré qu'un équilibre entre la vasodilatation et l'effet bêtabloquant de carvédilol est responsable des effets hémodynamiques et métaboliques suivants:
- Chez le patient hypertendu, la diminution de la pression artérielle ne s'accompagne pas d'une augmentation de la résistance périphérique totale.
- La fréquence cardiaque reste inchangée ou peut diminuer légèrement.
- La circulation rénale et la filtration glomérulaire ne sont pas modifiées.
- Carvédilol maintient la circulation périphérique, de sorte qu'une froideur des extrémités n'apparaît qu'exceptionnellement.
- Un rapport normal est maintenu entre les HDL et les LDL.
- Les électrolytes sériques ne sont pas modifiés.
- Le carvédilol ne stimule pas le système rénine-angiotensine; la rénine plasmatique diminue réellement. La rétention hydrique est rare.
- Chez le patient insuffisant cardiaque, carvédilol a exercé des effets favorables sur l'hémodynamique et a entraîné une amélioration de la taille et de la fraction d'éjection du ventricule gauche. Chez le patient atteint de cardiopathie ischémique, carvédilol a démontré des propriétés anti-ischémiques et anti-angineuses. Carvédilol diminue la précharge et la post-charge ventriculaire.
Dans une grande étude multicentrique, en double aveugle et contrôlée versus placebo, qui évaluait la mortalité (COPERNICUS), 2289 patients atteints d'insuffisance cardiaque chronique stable sévère, ischémique ou non et recevant un traitement standard ont été randomisés pour carvédilol (1156 patients) ou un placebo (1133 patients). Les patients présentaient une dysfonction systolique du ventricule gauche avec une fraction d'éjection moyenne inférieure à 20%. La mortalité toutes causes confondues a été diminuée de 35%-19,7% dans le groupe placebo - à 12,8% dans le groupe carvédilol (risques proportionnels de Cox, P=0,00013). Le bénéfice du carvédilol sur la mortalité a été constant dans tous les sous-groupes analysés. La mort subite a diminué de 41% dans le groupe carvédilol (4,2% versus 7,8%). Les critères de jugement secondaires combinés (mortalité ou hospitalisations dues à l'insuffisance cardiaque, mortalité ou hospitalisations de cause cardiovasculaire, et mortalité ou hospitalisations toutes causes confondues) ont tous été significativement améliorés dans le groupe carvédilol par rapport au groupe placebo (diminution de respectivement 31%, 27% et 24%, P=0,00004). L'incidence des effets indésirables sévères observés dans cette étude a été moindre dans le groupe carvédilol (39% versus 45,4%). Au début du traitement, l'incidence de l'aggravation de l'insuffisance cardiaque était comparable dans les deux groupes. L'incidence de l'aggravation de l'insuffisance cardiaque pendant l'étude a été moindre dans le groupe carvédilol (14,5% versus 21,1%).
Ivabradine
L'efficacité antiangoreuse et anti-ischémique d'ivabradine a été étudiée dans cinq études randomisées en double-aveugle (trois versus placebo, une versus aténolol et une versus amlodipine). Ces études ont inclus un total de 4111 patients atteints d'angor stable chronique, dont 2617 ont reçu de l'ivabradine.
Administrée à une posologie de 5 mg deux fois par jour, l'efficacité d'ivabradine a été démontrée sur tous les paramètres mesurés lors des tests d'effort dans les 3 à 4 semaines après le début du traitement. Son efficacité a été confirmée à une posologie de 7,5 mg deux fois par jour. En particulier, le bénéfice supplémentaire par rapport à une posologie de 5 mg deux fois par jour a notamment été démontré dans une étude versus produit de référence (aténolol): la durée totale de l'exercice à la concentration plasmatique minimale a été augmentée d'1 minute environ, après un mois de traitement sous ivabradine à une posologie de 5 mg deux fois par jour et s'est encore allongée de près de 25 secondes, après 3 mois de traitement supplémentaire sous ivabradine à une posologie de 7,5 mg deux fois par jour. Dans cette étude, l'action antiangineuse et anti-ischémique d'ivabradine a été confirmée chez les patients âgés de 65 ans ou plus. Les résultats d'efficacité des posologies de 5 et 7,5 mg d'ivabradine deux fois par jour sont cohérents entre les études sur l'ensemble des paramètres mesurés lors des tests d'effort (durée totale de l'exercice, délai de survenue de la douleur angineuse limitante, délai d'apparition de la douleur angineuse et délai d'apparition du sous-décalage du segment ST de 1 mm) et ont été associés à une baisse d'environ 70% de la fréquence des crises d'angor. L'administration d'ivabradine en deux prises par jour a permis de maintenir une efficacité constante tout au long du nycthémère.
Dans une étude randomisée contrôlée versus placebo réalisée chez 889 patients, l'association d'ivabradine à aténolol (50 mg une fois par jour), a démontré un supplément d'efficacité, sur l'ensemble des paramètres des épreuves d'effort, réalisées au creux de l'activité du médicament (12 heures après la prise).
L'efficacité de l'ivabradine s'est maintenue durant les 3 ou 4 mois de traitement des études d'efficacité. Aucun phénomène de tolérance pharmacologique (baisse d'efficacité) durant le traitement, ni d'effet rebond après arrêt brutal du traitement n'ont été observés. L'efficacité au long cours de l'ivabradine sur les symptômes d'angor a été confirmée lors d'études d'une durée d'un an, incluant plus de 1000 patients traités par 5 ou 7,5 mg d'ivabradine deux fois par jour. L'activité antiangoreuse et antiischémique de l'ivabradine a été associée à une diminution dose-dépendante de la fréquence cardiaque et à une diminution significative du produit fréquence × pression (fréquence cardiaque × pression artérielle systolique) au repos et à l'effort. Aucun effet n'a été observé sur la pression artérielle.
Une importante étude, BEAUTIFUL, a été réalisée chez 10.917 patients coronariens présentant une dysfonction ventriculaire gauche (FEVG<40%) et recevant déjà un traitement optimal, dont 86,9% sous bêtabloquants. Le critère principal d'efficacité était un critère combiné associant la mortalité cardiovasculaire, les hospitalisations pour infarctus aigu du myocarde et les hospitalisations pour survenue ou aggravation d'une insuffisance cardiaque. L'étude n'a pas mis en évidence de différence de survenue du critère principal combiné entre le groupe ivabradine, et le groupe placebo (risque relatif ivabradine/placebo 1,00, p=0,945).
Dans une étude post-hoc réalisée chez un sous-groupe de patients présentant un angor symptomatique au moment de la randomisation (n=1507), aucun problème de sécurité d'emploi relatif à des décès cardiovasculaires, des hospitalisations pour infarctus aigu du myocarde ou pour insuffisance cardiaque n'a été détecté (ivabradine 12,0% versus placebo 15,5%, p=0,05).
Une importante étude, SIGNIFY, a été réalisée chez 19102 patients coronariens sans signe clinique d'insuffisance cardiaque (FEVG >40%) et recevant déjà un traitement optimal. La posologie utilisée dans l'étude était supérieure à celle approuvée dans le résumé des caractéristiques du produit: la posologie initiale avait été fixée à 7,5 mg deux fois par jour (5 mg deux fois par jour pour les patients âgés d'au moins 75 ans) et était ensuite augmentée jusqu'à 10 mg deux fois par jour. Le critère principal d'efficacité était un critère combiné associant la mortalité cardiovasculaire et l'infarctus du myocarde non-fatal. L'étude n'a pas mis en évidence de différence de survenue du critère principal combiné entre le groupe ivabradine et le groupe placebo (risque relatif ivabradine/placebo 1,08, p=0.197). Une bradycardie a été rapportée par 17.9% des patients dans le groupe ivabradine (2,1% dans le groupe placebo). Au cours de l'étude, 7,1% des patients ont également reçu du vérapamil, du diltiazem ou des inhibiteurs puissants du CYP 3A4.
Contrairement à ce qu'il fût observé dans le sous-groupe de patients présentant un angor symptomatique de classe CCS ≥ I (n=14286) (risque relatif ivabradine/placebo 1,11, p=0,110), une augmentation faible mais statistiquement significative de la survenue du critère principal combiné a été observée dans un sous-groupe prédéfini de patients présentant un angor symptomatique de classe CCS II ou plus à l'inclusion (n=12049) (incidence annuelle de 3,4% vs 2,9%; risque relatif ivabradine/placebo 1,18; p=0,018). L'utilisation, au cours de l'étude, d'une posologie supérieure à celle approuvée dans l'information professionnelle n'explique pas totalement ces observations.
Une étude de morbi-mortalité, SHIFT, a été réalisée chez 6505 patients adultes présentant des symptômes modérés à sévères d'insuffisance cardiaque chronique, et une diminution de la fraction d'éjection ventriculaire gauche (FEVG ≤35%).
SHIFT est une étude internationale multicentrique, randomisée en double-aveugle, contrôlée versus placebo.
La population de cette étude présentait une insuffisance cardiaque chronique systolique de classe NYHA II (48,7% de la population); III (49,5%) et IV (1,7%), stable depuis au moins 4 semaines une hospitalisation documentée pour aggravation de l'insuffisance cardiaque dans les 12 mois précédant la sélection, et en rythme sinusal lors de la sélection avec une fréquence cardiaque au repos ≥70 bpm. Les patients recevaient un traitement standard comprenant des bêtabloquants (89%), des inhibiteurs de l'enzyme de conversion et/ou des antagonistes de l'angiotensine II (91%), des diurétiques (83%), des antagonistes de l'aldostérone (60%) et des préparations digitaliques (22%). Dans le groupe ivabradine, la dose moyenne était de 6,4 ± 1,4 mg deux fois par jour. La durée médiane de suivi a été de 22,9 mois.
Le critère principal était un critère combiné associant mortalité cardiovasculaire (y compris décès d'origine inconnue) et hospitalisation pour aggravation de l'insuffisance cardiaque. L'étude a mis en évidence une réduction de 18% du risque relatif de survenue du critère principal combiné cliniquement et statistiquement significative (hazard ratio ivabradine;placebo: 0.82, 95%CI [0.75;0.90] - p<0.0001). La réduction du risque absolu était de 4,2%. L'effet du traitement apparaît dans les 3 mois et était significatif dans les 6 mois après l'initiation du traitement.
La réduction de survenue du critère principal a été observée de façon similaire quels que soient le sexe, la classe NYHA, la prise ou non de bêtabloquants, l'étiologie ischémique ou non de l'insuffisance cardiaque et les antécédents de diabète ou d'hypertension.
Effet du traitement sur le critère principal combiné, ses composantes et sur les critères secondaires.
Ivabradine | Placebo | Risque relatif | p-value | |
|---|---|---|---|---|
Critère principal combiné | 793 (24.47) | 937 (28.71) | 0.82 [0.75; 0.90] | <0.0001 |
Composantes du critère combiné: | ||||
| 449 (13.85) | 491 (15.04) | 0.91 [0.80; 1.03] | 0.128 |
| 514 (15.86) | 672 (20.59) | 0.74 [0.66; 0.83] | <0.0001 |
Autres critères secondaires: | ||||
| 503 (15.52) | 552 (16.91) | 0.90 [0.80; 1.02] | 0.092 |
| 113 (3.49) | 151 (4.63) | 0.74 [0.58;0.94] | 0.014 |
| 1231 (37.98) | 1356 (41.54) | 0.89 [0.82;0.96] | 0.003 |
| 977 (30.15) | 1122 (34.38) | 0.85 [0.78; 0.92] | 0.0002 |
Une amélioration de la classe NYHA a été observée lors de la dernière évaluation, 887 (28%) patients sous ivabradine ont présenté une amélioration; versus 776 (24%) dans le groupe placebo (p=0.001).
Le traitement par ivabradine a été associé à une réduction moyenne de la fréquence cardiaque de 11 bpm par rapport au groupe placebo (valeur de référence de 80 bpm), qui a été maintenue pendant toute la durée de l'étude.
Dans une étude randomisée contrôlée versus placebo et menée chez 725 patients, l'association de l'ivabradine à l'amlodipine n'a pas montré d'efficacité supplémentaire au creux de l'activité du médicament (12 heures après la prise), alors qu'un supplément d'efficacité a été observé au pic (3-4 heures après la prise).
Dans une étude randomisée, contrôlée versus placebo réalisée chez 97 patients, des données ont été collectées lors d'investigations ophtalmiques spécifiques afin de documenter la fonction des cônes et bâtonnets rétiniens et des voies ophtalmiques ascendantes (notamment électrorétinogramme, champ visuel statique ou cinétique, tests de la vision en couleurs, mesure de l'acuité visuelle). Aucune toxicité rétinienne n'a été mise en évidence chez les patients traités par ivabradine depuis plus de 3 ans pour un angor stable chronique.
Pharmacocinétique
La vitesse et le degré d'absorption d'ivabradine et de carvédilol à partir de Carivalan ne sont pas significativement différents des valeurs correspondantes mesurées avec ivabradine et carvédilol pris séparément en monothérapie.
Carvédilol
Absorption
La biodisponibilité absolue de carvédilol administré par voie orale est de 25% environ. Le pic de concentration plasmatique est atteint 1 heure environ après la prise. Il existe une relation linéaire entre la dose et les concentrations plasmatiques. Chez les patients hydroxylant faiblement la débrisoquine, la concentration plasmatique de carvédilol a augmenté de 2 à 3 fois par rapport aux métaboliseurs rapides de la débrisoquine. La prise de nourriture ne modifie pas la biodisponibilité, mais le pic de concentration plasmatique est alors plus long à atteindre.
Distribution
Carvédilol est extrêmement lipophile. Sa liaison avec les protéines du plasma est de l'ordre de 98-99%. Le volume de distribution est approximativement de 2 l/kg.
Biotransformation
Carvédilol est fortement métabolisé en différents métabolites excrétés principalement par voie biliaire. Le métabolisme de premier passage après administration orale est de 60-75% environ. Les études chez l'animal ont mis en évidence une circulation entéro-hépatique de la substance non métabolisée.
Carvédilol est métabolisé dans le foie, principalement par oxydation du cycle aromatique et glucuronidation. Une déméthylation et une hydroxylation du cycle phénolique génèrent trois métabolites actifs dotés d'une activité bêtabloquante. Ces trois métabolites actifs exercent un effet vasodilatateur faible par rapport à carvédilol. D'après les études précliniques, l'activité bêtabloquante du métabolite 4‑hydroxyphénol est environ 13 fois supérieure à celle de carvédilol. Les concentrations des métabolites chez l'homme sont cependant environ 10 fois inférieures à celles de carvédilol. Deux des métabolites hydroxycarbazole du carvédilol sont des antioxydants extrêmement puissants, d'une puissance 30 à 80 fois supérieure à celle de carvédilol.
Le métabolisme oxydatif de carvédilol est stéréosélectif. L'énantiomère R est essentiellement métabolisé par le CYP2D6 et le CYP1A2, alors que l'énantiomère S est principalement métabolisé par le CYP2C9 et, dans une moindre mesure, par le CYP2D6. Les autres isoenzymes du CYP450 intervenant dans le métabolisme du carvédilol sont le CYP3A4, le CYP2E1 et le CYP2C19. Le pic de concentration plasmatique du R‑carvédilol est le double environ de la concentration du S‑carvédilol. L'énantiomère R est métabolisé principalement par hydroxylation. Chez les métaboliseurs lents du CYP2D6, une augmentation de la concentration plasmatique de carvédilol est possible, qui concerne surtout l'énantiomère R, et aboutit à une augmentation de l'activité alpha-bloquante.
Élimination
La demi-vie d'élimination moyenne de carvédilol varie de 6 à 10 heures. La clairance plasmatique est d'environ 590 ml/min. L'élimination se fait principalement par la bile. L'excrétion est principalement fécale. Une petite partie est éliminée par le rein sous forme de métabolites.
Populations particulières
- Sujets âgés: La pharmacocinétique de carvédilol dépend de l'âge. Les concentrations plasmatiques de carvédilol sont plus élevées de 50% environ chez le sujet âgé que chez le sujet jeune.
- Insuffisance hépatique: Dans une étude portant sur des patients atteints de cirrhose hépatique, la biodisponibilité de carvédilol était quatre fois supérieure, le pic de concentration plasmatique cinq fois supérieur et le volume de distribution trois fois supérieur à ceux de sujets sains.
- Insuffisance rénale: Chez certains patients hypertendus ayant une insuffisance rénale modérée (clairance de la créatinine 20-30 ml/min) ou sévère (clairance de la créatinine <20 ml/min), une augmentation des concentrations plasmatiques de carvédilol de l'ordre de 40-55% a été observée par rapport aux patients ayant une fonction rénale normale. Les résultats présentaient cependant une grande variabilité.
Ivabradine
Dans les conditions physiologiques, ivabradine est rapidement libérée des comprimés et est très soluble dans l'eau (>10 mg/ml). Ivabradine est l'énantiomère S et n'a pas montré de bioconversion in vivo. Le dérivé N-déméthylé d'ivabradine a été identifié comme le principal métabolite actif chez l'homme.
Absorption et biodisponibilité
Absorption d'ivabradine est rapide et presque complète après administration orale, avec un pic de concentration plasmatique atteint en 1,5 heure environ à jeun. La biodisponibilité absolue des comprimés pelliculés est proche de 40%, en raison de l'effet de premier passage intestinal et hépatique.
Les aliments retardent l'absorption d'environ 1 heure et augmentent l'exposition plasmatique de 20 à 30%. La prise de comprimés pendant les repas est recommandée afin de diminuer la variabilité intra-individuelle à l'exposition plasmatique (voir rubrique «Posologie/Mode d'emploi»).
Distribution
La liaison d'ivabradine aux protéines plasmatiques est d'environ 70% et le volume de distribution à l'état d'équilibre est proche de 100 l. La concentration plasmatique maximale après administration chronique de la dose recommandée de 5 mg deux fois par jour est d'environ 20 ng/ml. A l'état d'équilibre, la concentration plasmatique moyenne est de 10 ng/ml.
Biotransformation
Ivabradine est fortement métabolisée par l'intestin et par le foie, par un processus oxydatif impliquant uniquement le cytochrome P 450 3A4 (CYP3A4). Le métabolite actif principal est le dérivé N-déméthylé (S18982), ses taux plasmatiques sont environ 40% de ceux du composé principale, avec des propriétés pharmacocinétiques et pharmacodynamiques similaires. Ce métabolite actif est également métabolisé par le CYP3A4. Ivabradine n'a qu'une faible affinité pour le CYP3A4. Elle n'a pas d'effet cliniquement significatif d'inhibition ou d'induction de ce cytochrome CYP3A4 et par conséquent n'est pas susceptible de modifier le métabolisme ou les concentrations plasmatiques des substrats du CYP3A4. En revanche, les inhibiteurs et les inducteurs puissants du CYP3A4 sont susceptibles de modifier les concentrations plasmatiques de l'ivabradine de façon notable (voir rubrique «Interactions»).
Elimination
Ivabradine est éliminée avec une demi-vie plasmatique principale de 2 heures (70-75% de l'ASC) et une demi-vie effective de 11 heures. La clairance totale est d'environ 400 ml/min et la clairance rénale d'environ 70 ml/min. L'élimination des métabolites se fait, à parts égales, dans les selles et dans les urines. Environ 4% d'une dose orale est éliminée de manière inchangée dans les urines.
Linéarité/non-linéarité
Les cinétiques d'ivabradine sont linéaires et indépendantes du temps.
Populations particulières
- Sujets âgés: aucune différence pharmacocinétique (ASC et Cmax) n'a été observée entre le sujet âgé (≥65 ans), ou très âgé (≥75 ans) et la population générale (voir rubrique «Posologie/Mode d'emploi»).
- Insuffisance rénale: l'impact de l'insuffisance rénale (clairance de la créatinine de 15 à 60 ml/min) sur la pharmacocinétique d'ivabradine est minime, compte tenu de la faible contribution de la clairance rénale (environ 20%) dans l'élimination totale d'ivabradine et de son principal métabolite S18982 (voir rubrique «Posologie/Mode d'emploi»).
- Insuffisance hépatique: chez les patients ayant une insuffisance hépatique légère (score de Child-Pugh jusqu'à 7), les taux d'ivabradine libre et de son principal métabolite actif sont supérieurs d'environ 20% aux taux des sujets ayant une fonction hépatique normale. Les données sont insuffisantes pour tirer des conclusions chez les patients avec une insuffisance hépatique modérée. Aucune donnée n'est disponible chez les patients ayant une insuffisance hépatique sévère (voir rubriques «Posologie/Mode d'emploi» et «Contre-indications»).
Relation pharmacocinétique/pharmacodynamie (PK/PD)
L'analyse de la relation PK/PD a montré qu'il existait une relation quasi-linéaire entre les concentrations plasmatiques d'ivabradine et de S18982 et la baisse de la fréquence cardiaque, pour des doses allant jusqu'à 15 à 20 mg deux fois par jour. A des posologies plus élevées, la baisse de la fréquence cardiaque n'est plus proportionnelle à celle de la concentration plasmatique d'ivabradine et tend vers un plateau. Une forte exposition à ivabradine, qui pourrait se produire en cas d'administration concomitante avec des inhibiteurs puissants du CYP3A4, peut entraîner une réduction excessive de la fréquence cardiaque alors que ce risque est réduit avec les inhibiteurs modérés du CYP3A4 (voir rubriques «Contre-indications», «Mises en garde et précautions» et «Interactions»).
Données précliniques
Carvédilol
Carvédilol n'a pas été mutagène lors de tests in vitro et in vivo réalisés chez des mammifères et des non-mammifères.
Dans les études de cancérogenèse réalisées chez le rat et la souris avec des doses allant jusqu'à respectivement 75 mg/kg et 200 mg/kg (dépassant de 38 à 100 fois la dose maximale recommandée chez l'homme [MRHD] de 100 mg/jour de carvédilol, correspondant à 2 fois la dose maximale journalière de carvédilol (2× 25 mg/jour) contenue dans Carivalan), carvédilol n'a eu aucun effet carcinogène.
Les études chez l'animal n'ont pas révélé de propriétés tératogènes. Les doses supérieures à 60 mg/kg (>30 fois la MRHD) ont entraîné un retard de la croissance physique et du développement de la descendance. Une embryotoxicité (mortalité après implantation plus fréquentes) a été observée chez des rats et des lapins avec les doses respectives de 200 mg/kg et 75 mg/kg (38 à 100 fois la MRHD de 100 mg/jour); il n'y a cependant pas eu de malformations. Les bêtabloquants diminuent la perfusion placentaire et peuvent ainsi provoquer la mort fœtale intra-utérine ou la naissance de nouveau-nés immatures et très prématurés. De plus, les études chez l'animal ont montré que carvédilol traverse la barrière placentaire, ce qui oblige à envisager d'éventuels effets d'un blocage alpha ou bêta chez le fœtus ou le nouveau-né humain. Avec d'autres alpha- et bêtabloquants, ces effets se sont traduits par une détresse périnatale et néonatale (bradycardie, hypotension, troubles respiratoires, hypoglycémie, hypothermie). Pendant la période post-natale, le risque de complications cardiaques et pulmonaires chez le nouveau-né peut être accru. L'administration de doses toxiques de carvédilol au rat femelle adulte (>200 mg/kg, >100 fois la MRHD de 100 mg/jour) a entraîné des troubles de la fertilité (pas d'accouplements ou accouplements rares, diminution du nombre de corps jaunes et des implantations).
Des études réalisées chez le rat ont montré que carvédilol et ses métabolites (comme les autres bêtabloquants) sont excrétés dans le lait maternel. La mortalité une semaine après la mise bas a été augmentée chez de jeunes rats recevant des doses de 60 mg/kg/jour (30 fois la MRHD de 100 mg/jour) et pendant le premier trimestre jusqu'au 22e jour d'allaitement.
Ivabradine
Les études de toxicité sur la reproduction ont montré l'absence d'effet sur la fertilité chez le rat quel que soit le sexe. Une incidence plus élevée de fœtus atteints de malformations cardiaques a été observée chez le rat et un petit nombre de fœtus chez le lapin ont présenté une ectrodactylie quand les femelles en gestation étaient traitées durant l'organogenèse avec une exposition proche des doses thérapeutiques.
Chez le chien traité par l'ivabradine (doses de 2, 7 ou 24 mg/kg/jour) durant un an, des modifications réversibles des fonctions rétiniennes ont été observées mais n'ont provoqué aucun dommage sur les structures oculaires. Ces résultats sont cohérents avec l'effet pharmacologique de l'ivabradine sur le courant Ih rétinien activé par l'hyperpolarisation, et qui présente beaucoup d'homologie avec le courant pacemaker cardiaque If.
Aucune modification cliniquement pertinente n'a été observée dans d'autres études au long cours à doses répétées et dans les études de carcinogénèse.
Aucune évidence de mutagénicité ou d'activité clastogène significative n'a été observée après une revue et analyse exhaustive des données issues d'une série de tests de génotoxicité in vitro et in vivo, conformément aux exigences réglementaires.
Remarques particulières
Stabilité
Ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques concernant le stockage
Ne pas conserver au-dessus de 30 °C.
Tenir hors de portée des enfants.
Numéro d’autorisation
66213 Swissmedic.
Titulaire de l’autorisation
Servier (Suisse) S.A., 1242 Satigny.
Mise à jour de l’information
Octobre 2018.
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.



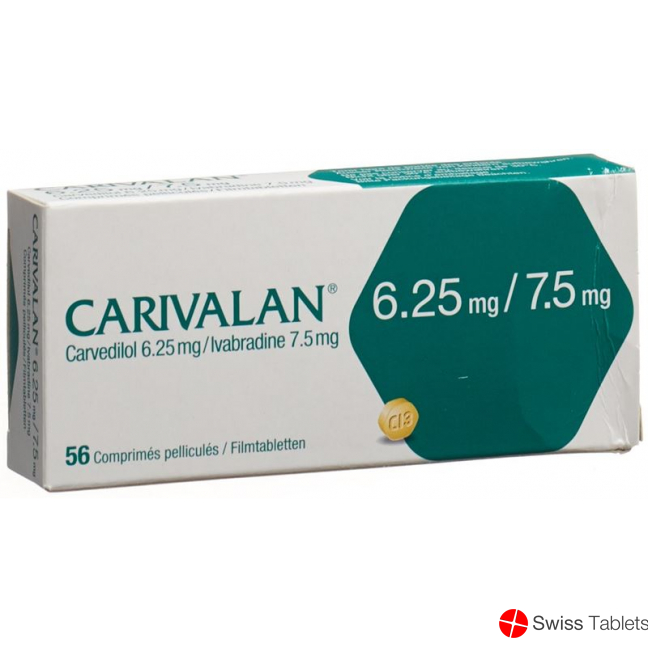
 Deutsch
Deutsch French
French Italian
Italian







