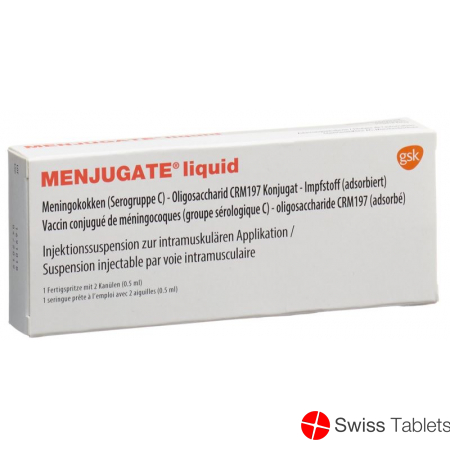
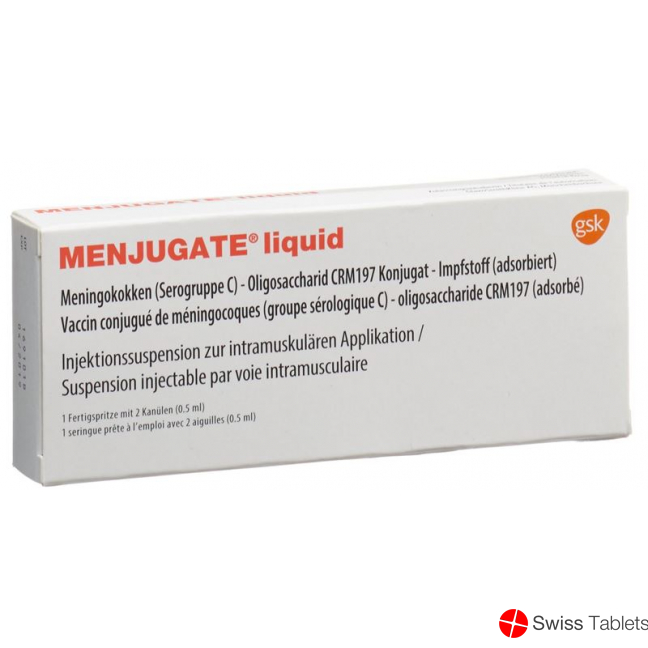
Menjugate Liquid Injektionssuspension Fertigspritze 0.5ml buy online
Menjugate Liquid Inj Susp Fertspr 0.5 ml
-
57.24 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: GLAXO SMITHKLINE AG
- Product Code: 7221543
- ATC-code J07AH07
- EAN 7680660370014
Ingredients:
Natriumchlorid, Histidin, Aluminium (Al3+) 0.3-0.4 mg, Aluminiumhydroxid, Diphtherie CRM197 Protein 12.5-25 mcg, Meningokokken C-Saccharid-CRM-Konjugat-Impfstoff , Neisseria meningitidis-C-Oligosaccharid 10 mcg.

Description
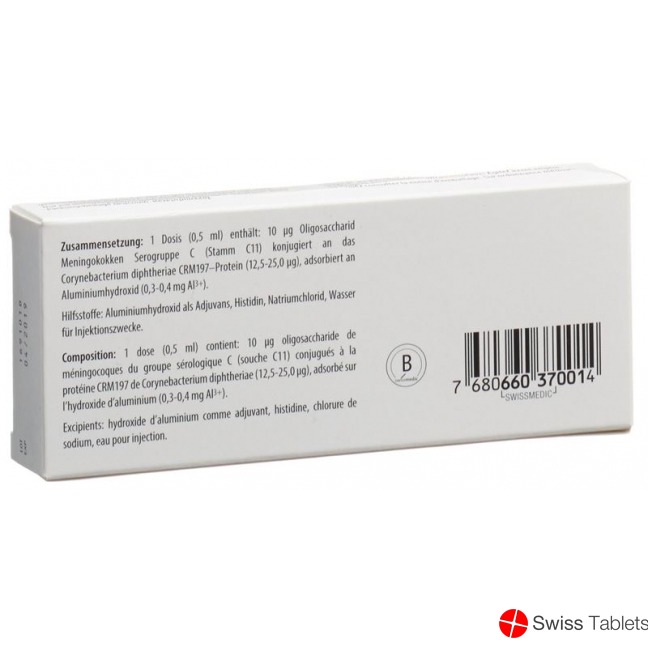
Zusammensetzung
Wirkstoffe: Menjugate enthält Neisseria meningitidis Oligosaccharide der Serogruppe C (Stamm C11), die an das Corynebacterium diphtheriae CRM197-Protein konjugiert und an Aluminiumhydroxid adsorbiert sind.
Hilfsstoffe: Aluminiumhydroxid als Adjuvans, Histidin, Natriumchlorid und Wasser für Injektionszwecke.
Galenische Form und Wirkstoffmenge pro Einheit
Menjugate ist eine Injektionssuspension zur intramuskulären Applikation.
Das Produkt besteht aus einer Fertigspritze, die eine weisse opaleszierende Suspension enthält.
Jede Impfdosis zu 0,5 ml enthält:
- Neisseria meningitidis der Serogruppe C (Stamm C11) Oligosaccharid 10 μg konjugiert an
- Corynebacterium diphtheriae CRM197-Protein 12,5 bis 25,0 µg adsorbiert an Aluminiumhydroxid (0,3 bis 0,4 mg Al3+).
Indikationen/Anwendungsmöglichkeiten
Aktive Immunisierung von Kindern ab 2 Monaten, Jugendlichen und Erwachsenen zur Vorbeugung von invasiven Erkrankungen, die durch Neisseria meningitidis der Serogruppe C verursacht werden.
Die Anwendung von Menjugate sollte auf Grundlage der offiziellen Impfempfehlungen erfolgen.
Dosierung/Anwendung
Es gibt keine Daten über den Gebrauch von verschiedenen Meningokokken Gruppe C Konjugatimpfstoffen während der Grundimmunisierung oder zur Auffrischung. Es sollte, soweit möglich, immer der gleiche Impfstoff verwendet werden. Für weitere Informationen zu Reaktionen auf Auffrischungsdosen und die gleichzeitige Verabreichung anderer Impfstoffe für Kinder siehe «Interaktionen» und «Eigenschaften/Wirkungen».
Grundimmunisierung
Säuglinge ab 2 Monaten bis zum 12. Monat erhalten 3 Dosen von jeweils 0,5 ml, die in einem Intervall von mindestens 1 Monat verabreicht werden sollten.
Kinder, die älter als 12 Monate sind, Jugendliche und Erwachsene erhalten eine Einzeldosis von 0,5 ml.
Für die flüssige Formulierung bei Kindern im Alter von 2–12 Monaten liegen keine Daten vor.
Auffrischimpfung
Es wird empfohlen, nach Abschluss der Grundimmunisierung in Säuglingen eine Auffrischimpfung zu verabreichen. Der Zeitpunkt dieser Dosis sollte den vorliegenden offiziellen Empfehlungen entsprechen. Die Notwendigkeit von Auffrischimpfungen für Patienten, die mit einer Einzeldosis grundimmunisiert wurden (d.h. bei der ersten Immunisierung 12 Monate oder älter), wurde noch nicht festgelegt.
Der Impfstoff (0,5 ml) wird tief intramuskulär verabreicht, bei Säuglingen vorzugsweise anterolateral in den Oberschenkel und bei älteren Kindern, Jugendlichen und Erwachsenen in der Region des M. deltoideus. Der Impfstoff darf nicht intravenös, subkutan oder intradermal verabreicht werden.
Menjugate darf nicht mit anderen Impfstoffen in derselben Spritze vermischt werden.
Falls mehr als ein Impfstoff verabreicht wird, muss die Injektion an unterschiedlichen Stellen erfolgen.
Für Anweisungen zur Handhabung des Impfstoffes vor der Verabreichung siehe «Sonstige Hinweise».
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe des Impfstoffes, einschliesslich Diphtherietoxoid (CRM197), oder eine lebensbedrohliche Reaktion nach der vorherigen Verabreichung eines Impfstoffes, der ähnliche Bestandteile enthält (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Warnhinweise und Vorsichtsmassnahmen
Vor Injektion eines jeden Impfstoffes muss die für die Verabreichung verantwortliche Person alle bekannten Vorsichtsmassnahmen zur Vorbeugung einer allergischen oder sonstigen Reaktion treffen.
Wie bei allen durch Injektion zu verabreichenden Impfstoffen müssen immer geeignete medizinische Behandlung- und Überwachungsmöglichkeiten für den Fall einer seltenen anaphylaktischen Reaktion nach Verabreichung des Impfstoffes bereitstehen.
Angstreaktionen einschliesslich vasovagale Reaktionen (Synkope), Hyperventilation oder Stressreaktionen können im Rahmen einer Impfung als psychogene Reaktion auf die Spritze auftreten (siehe «Unerwünschte Wirkungen»). Es ist sehr wichtig, dass Vorkehrungen getroffen sind, um Verletzungen im Rahmen von Ohnmachtsanfällen zu verhindern.
Menjugate wird nicht vor Meningokokken-Erkrankungen, die durch andere Meningokokken-Typen als Serogruppe C ausgelöst werden, schützen. Ein vollständiger Schutz vor einer Erkrankung durch Meningokokken der Serogruppe C kann nicht garantiert werden.
Es gibt keine Daten für die Anwendung der Impfung zur Ausbruchkontrolle nach Exposition.
Bei Personen mit mangelnder Antikörperbildung kann die Impfung keine angebrachte schützende Immunantwort auslösen. Menjugate wurde nicht spezifisch bei immungeschwächten Personen getestet. Personen mit HIV-Infektion, Komplementdefekten und Personen mit funktioneller oder anatomischer Asplenie können eine Immunantwort auf Meningokokken-Gruppe C-Konjugatimpfstoffe zeigen; das Ausmass des gebotenen Schutzes ist allerdings unbekannt.
Personen mit bestimmten Komplementdefizienzen und Personen, die eine Behandlung erhalten, welche die terminale Komplementaktivierung hemmt (zum Beispiel Eculizumab), haben ein erhöhtes Risiko für invasive Erkrankungen, die durch Neisseria meningitidis der Serogruppe C verursacht werden, selbst wenn sie nach der Impfung mit Menjugate Liquid Antikörper entwickeln.
Obwohl über Symptome eines Meningismus wie Nackenschmerzen und -steifheit oder Photophobie berichtet wurde, gibt es keinen Hinweis darauf, dass der Impfstoff eine Meningokokken C-Meningitis verursacht. Die Möglichkeit einer zeitgleich auftretenden Meningitis anderer Ursache sollte nicht ausser Betracht gelassen werden.
Konjugatimpfstoffe, die das kreuzreagierende Material 197 (CRM197) enthalten, sollten nicht als immunisierende Vermittler gegen Diphtherie betrachtet werden. Es wird empfohlen, die Impfschemata für die Verabreichung von Impfstoffen, die das Diphtherietoxoid enthalten, nicht zu verändern.
Akute Infekte oder fieberhaften Erkrankungen sind Gründe um die Verabreichung von Menjugate zu verschieben, es sei denn, der behandelnde Arzt hält die Verschiebung der Impfung für das grössere Risiko. Kleine Infekte oder kleine fieberhafte Erkrankungen sind in der Regel kein Grund, die Impfung zu verschieben.
Der Impfstoff darf nicht intravenös, subkutan oder intradermal verabreicht werden.
Menjugate wurde bei Personen mit Thrombozytopenie oder Blutungsneigung nicht untersucht. Bei diesen Personen sollte das Risiko von Blutungen nach intramuskulärer Injektion sorgfältig gegen den Nutzen der Impfung abgewogen werden.
Es liegen keine Daten für Erwachsene ab 65 Jahren vor.
Latexempfindliche Personen:
In der Schutzkappe der Fertigspritze ist kein Naturlatex nachweisbar, die sichere Anwendung von Menjugate Liquid bei latexempfindlichen Personen wurde jedoch nicht untersucht.
Interaktionen
Menjugate darf nicht mit anderen Impfstoffen in derselben Spritze vermischt werden. Bei der Gabe mit anderen Impfstoffen müssen diese an unterschiedlichen Injektionsstellen verabreicht werden.
Die gleichzeitige Verabreichung von Menjugate mit den folgenden Impfstoffen reduzierte in klinischen Studien die Immunantwort auf diese anderen Antigene nicht:
- Polio (inaktivierter Polioimpfstoff [IPV] und Oraler Lebend-Polioimpfstoff [OPV]);
- Diphtherie [D] und Tetanus [T] allein oder in Kombination mit Ganzkeim- [wP] oder azellulären Pertussis [aP];
- Haemophilus-influenzae-Typ-B-[HIB]-Konjugatimpfstoff;
- Hepatitis-B-[HBV]-Impfstoff allein verabreicht oder gleichzeitig als kombinierter Impfstoffe, der D, T, Hib, IPV und aP enthält;
- kombinierter Masern-, Mumps- und Röteln-Impfstoff.
Zwischen Studien wurden geringfügige Schwankungen des mittleren geometrischen Titers (GMT) beobachtet. Die klinische Signifikanz, wenn es eine gibt, dieser Beobachtungen wurde jedoch nicht nachgewiesen.
In unterschiedlichen klinischen Studien mit verschiedenen Impfstoffen hat die gleichzeitige Gabe von Konjugatimpfstoff gegen Meningokokken der Serogruppe C in Kombination mit einer azellulären Pertussis-Komponente (mit oder ohne inaktivierte Polio- Viren, Hepatitis-B Oberflächenantigene oder HIB-Konjugat) im Vergleich zur getrennten Gabe oder zur gleichzeitigen Gabe mit Ganzkeim-Pertussis, zu niedrigen SBA GMTs geführt. Die Anteile, die einen SBA-Titer von mindestens 1:8 oder 1:128 erreichen, werden nicht beeinflusst. Die möglichen Auswirkungen dieser Beobachtungen auf die Dauer des Schutzes sind unbekannt.
Schwangerschaft/Stillzeit
Es gibt keine Daten über die Anwendung des Impfstoffes bei schwangeren Frauen.
In Tierversuchen bei Kaninchen in verschiedenen Trächtigkeitsstadien konnten nach Verabreichung von Menjugate kein Risiko für den Fötus festgestellt werden. Dennoch sollte die Impfung angesichts der Schwere der Meningokokken-Serogruppe C-Erkrankung nicht aufgrund einer Schwangerschaft ausgeschlossen werden, wenn das Risiko einer Aussetzung klar definiert ist.
Es liegen keine Informationen zur Sicherheit des Impfstoffs in der Stillzeit vor. Vor einer Impfung während der Stillzeit muss eine Nutzen-Risiko-Abwägung durchgeführt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt.
Nach der Impfung wurde sehr selten über Benommenheit berichtet. Dies könnte vorübergehend zu einer Beeinträchtigung der Verkehrstüchtigkeit und beim Bedienen von Maschinen führen.
Unerwünschte Wirkungen
In klinischen Studien beobachtete Nebenwirkungen:
Folgende Häufigkeitsbeschreibungen wurden festgelegt: sehr häufig (≥1/10); häufig (<1/10, ≥1/100); gelegentlich (<1/100, ≥1/1000); selten (<1/1000, ≥1/10'000); sehr selten (<1/10'000).
Unerwünschte Arzneimittelwirkungen wurden in allen Altersgruppen berichtet und sind unten aufgeführt.
Unerwünschte Arzneimittelwirkungen wurden in den Studien am Tag der Impfung sowie jeweils täglich in einem Zeitraum von mindestens 3 bis zu 6 Tagen nach der Impfung erfasst. Die Mehrzahl der Reaktionen war selbstlimitierend und klang im Nachbeobachtungszeitraum ab.
In allen Altersgruppen (ab 2 Monaten und älter) waren Reaktionen an der Injektionsstelle (einschliesslich Rötung, Schwellung und Druckempfindlichkeit oder Schmerzen) sehr häufig (diese Reaktionen wurden bei einem von drei älteren Kindern und bei einem von zehn Kindern im Vorschulalter beobachtet).
Diese Reaktionen waren jedoch in der Regel klinisch nicht signifikant. Rötung oder Schwellungen von mehr als 3 cm und Druckempfindlichkeit, die die Bewegungsfähigkeit länger als 48 Stunden beeinträchtigen, wurden – sofern untersucht – nicht häufig beobachtet.
Fieber von mindestens 38,0 °C wird häufig beobachtet (in 1 von 20 Fällen bei Säuglingen und Kleinkindern und in 1 von 10 Fällen bei Kindern im Vorschulalter), aber es steigt in der Regel, vor allem bei den älteren Altersgruppen, nicht über 39,1 °C an.
Bei Säuglingen (2–11 Monate) und Kleinkindern (12–24 Monate) zeigten sich nach der Impfung häufig Symptome wie Weinen und Erbrechen (Kleinkinder). Sehr häufig waren nach der Impfung Reizbarkeit, Schläfrigkeit, Beeinträchtigung des Schlafes, Appetitlosigkeit, Durchfall und Erbrechen (Säuglinge).
Es ist nicht nachgewiesen, ob diese Symptome mit der Verabreichung von Menjugate oder mit der gleichzeitigen Verabreichung anderer Impfstoffe, vor allem mit DTP, in Zusammenhang stehen.
Sehr häufig wurde über Muskel- und Gelenkschmerzen bei Erwachsenen und sehr häufig über Schläfrigkeit bei kleineren Kindern berichtet. Kopfschmerzen waren sehr häufig bei Kindern an weiterführenden Schulen (11–16 Jahre) und häufig bei Grundschülern (4–11 Jahre) beobachtet worden.
Über nachfolgende unerwünschte Arzneimittelwirkungen aus allen Altersgruppen wurde in klinischen Studien berichtet:
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort (bis zu 81%*) | |
Sehr häufig | Reaktionen an der Injektionsstelle (Rötung, Schwellung und Druckempfindlichkeit/Schmerzen) |
Häufig | Fieber ≥38 °C |
Über folgende zusätzliche Reaktionen wurde bei Säuglingen (erstes Lebensjahr) und Kleinkindern (zweites Lebensjahr) berichtet:
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort (bis zu 30%*) | |
Sehr häufig | Reizbarkeit, Schläfrigkeit und Beeinträchtigung des Schlafes |
Häufig | Weinen |
Erkrankungen des Gastrointestinaltrakts (bis zu 18%*) | |
Sehr häufig | Durchfall und Appetitlosigkeit Erbrechen (Säuglinge) |
Häufig | Erbrechen (Kleinkinder) |
Über folgende zusätzliche Reaktionen wurde bei älteren Kindern und Erwachsenen berichtet:
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort (bis zu 34%*) | |
Sehr häufig | Unwohlsein Kopfschmerzen (Kinder an weiterführenden Schulen) |
Häufig | Kopfschmerzen (Grundschüler) |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen (bis zu 29%*) | |
Sehr häufig | Muskelschmerzen Gelenkschmerzen |
Erkrankungen des Gastrointestinaltrakts (bis zu 16%*) | |
Sehr häufig | Übelkeit (Erwachsene) |
* Dieser Prozentsatz bezieht sich auf die häufigste Nebenwirkung in dieser Gruppe von Erkrankungen.
Die Sicherheit der Formulierung Menjugate Liquid wurde in einer randomisierten klinischen Studie, die 989 Kinder im Alter von 12 Monaten bis 2 Jahren einschloss, mit der Sicherheit von der Formulierung Menjugate «Trockenimpfstoff und Lösungsmittel» verglichen. Das Sicherheitsprofil beider Formulierungen von Menjugate war vergleichbar.
Spontanmeldungen von unerwünschten Wirkungen aus der Postmarketing Surveillance (alle Altersgruppen):
Zu den am häufigsten berichteten vermuteten unerwünschten Wirkungen aus der Postmarketing Surveillance gehören Benommenheit, Fieber, Kopfschmerzen, Übelkeit, Erbrechen und Ohnmachtsanfälle.
Da diese Ereignisse freiwillig von einer Population von ungewisser Grösse berichtet wurden, ist es nicht möglich, ihre Häufigkeit zuverlässig abzuschätzen oder für alle Ereignisse einen kausalen Zusammenhang mit der Verabreichung des Impfstoffs herzustellen.
Erkrankungen des Immunsystems |
Lymphadenopathie, Anaphylaxie, einschliesslich anaphylaktischer Schock, Reaktionen von Überempfindlichkeit, einschliesslich Bronchospasmen, Gesichtsödem und Angioödem |
Erkrankungen des Nervensystems |
Benommenheit, Krämpfe, einschliesslich Fieberkrämpfen; Ohnmachtsanfällen; Hypo- und Parästhesie, Hypotonus |
Es gab sehr selten Berichte über Anfälle nach der Impfung mit Menjugate; die Impflinge erholten sich normalerweise schnell. Einige der angegebenen Anfälle könnten Ohnmachtsanfälle gewesen sein. Die Häufigkeit der Anfälle lag unterhalb der Spontaninzidenz von epileptischen Anfällen bei Kindern. Bei Säuglingen waren die Anfälle gewöhnlich mit Fieber verbunden; wahrscheinlich handelte es sich um Fieberkrämpfe.
Sehr selten wurden Sehstörungen und Photophobien nach Impfung mit Meningokokken- Konjugat-Impfstoffen der Serogruppe C beobachtet, die in der Regel zusammen mit anderen neurologischen Symptomen wie Kopfschmerzen und Schwindel auftraten.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Ausgeprägte Schwellung des geimpften Körpergliedes |
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Apnoe bei sehr unreifen Säuglingen |
Erkrankungen des Gastrointestinaltrakts |
Übelkeit, Erbrechen und Durchfall |
Erkrankungen der Haut und des Unterhautzellgewebes |
Ausschlag, Nesselsucht, Hautjucken, Purpura, Erythema multiforme und Stevens-Johnson-Syndrom |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Muskel- und Gelenkschmerzen |
Über Rückfälle des nephrotischen Syndroms im Zusammenhang mit Meningokokken- Konjugat-Impfstoffen der Serogruppe C wurde berichtet.
Überdosierung
Hierzu liegen keine Erfahrungen vor. Da es sich bei jeder Injektion um eine Einzeldosis von 0,5 Millilitern handelt, ist eine Überdosierung unwahrscheinlich.
Eigenschaften/Wirkungen
ATC-Code: J07AH07
Pharmakotherapeutische Gruppe: Meningokokken-Impfstoffe
Pharmakodynamik:
Es wurden entsprechend seinem Status als Impfstoff keine pharmakodynamischen Studien mit Menjugate durchgeführt.
Klinische Wirksamkeit:
Es wurden keine prospektiven Studien zur Wirksamkeit durchgeführt.
Die Wirksamkeit von Menjugate wurde basierend auf der Messung der Produktion von gruppenspezifischen antikapsulären Antikörpern mit bakterizider Aktivität abgeleitet. Die bakterizide Aktivität im Serum (SBA) wurde mittels Humanserum als Quelle des exogenen Komplements (hSBA) gemessen. Das hSBA war das ursprüngliche Korrelat zum Schutz vor Meningokokken-Erkrankungen.
In klinischen Studien mit 540 Säuglingen, die im Alter von 2, 3 und 4 Monaten jeweils eine Dosis erhielten, und mit 175 Säuglingen, die im Alter von 2, 4 und 6 Monaten jeweils eine Dosis erhielten, erreichten 98% der Kinder nach der zweiten und dritten Dosis (Humanserum als Komplementquelle) hSBA-Titer von mindestens 1:8.
Die Notwendigkeit von Auffrischimpfungen sollte auf Grundlage der offiziellen Impfempfehlungen festgelegt werden.
Im Vergleich mit zugelassenen nicht-konjugierten Meningokokken-Polysaccharid-Impfstoffen konnte in klinischen Studien gezeigt werden, dass die von Menjugate hervorgerufene Immunreaktion bei Kleinkindern, Kindern und Jugendlichen besser ist; bei Erwachsenen war sie vergleichbar (siehe Tabelle).
Zudem induziert Menjugate im Unterschied zu nicht-konjugierten Polysaccharid-Impfstoffen nach der Impfung ein immunologisches Gedächtnis. Die Dauer des Impfschutzes wurde jedoch noch nicht nachgewiesen.
Daten zu Erwachsenen ab 65 Jahren liegen nicht vor.
Vergleich des Prozentsatzes von Probanden mit bakteriziden Serumtitern gegen Meningokokken der Serogruppe C von ≥1:8 (humanes Komplement) ein Monat nach Verabreichung einer Dosis von Menjugate oder eines anderen zugelassenen nicht-konjugierten Meningokokken-Polysacharid-Impfstoffes, unterteilt nach Altersgruppen
Alter 1–2 Jahre | Alter 3–5 Jahre | Alter 11–17 Jahre | Alter 18–64 Jahre | |||||
Menjugate | Men PS(1) | Menjugate | Men PS(1) | Menjugate | Men PS(2) | Menjugate | Men PS(2) | |
SBA % ≥1:8 (95% KI) | 78% | 19% | 79% | 28% | 84% | 68% | 90% | 88% |
MenPS = zugelassener nicht-konjugierter Meningokokken-Polysaccharid-Impfstoff
(1) =Serogruppe A, C, W-135 und Y, enthält 50 μg der Serogruppe C pro Dosis
(2) =Serogruppe A und C, enthält 50 µg der Serogruppe C pro Dosis
In einer randomisierten klinischen Studie mit 989 Kindern im Alter von 12 Monaten bis 2 Jahren wurde die Immunogenität von Menjugate in der flüssigen Formulierung mit der von Menjugate in der lyophilisierten Formulierung, hergestellt mit dem Wirkstoff aus zwei unterschiedlichen Produktionsstätten, verglichen. Für Menjugate in der flüssigen Formulierung betrug das Verhältnis der geometrischen Mitteltiter (GMR) nach und vor der Impfung 4,69 (95% KI: 4,01–5,49); für Menjugate in der lyophilisierten Formulierung betrug das GMR 5,6 (95% KI: 4,79–6,54) und 6,34 (95% KI: 5,4–7,45). Die von beiden Formulierungen von Menjugate ausgelöste Antikörperreaktion war vergleichbar. Dies wurde durch das zweiseitige Konfidenzintervall von 95% für die GMR-Werte der entsprechenden Impfstoffgruppe belegt: Diese lagen 28 Tage nach der Impfung im vorher festgelegten Äquivalenzintervall (0,5–2,0). Gleichzeitig lag der Anteil der Probanden mit hSBA ≥1:8 bei 60% (95% KI: 54–65) für die flüssige Formulierung sowie bei 63% (95% KI: 57–69) und 70% (95% KI: 64–76) für die lyophilisierte Formulierung. Diese Ergebnisse entsprachen der gepoolten Rate, die in früheren Studien mit Menjugate in der lyophilisierten Formulierung bei Kindern im Alter von 12–23 Monaten beobachtet worden war (63%, 95%-KI: 60–67).
Post-Marketing-Surveillance nach einer Impfkampagne in Grossbritannien
Schätzungen der Wirksamkeit des Impfstoffes aus dem Routine-Impfprogramm in Grossbritannien (Verabreichung verschiedener Mengen der drei Meningokokken Serogruppe C Konjugatimpfstoffe) für den Zeitraum von der Einführung Ende 1999 bis März 2004 zeigten die Notwendigkeit einer Auffrischimpfung nach Abschluss der Grundimmunisierung (drei Dosen, die nach 2, 3 und 4 Monaten verabreicht werden). Innerhalb eines Jahres nach Abschluss der Grundimmunisierung wurde die Wirksamkeit des Impfstoffes in der Säugling-Kohorte auf 93% geschätzt (95% KI: 67-99). Mehr als ein Jahr nach Abschluss der Grundimmunisierung gab es jedoch klare Anzeichen für das Nachlassen des Schutzes.
Bis zum Jahr 2007 liegen die Gesamtschätzungen der Wirksamkeit in den Alterskohorten von 1–18 Jahren, die während des ersten Aufhol-Impfprogrammes in Grossbritannien eine Einzeldosis des Meningokokken-Serogruppe C Konjugatimpfstoffes erhielten, zwischen 83% und 100%. Die Daten zeigen keinen signifikanten Rückgang der Wirksamkeit bei diesen Alterskohorten im Vergleich zum Zeitraum von weniger als einem Jahr oder einem Jahr oder mehr seit der Immunisierung.
Pharmakokinetik
Es wurden entsprechend seinem Status als Impfstoff keine pharmakokinetischen Studien mit Menjugate durchgeführt.
Präklinische Daten
Basierend auf den konventionellen Studien zur Toxizität bei wiederholter Gabe und zur Reproduktionstoxizität (embryofetale Studien) lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen. Die Beeinträchtigung der Fruchtbarkeit wurde nicht untersucht.
Sonstige Hinweise
Inkompatibilitäten: Dieser Impfstoff darf nicht mit anderen Arzneimitteln vermischt werden.
Haltbarkeit: Der Impfstoff darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise: Im Kühlschrank bei +2 °C bis +8 °C lagern. Nicht einfrieren. Die Fertigspritze in der äusseren Verpackung aufbewahren, um das Präparat vor Licht zu schützen.
Hinweise für die Handhabung:
Fertigspritze:
Die Spritze mit dem Impfstoff vor der Verabreichung vorsichtig schütteln.
Schutzkappe der Spritze entfernen und eine geeignete Nadel aufsetzen. Der Impfstoff sollte vor der Verabreichung visuell auf Partikel und Verfärbungen geprüft werden.
Vor Injektion des Impfstoffes sicherstellen, dass sich keine Luftblasen in der Spritze befinden. Wenn Fremdpartikel und/oder eine Abweichung des Aussehens festgestellt worden sind, muss der Impfstoff verworfen werden.
Nicht verwendeter Impfstoff oder Verpackungsmaterialien sollten gemäss den lokalen Bestimmungen beseitigt werden.
Zulassungsnummer
66037 (Swissmedic).
Zulassungsinhaberin
GlaxoSmithKline AG, 3053 Münchenbuchsee.
Stand der Information
Februar 2019.
Composition
Principes actifs: Menjugate contient l'oligosaccharide de Neisseria meningitidis du groupe sérologique C (souche C11), conjugué à la protéine CRM197 de Corynebacterium diphtheriae et adsorbé sur hydroxyde d'aluminium.
Excipients: Hydroxyde d'aluminium comme adjuvant, histidine, chlorure de sodium et eau pour préparations injectables.
Forme galénique et quantité de principe actif par unité
Menjugate est une suspension injectable pour l'administration intramusculaire.
Le produit se présente sous la forme d'une seringue préremplie contenant une suspension opalescente blanche.
Chaque dose de vaccin de 0,5 ml contient:
- Oligosaccharide de Neisseria meningitidis du groupe sérologique C (souche C11) 10 µg conjugué à
- Protéine CRM197 de Corynebacterium diphtheriae entre 12,5 et 25,0 µg adsorbés sur hydroxyde d'aluminium (entre 0,3 et 0,4 mg Al3+).
Indications/Possibilités d’emploi
Immunisation active des enfants à partir de l'âge de 2 mois, des adolescents et des adultes pour la prévention des maladies invasives causées par Neisseria meningitidis du groupe sérologique C.
L'utilisation de Menjugate doit être conforme aux recommandations officielles en matière de vaccination.
Posologie/Mode d’emploi
On ne dispose pas de données concernant l'utilisation des différents vaccins conjugués contre les méningocoques du groupe C pendant l'immunisation de base ou les immunisations de rappel. Dans la mesure du possible, il est recommandé de toujours utiliser le même vaccin. Pour toute information complémentaire concernant les réactions aux immunisations de rappel et à l'administration simultanée d'autres vaccins chez l'enfant, voir «Interactions» et «Propriétés/Effets».
Immunisation de base
Les nourrissons dès l'âge de 2 mois jusqu'à l'âge de 12 mois reçoivent 3 doses de 0,5 ml séparées par des intervalles d'au moins 1 mois.
Les enfants de plus de 12 mois, les adolescents et les adultes reçoivent une dose unique de 0,5 ml.
On ne dispose pas de données concernant la formulation liquide chez les enfants âgés de 2 à 12 mois.
Immunisation de rappel
Il est recommandé d'administrer une vaccination de rappel aux enfants qui ont bénéficié de l'immunisation de base en tant que nourrissons. Le moment de l'injection de cette dose doit être conforme aux recommandations officielles disponibles. La nécessité d'immunisations de rappel pour les patients chez lesquels l'immunisation de base a été effectuée par une dose unique (c.à.d. après 12 mois ou plus tard) n'a pas été encore fixée.
Le vaccin (0,5 ml) doit être administré par voie intramusculaire profonde. Chez les nourrissons, il est recommandé d'administrer le vaccin dans la face antérolatérale de la cuisse. Chez les enfants plus âgés, les adolescents et les adultes, il est recommandé de l'administrer dans la région du muscle deltoïde. Le vaccin ne doit pas être administré par voie intraveineuse, sous-cutanée ou intradermique.
Menjugate ne doit pas être mélangé à d'autres vaccins dans la même seringue.
En cas d'administration de plus d'un vaccin, il faut choisir un site distinct pour chaque injection.
Pour les instructions concernant la manipulation du vaccin avant l'administration,voir «Remarques particulières».
Contre-indications
Hypersensibilité au principe actif ou à l'un des excipients entrant dans la composition du vaccin, y compris à l'anatoxine diphtérique (CRM197), ou réaction ayant engagé le pronostic vital lors de l'injection antérieure d'un vaccin contenant des composants semblables (voir «Mises en garde et précautions»).
Mises en garde et précautions
Avant l'injection de tout vaccin, la personne responsable de l'administration doit prendre toutes les mesures de précaution connues pour prévenir une réaction allergique ou toute autre réaction.
Comme lors de l'administration de tout vaccin injectable, les moyens appropriés de traitement médical et de surveillance doivent être toujours disponibles pour les cas, rares, où une réaction anaphylactique se produirait suite à l'administration du vaccin.
Des réactions psychogènes à la piqûre – réactions anxieuses, y compris vasovagales (syncope), hyperventilation ou réactions de stress – peuvent se produire dans le cadre d'une vaccination (voir «Effets indésirables»). Il est très important de prendre des mesures préventives afin d'éviter au patient de se blesser s'il perd connaissance.
Menjugate ne protège pas contre les maladies causées par les méningocoques d'autres groupes sérologiques que le groupe C. Une protection complète contre une infection à méningocoques du groupe sérologique C ne peut pas être garantie.
On ne dispose pas de données en ce qui concerne l'utilisation post-expositionnelle du vaccin pour contrôler le développement de la maladie après qu'elle s'est déclarée.
Chez les personnes produisant trop peu d'anticorps, la vaccination ne peut pas déclencher la réponse immunitaire protectrice requise. L'efficacité de Menjugate chez les personnes immunodéprimées n'a pas été testée de manière spécifique. Bien qu'il soit possible que les sujets présentant une infection à VIH, un déficit en fractions du complément ou une asplénie fonctionnelle ou anatomique développent une réponse immunitaire aux vaccins conjugués contre les méningocoques du groupe C, l'étendue de la protection conférée est toutefois inconnue.
Les personnes présentant certains déficits en complément et les personnes recevant un traitement inhibiteur de l'activation de la voie terminale du complément (l'éculizumab, par exemple) présentent un risque accru d'affections invasives causées par Neisseria meningitidis, y compris du sérogroupe C, même si elles ont développé des anticorps après la vaccination avec Menjugate.
Bien qu'on ait rapporté des symptômes de méningisme tels que douleurs ou raideur de la nuque ou photophobie, il n'existe aucune indication laissant supposer que le vaccin lui-même cause une méningite à méningocoques du groupe C. Il faut prendre en considération la possibilité d'une méningite d'une autre étiologie se produisant simultanément.
Les vaccins conjugués contenant la protéine Cross Reacting Material 197 (CRM197) ne doivent pas être considérés comme des agents immunisants contre la diphtérie. Il est recommandé de ne pas modifier les schémas d'immunisation des vaccins contenant l'anatoxine diphtérique.
Une infection aiguë ou une maladie fébrile est une raison suffisante pour reporter l'administration de Menjugate, à moins que le médecin traitant estime que le report de la vaccination représente un risque plus élevé. Les infections ou maladies fébriles banales ne constituent généralement pas un motif de report de la vaccination.
Le vaccin ne doit pas être administré par voie intraveineuse, sous-cutanée ou intradermique.
L'administration de Menjugate n'a pas été étudiée chez les patients présentant une thrombocytopénie ou une tendance aux saignements. Chez ces patients, le risque hémorragique consécutif à une injection intramusculaire doit soigneusement être mis en balance avec l'utilité de la vaccination.
On ne dispose d'aucune donnée concernant les adultes de plus de 65 ans.
Personnes sensibles au latex
Le latex naturel n'est pas détectable dans le capuchon de protection de la seringue, mais la sécurité d'emploi de Menjugate Liquid n'a pas été étudiée chez les personnes sensibles au latex.
Interactions
Menjugate ne doit pas être mélangé à d'autres vaccins dans la même seringue. Lors de l'administration simultanée avec d'autres vaccins, il faut choisir un site différent pour chaque injection.
L'administration simultanée de Menjugate et des vaccins suivants n'a pas diminué la réponse immunitaire à ces autres antigènes dans des études cliniques:
- Antipoliomyélitiques (vaccin antipoliomyélitique inactivé [IPV] et vaccin antipoliomyélitique oral vivant [OPV]);
- Antidiphtériques [D] et antitétaniques [T] seuls ou en combinaison avec un vaccin anticoquelucheux à germes entiers [wP] ou acellulaire [aP];
- Vaccin conjugué contre l'Haemophilus influenzae de type B [HIB];
- Vaccin contre l'hépatite B [HBV] seul ou combiné à un vaccin contre D, T, HIB, IPV et aP;
- Vaccin combiné contre la rougeole, les oreillons et la rubéole
Des variations minimes du titre géométrique moyen (TGM) ont été observées au cours de différentes études, mais rien n'indique que ces variations s'accompagnent de répercussions cliniquement significatives.
Au cours de différentes études cliniques avec différents vaccins, l'administration simultanée d'un vaccin conjugué contre les méningocoques du groupe sérologique C en association avec une composante anticoquelucheuse acellulaire (avec ou sans virus de la poliomyélite inactivés, antigènes de surface du virus de l'hépatite B ou vaccin conjugué contre l'HIB) s'est ensuivie de faibles TGM de l'activité bactéricide sérique (SBA) par rapport à l'administration différée ou à l'administration simultanée avec un vaccin anticoquelucheux à germes entiers. Le nombre de patients chez lesquels un titre de SBA d'au moins 1:8 ou de 1:128 a été atteint n'est cependant pas influencé. On ne connaît pas les effets possibles de ces observations sur la durée de la protection.
Grossesse/Allaitement
On ne dispose pas de données concernant l'utilisation du vaccin chez la femme enceinte.
Au cours d'expériences sur des lapins à différents stades de la gestation, aucun risque pour le fœtus n'a pu être mis en évidence après l'administration de Menjugate. Toutefois, compte tenu de la gravité d'une maladie à méningocoques du groupe sérologique C, une vaccination ne doit pas être exclue en cas de grossesse si le risque d'exposition est clairement défini.
On ne dispose d'aucune information concernant la sécurité du vaccin lors de son utilisation chez les femmes qui allaitent. Il faut soigneusement mettre en balance le rapport bénéfice/risque avant de vacciner une femme qui allaite.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude n'a été effectuée sur les effets de Menjugate sur l'aptitude à la conduite ou l'utilisation de machines.
Une torpeur a été rapportée dans de très rares cas après l'administration du vaccin, ce qui pourrait conduire à une altération passagère de l'aptitude à la conduite et à l'utilisation de machines.
Effets indésirables
Effets indésirables observés au cours des études cliniques:
Les fréquences sont définies comme suit: «très fréquents» (≥1/10), «fréquents» (<1/10, ≥1/100), «occasionnels» (<1/100, ≥1/1000), «rares» (<1/1000, ≥1/10'000), «très rares» (<1/10'000).
Des effets médicamenteux indésirables ont été rapportés dans toutes les catégories d'âge et sont répertoriés ci-dessous.
Au cours de ces études, ces effets indésirables ont été inventoriés le jour même de la vaccination ainsi que sur une période d'au moins 3 à 6 jours après la vaccination. La majorité des réactions se sont dissipées d'elles-mêmes au cours de la période d'observation.
Dans tous les groupes d'âge (à partir de 2 mois), les réactions sur le site d'injection (incluant érythème, tuméfaction, sensibilité à la pression ou douleur) étaient très fréquentes (ces réactions ont été observées chez un enfant sur trois à l'âge scolaire et chez un enfant sur dix à l'âge préscolaire).
Ces réactions ne se sont toutefois en règle générale pas accompagnées de répercussions cliniquement significatives. Des érythèmes ou des tuméfactions de plus de 3 cm de diamètre ainsi que des douleurs qui entravent la mobilité pendant plus de 48 heures n'ont pas été observés fréquemment dans le cadre de ces études (dans la mesure où ils ont été étudiés).
On observe fréquemment une fièvre d'au moins 38,0 °C (1 cas sur 20 chez les nourrissons et les petits enfants et 1 cas sur 10 chez les enfants d'âge préscolaire). En règle générale et surtout chez les enfants plus âgés, elle ne dépasse cependant pas 39,1 °C.
Chez les nourrissons (de 2 à 11 mois) et les petits enfants (de 12 à 24 mois), des symptômes tels que des pleurs et des vomissements (petits enfants) se sont fréquemment produits après la vaccination. Une irritabilité, une somnolence, des troubles du sommeil, une perte de l'appétit, des diarrhées et des vomissements étaient très fréquents (nourrissons) après la vaccination.
Il n'est cependant pas démontré que ces symptômes sont liés à l'administration de Menjugate ou à l'administration simultanée d'autres vaccins, en particulier DTCoq.
Des myalgies et des arthralgies ont très souvent été rapportées chez l'adulte et une somnolence a très fréquemment été signalée chez les petits enfants. Des céphalées ont été observées très fréquemment chez les enfants en école secondaire (de 11 à 16 ans) et fréquemment chez les élèves des écoles primaires (4 à 11 ans).
Les effets médicamenteux indésirables suivants ont été rapportés au cours des études cliniques pour tous les groupes d'âge:
Troubles généraux et anomalies au site d'administration (jusqu'à 81%*) | |
Très fréquents | Réactions au site d'injection (érythème, tuméfaction, sensibilité à la pression/douleur) |
Fréquents | Fièvre ≥38 °C. |
Les réactions suivantes ont en outre été rapportées chez les nourrissons (première année de vie) et les petits enfants (deuxième année de vie):
Troubles généraux et anomalies au site d'administration (jusqu'à 30%*) | |
Très fréquents | Irritabilité, somnolence et troubles du sommeil |
Fréquents | Pleurs |
Affections gastro-intestinales (jusqu'à 18%*) | |
Très fréquents | Diarrhée et perte d'appétit Vomissements (nourrissons) |
Fréquents | Vomissements (petits enfants) |
Les réactions suivantes ont en outre été rapportées chez les enfants plus âgés et les adultes:
Troubles généraux et anomalies au site d'administration (jusqu'à 34%*) | |
Très fréquents | Malaise Céphalées (enfants en école secondaire) |
Fréquents | Céphalées (enfants en école primaire) |
Affections musculo-squelettiques et du tissu conjonctif (jusqu'à 29%*) | |
Très fréquents | Myalgies Arthralgies |
Affections gastro-intestinales (jusqu'à 16%*) | |
Très fréquents | Nausées (adultes) |
* Ce pourcentage indique l'effet indésirable le plus fréquent dans ce groupe d'affections.
La sécurité du vaccin Menjugate Liquid a été comparée à celle de Menjugate «vaccin lyophilisé et solvant» dans un essai clinique randomisé portant sur 989 enfants âgés de 12 mois à 2 ans. Le profil d'innocuité des deux formules de Menjugate était comparable.
Annonces spontanées d'effets indésirables survenus au cours de la période de surveillance suivant la mise sur le marché (tous les groupes d'âge):
Les effets indésirables suspectés les plus fréquemment rapportés dans le cadre de la surveillance suivant la mise sur le marché étaient une torpeur, de la fièvre, des céphalées, des nausées, des vomissements ainsi que des syncopes.
Ces événements ayant été signalés volontairement par une population de taille incertaine, il n'est pas possible d'estimer avec fiabilité leur fréquence ou d'établir un lien causal en rapport avec l'administration du vaccin pour tous les événements.
Affections du système immunitaire |
Lymphadénopathie, anaphylaxie, y compris choc anaphylactique, réactions d'hypersensibilité incluant bronchospasmes, œdème facial et angiœdème |
Affections du système nerveux |
Torpeur, convulsions y compris convulsions fébriles; syncopes, hypoesthésie et paresthésie, hypotonie |
De très rares cas de crises convulsives ont été rapportés après la vaccination avec Menjugate; les patients vaccinés se sont généralement rétablis rapidement. Quelques-uns des cas signalés ont pu être des syncopes. La fréquence de ces crises convulsives était inférieure à l'incidence spontanée des crises d'épilepsie chez les enfants. Chez les nourrissons, ces crises étaient généralement en relation avec un état fébrile et il est probable qu'il s'agissait de convulsions fébriles.
Des troubles de la vision ainsi que de la photophobie ont été observés dans de très rares cas suite à l'administration d'un vaccin conjugué contre les méningocoques du groupe C. En règle générale, ces troubles se sont accompagnés d'autres symptômes neurologiques tels que céphalées et vertiges.
Troubles généraux et anomalies au site d'administration |
Gonflement prononcé du membre dans lequel la vaccination a été effectuée |
Affections respiratoires, thoraciques et médiastinales |
Apnée chez les grands prématurés |
Affections gastro-intestinales |
Nausées, vomissements et diarrhées |
Affections de la peau et du tissu sous-cutané |
Éruption cutanée, urticaire, prurit, purpura, érythème polymorphe et syndrome de Stevens-Johnson |
Affections musculo-squelettiques et du tissu conjonctif |
Myalgies et arthralgies |
Des cas de rechute d'un syndrome néphrotique en relation avec un vaccin conjugué contre les méningocoques du groupe sérologique C ont été rapportés.
Surdosage
On ne dispose d'aucune expérience à ce sujet. Chaque injection correspondant à une dose unique de 0,5 ml, un surdosage est peu probable.
Propriétés/Effets
Code ATC: J07AH07
Classe pharmacothérapeutique: vaccins méningococciques
Pharmacodynamique:
Menjugate étant un vaccin, aucune étude pharmacodynamique n'a été effectuée à son sujet.
Efficacité clinique:
Aucune étude prospective n'a été conduite au sujet de son efficacité.
L'efficacité de Menjugate a été déduite de la mesure de la production d'anticorps anticapsulaires spécifiques présentant une activité bactéricide. L'activité bactéricide sérique (SBA) a été mesurée en utilisant du sérum humain comme source du complément exogène (hSBA). Le hSBA a été le premier marqueur de protection contre les infections à méningocoques.
Au cours d'études cliniques portant sur 540 nourrissons ayant reçu une dose à 2, 3 et 4 mois, et chez 175 nourrissons ayant reçu une dose à 2, 4 et 6 mois, 98% des enfants ont atteint des titres hSBA (sérum humain comme source du complément) d'au moins 1:8 après la seconde et la troisième dose.
La nécessité de vaccinations de rappel doit être établie conformément aux recommandations officielles en matière de vaccination.
En comparaison avec les vaccins méningococciques polysaccharidiques non conjugués autorisés, il a pu être démontré au cours des études cliniques que la réaction immunitaire induite par Menjugate était supérieure chez les petits enfants, les enfants et les adolescents, et qu'elle était comparable chez les adultes (voir tableau).
De plus, contrairement aux vaccins à base de polysaccharides non conjugués, Menjugate induit une mémoire immunologique après la vaccination. La durée de protection n'a cependant pas encore été établie.
Il n'existe pas de données concernant les adultes âgés de 65 ans et plus.
Comparaison du pourcentage de sujets ayant des titres d'anticorps bactéricides contre les méningocoques du groupe sérologique C de ≥1:8 (complément humain) un mois après l'administration d'une dose de Menjugate ou d'un autre vaccin méningococcique polysaccharidique non conjugué autorisé par groupes d'âge
Âge: 1 à 2 ans | Âge: 3 à 5 ans | Âge: 11 à 17 ans | Âge: 18 à 64 ans | |||||
Menjugate | Men PS (1) | Menjugate | Men PS(1) | Menjugate | Men PS(2) | Menjugate | Men PS(2) | |
| SBA % ≥1:8 (IC à 95%) Complément humain | 78% (72–83) | 19% (13–26) | 79% (68-87) | 28% (18–39) | 84% (75–91) | 68% (57–77) | 90% (84–95) | 88% (82–93) |
MenPS = vaccin méningococcique polysaccharidique non conjugué autorisé
(1) = groupes sérologiques A, C, W-135 et Y, contenant 50 µg du groupe sérologique C par dose
(2) = groupes sérologiques A et C, contenant 50 µg du groupe sérologique C par dose
Dans une étude clinique randomisée portant sur 989 enfants âgés de 12 mois à 2 ans, l'immunogénicité de la présentation de Menjugate sous forme liquide a été comparée à celle de la présentation de Menjugate sous forme lyophilisée, produite avec des substances actives issues de deux sites de fabrication différents. Pour Menjugate sous forme liquide, les moyennes géométriques des titres d'anticorps (MGT) après et avant la vaccination étaient de 4,69 (IC à 95%: 4,01–5,49). Pour Menjugate sous forme lyophilisée, les MGT étaient de 5,6 (IC à 95%: 4,79–6,54) et 6,34 (IC à 95%: 5,4–7,45). La réponse en anticorps induite par les deux formes de Menjugate était comparable. C'est ce qu'a démontré l'intervalle de confiance bilatéral à 95% pour les valeurs MGT du groupe de vaccin correspondant: celles-ci se situaient dans l'intervalle d'équivalence prédéfini (0,5–2,0) 28 jours après la vaccination. Parallèlement, la proportion de sujets présentant des titres hSBA ≥1:8 était de 60% (IC à 95%: 54–65) pour la présentation sous forme liquide et de 63% (IC à 95%: 57–69) et 70% (IC à 95%: 64–76) pour la présentation sous forme lyophilisée. Ces résultats correspondaient au taux poolé recueilli dans des études antérieures sur Menjugate dans la présentation lyophilisée chez les enfants âgés de 12 à 23 mois (63%, IC à 95%: 60–67).
Surveillance suivant la mise sur le marché après une campagne de vaccination en Grande-Bretagne
Des estimations de l'efficacité du vaccin réalisées dans le cadre du programme de vaccination généralisée en Grande-Bretagne (administration des trois vaccins conjugués contre les méningocoques de groupe sérologique C en quantités variables) pour la période de son introduction fin 1999 à mars 2004 ont démontré la nécessité d'une vaccination de rappel à la suite de l'immunisation de base (3 doses administrées à 2, 3 et 4 mois). Au cours de l'année suivant la fin de l'immunisation de base, l'efficacité du vaccin dans la cohorte de nourrissons a été estimée à 93% (IC à 95%: 67-99). Cependant, plus d'un an après la fin de l'immunisation de base, une baisse de la protection a été clairement mise en évidence.
Jusqu'en 2007, les estimations globales de l'efficacité dans les groupes d'âge de 1 à 18 ans ayant reçu une dose unique de vaccin conjugué contre les méningocoques du groupe sérologique C durant le premier programme de vaccination de rattrapage en Grande-Bretagne se situaient entre 83% et 100%. Ces données ne mettent en évidence aucune baisse significative de l'efficacité dans ces groupes d'âge, que l'immunisation ait eu lieu depuis moins d'un an ou depuis un an ou plus.
Pharmacocinétique
Menjugate étant un vaccin, aucune étude pharmacocinétique n'a été effectuée à son sujet.
Données précliniques
Les données précliniques issues des études conventionnelles de toxicologie en administration répétée et des fonctions de reproduction (études embryofœtales) n'ont pas révélé de risque particulier pour l'être humain. Une altération de la fertilité n'a pas été étudiée.
Remarques particulières
Incompatibilités: Ce vaccin ne doit pas être mélangé avec d'autres médicaments.
Stabilité: Le vaccin ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques concernant le stockage: Conserver au réfrigérateur (de +2 °C à +8 °C). Ne pas congeler. Conserver la seringue préremplie dans son emballage extérieur pour protéger le vaccin de la lumière.
Remarques concernant la manipulation:
Seringue préremplie:
Agiter la seringue contenant le vaccin avec précaution avant de l'administrer.
Retirer le capuchon de la seringue et mettre en place une aiguille appropriée. Le vaccin doit être inspecté visuellement avant l'administration afin de détecter toute trace de particules ou de décoloration.
S'assurer qu'il n'y a pas de bulles d'air dans la seringue avant l'injection. En cas de présence de corps étrangers et/ou de modification des propriétés physiques, le vaccin doit être jeté.
Les vaccins non utilisés et les matériaux d'emballage doivent être éliminés conformément à la réglementation locale.
Numéro d’autorisation
66037 (Swissmedic)
Titulaire de l’autorisation
GlaxoSmithKline AG, 3053 Münchenbuchsee.
Mise à jour de l’information
Février 2019.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


 Deutsch
Deutsch French
French