Aprokam 50mg +10 Steril Filternadeln Durchstechflasche 10 Stück buy online
Aprokam Trockensub 50 mg + 10 sterile Filternadeln Durchstf 10 S
-
172.24 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: THEA PHARMA S.A.
- Product Code: 7112601
- ATC-code S01AA27
- EAN 7680630290052
Ingredients:
Cefuroxim 50 mg , Stickstoff, Trockensubstanz, Cefuroxim natrium 52.6 mg.

Description
Zusammensetzung
Wirkstoffe
Cefuroximum (ut Cefuroximum Natricum).
Hilfsstoffe
Keine.
Darreichungsform und Wirkstoffmenge pro Einheit
Pulver zur Herstellung einer Injektionslösung, 1 Durchstechflasche enthält 50 mg Cefuroxim (als 52,6 mg Cefuroxim-Natrium).
Nach Zubereitung mit 5 ml Lösungsmittel (siehe «Sonstige Hinweise») enthält 0,1 ml Lösung 1 mg Cefuroxim.
Indikationen/Anwendungsmöglichkeiten
Antibiotische Prophylaxe der postoperativen Endophthalmitis nach Kataraktoperation.
Gültige Richtlinien zur angemessenen Verwendung antibakterieller Substanzen sollen berücksichtigt werden, einschliesslich jenen zur antibiotischen Prophylaxe bei Augenoperationen.
Dosierung/Anwendung
Zur intrakameralen Anwendung. Durchstechflasche zur einmaligen Anwendung.
Dosierung
Erwachsene
Die empfohlene Dosis beträgt 0,1 ml der zubereiteten Lösung (siehe «Sonstige Hinweise»). Dies entspricht 1 mg Cefuroxim.
NICHT MEHR ALS DIE EMPFOHLENE DOSIS INJIZIEREN (siehe «Überdosierung»).
Kinder
Sicherheit und optimale Dosierung bei Kindern wurden nicht untersucht.
Ältere Patienten
Eine Dosisanpassung ist nicht notwendig.
Patienten mit Leber- und Nierenfunktionsstörungen
Eine Dosisanpassung ist nicht notwendig in Anbetracht der niedrigen Dosis und der vernachlässigbaren zu erwartenden systemischen Exposition.
Art der Anwendung (siehe «Sonstige Hinweise»)
Vor der Anwendung muss Aprokam mit 5 ml einer NaCl-Injektionslösung (9 mg/ml) rekonstituiert werden. Hinweise zur Rekonstitution des Arzneimittels vor der Anwendung, siehe «Sonstige Hinweise».
Vor der Injektion soll die Lösung von Aprokam visuell auf Partikel und Verfärbungen geprüft werden.
Aprokam muss durch einen Augenchirurgen unter den für Kataraktoperationen empfohlenen aseptischen Bedingungen intraokular in die Vorderkammer des Auges injiziert werden. Am Ende der Kataraktoperation werden 0,1 ml der zubereiteten Lösung langsam in die Vorderkammer des Auges vom Augenchirurgen injiziert.
Kontraindikationen
Überempfindlichkeit gegenüber Cefuroxim oder Cephalosporinen.
Warnhinweise und Vorsichtsmassnahmen
Aprokam ist nur zur intrakameralen Anwendung bestimmt.
Besondere Vorsicht ist bei Patienten geboten, bei denen es in der Vergangenheit zu einer allergischen Reaktion gegenüber Penicillinen oder andere Beta-Laktam-Antibiotika kam, da Kreuzreaktionen auftreten können.
Bei Patienten mit einem Risiko für Infektionen mit resistenten Keimen, z.B. Patienten mit bekannter früherer Infektion oder Kolonisierung mit MRSA (Methicillin-resistenter Staphylococcus aureus), sind alternative Antibiotika zur Prophylaxe in Erwägung zu ziehen.
Aufgrund mangelnder Daten zu spezifischen Patientengruppen (Patienten mit erhöhtem Infektionsrisiko, komplizierten Kataraktformen, mit Kataraktoperationen im Rahmen kombinierter chirurgischer Eingriffe, schwerer Schilddrüsenerkrankung, mit weniger als 2000 Hornhautendothelzellen/mm2) sollte Aprokam nur nach sorgfältiger Nutzen-/Risiko-Abwägung angewendet werden.
Die Anwendung von Cefuroxim sollte nicht als Einzelmassnahme angesehen werden. Für die Prophylaxe sind auch andere Massnahmen, wie z.B. eine antiseptische Behandlung, von Bedeutung.
Ein toxischer Effekt auf das Hornhautendothel wurde unter der empfohlenen Konzentration von Cefuroxim nicht beobachtet. Dennoch kann ein toxischer Effekt nicht ausgeschlossen werden und Ärzte sollten im Rahmen der postoperativen Überwachung dieses Risiko bedenken.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d.h. es ist im Wesentlichen «natriumfrei».
Interaktionen
Da die systemische Exposition erwartungsgemäss vernachlässigbar ist, sind systemische Wechselwirkungen unwahrscheinlich.
In der Literatur wurden keine Inkompatibilitäten mit den meisten gängigen Arzneimitteln, die in der Kataraktchirurgie eingesetzt werden, beschrieben.
Schwangerschaft/Stillzeit
Es liegen nur begrenzte Erfahrungen mit der Anwendung von Cefuroxim bei Schwangeren vor. Tierexperimentelle Studien lassen nicht auf schädliche Auswirkungen auf die embryonale/fetale Entwicklung schliessen. Cefuroxim ist placentagängig. Da die systemische Exposition durch Cefuroxim bei Anwendung von Aprokam zu vernachlässigen ist, wird davon ausgegangen, dass es während einer Schwangerschaft nicht zu Beeinträchtigungen kommt. Aprokam kann während der Schwangerschaft angewendet werden.
Cefuroxim wird in sehr geringen Mengen in die Muttermilch ausgeschieden, so dass Auswirkungen auf das gestillte Kind bei Anwendung therapeutischer Dosen von Aprokam unwahrscheinlich sind. Aprokam kann in der Stillzeit angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Nicht zutreffend.
Unerwünschte Wirkungen
Mit Ausnahme der unten aufgeführten Nebenwirkung werden in der Literatur keine spezifischen unerwünschten Wirkungen nach intraokularer Injektion von Cefuroxim beschrieben.
Erkrankungen des Immunsystems
Sehr selten (<1/10'000): Anaphylaktische Reaktion.
Augenerkrankungen
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar): Makulaödem.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Die in der Literatur beschriebenen Fälle von Überdosierung sind solche, die nach nicht bestimmungsgemässer Herstellung der Lösung oder Applikation von zur systemischen Anwendung bestimmtem Cefuroxim auftraten.
In n=6 Fällen, in denen versehentlich eine zu hohe Dosis von Cefuroxim (das 3-fache der empfohlenen Dosis) in die Augenkammer injiziert wurde, kam es bei keinem der Patienten zu erkennbaren unerwünschten Wirkungen, auch nicht an okulären Geweben.
Weiter wurde von n=6 Patienten berichtet, denen versehentlich das 40- bis 50-fache der empfohlenen Cefuroxim-Dosis intrakameral während einer Kataraktoperation injiziert wurde. Die mittlere Sehschärfe betrug anfänglich 20/200. Es kam zu einer schweren Entzündung des vorderen Augensegments und zu einem ausgedehnten Makulaödem. Sechs Wochen nach der Operation lag die Sehschärfe bei 20/25 unter vollständiger Rückbildung des Makulaödems. Bei allen Patienten wurde jedoch eine Verschlechterung der Ergebnisse der skotopischen Elektroretinographie um 30% beobachtet.
Die Gabe von nicht bestimmungsgemäss gelöstem Cefuroxim (10-100 mg pro Auge) führte bei n=16 Patienten zu toxischen Effekten am Auge, unter anderem zu einem nur zögerlich regredienten Hornhautödem, passager erhöhtem Augeninnendruck, Schäden des Hornhautendothels und Veränderungen der Elektroretinographie. Einige dieser Patienten erlitten einen dauerhaften und schweren Sehverlust.
Eigenschaften/Wirkungen
ATC-Code
S01AA27
Wirkungsmechanismus/Pharmakodynamik:
Wirkungsmechanismus
Cefuroxim hemmt die bakterielle Zellwandsynthese nach Bindung an Penicillin-bindende Proteine (PBP). Dies führt zu einer Störung der Zellwandsynthese (Peptidoglycansynthese) und so zu einem Auflösen und Absterben der Bakterienzellen.
PD/PK (pharmakodynamische/pharmakokinetische) Zusammenhänge
Der für Cephalosporine wichtigste pharmakokinetisch/pharmakodynamische Index, der mit der Wirksamkeit in vivo korreliert, ist der Anteil des Dosierungsintervalls (%T), um den die ungebundene Konzentration von Cefuroxim oberhalb der minimalen Hemmkonzentration (MHK) für die betroffene Zielspezies bleibt (d.h. %T > MHK).
Nach Injektion von 1 mg Cefuroxim in die Augenkammer lagen die Wirkstoffspiegel im Kammerwasser 4-5 Stunden nach dem Eingriff für verschiedene relevante Spezies über der MHK.
Resistenzmechanismus
Die Resistenz von Bakterien gegenüber Cefuroxim kann auf einem oder mehreren der folgenden Mechanismen beruhen:
- Hydrolyse durch Betalaktamasen. Cefuroxim wird durch bestimmte Betalaktamasen mit erweitertem Wirkungsspektrum (ESBLs) und durch chromosomal kodierte Enzyme (AmpC), die in bestimmten aeroben gramnegativen Bakterienspezies induziert oder anhaltend supprimiert werden können, effizient hydrolysiert;
- Verminderte Affinität Penicillin-bindender Proteine zu Cefuroxim;
- Impermeabilität der äusseren Membran, die den Zugang von Cefuroxim zu Penicillin-bindenden Proteinen in gramnegativen Bakterien einschränkt;
- bakterielle Effluxpumpen.
Methicillin-resistente Staphylokokken (MRS) sind resistent gegen alle zurzeit zur Verfügung stehenden β-Laktam-Antibiotika, einschliesslich Cefuroxim.
Penicillin-resistenter Streptococcus pneumoniae weist durch eine Veränderung der Penicillin-bindenden Proteine eine Kreuzresistenz gegen Cephalosporine einschliesslich Cefuroxim auf.
Betalaktamase-negative, Ampicillin-resistente (BLNAR) Stämme von H. influenzae sollten trotz einer in vitro beobachteten Empfindlichkeit als resistent gegen Cefuroxim angesehen werden.
Grenzwerte:
Die unten aufgeführten Mikroorganismen wurden entsprechend oben genannter Indikation (siehe «Indikationen/Anwendungsmöglichkeiten») ausgewählt.
Aprokam ist nur zur Anwendung in der Augenkammer und nicht zur Behandlung systemischer Infektionen bestimmt (siehe «Pharmakokinetik»). Klinische Grenzwerte sind für diese Art der Anwendung nicht relevant. Die epidemiologischen Cut-Off-Werte (Grenzwerte, ECOFF) zur Abgrenzung der Wildtyppopulation von Isolaten mit erworbenen Resistenzmerkmalen sind:
ECOFF (mg/l) | |
Staphylococcus aureus | ≤4 |
Streptococcus pneumoniae | ≤0,125 |
E. coli | ≤8 |
Proteus mirabilis | ≤4 |
H. influenzae | ≤2 |
Die Empfindlichkeit von Staphylokokken gegenüber Cefuroxim erschliesst sich aus der Empfindlichkeit gegenüber Methicillin.
Die Empfindlichkeit von Streptokokken der Gruppe A, B, C und G lässt sich von der Empfindlichkeit gegenüber Benzylpenicillin ableiten.
Pharmakodynamik
Nicht zutreffend.
Klinische Wirksamkeit
Eine prospektive, randomisierte und teilweise verblindete multizentrische Studie (ESCRS-Studie) wurde mit n=16603 Patienten und Kataraktoperation durchgeführt. Bei n=29 Patienten (davon n=24 aus den nicht mit Cefuroxim behandelten Gruppen und n=5 aus den Gruppen mit intrakameraler Anwendung von Cefuroxim) trat eine Endophthalmitis auf. Bei n=20 dieser Patienten (n=17 ohne Behandlung mit Cefuroxim und n=3 mit intrakameraler Cefuroxim-Behandlung) wurde diese Endophthalmitis als infektiös bestätigt. Diese bestätigten Endophtalmitiden traten bei n=10 Patienten der Behandlungsgruppe «Placebo-Augentropfen ohne Cefuroxim», bei n=7 Patienten der Gruppe «Levofloxacin-Augentropfen ohne Cefuroxim», bei n=2 Patienten der Gruppe «Placebo-Augentropfen und intrakameral gegebenes Cefuroxim» und bei n=1 Patienten der Gruppe «Levofloxacin-Augentropfen und intrakameral gegebenes Cefuroxim» auf. Die prophylaktische intrakamerale Gabe von Cefuroxim in einer Dosierung von 1 mg in 0,1 ml einer 0,9%igen NaCl-Lösung führte zu einer rund 5-fachen Reduktion des Risikos für eine postoperative Endophthalmitis. Die Ergebnisse von 2 prospektiven Studien (Wedje 2005 und Lundström 2007) sowie 5 retrospektiven Studien stützten diese Ergebnisse und bestätigten die Wirksamkeit von intrakameral angewendetem Cefuroxim zur Prophylaxe der postoperativen Endophthalmitis.
Pharmakokinetik
Absorption
Die systemische Exposition nach intrakameraler Injektion wurde nicht untersucht. Es ist von einer zu vernachlässigenden Exposition auszugehen.
Nach intrakameraler Injektion der empfohlenen Einmaldosis von 0,1 ml einer 10 mg/ml-Lösung von Cefuroxim bei Kataraktpatienten lag der Cefuroxim-Spiegel in der Augenkammer 30 Sekunden nach Anwendung im Mittel bei 2614 ± 209 mg/l (n=10 Patienten) bzw. 60 Minuten nach Anwendung bei 1027 ± 43 mg/l (n=9 Patienten).
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische Daten
Effekte in nicht-klinischen Studien wurden nur bei Expositionen beobachtet, die über der maximalen humantherapeutischen Exposition lagen.
Bei Albinokaninchen lag die Konzentration von Cefuroxim 30 Minuten nach intravitrealer Injektion von 1 mg bei 19-35 mg/l und 600-780 mg/l im Kammerwasser bzw. im Glaskörper. Nach 6 Stunden war die Konzentration auf 1,9-7,3 im Kammerwasser bzw. 190-260 mg/l im Glaskörper gesunken. Während der ersten 3 Tage nach Injektion kam es nicht zu einem Anstieg des Augeninnendrucks. Histopathologisch zeigten sich im Vergleich zu Kochsalzlösung keine degenerativen Veränderungen.
ERG: Die A-, B- und C-Wellen nahmen bis 14 Tage nach der Injektion sowohl in den Kontroll- als auch in den mit Antibiotika injizierten Augen ab.
Eine Wiederherstellung des Normalzustands trat ein, möglicherweise langsamer als in der Kontrollgruppe. Das ERG zeigte bis zu 55 Tage nach intravitrealer Injektion keine eindeutigen Veränderungen, die auf eine Retinatoxizität schliessen lassen.
Fertilität:
In tierexperimentellen Reproduktionsstudien zeigten sich keine Hinweise auf eine Beeinträchtigung der Fertilität.
Sonstige Hinweise
Inkompatibilitäten
Das Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Medikament darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15–25 °C) und vor Licht geschützt in der Originalpackung lagern.
Nach Rekonstitution ist die Lösung sofort zu verwenden und darf nicht wieder verwendet werden.
Arzneimittel für Kinder unerreichbar aufbewahren.
Hinweise für die Handhabung
Aprokam wird von einem Augenchirurgen unter den für Kataraktoperationen empfohlenen aseptischen Bedingungen intrakameral injiziert.
DURCHSTECHFLASCHE NUR ZUR EINMALIGEN ANWENDUNG.
EINE DURCHSTECHFLASCHE FÜR EINEN PATIENTEN ANWENDEN. Das Abreissetikett der Durchstechflasche auf das Patientenblatt kleben.
Bitte beachten Sie für die Zubereitung der Lösung zur intrakameralen Injektion die folgenden Anweisungen:
| 1. Die Integrität der Aluminiumkappe prüfen und die Aluminiumkappe abnehmen. |
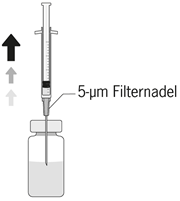
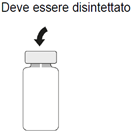
| 2. Äusseren Anteil des Gummistopfens der Durchstechflasche vor Einführen einer sterilen Nadel desinfizieren. |
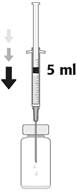
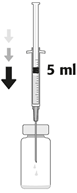
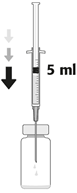
| 3. Die Nadel vertikal durch die Mitte des Stopfens der Durchstechflasche stechen und dabei die Durchstechflasche in einer aufrechten Position halten. Anschliessend 5 ml einer 0,9%igen NaCl-Lösung (9 mg/ml) aseptisch in die Durchstechflasche injizieren. Nur Natriumchloridlösung 9 mg/ml (0,9%) für Injektionen darf für die Herstellung der gebrauchsfertigen Zubereitung von Aprokam verwendet werden. |
| 4. Vorsichtig schwenken bis die Lösung keine sichtbaren Partikel mehr enthält. |
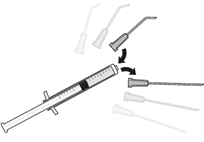
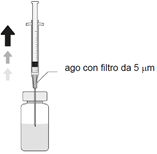
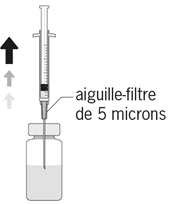
| 5. Auf eine sterile 1 ml Spritze eine sterile 5-Micrometer Filternadel stecken (die Filternadel kann in der Faltschachtel vorhanden sein). Diese Spritze vertikal durch die Mitte des Stopfens der Durchstechflasche stechen und dabei die Durchstechflasche in einer aufrechten Position halten. |
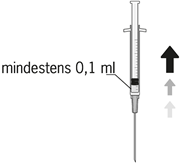
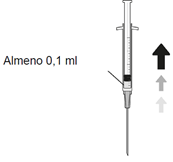
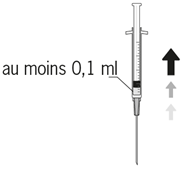
| 6. Mindestens 0,1 ml der Lösung aseptisch entnehmen. |
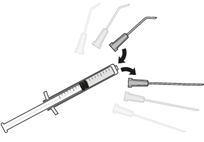
| 7. Die 5-Micrometer-Filternadel von der Spitze abziehen und geeignete Vorderkammerkanüle auf die Spitze aufsetzen. |
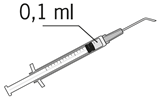
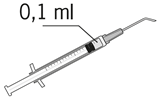
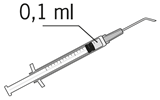
| 8. Luftblasen sorgfältig durch Klopfen aus der Spritze entfernen und den Flüssigkeitsspiegel auf die 0,1 ml-Marke einstellen. Die Spritze ist jetzt für die Injektion bereit. |
Die zubereitete Lösung soll visuell geprüft und nur verwendet werden, wenn sie farblos bis gelblich und frei von sichtbaren Partikeln ist. Der pH-Wert der Lösung und die Osmolalität entsprechen annähernd den physiologischen Werten (pH-Wert etwa 7,3; Osmolalität etwa 335 mosmol/kg).
Nach Gebrauch sind verbleibende Reste der zubereiteten Lösung zu verwerfen. Keine Lösungsreste für weitere Anwendungen aufbewahren.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen. Die Filternadel in einem geprüften Sicherheitsbehälter (Sharps Collector) entsorgen.
Zulassungsnummer
63029 (Swissmedic).
Zulassungsinhaberin
THEA Pharma S.A., 8200 Schaffhausen.
Stand der Information
März 2020.
Composizione
Principi attivi
Cefuroximum (ut Cefuroximum Natricum).
Sostanze ausiliarie
Nessuno.
Forma farmaceutica e quantità di principio attivo per unità
Polvere per soluzione iniettabile, 1 flacone contiene 50 mg di cefuroxima (corrispondenti a 52,6 mg di cefuroxima sodico).
Dopo ricostituzione con 5 ml di solvente (vedere «Altre indicazioni»), 0,1 ml di soluzione contiene 1 mg di cefuroxima.
Indicazioni/Possibilità d'impiego
Profilassi antibiotica di endoftalmite postoperatoria dopo chirurgia della cataratta.
Occorre prendere in considerazione le raccomandazioni ufficiali sull'impiego appropriato degli agenti antibatterici, comprese le linee guida per la profilassi antibiotica nella chirurgia dell'occhio.
Posologia/Impiego
Somministrazione intracamerale. Flacone monodose per una singola somministrazione.
Posologia
Adulti
La dose raccomandata è di 0,1 ml di soluzione ricostituita (vedere «Altre indicazioni»), corrispondente a 1 mg di cefuroxima.
NON INIETTARE PIÙ DELLA DOSE RACCOMANDATA (vedere «Posologia eccessiva»).
Bambini
La sicurezza e il dosaggio ottimale non sono stati studiati nella popolazione pediatrica.
Pazienti anziani
Non è necessario alcun aggiustamento della dose.
Pazienti con disturbi della funzionalità epatica o renale
Considerando la bassa dose e la trascurabile esposizione sistemica a cefuroxima attesa utilizzando Aprokam, nessun aggiustamento della dose è necessario.
Modo di somministrazione (vedere «Altre indicazioni»)
Prima dell'uso, Aprokam deve essere ricostituito con 5 ml di soluzione iniettabile di sodio cloruro (9 mg/ml). Per istruzioni sulla ricostituzione del medicinale prima dell'uso, vedere «Altre informazioni».
Prima dell'iniezione, la soluzione di Aprokam deve essere controllata visivamente, per verificare assenza di particelle e decolorazione.
Aprokam deve essere somministrato mediante iniezione intraoculare nella camera anteriore dell'occhio, da un chirurgo oftalmico, nelle condizioni asettiche raccomandate per la chirurgia della cataratta. Il chirurgo oftalmico deve iniettare lentamente 0,1 ml di soluzione ricostituita nella camera anteriore dell'occhio al termine dell'intervento di cataratta.
Controindicazioni
Ipersensibilità a cefuroxima o alle cefalosporine in generale.
Avvertenze e misure precauzionali
Aprokam deve essere utilizzato esclusivamente per via intracamerale.
Particolare attenzione è necessaria in pazienti che hanno avuto una reazione allergica alle penicilline o ad altri antibiotici beta-lattamici, in quanto si possono verificare reazioni allergiche crociate.
Una profilassi antibiotica alternativa dovrebbe essere presa in considerazione nei pazienti a rischio di infezioni da ceppi resistenti, come ad esempio quelli con accertata precedente infezione o colonizzazione da Staphylococcus aureus resistente alla meticillina (MRSA).
In assenza di dati sufficienti su particolari categorie di pazienti (pazienti con grave rischio di infezione, pazienti con cataratta complicata, pazienti con altri interventi combinati con la chirurgia della cataratta, i pazienti affetti da patologia tiroidea grave, pazienti con meno di 2000 cellule epiteliali corneali), Aprokam deve essere usato solo dopo un'attenta valutazione del rapporto rischio/beneficio.
L'uso di cefuroxima non dovrebbe essere considerato come l'unica procedura di prevenzione, ma anche altre misure sono importanti come il trattamento profilattico antisettico.
Una tossicità endoteliale della cornea non è stata riportata alla concentrazione raccomandata di cefuroxima, sebbene non si possa escludere questo rischio e nella sorveglianza post chirurgica il medico deve considerare questo potenziale rischio.
Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose, cioè essenzialmente «senza sodio».
Interazioni
Poiché l'esposizione sistemica a cefuroxima dovrebbe essere trascurabile, le interazioni sistemiche sono improbabili.
Nessuna incompatibilità è stata riportata in letteratura con i prodotti più comunemente utilizzati nella chirurgia della cataratta.
Gravidanza/Allattamento
Esistono solo limitate esperienze sull'uso di cefuroxima in gravidanza. Gli studi sugli animali non indicano effetti nocivi sullo sviluppo embrionale e fetale. Cefuroxima raggiunge l'embrione o il feto attraverso la placenta. Non sono previsti effetti durante la gravidanza, in considerazione della trascurabile esposizione sistemica a cefuroxima conseguente all'uso di Aprokam. Aprokam può essere utilizzato durante la gravidanza.
La cefuroxima viene escreta nel latte materno in quantità molto ridotte. Non sono attesi effetti avversi alla dose prevista di Aprokam. Cefuroxima può essere usato durante l'allattamento.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non applicabile.
Effetti indesiderati
Non sono stati riportati in letteratura particolari effetti indesiderati quando cefuroxima viene somministrato con iniezione intraoculare ad eccezione dei seguenti effetti avversi.
Disturbi del sistema immunitario
Molto raro (<1/10'000): Reazione Anafilattica.
Patologie dell'occhio
Non nota (la frequenza non può essere definita sulla base dei dati disponibili): Edema maculare.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-benefico del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
I casi di sovradosaggio descritti in letteratura sono quelli verificatisi dopo diluizione non corretta e uso non autorizzato di cefuroxima destinato alla somministrazione sistemica.
In n=6 casi in cui una dose elevata di cefuroxima (3 volte quella raccomandata) è stata iniettata accidentalmente nella camera oculare, nessuno dei pazienti ha manifestato effetti indesiderati riconoscibili, nemmeno sui tessuti oculari.
Sono stati inoltre riportati n=6 pazienti iniettati accidentalmente 40-50 volte la dose raccomandate di cefuroxima per via intracamerale durante l'intervento di cataratta. L'acuità visiva media iniziale era die 20/200. Vi è stata una grave infiammazione del segmento anteriore dell'occhio e un esteso edema maculare. Sei settimane dopo l'intervento, l'acuità visiva media ha raggiunto 20/25 con regressione completa dell'edema maculare. Tuttavia, una diminuzione del 30% dell'elettroretinografia scotopica era osservabile in tutti i pazienti.
La somministrazione di cefuroxima erroneamente diluito (10-100 mg per occhio) a 16 pazienti è risultata tossica a livello oculare incluso edema corneale risolvibile in poche settimane, aumento transitorio della pressione oculare, perdita di cellule endoteliali corneali, e modifiche dell'elettroretinografia. Alcuni di questi pazienti hanno avuto una perdita grave e permanente della vista.
Proprietà/Effetti
Codice ATC
S01AA27
Meccanismo d'azione/Farmacodinamica:
Meccanismo d'azione
Cefuroxima inibisce la sintesi della parete batterica interagendo con i siti proteici di legame della penicillina (PBP). Ciò comporta inibizione della biosintesi della parete cellulare (peptidoglicano), che determina lisi e morte delle cellule batteriche.
Correlazione Farmacocinetica / Farmacodinamica
Per le cefalosporine, il più importante indice farmacocinetico-farmacodinamico di correlazione con l'efficacia in vivo è risultato essere la percentuale dell'intervallo temporale tra le dosi (% T), in cui la concentrazione di farmaco non legato rimane al di sopra della concentrazione minima inibente (MIC) della cefuroxima per le singole specie batteriche bersaglio (ossia % T MIC>).
Dopo l'iniezione intracamerale di 1 mg di cefuroxima, i livelli di cefuroxima nell'umore acqueo sono stati superiori alle MIC per molte specie rilevanti, fino a 4 - 5 ore dopo l'intervento chirurgico.
Meccanismi di resistenza
La resistenza batterica a cefuroxima può essere dovuta a uno o più dei seguenti meccanismi:
- idrolisi da beta-lattamasi. Cefuroxima può essere efficacemente idrolizzata da alcune beta-lattamasi ad ampio spettro (ESBL) e dall'enzima codificato cromosomicamente (AmpC), che può essere indotto o stabilmente represso in alcune specie di batteri aerobi gram-negativi;
- ridotta affinità per cefuroxima delle proteine leganti la penicillina;
- impermeabilità della membrana esterna, che limita l'accesso di cefuroxima alle proteine leganti la penicillina in batteri gram-negativi;
- Le pompe di efflusso di farmaci antibatterici.
Gli Stafilococchi meticillino-resistenti (MRS) sono resistenti a tutti gli antibiotici β-lattamici attualmente disponibili compresa cefuroxima.
Gli Streptococchi pneumoniae penicillino-resistenti sono cross-resistenti alle cefalosporine come cefuroxima, a causa di un'alterazione delle proteine leganti la penicillina.
Ceppi di H. influenzae Beta-lattamasi negativi, ampicillina resistenti (BLNAR) devono essere considerati resistenti a cefuroxima, nonostante un'apparente sensibilità dimostrata in vitro.
Breakpoints:
L'elenco dei micro-organismi riportato più avanti è stato selezionato in base alle indicazioni (vedere «Indicazioni/possibilità d'impiego»).
Aprokam deve essere utilizzato esclusivamente per iniezione intracamerale e non deve essere usato per trattare le infezioni sistemiche (vedere «Farmacocinetica»); è da notare che i breakpoints non sono rilevanti per questa via di somministrazione. I valori epidemiologici di cut-off (ECOFF) sono i seguenti, distinguendo i ceppi selvaggi da quelli isolati con caratteristiche di resistenza acquisita:
ECOFF (mg/l) | |
Staphylococcus aureus | ≤4 |
Streptococcus pneumoniae | ≤0,125 |
E. coli | ≤8 |
Proteus mirabilis | ≤4 |
H. influenzae | ≤2 |
La sensibilità degli stafilococchi a cefuroxima si deduce dalla loro sensibilità alla meticillina.
La sensibilità degli streptococchi dei gruppi A, B, C e G può essere dedotta dalla loro sensibilità alla benzilpenicillina.
Farmacodinamica
Non applicabile.
Efficacia clinica
Uno studio clinico indipendente, multicentrico, prospettico, randomizzato e controllato in condizioni di parziale mascheramento del trattamento utilizzato è stato condotto su 16603 pazienti sottoposti ad intervento di cataratta. Ventinove pazienti hanno avuto una endoftalmite (24 nel gruppo «non trattato con cefuroxima» e 5 nel gruppo «trattato con cefuroxima intracamerale»), di cui 20 sono stati classificati come documentata endoftalmite infettiva (17 nel gruppo «non trattato con cefuroxima» e 3 nel gruppo «trattato con cefuroxima intracamerale»). Tra queste 20 endoftalmie comprovate: 10 pazienti sono nel gruppo «collirio placebo e senza cefuroxima», 7 pazienti nel gruppo «levofloxacina collirio e senza cefuroxima», 2 pazienti nel gruppo «collirio placebo e cefuroxima intracamerale» e 1 paziente nel gruppo «levofloxacina collirio e cefuroxima intracamerale». La somministrazione profilattica di cefuroxima intracamerale alla dose di 1 mg diluito in 0,1 ml di soluzione iniettabile (sodio cloruro 0,9%, 9 mg/ml) è stata associata ad una riduzione di 5 volte del rischio totale di endoftalmite post-operatoria. Due studi prospettici (Wedje 2005 e Lundström 2007) e 5 studi retrospettivi sono stati un supporto allo studio centrale ESCRS, sostenendo ulteriormente l'efficacia della cefuroxima intracamerale nelle endoftalmie post-operatorie.
Farmacocinetica
Assorbimento
L'esposizione sistemica a cefuroxima conseguente ad iniezione intracamerale non è stata studiata, ma è da considerare trascurabile.
Dopo iniezione intracamerale della dose singola raccomandata di 0,1 ml di una soluzione 10 mg/l di cefuroxima in pazienti affetti da cataratta, il livello medio intracamerale di cefuroxima era uguale a 2614 ± 209 mg/l (in 10 pazienti) ed a 1027 ± 43 mg/l (in 9 pazienti) rispettivamente dopo 30 secondi e dopo 60 minuti dalla somministrazione del farmaco.
Distribuzione
Non applicabile.
Metabolismo
Non applicabile.
Eliminazione
Non applicabile.
Dati preclinici
In studi non-clinici sono stati osservati effetti solo dopo esposizioni considerate sufficientemente in eccesso rispetto alla massima esposizione umana, che però indicano una scarsa rilevanza per l'uso clinico.
L'iniezione intravitreale di 1 mg cefuroxima in conigli albini ha fatto rilevare nei 30 minuti successivi all'iniezione livelli di 19-35 mg/l e 600-780 mg/l rispettivamente nell'umor acqueo e nell'umor vitreo. Dopo 6 ore i livelli si sono ridotti a 1,9-7,3 mg/l e 190-260 mg/l, rispettivamente in questi due comparti. Non c'è stato alcun aumento della pressione intraoculare durante i primi 3 giorni. L'esame istopatologico non ha mostrato cambiamenti degenerativi rispetto alla soluzione salina.
All'esame ERG si sono osservate onde a-, b- e c- ridotte fino al 14° giorno sia nell'occhio in cui è stato iniettato antibiotico che in quello di controllo.
Il recupero si è verificato e può essere più lento rispetto al gruppo di controllo. L'esame ERG non ha evidenziato cambiamenti che potessero essere ritenuti suggestivi di tossicità retinica fino a 55 giorni dopo la somministrazione intravitreale.
Fertilità:
Studi sulla riproduzione negli animali non hanno mostrato effetti sulla fertilità.
Altre indicazioni
Incompatibilità
Questo prodotto medicinale non deve essere miscelato con altri prodotti medicinali.
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni particolari concernenti l'immagazzinamento
Conservare nella confezione originale a temperatura ambiente (15–25 °C) e al riparo dalla luce.
Il prodotto deve essere utilizzato immediatamente dopo la ricostituzione e non riutilizzato in seguito.
Tenere i medicinali fuori dalla portata dei bambini.
Indicazioni per la manipolazione
Aprokam deve essere somministrato mediante iniezione intraoculare, da un chirurgo oftalmico nelle condizioni asettiche raccomandate per la chirurgia della cataratta.
FLACONE MONODOSE PER UNA SINGOLA SOMMINISTRAZIONE.
UTILIZZARE UN FLACONE PER UN SINGOLO PAZIENTE. Applicare l 'etichetta staccabile del flacone sulla cartella clinica del paziente.
Per preparare il prodotto per la somministrazione intracamerale attenersi alle seguenti istruzioni:
| 1. Verificare l'integrità della capsula flip-off prima di rimuoverla. |
| 2. Disinfettare la parte esterna del tappo di gomma del flaconcino prima di inserire un ago sterile. |
| 3. Inserire l'ago perpendicolarmente al centro del tappo del flaconcino, mantenendo il flaconcino in posizione verticale. Poi, iniettare nel flaconcino 5 ml di soluzione iniettabile di cloruro di sodio 9 mg/ml (0,9%) con tecnica asettica. Per la ricostituzione di Aprokam deve essere utilizzata solo una soluzione iniettabile di cloruro di sodio 9 mg/ml (0,9%). |
| 4. Agitare delicatamente fino a quando la soluzione è praticamente priva di particelle visibili. |
| 5. Assemblare l'ago sterile dotato di filtro da 5 micron (membrana in copolimero acrilico su nylon non tessuto) con una siringa sterile da 1 ml (l'ago sterile con filtro da 5 micron può essere fornito con la confezione). Poi, spingere la siringa sterile da 1 ml perpendicolarmente al centro del tappo del flaconcino, mantenendo il flaconcino in posizione verticale. |
| 6. Aspirare in maniera asettica almeno 0,1 ml di soluzione. |
| 7. Scollegare l'ago dalla siringa e assemblare la siringa con una cannula appropriata per la camera anteriore. |
| 8. Espellere attentamente l'aria dalla siringa e aggiustare la dose al segno 0,1 ml sulla siringa. La siringa è pronta per l'iniezione. |
La soluzione ricostituita deve essere ispezionata visivamente e deve essere utilizzata solo se è una soluzione da incolore a giallastra priva di particelle visibili. Ha un pH e una osmolalità vicine ai valori fisiologici (pH circa 7,3 e osmolalità circa 335 mosmol/kg).
Dopo l'uso, gettare il rimanente della soluzione ricostituita. Non tenerlo per un uso successivo.
Qualsiasi medicinale o rifiuti non utilizzato devono essere smaltiti in conformità con i requisiti nazionali. Smaltire l'ago del filtro in un contenitore di sicurezza testato (Sharps Collector).
Numero dell'omologazione
63029 (Swissmedic).
Titolare dell’omologazione
THEA Pharma S.A., 8200 Schaffhausen.
Stato dell'informazione
Marzo 2020.
Composition
Principes actifs
Cefuroximum (ut Cefuroximum Natricum).
Excipients
Aucun.
Forme pharmaceutique et quantité de principe actif par unité
Poudre pour solution injectable: Chaque flacon contient 50 mg de céfuroxime (52,6 mg sous forme de céfuroxime sodique).
Après reconstitution avec 5 ml de solvant (voir «Remarques particulières»), 0,1 ml de solution contient 1 mg de céfuroxime.
Indications/Possibilités d’emploi
Antibioprophylaxie des endophtalmies post-opératoires après une opération de la cataracte.
Il convient de tenir compte des recommandations en vigueur concernant l'utilisation appropriée des antibactériens, incluant celles sur l'antibioprophylaxie en chirurgie oculaire.
Posologie/Mode d’emploi
Voie intra-camérulaire. Flacon pour usage unique.
Posologie
Adultes
La posologie recommandée est de 0,1 ml de solution reconstituée (voir «Remarques particulières»). Cela correspond à 1 mg de céfuroxime.
NE PAS INJECTER UNE DOSE SUPÉRIEURE À CELLE RECOMMANDÉE (voir «Surdosage»).
Enfants
La sécurité et la posologie optimale pour les enfants n'ont pas été étudiées.
Sujets âgés
L'adaptation de la posologie n'est pas nécessaire.
Patients avec une insuffisance rénale ou hépatique
Considérant la faible dose et le passage systémique négligeable attendu, l'adaptation de la posologie n'est pas nécessaire.
Mode d'administration (voir «Remarques particulières»)
Avant son utilisation, Aprokam doit être reconstitué avec 5 ml d'une solution de chlorure de sodium à 9 mg/ml. Pour les instructions concernant la reconstitution du médicament avant son administration, voir «Remarques particulières».
Avant l'injection, la solution d'Aprokam doit être contrôlée visuellement afin de rechercher la présence de particules ou d'un changement de couleur.
Aprokam doit être administré par injection intra-oculaire dans la chambre antérieure de l'œil, par un chirurgien ophtalmologiste, dans les conditions recommandées d'asepsie de la chirurgie de la cataracte. Le chirurgien ophtalmologiste doit injecter lentement 0,1 ml de solution reconstituée dans la chambre antérieure de l'œil en fin de chirurgie de la cataracte.
Contre-indications
Hypersensibilité à la céfuroxime ou aux céphalosporines.
Mises en garde et précautions
Aprokam doit être utilisé uniquement par voie intra-camérulaire.
Une prudence particulière est de mise chez les patients ayant des antécédents de réactions allergiques aux pénicillines ou aux autres bêta-lactames car des réactions allergiques croisées pourraient survenir.
Chez les patients présentant un risque d'infections à germes résistants, par exemple les patients ayant eu une infection ou colonisation au SARM (Staphylococcus aureus résistant à la méticilline), un traitement antibioprophylactique alternatif doit être envisagé.
En l'absence de données suffisantes pour des groupes de patients spécifiques (patients avec un risque élevé d'infection, ayant une cataracte compliquée, soumis à la chirurgie de la cataracte dans le cadre d'opérations chirurgicales combinées, souffrant de troubles sévères de la thyroïde, ayant moins de 2000 cellules endothéliales cornéennes par mm2), Aprokam ne doit être utilisé qu'après une évaluation prudente de la balance bénéfice/risque.
L'utilisation de la céfuroxime ne doit pas être considérée comme une mesure isolée; pour la prophylaxie, d'autres mesures, comme par exemple le traitement prophylactique antiseptique, sont tout aussi importantes.
À la concentration de céfuroxime recommandée, aucun effet toxique sur l'endothélium cornéen n'a été signalé. Néanmoins, un effet toxique ne peut être exclu et les médecins doivent le garder à l'esprit dans le cadre de la surveillance postopératoire.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c'est-à-dire qu'il est essentiellement «sans sodium».
Interactions
L'exposition systémique attendue étant négligeable, les interactions systémiques sont peu probables.
Aucune incompatibilité avec les produits utilisés le plus couramment dans la chirurgie de la cataracte n'a été rapportée dans la littérature.
Grossesse/Allaitement
Il n'existe que des données limitées sur l'utilisation de la céfuroxime chez la femme enceinte. Les études chez l'animal n'ont montré aucun effet délétère sur le développement embryonnaire ou fœtal. La céfuroxime peut traverser le placenta. Aucun effet pendant la grossesse n'est à prévoir, étant donné que l'exposition systémique à la céfuroxime suite à l'utilisation d'Aprokam est négligeable. Aprokam peut être utilisé pendant la grossesse.
La céfuroxime est excrétée en très faible quantité dans le lait maternel. Des effets indésirables sur le nourrisson ne sont donc pas attendus aux doses thérapeutiques d'Aprokam. La céfuroxime peut être utilisée pendant l'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Non pertinent.
Effets indésirables
À l'exception de l'effet indésirable suivant, aucun effet indésirable spécifique n'a été rapporté dans la littérature quand la céfuroxime est administrée par injection intraoculaire.
Troubles du système immunitaire
Très rare (<1/10'000): Réaction anaphylactique.
Affections oculaires
Fréquence indéterminée (la fréquence ne peut être estimée sur la base des données disponibles): œdème maculaire.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Les cas de surdosage rapportés dans la littérature sont ceux décrits après une préparation de la solution incorrecte ou une administration inadéquate de céfuroxime destinée à l'administration systémique.
Dans n=6 cas où une dose excessive de céfuroxime (3 fois la dose recommandée) a été administrée par inadvertance par voie intra-camérulaire, ces injections n'ont causé aucun effet indésirable détectable, chez aucun des patients, même au niveau des tissus oculaires.
De plus, six cas de patients (n=6) ayant reçu, pendant la chirurgie de la cataracte, des doses 40 à 50 fois supérieures à la dose recommandée de céfuroxime ont été rapportés. L'acuité visuelle moyenne initiale était de 20/200. Il s'en suivit une inflammation sévère du segment antérieur et un important œdème maculaire. Six semaines après la chirurgie, l'acuité visuelle moyenne atteignait 20/25 et le profil maculaire était complètement revenu à la normale. Cependant une détérioration de 30% des résultats de l'électrorétinographie scotopique a été observée chez tous les patients.
L'administration de céfuroxime incorrectement diluée (10-100 mg par œil) chez n=16 patients s'est soldée par une toxicité oculaire, dont un œdème cornéen à régression lente, une augmentation transitoire de la pression intraoculaire, des dommages aux cellules endothéliales cornéennes et des modifications de l'électrorétinographie. Certains de ces patients présentaient une perte de vision sévère et durable.
Propriétés/Effets
Code ATC
S01AA27
Mécanisme d'action/Pharmacodynamique:
Mécanisme d'action
La céfuroxime inhibe la synthèse de la paroi bactérienne en se fixant aux protéines de liaison aux pénicillines (PLP). Ceci provoque une interruption de la biosynthèse de la paroi cellulaire (peptidoglycanes) entrainant une lyse cellulaire et la mort de la bactérie.
Relations pharmacodynamie/pharmacocinétique
Pour les céphalosporines, il a été démontré que l'index pharmacocinétique/pharmacodynamique le plus prédictif de l'efficacité in vivo était le pourcentage du temps d'exposition (T%) pendant lequel la concentration de la forme libre en céfuroxime se situe au-dessus de la concentration minimale inhibitrice (CMI) des bactéries cibles (c'est-à-dire T%>CMI).
Après injection intra-camérulaire de 1 mg de céfuroxime, les taux en céfuroxime dans l'humeur aqueuse étaient supérieurs aux CMI de plusieurs espèces concernées jusqu'à 4 à 5 heures après la chirurgie.
Mécanismes de résistance
La résistance bactérienne à la céfuroxime peut être due à un ou plusieurs des mécanismes suivants:
- hydrolyse par des bêta-lactamases. La céfuroxime peut être hydrolysée efficacement par certaines bêta-lactamases à spectre étendu (BLSE) et par des bêta-lactamases chromosomiques (AmpC) qui peuvent être induites ou déréprimées de façon stable chez certaines espèces de bactéries aérobies à Gram négatif;
- diminution de l'affinité des protéines de liaison aux pénicillines pour la céfuroxime;
- imperméabilité de la paroi externe, qui restreint l'accès de la céfuroxime aux protéines de liaison aux pénicillines chez des bactéries Gram négatif;
- pompes à efflux bactériennes.
Les Staphylococcus résistants à la méticilline (SARM) sont résistants aux bêta-lactamines actuellement disponibles, dont la céfuroxime.
Les Streptococcus pneumoniae résistants à la pénicilline ont une résistance croisée aux céphalosporines comme la céfuroxime, par une altération des protéines de liaison aux pénicillines.
Des souches d'H. influenzae bêta-lactamases négatives et résistantes à l'ampicilline (BLNAR) devraient être considérées résistantes à la céfuroxime malgré une apparente sensibilité in vitro.
Concentrations critiques:
La liste des micro-organismes présentés ci-après est ciblée sur l'indication mentionnée ci-dessus (voir «Indications//Possibilités d'emploi»).
Aprokam doit être utilisé uniquement par voie intra-camérulaire et ne doit pas être utilisé pour traiter des infections systémiques (voir «Pharmacocinétique»); les concentrations cliniques critiques ne sont pas transposables à cette voie d'administration. Les valeurs des seuils (cut-offs) épidémiologiques (ECOFFs), distinguant la population des souches sauvages des souches isolées avec des résistances acquises sont les suivantes:
ECOFF (mg/l) | |
Staphylococcus aureus | ≤4 |
Streptococcus pneumoniae | ≤0,125 |
E. coli | ≤8 |
Proteus mirabilis | ≤4 |
H. influenzae | ≤2 |
La sensibilité des staphylocoques à la céfuroxime est déduite de la sensibilité à la méticilline.
La sensibilité des streptocoques des groupes A, B, C et G peut être déduite de leur sensibilité à la benzylpénicilline.
Pharmacodynamique
Non pertinent.
Efficacité clinique
Une étude prospective randomisée, partiellement en aveugle et multicentrique (Étude de l'ESCRS) a été réalisée sur n=16603 patients et opérations de la cataracte. Chez n=29 patients (dont n=24 dans le groupe «sans céfuroxime» et n=5 dans le groupe «céfuroxime par injection intra-camérulaire») une endophtalmie est apparue. Chez n=20 patients (n=17 dans le groupe «sans céfuroxime» et n=3 dans le groupe «céfuroxime par injection intra-camérulaire»), cette endophtalmie était infectieuse. De ces cas d'endophtalmie documentés, n=10 patients faisaient partie du groupe «collyre placebo, sans céfuroxime», n=7 du groupe «collyre à base de lévofloxacine, sans céfuroxime», n=2 du groupe «collyre placebo et céfuroxime intracaméral» et n=1 du groupe «collyre à base de lévofloxacine et céfuroxime intracaméral». L'administration prophylactique par voie intra-camérulaire d'une solution de 1 mg de céfuroxime dans 0,1 ml de chlorure de sodium 0,9% a réduit le risque d'endophtalmie post-opératoire d'environ un facteur 5. Les résultats de 2 études prospectives (Wedje 2005 et Lundström 2007) et 5 études rétrospectives soutiennent ces résultats et confirment l'efficacité de la céfuroxime en utilisation intracamérulaire dans la prophylaxie des endophtalmies post-opératoires.
Pharmacocinétique
Absorption
L'exposition systémique suite à une injection intra-camérulaire n'a pas été étudiée mais devrait être négligeable. Après injection intra-camérulaire, à la dose recommandée de 0,1 ml d'une solution à 10 mg/ml de céfuroxime chez des patients atteints de cataracte, la concentration moyenne intra-camérulaire était de 2614 ± 209 mg/l (n=10 patients) 30 secondes après administration de la solution et de 1027 ± 43 mg/l (n=9 patients) 60 minutes après administration de la solution.
Distribution
Non pertinent
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniques
Lors des études précliniques, des effets n'ont été observés chez l'animal qu'à des expositions supérieures à l'exposition maximale chez l'homme.
Trente minutes suivant l'injection intra-vitréenne de 1 mg de céfuroxime chez des lapins albinos, des taux de 19-35 mg/l et de 600-780 mg/l ont été retrouvés respectivement dans l'humeur aqueuse et dans le vitré. Ces taux après 6 heures ont diminué à 1,9-7,3 mg/l dans l'humeur aqueuse et à 190-260 mg/l dans le vitré. Il n'y a pas eu d'augmentation de la pression intra-oculaire pendant les 3 premiers jours. L'histopathologie n'a montré aucune modification dégénérative en comparaison avec la solution saline.
Electrorétinogramme (ERG): les ondes a-, b- et c- ont diminué jusqu'au 14ème jour suivant l'injection aussi bien dans le groupe «témoin» que dans le groupe «œil ayant reçu une injection d'antibiotique». Un retour à la normale a été observé, éventuellement plus rapide dans le groupe «témoin». L'ERG n'a montré aucun changement définitif suggérant une toxicité rétinienne, jusqu'à 55 jours après l'administration intra-vitréenne.
Fertilité
Des études sur la reproduction chez l'animal n'ont montré aucun effet sur la fertilité.
Remarques particulières
Incompatibilités
Ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
À conserver à température ambiante (15–25 °C) et protégé de la lumière dans son emballage d'origine.
Après reconstitution, le produit doit être utilisé immédiatement et ne doit pas être réutilisé.
Conserver ce médicament hors de portée des enfants.
Remarques concernant la manipulation
Aprokam doit être administré par injection intra-camérulaire, par un chirurgien ophtalmologiste dans les conditions d'asepsie recommandées de la chirurgie de la cataracte.
FLACON POUR USAGE UNIQUE.
UTILISER UN FLACON PAR PATIENT. Coller l'étiquette drapeau du flacon dans le dossier patient.
Pour préparer le produit pour l'administration intra-camérulaire, veuillez suivre de façon stricte les instructions suivantes:
| 1. Vérifier l'intégrité de la capsule flip-off avant de la retirer. |
| 2. Désinfecter la partie extérieure du bouchon en caoutchouc du flacon avant d'enfoncer l'aiguille stérile. |
| 3. Enfoncer l'aiguille stérile verticalement au centre du bouchon, en maintenant le flacon en position verticale. Puis injecter, aseptiquement dans le flacon, 5 ml de solution pour injection de chlorure de sodium 9 mg/ml (0,9%). Seule une solution pour injection de chlorure de sodium 9 mg/ml (0,9%) doit être utilisée lors de la reconstitution d'aprokam. |
| 4. Secouer doucement le flacon jusqu'à que la solution soit sans particule visible. |
| 5. Fixer une aiguille stérile à filtre de 5 micromètres sur une seringue stérile de 1 ml (l'aiguille à filtre peut être fournie dans la boîte). Enfoncer l'aiguille verticalement au centre du bouchon, en maintenant le flacon en position verticale. |
| 6 Aspirer aseptiquement au moins 0,1 ml de solution. |
| 7 Déconnecter l'aiguille stérile à filtre de 5 micromètres de la seringue et assembler la seringue sur une canule appropriée pour la chambre antérieure. |
| 8. Expulser doucement l'air de la seringue et ajuster la dose à la marque 0,1 ml de la seringue. La seringue est prête pour l'injection. |
La solution reconstituée doit être inspectée visuellement et utilisée uniquement si elle est incolore à jaunâtre et sans particule visible. Son pH et son osmolalité sont proches des valeurs physiologiques (pH d'environ 7,3 et osmolalité d'environ 335 mosmol/kg).
Après utilisation, jeter la solution reconstituée restante. Ne pas la garder pour une utilisation ultérieure.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur. Jeter l'aiguille usagée dans un conteneur pour objets piquants (collecteur Sharps).
Numéro d’autorisation
63029 (Swissmedic).
Titulaire de l’autorisation
THEA Pharma S.A., 8200 Schaffhausen.
Mise à jour de l’information
Mars 2020.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


 Deutsch
Deutsch French
French Italian
Italian