Entresto Filmtabl 50 mg 28 pcs
Entresto Filmtabl 50 mg 28 Stk
-
139.37 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: NOVARTIS SCHWEIZ AG
- Product Code: 6475767
- ATC-code C09DX04
- EAN 7680656730013
Ingredients:
Valsartan 25.7 mg , Sacubitril 24.3 mg , Sacubitril natrium-Valsartan dinatrium (1:1)-2,5-Wasser.

Variants
Entresto Filmtabletten 50mg 56 Stück
234.45 CHF
Description
AMZV
Was ist Entresto und wann wird es angewendet?
Entresto wird zur Behandlung von Herzinsuffizienz bei Erwachsenen angewendet. Entresto wird verschrieben um das Risiko Herzinsuffizienz-bedingter Todesfälle und Krankenhauseinweisungen im Zusammenhang mit Herzinsuffizienz zu verringern.
Entresto wird in geeigneter Kombination mit anderen Therapien für Herzinsuffizienz verabreicht.
Bei einer Herzinsuffizienz ist die Pumpleistung des Herzmuskels nicht mehr stark genug, um den gesamten Organismus ausreichend mit Blut zu versorgen. Die häufigsten Symptome von Herzinsuffizienz sind Kurzatmigkeit und ein Anschwellen der Füsse und Beine aufgrund von Flüssigkeitsansammlungen.
Entresto ist ein sogenannter Angiotensin-Rezeptor-Neprilysin-Hemmer (ARNI), der Sacubitril (einen Neprilysin-Hemmer) und Valsartan (einen Angiotensin-Rezeptor-Blocker, ARB) enthält. Durch die Anwendung von Entresto entspannen sich die Blutgefässe, und im Körper kann sich weniger Wasser sammeln, was sich bei einer Herzinsuffizienz günstig auswirkt.
Entresto darf nur auf Verschreibung des Arztes bzw. der Ärztin angewendet werden.
Wann darf Entresto nicht angewendet werden?
Entresto darf nicht eingenommen werden,
- bei Überempfindlichkeit auf Sacubitril oder Valsartan oder einem sonstigen Bestandteil dieses Arzneimittels,
- wenn Sie andere Arzneimittel zur Behandlung von Bluthochdruck oder Herzinsuffizienz, so genannte ACE-Hemmer (Angiotensin-Converting-Enzym-Hemmer), einnehmen (siehe «wann ist bei der Anwendung von Entresto Vorsicht geboten?» und «Wie verwenden Sie Entresto». Beginnen Sie mit der Einnahme von Entresto frühestens 36 Stunden, nach der letzten Einnahme des ACE-Hemmers,
- wenn bei Ihnen in der Vergangenheit im Zusammenhang mit der Einnahme eines ACE-Hemmers oder einem Angiotensin-II-Rezeptorblocker (ARB) ein so genanntes Angioödem (Anschwellen des Gesichts, der Lippen, der Zunge und/oder des Rachens, Atemprobleme) aufgetreten ist,
- wenn Sie an einer vererbten Erkrankung, ein so genanntes hereditäres Angioödem, leiden,
- wenn Sie an Diabetes (Typ 1 und Typ 2) oder eingeschränkter Nierenfunktion leiden, und Sie den blutdrucksenkenden Wirkstoff Aliskiren einnehmen,
- wenn Ihre Nierenfunktion stark eingeschränkt ist,
- wenn Sie schwanger sind oder planen, schwanger zu werden.
Wann ist bei der Anwendung von Entresto Vorsicht geboten?
Bevor Sie mit der Behandlung mit Entresto beginnen, teilen Sie Ihrem Arzt bzw. Ihrer Ärztin mit, wenn bei Ihnen eines der folgenden Probleme besteht oder jemals bestanden hat:
- wenn sich Ihre Nierenarterie verengt hat.
- wenn bei Ihnen in der Vergangenheit ein so genanntes Angioödem (Anschwellen des Gesichts, der Lippen, der Zunge und/oder des Rachens, Atembeschwerden) aufgetreten ist (Patienten mit schwarzer Hautfarbe können eine erhöhte Neigung zu Angioödemen aufweisen).
- wenn Sie bereits Arzneimittel zur Behandlung von Bluthochdruck oder Herzinsuffizienz, so genannte ACE-Hemmer, ARB oder Aliskiren einnehmen.
- wenn Sie niedrigen Blutdruck haben (insbesondere Patienten im Alter ≥65 Jahren und Patienten mit Nierenerkrankung) oder andere Arzneimittel zur Blutdrucksenkung einnehmen (z.B. ein Diuretikum) oder wenn Sie an Erbrechen oder Durchfall leiden.
- wenn Ihr Kaliumspiegel im Blut erhöht ist (Hyperkaliämie) Dies kann durch gewisse Arzneimittel ausgelöst werden (siehe unten).
Treten bei Ihnen nach der Einnahme von Entresto Schwellungen im Gesicht, der Lippen, der Zunge und/oder des Rachens oder Atembeschwerden auf, ist sofort ein Arzt oder eine Ärztin zu kontaktieren.
Wechselwirkungen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbstgekaufte!) einnehmen oder äusserlich anwenden.
Dies betrifft insbesondere die im Folgenden genannten Arzneimittel:
- Nehmen Sie Entresto nicht zusammen mit ACE-Hemmern ein. Wenn Sie einen ACE-Hemmer einnehmen, beginnen Sie die erste Einnahme von Entresto frühestens 36 Stunden nach der letzten Einnahme des ACE-Hemmers. Wenn Sie Entresto absetzen, und Ihr Arzt Ihnen einen ACE-Hemmer verschrieben hat, beginnen Sie mit der Einnahme des ACE-Hemmers frühestens 36 Stunden nach der letzten Einnahme von Entresto.
- Andere Arzneimittel zur Behandlung von Herzinsuffizienz oder zur Blutdrucksenkung wie ARB (Angiotensin-Rezeptor-Blocker) oder Aliskiren.
- Arzneimittel zur Senkung hoher Cholesterinwerte, so genannte Statine (z.B. Atorvastatin).
- Sildenafil, ein Arzneimittel welches bei Erektionsproblemen oder einem erhöhten Blutdruck in der Lunge (pulmonale Hypertonie) eingenommen wird.
- Arzneimittel, die den Kaliumspiegel im Blut erhöhen. Hierzu zählen Kaliumergänzungsmittel, kaliumhaltige Salzsubstitutionsmittel und gewisse Diuretika (z.B. Amilorid, Spironolacton). Möglicherweise wird Ihr Arzt bzw. Ihre Ärztin den Kaliumspiegel in Ihrem Blut regelmässig kontrollieren.
- Bestimmte Arten von Schmerzmitteln, so genannte nicht Nicht-steroidale anti-inflammatorische Arzneimittel (NSAIDs) oder selektive Cyclooxygenase-2-Hemmer (Cox-2-Hemmer). Wenn Sie eines dieser Arzneimittel nehmen, wird Ihr Arzt bzw. Ihre Ärztin bei Einleitung oder Anpassung der Behandlung möglicherweise Ihre Nierenfunktion überprüfen.
- Lithium, ein Arzneimittel zur Behandlung bestimmter Formen von Depression.
- Einige Antibiotika (der Rifamycin-Gruppe), ein Wirkstoff zum Schutz gegen Transplantatabstossung (Ciclosporin) oder ein antiretroviraler Wirkstoff zur Behandlung einer HIV-Infektion/AIDS (Ritonavir). Diese Arzneimittel können die Wirkung von Valsartan, das in Entresto enthalten ist, verstärken.
Wenn bei Ihnen nach der Anwendung von Entresto ein Schwindelgefühl auftritt, sollen Sie erst wieder ein Fahrzeug lenken oder Maschinen bedienen, wenn dieses Schwindelgefühl vorüber ist.
Entresto kann die Reaktionsfähigkeit, die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge oder Maschinen zu bedienen, beeinträchtigen.
Darf Entresto während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Frauen im gebärfähigen Alter, müssen während der Einnahme von Entresto sowie bis eine Woche nach der letzten Einnahme ein Verhütungsmittel anwenden.
Wenn Sie schwanger sind oder planen schwanger zu werden, dürfen Sie Entresto nicht einnehmen.
Während der Behandlung mit Entresto wird das Stillen nicht empfohlen. Bitte informieren Sie Ihren Arzt bzw. Ihre Ärztin, wenn Sie stillen.
Wie verwenden Sie Entresto?
Ihr Arzt bzw. Ihre Ärztin legt die genaue Anfangsdosis danach fest, welche Arzneimittel Sie zuvor eingenommen haben. Anschliessend wird Ihr Arzt bzw. Ihre Ärztin die Dosis je nachdem, wie Sie auf die Behandlung ansprechen, anpassen, bis die für Sie optimale Dosis ermittelt wurde.
In der Regel wird die Einnahme zunächst mit 50 mg oder 100 mg zweimal täglich (eine Tablette morgens und eine Tablette abends) begonnen.
Die empfohlene Zieldosis beträgt üblicherweise 200 mg zweimal täglich (eine Tablette morgens und eine Tablette abends).
Wenn Sie zuvor mit einem ACE-Hemmer behandelt wurden, setzen sie den ACE-Hemmer ab und nehmen Sie Entresto frühestens 36 Stunden nach der letzten Einnahme des ACE-Hemmers ein. Wird die Behandlung mit Entresto beendet, und wird Ihnen ein ACE-Hemmer verschrieben, beginnen Sie mit der Einnahme des ACE-Hemmers frühestens 36 Stunden nach der letzten Einnahme von Entresto.
Schlucken Sie die Entresto Filmtabletten ganz, die Filmtablette darf dabei nicht zerbrochen oder geteilt werden.
Entresto kann mit oder unabhängig von den Mahlzeiten eingenommen werden.
Wenn Sie versehentlich zu viele Tabletten eingenommen haben, wenden Sie sich an Ihren Arzt bzw. Ihre Ärztin.
Wenn Sie die Einnahme einmal vergessen haben, holen Sie diese nach, sobald Sie daran denken. Nehmen Sie die nächste Tablette dann wieder zur gewohnten Zeit. Wenn es fast schon Zeit für die nächste Einnahme ist, lassen Sie die verpasste Dosis aus und setzen Sie die Einnahme wie gewohnt fort. Nehmen Sie nicht die doppelte Dosis ein, wenn Sie die vorherige Einnahme vergessen haben.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn sie glauben, dass Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin. Nehmen Sie Entresto täglich ein, so lange Ihr Arzt bzw. Ihre Ärztin Ihnen nichts anderes mitteilt. Ein Absetzen der Behandlung mit Entresto kann dazu führen, dass sich Ihre Erkrankung verschlechtert.
Kinder und Jugendliche (unter 18 Jahren)
Die Anwendung und Sicherheit von Entresto bei Kinder und Jugendlichen ist bisher nicht geprüft worden.
Welche Nebenwirkungen kann Entresto haben?
Wie bei allen Arzneimitteln kann es bei Patienten, die mit Entresto behandelt werden, zu Nebenwirkungen kommen, die aber nicht bei jedem auftreten müssen.
Setzen Sie Entresto ab und wenden Sie sich unverzüglich an Ihren Arzt bzw. Ihrer Ärztin, wenn bei Ihnen eines der folgenden Symptome auftritt: Anschwellen des Gesichts, der Zunge oder des Rachens, Schluckbeschwerden, Nesselsucht und Atembeschwerden. Es kann sich um Anzeichen einer allergischen Reaktion (ein so genanntes Angioödem) handeln.
Zu den häufigsten Nebenwirkungen bei der Einnahme von Entresto gehören: niedriger Blutdruck, Nierenerkrankungen (Anzeichen für eine eingeschränkte Nierenfunktion) und ein erhöhter Kaliumspiegel im Blut (nachgewiesen durch einen Bluttest).
Zu den häufigen Nebenwirkungen gehören: Husten, Schwindel, niedriger Spiegel roter Blutkörperchen (Anämie), Nierenversagen, niedriger Kaliumspiegel im Blut (nachgewiesen durch einen Bluttest), niedriger Blutzuckerspiegel, Durchfall, Müdigkeit, Kopfschmerzen, plötzlich auftretende Bewusstlosigkeit, Übelkeit, Schwäche, niedriger Blutdruck beim Aufstehen aus dem Sitzen oder Liegen und Drehschwindel.
Gelegentlich wurde über Schwindel beim Aufstehen aus dem Liegen oder Sitzen (oder umgekehrt), Anschwellen des Gesichts und des Rachens (Angioödem), Schwierigkeiten beim Atmen oder Schlucken, Juckreiz, Hautauschlag, Nesselausschlag und Schwindel (Anzeichen für eine Überempfindlichkeit, anaphylaktische Reaktion) berichtet.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
In der Originalverpackung, vor Feuchtigkeit geschützt und nicht über 30 °C aufbewahren.
Arzneimittel für Kinder unerreichbar aufbewahren.
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Entresto enthalten?
Die Wirkstoffe von Entresto sind Sacubitril und Valsartan als Natriumsalzkomplex.
Entresto 50 mg Filmtabletten enthalten 24.3 mg Sacubitril und 25.7 mg Valsartan als Natriumsalzkomplex sowie Hilfsstoffe. Violett-weisse ovaloide bikonvexe Filmtablette mit abgeschrägten Rändern, ohne Bruchkerbe, mit der Prägung «NVR» auf der einen und «LZ» auf der anderen Seite.
Entresto 100 mg Filmtabletten enthalten 48.6 mg Sacubitril und 51.4 mg Valsartan als Natriumsalzkomplex sowie Hilfsstoffe. Blassgelbe ovaloide bikonvexe Filmtablette mit abgeschrägten Rändern, ohne Bruchkerbe, mit der Prägung «NVR» auf der einen und «L1» auf der anderen Seite.
Entresto 200 mg Filmtabletten enthalten 97.2 mg Sacubitril und 102.8 mg Valsartan als Natriumsalzkomplex sowie Hilfsstoffe. Hellrosa ovaloide bikonvexe Filmtablette mit abgeschrägten Rändern, ohne Bruchkerbe, mit der Prägung «NVR» auf der einen und «L11» auf der anderen Seite.
Zulassungsnummer
65673 (Swissmedic).
Wo erhalten Sie Entresto? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Entresto 50 mg: Packungen à 28 und 56 Filmtabletten [B]
Entresto 100 mg: Packungen à 56 und 168 (3 Packungen à 56) Filmtabletten [B]
Entresto 200 mg: Packungen à 56 und 168 (3 Packungen à 56) Filmtabletten [B]
Zulassungsinhaberin
Novartis Pharma Schweiz AG, Risch; Domizil: 6343 Rotkreuz.
Diese Packungsbeilage wurde im April 2018 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
OEMéd
Qu’est-ce que Entresto et quand doit-il être utilisé?
Entresto est utilisé pour le traitement de l'insuffisance cardiaque chez l'adulte. Entresto est prescrit pour réduire le risque de décès lié à l'insuffisance cardiaque et le nombre d'hospitalisations nécessaires dû à une insuffisance cardiaque.
Entresto est administré en combinaison appropriée avec d'autres thérapies pour l'insuffisance cardiaque.
En cas d'insuffisance cardiaque, le travail de pompage du muscle cardiaque n'est plus assez fort pour alimenter suffisamment tout l'organisme en sang. Les symptômes les plus fréquents de l'insuffisance cardiaque sont l'essoufflement et le gonflement des pieds et des jambes du fait d'accumulations de liquide.
Entresto est ce qu'on appelle un inhibiteur de la néprylisine et des récepteurs de l'angiotensine (angiotensin receptor neprylisin inhibitor, ARNI) qui contient du sacubitril (un inhibiteur de la néprylisine) et du valsartan (un bloqueur des récepteurs de l'angiotensine II). Par l'utilisation d'Entresto, les vaisseaux sanguins se détendent et moins d'eau s'accumule dans le corps, ce qui exerce un effet favorable en cas d'insuffisance cardiaque.
Entresto ne doit être utilisé que sur prescription médicale.
Quand Entresto ne doit-il pas être utilisé?
Entresto ne doit pas être pris
- en cas d'hypersensibilité au sacubitril ou au valsartan ou à un autre composant de ce médicament,
- si vous prenez d'autres médicaments pour le traitement de l'hypertension ou de l'insuffisance cardiaque, à savoir des inhibiteurs de l'ECA (enzyme de conversion de l'angiotensine) (voir «Quelles sont les précautions à observer lors de la prise d'Entresto» et «Comment utiliser Entresto»). Ne commencez à prendre Entresto que 36 heures après la dernière dose d'inhibiteur de l'ECA,
- si vous avez manifesté par le passé un angio-œdème (gonflement du visage, des lèvres, de la langue et/ou de la gorge, problèmes respiratoires) consécutivement à la prise d'un inhibiteur de l'ECA ou un antagoniste du récepteur de l'angiotensine II (ARA),
- si vous souffrez d'une maladie héréditaire appelée angio-œdème héréditaire,
- si vous êtes atteint(e) de diabète (type 1 ou 2) ou souffrez d'insuffisance rénale et prenez la substance active aliskirène avec effet hypotenseur,
- si votre fonction rénale est fortement restreinte,
- si vous êtes enceinte ou prévoyez de le devenir.
Quelles sont les précautions à observer lors de la prise d’Entresto?
Avant de commencer le traitement par Entresto, informez votre médecin si vous présentez ou avez présenté l'un des problèmes suivants:
- Si votre artère rénale s'est rétrécie.
- si vous avez manifesté par le passé un angio-œdème (gonflement du visage, des lèvres, de la langue et/ou de la gorge, troubles respiratoires) (les patients de race noire peuvent présenter une susceptibilité accrue aux angio-œdèmes).
- si vous prenez déjà un médicament pour le traitement de l'hypertension ou de l'insuffisance cardiaque, à savoir un inhibiteur de l'ECA, un ARA ou de l'aliskirène.
- si vous avez une tension artérielle basse (en particulier des patients à l'âge de ≥65 ans et des patients avec une maladie des reins) ou prenez d'autres médicaments hypotenseurs (p.ex. un diurétique) ou si vous souffrez de vomissements ou de diarrhées.
- si votre taux de potassium dans le sang est élevé (hyperkaliémie). Ceci peut être déclenché par divers médicaments (voir ci-dessous).
Si vous avez des gonflements du visage, des lèvres, de la langue et/ou de la gorge ou des troubles respiratoires après la prise d'Entresto, contactez immédiatement un médecin.
Interactions médicamenteuses
Informez votre médecin ou pharmacien si
- vous souffrez d'autres maladies,
- avez des allergies ou
- prenez ou utilisez en application externe d'autres médicaments (même en automédication!).
Cette précaution concerne plus particulièrement les médicaments suivants:
- Ne prenez pas Entresto avec des inhibiteurs de l'ECA. Si vous prenez un inhibiteur de l'ECA, vous ne devez commencer à prendre Entresto que 36 heures après la dernière prise de l'inhibiteur de l'ECA. Si vous arrêtez votre traitement par Entresto et que votre médecin vous a prescrit un inhibiteur de l'ECA, vous ne devez commencer à prendre l'inhibiteur de l'ECA que 36 heures après la dernière prise d'Entresto.
- D'autres médicaments destinés au traitement de l'insuffisance cardiaque ou visant à faire baisser la tension artérielle comme des ARA (antagonistes des récepteurs de l'angiotensine) ou de l'aliskirène.
- Des médicaments visant à faire baisser le taux élevé de cholestérol, c.-à-d. des statines (p.ex. l'atorvastatine).
- Le sildénafil, un médicament pris en cas de problèmes d'érection ou d'une hypertension artérielle au niveau des poumons (hypertonie pulmonaire).
- Des médicaments qui augmentent le taux de potassium dans le sang. Ceux-ci comprennent les compléments alimentaires à base de potassium, les produits de substitution du sel contenant du potassium et certains diurétiques (par ex. amiloride, spironolactone). Il se peut que votre médecin doive contrôler la concentration de potassium dans votre sang à intervalles réguliers.
- Certains types d'analgésiques, à savoir les médicaments anti-inflammatoires non stéroïdiens (AINS) ou des inhibiteurs sélectifs de la cyclooxygénase-2 (inhibiteurs de la Cox-2). Si vous prenez un de ces médicaments, votre médecin pourrait devoir contrôler votre fonction rénale au moment de l'instauration ou de l'adaptation du traitement.
- Le lithium, un médicament destiné au traitement de certaines formes de dépression.
- Certains antibiotiques (la famille de la rifamycine), une substance active visant à protéger contre le rejet de greffe (ciclosporine) ou une substance active antirétrovirale destinée au traitement de l'infection par le VIH/SIDA (ritonavir). Ces médicaments peuvent renforcer l'action du valsartan qui est contenu dans Entresto.
Si vous avez des étourdissements après l'utilisation d'Entresto, vous ne devez ni conduire un véhicule ni utiliser de machines tant que les étourdissements ne se sont pas dissipés.
Entresto peut nuire à la capacité de réaction, l'aptitude à la conduite et la capacité à utiliser des outils ou des machines.
Entresto peut-il être pris pendant la grossesse ou l’allaitement?
Les femmes en âge de procréer doivent utiliser une méthode de contraception pendant la prise d'Entresto et pendant une semaine après la dernière prise.
Si vous êtes enceinte ou prévoyez de le devenir, vous ne pouvez pas prendre Entresto.
Il n'est pas recommandé d'allaiter pendant le traitement par Entresto. Veuillez informer votre médecin si vous allaitez.
Comment utiliser Entresto?
Votre médecin détermine ensuite la juste dose initiale pour les médicaments que vous avez pris au préalable. Enfin, votre médecin adaptera la dose en fonction de votre réponse au traitement et ce, jusqu'à ce que la dose qui est optimale pour vous soit déterminée.
En général, vous commencez par prendre 50 mg ou 100 mg deux fois par jour (un comprimé le matin et un comprimé le soir).
La dose cible recommandée s'élève généralement à 200 mg deux fois par jour (un comprimé le matin et un comprimé le soir).
Si vous suiviez préalablement un traitement par un inhibiteur de l'ECA, vous devez arrêter l'inhibiteur de l'ECA et ne devez prendre Entresto que 36 heures après votre dernière prise de l'inhibiteur de l'ECA. Si le traitement par Entresto est arrêté, et que vous vous voyez prescrire un inhibiteur de l'ECA, commencez à prendre celui-ci au plus tôt 36 heures après la dernière prise d'Entresto.
Avalez les comprimés d'Entresto entiers, les comprimés pelliculés ne doivent pas être brisés ni divisés.
Entresto peut être pris avec les repas comme en dehors.
Si vous avez pris accidentellement trop de comprimés, adressez-vous à votre médecin.
Si vous avez omis une prise, prenez-la dès que vous y pensez. Prenez ensuite le comprimé suivant au moment habituel. Si, lorsque vous y pensez, le moment de la prise suivante est déjà venu, ne prenez pas la dose manquée et poursuivez votre prise comme d'habitude. En cas d'oubli d'une prise, ne prenez pas de double dose.
Ne modifiez pas par vous-même le dosage prescrit. Si vous pensez que l'action du médicament est trop faible ou trop forte, parlez-en avec votre médecin ou votre pharmacien. Prenez Entresto tous les jours tant que votre médecin ne vous donne pas d'autres indications. L'arrêt du traitement par Entresto peut entraîner une aggravation de la maladie.
Enfants et jeunes (de moins de 18 ans)
L'utilisation et la sécurité d'emploi d'Entresto chez les enfants et les jeunes n'ont pas été vérifiées jusqu'ici.
Quels effets secondaires Entresto peut-il provoquer?
Comme avec tous les médicaments, des effets secondaires peuvent survenir chez les patients traités par Entresto même s'ils ne se manifestent pas nécessairement chez tout le monde.
Arrêtez Entresto et adressez-vous immédiatement à votre médecin
si vous présentez l'un des symptômes suivants: Gonflement du visage, de la langue ou de la gorge, troubles de la déglutition, urticaire ou troubles respiratoires. Il peut s'agir de signes d'une réaction allergique (c.-à-d. un angio-œdème).
Font partie des effets secondaires les plus fréquents lors de la prise d'Entresto: tension artérielle basse, maladie rénale (signes d'une insuffisance rénale) et taux élevé de potassium dans le sang (établi par une analyse de sang).
Font partie des effets secondaires fréquents: toux, étourdissements, faible taux de globules rouges (anémie), défaillance rénale, faible taux de potassium dans le sang (établi par une analyse de sang), hypoglycémie, diarrhées, fatigue, céphalées, perte de connaissance se produisant subitement, nausées, faiblesse, tension artérielle basse en passant de la position assise ou couchée à la position debout et vertiges.
Occasionnellement, des étourdissements en passant de la position assise ou couchée à debout (ou inversement) ainsi que des gonflements du visage et de la gorge (angio-œdème), des difficultés à respirer ou à avaler, des démangeaisons, des éruptions cutanées, de l'urticaire et des vertiges (signes d'une hypersensibilité, réaction anaphylactique) ont été rapportés.
Si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention?
Conserver dans l'emballage original, à l'abri de l'humidité et pas au-dessus de 30 °C.
Les médicaments doivent être tenus hors de portée des enfants.
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage. La date de péremption fait référence au dernier jour du mois.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien. Ces personnes disposent d'une information professionnelle détaillée.
Que contient Entresto?
Les substances actives d'Entresto sont le sacubitril et le valsartan ainsi qu'un complexe salin sodique.
Les comprimés pelliculés d'Entresto 50 mg contiennent 24,3 mg de sacubitril et 25,7 mg de valsartan ainsi qu'un complexe salin sodique et des excipients. Comprimé pelliculé violet-blanc, de forme ovaloïde biconvese, avec des bords en biseau, sans rainure de casse, un côté marqué de la mention «NVR» et l'autre de la mention «LZ».
Les comprimés pelliculés d'Entresto 100 mg contiennent 48,6 mg de sacubitril et 51,4 mg de valsartan ainsi qu'un complexe salin sodique et des excipients. Comprimé pelliculé jaune pâle, de forme ovaloïde biconvese, avec des bords en biseau, sans rainure de casse, un côté marqué de la mention «NVR» et l'autre de la mention «L1».
Les comprimés pelliculés d'Entresto 200 mg contiennent 97,2 mg de sacubitril et 102,8 mg de valsartan ainsi qu'un complexe salin sodique et des excipients. Comprimé pelliculé rose pâle, de forme ovaloïde biconvese, avec des bords en biseau, sans rainure de casse, un côté marqué de la mention «NVR» et l'autre de la mention «L11».
Numéro d’autorisation
65673 (Swissmedic).
Où obtenez-vous Entresto? Quels sont les emballages à disposition sur le marché?
En pharmacie, uniquement sur prescription médicale.
Entresto 50 mg: emballages de 28 et 56 comprimés pelliculés [B]
Entresto 100 mg: emballages de 56 et 168 comprimés pelliculés (3 emballages de 56) [B]
Entresto 200 mg: emballages de 56 et 168 comprimés (3 emballages de 56) [B]
Titulaire de l’autorisation
Novartis Pharma Schweiz AG, Risch; Domicile: 6343 Rotkreuz.
Cette notice d'emballage a été vérifiée pour la dernière fois en avril 2018 par l'autorité de contrôle des médicaments (Swissmedic).
OOMed
Che cos’è Entresto e quando si usa?
Entresto viene utilizzato per il trattamento dell'insufficienza cardiaca negli adulti. Entresto si prescrive per ridurre il rischio di decessi dovuti a insufficienza cardiaca e diminuire i ricoveri ospedalieri correlati alla stessa.
Entresto viene somministrato in corretta associazione con altre terapie per l'insufficienza cardiaca.
Nell'insufficienza cardiaca, la funzionalità della pompa cardiaca non è più sufficiente a rifornire di sangue l'intero organismo. I sintomi più comuni di insufficienza cardiaca sono mancanza di respiro e gonfiore dei piedi e delle gambe a causa dell'accumulo di liquidi.
Entresto è un cosiddetto inibitore del recettore dell'angiotensina e della neprilisina (angiotensin receptor neprilysin inhibitor, ARNI) contenente sacubitril (un inibitore della neprilisina) e valsartan (un bloccante del recettore dell'angiotensina). L'azione di Entresto determina il rilassamento dei vasi sanguigni e una potenziale riduzione dell'accumulo di acqua nell'organismo, il che è favorevole al trattamento dell'insufficienza cardiaca.
Entresto può essere utilizzato solo su prescrizione medica.
Quando non si può usare Entresto?
Non assuma Entresto
- In caso di ipersensibilità a sacubitril o valsartan o a uno qualsiasi dei componenti di questo medicamento.
- Se assume altri medicamenti per il trattamento di ipertensione o insufficienza cardiaca, i cosiddetti ACE-inibitori (inibitori dell'enzima di conversione dell'angiotensina [angiotensin converting enzyme, ACE]) (vedere «Quando è richiesta prudenza nella somministrazione di Entresto?» e «Come usare Entresto?»). Inizi ad assumere Entresto non prima di 36 ore dopo aver assunto l'ultima dose dell'ACE-inibitore.
- Qualora in passato abbia manifestato un cosiddetto angioedema (gonfiore del viso, delle labbra, della lingua e/o della gola, difficoltà respiratorie) in correlazione all'assunzione di un ACE-inibitore o di un antagonista del recettore dell'angiotensina II (ARB).
- Se soffre di una malattia ereditaria, il cosiddetto angioedema ereditario.
- Se è affetto/a da diabete (tipo 1 o tipo 2) o ha una funzionalità renale ridotta e assume il principio attivo aliskiren come antipertensivo.
- Se soffre di una grave patologia renale.
- Se è in gravidanza o sta pianificando una gravidanza.
Quando è richiesta prudenza nella somministrazione di Entresto?
Prima di iniziare il trattamento con Entresto, comunichi al medico se presenta attualmente, o ha presentato in passato, uno dei seguenti problemi:
- Se la sua arteria renale è ristretta.
- Se in passato ha manifestato un cosiddetto angioedema (gonfiore del viso, delle labbra, della lingua e/o della gola, difficoltà respiratorie) (i pazienti di colore possono manifestare una maggiore predisposizione allo sviluppo di angioedemi).
- Se assume già un medicamento per il trattamento di ipertensione o insufficienza cardiaca, un cosiddetto ACE-inibitore, ARB o aliskiren.
- Se soffre di ipotensione (in particolare se è un paziente di età ≥65 anni o un paziente affetto da patologia renale) o assume altri medicamenti antipertensivi (ad es. un diuretico) oppure se ha vomito o diarrea.
- Se i livelli di potassio nel sangue sono aumentati (iperkaliemia) in conseguenza all'assunzione di determinati medicamenti (vedere sotto).
Qualora, successivamente all'assunzione di Entresto, compaiano gonfiori sul viso, sulle labbra, sulla lingua e/o sulla gola o disturbi respiratori, consulti immediatamente il medico.
Interazioni con altri medicamenti
Informi il suo medico o il suo farmacista nel caso in cui
- soffra di altre malattie,
- soffra di allergie o
- assuma o applichi esternamente altri medicamenti (anche se acquistati di sua iniziativa!).
Questo riguarda in particolare i medicamenti elencati di seguito:
- Non assuma Entresto con altri ACE-inibitori. Se assume un ACE-inibitore, inizi con la prima assunzione di Entresto non prima di 36 ore dopo l'ultima assunzione dell'ACE-inibitore. Se interrompe Entresto e il medico le ha prescritto un ACE-inibitore, inizi con la prima assunzione dell'ACE-inibitore non prima di 36 ore dopo l'ultima assunzione di Entresto.
- Altri medicamenti per il trattamento dell'insufficienza cardiaca o dell'ipertensione come un ARB (bloccante dell'angiotensina) o aliskiren.
- Medicamenti per l'abbassamento del colesterolo, le cosiddette statine (ad es. atorvastatina).
- Sildenafil, un medicamento per il trattamento di disturbi erettili o dell'ipertensione polmonare.
- Medicamenti che innalzano il livello di potassio nel sangue, come ad esempio integratori di potassio, sostituti del sale a base di potassio e certi diuretici (p.e. amiloride, spironolattone). È possibile che il medico le controlli regolarmente il livello di potassio nel sangue.
- Determinati tipi di antidolorifici, i cosiddetti farmaci antinfiammatori non steroidei (FANS) o gli inibitori della ciclo-ossigenasi 2 (Cox-2-inibitori). Se assume uno di questi medicamenti, è possibile che il medico controlli la sua funzionalità renale al momento dell'avvio o dell'adeguamento del trattamento.
- Il litio, un medicamento per il trattamento di determinate forme di depressione.
- Alcuni antibiotici (del gruppo della rifamicina), un principio attivo utilizzato per prevenire il rigetto dei trapianti (ciclosporina) o un principio attivo antiretrovirale per il trattamento dell'infezione da HIV/AIDS (ritonavir). Questi medicamenti possono potenziare l'effetto di valsartan, contenuto in Entresto.
Qualora dopo l'impiego di Entresto manifesti vertigini, si metta alla guida di un veicolo o adoperi macchinari solo una volta che le vertigini sono scomparse.
Entresto può diminuire la capacità di reazione e compromettere la capacità di guida e di utilizzo di macchinari.
Si può usare Entresto durante la gravidanza o l’allattamento?
Le donne in età fertile devono utilizzare un metodo contraccettivo nel periodo in cui assumono Entresto e per un'altra settimana dopo l'assunzione dell'ultima dose di medicamento.
Se lei è incinta o ha in programma una gravidanza, non può assumere Entresto.
Durante il trattamento con Entresto l'allattamento è sconsigliato. Se allatta, informi il medico.
Come usare Entresto?
Il medico stabilisce la dose esatta in base al medicamento che ha assunto in precedenza. Infine il medico regola la dose a seconda di come lei risponde al trattamento fino a raggiungere la dose ottimale per lei.
Generalmente la dose iniziale è di 50 mg o 100 mg due volte al giorno (una compressa al mattino e una compressa alla sera).
La dose target consigliata è generalmente 200 mg due volte al giorno (una compressa al mattino e una compressa alla sera).
Se è stato/a trattato/a in precedenza con un ACE-inibitore, interrompa l'assunzione dell'ACE-inibitore e assuma Entresto non prima di 36 ore dopo l'ultima assunzione dell'ACE-inibitore. Se il trattamento con Entresto viene sospeso, e Le viene prescritto un ACE-inibitore, la terapia con l'ACE-inibitore potrà essere avviata solo dopo 36 ore dall'assunzione dell'ultima dose di Entresto.
Le compresse di Entresto vanno inghiottite. La compressa pellicolata non va rotta né divisa.
Entresto può essere assunto con i pasti o indipendentemente da essi.
Se ha assunto inavvertitamente troppe compresse, si rivolga al medico.
Se ha dimenticato di assumere una compressa, la prenda non appena se ne ricorda. Quindi assuma la compressa successiva di nuovo all'orario abituale. Se è già quasi ora di prendere la compressa successiva, lasci perdere la dose dimenticata e continui l'assunzione come di consueto. Se ha dimenticato di assumere una compressa, non assuma una doppia dose.
Non modifichi il dosaggio di sua iniziativa. Se ritiene che il farmaco agisca troppo poco o troppo, si rivolga al medico o al farmacista. Assuma Entresto ogni giorno, fino a diversa indicazione del medico. La sospensione del trattamento con Entresto può dare luogo a un aggravamento della malattia.
Bambini e adolescenti (sotto i 18 anni)
Finora l'impiego e la sicurezza di Entresto in bambini e adolescenti non sono stati comprovati.
Quali effetti collaterali può avere Entresto?
Come per tutti i medicamenti, i pazienti che vengono trattati con Entresto possono manifestare degli effetti collaterali, che però non insorgono necessariamente in tutti.
Interrompa l'assunzione di Entresto e si rivolga immediatamente al medico
qualora manifesti uno dei seguenti sintomi: gonfiore del viso, della lingua o della gola, disturbi della deglutizione, orticaria e disturbi respiratori. Potrebbe trattarsi di segni di una reazione allergica (un cosiddetto angioedema).
Alcuni degli effetti collaterali più comuni dell'assunzione di Entresto sono: ipotensione, malattie renali (segni di una limitata funzionalità renale) e un aumento del livello di potassio nel sangue (comprovato da analisi del sangue).
Alcuni effetti collaterali comuni sono: tosse, vertigini, basso livello di globuli rossi (anemia), disfunzioni renali, basso livello di potassio nel sangue (comprovato da analisi del sangue), ipoglicemia, diarrea, stanchezza, cefalea, perdita di coscienza improvvisa, nausea, astenia, ipotensione quando ci si alza da una posizione seduta o distesa e giramenti di testa.
Occasionalmente sono stati segnalati capogiri quando ci si alza da una posizione orizzontale o seduta (o al contrario) e gonfiore del viso e della gola (angioedema), difficoltà di respirazione o di deglutizione, prurito, eruzione cutanea, orticaria e capogiri (segni di ipersensibilità, reazione anafilattica).
Se osserva effetti collaterali qui non descritti, dovrebbe informare il suo medico o il suo farmacista.
Di che altro occorre tener conto?
Conservare le compresse nella confezione originale a temperature non superiori a 30 °C.
I medicamenti devono essere conservati fuori dalla portata dei bambini.
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore. La data di scadenza si riferisce all'ultimo giorno del mese indicato.
Il medico o il farmacista possono darle ulteriori informazioni.
Queste persone dispongono delle informazioni specialistiche dettagliate.
Cosa contiene Entresto?
I principi attivi di Entresto sono Sacubitril e Valsartan come complesso sodico.
Entresto 50 mg compresse pellicolate contiene 24.3 mg di sacubitril e 25.7 mg di valsartan come complesso sodico, oltre a eccipienti. Compresse pellicolate biconvesse ovaloidi, di colore viola-bianco, con bordi smussati, non divisibili, con la dicitura «NVR» su un lato e «LZ» sull'altro.
Entresto 100 mg compresse pellicolate contiene 48.6 mg di sacubitril e 51.4 mg di valsartan come complesso sodico, oltre a eccipienti. Compresse pellicolate biconvesse ovaloidi, di colore giallo chiaro, con bordi smussati, non divisibili, con la dicitura «NVR» su un lato e L1” sull'altro.
Entresto 200 mg compresse pellicolate contiene 97.2 mg di sacubitril e 102.8 mg di valsartan come complesso sodico, oltre a eccipienti. Compresse pellicolate biconvesse ovaloidi, di colore rosa chiaro, con bordi smussati, non divisibili, con la dicitura «NVR» su un lato e «L11» sull'altro.
Numero dell’omologazione
65673 (Swissmedic).
Dove è ottenibile Entresto? Quali confezioni sono disponibili?
In farmacia, solo dietro presentazione della prescrizione medica.
Entresto 50 mg: confezioni da 28 e 56 compresse pellicolate [B]
Entresto 100 mg: confezioni da 56 e 168 compresse pellicolate (3 confezioni da 56) [B]
Entresto 200 mg: confezioni da 56 e 168 compresse pellicolate (3 confezioni da 56) [B]
Titolare dell’omologazione
Novartis Pharma Schweiz AG, Risch; Domicilio: 6343 Rotkreuz.
Questo foglietto illustrativo è stato controllato l'ultima volta nell'aprile 2018 dall'autorità competente in materia di medicamenti (Swissmedic).
AMZV
Zusammensetzung
Wirkstoffe: Sacubitril/Valsartan.
Entresto enthält einen Salzkomplex der anionischen Formen von Sacubitril und Valsartan, Natriumkationen und Wassermoleküle im molaren Verhältnis 1:1:3:2,5. Nach oraler Verabreichung spaltet sich Entresto in Sacubitril (weiter zu LBQ657 metabolisiert) und Valsartan.
Hilfsstoffe: Excip. pro compr. Obduct.
Galenische Form und Wirkstoffmenge pro Einheit
Entresto 50 mg
Filmtabletten zu 50 mg (Sacubitril 24.3 mg/Valsartan 25.7 mg): Violett-weisse ovaloide bikonvexe Filmtablette mit abgeschrägten Rändern, ohne Bruchkerbe, mit der Prägung «NVR» auf der einen und «LZ» auf der anderen Seite.
Entresto 100 mg
Filmtablette zu 100 mg (Sacubitril 48.6 mg/Valsartan 51.4 mg): Blassgelbe ovaloide bikonvexe Filmtablette mit abgeschrägten Rändern, ohne Bruchkerbe, mit der Prägung «NVR» auf der einen und «L1» auf der anderen Seite.
Entresto 200 mg
Filmtabletten zu 200 mg (Sacubitril 97.2 mg/Valsartan 102.8 mg): Hellrosa ovaloide bikonvexe Filmtablette mit abgeschrägten Rändern, ohne Bruchkerbe, mit der Prägung «NVR» auf der einen und «L11» auf der anderen Seite.
Indikationen/Anwendungsmöglichkeiten
Entresto ist indiziert zur Reduktion des Risikos der kardiovaskulären Mortalität und Morbidität bei erwachsenen Patienten mit systolischer Herzinsuffizienz (NYHA-Klasse II-IV, LVEF ≤40%). Entresto wird in geeigneter Kombination mit anderen Therapien für Herzinsuffizienz (z.B. Betablocker, Diuretika und Mineralkortikoidantagonisten) anstelle eines ACE-Hemmers oder eines ARBs verabreicht (siehe «Eigenschaften/Wirkungen»).
Dosierung/Anwendung
Die empfohlene Initialdosis von Entresto ist 100 mg zweimal täglich. Eine Initialdosis von 50 mg zweimal täglich wird bei Patienten empfohlen, die derzeit nicht mit einem ACE (Angiotensin-converting-enzyme)-Hemmer oder einem Angiotensin-II-Rezeptorblocker (ARB) behandelt werden, und sollte bei Patienten in Erwägung gezogen werden, die bislang mit einer niedrigen Dosis dieser Wirkstoffe behandelt wurden (siehe «Eigenschaften/Wirkungen»).
Die Dosis von Entresto sollte alle 2-4 Wochen je nach Verträglichkeit auf eine Zieldosis von täglich 2× 200 mg verdoppelt werden.
Die angestrebte Erhaltungsdosis von Entresto ist 200 mg zweimal täglich.
Die Behandlung mit Entresto darf frühestens 36 Stunden nach Absetzen eines ACE-Hemmers eingeleitet werden, da bei gleichzeitiger Anwendung mit einem ACE-Hemmer das Risiko der Entwicklung eines Angioödemes besteht (siehe «Kontraindikationen»).
Entresto sollte aufgrund seiner Angiotensin-II-Rezeptor blockierenden Wirkung nicht zusammen mit einem ARB angewendet werden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»).
Patienten mit systolischem Blutdruck (systolic blood pressure, SBP) <100 mmHg wurden nicht untersucht, weshalb Entresto bei diesen Patienten mit Vorsicht verwendet werden sollte.
Wenn es bei Patienten zu Problemen hinsichtlich der Verträglichkeit kommt (symptomatische Hypotonie, Hyperkaliämie, Nierenfunktionsstörungen), wird eine Anpassung von gleichzeitig angewendeter Medikation, eine vorübergehende Dosissenkung oder ein Absetzen von Entresto empfohlen.
Art der Anwendung
Entresto kann unabhängig von den Mahlzeiten verabreicht werden (siehe «Eigenschaften/Wirkung»).
Spezielle Patientengruppen
Eingeschränkte Nierenfunktion
Bei Patienten mit leichter (eGFR 60-90 ml/min/1,73 m2) bis mittelschwerer (eGFR 30-60 ml/min/1,73 m²) Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Für Patienten mit schwerer Nierenfunktionsstörung (eGFR <30 ml/min/1,73 m2) wird eine Initialdosis von 50 mg zweimal täglich empfohlen. Bei einer Anwendung von Entresto bei dieser Patientengruppe ist Vorsicht geboten.
Entresto ist bei Patienten mit eGFR <10 ml/min/1.73 m2 kontraindiziert (siehe «Kontraindikationen»).
Eingeschränkte Leberfunktion
Bei der Verabreichung von Entresto an Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Klassifikation A) ist keine Dosisanpassung erforderlich
Bei Patienten mit mittelschwerer Leberfunktionsstörung (Child-Pugh-Klassifikation B) wird eine Initialdosis von 50 mg zweimal täglich empfohlen.
Es wurden keine Studien bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klassifikation C) durchgeführt. Daher wird die Anwendung von Entresto bei diesen Patienten nicht empfohlen (siehe «Eigenschaften/Wirkung»).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Entresto wurde für Kinder und Jugendliche unter 18 Jahren nicht nachgewiesen.
Ältere Patienten (über 65 Jahre)
Bei Patienten über 65 Jahren ist keine Dosisanpassung erforderlich.
Kontraindikationen
- Überempfindlichkeit gegenüber einem der Wirkstoffe Sacubitril oder Valsartan, oder gegenüber einem der Hilfsstoffe.
- gleichzeitige Anwendung eines ACE-Hemmers (siehe «Warnhinweise und Vorsichtsmassnahmen», «Dosierung/Anwendung» und «Interaktionen»). Entresto darf frühestens 36 Stunden nach Absetzen einer ACE-Hemmer-Therapie verabreicht werden.
- Bekanntes Angioödem in der Vorgeschichte im Zusammenhang mit einer früheren Behandlung mit einem ACE-Hemmer oder ARB.
- Hereditäres Angioödem.
- Gleichzeitige Anwendung von Entresto mit Aliskiren-haltigen Arzneimitteln bei Patienten mit Diabetes mellitus oder Patienten mit eingeschränkter Nierenfunktion (GFR <60 ml/min/1,73 m2) (s. Rubrik «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»).
- Schwere Nierenfunktionsstörung mit eGFR <10 ml/min/1,73 m2 aufgrund mangelnder Daten.
- Schwangerschaft (siehe «Schwangerschaft/Stillzeit»).
Warnhinweise und Vorsichtsmassnahmen
Duale Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS)
- Entresto darf aufgrund des Angioödem-Risikos nicht zusammen mit einem ACE-Hemmer verabreicht werden. Eine Behandlung mit Entresto darf frühestens 36 Stunden nach Einnahme der letzten Dosis einer ACE-Hemmer-Therapie eingeleitet werden. Bei einem Absetzen von Entresto darf eine Behandlung mit einem ACE-Hemmer frühestens 36 Stunden nach der letzten Dosis von Entresto eingeleitet werden (siehe «Kontraindikationen», «Dosierung/Anwendung» und «Interaktionen»).
- Entresto sollte aufgrund seiner Angiotensin-II-Rezeptor blockierenden Wirkung nicht zusammen mit einem ARB angewendet werden (siehe «Dosierung/Anwendung» und «Interaktionen»).
- Die gleichzeitige Anwendung von Entresto mit direkten Renin-Hemmern wie Aliskiren wird nicht empfohlen. (siehe «Kontraindikationen» und «Interaktionen»). Entresto darf bei Patienten mit Diabetes mellitus oder Patienten mit eingeschränkter Nierenfunktion (GFR <60 ml/min/1,73 m2) nicht zusammen mit Aliskiren verabreicht werden (siehe «Kontraindikationen» und «Interaktionen»).
Arterielle Hypotonie
Fälle von symptomatischer Hypotonie wurden bei Patienten berichtet, die im Rahmen klinischer Studien mit Entresto behandelt wurden; insbesondere bei Patienten im Alter ≥65 Jahren, bei Patienten mit einer Nierenerkrankung und bei Patienten mit niedrigem SBP (<112 mmHg).Berichte über Hypotonie als unerwünschtes Ereignis traten häufiger mit Entresto (17.6%) als mit Enalapril (12.0%) auf. Bei Beginn einer Therapie mit Entresto oder während einer Dosisanpassung sollte der Blutdruck in angemessenen Intervallen, in Übereinstimmung mit der üblichen klinischen Praxis, überwacht werden. Bei Auftreten von Hypotonie wird eine vorübergehende Dosissenkung oder ein vorübergehendes Absetzen von Entresto empfohlen (siehe «Dosierung/Anwendung»). Eine Dosisanpassung von Diuretika, gleichzeitig angewendeten Blutdrucksenkern und eine Behandlung anderer Ursachen für die Hypotonie (z.B. Hypovolämie) sollten in Betracht gezogen werden. In der Regel ist ein dauerhaftes Absetzen der Behandlung nicht erforderlich. Die Wahrscheinlichkeit einer symptomatischen Hypotonie ist bei einer Volumendepletion des Patienten, z.B. durch eine Behandlung mit Diuretika, eingeschränkte Salzaufnahme mit der Nahrung, Diarrhoe oder Erbrechen, erhöht. Eine Natrium- und/oder Volumendepletion ist vor Einleitung einer Behandlung mit Entresto zu korrigieren.
Eingeschränkte Nierenfunktion
Wie bei allen Wirkstoffen, die auf das Renin-Angiotensin-Aldosteron-System wirken, kann eine Anwendung von Entresto mit einer verminderten Nierenfunktion einhergehen. In der Studie PARADIGM-HF war die Inzidenz klinisch relevanter Nierenfunktionsstörungen gering, und ein damit in Zusammenhang stehendes Absetzen der Behandlung wurde bei Patienten unter Entresto weniger häufig (0,65%) beobachtet als unter Enalapril (1,28%). Eine Dosissenkung von Entresto sollte bei Patienten mit einem klinisch signifikanten Rückgang der Nierenfunktion erwogen werden. Bei der Anwendung von Entresto bei Patienten mit stark eingeschränkter Nierenfunktion (eGFR <30 ml/min/1,73 m2) ist mit Vorsicht vorzugehen (siehe «Dosierung/Anwendung» und «Eigenschaften/Wirkungen»). Entresto ist kontraindiziert bei eGFR <10 ml/min/1.73 m2 (siehe «Kontraindikationen»).
Hyperkaliämie
Wie bei allen Wirkstoffen, die auf das Renin-Angiotensin-Aldosteron-System wirken, kann eine Anwendung von Entresto mit einem erhöhten Hyperkaliämie-Risiko einhergehen. In der Studie PARADIGM-HF war die Inzidenz klinisch relevanter Hyperkaliämien, welche zu einem Absetzen der Behandlung führten, gering (0,26% der Patienten unter Entresto im Vergleich zu 0,35% der Patienten unter Enalapril). Hyperkaliämien >5,5 mmo/l traten bei je ca. 16% der Patienten unter Entresto resp. unter Enalapril auf. Mit Hyperkaliämien assoziierte unerwünschte Ereignisse wurden bei 11,9% der mit Entresto behandelten Patienten gegenüber 14,3% der mit Enalapril behandelten Patienten berichtet (s. «Unerwünschte Wirkungen»). Arzneimittel, die bekanntermassen den Kaliumspiegel erhöhen (z.B. kaliumsparende Diuretika, Kalium-Ergänzungspräparate), sind bei einer gleichzeitigen Verabreichung mit Entresto mit Vorsicht anzuwenden. Bei Auftreten einer klinisch signifikanten Hyperkaliämie sind Massnahmen wie etwa eine Senkung des Kaliumanteils in der Nahrung oder eine Anpassung der Dosis gleichzeitig verabreichter Arzneimittel in Erwägung zu ziehen. Eine Überwachung des Serumkaliumspiegels wird insbesondere bei Patienten mit Risikofaktoren wie schwerer Nierenfunktionsstörung, Diabetes mellitus, Hypoaldosteronismus oder einer kaliumreichen Diät empfohlen (siehe «Dosierung/Anwendung»).
Angioödeme
Es liegen Berichte vor über Angioödeme bei Patienten, die mit Entresto behandelt wurden. Bei Auftreten eines Angioödems ist Entresto unverzüglich abzusetzen, und eine angemessene Therapie und Überwachung sind einzuleiten, bis die Anzeichen und Symptome vollständig und nachhaltig abgeklungen sind. Entresto darf nicht erneut verabreicht werden. Bei gesichertem Angioödem, bei dem Schwellungen auf Gesicht und Lippen beschränkt sind, ist dieses in der Regel ohne Behandlung abgeklungen. Antihistaminika haben sich jedoch zur Symptomlinderung als hilfreich erwiesen.
Ein mit einem Rachenödem einhergehendes Angioödem kann zum Tode führen. Bei einer Beteiligung von Zunge, Glottis oder Rachen, die wahrscheinlich zu einer Obstruktion der Atemwege führt, sind unverzüglich eine geeignete Behandlung, z.B. mit Epinephrin-/Adrenalinlösung 1:1000 (0,3 ml bis 0,5 ml) subkutan und/oder Massnahmen zur Gewährleistung offener Atemwege einzuleiten.
Patienten mit Angioödem in der Vorgeschichte wurden nicht untersucht. Da diese Patienten ein höheres Angioödem-Risiko aufweisen können, ist bei einer Anwendung von Entresto bei dieser Patientengruppe Vorsicht geboten. Entresto darf bei Patienten mit anamnestisch bekanntem Angioödem im Zusammenhang mit einer früheren Therapie mit ACE-Hemmern oder ARB oder bei Patienten mit hereditärem Angioödem nicht angewendet werden (siehe «Kontraindikationen»).
Patienten schwarzer Hautfarbe können eine erhöhte Neigung zu Angioödemen aufweisen.
Patienten mit Nierenarterienstenose
Ähnlich wie andere Arzneimittel, die das Renin-Angiotensin-Aldosteron-System beeinflussen, kann Entresto bei Patienten mit beidseitiger oder einseitiger Nierenarterienstenose den Blutharnstoff und den Serumkreatininspiegel erhöhen. Bei Patienten mit Nierenarterienstenose ist Vorsicht angezeigt, und eine Überwachung der Nierenfunktion wird empfohlen
Biomarker
Bei mit Entresto behandelten Patienten ist das natriuretische Peptid Typ B (BNP) kein geeigneter Biomarker für Herzinsuffizienz, da BNP ein Neprilysinsubstrat ist (siehe «Eigenschaften/Wirkungen»).
Die durch Entresto erzeugte Wirkung der Neprilysin-Inhibition auf die Expression von CD10 in normalen und neoplastischen Zellen wurde nicht untersucht und ist nicht bekannt.
Interaktionen
Erwartete Wechselwirkungen, die in einer Kontraindikation resultieren
ACE-Hemmer: Die gleichzeitige Anwendung von Entresto mit ACE-Hemmern ist kontraindiziert, da die gleichzeitige Hemmung von Neprilysin (NEP) und eine ACE-Hemmer-Therapie das Angioödem-Risiko erhöhen können. Eine Behandlung mit Entresto darf frühestens 36 Stunden nach Einnahme der letzten Dosis einer ACE-Hemmer-Therapie eingeleitet werden. Eine Behandlung mit einem ACE-Hemmer darf frühestens 36 Stunden nach der letzten Dosis von Entresto eingeleitet werden (siehe «Kontraindikationen» und «Dosierung/Anwendung»).
Aliskiren: Die gleichzeitige Anwendung von Entresto und Aliskiren ist bei Patienten mit Diabetes mellitus oder bei Patienten mit eingeschränkter Nierenfunktion (eGFR <60 ml/min/1,73 m2) kontraindiziert (siehe «Kontraindikationen» und «Warnhinwiese und Vorsichtsmassnahmen»).
Erwartete Wechselwirkungen, die darin resultieren, dass eine gleichzeitige Anwendung nicht empfohlen wird
Entresto sollte aufgrund seiner Angiotensin-II-Rezeptor blockierenden Wirkung nicht zusammen mit einem ARB angewendet werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Zu berücksichtigende beobachtete Wechselwirkungen
Statine: In-vitro-Daten lassen darauf schliessen, dass Sacubitril die Transporter OATP1B1 und OATP1B3 hemmt. Daher kann Entresto die systemische Exposition gegenüber OATP1B1- und OATP1B3-Substraten wie Statinen erhöhen.
Die gleichzeitige Anwendung von Entresto erhöhte Cmax von Atorvastatin und seiner Metaboliten um das bis zu Zweifache und die AUC um das bis zu 1,3-Fache. Bei einer gleichzeitigen Anwendung von Entresto mit Statinen ist mit Vorsicht vorzugehen. Keine klinisch relevante Arzneimittelwechselwirkung wurde bei der gleichzeitigen Verabreichung von Entresto und Simvastatin beobachtet.
Sildenafil: Eine zusätzliche Einmalgabe von Sildenafil zu Entresto im Steady-state bei Patienten mit Hypertonie ging mit einer stärkeren Blutdrucksenkung einher als die Verabreichung von Entresto allein. Daher ist bei Einleitung einer Therapie mit Sildenafil oder einem anderen PDE-5-Hemmer bei Patienten unter Entresto Vorsicht geboten.
Zu berücksichtigende erwartete Wechselwirkungen
Kalium: Die gleichzeitige Anwendung von kaliumsparenden Diuretika (z.B. Triamteren, Amilorid), Mineralokortikoid-Antagonisten (z.B. Spironolacton, Eplerenon), Kaliumergänzungen oder einer kaliumhaltigen Salzsubstitution kann zu einem Anstieg des Serumkaliums und des Serumkreatinins führen. Bei einer gleichzeitigen Verabreichung von Entresto mit diesen Substanzen wird eine Überwachung des Serumkaliums empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Nicht-steroidale anti-inflammatorische Arzneimittel (NSAIDs) einschliesslich selektiver Cyclooxygenase-2-Hemmer (COX-2-Hemmer): Bei älteren Patienten, Patienten mit Volumendepletion (einschliesslich Patienten unter Diuretika) oder Patienten mit eingeschränkter Nierenfunktion kann die gleichzeitige Anwendung von Entresto und NSAR zu einem erhöhten Risiko einer Verschlechterung der Nierenfunktion führen. Daher wird bei der Einleitung oder Anpassung einer Behandlung bei Patienten unter Entresto, die gleichzeitig mit NSAIDs behandelt werden, eine Überwachung der Nierenfunktion empfohlen.
Lithium: Das Potenzial für eine Wechselwirkung zwischen Entresto und Lithium wurde nicht untersucht. Unter der gemeinsamen Verabreichung von Lithium und ACE-Hemmern oder Angiotensin-II-Rezeptor-Antagonisten wurde ein reversibler Anstieg der Lithium-Serumspiegel und Toxizität beschrieben. Daher wird während einer gleichzeitigen Anwendung mit Entresto eine sorgfältige Überwachung des Lithium-Serumspiegels empfohlen. Wird zudem ein Diuretikum angewendet, kann das Risiko für eine Lithiumtoxizität weiter erhöht sein.
Transporter: Der aktive Metabolit von Sacubitril (LBQ657) und von Valsartan sind OATP1B1-, OATP1B3-, OAT1- und OAT3-Substrate; Valsartan ist darüber hinaus ein MRP2-Substrat. Daher kann die gleichzeitige Verabreichung von Entresto mit Inhibitoren von OATP1B1, OATP1B3, OAT3 (z.B. Rifampicin/Rifampin, Cyclosporin), OAT1 (z.B. Tenofovir, Cidofovir) oder MRP2 (z.B. Ritonavir) die systemische Exposition gegenüber LBQ657 bzw. Valsartan erhöhen. Bei der Einleitung oder Beendigung einer gleichzeitigen Behandlung mit diesen Wirkstoffen ist mit entsprechender Vorsicht vorzugehen.
Keine signifikanten Wechselwirkungen
Keine klinisch bedeutsamen Arzneimittel-Wechselwirkungen wurden bei gleichzeitiger Verabreichung von Entresto und Furosemid, Digoxin, Warfarin, Hydrochlorothiazid, Amlodipin, Metformin, Omeprazol, Carvedilol, intravenösem Nitroglycerin oder Levonorgestrel/Ethinylestradiol in Kombination beobachtet. Wechselwirkungen mit Atenolol, Indomethacin, Glyburid oder Cimetidin sind nicht zu erwarten.
CYP-450-bezogene Wechselwirkungen: In-vitro-Stoffwechselstudien lassen darauf schliessen, dass das Potenzial für CYP-450-basierte Arzneimittel-Wechselwirkungen aufgrund der begrenzten Metabolisierung von Entresto über CYP-450-Enzyme gering ist. CYP-450-Enzyme werden durch Entresto weder induziert noch inhibiert.
Schwangerschaft/Stillzeit
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter müssen während der Behandlung mit Entresto sowie bis eine Woche nach der letzten Dosis eine Verhütungsmethode anwenden.
Schwangerschaft
Ebenso wie andere Wirkstoffe, die direkt auf das RAAS wirken, darf Entresto während der Schwangerschaft nicht angewendet werden (siehe «Kontraindikationen»). Entresto wirkt unter anderem über einen Angiotensin-II-Antagonismus; daher kann ein Risiko für den Fetus nicht ausgeschlossen werden. Für die Einnahme von Valsartan während der Schwangerschaft liegen Berichte über Schädigungen des sich entwickelnden Fetus (z.B. Spontanabort, Oligohydramnie und Nierenfunktionsstörungen beim Neugeborenen) vor. In einigen tierexperimentellen Studien wurde Reproduktionstoxizität beobachtet (siehe «Präklinische Daten»). Wird während der Therapie eine Schwangerschaft nachgewiesen, ist Entresto so rasch wie möglich abzusetzen.
Stillzeit
Es ist nicht bekannt, ob Entresto in die Muttermilch übergeht. Die Bestandteile von Entresto, Sacubitril und Valsartan, wurden über die Milch laktierender Ratten ausgeschieden (siehe «Präklinische Daten»). Aufgrund des potenziellen Risikos für unerwünschte Arzneimittelwirkungen bei gestillten Neugeborenen/Säuglingen wird die Anwendung von Entresto während der Stillzeit nicht empfohlen.
Fertilität
Über die Wirkung von Entresto auf die menschliche Fertilität liegen keine Daten vor. In Untersuchungen mit Entresto an männlichen und weiblichen Ratten wurde keine Beeinträchtigung der Fertilität nachgewiesen (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt. Beim Führen von Fahrzeugen und Bedienen von Maschinen wird zur Vorsicht geraten, da durch die Einnahme des Präparates Schwindelgefühl und Müdigkeit auftreten können.
Unerwünschte Wirkungen
Die Sicherheit von Entresto bei Patienten mit chronischer Herzinsuffizienz wurde in der pivotalen Phase-3-Studie PARADIGM-HF beurteilt, bei der zweimal täglich mit Entresto 200 mg (n=4'203) oder Enalapril 10 mg (n=4'229) behandelte Patienten verglichen wurden. Die Patienten, die Entresto erhielten, wurden über bis zu 4,3 Jahre mit einer medianen Expositionsdauer von 24 Monaten behandelt; 3271 Patienten wurden länger als ein Jahr behandelt.
Zu einem Absetzen der Therapie aufgrund einer unerwünschten Wirkung während der Doppelblindphase der Studie PARADIGM-HF kam es bei 450 Patienten unter Entresto (10,71%) und bei 516 Patienten unter Enalapril (12,20%). Die am häufigsten mit einer Dosisanpassung oder einer Behandlungsunterbrechung im Zusammenhang stehenden Ereignisse waren Hypotonie, Hyperkaliämie und eingeschränkte Nierenfunktion.
Die Gesamtinzidenz unerwünschter Arzneimittelwirkungen (UAW) von Entresto bei Patienten mit Herzinsuffizienz war mit derjenigen von Enalapril vergleichbar. Das Muster der UAW steht im Einklang mit den pharmakologischen Eigenschaften von Entresto und den Grunderkrankungen der Patienten.
Die Gesamthäufigkeit der unerwünschten Wirkungen war unabhängig von Geschlecht, Alter oder ethnischer Zugehörigkeit.
Die unerwünschten Arzneimittelwirkungen sind nach Systemorganklasse und dann entsprechend ihrer Häufigkeit – die am häufigsten auftretenden zuerst – gemäss der folgenden Konvention aufgeführt: Sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1'000, <1/100); selten (≥1/10'000, <1/1'000), sehr selten (<1/10'000), einschliesslich Einzelberichten. Innerhalb jeder Häufigkeitsgruppe sind die unerwünschten Wirkungen in absteigender Reihenfolge des Schweregrads angegeben.
Erkrankungen des Blutes und des Lymphsystems
Häufig: Anämie.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Hyperkaliämie.
Häufig: Hypokaliämie, Hypoglykämie.
Erkrankungen des Nervensystems
Häufig: Schwindel, Kopfschmerz.
Gelegentlich: Schwindel orthostatisch.
Erkrankungen des Ohrs und des Labyrinths
Häufig: Vertigo.
Gefässerkrankungen
Sehr häufig: Hypotonie.
Häufig: Synkope, Hypotonie orthostatisch.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten.
Erkrankungen des Gastrointestinaltrakts
Häufig: Durchfall, Übelkeit.
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Angioödeme, Pruritus, Hautausschlag.
Erkrankungen der Nieren und Harnwege
Sehr häufig: Eingeschränkte Nierenfunktion.
Häufig: Nierenversagen (Niereninsuffizienz, akutes Nierenversagen).
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeit (inkl. Anaphylaxie).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort.
Häufig: Ermüdung, Asthenie.
Tabelle 1: Unerwünschte Arzneimittelwirkungen in der Studie PARADIGM-HF, Sicherheitspopulation
| Unerwünschte Arzneimittelwirkungen | Entresto 200 mg zweimal täglich (%)* | ENALAPRIL 10 mg zweimal täglich (%)* | Häufigkeitskategorie |
|---|---|---|---|
Erkrankungen des Blutes und des Lymphsystems | |||
Anämie | 4,00 | 4,75 | Häufig |
Stoffwechsel- und Ernährungsstörungen | |||
| Hyperkaliämie** | 11,61 | 14,00 | Sehr häufig |
| Hypokaliämie | 3,31 | 2,53 | Häufig |
Erkrankungen des Nervensystems | |||
| Schwindel | 6,33 | 4,87 | Häufig |
| Schwindel orthostatisch | 0,57 | 0,28 | Gelegentlich |
| Kopfschmerz | 2,45 | 2,51 | Häufig |
Erkrankungen des Ohrs und des Labyrinths | |||
| Vertigo | 1,45 | 1,40 | Häufig |
Gefässerkrankungen | |||
| Hypotonie | 17,61 | 11,97 | Sehr häufig |
| Synkope | 2,24 | 2,70 | Häufig |
| Hypotonie orthostatisch | 1,52 | 0,80 | Häufig |
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |||
| Husten | 8,78 | 12,60 | Häufig |
Erkrankungen des Gastrointestinaltrakts | |||
| Durchfall | 4,62 | 4,47 | Häufig |
| Übelkeit | 2,09 | 2,36 | Häufig |
Erkrankungen der Haut und des Unterhautzellgewebes | |||
| Angioödeme | 0,45 | 0,24 | Gelegentlich |
Erkrankungen der Nieren und Harnwege | |||
| Eingeschränkte Nierenfunktion | 10,14 | 11,52 | Sehr häufig |
| Nierenversagen (Niereninsuffizienz, akutes Nierenversagen) | 4,76 | 5,30 | Häufig |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | |||
| Ermüdung | 2,97 | 3,05 | Häufig |
| Asthenie | 2,09 | 1,84 | Häufig |
* Sicherheitspopulation.
** Mit Hyperkaliämien assoziierte unerwünschte Ereignisse wurden bei 11,9% der mit Entresto behandelten Patienten gegenüber 14,3% der mit Enalapril behandelten Patienten berichtet (s. «Warnhinweisen und Vorsichtsmassnahmen»).
Kognitive Funktion
Neprilysin ist eines von zahlreichen Enzymen, die an der Clearance von Amyloid-β (Aβ) aus dem Gehirn und der Zerebrospinalflüssigkeit (ZSF) beteiligt sind. Die Verabreichung von 400 mg Entresto einmal täglich über 2 Wochen an gesunde Probanden zeigte keine Veränderungen der Konzentration von Aβ 1-40 und 1-42 in der ZSF, ging allerdings mit einem Anstieg von Aβ 1-38 in der ZSF im Vergleich zum Placebo einher. Die klinische Relevanz dieser Befunde ist nicht bekannt (siehe «Eigenschaften/Wirkungen»). In der Studie PARADIGM-HF erwies sich die Gesamtinzidenz von unerwünschten Ereignissen in Zusammenhang mit Demenz als niedrig und vergleichbar zwischen den Behandlungsgruppen (0.3% in der Gruppe mit Entresto und 0.4% in jener mit Enalapril). Eine spezifische prospektive Untersuchung der kognitiven Funktion wurde nicht vorgenommen. Patienten mit MCI (mild cognitive impairment) oder mit vorbestehender Demenz wurden nicht gesondert untersucht.
Die potenzielle Wirkung von Entresto auf die kognitive Funktion und die Amyloid-β-Ablagerung im Gehirn wird zurzeit in Studien an Patienten mit Herzinsuffizienz evaluiert.
Überdosierung
Für den Menschen liegen begrenzte Daten über eine Überdosierung von Entresto bei Probanden vor. Bei gesunden Freiwilligen wurde die einmalige Anwendung von 1200 mg und die wiederholte Anwendung von 900 mg (14 Tage) Entresto untersucht. Die Anwendungen wurden gut vertragen.
Aufgrund der blutdrucksenkenden Wirkung von Entresto ist Hypotonie das wahrscheinlichste Symptom einer Überdosierung. Eine symptomatische Behandlung ist einzuleiten.
Aufgrund der weitreichenden Proteinbindung ist eine Entfernung von Entresto durch Hämodialyse unwahrscheinlich.
Eigenschaften/Wirkungen
ATC-Code: C09DX04
Wirkungsmechanismus
Entresto enthält einen Salzkomplex, bestehend aus Sacubitril und Valsartan. LBQ657 ist der aktive Metabolit von Sacubitril und hemmt Neprilysin (neutrale Endopeptidase, NEP). Valsartan blockiert den Angiotensin-II-Typ-1 (AT1) Rezeptor. Die Kombination dieser beiden Hemmer wird als Angiotensin-Rezeptor-Neprilysin-Hemmer (ARNI) bezeichnet.
Die kardiovaskulären und renalen Wirkungen von Entresto bei Patienten mit Herzinsuffizienz werden auf einen dualen Wirkmechanismus zurückgeführt: Einerseits kommt es über eine Hemmung des Abbaus zu einer Anreicherung von Peptiden (etwa natriuretische Peptide, NP) durch den Neprilysin-Hemmer LBQ657 und anderseits, durch Valsartan, zur gleichzeitigen Hemmung der schädlichen Wirkungen von Angiotensin II . NP wirken über eine Aktivierung der membrangebundenen Guanylylcyclase-gekoppelten Rezeptoren, was zu erhöhten Konzentrationen von zyklischem Guanosinmonophosphat (cGMP) als «second messenger» führt. Dies wiederum fördert eine Vasodilatation, Natriurese und Diurese, erhöht die glomeruläre Filtrationsrate und renale Durchblutung, hemmt die Renin- und Aldosteronfreisetzung, senkt die Sympathikusaktivität und induziert antihypertrophe und antifibrotische Wirkungen. Eine anhaltende Aktivierung des Renin-Angiotensin-Aldosteron-Systems führt zu Vasokonstriktion, renaler Natrium- und Flüssigkeitsretention, einer Aktivierung von Zellwachstum und -proliferation sowie in der Folge zu maladaptiven kardiovaskulären Remodeling-Prozessen. Valsartan hemmt die schädlichen kardiovaskulären und renalen Wirkungen von Angiotensin II durch selektive Blockade des AT1-Rezeptors und hemmt ausserdem die Angiotensin-II-abhängige Aldosteronfreisetzung.
Pharmakodynamische Eigenschaften
Die pharmakodynamischen Wirkungen von Entresto wurden nach einmaliger und wiederholter Verabreichung bei gesunden Probanden und bei Patienten mit Herzinsuffizienz untersucht. Sie sind konsistent mit einer gleichzeitigen Neprilysinhemmung und RAAS-Blockade. Im Rahmen einer siebentägigen Valsartan-kontrollierten Studie bei Patienten mit verminderter Auswurffraktion (HFrEF) führte Entresto im Vergleich zu Valsartan zu einem signifikanten, nicht nachhaltigen Anstieg der Natriurese, erhöhtem cGMP im Urin und vermindertem MR-proANP und NT-proBNP im Plasm. Im Rahmen einer 21-tägigen Studie mit HFrEF-Patienten erhöhte Entresto verglichen mit Baseline das ANP und cGMP im Urin und das cGMP im Plasma und senkte das NT-proBNP, Aldosteron und Endothelin-1 im Plasma. Darüber hinaus blockierte Entresto den AT1-Rezeptor, was durch eine erhöhte Plasma-Renin-Aktivität und erhöhte Renin-Plasmaspiegel nachgewiesen wurde. Im Rahmen der Studie PARADIGM-HF senkte Entresto im Vergleich zu Enalapril das NT-proBNP im Plasma und erhöhte das BNP im Plasma und das cGMP im Urin. Während es sich bei BNP um ein Neprilysinsubstrat handelt, ist dies bei NT-proBNP nicht der Fall.
BNP ist deshalb kein geeigneter Biomarker für Herzinsuffizienz bei mit Entresto behandelten Patienten (siehe «Warnhinweise und Vorsichtsmassnahmen»). NT-proBNP ist kein Neprilysin Substrat und ist daher besser als Biomarker geeignet.
In einer speziell dafür geplanten klinischen Studie mit gesunden männlichen Probanden zeigte die einmalige Verabreichung von 400 mg und 1200 mg Entresto keinerlei Wirkungen auf die kardiale Repolarisation.
Neprilysin ist eines von zahlreichen Enzymen, die an der Clearance von Amyloid-β (Aβ) aus dem Gehirn und der Zerebrospinalflüssigkeit (ZSF) beteiligt sind. Die Verabreichung von 400 mg Entresto einmal täglich über 2 Wochen an gesunde Probanden zeigte keine Veränderungen der Konzentration von Aβ 1-40 und Aβ 1-42 in der ZSF, ging allerdings mit einem Anstieg von Aβ 1-38 in der ZSF im Vergleich zu Placebo einher. Die klinische Bedeutung dieser Befunde ist nicht bekannt (siehe «Präklinische Daten»), da strukturelle und funktionelle Veränderungen im ZNS nicht untersucht wurden. Eine Studie an Patienten mit Herzinsuffizienz wird potenzielle Wirkungen von Entresto auf die kognitive Funktion und Amyloid-β-Ablagerung im Gehirn untersuchen.
Klinische Wirksamkeit
PARADIGM-HF
Bei PARADIGM-HF handelte es sich um eine multinationale, randomisierte Doppelblindstudie mit 8'442 Patienten, bei der Entresto mit Enalapril verglichen wurde. Die Arzneimittel wurden erwachsenen Patienten mit chronischer Herzinsuffizienz (NYHA-Klasse II–IV) und systolischer Dysfunktion (linksventrikuläre Auswurffraktion ≤40%) zusätzlich zu anderen Therapien (>90% Betablocker, ca 80% Diuretika, ca. 50% Mineralokortikoidantagonisten) bei Herzinsuffizienz verabreicht. Der zusammengesetzte primäre Endpunkt bestand aus kardiovaskulär (KV) bedingtem Tod oder Hospitalisation aufgrund einer Herzinsuffizienz (HF).
Vor der Studienteilnahme waren die Patienten durch eine Therapie entsprechend dem Versorgungsstandard, u.a. mit ACE-Hemmern/ARB (>99%), Betablockern (94%), Mineralokortikoidantagonisten (58%) und Diuretika (83%), gut eingestellt. Die mediane Beobachtungsdauer betrug 27 Monate, und die Patienten wurden über maximal 4,3 Jahre behandelt. Patienten mit einem systolischen BD <100 mmHg wurden nicht in die Studie aufgenommen.
Die Patienten mussten ihre bestehende ACE-Hemmer- oder ARB-Therapie absetzen und wurden in eine sequenzielle, einfach verblindete Run-in-Phase eingeschlossen, während der sie mit Enalapril 10 mg zweimal täglich behandelt wurden. Die Anschlussbehandlung erfolgte mit einer Dosis von 100 mg Entresto zweimal täglich, die nach 1 bis 2 Wochen auf 200 mg zweimal täglich erhöht wurde. Patienten, die die Run-in-Behandlungen gut vertragen haben, wurden anschliessend randomisiert zu Entresto oder zu Enalapril. In der Doppelblindphase der Studie erhielten die Patienten 200 mg Entresto oder 10 mg Enalapril je zweimal täglich [Entresto (n=4'209); Enalapril (n=4'233)].
Das Durchschnittsalter des untersuchten Patientenkollektivs betrug 64 Jahre; 19% waren 75 Jahre oder älter. Bei der Randomisierung wurden 70% der Patienten in NYHA-Klasse II und 25% in Klasse III/IV eingestuft.
In der Gruppe unter Entresto erhielten 76% der Patienten bis zum Ende der Studie die angestrebte Dosis von 200 mg zweimal täglich (mittlere Tagesdosis 375 mg). In der Gruppe unter Enalapril erhielten 75% der Patienten bis zum Ende der Studie die angestrebte Dosis von 10 mg zweimal täglich (mittlere Tagesdosis 18,9 mg).
Entresto senkte gegenüber Enalapril statistisch signifikant das Risiko für kardiovaskulären Tod bzw. eine stationäre Aufnahme aufgrund von Herzinsuffizienz um 20% (Hazard Ratio [HR]: 0,80, 95-%-KI [0,73-0,87]. Die absolute Risikoreduktion betrug 4,69%. Diese Wirkung wurde frühzeitig beobachtet und wurde über die Dauer der Studie aufrechterhalten. Es wurde ein statistisch signifikanter Rückgang der kardiovaskulär-bedingten Todesfälle und der ersten Herzinsuffizienz-bedingten stationären Aufnahme beobachtet (KV-bedingter Tod: RRR 20%, HR 0,80; 95-%-KI [0,71-0,89], 3.13% absolute Risikoreduktion; Herzinsuffizienz-bedingte stationäre Aufnahme: RRR 21%; HR 0,79; 95-%-KI [0,71-0,89], absolute Risikoreduktion 2.80%); siehe Tabelle 2. Plötzlicher Herztod war die Ursache bei 45% der KV-bedingten Todesfälle. Dieser Wert wurde bei Patienten unter Entresto im Vergleich zu Patienten unter Enalapril um 20% gesenkt (HR 0,80;95% KI [0,68; 0,94]). Ein Ausfall der Pumpfunktion war die Ursache bei 26% der KV-bedingten Todesfälle. Dieser Wert wurde bei Patienten unter Entresto im Vergleich zu Patienten unter Enalapril um 21% gesenkt (HR 0,79; 95% KI [0,64; 0,98]).
Diese Risikoreduktion wurde in verschiedenen Untergruppen, u.a. bezüglich Alter, Geschlecht, ethnischer Zugehörigkeit, geografischer Herkunft, NYHA-Klasse, Auswurffraktion, Nierenfunktion, Diabetes oder Hypertonie in der Anamnese, frühere Behandlung bei Herzinsuffizienz und Vorhofflimmern, übereinstimmend beobachtet.
Darüber hinaus senkte Entresto im Vergleich zu Enalapril signifikant die Gesamtsterblichkeit um 16% (RRR 16%, HR 0,84; 95-%-KI [0,76-0,93]) (Tabelle 2). Die absolute Risikoreduktion betrug 2,84%.
Tabelle 2: Behandlungswirkung auf den zusammengesetzten primären Endpunkt, seine Komponenten und die Gesamtsterblichkeit
| Entresto N=4187# n (%) | Enalapril N=4212# n (%) | Hazard Ratio (95-%-KI) | Relative Risikoreduktion | Absolute Risikoreduktion | |
| Zusammengesetzter primärer Endpunkt bestehend aus KV-bedingtem Tod und stationärer Aufnahme aufgrund von Herzinsuffizienz* | 914 (21,83) | 1117 (26,52) | 0,80 (0,73-0,87) | 20% | 4,69% |
Einzelne Komponenten des zusammengesetzten primären Endpunkts | |||||
| KV-bedingter Tod ** | 558 (13,33) | 693 (16,45) | 0,80 (0,71-0,89) | 20% | 3,13% |
| Erste stationäre Aufnahme aufgrund von Herzinsuffizienz | 537 (12,83) | 658 (15,62) | 0,79 (0,71-0,89) | 21% | 2,80% |
Sekundärer Endpunkt | |||||
| Gesamtsterblichkeit | 711 (16,98) | 835 (19,82) | 0,84 (0,76-0,93) | 16% | 2,84% |
* Der primäre Endpunkt war als Zeit bis zum ersten Ereignis definiert.
** KV-bedingte Todesfälle beinhalteten alle Patienten, die bis zum Stichtag unabhängig von einer früheren stationären Aufnahme verstarben.
# Vollständige Analysepopulation.
Abbildung 0 Kaplan-Meier-Kurven für den zusammengesetzten primären Endpunkt und die Komponente «KV-bedingter Tod»

Eine geringere Anzahl von Patienten zeigte laut Beurteilung anhand des KCCQ-Fragebogens (Kansas City Cardiomyopathy Questionnaire) im Vergleich zu Enalapril eine Verschlechterung der HF-Symptome, einschliesslich Dyspnoe und Erschöpfung und körperlicher Einschränkungen.
Pharmakokinetik
Absorption
Nach oraler Verabreichung spaltet sich Entresto in Sacubitril, das weiter zu LBQ657 verstoffwechselt wird, und in Valsartan auf. Die Spitzenplasmakonzentrationen werden nach 0,5 Stunden, 2 Stunden bzw. 1,5 Stunden erreicht. Die absolute orale Bioverfügbarkeit von Sacubitril und Valsartan wird auf ≥60% bzw. 23% geschätzt.
Das in Entresto enthaltene Valsartan weist eine höhere Bioverfügbarkeit als das Valsartan in anderen vermarkteten Tablettenformulierungen auf; 25.7 mg, 51.4 mg bzw. 102.8 mg Valsartan in Entresto entsprechen jeweils 40 mg, 80 mg bzw. 160 mg Valsartan in anderen auf dem Markt erhältlichen Tablettenformulierungen.
Nach zweimal täglicher Gabe von Entresto werden die Steady-state von Sacubitril, LBQ657 und Valsartan nach 3 Tagen erreicht. Im Steady-state kommt es zu keiner signifikanten Akkumulation von Sacubitril und Valsartan, während sich LBQ657 um das 1,6-Fache akkumuliert.
Die Verabreichung von Entresto mit Nahrung hat keine klinisch signifikanten Auswirkungen auf die systemische Exposition gegenüber Sacubitril, LBQ657 und Valsartan. Auch wenn es bei einer Verabreichung von Entresto mit Nahrung zu einer Verringerung der Exposition gegenüber Valsartan kommt, ist dieser Rückgang nicht mit einer klinisch signifikanten Minderung der therapeutischen Wirkung assoziiert. Entresto kann daher unabhängig von den Mahlzeiten verabreicht werden.
Distribution
Entresto bindet zu einem hohen Anteil an Plasmaproteine (94%-97%). Ein Vergleich der Plasma- und ZSF-Exposition ergab, dass LBQ657 die Blut-Hirn-Schranke in begrenztem Ausmass (0,28%) überwindet. Das scheinbare Verteilungsvolumen von Entresto liegt zwischen 107,8 l und 157,4 l.
Metabolismus
Sacubitril wird durch Esterasenaktivität rasch zu LBQ657 umgewandelt, wobei LBQ657 nicht in bedeutendem Umfang weiter metabolisiert wird. Valsartan wird minimal metabolisiert, da lediglich ca. 20% der Dosis als Metaboliten wiedergewonnen werden. Im Plasma wurde ein Hydroxylmetabolit in geringer Konzentration (<10%) nachgewiesen. Da die Metabolisierung von Sacubitril und Valsartan nur zu einem geringen Teil über das CYP-450-Enzymsystem erfolgt, sind bei einer gleichzeitigen Verabreichung mit Wirkstoffen, die das CYP-450-Enzymsystem beeinflussen, keine Wirkungen auf die Pharmakokinetik zu erwarten.
Elimination
Nach oraler Verabreichung wird Sacubitril zu 52-68% (hauptsächlich als LBQ657) und Valsartan und seine Metaboliten zu ~13% über den Urin ausgeschieden; 37-48% von Sacubitril (hauptsächlich LBQ657) und 86% von Valsartan und seinen Metaboliten werden über die Fäzes ausgeschieden.
Sacubitril, LBQ657 und Valsartan werden aus dem Plasma mit einer mittleren Eliminationshalbwertzeit (T½) von ca. 1,43 Stunden, 11,48 Stunden bzw. 9,90 Stunden eliminiert.
Linearität/Nicht-Linearität
Die Pharmakokinetik von Sacubitril, LBQ657 und Valsartan ist im untersuchten Dosierungsbereich (50-400 mg Entresto) linear.
Spezielle Patientengruppen
Ältere Patienten (über 65 Jahre)
Die LBQ657- und Valsartan-Exposition ist bei älteren Patienten im Vergleich zu jüngeren Patienten um 42% bzw. 30% erhöht. Allerdings ist diese Erhöhung nicht mit klinisch relevanten Wirkungen verbunden, und eine Dosisanpassung ist somit nicht erforderlich.
Kinder und Jugendliche (≥18 Jahre)
Entresto wurde bei Kindern und Jugendlichen nicht untersucht.
Eingeschränkte Nierenfunktion
Es wurde eine Korrelation zwischen der Nierenfunktion und der systemischen Exposition gegenüber LBQ657, nicht jedoch gegenüber Valsartan beobachtet. Bei Patienten mit leichter (60 ml/min/1.73 m2 ≤eGFR <90 ml/min/1.73 m2) bis mittelschwerer Nierenfunktionsstörung (30 ml/min/1,73 m2 ≤ eGFR <60 ml/min/1,73 m2) war die AUC für LBQ657 um bis zu das 2-Fache erhöht. Bei Patienten mit leichten oder mässigen Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Eine Erhöhung der AUC für LBQ657 um das 2,7-Fache wurde bei Patienten mit schwerer Nierenfunktionsstörung beobachtet (eGFR <30 ml/min/1,73 m2). Bei diesen Patienten wird eine Initialdosis von 50 mg zweimal täglich empfohlen. Bei einer Verabreichung von Entresto bei diesen Patienten ist Vorsicht geboten.
Bei eGFR <10 ml/min/1,73 m2 ist Entresto kontraindiziert (siehe «Kontraindikationen»).
Bei dialysepflichtigen Patienten wurden keine Untersuchungen durchgeführt. Da LBQ657 und Valsartan jedoch in hohem Masse an Plasmaproteine binden, ist eine effektive Entfernung durch Dialyse unwahrscheinlich.
Eingeschränkte Leberfunktion
Bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung war die Sacubitril-Exposition im Vergleich zu entsprechenden gesunden Probanden um das 1,5- bzw. 3,4-Fache, die LBQ657-Exposition um das 1,5- bzw. 1,9-Fache und die Valsartan-Exposition um das 1,2- bzw. 2,1-Fache erhöht. Bei der Verabreichung von Entresto an Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Klassifikation A), einschliesslich Patienten mit Gallenobstruktionserkrankung, ist keine Dosisanpassung erforderlich. Für Patienten mit mittelschwerer Leberfunktionsstörung (Child-Pugh-Klassifikation B) wird aufgrund begrenzter klinischer Erfahrungen eine Initialdosis von 50 mg zweimal täglich empfohlen.
Entresto wurde bei Patienten mit schwerer Leberfunktionsstörung nicht untersucht. Daher wird die Anwendung bei Patienten mit schwerer Leberfunktionsstörung nicht empfohlen.
Ethnische Gruppen
Die Pharmakokinetik von Entresto (Sacubitril, LBQ657 und Valsartan) ist bei verschiedenen Rassen und ethnischen Gruppen (Weisse, Schwarze, Asiaten, Japanern und anderen) vergleichbar.
Geschlecht
Die Pharmakokinetik von Entresto (Sacubitril, LBQ657 und Valsartan) ist bei Männern und Frauen vergleichbar.
Präklinische Daten
Die präklinischen Studien zur Sicherheit mit Entresto umfassten eine Beurteilung der Sicherheitspharmakologie, der Toxizität bei wiederholter Gabe, der Genotoxizität, der Kanzerogenität sowie der Reproduktions- und Entwicklungstoxizität.
Kanzerogenität, Mutagenese und genetische Toxizität
Studien zur Kanzerogenität an Mäusen und Ratten mit Sacubitril und Valsartan ergaben für Entresto kein kanzerogenes Potenzial. Die untersuchten Sacubitril-Dosen (hohe Dosis 1.200 bzw. 400 mg/kg/Tag bei Mäusen bzw. Ratten) entsprachen dem ca. 29- bzw. 19-Fachen der empfohlenen Höchstdosis beim Menschen (MRHD) auf einer mg/m2-Basis. Die untersuchten Valsartan-Dosen (hohe Dosis 160 bzw. 200 mg/kg/Tag bei Mäusen bzw. Ratten) entsprachen dem ca. 4- bzw. 10-Fachen der empfohlenen Höchstdosis beim Menschen auf einer mg/m2-Basis.
In Studien zur Mutagenität (Ames-Test) und Klastogenität (Chromosomenaberration (humane periphere Blutlymphozyten oder CHO [Chinese hamster ovary]-Zellen in vitro und in vivo Mikrokern-Test) mit Entresto zeigten Sacubitril und Valsartan weder auf Gen- noch Chromosomenebene Wirkungen.
Fertilität, Reproduktion und Entwicklung
Entresto zeigte bei Ratten in einer Dosis von bis zu 150 mg/kg/Tag (≤1,0-fache bzw. ≤0,18-Fache der MRHD auf der Basis der Valsartan- bzw. LBQ657-AUC) keine Wirkungen auf die Fertilität oder die frühe embryonale Entwicklung.
Die Behandlung mit Entresto während der Organogenese führte zu einer erhöhten embryo-fetalen Letalität bei Ratten in Dosen ≥100 mg/kg/Tag [≤0,72-fache MRHD auf AUC-Basis] und bei Kaninchen in Dosen ≥10 mg/kg/Tag [2-fache bzw. 0,03-fache MRHD auf Basis der Valsartan- bzw. LBQ657-AUC]. Entresto ist basierend auf einer niedrigen Inzidenz fetaler Hydrozephalie assoziiert mit maternal toxischen Dosen, die bei Kaninchen unter Entresto in einer Dosis von ≥10 mg/kg/Tag beobachtet wurde, teratogen.
Bei Kaninchen führte eine Sacubitril-Behandlung assoziiert mit maternal toxischen Dosen (500 mg/kg/Tag; 5,7-fache MRHD auf Basis der LBQ657 AUC) während der Organogenese zu embryo-fetaler Letalität und embryo-fetaler Toxizität (geringeres fetales Körpergewicht und verzögerte fetale Ossifikation). Sacubitril wirkt bei Ratten und Kaninchen nicht teratogen. Bei mit Sacubitril behandelten Ratten gab es keine Hinweise auf eine embryo-fetale Toxizität oder Teratogenizität. Der embryo-fetale No-observed-adverse-effect level (NOAEL) betrug für Sacubitril bei Ratten mindestens 750 mg/kg/Tag und bei Kaninchen 200 mg/kg/Tag (2,2-fache MRHD auf Basis der LBQ657 AUC).
Studien zur prä- und postnatalen Entwicklung bei der Ratte mit Sacubitril in Dosen von bis zu 750 mg/kg/Tag [2,2-fache MRHD auf AUC-Basis] in Dosen von bis zu 600 mg/kg/Tag [0,86-fache MRHD auf AUC-Basis] lassen darauf schliessen, dass eine Behandlung mit Entresto während Organogenese, Trächtigkeit und Laktationsphase die Entwicklung und das Überleben der Nachkommen beeinflussen kann.
Sonstige präklinische Befunde
Die Wirkungen von Entresto auf Amyloid-β-Konzentrationen in der Zerebrospinalflüssigkeit (ZSF) und in Hirngewebe wurden bei jungen (2-4 Jahre alten) Cynomolgus-Affen, die zwei Wochen lang mit Entresto (50 mg/kg/Tag) behandelt wurden, beurteilt. In dieser Studie zeigte Entresto bei Cynomolgus-Affen eine pharmakodynamische Wirkung auf die Aβ-Clearance aus der ZSF, was zu einem Anstieg von Aβ 1-40, 1-42 und 1-38 in der ZSF führte; ein entsprechender Anstieg der Aβ-Werte im Gehirn wurde nicht beobachtet. Darüber hinaus fand sich in einer Studie zur Toxikologie bei Cynomolgus-Affen, die über 39 Wochen mit 300 mg Entresto/kg/Tag behandelt wurden (resultierend in einer höheren systemischen Exposition als der mit 200 mg BID beim Menschen erreichten), keine Amyloid-β-Akkumulierung im Gehirn.
Bei mit Sacubitril behandelten juvenilen Ratten (postnatal, Tage 7-70) kam es zu einer verringerten altersbedingten Entwicklung der Knochenmasse und -verlängerung. Eine Studie mit adulten Ratten zeigte eine nur minimale transiente Beeinträchtigung bei der Knochenmineraldichte; andere, für das Knochenwachstum relevante Parameter wurden nicht beeinflusst.
Sonstige Hinweise
Besondere Lagerungshinweise
In der Originalverpackung, vor Feuchtigkeit geschützt und nicht über 30 °C aufbewahren.
Arzneimittel für Kinder unerreichbar aufbewahren.
Spezielle Vorsichtsmassnahmen für die Entsorgung
Jedes nicht verwendete Produkt oder Abfallmaterial sollte entsprechend den lokalen Anforderungen fachgerecht entsorgt werden.
Zulassungsnummer
65673 (Swissmedic).
Zulassungsinhaberin
Novartis Pharma Schweiz AG, Risch; Domizil: 6343 Rotkreuz.
Stand der Information
April 2018.
OEMéd
Composition
Principes actifs: sacubitril/valsartan.
Entresto contient un complexe sodique des formes anioniques du sacubitril et du valsartan, des cations sodiques et des molécules d'eau dans un rapport molaire de 1:1:3:2,5. Après administration orale, Entresto se sépare en sacubitril (ensuite métabolisé en LBQ657) et valsartan.
Excipients: Excip. pro compr. Obduct.
Forme galénique et quantité de principe actif par unité
Entresto 50 mg
Comprimés pelliculés de 50 mg (sacubitril 24.3 mg/valsartan 25.7 mg): comprimé pelliculé violet-blanc de forme ovale biconvexe à bords biseautés, sans rainure de fragmentation, portant l'inscription «NVR» gravée sur une face et «LZ» sur l'autre face.
Entresto 100 mg
Comprimés pelliculés de 100 mg (sacubitril 48.6 mg/valsartan 51.4 mg): comprimé pelliculé jaune pâle de forme ovale biconvexe à bords biseautés, sans rainure de fragmentation, portant l'inscription «NVR» gravée sur une face et «L1» sur l'autre face.
Entresto 200 mg
Comprimés pelliculés de 200 mg (sacubitril 97.2 mg/valsartan 102.8 mg): comprimé pelliculé rose pâle de forme ovale biconvexe à bords biseautés, sans rainure de fragmentation, portant l'inscription «NVR» gravée sur une face et «L11» sur l'autre face.
Indications/Possibilités d’emploi
Entresto est indiqué pour réduire le risque de mortalité et de morbidité cardiovasculaires chez les patients adultes souffrant d'insuffisance cardiaque systolique (classe NYHA II-IV, FEVG ≤40%). Entresto est administré en étant associé, de manière appropriée, avec d'autres traitements de l'insuffisance cardiaque (par ex. bêtabloquants, diurétiques et antagonistes des minéralocorticoïdes) au lieu d'un inhibiteur de l'ECA ou d'un ARA (voir «Propriétés/Effets»).
Posologie/Mode d’emploi
La dose initiale recommandée d'Entresto est de 100 mg deux fois par jour. Une dose initiale de 50 mg deux fois par jour est recommandée pour les patients actuellement non traités par un inhibiteur de l'ECA (enzyme de conversion de l'angiotensine) ou un antagoniste du récepteur de l'angiotensine II (ARA), et doit être envisagée chez les patients traités jusqu'ici avec une dose faible de ces principes actifs (voir «Propriétés/Effets»).
La dose d'Entresto peut être doublée toutes les 2 à 4 semaines jusqu'à la dose cible de 2× 200 mg par jour, en fonction de la tolérance.
La dose d'entretien cible d'Entresto est de 200 mg deux fois par jour.
Le traitement par Entresto peut être initié au plus tôt 36 heures après l'arrêt d'un inhibiteur de l'ECA, compte tenu du risque potentiel d'angio-œdème lors de l'administration concomitante d'un inhibiteur de l'ECA (voir «Contre-indications»).
En raison de son activité antagoniste du récepteur de l'angiotensine II, Entresto ne doit pas être administré de façon concomitante avec un ARA (voir «Mises en garde et précautions» et «Interactions»).
Les patients avec une tension artérielle systolique (systolic blood pressure, SBP) <100 mmHg n'ont pas été étudiés; Entresto doit donc être utilisé avec prudence chez ces patients.
Si les patients présentent des problèmes de tolérance (hypotension symptomatique, hyperkaliémie, insuffisance rénale), il est recommandé d'ajuster la posologie des médicaments concomitants, de réduire temporairement la dose d'Entresto ou d'arrêter celui-ci.
Mode d'administration
Entresto peut être administré indépendamment des repas (voir «Propriétés/Effets»).
Groupes de patients particuliers
Insuffisance rénale
Aucune adaptation posologique n'est nécessaire chez les patients atteints d'insuffisance rénale légère (eGFR 60-90 ml/min/1,73 m2) à modérée (eGFR 30-60 ml/min/1,73 m²). Chez les patients atteints d'insuffisance rénale sévère (eGFR <30 ml/min/1,73 m2), il est recommandé de commencer par une dose de 50 mg deux fois par jour. La prudence est recommandée lors de l'utilisation d'Entresto chez ce groupe de patients.
Entresto est contre-indiqué chez les patients avec eGFR <10 ml/min/1.73 m2 (voir «Contre-indications»).
Insuffisance hépatique
Aucune adaptation posologique n'est nécessaire en cas d'administration d'Entresto à des patients atteints d'insuffisance hépatique légère (classe Child-Pugh A).
Chez les patients atteints d'insuffisance hépatique modérée (classe Child-Pugh B), il est recommandé de commencer par une dose de 50 mg deux fois par jour.
Aucune étude n'a été réalisée chez les patients atteints d'insuffisance hépatique sévère (classe Child-Pugh C). Il est donc déconseillé d'utiliser Entresto chez ces patients (voir «Propriétés/Effets»).
Enfants et adolescents
La sécurité et l'efficacité d'Entresto n'ont pas été établies chez les enfants et les adolescents de moins de 18 ans.
Patients âgés (plus de 65 ans)
Aucune adaptation posologique n'est nécessaire chez les patients âgés de plus de 65 ans.
Contre-indications
- Hypersensibilité à l'un des principes actifs, sacubitril ou valsartan, ou à l'un des excipients.
- Utilisation concomitante d'un inhibiteur de l'ECA (voir «Mises en garde et précautions», «Posologie/Mode d'emploi» et «Interactions»). Entresto peut être administré au plus tôt 36 heures après l'arrêt d'un traitement par inhibiteur de l'ECA.
- Antécédent connu d'angio-œdème lié à un traitement antérieur par inhibiteur de l'ECA ou ARA.
- Angio-œdème héréditaire.
- Utilisation concomitante d'Entresto avec des médicaments contenant de l'aliskirène chez les patients diabétiques ou insuffisants rénaux (GFR <60 ml/min/1,73 m2) (cf. rubriques «Mises en garde et précautions» et «Interactions»).
- Insuffisance rénale sévère avec eGFR <10 ml/min/1,73 m2 en raison de données manquantes.
- Grossesse (voir «Grossesse/Allaitement»).
Mises en garde et précautions
Double blocage du système rénine-angiotensine-aldostérone (SRAA)
- En raison du risque d'angio-œdème, Entresto ne doit pas être administré de façon concomitante avec un inhibiteur de l'ECA. Un traitement par Entresto peut commencer au plus tôt 36 heures après la prise de la dernière dose d'un traitement par inhibiteur de l'ECA. Lors de l'arrêt d'Entresto, un traitement par inhibiteur de l'ECA peut être initié au plus tôt 36 heures après la dernière dose d'Entresto (voir «Contre-indications», «Posologie/Mode d'emploi» et «Interactions»).
- En raison de son activité antagoniste du récepteur de l'angiotensine II, Entresto ne doit pas être administré avec un ARA (voir «Posologie/Mode d'emploi» et «Interactions»).
- L'utilisation concomitante d'Entresto avec des inhibiteurs directs de la rénine tels que l'aliskirène n'est pas recommandée (voir «Contre-indications» et «Interactions»). Entresto ne doit pas être administré avec l'aliskirène chez les patients avec diabète sucré ou les patients avec fonction rénale limitée (GFR <60 ml/min/1,73 m2), (voir «Contre-indications» et «Interactions»).
Hypotension artérielle
Des cas d'hypotension symptomatique ont été rapportés chez des patients traités par Entresto dans le cadre des études cliniques; en particulier chez les patients d'âge ≥65 ans, ceux atteints d'une maladie rénale et ceux avec une SBP basse (<112 mmHg). Les rapports d'hypotension en tant qu'événement indésirable ont été plus fréquents sous Entresto (17.6%) que sous énalapril (12.0%). Lors de l'initiation du traitement par Entresto ou pendant un ajustement posologique, il convient de surveiller la tension artérielle à intervalles réguliers, conformément à la pratique clinique habituelle. En cas d'hypotension, il est recommandé de réduire temporairement la dose ou de suspendre temporairement Entresto (voir «Posologie/Mode d'emploi»). Il faudra envisager d'ajuster la posologie des diurétiques, des traitements hypotenseurs concomitants et de traiter les autres causes d'hypotension (par ex. hypovolémie). En règle générale, il n'est pas nécessaire d'arrêter définitivement le traitement. La probabilité d'une hypotension symptomatique augmente en cas d'hypovolémie, par ex. à la suite d'un traitement par diurétique, d'un régime alimentaire hyposodé, d'une diarrhée ou de vomissements. La déplétion sodique et/ou volémique doit être corrigée avant d'instaurer le traitement par Entresto.
Insuffisance rénale
Comme tous les principes actifs agissant sur le système rénine-angiotensine-aldostérone, Entresto peut être associé à une dégradation de la fonction rénale. Dans l'étude PARADIGM-HF, l'incidence des cas d'insuffisance rénale cliniquement significative était faible et un arrêt du traitement lié à ce problème était moins fréquent sous Entresto (0,65%) que sous énalapril (1,28%). Une réduction de la dose d'Entresto doit être envisagée chez les patients qui développent une diminution cliniquement significative de la fonction rénale. En cas d'utilisation d'Entresto chez des patients présentant une insuffisance rénale sévère (eGFR <30 ml/min/1,73 m2), il convient de faire preuve de prudence (voir «Posologie/Mode d'emploi» et «Propriétés/Effets»). Entresto est contre-indiqué chez les patients avec eGFR <10 ml/min/1.73 m2 (voir «Contre-indications»).
Hyperkaliémie
Comme tous les principes actifs agissant sur le système rénine-angiotensine-aldostérone, Entresto peut être associé à un risque accru d'hyperkaliémie. Dans l'étude PARADIGM-HF, l'incidence des cas d'hyperkaliémie cliniquement significative entraînant l'arrêt du traitement était faible (0,26% des patients sous Entresto pour 0,35% des patients sous énalapril). Des hyperkaliémies >5,5 mmol/l ont été observées chez environ 16% des patients sous Entresto et respectivement, sous énalapril. Les événements indésirables associés à l'hyperkaliémie ont été rapportés chez 11,9% des patients traités par Entresto par rapport à 14,3% des patients traités par énalapril (voir «Effets indésirables»). Les médicaments connus pour élever le taux de potassium (par ex. les diurétiques épargneurs de potassium, les suppléments potassiques) doivent être utilisés avec précaution en cas d'administration concomitante d'Entresto. En cas d'hyperkaliémie cliniquement significative, il faut envisager des mesures telles que la réduction de l'apport de potassium dans l'alimentation ou un ajustement de la posologie des médicaments concomitants. Il est recommandé de surveiller le potassium sérique en particulier chez les patients présentant des facteurs de risque tels qu'une insuffisance rénale sévère, un diabète, un hypoaldostéronisme ou ceux ayant un régime alimentaire riche en potassium (voir «Posologie/Mode d'emploi»).
Angio-œdèmes
Des angio-œdèmes ont été signalés chez des patients traités par Entresto. En cas d'angio-œdème, il faut arrêter immédiatement Entresto et mettre en place un traitement et une surveillance appropriés, jusqu'à la disparition totale et durable des signes et symptômes. Entresto ne doit pas être ré-administré. Dans les cas confirmés d'angio-œdème où l'œdème est limité au visage et aux lèvres, celui-ci est généralement résorbé sans traitement. Toutefois, les antihistaminiques se sont avérés utiles pour soulager les symptômes.
Un angio-œdème accompagné d'un œdème pharyngé peut entraîner la mort. Si la langue, la glotte ou le pharynx sont impliqués, ce qui mène probablement à une obstruction des voies respiratoires, il faut immédiatement instaurer un traitement adéquat, par ex. par solution d'épinéphrine/adrénaline 1:1000 (0,3 ml à 0,5 ml) sous-cutanée et/ou des mesures pour maintenir ouvertes les voies respiratoires.
Les patients avec des antécédents d'angio-œdème n'ont pas été étudiés. Ces patients étant davantage exposés au risque d'angio-œdème, il convient de faire preuve de prudence en administrant Entresto à ce groupe de patients. Entresto ne doit pas être utilisé chez des patients avec un angio-œdème connu dans l'anamnèse lié à un traitement antérieur par inhibiteurs de l'ECA ou ARA ou chez des patients présentant un angio-œdème héréditaire (voir «Contre-indications»).
Les patients d'origine ethnique africaine peuvent avoir une plus grande susceptibilité aux angio-œdèmes.
Patients avec une sténose de l'artère rénale
Comme d'autres médicaments ayant un effet sur le système rénine-angiotensine-aldostérone, Entresto peut augmenter l'hématurie et la créatinine sérique chez les patients présentant une sténose bilatérale ou unilatérale de l'artère rénale. Chez les patients avec une sténose de l'artère rénale, il convient de faire preuve de prudence et de surveiller la fonction rénale.
Biomarqueurs
Chez les patients traités par Entresto, le peptide natriurétique de type B (BNP) n'est pas un biomarqueur approprié pour l'insuffisance cardiaque, car le BNP est un substrat de la néprilysine (voir «Propriétés/Effets»).
L'effet d'inhibition de la néprilysine d'Entresto sur l'expression de CD10 dans des cellules normales et néoplasiques n'a pas été étudié et est inconnu.
Interactions
Interactions prévisibles entraînant une contre-indication
Inhibiteurs de l'ECA: L'utilisation simultanée d'Entresto avec des inhibiteurs de l'ECA est contre-indiquée, car l'inhibition concomitante de la néprilysine (NEP) avec un traitement par inhibiteur de l'ECA peut augmenter le risque d'angio-œdème. Un traitement par Entresto peut être initié au plus tôt 36 heures après la prise de la dernière dose d'un traitement par inhibiteur de l'ECA. Un traitement par inhibiteur de l'ECA peut être initié au plus tôt 36 heures après la dernière dose d'Entresto (voir «Contre-indications» et «Posologie/Mode d'emploi»).
Aliskirène: L'utilisation concomitante d'aliskirène et d'Entresto est contre-indiquée chez les patients avec diabète sucré ou les patients avec fonction rénale limitée (eGFR <60 ml/min/1,73 m2), (voir «Contre-indications» et «Mises en garde et précautions»).
Interactions prévisibles en raison desquelles l'utilisation concomitante est déconseillée
En raison de son activité antagoniste du récepteur de l'angiotensine II, Entresto ne doit pas être pris avec un ARA (voir «Mises en garde et précautions»).
Interactions observées à prendre en compte
Statines: Les données in vitro portent à conclure que le sacubitril inhibe les transporteurs OATP1B1 et OATP1B3. Entresto peut donc augmenter l'exposition systémique aux substrats d'OATP1B1 et OATP1B3, tels que les statines.
L'utilisation concomitante d'Entresto a augmenté jusqu'à deux fois la Cmax de l'atorvastatine et de ses métabolites, l'ASC étant multipliée par 1,3. La prudence est donc de rigueur en cas d'utilisation concomitante d'Entresto avec des statines. Aucune interaction médicamenteuse cliniquement pertinente n'a été observée lors de l'administration concomitante d'Entresto et de simvastatine.
Sildénafil: L'administration d'une dose de sildénafil avec Entresto à l'état d'équilibre chez les patients atteints d'hypertension s'est accompagnée d'une baisse plus importante de la tension artérielle que l'administration d'Entresto seul. Il convient donc de faire preuve de prudence lors du début d'un traitement par sildénafil ou un autre inhibiteur de PDE-5 chez les patients sous Entresto.
Interactions prévisibles à prendre en compte
Potassium: L'utilisation concomitante de diurétiques épargneurs de potassium (par ex. triamtérène, amiloride), d'antagonistes des minéralocorticoïdes (par ex. spironolactone, éplérénone), de suppléments potassiques ou de substituts de sel contenant du potassium peut entraîner une augmentation du potassium sérique et de la créatininémie. Il convient de surveiller le potassium sérique en cas d'administration concomitante d'Entresto avec ces substances (voir «Mises en garde et précautions»).
Anti-inflammatoires non stéroïdiens (AINS) y compris inhibiteurs sélectifs de cyclooxygénase-2 (inhibiteurs de la COX-2): Chez les patients âgés, les patients présentant une déplétion volémique (y compris les patients sous diurétiques) ou les patients dont la fonction rénale est altérée, l'utilisation concomitante d'Entresto et d'AINS peut augmenter le risque de détérioration de la fonction rénale. C'est pourquoi il convient de surveiller la fonction rénale en cas d'instauration ou de modification du traitement par Entresto chez les patients traités en même temps par des AINS.
Lithium: Le potentiel d'interaction entre Entresto et le lithium n'a pas été étudié. Une augmentation réversible du lithium sérique et une toxicité ont été décrites sous administration concomitante de lithium et d'inhibiteurs de l'ECA ou d'antagonistes des récepteurs de l'angiotensine II. C'est pourquoi il est recommandé de surveiller étroitement le lithium sérique en cas d'utilisation concomitante avec Entresto. L'utilisation concomitante d'un diurétique peut encore augmenter le risque de toxicité au lithium.
Transporteurs: Les métabolites actifs du sacubitril (LBQ657) et du valsartan sont des substrats d'OATP1B1, OATP1B3, OAT1 et OAT3; le valsartan est d'ailleurs un substrat de MRP2. C'est pourquoi l'administration concomitante d'Entresto avec des inhibiteurs d'OATP1B1, OATP1B3, OAT3 (par ex. rifampicine/rifampine, cyclosporine), OAT1 (par ex. ténofovir, cidofovir) ou MRP2 (par ex. ritonavir) peut augmenter l'exposition systémique au LBQ657 ou au valsartan. Il convient de faire preuve de prudence lors de l'initiation ou de l'arrêt d'un traitement concomitant avec ces principes actifs.
Pas d'interactions significatives
Aucune interaction médicamenteuse cliniquement significative n'a été observée lors de l'administration concomitante d'Entresto et de furosémide, digoxine, warfarine, hydrochlorothiazide, amlodipine, metformine, oméprazole, carvédilol, nitroglycérine intraveineuse ou lévonorgestrel/éthinylestradiol en combinaison. Aucune interaction avec l'aténolol, l'indométhacine, le glyburide ou la cimétidine n'est attendue.
Interactions liées au CYP-450: Les études in vitro du métabolisme indiquent que le potentiel d'interactions médicamenteuses reposant sur le CYP-450 est faible en raison de la faible métabolisation d'Entresto par les enzymes CYP-450. Entresto n'a ni un effet inducteur, ni un effet inhibiteur sur les enzymes CYP-450.
Grossesse/Allaitement
Femmes en âge de procréer
Les femmes en âge de procréer doivent utiliser une méthode de contraception pendant le traitement par Entresto et jusqu'à une semaine après la dernière dose.
Grossesse
Comme d'autres principes actifs ayant un effet direct sur le SRAA, Entresto ne doit pas être utilisé pendant la grossesse (voir «Contre-indications»). Entresto agit entre autres par un antagonisme de l'angiotensine II; on ne peut donc exclure un risque pour le fœtus. En cas de prise de valsartan pendant la grossesse, des altérations du fœtus en développement (par ex. avortement spontané, oligoamnios et altération de la fonction rénale chez le nouveau-né) ont été rapportées. Dans certaines études expérimentales sur des animaux, une toxicité de reproduction a été observée (voir «Données précliniques»). En cas de grossesse survenant pendant le traitement, il faut arrêter Entresto dès que possible.
Allaitement
On ignore si Entresto passe dans le lait maternel. Les composants d'Entresto, le sacubitril et le valsartan, ont été excrétés dans le lait de rates allaitantes (voir «Données précliniques»). En raison du risque potentiel d'effets indésirables chez les nouveau-nés/nourrissons allaités, l'utilisation d'Entresto est déconseillée pendant l'allaitement.
Fertilité
Aucune donnée n'est disponible concernant l'effet d'Entresto sur la fertilité humaine. Dans des études chez des rats mâles et femelles, aucune altération de la fertilité n'a été observée (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude n'a été réalisée à ce sujet. Il convient d'être prudent en cas de conduite de véhicules ou d'utilisation de machines, des vertiges ou de la fatigue peuvent se présenter suite à la prise de la préparation.
Effets indésirables
La sécurité d'Entresto chez les patients atteints d'insuffisance cardiaque chronique a été évaluée dans l'étude pivot de phase 3 PARADIGM-HF, qui a comparé des patients traités par Entresto 200 mg deux fois par jour (n=4203) ou par énalapril 10 mg (n=4229). Les patients recevant Entresto ont été traités pendant une période maximale de 4,3 ans, avec une durée médiane d'exposition de 24 mois; 3271 patients ont été traités pendant plus d'une année.
L'arrêt du traitement en raison d'un effet indésirable pendant la phase en double aveugle de l'étude PARADIGM-HF est survenu chez 450 patients sous Entresto (10,71%) et 516 patients sous énalapril (12,20%). Les événements les plus fréquemment associés à une adaptation de la posologie ou un arrêt du traitement étaient l'hypotension, l'hyperkaliémie et l'insuffisance rénale.
L'incidence globale des effets indésirables du médicament (EIM) d'Entresto chez les patients souffrant d'insuffisance cardiaque était comparable à celle observée avec l'énalapril. Le profil des EIM correspond aux propriétés pharmacologiques d'Entresto et aux maladies sous-jacentes des patients.
La fréquence globale des effets indésirables était indépendante du sexe, de l'âge ou de l'origine ethnique.
Les effets indésirables sont classés selon le système de classification par organe et au sein de chaque classe par ordre décroissant de fréquence, selon la convention suivante: Très fréquent (≥1/10); fréquent (≥1/100, <1/10); peu fréquent (≥1/1000, <1/100); rare (≥1/10'000, <1/1000), très rare (<1/10'000), y compris les cas isolés. Dans chaque catégorie de fréquence, les effets indésirables sont classés par ordre décroissant de gravité.
Affections hématologiques et du système lymphatique
Fréquent: anémie.
Troubles du métabolisme et de la nutrition
Très fréquent: Hyperkaliémie.
Fréquent: Hypokaliémie, hypoglycémie.
Affections du système nerveux
Fréquent: Vertiges, céphalées.
Peu fréquent: Vertige orthostatique.
Affections de l'oreille et du labyrinthe
Fréquent: Vertige.
Affections vasculaires
Très fréquent: Hypotension.
Fréquent: Syncope, hypotension orthostatique.
Affections respiratoires, thoraciques et médiastinales
Fréquent: Toux.
Affections gastro-intestinales
Fréquent: Diarrhée, nausées.
Affections de la peau et du tissu sous-cutané
Peu fréquent: Angio-œdèmes, prurit, éruption cutanée.
Affections du rein et des voies urinaires
Très fréquent: Altération de la fonction rénale.
Fréquent: Insuffisance rénale (insuffisance rénale, insuffisance rénale aiguë).
Affections du système immunitaire
Peu fréquent: Hypersensibilité (y compris anaphylaxie).
Troubles généraux et anomalies au site d'administration
Fréquent: Fatigue, asthénie.
Tableau 1: Effets indésirables du médicament dans l'étude PARADIGM-HF, population de sécurité
| Effets indésirables du médicament | Entresto 200 mg deux fois par jour (%)* | ENALAPRIL 10 mg deux fois par jour (%)* | Catégorie de fréquence |
|---|---|---|---|
Affections hématologiques et du système lymphatique | |||
Anémie | 4,00 | 4,75 | Fréquent |
Troubles du métabolisme et de la nutrition | |||
| Hyperkaliémie** | 11,61 | 14,00 | Très fréquent |
| Hypokaliémie | 3,31 | 2,53 | Fréquent |
Affections du système nerveux | |||
| Vertiges | 6,33 | 4,87 | Fréquent |
| Vertige orthostatique | 0,57 | 0,28 | Peu fréquent |
| Céphalée | 2,45 | 2,51 | Fréquent |
Affections de l'oreille et du labyrinthe | |||
| Vertige | 1,45 | 1,40 | Fréquent |
Affections vasculaires | |||
| Hypotension | 17,61 | 11,97 | Très fréquent |
| Syncope | 2,24 | 2,70 | Fréquent |
| Hypotension orthostatique | 1,52 | 0,80 | Fréquent |
Affections respiratoires, thoraciques et médiastinales | |||
| Toux | 8,78 | 12,60 | Fréquent |
Affections gastro-intestinales | |||
| Diarrhée | 4,62 | 4,47 | Fréquent |
| Nausées | 2,09 | 2,36 | Fréquent |
Affections de la peau et du tissu sous-cutané | |||
| Angio-œdèmes | 0,45 | 0,24 | Peu fréquent |
Affections du rein et des voies urinaires | |||
| Insuffisance rénale | 10,14 | 11,52 | Très fréquent |
| Défaillance rénale (insuffisance rénale, défaillance rénale aiguë) | 4,76 | 5,30 | Fréquent |
Troubles généraux et anomalies au site d'administration | |||
| Fatigue | 2,97 | 3,05 | Fréquent |
| Asthénie | 2,09 | 1,84 | Fréquent |
* Population de sécurité.
** Les événements indésirables associés à l’hyperkaliémie ont été rapportés chez 11,9% des patients traités par Entresto par rapport à 14,3% des patients traités par énalapril (voir «Effets indésirables»).
Fonction cognitive
La néprilysine est l'une des nombreuses enzymes prenant part à la clairance de la bêta-amyloïde (Aβ) du cerveau et du liquide céphalo-rachidien (LCR). L'administration de 400 mg d'Entresto une fois par jour pendant 2 semaines chez des sujets sains n'a entraîné aucune modification de la concentration d'Aβ 1-40 et 1-42 dans le LCR, mais s'est accompagnée d'une augmentation de l'Aβ 1-38 dans le LCR par rapport au placebo. La pertinence clinique de cette découverte est inconnue (voir «Propriétés/Effets»). Dans l'étude PARADIGM-HF, l'incidence globale d'événements indésirables liés à la démence a été faible et comparable d'un groupe de traitement à l'autre (0.3% dans le groupe Entresto et 0.4% dans le groupe Énalapril). Aucune analyse prospective spécifique de la fonction cognitive n'a été entreprise. Des patients avec trouble cognitif léger (MCI [mild cognitive impairment]) ou avec démence existante n'ont pas été séparément étudiés.
L'effet potentiel d'Entresto sur la fonction cognitive et le dépôt de bêta-amyloïde dans le cerveau est actuellement évalué dans des études chez des patients insuffisants cardiaques.
Surdosage
Chez l'être humain, des données limitées sont disponibles sur le surdosage d'Entresto chez des sujets. L'administration unique de 1200 mg et l'administration répétée de 900 mg (14 jours) d'Entresto ont été étudiées chez des volontaires sains. Ces administrations ont été bien tolérées.
En raison de l'effet antihypertenseur d'Entresto, l'hypotension est le symptôme le plus probable d'un surdosage. Il convient d'instaurer un traitement symptomatique.
En raison d'une liaison importante aux protéines, il est peu probable qu'Entresto puisse être éliminé par hémodialyse.
Propriétés/Effets
Code ATC: C09DX04
Mécanisme d'action
Entresto contient un complexe sodique composé de sacubitril et de valsartan. LBQ657 est le métabolite actif du sacubitril; il inhibe la néprilysine (endopeptidase neutre, NEP). Le valsartan bloque le récepteur de l'angiotensine II type 1 (AT1). La combinaison de ces deux inhibiteurs est appelée inhibiteur du récepteur de l'angiotensine et de la néprilysine (ARNI - angiotensin receptor-neprilysin inhibitor).
Les effets cardiovasculaires et rénaux d'Entresto chez les patients insuffisants cardiaques s'expliquent par un mécanisme d'action double: D'une part, l'inhibition de la dégradation des peptides (par exemple les peptides natriurétiques, PN) par l'inhibiteur de la néprilysine LBQ657 entraîne leur accumulation et, d'autre part, le valsartan inhibe les effets nocifs de l'angiotensine II. Les PN agissent en activant les récepteurs membranaires couplés au système guanylate cyclase, ce qui entraîne une augmentation des concentrations de guanosine monophosphate cyclique (cGMP) en tant que «second messenger» (second messager). Ceci favorise à son tour une vasodilatation, une natriurèse et une diurèse, augmente le débit de filtration glomérulaire et le débit sanguin rénal, inhibe la libération de rénine et d'aldostérone, réduit l'activité sympathique et induit des effets antihypertrophiques et antifibrotiques. Une activation durable du système rénine-angiotensine-aldostérone entraîne une vasoconstriction, une rétention rénale hydrosodée, une activation de la croissance et de la prolifération cellulaires et, par la suite, des processus de remodelage cardiovasculaire mal adaptés. Le valsartan inhibe les effets néfastes cardiovasculaires et rénaux de l'angiotensine II en bloquant sélectivement le récepteur AT1, inhibant par ailleurs la libération d'aldostérone dépendante de l'angiotensine II.
Propriétés pharmacodynamiques
Les effets pharmacodynamiques d'Entresto ont été étudiés après l'administration de doses uniques et multiples chez des sujets sains et des patients insuffisants cardiaques. Ils correspondent à une inhibition de la néprilysine couplée à un blocage du SRAA. Dans le cadre d'une étude de sept jours contrôlée contre valsartan chez des patients avec une fraction d'éjection (HFrEF) réduite, Entresto a entraîné une augmentation significative, non continue, de la natriurèse, une élévation de la cGMP dans l'urine et une baisse du MR-proANP et du NT-proBNP dans le plasma par rapport au valsartan. Dans le cadre d'une étude de 21 jours chez des patients atteints de HFrEF, Entresto a augmenté l'ANP et la cGMP dans l'urine et la cGMP dans le plasma, réduisant le NT-proBNP, l'aldostérone et l'endothéline 1 dans le plasma par rapport aux valeurs initiales. En outre, Entresto a bloqué le récepteur AT1, comme le montrent l'augmentation de l'activité rénine plasmatique et les taux plasmatiques de rénine élevés. Dans le cadre de l'étude PARADIGM-HF, Entresto a réduit le NT-proBNP dans le plasma, augmentant le BNP dans le plasma et la cGMP dans l'urine par rapport à l'énalapril. Alors que le BNP est un substrat de la néprilysine, le NT-proBNP ne l'est pas.
Le BNP n'est donc pas un biomarqueur adapté pour surveiller l'insuffisance cardiaque chez les patients traités par Entresto (voir «Mises en garde et précautions»). Le NT-proBNP n'est pas un substrat de la néprilysine et convient donc mieux comme biomarqueur.
Dans une étude clinique spécialement conçue dans cette optique chez des hommes sains, l'administration unique de 400 mg et 1200 mg d'Entresto n'a eu aucun effet sur la repolarisation cardiaque.
La néprilysine est l'une des nombreuses enzymes prenant part à la clairance de la bêta-amyloïde (Aβ) du cerveau et du liquide céphalo-rachidien (LCR). L'administration de 400 mg d'Entresto une fois par jour pendant 2 semaines chez des sujets sains n'a entraîné aucune modification de la concentration d'Aβ 1-40 et 1-42 dans le LCR, mais s'est accompagnée d'une augmentation de l'Aβ 1-38 dans le LCR par rapport au placebo. La signification clinique de ces résultats est inconnue (voir «Données précliniques»), les changements structurels et fonctionnels du SNC n'ayant pas été étudiés. Les effets potentiels d'Entresto sur la fonction cognitive et le dépôt de bêta-amyloïde dans le cerveau seront évalués dans une étude chez des patients insuffisants cardiaques.
Efficacité clinique
PARADIGM-HF
PARADIGM-HF était une étude randomisée multinationale en double aveugle comparant Entresto à l'énalapril chez 8442 patients. Les médicaments ont été administrés à des patients adultes atteints d'insuffisance cardiaque chronique (classe NYHA II à IV) et de dysfonction systolique (fraction d'éjection du ventricule gauche ≤40%) en complément d'autres traitements (>90% de bêtabloquants, env. 80% de diurétiques, env. 50% d'antagonistes des minéralocorticoïdes). Le critère d'évaluation primaire composite était constitué du décès d'origine cardiovasculaire (CV) et de l'hospitalisation pour cause d'insuffisance cardiaque (IC).
Avant l'inclusion dans l'étude, les patients étaient bien contrôlés par un traitement correspondant à la prise en charge standard, notamment inhibiteurs de l'ECA/ARA (>99%), bêtabloquants (94%), antagonistes des minéralocorticoïdes (58%) et diurétiques (83%). La durée d'observation médiane était de 27 mois et les patients ont été traités pendant 4,3 ans au maximum. Les patients avec une TA systolique <100 mmHg n'ont pas été inclus dans l'étude.
Les patients devaient arrêter leur traitement actuel par inhibiteur de l'ECA ou ARA et ont été inclus dans une phase d'amorce séquentielle en simple aveugle pendant laquelle ils étaient traités par Énalapril 10 mg deux fois par jour. La suite du traitement s'est faite avec une dose de 100 mg d'Entresto deux fois par jour, augmentée à 200 mg deux fois par jour après 1 à 2 semaines. Les patients qui toléraient bien les traitements d'amorce ont ensuite été randomisés pour recevoir soit Entresto, soit l'énalapril. Dans la phase en double aveugle de l'étude, les patients recevaient 200 mg d'Entresto ou 10 mg d'énalapril deux fois par jour (Entresto [n=4209]; énalapril [n=4233]).
L'âge moyen du collectif de patients étudié était de 64 ans; 19% avaient 75 ans ou plus. Lors de la randomisation, 70% des patients ont été classés NYHA II et 25% NYHA III/IV.
Dans le groupe sous Entresto, 76% des patients ont reçu jusqu'à la fin de l'étude la dose cible de 200 mg deux fois par jour (dose quotidienne moyenne 375 mg). Dans le groupe sous énalapril, 75% des patients ont reçu jusqu'à la fin de l'étude la dose cible de 10 mg deux fois par jour (dose quotidienne moyenne 18,9 mg).
Entresto a réduit de manière statistiquement significative le risque de décès d'origine cardiovasculaire ou hospitalisation pour cause d'insuffisance cardiaque par rapport à énalapril, de 20% (hazard ratio [HR]: 0,80, IC à 95% [0,73-0,87]). La réduction absolue du risque était de 4,69%. Cet effet a été observé rapidement et s'est maintenu sur toute la durée de l'étude. Une réduction statistiquement significative des décès d'origine cardiovasculaire et de la première hospitalisation pour cause d'insuffisance cardiaque a été observée (décès cause CV: RRR 20%, HR 0,80; IC à 95% [0,71-0,89], 3,13% de réduction absolue du risque; hospitalisation pour cause insuffisance cardiaque: RRR 21%; HR 0,79; IC à 95 [0,71-0,89], réduction absolue du risque 2,80%); cf. tableau 1. La mort subite cardiaque était la cause de 45% des décès pour cause CV. Cette valeur était réduite de 20% chez les patients sous Entresto par rapport à ceux sous énalapril (HR 0,80; IC à 95% [0,68; 0,94]). La défaillance cardiaque a contribué à 26% des décès d'origine CV. Cette valeur était réduite de 21% chez les patients sous Entresto par rapport à ceux sous énalapril (HR 0,79; IC à 95% [0,64; 0,98]).
Cette réduction du risque a été observée de façon cohérente et homogène dans les différents sous-groupes, incluant l'âge, le sexe, l'origine ethnique, l'origine géographique, la classe NYHA, la fraction d'éjection, la fonction rénale, le diabète ou l'hypertension à l'anamnèse, le traitement antérieur pour insuffisance cardiaque et la fibrillation atriale.
En outre, Entresto a réduit de manière significative la mortalité toutes causes confondues par rapport à l'énalapril, de 16% (RRR 16%, HR 0,84; IC à 95% [0,76-0,93]) (Tableau 12-1). La réduction absolue du risque était de 2,84%.
Tableau 2: Effet du traitement concernant le critère d'évaluation primaire composite, ses composantes et la mortalité toutes causes confondues
| Entresto N=4187# n (%) | Enalapril N=4212# n (%) | Hazard Ratio (IC à 95%) | Réduction relative du risque | Réduction absolue du risque | |
| Critère d'évaluation primaire composite constitué du décès d'origine CV et de l'hospitalisation pour cause d'insuffisance cardiaque* | 914 (21,83) | 1117 (26,52) | 0,80 (0,73-0,87) | 20% | 4,69% |
Composantes individuelles du critère d'évaluation primaire composite | |||||
| Décès d'origine CV** | 558 (13,33) | 693 (16,45) | 0,80 (0,71-0,89) | 20% | 3,13% |
| Première hospitalisation pour cause d'insuffisance cardiaque | 537 (12,83) | 658 (15,62) | 0,79 (0,71-0,89) | 21% | 2,80% |
Critère d'évaluation secondaire | |||||
| Mortalité toutes causes confondues | 711 (16,98) | 835 (19,82) | 0,84 (0,76-0,93) | 16% | 2,84% |
* Le critère d'évaluation primaire était défini comme le comme le délai de survenue du premier événement.
** Les décès d'origine CV comprennent tous les patients décédés jusqu'à la date limite, qu'ils aient été hospitalisés ou non.
# Population d'analyse complète.
Illustration 0: Courbes de Kaplan-Meier pour le critère d'évaluation primaire composite et la composante «Décès d'origine CV»

Un faible nombre de patients a présenté une détérioration des symptômes d'IC selon le questionnaire KCCQ (Kansas City Cardiomyopathy Questionnaire), notamment la dyspnée, l'épuisement et les restrictions physiques, par rapport à l'énalapril.
Pharmacocinétique
Absorption
Après administration orale, Entresto se dissocie en sacubitril, qui est métabolisé en LBQ657, et en valsartan. Les concentrations plasmatiques maximales respectives sont atteintes après 0,5 heures, 2 heures et 1,5 heure. La biodisponibilité orale absolue de sacubitril et de valsartan est estimée à ≥60% et 23% respectivement.
Le valsartan contenu dans Entresto présente une biodisponibilité plus élevée que le valsartan dans d'autres formulations de comprimés commercialisées; 25,7 mg, 51,4 mg et 102,8 mg de valsartan dans Entresto correspondent à respectivement 40 mg, 80 mg et 160 mg de valsartan dans d'autres formulations de comprimés disponibles sur le marché.
Après administration deux fois par jour d'Entresto, les taux à l'état d'équilibre de sacubitril, LBQ657 et valsartan sont atteints après 3 jours. À l'état d'équilibre, il n'y a pas d'accumulation significative de sacubitril et de valsartan, mais l'accumulation du LBQ657 est multipliée par 1,6.
L'administration d'Entresto avec des aliments n'a pas d'influence cliniquement significative sur l'exposition systémique au sacubitril, au LBQ657 et au valsartan. Même si l'administration d'Entresto avec des aliments entraîne une réduction de l'exposition au valsartan, cette réduction n'est pas associée à une baisse cliniquement significative de l'effet thérapeutique. Entresto peut donc s'administrer indépendamment des repas.
Distribution
Entresto se lie dans une mesure importante aux protéines plasmatiques (94% à 97%). Une comparaison de l'exposition dans le plasma et le LCR a montré que le LBQ657 traverse la barrière hémato-encéphalique dans une faible mesure (0,28%). Le volume de distribution apparent d'Entresto se situe entre 107,8 l et 157,4 l.
Métabolisme
Le sacubitril est transformé rapidement en LBQ657 par l'activité des estérases, LBQ657 n'étant quant à lui pas métabolisé dans une mesure significative. Le valsartan est à peine métabolisé, puisque seuls 20% de la dose environ sont retrouvés en tant que métabolites. Un métabolite hydroxyl a été identifié dans le plasma à une concentration faible (<10%). La métabolisation du sacubitril et du valsartan ne se faisant que dans une faible mesure via le système enzymatique CYP-450, l'administration concomitante de principes actifs ayant une influence sur le système enzymatique CYP-450 ne devrait pas avoir d'effet sur la pharmacocinétique.
Élimination
Après administration orale, le sacubitril est éliminé dans l'urine à 52-68% (principalement sous forme de LBQ657), le valsartan et ses métabolites l'étant à ~13%; 37-48% du sacubitril (principalement sous forme de LBQ657) et 86% du valsartan et de ses métabolites sont excrétés dans les fèces.
Le sacubitril, le LBQ657 et le valsartan sont éliminés du plasma avec une demi-vie d'élimination moyenne (T½) d'env. 1,43 heure, 11,48 heures et 9,90 heures respectivement.
Linéarité/non-linéarité
La pharmacocinétique du sacubitril, du LBQ657 et du valsartan est linéaire dans la plage de doses étudiée (50-400 mg d'Entresto).
Groupes de patients particuliers
Patients âgés (plus de 65 ans)
L'exposition au LBQ657 et au valsartan est supérieure de 42% et 30% respectivement chez les patients âgés. Cependant, cette augmentation n'est pas associée à des effets cliniquement pertinents et par conséquent, aucune adaptation posologique n'est nécessaire.
Enfants et adolescents (≥18 ans)
Entresto n'a pas été étudié chez les enfants et les adolescents.
Insuffisance rénale
Une corrélation a été observée entre la fonction rénale et l'exposition systémique au LBQ657, mais pas au valsartan. Chez les patients atteints d'insuffisance rénale légère (60 ml/min/1,73 m² ≤ eGFR <90 ml/min/1,73 m²) à modérée (30 ml/min/1,73 m2 ≤ eGFR <60 ml/min/1,73 m2), l'ASC du LBQ657 était multipliée par 2. Aucune adaptation posologique n'est nécessaire chez les patients atteints d'insuffisance rénale légère ou modérée. Une augmentation de l'ASC du LBQ657 de 2,7 fois a été observée chez les patients atteints d'insuffisance rénale sévère (eGFR <30 ml/min/1,73 m2). Chez ces patients, il est recommandé de commencer par une dose initiale de 50 mg. Il convient de faire preuve de prudence en administrant Entresto à ce groupe de patients.
Entresto est contre-indiqué chez les patients avec eGFR <10 ml/min/1,73 m2 (voir «Contre-indications»).
Aucune étude n'a été réalisée chez les patients dialysés. Cependant, puisque le LBQ657 et le valsartan se lient dans une mesure importante aux protéines plasmatiques, il est peu probable qu'une dialyse les élimine efficacement.
Insuffisance hépatique
Chez les patients atteints d'insuffisance hépatique légère et modérée, l'exposition au sacubitril a été multipliée par 1,5 et 3,4, au LBQ657 par 1,5 et 1,9 et au valsartan par 1,2 et 2,1, respectivement, par rapport aux sujets sains appariés. Aucune adaptation posologique d'Entresto n'est nécessaire chez les patients atteints d'insuffisance hépatique légère (classe A de Child-Pugh) y compris chez les patients atteints de maladies obstructives biliaires. Chez les patients atteints d'insuffisance hépatique modérée (classe B de Child-Pugh), les expériences cliniques étant limitées, il est recommandé de commencer par une dose de 50 mg deux fois par jour.
Entresto n'a pas été étudié chez les patients avec une fonction hépatique gravement limitée. L'utilisation est donc déconseillée chez les patients atteints d'insuffisance hépatique sévère.
Groupes ethniques
La pharmacocinétique d'Entresto (sacubitril, LBQ657 et valsartan) est comparable chez divers groupes ethniques (blancs, noirs, asiatiques, japonais et autres).
Sexe
La pharmacocinétique d'Entresto (sacubitril, LBQ657 et valsartan) est comparable chez les hommes et les femmes.
Données précliniques
Les études précliniques portant sur la sécurité d'Entresto incluaient une évaluation de la pharmacologie de sécurité, de la toxicité en administration répétée, de la génotoxicité, de la cancérogénicité et de la toxicité sur la reproduction et le développement.
Cancérogénicité, mutagenèse et toxicité génétique
Les études de cancérogénicité chez le rat et la souris avec le sacubitril et le valsartan n'ont pas révélé de potentiel cancérigène pour Entresto. Les doses de sacubitril étudiées (dose élevée de 1200 et 400 mg/kg/jour chez la souris et le rat) correspondaient environ à 29 et 19 fois la dose maximale recommandée pour l'être humain (MRHD, maximum recommended human dose) en mg/m2. Les doses de valsartan étudiées (dose élevée de 160 et 200 mg/kg/jour chez la souris et le rat) correspondaient environ à 4 et 10 fois la dose maximale recommandée pour l'être humain en mg/m2.
Dans des études de mutagénicité (test d'Ames) et de clastogénicité (aberration chromosomique (test de micronoyaux in vitro et in vivo sur lymphocytes de sang humain périphérique ou sur cellules CHO [chinese hamster ovary (ovaire de hamster chinois)]) avec Entresto, le sacubitril et le valsartan n'ont révélé aucun effet, que ce soit au niveau génétique ou chromosomique.
Fertilité, reproduction et développement
Entresto n'a eu aucun effet sur la fertilité ou le développement embryonnaire précoce à une dose pouvant atteindre 150 mg/kg/jour (≤1,0 fois et ≤0,18 fois la MRHD sur la base de l'ASC du valsartan et de LBQ657).
Le traitement par Entresto pendant l'organogenèse a entraîné une augmentation de la létalité embryo-fœtale à des doses ≥100 mg/kg/jour (≤0,72 fois la MRHD sur la base de l'ASC) chez le rat et à des doses ≥10 mg/kg/jour (2 fois et 0,03 fois la MRHD sur la base de l'ASC du valsartan et du LBQ657) chez le lapin. Sur la base d'une incidence faible d'hydrocéphalie fœtale associée à des doses toxiques maternelles, observée chez le lapin à une dose ≥10 mg/kg/jour, Entresto est tératogène.
Chez le lapin, un traitement par sacubitril associé à des doses toxiques maternelles (500 mg/kg/jour; 5,7 fois la MRHD sur la base de l'ASC du LBQ657) pendant l'organogenèse a entraîné une létalité et une toxicité embryo-fœtales (diminution du poids fœtal et retard de l'ossification fœtale). Le sacubitril n'a pas d'effet tératogène chez le rat et le lapin. Chez les rats traités par sacubitril, il n'y a pas eu d'indices de toxicité ou de tératogénicité embryo-fœtale. Le No-observed-adverse-effect level (NOAEL) embryo-fœtal pour le sacubitril était d'au moins 750 mg/kg/jour chez le rat et de 200 mg/kg/jour chez le lapin (2,2 fois la MRHD sur la base de l'ASC du LBQ657).
Des études de développement prénatal et postnatal chez le rat à des doses de sacubitril jusqu'à 750 mg/kg/jour (2,2 fois la MRHD sur la base de l'ASC) et à des doses jusqu'à 600 mg/kg/jour (0,86 fois la MRHD sur la base de l'ASC) portent à conclure qu'un traitement par Entresto pendant l'organogenèse, la gravidité et la phase de lactation peut avoir une influence sur le développement et la survie de la progéniture.
Autres résultats précliniques
L'effet d'Entresto sur les concentrations de bêta-amyloïde dans le liquide céphalo-rachidien (LCR) et le tissu cérébral a été évalué chez des jeunes singes cynomolgus (2 à 4 ans) traités pendant deux semaines par Entresto (50 mg/kg/jour). Dans cette étude, Entresto a eu chez les singes cynomolgus un effet pharmacodynamique sur la clairance de l'Aβ du LCR, ce qui a entraîné une élévation de l'Aβ 1-40, 1-42 et 1-38 dans le LCR; aucune élévation correspondante de l'Aβ dans le cerveau n'a été observée. En outre, dans une étude de toxicologie chez des singes cynomolgus traités pendant 39 semaines avec 300 mg d'Entresto/kg/jour (donnant lieu à une exposition systémique supérieure que celle atteinte sous 200 mg BID chez l'être humain), il n'y a pas eu d'accumulation de bêta-amyloïde dans le cerveau.
Chez les rats juvéniles (post-partum, jours 7 à 70) traités par sacubitril, il y a eu réduction du développement de masse osseuse et de l'allongement des os liés à l'âge. Une étude chez des rats adultes n'a révélé qu'une altération transitoire minimale de la densité minérale osseuse; d'autres paramètres pertinents pour la croissance osseuse n'étaient pas influencés.
Remarques particulières
Remarques concernant le stockage
Conserver dans l'emballage original, à l'abri de l'humidité et pas au-dessus de 30 °C.
Conserver les médicaments hors de la portée des enfants.
Précautions spéciales d'élimination
Tout produit non utilisé ou tout produit résiduel doit être éliminé dans les règles conformément aux exigences locales en vigueur.
Numéro d’autorisation
65673 (Swissmedic).
Titulaire de l’autorisation
Novartis Pharma Schweiz AG, Risch; Domicile: 6343 Rotkreuz.
Mise à jour de l’information
Avril 2018.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


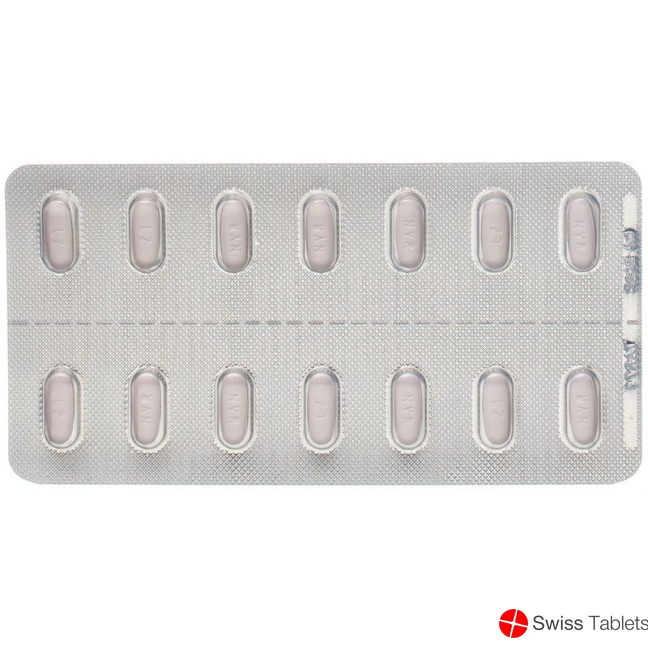
 Deutsch
Deutsch French
French Italian
Italian