Aerius Filmtabl 5 mg 90 pcs
Aerius Filmtabl 5 mg 90 Stk
-
86.52 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: MERCK SHARP & DOHME AG
- Product Code: 6286753
- ATC-code R06AX27
- EAN 7680556890015
Ingredients:
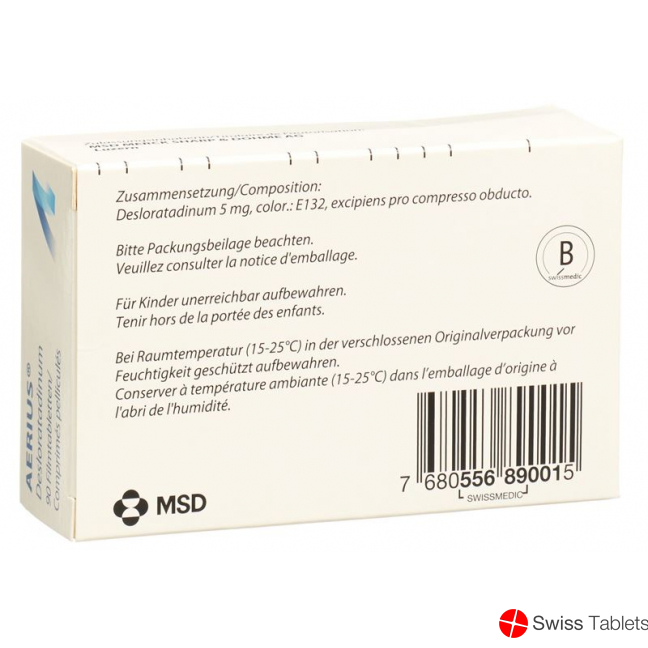
Titandioxid (E171), Indigocarmin (E132), Desloratadin 5 mg .

Variants
Aerius Filmtabletten 5mg 10 Stück
29.10 CHF
Aerius Filmtabletten 5mg 30 Stück
35.25 CHF
Description
Was ist Aerius und wann wird es angewendet?
Aerius verbessert die Symptome bei allergischer Rhinitis (beispielsweise Heuschnupfen), wie Niesen, laufende oder juckende Nase, verstopfte Nase, Juckreiz am Gaumen und juckende, gerötete oder tränende Augen.
Aerius wird ebenfalls zur Behandlung von Symptomen im Zusammenhang mit Nesselfieber (eine Hauterkrankung, die durch eine Allergie verursacht wird) angewendet. Zu diesen Symptomen gehören Juckreiz und Nesselausschlag.
Aerius darf nur auf Verschreibung des Arztes bzw. der Ärztin verwendet werden.
Wann darf Aerius nicht eingenommen/angewendet werden?
Aerius darf nicht angewendet werden bei Überempfindlichkeit gegenüber Desloratadin oder Loratadin, oder einem der sonstigen Bestandteile von Aerius.
Kinder unter 12 Jahren sollen Aerius Filmtabletten nicht einnehmen.
Die Sicherheit von Aerius Lösung zum Einnehmen wurde bei Kindern unter 6 Monaten bisher nicht nachgewiesen.
Wann ist bei der Einnahme/Anwendung von Aerius Vorsicht geboten?
Es liegen keine Daten vor für Aerius bei Patienten mit Nieren- und Lebererkrankungen.
Aerius beeinträchtigt in der Regel die Leistungs- und Konzentrationsfähigkeit nicht. Es wird jedoch empfohlen, sich nicht an Aktivitäten zu beteiligen, die geistige Wachsamkeit erfordern, wie z.B. Autofahren oder das Bedienen von Maschinen, bis Sie Ihre eigene Reaktion auf das Arzneimittel festgestellt haben.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie an anderen Krankheiten leiden, Allergien haben, andere Arzneimittel (auch selbstgekaufte!) einnehmen, oder eine medizinische oder familiäre Vorgeschichte von Krampfanfällen haben.
Darf Aerius während einer Schwangerschaft oder in der Stillzeit eingenommen/angewendet werden?
Wenn Sie schwanger sind oder stillen, sollten Sie Aerius nicht einnehmen.
Sprechen Sie mit Ihrem Arzt bzw. Ihrer Ärztin, wenn Sie schwanger sind, es werden möchten oder ein Kind stillen.
Wie verwenden Sie Aerius?
Filmtabletten:
Erwachsene und Jugendliche ab 12 Jahren:
Eine Aerius 5 mg Filmtablette einmal täglich einnehmen.
Die Filmtablette ganz (unzerkaut) mit Wasser schlucken.
Aerius Filmtabletten können unabhängig von den Mahlzeiten eingenommen werden.
Lösung zum Einnehmen:
Kinder von 6-11 Monaten: 2 ml Lösung (Markierung 2 ml des weissen Messlöffels) einmal täglich einnehmen.
Kinder von 1-5 Jahren: 2,5 ml Lösung (½ Messlöffel, farblos) einmal täglich einnehmen.
Kinder von 6-11 Jahren: 5 ml Lösung (einen Messlöffel, farblos) einmal täglich einnehmen.
Erwachsene und Kinder ab 12 Jahren: 10 ml Lösung (zwei Messlöffel, farblos) einmal täglich einnehmen.
Nach der Einnahme der Lösung sollen Sie etwas Wasser trinken. Aerius Lösung kann unabhängig von den Mahlzeiten eingenommen werden.
Nehmen Sie Aerius so lange ein, wie es Ihnen Ihr Arzt bzw. Ihre Ärztin verordnet hat.
Wenn Sie mehr Aerius eingenommen haben als Sie sollten, wenden Sie sich unverzüglich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin.
Wenn Sie die Einnahme von Aerius vergessen haben, nehmen Sie keine doppelte Dosis ein, um vergessene Einzeldosen nachzuholen, sondern folgen Sie dem normalen Behandlungsschema und nehmen Sie die nächste Dosis dann ein.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Aerius haben?
Folgende Nebenwirkungen können bei der Einnahme von Aerius auftreten:
Häufig (kann bis zu 1 von 10 Patienten betreffen): Müdigkeit; gelegentlich: Kopfschmerzen und Mundtrockenheit.
Sehr selten: schwere allergische Reaktionen (Schwierigkeiten beim Atmen, pfeifende Atmung) und Hautausschlag, Herzrasen, Herzklopfen, unregelmässiger Herzschlag, Übelkeit, Magenschmerzen, Erbrechen, Magenverstimmung, Durchfall, Schwindel, Halluzinationen, Schläfrigkeit, Unruhe verbunden mit vermehrten Körperbewegungen, Krampfanfälle, Muskelschmerzen, Leberentzündung und Störungen der Leberfunktion.
Nebenwirkung mit unbekannter Häufigkeit (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar): gesteigerter Appetit.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Die Arzneimittel sollen ausserhalb der Reichweite von Kindern und bei Raumtemperatur (15-25 °C) aufbewahrt werden.
Die Arzneimittel dürfen nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Die Filmtabletten in der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Aerius enthalten?
1 Aerius Filmtablette enthält 5 mg Desloratadin als Wirkstoff und Hilfsstoffe sowie den Farbstoff E132 (Indigotin).
1 ml Aerius Lösung zum Einnehmen enthält 0,5 mg Desloratadin als Wirkstoff; Sorbitol, Sucralose; Konservierungsmittel: Propylenglycol; Aroma: Vanillin und andere; weitere Hilfsstoffe.
Zulassungsnummer
55689, 55958 (Swissmedic).
Wo erhalten Sie Aerius? Welche Packungen sind erhältlich?
Aerius erhalten Sie in Apotheken nur gegen ärztliche Verschreibung.
Filmtabletten:
Packungen zu 10, 30 und 90 Tabletten.
Lösung zum Einnehmen:
Packung zu 120 ml, mit einem weissen Messlöffel für Kinder von 6-11 Monaten und einem farblosen Messlöffel für Kinder ab 12 Monaten und Erwachsene.
Zulassungsinhaberin
MSD MERCK SHARP & DOHME AG, Luzern.
Diese Packungsbeilage wurde im März 2018 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
S-CCDS-MK4117-MTL-112017(deletion 60ml)/ MK4117-CHE-2019-019912
Qu’est-ce que l'Aerius et quand doit-il être utilisé?
Aerius améliore les symptômes des rhinites allergiques (par exemple, le rhume des foins), tels qu'éternuements, écoulement nasal ou démangeaisons nasales, congestion nasale, démangeaisons du palais et yeux qui piquent, rouges ou larmoyants.
Aerius est également utilisé dans le traitement de symptômes associés à l'urticaire (une affection de la peau causée par une allergie). Au nombre de ces symptômes figurent des démangeaisons et une éruption cutanée.
Aerius ne peut être utilisé que sur prescription du médecin.
Quand Aerius ne doit-il pas être pris/utilisé?
Vous ne devez pas utiliser Aerius si vous êtes hypersensible à la desloratadine ou à la loratadine ou à l'un des autres composants d'Aerius.
Les enfants de moins de 12 ans ne doivent pas prendre les comprimés pelliculés d'Aerius.
La sécurité de la solution buvable d'Aerius n'a pas été établie à ce jour chez l' enfants de moins de 6 mois.
Quelles sont les précautions à observer lors de la prise/de l'utilisation d'Aerius?
On ne dispose pas de données pour Aerius chez les patients souffrant d'affections rénales et hépatiques.
En règle générale, Aerius n'affecte ni le rendement au travail ni la capacité de concentration. Il est toutefois recommandé de ne pas se livrer à des activités qui exigent une vigilance mentale, comme la conduite d'un véhicule ou l'utilisation de machines, avant d'avoir testé ses propres réactions au médicament.
Veuillez informer votre médecin ou votre pharmacien si vous souffrez d'une autre maladie, vous êtes allergique, vous prenez déjà d'autres médicaments (même en automédication) ou avez des antécédents médicaux ou familiaux de crises convulsives.
Aerius peut-il être pris/utilisé pendant la grossesse ou l’allaitement?
Vous ne pouvez pas prendre Aerius si vous êtes enceinte ou si vous allaitez.
Si vous êtes enceinte, envisagez une grossesse ou allaitez votre enfant, parlez-en à votre médecin.
Comment utiliser Aerius?
Comprimés pelliculés:
Adultes et adolescents à partir de 12 ans:
un comprimé pelliculé d'Aerius 5 mg une fois par jour.
Avaler le comprimé pelliculé en entier (sans le croquer) avec de l'eau.
Les comprimés pelliculés d'Aerius peuvent être pris indépendamment des repas.
Solution buvable:
Enfants de 6 à 11 mois: 2 ml de solution buvable (marque 2 ml de la mesurette blanche) une fois par jour.
Enfants de 1 à 5 ans: 2,5 ml de solution buvable (½ mesurette incolore) une fois par jour.
Enfants de 6 à 11 ans: 5 ml de solution buvable (1 mesurette incolore) une fois par jour.
Adultes et adolescents à partir de 12 ans: 10 ml de solution buvable (2 mesurettes incolores) une fois par jour.
Après avoir pris la solution buvable, vous devez boire un peu d'eau. La solution buvable d'Aerius peut être prise indépendamment des repas.
Prenez Aerius aussi longtemps que votre médecin vous l'a prescrit.
Avertissez immédiatement votre médecin ou votre pharmacien si vous avez pris plus d'Aerius que vous n'auriez dû.
Si vous avez oublié de prendre votre médicament, ne doublez pas la dose pour compenser la dose oubliée, mais poursuivez le schéma thérapeutique normal et prenez alors la dose suivante.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Aerius peut-il provoquer?
La prise d'Aerius peut provoquer les effets secondaires suivants:
Fréquents (pouvant affecter jusqu'à 1 patient sur 10): fatigue; occasionnels: maux de tête et sécheresse buccale
Très rares: réactions allergiques graves (difficultés respiratoires, respiration sifflante) et éruption cutanée, tachycardie, palpitations, battements irréguliers du cœur, nausées, maux d'estomac, vomissements, embarras gastrique, diarrhée, vertiges, hallucinations, somnolence, agitation liée à des mouvements accrus du corps, crises convulsives, douleurs musculaires, hépatite et troubles de la fonction hépatique.Effet secondaire de fréquence inconnue (fréquence ne pouvant être estimée sur la base des données disponibles): augmentation de l'appétit
Si vous remarquez des effets secondaires qui ne sont pas mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
A quoi faut-il encore faire attention?
Ces médicaments doivent être conservés hors de la portée des enfants et à température ambiante (15-25 °C).
Ces médicaments ne doivent pas être utilisés au-delà de la date figurant après la mention «EXP» sur le récipient.
Les comprimés pelliculés doivent être conservés dans leur emballage d'origine pour les protéger de l'humidité.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien qui disposent d'une information détaillée destinée aux professionnels.
Que contient Aerius?
1 comprimé pelliculé d'Aerius contient 5 mg de desloratadine en tant que principe actif, des excipients ainsi que le colorant E132 (indigotine).
1 ml de solution buvable d'Aerius contient 0,5 mg de desloratadine en tant que principe actif, sorbitol, sucralose, un agent de conservation: propylène glycol, des arômes: vanilline et autres, ainsi que d'autres excipients.
Numéro d’autorisation
55689, 55958 (Swissmedic).
Où obtenez-vous Aerius? Quels sont les emballages à disposition sur le marché?
Aerius est disponible en pharmacie, sur ordonnance médicale.
Comprimés pelliculés:
Emballages de 10, 30 et 90 comprimés.
Solution buvable:
Emballage de 120 ml, avec une mesurette blanche pour les enfants de 6 à 11 mois et une mesurette incolore pour les enfants à partir de 12 mois et les adultes.
Titulaire de l’autorisation
MSD MERCK SHARP & DOHME AG, Lucerne.
Cette notice d'emballage a été vérifiée pour la dernière fois en mars 2018 par l'autorité de contrôle des médicaments (Swissmedic).
S-CCDS-MK4117-MTL-112017(deletion 60ml)/ MK4117-CHE-2019-019912
Che cos'è Aerius e quando si usa?
Aerius allevia i sintomi della rinite allergica (ad esempio raffreddore da fieno), come starnuti, naso che cola, prurito al naso, naso intasato, prurito al palato, prurito agli occhi, occhi arrossati o lacrimanti.
Aerius è inoltre impiegato nel trattamento dei sintomi associati all'orticaria (una malattia della pelle causata da un'allergia). Di questi sintomi fanno parte il prurito e la tipica eruzione cutanea.
Aerius può essere utilizzato solo su prescrizione medica.
Quando non si può assumere/usare Aerius?
Aerius non può essere usato in caso d'ipersensibilità alla desloratadina o alla loratadina o ad uno degli altri componenti di Aerius.
I bambini sotto i 12 anni non possono assumere Aerius compresse rivestite con film.
La sicurezza di Aerius soluzione orale non è stata a tutt'oggi dimostrata nei bambini di età inferiore a 6 mesi.
Quando è richiesta prudenza nella somministrazione/nell'uso di Aerius?
Non sono disponibili dati relativi all'uso di Aerius nei pazienti affetti da malattie renali ed epatiche.
Generalmente Aerius non compromette la capacità di rendimento o di concentrazione. Si raccomanda, tuttavia, di non svolgere attività che richiedono una vigilanza mentale, quali ad esempio la guida di autoveicoli o l'uso di macchinari, fino a quando non si è stabilita la propria reazione al medicamento.
Informi il suo medico o il suo farmacista nel caso in cui soffre di altre malattie, soffre di allergie, assume o applica altri medicamenti (anche acquistati di sua iniziativa) o se ha una storia medica o familiare di convulsioni.
Si può assumere/usare Aerius durante la gravidanza o l'allattamento?
Durante la gravidanza o l'allattamento non dovrebbe assumere Aerius.
Informi il suo medico se è in stato di gravidanza o sta pianificando una gravidanza o se allatta.
Come usare Aerius?
Compresse rivestite con film:
Adulti e adolescenti dai 12 anni:
assumere una compressa rivestita con film Aerius da 5 mg una volta al giorno.
Ingerire la compressa intera (senza masticarla) con dell'acqua.
Le compresse rivestite con film Aerius possono essere assunte indipendentemente dai pasti.
Soluzione orale:
Bambini da 6 a 11 mesi: assumere 2 ml di soluzione orale (tacca da 2 ml del misurino bianco) una volta al giorno.
Bambini da 1 a 5 anni: assumere 2,5 ml di soluzione orale (½ misurino, incolore) una volta al giorno.
Bambini da 6 a 11 anni: assumere 5 ml di soluzione orale (un misurino, incolore) una volta al giorno.
Adulti e ragazzi dai 12 anni: assumere 10 ml di soluzione orale (due misurini, incolore) una volta al giorno.
Si consiglia di bere un po' d'acqua dopo aver assunto la soluzione orale.
Aerius soluzione orale può essere assunto indipendentemente dai pasti.
Assuma Aerius per tutto il tempo stabilito dal suo medico.
Se ha assunto una dose maggiore di Aerius di quanto dovuto, si rivolga immediatamente al suo medico o farmacista.
Se ha dimenticato una dose di Aerius, non assuma una dose doppia per recuperare dosi singole dimenticate, ma segua il normale schema di trattamento e assuma quindi la dose successiva al momento prescritto.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte, ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere Aerius?
Con l'assunzione di Aerius possono manifestarsi i seguenti effetti collaterali:
spesso (possono colpire 1 su 10 pazienti): stanchezza; occasionalmente: mal di testa e secchezza delle fauci.
Molto raramente: gravi reazioni allergiche (difficoltà respiratorie, respiro sibilante) ed eruzioni cutanee, tachicardia, palpitazioni, polso irregolare, nausea, mal di stomaco, vomito, disturbi di stomaco, diarrea, vertigini, allucinazioni, sonnolenza, agitazione associata ad aumentata attività fisica, convulsioni, dolori muscolari, infiammazione del fegato e disturbi della funzionalità epatica.
Effetti collaterali con frequenza non nota (frequenza non stimabile sulla base dei dati disponibili): aumentato appetito.
Se osserva effetti collaterali qui non descritti, dovrebbe informare il suo medico o il suo farmacista.
Di che altro occorre tener conto?
Conservare il medicamento al di fuori della portata dei bambini e a temperatura ambiente (15-25 °C).
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Conservare le compresse rivestite con film nella confezione originale, per proteggerle dall'umidità.
Il medico o il farmacista, che sono in possesso di documentazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Aerius?
1 compressa rivestita con film Aerius contiene, come principio attivo, 5 mg di desloratadina, sostanze ausiliarie e la sostanza colorante E132 (indigotina).
1 ml di Aerius soluzione orale contiene, come principio attivo, 0,5 mg di desloratadina; sorbitolo, sucralosio; conservante: glicole propilenico; aroma: vanillina e altri; altre sostanze ausiliarie.
Numero dell'omologazione
55689, 55958 (Swissmedic).
Dov'è ottenibile Aerius? Quali confezioni sono disponibili?
Aerius è ottenibile in farmacia dietro presentazione della prescrizione medica.
Compresse rivestite con film:
Confezioni da 10, 30 e 90 compresse.
Soluzione orale:
Confezione da 120 ml, con un misurino bianco per bambini dai 6 agli 11 mesi e un misurino incolore per bambini dai 12 mesi e adulti.
Titolare dell’omologazione
MSD MERCK SHARP & DOHME AG, Lucerna.
Questo foglietto illustrativo è stato controllato l'ultima volta nel marzo 2018 dall'autorità competente in materia di medicamenti (Swissmedic).
S-CCDS-MK4117-MTL-112017(deletion 60ml)/ MK4117-CHE-2019-019912
Zusammensetzung
Wirkstoff: Desloratadin.
Hilfsstoffe
Filmtabletten: Farbstoffe: Titandioxid (E171), Indigotin (E132), Excipiens pro compresso.
Lösung zum Einnehmen: Sorbitol, Sucralose; Konserv.: Propylenglycol, Aroma: Vanillinum et alia; Excip. ad solutionem.
Galenische Form und Wirkstoffmenge pro Einheit
Filmtabletten mit je 5 mg Desloratadin.
Lösung zum Einnehmen mit 0,5 mg Desloratadin pro ml.
Indikationen/Anwendungsmöglichkeiten
Symptomatische Behandlung der allergischen Rhinitis.
Symptomatische Behandlung der Urtikaria.
Dosierung/Anwendung
Aerius kann unabhängig von den Mahlzeiten eingenommen werden, zur Linderung der Symptome bei allergischer Rhinitis (einschliesslich intermittierender und persistierender allergischer Rhinitis) und Urtikaria.
Anschliessend soll etwas Wasser getrunken werden.
Filmtabletten
Erwachsene und Jugendliche ab 12 Jahren: 1 Filmtablette Aerius zu 5 mg 1× täglich.
Lösung zum Einnehmen
Erwachsene und Kinder ab 12 Jahren: 10 ml (5 mg) Aerius Lösung zum Einnehmen 1× täglich (farbloser Messlöffel).
Kinder im Alter von 6–11 Jahren: 5 ml (2,5 mg) Aerius Lösung zum Einnehmen 1× täglich (farbloser Messlöffel).
Kinder im Alter von 1–5 Jahren: 2,5 ml (1,25 mg) Aerius Lösung zum Einnehmen 1× täglich (farbloser Messlöffel).
Kinder im Alter von 6–11 Monaten: 2 ml (1 mg) Aerius Lösung zum Einnehmen 1× täglich (weisser Messlöffel).
Die meisten Fälle von Rhinitis bei Kindern unter 2 Jahren werden durch eine Infektion verursacht (siehe «Warnhinweise und Vorsichtsmassnahmen»). Es liegen keine Daten vor, die eine Behandlung einer infektiösen Rhinitis mit Aerius unterstützen.
Die Behandlung der intermittierenden allergischen Rhinitis (Auftreten der Symptome für weniger als 4 Tage pro Woche oder weniger als 4 Wochen) sollte entsprechend des bisherigen Krankheitsverlaufes erfolgen und kann nach dem Abklingen der Symptome beendet und bei deren Wiederauftreten wieder aufgenommen werden. Bei der persistierenden allergischen Rhinitis (Auftreten der Symptome an 4 oder mehr Tagen pro Woche und mehr als 4 Wochen) kann den Patienten während der Allergiezeit eine andauernde Behandlung empfohlen werden.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe oder Loratadin.
Warnhinweise und Vorsichtsmassnahmen
Desloratadin sollte bei Patienten mit Krampfanfällen in der persönlichen Anamnese oder Familienanamnese mit Vorsicht angewendet werden. Vor allem kleine Kinder können möglicherweise anfälliger auf neu auftretende Krampfanfälle unter Behandlung mit Desloratadin sein. Der behandelnde Arzt/Ärztin sollte das Absetzen von Desloratadin in Erwägung ziehen, falls der Patient während der Behandlung einen Krampfanfall erleidet.
Anaphylaktische Reaktionen: Aerius ist nicht zur Behandlung einer anaphylaktischen Reaktion indiziert. Patienten, bei welchen eine akute Urtikaria im Rahmen einer anaphylaktischen Reaktion zusammen mit respiratorischen oder Kreislaufsymptomen auftritt, sollten angewiesen werden, notfallmässig einen Arzt/Ärztin zu konsultieren.
Bei Kindern und Jugendlichen unter 12 Jahren wurde die Wirksamkeit und Verträglichkeit von Aerius Filmtabletten bisher nicht nachgewiesen. Die Wirksamkeit und Sicherheit von Aerius Lösung zum Einnehmen wurde bei Kindern unter 6 Monaten bisher nicht nachgewiesen. Bei Kindern unter 2 Jahren ist die Diagnose «Allergische Rhinitis» besonders schwer von anderen Formen der Rhinitis zu unterscheiden. Es ist dabei auf das Fehlen von Infektionen im oberen Respirationstrakt oder auf strukturelle Abnormalitäten zu achten, unter Berücksichtigung der Anamnese und der körperlichen Untersuchung. Angemessene Laboruntersuchungen und Hauttests sollen in Erwägung gezogen werden.
Interaktionen
Im Rahmen von klinischen Studien wurden keine klinisch relevanten Interaktionen von Aerius mit anderen Arzneimitteln beschrieben. Bei gleichzeitiger Einnahme von Aerius mit Alkohol wurde die leistungsmindernde Wirkung von Alkohol nicht potenziert.
In Interaktionsstudien mit Mehrfachdosis führte die gleichzeitige Gabe von 7,5 mg Desloratadin und Ketoconazol oder Erythromycin zu einer geringen Erhöhung des Desloratadin-Plasmaspiegels (AUC) um 39% bzw. 14%. Ausserdem beobachtete man eine Zunahme des wirksamen Metaboliten, 3-Hydroxy-Desloratadin, um 72% mit Ketoconazol bzw. 40% mit Erythromycin. EKG-Veränderungen traten nicht auf.
Schwangerschaft/Stillzeit
Schwangerschaft
In tierexperimentellen Studien wurde keine Teratogenität beobachtet. Die Sicherheit während der Schwangerschaft beim Menschen ist nicht belegt. Desloratadin sollte – wie andere Arzneimittel – während der Schwangerschaft nicht angewendet werden. Bei versehentlicher Einnahme während der Schwangerschaft ist keine fruchtschädigende Wirkung zu erwarten, dennoch sollte die Behandlung vorsichtshalber sofort abgesetzt werden.
Stillzeit
Desloratadin tritt in die Muttermilch über. Bei Anwendung von Aerius wird daher vom Stillen abgeraten.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen sind in den bisherigen Studien nicht beobachtet worden. Die Patienten sollten jedoch darüber aufgeklärt werden, dass es in sehr seltenen Fällen zu Benommenheit kommen kann, die zu einer Beeinträchtigung der Verkehrstüchtigkeit oder der Fähigkeit zum Bedienen von Maschinen führen kann.
Unerwünschte Wirkungen
In klinischen Studien mit Kindern und Jugendlichen erhielten insgesamt 246 Kinder im Alter zwischen 6 Monaten bis 11 Jahren Aerius Lösung zum Einnehmen.
Die Gesamthäufigkeit der Nebenwirkungen bei Kindern zwischen 2 und 11 Jahren war bei der Aerius Lösung zum Einnehmen-Gruppe ähnlich wie bei der Placebogruppe. Bei Säuglingen und Kleinkindern im Alter von 6–23 Monaten waren die häufigsten Nebenwirkungen, die in der Gruppe der Aerius behandelten häufiger waren als in der Placebogruppe: Diarrhö (3,7%), Fieber (2,3%), und Schlaflosigkeit (2,3%).
In einer Studie zur Geschmacksakzeptanz wurden bei einer Einmaldosis von 2,5 mg Aerius Lösung zum Einnehmen keine Nebenwirkungen bei Patienten im Alter zwischen 6 und 11 Jahren beobachtet.
In klinischen Studien mit Erwachsenen und Kindern in verschiedenen Indikationen, einschliesslich allergischer Rhinitis und chronisch idiopathischer Urtikaria, sind bei der empfohlenen Dosis 3% mehr unerwünschte Wirkungen beobachtet worden als bei Placebo.
Sehr häufig (>1/10); häufig >1/100, <1/10); gelegentlich (>1/1'000, <1/100); selten (>1/10'000, <1/1'000); sehr selten (<1/10'000) und nicht bekannt (Häufigkeit aus den verfügbaren Daten nicht verlässlich abschätzbar).
Psychiatrische Erkrankungen
Sehr selten: Halluzinationen.
Störungen des Nervensystems
Häufig: Müdigkeit.
Gelegentlich: Kopfschmerzen.
Sehr selten: Schwindel, Somnolenz, psychomotorische Hyperaktivität, Krampfanfälle.
Herz-Kreislauf-Störungen
Sehr selten: Tachykardie, Herzklopfen.
Gastrointestinale Störungen
Gelegentlich: Mundtrockenheit.
Sehr selten: Abdominalschmerzen, Übelkeit, Erbrechen, Dyspepsie, Diarrhö.
Funktionsstörungen der Leber und der Galle
Sehr selten: Erhöhung der Leberenzyme, Erhöhung des Bilirubins, Hepatitis.
Muskelskelettsystem
Sehr selten: Myalgie.
Allgemeine Störungen
Sehr selten: Anaphylaxie, Angioödem, Pruritus, Hautausschlag, Urtikaria.
Stoffwechsel- und Ernährungsstörungen
Unbekannt: gesteigerter Appetit.
Überdosierung
Im Falle einer massiven Überdosierung soll eine Magenspülung durchgeführt werden, zusammen mit den üblichen unterstützenden Massnahmen.
Basierend auf einer Studie mit Mehrfachdosen bei Erwachsenen und Jugendlichen, in der Desloratadin in einer Dosierung bis zu 45 mg (9× die klinische Dosis) verabreicht wurde, konnte keine klinisch relevante Wirkung beobachtet werden.
Desloratadin wird durch Hämodialyse nicht eliminiert; es ist nicht bekannt, ob es durch Peritonealdialyse eliminiert wird.
Eigenschaften/Wirkungen
ATC-Code: R06AX27
Wirkungsmechanismus
Bei Desloratadin handelt es sich um den wirksamen Hauptmetaboliten von Loratadin.
Desloratadin ist ein nicht sedierender, lang wirksamer Histamin-Antagonist mit starker und selektiver antagonistischer Wirkung auf periphere Histamin-H1-Rezeptoren. Nach oraler Verabreichung hemmt Desloratadin selektiv die peripheren Histamin-H1-Rezeptoren, da ein Übertritt des Arzneimittels in das zentrale Nervensystem nur geringgradig erfolgt.
Im Rahmen einer klinischen Studie mit Mehrfachdosen, in der Desloratadin in einer Dosierung von bis zu 20 mg täglich über 14 Tage verabreicht worden war, wurde keine statistisch signifikante oder klinisch relevante kardiovaskuläre Wirkung beschrieben. In einer klinisch-pharmakologischen Studie, in der Desloratadin in einer Dosierung von 45 mg täglich (das Neunfache der klinischen Dosis) über zehn Tage verabreicht wurde, zeigte sich keine Verlängerung des QTc-Intervalls. In wieweit dies für «Poor-Metabolizer» zutrifft (siehe Rubrik «Pharmakokinetik»), ist derzeit nicht geklärt.
Desloratadin geht in nur geringen Mengen in das zentrale Nervensystem über. Bei der empfohlenen Dosierung von 5 mg täglich wurde keine erhöhte Häufigkeit von Schläfrigkeit im Vergleich zu Placebo festgestellt.
In klinisch-pharmakologischen Studien kam es durch die gleichzeitige Einnahme von Alkohol weder zu einer Verstärkung der alkoholinduzierten Leistungsbeeinträchtigung noch zu einer Erhöhung der Schläfrigkeit. Bei den Ergebnissen des psychomotorischen Tests konnten keine signifikanten Unterschiede zwischen den mit Desloratadin und den mit Placebo behandelten Patienten festgestellt werden, unabhängig davon, ob Desloratadin alleine oder mit Alkohol eingenommen wurde.
Allergische Rhinitis
Zusätzlich zu der etablierten Klassifizierung in saisonal und perennial, kann allergische Rhinitis in Abhängigkeit von Dauer der Symptome alternativ auch in intermittierende allergische Rhinitis und persistierende allergische Rhinitis eingeteilt werden. Intermittierende allergische Rhinitis wird als Auftreten der Symptome für weniger als 4 Tage pro Woche oder weniger als 4 Wochen definiert. Persistierende allergische Rhinitis wird als Auftreten der Symptome an 4 oder mehr Tagen pro Woche und mehr als 4 Wochen definiert.
Die Dosierungsempfehlung für Aerius bei Kindern, Kleinkindern und Säuglingen basiert auf pharmakokinetischen Vergleichsstudien. Die Sicherheit von Aerius Sirup wurde bei 246 Kindern im Alter von 6 Monaten bis 11 Jahren in 3 Placebo-kontrollierten Studien untersucht. Da Pathogenese und Verlauf der allergischen Rhinitis/chronischen Urtikaria und das Profil von Desloratadin bei Kindern und Erwachsenen sehr ähnlich sind, kann aus den Wirksamkeitsdaten von Erwachsenen auch auf eine Wirksamkeit bei Kindern geschlossen werden.
Saisonale allergische Rhinitis: Die klinische Wirksamkeit und Sicherheit von Aerius-Tabletten wurden bei über 2'300 Patienten im Alter von 12 bis 75 Jahren mit saisonaler allergischer Rhinitis untersucht. Insgesamt 1'838 Patienten erhielten in 4 doppelblinden, randomisierten, Placebo-kontrollierten klinischen Studien von 2 bis 4 Wochen Dauer Aerius in einer Dosierung von 2,5–20 mg/Tag. Die Ergebnisse dieser Studien belegten die Wirksamkeit und Sicherheit von Aerius 5 mg bei der Behandlung erwachsener und jugendlicher Patienten mit saisonaler allergischer Rhinitis. In einer Dosisfindungsstudie wurde Aerius in einer Dosierung von 2,5–20 mg/Tag untersucht. Dosen von 5, 7,5, 10 und 20 mg/Tag waren Placebo überlegen; bei Dosierungen über 5,0 mg war kein zusätzlicher Nutzen nachweisbar.
In 2 vierwöchigen Studien, in denen 924 Patienten (Alter 15 bis 75 Jahre) mit saisonaler allergischer Rhinitis und gleichzeitig bestehendem Asthma teilnahmen, führten Aerius-Tabletten, 5 mg einmal täglich, zu einer Verbesserung der Rhinitis-Symptome, ohne die Lungenfunktion zu verschlechtern. Dies belegt die Sicherheit der Anwendung von Aerius-Tabletten bei erwachsenen Patienten mit saisonaler allergischer Rhinitis und gleichzeitigem leichtem bis mittelschwerem Asthma.
Die tägliche Einmalgabe von Aerius-Tabletten 5 mg bewirkte eine signifikante Reduktion des Gesamtsymptomscores (Summe der Einzelscores für nasale und nicht-nasale Symptome) bei Patienten mit saisonaler allergischer Rhinitis (siehe Tabelle 1).
Tabelle 1. Gesamtsymptomscore (Total Symptom Score, TSS)
Veränderungen in einer zweiwöchigen klinischen Studie bei Patienten mit saisonaler allergischer Rhinitis
Therapiegruppe (n) | Mittlerer Ausgangsscore* (SEM) | Veränderung im Vergleich zum Ausgangsscore** (SEM) | Vergleich mit Placebo (p-Wert) |
|---|---|---|---|
Aerius 5,0 mg (171) | 14,2 (0,3) | –4,3 (0,3) | p= <0,01 |
Placebo (173) | 13,7 (0,3) | –2,5 (0,3) |
* Zu Studienbeginn war ein nasaler Gesamtsymptomscore (Summe von 4 Einzelsymptomen) von mindestens 6 und ein nicht-nasaler Gesamtsymptomscore (Summe von 4 Einzelsymptomen) von mindestens 5 erforderlich (jedes Symptom wurde mit 0 bis 3 bewertet: 0= kein Symptom; 3= schwere Symptome), um für die Aufnahme in die Studie in Frage zu kommen. Der TSS liegt in einem Bereich von 0= keine Symptome bis 24= maximale Symptome.
** Mittlere Reduktion des TSS, Durchschnittswert während des zweiwöchigen Behandlungszeitraums.
Für die Wirksamkeit von Aerius-Tabletten 5 mg ergaben sich keine signifikanten Unterschiede zwischen den Patienten-Subgruppen, die nach Geschlecht, Alter oder Rasse festgelegt wurden.
Perenniale allergische Rhinitis: Die klinische Wirksamkeit und Sicherheit von Aerius-Tabletten 5 mg wurden bei über 1'300 Patienten im Alter von 12 bis 80 Jahren mit perennialer allergischer Rhinitis untersucht. Insgesamt 685 Patienten erhielten in 2 doppelblinden, randomisierten, Placebo-kontrollierten, klinischen Studien von 4 Wochen Dauer Aerius in einer Dosierung von 5 mg/Tag. In einer dieser Studien führten Aerius-Tabletten, 5 mg einmal täglich, nachweislich zu einer signifikanten Reduktion der Symptome der perennialen allergischen Rhinitis (Tabelle 2).
Tabelle 2. Gesamtsymptomscore (Total Symptom Score, TSS)
Veränderungen in einer vierwöchigen klinischen Studie bei Patienten mit perennialer allergischer Rhinitis
Therapiegruppe (n) | Mittlerer Ausgangsscore* (SEM) | Veränderung im Vergleich zum Ausgangsscore** (SEM) | Vergleich mit Placebo (p-Wert) |
|---|---|---|---|
Aerius 5,0 mg (337) | 12,37 (0,18) | –4,06 (0,21) | p= 0,01 |
Placebo (337) | 12,30 (0,18) | –3,27 (0,21) |
* Zu Studienbeginn war ein nasaler Gesamtsymptomscore (Summe von 5 nasalen Einzelsymptomen und 3 nicht-nasalen Symptomen; jedes Symptom wurde mit 0 bis 3 bewertet: 0= kein Symptom; 3= schwere Symptome) von mindestens 10 erforderlich, um für die Aufnahme in die Studie in Frage zu kommen. Der TSS liegt in einem Bereich von 0= keine Symptome bis 24= maximale Symptome.
** Mittlere Reduktion des TSS, Durchschnittswert während des vierwöchigen Behandlungszeitraums.
Urtikaria
Die chronisch idiopatische Urtikaria wurde stellvertretend für weitere Formen der Urtikaria untersucht, da chronische Patienten einfacher prospektiv rekrutiert werden können.
Wirksamkeit und Sicherheit von Aerius-Tabletten, 5 mg einmal täglich, wurden bei 416 Patienten mit chronisch idiopathischer Urtikaria im Alter von 12 bis 84 Jahren untersucht; 211 dieser Patienten erhielten Aerius. In zwei doppelblinden, Placebo-kontrollierten, randomisierten klinischen Studien von sechs Wochen Dauer bewirkten Aerius-Tabletten zu dem vorab festgelegten primären Untersuchungszeitpunkt nach einer Woche eine signifikante Reduktion des Schweregrads von Pruritus im Vergleich zu Placebo (Tabelle 3). Sekundäre Endpunkte wurden ebenfalls untersucht; während der ersten Therapiewoche reduzierten Aerius-Tabletten 5 mg die sekundären Endpunkte «Anzahl der Quaddeln» und «Grösse der grössten Quaddel» im Vergleich zu Placebo.
Tabelle 3: Pruritus-Symptomscore
Veränderungen in der ersten Woche einer klinischen Studie bei Patienten mit chronischer idiopathischer Urtikaria
Therapiegruppe (n) | Mittlerer Ausgangsscore* (SEM) | Veränderung im Vergleich zum Ausgangsscore** (SEM) | Vergleich mit Placebo (p-Wert) |
|---|---|---|---|
Aerius 5,0 mg (115) | 2,19 (0,04) | –1,05 (0,07) | p= <0,01 |
Placebo (110) | 2,21 (0,04) | –0,52 (0,07) |
* Der Pruritus wurde mit einem Score von 0 bis 3 bewertet: 0= kein Symptom; 3= maximales Symptom.
** Mittlere Reduktion des Pruritus, Durchschnittswert während der ersten Therapiewoche.
Lösung zum Einnehmen
Die Wirksamkeit von Aerius Lösung zum Einnehmen wurde nicht in speziellen Studien an Kindern untersucht. Die Unbedenklichkeit von Aerius Sirup, der die gleiche Konzentration an Desloratadin enthält, wurde jedoch in drei pädiatrischen Studien nachgewiesen. Kinder im Alter von 6 Monaten bis 11 Jahren mit einer dokumentierten Krankengeschichte über saisonale allergische Rhinitis oder chronisch idiopathische Urtikaria erhielten eine tägliche Dosis von 1 mg (im Alter von 6–11 Monaten), 1,25 mg (im Alter von 1–5 Jahren) oder 2,5 mg (im Alter von 6–11 Jahren). Die Behandlung wurde gut vertragen, was anhand von klinischen Labortests, vitalen Zeichen und EKG-Intervalldaten einschliesslich QTc belegt ist. Unter Einhaltung der empfohlenen Dosen war die pharmakokinetische Aktivität von Desloratadin bei der pädiatrischen Population mit der Erwachsenen-Population vergleichbar. Da der Verlauf von saisonaler allergischer Rhinitis/chronisch idiopathischer Urtikaria und das Profil von Desloratadin bei Erwachsenen und pädiatrischen Patienten ähnlich sind, können die Wirksamkeitsdaten von Desloratadin bei Erwachsenen auf die pädiatrische Population extrapoliert werden.
Pharmakokinetik
In einer Crossover-Studie mit Einzeldosis waren die Formulierungen der Filmtablette und des Sirups bioäquivalent. Bei Aerius Lösung zum Einnehmen ist aufgrund der Zusammensetzung zu erwarten, dass ihre Bioverfügbarkeit dem Sirup und den Tabletten entspricht.
Absorption
Desloratadin wird gut resorbiert, die maximale Serum-Konzentration ist nach etwa 3 Stunden erreicht. Innerhalb von 30 Minuten nach Gabe von Desloratadin lässt es sich im Blutplasma nachweisen. Die Bioverfügbarkeit von Desloratadin (Cmax und AUC) ist im Bereich zwischen 5 mg und 20 mg proportional zur Dosis. Die absolute Bioverfügbarkeit ist nicht bekannt. Die Bioverfügbarkeit von Desloratadin ist gleich gross nach 5 mg Desloratadin wie nach 10 mg Loratadin.
Distribution
Desloratadin wird mässig (83%–87%) an Plasmaproteine gebunden. Bei Patienten mit Einschränkung der Nieren- und Leberfunktion war die Proteinbindung von Desloratadin und 3-Hydroxy-Desloratadin unverändert. Es liegen keine Anhaltspunkte für eine klinisch relevante Akkumulation nach einmal täglicher Anwendung von Desloratadin (5–20 mg) über 14 Tage vor.
Metabolismus
Desloratadin wird ausgiebig zum aktiven Metaboliten 3-Hydroxy-Desloratadin metabolisiert und anschliessend glukuronidiert. Die für die Metabolisierung verantwortlichen Enzyme von Desloratadin sind noch nicht bekannt und deshalb können Interaktionen mit anderen Arzneimitteln nicht ausgeschlossen werden. In-vivo Untersuchungen mit spezifischen Inhibitoren von CYP3A4 und CYP2D6 haben gezeigt, dass diese Enzyme für die Metabolisierung von Desloratadin nicht wichtig sind.
Die Umwandlung von Desloratadin in 3-Hydroxy-Desloratadin ist bei einem Teil der Bevölkerung infolge eines noch nicht geklärten phenotypischen Polymorphismus im Stoffwechsel deutlich verlangsamt. Ca. 2% der Kaukasier und über 20% der Schwarzen weisen ein Verhältnis der AUC DL/3-OH-DL >10 (normal <4) auf und werden als «Poor Metabolizer» bezeichnet. Bei Erwachsenen, die als «Poor Metabolizer» klassifiziert wurden, war die Desloratadin-Exposition (AUC) nach Mehrfachdosen 6mal höher als die bei Erwachsenen mit normalem Stoffwechsel. Die pharmakodynamischen Auswirkungen dieser Variante, insbesondere die Auswirkungen auf die QTc Zeit, sind noch nicht vollständig geklärt.
Die Desloratadin-Exposition nach Mehrfachdosen ist bei Kindern nicht untersucht worden.
Elimination
Die terminale Halbwertszeit beträgt ungefähr 27 Stunden. Das Ausmass der Akkumulation von Desloratadin entsprach seiner Halbwertszeit (ungefähr 27 Stunden) und einer Dosierung von einmal täglich. Eine Massen-Gleichgewichtsstudie am Menschen ergab die Wiedergewinnung von ungefähr 87% der Gesamtdosis von 14C-Desloratadin, gleichmässig als Metaboliten in Urin und Stuhl verteilt. Die Analyse von 3-Hydroxy-Desloratadin im Plasma zeigte eine ähnliche tmax und Halbwertszeit wie mit Desloratadin. Desloratadin wird durch Hämodialyse nicht eliminiert.
Interaktionsstudien
In Interaktionsstudien mit Mehrfachdosis führte die gleichzeitige Gabe von 7,5 mg Desloratadin und Ketoconazol oder Erythromycin zu einer geringen Erhöhung des Desloratadin-Plasmaspiegels (AUC) um 39% bzw. 14%. Ausserdem beobachtete man eine Zunahme des wirksamen Metaboliten, 3-Hydroxy-Desloratadin, um 72% mit Ketoconazol bzw. 40% mit Erythromycin. EKG-Veränderungen traten nicht auf. Bei gleichzeitiger Verabreichung von 5 mg Desloratadin mit Azithromycin wurde eine Zunahme der Serumspitzenkonzentrationen um 15% und AUC um 5% beobachtet. Azithromycin hatte keinen Einfluss auf die pharmakokinetischen Parameter von Desloratadin.
Kinetik in speziellen Situationen
Einfluss der Nahrung
In einer Studie mit einer Einzeldosis von 7,5 mg Desloratadin zeigte sich kein Einfluss der Nahrung (Frühstück mit hohem Fett- und Kaloriengehalt) auf die Pharmakokinetik von Desloratadin.
In einer anderen Studie hatte Grapefruitsaft keinen Einfluss auf die Disposition von Desloratadin.
Patienten mit Niereninsuffizienz
Es liegen keine Erfahrungen zu wiederholter Desloratadin-Verabreichung bei Niereninsuffizienz vor. Bei Patienten mit unterschiedlichen Schweregraden einer stabilen Nierenfunktionsstörung war die AUC von Desloratadin nach Einmaldosierung 1,5- bis 2,5-fach erhöht und die Konzentration von 3-Hydroxy-Desloratadin minimal verändert. Desloratadin wurde durch Hämodialyse nur in geringem Masse (0,3%) eliminiert. Ausserdem war die Plasmaprotein-Bindung von Desloratadin und 3-Hydroxy-Desloratadin bei Nierenerkrankung unverändert; infolgedessen kam es zu keiner Veränderung der Konzentration des ungebundenen Wirkstoffs.
Patienten mit Leberschädigung
Bei Patienten mit mässiger Leberfunktionsstörung kann die Fläche unter der Kurve (AUC) bis auf das 3-fache erhöht sein. Die Plasma-Proteinbindung von Desloratadin und 3-Hydroxy-Desloratadin war bei Patienten mit Lebererkrankung unverändert. Die Häufigkeit unerwünschter Wirkungen bei maximal 10-tägiger Behandlung und bei Patienten mit mässiggradiger Leberschädigung (Child B) war nicht erhöht.
Kinder und Jugendliche
In separaten Studien mit Einzeldosis waren unter Einhaltung der empfohlenen Dosen die AUC- und Cmax-Werte von pädiatrischen Patienten mit denjenigen von Erwachsenen vergleichbar, die 5 mg Desloratadin Sirup erhielten.
Präklinische Daten
Das karzinogene Potenzial von Desloratadin wurde in einer Studie mit Mäusen und einer Studie mit Loratadin an Ratten untersucht. In einer 2-Jahres Studie mit Ratten wurde Loratadin in der Dosierung bis zu 25 mg/kg/Tag in Futter verabreicht. Das entspricht ungefähr einer 30-fach grösseren AUC-Belastung mit Desloratadin und Desloratadinmetaboliten als der beim Menschen empfohlenen Tagesdosis. Eine signifikant höhere Inzidenz von hepatozellulären Tumoren (Adenome und Karzinome) wurde bei männlichen Tieren beobachtet, die 10 mg/kg/Tag erhielten, sowie bei männlichen und weiblichen Tieren, die 25 mg/kg/Tag Loratadin erhielten. Die angenommene Desloratadin und Loratadinmetaboliten Belastung bei Ratten, die 10 mg/kg/Tag erhielten, entsprach ungefähr einer 7mal grösseren AUC als der beim Menschen mit der empfohlenen Tagesdosis. Die klinische Signifikanz dieser Beobachtungen während einer Langzeitanwendung von Desloratadin ist nicht bekannt.
In einer 2-Jahresstudie mit Mäusen, männlich und weiblich, die bis zu 16 mg/kg/Tag bzw. 32 mg/kg/Tag erhielten, zeigte sich keine signifikante Erhöhung der Inzidenz des Auftretens von irgendwelchen Tumoren. Die geschätzte Belastung mit Desloratadin und Loratadinmetaboliten bei Mäusen und diesen Dosierungen ergab eine 12- resp. 27-fache grössere AUC als beim Menschen mit der empfohlenen oralen Tagesdosis.
Reproduktionstoxikologie
Bei Ratten zeigte sich keine Beeinflussung der Fertilität unter einer Desloratadin-Dosis pro kg Körpergewicht, die 34mal so hoch war wie die klinisch empfohlene Dosis beim Menschen. In sehr hohen Dosen wurde jedoch bei männlichen Ratten eine Verringerung der Fertilität beobachtet.
Sonstige Hinweise
Haltbarkeit
Die Präparate dürfen nur bis zu dem auf dem Behälter mit «EXP.» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15–25 °C) lagern.
Filmtabletten in der Originalverpackung lagern, um den Inhalt vor Feuchtigkeit zu schützen.
Zulassungsnummer
55689, 55958 (Swissmedic).
Zulassungsinhaberin
MSD Merck Sharp & Dohme AG, Luzern.
Stand der Information
März 2018
S-CCDS-MK4117-MTL-112017(deletion 60ml)/MK4117-CHE-2019-019912
Composition
Principe actif: desloratadine.
Excipients
Comprimés pelliculés: colorants: dioxyde de titane (E171), indigotine (E132), Excipiens pro compresso.
Solution buvable: sorbitol, sucralose; conserv.: propylène glycol; arômes: Vanillinum et alia; Excip. ad solutionem.
Forme galénique et quantité de principe actif par unité
Comprimés pelliculés à 5 mg de desloratadine.
Solution buvable à 0,5 mg de desloratadine par ml.
Indications/Possibilités d’emploi
Traitement symptomatique de la rhinite allergique.
Traitement symptomatique de l'urticaire.
Posologie/Mode d’emploi
Aerius peut être pris indépendamment des repas pour le soulagement des symptômes associés à la rhinite allergique (incluant les rhinites allergiques intermittente et persistante) et à l'urticaire.
Le patient doit boire un peu d'eau après la prise.
Comprimés pelliculés
Adultes et adolescents de 12 ans et plus: 1 comprimé pelliculé d'Aerius à 5 mg 1× par jour.
Solution buvable
Adultes et enfants de 12 ans et plus: 10 ml (5 mg) de solution buvable d'Aerius 1× par jour (mesurette incolore).
Enfants de 6 à 11 ans: 5 ml (2,5 mg) de solution buvable d'Aerius 1× par jour (mesurette incolore).
Enfants de 1 à 5 ans: 2,5 ml (1,25 mg) de solution buvable d'Aerius 1× par jour (mesurette incolore).
Enfants de 6 à 11 mois: 2 ml (1 mg) de solution buvable d'Aerius 1× par jour (mesurette blanche).
La plupart des cas de rhinite survenant chez l'enfant de moins de 2 ans sont dus à une infection (voir «Mises en garde et précautions»). On ne dispose d'aucune donnée étayant le traitement d'une rhinite infectieuse par Aerius.
La rhinite allergique intermittente (présence de symptômes sur une période inférieure à 4 jours par semaine ou une période inférieure à 4 semaines) doit être traitée en fonction de l'évolution antérieure de la maladie, le traitement pouvant être interrompu après la disparition des symptômes et repris à leur réapparition. En cas de rhinite allergique persistante (présence de symptômes sur une période supérieure ou égale à 4 jours par semaine ou supérieure à 4 semaines), un traitement continu peut être recommandé aux patients pendant la période d'allergie.
Contre-indications
Hypersensibilité au principe actif ou à l'un des excipients ou à la loratadine.
Mises en garde et précautions
La desloratadine doit être utilisée avec prudence chez les patients présentant des crises convulsives dans leur anamnèse personnelle ou dans leur anamnèse familiale. Les enfants en bas âge surtout peuvent éventuellement être plus prédisposés à la survenue de nouvelles crises convulsives sous traitement de desloratadine. Le médecin traitant doit envisager l'arrêt de la desloratadine si le patient souffre d'une crise convulsive pendant le traitement.
Réactions anaphylactiques: Aerius n'est pas indiqué pour le traitement d'une réaction anaphylactique. Les patients chez lesquels survient une urticaire aiguë associée à des symptômes respiratoires ou circulatoires dans le cadre d'une réaction anaphylactique doivent être invités à consulter un médecin en urgence.
L'efficacité et la tolérance des comprimés pelliculés d'Aerius n'ont pas été établies à ce jour chez les enfants et adolescents de moins de 12 ans. L'efficacité et la sécurité de la solution buvable d'Aerius n'ont pas été établies à ce jour chez l'enfant de moins de 6 mois. Chez les enfants de moins de 2 ans, il est particulièrement difficile de distinguer la «rhinite allergique» des autres formes de rhinites. Le diagnostic sera étayé par l'absence d'infection respiratoire haute ou d'anomalie structurale et tiendra compte de l'anamnèse et de l'examen clinique. Des examens de laboratoire et des tests cutanés appropriés devront être envisagés.
Interactions
Aucune interaction cliniquement significative entre Aerius et d'autres médicaments n'a été décrite dans le cadre d'études cliniques. La prise concomitante d'Aerius et d'alcool n'a pas potentialisé la diminution des performances induite par l'alcool.
Dans les études d'interactions à doses répétées, la prise simultanée de 7,5 mg de desloratadine et de kétoconazole ou d'érythromycine a entraîné une faible augmentation de la concentration plasmatique de desloratadine (AUC), respectivement de 39% et 14%. En outre, on a observé une augmentation du métabolite actif, la 3-hydroxy-desloratadine, de 72% avec le kétoconazole et de 40% avec l'érythromycine. Aucune modification de l'ECG n'est survenue.
Grossesse/Allaitement
Grossesse
Aucun effet tératogène n'a été observé dans les études effectuées chez l'animal. La sécurité du produit pendant la grossesse n'est pas établie. Comme d'autres médicaments, la desloratadine ne doit pas être utilisée pendant la grossesse. Aucun effet nocif n'est attendu chez le fœtus en cas de prise accidentelle pendant la grossesse; toutefois, le traitement devra par mesure de précaution être immédiatement arrêté.
Allaitement
La desloratadine passant dans le lait maternel, il est conseillé de ne pas allaiter durant un traitement par Aerius.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune influence sur l'aptitude à la conduite et l'utilisation de machines n'a été observée dans les études menées jusqu'à ce jour. Cependant, les patients doivent être informés que de très rares cas de somnolence susceptibles d'affecter l'aptitude à conduire des véhicules ou à utiliser des machines ont été rapportés.
Effets indésirables
Lors des études cliniques menées chez l'enfant et l'adolescent, la solution buvable d'Aerius a été administrée à un total de 246 enfants âgés de 6 mois à 11 ans.
L'incidence globale des effets indésirables chez les enfants de 2 ans à 11 ans était similaire dans les groupes de la solution buvable d'Aerius et du placebo. Chez les nourrissons et jeunes enfants âgés de 6 à 23 mois, les effets indésirables les plus fréquemment rapportés dans le groupe Aerius, avec une incidence supérieure à celle du groupe placebo étaient: diarrhée (3,7%), fièvre (2,3%) et insomnie (2,3%).
Dans une étude sur l'acceptation du goût, aucun effet indésirable n'a été observé chez les patients âgés de 6 à 11 ans après l'administration d'une dose unique de 2,5 mg de solution buvable d'Aerius.
Lors des études cliniques menées chez des adultes et des adolescents dans différentes indications, y compris rhinite allergique et urticaire chronique idiopathique, des effets indésirables ont été observés à la dose recommandée chez 3% de patients de plus que chez ceux traités par le placebo.
Très fréquents (>1/10); fréquents >1/100, <1/10); occasionnels (>1/1000, <1/100); rares (>1/10'000, <1/1000); très rares (<1/10'000) et fréquence inconnue (ne peut être estimée de façon fiable sur la base des données disponibles).
Affections psychiatriques
Très rares: hallucinations.
Affections du système nerveux
Fréquents: fatigue.
Occasionnels: céphalées.
Très rares: vertiges, somnolence, hyperactivité psychomotrice, crises convulsives.
Affections cardiaques
Très rares: tachycardie, palpitations.
Affections gastro-intestinales
Occasionnels: sécheresse de la bouche.
Très rares: douleurs abdominales, nausées, vomissements, dyspepsie, diarrhée.
Affections hépatobiliaires
Très rares: augmentation des enzymes hépatiques, augmentation de la bilirubine, hépatite.
Affections musculo-squelettiques et du tissu conjonctif
Très rares: myalgies.
Troubles généraux et anomalies au site d'administration
Très rares: anaphylaxie, angio-œdème, prurit, exanthème, urticaire.
Troubles du métabolisme et de la nutrition
Fréquence inconnue: augmentation de l'appétit.
Surdosage
En cas de surdosage massif, il faut procéder à un lavage d'estomac, en plus des mesures symptomatiques habituelles.
Dans une étude à doses répétées chez l'adulte et l'adolescent, dans laquelle la desloratadine a été administrée à une dose allant jusqu'à 45 mg (9 fois la dose clinique), aucun effet cliniquement significatif n'a pu être observé.
La desloratadine n'est pas éliminée par hémodialyse et on ignore si elle est éliminée par dialyse péritonéale.
Propriétés/Effets
Code ATC: R06AX27
Mécanisme d'action
La desloratadine est le principal métabolite actif de la loratadine.
La desloratadine est un antihistaminique non sédatif, d'action prolongée exerçant un effet antagoniste puissant et sélectif sur les récepteurs histaminiques H1 périphériques. Après administration orale, la desloratadine bloque sélectivement les récepteurs histaminiques H1 périphériques, car elle diffuse très faiblement dans le système nerveux central.
Lors d'une étude clinique à doses répétées dans laquelle jusqu'à 20 mg par jour de desloratadine ont été administrés pendant 14 jours, aucun effet cardiovasculaire statistiquement ou cliniquement significatif n'a été observé. Dans le cadre d'une étude pharmacologique clinique dans laquelle la desloratadine a été administrée à une dose de 45 mg par jour (neuf fois la dose clinique) pendant dix jours, aucun allongement de l'intervalle QTc n'a été observé. Il n'est pas élucidé à ce jour si ceci concerne aussi les individus métaboliseurs lents (voir «Pharmacocinétique»).
La desloratadine ne diffuse qu'en faibles quantités dans le système nerveux central. A la posologie recommandée de 5 mg par jour, il n'y a pas eu d'augmentation de l'incidence de la somnolence par rapport au placebo.
Dans des études cliniques pharmacologiques, la prise concomitante d'alcool n'a pas accentué l'altération des performances induite par l'alcool ni augmenté la somnolence. Les résultats des tests psychomoteurs n'ont pas mis en évidence de différences significatives entre les patients traités par la desloratadine et ceux traités par placebo, que la desloratadine ait été associée à de l'alcool ou non.
Rhinite allergique
En plus de la classification établie de la rhinite allergique différenciant la rhinite saisonnière et perannuelle, la rhinite allergique peut aussi être divisée en rhinite allergique intermittente et rhinite allergique persistante selon la durée des symptômes. La rhinite allergique intermittente est définie par la présence de symptômes sur une période inférieure à 4 jours par semaine ou inférieure à 4 semaines. La rhinite allergique persistante est définie par la présence de symptômes sur une période supérieure ou égale à 4 jours par semaine et sur une période supérieure à 4 semaines.
Les recommandations posologiques pour Aerius chez l'enfant, l'enfant en bas âge et le nourrisson reposent sur des études pharmacocinétiques comparatives. La sécurité du sirop d'Aerius a été étudiée chez 246 enfants âgés de 6 mois à 11 ans dans 3 études contrôlées par placebo. La pathogenèse et l'évolution de la rhinite allergique et de l'urticaire chronique et le profil de la desloratadine étant très similaires chez l'enfant et chez l'adulte, l'efficacité chez l'enfant peut être extrapolée des données d'efficacité chez l'adulte.
Rhinite allergique saisonnière: l'efficacité clinique et la sécurité des comprimés d'Aerius ont été étudiées chez plus de 2300 patients âgés de 12 à 75 ans atteints de rhinite allergique saisonnière. Un total de 1838 patients ont été inclus dans 4 études cliniques en double aveugle, randomisées et contrôlées par placebo, au cours desquelles ils ont reçu des comprimés d'Aerius à la posologie de 2,5–20 mg/jour sur une durée de 2 à 4 semaines. Les résultats de ces études ont prouvé l'efficacité et la sécurité des comprimés d'Aerius à 5 mg dans le traitement de la rhinite allergique saisonnière de l'adulte et de l'adolescent. Dans une étude de recherche de doses, Aerius a été étudié à une posologie de 2,5–20 mg/jour. Des doses de 5, 7,5, 10 et 20 mg/jour ont montré des effets supérieurs à ceux du placebo; à des doses supérieures à 5,0 mg, aucun avantage supplémentaire n'a été mis en évidence.
Dans 2 études d'une durée respective de quatre semaines, englobant 924 patients (âgés de 15 à 75 ans) atteints de façon concomitante de rhinite allergique saisonnière et d'asthme, les comprimés d'Aerius à une posologie de 5 mg par jour ont entraîné une amélioration des symptômes dus à la rhinite, sans aggraver la fonction pulmonaire. Ceci démontre la sécurité d'emploi des comprimés d'Aerius chez l'adulte atteint de façon concomitante de rhinite allergique saisonnière et d'asthme léger à modéré.
La prise quotidienne unique de comprimés d'Aerius à 5 mg a entraîné une diminution significative du score total de symptômes (somme des scores isolés de symptômes nasaux et non nasaux) chez les patients atteints de rhinite allergique saisonnière (voir Tableau 1).
Tableau 1. Score total de symptômes (Total symptom Score TSS)
Modifications survenues dans une étude clinique de deux semaines chez des patients atteints de rhinite allergique saisonnière
Groupe de traitement (n) | Score initial moyen* (SEM) | Modification par rapport au score initial** (SEM) | Comparaison par rapport au placebo (valeur p) |
|---|---|---|---|
Aerius 5,0 mg (171) | 14,2 (0,3) | –4,3 (0,3) | p= <0,01 |
Placebo (173) | 13,7 (0,3) | –2,5 (0,3) |
* Au début de l'étude, un score total de symptômes nasaux (somme de 4 symptômes isolés) d'au moins 6 et un score total de symptômes non nasaux (somme de 4 symptômes isolés) d'au moins 5 était exigé pour l'inclusion dans l'étude (un score de 0 à 3 était attribué à chaque symptôme: 0= absence de symptômes; 3= symptômes sévères). Le TSS se situe entre 0= absence de symptômes et 24= maximum de symptômes.
** Réduction moyenne du TSS, valeur moyenne au cours des deux semaines de traitement.
En ce qui concerne l'efficacité des comprimés d'Aerius à 5 mg, aucune différence significative entre les sous-groupes de patients, définis en fonction du sexe, de l'âge et de la race, n'a été constatée.
Rhinite allergique perannuelle: l'efficacité clinique et la sécurité des comprimés d'Aerius à 5 mg ont été étudiées chez plus de 1300 patients âgés de 12 à 80 ans atteints de rhinite allergique perannuelle. Un total de 685 patients a été inclus dans 2 études cliniques en double aveugle, randomisées et contrôlées par placebo, au cours desquelles ceux-ci ont reçu des comprimés d'Aerius à raison de 5 mg/jour sur une durée de 4 semaines. Dans une de ces études, la prise d'un comprimé d'Aerius à 5 mg une fois par jour a entraîné une réduction prouvée et significative des symptômes de la rhinite allergique perannuelle (Tableau 2).
Tableau 2. Score total de symptômes (Total symptom Score TSS)
Modifications survenues dans une étude clinique de quatre semaines chez des patients atteints de rhinite allergique perannuelle
Groupe de traitement (n) | Score initial moyen* (SEM) | Modification par rapport au score initial** (SEM) | Comparaison par rapport au placebo (valeur p) |
|---|---|---|---|
Aerius 5,0 mg (337) | 12,37 (0,18) | –4,06 (0,21) | p= 0,01 |
Placebo (337) | 12,3 (0,18) | –3,27 (0,21) |
* Au début de l'étude, un score total de symptômes nasaux (somme de 5 symptômes nasaux isolés et 3 symptômes non nasaux, un score de 0 à 3 étant attribué à chaque symptôme: 0= absence de symptômes; 3= symptômes sévères) d'au moins 10 était exigé pour l'inclusion dans l'étude. Le TSS se situe entre 0= absence de symptômes et 24= maximum de symptômes.
** Réduction moyenne du TSS, valeur moyenne au cours des quatre semaines de traitement.
Urticaire
L'urticaire chronique idiopathique a été étudiée comme modèle clinique des autres formes d'urticaire parce que les patients chroniques peuvent être plus facilement recrutés prospectivement.
L'efficacité et la sécurité des comprimés d'Aerius à la posologie de 5 mg/jour ont été étudiées chez 416 patients âgés de 12 à 84 ans atteints d'urticaire chronique idiopathique; 211 de ces patients ont reçu Aerius. Dans deux études cliniques en double aveugle, contrôlées par placebo, randomisées, d'une durée de six semaines, les comprimés d'Aerius ont entraîné une réduction significative de l'intensité du prurit par rapport au placebo lors de l'examen primaire fixé au préalable au bout d'une semaine (Tableau 3). Des critères d'évaluation secondaires ont également été étudiés: au cours de la première semaine de traitement, les comprimés d'Aerius à 5 mg ont diminué les critères secondaires «nombre de papules» et «taille de la papule la plus volumineuse» par rapport au placebo.
Tableau 3. Score des symptômes du prurit
Modifications survenues dans la première semaine d'une étude clinique chez des patients atteints d'urticaire chronique idiopathique
Groupe de traitement (n) | Score initial moyen* (SEM) | Modification par rapport au score initial** (SEM) | Comparaison par rapport au placebo (valeur p) |
|---|---|---|---|
Aerius 5,0 mg (115) | 2,19 (0,04) | –1,05 (0,07) | p= <0,01 |
Placebo (110) | 2,21 (0,04) | –0,52 (0,07) |
* Le prurit a été évalué à l'aide d'un score allant de 0 à 3: 0= absence de symptômes; 3= maximum de symptômes.
** Réduction moyenne du prurit, valeur moyenne au cours de la première semaine de traitement.
Solution buvable
L'efficacité de la solution buvable d'Aerius n'a pas été spécifiquement examinée dans des études auprès d'enfants. L'innocuité du sirop d'Aerius qui contient la même concentration de desloratadine a cependant été démontrée dans trois études pédiatriques. Des enfants de 6 mois à 11 ans ayant une rhinite allergique saisonnière ou une urticaire idiopathique chronique dans leur anamnèse ont reçu une dose journalière de 1 mg (de 6 à 11 mois), de 1,25 mg (de 1 à 5 ans) ou de 2,5 mg (de 6 à 11 ans). Le traitement a été bien toléré, ce qui a été mis en évidence par les examens de laboratoire clinique, l'évaluation des signes vitaux et les données sur les intervalles de l'ECG, y compris l'intervalle QTc. Au dosage recommandé, l'activité pharmacocinétique de la desloratadine observée dans la population pédiatrique était comparable à celle de la population adulte. Comme l'évolution d'une rhinite allergique saisonnière ou d'une urticaire idiopathique chronique ainsi que le profil de la desloratadine sont similaires chez l'enfant et chez l'adulte, les données sur l'efficacité de la desloratadine chez l'adulte peuvent être extrapolées à la population pédiatrique.
Pharmacocinétique
Dans le cadre d'une étude clinique croisée à dose unique, les formulations des comprimés pelliculés et du sirop se sont avérées bioéquivalentes. Pour la solution buvable d'Aerius, on peut supposer, en raison de la composition, que la biodisponibilité correspond à celle du sirop et des comprimés.
Absorption
La desloratadine est bien absorbée; la concentration sérique maximale est atteinte environ 3 heures après l'administration. La desloratadine est décelable dans le plasma 30 minutes après l'administration. La biodisponibilité de la desloratadine (Cmax et AUC) est proportionnelle à la dose dans la fourchette comprise entre 5 mg et 20 mg. La biodisponibilité absolue n'est pas connue. La biodisponibilité de la desloratadine est la même après l'administration de 5 mg de desloratadine ou de 10 mg de loratadine.
Distribution
La liaison de la desloratadine aux protéines plasmatiques est modérée (83%–87%). Chez les patients souffrant d'insuffisance rénale ou hépatique, la liaison aux protéines de la desloratadine et de la 3-hydroxy-desloratadine est restée inchangée. Il n'existe aucun indice en faveur d'une accumulation cliniquement significative après une prise quotidienne unique de desloratadine (5–20 mg) pendant 14 jours.
Métabolisme
La desloratadine est largement métabolisée en 3-hydroxy-desloratadine, son métabolite actif, puis subit une glucuronidation. On ne connaît pas les enzymes responsables du métabolisme de la desloratadine. C'est pourquoi on ne peut pas exclure des interactions avec d'autres médicaments. Des études in vivo avec des inhibiteurs spécifiques du CYP3A4 et du CYP2D6 ont montré que ces enzymes ne sont pas importantes pour le métabolisme de la desloratadine.
Chez une partie de la population, la transformation de la desloratadine en 3-hydroxy-desloratadine est nettement ralentie suite à un polymorphisme phénotypique dans le métabolisme encore non élucidé. Environ 2% des Caucasiens et plus de 20% des Noirs présentent un rapport AUC DL/3-OH-DL >10 (normal <4) et sont qualifiés de métaboliseurs lents. Après la prise de doses répétées, l'exposition à la desloratadine (AUC) était six fois plus élevée chez des sujets adultes classés métaboliseurs lents que chez des sujets ayant un métabolisme normal. Les répercussions pharmacodynamiques de cette variante, notamment sur l'intervalle QTc, n'ont pas été complètement élucidées jusqu'ici.
L'exposition à la desloratadine après la prise de doses répétées n'a pas été étudiée chez l'enfant.
Elimination
La demi-vie terminale est d'environ 27 h. L'accumulation de la desloratadine a correspondu à sa demi-vie (environ 27 h) et à une administration une fois par jour. Une étude relative à l'équilibre des masses réalisée chez l'homme a montré qu'on retrouvait environ 87% de la dose totale de 14C-desloratadine sous forme de métabolites, répartis de façon équilibrée dans les urines et les fèces. L'analyse de la 3-hydroxy-desloratadine dans le plasma a mis en évidence un tmax et une demi-vie équivalents à ceux de la desloratadine. La desloratadine n'est pas éliminée par hémodialyse.
Etudes d'interactions
Dans les études d'interactions à doses répétées, la prise concomitante de 7,5 mg de desloratadine et de kétoconazole ou d'érythromycine a entraîné une faible augmentation de la concentration plasmatique de desloratadine (AUC), respectivement de 39% et 14%. En outre, on a observé une augmentation du métabolite actif, la 3-hydroxy-desloratadine, de 72% avec le kétoconazole et de 40% avec l'érythromycine. Aucune modification de l'ECG n'est survenue. Au cours de la prise concomitante de 5 mg de desloratadine et d'azithromycine, on a observé une augmentation des concentrations sériques maximales de 15% et de l'AUC de 5%. L'azithromycine n'a exercé aucune influence sur les paramètres pharmacocinétiques de la desloratadine.
Cinétique dans des situations particulières
Influence de l'alimentation
Une étude à dose unique de 7,5 mg de desloratadine n'a pas montré d'influence de l'alimentation (petit-déjeuner hypercalorique et riche en graisses) sur la pharmacocinétique de la desloratadine.
Dans une autre étude, le jus de pamplemousse n'a pas eu d'influence sur la biodisponibilité de la desloratadine.
Patients insuffisants rénaux
On ne dispose d'aucune expérience relative à l'administration répétée de la desloratadine chez des patients souffrant d'insuffisance rénale. Chez des patients présentant une insuffisance rénale stable de différents degrés, l'AUC de la desloratadine était multipliée par 1,5 voire 2,5 après une dose unique et la concentration de la 3-hydroxy-desloratadine était modifiée de manière minimale. La desloratadine n'était éliminée qu'en faible proportion (0,3%) par l'hémodialyse. Par ailleurs, la liaison aux protéines plasmatiques de la desloratadine et de la 3-hydroxy-desloratadine n'était pas modifiée en cas d'affections rénales; par conséquent, la concentration du principe actif libre n'était pas non plus modifiée.
Patients insuffisants hépatiques
Chez les patients souffrant d'une insuffisance hépatique modérée, l'aire sous la courbe (AUC) peut être multipliée par un facteur allant jusqu'à 3. La liaison aux protéines plasmatiques de la desloratadine et de la 3-hydroxy-desloratadine n'était pas modifiée chez les patients atteints d'une affection hépatique. La fréquence des effets indésirables n'était pas augmentée lors d'un traitement de 10 jours au maximum et chez des patients atteints d'une atteinte hépatique modérée (Child B).
Enfants et adolescents
Dans des études séparées à dose unique, les valeurs de l'AUC et de la Cmax chez les patients pédiatriques étaient, aux doses recommandées, comparables à celles trouvées chez les adultes ayant reçu 5 mg de desloratadine sous forme de sirop.
Données précliniques
Le potentiel cancérigène de la desloratadine a été examiné au cours d'une étude menée chez la souris et au cours d'une étude menée avec la loratadine chez le rat. La loratadine a été administrée avec la nourriture lors d'une étude réalisée chez le rat pendant 2 ans, à une dose allant jusqu'à 25 mg/kg/jour. Cette dose correspond à une exposition systémique à la desloratadine et à ses métabolites (représentée par l'AUC) environ 30 fois supérieure à celle obtenue chez l'être humain avec la dose journalière recommandée. Une augmentation significative de l'incidence des tumeurs hépatocellulaires (adénomes et carcinomes) a été observée chez les animaux mâles ayant reçu 10 mg/kg/jour de loratadine ainsi que chez les animaux mâles et femelles ayant reçu 25 mg/kg/jour de loratadine. L'exposition présumée à la desloratadine et aux métabolites de la loratadine chez le rat ayant reçu 10 mg/kg/jour, a correspondu à environ 7 fois l'AUC obtenue chez l'être humain avec la dose journalière recommandée. La pertinence clinique de ces observations pour une administration de desloratadine de longue durée est inconnue.
Une étude menée chez la souris pendant 2 ans avec des doses allant jusqu'à 16 mg/kg/jour pour les mâles et jusqu'à 32 mg/kg/jour pour les femelles, n'a mis en évidence aucune augmentation significative de l'incidence des tumeurs, quelles qu'elles soient. L'exposition estimée à la desloratadine et aux métabolites de la loratadine chez la souris recevant ces doses a correspondu à une AUC environ 12 fois supérieure pour les mâles et environ 27 fois supérieure pour les femelles à celle obtenue chez l'être humain avec la dose orale quotidienne recommandée.
Toxicologie de reproduction
Des études réalisées chez des rats à qui on a administré des doses par kg de poids corporel 34 fois supérieures à la dose clinique recommandée chez l'homme n'ont pas montré d'influence de la desloratadine sur la fertilité. A des doses très élevées, on a toutefois observé une diminution de la fertilité chez les rats mâles.
Remarques particulières
Stabilité
Les médicaments ne doivent pas être utilisés au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Conserver à température ambiante (15–25 °C).
Conserver les comprimés pelliculés dans leur emballage d'origine, pour les protéger de l'humidité.
Numéro d’autorisation
55689, 55958 (Swissmedic).
Titulaire de l’autorisation
MSD Merck Sharp & Dohme AG, Lucerne.
Mise à jour de l’information
Mars 2018
S-CCDS-MK4117-MTL-112017(deletion 60ml)/ MK4117-CHE-2019-019912
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.



 Deutsch
Deutsch French
French Italian
Italian








