Omnitrope cartridge for SurePal Inj Lös 15 mg / 1.5ml 5 pcs
Omnitrope Patrone für SurePal Inj Lös 15 mg/1.5ml 5 Stk
-
3,455.63 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: SANDOZ PHARMACEUT. AG
- Product Code: 6146319
- ATC-code H01AC01
- EAN 7680613060061
Ingredients:
Natriumchlorid, Natriumhydroxid, Phenol 4.5 mg, Natrium 4.70 mg, Somatropin ADNr 15 mg , Poloxamer 188, Phosphorsäure, Natrium dihydrogenphosphat-2-Wasser, Dinatrium-hydrogenphosphat-7-Wasser.

Description
Was ist Omnitrope und wann wird es angewendet?
Omnitrope enthält gentechnologisch hergestelltes, menschliches Wachstumshormon (auch Somatropin genannt). Es hat die gleiche Struktur und Eigenschaften wie das in der Hirnanhangdrüse (Hypophyse) des Menschen gebildete Wachstumshormon.
Die Anwendung erfolgt auf Verschreibung des Arztes oder der Ärztin.
Omnitrope wird bei kleinwüchsigen Kindern/Jugendlichen mit ungenügender körpereigener Wachstumshormon-Ausschüttung (Wachstumshormonmangel) oder bei vorgeburtlicher Entwicklungsverzögerung der Körperlänge, bei Wachstumsstörungen infolge chronischen Nierenversagens (sogenannte Niereninsuffizienz), beim sogenannten Prader-Willi-Syndrom zusammen mit einer kalorienreduzierten Diät sowie bei Mädchen mit sogenanntem Turner-Syndrom zur Wachstumsförderung eingesetzt.
Bei Erwachsenen kann Omnitrope sowohl bei ausgeprägtem Wachstumshormonmangel als Folge von Erkrankungen der Wachstumshormon produzierenden Drüsen (Hypothalamus und Hirnanhangdrüse) als auch zur Fortsetzung der Behandlung eines bereits in der Kindheit festgestellten Wachstumshormonmangels eingesetzt werden.
Vor der Behandlung mit Omnitrope wird der Arzt bzw. die Ärztin den Wachstumshormonmangel, die chronische Niereninsuffizienz, das Prader-Willi-Syndrom oder das Turner-Syndrom durch eine gründliche Untersuchung bestätigen. Eine Behandlung von Wachstumsstörungen sollte von einem Facharzt bzw. einer Fachärztin eingeleitet und sie sollte auch unter Kontrolle eines Facharztes bzw. einer Fachärztin weitergeführt werden.
Was sollte dazu beachtet werden?
Bei kleinwüchsigen Kindern/Jugendlichen ist Omnitrope nur auf das Körperwachstum wirksam, wenn die Wachstumsphase noch nicht abgeschlossen ist.
Jugendliche, die Leistungssport treiben, sollten beachten, dass der Wirkstoff von Omnitrope bei Dopingkontrollen einen positiven Befund geben kann.
Wann darf Omnitrope nicht angewendet werden?
Omnitrope darf nicht angewendet werden:
- Bei Überempfindlichkeit gegenüber Somatropin oder einem der in Omnitrope enthaltenen Hilfsstoffe (siehe Rubrik «Was ist in Omnitrope enthalten?»).
- Wenn Sie einen aktiven Tumor (Krebs) oder eine laufende Antitumorbehandlung haben.
- Wenn bei Ihnen eine schwerliegende Erkrankung vorliegt (z.B. Komplikationen nach operativen Eingriffen am offenen Herzen oder im Bauchraum, schwere Verletzungen, akute Atemnot oder Ähnliches).
- Bei gewissen (seltenen) angeborenen Krankheiten wie Down- oder Bloom-Syndrom oder Fanconi-Anämie.
Bei Patientinnen und Patienten mit schwerer Blutzuckerkrankheit (Diabetiker) kann der Arzt bzw. die Ärztin eine Therapie mit Omnitrope ausschliessen.
Wenn das Wachstum abgeschlossen ist (geschlossene Epiphysenfugen), ist Omnitrope nicht wirksam.
Wann ist bei der Anwendung von Omnitrope Vorsicht geboten?
Die Behandlung mit Omnitrope sollte von einem Arzt bzw. einer Ärztin überwacht werden, der/die in der Diagnose und Behandlung von Patienten mit Wachstumshormonmangel vertraut ist.
Bei einer Behandlung mit Wachstumshormon ist es unerlässlich, alle vom Arzt bzw. der Ärztin verordneten oder empfohlenen Kontrolluntersuchungen genau einzuhalten.
In Phasen eines starken Wachstums kann es bei Kindern zum Fortschreiten einer Skoliose (Krümmung der Wirbelsäule) kommen. Ihr Arzt bzw. Ihre Ärztin wird sie daher während der Behandlung mit einem Wachstumshormon entsprechend überwachen. Bei Patienten mit Prader-Willi-Syndrom (PWS) kommen Skoliosen häufig vor.
Pankreatitis: Selten kann unter Behandlung mit Omnitrope zu einer Entzündung der Bauchspeicheldrüse (Pankreatitis) kommen. Bei Auftreten von starken Oberbauchschmerzen sollten Sie umgehend Ihren Arzt bzw. Ihre Ärztin informieren.
Prader-Willi-Syndrom: Patienten mit Prader-Willi-Syndrom (PWS) müssen vor Beginn der Wachstumshormontherapie auf Anzeichen einer Verengung der Atemwege (Einsetzen oder Verschlimmerung des Schnarchens, pfeifendes Atemgeräusch), nächtlichen Atemstillstand oder Atemwegsinfektionen (z.B. Lungenentzündung) untersucht werden. Falls während der Behandlung mit Omnitrope Anzeichen für eine Verengung der Atemwege oder eine Atemwegsinfektion auftreten, müssen Sie sofort Ihren Arzt bzw. Ihre Ärztin kontaktieren.
Vor und während der Therapie mit Omnitrope muss eine effektive Gewichtskontrolle erfolgen. Die Behandlung sollte in Kombination mit einer kalorienreduzierten Diät durchgeführt werden.
Krebserkrankungen: Bei Patienten nach in der Kindheit überstandenen Krebserkrankungen, insbesondere bei solchen, die zur Behandlung ihrer Krebserkrankung eine Bestrahlung des Kopfes erhalten hatten, wurde unter einer Behandlung mit Wachstumshormonen über das Auftreten von Tumoren vor allem im Kopfbereich berichtet. Meist handelte es sich dabei um gutartige Geschwülste der Hirnhäute, es wurden aber auch bösartige Tumore und Leukämien beobachtet.
Bei Kindern mit bestimmten seltenen genetischen Ursachen eines Kleinwuchses wurde über ein erhöhtes Risiko für die Entwicklung von Krebserkrankungen berichtet. Sie werden während der Behandlung mit Omnitrope daher engmaschig durch den Arzt bzw. die Ärztin überwacht.
Bei Erwachsenen ist bisher nicht bekannt, ob ein Zusammenhang zwischen einer Behandlung mit Wachstumshormonen und dem erneuten Auftreten von Tumorerkrankungen bestehen könnte.
Bei Veränderungen oder Vergrösserungen von Muttermalen sollten Sie Ihren Arzt. bzw. Ihre Ärztin kontaktieren.
Benigne intrakranielle Hypertonie: In sehr seltenen Fällen kann unter der Behandlung mit Wachstumshormon eine Erkrankung des Gehirns mit einer Erhöhung des Hirndrucks auftreten. Dabei kommt es zu starken oder oft wiederkehrenden Kopfschmerzen, Sehstörungen (Doppelbilder, Einschränkung des Gesichtsfeldes), Bewusstseinsstörungen, Übelkeit und/oder Erbrechen. Sollte Ihr Kind anfangen, über solche Beschwerden zu klagen, müssen Sie unverzüglich Ihren Arzt bzw. Ihre Ärztin benachrichtigen. Er/Sie kann entscheiden, die Behandlung abzubrechen und eventuell erst später und unter sorgfältiger Kontrolle wieder aufzunehmen.
Blutzucker: Patienten mit Blutzuckerkrankheit oder bei familiärer Veranlagung dazu müssen speziell ärztlich überwacht werden, da Omnitrope den Blutzucker erhöhen und somit eine Erhöhung der Dosierung von Insulin erforderlich machen kann. Über eine solche Dosisanpassung kann nur der Arzt bzw. die Ärztin entscheiden.
Schilddrüsenfunktion: Unter einer Therapie mit Wachstumshormonen kann bei wenigen Patienten eine Schilddrüsenunterfunktion entstehen. Diese macht sich durch das Auftreten eines oder mehrerer der folgenden Zeichen bemerkbar: allgemeine Schwäche, leichte Ermüdbarkeit, psychische Störungen, Wasseransammlung in den Geweben (Ödeme, z.B. aufgedunsenes Gesicht), Gewichtszunahme, Verstopfung, Vertiefung der Stimme, deutliche Verlangsamung des Herzschlages. Deshalb wird Ihr Arzt bzw. Ihre Ärztin die Schilddrüsenhormone im Blut regelmässig kontrollieren und gegebenenfalls zusätzlich die Einnahme von Schilddrüsenhormon verschreiben.
Anwendung unter oraler Östrogentherapie: Bei Frauen, die mit Omnitrope behandelt werden und eine orale Therapie mit Östrogenen beginnen, muss möglicherweise die Dosis von Omnitrope erhöht werden. Bei Frauen, die unter der Therapie mit Omnitrope eine orale Östrogentherapie beenden, muss die Dosis von Omnitrope möglicherweise reduziert werden.
Skelettveränderungen: Teilen Sie Ihrem Arzt bzw. Ihrer Ärztin sofort mit, wenn Ihr Kind beim Gehen über Schmerzen oder eine Einschränkung der Gelenkbeweglichkeit in den Hüften oder Knien klagt und/oder anfängt zu hinken. In einem solchen Fall darf die Behandlung mit Omnitrope erst fortgesetzt werden, wenn der Arzt bzw. die Ärztin ausgeschlossen hat, dass diese Beschwerden durch eine Verschiebung des Oberschenkelhalses gegenüber dem Gelenkkopf (sogenannte Epiphysenlösung) oder durch eine so genannte Legg-Calvé-Perthes-Krankheit (Durchblutungsstörung des Hüftkopfes) hervorgerufen wurden.
Chronisches Nierenversagen: Bei chronischem Nierenversagen sollte Ihre Nierenfunktion von Ihrem Arzt oder Ihrer Ärztin während der Behandlung mit Omnitrope überwacht und behandelt werden. Erhält eine Patientin bzw. ein Patient mit chronischem Nierenversagen eine Spenderniere (Nierentransplantation), so wird der Arzt bzw. die Ärztin die Behandlung mit Omnitrope unabhängig vom Alter der Patientin bzw. des Patienten abbrechen.
Antikörperbildung: Bei wenigen Patienten kann es zur Bildung von Antikörpern gegen Omnitrope kommen. Falls Sie nicht wie erwartet auf die Behandlung mit Omnitrope ansprechen, wird Ihr Arzt bzw. Ihre Ärztin eine Kontrolle auf Antikörper gegen Somatropin durchführen.
Nebennierenrindenfunktion: Die Behandlung mit Omnitrope kann zu einer Beeinträchtigung der Nebennierenrindenfunktion führen. Dadurch kann eine Therapie mit Glukokortikoiden nötig werden. Falls Sie bereits eine Glukokortikoid-Substitutionstherapie erhalten, kann eine Anpassung der Dosis erforderlich sein.
Ältere Patienten: Die Erfahrungen bei Patienten/Innen über 60 Jahren sind beschränkt. Ältere Patienten/Innen reagieren evtl. empfindlicher auf die Wirkung von Omnitrope; daher kann es bei ihnen eher zu Nebenwirkungen kommen.
Wechselwirkungen mit anderen Arzneimitteln
Durch gleichzeitige Einnahme gewisser anderer Arzneimittel kann die wachstumsfördernde Wirkung von Omnitrope beeinflusst werden. Dazu gehören insbesondere gewisse Hormonpräparate, wie Kortikosteroide (z.B. Cortison, Prednison), Schilddrüsenhormone (z.B. Thyroxin) und Geschlechtshormone (z.B. Östrogene, Testosteron). Nur Ihr Arzt bzw. Ihre Ärztin kann über eine allfällige Anpassung der Dosierung dieser Präparate bzw. von Omnitrope entscheiden und er/sie wird Ihnen erklären, welche Vorsichtsmassnahmen in solchen Fällen zu beachten sind.
Zur Schwangerschaftsverhütung sind deshalb nicht hormonale Methoden zu bevorzugen.
Omnitrope 5, 10 und 15 enthalten weniger als 1 mmol Natrium (23 mg) pro Patrone, d.h. es ist nahezu «natriumfrei».
Benzylalkohol
Omnitrope 5 enthält 13,5 mg Benzylalkohol pro Patrone entsprechend 9 mg/ml. Benzylalkohol kann allergische Reaktionen hervorrufen. Wenn Sie an einer Leber- oder Nierenerkrankung leiden, fragen Sie Ihren Arzt oder Apotheker um Rat, da grosse Mengen Benzylalkohol sich in Ihrem Körper anreichern und Nebenwirkungen verursachen können (so genannte «metabolische Azidose»).
Benzylalkohol wurde mit dem Risiko schwerwiegender Nebenwirkungen, einschliesslich Atemproblemen (so genanntes «Gasping-Syndrom») bei Kleinkindern in Verbindung gebracht. Wenden Sie dieses Arzneimittel nicht bei Ihrem neugeborenen Baby (jünger als 4 Wochen) an,
es sei denn, Ihr Arzt hat es empfohlen.
Wenden Sie dieses Arzneimittel bei Kleinkindern (unter 3 Jahren) nicht länger als eine Woche an, ausser auf Anraten Ihres Arztes oder Apothekers.
Wenn Sie schwanger sind oder stillen, fragen Sie Ihren Arzt oder Apotheker um Rat, da sich in Ihrem Körper grosse Mengen Benzylalkohol anreichern und Nebenwirkungen verursachen können (so genannte «metabolische Azidose»).
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie
- an anderen Krankheiten leiden,
- Allergien haben oder
- andere Arzneimittel (auch selbst gekaufte!) einnehmen oder äusserlich anwenden.
Darf Omnitrope während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Omnitrope sollte während der Schwangerschaft nicht verabreicht werden. Deswegen sollte jede Patientin während der Therapie eine sichere Empfängnisverhütung auf nicht-hormoneller Basis betreiben, d.h. keine Anti-Baby-Pille zur Verhütung benutzen.
Da nicht bekannt ist, ob Omnitrope in die Muttermilch übergeht, sollte vorsichtshalber abgestillt werden.
Wie verwenden Sie Omnitrope?
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Der Wirkstoff von Omnitrope ist ein Eiweiss-Hormon, das, wenn es geschluckt wird, ebenso wie mit der Nahrung aufgenommenes Eiweiss im Magen verdaut wird. Weil es durch den Verdauungsprozess wirkungslos würde, muss es unter die Haut (subkutan) gespritzt werden.
Die Dosierung und die Behandlungsdauer werden vom Arzt bzw. der Ärztin auf jede Patientin bzw. jeden Patienten persönlich abgestimmt und festgelegt.
Normalerweise werden verabreicht:
- bei Kindern/Jugendlichen mit Wachstumshormonmangel 0,025–0,035 mg pro kg Körpergewicht und Tag;
- bei Prader-Willi-Syndrom 0,035 mg pro kg Körpergewicht und Tag. Die tägliche Dosis von 2,7 mg sollte nicht überschritten werden. Der Kohlenhydratstoffwechsel sollte vom Arzt bzw. der Ärztin kontrolliert werden;
- bei Erwachsenen mit Wachstumshormonmangel wird die Dosis individuell eingestellt, abhängig davon, wie Sie auf die Therapie ansprechen und welche Nebenwirkungen bei Ihnen auftreten. Bei Erwachsenen, welche die Wachstumshormon-Therapie nach einem Wachstumshormonmangel in der Kindheit fortsetzen, wird die Behandlung mit einer Dosis von 0,2–0,5 mg pro Tag empfohlen. Bei Patienten/Innen, bei denen der Wachstumshormonmangel erst im Erwachsenenalter festgestellt wird, wird normalerweise mit 0,15–0,30 mg pro Tag begonnen. Die Erhaltungsdosis übersteigt selten 1,33 mg pro Tag. Mit zunehmendem Alter nimmt die benötigte Dosis ab. Bei Patienten/Innen über 60 Jahren sollte die Therapie mit einer Dosis von 0,1–0,2 mg pro Tag beginnen. Die Erhaltungsdosis übersteigt bei diesen Patienten/Innen selten 0,5 mg pro Tag;
- bei Turner-Syndrom und bei chronischer Niereninsuffizienz 0,045–0,050 mg pro kg Körpergewicht und Tag;
- bei kleinwüchsigen Kindern mit vorgeburtlicher Entwicklungsverzögerung der Körperlänge 0,033–0,067 mg pro kg Körpergewicht und Tag.
Die genaue vom Arzt bzw. der Ärztin festgelegte Einzeldosis wird subkutan (unter die Haut) gespritzt. Der Arzt bzw. die Ärztin verschreibt dazu Omnitrope in der erforderlichen Dosierungsstärke und er/sie oder die von ihm/ihr bezeichnete Fachperson gibt Ihnen genaue Instruktionen zur Spritztechnik. Bitte wenden Sie sich bei der geringsten Unsicherheit bezüglich des Vorgehens an diese Spezialisten.
Wichtig: Bitte lesen Sie vor der ersten Anwendung mit dem SurePalTM 5 (Pen), SurePalTM 10 (Pen), SurePalTM 15 (Pen) die ausführliche Anleitung sorgfältig durch.
Hinweise zur Anwendung
Spritzen Sie die Omnitropelösung, wie vom Arzt bzw. der Ärztin oder der Fachperson instruiert, subkutan (unter die Haut) in den Oberschenkel, eventuell auch in die Bauchdecke oder in das Gesäss. Um Rückbildungserscheinungen (Gewebeschrumpfung unter der Haut, sogenannte Lipoatrophie) an der Injektionsstelle zu vermeiden, müssen Sie diese täglich wechseln, d.h. es sollte nie zweimal hintereinander in die genau gleiche Hautstelle gespritzt werden. Die Injektionsstelle soll nicht massiert werden.
Die vom Arzt bzw. der Ärztin verordnete Dosis wird allgemein abends vor dem Zubettgehen verabreicht.
Wenn Sie einmal eine Dosis vergessen haben, dann fahren Sie am darauffolgenden Tag wie gewohnt weiter. Auf keinen Fall dürfen Sie die verpasste Dosis zusammen mit der nächsten spritzen.
Die Behandlung dauert im Allgemeinen Jahre, d.h. so lange, bis mit einer Fortsetzung der Behandlung mit Omnitrope kein weiteres Wachstum mehr erzielt werden kann. Das ist der Fall, wenn in den Oberschenkeln die sogenannten Epiphysenfugen, d.h. die Übergänge zwischen den langen Röhrenknochen und den Gelenkköpfen, geschlossen sind und damit das Knochenwachstum beendet ist. Dieser Zustand kann nur vom Arzt bzw. der Ärztin festgestellt werden.
Alle vom Arzt bzw. der Ärztin verordneten oder empfohlenen Kontrolluntersuchungen sind genauestens einzuhalten.
Welche Nebenwirkungen kann Omnitrope haben?
Folgende Nebenwirkungen können bei der Anwendung von Omnitrope auftreten:
Häufig (betrifft 1 bis 10 von 100 Anwendern)
Bei Erwachsenen: Empfindungsstörungen/Kribbeln, Steifheit in Armen und Beinen, Gelenkschmerzen, Muskelschmerzen, Wassereinlagerung (die sich als geschwollene Finger oder geschwollene Fussgelenke äussert).
Bei Kindern: Vorübergehende Rötung, Juckreiz, Brennen oder Schmerz an der Einstichstelle.
Gelegentlich (betrifft 1 bis 10 von 1000 Anwendern)
Bei Erwachsenen: Schmerzen oder Brennen an Händen oder Unterarmen (bekannt als Karpaltunnelsyndrom).
Bei Kindern: Empfindungsstörungen/Kribbeln, Steifheit in Armen und Beinen, Gelenkschmerzen, Muskelschmerzen, Wassereinlagerung (die sich als geschwollene Finger oder geschwollene Fussgelenke äussert), Hautausschlag, Juckreiz, Nesselfieber.
Selten (betrifft 1 bis 10 von 10'000 Anwendern)
Bei Erwachsenen: Anstieg des Blutzuckers, Diabetes mellitus, Auftreten von Zeichen einer Unterfunktion der Schilddrüse, erhöhter Hirndruck (mit Beschwerden wie starken Kopfschmerzen, Sehstörungen oder Erbrechen), Vergrösserung der Brustdrüse beim Mann.
Bei Kindern: Erhöhter Hirndruck (mit Beschwerden wie starken Kopfschmerzen, Sehstörungen oder Erbrechen), vorzeitig (im Kindesalter) auftretendes Wachstum einer oder beider Brustdrüsen.
Sehr selten (betrifft weniger als 1 von 10'000 Anwendern)
Bei Kindern: Leukämie (bei einer kleinen Anzahl von Kindern mit Wachstumshormonmangel, von denen einige Somatropin erhielten, wurde über das Auftreten von Leukämie berichtet. Es gibt jedoch keinen Hinweis darauf, dass eine Wachstumshormontherapie die Häufigkeit von Leukämien bei Patienten ohne prädisponierende Faktoren erhöht).
Einzelfälle
Bei Erwachsenen: Schlafapnoe (Unterbrechung der Atmung im Schlaf) bei Patienten mit Prader-Willi-Syndrom, Grössenzunahme oder Veränderungen von vorbestehenden Muttermalen, Hautausschlag, Juckreiz, Nesselfieber, Schwellung im Gesicht (aufgrund Wassereinlagerung).
Bei Kindern: Epiphysenlösung, Legg-Calvé-Perthes-Krankheit (siehe «Wann ist bei der Anwendung von Omnitrope Vorsicht geboten?»), Bauchspeicheldrüsenentzündung (die sich als starke Oberbauchschmerzen äussert), Schwellung im Gesicht (aufgrund Wassereinlagerung).
Seltene Fälle von plötzlichem Tod bei Patienten mit Prader-Willi-Syndrom unter Somatropin-Behandlung wurden berichtet. Es konnte jedoch kein eindeutiger Zusammenhang mit der Somatropin-Behandlung nachgewiesen werden.
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Lagerungshinweis
Nach der ersten Anwendung die Patrone während maximal 28 Tagen verwenden.
In der Originalverpackung, im Kühlschrank (2–8°C), vor Licht geschützt und ausser Reichweite von Kindern lagern. Nicht einfrieren.
Eine einmal gefrorene Omnitropelösung darf nicht mehr verwendet werden.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Omnitrope enthalten?
Wirkstoffe
Eine 1,5 ml Patrone Omnitrope 5 enthält: 5 mg des Wirkstoffes Somatropin.
Eine 1,5 ml Patrone Omnitrope 10 enthält: 10 mg des Wirkstoffes Somatropin.
Eine 1,5 ml Patrone Omnitrope 15 enthält: 15 mg des Wirkstoffes Somatropin.
Hilfsstoffe
Eine 1,5 ml Patrone Omnitrope 5 enthält: Dinatriumhydrogenphosphat-Heptahydrat, Natriumdihydrogenphosphat-Dihydrat, Poloxamer 188, Benzylalkohol, Mannitol, Phosphorsäure, Natriumhydroxid und Wasser für Injektionszwecke.
Eine 1,5 ml Patrone Omnitrope 10 enthält: Dinatriumhydrogenphosphat-Heptahydrat, Natriumdihydrogenphosphat-Dihydrat, Poloxamer 188, Phenol, Glycin, Phosphorsäure, Natriumhydroxid und Wasser für Injektionszwecke.
Eine 1,5 ml Patrone Omnitrope 15 enthält: Dinatriumhydrogenphosphat-Heptahydrat, Natriumdihydrogenphosphat-Dihydrat, Poloxamer 188, Phenol, Natriumchlorid, Phosphorsäure, Natriumhydroxid und Wasser für Injektionszwecke.
Zulassungsnummer
61306 (Swissmedic)
Wo erhalten Sie Omnitrope? Welche Packungen sind erhältlich?
Sie erhalten Omnitrope in Apotheken gegen ärztliche Verschreibung, die nur zum einmaligen Bezug berechtigt, in folgenden Packungsgrössen:
Omnitrope 5: 1, 5 und 10 Patronen (zu je 1,5 ml) für den SurePalTM 5 (Pen).
Omnitrope 10: 1, 5 und 10 Patronen (zu je 1,5 ml) für den SurePalTM 10 (Pen).
Omnitrope 15: 1 und 5 Patronen (zu je 1,5 ml) für den SurePalTM 15 (Pen).
Zulassungsinhaberin
Sandoz Pharmaceuticals AG, Risch; Domizil: Rotkreuz
Diese Packungsbeilage wurde im September 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu’est-ce que l’Omnitrope et quand doit-il être utilisé?
Omnitrope contient une hormone de croissance humaine (aussi appelée somatropine) produite par génie génétique. Elle possède la même structure et les mêmes propriétés que l'hormone humaine libérée par l'hypophyse.
Il est utilisé sur prescription du médecin.
Omnitrope est utilisé pour stimuler la croissance chez les enfants/adolescents de petite taille présentant une insuffisance au niveau de la sécrétion de l'hormone de croissance (déficit en hormone de croissance) ou lors d'un retard du développement intrautérin de la longueur du corps, des troubles de la croissance dus à une insuffisance rénale chronique, en cas de syndrome de Prader-Willi en association à un régime hypocalorique, ainsi que chez les fillettes atteintes du syndrome de Turner.
Chez les adultes, le traitement par Omnitrope peut tout aussi bien être instauré dans le cadre d'un déficit marqué en hormone de croissance, consécutif à une affection des glandes productrices de l'hormone de croissance (hypothalamus et hypophyse) que pour poursuivre le traitement d'un déficit en hormone de croissance constaté au cours de l'enfance. Avant l'instauration d'un traitement d'Omnitrope, le médecin confirmera le déficit en hormone de croissance, l'insuffisance rénale chronique, le syndrome de Prader-Willi ou le syndrome de Turner par un examen approfondi. Seul un médecin spécialiste pourra ordonner un traitement lors de problèmes de croissance. De même, la poursuite d'un traitement ne se fera que sous le contrôle d'un médecin spécialiste.
De quoi faut-il tenir compte en dehors du traitement?
Chez les enfants/adolescents de petite taille, Omnitrope n'agira sur la croissance corporelle que si la phase de croissance n'est pas terminée.
Les adolescents pratiquant un sport de compétition doivent savoir que le principe actif d'Omnitrope peut donner un résultat positif lors d'un contrôle antidopage.
Quand Omnitrope ne doit-il pas être utilisé?
Omnitrope ne doit pas être utilisé:
- En cas d'hypersensibilité à la somatropine ou à l'un des excipients d'Omnitrope (voir rubrique «Que contient Omnitrope?»).
- Si vous présentez une tumeur active (cancer) ou que vous recevez actuellement un traitement anticancéreux.
- Si vous présentez une maladie grave (p.ex. complications après une intervention chirurgicale à cœur ouvert ou abdominale, des blessures graves, une détresse respiratoire aiguë ou d'autres affections de ce genre).
- Dans certaines maladies congénitales (rares) (comme le syndrome de Down ou le syndrome de Bloom ou une anémie de Fanconi).
Le médecin pourra ne pas prescrire un traitement d'Omnitrope chez les patients gravement diabétiques.
Lorsque la croissance est terminée (cartilages de conjugaison fermés), Omnitrope n'agit pas.
Quelles sont les précautions à observer lors de l’utilisation d’Omnitrope?
Le traitement par Omnitrope doit être surveillé par un médecin expérimenté dans le diagnostic et le traitement des patients présentant un déficit en hormone de croissance.
Lors d'un traitement par l'hormone de croissance, il est absolument nécessaire de se conformer aux visites médicales de contrôle fixées ou recommandées par le médecin.
Lors des phases de forte croissance, la progression d'une scoliose (déformation de la colonne vertébrale) est possible chez l'enfant. De ce fait, le médecin vous surveillera en conséquence pendant le traitement par l'hormone de croissance. Les scolioses sont fréquentes chez les patients atteints du syndrome de Prader-Willi (PWS).
Pancréatite: Dans de rares cas, une inflammation du pancréas (pancréatite) peut se produire lors du traitement par Omnitrope. Si de fortes douleurs abdominales hautes surviennent, informez-en immédiatement votre médecin.
Syndrome de Prader-Willi: Les patients atteints d'un syndrome de Prader-Willi (PWS) doivent être examinés à la recherche de signes d'un rétrécissement des voies respiratoires (apparition ou intensification de ronflements, respiration sifflante), d'arrêts respiratoires nocturnes ou d'infections des voies respiratoires (p.ex. pneumonie) avant le début d'un traitement par l'hormone de croissance. Vous devez contacter immédiatement votre médecin en cas d'apparition de signes d'un rétrécissement des voies respiratoires ou d'une infection des voies respiratoires pendant le traitement.
Avant et pendant le traitement par Omnitrope, le poids doit être contrôlé efficacement. Le traitement doit être associé à un régime hypocalorique.
Cancers: Chez les patients qui ont surmonté un cancer pendant l'enfance, surtout chez ceux qui ont reçu une radiothérapie de la tête pour traiter leur cancer, l'apparition de tumeurs, essentiellement au niveau de la tête, a été signalée en cas de traitement par hormones de croissance. Il s'agissait, dans la plupart des cas, de tumeurs bénignes des méninges. Toutefois, des tumeurs malignes et des leucémies ont également été observées.
Chez des enfants présentant certaines causes génétiques rares de nanisme, un risque accru de développement de cancers a été rapporté. Ils sont donc surveillés étroitement par leur médecin pendant leur traitement par Omnitrope.
Chez l'adulte, on ne sait pas encore s'il est possible d'établir un rapport entre un traitement par hormones de croissance et des récidives des tumeurs.
Veuillez contacter immédiatement votre médecin en cas de modifications ou de grossissements de grains de beauté.
Hypertension intracrânienne bénigne: Dans de très rares cas, une maladie du cerveau se manifestant par une augmentation de la pression intracrânienne peut apparaître lors d'un traitement par l'hormone de croissance. Les symptômes accompagnateurs sont des maux de tête forts ou répétitifs, des problèmes de vue (vue double ou rétrécissement du champ visuel), des pertes de connaissance, des nausées et/ou des vomissements. Veuillez alerter immédiatement votre médecin si votre enfant venait à se plaindre de tels symptômes. Il pourra décider d'interrompre le traitement puis de le reprendre éventuellement plus tard sous surveillance médicale étroite.
Diabète: Les patients diabétiques ou montrant une prédisposition familiale doivent faire l'objet d'une surveillance médicale spéciale. En effet, Omnitrope peut provoquer une augmentation du taux de sucre dans le sang, nécessitant alors l'augmentation de la dose d'insuline. Seul le médecin traitant pourra procéder en conséquence à l'adaptation du dosage.
Fonction thyroïdienne: Sous traitement par l'hormone de croissance, un déficit de la fonction thyroïdienne peut apparaître chez quelques patients. Ce déficit se manifeste par l'apparition d'un ou de plusieurs des symptômes suivants: faiblesse générale, fatigue rapide, troubles psychiques, accumulation d'eau dans les tissus (œdèmes, p.ex. visage gonflé), prise de poids, constipation, voix devenant plus grave, ralentissement net des battements cardiaques. C'est pourquoi le taux sanguin de vos hormones thyroïdiennes sera contrôlé régulièrement par votre médecin. La prescription d'hormones thyroïdiennes par votre médecin traitant pourra éventuellement être nécessaire.
Utilisation en même temps que des estrogènes oraux: Chez les femmes qui sont traitées par Omnitrope et qui commencent un traitement par des estrogènes oraux, la dose d'Omnitrope devra peut-être être augmentée. Chez les femmes qui sont traitées par Omnitrope et qui terminent un traitement par des estrogènes oraux, la dose d'Omnitrope devra peut-être être réduite.
Modifications squelettiques: Veuillez immédiatement alerter votre médecin si votre enfant se plaint de douleurs ou d'une diminution de la mobilité articulaire dans les hanches ou les genoux en marchant et/ou s'il commence à boiter. Dans ce cas, le traitement par Omnitrope ne sera poursuivi que lorsque le médecin aura exclu que ces symptômes sont en relation avec un déplacement de la tête du fémur par rapport au col du fémur (appelé décollement de l'épiphyse) ou avec une maladie appelée maladie de Legg-Calvé -Perthes (trouble de l'irrigation sanguine de la tête du fémur).
Insuffisance rénale chronique: En cas d'insuffisance rénale chronique, votre fonction rénale doit être surveillée et traitée par votre médecin pendant votre traitement par Omnitrope. Si un patient souffrant d'insuffisance rénale chronique reçoit le rein d'un donneur (transplantation rénale), le traitement par Omnitrope sera interrompu par le médecin, et cela quel que soit l'âge du patient.
Formation d'anticorps: Chez quelques patients, des anticorps dirigés contre Omnitrope peuvent se former. Si vous ne réagissez pas à Omnitrope comme attendu, votre médecin procédera à un contrôle des anticorps contre la somatropine.
Fonction surrénalienne: Le traitement par Omnitrope peut entraîner une altération de la fonction des glandes surrénales, qui peut nécessiter un traitement par des glucocorticoïdes. Si vous recevez déjà une glucocorticothérapie substitutive, un ajustement de la dose peut être nécessaire.
Patients âgés: L'expérience chez les patientes et les patients de plus de 60 ans est limitée. Les patientes et les patients d'un certain âge peuvent éventuellement réagir de manière plus sensible à l'effet d'Omnitrope; chez eux, les effets indésirables peuvent donc survenir plus facilement.
Interactions avec d'autres médicaments
La prise simultanée de certains autres médicaments peut influencer l'effet d'Omnitrope sur la croissance. Il s'agit en particulier de certains médicaments à base d'hormones, tels que les corticostéroïdes (p.ex. cortisone, prednisone), les hormones thyroïdiennes (p.ex. thyroxine) et les hormones sexuelles (p.ex. estrogènes, testostérone). Seul votre médecin peut décider d'un éventuel ajustement de la posologie de ces médicaments ou d'Omnitrope. Il vous expliquera dans ce cas les mesures de précaution à respecter.
Pour cette raison, les moyens de contraception non hormonaux sont à privilégier.
Omnitrope 5, 10 et 15 contiennent moins de 1 mmol (23 mg) de sodium par cartouche, c.-à-d. qu'il est essentiellement «sans sodium».
Alcool benzylique
Omnitrope 5 contient 13,5 mg d'alcool benzylique par cartouche équivalent à 9 mg/ml. L'alcool benzylique peut provoquer des réactions allergiques. Demandez conseil à votre médecin ou à votre pharmacien si vous souffrez d'une maladie du foie ou du rein. De grandes quantités d'alcool benzylique peuvent s'accumuler dans votre corps et entraîner des effets secondaires (appelés «acidose métabolique»).
L'alcool benzylique est associé à un risque d'effets secondaires graves y compris des problèmes respiratoires (appelés «syndrome de suffocation») chez les jeunes enfants. Ne pas utiliser chez le nouveau-né (jusqu'à 4 semaines) sauf recommandation contraire de votre médecin.
Ne pas utiliser pendant plus d'une semaine chez les jeunes enfants (moins de 3 ans), sauf avis contraire de votre médecin ou de votre pharmacien.
Demandez conseil à votre médecin ou à votre pharmacien si vous êtes enceinte ou si vous allaitez. De grandes quantités d'alcool benzylique peuvent s'accumuler dans votre corps et entraîner des effets secondaires (appelés «acidose métabolique»).
Veuillez informer votre médecin ou votre pharmacien si
- vous souffrez d'une autre maladie,
- vous êtes allergique ou
- vous prenez ou utilisez déjà d'autres médicaments en usage interne ou externe (même en automédication!).
Omnitrope peut-il être utilisé pendant la grossesse ou l’allaitement?
Omnitrope ne doit pas être administré durant une grossesse. C'est pourquoi, pendant le traitement d'Omnitrope, chaque patiente devra utiliser une méthode de contraception sûre et non hormonale, c'est-à-dire une autre méthode contraceptive que la pilule.
Comme aucune donnée concernant le passage d'Omnitrope dans le lait maternel n'est disponible, le sevrage est conseillé.
Comment utiliser Omnitrope?
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
La substance active d'Omnitrope est une hormone protéique. Comme les protéines ingérées avec la nourriture, elle est digérée dans l'estomac et perd ainsi ses effets. C'est la raison pour laquelle la somatropine doit être injectée sous la peau (injection sous-cutanée).
La posologie et la durée du traitement seront déterminées par le médecin traitant et adaptées individuellement pour chaque patient.
La posologie normale est la suivante:
- enfants/adolescents avec déficit en hormone de croissance: 0,025–0,035 mg par kg de poids corporel et par jour;
- en cas de syndrome de Prader-Willi: 0,035 mg par kg de poids corporel et par jour. Une dose journalière de 2,7 mg ne devrait pas être dépassée. Le métabolisme des glucides devra être contrôlé par le médecin;
- chez les adultes ayant un déficit en hormone de croissance, la dose sera fixée individuellement, en fonction de la réponse au traitement et des effets secondaires observés. Chez les adultes qui poursuivent le traitement par l'hormone de croissance après un déficit en hormone de croissance au cours de l'enfance, un traitement à une dose de 0,2 à 0,5 mg par jour est recommandé. Pour les patientes et les patients chez lesquels le déficit en hormone de croissance n'a été constaté qu'à l'âge adulte, la dose journalière initiale est normalement de 0,15–0,30 mg. La dose d'entretien journalière dépasse rarement 1,33 mg. La dose nécessaire diminue avec l'âge. Chez les patientes et les patients de plus de 60 ans, le traitement doit commencer avec une dose de 0,1 à 0,2 mg par jour. La dose d'entretien journalière dépasse rarement 0,5 mg chez eux;
- en cas de syndrome de Turner et d'insuffisance rénale chronique: 0,045–0,050 mg par kg de poids corporel et par jour;
- chez les enfants de petite taille avec un retard du développement intrautérin de la longueur du corps: 0,033–0,067 mg par kg de poids corporel et par jour.
La dose unique exacte déterminée par le médecin traitant sera injectée sous la peau (injection sous-cutanée). Le médecin prescrira Omnitrope au dosage nécessaire. Le médecin ou une personne spécialisée qu'il vous indiquera, vous donnera des instructions précises pour effectuer l'injection. N'hésitez pas à vous adresser à ces spécialistes à la moindre incertitude.
Important: veuillez lire attentivement les notices explicatives et exhaustives qui accompagnent SurePalTM 5 (Pen), SurePalTM 10 (Pen), SurePalTM 15 (Pen) avant la première manipulation.
Recommandations lors de l'utilisation
Administrez la solution d'Omnitrope comme votre médecin ou une personne spécialisée vous l'a appris, en injection sous-cutanée (sous la peau) dans la cuisse, éventuellement sous la peau du ventre ou de la fesse. L'endroit de la piqûre devra être différent chaque jour afin d'éviter un amincissement des tissus sous-cutanés à l'endroit de l'injection (ce qu'on appelle lipo-atrophie), autrement dit: ne jamais faire une injection au même endroit deux fois de suite. L'endroit de l'injection ne doit pas être massé.
La dose prescrite par le médecin traitant s'administre généralement le soir avant le coucher.
S'il devait vous arriver d'oublier une dose, continuez le lendemain comme si de rien n'était. En aucun cas vous ne devez administrer la dose oubliée avec la dose suivante.
La durée du traitement est généralement de plusieurs années, soit jusqu'au moment où la poursuite d'un traitement par Omnitrope ne provoque plus de croissance supplémentaire. Ce moment est atteint lorsque les cartilages de conjugaison des fémurs, c'est-à-dire les zones de croissance qui se trouvent entre la partie longue (tubulaire) du fémur et la partie articulaire, sont fermés, mettant ainsi fin à la croissance osseuse. Seul un médecin peut déterminer ce moment.
Vous devez respecter scrupuleusement tous les rendez-vous pour les contrôles médicaux fixés ou recommandés.
Quels effets secondaires Omnitrope peut-il provoquer?
L'utilisation d'Omnitrope peut provoquer les effets indésirables suivants:
Fréquent (concerne 1 à 10 utilisateurs sur 100)
Chez les adultes: Troubles sensoriels/fourmillement, raideur dans les bras et les jambes, douleurs articulaires, douleurs musculaires, accumulation d'eau (qui se manifeste par un gonflement des doigts ou des chevilles).
Chez les enfants: Rougeur, démangeaison, sensation de brûlures ou douleur temporaire au point d'injection.
Occasionnel (concerne 1 à 10 utilisateurs sur 1000)
Chez les adultes: Douleurs ou sensations de brûlure aux mains ou aux avant-bras (connues comme le syndrome du tunnel carpien).
Chez les enfants: Troubles sensoriels/fourmillement, raideur dans les bras et les jambes, douleurs articulaires, douleurs musculaires, accumulation d'eau (qui se manifeste par un gonflement des doigts ou des chevilles), rash cutané, démangeaison, urticaire.
Rare (concerne 1 à 10 utilisateurs sur 10'000)
Chez les adultes: Augmentation de la glycémie (taux de sucre sanguin), diabète, apparition de signes de hypothyroïdie, augmentation de la pression intracrânienne (accompagnée de symptômes tels que maux de tête sévères, troubles de la vue ou vomissements), augmentation du volume de la glande mammaire chez l'homme.
Chez les enfants: Augmentation de la pression intracrânienne (accompagnée de symptômes tels que maux de tête sévères, troubles de la vue ou vomissements), croissance précoce (pendant l'enfance) de l'une des glandes mammaires ou des deux.
Très rare (concerne moins d'un utilisateur sur 10'000)
Chez les enfants: Leucémie (des cas ont été rapportés chez un faible nombre d'enfants souffrant d'un déficit en hormone de croissance, dont certains ayant été traités par somatropine. Toutefois, rien ne prouve que l'incidence de la leucémie est accrue chez les patients traités par hormone de croissance sans facteurs prédisposants).
Cas isolés
Chez les adultes: Apnée du sommeil (interruption de la respiration pendant le sommeil) chez les patients atteints d'un syndrome de Prader-Willi, agrandissement ou modifications de grains de beauté préexistants, rash cutané, démangeaison, urticaire, gonflement du visage (dû à une rétention hydrique).
Chez les enfants: Épiphysiolyse, maladie de Legg-Calvé-Perthes (cf. «Quelles sont les précautions à observer lors de l'utilisation d'Omnitrope?»), inflammation du pancréas (qui se manifeste par de fortes douleurs abdominales hautes), gonflement du visage (dû à une rétention hydrique.
Des rares cas de mort subite ont été rapportés chez des patients atteints du syndrome de Prader-Willi et traités par somatropine. Toutefois, aucun rapport formel avec le traitement par somatotropine n'a été démontré.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
À quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Après sa 1ère utilisation, la cartouche peut être administrée au maximum durant 28 jours.
Conserver dans l'emballage original, au réfrigérateur (2–8°C), à l'abri de la lumière et hors de la portée des enfants. Ne pas congeler.
Une solution d'Omnitrope qui a été congelée ne doit plus être utilisée.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Omnitrope?
Principes actifs
Une cartouche d'1,5 ml d'Omnitrope 5 contient: 5 mg de somatropine comme principe actif.
Une cartouche d'1,5 ml d'Omnitrope 10 contient: 10 mg de somatropine comme principe actif.
Une cartouche d'1,5 ml d'Omnitrope 15 contient: 15 mg de somatropine comme principe actif.
Excipients
Une cartouche d'1,5 ml d'Omnitrope 5 contient: Hydrogénophosphate disodique heptahydraté, hydrogénophosphate de sodium dihydraté, poloxamère 188, alcool benzylique, mannitol, acide phosphorique, hydroxyde de sodium et eau pour préparations injectables.
Une cartouche d'1,5 ml d'Omnitrope 10 contient: Hydrogénophosphate disodique heptahydraté, hydrogénophosphate de sodium dihydraté, poloxamère 188, phénol, glycine, acide phosphorique, hydroxyde de sodium et eau pour préparations injectables.
Une cartouche d'1,5 ml d'Omnitrope 15 contient: Hydrogénophosphate disodique heptahydraté, hydrogénophosphate de sodium dihydraté, poloxamère 188, phénol, chlorure de sodium, acide phosphorique, hydroxyde de sodium et eau pour préparations injectables.
Numéro d’autorisation
61306 (Swissmedic)
Où obtenez-vous Omnitrope? Quels sont les emballages à disposition sur le marché?
Vous obtenez Omnitrope en pharmacie, seulement sur ordonnance médicale non renouvelable, dans les emballages suivants:
Omnitrope 5: 1, 5 et 10 cartouches (à 1,5 ml chacune) pour SurePalTM 5 (Pen).
Omnitrope 10: 1, 5 et 10 cartouches (à 1,5 ml chacune) pour SurePalTM 10 (Pen).
Omnitrope 15: 1 et 5 cartouches (à 1,5 ml chacune) pour SurePalTM 15 (Pen).
Titulaire de l’autorisation
Sandoz Pharmaceuticals SA, Risch; domicile: Rotkreuz
Cette notice d'emballage a été vérifiée pour la dernière fois en septembre 2020 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos’è Omnitrope e quando si usa?
Omnitrope contiene ormone della crescita umano (anche chiamato somatropina) preparato mediante tecnologia genetica. Ha la stessa struttura e le proprietà dell'ormone della crescita prodotto dalla ghiandola pituitaria (ipofisi) dell'uomo.
L'utilizzo avviene su prescrizione medica.
Omnitrope si usa per bambini/adolescenti con deficit di statura dovuto a insufficiente secrezione di ormone della crescita da parte dell'organismo (carenza di ormone della crescita) o in caso di ritardo dello sviluppo intrauterino della lunghezza del corpo, in caso di disturbi della crescita conseguenti a insufficienza renale cronica, nella cosiddetta sindrome di Prader-Willi parallelamente ad una dieta a ridotto apporto calorico, e per stimolare la crescita delle ragazze affette dalla cosiddetta sindrome di Turner.
Negli adulti il Omnitrope si può usare sia in caso di un accentuato deficit di ormone della crescita dovuto ad affezioni dell'ipotalamo e dell'ipofisi, le ghiandole che producono l'ormone somatotropo, come pure per proseguire il trattamento di un deficit di ormone della crescita già diagnosticato nell'infanzia.
Prima di iniziare la terapia con Omnitrope il medico confermerà la carenza di ormone della crescita, l'insufficienza renale cronica, la sindrome di Prader-Willi o la sindrome di Turner con un esame approfondito. Omnitrope si può usare solamente su prescrizione e sotto il controllo permanente del medico. La terapia dei disturbi della crescita dovrebbe essere iniziata da uno specialista ed essere continuata pure sotto il controllo di uno specialista.
Di che cosa occorre inoltre tener conto durante il trattamento?
In bambini/adolescenti con deficit staturale, Omnitrope agisce positivamente sull'accrescimento corporeo solo se il periodo della crescita non è ancora terminato. Gli adolescenti che praticano sport di competizione devono tener presente che il principio attivo di Omnitrope può dare un risultato positivo ai controlli antidoping.
Quando non si può usare Omnitrope?
Omnitrope non deve essere usato:
- In caso di ipersensibilità verso la somatropina o una delle sostanze ausiliarie contenute in Omnitrope (v. la rubrica «Cosa contiene Omnitrope?»).
- Se ha un tumore (cancro) attivo o si sta sottoponendo a un trattamento antitumorale.
- Se è gravemente malato (ad es. complicazioni a seguito di un intervento chirurgico a cuore aperto o all'addome, lesioni gravi, distress respiratorio acuto o simili).
- In caso di certe (rare) malattie congenite (sindrome di Down o di Bloom oppure anemia di Fanconi).
Nei pazienti con un diabete grave il medico può escludere la terapia con Omnitrope.
Omnitrope non è efficace quando la crescita è già completa (epifisi saldate).
Quando è richiesta prudenza nella nell’uso di Omnitrope?
La terapia con Omnitrope dovrebbe essere monitorata da un medico che ha dimestichezza con la diagnosi e il trattamento di pazienti affetti da carenza di ormone della crescita.
Nella terapia con ormone della crescita è indispensabile attenersi scrupolosamente a tutte le visite di controllo prescritte o raccomandate dal medico.
Nelle fasi di forte crescita, nei bambini può verificarsi una progressione della scoliosi (deformità della colonna vertebrale). Pertanto, il suo medico la sottoporrà a debito monitoraggio durante la terapia con un ormone della crescita. Nei pazienti affetti dalla sindrome di Prader-Willi (PWS) la comparsa di scoliosi è comune.
Pancreatite: in rari casi, durante la terapia con Omnitrope può verificarsi un'infiammazione del pancreas (pancreatite). Se si manifestano forti dolori alla parte alta dell'addome, informi immediatamente il suo medico.
Sindrome di Prader-Willi: i pazienti affetti dalla sindrome di Prader-Willi (PWS) devono essere esaminati per la presenza di segni di restringimento delle vie respiratorie (insorgenza o peggioramento del russamento, rumore respiratorio con emissione di fischio), arresto respiratorio notturno o infezioni delle vie respiratorie (ad es. polmonite) prima dell'inizio della terapia con ormone della crescita. Qualora durante la terapia con Omnitrope si manifestino segni di restringimento o di infezione delle vie respiratorie, deve rivolgersi subito al suo medico.
Prima e durante la terapia con Omnitrope deve essere effettuato un efficace controllo del peso. La terapia dovrebbe essere svolta in combinazione con una dieta a ridotto apporto calorico.
Malattie tumorali: in pazienti che hanno superato malattie cancerogene durante l'infanzia, soprattutto in quelli che sono stati esposti a radiazioni alla testa per il trattamento della malattia tumorale, è stata riportata l'insorgenza di tumori, in particolare nell'area della testa, durante il trattamento con ormoni della crescita. Nella maggior parte dei casi si è trattato di tumori benigni delle meningi, ma sono stati osservati anche tumori maligni e leucemie.
In bambini affetti da disturbo della crescita per specifiche cause genetiche rare, è stato riportato un rischio aumentato di sviluppo di malattie cancerogene. Durante la terapia con Omnitrope vengono pertanto attentamente monitorati dal medico.
Negli adulti non è ancora noto se la terapia con gli ormoni della crescita possa essere correlata alla ricomparsa di patologie tumorali.
Informi il suo medico in caso di alterazioni o ingrossamenti delle voglie.
Ipertensione intracranica benigna: in casi molto rari, durante la terapia con l'ormone della crescita può verificarsi una malattia cerebrale con aumento della pressione intracranica. Si manifestano allora delle cefalee forti o frequentemente ricorrenti, dei disturbi della vista (immagini doppie, riduzione del campo visivo), turbe della coscienza, nausea e/o vomito. Se il suo bambino comincia a lamentarsi di disturbi di questo genere deve avvertirne senza indugio il medico, che potrà decidere di interrompere la terapia ed eventualmente riprenderla più tardi e sotto accurato controllo.
Zucchero nel sangue: i pazienti diabetici o con predisposizione famigliare a questa malattia necessitano di una speciale sorveglianza medica perché Omnitrope può aumentare il tasso dello zucchero nel sangue (glicemia) e quindi richiedere un aumento della posologia dell'insulina. Solo il medico può decidere tale adeguamento della dose.
Funzionalità tiroidea: nel corso di una terapia con ormoni della crescita in un piccolo numero di pazienti può insorgere un'ipofunzione della tiroide. Essa si manifesta con la comparsa di uno o più dei seguenti sintomi: debolezza generale, facilità a stancarsi, disturbi psichici, accumulo d'acqua nei tessuti (edemi, p.es. viso gonfio), aumento di peso, stitichezza, abbassamento del tono della voce, netto rallentamento del battito cardiaco. Perciò il medico controllerà regolarmente il tasso sanguigno degli ormoni tiroidei e, all'occorrenza, prescriverà l'assunzione supplementare di ormone tiroideo.
Utilizzo durante una terapia orale con estrogeni: in donne trattate con Omnitrope che iniziano una terapia orale con estrogeni, potrebbe essere necessario aumentare la dose di Omnitrope. Nelle donne che durante la terapia con Omnitrope terminano una terapia orale con estrogeni, potrebbe essere necessario ridurre la dose di Omnitrope.
Alterazioni dello scheletro: se il suo bambino, camminando, si lamenta di dolori oppure di una riduzione della mobilità delle articolazioni delle anche o dei ginocchi e/o comincia a zoppicare lo comunichi subito al medico. In tal caso la terapia con Omnitrope si può continuare soltanto se il medico ha escluso che questi disturbi siano dovuti ad uno spostamento del collo del femore rispetto alla testa dell'osso (cosiddetto distacco epifisario) o alla cosiddetta malattia di Legg-Calvé-Perthes (disturbo del flusso sanguigno alla testa del femore).
Insufficienza renale cronica: in caso di insufficienza renale cronica la sua funzione renale deve essere monitorata e trattata dal suo medico durante la terapia con Omnitrope. Se a un paziente con insufficienza renale cronica viene trapiantato il rene di un donatore (trapianto renale), il medico interromperà la terapia con Omnitrope indipendentemente dall'età del paziente.
Sviluppo di anticorpi: in un numero limitato di pazienti possono svilupparsi anticorpi contro Omnitrope. Se non risponde alla terapia con Omnitrope secondo le aspettative, il suo medico eseguirà un controllo degli anticorpi contro la somatropina.
Funzionalità della corteccia surrenale: la terapia con Omnitrope può causare una compromissione della funzionalità della corteccia surrenale. Potrebbe quindi essere necessaria una terapia con glucocorticoidi. Se riceve già una terapia di sostituzione con glucocorticoidi, può essere necessario un aggiustamento della dose.
Pazienti anziani: le esperienze con pazienti al di sopra dei 60 anni sono limitate. Le persone anziane potrebbero reagire in modo più sensibile al Omnitrope e quindi essere più soggetti alla comparsa di effetti collaterali.
Interazioni con altri medicamenti
L'assunzione concomitante di certi altri medicamenti può influire sull'effetto stimolante la crescita di Omnitrope. Si tratta specialmente di certi preparati ormonali, quali corticosteroidi (ad es. cortisone, prednisone), ormoni tiroidei (ad es. tiroxina) e ormoni sessuali (ad es. estrogeni, testosterone). Solo il suo medico può decidere in merito a un eventuale adeguamento della posologia di questi preparati oppure di Omnitrope e le spiegherà quali precauzioni bisogna osservare in questi casi.
Ai fini contraccettivi pertanto non vanno privilegiati metodi ormonali.
Questo medicamento contiene meno di 1 mmol (23 mg) di sodio per cartuccia, cioè essenzialmente «senza sodio».
Alcol benzilico
Omnitrope 5 contiene 13,5 mg di alcol benzilico per cartuccia equivalente a 9 mg/ml. Alcol benzilico può causare reazioni allergiche. Chieda consiglio al medico o al farmacista se ha una patologia al fegato o ai reni. Questo perchè grandi quantità di alcol benzilico possono accumularsi nel corpo e causare effetti indesiderati (come l'acidosi metabolica).
Alcol benzilico è stato associato al rischio di gravi effetti indesiderati inclusi problemi respiratori (sindrome da respiro agonico) nei bambini piccoli. Non somministri a neonati fino a 4 settimane di età se non diversamente raccomandato dal medico.
Non usi per più di una settimana nei bambini piccoli (meno di 3 anni di età) se non diversamente raccomandato dal medico o dal farmacista.
Chieda consiglio al medico o al farmacista se è in gravidanza o sta allattando. Questo perchè grandi quantità di alcol benzilico possono accumularsi nel corpo e causare effetti indesiderati (come l'acidosi metabolica).
Informi il suo medico o il suo farmacista nel caso in cui
- soffra di altre malattie,
- soffra di allergie o
- assume altri medicamenti (anche se acquistati di sua iniziativa!) o li applica esternamente.
Si può usare Omnitrope durante la gravidanza o l’allattamento?
Omnitrope non dovrebbe essere somministrato durante la gravidanza. Perciò, durante la terapia, tutte le pazienti devono far uso di una contraccezione sicura a base non ormonica, cioè non devono usare la pillola anti-baby per la prevenzione.
Dato che non si sa se Omnitrope passa nel latte materno, per precauzione si deve smettere di allattare.
Come usare Omnitrope?
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Il principio attivo di Omnitrope è un ormone proteico che, se ingerito, viene digerito nello stomaco come le proteine assunte coll'alimentazione. Dato che per effetto dei processi digestivi diventerebbe inefficace lo si deve iniettare sotto la pelle (iniezione sottocutanea).
La posologia e la durata della terapia sono individuali e vengono adattate e stabilite dal medico per ogni paziente.
Normalmente si somministrano:
- a bambini/adolescenti con deficit di ormone della crescita: 0,025−0,035 mg per kg di peso corporeo e al giorno;
- nella sindrome di Prader-Willi: 0,035 mg per kg di peso corporeo e al giorno. Non si dovrebbe superare la dose giornaliera di 2,7 mg. Il metabolismo dei carboidrati dovrebbe essere controllato dal medico;
- in pazienti adulti con deficit di ormone somatotropo: la dose deve essere aggiustata caso per caso, tenendo conto della risposta individuale alla terapia e della comparsa di effetti collaterali. Negli adulti che proseguono la terapia con l'ormone della crescita a seguito di un deficit di ormone della crescita durante l'infanzia si consiglia il trattamento con una dose di 0,2−0,5 mg al giorno. Con pazienti nei quali il deficit di ormone della crescita è stato scoperto solo in età adulta, si inizia di solito con una dose di 0,15−0,30 mg al giorno. Raramente la dose di mantenimento è superiore a 1,33 mg al giorno. Con il progredire dell'età del paziente diminuisce la dose necessaria. Nei pazienti al di sopra dei 60 anni si dovrebbe iniziare la terapia con una dose di 0,1−0,2 mg al giorno. La dose di mantenimento per questi pazienti eccede raramente 0,5 mg al giorno;
- nella sindrome di Turner e nell'insufficienza renale cronica 0,045−0,050 mg per kg di peso corporeo al giorno;
- in bambini con deficit staturale con ritardo dello sviluppo intrauterino della lunghezza del corpo: 0,033−0,067 mg per kg di peso corporeo al giorno.
La dose singola precisa stabilita dal medico si inietta sottocute (sotto la pelle). A tal fine il medico prescrive il dosaggio di Omnitrope necessario e lui stesso o la persona competente da lui designata le darà istruzioni precise in merito alla tecnica d'iniezione. In caso di anche minima incertezza riguardo al modo di procedere si rivolga per favore a questi specialisti.
Importante: leggere attentamente le istruzioni prima di utilizzare per la prima volta SurePalTM 5 (Pen), SurePalTM 10 (Pen), SurePalTM 15 (Pen).
Avvertenze circa l'uso
Inietti la soluzione di Omnitrope, come le ha insegnato il medico o la persona competente, sottocute (sotto la pelle) nella coscia, oppure eventualmente nella parete addominale o nella natica. Per evitare fenomeni d'involuzione (atrofia del tessuto adiposo sottocutaneo, cosiddetta lipoatrofia) nel punto dell'iniezione bisogna cambiarlo tutti i giorni, cioè non iniettare mai due volte consecutive nell'identico punto della pelle. Non frizionare il punto dell'iniezione.
Generalmente la dose prescritta dal medico si somministra alla sera prima di coricarsi. Se avesse dimenticato una dose continui come di solito. In nessun caso inietti la dose dimenticata assieme alla successiva.
In generale la terapia dura anni, cioè finché continuando il trattamento con Omnitrope non si può più ottenere un'ulteriore crescita. Ciò succede quando nel femore la cosiddetta cartilagine commessurale, cioè la zona di passaggio tra la parte tubolare e la testa dell'osso (epifisi), si chiude e termina così la crescita ossea. Questa situazione può essere constatata solo dal medico.
Si attenga scrupolosamente a tutte le visite di controllo prescritte o raccomandate dal medico.
Quali effetti collaterali può avere Omnitrope?
In seguito alla somministrazione di Omnitrope possono manifestarsi i seguenti effetti collaterali:
Comune (riguarda da 1 a 10 utilizzatori su 100)
Negli adulti: Disturbi della sensibilità/formicolio, rigidità a braccia e gambe, dolori articolari, dolori muscolari, accumulo d'acqua (che si manifesta con dita o caviglie gonfie).
Nei bambini: Temporaneo arrossamento, prurito, bruciore o dolore al sito di iniezione.
Non comune (riguarda da 1 a 10 utilizzatori su 1'000)
Negli adulti: Dolori o bruciore alle mani o agli avambracci (conosciuta come sindrome del tunnel carpale).
Nei bambini: Disturbi della sensibilità/formicolio, rigidità a braccia e gambe, dolori articolari, dolori muscolari, accumulo d'acqua (che si manifesta con dita o caviglie gonfie), eruzione cutanea, prurito, orticaria.
Raro (riguarda da 1 a 10 utilizzatori su 10'000)
Negli adulti: Aumento della glicemia (zucchero nel sangue), diabete mellito, comparsa di sintomi di ipofunzione della tiroide, aumento della pressione intracranica (associata a sintomi come forte mal di testa, disturbi della vista o vomito), ingrossamento delle ghiandole mammarie nell'uomo.
Nei bambini: Aumento della pressione intracranica (associata a sintomi come forte mal di testa, disturbi della vista o vomito), sviluppo prematuro (in età infantile) di una o entrambe le ghiandole mammarie.
Molto raro (riguarda meno di 1 utilizzatore su 10'000)
Nei bambini: Leucemia (è stata riportata in un numero limitato di bambini con deficit dell'ormone della crescita, alcuni dei quali precedentemente trattati con somatropina. Tuttavia, non vi è alcuna evidenza che l'incidenza della leucemia sia maggiore in coloro che ricevono ormone della crescita senza fattori predisponenti).
Singoli casi
Negli adulti: Apnea notturna (interruzione della respirazione durante il sonno) nei pazienti affetti dalla sindrome di Prader-Willi, ingrossamento o mutazione di nei preesistenti, eruzione cutanea, prurito, orticaria, gonfiore in viso (dovuto alla ritenzione di liquidi).
Nei bambini: Distacco dell'epifisi, malattia di Legg-Calvé-Perthes (vedere «Quando è richiesta prudenza nella somministrazione di Omnitrope?»), infiammazione del pancreas (che si manifesta con forti dolori alla parte alta dell'addome), gonfiore in viso (dovuto alla ritenzione di liquidi).
Rari casi di morte improvvisa sono stati segnalati nei pazienti con il sindrome di Prader-Willi e sotto trattamento con somatropina. Tuttavia, un rapporto formale con il trattamento con somatropina non è stato dimostrato.
Se osserva effetti collaterali, si rivolga al suo medico o al suo farmacista, soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni per la conservazione
In seguito alla prima applicazione, la cartuccia può essere utilizzata per una durata massima di 28 giorni.
Conservare nella confezione originale, in frigorifero (2−8°C), e al riparo dalla luce e fuori dalla portata dei bambini. Non congelare.
Una soluzione di Omnitrope che è stata congelata non si può più usare.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Omnitrope?
Principi attivi
Una cartuccia da 1,5 ml di Omnitrope 5 contiene: 5 mg del principio attivo somatropina.
Una cartuccia da 1,5 ml di Omnitrope 10 contiene: 10 mg del principio attivo somatropina.
Una cartuccia da 1,5 ml di Omnitrope 15 contiene: 15 mg del principio attivo somatropina.
Sostanze ausiliarie
Una cartuccia da 1,5 ml di Omnitrope 5 contiene: Idrogeno fosfato disodico eptaidrato, diidrogeno fosfato sodico diidrato, poloxamero 188, alcol benzilico, mannitolo, acido fosforico, idrossido di sodio e acqua per preparazioni iniettabili.
Una cartuccia da 1,5 ml di Omnitrope 10 contiene: Idrogeno fosfato disodico eptaidrato, diidrogeno fosfato sodico diidrato, poloxamero 188, fenolo, glicina, acido fosforico, idrossido di sodio e acqua per preparazioni iniettabili.
Una cartuccia da 1,5 ml di Omnitrope 15 contiene: Idrogeno fosfato disodico eptaidrato, diidrogeno fosfato sodico diidrato, poloxamero 188, fenolo, sodio cloruro, acido fosforico, idrossido di sodio e acqua per preparazioni iniettabili.
Numero dell’omologazione
61306 (Swissmedic)
Dove è ottenibile Omnitrope? Quali confezioni sono disponibili?
Omnitrope è in vendita in farmacia, dietro presentazione della prescrizione medica non rinnovabile, nelle seguenti confezioni:
Omnitrope 5: 1, 5 e 10 cartucce (da 1,5 ml) per SurePalTM 5 (Pen).
Omnitrope 10: 1, 5 e 10 cartucce (da 1,5 ml) per SurePalTM 10 (Pen).
Omnitrope 15: 1 e 5 cartucce (da 1,5 ml) per SurePalTM 15 (Pen).
Titolare dell’omologazione
Sandoz Pharmaceuticals S.A., Risch; domicilio: Rotkreuz
Questo foglietto illustrativo è stato controllato l'ultima volta nel settembre 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoffe
Somatropinum ADNr.
Gentechnologisch (rekombinantes) humanes Wachstumshormon.
Hilfsstoffe
Omnitrope 5: Dinatrii phosphas heptahydricus, natrii dihydrogenophosphas dihydricus, poloxamerum 188, alcohol benzylicus 9 mg/ml, mannitolum, acidum phosphoricum, natrii hydroxidum, aqua ad iniectabilia.
1 Patrone enthält maximal 0,47 mg Natrium.
Omnitrope 10: Dinatrii phosphas heptahydricus, natrii dihydrogenophosphas dihydricus, poloxamerum 188, phenolum, glycinum, acidum phosphoricum, natrii hydroxidum, aqua ad iniectabilia.
1 Patrone enthält maximal 0,51 mg Natrium.
Omnitrope 15: Dinatrii phosphas heptahydricus, natrii dihydrogenophosphas dihydricus, poloxamerum 188, phenolum, natrii chloridum, acidum phosphoricum, natrii hydroxidum, aqua ad iniectabilia.
1 Patrone enthält maximal 4,70 mg Natrium.
Darreichungsform und Wirkstoffmenge pro Einheit
Injektionslösung:
1 Patrone Omnitrope 5 enthält 5 mg somatropinum.
1 Patrone Omnitrope 10 enthält 10 mg somatropinum.
1 Patrone Omnitrope 15 enthält 15 mg somatropinum.
Omnitrope Injektionslösung ist eine klare, farblose Lösung.
Indikationen/Anwendungsmöglichkeiten
Kinder
- Zur Substitution bei Patienten mit nachgewiesener, unzureichender endogener Wachstumshormonsekretion (hypophysärer Minderwuchs).
- Minderwuchs bei Patienten mit Turner-Syndrom.
- Wachstumsstörungen bei Patienten infolge chronischer Niereninsuffizienz.
- Prader-Willi-Syndrom (PWS), zur Verbesserung des Wachstums und der Körperzusammensetzung in Kombination mit einer hypokalorischen Diät. Die Diagnose PWS sollte durch geeignete genetische Untersuchungen bestätigt werden.
- Langzeitbehandlung von Wachstumsstörungen bei Patienten mit intrauterinem Kleinwuchs (SGA), die den Wachstumsrückstand bis zum zweiten Lebensjahr nicht aufgeholt haben. Andere Ursachen von Minderwuchs sollten ausgeschlossen sein.
Erwachsene
Wachstumshormon (GH)-Mangel beim Erwachsenen infolge hypothalamischer oder hypophysärer Erkrankung, mit Beginn im Kindes- oder Erwachsenenalter.
- Beginn in der Kindheit: Patienten mit angeborenem, genetisch bedingtem, erworbenem oder idiopathischem GH-Mangel in der Kindheit. Nach Abschluss des Längenwachstums sollte bei Patienten, bei denen der GH-Mangel bereits in der Kindheit festgestellt wurde, die Fähigkeit zur GH-Ausschüttung erneut überprüft werden. Bei Patienten mit höchstwahrscheinlich persistierendem GH-Mangel, z.B. mit angeborenem GH-Mangel oder einem GH-Mangel infolge von hypophysären/hypothalamischen Erkrankungen bzw. eines Infarkts, ist ein Insulin-like Growth Factor-I (IGF-I) - Standard-Deviation-Score (SDS) von <–2 nach einer mindestens 4-wöchigen Pause der GH-Therapie als ausreichender Beleg eines ausgeprägten GH-Mangels anzusehen.
Alle übrigen Patienten sollten einer IGF-I-Testung und einem GH-Stimulationstest unterzogen werden.
- Beginn im Erwachsenenalter: Patienten mit schwerem GH-Mangel in Verbindung mit anderen Hormonausfällen infolge bekannter Erkrankungen des Hypothalamus oder der Hypophyse und mindestens einem bekannten Hormonausfall der Hypophyse ausser Prolactin. Zur Diagnose bzw. zum Ausschluss eines GH-Mangels sollte bei diesen Patienten ein geeigneter dynamischer Test durchgeführt werden.
Dosierung/Anwendung
Eine Behandlung mit Somatropin sollte nur von einem Facharzt durchgeführt werden, der mit Diagnose und Behandlung von Wachstumsstörungen vertraut ist.
Die Dosierung erfolgt individuell.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Übliche Dosierung
Kinder
Hypophysärer Kleinwuchs
Generell wird eine Dosis von 0,025–0,035 mg/kg Körpergewicht pro Tag oder 0,7–1,0 mg/m² Körperoberfläche pro Tag empfohlen.
Bei unzureichendem Behandlungserfolg kann die Dosis individuell gesteigert werden. Eine Erhöhung der Dosierung sollte frühestens nach 6-monatiger Behandlung in Betracht gezogen werden und sollte 40% nicht überschreiten.
Bei einem GH-Mangel, welcher bereits in der Kindheit festgestellt wurde und ins Jugendalter hinein andauert, sollte die Behandlung mit dem Ziel fortgesetzt werden, eine vollständige somatische Entwicklung zu erreichen (z.B. Körperzusammensetzung, Knochendichte). Als Parameter für die Kontrolle der Therapieziele während der Übergangsphase dient das Erreichen einer normalen maximalen Knochendichte, definiert als ein T-Score >–1 (z.B. standardisiert auf die durchschnittliche Knochendichte eines Erwachsenen gemessen mittels DEXA-Verfahren (Dual-Röntgen-Absorptiometrie), unter Berücksichtigung von Geschlecht und ethnischer Herkunft). Dosierungshinweise siehe unten im entsprechenden Abschnitt.
Prader-Willi-Syndrom (PWS)
Generell wird eine Dosis von 0,035 mg/kg Körpergewicht pro Tag oder 1,0 mg/m² Körper-oberfläche pro Tag empfohlen. Eine tägliche Dosis von 2,7 mg soll nicht überschritten werden. Kinder mit einer Wachstumsgeschwindigkeit von weniger als 1 cm pro Jahr und baldigem Epiphysenschluss sollten nicht behandelt werden. Der Kohlenhydratstoffwechsel ist zu kontrollieren.
Turner-Syndrom
Empfohlen wird eine Dosis von 0,045–0,050 mg/kg Körpergewicht pro Tag oder 1,4 mg/m² Körperoberfläche pro Tag.
Bei Turner-Patientinnen ist bisher nicht definiert, in welchem Alter die Behandlung begonnen werden sollte. Aufgrund der vorliegenden Daten kann nicht beurteilt werden, ob von einem Behandlungsbeginn im Kleinkindesalter eine bessere Wirkung auf die Erwachsenenendgrösse zu erwarten ist als von einem Behandlungsbeginn in der Vorpubertät.
Wachstumsstörungen infolge chronischer Niereninsuffizienz
Empfohlen wird eine Dosis von 1,4 mg/m² Körperoberfläche pro Tag (entspricht etwa 0,045–0,050 mg/kg Körpergewicht pro Tag). Höhere Dosen können benötigt werden, wenn die Wachstumsgeschwindigkeit zu gering ist. Eine Erhöhung der Dosierung sollte frühestens nach 6-monatiger Behandlung in Betracht gezogen werden und 30% nicht überschreiten.
Kinder mit intrauterinem Kleinwuchs (SGA)
Empfohlen wird eine Dosis von 0,033–0,067 mg/kg Körpergewicht pro Tag oder 1,0–2,0 mg/m² Körperoberfläche pro Tag.
Erwachsene
Wachstumshormonmangel
Bei Patienten mit einem in der Kindheit diagnostizierten GH-Mangel wird für die Fortsetzung der Behandlung eine Dosierung von 0,2‒0,5 mg pro Tag empfohlen. Die Dosis sollte den individuellen Bedürfnissen des Patienten entsprechend und basierend auf der Bestimmung der IGF-I-Konzentration schrittweise erhöht bzw. reduziert werden.
Bei Patienten, bei denen der GH-Mangel erst im Erwachsenenalter festgestellt wird, beträgt die empfohlene Startdosis 0,15–0,30 mg pro Tag. Die Dosis sollte den individuellen Bedürfnissen des Patienten entsprechend und basierend auf der Bestimmung der IGF-I-Konzentration schrittweise eingestellt werden. Alter und Geschlecht sind bei der Einstellung zu berücksichtigen.
In beiden Fällen sollte die Dosierung anhand von IGF-I-Messungen kontrolliert werden. Die klinische Reaktion sowie auftretende unerwünschte Wirkungen sollten als Orientierung bei der Dosistitration einbezogen werden.
Bei Patienten, welche ein gutes klinisches Ansprechen zeigen, ist auch bei ausbleibender Normalisierung der IGF-I-Spiegel keine Dosissteigerung erforderlich.
Die tägliche Erhaltungsdosis übersteigt selten 1,33 mg pro Tag. Frauen können höhere Dosen benötigen als Männer (siehe «Spezielle Dosierungsempfehlungen - Geschlecht», «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»). Da die normale endogene Produktion von Wachstumshormon mit dem Alter sinkt, kann auch der Somatropin-Bedarf mit zunehmendem Alter abnehmen.
Bei Patienten über 60 Jahre sollte die Behandlung mit Dosen von 0,1–0,2 mg pro Tag begonnen und je nach individuellem Bedarf langsam gesteigert werden. Dabei sollte jeweils die kleinste wirksame Dosis eingesetzt werden. Die tägliche Erhaltungsdosis übersteigt bei diesen Patienten selten 0,5 mg pro Tag.
Therapiedauer
Bei der Behandlung von Wachstumsstörungen mit Omnitrope handelt es sich um eine kontinuierliche Langzeitbehandlung, die unter regelmässiger Kontrolle bis zum gewünschten klinischen Erfolg bzw. bis zum Epiphysenschluss fortgesetzt werden kann.
Bei Kindern und Jugendlichen mit chronischer Niereninsuffizienz ist die Behandlung nach einer Nierentransplantation unabhängig vom Alter zu beenden.
Die Dauer der Behandlung bei Erwachsenen ist unbestimmt. In jährlichen Intervallen ist fachärztlich zu überprüfen, ob die Behandlung dem Patienten einen reellen klinischen Gewinn bringt und demnach eine Weiterbehandlung sinnvoll ist.
Spezielle Dosierungsanweisungen
Geschlecht
Bei Frauen und Mädchen ab der Pubertät werden zur Erreichung einer adäquaten Wirksamkeit höhere Somatropin-Dosen benötigt als bei Männern. Dies gilt in verstärktem Masse bei Zufuhr oraler Östrogene (siehe «Interaktionen» und «Warnhinweise und Vorsichtsmassnahmen»).
Patienten mit Leberfunktionsstörungen
Somatropin wurde bei Patienten mit Leberinsuffizienz nicht untersucht. Es können daher keine Dosierungsempfehlungen gemacht werden.
Patienten mit Nierenfunktionsstörungen
Die Pharmakokinetik von Somatropin wurde bei Patienten mit Niereninsuffizienz nicht untersucht. Eine Dosisanpassung ist jedoch vermutlich nicht erforderlich. Zur Dosierung bei Kindern mit Wachstumsstörungen infolge chronischer Niereninsuffizienz siehe oben.
Ältere Patienten
Zur Dosierung bei Patienten ab 60 Jahren siehe oben. Die Dosierung richtet sich nach dem individuellen Bedarf.
Verspätete Dosisgabe
Falls eine Dosis vergessen wurde, sollte die Therapie am darauf folgenden Tag wie gewohnt weitergeführt werden. Auf keinen Fall dürfen zwei Dosen am gleichen Tag verabreicht werden.
Art der Anwendung
Omnitrope wird subkutan verabreicht.
Die Injektionsstelle sollte täglich gewechselt werden, um eine Lipoatrophie zu vermeiden.
Kontraindikationen
- Kinder mit Down- oder Bloom-Syndrom oder Fanconi-Anämie.
- Vorliegen eines aktiven Tumors und/oder aktiver intrakranieller Läsionen, bestehende Tumortherapie.
- Kritisch kranke Patienten mit Komplikationen nach offenen Herz- oder abdominalen Operationen, Polytrauma oder akuter respiratorischer Insuffizienz.
- Bekannte Überempfindlichkeit gegenüber einem der Inhaltsstoffe von Omnitrope (siehe «Zusammensetzung»).
Bei Kindern und Jugendlichen mit geschlossenen Epiphysen ist Omnitrope unwirksam.
Warnhinweise und Vorsichtsmassnahmen
Die Erfahrungen bei Patienten über 60 Jahren sind beschränkt. Ältere Patienten reagieren u. U. empfindlicher auf die Wirkung von Somatropin; daher kann es bei ihnen eher zu unerwünschten Wirkungen kommen.
Die Erfahrungen in der Langzeittherapie von Erwachsenen sind limitiert.
In Phasen eines starken Wachstums kann es bei allen Kindern zum Fortschreiten einer Skoliose kommen. Auf Zeichen einer Skoliose sollte daher während der Behandlung geachtet werden. Es gibt jedoch bis jetzt keine Hinweise, dass eine Behandlung mit Wachstumshormon den Schweregrad oder die Inzidenz einer Skoliose erhöht. Bei Patienten mit Prader-Willi-Syndrom (PWS) sind Skoliosen häufig.
Prader-Willi-Syndrom
Es gab Berichte über Todesfälle im Zusammenhang mit einer Wachstumshormon-Behandlung bei pädiatrischen Patienten mit PWS, welche einen oder mehrere der folgenden Risikofaktoren aufwiesen: schwere Adipositas (das Verhältnis Gewicht/Grösse übersteigt 200% des Medianwertes von Kindern gleicher Körpergrösse), Atembeschwerden oder Schlafapnoe in der Anamnese oder eine nicht diagnostizierte Atemwegsinfektion. Bei Patienten, bei denen einer oder mehrere dieser Faktoren zutreffen, könnte ein erhöhtes Risiko bestehen. Patienten mit PWS müssen daher vor Beginn der Behandlung mit Somatropin auf Anzeichen einer Obstruktion der oberen Atemwege, einer Schlafapnoe oder von Atemwegsinfekten untersucht werden. Wenn sich aufgrund pathologischer Befunde der Verdacht auf eine Obstruktion der oberen Atemwege ergibt, muss das Kind vor Beginn der Wachstumshormon-Therapie an einen ORL-Spezialisten zur weiteren Abklärung und Therapie der Atemwegsbeschwerden überwiesen werden.
Falls ein Patient während der Therapie mit Somatropin Anzeichen für eine Obstruktion der oberen Atemwege entwickelt (einschliesslich beginnendem oder zunehmendem Schnarchen), muss die Therapie unterbrochen und erneut eine ORL-ärztliche Untersuchung durchgeführt werden.
Eine Schlafapnoe muss vor Beginn der Wachstumshormon-Therapie durch anerkannte Methoden wie Polysomnographie oder nächtliche Oxymetrie untersucht und gegebenenfalls weiter überwacht werden. Bei Verdacht auf Schlafapnoe ist eine entsprechende Überwachung und wenn nötig Behandlung erforderlich.
Alle Patienten mit PWS müssen auf Anzeichen von Atemwegsinfektionen überwacht werden, die so früh als möglich diagnostiziert und aggressiv behandelt werden müssen.
Bei allen Patienten mit PWS muss vor und während der Wachstumshormon-Therapie eine effektive Gewichtskontrolle erfolgen.
PWS-Patienten sollten immer in Kombination mit einer kalorienreduzierten Diät behandelt werden.
Anwendung bei Tumorpatienten
Bei der Behandlung von Wachstumshormonmangel als Sekundärfolge einer Tumorbehandlung muss der Patient auf mögliche Rezidive des Tumors hin überwacht werden.
Bei Patienten nach in der Kindheit überstandener maligner Erkrankung (sogenannte «childhood cancer survivors») wurde unter Behandlung mit Somatropin über ein erhöhtes Risiko für Zweitneoplasien berichtet. Am häufigsten handelte es sich dabei um intrakranielle Tumoren, insbesondere Meningeome. Diese Tumoren wurden v.a. bei Patienten beobachtet, welche zur Therapie ihrer ersten Neoplasie eine Strahlentherapie des Kopfes erhalten hatten.
Bei Erwachsenen ist bisher nicht bekannt, ob ein Zusammenhang zwischen einer Somatropin-Therapie und Rezidiven von Tumoren des ZNS bestehen könnte.
Benigne intrakranielle Hypertonie
Bei schweren oder rezidivierenden Kopfschmerzen, Sehstörungen, Übelkeit und/oder Erbrechen sollte eine Funduskopie zum Ausschluss eines Papillenödems durchgeführt werden. Bei Vorliegen eines Papillenödems muss eine benigne intrakraniale Hypertonie in Betracht gezogen und ggf. die Therapie mit Wachstumshormon abgebrochen werden. Verbindliche Empfehlungen zur Wiederaufnahme der Behandlung nach Abklingen der Symptome können nicht gegeben werden. Falls die Wachstumshormonbehandlung weitergeführt wird, ist eine sorgfältige Überwachung notwendig.
Glucosetoleranz
Somatropin reduziert die Empfindlichkeit auf Insulin, weshalb Patienten auf Anzeichen einer Glucoseintoleranz beobachtet werden sollten. In seltenen Fällen kann die Somatropin-Therapie eine Störung der Glucosetoleranz hervorrufen, welche die Kriterien für einen Typ II Diabetes mellitus erfüllt. Das Risiko, während der Behandlung mit Somatropin einen Diabetes zu entwickeln, ist bei jenen Patienten am höchsten, welche bereits eine verminderte Glucosetoleranz und/oder andere Risikofaktoren für einen Typ II Diabetes mellitus aufweisen, wie z.B. Adipositas, positive Familienanamnese oder Steroidtherapie. Bei Patienten mit vorbestehendem Diabetes mellitus sollte deshalb die Gabe von Omnitrope nur unter strenger ärztlicher und laborchemischer Überwachung erfolgen. Die Dosierung der antidiabetischen Therapie muss nach Beginn der Somatropin-Behandlung allenfalls angepasst werden.
Schilddrüsenfunktion
Nach Beginn der Somatropin-Behandlung sowie nach allfälligen Dosisanpassungen sollte die Schilddrüsenfunktion kontrolliert werden.
Während der Behandlung mit Somatropin wurde infolge einer erhöhten peripheren Dejodierung von Thyroxin eine verstärkte Konversion von T4 zu T3 beobachtet, was zu verminderten T4 bzw. erhöhten T3 Serumkonzentrationen führen kann. Im Allgemeinen blieben die peripheren Hormonspiegel aber innerhalb des Normbereichs für Gesunde. Bei Patienten mit zentraler subklinischer Hypothyreose, bei denen sich theoretisch eine Hypothyreose entwickeln könnte, kann die Wirkung von Somatropin auf die Schilddrüsenhormonspiegel jedoch klinisch relevant sein. Umgekehrt kann eine unbehandelte Hypothyreose die Wirkung von Somatropin beeinträchtigen. Gegebenenfalls ist zusätzlich zu Omnitrope Schilddrüsenhormon zu verabreichen.
Bei Patienten, die eine Thyroxin-Substitutionstherapie erhalten, kann es jedoch auch umgekehrt zu einer milden Hyperthyreose kommen.
Interaktion mit Östrogenen
Orale Östrogene können die IGF-1-Konzentration im Serum reduzieren und dadurch die Wirksamkeit von Somatropin abschwächen. Bei Patientinnen, die mit Somatropin behandelt werden und eine Östrogentherapie beginnen, muss daher möglicherweise die Dosis von Somatropin erhöht werden, um die IGF-1- Serumspiegel im normalen, altersentsprechenden Bereich zu halten. Umgekehrt muss beim Absetzen einer Östrogentherapie die Somatropin-Dosis möglicherweise reduziert werden (siehe «Interaktionen»).
Zur Kontrazeption sind nicht-hormonale Methoden zu bevorzugen.
Skelettveränderungen
Bei Patienten mit endokrinen Störungen, einschliesslich solcher mit Wachstumshormonmangel, besteht ein erhöhtes Risiko einer Epiphyseolysis capitis femoris, und bei kleinwüchsigen Patienten tritt ein Morbus Perthes-Calvé-Legg gehäuft auf. Ob das Risiko für das Auftreten dieser Erkrankungen durch eine Somatropin-Behandlung erhöht wird, kann nicht abschliessend beurteilt werden. Arzt und Eltern sollten daher auf das mögliche Auftreten von sich langsam verstärkendem Hinken, von Hüft- und Knieschmerzen und/oder einer Einschränkung der Gelenkbeweglichkeit achten.
Insbesondere Patientinnen mit Turner-Syndrom sollten in regelmässigen Abständen sowie vor allem bei Auftreten von Knochenschmerzen auf Anzeichen einer Epiphyseolyse oder eines Morbus Scheuermann untersucht werden.
Somatropin-Therapie bei pädiatrischen Patienten mit chronischer Niereninsuffizienz
Vor der Entscheidung, eine Therapie mit Wachstumshormon zu beginnen, sollte ein Nierenfunktionstest durchgeführt werden. Der GFR-Wert sollte dabei unter 50% des Normwertes liegen. Damit Wachstumsstörungen erkannt und bestätigt werden können, sollte das Wachstum während eines Jahres verfolgt werden. Die Behandlung der chronischen Niereninsuffizienz sollte während der Wachstumshormon-Therapie wie üblich weitergeführt werden.
Antikörperbildung
Eine Antikörperbildung gegen Somatropin wurde beobachtet. Die Bindungskapazität dieser Antikörper war gering, und ihre Bildung wurde nicht mit klinischen Veränderungen in Zusammenhang gebracht. Falls der Patient nicht auf die Behandlung anspricht, sollen jedoch die Antikörper gegen Wachstumshormon bestimmt werden.
Weitere Vorsichtsmassnahmen
Die Wirkung von Somatropin auf die Genesung Schwerkranker wurde in zwei placebokontrollierten Studien an 522 erwachsenen Patienten mit Komplikationen nach offenen Herz- oder abdominalen Operationen, Polytrauma oder akuter respiratorischer Insuffizienz untersucht. Die Mortalität war höher bei Patienten, die täglich mit 5,3 oder 8 mg Somatropin behandelt wurden, als bei Patienten der Placebo-Gruppe (41,9% vs. 19,3%). Daher sollten solche Patienten nicht mit Somatropin behandelt werden. Da keine Angaben über die Sicherheit bei der Substitutionstherapie mit Wachstumshormon bei kritisch kranken Patienten vorliegen, müssen wie bei allen Patienten, die eine solche Erkrankung oder einen vergleichbaren kritischen Zustand entwickeln, die erwarteten Vorteile einer Fortsetzung der Behandlung gegen die potentiellen Nachteile abgewogen werden.
Bei Vorliegen einer kompletten oder partiellen Hypophysenvorderlappeninsuffizienz kann eine Substitutionstherapie mit zusätzlichen Hormonen (z.B. Glucokortikoiden) notwendig sein. Da Glucokortikoide die therapeutische Wirksamkeit von Somatropin reduzieren können, muss in diesem Fall das Wachstum engmaschig überwacht werden. Die Dosierung einer solchen Zusatztherapie muss besonders sorgfältig eingestellt werden, um eine Wachstumshemmung zu verhindern.
Der Beginn einer Somatropin-Therapie kann zu einer Hemmung der 11β-Hydroxysteroid-Dehydrogenase 1 (11βHSD-1) und zu verringerten Cortisol-Serumspiegeln führen. Bei mit Somatropin behandelten Patienten kann dadurch ein latenter zentraler (sekundärer) Hypoadrenalismus manifest werden, der eine Glucokortikoid-Substitutionstherapie erfordern kann. Darüber hinaus kann bei Patienten, die aufgrund eines zuvor diagnostizierten Hypoadrenalismus bereits eine Glucokortikoid-Substitutionstherapie erhalten, nach Beginn der Somatropin-Therapie eine Erhöhung der Erhaltungs- und/oder Stressdosis erforderlich sein (siehe «Interaktionen»).
Patienten unter einer Therapie mit Somatropin sollten bezüglich einer Grössenzunahme oder Hinweisen auf maligne Veränderungen vorbestehender Naevi überwacht werden.
Bei Kindern mit bestimmten seltenen genetischen Ursachen eines Kleinwuchses wurde über ein erhöhtes Risiko für die Entwicklung maligner Erkrankungen berichtet. Bei der Entscheidung, eine Therapie mit Wachstumshormon einzuleiten, sollte dieses Risiko bei der Nutzen-Risiko-Abwägung berücksichtigt werden. Unter der Behandlung mit Somatropin müssen solche Patienten engmaschig auf eine mögliche Entwicklung von Neoplasien überwacht werden.
Es liegen Berichte über das Auftreten einer Pankreatitis unter Behandlung mit Somatropin vor, insbesondere bei Kindern. Publizierte Daten deuten darauf hin, dass vor allem Mädchen mit Turner-Syndrom unter einer Somatropin-Therapie ein erhöhtes Risiko für eine Pankreatitis aufweisen könnten. Treten bei einem Patienten unter Behandlung mit Somatropin akute starke Oberbauchbeschwerden auf, sollte eine Pankreatitis in die Differentialdiagnose einbezogen werden.
Über reduzierte Cortisol-Serumspiegel, wahrscheinlich infolge Beeinflussung der Plasmaproteinbindung, wurde berichtet. Verlagerungen zu freiem Cortisol im Serum wurden jedoch nicht beobachtet.
Benzylalkohol
Omnitrope 5 enthält 13,5 mg Benzylalkohol pro Patrone entsprechend 9 mg/ml. Benzylalkohol kann allergische Reaktionen hervorrufen. Grosse Mengen sollten wegen des Risikos der Akkumulation und Toxizität («metabolische Azidose») nur mit Vorsicht und wenn absolut nötig angewendet werden, insbesondere bei Personen mit eingeschränkter Leber- oder Nierenfunktion. Benzylalkohol wurde mit dem Risiko schwerwiegender Nebenwirkungen, einschliesslich Atemproblemen (so genanntes «Gasping- Syndrom») bei Kleinkindern in Verbindung gebracht.
Bei Kleinkindern besteht aufgrund von Akkumulation ein erhöhtes Risiko.
Natriumgehalt
Omnitrope enthält weniger als 1 mmol (23 mg) Natrium pro Patrone. Dies ist von Patienten zu berücksichtigen, die eine salzarme Diät einhalten müssen.
Interaktionen
Pharmakokinetische Interaktionen
Somatropin kann die Clearance von Substanzen erhöhen, die durch das Cytochrom P450 3A4 metabolisiert werden (z.B. Geschlechtshormone, Kortikosteroide, Antikonvulsiva und Ciclosporin). Die klinische Bedeutung ist unklar.
Wachstumshormon reduziert die Umwandlung von Cortison in Cortisol (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Pharmakodynamische Interaktionen
Eine gleichzeitige Behandlung mit Glucokortikoiden hemmt die wachstumsfördernde Wirkung von Somatropin. Bei Patienten mit ACTH-Mangel muss die Dosierung der Glucokortikoid-Substitutionstherapie daher sorgfältig angepasst werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Orale Östrogene können die IGF-1-Konzentration im Serum reduzieren und dadurch die Wirksamkeit von Somatropin abschwächen (siehe «Dosierung Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»). Der Mechanismus dieser Interaktion ist nicht bekannt.
Bei gleichzeitiger Verabreichung von Androgenen, Anabolika oder Gonadotropinen kann es zu einer additiven Wirkung auf die Knochenreifung kommen.
Schwangerschaft/Stillzeit
Schwangerschaft
Die klinische Erfahrung bei schwangeren Frauen ist beschränkt. Reproduktionsstudien bei Tieren ergaben keine Hinweise auf eine Schädigung des Foeten. Die Auswirkungen einer erhöhten Wachstumshormon-Konzentration auf spezifische Stadien der Embryogenese bzw. des foetalen Wachstums beim Menschen sind bisher ungeklärt.
Somatropin-haltige Arzneimittel sind daher während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keinen entsprechenden Konzeptionsschutz verwenden, nicht zu empfehlen.
Während einer normalen Schwangerschaft sinken die endogenen Wachstumshormonspiegel nach der 20. Schwangerschaftswoche signifikant ab und normalisieren sich wieder bis zur 30. Schwangerschaftswoche. Vor diesem Hintergrund ist es unwahrscheinlich, dass im dritten Trimester eine Somatropin-Substitutionstherapie notwendig ist.
Stillzeit
Zu einem möglichen Übertritt von hGH in die Muttermilch liegen keine Daten vor. Auch wenn die Absorption von intaktem Protein aus dem Gastrointestinaltrakt des Kindes unwahrscheinlich ist, sollte während der Anwendung von Somatropin nicht gestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Ein Defizit an extrazellulärem Volumen ist charakteristisch bei Patienten mit einem Wachstumshormonmangel. Nach Beginn der Behandlung mit Somatropin wird dieses Defizit rasch korrigiert. In der Folge kann es zu einer Flüssigkeitsretention kommen.
Bei Patienten mit Prader-Willi-Syndrom wurden nach der Markteinführung seltene Fälle von plötzlichem Tod unter Somatropin-Behandlung beschrieben. Es ist jedoch nicht bekannt, ob diese in einem kausalen Zusammenhang zu der Therapie mit Wachstumshormonen stehen.
Nachstehend sind die unerwünschten Wirkungen aufgelistet, welche in klinischen Studien und/oder während der Marktüberwachung unter Anwendung von Somatropin beobachtet wurden, geordnet nach Systemorganklassen (MedDRA) und Häufigkeit, unter Berücksichtigung folgender Definitionen: «sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1'000, <1/100), «selten» (≥1/10'000, <1/1'000), «sehr selten» (<1/10'000), «nicht bekannt» (basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann nicht abgeschätzt werden).
Erwachsene
Die häufigsten unerwünschten Wirkungen waren in den klinischen Studien (mit einer Inzidenz von jeweils 1–10%) Flüssigkeitsretention mit peripheren Ödemen sowie Steifheit der Extremitäten, Arthralgien, Myalgien und Parästhesien. Im Allgemeinen treten diese unerwünschten Wirkungen zu Beginn der Behandlung auf und klingen entweder spontan oder bei Dosisreduktion wieder ab.
Die Häufigkeit dieser unerwünschten Wirkungen ist abhängig von der verabreichten Dosis und vom Alter des Patienten sowie wahrscheinlich umgekehrt proportional zum Alter des Patienten bei Einsetzen des Wachstumshormonmangels.
Erkrankungen des Immunsystems
Häufig: Antikörperbildung gegen Somatropin (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Endokrine Erkrankungen
Selten: Reduzierte Cortisol-Serumspiegel (siehe «Warnhinweise und Vorsichtsmassnahmen»), Erhöhung des Blutglucosespiegels (siehe «Warnhinweise und Vorsichtsmassnahmen»), Diabetes mellitus Typ 2, Hypothyreose.
Erkrankungen des Nervensystems
Häufig: Parästhesien.
Gelegentlich: Karpaltunnelsyndrom.
Selten: Benigne intrakranielle Hypertonie (Pseudotumor cerebri).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Nicht bekannt: Schlafapnoe bei Patienten mit Prader-Willi-Syndrom.
Erkrankungen der Haut und des Unterhautzellgewebes
Nicht bekannt: Selbstlimitierte Progression pigmentierter Naevi, Hautausschlag, Pruritus, Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Muskuloskelettale Steifigkeit, Arthralgien, Myalgien.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Selten: Gynäkomastie.
In einigen Fällen war diese trotz fortgeführter Behandlung spontan reversibel.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Periphere Ödeme.
Nicht bekannt: Gesichtsödem.
Pädiatrische Patienten
Die häufigsten unerwünschten Wirkungen bei Kindern sind vorübergehende lokale Hautreaktionen an der Injektionsstelle. Hingegen treten eine Flüssigkeitsretention sowie Symptome wie Parästhesien, Arthralgien, Myalgien und muskuloskelettale Steifigkeit in dieser Altersgruppe seltener auf als bei Erwachsenen. Darüber hinaus ist die Häufigkeit der unerwünschten Wirkungen bei Kindern abhängig von der Indikation. Insgesamt entspricht das Sicherheitsprofil von Somatropin bei Kindern und Jugendlichen jedoch jenem bei Erwachsenen.
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen)
Sehr selten: Leukämie bei Kindern mit hypophysärem Kleinwuchs. Die Inzidenz scheint jedoch mit jener bei Kindern ohne Wachstumshormonmangel vergleichbar zu sein.
Erkrankungen des Nervensystems
Gelegentlich: Parästhesien.
Selten: Benigne intrakranielle Hypertonie (Pseudotumor cerebri).
Bei niereninsuffizienten Kindern unter Somatropin tritt eine benigne intrakranielle Hypertonie mit einer Inzidenz von 0,9% etwa 10-mal häufiger auf als bei Anwendung von Somatropin in anderen Indikationen.
Erkrankungen des Gastrointestinaltrakts
Nicht bekannt: Akute Pankreatitis (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Hautausschlag, Pruritus, Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Muskuloskelettale Steifigkeit, Arthralgien, Myalgien.
Nicht bekannt: Epiphyseolysis capitis femoris, Morbus Perthes-Calvé-Legg (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Selten: Vorzeitige Thelarche.
In einigen Fällen schritt die Brustentwicklung trotz fortgesetzter Behandlung nicht weiter fort.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Vorübergehende lokale Hautreaktionen an der Injektionsstelle.
Gelegentlich: Periphere Ödeme.
Nicht bekannt: Gesichtsödem.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Eine akute Überdosierung könnte zunächst zu einer Hypoglykämie führen, der eine Hyperglykämie folgt. Eine Langzeit-Überdosierung kann eine Akromegalie verursachen.
Eigenschaften/Wirkungen
ATC-Code
H01AC01
Wirkungsmechanismus/Pharmakodynamik
Omnitrope enthält Somatropin (r-hGH), ein Polypeptid mit 191 Aminosäuren, welches in chemischer Zusammensetzung und Struktur mit dem humanen hypophysären Wachstumshormon völlig identisch ist. Es wird gentechnologisch in reinster Form in E. coli Bakterien hergestellt.
Bei Kindern mit ungenügender Produktion von endogenem Wachstumshormon stimuliert Somatropin das Längenwachstum und erhöht die Wachstumsrate. Diese Wirkung wird über eine Stimulierung der insulinähnlichen Wachstumsfaktoren (IGF, Somatomedine) vermittelt.
Neben seiner wachstumsfördernden Wirkung stimuliert Somatropin Zellteilung, Aufnahme von Aminosäuren, Proteinsynthese und Lipolyse und reduziert die Glucoseverwertung (Anti-Insulinwirkung).
Die Serumkonzentrationen von IGF-I und IGFBP3 (Insulin-like Growth Factor Binding Protein 3) werden durch Somatropin erhöht.
Beruht der Minderwuchs auf dem Unvermögen, IGF (Somatomedine) zu bilden oder auf dem Fehlen ihrer Rezeptoren, so ist durch eine exogene Zufuhr von Somatropin keine therapeutische Wirkung zu erwarten.
Klinische Wirksamkeit
Die Sicherheit und Wirksamkeit von Somatropin bei der Behandlung von Kindern mit intrauterinem Kleinwuchs (SGA) wurden in 4 randomisierten, offenen Studien untersucht. Die Behandlungsregimes variierten zwischen den Studien und schlossen in einigen Gruppen behandlungsfreie Intervalle ein. Während der ersten 24 Monate wurden die Kinder zwischen 2 und 9 Jahren mit Dosen von 0,033 mg/kg/Tag, 0,067 mg/kg/Tag oder 0,1 mg/kg/Tag behandelt. Für die restlichen 48 Monate waren die Dosen 0,033 mg/kg/Tag oder 0,067 mg/kg/Tag.
Veränderung des Standard-Deviation-Score (SDS) der Körperlänge pro Behandlungsgruppe von Baseline bis 72 Monate. Mittelwert ± SEM.
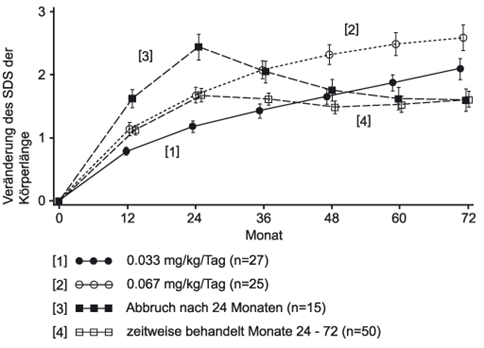
Die Abbildung zeigt, dass die kontinuierliche Behandlung über 72 Monate wirksam und dosisabhängig ist. Bei Patienten, die nur während der ersten 24 Monate behandelt wurden, sank der Standard-Deviation-Score (SDS) der Körperlänge zwischen 24 und 72 Monaten wieder ab. Bei Patienten, die nach 24 Monaten nur zeitweise behandelt wurden, blieb der Standard-Deviation-Score (SDS) der Körperlänge mehr oder weniger unverändert. Ein Abbruch der Behandlung führte zu einem Verlust des Wachstumsvorteils.
Die Auswirkungen eines Wachstumshormonmangels beim Erwachsenen werden durch Somatropin wie folgt beeinflusst
Keiner der nachfolgend aufgeführten Parameter wurde in doppelblinden, statistisch validierten Untersuchungen eindeutig belegt, sondern stellt eine Beschreibung der in 2 gepoolten kontrollierten und 3 unkontrollierten Studien an insgesamt 110 Patienten gewonnenen Daten dar.
- Zentrale Adipositas: wird leicht vermindert.
- Fettfreie Masse: wird leicht erhöht.
- Gesamtfettmasse: bleibt unverändert.
- Knochendichte (BMD): Nach initial leichtem Abbau erfolgt in der Regel nach 1–2 Jahren eine Zunahme. Frakturdaten liegen nicht vor.
- Plasmalipide: Verminderung von Gesamtcholesterin und LDL, Erhöhung von HDL. Die klinische Relevanz dieser Veränderungen ist nicht geklärt.
- Muskelkraft und kardiovaskuläre Leistungsfähigkeit: kein Einfluss.
- Subjektive Lebensqualität: variabler, nicht signifikanter Einfluss.
- Zur Mortalität (gesamte und kardiovaskuläre) liegen keine Daten vor.
Pharmakokinetik
Absorption
Nach subkutaner Applikation von Somatropin werden etwa 80% des Somatropins absorbiert. Nach Gabe einer subkutanen Dosis von 0,035 mg/kg Somatropin werden maximale Plasmakonzentrationen von 13−35 ng/ml nach 3−6 Stunden erreicht.
Distribution
Das mittlere Verteilungsvolumen von Somatropin nach Verabreichung an erwachsene Patienten mit GH-Mangel beträgt ca. 1,3 (± 0,8) l/kg.
Metabolismus
Die Metabolisierung von Somatropin erfolgt entsprechend dem allgemeinen Proteinstoffwechsel.
Elimination
Die mittlere Halbwertszeit von Somatropin nach intravenöser Verabreichung bei Erwachsenen mit Wachstumshormonmangel beträgt etwa 0,4 Stunden. Nach subkutaner Verabreichung beträgt die Halbwertszeit etwa 2–3 Stunden. Dieser Unterschied ist durch die langsame Absorption von der Injektionsstelle bei subkutaner Verabreichung zu erklären.
Kinetik spezieller Patientengruppen
Die absolute Bioverfügbarkeit von Somatropin nach subkutaner Verabreichung scheint bei Frauen und Männern vergleichbar zu sein.
Pharmakokinetische Daten über Somatropin bei geriatrischen und pädiatrischen Patientenpopulationen verschiedener Ethnien oder solchen mit Nieren-, Leber- oder Herzinsuffizienz sind nicht verfügbar.
Präklinische Daten
Präklinische in-vitro- und in-vivo-Genotoxizitätsstudien lieferten keine Hinweise auf Genmutationen oder Chromosomenaberrationen.
Studien zur allgemeinen Toxizität, lokalen Verträglichkeit und Reproduktionstoxizität erbrachten keine Hinweise auf klinisch relevante Effekte.
Eine erhöhte Chromosomenfragilität wurde nach Zugabe des Radiomimetikums Bleomycin in einer In-vitro-Studie mit Lymphozyten von Patienten nach Somatropin-Langzeitbehandlung festgestellt. Die klinische Bedeutung ist unklar.
Eine weitere Studie mit Lymphozyten von Patienten nach Somatropin-Langzeitbehandlung zeigte keine vermehrten Chromosomenanomalien.
Sonstige Hinweise
Inkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Nach der ersten Anwendung innerhalb von 28 Tagen verbrauchen.
Besondere Lagerungshinweise
In der Originalverpackung, im Kühlschrank (2–8°C), vor Licht geschützt und ausser Reichweite von Kindern lagern. Nicht einfrieren.
Hinweise für die Handhabung
Omnitrope 5, 10, 15 sind zur Verwendung mit den Injektionsgeräten SurePalTM 5, SurePalTM 10 und SurePalTM 15 bestimmt.
Die Glaspatronen für Omnitrope 5, 10, 15 zur Verwendung mit den Injektionsgeräten SurePalTM 5, 10 und 15 sind über einen Kunststoffmechanismus fest in ein transparentes Behältnis montiert. Diese fest verbundene Patroneneinheit verfügt über ein Gewinde an einem Ende für die Befestigung der Injektionsnadel.
Der SurePalTM 5 (Pen) wird für Omnitrope 5 und mit einer BDTM Pen-Nadel (29 G x 12,7 mm oder 31 G x 8 mm oder 31 G x 5 mm) verwendet. Der Pen kann in 0,05 mg Schritten auf jede Dosis bis max. 2,7 mg eingestellt werden.
Der SurePalTM 10 (Pen) wird für Omnitrope 10 und mit einer BDTM Pen-Nadel (29 G x 12,7 mm oder 31 G x 8 mm oder 31 G x 5 mm) verwendet. Der Pen kann in 0,1 mg Schritten auf jede Dosis bis max. 5,4 mg eingestellt werden.
Der SurePalTM 15 (Pen) wird für Omnitrope 15 und mit einer BDTM Pen-Nadel (29 G x 12,7 mm oder 31 G x 8 mm oder 31 G x 5 mm) verwendet. Der Pen kann in 0,1 mg Schritten auf jede Dosis bis max. 5,4 mg eingestellt werden (siehe detaillierte Anleitungen zu SurePalTM 5, SurePalTM 10 und SurePalTM 15).
Zulassungsnummer
61306 (Swissmedic)
Zulassungsinhaberin
Sandoz Pharmaceuticals AG, Risch; Domizil: Rotkreuz
Stand der Information
September 2020
Composizione
Principi attivi
Somatropinum ADNr.
Ormone somatotropo umano prodotto con tecnologia genetica (ricombinante).
Sostanze ausiliarie
Omnitrope 5: Dinatrii phosphas heptahydricus, natrii dihydrogenophosphas dihydricus, poloxamerum 188, alcohol benzylicus 9 mg/ml, mannitolum, acidum phosphoricum, natrii hydroxidum, aqua ad iniectabilia.
1 cartucce contiene maximal 0,47 mg di sodio.
Omnitrope 10: Dinatrii phosphas heptahydricus, natrii dihydrogenophosphas dihydricus, poloxamerum 188, phenolum, glycinum, acidum phosphoricum, natrii hydroxidum, aqua ad iniectabilia.
1 cartucce contiene maximal 0,51 mg di sodio.
Omnitrope 15: Dinatrii phosphas heptahydricus, natrii dihydrogenophosphas dihydricus, poloxamerum 188, phenolum, natrii chloridum, acidum phosphoricum, natrii hydroxidum, aqua ad iniectabilia.
1 cartucce contiene maximal 4,70 mg di sodio.
Forma farmaceutica e quantità di principio attivo per unità
1 cartucce Omnitrope 5 contiene 5 mg somatropinum.
1 cartucce Omnitrope 10 contiene 10 mg somatropinum.
1 cartucce Omnitrope 15 contiene 15 mg somatropinum.
Omnitrope Soluzione d'iniezione è una soluzione trasparente, incolore.
Indicazioni/Possibilità d'impiego
Bambini
- Per la terapia di sostituzione in pazienti con comprovata insufficiente secrezione endogena di ormone somatotropo (bassa statura di origine ipofisaria).
- Bassa statura in pazienti con sindrome di Turner.
- Disturbi della crescita nei pazienti dovuti a insufficienza renale cronica.
- Sindrome di Prader-Willi (PWS), per migliorare la crescita e la composizione corporea in combinazione con una dieta ipocalorica. La diagnosi di PWS deve essere confermata da test genetici appropriati.
- Trattamento a lungo termine dei disturbi della crescita in pazienti con ritardo di crescita intrauterina (SGA) che non hanno recuperato il ritardo di crescita entro il secondo anno di vita. Dovrebbe essere esclusa la presenza di altre cause di bassa statura.
Adulti
Deficit di ormone somatotropo (GH) negli adulti dovuto a malattia ipotalamica o ipofisaria con esordio infantile o in età adulta.
- Esordio infantile: pazienti con deficit di GH congenito, genetico, acquisito o idiopatico in età infantile. Nei pazienti cui è stato diagnostico un deficit di GH in età infantile, la capacità di secernere GH dovrebbe essere rivalutata dopo il completamento della crescita longitudinale. Nei pazienti che con ogni probabilità presentano un deficit di GH persistente, ad es. con deficit congenito di GH o deficit di GH dovuto a malattie ipofisarie/ipotalamiche o infarto, un punteggio di deviazione standard (SDS) relativo al fattore di crescita insulino-simile-I (IGF-I) <-2 dopo una sospensione di almeno 4 settimane della terapia con GH deve essere considerato prova sufficiente di un deficit marcato di GH.
Tutti gli altri pazienti dovrebbero essere sottoposti ad un esame dell'IGF-I e a un test di stimolazione del GH.
- Esordio in età adulta: pazienti con grave deficit di GH associato ad altri deficit ormonali dovuti a note malattie dell'ipotalamo o dell'ipofisi e ad almeno un deficit noto di ormoni ipofisari, ad eccezione della prolattina. Ai fini della diagnosi o dell'esclusione di un deficit di GH, questi pazienti dovrebbero essere sottoposti ad un test dinamico appropriato.
Posologia/Impiego
Il trattamento con somatropina dovrebbe essere effettuato solo da un medico specialista che abbia familiarità con la diagnosi e il trattamento dei disturbi della crescita.
La posologia viene determinata su base individuale.
Per garantire la tracciabilità dei medicamenti biotecnologici, si raccomanda di prendere nota del nome commerciale e del numero di lotto in occasione di ogni trattamento.
Posologia abituale
Bambini
Nanismo ipofisario
In generale si raccomanda una dose da 0,025–0,035 mg/kg di peso corporeo al giorno oppure da 0,7–1,0 mg/m² di superficie corporea al giorno.
In caso di risposta insufficiente al trattamento, la dose può essere aumentata individualmente. Un aumento della posologia dovrebbe essere considerato non prima che siano trascorsi 6 mesi di trattamento e non dovrebbe superare il 40%.
In caso di deficit di GH già diagnosticato in età infantile e che si protrae nell'adolescenza, il trattamento dovrebbe essere continuato con l'obiettivo di raggiungere uno sviluppo somatico completo (ad es. composizione corporea, densità ossea). Come parametro per il controllo degli obiettivi terapeutici durante la fase di transizione, viene utilizzato il raggiungimento di una normale densità ossea massima, definita come punteggio T >-1 (ad es. standardizzata alla densità ossea media di un adulto misurata con metodo DEXA (assorbimetria a raggi X a doppia energia), tenendo conto del sesso e dell'origine etnica). Per le indicazioni posologiche, cfr. di seguito la sezione corrispondente.
Sindrome di Prader-Willi (PWS)
In generale si raccomanda una dose da 0,035 mg/kg di peso corporeo al giorno oppure da 1,0 mg/m² di superficie corporea al giorno. Non si deve superare una dose giornaliera di 2,7 mg. I bambini con una velocità di crescita inferiore a 1 cm all'anno e imminente saldatura delle epifisi non dovrebbero essere trattati. È necessario controllare il metabolismo dei carboidrati.
Sindrome di Turner
Si raccomanda una dose da 0,045–0,050 mg/kg di peso corporeo al giorno oppure da 1,4 mg/m² di superficie corporea al giorno.
Nelle pazienti affette da sindrome di Turner finora non è stato definito a quale età dovrebbe essere avviato il trattamento. Sulla base dei dati disponibili non è possibile valutare se ci si possa aspettare un effetto migliore sulla statura definitiva dell'adulto iniziando il trattamento in età infantile rispetto alla prepubertà.
Disturbi della crescita dovuti a insufficienza renale cronica
Si raccomanda una dose da 1,4 mg/m² di superficie corporea al giorno (corrispondente a circa 0,045–0,050 mg/kg di peso corporeo al giorno). Qualora la velocità di crescita sia troppo bassa possono essere necessarie dosi più elevate. Un aumento della posologia dovrebbe essere considerato non prima che siano trascorsi 6 mesi di trattamento e non deve superare il 30%.
Bambini con ritardo di crescita intrauterina (SGA)
Si raccomanda una dose da 0,033–0,067 mg/kg di peso corporeo al giorno oppure da 1,0–2,0 mg/m2 di superficie corporea al giorno.
Adulti
Deficit di ormone somatotropo
Nei pazienti con un deficit di GH diagnosticato in età infantile, per il proseguimento del trattamento si raccomanda una posologia da 0,2–0,5 mg al giorno. La dose dovrebbe essere aumentata o diminuita gradualmente secondo le esigenze individuali del paziente e sulla base della determinazione della concentrazione di IGF-I.
Nei pazienti in cui il deficit di GH viene diagnosticato soltanto in età adulta, la dose iniziale raccomandata è di 0,15–0,30 mg al giorno. La dose dovrebbe essere aggiustata gradualmente secondo le esigenze individuali del paziente e sulla base della determinazione della concentrazione di IGF-I. Al momento dell'aggiustamento è necessario tenere conto dell'età e del sesso.
In entrambi i casi, la posologia dovrebbe essere controllata sulla base delle misurazioni dei livelli di IGF-I. La risposta clinica e gli effetti indesiderati che si manifestano dovrebbero essere utilizzati come riferimento nella titolazione della dose.
Nei pazienti che mostrano una buona risposta clinica, anche in assenza di normalizzazione dei livelli di IGF-I non è necessario alcun incremento della dose.
La dose giornaliera di mantenimento raramente supera 1,33 mg al giorno. Le donne possono necessitare di dosi più elevate rispetto agli uomini (cfr. «Raccomandazioni posologiche speciali - Sesso», «Avvertenze e misure precauzionali» e «Interazioni»). Poiché la normale produzione endogena di ormone somatotropo diminuisce con l'età, anche il fabbisogno di somatropina può diminuire con l'avanzare dell'età.
Nei pazienti di età superiore a 60 anni, il trattamento deve iniziare con dosi da 0,1–0,2 mg al giorno che dovranno essere aumentate lentamente in base al fabbisogno individuale. Si dovrebbe usare, di caso in caso, la più bassa dose efficace. In questi pazienti la dose giornaliera di mantenimento raramente supera 0,5 mg al giorno.
Durata della terapia
Il trattamento dei disturbi della crescita con Omnitrope è un trattamento continuativo a lungo termine che può essere proseguito sotto controllo periodico fino al raggiungimento del risultato clinico desiderato o fino alla saldatura delle epifisi.
Nei bambini e negli adolescenti con insufficienza renale cronica il trattamento deve essere interrotto dopo un trapianto di rene, indipendentemente dall'età.
La durata del trattamento negli adulti non è definita. A intervalli annuali, è necessario che uno specialista verifichi se il trattamento apporti o meno un reale beneficio clinico al paziente e se sia quindi opportuno continuare il trattamento.
Istruzioni posologiche speciali
Sesso
Le donne e le ragazze dalla pubertà in poi necessitano di dosi di somatropina più elevate rispetto agli uomini per ottenere un'efficacia adeguata. Ciò vale in misura maggiore in caso di assunzione di estrogeni orali (cfr. «Interazioni» e «Avvertenze e precauzioni»).
Pazienti con disturbi della funzionalità epatica
Somatropina non è stato esaminato in pazienti con insufficienza epatica. Pertanto, non è possibile formulare raccomandazioni posologiche.
Pazienti con disturbi della funzionalità renale
La farmacocinetica della somatropina non è stata esaminata in pazienti con insufficienza renale. Tuttavia, probabilmente non è necessario un aggiustamento della dose. Per la posologia nei bambini con disturbi della crescita dovuti a insufficienza renale cronica, cfr. sopra.
Pazienti anziani
Per la posologia nei pazienti a partire dai 60 anni, cfr. sopra. La posologia dipende dal fabbisogno individuale.
Somministrazione ritardata della dose
Se è stata dimenticata una dose si dovrebbe proseguire la terapia il giorno successivo, come d'abitudine. Non somministrare per nessun motivo due dosi nello stesso giorno.
Modo di somministrazione
Omnitrope viene somministrato per via sottocutanea.
La sede di iniezione dovrebbe essere cambiata quotidianamente per prevenire una lipoatrofia.
Controindicazioni
- Bambini con sindrome di Down o Bloom oppure anemia di Fanconi.
- Presenza di un tumore attivo e/o di lesioni endocraniche attive, terapia oncologica in corso.
- Pazienti critici con complicazioni a seguito di interventi chirurgici cardiaci o addominali a cielo aperto, politrauma o insufficienza respiratoria acuta.
- Ipersensibilità nota a uno qualsiasi dei componenti di Omnitrope (cfr. «Composizione»).
Omnitrope è inefficace nei bambini e negli adolescenti con epifisi saldate.
Avvertenze e misure precauzionali
Le esperienze nei pazienti di età superiore a 60 anni sono limitate. In determinate circostanze, i pazienti anziani reagiscono con maggiore sensibilità all'effetto di somatropina e pertanto hanno una maggiore probabilità di manifestare effetti indesiderati.
Le esperienze nella terapia a lungo termine degli adulti sono limitate.
Nelle fasi di forte crescita, in tutti i bambini può verificarsi un peggioramento della scoliosi. Si dovrebbe quindi prestare attenzione ai segni di scoliosi durante il trattamento. Tuttavia, ad oggi non vi sono prove che un trattamento con l'ormone somatotropo aumenti la gravità o l'incidenza di una scoliosi. La scoliosi è comune nei pazienti con sindrome di Prader-Willi (PWS).
Sindrome di Prader-Willi
Sono stati riportati casi di morte associati al trattamento con l'ormone somatotropo in pazienti pediatrici con PWS che presentavano uno o più dei seguenti fattori di rischio: obesità grave (il rapporto peso/altezza supera il 200% della mediana dei bambini della stessa altezza), disturbi respiratori o apnea del sonno all'anamnesi o infezione respiratoria non diagnosticata. I pazienti con uno o più di questi fattori potrebbero essere maggiormente a rischio. Pertanto, prima di iniziare il trattamento con somatropina, i pazienti con PWS devono essere esaminati per individuare segni di ostruzione delle vie respiratorie superiori, apnea del sonno o infezioni respiratorie.
Se i risultati patologici fanno sospettare la presenza di un'ostruzione delle vie respiratorie superiori, il bambino deve essere indirizzato a uno specialista in otorinolaringoiatria (ORL) per ulteriori accertamenti e per il trattamento dei disturbi respiratori prima di iniziare la terapia con l'ormone somatotropo.
Se un paziente sviluppa segni di ostruzione delle vie respiratorie superiori durante la terapia con somatropina (inclusi l'insorgenza o l'aggravamento del russamento), la terapia deve essere interrotta e deve essere eseguito nuovamente un esame medico ORL.
Un'apnea del sonno deve essere valutata, prima di iniziare la terapia con l'ormone somatotropo, con metodi riconosciuti come la polisonnografia o l'ossimetria notturna e, se necessario, va tenuta monitorata. Se si sospetta un'apnea del sonno, deve essere effettuato un monitoraggio adeguato e, se necessario, un trattamento.
Tutti i pazienti con PWS devono essere monitorati per individuare eventuali segni di infezioni delle vie respiratorie, le quali devono essere diagnosticate il prima possibile e trattate in modo aggressivo.
Tutti i pazienti con PWS devono essere sottoposti a un efficace controllo del peso prima e durante la terapia con l'ormone somatotropo. I pazienti con PWS dovrebbero sempre essere trattati in combinazione con una dieta ipocalorica.
Uso nei pazienti oncologici
Nel trattamento del deficit di ormone somatotropo come effetto secondario di un trattamento oncologico, il paziente deve essere monitorato per individuare eventuali recidive del tumore.
Nei pazienti sopravvissuti a una malattia maligna insorta durante l'infanzia (i cosiddetti «childhood cancer survivors») è stato riportato un aumentato rischio di seconde neoplasie durante il trattamento con somatropina. Il più delle volte si trattava di tumori endocranici, in particolare meningiomi. Questi tumori sono stati osservati soprattutto in pazienti trattati con una radioterapia della testa per curare la loro prima neoplasia.
Finora non è noto se negli adulti potrebbe esistere una correlazione tra una terapia con somatropina e recidive di tumori del SNC.
Ipertensione endocranica benigna
In caso di cefalea grave o recidivante, disturbi della vista, nausea e/o vomito, dovrebbe essere eseguita una fundoscopia per escludere la presenza di un papilledema. In presenza di un papilledema, occorre considerare l'eventualità di un'ipertensione endocranica benigna e, se necessario, interrompere la terapia con l'ormone somatotropo. Non è possibile fornire raccomandazioni vincolanti per la ripresa del trattamento dopo l'attenuazione dei sintomi. Se si prosegue il trattamento con l'ormone somatotropo, è necessario effettuare un attento monitoraggio.
Tolleranza al glucosio
La somatropina riduce la sensibilità all'insulina, motivo per cui i pazienti dovrebbero essere monitorati per eventuali segni di intolleranza al glucosio. In rari casi, la terapia con somatropina può causare un disturbo della tolleranza al glucosio che soddisfa i criteri per il diabete mellito di tipo II. Il rischio di sviluppare il diabete durante il trattamento con somatropina è massimo in quei pazienti che già presentano una ridotta tolleranza al glucosio e/o altri fattori di rischio per un diabete mellito di tipo II, come ad es. l'obesità, un'anamnesi familiare positiva o una terapia steroidea. Pertanto, nei pazienti con diabete mellito preesistente la somministrazione di Omnitrope dovrebbe avvenire solo sotto stretto monitoraggio medico e di laboratorio. La posologia della terapia antidiabetica deve essere aggiustata eventualmente dopo l'inizio del trattamento con somatropina.
Funzionalità tiroidea
La funzionalità tiroidea dovrebbe essere monitorata dopo l'inizio del trattamento con somatropina e dopo eventuali aggiustamenti della dose.
Durante il trattamento con somatropina è stata osservata una maggiore conversione di T4 in T3 a causa di un aumento della deiodinazione periferica della tiroxina, che può portare a una riduzione di T4 o a un aumento delle concentrazioni sieriche di T3. In generale, tuttavia, i livelli ormonali periferici si sono mantenuti all'interno dell'intervallo normale per gli individui sani. Tuttavia, in pazienti con ipotiroidismo subclinico centrale che potrebbero teoricamente sviluppare un ipotiroidismo, l'effetto della somatropina sui livelli di ormone tiroideo può essere clinicamente rilevante. Viceversa, un ipotiroidismo non trattato può influenzare l'effetto della somatropina. Se necessario, oltre a Omnitrope deve essere somministrato anche l'ormone tiroideo.
Ma anche all'inverso, i pazienti che ricevono una terapia di sostituzione con tiroxina possono sviluppare un lieve ipertiroidismo.
Interazione con gli estrogeni
Gli estrogeni orali possono ridurre la concentrazione di IGF-1 nel siero e, di conseguenza, attenuare l'efficacia della somatropina. Pertanto, nelle pazienti trattate con somatropina che iniziano una terapia estrogenica può essere necessario aumentare la dose di somatropina per mantenere i livelli sierici di IGF-1 entro il normale intervallo per l'età. Viceversa, se si interrompe la terapia estrogenica, può essere necessario ridurre la dose di somatropina (cfr. «Interazioni»).
Per la contraccezione è preferibile usare metodi non ormonali.
Alterazioni scheletriche
Nei pazienti con disturbi endocrini, compresi quelli con deficit di ormone somatotropo, sussiste un aumentato rischio di epifisiolisi della testa femorale e i pazienti affetti da nanismo hanno maggiori probabilità di sviluppare la malattia di Legg-Calvé-Perthes. Non è possibile valutare in modo definitivo se il trattamento con somatropina aumenti o meno il rischio di insorgenza di queste malattie. Il medico e i genitori dovrebbero quindi prestare attenzione alla possibile insorgenza di zoppicamento in lento peggioramento, dolori all'anca e al ginocchio e/o di una riduzione dell'escursione articolare.
In particolare, le pazienti con sindrome di Turner dovrebbero essere esaminate a intervalli regolari e soprattutto al manifestarsi di dolore osseo per individuare segni di epifisiolisi o di malattia di Scheuermann.
Terapia con somatropina in pazienti pediatrici con insufficienza renale cronica
Prima di decidere di iniziare una terapia con ormone somatotropo, è necessario eseguire un test di funzionalità renale. A tal riguardo, il valore GFR dovrebbe essere inferiore al 50% del valore normale. Affinché i disturbi della crescita possano essere individuati e confermati, si dovrebbe monitorare la crescita per un anno. Durante la terapia con ormone somatotropo, il trattamento dell'insufficienza renale cronica dovrebbe essere proseguito come di consueto.
Sviluppo di anticorpi
Si è osservato lo sviluppo di anticorpi anti-somatropina. La capacità di legame di questi anticorpi è risultata bassa e il loro sviluppo non è stato associato a cambiamenti clinici. Tuttavia, se il paziente non risponde al trattamento, si devono determinare gli anticorpi anti-ormone somatotropo.
Altre misure precauzionali
L'effetto di somatropina sul recupero di malati gravi è stato esaminato in due studi controllati verso placebo condotti su 522 pazienti adulti con complicazioni a seguito di interventi chirurgici cardiaci o addominali a cielo aperto, di politrauma o di insufficienza respiratoria acuta. La mortalità è risultata più alta nei pazienti trattati quotidianamente con 5,3 o 8 mg di somatropina rispetto ai pazienti del gruppo placebo (41,9% vs 19,3%). Pertanto, tali pazienti non dovrebbero essere trattati con somatropina. Poiché non sono disponibili dati sulla sicurezza della terapia di sostituzione con l'ormone somatotropo in pazienti critici, i benefici attesi dal proseguimento del trattamento devono essere valutati rispetto ai potenziali svantaggi, come nel caso di tutti i pazienti che sviluppano una tale malattia o una condizione critica comparabile.
In caso di insufficienza completa o parziale dell'ipofisi anteriore, può essere necessaria una terapia di sostituzione con ulteriori ormoni (ad es. glucocorticoidi). Poiché i glucocorticoidi possono ridurre l'efficacia terapeutica della somatropina, in tal caso la crescita deve essere attentamente monitorata. La posologia di tale terapia aggiuntiva deve essere aggiustata con particolare attenzione per prevenire un'inibizione della crescita.
L'inizio della terapia con somatropina può portare a un'inibizione della 11β-idrossisteroide deidrogenasi 1 (11βHSD-1) e alla riduzione dei livelli sierici di cortisolo. Ciò può rendere manifesto un iposurrenalismo (secondario) centrale latente nei pazienti trattati con somatropina, che può rendere necessaria una terapia di sostituzione con glucocorticoidi. Inoltre, dopo l'inizio della terapia con somatropina, nei pazienti già sottoposti a terapia di sostituzione con glucocorticoidi a causa di un iposurrenalismo precedentemente diagnosticato può essere necessario un aumento della dose di mantenimento e/o da stress (cfr. «Interazioni»).
I pazienti in terapia con somatropina dovrebbero essere monitorati per eventuali ingrossamenti o evidenze di alterazioni maligne di nevi preesistenti.
Nei bambini con determinate cause genetiche rare di nanismo è stato riportato un aumentato rischio di sviluppare malattie maligne. La decisione di iniziare una terapia con ormone somatotropo dovrebbe tenere conto di questo rischio nella valutazione del rapporto rischio-beneficio. Durante il trattamento con somatropina tali pazienti devono essere attentamente monitorati per il possibile sviluppo di neoplasie.
Sono stati segnalati casi di pancreatite durante il trattamento con somatropina, in particolare nei bambini. I dati pubblicati suggeriscono che soprattutto le ragazze con sindrome di Turner in terapia con somatropina potrebbero presentare un aumentato rischio di pancreatite. Se un paziente in trattamento con somatropina manifesta dolore acuto e intenso all'addome superiore, la pancreatite dovrebbe essere inclusa nella diagnosi differenziale.
Sono stati segnalati ridotti livelli sierici di cortisolo, probabilmente dovuti agli effetti del legame con le proteine plasmatiche. Tuttavia non si è osservato uno spostamento verso il cortisolo libero nel siero.
Benzylalkohol
Omnitrope 5 contiene 13,5 mg di alcol benzilico per cartucce equivalente a 9 mg/ml. Alcol benzilico può causare reazioni allergiche. Grandi volumi devono essere usati con cautela e solo se necessario, specialmente in pazienti con insufficienza epatica o renale a causa del rischio di accumulo e tossicità (acidosi metabolica). Alcool benzilico è stato associato al rischio di gravi effetti indesiderati inclusi problemi respiratori (sindrome da respiro agonico) nei bambini piccoli.
Rischio aumentato nei bambini piccoli a causa di accumulo.
Contenuto di sodio
Omnitrope contiene meno di 1 mmol (23 mg) di sodio per cartucce. Da tenere in considerazione soprattutto in pazienti che seguono una dieta a basso contenuto di sodio.
Interazioni
Interazioni farmacocinetiche
La somatropina può aumentare la clearance di sostanze metabolizzate dal citocromo P450 3A4 (ad es. ormoni sessuali, corticosteroidi, anticonvulsivanti e ciclosporina). La rilevanza clinica non è chiara.
L'ormone somatotropo riduce la conversione del cortisone in cortisolo (cfr. «Avvertenze e misure precauzionali»).
Interazioni farmacodinamiche
Un trattamento concomitante con glucocorticoidi inibisce l'effetto stimolante la crescita della somatropina. Nei pazienti con deficit di ACTH, la posologia della terapia di sostituzione con glucocorticoidi deve pertanto essere aggiustata attentamente (cfr. «Avvertenze e misure precauzionali»).
Gli estrogeni orali possono ridurre la concentrazione di IGF-1 nel siero e, di conseguenza, attenuare l'efficacia della somatropina (cfr. «Posologia/Impiego» e «Avvertenze e misure precauzionali»). Il meccanismo di queste interazioni non è noto.
La somministrazione concomitante di androgeni, anabolizzanti o gonadotropine può avere un effetto additivo sulla maturazione ossea.
Gravidanza/Allattamento
Gravidanza
L'esperienza clinica nelle donne in gravidanza è limitata. Gli studi sulla funzione riproduttiva negli animali non hanno evidenziato danni al feto. Gli effetti di un aumento della concentrazione di ormone somatotropo su specifici stadi dell'embriogenesi o della crescita fetale nell'uomo non sono ancora stati chiariti. Pertanto, non si devono consigliare medicamenti contenenti somatropina durante la gravidanza e nelle donne in età fertile che non utilizzano un'appropriata protezione contraccettiva.
Durante una gravidanza normale, i livelli endogeni di ormone somatotropo si riducono significativamente dopo la 20° settimana di gravidanza e si normalizzano entro la 30° settimana di gravidanza. In tale contesto, è improbabile che la terapia sostitutiva con somatropina sia necessaria nel terzo trimestre.
Allattamento
Non sono disponibili dati per quanto riguarda l'eventuale passaggio di hGH nel latte materno. Anche se l'assorbimento di proteine intatte dal tratto gastrointestinale del bambino è improbabile, durante l'uso di somatropina non si dovrebbe allattare.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono stati effettuati studi in merito.
Effetti indesiderati
I pazienti con deficit di ormone somatotropo si caratterizzano per un deficit di volume extracellulare. Questo deficit viene rapidamente corretto dopo l'inizio del trattamento con somatropina. In seguito può comparire ritenzione idrica.
Dopo l'introduzione sul mercato, nei pazienti con sindrome di Prader-Willi sono stati descritti casi rari di morte improvvisa durante il trattamento con somatropina. Tuttavia, non è noto se esista un nesso casuale con la terapia con l'ormone somatotropo.
Di seguito sono riportati gli effetti indesiderati osservati con l'utilizzo di somatropina nell'ambito di studi clinici e/o durante la sorveglianza post-marketing, elencati secondo la Classificazione sistemica organica (MedDRA) e in ordine di frequenza, tenendo conto delle seguenti definizioni: «molto comune» (≥1/10); «comune» (≥1/100, <1/10); «non comune» (≥1/1'000, <1/100); «raro» (≥1/10'000, <1/1'000); «molto raro» (<1/10'000), «non nota» (basata prevalentemente su segnalazioni spontanee provenienti dalla sorveglianza post-marketing; la frequenza esatta non può essere definita).
Adulti
Gli effetti indesiderati più comuni negli studi clinici (con un'incidenza rispettivamente dell'1–10%) sono stati la ritenzione idrica con edema periferico e rigidità delle estremità, artralgie, mialgie e parestesie. In generale questi effetti indesiderati si manifestano all'inizio del trattamento e si attenuano spontaneamente o con la riduzione della dose.
La frequenza di questi effetti indesiderati dipende dalla dose somministrata e dall'età del paziente, ed è probabilmente inversamente proporzionale all'età del paziente al momento della comparsa del deficit di ormone somatotropo.
Disturbi del sistema immunitario
Comune: formazione di anticorpi anti-somatropina (cfr. «Avvertenze e misure precauzionali»).
Patologie endocrine
Raro: ridotti livelli sierici di cortisolo (cfr. «Avvertenze e misure precauzionali»), aumento dei livelli ematici di glucosio (cfr. «Avvertenze e misure precauzionali»), diabete mellito di tipo 2, ipotiroidismo.
Patologie del sistema nervoso
Comune: parestesie.
Non comune: sindrome del tunnel carpale.
Raro: ipertensione endocranica benigna (pseudotumor cerebri).
Patologie respiratorie, toraciche e mediastiniche
Non nota: apnea del sonno in pazienti con sindrome di Prader-Willi.
Patologie della cute e del tessuto sottocutaneo
Non nota: progressione autolimitata di nevi pigmentati, eruzione cutanea, prurito, orticaria.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Comune: rigidità muscoloscheletrica, artralgie, mialgie.
Patologie dell'apparato riproduttivo e della mammella
Raro: ginecomastia.
In alcuni casi è risultata spontaneamente reversibile nonostante la prosecuzione del trattamento.
Patologie generali e condizioni relative alla sede di somministrazione
Comune: edemi periferici.
Non nota: edema della faccia.
Pazienti pediatrici
Gli effetti indesiderati più comuni nei bambini sono reazioni cutanee locali transitorie in sede di iniezione. La ritenzione idrica e sintomi come parestesie, artralgie, mialgie e rigidità muscoloscheletrica, invece, sono più rari in questa fascia di età rispetto agli adulti. Inoltre, la frequenza degli effetti indesiderati nei bambini dipende dall'indicazione. Nel complesso, tuttavia, il profilo di sicurezza di somatropina nei bambini e negli adolescenti equivale a quello degli adulti.
Tumori benigni, maligni e non specificati (incl. cisti e polipi)
Molto raro: leucemia in bambini con nanismo ipofisario. L'incidenza sembra tuttavia essere paragonabile a quella dei bambini senza deficit di ormone somatotropo.
Patologie del sistema nervoso
Non comune: parestesie.
Raro: ipertensione endocranica benigna (pseudotumor cerebri).
Un'ipertensione endocranica benigna, con un'incidenza dello 0,9%, si verifica circa 10 volte più frequentemente in bambini con insufficienza renale trattati con somatropina rispetto a quando la somatropina viene utilizzata in altre indicazioni.
Patologie gastrointestinali
Non nota: pancreatite acuta (cfr. «Avvertenze e misure precauzionali»).
Patologie della cute e del tessuto sottocutaneo
Non comune: eruzione cutanea, prurito, orticaria.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Non comune: rigidità muscoloscheletrica, artralgie, mialgie.
Non nota: epifisiolisi della testa femorale, malattia di Legg-Calvé-Perthes (cfr. «Avvertenze e misure precauzionali»).
Patologie dell'apparato riproduttivo e della mammella
Raro: telarca prematuro.
In alcuni casi non si è verificata una progressione dello sviluppo della mammella nonostante il proseguimento del trattamento.
Patologie generali e condizioni relative alla sede di somministrazione
Raro: reazioni cutanee locali transitorie in sede di iniezione.
Non comune: edemi periferici.
Non nota: edema della faccia.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Un sovradosaggio acuto potrebbe inizialmente portare a ipoglicemia e, in seguito, a iperglicemia. Un sovradosaggio prolungato può causare acromegalia.
Proprietà/Effetti
Codice ATC
H01AC01
Meccanismo d'azione/Farmacodinamica
Omnitrope contiene somatropina (r-hGH), un polipeptide con 191 aminoacidi, che è del tutto identico per composizione chimica e struttura all'ormone somatotropo ipofisario umano. Viene prodotto con tecnologia genetica nella sua forma più pura nei batteri E. coli.
Nei bambini con insufficiente produzione di ormone somatotropo endogeno, la somatropina stimola la crescita longitudinale e aumenta il ritmo di crescita. Questo effetto è mediato da una stimolazione dei fattori di crescita insulino-simili (IGF, somatomedine).
Oltre all'effetto stimolante la crescita, la somatropina stimola la divisione cellulare, l'assorbimento di aminoacidi, la sintesi proteica e la lipolisi e riduce l'utilizzo del glucosio (effetto anti-insulinico).
La somatropina aumenta le concentrazioni sieriche di IGF-I (Insulin-like Growth Factor-1) e IGFBP3 (Insulin-like Growth Factor Binding Protein 3).
Se la bassa statura è dovuta all'incapacità di produrre IGF (somatomedine) o alla mancanza dei suoi recettori, non ci si deve aspettare alcun effetto terapeutico da un apporto esogeno di somatropina.
Efficacia clinica
La sicurezza e l'efficacia di somatropina nel trattamento dei bambini con ritardo di crescita intrauterina (SGA) sono state esaminate in 4 studi randomizzati, in aperto. I regimi di trattamento variavano da uno studio all'altro e includevano in alcuni gruppi intervalli senza trattamento. Durante i primi 24 mesi, i bambini tra i 2 e i 9 anni sono stati trattati con dosi da 0,033 mg/kg/d, 0,067 mg/kg/d o 0,1 mg/kg/d. Per i restanti 48 mesi le dosi sono state di 0,033 mg/kg/d o 0,067 mg/kg/d.
Variazione del punteggio di deviazione standard (SDS) della lunghezza corporea per gruppo di trattamento dal basale a 72 mesi. Media ± media dell'errore standard.
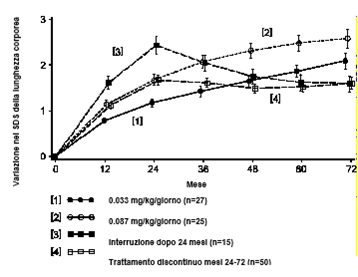
La figura mostra che il trattamento continuativo per 72 mesi è efficace e dose-dipendente. Nei pazienti trattati solo durante i primi 24 mesi, il punteggio di deviazione standard (SDS) della lunghezza corporea è diminuito tra i 24 e i 72 mesi. Nei pazienti che dopo 24 mesi sono stati trattati solo in maniera discontinua, il punteggio di deviazione standard (SDS) della lunghezza corporea è rimasto più o meno invariato. L'interruzione del trattamento ha portato alla perdita del beneficio in termini di guadagno staturale.
Gli effetti del deficit di ormone somatotropo negli adulti sono influenzati da somatropina come segue
Nessuno dei parametri sottoelencati è stato chiaramente dimostrato in studi in doppio cieco statisticamente validati, ma ognuno di essi costituisce una descrizione dei dati ottenuti da 2 studi controllati aggregati e 3 studi non controllati condotti su un totale di 110 pazienti.
- Obesità centrale: leggermente ridotta.
- Massa non grassa: leggermente aumentata.
- Massa grassa totale: rimane invariata.
- Densità ossea (BMD): dopo una lieve riduzione iniziale, di solito si ha un aumento dopo 1–2 anni. Non sono disponibili dati relativi alle fratture.
- Lipidi plasmatici: riduzione del colesterolo totale e di LDL, aumento di HDL. La rilevanza clinica di queste variazioni non è stata chiarita.
- Forza muscolare e prestazioni cardiovascolari: nessun effetto.
- Qualità di vita soggettiva: effetto non significativo.
- Non sono disponibili dati relativi alla mortalità (totale e cardiovascolare).
Farmacocinetica
Assorbimento
Dopo somministrazione sottocutanea di somatropina viene assorbito circa l'80% della somatropina. Dopo somministrazione di una dose sottocutanea da 0,035 mg/kg di somatropina, concentrazioni plasmatiche massime di 13−35 ng/ml vengono raggiunte dopo 3−6 ore.
Distribuzione
Il volume medio di distribuzione della somatropina dopo somministrazione a pazienti adulti con deficit di GH è di circa 1,3 (± 0,8) l/kg.
Metabolismo
Il metabolismo della somatropina corrisponde al metabolismo generale delle proteine.
Eliminazione
L'emivita media di somatropina dopo somministrazione endovenosa negli adulti con deficit di ormone somatotropo è di circa 0,4 ore. Dopo somministrazione sottocutanea, l'emivita è di circa 2–3 ore. Questa differenza si spiega con il lento assorbimento dalla sede di iniezione dopo somministrazione sottocutanea.
Cinetica di gruppi di pazienti speciali
La biodisponibilità assoluta di somatropina dopo somministrazione sottocutanea sembra essere paragonabile nelle donne e negli uomini.
Non sono disponibili dati farmacocinetici su somatropina in popolazioni di pazienti geriatrici e pediatrici di diverse etnie o in popolazioni con insufficienza renale, epatica o cardiaca.
Dati preclinici
Studi preclinici di genotossicità in vitro e in vivo non hanno fornito prove di mutazioni geniche o aberrazioni cromosomiche.
Gli studi sulla tossicità generale, sulla tollerabilità locale e sulla tossicità per la riproduzione non hanno fornito prove di effetti clinicamente rilevanti.
Una maggiore fragilità cromosomica è stata osservata dopo l'aggiunta del radiomimetico bleomicina in uno studio in vitro con linfociti di pazienti che avevano ricevuto un trattamento a lungo termine con somatropina. La rilevanza clinica non è chiara.
Un altro studio con linfociti di pazienti che avevano ricevuto un trattamento a lungo termine con somatropina non ha evidenziato alcun aumento delle anomalie cromosomiche.
Altre indicazioni
Incompatibilità
Poiché per questo medicamento non sono stati condotti studi di compatibilità, non lo si deve somministrare in combinazione con altri medicamenti.
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
In seguito alla prima applicazione, la cartuccia può essere utilizzata per una durata massima di 28 giorni.
Indicazioni particolari concernenti l'immagazzinamento
Conservare nella confezione originale, in frigorifero (2–8°C), al riparo dalla luce e fuori dalla portata dei bambini. Non congelare.
Indicazioni per la manipolazione
Le cartucce Omnitrope 5, 10, 15 sono destinate all'uso con i dispositivi per iniezione SurePalTM 5, SurePalTM 10 e SurePalTM 15.
Le cartucce di vetro per Omnitrope 5, 10, 15 da usarsi con i dispositivi per iniezione SurePalTM 5, 10 e 15 sono collegate a un meccanismo in plastica e incorporate irreversibilmente in un contenitore trasparente. Questo sistema presenta a un'estremità una barra filettata che lo fissa all'ago per iniezione.
Il dispositivo per iniezione SurePalTM 5 (penna) si usa per Omnitrope 5 e con un ago per penna BDTM (29 G x 12,7 mm o 31 G x 8 mm o 31 G x 5 mm). La penna può essere regolata con incrementi da 0,05 mg per somministrazione fino a un massimo di 2,7 mg.
Il dispositivo per iniezione SurePalTM 10 (penna) si usa per Omnitrope 10 e con un ago per penna BDTM (29 G x 12,7 mm o 31 G x 8 mm o 31 G x 5 mm). La penna può essere regolata con incrementi da 0,1 mg per somministrazione fino a un massimo di 5,4 mg.
Il dispositivo per iniezione SurePalTM 15 (penna) si usa per Omnitrope 15 e con un ago per penna BDTM (29 G x 12,7 mm o 31 G x 8 mm o 31 G x 5 mm). La penna può essere regolata con incrementi da 0,1 mg per somministrazione fino a un massimo di 5,4 mg (vedi istruzioni dettagliate per SurePalTM 5, SurePalTM 10 e SurePalTM 15).
Numero dell'omologazione
61306 (Swissmedic)
Titolare dell’omologazione
Sandoz Pharmaceuticals S.A., Risch; domicilio: Rotkreuz
Stato dell'informazione
Settembre 2020
Composition
Principes actifs
Somatropinum ADNr.
Hormone de croissance humaine obtenue par génie génétique (recombinante).
Excipients
Omnitrope 5: Dinatrii phosphas heptahydricus, natrii dihydrogenophosphas dihydricus, poloxamerum 188, alcohol benzylicus 9 mg/ml, mannitolum, acidum phosphoricum, natrii hydroxidum, aqua ad iniectabilia.
1 cartouche contient 0,47 mg du sodium au maximum.
Omnitrope 10: Dinatrii phosphas heptahydricus, natrii dihydrogenophosphas dihydricus, poloxamerum 188, phenolum, glycinum, acidum phosphoricum, natrii hydroxidum, aqua ad iniectabilia.
1 cartouche contient 0,51 mg du sodium au maximum.
Omnitrope 15: Dinatrii phosphas heptahydricus, natrii dihydrogenophosphas dihydricus, poloxamerum 188, phenolum, natrii chloridum, acidum phosphoricum, natrii hydroxidum, aqua ad iniectabilia.
1 cartouche contient 4,70 mg du sodium au maximum.
Forme pharmaceutique et quantité de principe actif par unité
Solution pour injection:
1 cartouche d'Omnitrope 5 contient 5 mg somatropinum.
1 cartouche d'Omnitrope 10 contient 10 mg somatropinum.
1 cartouche d'Omnitrope 15 contient 15 mg somatropinum.
La solution pour injection Omnitrope est claire et incolore.
Indications/Possibilités d’emploi
Enfants
- Substitution chez les patients présentant une sécrétion endogène insuffisante et démontrée d'hormone de croissance (nanisme hypophysaire).
- Petite taille des patients dans le syndrome de Turner.
- Déficit de croissance chez le patient lié à une insuffisance rénale chronique.
- Syndrome de Prader-Willi (SPW, afin d'améliorer la croissance et la composition corporelle, en association à un régime hypocalorique. Le diagnostic de SPW devrait être confirmé par des examens génétiques appropriés.
- Traitement à long terme des troubles de la croissance chez les patients avec retard de croissance intra-utérin (SGA) et n'ayant pas rattrapé leur déficit de croissance jusqu'à l'âge de 2 ans. Les autres causes de petite taille doivent être exclues.
Adultes
Déficit en hormone de croissance (GH) chez l'adulte, ayant débuté à l'enfance ou à l'âge adulte, à la suite d'une maladie hypothalamique ou hypophysaire.
- Début au cours de l'enfance: Patients atteints au cours de l'enfance d'un déficit en GH congénital, génétiquement déterminé, acquis ou idiopathique. La capacité à sécréter de la GH doit être réexaminée au terme de la période de croissance de la taille chez les patients chez lesquels le déficit en GH a déjà été constaté au cours de l'enfance. Chez les patients présentant selon toute vraisemblance un déficit en GH persistant, comme p.ex. un déficit en GH congénital ou un déficit en GH consécutif à une affection ou un infarctus hypophysaire/hypothalamique, un score IGF-I-SDS (insulin-like growth factor I standard deviation score) <–2 après une interruption du traitement par la GH d'au moins 4 semaines doit être considéré comme une preuve suffisante d'un déficit en GH prononcé. Tous les autres patients doivent être soumis à un test de production de l'IGF-I ainsi qu'à un test de stimulation de la GH.
- Début à l'âge adulte: Patients présentant un déficit en GH sévère associé à d'autres déficits hormonaux suite à une affection connue de l'hypothalamus ou de l'hypophyse, ainsi qu'au moins un déficit hormonal connu de l'hypophyse, à l'exception de la prolactine. Un test dynamique approprié doit être effectué chez ces patients afin d'établir ou d'exclure le diagnostic de déficit en GH.
Posologie/Mode d’emploi
Le traitement par la somatropine ne doit être entrepris que par un spécialiste versé dans le diagnostic et la thérapeutique des troubles de la croissance.
La posologie est à adapter à chaque cas individuel.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Posologie habituelle
Enfants
Retard de croissance hypophysaire
La dose journalière généralement recommandée est de 0,025–0,035 mg/kg de poids corporel ou de 0,7–1,0 mg/m² de surface corporelle.
En cas de résultat thérapeutique insuffisant, on pourra augmenter la dose de cas en cas. Une augmentation de la posologie ne sera prise en considération qu'après 6 mois au moins de traitement et n'excédera pas 40%.
En présence d'un déficit en GH qui a déjà été diagnostiqué au cours de l'enfance et qui se prolonge pendant l'adolescence, le traitement doit être poursuivi en ayant pour but d'atteindre un développement somatique complet (p.ex. constitution corporelle, densité osseuse). Au cours de la phase de transition, l'obtention d'une densité osseuse normale maximale sert de paramètre pour contrôler les objectifs thérapeutiques. Elle est définie par un score T (T-score) >–1 (standardisé p.ex. par rapport à la densité osseuse moyenne d'un adulte mesurée par DEXA (absorptiométrie biphotonique aux rayons X) tout en tenant compte du sexe et de l'origine ethnique). Voir le paragraphe correspondant ci-dessous pour les indications concernant la posologie.
Syndrome de Prader-Willi (SPW)
La dose journalière recommandée est de 0,035 mg/kg de poids corporel ou de 1,0 mg/m² de surface corporelle. La dose journalière de 2,7 mg ne doit pas être dépassée. Le traitement est contre-indiqué chez les enfants dont la vitesse de croissance est inférieure à 1 cm par an et dont la soudure épiphysaire est imminente. Le métabolisme glucidique devra être contrôlé.
Syndrome de Turner
La dose journalière recommandée est de 0,045–0,050 mg/kg de poids corporel ou de 1,4 mg/m² de surface corporelle.
Chez les femmes atteintes du syndrome de Turner, on n'a pas encore défini l'âge idéal pour le début du traitement. Les données actuelles ne permettent pas de déterminer si l'efficacité sur l'augmentation de la taille adulte serait supérieure si le traitement était commencé en bas âge par rapport à l'instauration du traitement en période prépubertaire.
Déficit de croissance lié à une insuffisance rénale chronique
La dose journalière recommandée est de 1,4 mg/m² de surface corporelle, soit environ 0,045−0,050 mg/kg de poids corporel. Des doses supérieures peuvent être nécessaires lorsque la croissance se fait à une vitesse estimée trop lente. Une augmentation de la posologie ne sera prise en considération qu'après 6 mois au moins de traitement et n'excédera pas 30%.
Enfants avec retard de croissance intra-utérin (SGA)
Dose recommandée: 0,033–0,067 mg/kg de poids corporel par jour ou 1,0 à 2,0 mg/m² de surface corporelle par jour.
Adultes
Déficit en hormone de croissance
Chez les patients présentant un déficit en GH diagnostiqué au cours de l'enfance, il est recommandé de reprendre le traitement à une posologie de 0,2 à 0,5 mg par jour. La posologie doit être augmentée ou diminuée par paliers selon les besoins individuels du patient et sur la base de la détermination de la concentration d'IGF-I.
Pour les patients chez lesquels le déficit en GH n'a été constaté qu'à l'âge adulte, la dose journalière initiale recommandée est de 0,15–0,30 mg. La posologie doit être ajustée par paliers selon les besoins individuels du patient et sur la base de la détermination de la concentration d'IGF-I. L'âge et le sexe doivent être pris en compte lors de cet ajustement.
Dans les deux cas, la posologie doit être contrôlée par des mesures de l'IGF-I. La réaction clinique ainsi que l'apparition d'effets indésirables doivent servir de points de repère au cours de la titration posologique.
Chez les patients présentant une bonne réponse clinique sans normalisation des taux d'IGF-I, aucune augmentation posologique n'est nécessaire.
La dose d'entretien journalière dépasse rarement 1,33 mg. Les femmes peuvent nécessiter des doses supérieures à celles des hommes (voir «Instructions spéciales pour la posologie - Sexe», «Mises en garde et précautions» et «Interactions»). Etant donné que la production normale endogène d'hormone de croissance diminue avec l'âge, les besoins en somatropine peuvent eux aussi diminuer avec l'âge.
Chez les patients de plus de 60 ans, le traitement doit être initié à une posologie de 0,1–0,2 mg par jour puis, le cas échéant, lentement augmentée selon le besoin individuel. Il faut alors toujours administrer la dose efficace la plus faible. La dose d'entretien journalière dépasse rarement 0,5 mg par jour chez ces patients.
Durée du traitement
Le traitement des retards de croissance par Omnitrope est un traitement continu au long cours, qui peut être poursuivi sous surveillance régulière jusqu'à obtention d'un succès clinique resp. jusqu'à la disparition du cartilage de conjugaison.
Chez les enfants et les adolescents souffrant d'insuffisance rénale chronique, le traitement devra être suspendu après une transplantation rénale, quel que soit l'âge du patient.
La durée du traitement chez les adultes n'est pas définie. Il convient de faire un contrôle médical annuel par un spécialiste pour évaluer si le traitement apporte des bénéfices cliniques réels au patient et si la poursuite du traitement est justifiée.
Instructions spéciales pour la posologie
Sexe
Chez les femmes et les jeunes filles à partir de la puberté, des doses de somatropine supérieures à celles des hommes sont nécessaires pour atteindre l'efficacité adéquate. Cela est d'autant plus le cas en présence d'un apport en estrogènes oraux (voir «Interactions» et «Mises en garde et précautions»).
Patients présentant des troubles de la fonction hépatique
L'utilisation de somatropine n'a pas été étudiée chez les patients souffrant d'insuffisance hépatique. Aucune instruction pour la posologie ne peut donc être donnée.
Patients présentant des troubles de la fonction rénale
Les propriétés pharmacocinétiques de la somatropine n'ont pas été étudiées chez les patients souffrant d'insuffisance rénale. Toutefois, il est probable qu'il ne soit pas nécessaire d'adapter la posologie. Pour connaître la posologie pour les enfants présentant un déficit de croissance lié à une insuffisance rénale chronique, voir ci-dessus.
Patients âgés
Pour connaître la posologie des patients de 60 ans et plus, voir ci-dessus. La posologie dépend des besoins individuels des patients.
Doses reportées
En cas d'oubli d'une dose, on reprendra le traitement le lendemain en appliquant le même schéma posologique. En aucun cas, on n'administrera deux doses le même jour.
Mode d'ulitisation
Omnitrope est administré par voie sous-cutanée.
On changera de site d'injection chaque jour pour éviter une lipoatrophie.
Contre-indications
- Enfants atteints d'un syndrome de Down, d'un syndrome de Bloom ou d'une anémie de Fanconi.
- Présence d'une tumeur active et/ou de lésions intracrâniennes actives, thérapie anticancéreuse en cours.
- Patients gravement malades montrant des complications après une opération à cœur ouvert ou abdominale, un polytraumatisme ou une insuffisance respiratoire aiguë.
- Hypersensibilité connue à l'un des constituants d'Omnitrope (voir «Composition»).
Omnitrope restera sans effet chez les enfants et les adolescents dont les épiphyses sont soudées.
Mises en garde et précautions
Les expériences chez les patients de plus de 60 ans sont limitées. Les patients d'un certain âge peuvent éventuellement réagir de manière plus sensible à l'effet de somatropine; chez eux, les effets indésirables peuvent donc survenir plus facilement.
L'expérience est limitée concernant le traitement à long terme de l'adulte.
Dans les phases de forte croissance, la progression d'une scoliose peut se produire chez tous les enfants. Il convient donc de surveiller les signes de scoliose pendant le traitement. Il n'existe toutefois aucun indice suggérant qu'un traitement par des hormones de croissance augmente la sévérité ou l'incidence de la scoliose. Chez les patients atteints du syndrome de Prader-Willi (SPW), les scolioses sont fréquentes.
Syndrome de Prader-Willi
Des rapports font état de décès en relation avec un traitement par l'hormone de croissance chez des patients pédiatriques atteints d'un SPW et qui présentaient un ou plusieurs des facteurs de risque suivants: adipose sévère (lorsque le rapport entre le poids et la taille est de 200% supérieur à la valeur médiane des enfants de même taille), troubles respiratoires ou antécédents d'apnée du sommeil, ou infection des voies respiratoires non diagnostiquée. Les patients chez lesquels un ou plusieurs de ces facteurs s'appliquent pourraient encourir un risque plus élevé. Les patients atteints d'un SPW doivent être examinés avant l'instauration d'un traitement par l'hormone somatropine à la recherche de signes indiquant une obstruction des voies respiratoires supérieures, une apnée du sommeil ou une infection des voies respiratoires. Si des résultats pathologiques laissent supposer une obstruction des voies respiratoires supérieures, l'enfant doit être adressé, avant l'instauration du traitement par les hormones de croissance, à un médecin spécialiste en ORL pour se soumettre à des examens complémentaires et recevoir un traitement pour les troubles respiratoires.
Si des signes d'obstruction des voies respiratoires supérieures se développent pendant le traitement par somatropine (y compris apparition ou intensification de ronflements), le traitement sera interrompu et il faudra à nouveau effectuer un examen médical de la sphère ORL.
Avant l'instauration d'un traitement par les hormones de croissance, les patients seront examinés et une apnée du sommeil sera recherchée par des méthodes reconnues comme la polysomnographie ou l'oxymétrie nocturne; les patients seront éventuellement surveillés par la suite. Si une apnée du sommeil est suspectée, le patient doit être surveillé et si nécessaire traité en conséquence.
Tous les patients atteints d'un SPW doivent être surveillés à la recherche de tout signe d'infection des voies respiratoires, qui doit être diagnostiquée le plus tôt possible et traitée de manière radicale.
Le poids corporel de tous les patients atteints d'un SPW doit être contrôlé de manière fiable avant et pendant un traitement par des hormones de croissance.
Le traitement des patients atteints du SPW devra toujours être accompagné d'un régime hypocalorique.
Utilisation chez les patients atteints de tumeurs
Lors du traitement d'une déficience en hormone de croissance secondaire à un traitement anticancéreux, le patient sera surveillé pour dépister toute récidive tumorale.
Chez les patients qui ont surmonté un cancer pendant l'enfance (que l'on appelle «childhood cancer survivors»), un risque accru de néoplasie secondaire a été signalé en cas de traitement par somatropine. Dans la plupart des cas, il s'agissait de tumeurs intracrâniennes, surtout de méningiomes. Ces tumeurs ont été essentiellement observées chez des patients ayant reçu une radiothérapie de la tête pour traiter leur première tumeur.
Chez l'adulte, on ne sait pas encore s'il est possible d'établir un rapport entre un traitement par somatropine et des récidives tumorales du SNC.
Hypertension intracrânienne bénigne
Une ophtalmoscopie devrait être faite lors de céphalées graves ou répétitives, de problèmes de vue, de nausées et/ou de vomissements afin d'exclure un oedème papillaire. En cas d'œdème papillaire, la possibilité d'une hypertension intracrânienne bénigne doit être envisagée. Si nécessaire, le traitement à l'hormone de croissance devra être interrompu. Une recommandation officielle sur le moment de la reprise du traitement après la disparition des symptômes ne peut pas être faite. Si le traitement à l'hormone de croissance est poursuivi, une surveillance étroite sera de mise.
Tolérance au glucose
La somatotropine réduit la sensibilité à l'insuline, c'est pourquoi il convient de surveiller les patients présentant des signes d'intolérance au glucose. Dans des rares cas, le traitement par la somatropine peut provoquer des troubles de la tolérance répondant aux critères d'un diabète sucré de type 2. Le risque de développer un diabète au cours du traitement par la somatropine est plus élevé chez les patients présentant déjà une tolérance diminuée au glucose et/ou d'autres facteurs de risque de développer un diabète de type 2, par ex. en cas d'adipose, d'anamnèse familiale positive ou de traitement aux stéroïdes. C'est pourquoi Omnitrope ne devrait être administré chez les patients diabétiques que sous stricte surveillance médicale et biologique. La posologie antidiabétique doit être adaptée lorsqu'elle est administrée avec la somatropine.
Fonction thyroïdienne
La fonction thyroïdienne devra être contrôlée après l'instauration du traitement à la somatropine, de même qu'après un ajustement de la dose.
Une conversion plus prononcée de la T4 en T3 a été observée durant un traitement à la somatropine, ce qui peut d'induire une baisse de la concentration sérique de la T4 ou une augmentation de la concentration sérique de la T3, en réponse à une déiodation plus importante de la thyroxine en circulation. En général, les taux d'hormone en circulation sont toutefois restés dans la limite de la norme pour des sujets sains. Chez les patients montrant une hypothyroïdie centrale subclinique et qui pourraient donc (en théorie) développer une hypothyroïdie, l'effet de la somatropine sur le taux des hormones thyroïdiennes peut cependant avoir une importance clinique. A l'inverse, une hypothyroïdie non traitée peut diminuer l'effet de somatropine. L'adjonction d'hormones thyroïdiennes pourra s'avérer nécessaire lors d'un traitement par Omnitrope.
Chez les patients recevant une thérapie substitutive par des hormones supplémentaires, une hyperthyroïdie modérée peut, à l'inverse, survenir.
Interaction avec les estrogènes
Les estrogènes oraux peuvent réduire la concentration sérique d'IGF-1 et ainsi diminuer l'efficacité de la somatropine. Chez les patientes traitées par la somatropine et débutant un traitement par des estrogènes, il peut donc être nécessaire d'augmenter la dose de somatropine afin de maintenir le taux sérique d'IGF-1 dans la norme en fonction de l'âge. À l'inverse, il peut être nécessaire de réduire la dose de somatropine en cas d'arrêt du traitement par des estrogènes (voir «Interactions»).
Pour la contraception, les méthodes non hormonales sont à privilégier.
Modifications du squelette
Parmi les patients atteints de maladies endocrines, y compris ceux montrant un déficit en hormone de croissance, le risque de développer une épiphysiolyse de la tête fémorale est accru. Parallèlement, chez les patients atteints de nanisme, une maladie de Legg-Calvé-Perthes se manifeste plus souvent. Il n'est pas possible de conclure avec certitude qu'un traitement par somatropine augmente le risque de survenue de ces maladies. Médecins et parents doivent donc être conscients de l'émergence probable d'une démarche boitillante progressive, de douleurs du bassin et des genoux et/ou d'une diminution de la souplesse articulaire.
Les contrôles doivent être réguliers en particulier chez les patientes présentant un syndrome de Turner, et surtout en cas d'apparition de douleurs osseuses, afin de dépister une épiphysiolyse ou une ostéochondrose vertébrale de croissance.
Traitement par somatropine chez les patients pédiatriques souffrant d'insuffisance rénale
Avant de décider de débuter un traitement par hormone de croissance, on aura recours à un test biochimique de la fonction rénale. Le taux de filtration glomérulaire devrait être inférieur à 50% de la valeur normale. On surveillera la croissance sur une année afin d'identifier et de confirmer les troubles de croissance. Durant la substitution d'hormone de croissance, l'insuffisance rénale chronique continuera d'être traitée comme d'habitude.
Formation d'anticorps
On a observé une formation d'anticorps dirigés contre la somatropine. La capacité de liaison de ces anticorps était faible et leur présence n'a pas été mise en rapport avec des modifications cliniques. On déterminera cependant les anticorps anti-hGH chez les patients ne répondant pas au traitement.
Précautions supplémentaires
L'action de somatropine sur la convalescence de malades gravement atteints a été étudiée dans deux études contrôlées par placebo chez 522 adultes présentant des complications à la suite d'une opération à cœur ouvert ou abdominale, d'un polytraumatisme ou d'une insuffisance respiratoire aiguë. La mortalité était supérieure parmi les patients qui recevaient 5,3 ou 8 mg par jour de somatropine par rapport à ceux du groupe placebo (41,9% vs 19,3%). C'est la raison pour laquelle de tels patients ne devraient pas être traités par somatropine. Du fait de l'absence de données concernant la sécurité de la substitution d'hormone de croissance chez des patients gravement malades, il importe d'évaluer les avantages d'une poursuite du traitement et ses inconvénients potentiels, tout comme pour chaque patient présentant une telle maladie ou se trouvant dans un état aussi critique.
En cas d'insuffisance antéhypophysaire totale ou partielle, il peut être nécessaire d'instituer une thérapie substitutive par des hormones supplémentaires (des glucocorticoïdes, p.ex.). Étant donné que les glucocorticoïdes peuvent réduire l'efficacité thérapeutique de la somatropine, il faudra dans ce cas surveiller étroitement la croissance et ajuster avec une extrême précision les doses d'un tel traitement associé de manière à éviter tout effet inhibiteur sur la croissance.
Le début d'un traitement par la somatropine peut entraîner une inhibition de la 11β-hydroxystéroïde-déshydrogénase 1 (11β-HSD-1) et une réduction du taux sérique de cortisol. Chez les patients traités par somatropine, un hypoadrénalisme central (secondaire) latent peut ainsi se manifester et nécessiter une glucocorticoïdothérapie substitutive. En outre, chez les patients recevant déjà une glucocorticoïdothérapie substitutive en raison d'un hypoadrénalisme diagnostiqué auparavant, une augmentation de la dose d'entretien ou de charge peut être nécessaire après le début du traitement par somatropine (voir «Interactions»).
Il convient de surveiller les patients recevant un traitement par somatropine pour repérer une augmentation de volume ou des modifications pouvant indiquer une malignité des nævi préexistants.
Chez les enfants présentant certaines causes génétiques rares de retard de croissance, un risque accru de développement d'affections malignes a été signalé. Il faut ce risque au bénéfice potentiel pour le patient si l'on décide d'entamer un traitement par hormone de croissance. Il sera également nécessaire de surveiller étroitement le développement néoplasique éventuel chez ces patients lorsqu'ils reçoivent un traitement par somatropine.
Des rapports font état de la survenue d'une pancréatite sous traitement par somatropine, surtout chez les enfants. Des données publiées indiquent que ce sont surtout les filles atteintes du syndrome de Turner qui pourraient présenter un risque accru de pancréatite sous traitement par somatropine. Si un fort inconfort abdominal haut aigu survient chez un patient, le diagnostic différentiel devra inclure une pancréatite.
Des réductions des taux sériques de cortisol, probablement dues à une action exercée par la somatropine sur les protéines plasmatiques, ont été signalées. Cependant, un déplacement vers du cortisol sérique libre n'a pas été observé.
Alcool benzylique
Omnitrope 5 contient 13,5 mg d'alcool benzylique par cartouche équivalent à 9 mg/ml. L'alcool benzylique peut provoquer des réactions allergiques. Les volumes élevés doivent être utilisés avec prudence et en cas de nécessité uniquement, en particulier chez les personnes atteintes d'insuffisance hépatique ou rénale en raison du risque d'accumulation et de toxicité (acidose métabolique). L'alcool benzylique est associé à un risque d'effets secondaires graves y compris des problèmes respiratoires (appelés «syndrome de suffocation») chez les jeunes enfants.
Risque accru en raison de l'accumulation chez les jeunes enfants.
Teneur en sodium
Omnitrope contient moins de 1 mmol (23 mg) de sodium par cartouche. Ceci doit être pris en considération par les patients devant suivre un régime pauvre en sel.
Interactions
Interactions pharmacocinétiques
La somatropine peut augmenter la clairance de substances métabolisées par le cytochrome P450 3A4 (comme les hormones sexuelles, les corticoïdes, les anticonvulsivants ou la ciclosporine). Une conséquence clinique n'a pas encore été établie.
L'hormone de croissance réduit la transformation de cortisone en cortisol (voir «Mises en garde et précautions»).
Interactions pharmacodynamiques
Un traitement concomitant par des glucocorticoïdes inhibe l'effet positif de la somatropine sur la croissance. Chez les patients présentant un déficit en adrénocorticotrophine (ACTH), la posologie de la glucocorticoïdothérapie substitutive doit donc être soigneusement adaptée (voir «Mises en garde et précautions»).
Les estrogènes oraux peuvent réduire la concentration sérique d'IGF-1 et ainsi diminuer l'efficacité de la somatropine (voir «Posologie/Mode d'emploi» et «Mises en garde et précautions»). On ne connaît pas le mécanisme de cette interaction.
L'administration concomitante d'androgènes, de substances anabolisantes ou de gonadotrophines peut avoir un effet additif sur la croissance osseuse.
Grossesse/Allaitement
Grossesse
L'expérience clinique chez la femme enceinte est limitée. Aucun effet néfaste sur les fœtus n'a pu être démontré dans des études de reproduction chez les animaux. Les effets d'une augmentation de la concentration de l'hormone de croissance sur les différents stades de l'embryogenèse ainsi que sur la croissance fœtale chez l'humain sont inconnus. De ce fait, les médicaments contenant de la somatropine ne sont pas recommandés durant la grossesse et chez les femmes en âge de procréer qui n'utilisent pas de contraception adaptée.
Au cours d'une grossesse normale, le taux de l'hormone de croissance baisse de façon significative après la 20e semaine et se normalise ensuite jusqu'à la 30e semaine de grossesse. Il est donc improbable qu'une thérapie substitutive à la somatropine soit nécessaire au cours du troisième trimestre de grossesse.
Allaitement
Aucune donnée n'existe sur le passage de l'hGH dans le lait maternel. Même si l'absorption d'une protéine intacte dans le tractus digestif reste peu probable, il ne faut pas allaiter au cours de l'utilisation de somatropine.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée.
Effets indésirables
Un volume extracellulaire réduit représente une caractéristique des patients atteints d'un déficit en hormone de croissance. Il sera rapidement corrigé après l'instauration d'un traitement à la somatropine. Par la suite, une rétention des fluides peut apparaître.
Après la commercialisation, des rares cas de mort subite ont été décrits chez des patients atteints d'un syndrome de Prader-Willi et traités par somatropine. Toutefois, aucun lien de causalité n'a été démontré.
Les effets indésirables observés dans des études cliniques et/ou lors de la pharmacovigilance dans le cadre de l'utilisation de somatropine sont répertoriés ci-dessous par classes de systèmes d'organes (MedDRA) et par fréquence, en tenant compte des définitions suivantes: «très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10), «occasionnels» (≥1/1'000 à <1/100), «rares» (≥1/10'000 à <1/1'000), «très rares» (<1/10'000), «inconnus» (basée sur les notifications spontanées de la surveillance du marché, la fréquence exacte ne peut être évaluée).
Adultes
Dans les études cliniques, les effets indésirables les plus fréquents (avec une incidence comprise entre 1 et 10%) étaient une rétention des fluides accompagnée d'œdèmes périphériques, ainsi qu'une rigidité des extrémités, des arthralgies, des myalgies et des paresthésies. Ces effets indésirables apparaissent généralement au début du traitement et disparaissent soit spontanément, soit lors d'une diminution de la posologie.
La fréquence de ces effets indésirables dépend de la dose administrée et de l'âge des patients. Elle est aussi vraisemblablement inversement proportionnelle à l'âge qu'avaient les patients au moment de la manifestation du déficit en hormone de croissance.
Affections du système immunitaire
Fréquents: formation d'anticorps dirigés contre la somatropine (cf. «Mises en garde et précautions»).
Affections endocriniennes
Rares: cortisol sérique diminué, (cf. «Mises en garde et précautions»), élévation de la glycémie (cf. «Mises et garde et précautions»), diabète de type 2, hypothyroïdie.
Affections du système nerveux
Fréquents: paresthésies.
Occasionnels: syndrome du canal carpien.
Rares: hypertension intracrânienne bénigne (pseudotumeur cérébrale).
Affections respiratoires, thoraciques et médiastinales
Inconnus: apnée du sommeil chez les patients ayant un syndrome de Prader-Willi.
Affections de la peau et du tissu sous-cutané
Inconnus: progression spontanément résolutive des nævi pigmentés, rash cutané, prurit, urticaire.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: raideur musculosquelettique, arthralgies, myalgies.
Affections des organes de reproduction et du sein
Rares: gynécomastie.
Dans certains cas, celle-ci était réversible spontanément malgré la poursuite du traitement.
Troubles généraux et anomalies au site d'injection
Fréquents: œdèmes périphériques.
Inconnus: œdème de la face.
Patients pédiatriques
Les effets indésirables les plus fréquents chez les enfants sont des réactions cutanées locales et passagères à l'endroit de l'injection. En revanche, une rétention des fluides ainsi que des symptômes tels que des paresthésies, des arthralgies, des myalgies et une raideur musculosquelettique apparaissent plus rarement dans ce groupe d'âge que chez les adultes. En outre, chez les enfants, la fréquence des effets indésirables dépend de l'indication. Globalement, le profil de sécurité de somatropine chez les enfants et les adolescents correspond cependant à celui des adultes.
Tumeurs bénignes, malignes et non précisées (incl. kystes et polypes)
Très rares: leucémie chez les enfants atteints de nanisme hypophysaire. L'incidence de ces cas apparaît cependant comparable à celle observée chez des enfants sans déficit en hormone de croissance.
Affections du système nerveux
Occasionnels: paresthésies.
Rares: hypertension intracrânienne bénigne (Pseudotumor cerebri).
Chez les enfants atteints d'insuffisance rénale et sous traitement par la somatropine, une hypertension intracrânienne bénigne apparaît avec une incidence de 0,9%, soit environ 10 fois plus souvent que lorsque la somatropine est utilisée dans d'autres indications.
Affections gastro-intestinales
Inconnus: pancréatite aiguë (cf. «Mises et garde et précautions»).
Affections de la peau et du tissu sous-cutané
Occasionnels: rash cutané, prurit, urticaire.
Affections musculosquelettiques et du tissu conjonctif
Occasionnels: raideur musculosquelettique, arthralgies, myalgies.
Inconnus: épiphysiolyse de la tête fémorale, maladie de Legg-Calvé-Perthes (cf. «Mises et garde et précautions»).
Affections des organes de reproduction et du sein
Rares: thélarche précoce.
Dans certains cas, le développement de la poitrine a stoppé sa progression, malgré la poursuite du traitement.
Troubles généraux et anomalies au site d'injection
Fréquents: réactions cutanées locales et passagères à l'endroit de l'injection.
Occasionnels: œdèmes périphériques.
Inconnus: œdème de la face.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Un surdosage aigu pourrait entraîner initialement une hypoglycémie suivie d'une hyperglycémie. Un surdosage prolongé peut provoquer une acromégalie.
Propriétés/Effets
Code ATC
H01AC01
Mécanisme d'action/Pharmacodynamique
Omnitrope contient de la somatropine (r-hGH), une hormone polypeptidique formée de 191 acides aminés, de composition chimique et de structure strictement identiques à celles de l'hormone de croissance humaine d'origine hypophysaire. La somatropine est obtenue par recombinaison génétique et synthétisée sous une forme extra pure dans E. coli.
La somatropine stimule la croissance chez les enfants dont la production endogène d'hormone de croissance est insuffisante. Son action repose sur la stimulation des facteurs de croissance analogues à l'insuline (IGF, somatomédine).
En plus de son effet sur la croissance, la somatropine stimule la division cellulaire, l'assimilation des acides aminés, la synthèse des protéines et la lipolyse. Elle diminue également la mobilisation glucidique (effet anti-insulinique).
La somatropine augmente les concentrations sériques d'IGF-I et d'IGFBP3 (Insulin-like Growth Factor Binding Protein 3).
Un apport externe de somatropine n'aura aucun effet thérapeutique si le retard de la croissance est dû à une incapacité de produire l'IGF (somatomédine) ou à une absence de ses récepteurs.
Efficacité clinique
L'efficacité et l'innocuité de somatropine dans le traitement des enfants avec retard de croissance intra-utérin (SGA) ont été étudiées dans 4 essais randomisés ouverts. Les schémas thérapeutiques étaient variables d'un essai à l'autre et incluaient dans certains groupes des intervalles sans traitement. Pendant les 24 premiers mois de traitement, les enfants âgés de 2 à 9 ans ont reçu des doses de 0,033 mg/kg/jour, 0,067 mg/kg/jour ou 0,1 mg/kg/jour. Pendant les 48 mois suivants, les doses étaient soit de 0,033 mg/kg/jour, soit de 0,067 mg/kg/jour.
Modification de l'écart type de la taille corporelle dans chaque groupe de traitement du stade initial jusqu'à 72 mois. Moyenne ± erreur type de la moyenne.
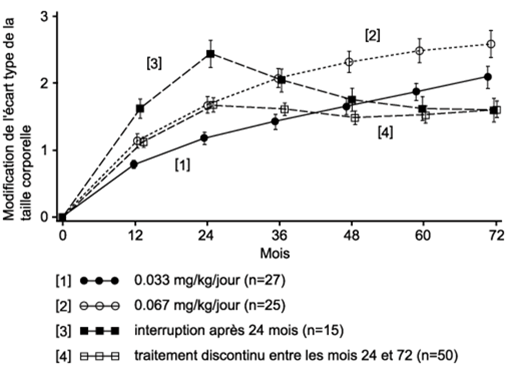
La figure montre que le traitement continu pendant 72 mois est efficace et dose-dépendant. L'écart type de la taille corporelle accuse une nouvelle diminution entre les mois 24 et 72 chez les patients traités seulement pendant les 24 premiers mois. L'écart type de la taille corporelle est resté plus ou moins inchangé chez les patients traités de manière discontinue après les 24 premiers mois. Une interruption du traitement a conduit à une perte de l'avantage de croissance.
Somatropine influence de la manière suivante les effets dus à un déficit en hormone de croissance chez l'adulte
Aucun des paramètres mentionnés n'a été prouvé sans équivoque dans des études en double aveugle, validées statistiquement. Ces paramètres représentent une description des données recueillies auprès d'un total de 110 patients inclus dans 2 études contrôlées et poolées ainsi que dans 3 études non contrôlées.
- Adiposité centrale: est légèrement diminuée.
- Masse non graisseuse: est légèrement augmentée.
- Masse de graisse totale: reste inchangée.
- Densité minérale osseuse (DMO): une légère réduction initiale est suivie en règle générale, au bout de 1–2 ans, d'une augmentation. Il n'existe pas de données concernant les fractures.
- Lipides plasmatiques: baisse du cholestérol total et du cholestérol LDL, élévation du HDL. La signification clinique de ces modifications n'est pas élucidée.
- Force musculaire et performance cardiovasculaire: aucune influence.
- Qualité de vie subjective: influence variable insignifiante.
- À propos de la mortalité (totale et cardiovasculaire), on ne dispose d'aucune donnée.
Pharmacocinétique
Absorption
Après injection sous-cutanée, environ 80% de la somatropine sont absorbés. Après administration d'une dose de somatropine en injection sous-cutanée de 0,035 mg/kg de poids corporel, on atteint des concentrations plasmatiques maximales de 13−35 ng/ml au bout de 3−6 h.
Distribution
Le volume de distribution moyen de la somatropine après administration chez des patients adultes présentant un déficit en GH est d'env. 1,3 (± 0,8) l/kg.
Métabolisme
Le métabolisme de la somatropine correspond au métabolisme général des protéines.
Élimination
La demi-vie moyenne après l'administration de somatropine par voie intraveineuse est de 0,4 h chez les adultes montrant un déficit en hormone de croissance et de 2–3 h après une administration par voie sous-cutanée. Une absorption plus lente depuis le site d'injection sous-cutané explique cette différence entre les demi-vies.
Cinétique pour certains groupes de patients
La biodisponibilité absolue de somatropine après injection sous-cutanée semble comparable entre les femmes et les hommes.
Aucune donnée pharmacocinétique n'existe sur somatropine administré à des populations gériatriques et pédiatriques de différentes ethnies ou montrant une insuffisance rénale, hépatique ou cardiaque.
Données précliniques
Les études précliniques in-vitro et in-vivo sur la toxicité génétique n'ont apporté aucune indication de mutation génétique ni d'aberration chromosomique.
Des études de toxicité générale, de tolérance locale et de toxicité reproductive n'ont pas mis en évidence d'effets cliniquement significatifs.
Une augmentation de la fragilité des chromosomes après addition d'un agent radiomimétique, la bléomycine, a été observée dans une étude in-vitro sur des lymphocytes prélevés chez des patients après un traitement de longue durée par la somatropine. Une conséquence clinique n'a pas encore été établie.
Une autre étude sur des lymphocytes de patients traités au long cours par la somatropine n'a pas révélé de multiplication des anomalies chromosomiques.
Remarques particulières
Incompatibilités
Aucune étude de tolérance n'ayant été effectuée, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
A administrer dans les 28 jours suivant la première utilisation.
Remarques particulières concernant le stockage
Conserver dans l'emballage original, au réfrigérateur (2–8°C), à l'abri de la lumière et hors de la portée des enfants. Ne pas congeler.
Remarques concernant la manipulation
Omnitrope 5, 10 et 15 doivent être utilisés avec les systèmes d'injection SurePalTM 5, SurePalTM 10 et SurePalTM 15 correspondant.
Les cartouches en verre pour Omnitrope 5, 10 et 15 à utiliser avec les systèmes d'injection SurePalTM 5, 10 et 15 sont installées de manière fixe dans un récipient transparent avec un mécanisme en plastique. Cette unité de cartouche est reliée de manière fixe avec un filetage sur l'une des extrémités, destinée à la fixation de l'aiguille d'injection.
Le SurePalTM 5 (Pen) est utilisé pour administrer Omnitrope 5 au moyen d'une aiguille à stylo BDTM (29 G x 12,7 mm ou 31 G x 8 mm ou 31 G x 5 mm). Le stylo peut s'ajuster à chaque dose, jusqu'à 2,7 mg maximum, par paliers de 0,05 mg.
Le SurePalTM 10 (Pen) est utilisé pour administrer Omnitrope 10 au moyen d'une aiguille à stylo BDTM (29 G x 12,7 mm ou 31 G x 8 mm ou 31 G x 5 mm). Le stylo peut s'ajuster à chaque dose, jusqu'à 5,4 mg maximum, par paliers de 0,1 mg.
Le SurePalTM 15 (Pen) est utilisé pour administrer Omnitrope 15 au moyen d'une aiguille à stylo BDTM (29 G x 12,7 mm ou 31 G x 8 mm ou 31 G x 5 mm). Le Pen peut s'ajuster à chaque dose, jusqu'à 5,4 mg maximum, par paliers de 0,1 mg (se reporter aux notices détaillées respectives des dispositifs SurePalTM 5, SurePalTM 10 et SurePalTM 15).
Numéro d’autorisation
61306 (Swissmedic)
Titulaire de l’autorisation
Sandoz Pharmaceuticals SA, Risch; domicile: Rotkreuz
Mise à jour de l’information
Septembre 2020
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French Italian
Italian







