Botox Dry Sub 100 E 2 Amp buy online
Botox Trockensub 100 E 2 Amp
-
817.58 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: ALLERGAN AG
- Product Code: 5842040
- ATC-code M03AX01
- EAN 7680524330017
Ingredients:
Natriumchlorid, Albumin human, Trockensubstanz, Botulinumtoxin Typ A 100.

Variants
Botox Trockensubstanz 100 E Ampullen
447.91 CHF
Description
Zusammensetzung
Wirkstoffe
Toxinum botulinicum A*.
* aus Clostridium botulinum
Hilfsstoffe
Albuminum humanum, 0,9 mg Natrii chloridum. Eine Durchstechflasche enthält 0.35 mg Natrium.
Darreichungsform und Wirkstoffmenge pro Einheit
Pulver zur Herstellung einer Injektionslösung.
100 Allergan-Einheiten pro Durchstechflasche.
Zur intramuskulären und intradermalen Anwendung.
Botulinumtoxin-Einheiten sind nicht von einem Präparat auf andere übertragbar.
Eine Einheit entspricht der LD50 nach intraperitonealer Injektion bei Mäusen unter definierten Bedingungen.
BOTOX® erscheint als dünne weisse Ablagerung am Boden der Durchstechflasche, welche möglicherweise schwierig zu erkennen ist.
Indikationen/Anwendungsmöglichkeiten
BOTOX® ist indiziert für:
Neurologische Erkrankungen:
•symptomatische Behandlung des Blepharospasmus, des Spasmus hemifacialis und assoziierter fokaler Dystonien, ebenso zur Korrektur des Strabismus bei Patienten über 12 Jahren.
•symptomatische Behandlung der zervikalen Dystonie (Torticollis spasticus) bei Erwachsenen.
•Behandlung von fokalen Spastizitäten, einschliesslich Spastizitäten in den oberen Extremitäten, die mit Schlaganfall einhergehen.
•Symptomatische Behandlung der dynamischen Spitzfussstellung (Equinus-Deformität) ohne Retraktion und ohne bedeutende Atrophie aufgrund spastischer Störungen bei Patienten mit infantiler Zerebralparese, die 2 Jahre und älter sind.
Blasenfunktionsstörungen:
•Behandlung der überaktiven Blase mit den Symptomen Harninkontinenz, Harndrang und häufige Miktion bei erwachsenen Patienten, die nicht ausreichend auf Anticholinergika ansprechen oder eine Unverträglichkeit gegenüber diesen Arzneimitteln aufweisen.
•Behandlung der Harninkontinenz infolge neurogener Detrusorhyperaktivität in Zusammenhang mit einer neurologischen Erkrankung (wie z.B. Rückenmarksverletzung, Multiple Sklerose) bei Erwachsenen.
Erkrankungen der Haut und mit der Haut verbundene Erkrankungen:
•Behandlung der primären Hyperhidrosis axillae bei Erwachsenen.
Dosierung/Anwendung
Botulinumtoxin-Einheiten sind nicht von einem Präparat auf andere übertragbar. Die in Allergan-Einheiten empfohlenen Dosierungen unterscheiden sich von denen anderer Botulinumtoxin-Präparate.
Hinsichtlich «Hinweise zur Handhabung» und «Entsorgung» der Durchstechflaschen siehe «Sonstige Hinweise».
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Spezielle Dosierungsanweisungen
Ältere Patienten
Es ist keine spezielle Dosisanpassung bei der Anwendung für ältere Patienten erforderlich. Initial sollte mit der niedrigsten empfohlenen Wirkdosis für die jeweilige Indikation begonnen werden. Für Wiederholungsinjektionen wird die niedrigste Wirkdosis und Einhaltung des grösstmöglichen klinisch vertretbaren Zeitraums zwischen den Injektionen empfohlen. Ältere Patienten mit umfangreicher medizinischer Vorgeschichte und Begleitmedikation sollten mit Vorsicht behandelt werden (für weitere Informationen siehe unter «Unerwünschte Wirkungen» und «Eigenschaften/Wirkungen»).
Kinder und Jugendliche
Über die Sicherheit und Wirksamkeit von BOTOX® bei der Behandlung von Blepharospasmus, Spasmus hemifacialis und Strabismus liegen keine Untersuchungen mit Kindern unter 12 Jahren vor.
Die Sicherheit und Wirksamkeit von BOTOX® bei der Behandlung von zervikaler Dystonie, von fokalen Spastizitäten der oberen Extremitäten in Zusammenhang mit Schlaganfall, primärer Hyperhidrosis axillae und der überaktiven Blase oder von Harninkontinenz infolge neurogener Detrusorhyperaktivität bei Kindern und Jugendlichen (unter 18 Jahren) wurden nicht nachgewiesen. Keine Daten sind verfügbar.
Art der Anwendung
BOTOX® darf nur von Ärzten mit geeigneter Qualifikation und Fachkenntnis in der Behandlung und der Anwendung der erforderlichen Ausstattung angewendet werden. Je nach Indikationsgebiet sollte die Diagnosestellung und Anwendung von BOTOX® möglichst in Zusammenarbeit mit einem Neurologen, Ophthalmologen, Pädiater, Kinderorthopäden, Dermatologen oder Urologen erfolgen.
Es liegen keine ausreichenden klinischen Daten vor, die die Festlegung einer allgemeingültigen optimalen Dosis und der Anzahl an Injektionsstellen im jeweiligen Muskel ermöglichen würden. Deshalb ist die Behandlung eines Patienten vom behandelnden Facharzt individuell zu gestalten. Dabei ist zu beachten, dass die Festlegung einer optimalen Dosis durch eine Dosistitration angestrebt werden sollte.
NEUROLOGISCHE ERKRANKUNGEN:
Blepharospasmus/Spasmus hemifacialis
Nur bei Patienten über 12 Jahren.
Empfohlene Nadel: Sterile 27-30 Gauge/0,40-0,30 mm Nadel
Applikationshinweise: Eine elektromyographische Kontrolle (EMG) ist nicht erforderlich.
Empfohlene Dosis: Die empfohlene initiale Dosis beträgt 1,25 - 2,5 Einheiten. Die Injektion erfolgt in den medialen und lateralen prätarsalen M. orbicularis oculi des Oberlids und den lateralen prätarsalen M. orbicularis oculi des Unterlids. Zusätzliche Injektionsstellen in der Augenbraue, dem lateralen M. orbicularis oculi und im oberen Gesichtsbereich sind möglich, wenn Spasmen hier das Sehen beeinträchtigen.
Maximale Gesamtdosis: Die Initialdosis pro Auge sollte 25 Einheiten nicht übersteigen. Für die Behandlung des Blepharospasmus sollte die Gesamtdosis von 100 Einheiten alle 12 Wochen nicht überschritten werden.
Zusätzliche Informationen: Injektionen in die Nähe des M. levator palpebrae sup. sollten vermieden werden, um so das Auftreten einer Ptosis gering zu halten. Aufgrund der Diffusion der Botulinumtoxin Typ A Lösung in den M. obliquus inf. kann sich eine Diplopie manifestieren. Diese unerwünschte Wirkung kann geringgehalten werden, wenn auf die mediale Injektion am unteren Augenlid verzichtet wird. In den nachfolgenden Abbildungen sind die möglichen Injektionsstellen dargestellt:

In der Regel tritt die Wirkung in den ersten drei Tagen ein und erreicht ein Maximum 1-2 Wochen nach der Behandlung. Jede Behandlung hält etwa 3 Monate an, dann können die Injektionen unbegrenzt wiederholt werden. Anlässlich weiterer Behandlungen kann die Dosis maximal verdoppelt werden, wenn die Dosierung der Initialbehandlung sich als nicht ausreichend erwiesen hat.
Der Nutzen scheint gering zu sein, wenn mehr als 5,0 Einheiten pro Injektionsstelle injiziert werden. Auch kommt es zu keinem zusätzlichen Nutzen, wenn in kürzeren Abständen behandelt wird als alle drei Monate.
Patienten mit hemifazialem Spasmus oder Störungen des VII. Hirnnervs (N. facialis) sind wie auf unilateralen Blepharospasmus zu behandeln, wobei in die übrigen betroffenen Fazialmuskeln BOTOX® entsprechend dem Grad des Spasmus injiziert wird.
Strabismus
Nur bei Patienten über 12 Jahren.
Empfohlene Nadel: Sterile 27 Gauge/0,40 mm Nadel
Applikationshinweise: Eine BOTOX®-Lösung mit 2,5 Allergan-Einheiten pro 0,1 ml wird zubereitet (siehe «Hinweise für die Handhabung» und «Entsorgung» unter «Sonstige Hinweise»).
BOTOX® ist zur Injektion in die extraokularen Muskeln mittels elektromyographischer Führung bestimmt.
Um das Auge auf die BOTOX® Injektion vorzubereiten, sollten einige Tropfen eines Lokalanästhetikums und einer okularen abschwellenden Lösung einige Minuten vor der Injektion verabreicht werden.
Empfohlene Dosis: Es sollen initial die niedrigsten Dosen zur Behandlung von leichten Abweichungen und höhere Dosen für stärker ausgeprägte Abweichungen angewendet werden.
Folgende Initialdosen in Einheiten werden empfohlen (die niedrigere Dosis ist für kleinere Schielwinkel vorgesehen):
oFür vertikale Muskeln und für horizontales Schielen von weniger als 20 Prismendioptrien: 1,25 Einheiten - 2,5 Einheiten (0,05–0,10 ml) in jeden Muskel.
oFür horizontales Schielen von 20-50 Prismendioptrien: 2,5 Einheiten - 5,0 Einheiten (0,10–0,20 ml) in jeden Muskel.
oFür Lähmung des äusseren Nervus oculomotorius, die einen Monat oder länger anhält: 1,25 Einheiten - 2,5 Einheiten in den M. rectus medialis.
Maximale Gesamtdosis: Die maximale empfohlene Dosis als Einzelinjektion in einen Augenmuskel beträgt 25 Einheiten.
Das empfohlene Injektionsvolumen von BOTOX®, das zur Behandlung des Strabismus verabreicht wird, beträgt zwischen 0,05 ml - 0,15 ml pro Muskel.
Zusätzliche Informationen: Die Initialdosen von verdünntem BOTOX® führen üblicherweise ein bis zwei Tage nach der Injektion zu einer Paralyse der injizierten Muskeln. Die Intensität der Paralyse nimmt in der ersten Woche zu. Die Lähmung hält 2-6 Wochen an und nimmt dann schrittweise über eine etwa gleich lange Periode ab. Überkorrekturen, die länger als 6 Monate anhalten, sind selten.
Etwa die Hälfte der behandelten Patienten benötigen zusätzliche Dosen infolge einer unzureichenden Paralyse des Muskels nach der Initialdosis oder wegen mechanischen Faktoren wie ausgeprägte Abweichungen oder Einschränkung oder wegen Fehlen von motorischer binokularer Fusion, um die Anpassung zu stabilisieren.
Folgedosen bei residualem Schielen oder Rezidiven:
Es wird empfohlen, die Patienten 7-14 Tage nach jeder Injektion wieder zu untersuchen und die Wirkung der Dosis zu beurteilen. Folgedosen bei Patienten, die eine ausreichende Paralyse des Zielmuskels aufweisen, sollten gleich hoch wie die Initialdosis sein.
Folgedosen bei Patienten, die eine unvollständige Paralyse des Zielmuskels aufweisen, können bis doppelt so hoch sein wie die zuvor verabreichte Dosis. Folgeinjektionen sollten nicht verabreicht werden, bis die Wirkungen der vorangehenden Dosis abgeklungen sind, was sich in der wieder hergestellten Funktion der injizierten und benachbarten Muskeln nachweisen lässt.
Zervikale Dystonie
Nur bei Erwachsenen.
Empfohlene Nadel: Geeignete sterile Nadel (in der Regel 25-30 Gauge/0,50-0,30 mm)
Applikationshinweise: In klinischen Studien wurde BOTOX® zur Behandlung der zervikalen Dystonie üblicherweise in den M. sternocleidomastoideus, M. levator scapulae, M. scalenus, M. splenius capitis, M. semispinalis, M. longissimus und/oder den M. trapezius injiziert. Diese Liste ist nicht vollständig, da alle Muskeln, die für die Kontrolle der Kopfhaltung verantwortlich sind, beteiligt sein können und deshalb eventuell behandelt werden müssen.
Dosisabhängige Nebenwirkungen werden bei Frauen häufiger beobachtet, deshalb sollte bei der Wahl der Dosis die Muskelmasse und der Grad der Hypertrophie bzw. der Atrophie des zu behandelnden Muskels in Betracht gezogen werden. Das Muster der Muskelaktivierung kann sich bei der zervikalen Dystonie spontan ändern, ohne dass sich das klinische Erscheinungsbild der Dystonie ändert.
Wenn der betreffende Muskel nicht eindeutig identifiziert werden kann, sollte die Injektion unter EMG-Kontrolle erfolgen.
Empfohlene Dosis: Bei der Ersttherapie sind nicht mehr als 200 Einheiten insgesamt zu injizieren. Bei Folgeinjektionen können je nach Initialwirkung Änderungen vorgenommen werden.
In den ursprünglichen kontrollierten klinischen Studien zum Wirksamkeits- und Sicherheitsnachweis bei zervikaler Dystonie wurden Dosen von rekonstituiertem BOTOX® von 140 bis 280 Einheiten eingesetzt. In aktuelleren Untersuchungen wurde eine Dosierung von 95-360 Einheiten (mit einer ungefähren mittleren Dosis von 240 Einheiten) gewählt.
Bislang unbehandelte Patienten sollten als Initialdosis die niedrigste Wirkdosis erhalten. Pro Injektionsstelle sollten nicht mehr als 50 Einheiten appliziert werden. In den M. sternocleidomastoideus sollen nicht mehr als 100 Einheiten verabreicht werden. Um das Auftreten von Dysphagie zu minimieren, ist der M. sternocleidomastoideus nicht bilateral zu injizieren
Maximale Gesamtdosis: Eine Gesamtdosis von 300 Einheiten pro Behandlung darf nicht überschritten werden. Die optimale Anzahl der Injektionsstellen hängt von der Grösse des Muskels ab. Eine Wiederholungsbehandlung ist vor Ablauf von 10 Wochen nicht empfohlen.
Zusätzliche Informationen: Klinische Verbesserungen sind im Allgemeinen innerhalb der ersten beiden Wochen mit einem Maximum nach ca. 6 Wochen nach der Behandlung zu beobachten. Die Wirkungsdauer zeigte im Rahmen der klinischen Studien starke Schwankungsbreiten (von 2 bis 33 Wochen) bei einer mittleren Dauer von 12 Wochen.
Fokale Spastizität der oberen Extremitäten in Zusammenhang mit Schlaganfall
Nur bei Erwachsenen.
Empfohlene Nadel: Sterile 25, 27 oder 30 Gauge Nadel für oberflächliche Muskeln und 22 Gauge Nadel für tiefer liegende Muskeln
Applikationshinweise: Für die Lokalisation der involvierten Muskeln kann die EMG-Führung oder die Nervenstimulation hilfreich sein. Durch Anwendung von BOTOX® an mehreren Injektionsstellen wird ein gleichmässigerer Kontakt mit den Innervationsbereichen der Muskeln erzielt, was bei grossen Muskeln besonders nützlich ist.
Empfohlene Dosis: Die genaue Dosierung erfolgt individuell. Dosis und Anzahl der Applikationsorte sind abhängig von Grösse, Anzahl und Lage der involvierten Muskeln, vom Vorliegen einer lokalen Muskelschwäche und dem Ansprechen des Patienten auf frühere Behandlung.
Höhere Dosen können zu einer längerdauernden Muskeltonusreduktion führen. Das Ausmass der Muskelspastizität und der involvierten Muskelgruppen kann sich mit der Zeit ändern und eine Änderung in der Dosierung von BOTOX® und der zu injizierenden Muskeln erwogen werden.
Folgende initiale Dosierungen und Applikationsorte sind empfohlen:
Muskel | Gesamtdosierung; Anzahl der Injektionsstellen |
Biceps brachii | 50-200 Einheiten; bis zu 4 |
Flexor digitorum profundus | 7,5-30 Einheiten; 1-2 |
Flexor digitorum sublimis | 7,5-30 Einheiten; 1-2 |
Flexor carpi radialis | 15-60 Einheiten; 1-2 |
Flexor carpi ulnaris | 10-40 Einheiten; 1-2 |
Maximale Gesamtdosis: In klinischen Studien wurde bei Erwachsenen eine Dosierung von 360 Einheiten nicht überschritten. Die Gesamtdosis wurde jeweils auf die ausgewählten Muskeln aufgeteilt (meist in den Flexormuskel des Ellbogens, des Handgelenks und der Finger). Generell sollte die Dosis 6 Einheiten/kg Körpergewicht nicht überschreiten.
Zusätzliche Informationen: In der Regel tritt eine Besserung des Muskeltonus innerhalb von 2 Wochen mit einem Maximum nach 4 bis 6 Wochen nach der Behandlung ein. Wiederholungsinjektionen sollten erst verabreicht werden, wenn der klinische Effekt der vorangegangenen Injektion abgeklungen ist, jedoch nicht häufiger als alle zwei Monate.
Infantile Zerebralparese - Dynamische Spitzfussstellung
Kinder von 2 Jahren und älter.
Empfohlene Nadel: Sterile 23-26 Gauge/0,60-0,45 mm Nadel
Applikationshinweise: Sie wird als aufgeteilte Dosis in einzelnen Injektionen in den medialen bzw. lateralen Muskelkopf des betroffenen M. gastrocnemius injiziert.
Die Behandlung sollte mit einer geringeren Dosis begonnen werden bei Patienten, die gleichzeitig Injektionen in andere Muskelgruppen benötigen oder falls vermutet wird, dass die genannte Dosierung zu einer übermässigen Schwächung der behandelten Muskeln führen könnte, etwa bei Patienten mit kleinen Muskeln.
Empfohlene Dosis: Hemiplegie: die anfänglich empfohlene Gesamtdosis beträgt 4 Einheiten/kg Körpergewicht zur Injektion in das betroffene Bein.
Diplegie: die anfänglich empfohlene Gesamtdosis beträgt 6 Einheiten/kg Körpergewicht und wird auf beide Beine verteilt.
Maximale Gesamtdosis: 200 Einheiten.
Zusätzliche Informationen: Eine klinische Besserung tritt im Allgemeinen innerhalb der ersten zwei Wochen nach der Injektion auf. Wiederholungsinjektionen sollten erst verabreicht werden, wenn der klinische Effekt der vorangegangenen Injektion abgeklungen ist, jedoch nicht häufiger als alle drei Monate.
Möglicherweise lässt sich das Dosierungsschema so anpassen, dass ein Behandlungsintervall von 6 Monaten erreicht werden kann.
BLASENFUNKTIONSSTÖRUNGEN
Injektion in den Detrusor-Muskel
Nur bei Erwachsenen.
Applikationshinweise: Zum Zeitpunkt der Behandlung sollten Patienten nicht an einer akuten Infektion der Harnwege leiden.
Antibiotika sollten prophylaktisch 1-3 Tage vor der Behandlung, am Tag der Behandlung und 1-3 Tage nach der Behandlung verabreicht werden.
Empfohlen wird, dass Patienten eine Behandlung mit Thrombozytenaggregationshemmern mindestens 3 Tage vor dem Injektionsvorgang absetzen. Mit Antikoagulantien behandelte Patienten müssen angemessen behandelt werden, um das Blutungsrisiko zu senken.
Überaktive Blase
Empfohlene Nadel: Ein flexibles oder starres Zystoskop kann verwendet werden. Die sterile Injektionsnadel sollte vor Beginn der Injektionen mit ungefähr 1 ml des rekonstituierten BOTOX® (abhängig von der Nadellänge) gefüllt (vorbereitet) werden, um daraus alle Luft zu entfernen.
Applikationshinweise: Eine intravesikale Instillation mit einem verdünnten Lokalanästhetikum mit oder ohne Sedierung kann vor der Injektion, je nach üblicher Vorgehensweise vor Ort, angewendet werden. Wird eine lokale anästhetische Instillation durchgeführt, sollte die Blase entleert und mit steriler Kochsalzlösung vor den nächsten Schritten des Injektionsvorgangs gespült werden.
Das rekonstituierte BOTOX® (100 Allergan-Einheiten/10 ml) wird in den Detrusor-Muskel über ein flexibles oder starres Zystoskop unter Vermeidung des Trigonums injiziert. Die Blase sollte mit ausreichend Kochsalzlösung instilliert werden, um für die Injektionen eine ausreichende Visualisierung zu erreichen. Eine übermässige Dehnung sollte jedoch vermieden werden.
Die Nadel sollte ungefähr 2 mm in den Detrusor-Muskel eingeführt und 20 Injektionen von jeweils 0,5 ml (Gesamtvolumen 10 ml) in einem Abstand von ungefähr 1 cm (siehe Abbildung unten) gesetzt werden. Als Abschlussinjektion sollte ungefähr 1 ml sterile physiologische Kochsalzlösung injiziert werden, damit die vollständige Dosis verabreicht wird. Nach Verabreichung der Injektionen sollte die für die Visualisierung der Blasenwand verwendete Kochsalzlösung nicht drainiert werden, damit der Patient vor dem Verlassen der Klinik seine Fähigkeit zum Wasserlassen zeigen kann. Der Patient sollte über mindestens 30 Minuten nach der Injektion beobachtet werden und bis eine spontane Entleerung der Blase erfolgt ist.

Empfohlene Dosis: Die empfohlene Dosis beträgt 100 Allergan-Einheiten BOTOX® in Form von je 0,5 ml (5 Allergan-Einheiten) Injektionen auf 20 Stellen im Detrusor-Muskel verteilt.
Zusätzliche Informationen: Eine klinische Verbesserung kann innerhalb von 2 Wochen eintreten. Eine erneute Injektion sollte für Patienten erwogen werden, bei denen der klinische Effekt der vorangegangenen Injektion nachgelassen hat (die mediane Dauer bei klinischen Phase-III-Studien betrug 166 Tage [~24 Wochen]). Die erneute Injektion sollte jedoch nicht früher als 3 Monate nach der vorangegangenen Blasen-Injektion durchgeführt werden.
Harninkontinenz infolge neurogener Detrusorhyperaktivität
Empfohlene Nadel: Ein flexibles oder starres Zystoskop kann verwendet werden. Die sterile Injektionsnadel sollte vor Beginn der Injektionen mit ungefähr 1 ml (abhängig von der Nadellänge) gefüllt (vorbereitet) werden, um daraus alle Luft zu entfernen.
Applikationshinweise: Eine intravesikale Instillation mit verdünnten Anästhetika mit oder ohne Sedierung oder Allgemeinanästhesie kann vor der Injektion, je nach üblicher Vorgehensweise vor Ort, angewendet werden. Wird eine lokale anästhetische Instillation durchgeführt, sollte die Blase entleert und mit steriler Kochsalzlösung vor den nächsten Schritten des Injektionsvorgangs gespült werden.
Das rekonstituierte BOTOX® (200 Allergan-Einheiten/30 ml) wird in den Detrusor-Muskel über ein flexibles oder starres Zystoskop unter Vermeidung des Trigonums injiziert. Die Blase sollte mit ausreichend Kochsalzlösung instilliert werden, um für die Injektionen eine ausreichende Visualisierung zu erreichen. Eine übermässige Dehnung sollte jedoch vermieden werden.
Die Nadel sollte ungefähr 2 mm in den Detrusor-Muskel eingeführt und 30 Injektionen von jeweils 1 ml (Gesamtvolumen 30 ml) in einem Abstand von ungefähr 1 cm (siehe Abbildung oben) gesetzt werden. Als Abschlussinjektion sollte ungefähr 1 ml sterile physiologische Kochsalzlösung injiziert werden, damit die vollständige Dosis verabreicht wird. Nach Verabreichung der Injektionen sollte die für die Visualisierung der Blasenwand verwendete Kochsalzlösung drainiert werden. Der Patient sollte über mindestens 30 Minuten nach der Injektion beobachtet werden.
Empfohlene Dosis: Die empfohlene Dosis beträgt 200 Allergan-Einheiten BOTOX® in Form von je 1 ml (~6,7 Allergan-Einheiten) Injektionen auf 30 Stellen im Detrusor-Muskel verteilt.
Zusätzliche Informationen: Eine klinische Verbesserung tritt im Allgemeinen innerhalb von 2 Wochen ein. Eine erneute Injektion sollte für die Patienten erwogen werden, bei denen der klinische Effekt der vorangegangenen Injektion nachgelassen hat (die mediane Dauer bei klinischen Phase-III-Studien betrug 256-295 Tage (~36-42 Wochen) für BOTOX® (200 Allergan-Einheiten)). Die erneute Injektion sollte jedoch nicht früher als 3 Monate nach der vorangegangenen Blasen-Injektion durchgeführt werden.
ERKRANKUNGEN DER HAUT UND MIT DER HAUT VERBUNDENE ERKRANKUNGEN
Primäre Hyperhidrosis axillae
Nur bei Erwachsenen
Empfohlene Nadel: Sterile 30 Gauge-Nadel
Applikationshinweise: Der hyperhidrotische Bereich kann anhand von Anfärbungsverfahren wie z.B. mit dem Minor-Test (Jod/Stärke) ermittelt werden.
Empfohlene Dosis: 50 Einheiten BOTOX® (100 Allergan-Einheiten/4,0 ml) werden intradermal injiziert, und zwar gleichmässig verteilt an mehreren Stellen etwa 1-2 cm auseinander innerhalb des hyperhidrotischen Bereichs jeder betroffenen Achselhöhle.
Maximale Gesamtdosis: Da andere Dosierungen als 50 Einheiten pro Achselhöhle nicht untersucht wurden, können sie nicht empfohlen werden. Injektionen sollten nicht häufiger als alle 16 Wochen wiederholt werden.
Zusätzliche Informationen: In der Regel tritt eine Besserung des klinischen Zustandes innerhalb der ersten Woche nach der Injektion ein. Wiederholungsinjektionen sollten erst verabreicht werden, wenn die klinische Wirkung der vorangegangenen Injektion abklingt und der behandelnde Arzt bzw. Ärztin dies für erforderlich hält. Erfahrungsgemäss hält jede Behandlung 4-7 Monate an.
ALLE INDIKATIONEN
Sollte nach durchgeführter Erstapplikation auch nach einem Monat kein therapeutischer Effekt eintreten, sind folgende Massnahmen durchzuführen:
•Klinische Verifizierung der Toxinwirkung auf den injizierten Muskel; dies kann eine elektromyographische Untersuchung in einer hierfür spezialisierten Einrichtung beinhalten.
•Analyse der Gründe für das Therapieversagen, z.B. schlechte Isolierung der Muskeln, die injiziert werden sollen, zu geringe Dosis, schlechte Injektionstechnik, fixe Kontraktur, zu schwacher Gegenmuskel, Antikörperbildung.
•Überprüfung der Behandlung mit Botulinumtoxin Typ A als angemessene Therapieform.
Sofern im Rahmen der Initialbehandlung keine unerwünschten Wirkungen aufgetreten sind, kann eine Wiederholungsbehandlung unter folgenden Voraussetzungen vorgenommen werden:
1.) Dosisanpassung unter Berücksichtigung der Analyse des vorausgegangenen Therapieversagens,
2.) EMG-Ableitung,
3.) Einhaltung eines 3-Monatsintervalls zwischen der Initial- und der Wiederholungsbehandlung.
Beim Ausbleiben des therapeutischen Effektes oder beim Nachlassen der Wirkung bei Wiederholungsinjektionen sind alternative Behandlungsmethoden in Betracht zu ziehen.
Kontraindikationen
•Bekannte Überempfindlichkeit gegenüber dem Wirkstoff Botulinumtoxin Typ A oder einem der Hilfsstoffe gemäss Zusammensetzung.
•Infektion an der(n) vorgesehenen Injektionsstelle(n).
BOTOX® Injektionen in den Detrusor-Muskel sind ebenfalls kontraindiziert bei:
•Patienten, die zum Zeitpunkt der Behandlung an einem Harnwegsinfekt leiden.
•Patienten, die zum Zeitpunkt der Behandlung an einer akuten Harnretention leiden und die nicht routinemässig katheterisiert werden.
•Patienten, die nicht willens und/oder fähig sind, falls notwendig nach der Behandlung einen Katheter zu verwenden.
Warnhinweise und Vorsichtsmassnahmen
Die empfohlenen Dosierungen und Häufigkeiten der Anwendung von BOTOX® sollten nicht überschritten werden, da es zu einer Überdosierung, einer gesteigerten Muskelschwäche, der Ausbreitung des Toxins fern von der Injektionsstelle und der Bildung von neutralisierenden Antikörpern kommen kann. Als Anfangsdosis bei nicht vorbehandelten Patienten sollte die niedrigste empfohlene Dosis für die spezielle Indikation verabreicht werden.
Ärzte und Patienten müssen sich bewusst sein, dass unerwünschte Wirkungen auftreten können, obwohl vorherige Injektionen gut vertragen wurden. Daher ist bei jeder Verabreichung Vorsicht geboten.
Es wurden unerwünschte Wirkungen berichtet, die sich auf die Ausbreitung des Toxins fern von der Injektionsstelle beziehen (siehe «Unerwünschte Wirkungen»). In manchen Fällen führten diese zum Tode, die wiederum in einigen Fällen mit Dysphagie, Pneumonie und/oder Schwächezuständen assoziiert waren. Die Symptome entsprechen dem Wirkungsmechanismus von Botulinumtoxin und wurden Stunden bis Wochen nach der Injektion berichtet. Die Gefahr des Auftretens von Symptomen ist wahrscheinlich bei Patienten mit Erkrankungen und Begleiterkrankungen am grössten, die eine Prädisposition für diese Symptome darstellen. Hierzu zählen auch Kinder und Erwachsene, die aufgrund von Spastiken mit hohen Dosen behandelt werden.
Der behandelnde Arzt sollte mit der elektromyographischen Technik vertraut sein, wenn er bei Strabismus BOTOX® injiziert. Die Wirkung von BOTOX® bei Abweichungen über 50 Prismendioptrien bei restriktivem Strabismus, beim Duane-Syndrom und bei sekundärem Strabismus infolge einer früheren chirurgischen Überkorrektur des Muskelantagonisten ist zweifelhaft. Allenfalls sind mehrere Behandlungszyklen erforderlich.
Bei Patienten, die mit therapeutischen Dosen behandelt werden, kann auch gesteigerte Muskelschwäche auftreten.
Vor Beginn der Behandlung mit BOTOX® müssen im Einzelfall Risiko und Nutzen abgewogen werden.
Über Dysphagie wurde auch nach Injektionen berichtet, die nicht in die zervikale Muskulatur erfolgten (für weitere Informationen siehe Abschnitt «Warnhinweise nach Indikation», «Zervikale Dystonie»).
BOTOX® sollte nur mit äusserster Vorsicht und unter engmaschiger Überwachung bei Patienten mit subklinischen oder klinischen Anzeichen gestörter neuromuskulärer Reizleitung wie z.B. bei Myasthenia gravis oder Eaton-Lambert-Syndrom, bei Patienten mit peripheren motorisch-neuropathischen Erkrankungen (z.B. amyotropher Lateralsklerose oder motorischer Neuropathie) und bei Patienten mit neurologischen Grunderkrankungen angewendet werden. Diese Patienten können eine erhöhte Sensibilität für Wirkstoffe wie BOTOX® haben, auch in therapeutischer Dosierung, was zu einer ausgeprägten Muskelschwäche und zu einem erhöhten Risiko für klinisch relevante systemische Wirkungen einschliesslich schwerer Dysphagie und respiratorischer Beeinträchtigung führen kann. Das Botulinumtoxin-Präparat soll bei diesen Patienten unter Aufsicht eines Spezialisten und nur angewendet werden, wenn der Nutzen der Behandlung das Risiko überwiegt. Patienten mit Dysphagie und Aspiration in der Anamnese sollen mit höchster Vorsicht behandelt werden.
Patienten und Pflegepersonal sollen darauf hingewiesen werden, dass sofort der Arzt zu verständigen ist, wenn Schluck-, Sprech- oder Atemstörungen auftreten.
Bislang bewegungsarme Patienten sollten darauf hingewiesen werden, körperliche Aktivitäten langsam und vorsichtig wieder zu beginnen.
Bevor der Arzt BOTOX® anwendet, muss er sich mit der Anatomie des Patienten sowie irgendwelchen aufgrund chirurgischer Eingriffe entstandenen anatomischen Veränderungen vertraut machen. Injektionen in verletzliche anatomische Strukturen sind zu vermeiden.
Nach der Anwendung von BOTOX® in Thoraxnähe wurde in Verbindung mit der Injektion über Pneumothorax berichtet. Vorsicht ist bei Injektionen in Nähe der Lunge (insbesondere der Apices) oder in andere verletzliche anatomische Strukturen geboten.
Es sind schwerwiegende unerwünschte Wirkungen, darunter auch mit tödlichem Verlauf, bei Patienten berichtet worden, die BOTOX® nicht-indikationsgemäss (off-label) direkt in die Speicheldrüsen, in den orolingualen Rachenraum, in die Speiseröhre und in den Magen injiziert bekommen hatten. Einige Patienten hatten eine bereits bestehende Dysphagie oder ausgeprägte Schwächezustände.
Selten wurde über schwere und/oder sofortige Überempfindlichkeitsreaktionen einschliesslich Anaphylaxie, Serumkrankheit, Urtikaria, Weichteilödem und Dyspnoe berichtet. Einige dieser Reaktionen wurden nach der Anwendung von BOTOX® als Monotherapie oder zusammen mit anderen Arzneimitteln berichtet, bei denen ähnliche Reaktionen bekannt sind. Bei Auftreten einer solchen Reaktion dürfen keine weiteren Injektionen mit BOTOX® verabreicht werden, und es ist eine geeignete medikamentöse Therapie, z.B. Adrenalin, sofort einzuleiten. In einem Fall wurde über eine Anaphylaxie mit tödlichem Ausgang berichtet, bei einem Patienten, der eine Injektion von fälschlicherweise in 5 ml 1%iger Lidocainlösung aufgelöstes BOTOX® erhielt.
Wie bei jeder Injektion kann eine mit dem Injektionsvorgang in Zusammenhang stehende Verletzung auftreten. Eine Injektion kann zu lokaler Infektion, Schmerzen, Entzündung, Parästhesie, Hypoästhesie, Druckempfindlichkeit, Schwellung, Erythem und/oder Blutung/Quetschung führen. Schmerzen und/oder Angst, die in Zusammenhang mit der Injektionsnadel stehen, können zu vasovagalen Reaktionen führen, z.B. Synkope, Hypotension, etc.
BOTOX® sollte nur mit Vorsicht angewendet werden bei Entzündung der vorgesehenen Injektionsstelle(n) oder bei ausgeprägter Schwäche oder Atrophie des zu injizierenden Muskels. Bei Patienten mit peripheren motorisch-neuropathischen Erkrankungen (z.B. amyotropher Lateralsklerose oder motorischer Neuropathie) sollte BOTOX® ebenfalls nur mit Vorsicht angewendet werden.
Unerwünschte Wirkungen nach Anwendung von BOTOX® wurden berichtet, die das kardiovaskuläre System betrafen, wie Arrhythmie und Herzinfarkt, einige davon mit tödlichem Ausgang. Einige dieser Patienten wiesen Risikofaktoren, wie Herz-Kreislauf-Erkrankungen, auf.
Neu oder wiederholt auftretende epileptische Anfälle wurden besonders bei Patienten mit Prädisposition für solche Vorkommnisse berichtet. Der genaue Zusammenhang dieser Vorfälle mit der Botulinumtoxin Injektion ist nicht nachgewiesen. Die Berichte über Vorkommnisse bei Kindern betrafen vorwiegend Patienten mit infantiler Zerebralparese, die gegen Spastizität behandelt wurden.
Die Bildung Botulinumtoxin Typ A neutralisierender Antikörper kann die Wirksamkeit einer BOTOX® Behandlung durch Inaktivierung der biologischen Aktivität des Toxins vermindern. Resultate einiger Studien deuten darauf hin, dass häufigere BOTOX® Injektionen oder höhere Dosen die Inzidenz einer Antikörperbildung erhöhen können. Gegebenenfalls kann eine potentielle Antikörperbildung durch Gabe der niedrigsten Wirkdosis und Einhaltung des grösstmöglichen, klinisch vertretbaren Zeitraums zwischen den Injektionen reduziert werden.
Klinische Fluktuationen, wie sie bei Folgeinjektionen mit BOTOX® (und allen anderen Botulinumtoxinen) auftreten können, sind möglicherweise auf unterschiedliches Vorgehen beim Rekonstituieren, auf die gewählten Injektionsintervalle, die injizierten Muskeln und eine geringfügig variierende Aktivität des Toxins, bedingt durch die verwendete biologische Testmethode, zurückzuführen.
Nach Hautkontakt mit BOTOX® sollte die betroffene Hautstelle zunächst mit verdünnter Hypochlorit-Lösung gereinigt und danach gründlich unter fliessendem Wasser abgespült werden. Im Falle einer Nadelstichverletzung sollte der betroffene Hautbereich ebenfalls sofort gereinigt und der Patient überwacht werden, wie es im Kapitel «Überdosierung» empfohlen ist. Bei Augenkontakt mit BOTOX® muss das betroffene Auge gründlich unter fliessendem Wasser oder mit einer hierfür geeigneten Lösung gespült werden.
Falls eine versehentliche Kontamination vermutet wird (z.B. Hautkontakt oder Nadelstichverletzung), sollte der Hautbereich sofort gereinigt werden. Der Patient sollte medizinisch überwacht werden, wie es im Kapitel «Überdosierung» empfohlen ist.
Anwendung bei Kindern und Jugendlichen
Die Unbedenklichkeit und Wirksamkeit von BOTOX® in anderen Anwendungsgebieten als denen, die für Kinder und Jugendliche im Kapitel «Indikationen/Anwendungsmöglichkeiten» beschrieben werden, sind nicht nachgewiesen. Berichte nach Markteinführung über eine mögliche Verteilung des Toxins an vom Applikationsort entfernte Stellen wurden bei Kindern und Jugendlichen mit Begleiterkrankungen hauptsächlich infantiler Zerebralparese sehr selten berichtet. Im Allgemeinen lag die Dosierung, die in diesen Fällen verwendet wurde, über der empfohlenen Dosierung (siehe «Unerwünschte Wirkungen»).
Selten wurde bei Kindern mit schwerer Zerebralparese nach einer Behandlung mit Botulinumtoxin über Todesfälle berichtet, die bisweilen mit Aspirationspneumonie im Zusammenhang stehen, darunter auch nach nicht-zugelassener (off-label) Anwendung (z.B. im Nackenbereich). Äusserste Vorsicht ist bei der Behandlung von Kindern und Jugendlichen mit ausgeprägten neurologischen Schwächezuständen, Dysphagie oder einer Vorgeschichte von Aspirationspneumonie oder Lungenerkrankung geboten. Die Behandlung bei Patienten mit schlechtem zugrundeliegendem Gesundheitszustand sollte nur erfolgen, wenn eingeschätzt wird, dass der potentielle Nutzen für den einzelnen Patienten die Risiken überwiegt.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosiereinheit, d.h. es ist nahezu «natriumfrei».
Warnhinweise nach Indikation
NEUROLOGISCHE ERKRANKUNGEN:
Blepharospasmus
Ein verringertes Blinzeln nach der Injektion von Botulinumtoxin in den M. orbicularis oculi kann zu kornealer Belastung, anhaltendem Epitheldefekt und Hornhautulzeration führen, insbesondere bei Patienten mit Störungen des VII. Hirnnervs. Eine sorgfältige Überprüfung der Hornhautempfindlichkeit bei vorausgegangener Operation ist angezeigt. Auf Injektionen in den medialen Bereich des Unterlids sollte verzichtet werden, um Ektropium zu vermeiden, und jeglicher Epitheldefekt ist aktiv zu behandeln. Gegebenenfalls sollten «künstliche Tränen», Augensalben, therapeutische weiche Kontaktlinsen oder die Anwendung einer Augenklappe oder Ähnliches in Betracht gezogen werden.
In den Weichteilen des Augenlids ist Ekchymose möglich. Wenn nach der Injektion ein leichter Druck auf die Injektionsstelle ausgeübt wird, kann diese Reaktion minimalisiert werden.
Aufgrund der anticholinergen Wirkung des Botulinumtoxins ist Vorsicht bei der Behandlung von Patienten mit Engwinkelglaukom angeraten, einschliesslich Patienten mit anatomisch bedingt engem Kammerwinkel.
Strabismus
BOTOX® ist unwirksam bei chronischem paralytischem Strabismus, ausser um die Kontraktur des Muskelantagonisten in Zusammenhang mit einer chirurgischen Korrektur zu reduzieren. Bei der Anwendung von BOTOX® zur Behandlung des Strabismus können retrobulbäre Blutungen und Bulbusperforationen auftreten.
Zervikale Dystonie
Bei zervikaler Dystonie können BOTOX®-Injektionen sehr milde bis schwere Dysphagien hervorrufen. Als Folge der Dysphagie können Aspiration und Dyspnoe auftreten, in ganz seltenen Fällen mit der Notwendigkeit einer künstlichen Ernährung. In seltenen Fällen wurde über das Auftreten von Dysphagie assoziiert mit Aspirationspneumonie und Tod berichtet. Die Dysphagie kann bis zu 2 bis 3 Wochen nach Injektion andauern, es wurde aber auch ein Andauern bis zu 5 Monaten nach der Injektion berichtet.
Das Auftreten von Dysphagie ist dosisabhängig und kann bei der Injektion in den M. sternocleidomastoideus durch eine Limitierung der Dosis auf <100 Einheiten vermindert werden. Patienten mit kleineren Nackenmuskeln oder Patienten, die bilaterale Injektionen in den M. sternocleidomastoideus erhalten, haben ein grösseres Dysphagierisiko. Dysphagie ist auf die Ausbreitung des Toxins in die Ösophagusmuskulatur zurückzuführen. Patienten mit zervikaler Dystonie sollten über die mögliche unerwünschte Wirkung einer Dysphagie aufgeklärt werden.
Injektionen in den Levator scapulae können mit einem erhöhten Risiko an oberen Atemwegsinfektionen und Dysphagie assoziiert sein.
Dysphagie kann zu einer verringerten Nahrungs- und Wasseraufnahme beitragen, die zu Gewichtsverlust und Dehydration führt. Patienten mit subklinischer Dysphagie können ein erhöhtes Risiko für eine schwerere Dysphagie nach einer BOTOX® Injektion haben.
Fokale Spastizitäten in Verbindung mit infantiler Zerebralparese und fokale Spastizitäten der oberen Extremitäten bei Erwachsenen, hervorgerufen durch Schlaganfall
BOTOX® wurde in der Behandlung fokaler Spastiken nur in Verbindung mit üblichen Standardtherapien untersucht und ist nicht als Ersatz für diese gedacht.
Es ist wenig wahrscheinlich, dass BOTOX® den Bewegungsspielraum von Gelenken, die von einer fixen Kontraktur betroffen sind, verbessern kann.
Es gibt Post-Marketing-Berichte über Todesfälle (in manchen Fällen mit Aspirationspneumonie) und über mögliche Verteilung des Toxins an vom Applikationsort entfernte Stellen bei Kindern mit Begleiterkrankungen wie insbesondere Zerebralparese nach Botulinumtoxin Behandlung. Siehe Warnhinweise hinsichtlich «Anwendung bei Kindern und Jugendlichen» unter «Warnhinweise und Vorsichtsmassnahmen». Ein kausaler Zusammenhang zu BOTOX® wurde in diesen Fällen nicht bewiesen.
BLASENFUNKTIONSSTÖRUNGEN
Injektionen in den Detrusor-Muskel
Eine Zystoskopie sollte mit der ärztlichen Sorgfalt durchgeführt werden.
Bei nicht-katheterisierten Patienten sollte das nach der Entleerung verbleibende Harnvolumen innerhalb von 2 Wochen nach der Behandlung und danach in medizinisch angezeigten Abständen bis zu 12 Wochen beurteilt werden. Patienten sollten angewiesen werden, sich mit ihrem Arzt in Verbindung zu setzen, wenn sie beim Entleeren der Blase Beschwerden haben, da dann möglicherweise eine Katheterisierung erforderlich ist.
Überaktive Blase
BOTOX® sollte mit Vorsicht bei Patienten mit Obstruktionen im Blasenhalsbereich (z.B. Obstruktion der Harnwege bei Patienten mit Prostatahyperplasie) eingesetzt werden.
Harninkontinenz infolge neurogener Detrusorhyperaktivität
Im Zusammenhang mit dem Verfahren kann eine autonome Dysreflexie auftreten. In diesem Fall ist möglicherweise eine sofortige medizinische Behandlung erforderlich.
ERKRANKUNGEN DER HAUT UND MIT DER HAUT VERBUNDENE ERKRANKUNGEN
Primäre Hyperhidrosis axillae
Die Ursachen einer sekundären Hyperhidrosis (z.B. Hyperthyreose, Phäochromozytom) müssen vor der Behandlung ausgeschlossen werden, um eine symptomatische Behandlung der Hyperhidrosis ohne Diagnose und/oder Behandlung der Grunderkrankung zu vermeiden.
Interaktionen
Theoretisch kann die Wirkung von Botulinumtoxin bei gleichzeitiger Verabreichung von Botulinumtoxin und Aminoglykosidantibiotika, Spectinomycin oder anderen Arzneimitteln, die auf die neuromuskuläre Reizleitung wirken (wie z.B. Muskelrelaxantien) potenziert werden.
Werden unterschiedliche Botulinumneurotoxin-Serotypen gleichzeitig oder innerhalb von mehreren Monaten verabreicht, ist die Wirkung nicht bekannt. Eine stark ausgeprägte neuromuskuläre Schwäche kann sich durch die Verabreichung eines anderen Botulinumtoxins vor dem vollständigen Abklingen der Wirkungen eines zuvor verabreichten Botulinumtoxins verschlimmern.
Muskelrelaxantien sollten mit Vorsicht eingesetzt werden.
Es wurden keine Interaktionsstudien durchgeführt. Interaktionen mit klinischer Relevanz wurden nicht berichtet.
Kinder und Jugendliche
Bei Kindern und Jugendlichen wurden keine Studien zur Erfassung von Interaktionen durchgeführt.
Schwangerschaft/Stillzeit
Schwangerschaft
Es liegen keine ausreichenden Daten zur Anwendung von Botulinumtoxin Typ A während der Schwangerschaft vor. Tierstudien haben eine reproduktionstoxikologische Wirkung gezeigt (siehe unter «Präklinische Daten»).
Das potentielle Risiko für den Menschen ist nicht bekannt. BOTOX® sollte daher während der Schwangerschaft und von Frauen im gebärfähigen Alter, die nicht verhüten, nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich. Wenn eine Patientin während der Behandlung schwanger wird, sollte sie auf die potentiellen Risiken wie Fehlgeburt oder fötale Missbildungen hingewiesen werden.
Stillzeit
Es ist nicht bekannt, ob BOTOX® in die Milch übergeht. Die Anwendung von BOTOX® während der Stillzeit kann nicht empfohlen werden
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. BOTOX® kann jedoch eine Asthenie, Muskelschwäche, Schwindel und Sehstörungen hervorrufen, wodurch die Fähigkeit zur aktiven Teilnahme am Strassenverkehr und zum Bedienen von Maschinen beeinflusst werden könnte
Unerwünschte Wirkungen
Allgemein
In kontrollierten klinischen Studien wurden unerwünschte Wirkungen berichtet, die nach Meinung der Prüfärzte in Zusammenhang mit BOTOX® standen: bei 35% der Patienten mit Blepharospasmus, bei 28% der Patienten mit zervikaler Dystonie, bei 17% der Patienten mit infantiler Zerebralparese (Spitzfuss), bei 11% der Patienten mit primärer Hyperhidrosis axillae und bei 16% der Patienten mit einem Schlaganfall assoziierter fokaler Spastizität der oberen Gliedmassen. In klinischen Studien zur überaktiven Blase betrug die Häufigkeit 26% bei der ersten Behandlung und 22% bei einer zweiten Behandlung. In klinischen Studien zur Harninkontinenz infolge neurogener Detrusorhyperaktivität betrug die Häufigkeit 32% nach der ersten Behandlung und sank auf 18% nach der zweiten Behandlung.
Generell treten Nebenwirkungen innerhalb der ersten Tage nach der Injektion auf und können, obwohl im Allgemeinen vorübergehend, mehrere Monate oder in seltenen Fällen noch länger andauern.
Lokale Muskelschwäche stellt eine erwartete pharmakologische Wirkung von Botulinumtoxin dar. Jedoch wurde über Schwäche von benachbarten Muskeln und/oder Muskeln fern von der Injektionsstelle berichtet.
Wie bei Injektionen zu erwarten, traten lokaler Schmerz, Entzündung, Parästhesie, Hypoästhesie, Druckempfindlichkeit, Schwellung/Ödem, Erythem, lokalisierte Infektion, Blutungen und/oder Blutergüsse im Bereich der Injektionsstelle auf. Mit der Injektionsnadel in Zusammenhang stehende Schmerzen und/oder Angstgefühle führten zu vasovagalen Reaktionen einschliesslich vorübergehender symptomatischer Hypotension und Synkope. Nach Injektionen mit Botulinumtoxin wurden auch Fieber und grippeähnliche Symptome berichtet.
Nebenwirkungen – Häufigkeitsangaben je Indikation
Nachfolgend sind für die einzelnen Anwendungsgebiete Angaben zur Häufigkeit von in klinischen Studien dokumentierten Nebenwirkungen gemacht.
Die Häufigkeitsangaben sind wie folgt definiert: sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1000, <1/100); selten (≥1/10'000, <1/1000); sehr selten (<1/10'000).
NEUROLOGISCHE ERKRANKUNGEN:
Blepharospasmus/Spasmus hemifacialis
Erkrankungen des Nervensystems
Gelegentlich: Schwindel, Fazialparese, Fazialparalyse.
Augenerkrankungen
Sehr häufig: Oberlidptosis (11%).
Häufig: Keratitis punctata, Lagophthalmus, trockenes Auge, Augenirritationen, Photophobie, Zunahme der Lakrimation.
Gelegentlich: Keratitis, Ektropium, Diplopie, Entropium, visuelle Störungen, verschwommenes Sehen.
Selten: Augenlidödem.
Sehr selten: Ulzerative Keratitis, kornealer Epitheldefekt, korneale Perforation.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Ekchymose.
Gelegentlich: Exanthem, Dermatitis.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Gesichtsödem, Irritationen.
Gelegentlich: Erschöpfung.
Strabismus
Augenerkrankungen
Sehr häufig: Störungen der Augenbewegung (16,9%), Oberlidptosis (15,7%).
Gelegentlich: okulare retrobulbare Blutungen, Augenpenetration, Holmes-Adie Pupille.
Selten: Glaskörperblutung.
Zervikale Dystonie
Infektionen und parasitäre Erkrankungen
Häufig: Rhinitis, Infektion der oberen Atemwege.
Erkrankungen des Nervensystems
Häufig: Schwindel, Kopfschmerzen, Hypoästhesie, Muskelhypertonus, Somnolenz.
Augenerkrankungen
Gelegentlich: Diplopie, Oberlidptosis.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Dyspnoe, Dysphonie.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Dysphagie (bis zu 18,6% bei einer mittleren Dosis von 240,5 Einheiten) (siehe auch «Zusätzliche Informationen» unten).
Häufig: trockener Mund, Übelkeit.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Muskelschwäche (12,8%).
Häufig: Steifheit der Skelettmuskulatur, Muskelkater.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Schmerz (16,3%).
Häufig: Asthenie, grippeähnliche Erkrankung, Unwohlsein.
Gelegentlich: Fieber.
Fokale Spastizität der oberen Extremitäten im Zusammenhang mit Schlaganfall
Psychiatrische Erkrankungen
Gelegentlich: Depression, Insomnie.
Erkrankungen des Nervensystems
Häufig: Muskelhypertonus.
Gelegentlich: Parästhesie, Kopfschmerzen, Hypoästhesie, Amnesie, Unkoordiniertheit.
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Schwindel.
Gefässerkrankungen
Gelegentlich: orthostatische Hypotonie.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Übelkeit, orale Parästhesie.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Ekchymose, Purpura.
Gelegentlich: Dermatitis, Pruritus, Exanthem.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Schmerzen in den Extremitäten, Muskelschwäche.
Gelegentlich: Arthralgie, Bursitis.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Schmerzen an der Injektionsstelle, Fieber, grippeähnliche Erkrankung, Blutung an der Einstichstelle, Irritation an der Injektionsstelle.
Gelegentlich: Schmerzen, Unwohlsein, Asthenie, Überempfindlichkeit an der Injektionsstelle, peripheres Ödem.
Einige der gelegentlich berichteten Nebenwirkungen können krankheitsbedingt sein.
Infantile Zerebralparese
Infektionen und parasitäre Erkrankungen
Sehr häufig: Virusinfektion (14,6%), Ohreninfektion (15,7%).
Erkrankungen des Nervensystems
Häufig: nervöses Zittern, Störung des Gangbildes, koordinative Veränderungen, Somnolenz, Parästhesie.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Exanthem.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Myalgie, Muskelschwäche, erhöhter Spannungszustand der (Bein-)Muskulatur, Schmerzen in den Extremitäten.
Gelegentlich: Arthralgie.
Erkrankungen der Nieren und Harnwege
Häufig: Harninkontinenz.
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Häufig: Sturz.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Unwohlsein, Asthenie, Schmerzen an der Injektionsstelle.
Gelegentlich: Fieber.
BLASENFUNKTIONSSTÖRUNGEN:
Überaktive Blase
Infektionen und parasitäre Erkrankungen
Sehr häufig: Infektionen der Harnwege (25,5%).
Häufig: Bakteriurie.
Erkrankungen der Nieren und Harnwege
Sehr häufig: Dysurie (10,9%).
Häufig: Harnretention, Pollakisurie.
Untersuchungen
Häufig: Restharnvolumen*.
*erhöhtes Restharnvolumen nach Blasenentleerung, das keine Katheterisierung erfordert.
Verfahrensbedingte Nebenwirkungen, die häufig auftraten, waren Dysurie und Hämaturie.
Eine saubere intermittierende Katheterisierung wurde bei 6,5% der Patienten nach Behandlung mit 100 Allergan-Einheiten BOTOX® gegenüber 0,4% in der Placebo-Gruppe eingeleitet.
Von 1'242 Patienten, die in den Placebo-kontrollierten klinischen Studien waren 41,4% (n = 514) ≥65 Jahre alt und 14,7% (n = 182) ≥75 Jahre alt. Es wurde in diesen Studien insgesamt kein Unterschied im Sicherheitsprofil nach der BOTOX®-Behandlung zwischen Patienten im Alter von 65 Jahren und älter und Patienten unter 65 Jahren festgestellt, mit der Ausnahme, dass Harnweginfekte bei älteren Patienten sowohl in der Placebo- als auch in der BOTOX®-Gruppe häufiger auftraten als bei jüngeren Patienten.
Bei wiederholter Verabreichung wurde insgesamt keine Veränderung des Sicherheitsprofils beobachtet.
Harninkontinenz infolge neurogener Detrusorhyperaktivität
Unerwünschte Wirkungen aus klinischen Studien der Phase 2 und aus pivotalen klinischen Studien der Phase 3
Infektionen und parasitäre Erkrankungen
Sehr häufig: Infektion der Harnwege (49%).
Psychiatrische Erkrankungen
Häufig: Schlaflosigkeit.
Erkrankungen des Gastrointestinaltrakts
Häufig: Konstipation.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: muskuläre Schwäche, muskuläre Spasmen.
Erkrankungen der Nieren und Harnwege
Sehr häufig: Harnretention (17%).
Häufig: Hämaturie*, Dysurie*, Blasendivertikel.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Müdigkeit, Gangstörungen.
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Häufig: autonome Dysreflexie*, Sturz.
* verfahrensbedingte Nebenwirkungen
In klinischen Studien wurden bei 49,2% der Patienten, die mit 200 Allergan-Einheiten BOTOX® behandelt wurden, sowie bei 35,7% der mit Placebo behandelten Patienten Harnwegsinfekte berichtet (53,0% der Patienten mit Multipler Sklerose, die 200 Allergan-Einheiten erhielten, gegenüber 29,3% in der Placebogruppe; 45,4% der Patienten mit Rückenmarksverletzung, die 200 Allergan-Einheiten erhielten, gegenüber 41,7% mit Placebo). Bei 17,2% der Patienten, die mit 200 Allergan-Einheiten BOTOX® behandelt wurden, sowie bei 2,9% der mit Placebo behandelten Patienten wurde Harnverhalt berichtet (28,8% der Patienten mit Multipler Sklerose, die 200 Allergan-Einheiten erhielten, gegenüber 4,5% in der Placebogruppe; 5,4% der Patienten mit Rückenmarksverletzung, die 200 Allergan-Einheiten erhielten, gegenüber 1,4% mit Placebo).
Bei wiederholter Anwendung wurde keine Veränderung der Art der Nebenwirkungen beobachtet.
Bei MS-Patienten, die an den zentralen Studien teilnahmen, wurde keine Veränderung der jährlichen MS-Schubrate (d.h. Anzahl der MS-Schubereignisse pro Patientenjahr) beobachtet (BOTOX® = 0,23; Placebo = 0,20).
Von den zu Studienbeginn und vor der Behandlung nicht-katheterisierten Patienten wurde bei 38,9% der Patienten nach der Behandlung mit BOTOX® 200 Allergan-Einheiten im Vergleich zu 17,3% der mit Placebo behandelten Patienten eine Katheterisierung eingeleitet.
Unerwünschte Wirkungen aus der Studie nach Marktzulassung mit BOTOX® 100 Allergan-Einheiten bei zu Studienbeginn nicht-katheterisierten MS-Patienten
Infektionen und parasitäre Erkrankungen
Sehr häufig: Infektion der Harnwege (39,4%), Bakteriurie (18,2%).
Erkrankungen der Nieren und Harnwege
Sehr häufig: Harnretention (16,7%).
Häufig: Hämaturie**, Dysurie**.
Untersuchungen
Sehr häufig: Restharnvolumen** (16,7%)
* verfahrensbedingte Nebenwirkungen.
** erhöhtes Restharnvolumen, das keine Katheterisierung erfordert
Eine Katheterisierung wurde bei 15,2% der Patienten nach der Behandlung mit BOTOX® 100 Allergan-Einheiten im Vergleich zu 2,6% der mit Placebo behandelten Patienten eingeleitet.
ERKRANKUNGEN DER HAUT UND MIT DER HAUT VERBUNDENE ERKRANKUNGEN
Primäre Hyperhidrosis axillae
Erkrankungen des Nervensystems
Häufig: Schmerzen, Kopfschmerzen, Parästhesie.
Gefässerkrankungen
Häufig: Hitzewallungen.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Übelkeit.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Hyperhidrosis (nicht-axillares Schwitzen), anormaler Hautgeruch, Pruritus, subkutaner Knoten, Alopezie.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Schmerzen in den Extremitäten.
Gelegentlich: Schwäche in den Armen, Myalgie, Arthropathie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Schmerzen an der Injektionsstelle (11,5%).
Häufig: Schmerzen, Ödem/Blutung/Überempfindlichkeit/Reizung an der Injektionsstelle, Asthenie, Reaktionen an der Injektionsstelle.
Bei der Behandlung der primären axillaren Hyperhidrosis wurde für 4,5% der Patienten über einen Anstieg der Schweissbildung ausserhalb der Achselhöhlen innerhalb eines Monats nach Injektion berichtet. Hierbei ergab sich kein Muster in Bezug auf die betroffenen anatomischen Stellen. Bei etwa 30% der Patienten konnte ein Rückgang innerhalb von 4 Monaten festgestellt werden.
Gelegentlich (0,7%) wurde über eine leichte, vorübergehende, nicht behandlungsbedürftige Schwäche in den Armen berichtet, die sich ohne Folgeerscheinungen besserte. Diese Nebenwirkung könnte mit der Behandlung, der Injektionstechnik oder beidem zusammenhängen. Bei der gelegentlich berichteten Muskelschwäche kann eine neurologische Untersuchung in Betracht gezogen werden. Zusätzlich ist eine Überprüfung der Injektionstechnik vor erneuten Injektionen ratsam, um die intradermale Platzierung der Injektionen sicherzustellen.
Unerwünschte Wirkungen nach Markteinführung
Die folgende Aufstellung enthält unerwünschte Arzneimittelwirkungen oder andere medizinisch relevante unerwünschte Wirkungen, über die unabhängig von der Indikation seit der Markteinführung des Arzneimittels berichtet wurde und zusätzlich zu den unerwünschten Wirkungen auftreten können, die unter «Warnhinweise und Vorsichtsmassnahmen» und unter «Unerwünschte Wirkungen» genannt werden.
Erkrankungen des Immunsystems
Anaphylaxie, Angioödem, Serumkrankheit und Urtikaria.
Stoffwechsel- und Ernährungsstörungen
Anorexie.
Erkrankungen des Nervensystems
Brachialplexopathie, Dysphonie, Dysarthrie, Fazialparese, Hypoästhesie, Muskelschwäche, Myasthenia gravis, periphere Neuropathie, Parästhesie, Radikulopathie, Krampfanfälle, Synkope und Fazialparalyse.
Augenerkrankungen
Engwinkelglaukom (bei der Behandlung von Blepharospasmus), Strabismus, verschwommenes Sehen, Sehstörungen, trockene Augen und Augenlidödem.
Erkrankungen des Ohrs und des Labyrinths
Hypoakusis, Tinnitus und Vertigo.
Herzerkrankungen
Arrhythmie, Herzinfarkt.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Aspirationspneumonie (manchmal mit tödlichem Ausgang), Dyspnoe, Atemdepression und respiratorische Insuffizienz.
Erkrankungen des Gastrointestinaltrakts
Abdominale Schmerzen, Diarrhö, Obstipation, trockener Mund, Dysphagie, Nausea und Erbrechen.
Erkrankungen der Haut und des Unterhautzellgewebes
Alopezie, Psoriasis-artige Dermatitis, Erythema multiforme, Hyperhidrose, Madarosis, Pruritus und Hautausschlag.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Muskelathropie, Myalgie und lokalisierte Muskelzuckungen/unfreiwillige Muskelkontraktionen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Denervationsatrophie, Malaise und Fieber.
Bei der Behandlung des Strabismus ist in einem Fall eine Blutung in den Glaskörper bekannt geworden, die sich später wieder zurückbildete. Es sind einige Fälle von retrobulbärer Hämorrhagie bekannt geworden, ein Visusverlust wurde jedoch nie festgestellt. 5 Augen wiesen Pupillenveränderungen mit einem Ziliarganglionschaden (Adies-Pupille) auf.
Eine Patientin entwickelte zwei Tage nach der Injektion von 120 Allergan-Einheiten BOTOX® zur Behandlung der zervikalen Dystonie eine Erkrankung des Plexus brachialis, die etwa fünf Monate andauerte.
In einer Studie bei Patienten mit Spastizitäten der oberen Extremitäten nach Schlaganfall wurden pulmonale Spirometrie Messungen durchgeführt, welche eine 15% verminderte Lungenfunktion aufzeigten. Die Häufigkeit dieser unerwünschten Wirkung wurde vermehrt in der BOTOX®-Patienten-Gruppe berichtet als in der Placebo-Gruppe, wobei die Unterschiede weder klinische noch statistische Signifikanz erreichten.
Bei der Behandlung der primären axillaren Hyperhidrosis wurde innerhalb von 1 Monat nach Injektion bei 4,5% der Patienten eine Zunahme der nicht-axillaren Schweissabsonderung wahrgenommen. Hierbei ergab sich kein Muster hinsichtlich der betroffenen anatomischen Stellen. Ein Rückgang wurde bei etwa 30% der Patienten innerhalb von 4 Monaten festgestellt.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch
Überdosierung
Überdosierung von BOTOX® ist ein relativer Begriff und abhängig von Dosierung, Injektionsstelle und den zugrundeliegenden Gewebeeigenschaften. Es wurden keine Fälle systemischer Intoxikation aufgrund versehentlicher Injektion von BOTOX®-Lösung beobachtet. Überhöhte Dosierungen können lokale oder entfernt liegende, allgemeine und profunde neuromuskuläre Paralysen hervorrufen. Es wurden keine Fälle einer Ingestion von BOTOX® berichtet.
Anzeichen und Symptome einer Überdosierung treten nicht unmittelbar nach einer Injektion auf. Nach versehentlicher Injektion oder Ingestion oder vermuteter Überdosierung muss der Patient mehrere Wochen hinsichtlich fortschreitender Anzeichen und Symptome einer lokalen oder vom Applikationsort entfernten Muskelschwäche wie Ptosis, Diplopie, Dysphagie, Dysarthrie, generalisierte Schwäche oder respiratorische Insuffizienz medizinisch überwacht werden. Bei diesen Patienten soll eine weitere medizinische Abklärung erwogen werden, und eine geeignete medizinische Behandlung ist sofort einzuleiten, was Hospitalisation einschliessen kann.
Wenn die Muskulatur von Oropharynx und Ösophagus betroffen ist, manifestiert sich evtl. eine Aspirationspneumonie. Wenn es zur Paralyse oder zu ausgeprägter Schwächung der Atemmuskulatur kommt, werden Intubation und assistierte Beatmung erforderlich, bis Besserung eintritt, und es können eine Tracheostomie und längere künstliche Beatmung zusätzlich zu anderen allgemeinen unterstützenden Massnahmen erforderlich sein.
Eigenschaften/Wirkungen
ATC-Code: M03AX01
Wirkungsmechanismus
Das Botulinumtoxin Typ A blockiert durch Spaltung von SNAP 25 («synaptosomal-associated protein of 25 kDa») die periphere Acetylcholin-Freisetzung an den präsynaptischen Nervenendigungen. SNAP 25 ist ein Protein, das wesentlich für die erfolgreiche Bindung und Freisetzung von Acetylcholin aus den Vesikeln ist, die sich in den Nervenendigungen befinden
Pharmakodynamik
Nach der Injektion erfolgt initial eine hoch-affine Bindung des Toxins an spezifische zelluläre Oberflächenrezeptoren. Durch einen Rezeptor-vermittelten Endozytose-Prozess wird das Toxin durch die Plasmamembran transportiert und anschliessend im Cytosol freigesetzt. Dieser Prozess wird von einer progressiven Inhibition der Acetylcholin-Freisetzung begleitet. Klinische Befunde manifestieren sich innerhalb von 2-3 Tagen. Die maximale Wirkung ist 5-6 Wochen nach der Injektion zu beobachten. In sensorischen Neuronen hemmt BOTOX® die Freisetzung von sensorischen Neurotransmittern (z.B. Substanz P, CGRP) und reguliert die Expression von Zelloberflächenrezeptoren (z.B. TRPV1) herunter. BOTOX® verhindert auch eine Sensibilisierung nozizeptiver sensorischer Neuronen und macht diese rückgängig.
Nach intramuskulärer Injektion erfolgt innerhalb von 12 Wochen die Wiederherstellung der Impulsübertragung durch neugebildete Nervenendigungen und deren Wiederverbindung mit den motorischen Endplatten.
Bei intradermaler Injektion, wo das Ziel die ekkrinen Schweissdrüsen sind, hält der Effekt bei Patienten, die 50 Einheiten pro Axilla erhielten, ungefähr 4-7 Monate an.
Wird BOTOX® zur Behandlung des Strabismus eingesetzt, dann wird angenommen, dass es auf Muskelpaare einwirkt, indem der behandelte Muskel atrophisch verlängert und der entsprechende Muskelantagonist verkürzt wird.
Nach Injektion in die Halsmuskulatur verbessert BOTOX® sowohl die objektiven Anzeichen als auch die subjektiven Symptome der zervikalen Dystonie. Dies äussert sich in einer Verringerung der Drehung des Kopfes zur Seite, verringerter Anhebung der Schulter, verringerter Grösse und Kraft hypertrophischer Muskeln und Verringerung der Schmerzen.
Bei Erwachsenen mit fokalen Spastizitäten der oberen Extremitäten nach Schlaganfall verbessert BOTOX® deutlich den Bewegungsspielraum (Ellbogen und Handgelenksstreckung).
Die Injektion von BOTOX® bei Kindern mit dynamischer Spitzfussstellung (Equinus-Deformität) ohne Retraktion und ohne bedeutende Atrophie führt durch teilweise Denervierung des M. gastrocnemius zu einer veränderten Sprunggelenksposition und dadurch zu einer deutlichen Verbesserung des Gangbildes.
Nach Injektion in den Detrusor-Muskel wirkt BOTOX® auf die efferenten Nervenbahnen der Detrusor-Aktivität durch Hemmung der Freisetzung von Acetylcholin. Zusätzlich hemmt BOTOX® afferente Neurotransmitter und sensorische Bahnen.
Klinische Wirksamkeit
NEUROLOGISCHE ERKRANKUNGEN:
Blepharospasmus/hemifazialer Spasmus
In einer offenen Studie wurde 56 Patienten mit Spasmus hemifacialis eine Anfangsdosis von 10 bis 50 Einheiten injiziert. Die Patienten wurden anschliessend 22 Wochen beobachtet. Patienten, die in Woche 4 keine Besserung zeigten, erhielten eine erneute Injektion (5 bis 50 Einheiten). Die Patienten wurden in Woche 2, 4 (sofern eine erneute Behandlung erforderlich war), 6, 14 und 22 beobachtet. Die klinische Wirkung wurde zu jedem Kontrollzeitpunkt für die verschiedenen oberen und unteren Gesichtsmuskeln bewertet.
Bei allen 56 Patienten trat eine Besserung ein, und 62,5% (35/56) zeigten eine deutliche Besserung. Bezogen auf die oberen Gesichtsmuskeln wurde bei allen Patienten eine Besserung beobachtet. Bei der Beurteilung der unteren Gesichtsmuskeln zeigte sich, dass mit Ausnahme von 2 Patienten alle auf die Behandlung angesprochen hatten.
Bei Patienten mit gutartigem essentiellem Blepharospasmus wurde eine zusätzliche randomisierte, multizentrische Doppelblindstudie mit parallelen Gruppen zum Vergleich der Sicherheit und Wirksamkeit von 2 BOTOX®-Formulierungen (der Wirkstoff stammte aus verschiedenen Master-Zellbanken - eine davon entspricht der derzeitigen BOTOX®-Formulierung) durchgeführt. In die Studie wurden Patienten aufgenommen, die schon früher mit BOTOX® behandelt worden waren, und die Behandlung bestand aus einem einzelnen Injektionszyklus in die M. orbicularis oculi beider Augen. Die Dosis (maximal zulässig waren 100 Einheiten) und Injektionsstellen wurden vom Prüfarzt aufgrund des Ansprechens der Patienten auf frühere BOTOX®-Behandlungen festgelegt. Die Patienten wurden über einen Zeitraum von 12 Wochen nach der Behandlung beobachtet. In die Studie wurden 98 Patienten aufgenommen (48 in die Gruppe mit der derzeitigen BOTOX®-Formulierung).
Die Erfolgsrate der Behandlung wurde auf einer 5-Punkte-Skala von 0 bis 4 beurteilt. Dabei stand 0 für «keinen» und 4 für «starken» behindernden Spasmus der Augenlider und möglicherweise anderer Gesichtsmuskeln. Eine Abnahme auf einen Punktwert von ≤2 an beiden Augen galt als Behandlungserfolg. Der primäre Endpunkt lag in Woche 4. Die Patienten erhielten eine durchschnittliche Dosis von 33 Einheiten pro Auge, injiziert an 3 bis 15 Injektionsstellen. Vergleichbar mit der früheren BOTOX®-Formulierung lag die Erfolgsrate der Behandlung mit der derzeitigen BOTOX®-Formulierung bei ca. 90% in Woche 4.
Zervikale Dystonie
Bei Patienten mit zervikaler Dystonie (CD) wurde eine randomisierte, Placebo-kontrollierte, multizentrische Doppelblindstudie durchgeführt. In diese Studie wurden erwachsene Patienten mit CD aufgenommen, die positiv auf eine frühere Behandlung mit BOTOX® angesprochen hatten. Die Studie war in 2 Behandlungsphasen unterteilt, in eine offene Studienphase, in der alle Patienten mit BOTOX® behandelt wurden, wobei Dosierung und Injektionsstellen individuell vom Prüfarzt festgelegt wurden, und in eine Doppelblindphase, in der Patienten, die in der offenen Phase als Responder eingestuft wurden, doppelblind entweder BOTOX® oder Placebo erhielten. Zwischen diesen beiden Phasen lag ein Zeitraum von bis zu 6 Wochen. Insgesamt wurden den Patienten bis zu 360 Allergan-Einheiten BOTOX® verabreicht.
In der offenen Studienphase wurden 214 Patienten beurteilt, von denen 170 für den Doppelblindteil der Studie randomisiert wurden (88 Patienten wurden in die BOTOX®-Gruppe, 82 in die Placebo-Gruppe aufgenommen). Anschliessend wurden die Patienten im Abstand von jeweils 2 Wochen über einen Zeitraum von bis zu 10 Wochen nach der Behandlung beobachtet. Die primären Wirksamkeitsvariablen waren eine Veränderung der Kopfhaltung (gemessen auf der Skala zur Beurteilung der Schwere der zervikalen Dystonie) und der prozentuale Anteil der Patienten mit einer Besserung des CD-Status, gemessen anhand einer ärztlich beurteilten Bewertungsskala 6 Wochen nach der Behandlung. Schmerzen als wichtiges Symptom von CD wurden von den Patienten im Hinblick auf Häufigkeit und Intensität beurteilt. Zusätzlich beurteilten Arzt und Patient die funktionale Behinderung.
BOTOX® erwies sich bei beiden primären Wirksamkeitsvariablen nach 6 Wochen dem Placebo sowohl klinisch als auch statistisch signifikant überlegen. BOTOX® verringerte auch die Intensität und Häufigkeit von Schmerzen statistisch signifikant besser als Placebo. Signifikante Verbesserungen wurden auch bei der Beurteilung der funktionalen Behinderung durch Arzt und Patient in Woche 6 beobachtet.
Bei Patienten mit zervikaler Dystonie wurde eine zusätzliche randomisierte Doppelblindstudie im Crossover-Design zur Untersuchung der Sicherheit und Wirksamkeit von 2 BOTOX®-Formulierungen (der Wirkstoff stammte aus verschiedenen Master-Zellbanken - eine davon entspricht der derzeitigen BOTOX®-Formulierung) durchgeführt. In die Studie wurden Patienten aufgenommen, die bereits früher mit zufriedenstellenden Ergebnissen behandelt worden waren; die Behandlung umfasste 2 Injektionen mit einer dazwischen liegenden Auswaschphase von 8 bis 16 Wochen. Die Patienten wurden nach jeder Behandlung über einen Zeitraum von 8 bis 16 Wochen beobachtet, wobei der primäre Endpunkt in Woche 6 nach jeder Behandlung lag.
In diese Studie wurden 135 Patienten aufgenommen. Die primäre Wirksamkeitsvariable war die Gesamtbeurteilung des Schweregrads auf der Toronto Western Spasmodic Torticollis Rating Scale (TWSTRS). Sekundäre Wirksamkeitsvariablen waren der Behinderungs-Schmerzscore (anhand der modifizierten TWSTRS) und die Gesamtbeurteilung der zervikalen Dystonie durch Patient und Arzt. Die Ergebnisse bestätigten, dass eine maximale klinische Besserung nach Injektion von BOTOX® in Woche 6 erreicht wird. Die mittlere Verringerung des Gesamtwerts auf der TWSTRS stellte eine 35%ige Besserung gegenüber den Ausgangswerten dar, und die höchste mittlere Verringerung des Behinderungs-Schmerzscores entsprach einer 50%igen Besserung gegenüber dem Ausgangswert zu diesem Zeitpunkt.
Die Gesamtbeurteilung durch Ärzte und Patienten zeigte ebenfalls den positiven Behandlungseffekt mit einem für die neue BOTOX®-Formulierung berichteten Behandlungserfolg in über 85% bzw. 80% der Fälle in Woche 6.
Infantile Zerebralparese
Eine multizentrische, Placebo-kontrollierte Doppelblindstudie wurde mit 145 Kindern mit Zerebralparese durchgeführt, die an Spastizität der unteren Gliedmassen im Zusammenhang mit dynamischer Muskelkontraktur und Spitzfussstellung beim Gehen litten. Die Patienten wurden in die BOTOX®- (N = 72) oder Placebo-Gruppe (N = 73) randomisiert. Die Gesamtdosis, die jedem Patienten in den M. gastrocnemius injiziert wurde, betrug 4 Einheiten/kg bis zu einer Höchstdosis von 200 Einheiten in einem Zeitraum von 30 Tagen. Die Patienten wurden für die Dauer von 12 Wochen nach der Behandlung beobachtet. Die primäre Wirksamkeitsvariable, die Erfolgsrate der Behandlung, war definiert als Anstieg des dynamischen Scores für das Gangmuster (beim Gehen) um ≥2 Punkte gegenüber dem Ausgangswert.
Die Erfolgsrate war zu jedem Kontrollzeitpunkt in der BOTOX®-Gruppe signifikant höher als in der Placebo-Gruppe.
Fokale Spastizitäten der oberen Extremitäten in Zusammenhang mit Schlaganfall
Bei Patienten mit Spastizitäten der oberen Extremitäten nach einem Schlaganfall wurde eine Placebo-kontrollierte, multizentrische Doppelblindstudie zur Untersuchung der Wirksamkeit und Sicherheit von BOTOX® durchgeführt. Die Patienten waren noch nie mit BOTOX® behandelte Erwachsene, deren Schlaganfall ≥6 Wochen zurücklag und die erweiterte Ashworth-Scores von ≥3 am Handgelenk und ≥2 am Ellbogen aufwiesen. Einundneunzig Patienten wurden auf eine von vier Behandlungsgruppen randomisiert (BOTOX® 90, 180 oder 360 Allergan-Einheiten, oder Placebo). Der primäre Endpunkt, Spastizität des Flexors im Handgelenk, wurde in Woche 6 auf der Erweiterten Ashworth-Skala (EAS) gemessen. Sekundäre Wirksamkeitsvariablen waren Spastizität der Flexoren in Ellbogen und Fingern, gemessen auf der EAS und nach Gesamtbeurteilung des Arztes.
In die Studie wurden 91 Patienten aufgenommen (65 Patienten erhielten BOTOX® in 90, 180 oder 360 Allergan-Einheiten). Die mittlere Abnahme auf der EAS für die Flexoren des Handgelenks war in allen BOTOX®-Gruppen bis Woche 12 grösser als in der Placebo-Gruppe.
In allen BOTOX®-Behandlungsgruppen war der Flexortonus im Handgelenk, gemessen auf der EAS, wirksamer verringert als unter Placebo. Die Flexoren der Ellbogen zeigten ähnliche Verbesserungsmuster. Bei den Fingerflexoren fand sich zwar insgesamt eine gewisse Variabilität (signifikante Verbesserungen nur in Woche 1 und 3), aber die Daten weisen auf vergleichbare Dosis/Wirkungs-Beziehungen hin. Die ärztlich beurteilte Bewertungsskala zeigte ebenfalls einen signifikanten Vorteil bei Dosen von 180 Einheiten und 360 Einheiten.
Eine weitere Placebo-kontrollierte, multizentrische Doppelblindstudie wurde bei Patienten mit Spastizität im Handgelenk und den Fingern als sekundäre Folge eines Schlaganfalls durchgeführt. Die Dauer der Studie betrug 12 Wochen. Primärer Endpunkt war die Spastizität des Flexors im Handgelenk in Woche 6, gemessen auf der Ashworth-Skala (AS). Weitere Variablen waren die ärztlich beurteilte Bewertungsskala, die Gesamtbeurteilung durch die Betreuungsperson des Patienten, die Skala zur Beurteilung von Behinderungen und die Grundsätzlichen Therapeutischen Interventionsziele.
126 Patienten wurden randomisiert und erhielten BOTOX® (N = 64) oder Placebo (N = 62). Die injizierte Dosis von BOTOX® lag zwischen 200 bis 240 Allergan-Einheiten, verteilt auf die betroffenen Muskeln im Handgelenk und in den Fingern. Es zeigte sich, dass BOTOX® die AS-Werte für Handgelenk und Finger zu allen Kontrollzeitpunkten nach der Injektion verbessert hatte. In Woche 6 zeigten 88% der Patienten eine Verbesserung auf der AS unter BOTOX®, gegenüber 34% in der Placebo-Gruppe.
Alle anderen Variablen zeigten in Woche 6 ebenfalls einen signifikanten Vorteil gegenüber Placebo.
BLASENFUNKTIONSSTÖRUNGEN:
Überaktive Blase
Zwei doppel-blinde, Placebo-kontrollierte, randomisierte, multizentrische 24-wöchige klinische Phase-III-Studien wurden bei Patienten mit überaktiver Blase mit den Symptomen Harninkontinenz, Harndrang und häufige Miktion durchgeführt. Insgesamt wurden1'105 Patienten, deren Symptome durch Anticholinergika nicht adäquat kontrolliert werden konnten (unzureichendes Ansprechen oder inakzeptable Nebenwirkungen), entweder auf 100 Allergan-Einheiten BOTOX® (n = 557) oder Placebo (n = 548) randomisiert.
In beiden Studien wurden für BOTOX® (100 Allergan-Einheiten) signifikante Verbesserungen im Vergleich zu Placebo bei der Änderung der täglichen Häufigkeit von Harninkontinenzepisoden verglichen mit dem Ausgangswert, einschliesslich des Anteils trockener Patienten, zum primären Zeitpunkt in Woche 12 festgestellt. Gemessen anhand der Skala für den Behandlungsnutzen war der Anteil der Patienten, die über ein positives Behandlungsansprechen berichteten (ihr Zustand hatte sich «stark verbessert» oder «verbessert»), in beiden Studien in der BOTOX®-Gruppe signifikant grösser als in der Placebo-Gruppe. Signifikante Verbesserungen im Vergleich zu Placebo wurden auch bei der täglichen Miktionshäufigkeit und der Häufigkeit der Episoden von Harndrang und Nykturie beobachtet. Die pro Miktion ausgeschiedene Urinmenge war ebenfalls signifikant grösser. Signifikante Verbesserungen wurden ab Woche 2 bei allen Symptomen der überaktiven Blase festgestellt.
Die BOTOX®-Behandlung war gegenüber Placebo mit signifikanten Verbesserungen der gesundheitsbezogenen Lebensqualität verbunden, gemessen anhand des I-QOL-Fragebogens (Incontinence Quality of Life) (mit den Faktoren Vermeidungsverhalten und Einschränkungen, psychosoziale Folgen und soziale Peinlichkeit) und des KHQ-Fragebogens (King's Health Questionnaire) (mit den Faktoren Folgen der Inkontinenz, Einschränkungen bei Alltagsaktivitäten, soziale Einschränkungen, körperliche Einschränkungen, persönliche Beziehungen, Gefühlszustand, Schlaf/Energie und Schweregrad/Gegenmassnahmen).
Zwischen Patienten im Alter von 65 Jahren und älter und Patienten unter 65 Jahren wurde insgesamt nach der BOTOX®-Behandlung kein Unterschied in der Wirkung festgestellt.
Die Ergebnisse der gepoolten zentralen Studien sind unten dargestellt:
Primäre und sekundäre Wirksamkeitsendpunkte zu Studienbeginn und Veränderung gegenüber Studienbeginn in den gepoolten zentralen Studien
BOTOX® 100 Allergan-Einheiten (N = 557) | Placebo (N = 548) | p-Wert | |
Tägliche Häufigkeit von Harninkontinenzepisoden* | |||
Mittelwert zu Studienbeginn Mittlere Veränderung in Woche 2 Mittlere Veränderung in Woche 6 Mittlere Veränderung in Woche 12 | 5,49 -2,85 -3,11 -2,80 | 5,39 -1,21 -1,22 -0,95 | <0,001 <0,001 <0,001 |
Anteil der Patienten mit positivem Behandlungsansprechen auf der Skala des Behandlungsnutzens (%) | |||
Woche 2 Woche 6 Woche 12 | 64,4 68,1 61,8 | 34,7 32,8 28,0 | <0,001 <0,001 <0,001 |
Tägliche Häufigkeit von Miktionsepisoden | |||
Mittelwert zu Studienbeginn Mittlere Veränderung in Woche 2 Mittlere Veränderung in Woche 6 Mittlere Veränderung in Woche 12 | 11,99 -1,53 -2,18 -2,35 | 11,48 -0,78 -0,97 -0,87 | <0,001 <0,001 <0,001 |
Tägliche Häufigkeit der Harndrangepisoden | |||
Mittelwert zu Studienbeginn Mittlere Veränderung in Woche 2 Mittlere Veränderung in Woche 6 Mittlere Veränderung in Woche 12b | 8,82 -2,89 -3,56 -3,30 | 8,31 -1,35 -1,40 -1,23 | <0,001 <0,001 <0,001 |
I-QOL-Gesamtscore | |||
Mittelwert zu Studienbeginn Mittlere Veränderung nach Woche 12bc | 34,1 +22,5 | 34,7 +6,6 | <0,001 |
KHQ-Fragebogen: Rolleneinschränkungen | |||
Mittelwert zu Studienbeginn Mittlere Veränderung nach Woche 12bc | 65,4 -25,4 | 61,2 -3,7 | <0,001 |
KHQ-Fragebogen: Soziale Einschränkungen | |||
Mittelwert zu Studienbeginn Mittlere Veränderung nach Woche 12bc | 44,8 -16,8 | 42,4 -2,5 | <0,001 <0,001 |
* Der prozentuale Anteil der Patienten, die in Woche 12 trocken (frei von Inkontinenz) waren, betrug 27,1% in der BOTOX®-Gruppe und 8,4% in der Placebo-Gruppe. Die prozentualen Anteile der Patienten, die eine Verringerung der Harninkontinenzepisoden im Vergleich zum Ausgangswert von mindestens 75% bzw. 50% erzielten, waren 46,0% bzw. 60,5% in der BOTOX®-Gruppe und 17,7% bzw. 31,0% in der Placebo-Gruppe.
a Koprimäre Endpunkte
b Sekundäre Endpunkte
c Die vorab definierte bedeutsame Mindeständerung im Vergleich zur Baseline war +10 Punkte für I-QOL und 5 Punkte für KHQ.
Die mediane Dauer des Ansprechens nach der BOTOX®-Behandlung, basierend auf dem Verlangen der Patienten nach einer erneuten Behandlung, betrug 166 Tage (~24 Wochen).
Bei Patienten, die auch noch an der offenen Verlängerungsstudie teilnahmen und nur mit BOTOX® 100 Allergan-Einheiten behandelt wurden (N = 438), betrug die mediane Dauer des Ansprechens 212 Tage (~30 Wochen).
In den beiden pivotalen Studien nahm nur eine begrenzte Anzahl männlicher Patienten (ca. 12.2% der gesamten Studienpopulation) teil. Eine statistisch signifikante Wirksamkeit konnte in dieser kleinen Subgruppe nicht gezeigt werden.
Insgesamt wurden 834 Patienten in einer Langzeit-Verlängerungsstudie untersucht. Bei erneuten Behandlungen zeigten die Patienten für alle Wirksamkeitsendpunkte ein gleichbleibendes Ansprechen.
In den zentralen Studien entwickelte keiner der 615 Patienten, bei denen Proben analysiert wurden, neutralisierende Antikörper. Bei Patienten, bei denen Proben aus der pivotalen Phase-III-Studie und den offenen Verlängerungsstudien analysiert wurden, entwickelten sich in den folgenden Fällen neutralisierende Antikörper: bei 0 von 954 Patienten (0,0%) während der Behandlung mit 100 Allergan-Einheiten BOTOX® und bei 3 von 260 Patienten (1,2%) nach anschliessender Behandlung mit mindestens einer Dosis von 150 Allergan-Einheiten. Einer dieser drei Patienten zeigte einen anhaltenden klinischen Nutzen.
Harninkontinenz infolge neurogener Detrusorhyperaktivität
Zwei doppel-blinde, Placebo-kontrollierte, randomisierte, multizentrische klinische Studien der Phase III wurden bei Patienten mit Harninkontinenz aufgrund neurogener Überaktivität des Detrusor-Muskels und entweder mit spontaner Harnentleerung oder Katheterisierung durchgeführt. Insgesamt wurden 691 Patienten mit Rückenmarksverletzung oder Multipler Sklerose aufgenommen, die mit mindestens einem anticholinergen Wirkstoff nicht angemessen behandelt wurden. Diese Patienten wurden entweder auf 200 Allergan-Einheiten BOTOX® (n = 227), 300 Allergan-Einheiten BOTOX® (n = 223) oder Placebo (n = 241) randomisiert.
Im Vergleich zu Placebo wurden in beiden Phase-III-Studien signifikante Verbesserungen des primären Wirksamkeitsparameters, Veränderung der wöchentlichen Häufigkeit von Inkontinenz-Episoden gegenüber Studienbeginn, beobachtet, wobei BOTOX® (200 Allergan-Einheiten und 300 Allergan-Einheiten) zum primären Wirksamkeitszeitpunkt in Woche 6 einschliesslich des Anteils bei Patienten, bei denen keine Harninkontinenz mehr auftrat, am besten abschnitt. Es wurden signifikante Verbesserungen der urodynamischen Parameter einschliesslich eines Anstiegs der maximalen zystometrischen Kapazität und einem verringerten Maximaldruck auf den Detrusor-Muskel bei der ersten unbeabsichtigten Detrusor-Kontraktion beobachtet. Ebenso wurden im Vergleich zu Placebo signifikante Verbesserungen in den vom Patienten beurteilten Inkontinenz-spezifischen, gesundheitsbezogenen Wert zur Lebensqualität, die mit dem I-QOL–Fragebogen erfasst wurden, beobachtet (einschliesslich einschränkender Vermeidungstaktiken, psychosozialer Auswirkungen und Schamgefühle). Ein zusätzlicher Nutzen von BOTOX® 300 Allergan-Einheiten gegenüber 200 Allergan-Einheiten konnte nicht gezeigt werden.
Die Ergebnisse der gepoolten zentralen Studien werden nachfolgend vorgestellt:
Primäre und sekundäre Endpunkte zu Studienbeginn und Veränderung gegenüber Studienbeginn in den gepoolten zentralen Studien
BOTOX® 200 Allergan-Einheiten (N = 227) | Placebo (N = 241) | p-Wert | |
Wöchentliche Häufigkeit der Harninkontinenz* | |||
Mittelwert zu Studienbeginn Mittlere Veränderung in Woche 2 Mittlere Veränderung in Woche 6a Mittlere Veränderung in Woche 12 | 32,4 -17,7 -21,3 -20,6 | 31,5 -9.0 -10,5 -9,9 | <0,001 <0,001 <0,001 |
Maximale zystometrische Kapazität (ml) | |||
Mittelwert zu Studienbeginn Mittlere Veränderung in Woche 6b | 250,2 +153,6 | 253,5 +11,9 | <0,001 |
O):2Maximaler Detrusor-Druck während der 1. unbeabsichtigten Detrusor-Kontraktion (cmH | |||
Mittelwert zu Studienbeginn Mittlere Veränderung in Woche 6b | 51,5 -32,4 | 47,3 +1,1 | <0,001 |
Gesamtscore Inkontinenz-spezifische Lebensqualitätc,d | |||
Mittelwert zu Studienbeginn Mittlere Veränderung in Woche 6b Mittlere Veränderung in Woche 12 | 35,37 +25,89 +28,89 | 35,32 +11,15 +8,86 | <0,001 <0,001 |
* Der Prozentsatz der Patienten, bei denen eine Inkontinenz nicht mehr auftrat, lag während der gesamten Woche 6 bei 37% in der mit 200 BOTOX® Allergan-Einheiten behandelten Gruppe und bei 9% in der Placebo-Gruppe. Der Anteil, der eine um mindestens 75% reduzierte Häufigkeit von Inkontinenz-Episoden gegenüber Studienbeginn erreichte, lag bei 63% bzw. 24%. Der Anteil, der eine um mindestens 50% reduzierte Häufigkeit gegenüber Studienbeginn erreichte, lag bei 76% bzw. 39%.
a Primärer Endpunkt
b Sekundärer Endpunkt
c Die Skala des I-QOL-Gesamtscores reicht von 0 (grösstes Problem) bis 100 (überhaupt kein Problem).
d In den zentralen Studien lag die vordefinierte minimal-bedeutsame Veränderung (MID – Minimally Important Difference) des I-QOL-Gesamtscores bei 8 Punkten, ausgehend von einem geschätzten MID-Wert von 4-11 Punkten, der von Patienten mit neurogener Überaktivität des Detrusor-Muskels angegeben wurde.
In den beiden zentralen Studien wurde die mediale Dauer des Ansprechens auf die Therapie, ausgehend von der Bitte der Patienten nach erneuter Behandlung, ermittelt und lag bei 256-295 Tagen (36-42 Wochen) in der mit 200 Einheiten behandelten Gruppe im Vergleich zu 92 Tagen (13 Wochen) bei der Gruppe unter Placebo. Bei Patienten, die auch noch an der offenen Verlängerungsstudie teilnahmen und nur mit BOTOX® 200 Allergan-Einheiten behandelt wurden (N = 174), betrug die mediane Dauer des Ansprechens 253 Tage (~36 Wochen).
Bei erneuter Behandlung wiesen die Patienten ein gleichbleibendes Ansprechen auf die Therapie hinsichtlich aller Endpunkte zur Wirksamkeit auf.
In den zentralen Studien entwickelte keiner der 475 Patienten mit neurogener Überaktivität des Detrusor-Muskels, bei denen Proben untersucht wurden, neutralisierende Antikörper.
Bei Patienten, bei denen Proben aus dem Programm zur Entwicklung neuer Medikamente (einschliesslich offene Verlängerungsstudie) analysiert wurden, entwickelten sich in den folgenden Fällen neutralisierende Antikörper: bei 3 von 300 Patienten (1,0%), die nur mit BOTOX® 200 Allergan-Einheiten behandelt wurden, und bei 5 von 258 Patienten (1,9%) nach der Behandlung mit mindestens einer Dosis von 300 Allergan-Einheiten. Vier dieser acht Patienten zeigten einen anhaltenden klinischen Nutzen.
Nach Marktzulassung wurde eine Placebo-kontrollierte, doppel-blinde Studie bei Patienten mit multipler Sklerose (MS) durchgeführt, die aufgrund einer neurogenen Detrusorhyperaktivität eine Harninkontinenz zeigten und die mit mindestens einem anticholinergen Wirkstoff nicht angemessen behandelt wurden und zu Studienbeginn nicht katheterisiert waren. Diese Patienten wurden entweder auf BOTOX® 100 Allergan-Einheiten (n = 66) oder Placebo (n = 78) randomisiert.
Signifikante Verbesserungen des primären Wirksamkeitsparameters, Veränderung der täglichen Häufigkeit von Inkontinenz-Episoden, gegenüber Studienbeginn wurden im Vergleich zu Placebo für BOTOX® (100 Allergan-Einheiten) zum primären Wirksamkeitszeitpunkt in Woche 6 beobachtet. Dazu zählte auch der Anteil der Patienten, bei denen eine Harninkontinenz nicht mehr auftrat. Es wurden signifikante Verbesserungen der urodynamischen Parameter und des vom Patienten beurteilten I-QOL–Fragebogens beobachtet. Hierzu gehören auch einschränkende Vermeidungstaktiken, psychosoziale Auswirkungen und Schamgefühle im Beisein anderer.
Die Ergebnisse der Studie nach Markteinführung werden nachfolgend vorgestellt:
Primäre und sekundäre Endpunkte zu Studienbeginn und Veränderung gegenüber Studienbeginn in der Studie nach Markteinführung mit BOTOX 100 Allergan-Einheiten und bei zu Studienbeginn nicht-katheterisierten MS-Patienten
BOTOX® 100 Allergan-Einheiten (N=66) | Placebo (N=78) | p-Wert | |
Tägliche Häufigkeit von Harninkontinenzepisoden* | |||
Mittelwert zu Studienbeginn Mittlere Veränderung in Woche 2 Mittlere Veränderung in Woche 6a Mittlere Veränderung in Woche 12 | 4.2 -2.9 -3.3 -2.8 | 4.3 -1.2 -1.1 -1.1 | p<0.001 p<0.001 p<0.001 |
Maximale zystometrische Kapazität (ml) | |||
Mittelwert zu Studienbeginn Mittlere Veränderung in Woche 6b | 246.4 +127.2 | 245.7 -1.8 | p<0.001 |
O):2Maximaler Detrusor-Druck während der 1. unbeabsichtigten Detrusor-Kontraktion (cmH | |||
Mittelwert zu Studienbeginn Mittlere Veränderung in Woche 6b | 35.9 -19.6 | 36.1 +3.7 | p=0.007 |
Gesamtscore Inkontinenz-spezifische Lebensqualitätc, d | |||
Mittelwert zu Studienbeginn Mittlere Veränderung in Woche 6b Mittlere Veränderung in Woche 12 | 32.4 +40.4 +38.8 | 34.2 +9.9 +7.6 | p<0.001 p<0.001 |
* Der Prozentsatz der Patienten, bei denen eine Inkontinenz nicht mehr auftrat, lag während der gesamten Woche 6 bei 53,0% in der mit 100 BOTOX® Allergan-Einheiten behandelten Gruppe und bei 10,3% in der Placebo-Gruppe.
a Primärer Endpunkt
b Sekundäre Endpunkte
c Die Skala des I-QOL-Gesamtscores reicht von 0 (grösstes Problem) bis 100 (überhaupt kein Problem).
d Die vordefinierte minimal-bedeutsame Veränderung (MID – Minimally Important Difference) des I-QOL-Gesamtscores lag bei 11 Punkten, ausgehend von einem geschätzten MID-Wert von 4–11 Punkten, der von Patienten mit neurogener Überaktivität des Detrusor-Muskels angegeben wurde.
Die mediane Dauer des Ansprechens in dieser Studie, basierend auf dem Verlangen der Patienten nach einer erneuten Behandlung, betrug 362 Tage (~52 Wochen) in der mit BOTOX® 100 Allergan-Einheiten behandelten Gruppe im Vergleich zu 88 Tagen (~13 Wochen) bei der Gruppe unter Placebo.
ERKRANKUNGEN DER HAUT UND MIT DER HAUT VERBUNDENE ERKRANKUNGEN:
Primäre Hyperhidrosis axillaris
Es wurde eine doppel-blinde, multizentrische klinische Studie bei Patienten mit persistierender bilateraler primärer Hyperhidrosis axillaris durchgeführt. Eine primäre Hyperhidrosis axillaris lag vor, wenn bei einer Ausgangsmessung in Ruhe und bei Raumtemperatur pro Achsel über 5 Minuten mindestens 50 mg Schweiss spontan produziert wurden. 320 Patienten wurden randomisiert und erhielten entweder 50 Allergan-Einheiten BOTOX® (N = 242) oder Placebo (N = 78). Patienten wurden als auf die Therapie ansprechend definiert, wenn sie zumindest eine Reduzierung der Achselschweissproduktion um 50% von der Ausgangsmessung zeigten. Am primären Endpunkt 4 Wochen nach den Injektionen sprachen in der BOTOX®-Gruppe 93,8% der Patienten im Vergleich zu 35,9% der Patienten in der Placebo-Gruppe (p <0,001) auf die Behandlung an. Die Rate der auf die Therapie ansprechenden Patienten war in der BOTOX®-Gruppe kontinuierlich an allen nachfolgenden Messpunkten bis zu 16 Wochen nach den Injektionen signifikant grösser (p <0,001) als in der Placebo-Gruppe.
In einer offenen Folgestudie wurden 207 geeignete Patienten eingeschlossen, die bis zu 3 BOTOX®-Behandlungen erhielten. Insgesamt schlossen 174 Patienten die volle Dauer von 16 Monaten der zwei kombinierten Studien ab (4 Monate doppel-blind und 12 Monate offene Nachfolgestudie). Die Ansprechrate 16 Wochen nach der ersten (n = 287), der zweiten (n = 123) und der dritten (n = 30) Behandlung war jeweils 85,0%, 86,2% und 80%. Die mittlere Dauer der Wirkung basierend auf der Einzelbehandlung kombiniert mit der offenen Nachfolgestudie war 7,5 Monate nach der ersten Behandlung, jedoch hielt der Effekt bei 27,5% der Patienten über ein Jahr oder länger an.
Pharmakokinetik
Aufgrund der Beschaffenheit von Botulinumtoxin Typ A wurden keine klassischen Resorptions-, Verteilungs-, Biotransformations- und Eliminationsuntersuchungen mit dem Wirkstoff durchgeführt.
Allgemeine Merkmale der aktiven Substanz
Distribution/Metabolismus/Elimination
Verteilungsstudien bei Ratten zeigen eine langsame Diffusion des radioaktiv markierten Botulinumtoxin Typ A im M. gastrocnemius, gefolgt von einer raschen systemischen Metabolisierung und Ausscheidung im Urin.
Die Halbwertszeit des markierten Materials betrug etwa 10 Stunden. An der Injektionsstelle wurde Radioaktivität an grosse Protein-Moleküle gebunden. Im Plasma erfolgte die Bindung an kleine Moleküle, was auf einen schnellen systemischen Metabolismus schliessen lässt. Innerhalb von 24 Stunden nach Applikation wurden 60% der Radioaktivität über den Urin ausgeschieden. Das Toxin wird vermutlich von Proteasen metabolisiert, und die Molekülkomponenten werden auf dem normalen Stoffwechselweg wiederverwertet
Distribution
Verteilung des arzneilich wirksamen Bestandteils im Patienten:
Es wird angenommen, dass therapeutische BOTOX®-Dosen wenig systemisch verteilt werden. In klinischen Studien konnte mit Hilfe der Einzelfaser-EMG-Technik für Muskeln, die entfernt von der Injektionsstelle lagen, eine erhöhte elektrophysiologische neuromuskuläre Aktivität gezeigt werden. Gleichzeitige klinische Befunde oder Symptome wurden nicht beobachtet. Der Umfang der Diffusion und damit von unerwünschten Wirkungen ist von den anatomischen Gegebenheiten, vom Injektionsvolumen und von der Dosis abhängig
Präklinische Daten
Präklinische Daten zur Sicherheit
Zusätzlich zur Reproduktionstoxikologie wurden die folgenden präklinischen Studien zur Sicherheit von BOTOX® durchgeführt: akute Toxizität, chronische Toxizität, lokale Verträglichkeit, Mutagenität, Antigenität, sowie Verträglichkeit mit menschlichem Blut. Für klinisch relevante Dosen konnte in diesen Studien kein spezielles Risiko für den Menschen nachgewiesen werden. Aus der Literatur ist für juvenile Affen bei intramuskulärer Applikation eine LD50 von 39 Einheiten/kg Körpergewicht bekannt.
Nach einer einzelnen Injektion von <50 Allergan-Einheiten/kg BOTOX® in den Detrusor-Muskel von Ratten wurde keine systemische Toxizität beobachtet. Zur Simulation einer versehentlichen Injektion wurde eine Einzeldosis BOTOX® (~7 Allergan-Einheiten/kg) in die prostatische Harnröhre und das proximale Rektum, die Samenblase und Harnblasenwand oder den Uterus von Affen (~3 Allergan-Einheiten/kg) injiziert, ohne dass unerwünschte klinische Wirkungen auftraten.
In einer Studie über 9 Monate in Affen, in der wiederholte Injektionen in den Detrusor-Muskel untersucht wurden (4 Injektionen), wurde bei Dosierungen von 24 Einheiten/kg Ptosis beobachtet. Mortalität trat bei Dosierungen von 36 Einheiten/kg nach der ersten von vier Injektionen auf und bei einem Tier bei einer Dosierung von 24 Einheiten/kg nach der zweiten Injektion. Verminderte motorische Aktivität und erschwerte Atmung traten bei moribunden Tieren nach Dosierungen ≥24 Einheiten/kg auf. Bei einer Dosierung von 12 Einheiten/kg bei Affen wurden keine unerwünschten Wirkungen beobachtet, was einer um das 3-fache erhöhten Dosierung mit BOTOX® gegenüber der empfohlenen klinischen Dosis von 200 Allergan-Einheiten bei Harninkontinenz infolge neurogener Detrusorhyperaktivität (bei einem 50 kg schweren Patienten) entspricht.
Reproduktionstoxikologie
Trächtige Mäuse, Ratten und Kaninchen erhielten während der Organogenese intramuskuläre Injektionen von BOTOX®. Der NOAEL-Wert (No Observed Adverse Effect Level) in der Entwicklungsphase lag bei 4 bzw. 1 bzw. 0,125 Einheiten/kg Körpergewicht. Höhere Dosen führten zu verminderten fetalen Körpergewichten und/oder verzögerter Skelett-Ossifikation. Bei Kaninchen wurden Aborte beobachtet.
Sonstige Hinweise
Inkompatibilitäten
Da keine Verträglichkeitsstudien zu möglichen Inkompatibilitäten durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Ungeöffnete Durchstechflaschen: Im Kühlschrank bei 2-8 °C oder Gefrierschrank bei –5 °C oder darunter lagern.
Potenzstudien haben gezeigt, dass das Arzneimittel nach Rekonstitution bis zu 3 Tage bei 2-8 °C aufbewahrt werden kann. Da das Arzneimittel kein Konservierungsmittel enthält, ist die gebrauchsfertige Zubereitung aus mikrobiologischen Gründen unmittelbar nach Verdünnung zu verwenden, es sei denn, diese hat unter kontrollierten und validierten aseptischen Bedingungen stattgefunden. Das Arzneimittel sollte üblicherweise nicht länger als 24 Stunden bei 2-8 °C gelagert werden.
Hinweise für die Handhabung
Zubereitung der BOTOX®-Injektionslösung
Es wird empfohlen, die Rekonstitution der Lösung und die Vorbereitung der Spritze auf einem plastiküberzogenen Papiertuch vorzunehmen, um versehentlich vergossene BOTOX®-Lösung sofort wegwischen zu können. Vor Gebrauch muss BOTOX® mit steriler physiologischer Kochsalzlösung (ohne Konservierungsmittel) aufbereitet werden.
Die gewünschte Menge Lösungsmittel (siehe dazu die nachstehende Tabelle) wird in die Spritze aufgezogen. Die Oberfläche des Gummistopfens der Durchstechflasche soll mit einem Alkoholtupfer gereinigt werden, bevor man die Injektionsnadel durchsticht.
Verdünnungstabelle für Durchstechflaschen mit BOTOX® 100 Allergan-Einheiten für alle Indikationen (ohne Injektionen in den Detrusor-Muskel)
Menge an Lösungsmittel (Natriumchlorid 9 mg/ml (0,9%)), welches einer Durchstechflasche mit 100 Allergan-Einheiten zugesetzt wird: | 100 Allergan-Einheiten Durchstechflasche |
Resultierende Dosis (Allergan-Einheiten pro 0,1 ml) | |
0,5 ml 1,0 ml 2,0 ml 4,0 ml 8,0 ml | 20,0 E 10,0 E 5,0 E 2,5 E 1,25 E |
Überaktive Blase
Verdünnungsanleitung für eine Durchstechflasche mit BOTOX® 100 Allergan-Einheiten:
•Eine Durchstechflasche mit BOTOX® 100 Allergan-Einheiten mit 10 ml 0,9%iger Kochsalzlösung (ohne Konservierungsmittel) rekonstituieren und den Inhalt der Durchstechflasche behutsam mischen.
•Aus der Durchstechflasche 10 ml in einer 10 ml Spritze aufziehen.
Dies ergibt nun eine 10 ml Spritze mit insgesamt 100 Allergan-Einheiten rekonstituiertem BOTOX®. Nach Rekonstitution in der Spritze sofort verwenden. Nicht verwendete Kochsalzlösung verwerfen.
Harninkontinenz infolge neurogener Detrusorhyperaktivität
Verdünnungsanleitung für zwei Durchstechflaschen mit BOTOX® 100 Allergan-Einheiten:
•Zwei Durchstechflaschen mit BOTOX® 100 Allergan-Einheiten mit je 6 ml 0,9%iger Kochsalzlösung (ohne Konservierungsmittel) rekonstituieren und den Inhalt der Durchstechflaschen behutsam mischen.
•Aus jeder Durchstechflasche je 4 ml in zwei 10 ml Spritzen aufziehen.
•Die jeweils verbleibenden 2 ml aus den beiden Durchstechflaschen in eine dritte 10 ml Spritze aufziehen.
•Die Rekonstitution durch Zugabe von je 6 ml 0,9%iger Kochsalzlösung in jede der drei 10 ml Spritzen abschliessen und deren Inhalt behutsam mischen.
Dies ergibt nun drei 10 ml Spritzen mit insgesamt 200 Allergan-Einheiten rekonstituiertem BOTOX®.
Nach Rekonstitution in der Spritze sofort verwenden. Nicht verwendete Kochsalzlösung verwerfen
Eine niedrigere oder höhere BOTOX®-Konzentration kann durch Zugabe eines kleineren oder grösseren Lösungsmittelvolumens erreicht werden.
Da BOTOX® durch Blasenwerfen oder starkes Schütteln denaturiert werden kann, soll das Lösungsmittel vorsichtig in die Durchstechflasche eingegeben werden. Die Durchstechflasche darf nicht verwendet werden, wenn das Lösungsmittel nicht durch einen leichten Unterdruck eingezogen wird. Das aufbereitete BOTOX® ist eine klare farblose bis leicht gelbliche Lösung, die frei von sichtbaren Teilchen ist. Die zubereitete Lösung sollte auf Klarheit und Schwebeteilchen hin mit dem Auge überprüft werden.
Die rekonstituierte Lösung ist zum einmaligen Gebrauch bestimmt. Wenn BOTOX® zur Injektion in den Detrusor-Muskel in einer Spritze weiter verdünnt wird, sollte es sofort verbraucht werden. Verbleibende Restmengen der Toxinlösung sind fachgerecht zu verwerfen.
Entsorgung
Verschüttetes BOTOX®-Pulver sollte mit einem saugfähigen Tuch aufgewischt werden, welches mit verdünnter Hypochlorit-Lösung (0,5%) getränkt wurde. Verschüttete BOTOX®-Injektionslösung sollte mit einem trockenen, saugfähigen Tuch aufgewischt werden. Die verunreinigten Oberflächen sollten mit einem saugfähigen Tuch, welches mit verdünnter Hypochlorit-Lösung getränkt wurde, gereinigt und anschliessend trockengerieben werden.
Falls eine Durchstechflasche zerbrochen ist, müssen Glasscherben vorsichtig gesammelt werden, um Hautverletzungen zu vermeiden.
Ungebrauchte Durchstechflaschen sollten mit etwas Wasser aufbereitet und autoklaviert werden. Alle gebrauchten Durchstechflaschen, Spritzen, Kanülen, etc. sollten ebenfalls autoklaviert werden. Rückstände von Botulinumtoxin können auch mit verdünnter Hypochlorit-Lösung inaktiviert werden. Die Lösung sollte mindestens 5 Minuten einwirken. Andere kontaminierte Materialien wie Glasscherben, Handschuhe, etc. sollten in einem für spitze Gegenstände geeigneten Behälter entsorgt und der Müllverbrennung zugeführt werden.
Identifizierung des Arzneimittels
Wird ein authentisches BOTOX®-Produkt verwendet, werden horizontale Linien in Regenbogenfarben und der Name «Allergan» auf der Etikette sichtbar (Hologramm), und zwar beim Hin- und Herdrehen der Durchstechflasche in der Hand unter einer Schreibtischlampe oder Leuchtstoffröhre. Ist dies nicht der Fall und/oder ist das Sicherheitssiegel mit einem durchscheinenden silbernen Allergan-Logo an den oberen oder unteren Laschen der Faltschachtel nicht intakt, soll das Produkt nicht verwendet werden, und Allergan ist zu kontaktieren.
Zusätzlich können Aufkleber mit Chargennummer und Verfalldatum von der Etikette der BOTOX®-Durchstechflasche abgezogen und in die Patientenakte geklebt werden, um die Rückverfolgbarkeit der Charge zu erleichtern. Nach dem Abziehen des Aufklebers von der Etikette der Durchstechflasche wird «Verwendet/Utilisé» erscheinen.
Zulassungsnummer
52433 (Swissmedic)
Zulassungsinhaberin
Allergan AG, Zürich
Stand der Information
März 2020
Composizione
Principi attivi
Tossina botulinica di tipo A*.
* da Clostridium botulinum.
Sostanze ausiliarie
Albuminum humanum, 0.9 mg Natrii chloridum. Una fiala contiene 0,35 mg di sodio.
Forma farmaceutica e quantità di principio attivo per unità
Polvere per soluzione iniettabile.
100 unità Allergan per flacone.
Per uso intramuscolare e intradermale.
Le unità di tossina botulinica non sono comparabili tra un preparato all'altro.
Un'unità equivale alla LD50 nei topi dopo iniezione intraperitoneale in condizioni definite.
BOTOX® appare come un sottile deposito bianco sul fondo del flacone che può essere difficile da individuare.
Indicazioni/Possibilità d'impiego
BOTOX® è indicato per:
Patologie neurologiche:
•trattamento sintomatico del blefarospasmo, spasmo emifacciale, distonie focali associate, nonché per correggere lo strabismo nei pazienti di età superiore ai 12 anni.
•Trattamento sintomatico della distonia cervicale (Torticollis spasticus) negli adulti.
•Trattamento della spasticità focale, compresa la spasticità degli arti superiori associata a ictus cerebrale.
•Trattamento sintomatico dell'alluce dinamico (deformità dell'equino) senza retrazione e senza atrofia significativa, dovuto a spasticità in pazienti con paralisi cerebrale infantile di 2 anni di età e superiore.
Patologie della vescica:
•Trattamento della vescica iperattiva con i sintomi di incontinenza urinaria, urgenza di urinare e minzione frequente in pazienti adulti che non abbiano una risposta adeguata o siano intolleranti ai medicamenti anticolinergici.
•Trattamento dell'incontinenza urinaria in pazienti adulti affetti da iperattività neurogena del muscolo detrusore causata da patologie neurologiche (ad es. lesione del midollo spinale, sclerosi multipla).
Patologie della cute e degli annessi cutanei:
•Trattamento dell'iperidrosi ascellare primaria negli adulti.
Posologia/Impiego
Le unità di tossina botulinica non sono comparabili tra un preparato all'altro. I dosaggi in unità Allergan raccomandati sono diversi da quelli di altri preparati a base di tossina botulinica.
Per le «Indicazioni per la manipolazione» e lo «Smaltimento» dei flaconi, vedere «Altre indicazioni».
Per garantire la tracciabilità dei medicamenti biotecnologici, si raccomanda di prendere nota del nome commerciale e del numero di lotto in occasione di ogni trattamento.
Istruzioni posologiche speciali
Pazienti anziani
Non è richiesto alcun specifico aggiustamento della dose per l'uso negli anziani. La dose iniziale deve essere la più bassa dose raccomandata per la specifica indicazione. Per iniezioni ripetute si raccomanda di somministrare la dose efficace più bassa con l'intervallo più lungo clinicamente appropriato tra un trattamento e l'altro. I pazienti anziani con un'anamnesi rilevante e che assumono medicamenti concomitanti devono essere trattati con cautela (per ulteriori informazioni vedere «Effetti indesiderati» e «Proprietà/effetti»).
Bambini e adolescenti
Non esistono studi sulla sicurezza e sull'efficacia di BOTOX® nel trattamento del blefarospasmo, dello spasmo emifacciale e dello strabismo nei bambini di età inferiore ai 12 anni.
La sicurezza e l'efficacia di BOTOX® nel trattamento della distonia cervicale, della spasticità focale degli arti superiori associata ad ictus, dell'iperidrosi ascellare primaria e dell'incontinenza urinaria o della vescica iperattiva a seguito di iperattività neurogenica del detrusore nei bambini e negli adolescenti (di età inferiore ai 18 anni) non sono state dimostrate. Non sono disponibili dati.
Modo di somministrazione
BOTOX® deve essere somministrato solamente da medici appropriatamente qualificati e con esperienza nel trattamento e nell'uso delle attrezzature richieste. A seconda delle indicazioni, la diagnosi e la somministrazione di BOTOX® devono essere effettuate in collaborazione con un neurologo, un oculista, un pediatra, un chirurgo ortopedico pediatrico, un dermatologo o un urologo.
Non sono disponibili dati clinici sufficienti per determinare una dose ottimale generalmente accettata e il numero di siti di iniezione in ogni muscolo; pertanto, il trattamento di ciascun paziente deve essere stabilito individualmente dallo specialista del trattamento. I livelli ottimali per il dosaggio devono essere determinati mediante titolazione della dose.
PATOLOGIE NEUROLOGICHE
Blefarospasmo/spasmo emifacciale
Solo in pazienti di età superiore ai 12 anni.
Ago raccomandato: Ago sterile da 27-30 gauge/0,40-0,30 mm
Indicazioni per la
somministrazione: Non è necessario un controllo elettromiografico (EMG).
Dose raccomandata: La dose iniziale raccomandata è di 1,25 - 2,5 unità. L'iniezione viene effettuata nella regione mediale e laterale del muscolo orbicolare pretarsale della palpebra superiore e nella regione laterale del muscolo orbicolare pretarsale della palpebra inferiore. Possono essere iniettati ulteriori siti nell'area del sopracciglio, della regione laterale del muscolo orbicolare e nella parte superiore del volto, se gli spasmi in queste zone interferiscono sulla vista.
Dose massima totale: La dose iniziale per occhio non dovrebbe superare le 25 unità. Per il trattamento del blefarospasmo, la dose totale non deve superare le 100 unità ogni 12 settimane.
Informazioni aggiuntive: Evitare di effettuare iniezioni in prossimità del muscolo elevatore della palpebra superiore può ridurre la possibilità di indurre la manifestazione di ptosi. La diffusione della soluzione della tossina botulinica di tipo A nel muscolo obliquo inferiore può portare all'insorgenza di diplopia. Questo effetto indesiderato può essere minimizzato evitando l'iniezione mediale sulla palpebra inferiore. Le seguenti figure indicano i possibili siti di iniezione:

In generale, l'effetto iniziale delle iniezioni si osserva entro i primi tre giorni e raggiunge il massimo dopo 1-2 settimane dal trattamento. Ciascun trattamento dura circa 3 mesi, dopodiché la procedura può essere ripetuta secondo le necessità. Nelle sedute successive, la dose può essere aumentata fino al doppio se la risposta al trattamento iniziale è considerata insufficiente.
Tuttavia, sembra che siano stati riportati pochi benefici elevando la dose oltre le 5,0 unità per sito di iniezione. Normalmente non si ottiene ulteriore beneficio trattando più frequentemente di una volta ogni tre mesi.
Pazienti con spasmo emifacciale o disturbi del VII nervo cranico (N. facialis) devono essere trattati come per il blefarospasmo monolaterale, iniettando BOTOX® negli altri muscoli facciali interessati secondo le necessità.
Strabismo
Solo in pazienti di età superiore ai 12 anni.
Ago raccomandato: Ago sterile da 27 gauge/0,40 mm
Indicazioni per la
somministrazione: Preparare una soluzione di BOTOX® con 2,5 unità Allergan per 0,1 ml (vedere «Indicazioni per la manipolazione» e «Smaltimento» sotto «Altre indicazioni»).
BOTOX® è destinato all'iniezione nei muscoli extraoculari mediante guida elettromiografica.
Per preparare l'occhio all'iniezione del BOTOX®, devono essere somministrate alcune gocce di anestetico locale e una soluzione decongestionante oculare alcuni minuti prima dell'iniezione.
Dose raccomandata: Dosi più ridotte dovrebbero essere inizialmente somministrate per trattare le deviazioni leggere e dosi più alte per le deviazioni più pronunciate.
Si raccomandano le seguenti dosi iniziali in unità (la dose più bassa è prevista per angoli di deviazione più piccoli):
oPer i muscoli verticali e per lo strabismo orizzontale di meno di 20 diottrie prismatiche: 1,25 unità - 2,5 unità (0,05–0,10 ml) in ogni muscolo.
oPer lo strabismo orizzontale di 20-50 diottrie prismatiche: 2,5 unità - 5,0 unità (0,10–0,20 ml) in ogni muscolo.
oPer la paralisi del nervo oculomotore esterno con durata pari a un mese o superiore: 1,25 unità - 2,5 unità nel muscolo retto mediale.
Dose massima totale: La dose massima raccomandata come singola iniezione in un muscolo oculare è di 25 unità.
Il volume di iniezione consigliato di BOTOX® somministrato per il trattamento dello strabismo è compreso tra 0,05 ml - 0,15 ml per muscolo.
Informazioni aggiuntive: Le dosi iniziali di BOTOX® diluito portano solitamente alla paralisi dei muscoli iniettati uno o due giorni dopo l'iniezione. L'intensità della paralisi aumenta nella prima settimana. La paralisi dura per 2-6 settimane e poi diminuisce gradualmente per un periodo di circa la stessa durata. Sono rare le sovra correzioni che durano più di 6 mesi.
Circa la metà dei pazienti trattati richiede dosi aggiuntive a causa di una paralisi inadeguata del muscolo dopo la dose iniziale o a causa di fattori meccanici come pronunciate anomalie o restrizioni o a causa della mancanza di fusione binoculare motoria volta a stabilizzare l'aggiustamento.
Dosi di follow-up per strabismo residuo o ricorrente:
Si raccomanda di riesaminare i pazienti 7-14 giorni dopo ogni iniezione per valutare l'effetto della dose. Le dosi di follow-up in pazienti con sufficiente paralisi del muscolo bersaglio devono essere pari alla dose iniziale.
Le dosi di follow-up in pazienti con paralisi incompleta del muscolo bersaglio possono essere fino al doppio della dose precedentemente somministrata. Le iniezioni successive non devono essere somministrate fino a quando gli effetti della dose precedente non si sono attenuati, come dimostra la funzione ripristinata dei muscoli iniettati e adiacenti.
Distonia cervicale
Solo per adulti.
Ago raccomandato: Ago di dimensioni adeguate (generalmente da 25-30 gauge/0,50 - 0,30 mm)
Indicazioni per la
somministrazione: In studi clinici il trattamento della distonia cervicale è consistito tipicamente in un'iniezione di BOTOX® nei muscoli sternocleidomastoideo, elevatore della scapola, scaleno, splenio della testa, semispinale, lunghissimo e/o trapezio. Questo elenco non è esaustivo poiché tutti i muscoli responsabili del controllo della posizione della testa possono essere coinvolti e necessitare pertanto di trattamento.
Gli effetti indesiderati dose-dipendenti sono più comuni nelle donne, quindi la scelta della dose deve tenere in considerazione la massa muscolare e il grado di ipertrofia o atrofia del muscolo trattato. I modelli di attivazione del muscolo possono cambiare spontaneamente nella distonia cervicale senza un cambiamento nella manifestazione clinica della distonia stessa.
Se il muscolo interessato non può essere chiaramente isolato, l'iniezione deve essere eseguita sotto controllo EMG.
Dose raccomandata: Non devono essere iniettate più di 200 unità complessive nel primo ciclo di terapia; nei cicli successivi è possibile apportare opportuni aggiustamenti al dosaggio sulla base della risposta iniziale.
Nei primi studi clinici controllati per determinare la sicurezza e l'efficacia del prodotto per il trattamento della distonia cervicale, le dosi di BOTOX® ricostituito sono state comprese fra 140 e 280 unità. In studi più recenti le dosi somministrate sono state comprese fra 95 e 360 unità (in media circa 240 unità).
Il dosaggio iniziale in un paziente mai trattato deve consistere nella minima dose efficace. Non devono essere somministrate più di 50 unità per ciascun sito di iniezione. Non devono essere iniettate più di 100 unità nel muscolo sternocleidomastoideo. Per ridurre al minimo l'incidenza di disfagia, lo sternocleidomastoideo non deve essere iniettato bilateralmente
Dose massima totale: Non deve essere superata la dose totale di 300 unità per singola seduta. Il numero ottimale di siti d'iniezione dipende dalla dimensione del muscolo. Intervalli nel trattamento di durata inferiore a 10 settimane sono sconsigliati.
Informazioni aggiuntive: Il miglioramento clinico si osserva generalmente entro le prime due settimane con il massimo beneficio clinico circa 6 settimane dopo il trattamento. La durata dell'effetto benefico negli studi clinici ha manifestato una sostanziale variabilità (da 2 a 33 settimane) con una durata tipica di circa 12 settimane.
Spasticità focale degli arti superiori associata ad ictus cerebrale
Solo per adulti.
Ago raccomandato: Ago sterile da 25, 27 o 30 gauge per i muscoli superficiali e ago da 22 gauge per i muscoli più profondi
Indicazioni per la
somministrazione: Per la localizzazione dei muscoli interessati può essere utile avvalersi delle tecniche di guida elettromiografica o della stimolazione nervosa. Siti multipli di iniezione possono consentire un contatto più uniforme del BOTOX® con le aree di innervazione del muscolo e sono utili in modo particolare nel caso di muscoli più grandi.
Dose raccomandata: La corretta posologia deve essere stabilita individualmente. La dose e il numero di siti di iniezione devono essere adattati alle necessità individuali in base alla dimensione, al numero ed alla localizzazione dei muscoli coinvolti, all'eventuale debolezza locale del muscolo ed alla risposta del paziente ad un precedente trattamento.
Dosi più elevate possono portare ad una riduzione più duratura del tono muscolare. Il grado di spasticità muscolare e i gruppi muscolari coinvolti possono cambiare nel tempo e si può considerare una modifica del dosaggio di BOTOX® e dei muscoli da iniettare.
Si consigliano i seguenti dosaggi iniziali e siti di iniezione:
Muscolo | Posologia totale; numero di siti di iniezione |
Bicipite brachiale | 50-200 unità; fino a 4 |
Flessore profondo delle dita | 7,5-30 unità; 1-2 |
Flessore superficiale delle dita | 7,5-30 unità; 1-2 |
Flessore radiale del carpo | 15-60 unità; 1-2 |
Flessore ulnare del carpo | 10-40 unità; 1-2 |
Dose massima totale: Negli studi clinici, un dosaggio di 360 unità non è stato superato negli adulti. La dose totale è stata divisa tra i muscoli selezionati (di solito i muscoli flessori del gomito, del polso e delle dita). In generale, la dose non dovrebbe superare le 6 unità/kg di peso corporeo.
Informazioni aggiuntive: Di norma, miglioramenti del tono muscolare sono stati osservati entro 2 settimane e l'effetto maggiore è stato generalmente rilevato entro 4-6 settimane. Le iniezioni ripetute devono essere effettuate solo dopo che l'effetto clinico dell'iniezione precedente si è attenuato, ma non più frequentemente di ogni due mesi.
Paralisi cerebrale infantile - Deformità dinamica del piede a punta
Bambini dai 2 anni in su.
Ago raccomandato: Ago sterile da 23-26 gauge/0,60-0,45 mm
Indicazioni per la
somministrazione: Somministrare come dose frazionata mediante singole iniezioni nelle sommità mediale e laterale del muscolo gastrocnemio interessato.
Il trattamento deve essere iniziato con una dose più bassa nei pazienti che necessitano di iniezioni simultanee in altri gruppi muscolari o se si sospetta che la dose indicata possa portare ad un eccessivo indebolimento dei muscoli trattati, per esempio nei pazienti con muscoli piccoli.
Dose raccomandata: Emiplegia: la dose iniziale raccomandata è di 4 unità/kg di peso corporeo nella gamba interessata.
Diplegia: la dose iniziale raccomandata è di 6 unità/kg di peso corporeo suddivisa tra le due gambe.
Dose massima totale: 200 unità.
Informazioni aggiuntive: Il miglioramento clinico generalmente si osserva entro le prime due settimane dopo l'iniezione. Devono essere somministrate ulteriori dosi quando l'effetto clinico della precedente iniezione diminuisce, ma non più frequentemente di una volta ogni tre mesi.
È possibile adattare il regime di dosaggio in modo da ottenere un intervallo di almeno 6 mesi fra cicli successivi di trattamento.
PATOLOGIE DELLA VESCICA
Iniezione nel muscolo detrusore
Solo per adulti.
Indicazioni per la
somministrazione: Al momento del trattamento, i pazienti non devono presentare alcuna infezione delle vie urinarie.
È necessario somministrare antibiotici a scopo di profilassi 1-3 giorni prima del trattamento, il giorno del trattamento e 1-3 giorni dopo il trattamento.
Si raccomanda che i pazienti sospendano la terapia antiaggregante almeno 3 giorni prima della procedura di iniezione. I pazienti in terapia anticoagulante devono essere opportunamente gestiti per ridurre il rischio di emorragie.
Vescica iperattiva
Ago raccomandato: Deve essere utilizzato un cistoscopio rigido o flessibile. Per rimuovere eventuale aria presente, l'ago per le iniezioni deve essere riempito con circa 1 ml di BOTOX® ricostituito (a seconda della lunghezza dell'ago) prima di iniziare le iniezioni.
Indicazioni per la
somministrazione: Prima dell'iniezione è possibile eseguire un'instillazione intravescicale di anestetico locale diluito (con o senza sedazione), secondo la prassi locale della struttura sanitaria operante. Se si esegue un'instillazione locale di anestetico, la vescica deve essere svuotata e lavata con soluzione fisiologica sterile prima dei successivi passaggi della procedura di iniezione.
Il BOTOX® ricostituito (100 unità Allergan/10 ml) viene iniettato nel muscolo detrusore tramite un cistoscopio rigido o flessibile, evitando il trigono. Instillare nella vescica sufficiente soluzione fisiologica al fine di ottenere un'adeguata visualizzazione per le iniezioni, evitando tuttavia un'eccessiva distensione.
Inserire l'ago nel muscolo detrusore per circa 2 mm ed eseguire 20 iniezioni da 0,5 ml ciascuna (volume totale 10 ml), distanti tra loro circa 1 cm (vedere figura sotto). Per l'iniezione finale, iniettare circa 1 ml di soluzione fisiologica normale sterile in modo da somministrare la dose completa. Una volta eseguite le iniezioni, la soluzione fisiologica utilizzata per la visualizzazione della parete vescicale non deve essere drenata così che il paziente possa dimostrare la propria capacità di svuotamento prima di lasciare la clinica. Tenere in osservazione il paziente per almeno 30 minuti dopo le iniezioni e finché non vi sia stato uno svuotamento spontaneo.

Dose raccomandata: La dose raccomandata è 100 unità Allergan di BOTOX®, ovvero iniezioni da 0,5 ml (5 unità Allergan) in 20 siti del muscolo detrusore.
Informazioni aggiuntive: Il miglioramento clinico può avvenire entro 2 settimane. Valutare la possibilità di sottoporre i pazienti a un nuovo ciclo di trattamento in caso di riduzione dell'effetto clinico del trattamento precedente (la durata mediana negli studi clinici di Fase III è stata di 166 giorni [~24 settimane]), ma non prima che siano trascorsi 3 mesi dalle precedenti iniezioni nella vescica.
Incontinenza urinaria dovuta a iperattività neurogena del detrusore
Ago raccomandato: Deve essere utilizzato un cistoscopio rigido o flessibile. Per rimuovere eventuale aria presente, l'ago per le iniezioni deve essere riempito con circa 1 ml di soluzione (a seconda della lunghezza dell'ago) prima di iniziare le iniezioni.
Indicazioni per la
somministrazione: Prima dell'iniezione è possibile eseguire un'instillazione intravescicale di anestetico diluito (con o senza sedazione) o procedere ad un'anestesia generale, secondo la prassi locale della struttura sanitaria operante. Se si esegue un'instillazione locale di anestetico, la vescica deve essere svuotata e lavata con soluzione fisiologica sterile prima dei successivi passaggi della procedura di iniezione.
Il BOTOX® ricostituito (200 unità Allergan/30 ml) viene iniettato nel muscolo detrusore tramite un cistoscopio rigido o flessibile, evitando il trigono. Instillare nella vescica sufficiente soluzione fisiologica al fine di ottenere un'adeguata visualizzazione per le iniezioni, evitando tuttavia un'eccessiva distensione.
Inserire l'ago nel muscolo detrusore per circa 2 mm ed eseguire 30 iniezioni da 1 ml ciascuna (volume totale 30 ml) distanti tra loro circa 1 cm (vedere la figura sopra). Per l'iniezione finale, iniettare circa 1 ml di soluzione fisiologica normale sterile in modo da somministrare la dose completa. Una volta eseguite le iniezioni, procedere al drenaggio della soluzione fisiologica utilizzata per la visualizzazione della parete vescicale. Tenere in osservazione il paziente per almeno 30 minuti dopo l'iniezione.
Dose raccomandata: La dose raccomandata è 200 unità Allergan di BOTOX®, ovvero iniezioni da 1 ml (~6,7 unità Allergan) in 30 siti del muscolo detrusore.
Informazioni aggiuntive: Generalmente si osserva un miglioramento clinico entro 2 settimane. Valutare la possibilità di sottoporre i pazienti a un nuovo ciclo di trattamento in caso di riduzione dell'effetto clinico del trattamento precedente (la durata mediana negli studi clinici di Fase III è stata di 256-295 giorni (~36-42 settimane) per BOTOX® (200 unità Allergan)), ma non prima che siano trascorsi 3 mesi dalle precedenti iniezioni nella vescica.
PATOLOGIE DELLA CUTE E DEGLI ANNESSI CUTANEI
Iperidrosi primaria delle ascelle
Solo per adulti
Ago raccomandato: Ago sterile da 30 gauge
Indicazioni per la
somministrazione: L'area iperidrotica può essere definita utilizzando tecniche standard di colorazione, come ad esempio il test di Minor amido-iodato.
Dose raccomandata: 50 unità di BOTOX® (100 unità Allergan/4,0 ml) vengono iniettate per via intradermale, distribuite equamente in siti multipli approssimativamente 1-2 cm l'uno dall'altro, nell'area iperidrotica di ciascuna ascella.
Dose massima totale: Poiché non sono stati studiati dosaggi diversi da 50 unità per ascella, questi non possono essere consigliati. Le iniezioni non devono essere ripetute più spesso di ogni 16 settimane.
Informazioni aggiuntive: Di norma, un miglioramento della condizione clinica si verifica entro la prima settimana dopo l'iniezione. Le iniezioni ripetute devono essere effettuate quando l'effetto clinico della precedente iniezione diminuisce e quando il medico curante lo ritiene necessario. L'esperienza dimostra che ogni trattamento dura 4-7 mesi.
TUTTE LE INDICAZIONI
Nel caso di fallimento del trattamento dopo il primo ciclo di terapia, ad esempio di assenza, dopo un mese dall'iniezione, di un significativo miglioramento clinico, è necessario adottare le seguenti misure:
•Verifica clinica, che può comprendere un esame elettromiografico in contesto specialistico, dell'azione della tossina sui muscoli iniettati.
•Analisi delle cause del fallimento, ad es. una cattiva scelta dei muscoli da iniettare, una dose insufficiente, una tecnica d'iniezione errata, la comparsa di una contrattura fissa, muscoli antagonisti troppo deboli, la formazione di anticorpi neutralizzanti la tossina.
•Rivalutazione dell'adeguatezza del trattamento con tossina botulinica di tipo A.
In assenza di effetti indesiderati secondari al primo ciclo di trattamento, istituire un secondo ciclo di trattamento nel modo seguente:
1.) Aggiustamento della dose, tenendo in considerazione l'analisi del precedente fallimento della terapia,
2.) Fare uso di tecnica EMG,
3.) Osservare un intervallo di 3 mesi fra il primo e il ciclo di trattamento ripetuto.
Nel caso di fallimento della terapia o della diminuzione dell'effetto dopo la ripetizione delle iniezioni, devono essere impiegati metodi di terapia alternativi.
Controindicazioni
•Ipersensibilità nota alla tossina botulinica di tipo A o ad uno degli eccipienti a seconda della composizione.
•Infezione nel sito o nei siti di iniezione previsti.
Le iniezioni di BOTOX® nel muscolo detrusore sono ugualmente controindicate in:
•Pazienti che presentano un'infezione delle vie urinarie al momento del trattamento.
•Pazienti con ritenzione urinaria acuta al momento del trattamento, non sottoposti abitualmente a cateterizzazione.
•Pazienti che non vogliono e/o non sono in grado di iniziare una cateterizzazione post-trattamento, se necessaria.
Avvertenze e misure precauzionali
Non devono essere superate le dosi e le frequenze raccomandate per le somministrazioni di BOTOX® a causa del rischio potenziale di sovradosaggio, esagerata debolezza muscolare, diffusione della tossina a distanza dal sito di iniezione e formazione di anticorpi neutralizzanti. Il dosaggio iniziale, nel trattamento di pazienti naїve, deve iniziare con la più bassa dose raccomandata per la specifica indicazione.
I medici e i pazienti devono essere informati degli effetti indesiderati che possono manifestarsi, nonostante le precedenti iniezioni siano state ben tollerate. Prestare pertanto particolare attenzione in ogni trattamento.
Sono stati riportati effetti indesiderati dovuti alla diffusione della tossina a distanza dal sito di iniezione (vedere «Effetti indesiderati»), che hanno causato in alcuni casi il decesso, talvolta associato a disfagia, polmonite e/o ad una astenia significativa. I sintomi sono correlati al meccanismo di azione della tossina botulinica e sono stati riportati da ore a settimane dopo l'iniezione. Il rischio di sintomi è probabilmente maggiore in pazienti con condizioni di base o comorbilità che possono predisporli a questi sintomi, inclusi i bambini e gli adulti trattati per spasticità e che sono stati trattati con alte dosi.
Il medico curante deve avere familiarità con la tecnica elettromiografica quando inietta il BOTOX® in caso di strabismo. L'effetto di BOTOX® sulle deviazioni superiori a 50 diottrie prismatiche nello strabismo restrittivo, nella sindrome di Duane e nello strabismo secondario derivanti da precedenti sovracorrezioni chirurgiche dell'antagonista muscolare non è stato stabilito. Possono essere eventualmente necessari diversi cicli di trattamento.
Pazienti trattati con dosi terapeutiche possono anche manifestare esagerata debolezza muscolare.
Occorre prendere in considerazione le implicazioni del rischio/beneficio per il singolo paziente prima di iniziare il trattamento con BOTOX®.
La disfagia è stata segnalata anche dopo iniezioni che non sono state somministrate nei muscoli cervicali (per ulteriori informazioni si veda la sezione «Avvertenze secondo le indicazioni», «Distonia cervicale»).
BOTOX® deve essere utilizzato con particolare prudenza e sotto attenta supervisione in pazienti che presentano evidenza clinica o subclinica di difetto della trasmissione neuromuscolare, ad esempio, miastenia grave o sindrome di Lambert-Eaton, in pazienti con malattie del motoneurone periferico (ad esempio sclerosi laterale amiotrofica o neuropatia motoria) e in pazienti con disordini neurologici di base. Questi pazienti possono presentare un'aumentata sensibilità ad agenti come BOTOX®, anche a dosi terapeutiche, che può determinare eccessiva debolezza muscolare ed un aumentato rischio di reazioni sistemiche clinicamente significative, incluse disfagia grave e compromissione respiratoria. Il prodotto a base di tossina botulinica deve essere utilizzato in questi pazienti sotto la supervisione dello specialista e deve essere utilizzato solo se il beneficio del trattamento è considerato superiore al rischio. I pazienti con una storia di disfagia e polmonite da aspirazione devono essere trattati con estrema cautela.
I pazienti e il personale infermieristico devono essere avvisati di richiedere immediato soccorso nel caso di comparsa di disturbi della deglutizione, dell'eloquio o della respirazione.
Ai pazienti che sono rimasti finora immobili si consiglia di riprendere l'attività fisica in modo graduale e con cautela.
Prima di somministrare BOTOX® è necessario essere a conoscenza della relativa anatomia normale dell'area interessata e di qualsiasi situazione anatomica anormale dovuta a precedenti interventi chirurgici. Inoltre, devono essere evitate iniezioni in strutture anatomiche vulnerabili.
È stato riportato pneumotorace associato alla procedura di iniezione dopo la somministrazione di BOTOX® in prossimità del torace. Prestare attenzione quando si inietta in prossimità dei polmoni (in particolare nella zona apicale) o di altre aree anatomiche deboli.
Effetti indesiderati gravi anche con esito fatale sono stati riportati in pazienti che avevano ricevuto iniezioni fuori indicazione di BOTOX® direttamente nelle ghiandole salivari, nella regione oro-linguale-faringea, nell'esofago e nello stomaco. Alcuni pazienti presentavano una preesistente disfagia o significativa debilitazione.
Raramente sono state riportate reazioni gravi e/o immediate di ipersensibilità, inclusi anafilassi, malattie sieriche, orticaria, edema dei tessuti molli e dispnea. Alcune di queste reazioni sono state riportate a seguito dell'uso di BOTOX® in monoterapia o associato ad altri prodotti che risultano causare simili reazioni. Se si verificano tali reazioni, evitare di trattare il paziente con una nuova iniezione di BOTOX® ed iniziare immediatamente un'appropriata terapia farmacologica, ad esempio somministrando adrenalina. È stato riportato un caso di anafilassi riguardante un paziente deceduto dopo iniezione di BOTOX® diluito in modo inappropriato con 5 ml di lidocaina 1%.
Come con ogni iniezione, si possono verificare danni procedura-relativi. Un'iniezione può determinare infezione localizzata, dolore, infiammazione, parestesie, ipoestesie, indolenzimento, tumefazione, eritema e/o sanguinamento/ecchimosi. Il dolore relativo all'uso dell'ago e/o l'ansietà può determinare una risposta vasovagale, come sincope, ipotensione, ecc.
È necessario usare cautela quando si somministra BOTOX® in presenza di un'infiammazione in corrispondenza del(i) sito(i) prescelto(i) per l'iniezione o quando si osserva un'eccessiva debolezza o atrofia nel muscolo bersaglio. Adottare cautela anche quando si usa BOTOX® per il trattamento di pazienti con malattie neuropatiche motorie periferiche (come ad esempio, sclerosi amiotrofica laterale o neuropatia motoria).
Dopo somministrazione di BOTOX® sono stati riportati casi di effetti indesiderati che interessavano l'apparato cardiovascolare, fra cui aritmie e infarto del miocardio, alcuni dei quali con esito fatale. Alcuni di questi pazienti presentavano dei fattori di rischio, fra cui malattie cardiovascolari.
Sono stati riportati casi di crisi convulsive iniziali o ricorrenti, specialmente in pazienti predisposti a questi tipi di reazioni. Non è stata stabilita l'esatta relazione di questi eventi con l'iniezione di tossina botulinica. Nei bambini tali reazioni sono state riportate prevalentemente in soggetti affetti da paralisi cerebrale, trattati per la spasticità.
La formazione di anticorpi neutralizzanti la tossina botulinica di tipo A può ridurre l'efficacia del trattamento con BOTOX® a causa dell'inattivazione dell'attività biologica della tossina. I risultati di alcuni studi suggeriscono che l'uso di BOTOX® ad intervalli più frequenti o a dosi più elevate possa determinare una più elevata incidenza di formazione di anticorpi. Se necessario, il potenziale rischio di formazione di anticorpi può essere minimizzato mediante iniezione della dose efficace più bassa somministrata con l'intervallo più lungo clinicamente appropriato, tra un trattamento e l'altro.
Fluttuazioni cliniche durante l'uso ripetuto di BOTOX® (come con tutte le tossine botuliniche) possono essere dovute a differenti procedure di ricostituzione del flacone, ad intervalli di iniezione, ai muscoli iniettati e ad un'attività della tossina leggermente variabile, a causa del metodo di test biologico utilizzato.
Dopo il contatto della pelle con BOTOX®, l'area cutanea interessata deve essere prima pulita con una soluzione diluita di ipoclorito e poi sciacquata a fondo sotto acqua corrente. In caso di lesione da ago, anche l'area cutanea interessata deve essere immediatamente pulita e il paziente deve essere monitorato come raccomandato nel capitolo «Sovradosaggio». In caso di contatto oculare con BOTOX®, l'occhio interessato deve essere sciacquato accuratamente sotto acqua corrente o con una soluzione adeguata.
Se si sospetta una contaminazione accidentale (ad es. contatto con la pelle o lesioni da ago), la zona della pelle interessata deve essere pulita immediatamente. Il paziente deve restare sotto controllo medico come raccomandato nel capitolo «Sovradosaggio».
Somministrazione in bambini e adolescenti
Non sono state stabilite la sicurezza e l'efficacia di BOTOX® in indicazioni diverse da quelle descritte nel capitolo «Indicazioni/possibilità di impiego per bambini e adolescenti. Molto raramente sono state riportate segnalazioni post marketing relative ad una possibile diffusione a distanza della tossina in bambini e adolescenti con comorbilità, principalmente con paralisi cerebrale infantile. In generale la dose utilizzata in questi casi era in eccesso rispetto a quella raccomandata (vedi «Effetti indesiderati»).
Sono state riportate rare segnalazioni spontanee di decesso a volte associate a polmonite da aspirazione in bambini con grave paralisi cerebrale dopo trattamento con tossina botulinica, inclusi casi di utilizzo fuori indicazioni (per esempio l'area del collo). Deve essere prestata estrema cautela quando si trattano pazienti pediatrici che presentano una significativa debolezza neurologica, disfagia o hanno avuto di recente una polmonite da aspirazione o una malattia polmonare. Il trattamento in pazienti con un precario stato di salute di base deve essere effettuato solo se il potenziale beneficio per il paziente è considerato superiore rispetto ai rischi.
Questo medicinale contiene meno di 1 mmol di sodio (23 mg) per unità di dosaggio, cioè è praticamente «senza sodio».
Avvertenze secondo le indicazioni
PATOLOGIE NEUROLOGICHE
Blefarospasmo
La riduzione dell'ammiccamento causata dall'iniezione di tossina botulinica nel muscolo orbicolare può portare ad affaticamento corneale, persistente difetto epiteliale e ulcerazione corneale, specialmente in pazienti con disordini del VII nervo cranico. È opportuno effettuare un esame accurato della sensibilità corneale in occhi precedentemente operati, evitare iniezioni nell'area della palpebra inferiore per prevenire ectropion ed adottare un efficace trattamento preventivo di qualsiasi difetto epiteliale. Ciò può richiedere l'uso di lacrime artificiali, unguenti, lenti a contatto terapeutiche morbide, chiusura dell'occhio tramite bendaggio o altri mezzi.
È possibile riscontrare ecchimosi nei tessuti molli della palpebra; questa può essere minimizzata comprimendo delicatamente il sito di iniezione immediatamente dopo l'iniezione stessa.
A causa dell'attività anticolinergica della tossina botulinica, è necessario adottare particolare cautela nel trattamento di pazienti a rischio di glaucoma ad angolo chiuso, inclusi pazienti con angolo anatomicamente stretto.
Strabismo
BOTOX® è inefficace nello strabismo paralitico cronico, tranne che per ridurre la contrattura dell'antagonista muscolare in relazione alla correzione chirurgica. Quando si utilizza BOTOX® per il trattamento dello strabismo, possono verificarsi sanguinamento retrobulbare e perforazioni del bulbo.
Distonia cervicale
Nella distonia cervicale, le iniezioni di BOTOX® possono causare una disfagia da lieve a grave. Conseguentemente alla disfagia esiste la possibilità di aspirazione e dispnea, e raramente la necessità di ricorrere all'alimentazione mediante sonda. In casi rari è stata riportata disfagia seguita da polmonite da aspirazione e morte. La disfagia può persistere fino a 2-3 settimane dopo l'iniezione, ma è stata descritta durare anche fino a 5 mesi dopo l'iniezione.
La limitazione della dose iniettata nel muscolo sternocleidomastoideo ad una dose inferiore a 100 unità può ridurre l'insorgenza di disfagia. I pazienti con una massa muscolare del collo di dimensione minore o i pazienti che ricevono iniezioni bilaterali nel muscolo sternocleidomastoideo sono stati valutati come a maggiore rischio di disfagia. La disfagia è da attribuirsi alla diffusione della tossina nella muscolatura dell'esofago. I pazienti con distonia cervicale devono essere istruiti sui possibili effetti indesiderati della disfagia.
Le iniezioni nel muscolo elevatore della scapola possono essere associate ad un maggiore rischio di infezione respiratoria delle vie aeree superiori e disfagia.
La disfagia può contribuire a diminuire l'assunzione di cibo ed acqua determinando perdita di peso e disidratazione. I pazienti con disfagia subclinica possono presentare un maggiore rischio di disfagia grave dopo iniezione di BOTOX®.
Spasticità focale associata a paralisi cerebrale infantile e spasticità focale degli arti superiori negli adulti causata da ictus
BOTOX® è stato studiato nel trattamento della spasticità focale solamente in associazione con altri regimi di cura standard, e non è da intendersi quale sostituto per tali modalità di terapia.
È improbabile che BOTOX® risulti efficace per migliorare l'arco di movimento in un'articolazione affetta da contrattura patologica persistente.
Dopo la commercializzazione sono state riportate segnalazioni di decesso (a volte associate a polmonite da aspirazione) e di possibile diffusione a distanza di tossina in pazienti pediatrici con comorbilità, in prevalenza con paralisi cerebrale, dopo il trattamento con tossina botulinica. Vedere le avvertenze relative in «Somministrazione nei bambini e negli adolescenti» al capitolo «Avvertenze e misure precauzionali». In questi casi non è stata stabilita l'esatta relazione di questi eventi con l'iniezione di BOTOX®.
PATOLOGIE DELLA VESCICA
Iniezioni nel muscolo detrusore
Il medico deve utilizzare la necessaria cautela durante l'esecuzione della cistoscopia.
Nei pazienti non sottoposti a cateterizzazione, deve essere valutato il volume residuo urinario post-minzionale entro 2 settimane dal trattamento e periodicamente secondo il parere del medico fino a 12 settimane. Avvertire i pazienti di rivolgersi al medico curante qualora manifestino difficoltà durante la minzione, poiché può rendersi necessaria una cateterizzazione.
Vescica iperattiva
BOTOX® deve essere usato con cautela nei pazienti con ostruzioni nella zona del collo vescicale (ad es. ostruzione del tratto urinario nei pazienti con iperplasia prostatica).
Incontinenza urinaria da iperattività detrusoriale neurogena
Può verificarsi disreflessia autonomica associata alla procedura. In questo caso può essere necessario effettuare un controllo immediato del paziente trattato.
PATOLOGIE DELLA CUTE E DEGLI ANNESSI CUTANEI
Iperidrosi primaria delle ascelle
Le cause dell'iperidrosi secondaria (ad es. ipertiroidismo, feocromocitoma) devono essere escluse prima del trattamento, al fine di evitare trattamenti sintomatici dell'iperidrosi senza la diagnosi e/o il trattamento della patologia di base.
Interazioni
In teoria, l'effetto della tossina botulinica può essere potenziato dalla somministrazione concomitante di antibiotici aminoglicosidici, dalla spectinomicina o da altri medicamenti che interferiscono con la trasmissione neuromuscolare (ad es. miorilassanti).
Non è noto l'effetto della somministrazione concomitante o entro alcuni mesi di differenti sierotipi di neurotossina botulinica. La somministrazione di un'altra tossina botulinica effettuata prima che si siano esauriti gli effetti di una precedente somministrazione di tossina botulinica può causare un peggioramento della debolezza neuromuscolare.
I miorilassanti devono essere usati con cautela.
Non sono stati condotti studi di interazione. Non sono state riportate interazioni di importanza clinica.
Bambini e adolescenti
Non sono stati effettuati studi di interazione nei bambini e negli adolescenti.
Gravidanza/Allattamento
Gravidanza
Non vi sono dati adeguati sull'uso della tossina botulinica di tipo A nelle donne in gravidanza. Gli studi condotti sugli animali hanno dimostrato tossicità per la riproduzione (vedere il capitolo «Dati preclinici»).
Il rischio potenziale per la specie umana non è noto. BOTOX® non deve perciò essere usato in gravidanza e nelle donne in età fertile che non fanno uso di contraccettivi se non in caso di evidente necessità. Se una paziente rimane incinta durante il trattamento, deve essere messa al corrente dei rischi potenziali come l'aborto spontaneo o le malformazioni fetali.
Allattamento
Non è noto se BOTOX® passi nel latte materno. L'uso di BOTOX® durante l'allattamento è sconsigliato.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono stati effettuati studi riguardo agli effetti sulla capacità di guidare veicoli e utilizzare macchine. Tuttavia, BOTOX® può provocare astenia, debolezza muscolare, vertigini e disturbi visivi e potrebbe quindi incidere sulla capacità di partecipare attivamente alla circolazione stradale e usare macchine.
Effetti indesiderati
Generale
In studi clinici controllati, effetti indesiderati ritenuti dagli sperimentatori essere correlati a BOTOX® sono stati riferiti nel 35% dei pazienti affetti da blefarospasmo, nel 28% dei pazienti affetti da distonia cervicale, nel 17% dei pazienti affetti da paralisi cerebrale infantile (piede equino), nell'11% dei pazienti affetti da iperidrosi ascellare primaria e nel 16% dei pazienti affetti da spasticità focale degli arti superiori associata a ictus cerebrale. Negli studi clinici sulla vescica iperattiva, l'incidenza è stata del 26% con il primo trattamento e del 22% con un secondo trattamento. Negli studi clinici sull'incontinenza urinaria dovuta all'iperattività neurogenica del detrusore, l'incidenza è stata del 32% con il primo trattamento e si è ridotta al 18% con un secondo trattamento.
In generale, le reazioni avverse si verificano entro i primi giorni dopo l'iniezione e, sebbene generalmente transitorie, possono avere una durata di diversi mesi o, in rari casi, maggiore.
La debolezza muscolare localizzata rappresenta l'effetto farmacologico atteso della tossina botulinica nel tessuto muscolare; tuttavia, è stata riportata debolezza dei muscoli adiacenti e/o dei muscoli distanti dal sito di iniezione.
Come è da attendersi per qualsiasi procedura di iniezione, dolore localizzato, infiammazione, parestesie, ipoestesie, indolenzimento, gonfiore/edema, eritema, infezione localizzata, sanguinamento e/o ecchimosi sono state associate all'area del sito di iniezione. Il dolore e/o ansia da ago può determinare una risposta vasovagale, incluse ipotensione transitoria sintomatica e sincope. Sono state riportate anche febbre e sindrome influenzale dopo iniezioni di tossina botulinica.
Effetti indesiderati – sulla base della loro frequenza
Di seguito si forniscono informazioni sulla frequenza degli effetti indesiderati documentati negli studi clinici per le singole aree di applicazione.
Le indicazioni relative alla frequenza si basano sulle seguenti definizioni: molto comune (≥1/10), comune (<1/10, ≥1/100), non comune (<1/100, ≥1/1000), raro (<1/1000, ≥1/10'000), molto raro (<1/10'000).
PATOLOGIE NEUROLOGICHE
Blefarospasmo/Spasmo emifacciale
Patologie del sistema nervoso
Non comune: Vertigini, paresi facciale, paralisi facciale.
Patologie dell'occhio
Molto comune: Ptosi palpebrale superiore (11%).
Comune: Cheratite puntata, lagoftalmo, occhio secco, fotofobia, irritazione oculare, aumento della lacrimazione.
Non comune: Cheratite, ectropion, diplopia, entropion, disturbi visivi, offuscamento della vista.
Raro: Edema palpebrale.
Molto raro: Cheratite ulcerativa, alterazione dell'epitelio corneale, perforazione corneale.
Patologie della cute e del tessuto cellulare sottocutaneo
Comune: Ecchimosi.
Non comune: Esantema, dermatite.
Patologie sistemiche e disturbi relativi alla sede di somministrazione
Comune: Edema facciale, irritazione.
Non comune: Spossatezza.
Strabismo
Patologie dell'occhio
Molto comune: Disturbi del movimento oculare (16,9%), ptosi palpebrale superiore (15,7%).
Non comune: emorragia oculare retrobulbare, penetrazione oculare, pupilla di Holmes-Adie.
Raro: Emorragia vitreale.
Distonia cervicale
Infezioni e malattie parassitarie
Comune: Rinite, infezione delle vie respiratorie superiori.
Patologie del sistema nervoso
Comune: Vertigini, cefalea, ipoestesia, ipertensione muscolare, sonnolenza.
Patologie dell'occhio
Non comune: Diplopia, ptosi palpebrale superiore.
Patologie respiratorie, toraciche e mediastiniche
Non comune: Dispnea, disfonia.
Patologie del tratto gastrointestinale
Molto comune: Disfagia (fino al 18,6% ad una dose media di 240,5 unità) (vedere anche «Informazioni aggiuntive» in basso).
Comune: bocca secca, nausea.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Molto comune: Debolezza muscolare (12,8%).
Comune: Rigidità, indolenzimento muscoloscheletrico.
Patologie sistemiche e condizioni relative alla sede di somministrazione
Molto comune: Dolore (16,3%).
Comune: Astenia, sintomi di tipo influenzale, malessere.
Non comune: Febbre.
Spasticità focale degli arti superiori associata a ictus cerebrale
Disturbi psichiatrici
Non comune: Depressione, insonnia.
Patologie del sistema nervoso
Comune: Ipertensione muscolare.
Non comune: Parestesia, cefalea, ipoestesia, mancata coordinazione, amnesia.
Patologie dell'orecchio e del labirinto
Non comune: Vertigine.
Patologie vascolari
Non comune: ipotensione ortostatica.
Patologie del tratto gastrointestinale
Non comune: Nausea, parestesia orale.
Patologie della cute e del tessuto cellulare sottocutaneo
Comune: Ecchimosi, porpora.
Non comune: Dermatite, prurito, esantema.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Comune: Dolore alle estremità, debolezza muscolare.
Non comune: Artralgia, borsite.
Patologie sistemiche e disturbi relativi alla sede di somministrazione
Comune: Dolore al sito di iniezione, febbre, sindrome influenzale, emorragia ed irritazione al sito di iniezione.
Non comune: Dolore, malessere, astenia, ipersensibilità al sito di iniezione, edema periferico.
Alcuni degli eventi non comuni possono essere correlati alla malattia.
Paralisi cerebrale infantile
Infezioni e malattie parassitarie
Molto comune: Infezione virale (14,6%), infezione dell'orecchio (15,7%).
Patologie del sistema nervoso
Frequenti: tremore nervoso, disturbi del portamento, cambiamenti coordinativi, sonnolenza, parestesia.
Patologie della cute e del tessuto cellulare sottocutaneo
Comune: Esantema.
Patologie del sistema muscoloscheletrico e del tessuto
Comune: Mialgia, debolezza muscolare, aumento della tensione nei muscoli (delle gambe), dolore alle estremità.
Non comune: Artralgia.
Patologie renali e urinarie
Comune: Incontinenza urinaria.
Traumatismo, avvelenamenti e complicazioni procedurali
Comune: Cadute.
Patologie sistemiche e disturbi relativi alla sede di somministrazione
Comune: Malessere, dolore al sito di iniezione, astenia.
Non comune: Febbre.
PATOLOGIE DELLA VESCICA
Vescica iperattiva
Infezioni e malattie parassitarie
Molto comune: Infezioni delle vie urinarie (25,5%).
Comune: Batteriuria.
Patologie renali e urinarie
Molto comune: Disuria (10,9%).
Comune: Ritenzione urinaria, pollachiuria.
Esami diagnostici
Comune: Volume residuo urinario*.
*elevato volume residuo urinario post-minzionale che non richiede cateterizzazione.
Reazioni avverse correlate alla procedura che si sono verificate con frequenza comune sono state la disuria e l'ematuria.
È stata avviata una cateterizzazione intermittente con tecnica pulita nel 6,5% dei pazienti dopo il trattamento con 100 unità Allergan di BOTOX® rispetto allo 0,4% nel gruppo trattato con placebo.
Negli studi clinici controllati con placebo, su un numero di 1242 pazienti, il 41,4% (n = 514) era di età ≥65 anni e il 14,7% (n = 182) era di età ≥75 anni. In questi studi non è stata osservata alcuna differenza complessiva relativamente al profilo di sicurezza in seguito al trattamento con BOTOX® tra i pazienti ≥65 anni in confronto ai pazienti di età inferiore a 65 anni, fatta eccezione per le infezioni delle vie urinarie, dove l'incidenza è stata superiore nei pazienti anziani in entrambi i gruppi BOTOX® e placebo rispetto ai pazienti più giovani.
Non è stata osservata nessuna variazione nel profilo di sicurezza complessivo con le dosi ripetute.
Incontinenza urinaria da iperattività neurogena del detrusore
Effetti indesiderati osservati negli studi clinici di Fase II e negli studi clinici pivotali di Fase III
Infezioni e malattie parassitarie
Molto comune: Infezione delle vie urinarie (49%).
Disturbi psichiatrici
Comune: Insonnia.
Patologie del tratto gastrointestinale
Comune: Stipsi.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Comune: Debolezza muscolare, spasmo muscolare.
Patologie renali e urinarie
Molto comune: Ritenzione urinaria (17%).
Comune: Ematuria*, disuria*, diverticolo vescicale.
Patologie sistemiche e disturbi relativi alla sede di somministrazione
Comune: Spossatezza, disturbi della deambulazione.
Traumatismo, avvelenamento e complicazioni da procedura
Comune: Disreflessia autonoma*, cadute.
* reazioni avverse correlate alla procedura
Negli studi clinici sono state riferite infezioni delle vie urinarie nel 49,2% dei pazienti trattati con 200 unità Allergan di BOTOX® e nel 35,7% dei pazienti trattati con placebo (53,0% dei pazienti con sclerosi multipla trattati con 200 unità Allergan rispetto al 29,3% trattato con placebo; 45,4% dei pazienti con lesioni del midollo spinale trattati con 200 unità Allergan rispetto al 41,7% trattato con placebo). È stata riferita ritenzione urinaria nel 17,2% dei pazienti trattati con 200 unità Allergan di BOTOX® e nel 2,9% dei pazienti trattati con placebo (28,8% di pazienti con sclerosi multipla trattati con 200 unità Allergan rispetto al 4,5% trattato con placebo; 5,4% di pazienti con lesioni del midollo spinale trattati con 200 unità Allergan rispetto all'1,4% trattato con placebo).
Non è stata osservata alcuna variazione nella tipologia delle reazioni avverse con la ripetizione del dosaggio.
Non è stata osservata alcuna differenza nel tasso annuale di riacutizzazioni di sclerosi multipla (SM) (ovvero il numero di eventi di riacutizzazione di SM per paziente-anno) (BOTOX® = 0,23; placebo = 0,20) nei pazienti affetti da SM negli studi cardine.
Negli studi iniziali, tra i pazienti non cateterizzati al basale prima del trattamento, la cateterizzazione è stata iniziata nel 38,9% dopo il trattamento con 200 unità Allergan di BOTOX® rispetto al 17,3% con placebo.
Effetti indesiderati osservati nello studio post-autorizzativo di BOTOX®100 unità Allergan in pazienti SM non cateterizzati al basale
Infezioni e malattie parassitarie
Molto comune: Infezione delle vie urinarie (39,4%), batteriuria (18,2%).
Patologie renali e urinarie
Molto comune: Ritenzione urinaria (16,7%).
Comune: Ematuria**, disuria**.
Esami diagnostici
Molto comune: Volume residuo urinario** (16,7%)
* reazioni avverse correlate alla procedura
** elevato volume residuo urinario che non richiede cateterizzazione
La cateterizzazione è stata avviata nel 15,2% dei pazienti dopo il trattamento con 100 unità Allergan di BOTOX® rispetto al 2,6% dei pazienti trattati con placebo.
PATOLOGIE DELLA CUTE E DEGLI ANNESSI CUTANEI
Iperidrosi primaria delle ascelle
Patologie del sistema nervoso
Comune: Dolore, cefalea, parestesia.
Patologie vascolari
Comune: Vampate di calore.
Patologie del tratto gastrointestinale
Non comune: Nausea.
Patologie della cute e del tessuto cellulare sottocutaneo
Comune: Iperidrosi (sudorazione non ascellare), anomalo odore della pelle, prurito, nodulo subcutaneo e alopecia.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Comune: Dolore alle estremità.
Non comune: Debolezza alle braccia, mialgia, artropatia.
Patologie sistemiche e condizioni relative alla sede di somministrazione
Molto comune: Dolore al sito di iniezione (11,5%).
Comune: Dolore, edema/emorragia/ipersensibilità/irritazione al sito di iniezione, astenia, reazioni al sito di iniezione.
Nel trattamento dell'iperidrosi primaria ascellare, l'aumento della sudorazione non ascellare è stato riportato nel 4,5% dei pazienti entro un mese dall'iniezione, senza riferimento diretto ai siti anatomici interessati. Questo effetto si risolveva in circa il 30% dei pazienti entro 4 mesi.
La debolezza degli arti superiori è stata anche riportata come non comune (0,7%), di lieve entità, transitoria, tale da non richiedere trattamento e da risolversi senza sequele. Questa reazione avversa può essere relativa al trattamento, alla tecnica d'iniezione o ad entrambi. Nel caso non comune di debolezza muscolare riportata dopo il trattamento può rendersi necessaria una visita neurologica. Inoltre, può essere necessaria una rivalutazione della tecnica di iniezione nei successivi trattamenti in modo da assicurare un posizionamento intradermale dell'iniezione.
Effetti indesiderati post-marketing
Il seguente elenco contiene le reazioni avverse al medicamento o altri effetti indesiderati clinicamente rilevanti che sono stati riportati da quando il medicamento è presente sul mercato, indipendentemente dalle indicazioni, e possono essere in aggiunta a quelle riportate di cui ai punti «Avvertenze e misure precauzionali» ed «Effetti indesiderati».
Patologie del sistema immunitario
Anafilassi, angioedema, malattie del siero e orticaria.
Disturbi del metabolismo e della nutrizione
Anoressia.
Patologie del sistema nervoso
Plessopatia brachiale, disfonia, disartria, paresi facciale, ipoestesie, debolezza muscolare, miastenia grave, neuropatia periferica, parestesie, radicolopatia, convulsioni, sincope, paralisi facciale.
Patologie dell'occhio
Glaucoma ad angolo chiuso (nel trattamento del blefarospasmo), strabismo, visione sfocata, disturbi visivi, occhio secco ed edema palpebrale.
Patologie dell'orecchio e del labirinto
Ipoacusia, tinnito, vertigini.
Patologie cardiache
Aritmia, infarto del miocardio.
Patologie respiratorie, toraciche e mediastiniche
Polmonite da aspirazione (con esito fatale in alcuni casi), dispnea, depressione respiratoria, insufficienza respiratoria.
Patologie del tratto gastrointestinale
Dolore addominale, diarrea, stipsi, bocca secca, disfagia, nausea, vomito.
Patologie della cute e del tessuto cellulare sottocutaneo
Alopecia, dermatite psoriasiforme, eritema multiforme, iperidrosi, madarosi, prurito, eruzione cutanea.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Atrofia muscolare, mialgia, contrazioni muscolari localizzate/contrazioni muscolari involontarie.
Patologie sistemiche e disturbi relativi alla sede di somministrazione
Atrofia da denervazione, malessere, febbre.
Durante il trattamento dello strabismo, è stato riferito un caso di emorragia nel corpo vitreo che si è poi riassorbita. Sono stati segnalati alcuni casi di emorragia retrobulbare, ma la perdita di acuità visiva non è mai stata rilevata. 5 occhi hanno mostrato cambiamenti della pupilla con danni ai gangli ciliari (pupilla di Adie).
Due giorni dopo l'iniezione di 120 unità Allergan di BOTOX® per il trattamento della distonia cervicale, una paziente ha sviluppato una plessopatia brachiale che è durata circa cinque mesi.
In uno studio su pazienti con spasticità degli arti superiori dopo l'ictus sono state effettuate misurazioni spirometriche polmonari che hanno mostrato una riduzione del 15% della funzione polmonare. L'incidenza di questo effetto indesiderato è stata riportata con maggiore frequenza nel gruppo di pazienti trattati con BOTOX® rispetto al gruppo trattato con placebo, con differenze che non raggiungono né la rilevanza clinica né quella statistica.
Nel trattamento dell'iperidrosi primaria ascellare, l'aumento del sudore non ascellare è stato riportato nel 4,5% dei pazienti, entro 1 mese dall'iniezione, senza riferimento diretto ai siti anatomici coinvolti. Questo effetto si risolveva in circa il 30% dei pazienti entro 4 mesi.
La segnalazione del sospetto di effetti collaterali in seguito all'omologazione è di grande importanza e permette un monitoraggio costante del rapporto rischio/beneficio del medicamento. Gli appartenenti alle professioni sanitarie sono invitati a notificare ogni sospetto di effetti collaterali nuovi o gravi attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sono disponibili su www.swissmedic.ch.
Posologia eccessiva
Nel caso di BOTOX®, il concetto di sovradosaggio è relativo e dipende dalla dose, dal sito di iniezione e dalle caratteristiche di base dei tessuti. Non si segnalano casi di intossicazione sistemica dovuta a iniezione accidentale di soluzioni di tossina botulinica di tipo A. Dosi eccessive possono provocare una paralisi neuromuscolare locale o distante dal sito di iniezione, generalizzata e profonda. Non sono noti casi di assunzione per via orale di BOTOX®.
I sintomi di sovradosaggio non insorgono subito dopo l'iniezione. In seguito a ingestione o iniezione accidentale o di sospetto sovradosaggio, il paziente deve essere sottoposto per diverse settimane a monitoraggio clinico dei segni e sintomi progressivi di debolezza muscolare che possono essere locali o distanti dal sito di iniezione e che possono includere ptosi, diplopia, disfagia, disartria, astenia generalizzata o insufficienza respiratoria. Questi pazienti devono essere sottoposti ad ulteriori valutazioni mediche e deve essere immediatamente stabilita una appropriata terapia medica, che può richiedere anche il ricovero in ospedale.
Se risultano interessate le muscolature dell'orofaringe e dell'esofago, si può verificare una polmonite da aspirazione. Nel caso di paralisi dei muscoli respiratori o di sufficiente indebolimento, si renderà necessario il ricorso all'intubazione e alla respirazione assistita fino alla guarigione, e potranno essere necessarie anche una tracheostomia e una ventilazione meccanica prolungata oltre ad altre cure generali di supporto.
Proprietà/Effetti
Codice ATC: M03AX01
Meccanismo d'azione
La tossina botulinica di tipo A blocca, attraverso la scissione di SNAP 25, il rilascio di acetilcolina dalle terminazioni nervose presinaptiche periferiche. SNAP 25 è una proteina essenziale per il legame e rilascio dell'acetilcolina dalle vescicole presenti nelle terminazioni nervose.
Farmacocinetica
Dopo l'iniezione si stabilisce inizialmente un legame ad alta affinità tra la tossina e i recettori specifici presenti sulla superficie cellulare. Attraverso un processo di endocitosi mediata da recettore la tossina viene trasportata attraverso la membrana plasmatica e rilasciata nel citosol. Questo processo è accompagnato da una progressiva inibizione del rilascio di acetilcolina. L'effetto clinico si manifesta entro 2-3 giorni. La massima efficacia si osserva 5-6 settimane dopo l'iniezione. Nei neuroni sensoriali BOTOX® inibisce il rilascio di neurotrasmettitori sensoriali (ad es. sostanza P, CGRP) e regola l'espressione dei recettori superficiali delle cellule (ad es. TRPV1). BOTOX® impedisce anche la sensibilizzazione dei neuroni sensoriali nocicettivi e la inverte.
Il recupero, dopo iniezione intramuscolare, avviene normalmente entro 12 settimane dopo l'iniezione in quanto le terminazioni nervose si rigenerano e si ricollegano con le placche terminali.
Dopo l'iniezione intradermale, dove l'obiettivo sono le ghiandole sudoripare esocrine, l'effetto durava circa 4-7 mesi dopo la prima iniezione in pazienti trattati con 50 unità per ascella.
Quando BOTOX® viene utilizzato per trattare lo strabismo, si presume che agisca sulle coppie muscolari allungando atroficamente il muscolo trattato e accorciando il corrispondente antagonista muscolare.
Dopo l'iniezione nei muscoli del collo, BOTOX® migliora sia i sintomi oggettivi che i sintomi soggettivi della distonia cervicale. Questo si manifesta in una riduzione della rotazione della testa verso il lato, riduzione del sollevamento della spalla, riduzione delle dimensioni e della forza dei muscoli ipertrofici e riduzione del dolore.
Negli adulti con spasticità focale degli arti superiori dopo l'ictus, BOTOX® migliora significativamente l'arco di movimento (distensione del gomito e del polso).
L'iniezione di BOTOX® nei bambini con posizione dinamica del piede a punta (deformità dell'equino) senza retrazione e senza atrofia significativa porta ad una posizione della caviglia modificata a causa della parziale denervazione del muscolo gastrocnemio e quindi ad un significativo miglioramento dell'andatura.
BOTOX®, a seguito di iniezione intradetrusoriale, ha effetti sui percorsi neurali efferenti dell'attività detrusoriale stessa tramite l'inibizione del rilascio di acetilcolina. Inoltre, BOTOX® può inibire i neurotrasmettitori afferenti e le vie della sensibilità.
Efficacia clinica
PATOLOGIE NEUROLOGICHE
Blefarospasmo/spasmo emifacciale
In uno studio aperto 56 pazienti con spasmo emifacciale sono stati iniettati con una dose iniziale da 10 a 50 unità. I pazienti sono stati poi osservati per 22 settimane. I pazienti che non hanno mostrato alcun miglioramento nella settimana 4 hanno ricevuto una nuova iniezione (da 5 a 50 unità). I pazienti sono stati osservati alle settimane 2, 4 (laddove fosse stato necessario un nuovo trattamento), 6, 14 e 22. L'effetto clinico è stato valutato in ogni punto di controllo per i diversi muscoli facciali superiori e inferiori.
Tutti i 56 pazienti hanno mostrato un miglioramento mentre il 62,5% (35/56) ha mostrato un netto miglioramento. In relazione ai muscoli facciali superiori, è stato osservato un miglioramento in tutti i pazienti. La valutazione dei muscoli facciali inferiori ha mostrato che tutti i pazienti, tranne 2, avevano risposto al trattamento.
Nei pazienti con blefarospasmo essenziale benigno è stato condotto un ulteriore studio di gruppo randomizzato, multicentrico, in doppio cieco, parallelo, per confrontare la sicurezza e l'efficacia di 2 formulazioni di BOTOX® (il principio attivo è stato derivato da diverse banche di cellule master, una delle quali corrisponde all'attuale formulazione di BOTOX®). Lo studio comprendeva pazienti che erano stati precedentemente trattati con BOTOX® e il trattamento consisteva in un unico ciclo di iniezione nel muscolo orbicolare di entrambi gli occhi. La dose (la massima consentita era di 100 unità) e i siti di iniezione sono stati determinati dallo sperimentatore in base alla risposta dei pazienti ai precedenti trattamenti di BOTOX®. I pazienti sono stati osservati per un periodo di 12 settimane dopo il trattamento. Lo studio comprendeva 98 pazienti (48 nel gruppo con l'attuale formulazione di BOTOX®).
Il tasso di successo del trattamento è stato valutato su una scala a 5 punti da 0 a 4, dove 0 stava per «nessuno» e 4 per «grave» spasmo ostruttivo delle palpebre ed eventualmente altri muscoli facciali. Una diminuzione ad un punteggio di ≤2 in entrambi gli occhi è stata considerata un successo del trattamento. L'endpoint primario si trovava alla settimana 4. I pazienti hanno ricevuto una dose media di 33 unità per occhio, iniettata in 3-15 siti di iniezione. Paragonabile alla precedente formulazione di BOTOX®, la percentuale di successo del trattamento con l'attuale formulazione di BOTOX® è stata di circa il 90% nella settimana 4.
Distonia cervicale
È stato condotto uno studio randomizzato, controllato con placebo, in doppio cieco, multicentrico, in pazienti con distonia cervicale (CD). Questo studio comprendeva pazienti adulti con distonia cervicale che avevano risposto positivamente al precedente trattamento con BOTOX®. Lo studio è stato diviso in 2 fasi di trattamento, una fase di studio aperto, in cui tutti i pazienti sono stati trattati con BOTOX®, dove il dosaggio e i siti di iniezione sono stati determinati individualmente dallo sperimentatore, e una fase in doppio cieco, in cui i pazienti classificati come rispondenti nella fase aperta hanno ricevuto o BOTOX® o placebo in doppio cieco. Tra queste due fasi è intercorso un intervallo di 6 settimane. Ai pazienti sono state somministrate fino a 360 unità Allergan di BOTOX®.
Nella fase di studio aperto, sono stati valutati 214 pazienti, 170 dei quali sono stati randomizzati per la parte in doppio cieco dello studio (88 pazienti sono stati inclusi nel gruppo trattato con BOTOX®, 82 nel gruppo trattato con placebo). Successivamente, i pazienti sono stati osservati ad intervalli di 2 settimane ciascuno per un periodo fino a 10 settimane dopo il trattamento. Le principali variabili di efficacia sono state una variazione della postura della testa (misurata sulla scala di valutazione della gravità della distonia cervicale) e la percentuale di pazienti con un miglioramento dello stato di distonia cervicale, misurata su una scala di valutazione medica 6 settimane dopo il trattamento. Il dolore come sintomo importante della distonia cervicale è stato valutato dai pazienti in termini di frequenza e intensità. Inoltre, il medico e il paziente hanno valutato la disabilità funzionale.
BOTOX® si è dimostrato clinicamente e statisticamente significativamente superiore al placebo per entrambe le variabili di efficacia primaria dopo 6 settimane. BOTOX® ha anche ridotto l'intensità e la frequenza del dolore in modo statisticamente significativo rispetto al placebo. Sono stati osservati miglioramenti significativi anche nella valutazione della disabilità funzionale da parte del medico e del paziente alla settimana 6.
Nei pazienti affetti da distonia cervicale è stato condotto un ulteriore studio randomizzato in doppio cieco nella progettazione di crossover per studiare la sicurezza e l'efficacia di 2 formulazioni di BOTOX® (il principio attivo è stato derivato da diverse banche di cellule master - una delle quali corrisponde all'attuale formulazione di BOTOX®). Lo studio ha arruolato pazienti che erano stati precedentemente trattati con risultati soddisfacenti; il trattamento comprendeva 2 iniezioni con una fase intermedia di lavaggio di 8-16 settimane. I pazienti sono stati seguiti per 8-16 settimane dopo ogni trattamento, con l'endpoint primario alla settimana 6 dopo ogni trattamento.
In questo studio sono stati inclusi 135 pazienti. La variabile di efficacia primaria è stata la valutazione complessiva della gravità sulla Toronto Western Spasmodic Torticollis Rating Scale (TWSTRS). Le variabili secondarie di efficacia sono state il punteggio del dolore da disabilità (utilizzando la TWSTRS modificata) e la valutazione complessiva della distonia cervicale da parte del paziente e del medico. I risultati hanno confermato che il massimo miglioramento clinico si ottiene dopo l'iniezione di BOTOX® alla settimana 6. La riduzione media del punteggio complessivo sulla TWSTRS ha rappresentato un miglioramento del 35% rispetto al basale, e la più alta riduzione media del punteggio del dolore da disabilità ha rappresentato un miglioramento del 50% rispetto al basale in quel momento.
La valutazione complessiva da parte di medici e pazienti ha mostrato anche l'effetto positivo del trattamento con un successo terapeutico riportato per la nuova formulazione di BOTOX® in oltre l'85% e l'80% dei casi nella settimana 6.
Paralisi cerebrale infantile
È stato condotto uno studio multicentrico, in doppio cieco, controllato con placebo su 145 bambini con paralisi cerebrale che soffrivano di spasticità degli arti inferiori associata a contrattura muscolare dinamica e posizione del piede a punta durante la camminata. I pazienti sono stati randomizzati nel gruppo trattato con BOTOX® (N = 72) o nel gruppo trattato con placebo (N = 73). La dose totale iniettata nel muscolo gastrocnemio di ogni paziente è stata di 4 unità/kg fino ad una dose massima di 200 unità in un periodo di 30 giorni. I pazienti sono stati osservati per un periodo di 12 settimane dopo il trattamento. La variabile primaria dell'efficacia, il tasso di successo del trattamento, è stata definita come un aumento del punteggio dinamico del modello di andatura (durante la deambulazione) di ≥2 punti dal basale.
La percentuale di successo in ogni punto di controllo era significativamente più alta nel gruppo trattato con BOTOX® rispetto al gruppo trattato con placebo.
Spasticità focale degli arti superiori associata all'ictus
È stato condotto uno studio in doppio cieco, multicentrico, controllato con placebo in pazienti affetti da spasticità degli arti superiori post-ictus al fine di studiare l'efficacia e la sicurezza di BOTOX®. I pazienti, il cui ictus risale a ≥6 settimane prima, non sono mai stati adulti trattati con BOTOX® e hanno ottenuto un punteggio sulla scala di Ashworth modificata di ≥3 al polso e ≥2 al gomito. Novantuno pazienti sono stati randomizzati in uno dei quattro gruppi di trattamento (90, 180 o 360 unità Allergan di BOTOX® o placebo). L'endpoint primario, la spasticità del flessore del polso, è stata misurata alla settimana 6 sulla scala di Ashworth modificata (MAS). Le variabili secondarie di efficacia erano la spasticità dei flessori dei gomiti e delle dita, misurata sulla MAS e dopo la valutazione complessiva del medico.
Lo studio comprendeva 91 pazienti (65 pazienti hanno ricevuto BOTOX® in 90, 180 o 360 unità Allergan). La riduzione media sulla MAS per i flessori del polso è stata maggiore in tutti i gruppi trattati con BOTOX® per la settimana 12 rispetto al gruppo trattato con placebo.
In tutti i gruppi di trattamento BOTOX®, il tono flessore del polso, misurato sulla MAS, è stato ridotto in modo più efficace rispetto al gruppo trattato con placebo. I flessori dei gomiti hanno mostrato modelli di miglioramento simili. Sebbene ci sia stata una certa variabilità complessiva dei flessori delle dita (miglioramenti significativi solo nelle settimane 1 e 3), i dati indicano relazioni dose-risposta comparabili. Anche la scala di valutazione medica ha mostrato un vantaggio significativo a dosi di 180 unità e 360 unità.
È stato condotto un altro studio controllato con placebo, multicentrico, in doppio cieco, in pazienti con spasticità del polso e delle dita come conseguenza secondaria dell'ictus. La durata dello studio è stata di 12 settimane. L'endpoint primario era la spasticità del flessore del polso alla settimana 6, misurata sulla scala di Ashworth (MAS). Altre variabili sono state la scala di valutazione valutata dal medico, la valutazione complessiva da parte del personale di assistenza del paziente, la scala di valutazione delle disabilità e gli obiettivi di base dell'intervento terapeutico.
126 pazienti sono stati randomizzati e hanno ricevuto BOTOX® (N = 64) o placebo (N = 62). La dose iniettata di BOTOX® era compresa tra 200 e 240 unità di Allergan, distribuite ai muscoli interessati del polso e delle dita. È stato dimostrato che BOTOX® ha migliorato i valori della AS per polso e dita in tutti i punti di controllo dopo l'iniezione. Alla settimana 6, l'88% dei pazienti ha mostrato un miglioramento sulla AS con BOTOX®, rispetto al 34% del gruppo trattato con placebo.
Anche tutte le altre variabili hanno mostrato un vantaggio significativo rispetto al placebo alla settimana 6.
PATOLOGIE DELLA VESCICA
Vescica iperattiva
Sono stati condotti due studi clinici di Fase III multicentrici, randomizzati, in doppio cieco, controllati con placebo, della durata di 24 settimane su pazienti affetti da vescica iperattiva con sintomi di incontinenza urinaria, urgenza di urinare e minzione frequente. Un totale di 1105 pazienti, i cui sintomi non erano stati adeguatamente controllati con almeno una terapia anticolinergica (risposta inadeguata o effetti collaterali intollerabili) è stato randomizzato a ricevere 100 unità Allergan di BOTOX® (n = 557) o placebo (n = 548).
In entrambi gli studi sono stati osservati significativi miglioramenti a favore di BOTOX® (100 unità Allergan) rispetto al placebo nella variazione dal basale nella frequenza giornaliera di episodi di incontinenza urinaria al momento di rilevazione primario alla settimana 12, compresa la percentuale di pazienti senza episodi di incontinenza. Utilizzando la scala dei benefici del trattamento, la percentuale di pazienti che hanno riferito una risposta positiva al trattamento (le loro condizioni erano «molto migliorate» o «migliorate») è stata significativamente superiore nel gruppo trattato con BOTOX®, rispetto al gruppo placebo in entrambi gli studi. Miglioramenti significativi rispetto al placebo sono stati anche osservati per quanto riguarda la frequenza quotidiana di minzione, l'urgenza di urinare e la nicturia. Il volume di urina per minzione è stato anche significativamente maggiore. Miglioramenti significativi sono stati osservati in tutti i sintomi di vescica iperattiva a partire dalla settimana 2.
Il trattamento con BOTOX® è stato associato a miglioramenti significativi, rispetto al placebo, nei punteggi della qualità di vita correlata alla salute misurati dal questionario I-QOL (Incontinence Quality of Life) (compresi il comportamento limitante e di evitamento, l'impatto psicosociale e l'imbarazzo sociale) e nei punteggi del questionario KHQ (King's Health Questionnaire) (compresi l'impatto dell'incontinenza, le limitazioni di ruolo, le limitazioni sociali, le limitazioni fisiche, le relazioni personali, le emozioni, la valutazione sonno/energia e severità/tolleranza).
Non è stata osservata una differenza complessiva di efficacia a seguito del trattamento con BOTOX® tra pazienti di età di 65 anni rispetto ai pazienti di età inferiore a 65 anni.
Di seguito sono riportati i risultati degli studi cardine aggregati:
Endpoint primari e secondari di efficacia al basale e variazione dal basale in studi cardine aggregati
BOTOX® 100 unità Allergan (N = 557) | Placebo (N = 548) | Valore p | |
Frequenza quotidiana di episodi di incontinenza urinaria* | |||
Valore medio all'inizio dello studio Variazione media alla settimana 2 Variazione media alla settimana 6 Variazione media alla settimana 12 | 5,49 -2,85 -3,11 -2,80 | 5,39 -1,21 -1,22 -0,95 | <0,001 <0,001 <0,001 |
Percentuale di risposte positive al trattamento utilizzando la scala dei benefici del trattamento (%) | |||
Settimana 2 Settimana 6 Settimana 12 | 64,4 68,1 61,8 | 34,7 32,8 28,0 | <0,001 <0,001 <0,001 |
Frequenza giornaliera degli episodi di minzione | |||
Valore medio all'inizio dello studio Variazione media alla settimana 2 Variazione media alla settimana 6 Variazione media alla settimana 12 | 11,99 -1,53 -2,18 -2,35 | 11,48 -0,78 -0,97 -0,87 | <0,001 <0,001 <0,001 |
Frequenza giornaliera degli episodi di urgenza | |||
Valore medio all'inizio dello studio Variazione media alla settimana 2 Variazione media alla settimana 6 Variazione media alla settimana 12b | 8,82 -2,89 -3,56 -3,30 | 8,31 -1,35 -1,40 -1,23 | <0,001 <0,001 <0,001 |
Punteggio totale I-QOL | |||
Valore medio all'inizio dello studio Variazione media dopo la settimana 12bc | 34,1 +22,5 | 34,7 +6,6 | <0,001 |
Questionario KHQ: Limitazione del ruolo | |||
Valore medio all'inizio dello studio Variazione media dopo la settimana 12bc | 65,4 -25,4 | 61,2 -3,7 | <0,001 |
Questionario KHQ: Limitazione sociale | |||
Valore medio all'inizio dello studio Variazione media dopo la settimana 12bc | 44,8 -16,8 | 42,4 -2,5 | <0,001 <0,001 |
* La percentuale di pazienti senza manifestazioni di incontinenza alla settimana 12 è stata del 27,1% per il gruppo trattato con BOTOX® e dell'8,4% per il placebo. Le percentuali di pazienti che hanno ottenuto una riduzione degli episodi di incontinenza urinaria rispetto al basale di almeno il 75% e il 50% sono state rispettivamente del 46,0% e del 60,5% nel gruppo BOTOX® e del 17,7% e del 31,0% nel gruppo placebo.
a Endpoint co-primari
b Endpoint secondari
c La minima variazione importante prespecificata rispetto al basale è stata di +10 punti per il punteggio I-QOL e di 5 punti per il KHQ.
La durata mediana di risposta dopo il trattamento con BOTOX® in base alla richiesta di ri-trattamento da parte del paziente è stata di 166 giorni (~24 settimane).
La durata mediana di risposta, in base alla richiesta di ri-trattamento da parte del paziente, nei pazienti che avevano proseguito nello studio di estensione in aperto e che erano stati trattati solo con 100 unità Allergan di BOTOX® (N = 438), è stata di 212 giorni (~30 settimane).
Solo un numero limitato di pazienti maschi (circa il 12,2% della popolazione totale dello studio) ha partecipato ai due studi pivotali. Non è stato possibile dimostrare un'efficacia statisticamente significativa in questo piccolo sottogruppo.
Un totale di 834 pazienti è stato valutato in uno studio di estensione in aperto a lungo termine. Per tutti gli endpoint di efficacia, i pazienti hanno manifestato una risposta coerente con i trattamenti ripetuti.
Negli studi cardine, nessuno dei 615 pazienti i cui campioni sono stati analizzati ha sviluppato anticorpi neutralizzanti. Nei pazienti i cui campioni sono stati analizzati nello studio pivotale di Fase III e negli studi di estensione in aperto, gli anticorpi neutralizzanti si sono sviluppati in 0 dei 954 pazienti (0,0%) durante il trattamento con 100 unità Allergan di BOTOX® e in 3 dei 260 pazienti (1,2%) dopo aver successivamente ricevuto almeno una dose da 150 unità Allergan. Uno di questi tre pazienti ha continuato ad avere un beneficio clinico.
Incontinenza urinaria dovuta a iperattività detrusoriale neurogena
Sono stati condotti due studi clinici di Fase III multicentrici, randomizzati, in doppio cieco, controllati con placebo, in pazienti affetti da incontinenza urinaria dovuta a iperattività neurogena del detrusore, in grado di eseguire minzione spontanea o che utilizzavano un catetere. È stato arruolato un totale di 691 pazienti con lesione del midollo spinale o affetti da sclerosi multipla, non adeguatamente trattati con almeno un agente anticolinergico. Questi pazienti sono stati randomizzati a ricevere 200 unità Allergan di BOTOX® (n = 227), 300 unità Allergan di BOTOX® (n = 223) o placebo (n = 241).
In entrambi gli studi di Fase III sono stati osservati significativi miglioramenti a favore di BOTOX® (200 unità Allergan e 300 unità Allergan) rispetto al placebo nella variabile primaria di efficacia di variazione dal basale nella frequenza settimanale di episodi di incontinenza al momento della rilevazione dell'efficacia primaria alla settimana 6, compresa la percentuale di pazienti senza episodi di incontinenza. Sono stati osservati miglioramenti significativi nei parametri urodinamici, compresi aumento della capacità cistometrica massima e riduzioni della pressione di picco sul muscolo detrusore durante la prima contrazione detrusoriale involontaria. Sono stati inoltre osservati miglioramenti significativi, rispetto al placebo, nei punteggi riferiti dai pazienti sulla qualità di vita correlata alla salute e specifica per l'incontinenza, misurati dal questionario I-QOL (compresi il comportamento limitante di evitamento, l'impatto psicosociale e l'imbarazzo sociale). Non è stato dimostrato alcun ulteriore beneficio con 300 unità Allergan di BOTOX® rispetto a 200 unità Allergan.
Di seguito sono riportati i risultati degli studi cardine con dati aggregati:
Endpoint primari e secondari al basale e variazione dal basale in studi cardine con dati aggregati
BOTOX® 200 unità Allergan (N = 227) | Placebo (N = 241) | Valore p | |
Frequenza settimanale di incontinenza urinaria* | |||
Valore medio all'inizio dello studio Variazione media alla settimana 2 Variazione media nella settimana 6a Variazione media alla settimana 12 | 32,4 -17,7 -21,3 -20,6 | 31,5 -9,0 -10,5 -9,9 | <0,001 <0,001 <0,001 |
Capacità cistometrica massima (ml) | |||
Valore medio all'inizio dello studio Variazione media alla settimana 6b | 250,2 +153,6 | 253,5 +11,9 | <0,001 |
Pressione massima sul muscolo detrusore durante la 1a contrazione involontaria detrusoriale (cmH2O): | |||
Valore medio all'inizio dello studio Variazione media alla settimana 6b | 51,5 -32,4 | 47,3 +1,1 | <0,001 |
Punteggio totale della qualità di vita specifica per incontinenzac,d | |||
Valore medio all'inizio dello studio Variazione media alla settimana 6b Variazione media alla settimana 12 | 35,37 +25,89 +28,89 | 35,32 +11,15 +8,86 | <0,001 <0,001 |
* La percentuale di pazienti senza manifestazioni di incontinenza durante la settimana 6 è stata del 37% per il gruppo trattato con 200 unità Allergan di BOTOX® e del 9% per il gruppo trattato con placebo. Le percentuali che hanno ottenuto una riduzione degli episodi di incontinenza di almeno il 75% rispetto al basale sono state rispettivamente del 63% e del 24%. Le percentuali che hanno ottenuto una riduzione di almeno il 50% rispetto al basale sono state rispettivamente del 76% e del 39%.
a Endpoint primario
b Endpoint secondario
c La scala del punteggio totale dell'I-QOL varia da 0 (problema estremo) a 100 (nessun problema).
d Negli studi cardine, la minima differenza importante prespecificata (MID – Minimally Important Difference) per il punteggio I-QOL totale è stata di 8 punti in base alle stime MID di 4-11 punti riferite nei pazienti con iperattività detrusoriale neurogena.
La durata mediana di risposta nei due studi cardine, in base alla richiesta di ri-trattamento da parte del paziente, è stata di 256-295 giorni (36-42 settimane) per il gruppo trattato con 200 unità di dosaggio, rispetto a 92 giorni (13 settimane) per il gruppo trattato con placebo. La durata mediana di risposta nei pazienti che avevano proseguito nello studio di estensione in aperto e che erano stati trattati solo con 200 unità Allergan di BOTOX® (N = 174), è stata di 253 giorni (~36 settimane).
Per tutti gli endpoints di efficacia, i pazienti hanno avuto risposte coerenti con il ri-trattamento.
Negli studi cardine, nessuno dei 475 pazienti affetti da iperattività neurogena del detrusore, nei campioni analizzati, ha sviluppato anticorpi neutralizzanti.
Nei pazienti i cui campioni sono stati analizzati all'interno del programma di sviluppo del medicamento (incluso lo studio di estensione in aperto), gli anticorpi neutralizzanti si sono sviluppati in 3 dei 300 pazienti (1,0%) dopo aver ricevuto solo dosi di 200 unità Allergan di BOTOX® e in 5 dei 258 pazienti (1,9%) dopo aver ricevuto almeno una dose da 300 unità Allergan. Quattro di questi otto pazienti hanno continuato a riportare un beneficio clinico.
È stato condotto uno studio post-autorizzativo in doppio cieco controllato con placebo in pazienti affetti da sclerosi multipla (SM) con incontinenza urinaria dovuta ad iperattività neurogena del muscolo detrusore, che non erano stati adeguatamente trattati con almeno un agente anticolinergico e non cateterizzati al basale. Questi pazienti sono stati randomizzati a ricevere o 100 unità Allergan di BOTOX® (n = 66) o placebo (n = 78).
Con BOTOX® (100 unità Allergan) sono stati osservati miglioramenti significativi rispetto al placebo nella variabile primaria di efficacia di variazione rispetto al basale nella frequenza giornaliera di episodi di incontinenza al primo time point di efficacia alla settimana 6, compresa la percentuale di pazienti senza manifestazioni di incontinenza. Sono stati osservati anche miglioramenti significativi nei parametri urodinamici e nel questionario I-QOL, compresi il comportamento limitante di evitamento, l'impatto psicosociale e l'imbarazzo sociale.
Di seguito vengono presentati i risultati dello studio dopo il lancio sul mercato:
Endpoint primari e secondari al basale e variazione dal basale nello studio post-autorizzativo di 100 unità Allergan di BOTOX in pazienti con SM non cateterizzati al basale
BOTOX® 100 unità Allergan (N=66) | Placebo (N=78) | Valore p | |
Frequenza quotidiana di episodi di incontinenza urinaria* | |||
Valore medio all'inizio dello studio Variazione media alla settimana 2 Variazione media nella settimana 6a Variazione media alla settimana 12 | 4,2 -2,9 -3,3 -2,8 | 4,3 -1,2 -1,1 -1,1 | p<0,001 p<0,001 p<0,001 |
Capacità cistometrica massima (ml) | |||
Valore medio all'inizio dello studio Variazione media alla settimana 6b | 246,4 +127,2 | 245,7 -1,8 | p<0,001 |
Pressione massima sul muscolo detrusore durante la 1a contrazione involontaria detrusoriale (cmH2O): | |||
Valore medio all'inizio dello studio Variazione media alla settimana 6b | 35,9 -19,6 | 36,1 +3,7 | p=0,007 |
Punteggio totale della qualità di vita specifica per incontinenzac,d | |||
Valore medio all'inizio dello studio Variazione media alla settimana 6b Variazione media alla settimana 12 | 32,4 +40,4 +38,8 | 34,2 +9,9 +7,6 | p<0,001 p<0,001 |
* La percentuale di pazienti senza manifestazioni di incontinenza durante la settimana 6 è stata del 53,0% nel gruppo trattato con 100 unità Allergan di BOTOX® e del 10,3% nel gruppo trattato con placebo.
a Endpoint primario
b Endpoint secondario
c La scala del punteggio totale dell'I-QOL varia da 0 (problema estremo) a 100 (nessun problema).
d La minima differenza importante prespecificata (MID – Minimally Important Difference) per il punteggio I-QOL totale è stata di 11 punti in base alle stime MID di 4–11 punti riferite nei pazienti con iperattività detrusoriale neurogena.
La durata mediana di risposta in questo studio, in base alla richiesta di ri-trattamento da parte del paziente, è stata di 362 giorni (~52 weeks) per il gruppo trattato con 100 unità Allergan di BOTOX® rispetto agli 88 giorni (~13 settimane) per il gruppo trattato con placebo.
PATOLOGIE DELLA CUTE E DEGLI ANNESSI CUTANEI
Iperidrosi ascellare primaria
È stato condotto uno studio clinico multicentrico, in doppio cieco, in pazienti che presentavano persistente iperidrosi primaria ascellare bilaterale. Un'iperidrosi ascellare primaria si manifestava se venivano prodotti spontaneamente almeno 50 mg di sudore per ascella per più di 5 minuti a temperatura ambiente e a riposo. 320 pazienti sono stati randomizzati a ricevere 50 unità Allergan di BOTOX® (N = 242) o placebo (N = 78). I pazienti risponder erano definiti come soggetti che mostravano una riduzione, rispetto al basale, di almeno il 50% della sudorazione ascellare. All'endpoint primario, alla 4a settimana dopo l'iniezione, la percentuale di risposta nel gruppo dei pazienti trattati con BOTOX® è stata del 93,8%, confrontata al 35,9% dei pazienti trattati con placebo (p <0,001). La percentuale dei pazienti rispondere tra quelli trattati con BOTOX® ha continuato ad essere significativamente più alta (p <0,001) rispetto ai pazienti trattati con placebo, in tutti i punti post-trattamento dello studio fino a 16 settimane.
In uno studio clinico di follow-up in aperto sono stati arruolati 207 pazienti idonei che avevano ricevuto fino a 3 trattamenti di BOTOX®. Un totale di 174 pazienti ha completato l'intera durata di 16 mesi dei due studi combinati (4 mesi di studio in doppio cieco e proseguimento di 12 mesi di studio in aperto). La percentuale della risposta clinica alla 16a settimana dopo il primo (n = 287), secondo (n = 123) e terzo (n = 30) trattamento risultava essere rispettivamente di 85,0%, 86,2% e 80%. La durata media dell'effetto basata sullo studio combinato di proseguimento a dose singola e sullo studio in aperto era di 7,5 mesi dal primo trattamento; inoltre, nel 27,5% dei pazienti la durata dell'effetto perdurava per un anno o più.
Farmacodinamica
A causa della natura della tossina botulinica di tipo A, i classici studi di assorbimento, distribuzione, biotrasformazione ed eliminazione con il principio attivo non sono stati effettuati.
Caratteristiche generali del principio attivo
Distribuzione/Metabolismo/Eliminazione
Gli studi di distribuzione nei ratti mostrano una lenta diffusione della tossina botulinica di tipo A marcata radioattivamente nel muscolo gastrocnemio, seguita da una rapida metabolizzazione sistemica ed eliminazione urinaria.
L'emivita del materiale marcato è stata di circa 10 ore. Nel sito di iniezione la radioattività era legata a macromolecole di natura proteica, mentre nel plasma era legata a molecole di piccole dimensioni; questo fa supporre un rapido metabolismo sistemico. Nelle 24 ore successive alla somministrazione è stato eliminato attraverso le urine il 60% della radioattività. Probabilmente la tossina viene metabolizzata dalle proteasi e i suoi componenti molecolari vengono riutilizzati nelle normali vie metaboliche.
Distribuzione
Distribuzione del componente farmacologicamente attivo nei pazienti:
Si ritiene che alle dosi terapeutiche BOTOX® sia soggetto a una limitata distribuzione sistemica. Negli studi clinici è stato possibile dimostrare, mediante elettromiografia di singola fibra, un aumento dell'attività elettrofisiologica neuromuscolare in muscoli lontani dal sito di iniezione, che non è stato accompagnato da sintomi o effetti clinici. L'entità della diffusione e quindi degli effetti indesiderati dipende dalle condizioni anatomiche, dal volume di iniezione e dalla dose.
Farmacocinetica
Dati preclinici
Dati preclinici di sicurezza
Oltre agli studi di tossicità per la riproduzione sono stati effettuati i seguenti studi di sicurezza con BOTOX®: tossicità acuta, tossicità cronica, tollerabilità locale, mutagenicità, antigenicità e compatibilità con il sangue umano. In questi studi non sono stati riscontrati rischi specifici per gli esseri umani alle dosi clinicamente rilevanti. Dalla letteratura è nota la LD50 per le scimmie giovani in seguito a somministrazione intramuscolare, che è di 39 unità/kg di peso corporeo.
Nessuna tossicità sistemica è stata osservata a seguito di una singola iniezione intradetrusoriale di <50 unità Allergan/kg di BOTOX® nei ratti. Per simulare un'iniezione involontaria, una singola dose di BOTOX®(~7 unità Allergan/kg) è stata somministrata nell'uretra prostatica e nel retto prossimale, nella vescicola seminale e nella parete vescicale urinaria o nell'utero di scimmie (~3 unità Allergan/kg) senza effetti indesiderati.
In uno studio di 9 mesi con dosi ripetute iniettate nel muscolo detrusore (4 iniezioni) è stata osservata ptosi con 24 unità/kg. La mortalità si è verificata a dosi di 36 unità/kg dopo la prima di quattro iniezioni e in un animale alla dose di 24 unità/kg dopo la seconda iniezione. La ridotta attività motoria e la respirazione difficoltosa si è verificata in animali moribondi dopo dosi ≥24 unità/kg. Non sono stati osservati effetti indesiderati ad un dosaggio di 12 unità/kg nelle scimmie, il che corrisponde ad un aumento di 3 volte del dosaggio di BOTOX® rispetto alla dose clinica raccomandata di 200 unità Allergan per l'incontinenza urinaria dovuta all'iperattività neurogenica del detrusore (in un paziente di 50 kg).
Tossicità per la riproduzione
Femmine gravide di topo, ratto e coniglio sono state trattate durante l'organogenesi con iniezioni intramuscolari di BOTOX®. Il NOAEL (No Observed Adverse Effect Level) nella fase di sviluppo è stato rispettivamente di 4, 1 e 0,125 unità/kg di peso corporeo. Dosi più elevate hanno portato a una riduzione del peso fetale e/o a un ritardo nell'ossificazione dello scheletro. Nei conigli sono stati osservati aborti.
Altre indicazioni
Incompatibilità
Poiché per questo medicamento non sono stati condotti studi di compatibilità, non lo si deve somministrare in combinazione con altri medicamenti.
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «Exp» sulla confezione.
Indicazioni particolari concernenti l'immagazzinamento
Conservare fuori dalla portata dei bambini.
Flaconi chiusi: Conservare in frigorifero a 2-8 °C oppure in congelatore a una temperatura di –5 °C o inferiore.
Studi sulla potenza hanno mostrato che il medicamento può essere conservato a 2-8 °C per un massimo di 3 giorni dopo la ricostituzione. Poiché il medicamento non contiene conservanti, il preparato pronto all'uso deve essere utilizzato – per ragioni microbiologiche – immediatamente dopo la diluizione, a meno che questa non sia avvenuta in condizioni asettiche controllate e validate. In generale, il medicamento non deve essere conservato per più di 24 ore a 2-8 °C.
Indicazioni per la manipolazione
Preparazione della soluzione iniettabile BOTOX®
La ricostituzione del contenuto del flacone e il riempimento della siringa devono essere effettuati su carta assorbente plastificata, per raccogliere immediatamente eventuali schizzi di BOTOX®. Per la preparazione della soluzione pronta per l'uso di BOTOX® deve essere utilizzata una soluzione fisiologica sterile senza conservanti.
La quantità di solvente prescritta (cfr. la tabella di diluizione in basso) viene prelevata con una siringa di dimensioni adeguate e iniettata nel flacone. La superficie del tappo di gomma del flacone deve essere pulita con un tampone di alcol prima di perforare l'ago.
Tabella di diluizione per flaconi con 100 unità Allergan di BOTOX® valida per tutte le indicazioni (senza iniezioni nel muscolo detrusore)
Quantità di diluente (cloruro di sodio 9 mg/ml (0,9%)), che viene aggiunto ad un flacone contenente 100 unità Allergan: | 100 unità Allergan Flacone |
Dose risultante (unità Allergan per 0,1 ml) | |
0,5 ml 1,0 ml 2,0 ml 4,0 ml 8,0 ml | 20,0 E 10,0 E 5,0 E 2,5 E 1,25 E |
Vescica iperattiva
Istruzioni di diluizione per un flacone con 100 unità Allergan di BOTOX®:
•Ricostituire un flacone di BOTOX® 100 unità Allergan con 10 ml di soluzione salina allo 0,9% (senza conservanti) e miscelare accuratamente il contenuto del flacone.
•Prelevare 10 ml dal flacone in una siringa da 10 ml.
Il risultato è una siringa da 10 ml con un totale di 100 unità Allergan di BOTOX® ricostituito. Utilizzare immediatamente dopo la ricostituzione nella siringa. Scartare la soluzione salina inutilizzata.
Incontinenza urinaria dovuta a iperattività detrusoriale neurogena
Istruzioni di diluizione per due flaconi con 100 unità Allergan di BOTOX®:
•Ricostituire due flaconi di BOTOX® 100 unità Allergan con 6 ml di soluzione salina allo 0,9% ciascuna (senza conservanti) e miscelare accuratamente il contenuto dei flaconi.
•Prelevare 4 ml da ogni flacone in due siringhe da 10 ml.
•Estrarre i 2 ml rimanenti da ciascuna dei due flaconi in una terza siringa da 10 ml.
•Completare la ricostituzione aggiungendo 6 ml di soluzione salina allo 0,9% a ciascuna delle tre siringhe da 10 ml e miscelare accuratamente il loro contenuto.
Ne risultano ora tre siringhe da 10 ml con un totale di 200 unità Allergan di BOTOX® ricostituito.
Utilizzare immediatamente dopo la ricostituzione nella siringa. Scartare la soluzione salina inutilizzata
Una concentrazione minore o maggiore di BOTOX® può essere ottenuta aggiungendo un volume minore o maggiore di diluente.
Poiché BOTOX® viene denaturato da effervescenza o da agitazioni vigorose, il diluente deve essere iniettato lentamente dentro il flacone. Il flacone non deve essere utilizzato se il solvente non viene aspirato all'interno del flacone dalla pressione negativa. La soluzione pronta per l'uso di BOTOX® è un liquido limpido e incolore o di colore giallo chiaro, privo di particelle visibili. La soluzione preparata deve essere ispezionata visivamente prima dell'uso per verificare la limpidezza e l'assenza di particelle in sospensione.
La soluzione ricostituita è destinata all'uso singolo. Se si diluisce ulteriormente BOTOX® in una siringa per l'iniezione intradetrusoriale, è necessario utilizzarlo immediatamente. I residui della soluzione contenente la tossina devono essere smaltiti in maniera appropriata.
Smaltimento
La polvere BOTOX® agitata deve essere pulita con un panno assorbente imbevuto di una soluzione diluita di ipoclorito (0,5%). La soluzione iniettabile BOTOX® miscelata deve essere pulita con un panno asciutto e assorbente. Le superfici contaminate devono essere pulite con un panno assorbente imbevuto di soluzione di ipoclorito diluito e poi strofinate a secco.
Se un flacone è rotto, i frammenti di vetro devono essere raccolti con attenzione al fine di evitare lesioni cutanee.
I flaconi non utilizzati devono essere preparati con acqua e autoclavati. Anche tutti i flaconi e le siringhe utilizzati, i residui di solvente versati, ecc. devono essere inattivati in autoclave. I residui di tossina botulinica possono essere inattivati anche con una soluzione diluita di ipoclorito di sodio, che bisogna lasciare agire per almeno 5 minuti. Altri materiali contaminati come vetri rotti, guanti, ecc. devono essere smaltiti in un contenitore adatto per oggetti appuntiti e inviati all'incenerimento.
Identificazione del medicamento
Se si utilizza il prodotto BOTOX® autentico, ruotando avanti e indietro il flacone alla luce di una lampada da tavolo o a fluorescenza è possibile vedere sull'etichetta (ologramma) delle linee orizzontali con i colori dell'arcobaleno e la scritta «Allergan». Qualora ciò non fosse possibile e/o il sigillo di sicurezza con il logo Allergan argentato traslucido sulla faccia superiore o inferiore della scatola non fosse integro, il prodotto non deve essere utilizzato e si deve contattare Allergan.
Inoltre, per facilitare la tracciabilità del lotto, gli adesivi con il numero di lotto e la data di scadenza possono essere staccati dall'etichetta del flacone di BOTOX® e applicati sulla cartella clinica del paziente. Una volta rimosso l'adesivo dall'etichetta del flacone comparirà la scritta «Verwendet/Utilisé».
Numero dell'omologazione
52433 (Swissmedic)
Titolare dell’omologazione
Allergan SA, Zurigo
Stato dell'informazione
Marzo 2020
Composition
Principes actifs
Toxinum botulinicum A*.
* de Clostridium botulinum
Excipients
Albuminum humanum, 0.9 mg Natrii chloridum. Un flacon contient 0,35 mg de sodium.
Forme pharmaceutique et quantité de principe actif par unité
Poudre pour solution injectable.
100 unités Allergan par flacon.
Par voie intramusculaire et intradermal.
Les unités de toxine botulique ne sont pas applicables à d'autres préparations.
Une unité correspond à la dose létale moyenne (DL50) lorsque le produit reconstitué est injecté à des souris par voie intrapéritonéale dans des conditions définies.
BOTOX® apparaît comme un mince dépôt blanc sur le fond du flacon qui peut être difficile à voir.
Indications/Possibilités d’emploi
BOTOX® est indiqué pour:
Affections neurologiques:
•traitement symptomatique du blépharospasme, de l'hémispasme facial et des dystonies focales associées, ainsi que pour la correction du strabisme chez les patients de plus de 12 ans.
•traitement symptomatique de la dystonie cervicale (torticolis spasmodique) chez l'adulte.
•traitement des spasticités focales, y compris des spasticités des membres supérieurs, résultant d'un accident vasculaire cérébral (AVC).
•traitement symptomatique de la déformation dynamique du pied en équin sans rétraction et sans atrophie importante due à des troubles spasmodiques, chez des patients de deux ans ou plus avec une parésie cérébrale infantile.
Affections vésicales:
•traitement de la vessie hyperactive accompagnée des symptômes suivants: incontinence urinaire, mictions impérieuses et mictions fréquentes, chez le patient adulte qui ne répond pas suffisamment aux anticholinergiques ou qui présente une intolérance à ces médicaments.
•traitement de l'incontinence urinaire causée par l'hyperactivité neurogène du détrusor associée à une affection neurologique (p.ex. lésion médullaire, sclérose en plaques) chez l'adulte.
Affections de la peau et apparentées:
•traitement de l'hyperhidrose axillaire primaire chez l'adulte.
Posologie/Mode d’emploi
Les unités de toxine botulique ne sont pas applicables à d'autres préparations. Les posologies exprimées en Unités Allergan sont différentes de celles d'autres préparations de toxine botulique.
Voir «Remarques particulières» quant à «Remarques concernant la manipulation» et «Élimination» des flacons.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Instructions posologiques particulières
Patients âgés
Aucun ajustement spécifique de la posologie est nécessaire pour l'utilisation chez les patients âgés. Le dosage initial doit commencer à la dose minimale recommandé pour l'indication spécifique. Pour les injections répétées, il est recommandé d'administrer la plus faible dose efficace en respectant entre les injections l'intervalle le plus long possible qui est cliniquement indiqué. Les patients âgés présentant une anamnèse médicale importante et des médicaments concomitants doivent être traités avec précautions (pour des informations supplémentaires voir la rubrique «Effets indésirables» et «Propriétés/Effets»).
Enfants et adolescents
Il n'existe pas d'étude sur la sécurité et l'efficacité de BOTOX® dans le traitement du blépharospasme, de l'hémispasme facial et du strabisme chez l'enfant de moins de 12 ans.
La sécurité et l'efficacité de BOTOX® pour le traitement de la dystonie cervicale, de spasticité focale des extrémités supérieures en relation avec un AVC, de l'hyperhidrose axillaire primaire et une vessie hyperactive ou de l'incontinence urinaire causée par l'hyperactivité neurogène du détrusor n'ont pas été établies chez les enfants et les adolescents (âgés de moins de 18 ans). Aucune donnée n'est disponible.
Mode d'administration
BOTOX® doit seulement être administré par des médecins possédant la qualification et les connaissances professionnelles adéquates dans le traitement et l'utilisation de l'équipement nécessaire. En fonction de l'indication, le diagnostic et l'administration de BOTOX® doivent être effectués dans la mesure du possible en collaboration avec un neurologue, un ophtalmologiste, un pédiatre, un orthopédiste pédiatrique, un dermatologue ou un urologue.
On ne dispose pas de données cliniques suffisantes pour déterminer une posologie générale et un nombre fixe de sites d'injection dans chaque muscle. Le traitement doit donc être mis en place individuellement par le médecin spécialiste traitant le patient. Les doses optimales doivent être déterminées par titration.
AFFECTIONS NEUROLOGIQUES
Blépharospasme/hémispasme facial
Pour les patients de plus de 12 ans uniquement.
Aiguille recommandée: | Aiguille stérile de 27 à 30 gauges/0,40 à 0,30 mm. |
Instruction d'administration: | Le guidage électromyographique n'est pas nécessaire. |
Dose recommandée: | La dose initiale recommandée est de 1,25 à 2,5 unités, injectée dans les parties prétarsales médiale et latérale du muscle orbiculaire de l'œil de la paupière supérieure et dans la partie prétarsale latérale du muscle orbiculaire de l'œil de la paupière inférieure. Le produit peut également être injecté dans d'autres sites de l'arcade sourcilière, de la partie latérale du muscle orbiculaire de l'œil et de la zone faciale supérieure, si des spasmes gênent la vision. |
Dose totale maximale: | La dose initiale ne doit pas dépasser 25 unités par œil. Pour le traitement du blépharospasme la dose totale ne doit pas dépasser de 100 unités toutes les 12 semaines. |
Informations complémentaires: | Les injections à proximité du muscle releveur de la paupière supérieure sont à éviter pour éviter le risque de ptose. En raison de la diffusion de la solution de toxine botulique de type A dans le muscle oblique inférieur, une diplopie peut se manifester. Cet effet indésirable peut être réduit en évitant les injections médiales dans la paupière inférieure. Les schémas suivants indiquent les sites d'injection possibles: |

En général, l'effet initial des injections s'observe dans les trois jours suivants et atteint un maximum une à deux semaines après le traitement. L'effet de chaque traitement persiste environ 3 mois, après quoi les injections peuvent être répétées sans limitation. Lors des nouvelles séances de traitement, la dose peut être augmentée jusqu'à être doublée, si la réponse au traitement initial est jugée insuffisante. Toutefois, l'injection de plus de 5,0 unités par site d'injection semble peu bénéfique. De même, un intervalle inférieur à trois mois entre deux traitements n'apporte aucun bénéfice supplémentaire. Les patients atteints d'hémispasme facial ou de troubles du nerf facial (VII) doivent être traités comme pour un blépharospasme unilatéral et les autres muscles faciaux touchés doivent être traités par des injections de BOTOX® en fonction du degré de spasme. |
Strabisme
Pour les patients de plus de 12 ans uniquement. | |
Aiguille recommandée: | Aiguille stérile de 27 gauges/0,40 mm. |
Instruction d'administration: | Une solution de BOTOX® contenant 2,5 unités par 0,1 ml (voir «Remarques concernant la manipulation» et «Élimination» sous «Remarques particulières»). BOTOX® est destiné à être injecté dans les muscles extra-oculaires en utilisant un guidage électromyographique. Afin de préparer l'œil à l'injection de BOTOX®, quelques gouttes d'un anesthésique local et d'une solution oculaire décongestionnante doivent être administrées quelques minutes avant l'injection. |
Dose recommandée: | Initialement, les doses les plus faibles doivent être utilisées pour le traitement des légères divergences et des doses plus élevées pour les divergences plus marquées. Les doses initiales suivantes en unités sont recommandées (la dose la plus faible est prévue pour des angles de strabisme plus petits): |
opour les muscles verticaux et un strabisme horizontal de moins de 20 dioptries prismatiques: 1,25 unités à 2,5 unités (0,05 à 0,10 ml) dans chaque muscle.
opour un strabisme horizontal de 20 à 50 dioptries prismatiques: 2,5 unités à 5,0 unités (0,10 à 0,20 ml) dans chaque muscle.
opour une paralysie du nerf oculomoteur externe, qui perdure depuis un mois ou plus: 1,25 unités à 2,5 unités dans le muscle rectus medialis.
Dose totale maximale: | La dose maximale recommandée pour une injection unique dans un muscle de l'œil est de 25 unités. Le volume d'injection recommandé de BOTOX® à administrer pour le traitement du strabisme est de 0,05 à 0,15 ml par muscle. |
Informations complémentaires: | Les doses initiales de BOTOX® dilué provoquent habituellement une paralysie des muscles injectés un à deux jours après l'injection. L'intensité de la paralyse augmente pendant la première semaine. Cette paralysie dure 2 à 6 semaines et se résorbe progressivement pendant une période à peu près équivalente. Les sur-corrections durant plus de 6 mois sont rares. Environ la moitié des patients traités nécessitent des doses supplémentaires en raison d'une paralysie insuffisante du muscle après la dose initiale ou à cause de facteurs mécaniques tels que des divergences marquées ou une limitation ou en raison du manque de fusion binoculaire motrice afin de stabiliser l'adaptation. Doses consécutives en cas de strabisme résiduel ou de récidive: |
Il est recommandé de réexaminer les patients 7 à 14 jours après chaque injection pour évaluer l'effet de la dose. Les doses consécutives chez les patients présentant une paralysie suffisante du muscle cible doivent être identiques à la dose initiale. Chez les patients présentent une paralysie incomplète du muscle cible, les doses consécutives peuvent aller jusqu'au double de la dose précédente. Il convient de n'effectuer aucune administration consécutive tant que l'effet de la dose précédente ne s'est pas résorbé, c'est-à-dire tant que les fonctions du muscle injecté et des muscles voisins ne sont pas rétablies. |
Dystonie cervicale
Adultes seulement. | |
Aiguille recommandée: | Aiguille stérile de taille appropriée (généralement 25 à 30 gauges/0,50 à 0,30 mm). |
Instruction d'administration: | Dans les études cliniques sur le traitement de la dystonie cervicale, BOTOX® a été habituellement injecté dans les muscles suivants: sterno-cléido-mastoïdien, élévateur de l'omoplate, scalène, splénius de la tête, semi-épineux, longissimus et/ou trapèze. Cette liste n'est pas exhaustive, car tout muscle qui contrôle la position de la tête peut être atteint et dès lors nécessiter un traitement. Chez les femmes, on observe plus fréquemment des effets secondaires dose-dépendants. Il convient donc de prendre en compte la masse musculaire et le degré d'hypertrophie ou d'atrophie du muscle à traiter lors de la sélection de la dose appropriée. Le schéma d'activation musculaire de la dystonie cervicale peut changer spontanément sans que le tableau clinique de la dystonie en soit modifié. En cas de difficulté pour identifier clairement le muscle touché, les injections doivent être effectuées avec une assistance électromyographique. |
Dose recommandée: | Lors de la première séance de traitement, la dose totale injectée ne doit pas dépasser 200 unités. Lors des séances suivantes, la dose sera ajustée en fonction de la réponse initiale. Dans les premières études cliniques contrôlées visant à prouver l'innocuité et l'efficacité du produit pour le traitement de la dystonie cervicale, les doses de BOTOX® reconstitué allaient de 140 à 280 unités. Dans des études plus récentes, les doses allaient de 95 à 360 unités (avec une moyenne de 240 unités environ). L'administration initiale chez un patient jamais traité auparavant doit commencer à la dose minimale efficace. Il ne faut pas administrer plus de 50 unités dans un même site. Le sterno-cléido-mastoïdien ne doit pas recevoir plus de 100 unités. Afin de minimiser le risque de dysphagie, les injections dans le sterno-cléido-mastoïdien ne doivent pas être bilatérales. |
Dose totale maximale: | La dose totale de 300 unités par traitement ne doit pas être dépassée. Le nombre optimal de sites d'injection dépend de la taille du muscle. Ne pas répéter les injections à moins de 10 semaines d'intervalle. |
Informations complémentaires: | Les améliorations cliniques surviennent généralement dans les deux premières semaines après l'injection. Les effets cliniques maximaux apparaissent en général vers la sixième semaine après l'injection. La durée de l'effet rapportée dans les essais cliniques était très inégale (de 2 à 33 semaines), avec une durée moyenne d'environ 12 semaines. |
Spasticité focale des membres supérieurs associée à un accident vasculaire cérébral (AVC)
Adultes seulement. | |
Aiguille recommandée: | Une aiguille stérile de 25, 27 ou 30 gauges dans les muscles superficiels et une aiguille de 22 gauges dans les muscles plus profonds. |
Instruction d'administration: | Pour localiser les muscles concernés, le recours à un guidage électromyographique ou à la stimulation nerveuse peut être utile. Un contact plus uniforme avec les régions d'innervation du muscle peut être obtenu par l'administration de BOTOX® à plusieurs sites d'injection. Cela peut être utile en particulier chez les muscles grands. |
Dose recommandée: | La posologie exacte doit être déterminée individuellement. La dose et le nombre des sites d'injection dépendent de la grosseur, du nombre et de l'emplacement des muscles impliqués, de la présence d'une faiblesse musculaire locale et de la réponse au traitement antérieur chez le patient. De fortes doses peuvent entraîner une réduction plus durable de la tonicité musculaire. La sévérité de la spasticité musculaire et les groupes musculaires impliqués peuvent varier au cours du temps et il peut être nécessaire d'envisager une modification de la dose de BOTOX® et des muscles à traiter. |
Les doses initiales et les sites d'injection suivants sont recommandés:
Muscle | Posologie totale; | ||
Biceps brachii | 50 à 200 unités; jusqu'à 4 | ||
Flexor digitorum profundus | 7,5 à 30 unités; 1 à 2 | ||
Flexor digitorum sublimis | 7,5 à 30 unités; 1 à 2 | ||
Flexor carpi radialis | 15 à 60 unités; 1 à 2 | ||
Flexor carpi ulnaris | 10 à 40 unités; 1 à 2 | ||
Dose totale maximale: | Dans les études cliniques, la dose de 360 unités chez l'adulte n'a pas été dépassée. La dose totale a été répartie entre les muscles sélectionnés (habituellement, les muscles fléchisseurs du coude, du poignet et des doigts). Il convient généralement de ne pas dépasser une dose de 6 unités/kg de poids corporel. | ||
Informations complémentaires: | Habituellement, on obtient une amélioration du tonus musculaire en l'espace de 2 semaines, avec un effet maximum 4 à 6 semaines après le traitement. Des doses répétées ne doivent être administrées qu'une fois l'effet clinique de l'injection précédente a disparu, mais avec un intervalle de deux mois au moins. | ||
Spasticité cérébrale infantile – Déformation dynamique du pied en équin
Enfants de deux ans et plus. | |
Aiguille recommandée: | Une aiguille stérile appropriée de 23 à 26 gauges/0,60 à 0,45 mm. |
Instruction d'administration: | La dose est injectée en répartissant la dose en plusieurs injections dans le chef médial ou latéral du muscle gastrocnémien atteint. Le traitement doit être commencé à une dose plus faible chez les patients nécessitant en même temps des injections dans d'autres groupes musculaires ou si on suppose que la dose mentionnée puisse entraîner un affaiblissement excessif des muscles traités, p.ex. chez des patients avec de petits muscles. |
Dose recommandée: | Hémiplégie: la dose initiale recommandée est de 4 unités/kg de poids corporel dans la jambe concernée. Diplégie: la dose initiale recommandée est de 6 unités/kg de poids corporel, à répartir entre les deux jambes. |
Dose totale maximale: | 200 unités. |
Information complémentaires: | L'amélioration clinique s'observe généralement dans les deux premières semaines suivant l'injection. De nouvelles injections doivent être effectuées lorsque l'effet clinique de l'injection précédente a disparu, mais avec un intervalle de trois mois minimum entre les séances. Il devrait être possible d'adapter le schéma posologique pour obtenir un intervalle de 6 mois entre deux séances d'injection. |
AFFECTIONS VÉSICALES
Injection dans le muscle détrusor
Adultes seulement.
Instruction d'administration: | Au moment du traitement, les patients ne doivent pas être atteints d'une infection urinaire aiguë. Un traitement antibiotique prophylactique doit être administré 1 à 3 jours avant le traitement, le jour du traitement et 1 à 3 jours après le traitement. Il est conseillé aux patients de cesser le traitement anti-agrégation plaquettaire au moins 3 jours avant l'injection. Les patients sous traitement anticoagulant doivent être pris en charge de façon appropriée pour réduire le risque d'hémorragie. |
Vessie hyperactive
Aiguille recommandée: | Un cystoscope flexible ou rigide peut être utilisé. Avant de commencer les injections, il faut remplir (préparer) l'aiguille d'injection stérile par environ 1 ml de BOTOX® reconstitué (selon la longueur de l'aiguille) pour en retirer totalement l'air. |
Instruction d'administration: | Une instillation intravésicale avec un anesthésique local dilué avec ou sans sédation peut être utilisée avant l'injection, selon les pratiques locales. Si une instillation d'anesthésique locale est effectuée, la vessie doit être vidangée et rincée avec une solution de chlorure de sodium stérile avant les étapes suivantes du processus d'injection. La solution de BOTOX® reconstituée (100 unités Allergan/10 ml) est injectée dans le muscle détrusor au moyen d'un cystoscope souple ou rigide en évitant le trigone. La vessie doit être instillée avec suffisamment de solution de chlorure de sodium afin d'obtenir une visualisation suffisante pour l'injection. Une dilatation exagérée doit cependant être évitée. L'aiguille doit être introduite sur environ 2 mm dans le muscle détrusor et 20 injections de 0,5 ml (volume total de 10 ml) doivent être effectuées à une distance d'environ 1 cm (voir illustration ci-dessous). Comme injection finale, environ 1 ml de solution de chlorure de sodium physiologique stérile sera injecté afin que la dose totale soit administrée. Après administration des injections, la solution de chlorure de sodium utilisée pour la visualisation de la paroi vésicale ne sera pas drainée afin que le patient puisse démontrer sa capacité d'uriner avant sa sortie de la clinique. Le patient sera surveillé pendant au moins 30 minutes après l'injection et jusqu'à ce qu'une vidange spontanée de la vessie ait eu lieu. |

Dose recommandée: | La dose recommandée est de 100 unités Allergan de BOTOX® sous forme d'injections de 0,5 ml (5 unités Allergan), réparties sur 20 endroits du muscle détrusor. |
Informations complémentaires: | Une amélioration clinique peut se manifester dans un délai de 2 semaines. Une nouvelle injection devrait être envisagée pour les patients chez lesquels l'effet clinique de l'injection précédente a diminué (la durée médiane dans les études cliniques de phase III était de 166 jours [~24 semaines]). La nouvelle injection ne devrait cependant pas être effectuée dans les 3 mois qui suivent l'injection vésicale précédente. |
Incontinence urinaire causée par l'hyperactivité neurogène du détrusor
Aiguille recommandée: | Un cystoscope flexible ou rigide peut être utilisé. Avant de commencer les injections, il faut remplir (préparer) l'aiguille d'injection par environ 1 ml (selon la longueur de l'aiguille) pour en retirer totalement l'air. |
Instruction d'administration: | Il est possible d'instiller par voie intravésicale un anesthésique dilué, avec ou sans sédation, ou recourir à une anesthésie générale avant l'injection, selon les pratiques locales. Si un anesthésique local est instillé, la vessie doit être drainée et rincée à l'aide d'une solution saline stérile avant de poursuivre la procédure d'injection. La solution reconstituée de BOTOX® (200 unités Allergan/30 ml) est injectée dans le détrusor à l'aide d'un cystoscope flexible ou rigide, en évitant le trigone. Il faut instiller dans la vessie une quantité suffisante de solution saline pour une bonne visualisation des injections. Une dilatation exagérée doit cependant être évitée. L'aiguille doit être introduite sur environ 2 mm à l'intérieur du détrusor et 30 injections de 1 ml chacune (volume total de 30 ml) doivent être effectuées avec un espace d'environ 1 cm (voir la figure ci-dessus). Pour la dernière injection, environ 1 ml de solution physiologique stérile doit être injecté pour que la dose complète puisse être administrée. Une fois les injections réalisées, la solution saline injectée dans la vessie pour permettre d'en voir les parois doit être drainée. Le patient doit être gardé en observation pendant au moins 30 minutes après l'intervention. |
Dose recommandée: | La dose recommandée est de 200 unités Allergan de BOTOX® réparties en 30 injections d'un volume de 1 ml (~6,7 unités Allergan) dans le détrusor. |
Informations complémentaires: | Une amélioration clinique se produit en général dans les 2 semaines suivant l'intervention. De nouvelles injections sont envisageables chez le patient lorsque l'effet clinique des injections précédentes a diminué (la durée médiane dans les essais cliniques de phase III était de 256 à 295 jours (~36-42 semaines) pour BOTOX® (à raison de 200 unités Allergan)), mais ces nouvelles injections ne doivent pas être faites moins de 3 mois après la dernière injection vésicale. |
AFFECTIONS DE LA PEAU ET APPARENTÉES
Hyperhidrose axillaire primaire
Adultes seulement. | |
Aiguille recommandée: | Aiguille stérile de 30 gauges. |
Instruction d'administration: | Il est possible de délimiter la zone hyperhidrotique en utilisant des techniques de coloration standard, p.ex. le test iode-amidon de Minor. |
Dose recommandée: | 50 unités de BOTOX® (100 unités Allergan/4,0 ml) sont injectés par voie intradermique, réparties équitablement entre plusieurs sites distants d'environ 1 à 2 cm, dans la zone hyperhidrotique de chaque aisselle atteinte. |
Dose totale maximale: | D'autres doses que 50 unités par aisselle n'ayant pas fait l'objet d'études, elles ne peuvent pas être recommandées. Les injections ne doivent pas être répétées plus fréquemment que toutes les 16 semaines. |
Informations complémentaires: | L'amélioration clinique se manifeste généralement dans la première semaine suivant l'injection. Des injections consécutives peuvent être effectuées lorsque les effets cliniques des injections précédentes diminuent et que le médecin traitant l'estime nécessaire. Par expérience, la réponse au traitement persiste pendant 4 à 7 mois. |
TOUTES LES INDICATIONS
En cas d'absence, un mois après la première injection, d'effet thérapeutique, il y lieu de prendre les mesures suivantes:
•Vérification clinique, pouvant inclure un examen électromyographique dans un centre spécialisé, de l'action de la toxine sur le(s) muscle(s) traités).
•Analyse des causes de l'échec thérapeutique, p.ex. mauvaise sélection des muscles à traiter, dose insuffisante, technique d'injection inadaptée, apparition d'une contracture fixée, muscles antagonistes trop faibles, formation d'anticorps.
•Réévaluation de la pertinence du traitement par la toxine botulique de type A.
En l'absence de tout effet indésirable à l'issue de la première séance de traitement, mise en œuvre d'une deuxième séance en respectant les conditions suivantes:
1.) ajustement de la dose en fonction de l'analyse de l'échec thérapeutique précédent,
2.) utilisation du guidage électromyographique,
3.) maintien d'un intervalle de trois mois entre deux séances.
En cas d'absence d'effet thérapeutique ou de diminution des effets après des injections répétées, d'autres méthodes thérapeutiques devront être envisagées.
Contre-indications
•Hypersensibilité connue à la substance active, à savoir la toxine botulique de type A, ou à l'un des excipients selon la composition.
•Présence d'une infection au niveau du (des) site(s) d'injection prévu(s).
Les injections de BOTOX® dans le muscle détrusor sont également contre-indiquées:
•Chez les patients qui souffrent d'une infection urinaire au moment du traitement.
•Chez les patients qui présentent une rétention urinaire aiguë au moment du traitement et qui n'utilisent pas régulièrement un sondage vésical.
•Chez les patients qui ne veulent pas et/ou ne peuvent pas, en cas de besoin, recourir au sondage après le traitement.
Mises en garde et précautions
Les posologies recommandées et la fréquence d'administration de BOTOX® ne doivent pas être dépassées, sous peine de causer un surdosage, une augmentation de la faiblesse musculaire, une diffusion de la toxine à distance du site d'administration et la formation d'anticorps neutralisants. La dose initiale chez des patients non traités auparavant doit être la dose recommandée la plus faible pour l'indication correspondante.
Les médecins et les patients doivent être conscients que des effets indésirables peuvent survenir même si les injections précédentes ont été bien tolérées. Il convient donc de prendre des précautions à chaque administration.
Des effets indésirables liés à la diffusion de la toxine à distance du site d'administration ont été rapportés (voir «Effets indésirables»). Dans quelques cas, ces effets ont été fatals et parfois associés à une dysphagie, une pneumonie et/ou des états de faiblesse. Des symptômes correspondent au mécanisme d'action de la toxine botulique et ont été rapportés plusieurs heures à plusieurs semaines après l'injection. Le risque d'apparition des symptômes est probablement élevé chez les patients souffrant de maladies susceptibles d'augmenter la prédisposition envers ces symptômes. Parmi ces patients, on trouve également des enfants et des adultes traités par de fortes doses pour cause de spasticité.
Le médecin traitant doit être familiarisé avec la technique électromyographique lorsqu'il injecte BOTOX® pour traiter un strabisme. L'effet de BOTOX® n'est pas assuré en présence d'écart supérieur à 50 dioptries en cas de strabisme de type restrictif, de syndrome de Duane ou de strabisme secondaire résultant d'une sur-correction chirurgicale antérieure du muscle antagoniste. Plusieurs cycles de traitement peuvent éventuellement être nécessaires.
Chez les patients traités par des doses thérapeutiques, une faiblesse musculaire accrue peut également survenir.
Avant le début du traitement par BOTOX®, les bénéfices et les risques individuels doivent être évalués.
Des cas de dysphagie après des injections qui n'avaient pas été effectuées dans la musculature cervicale ont aussi été rapportés (pour d'autres informations, voir la section «Précautions à prendre selon les indications», «Dystonie cervicale»).
BOTOX® ne doit être administré qu'avec une extrême prudence et sous contrôle strict chez les patients atteints d'un trouble de la conduction neuromusculaire subclinique ou clinique avéré, comme p.ex. en cas de myasthénie grave ou de syndrome de Eaton-Lambert, chez les patients souffrant de maladies motrices neuropathiques périphériques (p.ex. sclérose latérale amyotrohique ou neuropathie motrice) et chez les patients avec des maladies neurologiques de base. Ces patients peuvent présenter une sensibilité accrue aux principes actifs tels que BOTOX®, également aux doses thérapeutiques, ce qui peut entraîner une faiblesse musculaire prononcée et un risque accru d'effets systémiques cliniquement significatifs, y compris de dysphagie sévère et de trouble respiratoire. La préparation de toxine botulique ne doit, chez ces patients, être utilisée que sous la surveillance par un spécialiste et seulement lorsque les bénéfices du traitement dépassent les risques associés. Les patients avec des antécédents de dysphagie et d'aspiration doivent être traités avec la plus grande prudence.
Il convient d'informer les patients et le personnel soignant de la nécessité de contacter immédiatement le médecin en cas d'apparition de troubles de la déglutition, de l'élocution ou de la respiration.
Il faut conseiller aux patients sortant d'une période de sédentarité de reprendre progressivement et prudemment l'activité physique.
Avant d'utiliser BOTOX®, le médecin doit se familiariser avec l'anatomie du patient et avec les changements anatomiques dus à des interventions chirurgicales. Il faut éviter les injections dans des structures anatomiques fragiles.
Après l'utilisation de BOTOX® à proximité du thorax, un pneumothorax en relation avec l'injection a été rapporté. Il convient d'être prudent en cas d'injection à proximité des poumons (en particulier l'apex) ou dans d'autres structures fragiles.
Des effets indésirables sévères, comprenant des effets avec issue fatale, ont été rapportés chez des patients ayant reçu BOTOX® directement dans les glandes salivaires, la sphère orolinguale, l'œsophage ou l'estomac (indications non autorisées (off-label)). Certains patients souffraient déjà d'une dysphagie ou étaient dans un état de faiblesse avancé.
De rares réactions d'hypersensibilité graves et/ou immédiates y compris choc anaphylactique, maladie sérique, urticaire, œdème des parties molles et dyspnée ont été rapportées. Quelques-unes de ces réactions sont survenues soit après utilisation de BOTOX® seul, soit après utilisation de BOTOX® combiné à d'autres préparations dont l'utilisation s'accompagne de réactions similaires. Si une telle réaction survient, il faut renoncer à une autre injection de BOTOX® et instaurer immédiatement un traitement médical adéquat, p.ex. adrénaline. Dans un cas, une anaphylaxie avec issue fatale a été rapportée chez un patient ayant reçu une injection de BOTOX® reconstituée par inadvertance dans 5 ml d'une solution de lidocaïne à 1%.
Comme pour toute injection, une lésion inhérente à l'administration du médicament peut survenir. Une injection peut conduire à une infection locale, des douleurs, des inflammations, une paresthésie, une hypoesthésie, une sensibilité, une enflure, un érythème et/ou un saignement/une ecchymose. Des douleurs et/ou l'anxiété en rapport avec l'aiguille peuvent induire des réactions vasovagales, p.ex. syncope, hypotension, etc.
La prudence s'impose lorsque BOTOX® est utilisé en présence d'une inflammation au(x) site(s) d'injection proposé(s) ou lorsque le muscle cible présente une faiblesse excessive ou une atrophie. La prudence s'impose également lorsque BOTOX® est utilisé pour le traitement de patients atteints de maladies motrices neuropathies périphériques (p.ex. sclérose latérale amyotrophique ou neuropathie motrice).
Des effets indésirables touchant le système cardiovasculaire comme l'arythmie et l'infarctus du myocarde, parfois avec issue fatale, ont été rapportés après l'utilisation de BOTOX®. Certains de ces patients présentaient des facteurs de risque comme des maladies cardiovasculaires.
Des crises d'épilepsie nouvelles ou répétées ont été rapportées, particulièrement chez des patients avec une prédisposition pour de telles manifestations. La relation précise entre ces cas et l'injection de toxine botulique n'est pas prouvée. Les rapports d'effets indésirables chez les enfants concernent surtout des patients avec parésie cérébrale infantile traités contre la spasticité.
La formation d'anticorps neutralisants dirigés contre la toxine botulique de type A peut réduire l'efficacité d'un traitement par BOTOX® en bloquant l'activité biologique de la toxine. Des résultats de quelques études laissent supposer que l'administration d'injections de BOTOX® à intervalles plus fréquents ou à des doses plus élevées peut conduire à une augmentation de l'incidence de la formation d'anticorps. Le cas échéant, la formation d'anticorps potentielle peut être réduite par l'administration de la dose efficace la plus faible et par le maintien d'un intervalle le plus long possible tout en restant cliniquement approprié entre les injections.
Lors de l'utilisation répétée de BOTOX® (comme avec toutes les toxines botuliques), des variations cliniques peuvent survenir en raison des différences entre les procédures de reconstitution des flacons, des intervalles d'injection, des muscles traités et de légères différences d'activité de la toxine qui sont dues aux essais biologiques utilisés.
Après un contact de BOTOX® avec la peau, la zone de peau concernée doit d'abord être nettoyée avec une solution diluée d'hypochlorite, puis rincée abondamment à l'eau courante. Dans le cas d'une piqûre accidentelle, la zone de peau concernée doit également être nettoyée immédiatement et le patient doit être surveillé comme recommandé dans la rubrique «Surdosage». En cas de contact avec les yeux, l'œil concerné doit être rincé abondamment à l'eau courante ou avec une solution appropriée.
Si une contamination accidentelle est suspectée (p.ex. contact avec la peau ou piqûre accidentelle), la zone de peau doit immédiatement être nettoyée. Le patient doit être surveillé médicalement comme recommandé dans le paragraphe «Surdosage».
Utilisation chez les enfants et les adolescents
L'innocuité et l'efficacité de BOTOX® ne sont pas prouvées pour des indications autres que celles mentionnées pour les enfants et les adolescents dans la rubrique «Indications/Possibilités d'emploi». Des cas de diffusion éventuelle de la toxine dans des zones éloignées du site d'injection ont été très rarement rapportés après la commercialisation du produit chez des enfants et des adolescents présentant une maladie supplémentaire. Ces cas concernaient surtout des patients présentant des parésies cérébrales infantiles. En général, la posologie utilisée dans ces cas était supérieure à celle recommandée (voir «Effets indésirables»).
Des décès ont été rarement rapportés chez des enfants souffrant de parésie cérébrale sévère après un traitement par la toxine botulique, parfois en relation avec une pneumonie d'aspiration et parfois après une utilisation non autorisée (off-label) (p.ex. au niveau de la nuque). Des précautions extrêmes sont indispensables lors du traitement des enfants et des adolescents en état de faiblesse neurologique sévère, de dysphagie ou avec des antécédents de pneumonie d'aspiration ou de maladie pulmonaire. Le traitement chez les patients en mauvaise santé ne doit avoir lieu que si le médecin estime que les bénéfices éventuels dépassent les risques en fonction de la situation individuelle.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par unité de dosage, c'est-à-dire qu'il est pratiquement «sans sodium».
Précautions à prendre selon les indications
AFFECTIONS NEUROLOGIQUES
Blépharospasme
Une diminution des clignements après l'injection de toxine botulique dans le muscle orbiculaire de l'œil peut conduire à une sollicitation intense de la cornée, des défauts épithéliaux durables et des ulcérations de la cornée, surtout chez les patients avec des troubles du nerf cérébral VII. Il convient d'effectuer des tests minutieux de sensibilité cornéenne sur les yeux précédemment opérés, d'éviter toute injection dans la zone médiale de la paupière inférieure pour prévenir la formation d'ectropion et de traiter activement toute lésion épithéliale. Ces traitements peuvent nécessiter l'emploi d'un collyre protecteur, d'une pommade, de lentilles souples thérapeutiques ou l'occlusion de l'œil par un cache-œil ou un autre moyen.
Des ecchymoses sont possibles dans les tissus mous de la paupière. Il est possible de minimiser ce phénomène en appliquant une pression légère au point d'injection après l'injection.
En raison de l'activité anticholinergique de la toxine botulique, la prudence s'impose chez les patients présentant un glaucome à angle fermé, y compris les patients atteints d'un angle de la chambre antérieure anatomiquement étroit.
Strabisme
BOTOX® est inefficace dans le traitement du strabisme paralytique chronique, sauf pour réduire une contracture du muscle antagoniste en relation avec une correction chirurgicale. Lors de l'utilisation de BOTOX® pour traiter le strabisme, un saignement rétrobulbaire ou une perforation du bulbe peuvent se produire.
Dystonie cervicale
En cas de dystonie cervicale, des injections de BOTOX® peuvent causer une dysphagie très légère à sévère. Consécutivement à la dysphagie, une aspiration et une dyspnée sont possibles et peuvent entraîner dans des cas très rares la nécessité d'une alimentation artificielle. On a signalé de rares cas de dysphagies associée à une pneumonie d'aspiration et la mort. La dysphagie peut durer pendant 2 à 3 semaines après l'injection mais des cas de dysphagie durant jusqu'à 5 mois ont été rapportés.
La fréquence des dysphagies est dose-dépendante et il est possible de la réduire en maintenant la dose injectée dans le muscle sterno-cléido-mastoïdien inférieure à 100 unités. Les patients présentant une faible masse musculaire au niveau du cou ou ayant reçu une injection bilatérale dans le muscle sterno-cléido-mastoïdien présentent un risque de dysphagie plus élevé. La dysphagie est imputable à la diffusion de la toxine dans la musculature œsophagienne. Les patients souffrant de dystonie cervicale doivent être informés du risque de dysphagie en tant qu'effet indésirable.
Des injections dans l'élévateur de l'omoplate peuvent s'accompagner d'une augmentation du risque d'infection des voies respiratoires supérieures et de dysphagie.
Une dysphagie peut contribuer à une diminution de la prise de nourriture et d'eau, ce qui conduit à une perte de poids et à une déshydratation. Les patients avec une dysphagie subclinique peuvent présenter un risque accru de dysphagie sévère après une injection de BOTOX®.
Spasticités focales associée à une infirmité motrice cérébrale infantile et spasticités focales des extrémités supérieures chez l'adulte due à un accident vasculaire cérébral
BOTOX® est un traitement des spasticités focales étudié seulement en association avec des traitements standards qu'il ne vise pas à remplacer.
Il est peu probable qu'il puisse améliorer la mobilité d'une articulation touchée par une contracture fixée.
Il existe des rapports post-commercialisation signalant des cas de décès suite à un traitement par la toxine botulique (dans certains cas dus à une pneumonie d'aspiration) et une diffusion possible de la toxine dans des zones éloignées du site d'application chez des enfants souffrant de maladies supplémentaires, en particulier d'infirmité motrice cérébrale. Voir les mises en garde concernant «l'utilisation chez les enfants et les adolescents» dans la rubrique «Mises en garde et précautions». Un rapport causal avec BOTOX® n'a pas été démontré dans les cas mentionnés.
DYSFONCTIONS VÉSICALES
Injections dans le muscle détrusor
Les précautions médicales d'usage doivent être mises en œuvre lors de la cystoscopie.
Chez les patients qui n'ont pas recours au sondage vésical, le volume urinaire résiduel post-mictionnel doit être évalué dans les 2 semaines suivant le traitement, puis de façon périodique selon avis médical durant une période allant jusqu'à 12 semaines. Les patients doivent être informés de la nécessité de contacter leur médecin en cas de difficultés lors de la miction, car dans ce cas, un sondage vésical est éventuellement nécessaire.
Vessie hyperactive
BOTOX® doit être utilisé avec précautions chez les patients atteints d'obstructions dans la région du col vésical (p.ex. obstructions des voies urinaires chez les patients atteints d'une hyperplasie de la prostate).
Incontinence urinaire causée par l'hyperactivité neurogène du détrusor
Une hyper-refléxie autonome associée à la procédure peut survenir. Dans ce cas, un traitement médical immédiat peut être nécessaire.
AFFECTIONS DE LA PEAU ET APPARENTÉES
Hyperhidrose axillaire primaire
Il convient de rechercher les causes éventuelles d'une hyperhidrose secondaire (p.ex. hyperthyroïdie, phéochromocytome), afin d'éviter le traitement symptomatique d'une hyperhidrose, sans diagnostic et/ou traitement de la pathologie sous-jacente.
Interactions
Théoriquement l'effet de la toxine botulique de type A peut-être potentialisé par la co-administration de BOTOX® avec des antibiotiques aminoglycosides, la spectinomycine ou d'autres agents pouvant interférer avec la transmission neuromusculaire (p.ex. relaxants musculaires).
L'effet de l'administration simultanée ou à plusieurs mois d'intervalle de différents sérotypes de toxine botulique est inconnu. Une faiblesse neuromusculaire marquée peut être exacerbée par l'administration d'une autre toxine botulique avant la résolution complète des effets d'une toxine botulique préalablement administrée.
Les myorelaxants doivent être utilisés avec prudence.
Aucune étude d'interaction n'a été effectuée. Aucune interaction d'importance clinique n'a été rapportée.
Enfants et adolescents
Aucune étude pour l'enregistrement des interactions n'a été réalisée chez l'enfant et l'adolescent.
Grossesse/Allaitement
Grossesse
Il n'existe pas de données suffisantes concernant l'utilisation de la toxine botulique de type A pendant la grossesse. Les études réalisées sur les animaux ont mis en évidence un effet de toxicité reproductive (voir section «Données précliniques»).
Le risque potentiel pour l'homme est inconnu. BOTOX® ne doit pas être utilisé pendant la grossesse ou chez des femmes en âge de procréer qui n'utilisent pas de méthode de contraception, sauf en cas de nécessité absolue. Si la patiente tombe enceinte pendant le traitement, elle doit être informée des risques potentiels de fausse couche et de malformation congénitale.
Allaitement
On ne sait pas si BOTOX® passe dans le lait maternel. L'utilisation de BOTOX® pendant l'allaitement ne peut pas être recommandée.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude concernant les effets sur l'aptitude à la conduite et l'utilisation des machines n'a été effectuée.
BOTOX® peut cependant provoquer une asthénie, une faiblesse musculaire, des vertiges et des troubles visuels pouvant influencer l'aptitude à participer activement au trafic routier et à utiliser des machines.
Effets indésirables
En général
Des effets indésirables, qui, de l'avis des médecins investigateurs étaient en rapport avec BOTOX®, ont été rapportés dans des études cliniques contrôlées: chez 35% des patients avec blépharospasme, chez 28% des patients avec dystonie cervicale, chez 17% des patients avec infirmité motrice cérébrale infantile (pied équin), chez 11% des patients avec hyperhidrose axillaire primaire et chez 16% des patients avec spasticité focale des membres supérieurs associée à l'AVC. Dans des études cliniques portant sur la vessie hyperactive, la fréquence était de 26% lors du premier traitement et de 22% lors du second traitement. Dans des études cliniques relatives à l'incontinence urinaire causée par l'hyperactivité neurogène du détrusor, la fréquence était de 32% après le premier traitement, puis de 18% après le second traitement.
En général, les effets secondaires s'observent dans les premiers jours suivant l'injection et peuvent persister pendant plusieurs mois ou, dans des cas rares, plus longtemps, bien qu'en général ils soient transitoires.
L'action pharmacologique attendue de la toxine botulique est une faiblesse musculaire locale. Cependant la faiblesse des muscles adjacents et/ou des muscles à distance du site d'injections a été rapportée.
Comme pour toute injection, on peut observer une douleur localisée, une inflammation, une paresthésie, une hypoesthésie, une sensibilité à la pression, un gonflement/œdème, un érythème, une infection locale, des saignements et/ou épanchements sanguins sont survenus au site d'injection. Des douleurs dues à l'aiguille d'injection et/ou des sentiments d'angoisse ont entraîné des réactions vasovagales, y compris une hypotension symptomatique transitoire et une syncope. De la fièvre et des symptômes grippaux ont aussi été rapportés après des injections de toxine botulique.
Effets secondaires – fréquence par indication
Les paragraphes suivants contiennent, en fonction des domaines d'indications, des données sur la fréquence des effets secondaires documentés dans des études cliniques.
Les fréquences sont définies comme suit: très fréquents (≥1/10); fréquents (≥1/100 à <1/10); occasionnels ( ≥1/1000 à <1/100); rares (≥1/10 000 à <1/1000); très rares (<1/10 000).
AFFECTIONS NEUROLOGIQUES
Blépharospasme/hémispasme facial
Affections du système nerveux
Occasionnels: vertiges, parésie faciale, paralysie faciale.
Affections oculaires
Très fréquents: ptose de la paupière supérieure (11%).
Fréquents: kératite ponctuée, lagophthalmie, sécheresse oculaire, irritation oculaire, photophobie, larmoiement augmenté.
Occasionnels: kératite, ectropion, diplopie, entropion, troubles visuels, vision trouble.
Rares: œdème palpébral.
Très rares: kératite ulcéreuse, altération de l'épithélium cornéen, perforation de la cornée.
Affections de la peau et du tissu sous-cutané
Fréquents: ecchymose.
Occasionnels: exanthème, dermatite.
Troubles généraux et anomalies au site d'administration
Fréquents: œdème facial, irritations.
Occasionnels: asthénie.
Strabisme
Affections oculaires
Très fréquents: troubles du mouvement des yeux (16,9%), ptose de la paupière supérieure (15,7%).
Occasionnels: hémorragies oculaires rétrobulbaires, pénétration des yeux, pupille d'Adie-Holmes.
Rares: hémorragie du corps vitré.
Dystonie cervicale
Infections et infestations
Fréquents: rhinite, infection des voies respiratoires supérieures.
Affections du système nerveux
Fréquents: vertiges, céphalées, hypoesthésie, hypertonie musculaire, somnolence.
Affections oculaires
Occasionnels: diplopie, ptose de la paupière supérieure.
Affections respiratoires, thoraciques et médiastinales
Occasionnels: dyspnée, dysphonie.
Affections gastro-intestinales
Très fréquents: dysphagie (jusqu'à 18,6% des patients, avec une dose moyenne de 240,5 unités) (voir également «Informations supplémentaires» plus bas).
Fréquents: bouche sèche, nausées.
Affections musculo-squelettiques et du tissu conjonctif
Très fréquents: faiblesse musculaire (12,8%).
Fréquents: raideur de la musculature squelettique, courbatures.
Troubles généraux et anomalies au site d'administration
Très fréquents: douleur (16,3%).
Fréquents: asthénie, symptômes grippaux, malaise.
Occasionnels: fièvre.
Spasticité focale des extrémités supérieures associée à un AVC
Affections psychiatriques
Occasionnels: dépression, insomnie.
Affections du système nerveux
Fréquents: hypertonie musculaire.
Occasionnels: paresthésie, céphalées, hypoesthésie, amnésie, troubles de la coordination.
Affections de l'oreille et du labyrinthe
Occasionnels: vertiges.
Affections vasculaires
Occasionnels: hypotension orthostatique.
Affections gastro-intestinales
Occasionnels: nausées, paresthésie orale.
Affections de la peau et du tissu sous-cutané
Fréquents: ecchymoses, purpura.
Occasionnels: dermatite, prurit, exanthème.
Affections musculo-squelettiques et du tissu conjonctif
Fréquents: douleur dans les extrémités, faiblesse musculaire.
Occasionnels: arthralgie, bursite.
Troubles généraux et anomalies au site d'administration
Fréquents: douleurs au site d'injection, fièvre, symptômes grippaux, saignements ou irritations au site d'injection.
Occasionnels: douleurs, sensation de malaise, asthénie, hypersensibilité au site d'administration, œdème périphérique.
Certains des effets indésirables rapportés occasionnellement peuvent être dus à la maladie.
Parésie cérébrale infantile
Infections et infestations
Très fréquents: infection virale (14,6%), infection auriculaire (15,7%).
Affections du système nerveux
Fréquents: tremblement nerveux, troubles de la démarche, anomalie de la coordination, somnolence, paresthésie.
Affections de la peau et du tissu sous-cutané
Fréquents: exanthème.
Affections musculo-squelettiques et du tissu conjonctif
Fréquents: myalgie, faiblesse musculaire, tonus élevé de la musculature (de la jambe), douleurs dans les extrémités.
Occasionnels: arthralgie.
Affections du rein et des voies urinaires
Fréquents: incontinence urinaire.
Troubles généraux et anomalies au site d'administration
Fréquents: malaise, asthénie, douleurs au site d'administration.
Occasionnels: fièvre.
Lésions, intoxications et complications liées aux procédures
Fréquents: chutes.
AFFECTIONS VÉSICALES
Vessie hyperactive
Infections et infestations
Très fréquents: infections des voies urinaires (25,5%).
Fréquents: bactériurie.
Affections du rein et des voies urinaires
Très fréquents: dysurie (10,9%).
Fréquents: rétention urinaire, pollakiurie.
Investigations
Fréquents: volume d'urine restante*.
*Volume d'urine restante accru après vidange de la vessie qui ne nécessite pas de cathétérisme.
Les effets secondaires fréquents dus à la procédure étaient la dysurie et l'hématurie.
Un cathétérisme intermittent propre a été instauré chez 6,5% des patients après le traitement par 100 unités Allergan de BOTOX® contre 0,4% dans le groupe placebo.
Parmi les 1'242 patients participant à des études cliniques contrôlées contre placebo, 41,4% (n = 514) avaient ≥65 ans et 14,7% (n = 182) ≥75 ans. Dans l'ensemble, aucune différence sur le plan du profil de la sécurité n'a été constatée après le traitement par BOTOX® entre les patients de 65 ans et plus et les patients de moins de 65 ans, à l'exception du fait que les infections des voies urinaires se sont manifestées plus fréquemment chez les patients plus âgés, tant dans le groupe placebo que dans le groupe BOTOX®, que chez les patients plus jeunes.
Dans l'ensemble, aucune modification du profil de la sécurité n'a été observée lors de l'administration répétée.
Incontinence urinaire causée par l'hyperactivité neurogène du détrusor
Effets indésirables à l'issue des études cliniques de phase 2 et des études cliniques pivots de phase 3
Infections et infestations
Très fréquents: infections des voies urinaires (49%).
Affections psychiatriques
Fréquents: insomnie.
Affections gastro-intestinales
Fréquents: constipation.
Affections musculo-squelettiques et du tissu conjonctif
Fréquents: faiblesse musculaire, spasmes musculaires.
Affections du rein et des voies urinaires
Très fréquents: rétention urinaire (17%).
Fréquents: hématurie*, dysurie*, diverticules vésicaux.
Troubles généraux et anomalies au site d'administration
Fréquents: fatigue, troubles de la marche.
Lésions, intoxications et complications liées aux procédures
Fréquents: hyper-réflexie* autonome, chute.
* Effets indésirables liées à la procédure
Dans les études cliniques, des infections des voies urinaires ont été rapportées chez 49,2% des patients ayant été traités par 200 unités Allergan de BOTOX® et chez 35,7% des patients ayant été traités par un placebo (53,0% des patients avec sclérose en plaques (SEP) ayant reçu 200 unités Allergan contre 29,3% dans le groupe placebo; 45,4% des patients atteints de lésions médullaires ayant été traités par 200 unités Allergan contre 41,7% de ceux ayant été traités par placebo). Des rétentions urinaires ont été rapportées chez 17,2% des patients ayant été traités par 200 unités Allergan de BOTOX®, ainsi que chez 2,9% de ceux traités par placebo (28,8% des patients avec sclérose en plaques ayant reçu 200 unités Allergan contre 4,5% dans le groupe placebo; 5,4% des patients atteints de lésions médullaires ayant été traités par 200 unités Allergan contre 1,4% de ceux ayant été traités par placebo).
Lors d'administrations répétées, aucune modification de la nature des effets indésirables n'a été rapportée.
Chez les patients avec SEP ayant participé aux études pivots, aucune modification du taux annuel de poussée de SEP (c.-à-d. le nombre de poussées de SEP par année-patient) n'a été observée (BOTOX® = 0,23; placebo = 0,20).
Parmi les patients qui n'avaient pas recours à un sondage vésical au début de l'étude, avant le traitement, un sondage a été instauré dans 38,9% des cas après le traitement par BOTOX® 200 unités Allergan contre 17,3% des cas chez les patients recevant le placebo.
Effets indésirables à l'issue de l'étude réalisée après l'autorisation de mise sur le marché avec 100 unités Allergan de BOTOX® sur des patients SEP non cathétérisés en début d'étude
Infections et infestations
Très fréquents: infections des voies urinaires (39,4%), bactériurie (18,2%).
Affections du rein et des voies urinaires
Très fréquents: rétention urinaire (16,7%).
Fréquents: hématurie**, dysurie**.
Investigations
Très fréquents: volume d'urine restante** (16,7%)
* Effets indésirables liées à la procédure
** Volume d'urine restante accru qui ne nécessite pas de cathétérisme
Un sondage a été instauré chez 15,2% des patients après le traitement avec 100 unités Allergan de BOTOX® par rapport à 2,6% des patients recevant le placebo.
AFFECTIONS DE LA PEAU ET DU TISSU SOUS-CUTANÉ
Hyperhidrose axillaire primaire
Affections du système nerveux
Fréquents: douleurs, céphalées, paresthésie.
Affections vasculaires
Fréquents: bouffées de chaleur.
Affections gastro-intestinales
Occasionnels: nausées.
Affections de la peau et du tissu sous-cutané
Fréquents: hyperhidrose (sudation non-axillaire), odeur anormale de la peau, prurit, nodule sous-cutané, alopécie.
Affections musculo-squelettiques et du tissu conjonctif
Fréquents: douleurs dans les extrémités.
Occasionnels: faiblesse des bras, myalgie, arthropathie.
Troubles généraux et anomalies au site d'administration
Très fréquents: douleurs au site d'injection (11,5%).
Fréquents: douleurs, œdème/saignement/hypersensibilité/irritation au site d'administration, asthénie, réactions au site d'administration.
Lors du traitement de l'hyperhidrose axillaire primaire, une augmentation de la production de sueur en dehors des aisselles a été rapportée chez 4,5% des patients dans le mois suivant l'injection. Ce faisant, un schéma relatif aux sites anatomiques n'a pas été défini. Chez environ 30% des patients, une régression a pu être constatée dans les 4 mois.
Occasionnellement (0,7%) une légère faiblesse transitoire des bras ne nécessitant cependant pas de traitement et qui s'est améliorée sans séquelles a été rapportée. Cet effet secondaire pourrait être dû au traitement, à la technique d'injection ou aux deux. Lors de la faiblesse musculaire rapportée occasionnellement, un examen neurologique peut être envisagé. En outre, un contrôle de la technique d'injection est indiqué avant les injections suivantes afin d'assurer le placement intradermique des injections.
Effets indésirables après commercialisation
La liste suivante indique des effets médicamenteux indésirables ou d'autres effets indésirables médicalement pertinents rapportés indépendamment de l'indication depuis la commercialisation du médicament, en plus des effets indésirables mentionnés dans la rubrique «Mises en garde et précautions» et la rubrique «Effets indésirables».
Affections du système immunitaire
Anaphylaxie, angio-œdème, maladie sérique et urticaire.
Troubles du métabolisme et de la nutrition
Anorexie.
Affections du système nerveux
Plexopathie brachiale, dysphonie, dysarthrie, parésie faciale, hypoesthésie, faiblesse musculaire, myasthénie grave, neuropathie périphérique, paresthésie, radiculopathie, convulsions, syncope et paralysie faciale.
Affections oculaires
Glaucome à angle étroit (lors du traitement du blépharospasme), strabisme, vue trouble, troubles de la vue, sécheresse oculaire et œdème palpébral.
Affections de l'oreille et du labyrinthe
Hypoacousie, acouphène et vertiges.
Affections cardiaques
Arythmie, infarctus du myocarde.
Affections respiratoires, thoraciques et médiastinales
Pneumonie d'aspiration (avec parfois une issue fatale), dyspnée, dépression respiratoire et insuffisance respiratoire.
Affections gastro-intestinales
Douleurs abdominales, diarrhée, constipation, sécheresse buccale, dysphagie, nausées et vomissements.
Affections de la peau et du tissu sous-cutané
Alopécie, dermatite de type psoriasis, érythème multiforme, hyperhidrose, madarosis, prurit et éruption cutanée.
Troubles musculo-squelettiques et du tissu conjonctif
Atrophie musculaire, myalgie et contractions musculaires localisées/contractions musculaires involontaires.
Troubles généraux et anomalies au site d'administration
Atrophie par dénervation, malaise et fièvre.
Dans le traitement du strabisme, on a enregistré un cas de saignement du corps vitré, qui s'est résorbé par la suite. On connaît certains cas d'hémorragies rétrobulbaires, sans perte de vision cependant. Cinq yeux ont présenté des modifications pupillaires, avec une lésion du ganglion ciliaire (pupille d'Adie).
Une patiente a développé une plexopathie brachiale deux jours après avoir reçu par injection 120 unités de BOTOX® pour le traitement d'une dystonie cervicale, la guérison intervenant cinq mois après.
Chez des patients atteints de spasticité des extrémités supérieures après un AVC, on a réalisé des mesures de spirométrie pulmonaire indiquant une diminution de 15% de la fonction pulmonaire. L'incidence de cet effet indésirable a été plus importante parmi le groupe de patients ayant reçu BOTOX® que dans le groupe ayant reçu un placebo, même si les différences n'étaient ni cliniquement, ni statistiquement, significatives.
Dans le traitement de l'hyperhidrose axillaire primaire, on a signalé une augmentation perçue de la sudation non-axillaire chez 4,5% des patients dans le mois suivant l'injection, sans lien systématique avec les sites anatomiques touchés. On a constaté une résolution de ce trouble chez 30% environ des patients au bout de quatre mois.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Le surdosage de BOTOX® est un terme relatif et dépend de la dose, du site d'injection et des propriétés tissulaires sous-jacentes. Aucun cas de toxicité systémique résultant d'une injection accidentelle de solution de BOTOX® n'a été observé. Des surdosages peuvent causer des paralysies neuromusculaires locales ou éloignées, générales et profondes. Aucun cas d'ingestion de BOTOX® n'a été rapporté.
Les signes et symptômes d'un surdosage ne se manifestent pas immédiatement après une injection. En cas d'injection accidentelle ou d'ingestion ou de surdosage suspecté, le patient doit être soumis à une surveillance médicale durant plusieurs semaines à la recherche des signes et symptômes croissants d'une faiblesse musculaire locale ou éloignée du site d'injection, comme la ptose, la diplopie, la dysphagie, la dysarthrie, la faiblesse généralisée ou l'insuffisance respiratoire. Chez ces patients, on considérera des investigations complémentaires et initiera immédiatement un traitement médical approprié, éventuellement avec hospitalisation du patient.
Si la musculature de l'oropharynx et de l'œsophage est touchée, une pneumonie d'aspiration peut se manifester. Si une paralysie ou un affaiblissement marqué des muscles respiratoires survient, une intubation et une assistance respiratoire seront nécessaires jusqu'au rétablissement et une trachéostomie ainsi qu'une respiration artificielle durant une longue période peuvent s'avérer nécessaires en plus des mesures de soutien générales.
Propriétés/Effets
Code ATC
M03AX01
Mécanisme d'action
La toxine botulique de type A bloque la libération d'acétylcholine périphérique au niveau des terminaisons nerveuses cholinergiques présynaptiques par clivage de la SNAP-25. Cette dernière est une protéine synaptique de 25 kDa, nécessaire à l'ancrage et à la libération de l'acétylcholine par les vésicules situées au sein des terminaisons nerveuses.
Pharmacodynamique
Après l'injection, il se produit une liaison initiale rapide et de haute affinité entre la toxine et des récepteurs cellulaires de surface spécifiques. Celle-ci est suivie du transfert de la toxine à travers la membrane plasmique par endocytose médiée par les récepteurs. Enfin, la toxine est libérée dans le cytoplasme. Ce processus est accompagné d'une inhibition progressive de la libération d'acétylcholine. Les signes cliniques se manifestent dans un délai de 2 à 3 jours, avec un effet maximal constaté 5 à 6 semaines après l'injection. Au niveau des neurones sensoriels, BOTOX® inhibe la libération des neurotransmetteurs sensoriels (p.ex. substance P, CGRP) et réduit l'expression des récepteurs de surface cellulaire (p.ex. TRPV1). BOTOX® empêche également la sensibilisation des neurones sensoriels nociceptifs et l'inverse.
Après une injection intramusculaire, la transmission de l'influx nerveux se rétablit normalement en l'espace de 12 semaines, lorsque les terminaisons nerveuses repoussent et se reconnectent avec les plaques motrices.
Après une injection intradermique visant les glandes sudoripares écrins, l'effet dure environ 4 à 7 mois chez des patients traités par 50 unités par aisselle.
En utilisant BOTOX® pour traiter le strabisme, on suppose que ce produit agit sur des paires de muscles dans lesquelles le muscle traité est soumis à un étirement atrophique et le muscle antagoniste correspondant est raccourci.
Après injection dans la musculature de la nuque, BOTOX® améliore les signes objectifs et les symptômes subjectifs de la dystonie cervicale. Cette amélioration se manifeste par une réduction de la torsion latérale de la tête, un moindre soulèvement des épaules, un volume et une force plus faibles des muscles hypertrophiés, ainsi qu'une atténuation de la douleur.
Chez l'adulte atteint de spasticité focale des extrémités supérieures après un AVC, BOTOX® améliore de façon importante la mobilité (coude et poignet).
Chez les enfants présentant une déformation dynamique du pied en équin sans rétraction et sans atrophie importante, l'injection de BOTOX® entraîne, grâce à la dénervation partielle du muscle gastrocnémien, une modification de la position de la cheville et par conséquent une amélioration importante de la démarche.
Après injection dans le détrusor, BOTOX® inhibe le message efférent contrôlant l'activité motrice du détrusor en bloquant la libération d'acétylcholine. De plus, BOTOX® inhibe les neurotransmetteurs afférents et les voies sensitives.
Efficacité clinique
AFFECTIONS NEUROLOGIQUES
Blépharospasme/hémispasme facial
Au cours d'une étude ouverte, 56 patients souffrant d'hémispasme facial ont reçu une injection initiale de 10 à 50 unités de BOTOX®, ils ont été ensuite observés pendant 22 semaines. Les patients sans amélioration à la semaine 4 ont reçu une nouvelle injection (5 à 50 unités). Les patients ont été contrôlés aux semaines 2, 4 (si un nouveau traitement s'avérait nécessaire), 6, 14 et 22. A chaque contrôle, l'effet clinique a été évalué pour les divers muscles inférieurs et supérieurs du visage.
Une amélioration est intervenue chez tous les 56 patients et elle était nette chez 62,5% (35/56) d'entre eux. Une amélioration des muscles supérieurs du visage a été observée chez tous les patients. Lors de l'évaluation des muscles inférieurs du visage, il est apparu que tous les patients sauf deux avaient répondu au traitement.
Une étude supplémentaire, randomisée et multicentrique à double insu avec groupes parallèles, a été effectuée chez des patients avec blépharospasme essentiel bénin pour comparer la sécurité et l'efficacité de deux formulations de BOTOX® (la substance active provenait de diverses banques de cellules primaires - dont l'une correspond à la formulation actuelle de BOTOX®). Les participants à l'étude avaient déjà été traités par BOTOX®. Le traitement consistait en un cycle unique d'injections dans les muscles orbiculaires des deux yeux. Le médecin examinateur déterminait la dose (maximum admissible: 100 unités) et les sites d'injection en fonction de la réponse du patient aux précédents traitements au BOTOX®. Les patients sont restés sous observation pendant 12 semaines après le traitement. L'étude comprenait 98 patients (48 dans le groupe traité par la formulation BOTOX® actuelle).
Le taux de succès du traitement a été noté de 0 à 4 sur une échelle de 5 points. Le score 0 signifiait «aucun» spasme des paupières et le 4 un spasme «sérieux» invalidant pouvant éventuellement affecter d'autres muscles du visage. En cas de diminution du score ≤2 aux deux yeux, le traitement était considéré comme un succès. Le critère primaire d'évaluation se situait à la semaine 4. Les patients ont reçu une dose moyenne de 33 unités par œil, injectée dans 3 à 15 sites. Le taux de succès de la formulation BOTOX® actuelle s'est élevé à environ 90% à la semaine 4, ce qui est comparable avec l'ancienne formulation BOTOX®.
Dystonie cervicale
Une étude multicentrique randomisée à double insu et contrôlée contre placebo a été effectuée auprès de patients adultes souffrant de dystonie cervicale (DC) qui avaient répondu positivement à un traitement antérieur par BOTOX®. Cette étude comprenait 2 phases de traitement, à savoir une phase ouverte où tous les patients étaient traités par BOTOX®, le dosage et les sites d'injection étant déterminés individuellement par le médecin examinateur, et une phase à double insu dans laquelle BOTOX® ou le placebo étaient administrés à tous les patients ayant répondu durant la phase ouverte. Un intervalle de jusqu'à 6 semaines séparait ces deux phases. Les patients ont reçu jusqu'à 360 unités BOTOX® au total.
Dans la phase d'étude ouverte, 214 patients ont été évalués, dont 170 ont participé à la phase d'étude randomisée en double insu, soit 88 dans le groupe BOTOX® et 82 dans le groupe placebo. Par la suite, les patients ont été contrôlés toutes les 2 semaines pendant une période allant jusqu'à 10 semaines après le traitement. Les variables primaires d'efficacité étaient la modification de la position de la tête (mesurée sur l'échelle d'évaluation de la sévérité de la DC) et le pourcentage des patients présentant une amélioration de leur DC, mesurée six semaines après le traitement au moyen d'une échelle d'évaluation médicale. Les douleurs, symptôme important de la DC, ont été évaluées par les patients quant à leur fréquence et leur intensité. En outre, médecins et patients ont apprécié le degré de handicap fonctionnel.
BOTOX® s'est avéré significativement supérieur au placebo après 6 semaines selon les deux variables primaires d'efficacité, tant cliniquement que statistiquement. BOTOX® a également permis une diminution significativement meilleure au niveau statistique de l'intensité et de la fréquence des douleurs que le placebo. Des améliorations significatives ont aussi été observées à la semaine 6 lors de l'évaluation du handicap fonctionnel par le médecin et le patient.
Une étude supplémentaire, randomisée à double insu en essai croisé, a été effectuée chez des patients souffrant de dystonie cervicale pour analyser la sécurité et l'efficacité de deux formulations de BOTOX® (la substance active provenait de diverses banques de cellules primaires – dont l'une correspond à la formulation actuelle de BOTOX®). Les participants à l'étude avaient déjà été traités par BOTOX® avec des résultats satisfaisants; le traitement comprenait 2 injections séparées par une période de «lavage» de 8 à 16 semaines. Après chaque traitement, les patients ont observé pendant 8 à 16 semaines, le critère primaire d'évaluation étant déterminé à la semaine 6 après chaque traitement.
Cette étude comprenait 135 patients. La variable primaire d'efficacité était l'évaluation globale de la gravité sur la «Toronto Western Spasmodic Torticollis Rating Scale» (TWSTRS). Les variables secondaires d'efficacité étaient le score d'infirmité/douleur selon la TWSTRS modifiée et l'évaluation globale de la dystonie cervicale par le médecin et le patient. Les résultats ont confirmé qu'une amélioration clinique maximale après l'injection de BOTOX® a été atteinte à la semaine 6. La diminution moyenne du score total sur la TWSTRS a correspondu à une amélioration de 35% par rapport aux valeurs initiales; la plus forte diminution moyenne du score d'infirmité/douleurs a correspondu à une amélioration de 50% par rapport à la valeur initiale à ce moment.
L'évaluation globale faite par les médecins et les patients a indiqué également un effet positif du traitement avec un taux de succès noté à la semaine 6 pour la nouvelle formulation de BOTOX® de plus de 85% resp. 80% des cas.
Parésie cérébrale infantile
Une étude multicentrique contrôlée contre placebo à double insu a été effectuée auprès de 145 enfants atteints de parésie cérébrale qui souffraient de spasticité des extrémités inférieures en relation avec une contracture musculaire dynamique et une position du pied en équin à la marche. Les patients ont été randomisés dans le groupe BOTOX® (n = 72) ou placebo (n = 73). La dose totale injectée dans le muscle gastrocnémien de chaque patient a été de 4 unités/kg avec un maximum de 200 unités au cours d'une période de 30 jours. Les patients ont été observés pendant 12 semaines après le traitement. La variable primaire d'efficacité, le taux de succès du traitement, était définie comme l'augmentation de ≥2 points du score dynamique pour le profil de démarche (en marche) par rapport à la valeur initiale.
Lors de chaque contrôle, le taux de succès a été significativement plus élevé dans le groupe BOTOX® que dans le groupe placebo.
Spasticités focales des membres supérieurs résultant d'un AVC
Une étude multicentrique à double insu et contrôlée contre placebo concernant l'efficacité et la sécurité de BOTOX® a été réalisée chez des patients avec spasticité des membres supérieurs suivant un AVC. Les patients étaient des adultes n'ayant jamais été traités par BOTOX®, dont l'AVC remontait à ≥6 semaines et qui présentaient des scores d'échelle Ashworth élargie (EAE) de ≥3 au poignet et ≥2 au coude. 91 patients ont été randomisés en quatre groupes de traitement (BOTOX® 90, 180 ou 360 unités, ou placebo). Le critère primaire d'évaluation, soit la spasticité du fléchisseur du carpe, a été mesuré à la semaine 6 sur l'échelle EAE. Les variables secondaires d'efficacité étaient la spasticité des fléchisseurs au coude et aux doigts, mesurée sur l'EAE et selon l'évaluation globale du médecin.
L'étude comprenait 91 patients, dont 65 reçurent BOTOX® à raison de 90, 180 ou 360 unités. La diminution moyenne du score EAE des fléchisseurs du poignet s'est avérée à la semaine 12 supérieure dans tous les groupes BOTOX® à celle du groupe placebo.
Dans tous les groupes de traitement par BOTOX®, le tonus du fléchisseur du carpe, mesuré sur l'EAE, a été plus efficacement diminué que sous placebo. Les fléchisseurs du coude ont présenté un type d'amélioration analogue. Concernant les fléchisseurs des doigts, une certaine variabilité a été globalement observée (améliorations significatives seulement dans les semaines 1 et 3), mais les données indiquent des relations de dose/efficacité comparables. L'échelle d'évaluation médicale montre également un avantage significatif des doses de 180 et 360 unités.
Une autre étude multicentrique à double insu et contrôlée contre placebo a été réalisée auprès de patients souffrant de spasticité du poignet et des doigts en tant que conséquence secondaire d'un AVC. La durée de l'étude était de 12 semaines. Le critère primaire d'évaluation était la spasticité du fléchisseur du carpe à la semaine 6, mesurée sur l'échelle d'Ashworth (EA). D'autres variables étaient l'échelle d'évaluation médicale, l'évaluation globale par la personne prenant soin du patient, l'échelle d'évaluation de l'invalidité et les objectifs principaux d'intervention thérapeutique.
Cette étude comprenait 126 patients randomisés et recevant BOTOX® (n = 64) ou un placebo (n = 62). La dose de BOTOX® injectée se situait entre 200 et 240 unités Allergan, répartie entre les muscles atteints du poignet et des doigts. Il est apparu que BOTOX® avait amélioré le score EA du poignet et des doigts lors de tous les contrôles après injection. A la semaine 6, 88% des patients présentaient une amélioration sur l'EA sous BOTOX® contre 34% dans le groupe placebo.
A la semaine 6, toutes les autres variables présentaient également un avantage significatif par rapport au placebo.
AFFECTIONS VÉSICALES
Vessie hyperactive
Deux études cliniques de phase III, multicentriques, randomisées, contrôlées contre placebo, menées en double aveugle sur une période de 24 semaines ont été effectuées auprès de patients atteints de vessie hyperactive accompagnée des symptômes suivants: incontinence urinaire, mictions impérieuses et mictions fréquentes. Au total, 1'105 patients dont les symptômes n'ont pas pu être contrôlés de façon adéquate par les anticholinergiques (réponse insuffisante ou effets secondaires inacceptables) ont été randomisés pour recevoir soit 100 unités Allergan BOTOX® (n = 557) ou un placebo (n = 548).
Dans les deux études, des améliorations significatives par rapport au placebo ont été constatées pour BOTOX® (100 unités Allergan) en ce qui concerne la modification de la fréquence journalière des épisodes d'incontinence urinaire par rapport à la valeur initiale, y compris la proportion de patients continents, à la semaine 12 (critère primaire). La proportion des patients, mesurée au moyen de l'échelle pour le bénéfice du traitement, qui ont rapporté une réponse positive au traitement (leur état s'était «fortement amélioré» ou «amélioré») était, dans les deux études, significativement plus élevée dans le groupe BOTOX® que dans le groupe placebo.
Par rapport au placebo, des améliorations significatives ont également été observées au niveau de la fréquence mictionnelle journalière et de la fréquence des épisodes de mictions impérieuses et de nycturie. La quantité d'urine excrétée par miction était également significativement plus élevée. Des améliorations significatives ont été constatées à partir de la semaine 2 pour tous les symptômes de la vessie hyperactive.
Par comparaison avec le placebo, le traitement par BOTOX® a été associé à des améliorations significatives de la qualité de vie liée à la santé, mesurée au moyen du questionnaire I-QOL (Incontinence Quality of Life) (avec les facteurs suivants: comportement d'éviction et restrictions, conséquences psychosociales et gêne sociale) et du questionnaire (King's Health Questionnaire) (avec les facteurs suivants: conséquences de l'incontinence, limitations des activités quotidiennes, limitations sociales, limitations corporelles, relations personnelles, état émotionnel, sommeil/énergie et degré de sévérité/contre-mesures).
Dans l'ensemble, aucune différence au niveau de l'effet n'a été constatée entre les patients de 65 ans et plus et les patients de moins de 65 ans suite au traitement par BOTOX®.
Les résultats des études centrales compilées sont représentés ci-dessous.
Critères primaires et secondaires au début de l'étude et modification par rapport au début de l'étude dans les études centrales compilées
BOTOX®100 (N = 557) | Placebo (N = 548) | Valeur p | |
Fréquence journalière des épisodes d'incontinence urinaire* | |||
Valeur moyenne au début de l'étude Modification moyenne à la semaine 2 Modification moyenne à la semaine 6 Modification moyenne à la semaine 12 | 5,49 -2,85 -3,11 -2,80 | 5,39 -1,21 -1,22 -0,95 | <0,001 <0,001 <0,001 |
Proportion de réponse positive au traitement sur l'échelle du bénéfice du traitement (%) | |||
Semaine 2 Semaine 6 Semaine 12 | 64,4 68,1 61,8 | 34,7 32,8 28,0 | <0,001 <0,001 <0,001 |
Fréquence mictionnelle journalière | |||
Valeur moyenne au début de l'étude Modification moyenne à la semaine 2 Modification moyenne à la semaine 6 Modification moyenne à la semaine 12 | 11,99 -1,53 -2,18 -2,35 | 11,48 -0,78 -0,97 -0,87 | <0,001 <0,001 <0,001 |
Fréquence journalière des épisodes de mictions impérieuses | |||
Valeur moyenne au début de l'étude Modification moyenne à la semaine 2 Modification moyenne à la semaine 6 Modification moyenne à la semaine 12b | 8,82 -2,89 -3,56 -3,30 | 8,31 -1,35 -1,40 -1,23 | <0,001 <0,001 <0,001 |
Score total I-QOL | |||
Valeur moyenne au début de l'étude Modification moyenne après la semaine 12bc | 34,1 +22,5 | 34,7 +6,6 | <0,001 |
Questionnaire KHQ | |||
Limitation des activités Valeur moyenne au début de l'étude Modification moyenne après la semaine 12bc | 65,4 -25,4 | 61,2 -3,7 | <0,001 |
Questionnaire KHQ: limitations sociales | |||
Valeur moyenne au début de l'étude Modification moyenne après la semaine 12bc | 44,8 -16,8 | 42,4 -2,5 | <0,001 <0,001 |
* Dans le groupe BOTOX®, la proportion de patients continents à la semaine 12 était de 27,1% et de 8,4% dans le groupe placebo. La proportion des patients atteignant une fréquence réduite d'au moins 75% ou 50% des épisodes d'incontinence par rapport à la valeur initiale était de 46,0% ou 60,5% dans le groupe BOTOX® et de 17,7% ou 31,0% dans le groupe placebo.
a Critères d'évaluation coprimaires
b Critères d'évaluation secondaires
c La différence minimale significative prédéfinie par rapport à la valeur initiale était de +10 points pour le I-QOL et de -5 points pour le KHQ.
La durée médiane de la réponse suite au traitement par BOTOX®, basée sur une demande de retraitement exprimée par les patients, était de 166 jours (~24 semaines).
Chez les patients qui ont également participé à l'étude de prolongation ouverte et qui ont été traités uniquement avec 100 unités Allergan de BOTOX® (n = 438), la durée médiane de la réponse était de 212 jours (~30 semaines).
Seul un nombre limité de patients de sexe masculin (12,2% de la population totale de l'étude) ont pris part aux deux études pivots. Un effet statistiquement significatif n'a pas pu être mis en évidence dans ce petit sous-groupe.
Au total, 834 patients ont été examinés dans une étude de prolongation au long cours. Lors de nouveaux traitements, les patients ont montré une réponse constante pour tous les critères d'évaluation de l'efficacité.
Dans les études centrales, aucun des 615 patients chez lesquels des échantillons ont été analysés n'a développé d'anticorps neutralisants. Chez les patients dont les échantillons issus de l'étude pivot de phase III et des études de prolongation ouvertes ont été analysés, des anticorps neutralisants se sont développés dans les cas suivants: chez 0 patient sur 954 (0,0%) durant le traitement avec 100 unités Allergan de BOTOX® et chez 3 patients sur 260 (1,2%) après un traitement ultérieur avec au minimum une dose de 150 unités Allergan. L'un de ces trois patients a présenté un bénéfice clinique durable.
Incontinence urinaire causée par l'hyperactivité neurogène du détrusor
Deux études cliniques de phase 3, multicentriques, randomisées, en double aveugle, contrôlées contre placebo, ont été réalisées chez des patients présentant une incontinence urinaire due à une hyperactivité neurogène du détrusor, soit avec miction spontanée, soit sondés. Au total, 691 patients présentant une lésion médullaire ou atteints de sclérose en plaques et qui n'étaient pas traités d'une manière satisfaisante par au moins un agent anticholinergique ont participé aux études. Les patients ont été randomisés pour recevoir soit 200 unités Allergan de BOTOX® (n = 227), soit 300 unités Allergan de BOTOX® (n = 223), soit un placebo (n = 241).
Dans les deux études de phase III, des améliorations significatives ont été observées par rapport au placebo concernant le critère principal d'efficacité (modification de la fréquence hebdomadaire des épisodes d'incontinence, par rapport au début de l'étude): de meilleurs résultats ont été notés sous BOTOX® (200 unités Allergan et 300 unités Allergan) à la semaine 6 (temps d'évaluation du critère d'efficacité) y compris pour les patients chez lesquels l'incontinence urinaire avait disparu. Des améliorations significatives des paramètres urodynamiques ont également été observées, y compris une augmentation de la capacité cystométrique maximale et une diminution du pic de pression sur le muscle détrusor durant la première contraction involontaire de ce dernier. Par rapport au placebo, on a également observé des améliorations significatives de l'évaluation de la qualité de vie par le patient spécifiquement en rapport avec l'incontinence et la santé, déterminées au moyen d'un questionnaire I-QOL (incluant tactiques d'évitement, conséquences psychosociales et sentiments de honte restrictifs). Un bénéfice supplémentaire de BOTOX® 300 unités Allergan par rapport à 200 unités Allergan n'a pas pu être mis en évidence.
Les résultats compilés des études pivots sont présentés ci-dessous:
Résultats compilés des études pivots concernant les critères d'évaluation primaires et secondaires au début de l'étude et les changements par rapport au début de l'étude
BOTOX® 200 Unités Allergan (N = 227) | Placebo (N = 241) | Valeur p | |
Fréquence hebdomadaire de l'incontinence urinaire* | |||
Valeur moyenne au début de l'étude Modification moyenne à la semaine 2 Modification moyenne à la semaine 6a Modification moyenne à la semaine 12 | 32,4 -17,7 -21,3 -20,6 | 31,5 -9,0 -10,5 -9,9 | <0,001 <0,001 <0,001 |
Capacité cystométrique maximale (ml) | |||
Valeur moyenne au début de l'étude Modification moyenne à la semaine 6b | 250,2 +153,6 | 253,5 +11,9 | <0,001 |
O):2Pression maximale détrusorienne durant la première contraction involontaire du détrusor (cmH | |||
Valeur moyenne au début de l'étude Modification moyenne à la semaine 6b | 51,5 -32,4 | 47,3 +1,1 | <0,001 |
Score global relatif à la qualité de vie spécifiquement en rapport avec l'incontinencec,d | |||
Valeur moyenne au début de l'étude Modification moyenne à la semaine 6b Modification moyenne à la semaine 12 | 35,37 +25,89 +28,89 | 35,32 +11,15 +8,86 | <0,001 <0,001 |
* Dans le groupe traité par 200 unités Allergan de BOTOX®, la proportion de patients continents était de 37% pendant toute la semaine 6 et de 9% dans le groupe sous placebo. La proportion atteignant une réduction de 75% au moins de la fréquence des épisodes d'incontinence par rapport au début de l'étude était de 63% et 24%. La proportion atteignant une réduction de 50% au moins de la fréquence des épisodes d'incontinence par rapport au début de l'étude était de 76% et 39%.
a Critère d'évaluation primaire
b Critère d'évaluation secondaire
c L'échelle du score total de l'I-QOL va de 0 (problème majeur) à 100 (absolument aucun problème).
d Dans les études pivots, la différence minimale significative prédéfinie (MID – Minimally Important Difference) du score global I-QOL était de 8 points, en partant d'une valeur estimée de MID de 4 à 11 points indiquée par les patients avec une hyperactivité neurogène du détrusor.
La durée médiane de l'effet du traitement dans les deux études pivots, basée sur une demande de retraitement exprimée par le patient, était de 256 à 295 jours (36 à 42 semaines) pour le groupe ayant reçu 200 unités Allergan de BOTOX® comparé à 92 jours (13 semaines) pour le groupe placebo. Chez les patients qui ont également participé à l'étude de prolongation ouverte et qui ont été traités uniquement avec 200 unités Allergan de BOTOX® (n = 174), la durée médiane de la réponse était de 253 jours (~36 semaines).
Lors de la répétition du traitement, la réponse des patients est restée constante concernant tous les critères d'évaluation de l'efficacité.
Dans les études pivots, aucun des 475 patients présentant une hyperactivité neurogène du détrusor et pour lesquels des échantillons ont été analysés n'a développé des anticorps neutralisants.
Chez les patients dont les échantillons issus du programme de développement de nouveaux médicaments (y compris étude de prolongation ouverte) ont été analysés, des anticorps neutralisants se sont développés dans les cas suivants: chez 3 patients sur 300 (1,0%) traités uniquement avec 200 unités Allergan de BOTOX® et chez 5 patients sur 258 (1,9%) après un traitement avec au minimum une dose de 300 unités Allergan. Quatre de ces huit patients ont présenté un bénéfice clinique durable.
Après l'autorisation de mise sur le marché, une étude a été réalisée en double aveugle et contre placebo sur des patients atteints de sclérose en plaques (SEP), lesquels présentaient une incontinence urinaire causée par une hyperactivité neurogène du détrusor et n'ont pas été traités de manière satisfaisante par au moins un agent anticholinergique et n'étaient pas cathétérisés en début d'étude. Ces patients ont été randomisés pour recevoir soit 100 unités Allergan de BOTOX® (n = 66) soit un placebo (n = 78).
Des améliorations significatives du paramètre d'efficacité primaire, une modification dans la fréquence quotidienne des épisodes d'incontinence par rapport au début de l'étude, ont été observées pour BOTOX® (100 unités Allergan) à la période d'efficacité primaire en semaine 6 en comparaison avec un placebo. Cela englobait également le groupe de patients chez qui l'incontinence urinaire avait disparu. Des améliorations significatives des paramètres urodynamiques et du questionnaire I-QOL rempli par le patient ont été observées. Cela inclut les tactiques d'évitement, les conséquences psychosociales et les sentiments de honte restrictifs.
Les résultats de l'étude après introduction sur le marché sont présentés comme suit:
Critères primaires et secondaires au début de l'étude et modification par rapport au début de l'étude après introduction sur le marché avec 100 unités Allergan de BOTOX® et dans le cas de patients SEP progressive non cathétérisés en début d'étude
BOTOX® 100 unités Allergan (N=66) | Placebo (N=78) | Valeur p | |
Fréquence journalière des épisodes d'incontinence urinaire* | |||
Valeur moyenne au début de l'étude Modification moyenne à la semaine 2 Modification moyenne à la semaine 6a Modification moyenne à la semaine 12 | 4.2 -2.9 -3.3 -2.8 | 4.3 -1.2 -1.1 -1.1 | p<0.001 p<0.001 p<0.001 |
Capacité cystométrique maximale (ml) | |||
Valeur moyenne au début de l'étude Modification moyenne à la semaine 6b | 246.4 +127.2 | 245.7 -1.8 | p<0.001 |
Pression maximale détrusorienne durant la première contraction involontaire du détrusor (cmH2O): | |||
Valeur moyenne au début de l'étude Modification moyenne à la semaine 6b | 35.9 -19.6 | 36.1 +3.7 | p=0.007 |
c,dScore global relatif à la qualité de vie spécifiquement en rapport avec l'incontinence | |||
Valeur moyenne au début de l'étude Modification moyenne à la semaine 6b Modification moyenne à la semaine 12 | 32.4 +40.4 +38.8 | 34.2 +9.9 +7.6 | p<0.001 p<0.001 |
* Dans le groupe traité par 100 unités Allergan de BOTOX®, la proportion de patients continents était de 53% pendant toute la semaine 6 et de 10,3% dans le groupe sous placebo.
a Critère d'évaluation primaire
b Critère d'évaluation secondaire
c L'échelle du score total de l'I-QOL va de 0 (problème majeur) à 100 (absolument aucun problème).
d La différence minimale significative prédéfinie (MID – Minimally Important Difference) du score global I-QOL était de 11 points, en partant d'une valeur estimée de MID de 4 à 11 points indiquée par les patients avec une hyperactivité neurogène du muscle détrusorien.
La durée médiane de la réponse dans cette étude, basée sur une demande de retraitement exprimée par les patients, était de 362 jours (~52 semaines) dans le groupe traité avec 100 unités Allergan de BOTOX® contre 88 jours (~13 semaines) pour le groupe ayant reçu un placebo.
AFFECTIONS DE LA PEAU ET APPERENTÉES
Hyperhidrose axillaire primaire
Une étude clinique multicentrique à double insu a été réalisée auprès de patients souffrant d'une hyperhidrose axillaire primaire bilatérale persistante. L'hyperhidrose axillaire primaire était présente lorsque la mesure initiale indiquait une production spontanée d'au moins 50 mg de sueur par aisselle en 5 minutes, au repos et à la température ambiante. L'étude comprenait 320 patients randomisés recevant 50 unités Allergan de BOTOX® (n = 242) ou un placebo (n = 78). La réponse au traitement était définie comme une diminution de la production de sueur d'au moins 50% par rapport à la valeur initiale. Au critère d'évaluation primaire, 4 semaines après l'injection, 93,8% des patients du groupe BOTOX® avaient répondu au traitement contre 35,9% du groupe placebo (p <0,001). Lors de tous les contrôles durant les 16 semaines suivant l'injection, le taux de réponse dans le groupe BOTOX® s'est continuellement montré supérieur (p <0,001) à celui du groupe placebo.
Une étude ouverte a été ensuite réalisée auprès de 207 patients adéquats qui ont reçu jusqu'à 3 traitements par BOTOX®. Parmi ceux-ci, 174 ont terminé les 16 mois au total que duraient les deux études combinées (4 mois en double aveugle et 12 mois à la suite en étude ouverte). Le taux de réponse 16 semaines après le premier (n = 287), le deuxième (n = 123) et le troisième (n = 30) traitement s'est élevé à 85,0%, 86,2% et 80%. Au cours des deux études combinées, la durée moyenne de l'effet a été de 7,5 mois après le premier traitement, mais l'effet a persisté encore un an ou plus chez 27,5% des patients.
Pharmacocinétique
Des études classiques portant sur l'absorption, la distribution, la biotransformation et l'élimination de la substance active n'ont pas été réalisées en raison de la nature de la toxine botulique de type A.
Propriétés générales de la substance active
Distribution/Métabolisme/Élimination
Les études portant sur la distribution chez les rats indiquent une lente diffusion musculaire de la toxine botulique A radiomarquée dans le muscle gastrocnémien. Elle est suivie d'une métabolisation systémique rapide et d'une excrétion urinaire.
La demi-vie du produit radiomarqué était d'environ 10 heures. Au point d'injection, les éléments radioactifs étaient liés à de grosses molécules protéiques, tandis que dans le plasma, la radioactivité était liée à de petites molécules. Cela suggère une métabolisation systémique rapide.
Dans les 24 heures après l'administration de la dose, 60% de la radioactivité était excrétée dans les urines. La toxine est probablement métabolisée par des protéases et les composants moléculaires sont recyclés par les voies métaboliques normales.
Distribution
Distribution du principe actif dans le patient:
On pense que la distribution systémique des doses thérapeutiques de BOTOX® est faible. Des études cliniques utilisant des techniques électromyographiques à fibre unique ont mis en évidence une augmentation de l'activité électrophysiologique neuromusculaire dans les muscles distants du point d'injection, sans aucun signe ou symptôme clinique associé. L'ampleur de la diffusion et des effets secondaires associés dépend des caractéristiques anatomiques, ainsi que des volumes et de la dose injectés.
Données précliniques
Pharmacologie de sécurité
Outre les études de toxicité pour la reproduction, les études de sécurité précliniques suivantes ont été conduites avec BOTOX®: toxicité aiguë, toxicité chronique, tolérance locale, potentiel mutagène, pouvoir antigénique, compatibilité sanguine chez l'homme. Ces études n'ont révélé aucun risque particulier chez l'homme aux doses cliniquement significatives. La DL50 intramusculaire reconnue dans la littérature est de 39 unités/kg chez le jeune singe.
Aucune toxicité systémique n'a été observée après une injection unique dans le détrusor de <50 unités Allergan/kg de BOTOX® chez le rat. Afin de simuler une injection accidentelle, une dose unique de BOTOX® (~7 unités Allergan/kg) a été administrée dans l'urètre prostatique et le rectum proximal, la vésicule séminale et la paroi vésicale ainsi que dans l'utérus (~3 unités Allergan/kg) de singes sans qu'aucun effet clinique indésirable n'ait été observé.
Dans une étude d'administration répétée dans le détrusor de singes pendant 9 mois (4 injections), une ptose a été observée à la dose de 24 unités/kg. Des cas de mortalité ont été observés après une dose de 36 unités/kg après la première des quatre injections et chez un animal à la dose de 24 unités/kg après la deuxième injection. On a observé une activité motrice réduite et des difficultés respiratoires chez des animaux moribonds après administrations de doses ≥24 unités/kg. Aucun effet indésirable n'a été observé chez le singe à la dose de 12 unités/kg, qui correspond à une exposition 3 fois plus importante de BOTOX® que celle attendue avec la dose clinique recommandée de 200 unités Allergan dans le traitement de l'incontinence urinaire causée par une hyperactivité neurogène du détrusor (basée sur une personne de 50 kg).
Toxicité sur la reproduction
Des souris, des rates et des lapines gravides ont reçu pendant la période d'organogenèse des injections de BOTOX® par voie intramusculaire. La dose sans effet toxique observé (NOAEL) au cours de la phase de développement était de 4, de 1 et de 0,125 unités/kg de poids corporel, respectivement. Les doses plus élevées ont entraîné une réduction du poids du fœtus et/ou un retard d'ossification. On a constaté des avortements chez le lapin.
Remarques particulières
Incompatibilités
En l'absence d'étude d'incompatibilité, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «Exp» sur le récipient.
Remarques particulières concernant le stockage
Tenir hors de la portée des enfants.
Flacons fermés: Conserver au réfrigérateur entre 2-8 °C ou au congélateur à -5 °C ou en dessous.
Les études sur l'activité ont montré que le médicament peut être conservé après reconstitution jusqu'à 3 jours à 2–8 °C. Comme le médicament ne contient pas de conservateur, il faut, pour des raisons microbiologiques, utiliser la préparation prête à l'emploi immédiatement après dilution, sauf si cette dernière a été effectuée dans des conditions aseptiques contrôlées et validées. Le médicament ne devrait normalement pas être conservé plus de 24 heures à 2–8 °C.
Remarques concernant la manipulation
Préparation de la solution injectable de BOTOX®
Il est recommandé d'effectuer la reconstitution de la solution et la préparation de la seringue sur des serviettes en papiers doublées de plastique afin d'absorber toute quantité renversée. Reconstituer BOTOX® avec une solution saline normale sans conservateur (chlorure de sodium à 0,9% pour préparations injectables).
Prélever une quantité appropriée de diluant (voir table de dilution ci-dessous) dans une seringue. Il convient de nettoyer la surface du bouchon en caoutchouc du flacon avec un tampon imbibé d'alcool avant d'introduire l'aiguille.
Tableau de dilution pour les flacons contenant BOTOX® 100 unités Allergan pour toutes les indications (sauf injections dans le muscle détrusor)
Quantité de solvant (chlorure de sodium 9 mg/ml (0,9%)), à ajouter à un flacon de 100 unités Allergan: | Flacon de 100 unités Allergan |
Dose résultante (Unités Allergan par 0,1 ml) | |
0,5 ml 1,0 ml 2,0 ml 4,0 ml 8,0 ml | 20,0 U 10,0 U 5,0 U 2,5 U 1,25 U |
Vessie hyperactive
Instructions pour la dilution d'un flacon BOTOX® de 100 unités Allergan:
•Reconstituer un flacon BOTOX® de 100 unités Allergan avec 10 ml d'une solution de chlorure de sodium à 0,9% (sans agent conservateur) et mélanger le contenu du flacon avec précautions.
•Aspirer 10 ml du flacon dans une seringue de 10 ml.
Il en résulte une seringue de 10 ml contenant au total 100 unités Allergan de BOTOX® reconstitué. Utiliser immédiatement après reconstitution dans la seringue. Jeter toute solution de chlorure de sodium non utilisée.
Incontinence urinaire causée par une hyperactivité neurogène du détrusor
Instructions pour la dilution de deux flacons de 100 unités Allergan de BOTOX®:
•Reconstituez deux flacons de 100 unités Allergan de BOTOX®, chacun à l'aide de 6 ml de solution saline à 0,9% (sans agent conservateur) et agitez doucement les flacons.
•Aspirez 4 ml du contenu de chacun des flacons dans deux seringues de 10 ml chacune.
•Aspirez les 2 ml restants du contenu de chaque flacon dans une troisième seringue de 10 ml.
•Terminez la reconstitution en ajoutant 6 ml de solution saline à 0,9% sans conservateur dans chacune des seringues de 10 ml et agitez-les doucement.
Vous obtiendrez ainsi trois seringues de 10 ml contenant un total de 200 unités Allergan de solution reconstituée de BOTOX®.
Utilisez BOTOX® immédiatement après l'avoir reconstitué dans la seringue et jetez toute solution saline non utilisée.
Il est possible d'obtenir une concentration de BOTOX® plus ou moins forte en ajoutant un volume de diluant plus ou moins important.
BOTOX® étant susceptible d'être dénaturé par la formation de bulles ou une agitation vigoureuse, le diluant doit être injecté délicatement dans le flacon. Ne pas utiliser le flacon si un léger vide n'entraîne pas l'aspiration du diluant à l'intérieur du flacon. Une fois reconstitué, BOTOX® est une solution incolore ou légèrement jaune, exempte de particules en suspension. La solution reconstituée doit être contrôlée visuellement avant utilisation afin de vérifier qu'elle est claire et ne contient pas de particules.
La solution reconstituée est à usage unique. La solution reconstituée de BOTOX®, qui est de nouveau diluée dans une seringue pour injection dans le muscle détrusor, doit être utilisée immédiatement. Toute solution non utilisée doit être éliminée de manière appropriée.
Élimination
Si la poudre BOTOX® s'est répandue, elle doit être essuyée avec un linge absorbant imbibé de solution diluée d'hypochlorite (à 0,5%). Si la solution injectable BOTOX® s'est répandue, elle doit être essuyée avec un linge absorbant sec. Les surfaces souillées doivent être nettoyées avec un linge absorbant imbibé de solution diluée d'hypochlorite, puis séchées en frottant. Si un flacon-ampoule s'est brisé, les éclats de verre doivent être recueillis prudemment de sorte à éviter toute blessure de la peau.
Des flacons pour injection non utilisés doivent être préparés avec un peu d'eau et autoclavés. Tous les flacons pour injection utilisés, seringues, aiguilles, etc. doivent également être autoclavés. Les résidus de toxine botulique peuvent également être inactivés avec une solution d'hypochlorite diluée à 0,5%. La solution doit être appliquée pendant au moins 5 minutes. Les autres éléments contaminés, p.ex. éclats de verre, gants, etc., doivent être jetés dans un contenant pour déchets tranchants et éliminés par incinération.
Identification du médicament
Si le produit BOTOX® utilisé est authentique, des lignes horizontales aux couleurs de l'arc-en-ciel et le nom «Allergan» sont visibles sur l'étiquette (hologramme) en tournant le flacon à droite et à gauche sous une lampe de bureau ou un néon. Si cela n'est pas le cas et/ou si le scellé de sécurité laissant apparaître le logo argenté Allergan sur le rabat supérieur ou inférieur de la boîte n'est pas intact, alors le produit ne doit pas être utilisé et Allergan doit être contacté.
En outre, l'autocollant avec le numéro de lot et la date d'expiration peut être détaché de l'étiquette du flacon de BOTOX® et collé dans le dossier du patient pour faciliter la traçabilité du lot. Après le décollement de l'autocollant de l'étiquette du flacon, la mention «Verwendet/Utilisé» apparaît.
Numéro d’autorisation
52433 (Swissmedic)
Titulaire de l’autorisation
Allergan S.A., Zürich
Mise à jour de l’information
Mars 2020
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

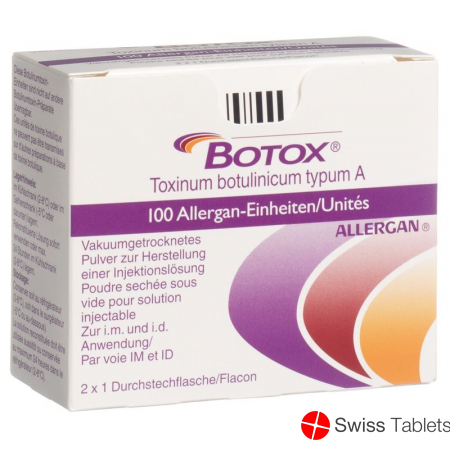
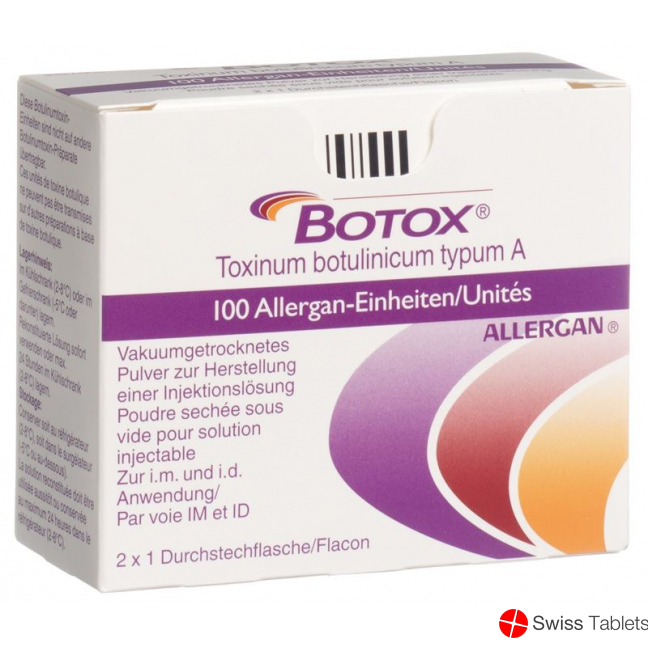
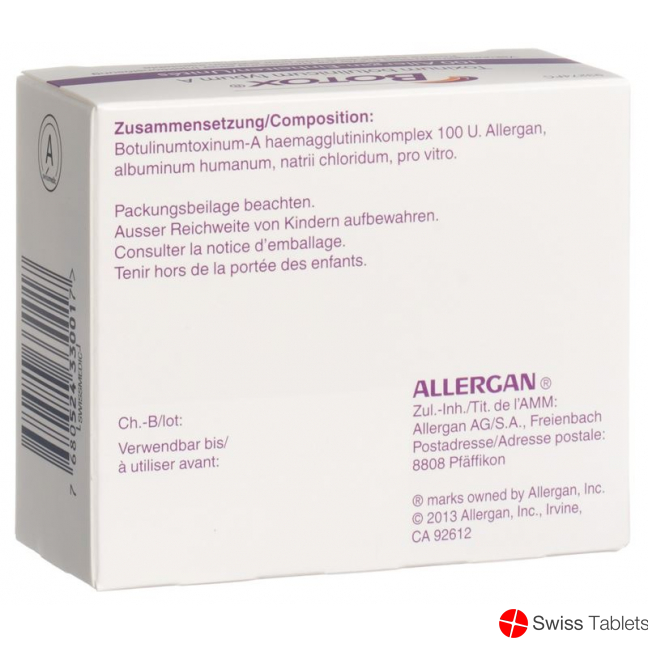

 Deutsch
Deutsch French
French Italian
Italian







