Levetiracetam DESITIN 500 mg / 5ml 10 Amp 5 ml
Levetiracetam DESITIN 500 mg/5ml 10 Amp 5 ml
-
273.51 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: DESITIN PHARMA GMBH
- Product Code: 5827810
- ATC-code N03AX14
- EAN 7680626160024
Ingredients:
Natriumchlorid, Essigsäure, konzentrierte (Eisessig), Levetiracetam 500 mg , Natrium acetat-3-Wasser.

Description
Zusammensetzung
Wirkstoff: Levetiracetam.
Hilfsstoffe: Natriumacetat Trihydrat, Natriumchlorid, Eisessig, Wasser für Injektionszwecke.
Galenische Form und Wirkstoffmenge pro Einheit
Ampulle mit Infusionskonzentrat zu 500 mg/5 ml.
Indikationen/Anwendungsmöglichkeiten
Levetiracetam DESITIN Infusionskonzentrat ist indiziert zur Monotherapie bei der Behandlung von partiellen Anfällen mit oder ohne sekundäre Generalisierung bei Patienten ab 16 Jahren mit Epilepsie.
Levetiracetam DESITIN Infusionskonzentrat ist indiziert zur Zusatzbehandlung von
– partiellen Anfällen mit oder ohne sekundäre Generalisierung bei Patienten ab 16 Jahren mit Epilepsie;
– myoklonischen Anfällen bei Patienten ab 16 Jahren mit juveniler myoklonischer Epilepsie;
– primär generalisierten tonisch-klonischen Anfällen bei Patienten ab 16 Jahren mit idiopathischer generalisierter Epilepsie.
Levetiracetam DESITIN Infusionskonzentrat ist eine kurzfristige Alternative für Patienten, bei denen eine orale Verabreichung vorübergehend nicht möglich ist.
Dosierung/Anwendung
Die Therapie mit Levetiracetam DESITIN kann entweder durch intravenöse oder orale Verabreichung initiiert werden. Der Wechsel von oral zu intravenös bzw. umgekehrt kann direkt ohne Titration vorgenommen werden, wobei die Tagesdosis und die Häufigkeit der Anwendung beibehalten werden sollten.
Levetiracetam DESITIN Infusionskonzentrat ist nur für die intravenöse Anwendung vorgesehen. Die Verabreichung erfolgt nach Verdünnung als intravenöse Infusion über 15 Minuten (siehe «Sonstige Hinweise»/«Hinweise für die Handhabung»).
Es liegen aus den aktuellen Studien keine Erfahrungen mit der intravenösen Anwendung von Levetiracetam über einen längeren Zeitraum als 4 Tage vor.
Die nachfolgenden Angaben stammen daher überwiegend aus den klinischen Studien mit der oralen galenischen Formulierung.
Erwachsene und Jugendliche ab 16 Jahren
Monotherapie
Die Behandlung sollte mit 2× 250 mg/Tag gestartet werden und die Dosierung nach 2 Wochen auf 2× 500 mg/Tag erhöht werden. Je nach klinischem Ansprechen kann die Dosis in Schritten von 2× 250 mg/Tag alle 2 Wochen auf maximal 2× 1500 mg/Tag gesteigert werden.
Zusatztherapie
Die therapeutische Initialdosis beträgt zweimal täglich 500 mg. Je nach klinischem Ansprechen und Verträglichkeit kann die Tagesdosis bis auf zweimal täglich 1500 mg gesteigert werden. Dosiserhöhungen bzw. -reduzierungen können in Schritten von zweimal täglich 500 mg alle 2 bis 4 Wochen vorgenommen werden.
Jugendliche ab 16 Jahren unter 50 kg Körpergewicht:
Die therapeutische Initialdosis beträgt 10 mg/kg Körpergewicht zweimal täglich.
Je nach klinischem Ansprechen und je nach Verträglichkeit kann die Dosis bis zu 30 mg/kg zweimal täglich erhöht werden. Die Anpassung der Dosis (zunehmend und abnehmend) sollte in Schritten von maximal 10 mg/kg zweimal täglich alle 2 bis 4 Wochen vorgenommen werden.
Die geringste wirksame Dosis sollte angewendet werden.
Spezielle Dosierungsanweisungen
Kinder:
Sicherheit und Wirksamkeit von Levetiracetam DESITIN Infusionskonzentrat bei Patienten unter 16 Jahren sind nicht untersucht und damit auch nicht nachgewiesen.
Ältere Patienten:
Bei älteren Patienten wird eine Dosisanpassung in Abhängigkeit von der Kreatinin-Clearance empfohlen (siehe «Patienten mit eingeschränkter Nierenfunktion»).
Patienten mit eingeschränkter Nierenfunktion:
Die Tagesdosis (Erhaltungsdosis) von Levetiracetam DESITIN muss individuell entsprechend der Nierenfunktion festgelegt werden.
Bei der Anwendung der untenstehenden Tabelle ist es notwendig, die Kreatininclearance des Patienten (CLcr) in ml/min zu schätzen. Die CLcr in ml/min kann durch die Bestimmung des Serumkreatininwertes (mg/dl) mit folgender Formel geschätzt werden:
CLcr (ml/min) = (140 – Alter [Jahre]) × Gewicht (kg): (72 × Serumkreatinin [mg/dl]) (× 0,85 für Frauen).
Anschliessend wird die CLcr wie folgt für die Körperoberfläche (KOF) angepasst:
CLcr (ml/min/1,73 m²) = CLcr (ml/min) × 1,73 : KOF Patient (m²).
Dosisanpassung bei erwachsenen und jugendlichen Patienten ab 16 Jahren mit eingeschränkter Nierenfunktion, die mehr als 50 kg wiegen:
Nierenfunktion | Kreatinin-Clearance | Erhaltungsdosis und Einnahmehäufigkeit |
Normal | >80 | 500–1500 mg zweimal täglich |
Leicht eingeschränkt | 50–79 | 500–1000 mg zweimal täglich |
Mässig eingeschränkt | 30–49 | 250–750 mg zweimal täglich |
Stark eingeschränkt | <30 | 250–500 mg zweimal täglich |
Dialysepflichtige Patienten* | – | 500–1000 mg einmal täglich** |
* Am ersten Tag der Behandlung mit Levetiracetam wird eine Anfangsdosis von 750 mg empfohlen.
** Nach der Dialyse wird eine zusätzliche Dosis von 250–500 mg empfohlen.
Patienten mit eingeschränkter Leberfunktion:
Bei Patienten mit leicht bis mässig eingeschränkter Leberfunktion ist eine Dosisanpassung nicht erforderlich. Bei Patienten mit schwerer Beeinträchtigung der Leberfunktion kann die Kreatinin-Clearance zu einer Fehleinschätzung der Niereninsuffizienz führen. Daher wird eine Halbierung der täglichen Erhaltungsdosis empfohlen, wenn die Kreatinin-Clearance weniger als 60 ml/min/1,73m2 beträgt.
Absetzen der Medikation:
Falls Levetiracetam DESITIN abgesetzt werden muss, sollte dies in Übereinstimmung mit der gängigen klinischen Praxis ausschleichend erfolgen.
Kontraindikationen
Überempfindlichkeit gegenüber Levetiracetam bzw. verwandten Substanzen oder einem der Hilfsstoffe.
Warnhinweise und Vorsichtsmassnahmen
Allgemein
Der Hinweis « Levetiracetam DESITIN Infusionskonzentrat ist eine kurzfristige Alternative für Patienten, bei denen eine orale Verabreichung vorübergehend nicht möglich ist» impliziert unter Umständen instabile, auf jeden Fall neue, veränderte, unterschiedliche klinische Situationen. Weiterhin wird bei der Verwendung von Levetiracetam DESITIN als Zusatztherapie auch die Primärtherapie auf eine intravenöse Formulierung oder – wenn nicht vorhanden – sogar auf einen anderen Wirkstoff umgestellt werden müssen.
Für die veränderte Gesamtsituation des Patienten liegen keine Erfahrungen bezüglich Sicherheit und Wirksamkeit der antikonvulsiven Kombinationstherapie vor. Der Arzt muss daher sehr engmaschig den Patienten überwachen und gegebenenfalls weitere Modifikationen der antikonvulsiven Therapie vornehmen.
Anfallshäufung:
Ein Anstieg der Anfallshäufigkeit um mehr als 25% wurde bei 14% der mit Levetiracetam behandelten erwachsenen und pädiatrischen Patienten mit partiellen Anfällen berichtet, während es bei 26% bzw. 21% der mit Placebo behandelten erwachsenen bzw. pädiatrischen Patienten berichtet wurde.
Absencen:
Bei Anwendung von Levetiracetam zur Behandlung von primär generalisierten tonisch-klonischen Anfällen bei Erwachsenen und Jugendlichen mit idiopathisch generalisierter Epilepsie wurde keine Wirksamkeit im Sinne einer Senkung der Häufigkeit von Absencen festgestellt.
Status epilepticus:
Die Wirksamkeit bei Status epilepticus wurde nicht gezeigt. Ein Einsatz von Levetiracetam DESITIN Infusionskonzentrat bei Status epilepticus wird daher nicht empfohlen.
Blutbild
Im Zusammenhang mit der Einnahme von Levetiracetam wurden Fälle von verminderten Blutzellzahlen beschrieben (Neutropenie, Agranulozytose, Leukopenie, Thrombozytopenie und Panzytopenie), in der Regel zu Beginn der Behandlung. Ein komplettes Blutbild wird bei Patienten mit erheblicher Schwäche, Pyrexie, wiederkehrenden Infektionen oder Koagulationsstörungen empfohlen (siehe «Unerwünschte Wirkungen»).
Suizid:
Es liegen Berichte von Suiziden, Suizidversuchen und suizidalen Gedanken bei mit Levetiracetam behandelten Patienten (Erwachsene und Kinder) vor. Die Patienten und ihre Angehörigen bzw. Bezugspersonen sollten deshalb insbesondere auch vor Therapiebeginn in einem ausführlichen Gespräch darüber informiert werden, dass sie bei Verschlechterung der Stimmung und/oder bei sozialem Rückzug und/oder dem Auftreten von depressiven Symptomen und/oder gereiztem bis feindseligem Verhalten bzw. auch anderen Veränderungen des Verhaltens bzw. der Persönlichkeit, insbesondere aber bei der Äusserung von suizidalen Gedanken, sofort einen Arzt oder eine Ärztin kontaktieren sollten. Es muss bedacht werden, dass Suizidalität sich auch in manchen Fällen nur durch Verhaltensänderungen ankündigen kann. Vor Therapiebeginn sollte geklärt werden, ob einer der wissenschaftlich nachgewiesenen Risikofaktoren für Suizidalität, z.B. psychiatrische Erkrankungen, Suizidalität in der Vorgeschichte, vorliegen, und das Nutzen-Risiko-Verhältnis muss gerade auch unter diesen Aspekten sehr sorgfältig abgewogen werden.
Schwere Hautreaktionen:
Fälle von lebensbedrohlichen Hautreaktionen, einschliesslich Stevens-Johnson Syndrom (SJS) und toxischer epidermaler Nekrolyse (TEN) wurden bei mit Levetiracetam behandelten Patienten (Erwachsene und Kinder) berichtet. Das Risiko für das Auftreten von SJS oder TEN ist in den ersten Behandlungswochen am höchsten (im Median lag der Beginn bei 14 bis 17 Tagen). Allerdings traten solche Fälle auch noch nach mindestens 4-monatiger Einnahme und später auf. Die Patienten sollten über die Anzeichen und Symptome dieser schweren Nebenwirkungen informiert und insbesondere zu Beginn der Behandlung engmaschig bezüglich des Auftretens von Hautreaktionen überwacht werden. Wenn Anzeichen oder Symptome von SJS oder TEN auftreten (z.B. ein progredienter Hautausschlag, oft mit Blasenbildung oder begleitenden Schleimhautläsionen), muss die Therapie mit Levetiracetam beendet werden, es sei denn der Hautausschlag ist eindeutig nicht arzneimittelassoziiert. Der Verlauf von SJS und TEN wird massgeblich von der frühzeitigen Diagnosestellung und dem sofortigen Absetzen aller verdächtigen Arzneimittel bestimmt, d.h. frühzeitiges Absetzen verbessert die Prognose. Nach Auftreten von SJS oder TEN in Zusammenhang mit der Anwendung von Levetiracetam darf der Patient nicht erneut mit Levetiracetam behandelt werden.
Hypersensitivitätsreaktionen mit systemischer Implikation:
Generalisierte Exantheme können auch im Rahmen eines Überempfindlichkeitssyndroms in Kombination mit irgendeinem der folgenden systemischen Symptome wie Fieber, Lymphadenopathie, Leukozytose, Eosinophilie, atypischen Lymphozyten, anormalen Leber- ,Nierenwerten oder mit anderen Symptomen, die auf eine systemische Implikation hinweisen (siehe «Unerwünschte Wirkungen - DRESS: Drug Reaction with Eosinophilia and Systemic Symptoms») auftreten. Dieses Syndrom variiert hinsichtlich seines klinischen Schweregrades beträchtlich, mit zum Teil letalem Verlauf. Es ist wichtig zu beachten, dass die systemischen Anzeichen einer Überempfindlichkeit (wie z.B. Fieber und Lymphadenopathie) bereits manifest sein können, auch wenn keine Hautveränderungen sichtbar sind. Grundsätzlich sollte Levetiracetam sofort abgesetzt werden, wenn Symptome auftreten, die auf eine Hypersensitivitätsreaktion hinweisen.
Natrium:
Der Natriumgehalt pro Ampulle beträgt ungefähr 17,536 mg. Dies sollte bei Patienten mit einer natriumarmen Diät berücksichtigt werden.
Interaktionen
In vitro wurde gezeigt, dass Levetiracetam und sein Hauptmetabolit weder die Aktivitäten der wichtigsten Cytochrom P450 Isoformen beim Menschen (CYP3A4, 2A6, 2C9, 2C19, 2D6, 2E1 und 1A2) noch der Glucuronyltransferase (UGT1A1 und UGT1A6) oder der Epoxidhydroxylase hemmt. Levetiracetam beeinflusst auch die in vitro Glucuronidierung von Valproinsäure nicht und hatte in humanen Hepatozytenkulturen einen geringen oder keinen Effekt auf die Ethinylestradiolkonjugation. Levetiracetam verursachte in hohen Konzentrationen (680 µg/ml) eine milde Induktion von CYP2B6 und CYP3A4; bei Cmax-Konzentrationen jedoch, wie sie bei wiederholter Dosierung mit zweimal täglich 1500 mg auftreten, wurden diese Effekte nicht als klinisch relevant beurteilt.
Eine Interaktion von Levetiracetam mit anderen Substanzen ist aufgrund von Enzyminhibition oder -induktion sehr unwahrscheinlich.
Probenecid vermindert die renale Clearance des Hauptmetaboliten, jedoch nicht die von Levetiracetam. Die Konzentration des Hauptmetaboliten bleibt jedoch niedrig. Vermutlich verringern auch andere Substanzen, die durch aktive tubuläre Sekretion ausgeschieden werden, die renale Clearance dieses Metaboliten. Die Wirkung von Levetiracetam auf Probenecid wurde nicht untersucht, und der Einfluss von Levetiracetam auf andere aktiv sezernierte Arzneimittel wie z.B. NSAR, Sulfonamide und Methotrexat ist unbekannt.
Bei gleichzeitiger Gabe von anderen Antiepileptika (Carbamazepin, Phenytoin, Valproinsäure, Phenobarbital, Lamotrigin, Primidon und Gabapentin) verändern sich die pharmakokinetischen Parameter von Levetiracetam nicht und umgekehrt beeinflusst auch Levetiracetam die Serumkonzentrationen dieser Antiepileptika nicht.
Pharmakokinetische Studien zeigen keine Wechselwirkungen mit Digoxin, oralen Kontrazeptiva (Ethinylestradiol und Levonorgestrel) und Warfarin. Endokrine Parameter (LH und Progesteron) sowie die Prothrombinzeit werden nicht verändert.
Daten über eine mögliche Wechselwirkung von Levetiracetam mit Alkohol liegen nicht vor.
Schwangerschaft/Stillzeit
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter sollten von einem Spezialisten beraten werden. Für die Dauer der Behandlung wird eine sichere Methode der Empfängnisverhütung empfohlen. Wenn eine Frau plant schwanger zu werden, ist die Behandlung mit Levetiracetam zu überdenken. Wie bei anderen Antiepileptika auch, ist ein plötzlicher Abbruch der Einnahme von Levetiracetam zu vermeiden, da dies zu Entzugsanfällen oder Status epilepticus führen kann, die schwerwiegende Konsequenzen für die Frau und das ungeborenen Kind haben können. Soweit möglich ist eine Monotherapie zu bevorzugen, da die Therapie mit mehreren Antiepileptika je nach Kombination mit einem höheren Risiko für kongenitale Fehlbildungen verknüpft sein könnte als die Monotherapie.
Schwangerschaft
Ein hoher Anteil der Post-Marketing-Daten zu schwangeren Frauen, die eine Monotherapie mit Levetiracetam erhalten haben (mehr als 1'800, von welchen die Einnahme in 1'500 Fällen im ersten Schwangerschaftstrimester erfolgte), deuten nicht auf ein erhöhtes Risiko für schwere kongenitale Fehlbildungen hin. Es liegen nur wenige Daten vor zur neurologischen Entwicklung bei Kindern, die in utero einer Monotherapie mit Levetiracetam DESITIN Infusionskonzentrat ausgesetzt waren. Aktuelle epidemiologische Studien (mit etwa 100 Kindern) weisen nicht auf ein erhöhtes Risiko für Störungen oder Verzögerungen in der neurologischen Entwicklung hin.
Levetiracetam kann während der Schwangerschaft angewendet werden, wenn es nach sorgfältiger Bewertung als klinisch notwendig erachtet wird. In diesem Fall wird die niedrigste wirksame Dosis empfohlen.
Wie auch mit anderen antiepileptischen Arzneimitteln beobachtet, können physiologische Veränderungen während der Schwangerschaft die Levetiracetam-Plasma-Konzentration beeinflussen.
Es gibt Berichte über die Abnahme der Levetiracetam-Plasma-Konzentration während der Schwangerschaft.
Diese Abnahme ist deutlich ausgeprägter im dritten Trimenon (bis zu 60% der Anfangskonzentration vor Schwangerschaftsbeginn).
Bei schwangeren Frauen, die mit Levetiracetam behandelt werden, sollte eine geeignete klinische Überwachung gewährleistet sein.
Einnahme während der Stillzeit
Levetiracetam wird in die Muttermilch ausgeschieden. Daher wird das Stillen nicht empfohlen. Sollte jedoch eine Behandlung mit Levetiracetam während der Stillzeit erforderlich sein, müssen Nutzen und Risiko einer Behandlung, unter Berücksichtigung der Bedeutung des Stillens für den Säugling, gegeneinander abgewogen werden.
Fertilität
Es liegen keine klinischen Daten vor. Das potentielle Risiko für den Menschen ist nicht bekannt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Aufgrund einer möglichen individuell unterschiedlichen Empfindlichkeit können bei einigen Patienten zu Behandlungsbeginn oder nach einer Dosissteigerung Somnolenz oder andere zentralnervöse Störungen auftreten. Deshalb ist bei Tätigkeiten, die ein hohes Mass an Geschicklichkeit erfordern, wie z.B. beim Führen eines Fahrzeuges oder beim Bedienen von Maschinen, Vorsicht geboten.
Unerwünschte Wirkungen
Die unerwünschten Wirkungen, die bei der intravenösen Anwendung von Levetiracetam auftraten, sind vergleichbar mit denen bei oraler Anwendung. Die am häufigsten berichteten Nebenwirkungen waren Benommenheit, Somnolenz, Kopfschmerzen und Lageschwindel.
Da Levetiracetam nur in begrenztem Umfang intravenös angewendet wurde und die oralen und intravenösen Darreichungsformen bioäquivalent sind, beziehen sich die Sicherheitsinformationen zur intravenösen Anwendung von Levetiracetam auf diejenigen zur oralen Anwendung.
Der behandelnde Arzt sollte berücksichtigen, dass die folgenden Daten aus Studien stammen, in denen Levetiracetam mit anderen Antiepileptika kombiniert wurde. Es war daher nicht in allen Fällen möglich, die beobachteten unerwünschten Ereignisse einem bestimmten Arzneimittel zuzuordnen.
Die anhand der Studien gesammelten Daten zur Sicherheit und Verträglichkeit der oralen Darreichungsformen von Levetiracetam bei partiellen Anfällen ergaben, dass bei 46,4% der erwachsenen Patienten der Levetiracetam-Gruppe und bei 42,2% der Patienten der Placebo-Gruppe unerwünschte Wirkungen auftraten; 2,4% bzw. 2,0% der Patienten der Levetiracetam- bzw. Placebo-Gruppe erlitten schwerwiegende unerwünschte Wirkungen.
Die häufigsten unerwünschten Wirkungen bei erwachsenen Patienten waren Somnolenz, Asthenie und Benommenheit.
Bei der zusammenfassenden Analyse der Daten zur Sicherheit und Verträglichkeit konnte keine eindeutige Dosis-Nebenwirkungs-Beziehung festgestellt werden. Die Inzidenz und der Schweregrad der zentralnervösen unerwünschten Wirkungen nahmen jedoch im Laufe der Zeit ab.
Unter Monotherapie trat bei 49,8% der Patienten mindestens eine Nebenwirkung auf. Die am häufigsten berichteten unerwünschten Wirkungen waren Müdigkeit und Somnolenz.
Ausserdem wurden psychopathologische Symptome berichtet wie Agitiertheit, Depersonalisierung, Bewegungsunruhe (Hyperkinesie), Persönlichkeitsstörungen. Solche verhaltensbezogenen und psychopathologischen Ereignisse traten häufiger bei Kindern auf als bei Erwachsenen (38,6% versus 18,6%).
Eine Studie bei Erwachsenen und Jugendlichen mit myoklonischen Anfällen (12 bis 65 Jahre) zeigte, dass bei 33,3% der Patienten der Levetiracetam-Gruppe und bei 30,0% der Placebo-Gruppe unerwünschte Wirkungen auftraten, die als mit der Behandlung zusammenhängend bewertet wurden. Die am häufigsten berichteten unerwünschten Wirkungen waren Kopfschmerzen und Somnolenz. Die Inzidenz der unerwünschten Wirkungen bei Patienten mit myoklonischen Anfällen war niedriger als die bei Patienten mit partiellen Anfällen (33,3% gegenüber 46,4%).
Eine Studie bei Erwachsenen und Kindern (4 bis 65 Jahre) mit idiopathischer generalisierter Epilepsie mit primär generalisierten tonisch-klonischen Anfällen zeigte, dass 39,2% der Patienten der mit Levetiracetam behandelten Gruppe und 29,8% der mit Placebo behandelten Gruppe unerwünschte Wirkungen hatten, die mit der Behandlung in Verbindung gebracht wurden. Die häufigste unerwünschte Wirkung war Müdigkeit.
Unerwünschte Wirkungen aus klinischen Studien und aus Erfahrungen nach der Zulassung sind in der folgenden System-Organklassen-Tabelle nach Häufigkeit aufgeführt. Für klinische Versuche wird die Häufigkeit folgendermassen definiert: sehr häufig: ≥1/10; häufig: ≥1/100 bis <1/10; gelegentlich: ≥1/1'000 bis <1/100; selten: ≥1/10'000 bis <1/1000; sehr selten: <1/10'000, inklusive Einzelfälle.
Die Daten aus Erfahrungen nach der Zulassung reichen nicht aus, um eine Schätzung über die Inzidenz in der behandelten Population abzugeben.
Infektionen und parasitäre Erkrankungen
Sehr häufig: Nasopharyngitis.
Selten: Infektion.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Thrombozytopenie.
Erfahrungen nach der Zulassung: Panzytopenie (in einigen Fällen wurde eine Knochenmarkssuppression festgestellt), Agranulozytose, Leukopenie, Neutropenie.
Erkrankungen des lmmunsystems
Erfahrungen nach der Zulassung: Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (Drug Reaction with Eosinophilia and Systemic Symptoms [DRESS], siehe «Warnhinweise und Vorsichtsmassnahmen»); anaphylaktische Reaktionen.
Stoffwechsel und Ernährungsstörungen
Häufig: Anorexie.
Gelegentlich: Gewichtszunahme.
Erfahrung nach der Zulassung: Gewichtsverlust, Hyponatriämie.
Psychiatrische Erkrankungen
Häufig: Depression, Feindseligkeit, Aggression, Schlaflosigkeit, Nervosität, Reizbarkeit.
Gelegentlich: emotionale Labilität/Stimmungsschwankung, Agitation.
Selten: Persönlichkeitsveränderungen, anormales Denken.
Erfahrungen nach der Zulassung: anormales Verhalten, Wut, Panikattacke, Ängstlichkeit, Verwirrungszustand, Halluzination, psychotische Störungen, suizidale Gedanken, Suizidversuch, Suizid, Delirium.
Erkrankungen des Nervensystems
Sehr häufig: Somnolenz, Kopfschmerzen.
Häufig: Konvulsion, Benommenheit, Tremor, Gleichgewichtsstörungen.
Gelegentlich: Amnesie, Koordinationsstörungen/Ataxie, Aufmerksamkeitsstörungen, Beeinträchtigung des Gedächtnisses.
Selten: Hyperkinesie.
Erfahrung nach der Zulassung: Choreoathetose, Dyskinesie, Parästhesie, Lethargie, Gehstörungen.
Augenerkrankungen
Gelegentlich: Diplopie, verschwommenes Sehen.
Erkrankungen des Ohres und des Labyrinths
Häufig: Schwindel.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten.
Erkrankungen des Gastrointestinaltrakts
Häufig: Abdominalschmerzen, Diarrhö, Dyspepsie, Nausea, Erbrechen.
Erfahrungen nach der Zulassung: Pankreatitis.
Leber und Gallenerkrankungen
Erfahrung nach der Zulassung: Leberversagen, Hepatitis, anormale Leberfunktionstests.
Erkrankungen der Nieren und Harnwege
Erfahrung nach der Zulassung: akute Nierenschädigung.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Hautausschlag.
Gelegentlich: Ekzem, Juckreiz.
Erfahrungen nach der Zulassung: toxische epidermale Nekrolyse, Stevens-Johnson-Syndrom (siehe «Warnhinweise und Vorsichtsmassnahmen»), Erythema multiforme und Alopezie (in mehreren Fällen von Alopezie wurde nach dem Absetzen von Levetiracetam eine Besserung beobachtet), Angioödem.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Myalgie.
Erfahrungen nach der Zulassung: Muskelschwäche, Rhabdomyolyse und erhöhte Kreatinphosphokinase im Blut1.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Asthenie, Müdigkeit.
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Gelegentlich: Verletzungen.
Beschreibung ausgewählter unerwünschter Wirkungen
1 Rhabdomyolyse und erhöhte Kreatinphosphokinase im Blut treten bei japanischen Patienten im Vergleich zu nicht-japanischen Patienten signifikant häufiger auf.
Überdosierung
Symptome
Bei Überdosierung von Levetiracetam wurden Fälle von Somnolenz, Agitiertheit, Aggression, Bewusstseinstrübung, Atemdepression und Koma beobachtet.
Massnahmen bei Überdosierung
Ein spezifisches Antidot für Levetiracetam ist nicht bekannt. Die Behandlung einer Überdosierung erfolgt symptomatisch und kann eine Hämodialyse einschliessen. Die Extraktionsrate bei Dialyse beträgt für Levetiracetam 60%, für den Metaboliten 74%.
Eigenschaften/Wirkungen
ATC-Code: N03AX14
Der Wirkstoff Levetiracetam ist ein Pyrrolidon-Derivat, das S-Enantiomer des α-Ethyl-2-oxo-1-pyrrolidin-acetamids, und ist chemisch nicht mit bekannten Antiepileptika verwandt.
Wirkungsmechanismus
Der Wirkmechanismus von Levetiracetam muss noch vollständig aufgeklärt werden, scheint sich aber von den Wirkmechanismen der bekannten antiepileptischen Arzneimittel zu unterscheiden.
In vitro und in vivo Experimente deuten darauf hin, dass Levetiracetam grundlegende Zellfunktionen und die normale Neurotransmission nicht verändert.
In vitro Studien zeigen, dass Levetiracetam die intraneuronalen Ca2+-Spiegel beeinflusst, indem der durch N-Typ-Kanäle vermittelte Ca2+-Strom partiell inhibiert sowie die Freisetzung von Ca2+ aus intraneuronalen Speichern vermindert wird. Weiterhin kehrt es partiell die Reduktion der GABA- und Glycin-gesteuerten Ströme um, die durch Zink und β-Carboline induziert wird.
Darüber hinaus wurde in in vitro Studien gezeigt, dass Levetiracetam an eine spezifische Stelle im Hirngewebe von Nagern bindet. Bei dieser Bindungsstelle handelt es sich um das synaptische Vesikelprotein 2A, von dem angenommen wird, dass es an der Vesikelfusion und der Exozytose von Neurotransmittern beteiligt ist.
Levetiracetam und Analoga weisen bei der Bindungsaffinität zum synaptischen Vesikelprotein 2A eine Rangfolge auf, die im audiogenen Epilepsie-Modell an der Maus mit der Potenz ihres antikonvulsiven Schutzes korreliert ist. Dieser Befund weist darauf hin, dass die Interaktion zwischen Levetiracetam und dem synaptischen Vesikelprotein 2A zu dem antiepileptischen Wirkmechanismus der Substanz beizutragen scheint.
Pharmakodynamik
Levetiracetam ist in den klassischen Screening-Modellen für Antikonvulsiva nicht aktiv. Levetiracetam gewährt aber in einer Vielzahl von Tiermodellen für partielle und primär generalisierte Anfälle einen starken Anfallsschutz, verbunden mit einem ungewöhnlich hohen Sicherheitsabstand zwischen therapeutischen Dosen und den Dosen, bei denen Nebenwirkungen ausgelöst werden können.
Klinische Wirksamkeit
Klinische Studien mit dem Infusionskonzentrat
Daten zur Anwendung des Infusionskonzentrats sind begrenzt. Die Daten stammen überwiegend aus klinischen Studien mit einer oralen Darreichungsform (Filmtablette).
Die Studien bei Erwachsenen mit dem Infusionskonzentrat dauerten maximal 4 Tage und bezogen sich auf Vergleiche der pharmakokinetischen Parameter zwischen den verschiedenen galenischen Formulierungen.
Zur Evaluierung der Sicherheit und Verträglichkeit wurde eine offene, einarmige Studie an 25 Patienten mit Levetiracetam-Dosierungen von 1000 mg/Tag bis 3000 mg/Tag durchgeführt. Anstelle der üblichen oralen Dosierung wurde die gleiche Dosis Levetiracetam durch intravenöse Infusion während 15 Minuten an erwachsenen Patienten mit partiellen Anfällen als Zusatzbehandlung verabreicht (4 Tage zweimal täglich). Es wurde keine Verschlimmerung der Anfälle während dieses klinischen Versuchs und des kurzen Follow-Up beobachtet.
Die beobachteten Nebenwirkungen entsprachen dem bekannten Levetiracetam-Nebenwirkungungsprofil. Zusätzlich traten EKG-Veränderungen und Blutdruckabfall (diastolisch unter 40 mm Hg) auf.
Klinische Studien mit der oralen Darreichungsform
Zusatzbehandlung partieller Anfälle mit oder ohne sekundäre Generalisierung bei Erwachsenen und Kindern ab 4 Jahren mit Epilepsie
Die therapeutische Wirksamkeit und Sicherheit von Levetiracetam wurde bei über 3000 Patienten und Probanden untersucht, die mit einer oralen Darreichungsform (Filmtabletten) behandelt wurden. Der grundlegende Nachweis der Wirksamkeit wurde durch drei randomisierte placebokontrollierte Studien mit insgesamt 904 erwachsenen Patienten erbracht. Die Studienteilnehmer waren Patienten mit refraktärer Epilepsie, bei denen Anfälle mit oder ohne sekundäre Generalisierung auftraten, obwohl sie auf ein stabiles Dosisschema von maximal zwei Standard-Antiepileptika eingestellt waren. In diesem Patientenkollektiv wurde ein klinisch relevanter Nutzen von Levetiracetam nachgewiesen. Levetiracetam als Zusatzbehandlung in Tagesdosen von 1000 bis 3000 mg konnte die Anfallshäufigkeit bei Patienten mit refraktärer partieller Epilepsie im Vergleich zu Placebo signifikant verringern. Die Verringerung der Anfallshäufigkeit betrug zwischen 17% und 40% gegenüber dem Ausgangswert verglichen mit 6%–7% bei Placebo. Die Ansprechrate in der aktiven Gruppe lag zwischen 22% und 42% (Placebo: 10%–16%).
Zusatzbehandlung myoklonischer Anfälle bei Erwachsenen und Jugendlichen ab 12 Jahren mit juveniler myoklonischer Epilepsie
Die Wirksamkeit von Levetiracetam wurde in einer doppelblinden, placebokontrollierten Studie mit einer Dauer von 16 Wochen bei Patienten ab 12 Jahren, die an verschiedenen Syndromen idiopathischer generalisierter Epilepsie mit myoklonischen Anfällen litten, nachgewiesen. Die Mehrzahl der Patienten hatte juvenile myoklonische Epilepsie. In dieser Studie betrug die Levetiracetam-Dosis 3000 mg/Tag, die auf zwei Einzeldosen aufgeteilt wurde. Bei 58,3% der mit Levetiracetam und 23,3% der mit Placebo behandelten Patienten wurden die Tage mit myoklonischen Anfällen pro Woche um mindestens 50% reduziert. Bei fortgesetzter Langzeitbehandlung waren 28,6% der Patienten für mindestens 6 Monate und 21,0% der Patienten für mindestens 1 Jahr frei von myoklonischen Anfällen.
Zusatzbehandlung von primär generalisierten tonisch-klonischen Anfällen bei Erwachsenen und Jugendlichen ab 12 Jahren mit idiopathischer generalisierter Epilepsie
Die Wirksamkeit von Levetiracetam wurde in einer 24-wöchigen, doppelblinden, placebokontrollierten Studie untersucht, welche erwachsene Patienten, Jugendliche und eine limitierte Anzahl Kinder einschloss, die an verschiedenen Syndromen idiopathischer generalisierter Epilepsie mit primär generalisierten tonisch-klonischen (PGTK) Anfällen (juvenile myoklonische Epilepsie, juvenile Absencen-Epilepsie, kindliche Absencen-Epilepsie oder Epilepsie mit Aufwach-Grand-Mal-Anfällen) litten. In dieser Studie wurden Erwachsene und Jugendliche mit 3000 mg/Tag und die Kinder mit 60 mg/kg/Tag behandelt. Das Arzneimittel wurde aufgeteilt auf zwei gleich grosse tägliche Gaben verabreicht. Bei 72,2% der mit Levetiracetam behandelten Patienten und 45,2% der mit Placebo behandelten Patienten zeigte sich eine 50%ige oder höhere Reduktion der PGTK Anfälle pro Woche. Mit einer weitergeführten Langzeitbehandlung waren 47,4% der Patienten für mindestens sechs Monate und 31,5% für mindestens ein Jahr frei von tonisch-klonischen Anfällen.
Monotherapie partieller Anfälle mit und ohne sekundärer Generalisierung bei Patienten ab 16 Jahren mit Epilepsie
Die Wirksamkeit von Levetiracetam als Monotherapie wurde in einer Nicht-Unterlegenheits-Studie im Vergleich zu kontrolliert freigesetztem (controlled release, CR) Carbamazepin in einem doppelblinden Parallelgruppen-Design bei 576 Patienten ab 16 Jahren mit neu oder kürzlich diagnostizierter Epilepsie nachgewiesen.
Die Patienten mussten entweder nichtprovozierte partielle Anfälle oder generalisierte tonisch-klonische Anfälle aufweisen. Die Patienten wurden auf 400–1200 mg Carbamazepin CR/Tag oder auf 1000–3000 mg Levetiracetam/Tag randomisiert. Die Dauer der Behandlung betrug je nach Ansprechen bis zu 121 Wochen. Bei 73,0% der mit Levetiracetam und bei 72,8% der mit Carbamazepin CR behandelten Patienten wurde eine Anfallsfreiheit von 6 Monaten erreicht; der berechnete absolute Unterschied zwischen den Behandlungen betrug 0,2% (95% KI: –7,8; 8,2). Mehr als die Hälfte der Patienten blieb 12 Monate lang anfallsfrei (56,6% der mit Levetiracetam bzw. 58,5% der mit Carbamazepin CR behandelten Patienten).
Konversion zur Monotherapie
Bei 36 von 69 Patienten (52%) mit fokaler Epilepsie, die erfolgreich auf eine Zusatztherapie mit Levetiracetam angesprochen hatten, war dieser Effekt auch nach Umstellung auf eine Levetiracetam-Monotherapie über 12 Wochen nachweisbar.
Pharmakokinetik
Das pharmakokinetische Profil wurde nach oraler Anwendung erstellt. Eine Einzeldosis von 1500 mg Levetiracetam verdünnt in 100 ml eines kompatiblen Verdünnungsmittels, über 15 Minuten intravenös infundiert, ist bioäquivalent mit der oralen Einnahme von 1500 mg Levetiracetam, gegeben als 3 Tabletten à 500 mg.
Das pharmakokinetische Profil zeichnet sich durch Dosislinearität verbunden mit einer geringen intra- und interindividuellen Variabilität aus. Die Clearance verändert sich nach wiederholter Anwendung nicht.
Das zeitunabhängige pharmakokinetische Profil von Levetiracetam wurde auch nach zweimal täglicher intravenöser Infusion von 1500 mg über 4 Tage bestätigt.
Es gibt keinen Hinweis auf relevante geschlechts- oder ethnienspezifische Unterschiede oder zirkadiane Schwankungen. Das pharmakokinetische Profil bei gesunden Probanden und bei Patienten mit Epilepsie ist vergleichbar.
Distribution
Die maximale Plasmakonzentration (Cmax), die nach intravenöser Einzeldosis von 1500 mg infundiert über 15 Minuten beobachtet wurde, betrug 51 ± 19 µg/ml.
Weder Levetiracetam noch sein Hauptmetabolit werden signifikant an Plasmaproteine gebunden (<10%). Das Verteilungsvolumen von Levetiracetam beträgt annähernd 0,5–0,7 l/kg; ein Wert, der nahe am Volumen der intra- und extrazellulären Flüssigkeit liegt. Es konnte eine signifikante Korrelation zwischen Speichel- und Plasmakonzentrationen aufgezeigt werden (das Verhältnis von Speichel- zu Plasmakonzentration war zwischen 1 und 1,6).
Metabolismus
Der Hauptmetabolisierungsweg ist die enzymatische Hydrolyse der Acetamidgruppe von Levetiracetam (24% der Dosis) zum inaktiven Metaboliten. Bei der Bildung dieses Metaboliten sind Isoformen des Cytochrom P450-Systems der Leber nicht beteiligt.
Die Hydrolyse der Acetamidgruppe erfolgt in verschiedenen Geweben und im Vollblut, dagegen nicht im Plasma. Weiterhin wurden zwei Nebenmetaboliten identifiziert. Der eine entsteht durch Hydroxylierung des Pyrrolidinrings (1,6% der Dosis), der andere durch Öffnung des Pyrrolidinrings (0,9% der Dosis). Weitere, nicht-identifizierte Abbauprodukte haben einen Anteil von 0,6% der Dosis.
Weder für Levetiracetam noch für seinen inaktiven Hauptmetaboliten wurde in vivo eine Umwandlung der Enantiomere ineinander festgestellt.
Elimination
Die Plasmahalbwertszeit beträgt 7,2 Stunden.
Die Gesamtkörperclearance beträgt im Mittel 0,96 ml/min/kg.
Die Ausscheidung erfolgt mit ca. 95% der Dosis hauptsächlich über den Urin. Lediglich 0,3% der Dosis werden mit den Faeces ausgeschieden. Die kumulierte renale Ausscheidung von Levetiracetam und seinem Hauptmetaboliten innerhalb der ersten 48 Stunden liegt bei 66% bzw. 24% der verabreichten Dosis. Die renale Clearance von Levetiracetam und dem Metaboliten beträgt 0,6 bzw. 4,2 ml/min/kg. Diese Werte deuten darauf hin, dass Levetiracetam über glomeruläre Filtration ausgeschieden und anschliessend tubulär rückresorbiert wird, während der Hauptmetabolit glomerulär filtriert und zusätzlich noch aktiv tubulär sezerniert wird.
Die Elimination von Levetiracetam korreliert mit der Kreatinin-Clearance.
Kinetik spezieller Patientengruppen
Ältere Patienten
Die Halbwertszeit von Levetiracetam verlängert sich bei älteren Patienten um etwa 40% auf 10–11 Stunden. Dies hängt mit der verminderten Nierenfunktion bei dieser Personengruppe zusammen (siehe «Dosierung/Anwendung»).
Kinder und Jugendliche
Wirksamkeit und Sicherheit von Levetiracetam Infusionskonzentrat wurden bei Kindern und Jugendlichen <16 Jahren nicht untersucht. Daher liegen nur Daten aus Studien mit den oralen Darreichungsformen vor (siehe Fachinformation zu Levetiracetam DESITIN Mini-Filmtabletten und Lösung).
Patienten mit eingeschränkter Nierenfunktion
Die Gesamtkörperclearance von Levetiracetam und seinem Hauptmetaboliten korreliert mit der Kreatinin-Clearance. Es wird daher empfohlen, die tägliche Erhaltungsdosis von Levetiracetam entsprechend der Kreatinin-Clearance bei Patienten mit mässiger bis schwerer Nierenfunktionsstörung anzupassen (siehe «Dosierung/Anwendung»).
Bei anurischen erwachsenen Patienten mit Nierenerkrankungen im Endstadium beträgt die Halbwertszeit ca. 25 Stunden zwischen zwei Dialysevorgängen bzw. 3,1 Stunden während der Dialyse. Während einer typischen, 4-stündigen Dialyse werden 51% der Levetiracetam-Dosis aus dem Plasma entfernt.
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit leichter bis mässiger Beeinträchtigung der Leberfunktion ist die Clearance von Levetiracetam nur unwesentlich verändert. Dagegen ist bei den meisten Patienten mit schwerer Leberfunktionsstörung aufgrund einer gleichzeitig vorliegenden Beeinträchtigung der Nierenfunktion die Clearance von Levetiracetam um mehr als 50% herabgesetzt (siehe «Dosierung/Anwendung»).
Präklinische Daten
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Genotoxizität und zum kanzerogenen Potential lassen die präklinischen Daten kein besonderes Risiko für den Menschen erkennen. Studien an Mäusen und Ratten ergaben kein karzinogenes Potential von Levetiracetam. Nebenwirkungen, die bei Ratten und in geringerem Ausmass auch bei Mäusen nach Exposition im humantherapeutischen Bereich auftraten und nicht in klinischen Studien beobachtet wurden, jedoch als möglicherweise relevant für die klinische Anwendung zu bewerten sind, waren Leberveränderungen, die auf eine adaptive Reaktion hinweisen wie z.B. erhöhtes Lebergewicht, zentrolubuläre Hypertrophie, Fettinfiltration und erhöhte Leberenzyme im Plasma.
In reproduktionstoxikologischen Studien an der Ratte, bei Wirkstoffspiegeln ähnlich oder höher denen beim Menschen, wirkte Levetiracetam toxisch auf die Entwicklung (vermehrte Skelettveränderungen/geringfügige Skelettanomalien, verzögertes Wachstum, erhöhte Sterblichkeit der Jungtiere). Beim Kaninchen wurden nach maternaltoxischen Dosierungen schädliche Wirkungen auf den Embryo beobachtet (Tod des Embryo, vermehrte Skelettanomalien und vermehrte Missbildungen).
Der Wirkstoffspiegel, bei dem noch kein toxischer Effekt beim Kaninchen beobachtet wurde, betrug etwa das 4- bis 5-fache des Wirkstoffspiegels beim Menschen.
Studien mit neonatalen und juvenilen Ratten und Hunden zeigten keine für den Menschen relevanten Wirkungen auf irgendeinen der Entwicklungs- oder Reifungsendpunkte bei Dosen bis zu 1800 mg/kg/Tag. Die Exposition bei den Tieren lag deutlich über der Exposition, die beim Menschen nach maximal empfohlener Dosierung zu finden ist.
Sonstige Hinweise
Inkompatibilitäten
Levetiracetam DESITIN Infusionkonzentrat darf nur mit den unter «Hinweise für die Handhabung» aufgeführten Arzneimitteln gemischt werden.
Beeinflussung diagnostischer Methoden
Es ist keine Beeinflussung von diagnostischen Methoden durch Levetiracetam DESITIN bekannt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden. Levetiracetam DESITIN Infusionskonzentrat enthält kein Konservierungsmittel. Nach Anbruch der Ampulle ist es sofort zu verwenden. Allfällige Reste sind zu verwerfen. Die chemische und physikalische Stabilität der gebrauchsfertigen Zubereitung (siehe unten, «Hinweise für die Handhabung») wurde für 24 h bei 2–8 °C gezeigt. Aus mikrobiologischen Gründen ist sie unmittelbar nach Verdünnung zu verwenden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15–25 °C) in der Originalverpackung und für Kinder unzugänglich aufbewahren.
Hinweise für die Handhabung
Eine Ampulle Levetiracetam DESITIN Infusionskonzentrat zu 5 ml enthält 500 mg Levetiracetam. Das erforderliche Volumen wird der Ampulle entnommen und mit 100 ml Natriumchlorid 0,9%, Glukose 5% oder Ringer Laktat verdünnt. Die Applikation erfolgt als intravenöse Infusion über 15 Minuten. Das zu entnehmende Volumen Infusionskonzentrat für eine bestimmte Dosis ist in der untenstehenden Tabelle dargestellt:
Dosis | Entnahmevolumen |
250 mg | 2,5 ml (½ Ampulle) |
500 mg | 5 ml (1 Ampulle) |
1000 mg | 10 ml (2 Ampullen) |
1500 mg | 15 ml (3 Ampullen) |
Levetiracetam DESITIN Infusionskonzentrat ist mit folgenden Arzneimitteln kompatibel: Lorazepam, Diazepam, Natrium-Valproat.
Zulassungsnummer
62616(Swissmedic).
Zulassungsinhaberin
Desitin Pharma GmbH, 4410 Liestal.
Stand der Information
Dezember 2018
Composition
Principe actif: lévétiracétam.
Excipients: acétate de sodium trihydrate, chlorure de sodium, acide acétique glacial, eau pour injection.
Forme galénique et quantité de principe actif par unité
Ampoule avec solution concentrée pour perfusion à 500 mg/5 ml.
Indications/Possibilités d’emploi
Levetiracetam DESITIN solution concentrée pour perfusion est indiqué en monothérapie dans le traitement des crises partielles avec ou sans généralisation secondaire chez les patients épileptiques à partir de 16 ans.
Levetiracetam DESITIN solution concentrée pour perfusion est indiqué en traitement adjuvant
– des crises partielles avec ou sans généralisation secondaire chez les patients épileptiques à partir de 16 ans.
– des crises myocloniques chez les patients à partir de 16 ans présentant une épilepsie juvénile myoclonique;
– des crises généralisées tonico-cloniques primaires chez les patients à partir de 16 ans présentant une épilepsie généralisée idiopathique.
Levetiracetam DESITIN solution concentrée pour perfusion constitue une alternative de courte durée pour les patients chez lesquels l'administration par voie orale est momentanément impossible.
Posologie/Mode d’emploi
Le traitement par Levetiracetam DESITIN peut être instauré par voie intraveineuse ou orale. Le passage de la voie orale à la voie intraveineuse et inversement peut se faire directement sans titration, mais la dose journalière et la fréquence d'administration doivent être maintenues.
Levetiracetam DESITIN solution concentrée pour perfusion doit être utilisé par voie intraveineuse uniquement. Après dilution, la dose est administrée en perfusion en l'espace de 15 minutes (voir «Remarques particulières» et «Remarques concernant la manipulation»). Les études récentes ne fournissent pas de données quant à l'utilisation du lévétiracétam intraveineux durant une période de plus de 4 jours.
Les données ci-dessous proviennent de ce fait essentiellement des études cliniques menées avec la forme galénique orale.
Adultes et adolescents à partir de 16 ans
Monothérapie
Le traitement devrait commencer par2× 250 mg/jour et la posologie sera augmentée à 2× 500 mg/jour après 2 semaines. En fonction de la réponse clinique, il est possible de l'augmenter encore par paliers de 2× 250 mg/jour toutes les 2 semaines jusqu' à une dose maximale de 2× 1500 mg/jour.
Traitement adjuvant
La posologie initiale est de 500 mg deux fois par jour. Selon l'efficacité clinique et la tolérance, la dose journalière peut être augmentée jusqu'à 1500 mg deux fois par jour. Les augmentations ou diminutions de la posologie peuvent s'effectuer par paliers de 500 mg deux fois par jour toutes les 2 à 4 semaines.
Adolescents à partir de 16 ans de moins de 50 kg
La dose thérapeutique initiale est de 10 mg/kg deux fois par jour. En fonction de la réponse clinique et de la tolérance, elle peut être augmentée jusqu'à 30 mg/kg deux fois par jour. L'adaptation posologique (augmentations et diminutions) doit s'effectuer par paliers de 10 mg/kg deux fois par jour toutes les 2 à 4 semaines.
Il convient d'utiliser la plus petite dose efficace.
Recommandations posologiques particulières
Enfants
La sécurité d'emploi et l'efficacité de Levetiracetam DESITIN solution concentrée pour perfusion n'ont pas été étudiées chez les patients de moins de 16 ans et ne sont donc pas établies.
Patients âgés
Chez les patients âgés, une adaptation posologique en fonction de la clairance de la créatinine est recommandée (voir «Patients dont la fonction rénale est diminuée»).
Patients dont la fonction rénale est diminuée
La dose journalière (posologie d'entretien) de Levetiracetam DESITIN doit être fixée individuellement selon la fonction rénale.
Pour utiliser le tableau ci-dessous, il est nécessaire d'évaluer la clairance de la créatinine (CLcr) du patient.
La CLcr en ml/min peut être estimée à partir du taux de créatinine sérique (mg/dl) selon la formule suivante:
CLcr (ml/min) = (140 – âge [années]) × poids (kg): (72 × créatinine sérique [mg/dl]) (× 0,85 pour la femme).
Ensuite, la CLcr est ajustée comme suit selon la surface corporelle (SC):
CLcr (ml/min/1,73 m²) = Clcr (ml/min) × 1,73 : SC patient (m²).
Adaptation de la posologie chez les patients adultes et adolescents à partir de 16 ans présentant une insuffisance rénale et pesant plus de 50 kg:
Fonction rénale | Clairance de la créatinine | Dose d'entretien et |
normale | >80 | 500–1500 mg |
légèrement diminuée | 50–79 | 500–1000 mg |
modérément diminuée | 30–49 | 250–750 mg |
fortement diminuée | <30 | 250–500 mg |
Patients nécessitant | – | 500–1000 mg |
* Une dose initiale de 750 mg est recommandée pour le premier jour de traitement par lévétiracétam.
** Une dose supplémentaire de 250-500 mg est recommandée après la dialyse.
Patients dont la fonction hépatique est diminuée
Une adaptation posologique n'est pas nécessaire chez les patients présentant une insuffisance hépatique légère à modérée. Dans les cas d'insuffisance hépatique sévère, la clairance de la créatinine peut fausser l'estimation de la fonction rénale. C'est pourquoi une diminution de moitié de la posologie journalière d'entretien est recommandée lorsque la clairance de la créatinine est inférieure à 60 ml/min/1.73m².
Arrêt du traitement
Conformément à la pratique clinique usuelle, l'arrêt du traitement par Levetiracetam DESITIN doit être réalisé de manière progressive.
Contre-indications
Hypersensibilité au lévétiracétam, aux substances de structure apparentée ou à l'un des excipients.
Mises en garde et précautions
Généralités
L'indication «Levetiracetam DESITIN solution concentrée pour perfusion constitue une alternative de courte durée pour les patients chez lesquels l'administration par voie orale est momentanément impossible» implique le cas échéant diverses situations cliniques modifiées, instables, et en tous les cas d'apparition récente. Par ailleurs, lors de l'utilisation de Levetiracetam DESITIN comme traitement adjuvant, il convient de passer du traitement initial à la forme intraveineuse ou, si celle-ci n'existe pas, avoir même recours à un autre principe actif.
Pour ce qui est de la situation générale modifiée du patient, on ne dispose pas d'expérience quant à la sécurité d'emploi et l'efficacité d'une association thérapeutique anticonvulsive. C'est pourquoi le médecin devra surveiller très étroitement le patient et procéder le cas échéant à d'autres modifications du traitement anticonvulsivant.
Fréquence des crises:
Une augmentation de plus de 25% de la fréquence des crises a été rapportée chez 14% des patients adultes et pédiatriquesatteints de crises partielles traités para le lévétiracetam et chez 26% des patient adultes et 21% des patients pédiatriques sous placebo.
Absences:
Lorsque le lévétiracétam a été utilisé dans le traitement des crises généralisées tonico-cloniques primaires chez des adultes et adolescents atteints d'épilepsie généralisée idiopathique, aucune efficacité dans le sens d'une diminution de la fréquence des absences n'a été observée.
État de mal épileptique:
L'efficacité pour le mal épileptique n'a pas été démontrée. L'utilisation de Levetiracetam DESITIN solution concentrée pour perfusion n'est alors pas recommandée.
Hémogramme:
Des cas de diminution du nombre de cellules sanguines (neutropénie, agranulocytose, leucopénie, thrombocytopénie et pancytopénie) ont été décrits en rapport avec la prise de lévétiracétam et ce, généralement au début du traitement. Une numération formule sanguine complète est recommandée chez les patients présentant une faiblesse significative, une pyrexie, des infections récurrentes ou des troubles de la coagulation (voir « Effets indésirables »).
Suicide
Il existe des rapports relatifs à des suicides, tentatives de suicide et idées suicidaires chez des patients sous lévétiracétam (adulte et enfants). Les patients, leurs proches ou leurs référents devraient par conséquent être informés, au cours d'un entretien détaillé et surtout avant le traitement, qu'il leur faut contacter immédiatement un médecin en cas d'aggravation de l'humeur et/ou de retrait social et/ou de survenue de symptômes dépressifs et/ou d'hostilité/agressivité ou d'autres modifications du comportement ou de la personnalité, mais en particulier lors d'idées suicidaires. Il faut savoir que la suicidalité ne peut s'annoncer dans certains cas que par des modifications du comportement. Avant le début du traitement, il convient de déterminer s'il existe des facteurs de risque de suicidalité scientifiquement prouvés, p.ex. affections psychiatriques et antécédents de suicidalité, et évaluer très soigneusement le rapport bénéfice/risque particulièrement sous ces aspects.
Réactions cutanées graves:
Des cas de réactions cutanées susceptibles d'entraîner la mort, dont le syndrome de Stevens-Johnson (SSJ) et la nécrolyse épidermique toxique (NET, ou syndrome de Lyell), ont été rapportés chez des malades (adultes et enfants) traités au lévétiracétam. Le risque de survenue d'un SSJ ou d'une NET est le plus élevé dans les premières semaines du traitement (déclenchement en moyenne entre le 14e et le 17e jour). Des cas se produisant encore après plus de quatre mois de prise et plus tard ont cependant été observés. Il convient d'informer les patients des signes avant-coureurs et des symptômes de ces effets secondaires graves, et de les surveiller étroitement, en particulier au début du traitement, afin de détecter toute réaction cutanée. Les signes ou symptômes d'un SSJ ou d'une NET (tel un exanthème d'extension progressive, s'accompagnant souvent de vésicules ou de lésions des muqueuses) doivent entraîner l'abandon du traitement au lévétiracétam, sauf si l'exanthème n'est clairement pas d'origine médicamenteuse. L'évolution du SSJ et de la NET dépend très largement de la rapidité du diagnostic et de l'arrêt immédiat de tous les médicaments suspects. Plus le traitement est interrompu tôt, meilleur est le pronostic. La survenue d'un SSJ ou d'une NET provoqués par la prise de lévétiracétam interdit toute administration ultérieure de cette molécule au patientconcerné.
Réactions d'hypersensibilité à impact systémique:
Les exanthèmes généralisés peuvent aussi survenir dans le cadre d'un syndrome d'hypersensibilité associé à l'un des symptômes systémiques suivants: fièvre, adénopathie, leucocytose, éosinophilie, lymphocytes atypiques, bilan hépatique ou rénal anormal, ou à d'autres symptômes évoquant un impact systémique (cf. «Effets indésirables - SHM: syndrome d'hypersensibilité médicamenteuse ou réaction médicamenteuse avec éosinophilie et symptômes systémiques [syndrome DRESS]»). Ce syndrome présente un degré de gravité clinique extrêmement variable, avec parfois une issue fatale. Il importe de tenir compte du fait que les premiers signes systémiques d'une hypersensibilité (fièvre, adénopathie par exemple) peuvent être manifestes alors qu'aucune altération cutanée n'est apparente.
Il convient d'une manière générale d'arrêter immédiatement les prises de lévétiracétam lorsque surviennent des symptômes indiquant une réaction d'hypersensibilité.
Sodium:
La teneur en sodium par ampoule est d'environ 17,536 mg, ce dont il convient de tenir compte chez les patients suivant un régime pauvre en sodium.
Interactions
Il a été démontré in vitro que le lévétiracétam et son métabolite principal n'inhibent l'activité ni des principales isoformes du cytochrome P450 (CYP3A4, 2A6, 2C9, 2C19, 2D6, 2E1 et 1A2) ni de la glucuronyltransférase (UGT1A1 et UGT1A6) ni de l'hydrolase époxyde. Le lévétiracétam n'influence pas non plus la glucuronidation in vitro de l'acide valproïque et na 'exercé qu'un effet faible ou nul sur la conjugaison de l'éthinylestradiol en cultures d'hépatocytes humains. A des concentrations élevées, le lévétiracétam exerce néanmoins une légère induction du CYP2B6 et du CYP3A4; à des concentrations cmax cependant, telles qu'elles ont été observées lors d'une administration répétée de 1500 mg deux fois par jour, ces effets ont été jugés comme étant sans pertinence clinique. Une interactions parinhibition ou induction enzymatique du lévétiracétam avec d'autres substances esttrès improbables. Le probénécide diminue la clairance rénale du métabolite principal mais pas celle du lévétiracétam. La concentration du métabolite principal reste cependant faible. Il est vraisemblable que d'autres substances éliminées par sécrétion tubulaire diminuent également la clairance rénale de ce métabolite. L'effet du lévétiracétam sur le probénécide n'a pas été étudié et l'effet du lévétiracétam sur d'autres principes actifs de sécrétion active, tels que les AINS, les sulfamidés et le méthotrexate est inconnu.
L'administration concomitante d'autres antiépileptiques (carbamazépine, phénytoïne, acide valproïque, phénobarbital, lamotrigine, primidone et gabapentine) ne modifie pas les paramètres pharmacocinétiques du lévétiracétam et inversement, le lévétiracétam n'influence également pas les concentrations sériques de ces antiépileptiques.
Les études pharmacocinétiques ne montrent d'interactions ni avec la digoxine ni avec les contraceptifs oraux (éthinylestradiol et lévonorgestrel) ni avec la warfarine. Les paramètres endocriniens (LH et progestérone) ainsi que le temps de prothrombine ne sont pas modifiés.
Aucune donnée n'est disponible sur une éventuelle interaction entre le lévétiracétam et l'alcool.
Grossesse/Allaitement
Femmes en âge de procréer
Les femmes en âge de procréer doivent être conseillées par un spécialiste. Il est recommandé d'utiliser une méthode de contraception sûre pendant toute la durée du traitement. Si une femme planifie une grossesse, le traitement par le lévétiracétam doit être reconsidéré. Comme avec d'autres médicaments antiépileptiques, un arrêt soudain de la prise du lévétiracétam doit être évité, car cela peut provoquer des crises de sevrage et un état de mal épileptique, qui peuvent avoir de graves conséquences pour la femme et l'enfant à naître. Une monothérapie est à privilégier dans la mesure du possible, car un traitement par plusieurs médicaments antiépileptiques pourrait êtres associé– selon sa combinaison à un risque plus élevé de malformations congénitales que la monothérapie.
Grossesse
Une forte proportion des données post-marketing sur les femmes enceintes traitées par le lévétiracétam en monothérapie (plus de 1800 femmes, 1500 femmes ont pris du lévétiracétam au cours du premmier trimestre de la grossesse), n'indique pas d'augmentation du risque de malfomations congénitales sévères. Il n'exites que peu de données sur le développement neurologique chez les enfants exposés in utero à Levetiracetam DESITIN solution concentrée pour perfusion en monothérapie. Les études épidémiologiques actuelles (portant surenviron 100 enfants) n'indiquent pas d'augmentation du risque accru de troubles ou de retards du développement neurologique.
Le lévétricétam peut être utilisé pendant la gorssesse si, après une évaluation minutieuse, il est considéré comme cliniquement nécessaire. Dans ce cas, la dose efficace la plus faible est recommandée.
Comme il a été observé avec d'autres médicaments antiépileptiques, des modifications physiologiques pendant la grossesse peuvent influencer la concentration plasmatique du lévétiracétam.
Il existe des rapports relatifs à la diminution de la concentration plasmatique du lévétiracétam pendant la grossesse. Cette diminution est nettement plus marquée durant le troisième trimestre (jusqu'à 60% de la concentration avant le début de la grossesse).
.
Chez les femmes enceintes traitées par le lévétiracétam, une surveillance clinique appropriée doit être assurée.
Prise pendant l'allaitement
Le lévétiracétam est excrétédans le lait maternel. L'allaitement n'est pas donc recommandé. Cependant, si le traitement par le lévétiracétam devait être nécessaire pendant l'allaitement, il faudra évaluer les avantages et les risques du traitement en considérant l'importance de l'allaitement pour le nourrison.
Fertilité
Il n'existe pas de données cliniques. Le risque potentiel pour les l'être humain est inconnu.
Effet sur l’aptitude à la conduite et l’utilisation de machines
L'effet sur l'aptitude à la conduite et l'utilisation de machines n'a pas fait l'objet d'études. En raison d'une possible sensibilité individuelle différente, certains patients peuvent présenter un état de somnolence ou d'autres troubles du système nerveux central en début de traitement ou à la suite d'une augmentation de la dose. C'est pourquoi la prudence est de rigueur lors d'activités nécessitant une grande habileté telles que la conduite d'un véhicule ou l'utilisation de machines.
Effets indésirables
Les effets indésirables observés lors de l'administration intraveineuse du lévétiracétam sont comparables à ceux observés sous administration orale. Les plus fréquents sont les étourdissements, la somnolence, les maux de tête et les vertiges orthostatiques.
Etant donné que le lévétiracétam intraveineux n'a été que peu utilisé et que les formes orale et intraveineuse d'administration sont bioéquivalentes, les données de sécurité d'emploi du lévétiracétam intraveineux se basent sur celles de l'administration orale.
Le médecin traitant doit tenir compte du fait que les données suivantes proviennent d'études dans lesquelles le lévétiracétam était associé à d'autres antiépileptiques. Il n'était donc pas toujours possible d'attribuer les effets indésirables observés à un médicament précis.
Les données de sécurité d'emploi et de tolérance recueillies au cours des études concernant les formes orales du lévétiracétam administré en cas de crises partielles indiquent la survenue d'effets indésirables chez 46,4% des patients adultes du groupe lévétiracétam et 42,2% du groupe placebo; 2,4% des patients du groupe lévétiracétam et 2,0% des patients du groupe placebo ont présenté des effets indésirables graves.
Les effets indésirables les plus fréquemment rapportés chez les patients adultes ont été la somnolence, l'asthénie et les étourdissements.
L'analyse récapitulative des données de sécurité d'emploi et de tolérance n'a pas montré de corrélation nette entre la dose et les effets secondaires. L'incidence et la gravité des effets indésirables affectant le système nerveux central ont toutefois diminué avec le temps.
Sous monothérapie, 49,8% des patients ont présenté au moins un effet secondaire. Les effets indésirables les plus fréquents étaient la fatigue et la somnolence.
Par ailleurs, des symptômes psychopathologiques tels qu'agitation, dépersonnalisation, agitation motrice (hyperkinésie) et troubles de la personnalité ont été rapportés. Les évènements comportementaux et psychopathologiques étaient plus fréquents chez les enfants que chez les adultes (38,6% versus 18,6%).
Une étude menée chez des adultes et adolescents (de 12 à 65 ans) présentant des crises myocloniques a montré que 33,3% des patients du groupe lévétiracétam et 30,0% des patients du groupe placebo ont eu des effets indésirables considérés comme liés au traitement. Les effets indésirables rapportés le plus souvent étaient les maux de tête et la somnolence. L'incidence des effets indésirables survenant chez les patients atteints de crises myocloniques était plus faible que chez les patients souffrant de crises partielles (33,3% versus 46,4%).
Une étude effectuée chez des adultes et des enfants (de 4 à 65 ans) atteints d'épilepsie généralisée idiopathique à crises généralisées tonico-cloniques primaires a montré que 39,2% des patients du groupe traité par lévétiracétam et 29,8% des patients du groupe sous placebo présentaient des effets indésirables considérés comme liés au traitement. L'effet indésirable le plus fréquent était la fatigue.
Les effets indésirables observés au cours d'études et faisant l'objet de rapports de pharmacovigilance figurent ci-après, classés par systèmes d'organes et en fonction de leur fréquence. Pour les études cliniques, la fréquence est définie comme suit: très fréquent: ≥1/10; fréquent: ≥1/100 à <1/10; peu fréquent: ≥1/1000 à <1/100; rare: ≥1/10'000 à <1/1000; très rare: <1/10'000, y compris les cas isolés.
Les données recueillies depuis la commercialisation sont insuffisantes pour déterminer leur incidence dans la population traitée.
Infections et infestations
Très fréquent: nasopharyngite.
Rare: infection
Affections hématologiques et du système lymphatique
Peu fréquent: thrombocytopénie.
Expérience après commercialisation: pancytopénie (avec aplasie médullaire dans quelques cas), agranulocytose, leucopénie, neutropénie.
Affections du système immunitaire
Expérience après commercialisation: exanthème médicamenteux avec éosinophilie et symptômes systémiques (syndrome d'hypersensibilité médicamenteuse [SHM] ou syndrome DRESS [Drug Reaction with Eosinophilia and Systemic Symptoms], voir «Mises en gare et précautions») , réactions anaphylactiques.
Troubles du métabolisme et de la nutrition
Fréquent: anorexie.
Peu fréquent: prise de poids.
Expérience après commercialisation: perte de poids, hyponatrémie.
Affections psychiatriques
Fréquent: dépression, hostilité, agressivité, insomnie, nervosité, irritabilité.
Peu fréquent: labilité émotionelle/sautes d'humeur, agitation.
Rare: troubles de la personnalité, pensées anormales.
Expérience après commercialisation: trouble ducomportement, colère, accès de panique, anxiété, état de confusion, hallucinations, troubles psychotiques, idées suicidaires, tentative de suicide, suicide, délire.
Affections du système nerveux
Très fréquents: somnolence, céphalée.
Fréquents: convulsions, étourdissements, céphalées, hyperkinésie, tremblements, troubles de l'équilibre.
Peu fréquent: amnésie, troubles de la coordination/ataxie, troubles de l'attention, troubles de la mémoire.
Rare: hyperkinésie.
Expérience après commercialisation: choréoathétose, dyskinésie, paresthésie, léthargie, trouble de la marche
Affections oculaires
Peu fréquents: diplopie, vision trouble.
Affections de l'oreille et du labyrinthe
Fréquents: vertige.
Affections respiratoires, thoraciques et médiastinales
Fréquents: toux.
Affections gastro-intestinales
Fréquents: douleurs abdominales, diarrhée, dyspepsie, nausée, vomissements.
Expérience après commercialisation: pancréatite.
Affections hépatobiliaires
Expérience après commercialisation: insuffisance hépatique, hépatite, anomalies des tests de la fonction hépatique.
Affections du rein et des voies urinaires
Expérience après commercialisation: lésion rénale aiguë.
Affections de la peau et du tissu sous-cutané
Fréquents: éruption cutanée.
Peu fréquent: eczéma, prurit.
Expérience après commercialisation: nécrolyse épidermique toxique, syndrome de Stevens-Johnson (voir «Mises en garde et précautions»), érythème polymorphe et alopécie. Dans plusieurs cas d'alopécie, une amélioration a été observée après l'arrêt du lévétiracétam, angio-œdème.
Affections musculo-squelettiques et du tissu conjonctif
Peu fréquents: myalgie.
Expérience après commercialisation: faiblesse musculaire, rhabdomyolyse et augmentation du taux de créatine phosphokinase dans le sang1.
Troubles généraux et anomalies au site d'administration
Fréquent: asthénie, fatigue.
Lésions, intoxications et complications liées aux procédures
Peu fréquent: blessures.
Description d'effets indésirables sélectionnés:
1 La rhabdomyolyse et l'augmentation du taux de créatine phosphokinase dans le sang sont significativement plus fréquentes chez les patients japonais que chez les patients non japonais.
Surdosage
Symptômes
En cas de surdosage du lévétiracétam, des cas de somnolence, agitation, agressivité, troubles de l'état de conscience, dépression respiratoire et coma ont été observés.
Mesures à prendre en cas de surdosage
Un antidote spécifique au lévétiracétam n'est pas connu. Le traitement d'un surdosage est symptomatique et peut inclure une hémodialyse. Le taux d'extraction par dialyse s'élève à 60% pour le lévétiracétam et à 74% pour son métabolite.
Propriétés/Effets
Code ATC: N03AX14
Le principe actif lévétiracétam est un dérivé de la pyrrolidone, à savoir le S-énantiomère de l'acétamide α-éthyl-2-oxo-1-pyrrolidine, d'une structure chimique non apparentée à celle d'antiépileptiques connus.
Mécanisme d'action
Le mécanisme d'action du lévétiracétam n'est pas encore complètement élucidé, mais semble être différent des mécanismes d'action d'antiépileptiques connus.
Les expériences in vitro et in vivo suggèrent que le lévétiracétam ne modifie ni les fonctions cellulaires essentielles ni la neurotransmission normale.
Des études in vitro montrent que le lévétiracétam agit sur le taux de Ca2+ intraneuronal en inhibant partiellement le flux de Ca2+ médié par les canaux calciques de type N et en diminuant la libération du Ca2+ des réserves intra-neuronales. Il inverse, en outre, partiellement la diminution des flux GABAergiques et glycinergiques qu'induisent le zinc et les β-carbolines.
Par ailleurs, des études in vitro ont montré que le lévétiracétam se lie à un site spécifique du tissu cérébral des rongeurs. Ce site est la protéine vésiculaire synaptique 2A qui semble être impliquée dans la fusion vésiculaire et l'exocytose des neurotransmetteurs.
Le lévétiracétam et ses analogues montrent un degré d'affinité pour la protéine vésiculaire synaptique 2A en corrélation avec la puissance de protection anticonvulsive dans le modèle d'épilepsie audiogène de la souris. Cette découverte suggère que l'interaction entre le lévétiracétam et la protéine 2A de la vésicule synaptique semble contribuer à l'effet antiépileptique de la substance.
Pharmacodynamie
Le lévétiracétam est inactif dans les modèles classiques de sélection d'anticonvulsifs. Cependant, le lévétiracétam assure, dans de nombreux modèles animaux, une haute protection contre les crises partielles et primaires généralisées, associée à une marge de sécurité particulièrement importante entre les doses thérapeutiques et les doses susceptibles de déclencher des effets secondaires.
Efficacité clinique
Etudes cliniques relatives à la solution concentrée pour perfusion
Les données relatives à l'utilisation de la solution concentrée pour perfusion sont limitées et proviennent pour la plupart d'études cliniques menées avec la forme d'administration orale (comprimés filmés).
Les études menées chez les adultes avec la solution concentrée pour perfusion duraient au maximum 4 jours et portaient sur la comparaison des paramètres pharmacocinétiques des différentes formes galéniques.
Pour évaluer la sécurité d'emploi et la tolérance, une étude ouverte à un bras a été menée chez 25 patients recevant des doses de 1000 à 3000 mg/jour de lévétiracétam. Au lieu de la posologie orale usuelle, la même dose de lévétiracétam était administrée en perfusion intraveineuse pendant 15 minutes en traitement adjuvant (deux fois par jour pendant 4 jours) chez des patients adultes atteints de crises partielles. Aucune aggravation des crises n'a été observée durant cette étude clinique ou durant son suivi de courte durée.
Les effets secondaires observés correspondaient au profil d'effets secondaires connu du lévétiracétam. Des modifications de l'ECG et une chute de pression artérielle (diastolique inférieure à 40 mmHg) ont été, en outre, observées.
Etudes cliniques avec la forme d'administration orale
Traitement adjuvant de crises partielles avec ou sans généralisation secondaire chez des épileptiques adultes et enfants à partir de 4 ans
L'efficacité thérapeutique et la sécurité d'emploi du lévétiracétam ont été étudiées chez plus de 3000 patients et volontaires qui recevaient le traitement par voie orale (comprimés filmés). La preuve fondamentale de l'efficacité a été fournie par trois études randomisées et contrôlées contre placebo chez 904 patients adultes au total. Les participants étaient atteints d'épilepsie réfractaire présentant des crises avec ou sans généralisation secondaire en dépit d'un schéma posologique stable comprenant au maximum deux antiépileptiques usuels. Un bénéfice clinique significatif sous lévétiracétam a été démontré dans cet effectif de patients. Le lévétiracétam en traitement adjuvant à raison de 1000 à 3000 mg par jour a significativement diminué par rapport au placebo la fréquence des crises des patients atteints d'épilepsie partielle réfractaire. La diminution de la fréquence des crises se situait entre 17% et 40% par rapport à la valeur initiale, contre 6-7% sous placebo. Le taux de réponse dans le groupe actif se situait entre 22% et 42% (placebo 10-16%).
Traitement adjuvant des crises myocloniques chez des adultes et adolescents à partir de 12 ans atteints d'épilepsie myoclonique juvénile
L'efficacité du lévétiracétam a été établie dans une étude de 16 semaines en double aveugle, contrôlée contre placebo, chez des patients de 12 ans et plus atteints de syndromes divers d'épilepsie idiopathique généralisée à crises myocloniques. Les patients présentaient en majorité une épilepsie myoclonique juvénile. Dans cette étude, la dose de lévétiracétam était de 3000 mg par jour, répartie en deux prises. Chez 58,3% des patients sous lévétiracétam et 23,3% des patients sous placebo, une diminution de 50% du nombre de jours à crises myocloniques par semaine est intervenue. Sous traitement maintenu à plus long terme, 28,6% des patients sont resté exempts de crises myocloniques pendant au moins 6 mois et 21% pendant au moins 1 an.
Traitement adjuvant des crises généralisées tonico-clonique primaires chez des adultes et adolescents à partir de 12 ans atteints d'épilepsie généralisée idiopathique
L'efficacité du lévétiracétam a été examinée dans une étude de 24 semaines en double aveugle, contrôlée contre placebo, incluant des adultes, des adolescents et un nombre limité d'enfants atteints de divers syndromes d'épilepsie généralisée idiopathique avec des crises généralisées tonico-cloniques primaires (GTCP), à savoir épilepsie myoclonique juvénile, épilepsie absence de l'adolescence, épilepsie absence de l'enfant ou épilepsie avec crises grand mal du réveil. Au cours de cette étude, les adultes et adolescents étaient traités par 3000 mg/jour, les enfants par 60 mg/kg/jour. L'administration du médicament était répartie en deux prises quotidiennes égales. Chez 72,2% des patients sous lévétiracétam et 45,2% des patients sous placebo, la fréquence des crises de GTCP a diminué de 50% ou plus. Sous traitement maintenu à long terme, 47,4% des patients sont restés exempts de crises tonico-cloniques pendant au moins six mois et 31,5% pendant au moins un an.
Monothérapie de crises partielles avec ou sans généralisation secondaire chez des patients épileptiques à partir de 16 ans
L'efficacité du lévétiracétam en monothérapie a été établie dans une étude comparative de non-infériorité en double aveugle et groupes parallèles contre la carbamazépine à libération contrôlée (controlled release, CR) chez 576 patients de 16 ans ou plus atteints d'épilepsie nouvellement ou récemment diagnostiquée.
Les patients devaient présenter, soit des crises partielles non provoquées, soit des crises tonico-cloniques généralisées. Ils étaient randomisés pour recevoir 400-1200 mg par jour de carbamazépine CR ou 1000-3000 mg par jour de lévétiracétam. Le traitement pouvait durer jusqu'à 121 semaines en fonction de la réponse. L'absence de crises pendant 6 mois a été obtenue chez 73,0% des patients sous lévétiracétam et chez 72,8% des patients sous carbamazépine CR; la différence absolue calculée entre les traitements était de 0,2% (IC 95%: -7,8; 8,2). Plus de la moitié des patients sont restés exempts de crises pendant 12 mois (56,6% sous lévétiracétam et 58,5% sous carbamazépine CR).
Passage à une monothérapie
Chez 36 des 69 patients (52%) atteints d'épilepsie focale ayant bien répondu à un traitement adjuvant par lévétiracétam, cet effet était également démontrable pendant 12 semaines après le passage à une monothérapie par lévétiracétam seul.
Pharmacocinétique
Le profil pharmacocinétique a été établi après administration orale. Une dose unique de 1500 mg de lévétiracétam diluée dans 100 ml d'un solvant compatible et administrée en perfusion intraveineuse de 15 minutes est bioéquivalente à 1500 mg de lévétiracétam administrés per os, soit 3 comprimés à 500 mg.
Le profil pharmacocinétique se caractérise par la linéarité de la relation dose-taux plasmatique, associée à une faible variabilité intra- et interindividuelle. La clairance reste inchangée après administration répétée.
Le profil pharmacocinétique du lévétiracétam indépendant du temps a été confirmé après perfusion intraveineuse de 1500 mg deux fois par jour pendant 4 jours.
Il n'existe aucune preuve de variabilité significative liée au sexe, à l'origine ethnique, ou au cycle nycthéméral. Le profil pharmacocinétique des volontaires sains et des patients épileptiques est comparable.
Distribution
Le pic de concentration plasmatique (Cmax) observé après une dose unique intraveineuse de 1500 mg perfusée en 15 minutes était de 51 ± 19 µg/ml.
Ni le lévétiracétam ni son métabolite principal ne se lient de façon significative aux protéines plasmatiques (<10%). Le volume de distribution du lévétiracétam est d'environ 0,5-0,7 l/kg, une valeur proche du volume de liquide intra- et extracellulaire. Une corrélation significative entre la concentration salivaire et la concentration plasmatique a pu être établie (le rapport des concentrations, salivaire / plasmatique, était de 1 à 1,6).
Métabolisme
La voie métabolique principale est l'hydrolyse enzymatique du groupe acétamide du lévétiracétam (24% de la dose) produisant un métabolite inactif. Les iso-enzymes du système cytochrome P450 hépatique ne participent pas à la formation de ce métabolite.
L'hydrolyse du groupe acétamide a lieu dans différents tissus et dans le sang total, mais pas dans le plasma. Par ailleurs, deux métabolites mineurs ont été identifiés, l'un est formé par hydroxylation du cycle pyrrolidine (1,6% de la dose), l'autre par ouverture du cycle pyrrolidine (0,9% de la dose). D'autres produits de dégradation non identifiés représentent 0,6% de la dose.
Une interconversion des énantiomères n'a été observée in vivo ni pour le lévétiracétam ni pour son principal métabolite inactif.
Elimination
La demi-vie plasmatique est de 7,2 heures.
La clairance corporelle totale s'élève en moyenne à 0,96 ml/min/kg.
L'élimination se fait principalement par voie urinaire, soit environ 95% de la dose. Seulement 0,3% de la dose est éliminé par voie fécale. L'élimination rénale cumulée du lévétiracétam et de son métabolite principal dans les premières 48 heures s'élève à respectivement 66% et 24% de la dose administrée. La clairance rénale du lévétiracétam est de 0,6 ml/min/kg, celle de son métabolite de 4,2 ml/min/kg. Ces valeurs indiquent que le lévétiracétam est éliminé par filtration glomérulaire couplée à une réabsorption tubulaire consécutive, alors que le métabolite principal est filtré au niveau glomérulaire et de plus activement sécrété au niveau tubulaire.
L'élimination du lévétiracétam est en corrélation avec la clairance de la créatinine.
Cinétique pour certains groupes de patients
Patients âgés
Chez les patients âgés, la demi-vie du lévétiracétam est prolongée d'environ 40%, atteignant 10-11 heures. Ce phénomène est en rapport avec la diminution de la fonction rénale dans ce groupe de personnes (voir «Posologie/Mode d'emploi»).
Enfants et adolescents
L'efficacité et la sécurité d'emploi de la solution concentrée pour perfusion de lévétiracétam n'ont pas été étudiées chez les enfants et adolescents de <16 ans. C'est pourquoi on ne dispose que de données relatives aux formes d'administration orale (voir information professionnelle de Levetiracetam DESITIN mini-comprimés filmés et solution).
Patients dont la fonction rénale est diminuée
La clairance corporelle totale du lévétiracétam et de son métabolite principal est en corrélation avec la clairance de la créatinine. Il est donc recommandé d'adapter la dose journalière d'entretien en fonction de la clairance de la créatinine chez les patients atteints de troubles modérés à sévères de la fonction rénale (voir «Posologie/Mode d'emploi»).
Chez les patients anuriques adultes au stade terminal d'affection rénale, la demi-vie est d'environ 25 heures entre deux séances de dialyse et de 3,1 heures pendant la dialyse. Au cours d'une dialyse classique de 4 heures, 51% de la dose de lévétiracétam sont extraits du plasma.
Patients dont la fonction hépatique est diminuée
Chez les patients présentant une altération légère à modérée de la fonction hépatique, la clairance du lévétiracétam est pratiquement inchangée. En revanche, chez la plupart des patients dont les troubles de la fonction hépatique sont sévères, la clairance du lévétiracétam est diminuée de plus de 50% en raison de la détérioration concomitante de la fonction rénale (voir «Posologie/Mode d'emploi»).
Données précliniques
Sur la base d'études conventionnelles de tolérance pharmacologique, de génotoxicité et du potentiel carcinogène, les données précliniques n'ont pas mis en évidence de risque particulier pour l'homme. Les études effectuées chez la souris et le rat n'ont pas montré de potentiel carcinogène du lévétiracétam. Les effets secondaires survenus chez les rats et dans une moindre mesure chez les souris après exposition aux doses utilisées en thérapeutique humaine, et qui n'ont pas été observés lors d'études cliniques mais pourraient être pertinents pour l'utilisation clinique, étaient des modifications hépatiques suggérantune réponse d'adaptation, p.ex. augmentation du poids du foie, hypertrophie centrolobulaire, infiltration adipeuse et élévation des enzymes hépatiquesplasmatiques.
Dans les études de toxicité sur la reproduction chez le rat, le lévétiracétam s'est avéré toxique sur le développement (modifications squelettiques/anomalies squelettiques mineures plus nombreuses, retard de croissance, mortalité supérieure des nouveau-nés) à des taux de principe actif similaires ou supérieurs à ceux dosés chez l'homme. Chez le lapin, des effets nuisibles sur l'embryon ont été observés à doses toxiques pour la mère (mort embryonnaire, anomalies squelettiques et malformations plus nombreuses).
Le taux de principe actif ne produisant pas encore d'effet toxique chez le lapin est environ 4 à 5 fois supérieur au taux de principe actif chez l'homme.
Les études chez des rats et chiens nouveau-nés et juvéniles, à des doses allant jusqu'à 1800 mg/kg/jour, n'ont pas mis en évidence d'effets indésirables pertinents pour l'homme sur aucun des critères d'évaluation du développement ou de la maturation. L'exposition des animaux était nettement supérieure à celle subie par l'homme à la posologie maximale recommandée.
Remarques particulières
Incompatibilités
Levetiracetam DESITIN solution concentrée pour perfusion ne peut être mélangé qu'aux médicaments mentionnés à la rubrique «Remarques concernant la manipulation».
Influence sur les méthodes de diagnostic
Aucune influence de Levetiracetam DESITIN sur les méthodes de diagnostic n'est connue.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient. Levetiracetam DESITIN solution concentrée pour perfusion ne contient pas d'agent conservateur, il faut l'utiliser immédiatement après ouverture de l'ampoule. Tout produit non utilisé doit être éliminé. La stabilité chimique et physique de la solution prête à l'emploi (voir ci-après «Remarques concernant la manipulation») a été démontrée pour une durée de 24 h à 2-8 °C. Il faut cependant l'utiliser immédiatement après dilution pour des raisons microbiologiques.
Remarques concernant le stockage
Conserver à température ambiante (15-25 °C) dans l'emballage original et hors de portée des enfants.
Remarques concernant la manipulation
Une ampoule à 5 ml de Levetiracetam DESITIN solution concentrée pour perfusion contient 500 mg de lévétiracétam. Le volume nécessaire est prélevé dans l'ampoule, puis dilué avec 100 ml de chlorure de sodium à 0,9%, de glucose à 5% ou de lactate de Ringer. L'administration s'effectue en perfusion intraveineuse durant 15 minutes. Le volume de concentrée pour perfusion à prélever pour obtenir une dose donnée figure dans le tableau ci-dessous:
Dose | Volume à prélever |
250 mg | 2,5 ml (½ ampoule) |
500 mg | 5 ml (1 ampoule) |
1000 mg | 10 ml (2 ampoules) |
1500 mg | 15 ml (3 ampoules) |
Levetiracetam DESITIN solution concentrée pour perfusion est compatible avec les médicaments suivants: lorazépam, diazépam, valproate sodique.
Numéro d’autorisation
62616 (Swissmedic).
Titulaire de l’autorisation
Desitin Pharma GmbH, 4410 Liestal.
Mise à jour de l’information
Décembre 2018
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


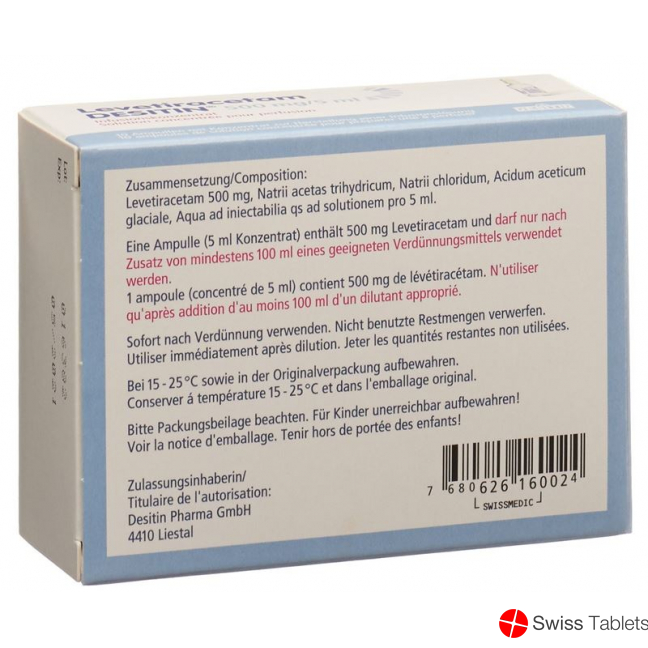
 Deutsch
Deutsch French
French







