Levetiracetam DESITIN Lös 100 mg / ml Fl 300 ml
Levetiracetam DESITIN Lös 100 mg/ml Fl 300 ml
-
127.59 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: DESITIN PHARMA GMBH
- Product Code: 5819087
- ATC-code N03AX14
- EAN 7680618480024
Ingredients:
Natriumhydroxid, Methylparaben (E218), Propylparahydroxybenzoat (E216), Aromatica, Acesulfam, Levetiracetam 100 mg , Citronensäure-Monohydrat.

Description
Was ist Levetiracetam DESITIN und wann wird es angewendet?
Levetiracetam DESITIN enthält als Wirkstoff Levetiracetam und wird zur Behandlung der Epilepsie eingesetzt. Es ist ein Arzneimittel, welches epileptische Anfälle verhindert oder abschwächt (Antiepileptikum).
Angewendet wird das Präparat
– allein (Monotherapie) zur Behandlung von partiellen epileptischen Anfällen mit oder ohne sekundäre Generalisierung bei Patienten und Patientinnen ab 16 Jahren oder
– in Kombination mit anderen Arzneimitteln zur Behandlung von
– partiellen epileptischen Anfällen mit oder ohne sekundäre Generalisierung bei Patienten und Patientinnen ab einem Alter von 1 Monat
– myoklonischen Anfällen bei Patienten und Patientinnen ab 12 Jahren mit juveniler myoklonischer Epilepsie,
– primär generalisierten tonisch-klonischen Anfällen (bei idiopathischer generalisierter Epilepsie) bei Patienten und Patientinnen ab 12 Jahren.
Levetiracetam DESITIN darf nur auf Verschreibung des Arztes oder der Ärztin verwendet werden.
Wann darf Levetiracetam DESITIN nicht angewendet werden?
Levetiracetam DESITIN darf nicht eingenommen werden, wenn Sie gegenüber dem Wirkstoff (Levetiracetam) oder einem der anderen Bestandteile von Levetiracetam DESITIN überempfindlich (allergisch) reagieren.
Wann ist bei der Einnahme von Levetiracetam DESITIN Vorsicht geboten?
Kontaktieren Sie umgehend Ihren Arzt bzw. Ihre Ärztin, wenn Sie eine Verschlechterung der Stimmungslage, inklusive gereizter, feindseliger Stimmung, Symptome einer Depression und/oder lebensmüde Gedanken bemerken.
Beenden Sie die Behandlung mit Levetiracetam DESITIN nie abrupt, ohne Ihren Arzt bzw. Ihre Ärztin zu konsultieren. Befolgen Sie bei Therapieabbruch die Anweisungen Ihres Arztes bzw. Ihrer Ärztin zum schrittweisen Absetzen von Levetiracetam DESITIN.
Levetiracetam DESITIN Lösung enthält die Konservierungsstoffe Parahydroxybenzoate (Methylparaben (E 218), Propylparaben (E216)), welche allergische Reaktionen hervorrufen können (möglicherweise verzögert).
Wechselwirkungen von Levetiracetam DESITIN mit anderen Arzneimitteln sind eher unwahrscheinlich. Teilen Sie dennoch Ihrem Arzt bzw. Ihrer Ärztin mit, wenn Sie noch andere Arzneimittel anwenden.
Dieses Arzneimittel kann zu unerwünschten Wirkungen wie Benommenheit oder Schläfrigkeit führen und somit die Reaktionsfähigkeit, die Fähigkeit Werkzeuge oder Maschinen zu bedienen und die Fahrtüchtigkeit beeinträchtigen!
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie an anderen Krankheiten leiden, Allergien haben oder andere Arzneimittel (auch selbst gekaufte!) einnehmen oder äusserlich anwenden!
Darf Levetiracetam DESITIN während der Schwangerschaft oder in der Stillzeit eingenommen werden?
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Einnahme dieses Arzneimittels Ihren Arzt oder Ihre Ärztin um Rat. Sie sollten die Behandlung mit Levetiracetam DESITIN nicht abbrechen, ohne vorherige Besprechung mit Ihrem Arzt oder Ihrer Ärztin. Für die Dauer der Behandlung wird eine sichere Methode der Empfängnisverhütung empfohlen.
Ein Risiko von Geburtsfehlern für Ihr ungeborenes Kind kann nicht vollständig ausgeschlossen werden.
Das Stillen wird während der Behandlung nicht empfohlen.
Wie verwenden Sie Levetiracetam DESITIN?
Nehmen Sie dieses Arzneimittel immer genau nach Anordnung Ihres Arztes oder Ihrer Ärztin ein. Levetiracetam hat einen bitteren Geschmack, der nach der oralen Einnahme wahrgenommen werden kann.
Die Dosis wird speziell an das Ausmass Ihrer Erkrankung angepasst und beträgt für Erwachsene und Kinder ab 12 Jahren (ab 40 kg) in der Regel 500 mg zweimal täglich.
Je nach Ansprechen auf die Behandlung und die Verträglichkeit kann Ihr Arzt bzw. Ihre Ärztin die Dosis bis auf zweimal täglich 1500 mg erhöhen. Bei Säuglingen und Kleinkindern von 6 bis 23 Monaten und bei Kindern von 2 bis 11 Jahren (unter 40 kg) beträgt die Dosis 10 bis 30 mg/kg zweimal täglich. Die Behandlung bei Kindern sollte vorzugsweise mit Levetiracetam DESITIN Lösung begonnen werden.
Die genaue Menge der Lösung zum Einnehmen sollte
−bei einer Dosis bis zu 2,5 ml (entspricht bis zu 250 mg) mittels der 1 ml Dosierspritze, die in 0,05 ml-Schritten unterteilt ist, oder
−bei einer Dosis grösser als 2,5 ml (entspricht mehr als 250 mg) mittels der 10 ml Dosierspritze, die in 0,25 ml-Schritten unterteilt ist, verabreicht werden.
Körpergewicht | Anfangsdosis: 0,1 ml/kg 2-mal täglich | Höchstdosis: 0,3 ml/kg 2-mal täglich |
6 kg | 0,6 ml 2-mal täglich | 1,8 ml 2-mal täglich |
8 kg | 0,8 ml 2-mal täglich | 2,4 ml 2-mal täglich |
10 kg | 1 ml 2-mal täglich | 3 ml 2-mal täglich |
15 kg | 1,5 ml 2-mal täglich | 4,5 ml 2-mal täglich |
20 kg | 2 ml 2-mal täglich | 6 ml 2-mal täglich |
25 kg | 2,5 ml 2-mal täglich | 7,5 ml 2-mal täglich |
Ab 40 kg | 5 ml 2-mal täglich | 15 ml 2-mal täglich |
Bei voll ausgetragenen Säuglingen von 1 Monat bis unter 6 Monate beträgt die Dosis 7 bis 21 mg/kg zweimal täglich. Levetiracetam DESITIN Lösung zum Einnehmen ist die für Säuglinge am besten geeignete Darreichungsform. Die genaue Menge der Lösung zum Einnehmen sollte mittels der 1 ml Dosierspritze, die in 0,05 ml-Schritten unterteilt ist, verabreicht werden.
Körpergewicht | Anfangsdosis: 0,07 ml/kg 2-mal täglich | Höchstdosis: 0,21 ml/kg 2-mal täglich |
4 kg | 0,3 ml 2-mal täglich | 0,85 ml 2-mal täglich |
5 kg | 0,35 ml 2-mal täglich | 1,05 ml 2-mal täglich |
6 kg | 0,45 ml 2-mal täglich | 1,25 ml 2-mal täglich |
7 kg | 0,5 ml 2-mal täglich | 1,5 ml 2-mal täglich |
Die Mini-Filmtabletten und die Lösung sollen zweimal täglich, morgens und abends, ungefähr zur gleichen Uhrzeit eingenommen werden.
Die Mini-Filmtabletten werden unzerkaut zusammen mit einer ausreichenden Menge Flüssigkeit (z.B. mit einem Glas Wasser) geschluckt.
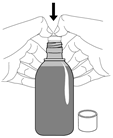
Die Lösung kann unverdünnt oder mit einem Glas Wasser verdünnt eingenommen werden. Anleitung zur Benutzung der Dosierspritze: siehe Abbildung weiter unten. Levetiracetam DESITIN kann unabhängig von einer Mahlzeit eingenommen werden.
Bei älteren Patienten und Patientinnen sowie bei Patienten und Patientinnen mit Nieren- und/oder Leberbeschwerden wird die Arzneimitteldosis möglicherweise speziell angepasst.
Benachrichtigen Sie bitte Ihren Arzt bzw. Ihre Ärztin, falls Sie eine oder mehrere Einnahmen vergessen haben. Nehmen Sie keine doppelte Dosis ein, um vergessene Einzeldosen nachzuholen. Benachrichtigen Sie bitte ebenfalls Ihren Arzt bzw. Ihre Ärztin, falls Sie mehr Mini-Filmtabletten oder mehr Lösung als vorgeschrieben eingenommen haben.
Levetiracetam DESITIN ist zur Langzeitbehandlung vorgesehen. Befolgen Sie unbedingt die Anweisungen Ihres Arztes bzw. Ihrer Ärztin, und setzen Sie die Behandlung keinesfalls ohne Rücksprache mit Ihrem Arzt bzw. Ihrer Ärztin ab. Genauso wie andere antiepileptische Arzneimittel sollte Levetiracetam DESITIN schrittweise abgesetzt werden, um häufigere Anfälle zu vermeiden.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Für die Einnahme der Levetiracetam DESITIN Minipacks beachten Sie bitte folgende Hinweise:
| 1. Beutel oberhalb der Markierung (Pfeil) anfassen und den Inhalt nach unten schütteln. |
| 2. An der Markierung (Pfeil) den oberen Teil der Packung abreissen oder abschneiden. |
| 3. Den Inhalt direkt in den Mund entleeren, unzerkaut mit etwas Flüssigkeit schlucken und nachtrinken. |
Hinweis: Die Mini-Filmtabletten sind nach Suspendieren in Wasser sondengängig. Bei dieser Form der Einnahme ist die Suspension unmittelbar vor der Verabreichung herzustellen.
Benutzung der Dosierspritze von Levetiracetam DESITIN Lösung
Bitte lesen Sie diese Anweisungen sorgfältig, damit Sie wissen, wie dieses Arzneimittel anzuwenden ist.
Wie das Arzneimittel-Set angewendet wird
Das Arzneimittel-Set besteht aus fünf Teilen: | |
| 1. Zwei Spritzenadapter, einer passend für die 1 ml Dosierspritze und einer passend für die 10-ml-Dosierspritze. Den entsprechenden Spritzenadapter müssen Sie fest in die Flaschenöffnung eindrücken. Der Adapter verbleibt immer in der Flasche. |
| 2. Eine Flasche mit kindersicherem Verschluss mit 300 ml des Arzneimittels. Nach Gebrauch immer die Flasche zuschrauben. |
| 3. Eine 1 ml Dosierspritze für Dosierungen bis zu 250 mg (entspricht bis zu 2,5 ml) und eine 10-ml-Dosierspritze für Dosierungen grösser 250 mg (entspricht mehr als 2,5 ml). Diese passen in den entsprechenden Kunststoffadapter. Mit der entsprechenden Dosierspritze entnehmen Sie die verschriebene Menge Lösung aus der Flasche. |
Wie der Kunststoffadapter und die neue Flasche für den ersten Gebrauch vorbereitet werden
1. Entfernen Sie den kindersicheren Verschluss, indem Sie ihn fest herunterdrücken und gegen den Uhrzeigersinn drehen (wie auf dem Verschluss dargestellt). Anmerkung: Behalten Sie den Verschluss in der Nähe, um die Flasche nach der Anwendung wieder zu schliessen. | |
| 2. Stellen Sie die offene Flasche aufrecht auf einen Tisch. Drücken Sie den Plastikadapter so weit wie möglich fest in den Flaschenhals. Anmerkung: Der Adapter lässt sich möglicherweise nicht vollständig hineindrücken, wird jedoch in die Flasche gedrückt, wenn Sie den Verschluss wieder aufschrauben. Bitte befolgen Sie nun die Anweisungen im Abschnitt „Entnahme einer Arzneimitteldosis“. |
Entnahme einer Arzneimitteldosis
Das Arzneimittel kann direkt aus der Dosierspritze eingenommen oder in einem Glas mit etwas Wasser vermischt werden. | |
1. Drücken und drehen Sie den kindersicheren Verschluss, um die Flasche zu öffnen. (Verschluss nach Anwendung immer zuschrauben.) | |
| 2. Prüfen Sie, ob der Kolben in der Dosierspritze ganz hinuntergedrückt ist. 3. Halten Sie die Flasche senkrecht und drücken Sie die Dosierspritze mit ihrer Spitze fest in die Öffnung des Kunststoffadapters. |
| 4. Halten Sie die Flasche senkrecht und drehen Sie die Flasche vorsichtig um. 5. Ziehen Sie den Kolben langsam herunter, so dass sich die Dosierspritze mit dem Arzneimittel füllt. Drücken Sie den Kolben vollständig zurück, um möglicherweise in der Dosierspritze befindliche grosse Luftblasen zu entfernen. |
| 6. Entnehmen Sie die verschriebene Dosis: Ziehen Sie den Spritzenkolben langsam herunter, bis sich der Beginn des dickeren Teils des Kolbens genau mit der Markierung für Ihre verschriebene Dosis (in ml) deckt. Anmerkung: −Wenn Ihnen eine Dosis von mehr als 1 ml und bis zu 2,5 ml verschrieben wurde, entnehmen Sie die verschriebene Dosis in mehreren Schritten. Füllen Sie die 1 ml Dosierspritze zunächst bis zur 1-ml-Marke und nehmen Sie 1 ml ein; wiederholen Sie diesen Schritt gegebenenfalls (wenn die verschriebene Dosis mehr als 2 ml beträgt). Füllen Sie anschliessend die Dosierspritze neu bis zur erforderlichen Menge und nehmen Sie den Rest ein. −Wenn Ihnen eine Dosis von mehr als 10 ml verschrieben wurde, entnehmen Sie die verschriebene Dosis in zwei Schritten. Füllen Sie die 10 ml Dosierspritze zunächst bis zur 10-ml-Marke und nehmen Sie die 10 ml ein. Füllen Sie anschliessend die Dosierspritze neu bis zur erforderlichen Menge und nehmen Sie den Rest ein. Fragen Sie Ihren Apotheker oder Ihre Apothekerin, wenn Sie sich nicht ganz sicher sind. |
| 7. Drehen Sie die Flasche vorsichtig wieder um. Drehen Sie die Dosierspritze sanft aus dem Adapter heraus. |
| 8. Die Arzneimitteldosis kann direkt aus der Dosierspritze eingenommen werden. Der Patient muss dabei aufrecht sitzen und der Kolben muss langsam heruntergedrückt werden, um das Schlucken zu ermöglichen. Alternativ hierzu kann die Dosis unmittelbar vor der Einnahme in einem Glas mit etwas Wasser gemischt werden. Rühren Sie um und trinken Sie die Mischung in einem Zug. 9. Schrauben Sie den kindersicheren Verschluss nach Gebrauch wieder auf die Flasche. Der Adapter bleibt dabei auf der Flasche. 10. Reinigung: Wischen Sie nach Gebrauch die Aussenseite der Dosierspritze mit einem sauberen, trockenen Tuch ab. |
Welche Nebenwirkungen kann Levetiracetam DESITIN haben?
Folgende Nebenwirkungen können bei der Einnahme von Levetiracetam DESITIN auftreten:
Am häufigsten sind Entzündungen des Nasen-Rachen-Raumes, Schläfrigkeit und Kopfschmerzen.
Andere, unter der Behandlung mit Levetiracetam berichtete Nebenwirkungen sind:
Infektionen
Entzündungen des Nasen-Rachen-Raumes, Infektion.
Blutsystem
Verminderte Anzahl der roten Blutkörperchen, der weissen Blutkörperchen und/oder der Blutplättchen.
Immunsytem
(Schwerwiegende) Überempfindlichkeitsreaktionen (mit z.B. Fieber, Lymphknotenschwellung, Gesichtsschwellung) mit Hautausschlag; schwerwiegende allergische (anaphylaktische) Reaktionen mit z.B. Schwäche, Benommenheit oder Schwindel, oder Schwierigkeiten zu atmen.
Ernährungsstörungen
Appetitlosigkeit, Gewichtszunahme, Gewichtsverlust, zu niedriger Natriumspiegel im Blut (Hyponatriämie).
Nervensystem/psychische Störungen
Benommenheit, Krämpfe, Kopfschmerzen, mangelnde Koordination der Bewegungen, Schläfrigkeit, Zittern, Hyperaktivität, Agitation, Gleichgewichtsstörungen, Aufmerksamkeitsstörungen, Beeinträchtigung des Gedächtnisses, anormales Verhalten, Persönlichkeitsveränderungen, Aggression, Wut, Panikattacke, Angst, Verwirrtheit, Depression, lebensmüde Gedanken, selbstverletzendes Verhalten, Suizid (Selbstmord), Delirium, Stimmungsschwankungen, Halluzination, Feindseligkeit, Schlaflosigkeit, Reizbarkeit, Nervosität, anormales Denken, Konzentrationsschwierigkeiten, psychotische Störungen und Missempfindung (z.B. Kribbeln oder Taubheit), unwillkürliche langsame Bewegungen und Störungen des Bewegungsablaufes, Gehstörungen.
Augen
Doppeltsehen, verschwommenes Sehen.
Ohr
Schwindel.
Atemapparat
Vermehrter Husten.
Verdauungssystem
Bauchschmerzen, Übelkeit, Verdauungsstörungen, Durchfall, Erbrechen, Bauchspeicheldrüsen-Entzündung.
Leber
Hepatitis (Leberentzündung), Leberversagen.
Nieren und Harnwege
Akute Nierenschädigung
Haut
Hautausschlag, Ekzem, Juckreiz, Haarausfall, schwere Hautreaktionen (Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse, Erythema multiforme) mit Blasenbildung und Abschälen der Haut, besonders um Mund, Nase, Augen und Genitalien; Angioödem (Schwellung der Haut, Schleimhäute und umgebende Gewebe, z.B. von Gesicht, Lippen, Zunge und Rachen).
Skelettmuskulatur
Muskelschmerzen, Muskelschwäche, Rhabdomyolyse (Abbau von Muskelgewebe).
Allgemeine Störungen
Kraftlosigkeit, Müdigkeit, zufällige Verletzungen.
Einige der erwähnten Nebenwirkungen wie z.B. Schläfrigkeit, Schwächegefühl und Benommenheit können zu Behandlungsbeginn oder bei einer Dosissteigerung häufiger auftreten.
Falls Sie der Meinung sind, dass Sie von einer dieser Nebenwirkungen betroffen sind, sollten Sie Levetiracetam DESITIN weiterhin einnehmen, aber sofort Ihren Arzt bzw. Ihre Ärztin informieren.
Wenn Sie Nebenwirkungen bemerken, die hier nicht beschrieben sind, sollten Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin informieren.
Was ist ferner zu beachten?
Mini-Filmtabletten
Bewahren Sie das Arzneimittel ausserhalb der Reichweite von Kindern bei 15-30 °C sowie in der Originalverpackung auf.
Lösung
Bewahren Sie das Arzneimittel ausserhalb der Reichweite von Kindern bei 15–30 °C sowie in der Originalverpackung auf. Nach Anbruch der Lösung innerhalb von 4 Monaten aufbrauchen.
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «Verwendbar bis» bezeichneten Datum verwendet werden.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Levetiracetam DESITIN enthalten?
Mini-Filmtabletten
1 Minipack mit Mini-Filmtabletten enthält 250 mg oder 500 mg oder 1000 mg Wirkstoff Levetiracetam sowie Hilfsstoffe: Povidon K30, Mikrokristalline Cellulose, Hochdisperses Siliciumdioxid, Magnesiumstearat [pflanzlich], Poly(vinylalkohol), Titandioxid (E 171), Macrogol 3350, Talkum
Lösung
1 ml Lösung enthält 100 mg Levetiracetam als Wirkstoff und Hilfsstoffe: , Citronensäure-Monohydrat, Natriumhydroxid, gereinigtes Wasser, Acesulfam-Kalium (E950), Trauben-Aroma , Konservierungsstoffe: Methyl-4-hydroxybenzoat (E218), Propyl-4-hydroxybenzoat (E216)
Zulassungsnummer
62069
61848
(Swissmedic).
Wo erhalten Sie Levetiracetam DESITIN? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Levetiracetam DESITIN 250 mg: Packungen zu 30 Minipacks
Levetiracetam DESITIN 500 mg: Packungen zu 20, 100 und 200 Minipacks
Levetiracetam DESITIN 1000 mg: Packungen zu 30, 100 und 200 Minipacks
Levetiracetam DESITIN Lösung 100 mg/ml: Flasche zu 300 ml (mit 2 verschiedenen Dosierspritzen à 1 ml und à 10 ml sowie 2 Adaptern)
Zulassungsinhaberin
Desitin Pharma GmbH, 4410 Liestal
Diese Packungsbeilage wurde im Dezember 2018 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu’est-ce que Levetiracetam DESITIN et quand doit-il être utilisé?
Levetiracetam DESITIN, qui contient comme principe actif le lévétiracétam, est utilisé dans le traitement de l'épilepsie. C'est un médicament qui prévient ou atténue les crises épileptiques (antiépileptique).
Le médicament est utilisé
−seul (monothérapie) dans le traitement des crises épileptiques partielles avec ou sans généralisation secondaire chez les patients dès 16 ans, ou
−en association avec d'autres médicaments pour traiter
−des crises épileptiques partielles avec ou sans généralisation secondaire chez les patients à partir d'un âge de 1 mois.
−des crises myocloniques chez les patients à partir de 12 ans présentant une épilepsie juvénile myoclonique.
−des crises généralisées tonico-cloniques primaires de l'adulte et de l'adolescent à partir de 12 ans présentant une épilepsie généralisée idiopathique.
Levetiracetam DESITIN ne doit être utilisé que sur prescription du médecin.
Quand Levetiracetam DESITIN ne doit-il pas être utilisé?
Levetiracetam DESITIN ne doit pas être utilisé si vous êtes hypersensible (allergique) au principe actif (lévétiracétam) ou à l'un des autres composants de Levetiracetam DESITIN.
Quelles sont les précautions à observer lors de la prise de Levetiracetam DESITIN?
Veuillez immédiatement contacter votre médecin si vous observez une détérioration de l'humeur, y compris une humeur irritable, hostile, des symptômes dépressifs et/ou des pensées de lassitude de vivre.
N'arrêtez jamais brusquement le traitement par Levetiracetam DESITIN sans consulter votre médecin. Si le traitement doit être interrompu, suivez les instructions de votre médecin concernant l'arrêt progressif de Levetiracetam DESITIN.
Levetiracetam DESITIN solution contient des agents conservateurs parahydroxybenzoates (méthylparabène (E 218), propylparabène (E 216)) qui peuvent entraîner des réactions allergiques (pouvant être retardées).
Des interactions de Levetiracetam DESITIN avec d'autres médicaments sont peu probables. Veuillez toutefois informer votre médecin si vous prenez déjà d'autres médicaments.
Ce médicament peut entraîner des effets indésirables tels que des étourdissements ou de la somnolence et peut, par conséquent, affecter les réactions, l'aptitude à conduire et l'aptitude à utiliser des outils et des machines!
Veuillez informer votre médecin ou votre pharmacien si vous souffrez d'une autre maladie, vous êtes allergique, vous prenez déjà d'autres médicaments en usage interne ou externe (même en automédication!).
Levetiracetam DESITIN peut-il être pris pendant la grossesse ou l’allaitement?
Si vous êtes enceinte ou si vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.. Vous ne devez pas arrêter le traitement par Levetiracetam DESITIN sans consulter au préalable votre médecin. Une méthode de contraception sûre est recommandée pendant toute la durée du traitement.
Un risque de malformations congénitales pour votre enfant à naître ne peut pas être complètement exclu.
L'allaitement n'est pas recommandé pendant le traitement.
Comment utiliser Levetiracetam DESITIN?
Prenez toujours ce médicament en suivant exactement les instructions de votre médecin. Le lévétiracétam a un goût amer qui peut être perçu après la prise orale.
Le dosage s'ajuste spécialement à la gravité de votre affection. Chez les adultes et les enfants à partir de 12 ans (à partir de 40 kg), il est habituellement de 500 mg deux fois par jour. Suivant la réponse au traitement et la tolérance, votre médecin peut l'augmenter jusqu'à 1500 mg deux fois par jour. Chez les nourrissons et les enfants en bas âge de 6 à 23 mois, ainsi que chez les enfants âgés de 2 à 11 ans (moins de 40 kg), le dosage est de 10 à 30 mg/kg 2 fois par jour. Chez les enfants, le traitement devrait être commencé de préférence par Levetiracetam DESITIN solution.
La quantité exacte de solution buvable doit être administrée
−avec la seringue doseuse de 1 ml graduée tous les 0,05 ml pour une dose allant jusqu'à 2,5 ml (correspondant à jusqu'à 250 mg) ou
−avec la seringue doseuse de 10 ml graduée tous les 0,25 ml pour une dose supérieure à 2,5 ml (correspondant à plus de 250 mg).
Poids corporel | Dose initiale: 0,1 ml/kg 2 fois par jour | Dose maximale: 0,3 ml/kg 2 fois par jour |
6 kg | 0,6 ml 2 fois par jour | 1,8 ml 2 fois par jour |
8 kg | 0,8 ml 2 fois par jour | 2,4 ml 2 fois par jour |
10 kg | 1 ml 2 fois par jour | 3 ml 2 fois par jour |
15 kg | 1,5 ml 2 fois par jour | 4,5 ml 2 fois par jour |
20 kg | 2 ml 2 fois par jour | 6 ml 2 fois par jour |
25 kg | 2,5 ml 2 fois par jour | 7,5 ml 2 fois par jour |
À partir de 40 kg | 5 ml 2 fois par jour | 15 ml 2 fois par jour |
Chez les nourrissons nés à terme âgés de 1 mois à moins de 6 mois, la dose est de 7 à 21 mg/kg deux fois par jour. Levetiracetam DESITIN solution buvable est la forme galénique la mieux adaptée aux nourrissons. La quantité exacte de solution buvable doit être administrée avec la seringue doseuse de 1 ml graduée tous les 0,05 ml.
Poids corporel | Dose initiale: 0,07 ml/kg 2 fois par jour | Dose maximale: 0,21 ml/kg 2 fois par jour |
4 kg | 0,3 ml 2 fois par jour | 0,85 ml 2 fois par jour |
5 kg | 0,35 ml 2 fois par jour | 1,05 ml 2 fois par jour |
6 kg | 0,45 ml 2 fois par jour | 1,25 ml 2 fois par jour |
7 kg | 0,5 ml 2 fois par jour | 1,5 ml 2 fois par jour |
Les mini-comprimés pelliculés et la solution doivent être pris deux fois par jour, matin et soir, à peu près à la même heure.
Les mini-comprimés pelliculés sont avalés sans être mâchés avec une quantité de liquide suffisante (par exemple avec un verre d'eau).
La solution peut être avalée non diluée ou diluée dans un verre d'eau. Pour l'utilisation de la seringue doseuse, voir l'illustration plus bas. Levetiracetam DESITIN peut être pris indépendamment des repas.
Chez les patients âgés ainsi que chez les patients atteints d'une affection des reins et/ou du foie, il est possible que la dose médicamenteuse doive être spécialement adaptée.
Veuillez informer votre médecin si vous avez oublié une ou plusieurs fois de prendre le médicament. Ne doublez pas la dose pour compenser un oubli. Veuillez aussi informer votre médecin si vous avez pris davantage de mini-comprimés pelliculés ou de solution que prescrit.
Levetiracetam DESITIN est prévu pour un traitement à long terme. Suivez scrupuleusement les instructions de votre médecin et n'arrêtez en aucun cas le traitement sans l'avoir consulté. Tout comme d'autres médicaments antiépileptiques, Levetiracetam DESITIN doit être arrêté progressivement pour éviter une augmentation de la fréquence des crises.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Veuillez respecter les conseils suivants pour prendre les minipacks Levetiracetam DESITIN:
| 1.Prendre le sachet au-dessus du marquage (flèche) et agiter le contenu vers le bas. |
| 2.Déchirer ou couper le sachet au niveau du marquage (flèche). |
| 3.Vider le contenu directement dans la bouche, avaler les mini-comprimés entiers avec un peu d'eau, et boire à nouveau. |
Remarque: Les mini-comprimés pelliculés peuvent être administrés par une sonde, après avoir été mis en suspension dans l'eau. Dans ce cas, la suspension doit être préparée immédiatement avant l'administration.
Utilisation de la seringue doseuse de Levetiracetam DESITIN solution
Veuillez lire attentivement ces indications afin de savoir comment utiliser ce médicament.
Utilisation du set de médicaments
1. Le set de médicaments se compose de cinq parties: | |
| Deux adaptateurs à seringue, l'un pour la seringue doseuse de 1 ml et l'autre pour la seringue doseuse de 10 ml. L'adaptateur à seringue correspondant doit être fermement inséré dans l'ouverture du flacon. L'adaptateur reste toujours dans le flacon. |
| 2. Un flacon fermé par un bouchon avec une sécurité enfant et contenant 300 ml du médicament. Toujours refermer le flacon après utilisation. |
| 3. Une seringue doseuse de 1 ml pour des dosages allant jusqu'à 250 mg (correspondant à jusqu'à 2,5 ml) et une seringue doseuse de 10 ml pour des dosages de plus de 250 mg (correspondant à plus de 2,5 ml) qui s'adaptent dans l'adaptateur à seringue en plastique correspondant. Prélevez à l'aide de la seringue doseuse correspondante la quantité de solution prescrite du flacon. |
Préparation de l'adaptateur à seringue en plastique et du flacon neuf à la première utilisation
1. Retirez le bouchon avec la sécurité enfant en le pressant fermement vers le bas et en le tournant dans le sens inverse des aiguilles d'une montre (tel que représenté sur le bouchon). Remarque: Gardez le bouchon à proximité afin de pouvoir refermer le flacon après utilisation. | |
| 2. Posez le flacon ouvert verticalement sur une table. Pressez l'adaptateur en plastique autant que possible fermement dans le col de la bouteille. Remarque: l'adaptateur ne pourra certainement pas être pressé complètement à l'intérieur mais sera néanmoins poussé dans le flacon lorsque vous le rouvrirez. Veuillez suivre à présent les indications du paragraphe «Prise d'une dose médicamenteuse». |
Prise d'une dose médicamenteuse
Le médicament peut être avalé directement à partir de la seringue doseuse ou dissous dans un verre d'eau. | |
1. Pressez et tournez le bouchon avec la sécurité enfant afin d'ouvrir le flacon. (Toujours refermer le flacon après utilisation.) | |
| 2. Vérifiez que le piston est inséré jusqu'au fond du tube de la seringue. 3. Maintenez le flacon en position verticale et insérez fermement la pointe de la seringue doseuse dans l'ouverture de l'adaptateur en plastique. |
| 4. Maintenez le flacon en position verticale et retournez-le avec précaution. 5. Faites coulisser lentement le piston vers le bas afin que la seringue se remplisse du médicament. Poussez à nouveau le piston jusqu'au fond du tube afin d'éliminer d'éventuelles grosses bulles d'air qui s'y trouveraient. |
| 6. Prélevez la dose prescrite: faites coulisser lentement le piston de la seringue vers le bas jusqu'à ce que le début de la partie épaisse du piston se trouve à la hauteur de la graduation correspondant à la dose qui vous a été prescrite (en ml). Remarque: -Si une dose supérieure à 1 ml et jusqu'à 2,5 ml vous a été prescrite, vous devrez la prélever en plusieurs fois. Remplissez d'abord la seringue doseuse de 1 ml jusqu'à la graduation de 1 ml puis avalez cette dose de 1 ml; le cas échéant, recommencez cette étape (si la dose prescrite est supérieure à 2 ml). Remplissez ensuite la seringue doseuse à nouveau jusqu'à la quantité nécessaire et avalez le reste. -Si une dose supérieure à 10 ml vous a été prescrite, vous devrez la prélever en deux fois. Remplissez d'abord la seringue doseuse de 10 ml jusqu'à la graduation des 10 ml puis avalez ces 10 ml. Remplissez ensuite la seringue à nouveau jusqu'à la quantité nécessaire et avalez le reste. Si vous n'êtes pas entièrement sûr(e), demandez à votre pharmacien. |
| 7. Retournez à nouveau le flacon avec précaution. Retirez doucement la seringue doseuse de l'adaptateur. |
| 8. La dose médicamenteuse peut être avalée directement à partir de la seringue doseuse. Le patient doit être en position assise et le piston doit être poussé lentement vers le bas afin de permettre au patient d'avaler. La dose peut également être dissoute dans un verre d'eau immédiatement avant d'être avalée. Remuez puis avalez la solution d'un trait. 9. Revissez le bouchon avec la sécurité enfant sur le flacon après utilisation. L'adaptateur reste en place sur le flacon. 10. Nettoyage: après utilisation, essuyez le côté extérieur de la seringue doseuse à l'aide d'un morceau de tissu propre et sec. |
Quels effets secondaires Levetiracetam DESITIN peut-il provoquer?
La prise de Levetiracetam DESITIN peut provoquer les effets secondaires suivants:
Les plus fréquents sont les inflammations de la gorge et du nez, la somnolence et les maux de tête.
D'autres effets secondaires rapportés sous traitement par lévétiracétam sont:
Infections
Inflammations de la gorge et du nez, infections
Système sanguin
Diminution du nombre des globules rouges, des globules blancs et/ou des plaquettes sanguines.
Système immunitaire
Réactions d'hypersensibilité (graves) (s'accompagnant, par exemple, de la fièvre, d'un gonflement des ganglions lymphatiques, d'un gonflement du visage) avec éruption cutanée; réactions allergiques (anaphylactiques) graves (avec par exemple, faiblesse, étourdissement ou vertiges ou difficultés à respirer).
Troubles de la nutrition
Manque d'appétit, prise de poids, perte de poids, pour diminuer le taux de sodium dans le sang (hyponatrémie).
Système nerveux/troubles psychiques
Étourdissement, crampes, maux de tête, mauvaise coordination des mouvements, tremblements, envie de dormir, hyperactivité, agitation, troubles de l'équilibre, troubles de l'attention, troubles de la mémoire, comportement anormal, modifications de la personnalité, agressivité, colère, accès de panique, anxiété, confusion, dépression, lassitude de vivre, comportement d'automutilation, suicide, délires, instabilités d'humeur, hallucinations, hostilité, insomnie, irritabilité, nervosité, pensées anormales, difficultés de concentration, troubles psychotiques et anomalies de la perception (p.ex. fourmillements ou sensation d'insensibilité), mouvements lents involontaires ou troubles des mouvements, troubles de la marche.
Yeux
Vision double, vision floue.
Oreille
Vertiges.
Appareil respiratoire
Toux augmentée.
Système digestif
Maux de ventre, nausée, troubles digestifs, diarrhée, vomissements, inflammation du pancréas.
Foie
Hépatite (inflammation du foie), insuffisance hépatique.
Reins et voies urinaires
Insuffisance rénale aiguë.
Peau
Éruptions cutanées, eczéma, démangeaisons, chute de cheveux, réactions cutanées sévères (syndrome de Stevens-Johnson, nécrolyse épidermique toxique, érythème polymorphe) avec formation de cloques et desquamation de la peau, en particulier autour de la bouche, du nez, des yeux et des parties génitales, angioedème (gonflement de la peau, des muqueuses et des tissus environnants, tels que le visage, les lèvres, la langue et la gorge).
Muscles squelettiques
Douleurs musculaires, faiblesse musculaire, rhabdomyolyse (dégradation du tissu musculaire).
Troubles généraux
Faiblesse, fatigue, blessures accidentelles.
Certains des effets secondaires mentionnés, comme par exemple la somnolence, la sensation de faiblesse et l'étourdissement, peuvent survenir plus fréquemment en début de traitement ou après une augmentation de dose.
Si vous estimez présenter l'un de ces effets secondaires, vous devez continuer à prendre Levetiracetam DESITIN, mais immédiatement en informer votre médecin.
Si vous remarquez des effets secondaires qui ne sont pas décrits dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
À quoi faut-il encore faire attention?
Mini-comprimés
Conservez le médicament hors de portée des enfants, à température ambiante (15–30 °C) dans l'emballage original.
Solution
Conservez le médicament hors de portée des enfants, à température ambiante (15–30 °C) dans l'emballage original. A utiliser dans les 4 mois après l'ouverture de la solution.
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «À utiliser jusqu'au» sur le récipient.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Levetiracetam DESITIN?
Mini-comprimés
1 minipack de mini-comprimés pelliculés contient comme principe actif 250 mg ou 500 mg ou 1000 mg de lévétiracétam, ainsi que des excipients: povidone K30, cellulose microcristalline, silice colloïdale anhydre, stéarate de magnésium [d'origine végétale], polyalcool vinylique, dioxyde de titane (E 171), macrogol 3350, talc
Solution
1 ml de solution contient comme principe actif 100 mg de lévétiracétam, ainsi que des excipients: acide citrique monohydraté, hydroxyde de sodium, eau purifiée, acésulfame potassique (E950), arômes de raisins, conservateurs: parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyl (E216)
Numéro d’autorisation
62069
61848
(Swissmedic).
Où obtenez-vous Levetiracetam DESITIN? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Levetiracetam DESITIN 250 mg: emballages de 30 minipacks
Levetiracetam DESITIN 500 mg: emballages de 20, 100 et 200 minipacks
Levetiracetam DESITIN 1000 mg: emballages de 30, 100 et 200 minipacks
Levetiracetam DESITIN Solution 100 mg/ml: flacon de 300 ml (avec 2 seringues doseuses différentes de 1 ml et de 10 ml, ainsi que 2 adaptateurs)
Titulaire de l’autorisation
Desitin Pharma Sàrl, 4410 Liestal
Cette notice d'emballage a été vérifiée pour la dernière fois en décembre 2018 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos’è Levetiracetam DESITIN e quando si usa?
Levetiracetam DESITIN contiene levetiracetam quale principio attivo ed è impiegato per il trattamento dell'epilessia. È un medicamento che impedisce gli attacchi epilettici o ne diminuisce l'intensità (medicamento antiepilettico).
Il preparato si usa
– da solo (monoterapia) per il trattamento di attacchi epilettici parziali, con o senza generalizzazione secondaria, in pazienti dai 16 anni, oppure
– in combinazione con altri medicamenti per il trattamento di
- attacchi epilettici parziali, con o senza generalizzazione secondaria, in pazienti a partire dall'età di 1 mese
- crisi miocloniche in pazienti a partire dai 12 anni con epilessia mioclonica giovanile
- crisi tonico-cloniche primarie generalizzate (nell'epilessia idiopatica generalizzata) in pazienti a partire dai 12 anni.
Levetiracetam DESITIN può essere usato solo su prescrizione medica.
Quando non si può assumere Levetiracetam DESITIN?
Non può assumere Levetiracetam DESITIN se reagisce con ipersensibilità (reazione allergica) al principio attivo (levetiracetam) o a una delle altre componenti di Levetiracetam DESITIN.
Quando è richiesta prudenza nella somministrazione di Levetiracetam DESITIN?
Contatti immediatamente il suo medico, se nota un peggioramento del suo stato emozionale, compresi i casi in cui si dovesse sentire teso, d'animo ostile, o se nota sintomi di depressione e/o pensieri pessimistici.
Non interrompa improvvisamente il trattamento con Levetiracetam DESITIN per nessun motivo senza aver consultato il suo medico. Per interrompere la terapia, segua le istruzioni del suo medico riguardo all'interruzione graduale di Levetiracetam DESITIN.
Levetiracetam DESITIN soluzione contiene paraidrossibenzoati come conservanti (metilparaben (E 218), propilparaben (E 216)), che possono scatenare reazioni allergiche (a volte ritardate).
Interazioni di Levetiracetam DESITIN con altri medicamenti sono piuttosto improbabili. Informi comunque il suo medico se fa uso di altri medicamenti.
Questo medicamento può causare effetti indesiderati quali stordimento o sonnolenza, e quindi esso può ridurre la capacità di reazione, la capacità di condurre un veicolo e la capacità di utilizzare attrezzi o macchine!
Informi il suo medico o farmacista nel caso in cui soffra di altre malattie, di allergie o se assume o applica esternamente altri medicamenti (anche se acquistati di sua iniziativa!).
Si può assumere Levetiracetam DESITIN durante la gravidanza o l’allattamento?
Se è incinta o sta allattando, pensa di poter essere incinta o sta pianificando una gravidanza, chieda consiglio al medico o al farmacista prima di prendere questo medicamento.
Non interrompa il trattamento con Levetiracetam DESITIN senza aver prima consultato il suo medico. Durante il trattamento si consiglia un metodo contraccettivo sicuro. Non è possibile escludere completamente il rischio di difetti alla nascita per il feto.
L'allattamento al seno durante il trattamento è sconsigliato.
Come usare Levetiracetam DESITIN?
Assuma questo medicamento sempre esattamente secondo la prescrizione del suo medico. Levetiracetam ha un sapore amero che può essere percepito dopo l'assunione orale.
La dose è adattata individualmente all'intensità della sua malattia; per gli adulti e i bambini dai 12 anni in su (a partire da 40 kg), essa ammonta solitamente a 500 mg due volte al giorno . A seconda della risposta alla terapia e della tollerabilità, il suo medico può aumentare la dose fino a 1500 mg due volte al giorno . Nei lattanti e nei bambini piccoli dai 6 ai 23 mesi e nei bambini dai 24 mesi agli 11 anni (al di sotto di 40 kg) la dose è da 10 a 30 mg/kg due volte al giorno. Nei bambini è consigliabile iniziare il trattamento con Levetiracetam DESITIN soluzione.
L'esatta quantità della soluzione orale dovrà essere somministrata:
-nel caso di una dose fino ai 2,5 ml (equivalente in peso fino a 250 mg) con l'ausilio della siringa dosatrice da 1 ml, suddivisa in tacche da 0,05 ml, oppure
-nel caso di una dose maggiore di 2,5 ml (equivalente in peso a più di 250 mg)
con l'ausilio della siringa dosatrice da 10 ml, suddivisa in tacche da 0,25 ml.
Peso corporeo | Dose iniziale 0,1 ml/kg 2 volte al giorno | Dose massima 0,3 ml/kg 2 volte al giorno |
6 kg | 0,6 ml 2 volte al giorno | 1,8 ml 2 volte al giorno |
8 kg | 0,8 ml 2 volte al giorno | 2,4 ml 2 volte al giorno |
10 kg | 1 ml 2 volte al giorno | 3 ml 2 volte al giorno |
15 kg | 1,5 ml 2 volte al giorno | 4,5 ml 2 volte al giorno |
20 kg | 2 ml 2 volte al giorno | 6 ml 2 volte al giorno |
25 kg | 2,5 ml 2 volte al giorno | 7,5 ml 2 volte al giorno |
A partire dai 40 kg | 5 ml 2 volte al giorno | 15 ml 2 volte al giorno |
Nei lattanti nati a termine dell'età da 1 mese fino a meno di 6 mesi la dose è da 7 a 21 mg/kg, due volte al giorno. Levetiracetam DESITIN soluzione orale è la forma di somministrazione più adatta ai lattanti. L'esatta quantità della soluzione orale dovrà essere somministrata con l'ausilio della siringa dosatrice da 1 ml, suddivisa in tacche da 0,05 ml.
Peso corporeo | Dose iniziale: 0,07 ml/kg 2 volte al giorno | Dose massima: 0,21 ml/kg 2 volte al giorno |
4 kg | 0,3 ml 2 volte al giorno | 0,85 ml 2 volte al giorno |
5 kg | 0,35 ml 2 volte al giorno | 1,05 ml 2 volte al giorno |
6 kg | 0,45 ml 2 volte al giorno | 1,25 ml 2 volte al giorno |
7 kg | 0,5 ml 2 volte al giorno | 1,5 ml 2 volte al giorno |
Le mini-compresse rivestite con film e la soluzione vanno assunte due volte al giorno, al mattino e alla sera, sempre circa alla stessa ora.
Le mini-compresse rivestite con film vanno ingerite senza essere masticate, con una quantità sufficiente di liquido (p.es. con un bicchiere d'acqua).
La soluzione può essere assunta pura o sciolta in un bicchiere d'acqua. Istruzioni per l'uso della siringa dosatrice: vedi immagine più sotto. Levetiracetam DESITIN può essere somministrato indipendentemente dai pasti.
Nei pazienti anziani e nei pazienti con problemi renali e/o epatici, la dose del medicamento può essere adattata individualmente.
Informi il suo medico se ha dimenticato una o più dosi. Non assuma una dose doppia per recuperare una dose singola dimenticata. Informi il suo medico anche nel caso in cui abbia assunto più mini-compresse rivestite con film o soluzione di quanto le sia stato prescritto.
Levetiracetam DESITIN è indicato per terapie a lungo termine. Segua assolutamente le istruzioni del medico e non interrompa la terapia in nessun caso senza averne discusso con il suo medico. Così come per altri medicamenti antiepilettici, anche la terapia con Levetiracetam DESITIN dev'essere interrotta progressivamente per evitare che la frequenza degli attacchi aumenti.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Per l'assunzione di Levetiracetam DESITIN Minipacks, presti attenzione alle seguenti avvertenze:
| 1. Tenere la bustina al di sopra della freccia e scuotere affinché il contenuto si depositi nel fondo. |
| 2. Strappare o tagliare la parte superiore della bustina partendo dalla freccia. |
| 3. Svuotare il contenuto direttamente in bocca, inghiottire, senza masticare, con un po' di liquido e bere nuovamente del liquido. |
Avvertenza: le mini-compresse rivestite con film possono attraversare una sonda dopo essere state sospese in acqua. In questo tipo di assunzione, la sospensione deve essere preparata appena prima della somministrazione.
Come utilizzare la siringa dosatrice di Levetiracetam DESITIN soluzione
Voglia leggere attentamente queste istruzioni per capire bene come va utilizzato questo medicamento.
Come utilizzare il kit medicinale
Il kit medicinale è composto da cinque parti: | |
| 1. Due adattatori per siringa, uno adeguato per la siringa dosatrice da 1 ml e uno adeguato per la siringa dosatrice da 10 ml. Fissare il relativo adattatore per siringhe inserendolo fermamente nell'apertura del flacone. L'adattatore resterà poi sempre inserito nel flacone. |
| 2. Un flacone con tappo a prova di bambino con 300 ml del medicamento. Chiudere il flacone dopo ogni impiego. |
| 3. Una siringa dosatrice da 1 ml per dosaggi fino a 250 mg (equivalenti a una quantità fino a 2,5 ml), e una siringa dosatrice da 10 ml per dosaggi maggiori di 250 mg (corrispondenti a più di 2,5 ml). Esse sono applicabili al rispettivo adattatore in plastica. Con la relativa siringa dosatrice, aspirare dal flacone la quantità di soluzione prescritta. |
Come preparare l'adattatore di plastica e il nuovo flacone per il primo impiego
1. Svitare il tappo a prova di bambino schiacciandolo in modo deciso verso il basso e girandolo in senso antiorario (come indicato sul tappo stesso). Avvertenza: Tenere il tappo vicino al flacone per poterlo richiudere dopo l'impiego. | |
| 2. Porre il flacone verticalmente su un tavolo. Premere l'adattatore di plastica il meglio possibile nel collo del flacone. Avvertenza: è possibile che non si riesca ad inserire l'adattatore completamente, ma sarà premuto nel flacone non appena esso sarà richiuso riavvitando il tappo. Voglia ora seguire le istruzioni del paragrafo «Estrazione di una dose del medicamento». |
Estrazione di una dose del medicamento
Il medicamento può essere assunto direttamente dalla siringa dosatrice o mescolato in un bicchiere d'acqua. | |
1. Premere e svitare il tappo a prova di bambino per aprire il flacone. (Riavvitare il tappo dopo ogni impiego.) | |
| 2. Assicurarsi che lo stantuffo della siringa dosatrice sia premuto fino in fondo. 3. Tenendo il flacone verticalmente premere bene la punta della siringa dosatrice nell'apertura dell'adattatore di plastica. |
| 4. Capovolgere cautamente il flacone e tenerlo verticalmente. 5. Tirare lo stantuffo lentamente verso il basso riempiendo così la siringa dosatrice con il medicamento. Premere di nuovo lo stantuffo svuotandolo completamente per eliminare eventuali grandi bolle d'aria nella siringa dosatrice. |
| 6. Aspirare la dose prescritta: tirare lo stantuffo della siringa lentamente verso il basso fino a quando l'inizio della parte più grossa dello stantuffo viene a trovarsi sulla tacca della dose che le è stata prescritta (in ml). −Avvertenza: se le è stata prescritta una dose di più di 1 ml e fino a 2,5 ml, prelevare la dose prescritta in più passi. Riempire la siringa dosatrice da 1 ml inizialmente fino alla tacca da 1 ml e assumere 1 ml; ripetere eventualmente questo passo (se la dose prescritta supera i 2 ml). Quindi riempire la siringa dosatrice di nuovo fino alla quantità necessaria e assumere il resto. −Se le è stata prescritta una dose maggiore di 10 ml, deve estrarla in due passi. Riempire prima la siringa da 10 ml fino alla tacca di 10 ml ed assumere i 10 ml. Dopodiché riempire la siringa dosatrice nuovamente fino alla quantità necessaria e assumere il resto della dose. Se non è del tutto sicuro, chieda al suo farmacista. |
| 7. Capovolgere di nuovo il flacone con cautela. Svitare la siringa dosatrice cautamente dall'adattatore. |
| 8. La dose del medicamento può essere assunta direttamente dalla siringa dosatrice. Il paziente deve essere seduto con il busto eretto e lo stantuffo deve essere spinto lentamente verso il basso, per rendere possibile la deglutizione. In alternativa si può mescolare la dose in un bicchiere d'acqua, subito prima dell'assunzione. Rimescolare e deglutire la miscela in un sorso. 9. Riavvitare il tappo a prova di bambino sul flacone dopo l'impiego lasciando l'adattatore sul flacone. 10. Pulizia: dopo l'impiego pulire la parte esterna della siringa dosatrice con un panno pulito e asciutto. |
Quali effetti collaterali può avere Levetiracetam DESITIN?
I seguenti effetti collaterali possono insorgere durante la terapia con Levetiracetam DESITIN:
Gli effetti collaterali più frequenti sono infiammazioni della cavità nasofaringea, sonnolenza e mal di testa.
Altri effetti collaterali descritti durante la terapia con levetiracetam sono:
Infezioni
Infiammazioni della cavità nasale e della faringe, infezione.
Sistema sanguigno
Diminuzione del numero di globuli rossi, globuli bianchi e/o piastrine.
Sistema immunitario
(Gravi) reazioni di'ipersensibilità (con, ad esempio, febbre, gonfiore dei linfonodi o del viso) con eruzione cutanea, gravi reazioni allergiche (anafilattiche) con per esempio debolezza, sonnolenza, vertigini o difficoltà a respirare.
Disturbi dell'alimentazione
Mancanza di appetito, aumento o diminuzione del peso corporeo, che abbassano il livello del sodio nel sangue (iponatriemia).
Sistema nervoso/disturbi psichici
Stordimento, crampi, cefalee, mancanza di coordinazione dei movimenti, sonnolenza, tremore, iperattività, agitazione, disturbi dell'equilibrio, disturbi dell'attenzione, peggioramento della memoria, comportamento anormale, cambiamenti della personalità, comportamento aggressivo, rabbia, attacchi di panico, paura, stato confusionale, depressione, pensieri pessimistici, comportamento autolesionista, suicidio, delirium, cambiamenti d'umore, allucinazioni, ostilità, insonnia, irritabilità, nervosismo, pensieri anormali, difficoltà della concentrazione, disturbi psicotici e disturbi sensoriali (p.es. formicolio o intorpidimento), movimenti lenti involontari e alterazioni della sequenza dei movimenti, disturbi della deambulazione.
Occhio
Sdoppiamento della vista, vista offuscata.
Orecchio
Vertigini.
Apparato respiratorio
Tosse frequente.
Sistema digestivo
Dolori addominali, nausea, disturbi della digestione, diarrea, vomito, infiammazione del pancreas.
Fegato
Epatite (infiammazione del fegato), insufficienza epatica.
Reni e vie urinarie
Lesione renale acuta
Pelle
Eruzione cutanea, eczema, prurito, alopecia, reazioni cutanee gravi (sindrome di Stevens-Johnson, necrolisi epidermica tossica, eritema multiforme) con formazione divesciche e desquamazione della pelle, specialmente intorno alla bocca, al naso, agli occhi e ai genitali angioedema (gonfiore della pelle, delle mucose e dei tessuti circostanti, p.es. del viso, della labbra, della lingua e della gola).
Muscolatura scheletrica
Dolori muscolari, debolezza muscolare, rabdomiolisi (distruzione del tessuto muscolare).
Disturbi generali
Perdita delle forze, stanchezza, lesioni casuali.
Alcuni degli effetti collaterali citati, come p.es. sonnolenza, sensazione di debolezza e stordimento, possono insorgere più frequentemente all'inizio della terapia o subito dopo aver aumentato la dose.
Se pensa di soffrire di uno di questi effetti collaterali, dovrebbe continuare ad assumere Levetiracetam DESITIN e informare immediatamente il suo medico.
Se osserva effetti collaterali qui non descritti, dovrebbe informare il suo medico o il suo farmacista.
Di che altro occorre tener conto?
Mini-compresse rivestite con film
Conservi il medicamento al di fuori della portata dei bambini, tra 15 e 30 °C e nella confezione originale.
Soluzione
Conservi il medicamento al di fuori della portata dei bambini, tra 15 e 30 °C e nella confezione originale. Una volta aperto il flacone, consumare la soluzione entro 4 mesi.
Il medico o il farmacista possono darle ulteriori informazioni. Essi dispongono di informazioni professionali dettagliate.
Cosa contiene Levetiracetam DESITIN?
Mini-compresse rivestite con film
1 minipack con mini-compresse rivestite con film contiene 250 mg, 500 mg o 1000 mg levetiracetam quale principio attivo, nonché sostanze ausiliarie: povidone K30, cellulosa microcristallina, biossido di silicio colloidale, magnesio stearato [vegetale], alcool polivinilico, titanio diossido (E 171), macrogol 3350, talco.
Soluzione
1 ml di soluzione contiene 100 mg di levetiracetam quale principio attivo e le seguenti sostanze ausiliarie: acido citrico monoidrato, idrossido di sodio, acqua depurata, acesulfame potassio (E950), aroma d'uva, conservanti: metile-p-idrossibenzoato (E218), propile-p-idrossibenzoato (E216).
Numero dell’omologazione
62069
61848
(Swissmedic)
Dove è ottenibile Levetiracetam DESITIN? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Levetiracetam DESITIN 250 mg: confezioni da 30 minipack
Levetiracetam DESITIN 500 mg: confezioni da 20, 100 e 200 minipack
Levetiracetam DESITIN 1000 mg: confezioni da 30, 100 e 200 minipack
Levetiracetam DESITIN soluzione 100 mg/ml: flacone da 300 ml (con 2 diverse siringhe dosatrici, da 1 ml e da 10 ml, e 2 adattatori)
Titolare dell’omologazione
Desitin Pharma GmbH, 4410 Liestal
Questo foglietto illustrativo è stato controllato l'ultima volta nel dicembre 2018 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoff: Levetiracetam.
Minipacks mit Mini-Filmtabletten:
Hilfsstoffe
Povidone K30, Mikrokristalline Cellulose, Hochdisperses Siliciumdioxid, Magnesiumstearat [pflanzlich], Poly(vinylalkohol), Titandioxid (E 171), Macrogol 3350, Talkum
Lösung:
Hilfsstoffe
Citronensäure-Monohydrat, Natriumhydroxid, gereinigtes Wasser, Acesulfam-Kalium (E950), Trauben-Aroma , Konservierungsstoffe: Methyl-4-hydroxybenzoat (E218), Propyl-4-hydroxybenzoat (E216)
Galenische Form und Wirkstoffmenge pro Einheit
1 Minipack mit Mini-Filmtabletten enthält 250, 500 oder 1000 mg Levetiracetam.
Lösung zu 100 mg/ml Levetiracetam; Flasche zu 300 ml
Indikationen/Anwendungsmöglichkeiten
Levetiracetam DESITIN ist indiziert zur Monotherapie bei der Behandlung von partiellen Anfällen mit oder ohne sekundäre Generalisierung bei Patienten ab 16 Jahren mit Epilepsie.
Levetiracetam DESITIN ist indiziert zur Zusatzbehandlung von partiellen Anfällen mit oder ohne sekundäre Generalisierung bei Erwachsenen und Kindern und voll ausgetragenen Säuglingen ab 1 Monat mit Epilepsie.
Levetiracetam DESITIN ist indiziert zur Zusatzbehandlung von myoklonischen Anfällen bei Erwachsenen und Jugendlichen ab 12 Jahren mit juveniler myoklonischer Epilepsie.
Levetiracetam DESITIN ist indiziert zur Zusatzbehandlung von primären generalisierten tonisch-klonischen Anfällen bei Erwachsenen und Jugendlichen ab 12 Jahren mit idiopathischer generalisierter Epilepsie.
Dosierung/Anwendung
Die Mini-Filmtabletten werden unzerkaut mit ausreichend Flüssigkeit (z.B. einem Glas Wasser) eingenommen. Die Lösung kann unverdünnt oder verdünnt in einem Glas Wasser eingenommen werden. Die Tagesdosis wird auf zwei gleich grosse Einzeldosen verteilt. Levetiracetam DESITIN kann unabhängig von den Mahlzeiten eingenommen werden. Nach der oralen Einnahme kann der bittere Geschmack von Levetiracetam wahrgenommen werden.
Für die Einnahme der Levetiracetam DESITIN Minipacks beachten Sie bitte folgende Hinweise:
| 1. Beutel oberhalb der Markierung (Pfeil) anfassen und den Inhalt nach unten schütteln. |
| 2. An der Markierung (Pfeil) den oberen Teil der Packung abreissen oder abschneiden. |
| 3. Den Inhalt direkt in den Mund entleeren, unzerkaut mit etwas Flüssigkeit schlucken und nachtrinken. |
Hinweis: Die Mini-Filmtabletten sind nach Suspendieren in Wasser sondengängig. Bei dieser Form der Einnahme ist die Suspension unmittelbar vor der Verabreichung herzustellen.
Benutzung der Dosierspritzen von Levetiracetam DESITIN Lösung
Anwendung des Arzneimittel-Sets
Das Arzneimittel-Set besteht aus fünf Teilen: | |
| 1. Zwei Spritzenadapter, einer passend für die 1 ml Dosierspritze und einer passend für die 10-ml-Dosierspritze. Der entsprechende Spritzenadapter muss fest in die Flaschenöffnung eingedrückt werden. Der Adapter verbleibt immer in der Flasche. |
| 2. Eine Flasche mit kindersicherem Verschluss mit 300 ml des Arzneimittels. Nach Gebrauch muss die Flasche immer zugeschraubt werden. |
| 3. Eine 1 ml Dosierspritze für Dosierungen bis zu 250 mg und eine 10-ml-Dosierspritze für Dosierungen grösser 250 mg. Diese passen in den entsprechenden Kunststoffadapter. Mit der entsprechenden Dosierspritze wird die verschriebene Menge Lösung aus der Flasche entnommen. |
Vorbereitung des Kunststoffadapters und der neuen Flasche für den ersten Gebrauch
1. Der kindersichere Verschluss wird entfernt, indem er fest heruntergedrückt und gegen den Uhrzeigersinn gedreht wird (wie auf dem Verschluss dargestellt). | |
| 2. Die offene Flasche wird aufrecht auf einen Tisch gestellt und der Plastikadapter so weit wie möglich fest in den Flaschenhals gedrückt. Anmerkung: Der Adapter lässt sich möglicherweise nicht vollständig hineindrücken, wird jedoch durch erneutes Aufschrauben des Verschlusses in die Flasche gedrückt. |
Entnahme einer Arzneimitteldosis
Das Arzneimittel kann direkt aus der Dosierspritze eingenommen oder in einem Glas mit etwas Wasser vermischt werden. | |
1. Öffnen der Flasche durch Drücken und Drehen des kindersicheren Verschlusses. (Verschluss nach Anwendung immer zuschrauben.) | |
| 2. Prüfen, ob der Kolben in der Dosierspritze ganz hinuntergedrückt ist. 3. Bei senkrecht gehaltener Flasche die Dosierspritze mit ihrer Spitze fest in die Öffnung des Kunststoffadapters drücken. |
| 4. Die Flasche senkrecht halten und vorsichtig umdrehen. 5. Den Kolben langsam herunterziehen, so dass sich die Dosierspritze mit dem Arzneimittel füllt. Den Kolben vollständig zurückdrücken, um möglicherweise in der Dosierspritze befindliche grosse Luftblasen zu entfernen. |
| 6. Entnahme der verschriebenen Dosis: Den Spritzenkolben langsam herunterziehen, bis sich der Beginn des dickeren Teils des Kolbens genau mit der Markierung für die verschriebene Dosis (in ml) deckt. Anmerkung: Eine Dosis von mehr als 1 ml bis zu 2,5 ml wird in mehreren Schritten mit der 1 ml Dosierspritze entnommen: - Füllen der Spritze bis zur 1-ml-Marke und Einnahme der 1 ml. - Abhängig von Ihrer verordneten Dosis müssen Sie diesen Schritt möglicherweise wiederholen. - Erneutes Füllen der Dosierspritze bis zur erforderlichen Menge und Einnahme der restlichen Menge. Eine Dosis von mehr als 10 ml wird in zwei Schritten mit der 10 ml Dosierspritze entnommen: - Füllen der Spritze bis zur 10-ml-Marke und Einnahme der 10 ml. - Erneutes Füllen der Dosierspritze bis zur erforderlichen Menge und Einnahme der restlichen Menge. |
| 7. Die Flasche vorsichtig wieder umdrehen und die Dosierspritze sanft aus dem Adapter herausdrehen. |
| 8. Die Arzneimitteldosis kann direkt aus der Dosierspritze eingenommen werden. Der Patient muss dabei aufrecht sitzen und der Kolben muss langsam heruntergedrückt werden, um das Schlucken zu ermöglichen. Alternativ hierzu kann die Dosis unmittelbar vor der Einnahme in einem Glas mit etwas Wasser gemischt werden. Umrühren und die Mischung in einem Zug trinken. 9. Aufschrauben des kindersicheren Verschlusses auf die Flasche. Der Adapter bleibt dabei auf der Flasche. 10. Reinigung: Abwischen der Aussenseite der Dosierspritze mit einem sauberen, trockenen Tuch. |
Galenische Form | Dosisstärke | Empfohlene Altersgrenze |
Levetiracetam DESITIN Levetiracetam DESITIN | 100 mg/ml 250 mg | Erwachsene, Kinder und voll ausgetragene Säuglinge ab 1 Monat und älter |
Levetiracetam DESITIN | 500 mg | Erwachsene und Kinder ab 10 Jahren |
Levetiracetam DESITIN | 1000 mg | Erwachsene und Kinder ab 12 Jahren |
Monotherapie
Erwachsene und Jugendliche ab 16 Jahren
Die Behandlung sollte mit 2× 250 mg/Tag gestartet werden und die Dosierung nach 2 Wochen auf 2× 500 mg/Tag erhöht werden. Je nach klinischem Ansprechen kann die Dosis in Schritten von 2× 250 mg/Tag alle 2 Wochen auf maximal 2× 1500 mg/Tag gesteigert werden.
Kinder und Jugendliche <16 Jahren
Da keine Daten vorliegen, kann die Anwendung von Levetiracetam als Monotherapie bei Kindern und Jugendlichen <16 Jahren nicht empfohlen werden.
Zusatzbehandlung
Bei Erwachsenen (≥18 Jahre) und Jugendlichen (12 bis 17 Jahre) ab 40 kg
Die therapeutische Dosis beträgt bei Zusatztherapie 1000 mg/Tag (500 mg zweimal täglich). Mit dieser Dosis kann ab dem ersten Behandlungstag begonnen werden. Je nach klinischem Ansprechen und Verträglichkeit kann die Tagesdosis bis auf 3000 mg gesteigert werden. Dosiserhöhungen bzw. -reduzierungen können in Schritten von 1000 mg alle 2–4 Wochen vorgenommen werden.
Spezielle Dosierungsanweisungen
Säuglinge, Kinder und Jugendliche
Bei Säuglingen und Kindern sollte die Behandlung mit Levetiracetam DESITIN Lösung begonnen werden.
Voll ausgetragene Säuglinge von 1 Monat bis unter 6 Monate
Die therapeutische Initialdosis beträgt zweimal täglich 7 mg/kg.
Je nach klinischem Ansprechen und Verträglichkeit kann die Dosis auf bis zu zweimal täglich 21 mg/kg gesteigert werden. Dosiserhöhungen bzw. -reduzierungen sollten zweimal täglich 7 mg/kg alle zwei Wochen nicht überschreiten. Es sollte die niedrigste wirksame Dosis verwendet werden.
Bei Säuglingen sollte die Behandlung mit Levetiracetam DESITIN Lösung begonnen werden.
Dosisempfehlungen für Säuglinge unter 6 Monaten
Gewicht | Initialdosis: 7 mg/kg zweimal täglich | Maximale Dosis: 21 mg/kg zweimal täglich |
4 kg | 28 mg (0,3 ml) zweimal täglich | 84 mg (0,85 ml) zweimal täglich |
5 kg | 35 mg (0,35 ml) zweimal täglich | 105 mg (1,05 ml) zweimal täglich |
7 kg | 49 mg (0,5 ml) zweimal täglich | 147 mg (1,5 ml) zweimal täglich |
Säuglinge und Kleinkinder von 6 bis 23 Monaten, Kinder von 2 bis 11 Jahren und Jugendliche (12 bis 17 Jahre) unter 40 kg
Bei Kindern beträgt die initiale therapeutische Dosierung 10 mg/kg Körpergewicht zweimal pro Tag.
Je nach klinischer Besserung und Verträglichkeit kann die Dosierung bis 30 mg/kg zweimal pro Tag angehoben werden. Dosiserhöhungen bzw. -reduzierungen können in Schritten von 10 mg/kg zweimal pro Tag alle 2–4 Wochen vorgenommen werden. Die niedrigste wirksame Dosis sollte angewendet werden. Kinder und Jugendliche ≥40 kg werden mit derselben Dosis behandelt wie Erwachsene.
Dosisempfehlungen für Säuglinge ab einem Alter von 6 Monaten, Kinder und Jugendliche:
Gewicht | Initialdosis: 10 mg/kg zweimal täglich | Maximale Dosis: 30 mg/kg zweimal täglich |
6kg1 | 60 mg (0,6 ml) zweimal täglich | 180 mg (1,8 ml) zweimal täglich |
10kg1 | 100 mg (1 ml) zweimal täglich | 300 mg (3 ml) zweimal täglich |
15 kg1 | 150 mg (1,5 ml) Zweimal täglich | 450 mg (4,5 ml) Zweimal täglich |
20 kg1 | 200 mg (2 ml) zweimal täglich | 600 mg (6 ml) zweimal täglich |
25 kg | 250 mg zweimal täglich | 750 mg zweimal täglich |
Über 40 kg2 | 500 mg zweimal täglich | 1500 mg zweimal täglich |
1Bei Kindern bis 20 kg sollte die Behandlung vorzugsweise mit Levetiracetam Desitin 100 mg/ml Lösung zum Einnehmen begonnen werden.
2Die Dosierung bei Kindern und Jugendlichen ab 40 kg entspricht der bei Erwachsenen.
Eine Packungsgrösse der Levetiracetam Desitin Lösung ist erhältlich:
– Eine 300 ml Flasche mit einer 1 ml Dosierspritze mit Skalierungsschritten von jeweils 0,05 ml (entsprechend 5 mg) sowieeiner 10 ml Dosierspritze mit Skalierungsschritten von jeweils 0,25 ml (entsprechend 25 mg). Um eine möglichst genaue Dosierung sicher zu stellen, sollte bei Säuglingen ab 1 Monat bis unter 6 Monaten die 1 ml Dosierspritze verwendet werden.
Ältere Patienten (ab 65 Jahre)
Bei älteren Patienten wird eine Dosisanpassung in Abhängigkeit von der Kreatinin-Clearance empfohlen (siehe «Patienten mit eingeschränkter Nierenfunktion»).
Patienten mit eingeschränkter Nierenfunktion
Die Tagesdosis (Erhaltungsdosis) von Levetiracetam DESITIN bei Erwachsenen muss individuell entsprechend der Nierenfunktion festgelegt werden.
Bei der Anwendung der untenstehenden Tabelle ist es notwendig, die Kreatininclearance des Patienten (CLcr) in ml/min zu schätzen. Die CLcr in ml/min kann durch die Bestimmung des Serumkreatininwertes (mg/dl) mit folgender Formel geschätzt werden:
CLcr (ml/min) = [(140-Alter (Jahre)) × Gewicht (kg)]: [72 × Serumkreatinin (mg/dl)] (× 0,85 für Frauen).
Anschliessend wird die CLcr wie folgt für die Körperoberfläche (KOF) angepasst:
CLcr (ml/min/1,73 m²) = CLcr (ml/min): KOF Patient (m²) × 1,73.
Dosisanpassung bei erwachsenen und jugendlichen Patienten mit eingeschränkter Nierenfunktion, die mehr als 50 kg wiegen:
Nierenfunktion | Kreatinin- Clearance (ml/min/1,73 m²) | Erhaltungsdosis und Einnahmehäufigkeit |
Normal | >80 | 500–1500 mg zweimal täglich |
Leicht eingeschränkt | 50–79 | 500–1000 mg zweimal täglich |
Mässig eingeschränkt | 30–49 | 250–750 mg zweimal täglich |
Schwer eingeschränkt | <30 | 250–500 mg zweimal täglich |
Dialysepflichtige Patienten* | – | 500–1000 mg einmal täglich** |
* Am ersten Tag der Behandlung mit Levetiracetam wird eine Anfangsdosis von 750 mg empfohlen.
** Nach der Dialyse wird eine zusätzliche Dosis von 250–500 mg empfohlen.
Obwohl die Studie nur an erwachsenen Patienten mit Niereninsuffizienz durchgeführt worden ist, soll die Dosis von Levetiracetam auch bei Säuglingen, Kindern und Jugendlichen mit Niereninsuffizienz gemäss der Nierenfunktion angepasst werden.
Die CLcr in ml/min/1,73 m² kann für Jugendliche, Kinder und Säuglinge aus dem Serum-Kreatinin (mg/dl) nach folgender Formel (Schwartz Formel) bestimmt werden:
CLcr (ml/min/1,73 m²) = Grösse (cm) × ks: Serum-Kreatinin (mg/dl).
ks = 0,45 für voll ausgetragene Säuglinge ab 1 Monat und Kleinkinder bis zu 1 Jahr; ks = 0,55 für Kinder unter 13 Jahren und weibliche Jugendliche; ks = 0,7 für männliche Jugendliche.
Dosisanpassung bei Säuglingen, Kindern und jugendlichen Patienten mit eingeschränkter Nierenfunktion, die weniger als 50 kg wiegen:
Gruppe | Kreatinin- Clearance (ml/min/1,73m2) | Dosis und Einnahmehäufigkeit | |
Säuglinge von 1 Monat bis unter 6 Monaten | Säuglinge und Kleinkinder von 6 bis 23 Monaten, Kinder und Jugendliche unter 50 kg Körpergewicht | ||
Normal | >80 | 7 bis 21 mg/kg (0,07 bis 0,21 ml/kg) zweimal täglich | 10 bis 30 mg/kg (0,1 bis 0,3 ml/kg) zweimal täglich |
Leicht | 50–79 | 7 bis 14 mg/kg (0,07 bis 0,14 ml/kg) zweimal täglich | 10 bis 20 mg/kg (0,1 bis 0,2 ml/kg) zweimal täglich |
Mässig | 30–49 | 3,5 bis 10,5 mg/kg (0,035 bis 0,105 ml/kg) zweimal täglich | 5 bis 15 mg/kg (0,05 bis 0,15 ml/kg) zweimal täglich |
Schwer | <30 | 3,5 bis 7 mg/kg (0,035 bis 0,07 ml/kg) zweimal täglich | 5 bis 10 mg/kg (0,05 bis 0,1 ml/kg) zweimal täglich |
Dialysepflichtige Patienten* | – | 7 bis 14 mg/kg (0,07 bis 0,14 ml/kg) einmal täglich1, 3 | 10 bis 20 mg/kg (0,1 bis 0,2 ml/kg) einmal täglich2, 4 |
1 Am ersten Tag der Behandlung mit Levetiracetam wird eine Initialdosis von 10,5 mg/kg (0,105 ml/kg) empfohlen.
2 Am ersten Tag der Behandlung mit Levetiracetam wird eine Initialdosis von 15 mg/kg (0,15 ml/kg) empfohlen.
3Nach der Dialyse wird eine zusätzliche Dosis von 3,5 bis 7 mg/kg (0,035 bis 0,07 ml/kg) empfohlen.
4Nach der Dialyse wird eine zusätzliche Dosis von 5 bis 10 mg/kg (0,05 bis 0,10 ml/kg) empfohlen.
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit leicht bis mässig eingeschränkter Leberfunktion ist eine Dosisanpassung nicht erforderlich. Bei Patienten mit schwerer Beeinträchtigung der Leberfunktion kann die Kreatinin-Clearance zu einer Fehleinschätzung der Niereninsuffizienz führen.
Daher wird eine Halbierung der täglichen Erhaltungsdosis empfohlen, wenn die Kreatinin-Clearance weniger als 60 ml/min/1,73 m2 beträgt.
Absetzen der Medikation
Falls Levetiracetam DESITIN abgesetzt werden muss, sollte dies in Übereinstimmung mit der gängigen klinischen Praxis ausschleichend erfolgen (siehe «Dosierung/Anwendung»).
Kontraindikationen
Überempfindlichkeit gegenüber Levetiracetam bzw. verwandten Substanzen oder einem der Hilfsstoffe.
Warnhinweise und Vorsichtsmassnahmen
Säuglinge, Kinder und Jugendliche
Die vorhandenen Daten bei Kindern lassen keinen Einfluss auf das Wachstum und die Pubertät vermuten. Allerdings sind Langzeiteffekte hinsichtlich Lernverhalten, Intelligenz, Wachstum, endokriner Funktion, Pubertät und Gebärfähigkeit bei Kindern unbekannt.
Die Sicherheit und Wirksamkeit von Levetiracetam wurde an Säuglingen unter 1 Jahr nicht ausreichend untersucht. Es wurden nur 35 Säuglinge unter 1 Jahr in klinischen Studien untersucht. Darunter waren 13 Säuglinge unter 6 Monaten.
Die Sicherheit und die Wirksamkeit von Levetiracetam bei Säuglingen unter 1 Monat wurden nicht untersucht.
Frühgeborene Säuglinge sollten nicht bereits mit 1 Monat behandelt werden, da bei diesen die Nierenreifung zu diesem Zeitpunkt noch nicht abgeschlossen und somit die renale Elimination von Levetiracetam nicht gewährleistet ist.
Anfallshäufung
Ein Anstieg der Anfallshäufigkeit um mehr als 25% wurde bei 14% der mit Levetiracetam behandelten erwachsenen und pädiatrischen Patienten (4 bis 16 Jahre) mit partiellen Anfällen berichtet, während es bei 26% bzw. 21% der mit Placebo behandelten erwachsenen bzw. pädiatrischen Patienten berichtet wurde.
Absencen
Bei Anwendung von Levetiracetam zur Behandlung von primär generalisierten tonisch-klonischen Anfällen bei Erwachsenen und Jugendlichen mit idiopathisch generalisierter Epilepsie wurde keine Wirksamkeit im Sinne einer Senkung der Häufigkeit von Absenzen festgestellt.
Blutbild
In Zusammenhang mit der Einnahme von Levetiracetam wurden Fälle von verminderten Blutzellzahlen beschrieben (Neutropenie, Agranulozytose, Leukopenie, Thrombozytopenie und Panzytopenie), in der Regel zu Beginn der Behandlung. Ein komplettes Blutbild wird bei Patienten mit erheblicher Schwäche, Pyrexie, wiederkehrenden Infektionen oder Koagulationsstörungen empfohlen (siehe «Unerwünschte Wirkungen»).
Suizid
Es liegen Berichte von Suiziden, Suizidversuchen und suizidalen Gedanken bei mit Levetiracetam behandelten Patienten (Erwachsene und Kinder) vor.
Die Patienten und ihre Angehörigen bzw. Bezugspersonen sollten deshalb insbesondere auch vor Therapiebeginn in einem ausführlichen Gespräch darüber informiert werden, dass sie bei Verschlechterung der Stimmung und/oder bei sozialem Rückzug und/ oder dem Auftreten von depressiven Symptomen und/oder gereiztem bis feindseligem Verhalten bzw. auch anderen Veränderungen des Verhaltens bzw. der Persönlichkeit, insbesondere aber bei der Äusserung von suizidalen Gedanken, sofort einen Arzt oder eine Ärztin kontaktieren sollten. Es muss bedacht werden, dass Suizidalität sich auch in manchen Fällen nur durch Verhaltensänderungen ankündigen kann. Vor Therapiebeginn sollte geklärt werden, ob einer der wissenschaftlich nachgewiesenen Risikofaktoren für Suizidalität , z.B. psychiatrische Erkrankungen und Suizidalität in der Vorgeschichte, vorliegt, und das Nutzen-Risiko-Verhältnis muss gerade auch unter diesen Aspekten sehr sorgfältig abgewogen werden.
Schwere Hautreaktionen:
Fälle von lebensbedrohlichen Hautreaktionen, einschliesslich Stevens-Johnson Syndrom (SJS) und toxischer epidermaler Nekrolyse (TEN) wurden bei mit Levetiracetam behandelten Patienten (Erwachsene und Kinder) berichtet. Das Risiko für das Auftreten von SJS oder TEN ist in den ersten Behandlungswochen am höchsten (im Median lag der Beginn bei 14 bis 17 Tagen). Allerdings traten solche Fälle auch noch nach 4 monatiger Einnahme und später auf. Die Patienten sollten über die Anzeichen und Symptome dieser schweren Nebenwirkungen informiert und insbesondere zu Beginn der Behandlung engmaschig bezüglich des Auftretens von Hautreaktionen überwacht werden. Wenn Anzeichen oder Symptome von SJS oder eine TEN auftreten (z.B. ein progredienter Hautausschlag, oft mit Blasenbildung oder begleitenden Schleimhautläsionen), muss die Therapie mit Levetiracetam beendet werden, es sei denn, der Hautausschlag ist eindeutig nicht arzneimittelassoziiert. Der Verlauf von SJS und TEN wird massgeblich von der frühzeitigen Diagnosestellung und dem sofortigen Absetzen aller verdächtigen Arzneimittel bestimmt, d.h. frühzeitiges Absetzen verbessert die Prognose. Nach Auftreten von SJS oder TEN in Zusammenhang mit der Anwendung von Levetiracetam darf der Patient nicht erneut mit Levetiracetam behandelt werden.
Hypersensitivitätsreaktionen mit systemischer Implikation:
Generalisierte Exantheme können auch im Rahmen eines Überempfindlichkeitssyndroms in Kombination mit irgendeinem der folgenden systemischen Symptome wie Fieber, Lymphadenopathie, Leukozytose, Eosinophilie, atypischen Lymphozyten, anormalen Leber- ,Nierenwerten oder mit anderen Symptomen, die auf eine systemische Implikation hinweisen (siehe «Unerwünschte Wirkungen - DRESS: Drug Reaction with Eosinophilia and Systemic Symptoms») auftreten. Dieses Syndrom variiert hinsichtlich seines klinischen Schweregrades beträchtlich mit zum Teil letalem Verlauf. Es ist wichtig zu beachten, dass die systemischen Anzeichen einer Überempfindlichkeit (wie z.B. Fieber und Lymphadenopathie) bereits manifest sein können, auch wenn keine Hautveränderungen sichtbar sind. Grundsätzlich sollte Levetiracetam sofort abgesetzt werden, wenn Symptome auftreten, die auf eine Hypersensitivitätsreaktion hinweisen.
Sonstige Bestandteile:
Levetiracetam DESITIN 100 mg/ml Lösung zum Einnehmen enthält die Konservierungsstoffe Parahydroxybenzoate (Methylparaben (E 218), Propylparaben (E 216), welche allergische Reaktionen hervorrufen können (möglicherweise verzögert).
Interaktionen
In vitro wurde gezeigt, dass Levetiracetam und sein Hauptmetabolit weder die Aktivitäten der wichtigsten Cytochrom P450 Isoformen beim Menschen (CYP3A4, 2A6, 2C9, 2C19, 2D6, 2E1 and 1A2) noch der Glucuronyltransferase (UGT1A1 und UGT1A6) oder der Epoxidhydroxylase hemmt. Levetiracetam beeinflusst auch die in vitro Glucuronidierung von Valproinsäure nicht und hatte in humanen Hepatozytenkulturen einen geringen oder keinen Effekt auf die Ethinylestradiolkonjugation.
Levetiracetam verursachte in hohen Konzentrationen (680 µg/ml) eine milde Induktion von CYP2B6 und CYP3A4; bei Cmax-Konzentrationen jedoch, wie sie bei wiederholter Dosierung mit zweimal täglich 1500 mg auftreten, wurden diese Effekte nicht als klinisch relevant beurteilt. Eine Interaktion von Levetiracetam mit anderen Substanzen aufgrund von Enzyminhibition oder -induktion ist sehr unwahrscheinlich.
Probenecid vermindert die renale Clearance des Hauptmetaboliten, jedoch nicht die von Levetiracetam. Die Konzentration des Hauptmetaboliten bleibt jedoch niedrig. Vermutlich verringern auch andere Substanzen, die durch aktive tubuläre Sekretion ausgeschieden werden, die renale Clearance dieses Metaboliten. Die Wirkung von Levetiracetam auf Probenecid wurde nicht untersucht, und der Einfluss von Levetiracetam auf andere aktiv sezernierte Arzneimittel wie z.B. NSAR, Sulfonamide und Methotrexat ist unbekannt.
Bei gleichzeitiger Gabe von anderen Antiepileptika (Carbamazepin, Phenytoin, Valproinsäure, Phenobarbital, Lamotrigin, Primidon und Gabapentin) verändern sich die pharmakokinetischen Parameter von Levetiracetam nicht, und umgekehrt beeinflusst auch Levetiracetam die Serumkonzentrationen dieser Antiepileptika nicht.
Eine retrospektive Beurteilung der pharmakokinetischen Interaktionen bei Kindern und Jugendlichen mit Epilepsie (4–17 Jahre) bestätigte, dass die Zusatztherapie mit Levetiracetam die Steady-State-Serumkonzentrationen von gleichzeitig verabreichtem Carbamazepin und Valproat nicht beeinflusst. Ähnliche Ergebnisse wurden für Topiramat und Lamotrigin beobachtet. Jedoch erhöhten enzyminduzierende Antiepileptika (z.B. Carbamazepin) die Levetiracetam-Clearance um 22% und verkürzten die Halbwertszeit von Levetiracetam um 22%. Dieser Befund wurde jedoch nicht als klinisch relevant beurteilt und eine Dosisanpassung ist nicht notwendig.
Pharmakokinetische Studien zeigen keine Wechselwirkungen mit Digoxin, oralen Kontrazeptiva (Ethinylestradiol und Levonorgestrel) und Warfarin. Endokrine Parameter (LH und Progesteron) sowie die Prothrombinzeit werden nicht verändert.
Daten über eine mögliche Wechselwirkung von Levetiracetam mit Alkohol liegen nicht vor.
Schwangerschaft/Stillzeit
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter sollten von einem Spezialisten beraten werden. Für die Dauer der Behandlung wird eine sichere Methode der Empfängnisverhütung empfohlen. Wenn eine Frau plant schwanger zu werden, ist die Behandlung mit Levetiracetam zu überdenken. Wie bei anderen Antiepileptika auch, ist ein plötzlicher Abbruch der Einnahme von Levetiracetam zu vermeiden, da dies zu Entzugsanfällen oder Status epilepticus führen kann, die schwerwiegende Konsequenzen für die Frau und das ungeborene Kind haben können. Soweit möglich ist eine Monotherapie zu bevorzugen, da die Therapie mit mehreren Antiepileptika je nach Kombination mit einem höheren Risiko für kongenitale Fehlbildungen verknüpft sein könnte als die Monotherapie.
Schwangerschaft
Ein hoher Anteil der Post-Marketing-Daten zu schwangeren Frauen, die eine Monotherapie mit Levetiracetam erhalten haben (mehr als 1'800, von welchen die Einnahme in 1'500 Fällen im ersten Schwangerschaftstrimester erfolgte), deuten nicht auf ein erhöhtes Risiko für schwere kongenitale Fehlbildungen hin. Es liegen nur wenige Daten vor zur neurologischen Entwicklung bei Kindern, die in utero einer Monotherapie mit Levetiracetam DESITIN ausgesetzt waren. Aktuelle epidemiologische Studien (mit etwa 100 Kindern) weisen nicht auf ein erhöhtes Risiko für Störungen oder Verzögerungen in der neurologischen Entwicklung hin.
Levetiracetam kann während der Schwangerschaft angewendet werden, wenn es nach sorgfältiger Bewertung als klinisch notwendig erachtet wird. In diesem Fall wird die niedrigste wirksame Dosis empfohlen.
Wie auch mit anderen antiepileptischen Arzneimitteln beobachtet, können physiologische Veränderungen während der Schwangerschaft die Levetiracetam-Plasma-Konzentration beeinflussen.
Es gibt Berichte über die Abnahme der Levetiracetam-Plasma-Konzentration während der Schwangerschaft.
Diese Abnahme ist deutlich ausgeprägter im dritten Trimenon (bis zu 60% der Anfangskonzentration vor Schwangerschaftsbeginn).
Bei schwangeren Frauen, die mit Levetiracetam behandelt werden, sollte eine geeignete klinische Überwachung gewährleistet sein.
Einnahme während der Stillzeit
Levetiracetam wird in die Muttermilch ausgeschieden. Daher wird das Stillen nicht empfohlen. Sollte jedoch eine Behandlung mit Levetiracetam während der Stillzeit erforderlich sein, müssen Nutzen und Risiko einer Behandlung, unter Berücksichtigung der Bedeutung des Stillens für den Säugling, gegeneinander abgewogen werden.
Fertilität
Es liegen keine klinischen Daten vor. Das potentielle Risiko für den Menschen ist nicht bekannt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Aufgrund einer möglichen individuell unterschiedlichen Empfindlichkeit können bei einigen Patienten zu Behandlungsbeginn oder nach einer Dosissteigerung Somnolenz oder andere zentralnervöse Störungen auftreten. Deshalb ist bei Tätigkeiten, die ein hohes Mass an Geschicklichkeit erfordern, wie z.B. beim Führen eines Fahrzeuges oder beim Bedienen von Maschinen, Vorsicht geboten.
Unerwünschte Wirkungen
Der behandelnde Arzt sollte berücksichtigen, dass die folgenden Daten aus Studien stammen, in denen Levetiracetam mit anderen Antiepileptika kombiniert wurde. Es war daher nicht in allen Fällen möglich, die beobachteten unerwünschten Ereignisse einem bestimmten Arzneimittel zuzuordnen.
Die anhand der Studien gesammelten Daten zur Sicherheit und Verträglichkeit bei erwachsenen Patienten ergaben bei partiellen Anfällen, dass bei 46,4% der erwachsenen Patienten der Levetiracetam-Gruppe und bei 42% der Patienten der Placebo-Gruppe unerwünschte Wirkungen auftraten; 2,4% bzw. 2,0% der Patienten der Levetiracetam- bzw. Placebo-Gruppe erlitten schwerwiegende unerwünschte Wirkungen.
Die häufigsten unerwünschten Wirkungen bei erwachsenen Patienten waren Somnolenz, Asthenie und Benommenheit. Bei der zusammenfassenden Analyse der Daten zur Sicherheit und Verträglichkeit konnte keine eindeutige Dosis-Nebenwirkungs-Beziehung festgestellt werden. Die Inzidenz und der Schweregrad der zentralnervösen unerwünschten Wirkungen nahmen jedoch im Laufe der Zeit ab.
Unter Monotherapie bei partiellen Anfällen trat bei 49,8% der Patienten mindestens eine Nebenwirkung auf. Die am häufigsten berichteten unerwünschten Wirkungen waren Müdigkeit und Somnolenz.
Eine Studie bei Erwachsenen und Jugendlichen mit myoklonischen Anfällen (12 bis 65 Jahre) zeigte, dass bei 33,3% der Patienten der Levetiracetam-Gruppe und bei 30,0% der Placebo-Gruppe unerwünschte Wirkungen auftraten, die als mit der Behandlung zusammenhängend bewertet wurden. Die am häufigsten berichteten unerwünschten Wirkungen waren Kopfschmerzen und Somnolenz. Die Inzidenz der unerwünschten Wirkungen bei Patienten mit myoklonischen Anfällen war niedriger als die bei Patienten mit partiellen Anfällen (33,3% gegenüber 46,4%).
Eine Studie bei Erwachsenen und Kindern (4 bis 65 Jahre) mit idiopathischer generalisierter Epilepsie mit primär generalisierten tonisch-klonischen Anfällen zeigte, dass 39,2% der Patienten der mit Levetiracetam behandelten Gruppe und 29,8% der mit Placebo behandelten Gruppe unerwünschte Wirkungen hatten, die mit der Behandlung in Verbindung gebracht wurden. Die häufigste unerwünschte Wirkung war Müdigkeit.
Säuglinge ab 1 Monat, Kinder und Jugendliche
Eine Studie, die bei pädiatrischen Patienten (1 Monat bis unter 4 Jahren) mit partiellen Anfällen durchgeführt wurde, zeigte, dass bei 21,7% der Patienten der Levetiracetam- und 7,1% der Patienten der Placebo-Gruppe Nebenwirkungen auftraten. Schwerwiegende Nebenwirkungen traten weder bei den Patienten der Levetiracetam- noch bei Patienten der Placebo-Gruppe auf. Die während der Langzeit-Nachbeobachtungsstudie N01148 am häufigsten berichteten arzneimittelabhängigen Nebenwirkungen in der pädiatrischen Population von 1 Monat bis unter 4 Jahren waren Reizbarkeit (7,9%), Konvulsion (7,2%), Somnolenz (6,6%), psychomotorische Überaktivität (3,3%), Schlafstörungen (3,3%) und Aggressionen (3,3%). Die Sicherheitsergebnisse bei pädiatrischen Patienten stimmten mit dem Verträglichkeitsprofil von Levetiracetam bei Kindern und Jugendlichen im Alter von 4 bis 16 Jahren überein.
Eine Studie bei Kindern (4 bis 16 Jahre) zeigte, dass bei 55,4% der pädiatrischen Patienten der Levetiracetam-Gruppe und bei 40,2% der Patienten der Placebo-Gruppe unerwünschte Wirkungen auftraten; 0% bzw. 1,0% der pädiatrischen Patienten der Levetiracetam- bzw. Placebo-Gruppe erlitten schwerwiegende unerwünschte Wirkungen.
Die häufigsten unerwünschten Wirkungen in der pädiatrischen Population waren Somnolenz, Feindseligkeit, Nervosität, emotionale Labilität, Ruhelosigkeit, Asthenie, Anorexie und Kopfschmerzen.
Ausserdem wurden psychopathologische Symptome berichtet wie Agitiertheit, Depersonalisierung, Bewegungsunruhe (Hyperkinesie), Persönlichkeitsstörungen. Solche verhaltensbezogenen und psychopathologischen Ereignisse traten häufiger bei Kindern auf als bei Erwachsenen (38,6% versus 18,6%).
In einer doppelblinden, placebokontrollierten pädiatrischen Sicherheitsstudie, die auf «Nicht-Unterlegenheit» prüfte, wurde bestimmt, welche kognitiven und neuropsychologischen Effekte Levetiracetam auf Kinder im Alter von 4 bis 16 Jahren, die an partiellen Anfällen leiden, hat. Levetiracetam war im Vergleich zu Placebo gleichwertig in Bezug auf die Differenz zu den Ausgangswerten des «Leiter-R Attention and Memory, Memory Screen Composite score» in der «per-protocol» Patientenpopulation. Die Ergebnisse, die sich auf das Verhalten und die Gefühlslage bezogen, deuten darauf hin, dass sich aggressives Verhalten bei den mit Levetiracetam behandelten Patienten verschlechterte. Dieses Ergebnis wurde unter standardisierten Bedingungen und unter Verwendung einer validierten Messskala ermittelt (CBCL – Achenbach Child Behavior Checklist). Allerdings zeigten Studienteilnehmer, die Levetiracetam während der offenen Langzeit-Nachbeobachtungsstudie einnahmen, im Durchschnitt keine Verschlechterung des Verhaltens und der Gefühlslage; insbesondere waren die Ergebnisse für aggressives Verhalten nicht schlechter als die Ausgangswerte.
Unerwünschte Wirkungen aus klinischen Studien (Erwachsene, Jugendliche, Kinder und Säuglinge ab 1 Monat) und aus den Erfahrungen nach der Zulassung sind in der folgenden System-Organklassen-Tabelle nach Häufigkeit aufgeführt. Für klinische Versuche wird die Häufigkeit folgendermassen definiert: sehr häufig: ≥1/10; häufig: ≥1/100 bis <1/10; gelegentlich: ≥1/1'000 bis <1/100; selten: ≥1/10'000 bis <1/1'000; sehr selten: <1/10'000, inklusive Einzelfälle.
Die Daten aus Erfahrungen nach der Zulassung reichen nicht aus, um eine Schätzung über die Inzidenz in der behandelten Population abzugeben.
Infektionen und parasitäre Erkrankungen
Sehr häufig: Nasopharyngitis.
Selten: Infektion.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Thrombozytopenie.
Erfahrungen nach der Zulassung: Panzytopenie (in einigen Fällen wurde eine Knochenmarkssuppression festgestellt), Agranulozytose, Leukopenie, Neutropenie.
Erkrankungen des lmmunsystems
Erfahrungen nach der Zulassung: Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (Drug Reaction with Eosinophilia and Systemic Symptoms [DRESS], siehe «Warnhinweise und Vorsichtsmassnahmen»); anaphylaktische Reaktionen.
Stoffwechsel- und Ernährungsstörungen
Häufig: Anorexie.
Gelegentlich: Gewichtszunahme.
Erfahrung nach der Zulassung: Gewichtsverlust, Hyponatriämie.
Psychiatrische Erkrankungen
Häufig: Depression, Feindseligkeit, Aggression, Schlaflosigkeit, Nervosität, Reizbarkeit.
Gelegentlich: emotionale Labilität/Stimmungsschwankungen, Agitation.
Selten: Persönlichkeitsveränderungen, anormales Denken.
Erfahrungen nach der Zulassung: anormales Verhalten, Wut, Panikattacke, Ängstlichkeit, Verwirrungszustand, Halluzination, psychotische Störungen, suizidale Gedanken, Suizidversuch, Suizid, Delirium.
Erkrankungen des Nervensystems
Sehr häufig: Somnolenz, Kopfschmerzen.
Häufig: Konvulsion, Benommenheit, Tremor, Gleichgewichtsstörungen.
Gelegentlich: Amnesie, Koordinationsstörungen/Ataxie, Aufmerksamkeitsstörungen, Beeinträchtigung des Gedächtnisses.
Selten: Hyperkinesie.
Erfahrung nach der Zulassung: Choreoathetose, Dyskinesie, Parästhesie, Lethargie, Gehstörungen.
Augenerkrankungen
Gelegentlich: Diplopie, verschwommenes Sehen.
Erkrankungen des Ohrs und des Labyrinths
Häufig: Schwindel.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten.
Erkrankungen des Gastrointestinaltrakts
Häufig: Abdominalschmerzen, Diarrhö, Dyspepsie, Nausea, Erbrechen.
Erfahrungen nach der Zulassung: Pankreatitis.
Leber- und Gallenerkrankungen
Erfahrung nach der Zulassung: Leberversagen, Hepatitis, anormale Leberfunktionstests.
Erkrankungen der Nieren und Harnwege
Erfahrung nach der Zulassung: akute Nierenschädigung.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Hautausschlag.
Gelegentlich: Ekzem, Juckreiz.
Erfahrungen nach der Zulassung: toxische epidermale Nekrolyse, Stevens-Johnson-Syndrom (siehe «Warnhinweise und Vorsichtsmassnahmen»), Erythema multiforme und Alopezie (in mehreren Fällen von Alopezie wurde nach dem Absetzen von Levetiracetam eine Besserung beobachtet); Angioödem.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Myalgie.
Erfahrungen nach der Zulassung: Muskelschwäche, Rhabdomyolyse und erhöhte Kreatinphosphokinase im Blut.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Asthenie, Müdigkeit.
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Gelegentlich: Verletzungen.
Beschreibung ausgewählter unerwünschter Wirkungen
1Rhabdomyolyse und erhöhte Kreatinphosphokinase im Blut treten bei japanischen Patienten im Vergleich zu nicht-japanischen Patienten signifikant häufiger auf.
Überdosierung
Symptome
Bei Überdosierung von Levetiracetam wurden Fälle von Somnolenz, Agitiertheit, Aggression, Bewusstseinstrübung, Atemdepression und Koma beobachtet.
Massnahmen bei Überdosierung
Ein spezifisches Antidot für Levetiracetam ist nicht bekannt. Die Behandlung einer Überdosierung erfolgt symptomatisch und kann eine Hämodialyse einschliessen. Die Extraktionsrate bei Dialyse beträgt für Levetiracetam 60%, für den Metaboliten 74%.
Eigenschaften/Wirkungen
ATC-Code: N03AX14
Der Wirkstoff Levetiracetam ist ein Pyrrolidon-Derivat (das S-Enantiomer des α-Ethyl-2-oxo-1-pyrrolidin-acetamids) und ist chemisch nicht mit bekannten Antiepileptika verwandt.
Wirkungsmechanismus
Der Wirkmechanismus von Levetiracetam muss noch vollständig aufgeklärt werden, scheint sich aber von den Wirkmechanismen der bekannten antiepileptischen Arzneimittel zu unterscheiden. In vitro und in vivo Experimente deuten darauf hin, dass Levetiracetam grundlegende Zellfunktionen und die normale Neurotransmission nicht verändert.
In vitro Studien zeigen, dass Levetiracetam die intraneuronalen Ca2+-Spiegel beeinflusst, indem der durch N-Typ-Kanäle vermittelte Ca2+-Strom partiell inhibiert sowie die Freisetzung von Ca2+ aus intraneuronalen Speichern vermindert wird. Weiterhin kehrt es partiell die Reduktion der GABA- und Glycin-gesteuerten Ströme um, die durch Zink und β-Carboline induziert wird. Darüber hinaus wurde in in vitro Studien gezeigt, dass Levetiracetam an eine spezifische Stelle im Hirngewebe von Nagern bindet. Bei dieser Bindungsstelle handelt es sich um das synaptische Vesikelprotein 2A, von dem angenommen wird, dass es an der Vesikelfusion und der Exozytose von Neurotransmittern beteiligt ist.
Levetiracetam und verwandte Analoga weisen bei der Bindungsaffinität zum synaptischen Vesikelprotein 2A eine Rangfolge auf, die im audiogenen Epilepsie-Modell an der Maus mit der Potenz ihres antikonvulsiven Schutzes korreliert ist. Dieser Befund weist darauf hin, dass die Interaktion zwischen Levetiracetam und dem synaptischen Vesikelprotein 2A zu dem antiepileptischen Wirkmechanismus der Substanz beizutragen scheint.
Pharmakodynamik
Levetiracetam ist in den klassischen Screening-Modellen für Antikonvulsiva nicht aktiv. Levetiracetam gewährt aber in einer Vielzahl von Tiermodellen für partielle und primär generalisierte Anfälle einen starken Anfallsschutz, verbunden mit einem ungewöhnlich hohen Sicherheitsabstand zwischen therapeutischen Dosen und den Dosen, bei denen Nebenwirkungen ausgelöst werden können.
Klinische Wirksamkeit
Zusatzbehandlung partieller Anfälle mit und ohne sekundäre Generalisierung bei Erwachsenen, Jugendlichen, Kindern und voll ausgereiften Säuglingen ab 1 Monat mit Epilepsie
Die therapeutische Wirksamkeit und Sicherheit von Levetiracetam wurde bei über 3'000 Patienten und Probanden untersucht. Der grundlegende Nachweis der Wirksamkeit wurde durch drei randomisierte placebokontrollierte Studien mit insgesamt 904 erwachsenen Patienten erbracht. Die Studienteilnehmer waren Patienten mit refraktärer Epilepsie, bei denen Anfälle mit oder ohne sekundäre Generalisierung auftraten, obwohl sie auf ein stabiles Dosisschema von maximal zwei Standard – Antiepileptika eingestellt waren. In diesem Patientenkollektiv wurde ein klinisch relevanter Nutzen von Levetiracetam nachgewiesen. Levetiracetam als Zusatzbehandlung in Tagesdosen von 1000 bis 3000 mg konnte die Anfallshäufigkeit bei Patienten mit refraktärer partieller Epilepsie im Vergleich zu Placebo signifikant verringern. Die Verringerung der Anfallshäufigkeit betrug zwischen 17% und 40% gegenüber dem Ausgangswert verglichen mit 6%–7% bei Placebo. Die Ansprechrate in der aktiven Gruppe lag zwischen 22% und 42% (Placebo: 10%–16%).
Bei pädiatrischen Patienten (1 Monat bis unter 4 Jahren) wurde die Wirksamkeit von Levetiracetam in einer doppelblinden, placebokontrollierten Studie mit 116 Patienten und einer Behandlungsdauer von 5 Tagen nachgewiesen. In dieser Studie erhielten die Patienten in Übereinstimmung mit ihrer altersabhängigen Dosierungsempfehlung eine Tagesdosis von 20 mg/kg, 25 mg/kg, 40 mg/kg oder 50 mg/kg der Lösung zum Einnehmen. In dieser Studie wurde bei Säuglingen ab 1 Monat bis unter 6 Monaten eine Dosis von 20 mg/kg/Tag, die auf 40 mg/kg/Tag gesteigert wurde, verwendet. Bei Säuglingen und Kleinkindern ab 6 Monaten bis unter 4 Jahren wurde eine Dosis von 25 mg/kg/Tag, die bis auf 50 mg/kg/Tag gesteigert wurde, verwendet. Die Tagesgesamtdosis wurdeauf zwei Einzelgaben aufgeteilt.
Die primäre Wirksamkeitsvariable war der prozentuale Anteil der Patienten, bei denen sich die Frequenz der täglichen partiellen Anfälle im Vergleich zum Ausgangswert um mindestens 50%reduzierte. Dies wurde durch einen verblindeten, zentralen Befunder auf der Basis von 48-Stunden Video-EEGs ausgewertet. Die Bewertung der Wirksamkeit basierte auf den 24-Stunden Video-EEGs von 109 Patienten, die zu Beginn und zu den Beobachtungszeitpunkten aufgezeichnet wurden. 43,6% der mit Levetiracetam behandelten Patienten und 19,6% der Patienten, die Placebo erhielten, sprachen auf die Behandlung an. Die Ergebnisse sind konsistent über die verschiedenen Altersgruppen hinweg einheitlich. Wurde die Behandlung über einen längeren Zeitraum weitergeführt, waren 8,6% der Patienten für mindestens 6 Monate und 7,8% der Patienten für mindestens 1 Jahr anfallsfrei.
Bei Kindern und Jugendlichen (4 bis 16 Jahre) wurde die Wirksamkeit von Levetiracetam in einer doppelblinden, placebokontrollierten Studie mit 198 Patienten und einer Behandlungsdauer von 14 Wochen untersucht. In dieser Studie erhielten die Patienten Levetiracetam in einer festen Dosierung von 60mg/kg/Tag (aufgeteilt auf 2Einzelgaben).
Bei 44,6% der mit Levetiracetam und bei 19,6% der mit Placebo behandelten Patienten war die Häufigkeit der partiellen Anfälle pro Woche im Vergleich zur Baseline um 50% oder mehr reduziert. Bei fortgesetzter Langzeitbehandlung waren 11,4% der Patienten für mindestens 6 Monate und 7,2% für mindestens 1 Jahr anfallsfrei.
Zusatzbehandlung myoklonischer Anfälle bei Erwachsenen und Jugendlichen ab 12 Jahren mit juveniler myoklonischer Epilepsie
Die Wirksamkeit von Levetiracetam wurde in einer doppelblinden, placebokontrollierten Studie mit einer Dauer von 16 Wochen bei Patienten ab 12 Jahren, die an verschiedenen Syndromen idiopathischer generalisierter Epilepsie mit myoklonischen Anfällen litten, nachgewiesen. Die Mehrzahl der Patienten hatte juvenile myoklonische Epilepsie. In dieser Studie betrug die Levetiracetam-Dosis 3000 mg/Tag, die auf zwei Einzelgaben aufgeteilt wurde. Bei 58,3% der mit Levetiracetam und bei 23,3% der mit Placebo behandelten Patienten reduzierten sich die Tage mit myoklonischen Anfällen pro Woche um mindestens 50%. Bei fortgesetzter Langzeitbehandlung waren 28,6% der Patienten für mindestens 6 Monate und 21,0% der Patienten für mindestens 1 Jahr frei von myoklonischen Anfällen.
Zusatzbehandlung von primär generalisierten tonisch-klonischen Anfällen bei Erwachsenen und Jugendlichen ab 12 Jahren mit idiopathischer generalisierter Epilepsie
Die Wirksamkeit von Levetiracetam wurde in einer 24-wöchigen, doppelblinden, placebokontrollierten Studie untersucht, welche erwachsene Patienten, Jugendliche und eine limitierte Anzahl Kinder einschloss, die an verschiedenen Syndromen idiopathischer generalisierter Epilepsie und primär generalisierten tonisch-klonischen (PGTK) Anfällen (juvenile myoklonische Epilepsie, juvenile Absencen-Epilepsie, kindliche Absencen-Epilepsie oder Epilepsie mit Aufwach-Grand-Mal-Anfällen) litten.
In dieser Studie wurden Erwachsene und Jugendliche mit 3000 mg/Tag und Kinder mit 60 mg/kg/Tag behandelt. Das Arzneimittel wurde aufgeteilt auf zwei geteilt, gleich grosse tägliche Gaben verabreicht. Bei 72,2% der mit Levetiracetam behandelten Patienten und 45,2% der mit Placebo behandelten Patienten zeigte sich eine 50%ige oder höhere Reduktion der PGTK Anfälle pro Woche.
Mit einer weitergeführten Langzeitbehandlung waren 47,4% der Patienten für mindestens sechs Monate und 31,5% für mindestens ein Jahr frei von tonisch-klonischen Anfällen.
Monotherapie partieller Anfälle mit und ohne sekundäre Generalisierung bei Patienten ab 16 Jahren mit Epilepsie
Die Wirksamkeit von Levetiracetam als Monotherapie wurde in einer Nicht-Unterlegenheits-Studie im Vergleich zu kontrolliert freigesetztem (controlled release, CR) Carbamazepin in einem doppelblindem Parallelgruppen-Design bei 576 Patienten ab 16 Jahren mit neu oder kürzlich diagnostizierter Epilepsie nachgewiesen. Die Patienten mussten entweder nicht-provozierte partielle Anfälle oder generalisierte tonisch-klonische Anfälle aufweisen. Die Patienten wurden auf 400–1200 mg Carbamazepin CR/Tag oder auf 1000–3000 mg Levetiracetam/Tag randomisiert. Die Dauer der Behandlung betrug je nach Ansprechen bis zu 121 Wochen. Bei 73,0% der mit Levetiracetam und bei 72,8% der mit Carbamazepin CR behandelten Patienten wurde eine Anfallsfreiheit von 6 Monaten erreicht; der berechnete absolute Unterschied zwischen den Behandlungen betrug 0,2% (95% KI: –7,8; 8,2). Mehr als die Hälfte der Patienten blieb 12 Monate lang anfallsfrei (56,6% der mit Levetiracetam bzw. 58,5% der mit Carbamazepin CR behandelten Patienten).
Konversion zur Monotherapie
Bei 36 von 69 erwachsenen Patienten (52%) mit fokaler Epilepsie, die erfolgreich auf eine Zusatztherapie mit Levetiracetam angesprochen hatten, war dieser Effekt auch nach Umstellung auf eine Levetiracetam-Monotherapie über 12 Wochen nachweisbar.
Pharmakokinetik
Das pharmakokinetische Profil zeichnet sich durch Dosislinearität verbunden mit einer geringen intra- und interindividuellen Variabilität aus. Die Clearance verändert sich nach wiederholter Anwendung nicht. Es gibt keinen Hinweis auf relevante geschlechts- oder ethnienspezifische Unterschiede oder zirkadiane Schwankungen. Das pharmakokinetische Profil bei gesunden Probanden und bei Patienten mit Epilepsie ist vergleichbar.
Aufgrund der vollständigen und linearen Resorption von Levetiracetam ist es möglich, die Plasmaspiegel anhand der verabreichten oralen Dosis (mg/kg Körpergewicht) vorherzusagen. Es ist daher nicht notwendig, die Plasmaspiegel von Levetiracetam zu überwachen.
Erwachsene (≥18 Jahre) und Jugendliche (12–17 Jahre)
Absorption
Levetiracetam wird nach oraler Gabe rasch resorbiert, maximale Plasmakonzentrationen (Cmax) werden ca. 1,3 Stunden nach der Einnahme erzielt. Die orale absolute Bioverfügbarkeit beträgt nahezu 100%. Bei einer zweimal täglichen Gabe wird die Steady-State-Konzentration nach 2 Tagen erreicht. Die maximalen Plasmakonzentrationen (Cmax) betragen etwa 31 bzw. 43 µg/ml nach einer Einmalgabe von 1000 mg bzw. nach der wiederholten Gabe von 1000 mg zweimal täglich. Das Ausmass der Resorption wird durch Nahrungsmittel nicht beeinflusst.
Distribution
Weder Levetiracetam noch sein Hauptmetabolit werden signifikant an Plasmaproteine gebunden (<10%). Das Verteilungsvolumen von Levetiracetam beträgt annähernd 0,5–0,7 l/kg; ein Wert, der nahe am Volumen der intra- und extrazellulären Flüssigkeit liegt.
Es konnte eine signifikante Korrelation zwischen Speichel- und Plasmakonzentrationen aufgezeigt werden (das Verhältnis von Speichel- zu Plasmakonzentration war zwischen 1 und 1,6).
Metabolismus
Der Hauptmetabolisierungsweg ist die enzymatische Hydrolyse der Acetamidgruppe von Levetiracetam (24% der Dosis) zum inaktiven Metaboliten. Bei der Bildung dieses Metaboliten sind Isoformen des Cytochrom P450-Systems der Leber nicht beteiligt.
Die Hydrolyse der Acetamidgruppe erfolgt in verschiedenen Geweben und im Vollblut, dagegen nicht im Plasma. Weiterhin wurden zwei Nebenmetaboliten identifiziert. Der eine entsteht durch Hydroxylierung des Pyrrolidinrings (1,6% der Dosis), der andere durch Öffnung des Pyrrolidinrings (0,9% der Dosis). Weitere, nicht-identifizierte Abbauprodukte haben einen Anteil von 0,6% der Dosis.
Weder für Levetiracetam noch für seinen inaktiven Hauptmetaboliten wurde in vivo eine Umwandlung der Enantiomere ineinander festgestellt.
Elimination
Die Plasmahalbwertszeit beträgt 7,2 Stunden. Die Gesamtkörperclearance beträgt im Mittel 0,96 ml/min/kg.
Die Ausscheidung erfolgt mit ca. 95% der Dosis hauptsächlich über den Urin. Lediglich 0,3% der Dosis werden mit den Faeces ausgeschieden. Die kumulierte renale Ausscheidung von Levetiracetam und seinem Hauptmetaboliten innerhalb der ersten 48 Stunden liegt bei 66% bzw. 24% der verabreichten Dosis. Die renale Clearance von Levetiracetam und dem Metaboliten beträgt 0,6 bzw. 4,2 ml/min/kg. Diese Werte deuten darauf hin, dass Levetiracetam über glomeruläre Filtration ausgeschieden wird und anschliessend tubulär rückresorbiert wird, während der Hauptmetabolit glomerulär filtriert und zusätzlich noch aktiv tubulär sezerniert wird. Die Elimination von Levetiracetam korreliert mit der Kreatinin-Clearance.
Kinetik spezieller Patientengruppen
Ältere Patienten
Die Halbwertszeit von Levetiracetam verlängert sich bei älteren Patienten um etwa 40% auf 10–11 Stunden. Dies hängt mit der verminderten Nierenfunktion bei dieser Personengruppe zusammen (siehe «Dosierung/Anwendung»).
Kinder (4–12 Jahre)
Nach Verabreichung einer Einzeldosis von 20 mg/kg an Kinder mit Epilepsie (6–12 Jahre) beträgt die Halbwertszeit von Levetiracetam 6,0 Stunden. Die Gesamtkörperclearance ist um etwa 30% höher als bei erwachsenen Epileptikern.
Nach wiederholter oraler Verabreichung (20 bis 60 mg/kg/Tag) wurde Levetiracetam bei Kindern mit Epilepsie (4 bis 12 Jahre) rasch absorbiert. Maximale Plasmakonzentrationen wurden 0,5–1,0 Stunden nach der Einnahme beobachtet. Die Eliminationshalbwertszeit liegt bei ungefähr 5 Stunden. Die Gesamtkörperclearance beträgt 1,1 ml/min/kg.
Voll ausgetragene Säuglinge und Kinder (1 Monat bis unter 4 Jahre)
Nach Anwendung einer Einzeldosis (20 mg/kg) einer 100 mg/ml Lösung zum Einnehmen bei Kindern mit Epilepsie (1 Monat bis 4 Jahre) wurde Levetiracetam schnell resorbiert. Maximale Plasmakonzentrationen wurden etwa 1 Stunde nach der Dosisgabe beobachtet. Die pharmakokinetischen Ergebnisse weisen darauf hin, dass die Halbwertszeit kürzer (5,3 h) als bei Erwachsenen (7,2 h) und die scheinbare Clearance schneller (1,5 ml/min/kg) als bei Erwachsenen (0,96 ml/min/kg) war.
In populationspharmakokinetischen Untersuchungen bei Patienten ab 1 Monat bis zu 16 Jahren korrelierte das Körpergewicht signifikant mit der scheinbaren Körperclearance (die Clearance wurde mit zunehmendem Körpergewicht grösser) und dem scheinbaren Verteilungsvolumen. Das Alter hatte ebenfalls Einfluss auf beide Parameter. Dieser Effekt war besonders ausgeprägt bei Säuglingen, liess mit zunehmendem Alter nach und wurde vernachlässigbar ab dem Alter von ungefähr 4 Jahren.
In beiden populationspharmakokinetischen Untersuchungen wurde eine 20%ige Steigerung der scheinbaren Körperclearance von Levetiracetam beobachtet, wenn es zusammen mit einem enzym-induzierenden Antiepileptikum verabreicht wurde.
Patienten mit eingeschränkter Nierenfunktion
Die Gesamtkörperclearance von Levetiracetam und seinem Hauptmetaboliten korreliert mit der Kreatinin-Clearance. Es wird daher empfohlen, die tägliche Erhaltungsdosis von Levetiracetam DESITIN entsprechend der Kreatinin-Clearance bei Patienten mit mässiger bis schwerer Nierenfunktionsstörung anzupassen (siehe «Dosierung/Anwendung»).
Bei anurischen erwachsenen Patienten mit Nierenerkrankungen im Endstadium beträgt die Halbwertszeit ca. 25 Stunden zwischen zwei Dialysevorgängen bzw. 3,1 Stunden während der Dialyse. Während einer typischen, 4-stündigen Dialyse werden 51% der Levetiracetam-Dosis aus dem Plasma entfernt.
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit leichter bis mässiger Beeinträchtigung der Leberfunktion ist die Clearance von Levetiracetam nur unwesentlich verändert. Dagegen ist bei den meisten Patienten mit schwerer Leberfunktionsstörung aufgrund einer gleichzeitig vorliegenden Beeinträchtigung der Nierenfunktion die Clearance von Levetiracetam um mehr als 50% herabgesetzt (siehe «Dosierung/Anwendung»).
Präklinische Daten
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Genotoxizität und zum kanzerogenen Potential lassen die präklinischen Daten kein besonderes Risiko für den Menschen erkennen. Studien an Mäusen und Ratten ergaben kein karzinogenes Potential von Levetiracetam.
Nebenwirkungen, die bei Ratten und in geringerem Ausmass auch bei Mäusen nach Exposition im humantherapeutischen Bereich auftraten, und nicht in klinischen Studien beobachtet wurden, jedoch als möglicherweise relevant für die klinische Anwendung zu bewerten sind, waren Leberveränderungen, die auf eine adaptive Reaktion hinweisen, wie z.B. erhöhtes Lebergewicht, zentrolobuläre Hypertrophie, Fettinfiltration und erhöhte Leberenzyme im Plasma.
In reproduktionstoxikologischen Studien an der Ratte, bei Wirkstoffspiegeln ähnlich oder höher denen beim Menschen, wirkte Levetiracetam toxisch auf die Entwicklung (vermehrte Skelettveränderungen/geringfügige Skelettanomalien, verzögertes Wachstum, erhöhte Sterblichkeit der Jungtiere). Beim Kaninchen wurden nach maternaltoxischen Dosierungen schädliche Wirkungen auf den Embryo beobachtet (Tod des Embryo, vermehrte Skelettanomalien und vermehrte Missbildungen). Der Wirkstoffspiegel, bei dem noch kein toxischer Effekt beim Kaninchen beobachtet wurde, betrug etwa das 4- bis 5-Fache des Wirkstoffspiegels beim Menschen.
Studien mit neonatalen und juvenilen Ratten und Hunden zeigten keine für den Menschen relevanten Wirkungen auf irgendeinen der Entwicklungs- oder Reifungsendpunkte bei Dosen bis zu 1800 mg/kg/Tag. Die Exposition bei den Tieren lag deutlich über der Exposition, die beim Menschen nach maximal empfohlener Dosierung zu finden ist.
Sonstige Hinweise
Beeinflussung diagnostischer Methoden
Es ist keine Beeinflussung von diagnostischen Methoden durch Levetiracetam bekannt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «Verwendbar bis» bezeichneten Datum verwendet werden. Nach Anbruch die Lösung innerhalb von 4 Monaten aufbrauchen.
Besondere Lagerungshinweise
Minipacks mit Mini-Filmtabletten:
Bei 15-30 °C sowie in der Originalpackung aufbewahren und für Kinder unzugänglich aufbewahren.
Lösung:
Bei 15-30 °C sowie in der Originalpackung aufbewahren und für Kinder unzugänglich aufbewahren.
Zulassungsnummer
62069, 61848 (Swissmedic).
Zulassungsinhaberin
Desitin Pharma GmbH, 4410 Liestal
Stand der Information
Dezember 2018
Composition
Principe actif: Lévétiracétam
Minipacks de mini-comprimés pelliculés:
Excipients
Povidone K30, cellulose microcristalline, silice colloïdale anhydre, stéarate de magnésium [d'origine végétale], poly(alcool vinylique), dioxyde de titane (E171), macrogol 3350, talc
Solution:
Excipients
Acide citrique monohydraté, hydroxyde de sodium, eau purifiée, acésulfame potassique (E 950), arôme de raisins, conservateurs: parahydroxybenzoate de méthyle (E 218), parahydroxybenzoate de propyle (E 16)
Forme galénique et quantité de principe actif par unité
1 minipack de mini-comprimés pelliculés contient 250, 500 ou 1000 mg de lévétiracétam.
Solution à 100 mg/ml de lévétiracétam; flacon de 300 ml
Indications/Possibilités d’emploi
Levetiracetam DESITIN est indiqué en monothérapie dans le traitement des crises partielles avec ou sans généralisation secondaire chez les patients dès 16 ans atteints d'épilepsie.
Levetiracetam DESITIN est indiqué en traitement adjuvant des crises partielles avec ou sans généralisation secondaire chez les adultes, les enfants et les nourrissons nés à terme à partir de 1 mois atteints d'épilepsie.
Levetiracetam DESITIN est indiqué en association dans le traitement des crises myocloniques de l'adulte et de l'adolescent à partir de 12 ans présentant une épilepsie juvénile myoclonique.
Levetiracetam DESITIN est indiqué en association dans le traitement des crises généralisées tonico-cloniques primaires de l'adulte et de l'adolescent à partir de 12 ans présentant une épilepsie généralisée idiopathique.
Posologie/Mode d’emploi
Les mini-comprimés pelliculés doivent être avalés sans être mâchés avec suffisamment de liquide (p.ex. un verre d'eau). La solution peut être prise non diluée ou diluée dans un verre d'eau. La dose journalière est à fractionner en deux doses égales. Levetiracetam DESITIN peut être pris indépendamment des repas. Lors de l'administration orale, le goût amer du lévétiracétam peut être perçu.
Veuillez suivre les instructions suivantes pour la prise des minipacks Levetiracetam DESITIN:
| 1. Prendre le sachet au-dessus de la marque (flèche) et secouer son contenu vers le bas. |
| 2. Déchirer ou découper à la marque (flèche) la partie supérieure du sachet. |
| 3. Verser le contenu dans la bouche, l'avaler sans le mâcher avec un peu de liquide et boire encore. |
Remarque: après suspension dans l'eau, les mini-comprimés pelliculés peuvent être administrés par une sonde. Pour ce mode d'administration, la suspension doit être faite extemporanément.
Utilisation de la seringue doseuse de Levetiracetam DESITIN solution
Emploi du set de médicaments
Le set de médicaments se compose de cinq parties: | |
| 1. Deux adaptateurs à seringue, l'un pour la seringue doseuse de 1 ml et l'autre pour la seringue doseuse de 10 ml. L'adaptateur à seringue correspondant doit être fermement inséré dans l'ouverture du flacon. L'adaptateur reste toujours dans le flacon. |
| 2. Un flacon fermé par un bouchon avec une sécurité enfant et contenant 300 ml du médicament. Le flacon doit toujours être refermé après utilisation. |
| 3. Une seringue doseuse de 1 ml pour des dosages allant jusqu'à 250 mg et une seringue doseuse de 10 ml pour des dosages de plus de 250 mg qui s'adaptent dans l'adaptateur à seringue en plastique correspondant. Prélevez à l'aide de la seringue doseuse correspondante la quantité de solution prescrite. |
Préparation à la première utilisation de l'adaptateur à seringue en plastique et du flacon neuf
1. Le bouchon avec la sécurité enfant est retiré en le pressant fermement vers le bas et en le tournant dans le sens inverse des aiguilles d'une montre (tel que représenté sur le bouchon). | |
| 2. Le flacon ouvert est à poser verticalement sur une table et l'adaptateur en plastique est à presser fermement aussi loin que possible dans le col du flacon. Remarque: il est possible que l'adaptateur ne se laisse pas complètement pousser à l'intérieur dans l'immédiat, mais ce sera le cas en revissant la fermeture du flacon. |
Prise d'une dose médicamenteuse
Le médicament peut être avalé directement à partir de la seringue doseuse ou dissous dans un verre d'eau. | |
1. Le flacon s'ouvre en pressant et en tournant le bouchon avec la sécurité enfant (toujours refermer le flacon après utilisation.) | |
| 2. Vérifier que le piston est inséré jusqu'au fond du tube de la seringue. 3. Le flacon étant en position verticale, insérer fermement la pointe de la seringue doseuse dans l'ouverture de l'adaptateur en plastique. |
| 4. Maintenir le flacon en position verticale et le retourner avec précaution. 5. Faire coulisser lentement le piston vers le bas afin que la seringue se remplisse du médicament. Le pousser à nouveau jusqu'au fond de la seringue afin d'éliminer d'éventuelles grosses bulles d'air qui s'y trouveraient. |
| 6. Prélèvement de la dose prescrite: faire coulisser lentement le piston de la seringue vers le bas jusqu'à ce que le début de la partie épaisse du piston se trouve à la hauteur de la graduation correspondant à la dose prescrite (en ml). Remarque: Une dose supérieure à 1 ml et jusqu'à 2,5 ml sera prélevée en plusieurs fois avec la seringue doseuse de 1 ml. -Remplissage de la seringue jusqu'à la graduation de 1 ml puis prise de cette dose de 1 ml. -En fonction de la dose prescrite, il se peut que vous deviez recommencer cette étape. -Nouveau remplissage de la seringue doseuse pour obtenir la dose nécessaire et prise de cette quantité restante. Une dose supérieure à 10 ml est à prélever en deux fois avec la seringue doseuse de 10 ml: - Remplissage de la seringue jusqu'à la graduation de 10 ml et prise de cette dose, - Nouveau remplissage de la seringue doseuse pour obtenir la dose nécessaire et prise de cette quantité restante. |
| 7. Retourner à nouveau le flacon précautionneusement. Retirer doucement la seringue doseuse hors de l'adaptateur. |
| 8. La dose médicamenteuse peut être avalée directement à partir de la seringue doseuse. Le patient doit être en position assise et le piston doit être poussé lentement vers le bas afin de permettre la déglutition. La dose peut également être mélangée en remuant dans un verre d'eau immédiatement avant d'être avalée d'un trait. 9. Revissage sur le flacon du bouchon avec la sécurité enfant. L'adaptateur reste en place dans le flacon. 10. Nettoyage: après utilisation, essuyer le côté extérieur de la seringue doseuse à l'aide d'un morceau de tissu propre et sec. |
Forme galénique | Teneur de la dose | Limites d'âge recommandées |
Levetiracetam DESITIN Levetiracetam DESITIN | 100 mg/ml 250 mg | Adultes, enfants et nourrissons nés à terme à partir de 1 mois |
Levetiracetam DESITIN | 500 mg | Adultes et enfants dès 10 ans |
Levetiracetam DESITIN | 1000 mg | Adultes et enfants dès 12 ans |
Monothérapie
Adultes et adolescents dès 16 ans
Le traitement devrait commencer par 2× 250 mg/jour et la posologie sera augmentée à 2× 500 mg/jour après 2 semaines. En fonction de la réponse clinique, la dose peut être augmentée par paliers de 2× 250 mg/jour toutes les 2 semaines jusqu'à un maximum de 2× 1500 mg/jour.
Enfants et adolescents de <16 ans
En l'absence de données, l'utilisation de lévétiracétam en monothérapie chez les enfants et adolescents de <16 ans ne peut être recommandée.
Traitement adjuvant
Chez les adultes (≥18 ans) et les adolescents (12 à 17 ans) dès 40 kg
La dose thérapeutique journalière en traitement adjuvant est de 1000 mg/jour (500 mg deux fois par jour). On peut commencer dès le premier jour de traitement avec cette posologie. Selon la réponse clinique et la tolérance, la dose journalière peut être augmentée jusqu'à 3000 mg. Les augmentations ou diminutions de la posologie peuvent s'effectuer toutes les 2-4 semaines par paliers de 1000 mg.
Instructions spéciales pour la posologie
Nourrissons, enfants et adolescents
Chez les nourrissons et les enfants, il convient d'initier le traitement avec Levetiracetam DESITIN Solution.
Nourrissons nés à terme à partir de 1 mois jusqu'à moins de 6 mois
La dose thérapeutique initiale est de 7 mg/kg 2 fois par jour.
En fonction de la réponse clinique et de la tolérance, la dose peut être augmentée jusqu'à 21 mg/kg 2 fois par jour. Les augmentations ou diminutions de doses ne doivent pas dépasser 7 mg/kg 2 fois par jour toutes les 2 semaines. La dose minimale efficace doit être utilisée.
Le traitement chez le nourrisson doit être initié avec Levetiracetam DESITIN Solution.
Recommandations posologiques chez le nourrisson de moins de 6 mois
Poids | Dose initiale: 7 mg/kg 2×/jour | Dose maximale: 21 mg/kg 2×/jour |
4 kg | 28 mg (0,3 ml) 2×/jour | 84 mg (0,85 ml) 2×/jour |
5 kg | 35 mg (0,35 ml) 2×/jour | 105 mg (1,05 ml) 2×/jour |
7 kg | 49 mg (0,5 ml) 2×/jour | 147 mg (1,5 ml) 2×/jour |
Nourrissons et enfants en bas âge de 6 à 23 mois, enfants de 2 à 11 ans et adolescents de 12 à 17 ans pesant moins de 40 kg
Chez les enfants, il convient d'initier le traitement avec Levetiracetam DESITIN Solution.
Chez les enfants, la posologie thérapeutique initiale est de 10 mg/kg de poids corporel deux fois par jour.
Selon l'amélioration clinique et la tolérance, la posologie peut être augmentée jusqu'à 30 mg/kg deux fois par jour. Les augmentations ou diminutions de la posologie peuvent s'effectuer toutes les 2-4 semaines par paliers de 10 mg/kg deux fois par jour. La dose minimale efficace doit être utilisée.
Les enfants et les adolescents de 40≥ kg sont traités avec la même posologie que les adultes.
Recommandations posologiques chez le nourrisson à partir de 6 mois, l'enfant et l'adolescent:
Poids | Dose initiale: 10 mg/kg deux fois par jour | Dose maximale: 30 mg/kg deux fois par jour |
6 kg1 | 60 mg (0,6 ml) deux fois par jour | 180 mg (1,8 ml) deux fois par jour |
10 kg1 | 100 mg (1 ml) deux fois par jour | 300 mg (3 ml) deux fois par jour |
15 kg1 | 150 mg (1,5 ml) deux fois par jour | 450 mg (4,5 ml) deux fois par jour |
20 kg1 | 200 mg (2 ml) deux fois par jour | 600 mg (6 ml) deux fois par jour |
25 kg | 250 mg deux fois par jour | 750 mg deux fois par jour |
Plus de 40 kg2 | 500 mg deux fois par jour | 1500 mg deux fois par jour |
1Les enfants de 20 kg ou moins doivent de préférence commencer le traitement par Levetiracetam Desitin 100 mg/ml solution buvable.
2La posologie chez l'enfant et l'adolescent de 40 kg ou plus est la même que chez l'adulte.
Un conditionnement de Levetiracetam Desitin Solution est disponible:
– Un flacon de 300 ml avec une seringue doseuse de 1 ml graduée tous les 0,05 ml (correspondant à 5 mg) ainsi qu'avec une seringue doseuse de 10 ml graduée tous les 0,25 ml (correspondant à 25 mg). Afin d'assurer la précision du dosage, la seringue doseuse de 1 ml doit être utilisée chez les nourrissons à partir de 1 mois et jusqu'à moins de 6 mois.
Patients âgés (à partir de 65 ans)
Chez les patients âgés, une adaptation posologique en fonction de la clairance de la créatinine est recommandée (voir «Insuffisance rénale»).
Insuffisance rénale
Chez l'adulte, la posologie journalière (dose d'entretien) de Levetiracetam DESITIN doit être fixée individuellement selon la fonction rénale.
Lors de l'utilisation du tableau ci-dessous, il est nécessaire d'évaluer la clairance de la créatinine (ClCr) du patient en ml/min. Celle-ci peut être estimée en dosant le taux de créatinine sérique (mg/dl) et en appliquant la formule suivante:
ClCr (ml/min) = [(140-âge (ans)) × poids (kg)]: [72 × créatinine sérique (mg/dl)] (× 0,85 pour les femmes).
Ensuite, la ClCr est adaptée à la surface corporelle (Sc) comme suit:
ClCr (ml/min/1,73 m²) = ClCr (ml/min): Sc patient (m²) × 1,73.
Adaptation posologique chez l'adulte et l'adolescent atteints d'insuffisance rénale, pesant plus de 50 kg:
Fonction rénale | Clairance de la créatinine (ml/min/1,73 m²) | Dose d'entretien et fréquence de prises |
Normale | >80 | 500–1500 mg deux fois par jour |
Insuffisance légère | 50–79 | 500–1000 mg deux fois par jour |
Insuffisance modérée | 30–49 | 250–750 mg deux fois par jour |
Insuffisance sévère | <30 | 250–500 mg deux fois par jour |
Patients devant être dialysés* | – | 500–1000 mg une fois par jour ** |
* Au premier jour de traitement par lévétiracétam, une dose initiale de 750 mg est recommandée.
** Après dialyse, une dose supplémentaire de 250-500 mg est recommandée.
Bien que l'étude n'ait été effectuée que chez des insuffisants rénaux adultes, la dose de lévétiracétam devrait être également adaptée à la fonction rénale chez les nourrissons, enfants et adolescents atteints d'insuffisance rénale.
La Clcr en ml/min/1,73 m² peut être déterminée à partir de la créatinine sérique (mg/dl) chez l'adolescent, l'enfant et le nourrisson, en utilisant la formule suivante (formule de Schwartz):
Clcr (ml/min/1,73 m²) = Taille (cm) × ks: Créatinine sérique (mg/dl).
ks = 0,45 chez le nourrisson né à terme et jusqu'à 1 an; ks = 0,55 chez l'enfant de moins de 13 ans et l'adolescente; ks = 0,7 chez l'adolescent.
Ajustement posologique chez le nourrisson, l'enfant et l'adolescent, atteints d'insuffisance rénale, pesant moins de 50 kg:
Groupe | Clairance de la créatinine | Dose et fréquence de prise | |||
Nourrissons de 1 mois à moins de 6 mois | Nourrissons et enfants en bas âge de 6 à 23 mois, Enfants et adolescents pesant moins de 50 kg | ||||
Normal | >80 | 7 à 21 mg/kg (0,07 à 0,21 ml/kg) deux fois par jour | 10 à 30 mg/kg (0,1 à 0,3 ml/kg) deux fois par jour | ||
Légère | 50–79 | 7 à 14 mg/kg (0,07 à 0,14 ml/kg) deux fois par jour | 10 à 20 mg/kg (0,1 à 0,2 ml/kg) deux fois par jour | ||
Modérée | 30–49 | 3,5 à 10,5 mg/kg (0,035 à 0,105 ml/kg) deux fois par jour | 5 à 15 mg/kg (0,05 à 0,15 ml/kg) deux fois par jour | ||
Sévère | <30 | 3,5 à 7 mg/kg (0,035 à 0,07 ml/kg) deux fois par jour | 5 à 10 mg/kg (0,05 à 0,1 ml/kg) deux fois par jour | ||
Patients sous dialyse* | – | 7 à 14 mg/kg (0,07 à 0,14 ml/kg) une fois par jour1, 3 | 10 à 20 mg/kg (0,1 à 0,2 ml/kg) une fois par jour 2, 4 | ||
1 Une dose initiale de 10,5 mg/kg (0,105 ml/kg) est recommandée le premier jour du traitement par le lévétiracétam.
2 Une dose initiale de 15 mg/kg (0,15 ml/kg) est recommandée le premier jour du traitement par le lévétiracétam.
3Après la dialyse, une dose supplémentaire de 3,5 à 7 mg/kg (0,035 à 0,07 ml/kg) est recommandée.
4Après la dialyse, une dose supplémentaire de 5 à 10 mg/kg (0,05 à 0,10 ml/kg) est recommandée.
Insuffisance hépatique
Chez les patients atteints d'insuffisance hépatique légère à modérée, une adaptation posologique n'est pas nécessaire. En cas d'insuffisance hépatique sévère, la clairance de la créatinine peut induire une fausse estimation du degré d'insuffisance rénale.
C'est pourquoi il est recommandé de diminuer de moitié la dose d'entretien quotidienne lorsque la clairance de la créatinine est inférieure à 60 ml/min/1,73 m2.
Arrêt du traitement
Conformément à la pratique clinique usuelle, l'arrêt éventuel du traitement par Levetiracetam DESITIN doit être réalisé de manière progressive (voir «Posologie/Mode d'emploi»).
Contre-indications
Hypersensibilité à l'égard du lévétiracétam, de substances apparentées ou de l'un des excipients.
Mises en garde et précautions
Nourrissons, enfants et adolescents
Les données existantes concernant les enfants ne laissent supposer aucune influence sur la croissance et la puberté. Cependant, les effets à long terme sur l'apprentissage, l'intelligence, la croissance, les fonctions endocriniennes, la puberté et la procréation sont inconnus s'agissant d'enfants.
La sécurité et l'efficacité du lévétiracétam n'ont pas été complètement établies chez le nourrisson âgé de moins d'un an. Seulement 35 nourrissons de moins de 1 an ont été étudiés au cours des essais cliniques, parmi lesquels13 étaient âgés de moins de 6 mois.
La sécurité et l'efficacité du lévétiracétam n'ont pas été étudiées chez les nourrissons de moins de 1 mois.
Les nourrissons prématurés ne doivent pas déjà être traités à partir de 1 mois, car leur maturation rénale n'est pas encore achevée à ce stade et l'élimination rénale du lévétiracétam n'est par conséquent pas garantie.
Fréquence des crises
Une augmentation de plus de 25% de la fréquence des crises a été rapportée chez 14% des patients adultes et pédiatriques (4 à 16 ans) atteints de crises partielles traités par lévétiracétam et chez 26% des patients adulte et 21% des patients pédiatriques sous placebo.
Absences
Quand Levetiracetam a été utilisé dans le traitement des crises généralisées tonico-cloniques primaires de l'adulte et de l'adolescent présentant une épilepsie généralisée idiopathique, il n'y a pas eu d'effet dans le sens d'une diminution de la fréquence des absences.
Hémogramme
Des cas de diminution du nombre de cellules sanguines (neutropénie, agranulocytose, leuecopénie, thrombocytopénie et pancytopénie) ont été décrits en rapport avec la prise de lévétiracétam et ce généralement au début du traitement. Une numération formule sanguine complète est recommandée chez les patients présentant une faiblesse significative, une pyrexie, des infections récurrentes ou des troubles de la coagulation (voir «Effets indésirables»)
Suicide
Il existe des rapports de suicides, de tentatives de suicide et de pensées suicidaires chez des patients (adultes et enfants) traités par lévétiracétam.
Les patients, leurs proches ou d'autres personnes concernées devraient dès lors être informés dans le cadre d'un entretien détaillé qu'il leur faut contacter sans délai un médecin en cas d'aggravation de l'humeur et/ou de retrait social et/ou de survenue de symptômes dépressifs et/ou d'hostilité/agressivité ou d'autres modifications du comportement ou de la personnalité, et notamment lors de l'expression de pensées suicidaires. Il faut tenir compte du fait que la suicidalité peut ne s'annoncer dans bien des cas que par des modifications du comportement. Avant le début du traitement, il convient d'investiguer la présence anamnestique de l'un des facteurs de risque suicidaire avérés, p.ex. affections psychiatriques et suicidalité, puis de peser très soigneusement le rapport bénéfice/risque, justement sous cet aspect.
Réactions cutanées graves
Des cas de réactions cutanées susceptibles d'entraîner la mort, dont le syndrome de Stevens-Johnson (SSJ) et la nécrolyse épidermique toxique (NET, ou syndrome de Lyell), ont été rapportés chez des malades (adultes et enfants) traités au lévétiracétam. Le risque de survenue d'un SSJ ou d'une NET est le plus élevé dans les premières semaines du traitement (déclenchement en moyenne entre le 14e et le 17e jour). Des cas se produisant encore après quatre mois de prise et plus tard ont cependant été observés. Il convient d'informer les patients des signes avant-coureurs et des symptômes de ces effets secondaires graves, et de les surveiller étroitement, en particulier au début du traitement, afin de détecter toute réaction cutanée. Les signes ou symptômes des syndromes d'une SSJ ou d'une NETs (tel un exanthème d'extension progressive, s'accompagnant souvent de vésicules ou de lésions des muqueuses) doivent entraîner l'abandon du traitement au lévétiracétam, sauf si l'exanthème n'est clairement pas d'origine médicamenteuse. L'évolution du SSJ et de la NET dépend très largement de la rapidité du diagnostic et de l'arrêt immédiat de tous les médicaments suspects. Plus le traitement est interrompu tôt, meilleur est le pronostic. La survenue d'un SSJ ou d'une NET provoqués par la prise de lévétiracétam interdit toute administration ultérieure de cette molécule au patientconcerné.
Réactions d'hypersensibilité à impact systémique
Les exanthèmes généralisés peuvent aussi survenir dans le cadre d'un syndrome d'hypersensibilité associé à l'un des symptômes systémiques suivants: fièvre, adénopathie, leucocytose, éosinophilie, lymphocytes atypiques, bilan hépatique ou rénal anormal, ou à d'autres symptômes évoquant un impact systémique (cf. «Effets indésirables - SHM: syndrome d'hypersensibilité médicamenteuse ou réaction médicamenteuse avec éosinophilie et symptômes systémiques [syndrome DRESS]»). Ce syndrome présente un degré de gravité clinique extrêmement variable, avec parfois une issue fatale. Il importe de tenir compte du fait que les premiers signes systémiques d'une hypersensibilité (fièvre, adénopathie par exemple) peuvent être manifestes alors qu'aucune altération cutanée n'est apparente.
Il convient d'une manière générale d'arrêter immédiatement les prises de lévétiracétam lorsque surviennent des symptômes indiquant une réaction d'hypersensibilité.
Autres éléments
Levetiracetam DESITIN 100 mg/ml Solution buvable contient des parahydroxybenzoates au titre d'agents conservateurs (méthylparabène (E 218) et propylparabène (E216) susceptibles d'entraîner des réactions allergiques (éventuellement tardives).
Interactions
Il a été démontré in vitro que le lévétiracétam et son métabolite principal n'inhibent chez l'homme ni l'activité des principales iso-enzymes du cytochrome P450 (CYP3A4, 2A6, 2C9, 2C19, 2D6, 2E1 et 1A2) ni la glucuronyltransférase (UGT1A1 et UGT1A6) ou l'époxyde hydrolase. Le lévétiracétam n'influence pas non plus la glucuronidation in vitro de l'acide valproïque et n'a exercé qu'un effet faible ou nul sur la conjugaison d'éthinylestradiol en cultures d'hépatocytes humains.
A des concentrations élevées (680 µg/ml), le lévétiracétam a provoqué une induction modérée de CYP2B6 et CYP3A4; à des concentrations de Cmax cependant, telles qu'elles s'obtiennent lors d'une administration répétée de 1500 mg deux fois par jour, ces effets ont été jugés sans importance clinique. Une interaction par inhibition ou induction enzymatique du lévétiracétam avec d'autres substances est très improbable.
Le probénécide diminue la clairance rénale du métabolite principal, mais non celle du lévétiracétam. La concentration du métabolite principal reste cependant faible. Il est possible que d'autres substances éliminées par sécrétion tubulaire active diminuent aussi la clairance rénale de ce métabolite. L'effet du lévétiracétam sur le probénécide n'a pas été étudié, et l'influence du lévétiracétam sur d'autres médicaments à sécrétion active, tels que les AINS, les sulfamidés et le méthotrexate, est inconnue.
L'administration concomitante d'autres antiépileptiques (carbamazépine, phénytoïne, acide valproïque, phénobarbital, lamotrigine, primidone et gabapentine) ne modifie pas les paramètres pharmacocinétiques du lévétiracétam et à l'inverse, le lévétiracétam n'influence pas les concentrations sériques de ces antiépileptiques.
Une évaluation rétrospective des interactions pharmacocinétiques chez des enfants et adolescents épileptiques (4-17 ans) a confirmé que le traitement adjuvant par lévétiracétam n'influence pas les taux sériques à l'état d'équilibre de la carbamazépine et du valproate administrés simultanément. Des résultats similaires ont été observés avec le topiramate et la lamotrigine. Toutefois, des antiépileptiques inducteurs enzymatiques (p.ex. carbamazépine) ont augmenté de 22%la clairance du lévétiracétam et diminué de 22% sa demi-vie. Cette observation n'a cependant pas été jugée d'importance clinique et ne nécessite pas d'adaptation posologique.
Les études pharmacocinétiques n'indiquent pas d'interactions avec la digoxine, les contraceptifs oraux (éthinylestradiol et lévonorgestrel) et la warfarine. Les paramètres endocriniens (LH et progestérone), ainsi que le temps de prothrombine ne sont pas modifiés.
Il n'y a pas de données sur une éventuelle interaction entre le lévétiracétam et l'alcool.
Grossesse/Allaitement
Femmes en âge de procréer
Les femmes en âge de procréer doivent être conseillées par un spécialiste. Il est recommandé d'utiliser une méthode de contraception sûre pendant toute la durée du traitement. Si une femme planifie une grossesse, le traitement par le lévétiracétam doit être reconsidéré. Comme avec d'autres médicaments antiépileptiques, un arrêt soudain de la prise du lévétiracétam doit être évité car cela peut provoquer des crises de sevrage et un état de mal épileptique, qui peuvent avoir de graves conséquences pour la femme et l'enfant à naître. Une monothérapie est à privilégier dans la mesure du possible, car un traitement par plusieurs médicaments antiépileptiques pourrait être asssocié – selon sa combinaison – à un risque plus élevé de malformations congénitales que la monothérapie.
Grossesse
Une forte proportion des données post-marketing sur les femmes enceintes qui ont reçu une monothérapie par le lévétiracétam (sur plus de 1800 femmes, 1500 femmes ont pris due lévétiracétam au cours du primier trimestre de la grossesse), n'indique pas d'augmentation du risque de malformations congénitales sévères. Il n'existe que peu dedonnées sur le développement neurologique chez les enfants exposés in utero à Levetiracetam DESITIN en monothérapie avec lévétiracétam DESITIN. Les études épidémiologiques actuelles (portant sur eviron 100 enfants) n'indiquent pas d'un risque de troubles ou de retards du développement neurologique.
Le lévétiracétam peut être utilisé pendant la grossesse si, après une évaluation minutieuse, il est considéré comme cliniquement nécessaire. Dans ce cas, la dose efficace la plus faible est recommandée.
Comme pour d'autres médicaments antiépileptiques, des modifications physiologiques pendant la grossesse peuvent influencer la concentration plasmatique du lévétiracétam.
Certains rapports signalent une diminution de la concentration plasmatique du lévétiracétam pendant la grossesse.
Cette diminution est nettement plus marquée au cours du troisième trimestre (jusqu'à 60% du taux initial avant le début de la grossesse).
Chez les femmes enceintes traitées par le lévétiracétam, une surveillance clinique appropriée doit être assurée.
Administration pendant l'allaitement
Le lévétiracétam est excrétédans le lait maternel. L'allaitement n'est donc pas recommandé. Cependant, si le traitement de lévétiraceétam devait être nécessaire pendant l'allaitement, il faudra évaluer les bénéfices et les risques du traitement en considérant l'importance de l'allaitement pour le nourrisson.
Fertilité
Il n'existe pas de données cliniques. Le risque potentiel pour l'être humain est inconnu.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude des effets sur l'aptitude à la conduite et l'utilisation de machines n'a été réalisée. Sur la base d'une sensibilité individuelle possible, un état de somnolence ou d'autres troubles nerveux centraux peuvent se produire chez certains patients en début de traitement ou après une augmentation de la posologie. C'est pourquoi la prudence est de rigueur lors d'activités qui exigent une bonne habileté, p.ex. la conduite d'un véhicule ou l'utilisation de machines.
Effets indésirables
Le médecin traitant devrait tenir compte du fait que les données suivantes proviennent d'études dans lesquelles le lévétiracétam était associé à d'autres antiépileptiques. C'est pourquoi l'attribution des effets indésirables observés à un médicament précis n'était pas toujours possible.
Les données de sécurité et de tolérance recueillies au cours des étudesmenées chez des patients adultes ayant des crises partielles ont montré que des effets indésirables sont survenus chez 46,4% des patients adultes du groupe lévétiracétam et 42% des patients du groupe placebo; 2,4% des patients du groupe lévétiracétam et 2,0% des patients du groupe placebo ont souffert d'effets indésirables graves.
Les effets indésirables les plus fréquents chez les patients adultes étaient la somnolence, l'asthénie et la torpeur. Une analyse d'ensemble des données de sécurité et de tolérance n'a pas montré de corrélation nette entre la dose et les effets secondaires. La fréquence et le degré de sévérité des effets indésirables sur le système nerveux central ont cependant diminué avec le temps.
Sous monothérapie lors de crises partielles, 49,8% des patients ont présenté au moins un effet indésirable. Les effets indésirables les plus fréquemment rapportés étaient la fatigue et la somnolence.
Une étude menée chez des adultes et des adolescents présentant des crises myocloniques (âgés de 12 à 65 ans) a montré que 33,3% des patients dans le groupe lévétiracétam et 30,0% des patients dans le groupe placebo ont eu des effets indésirables considérés comme liés au traitement. Les effets indésirables rapportés le plus souvent ont été des maux de tête et de la somnolence. La fréquence des effets indésirables chez des patients souffrant de crises myocloniques était plus faible que chez des adultes souffrant de crises partielles (33,3% versus 46,4%).
Une étude menée chez des adultes et des enfants (de 4 à 65 ans) présentant une épilepsie généralisée idiopathique avec des crises généralisées tonico-cloniques primaires a montré que 39,2% des patients du groupe lévétiracétam et 29,8% des patients du groupe placebo ont eu des effets indésirables considérés comme liés au traitement. L'effet indésirable rapporté le plus fréquemment était la fatigue.
Nourrissons à partir de 1 mois, enfants et adolescents
Une étude réalisée chez l'enfant (de 1 mois à moins de 4 ans) ayant des crises partielles a montré que 21,7% des patients du groupe lévétiracétam et 7,1% des patients du groupe placebo ont présenté des effets indésirables. Aucun effet indésirable grave n'est survenu chez les patients du groupe lévétiracétam ni chez les patients du groupe placebo. Au cours de l'étude de suivi à long terme N01148, les effets indésirables les plus fréquents dans le groupe des patients âgés de 1 mois à moins de 4 ans ont été: irritabilité (7,9%), convulsion (7,2%), somnolence (6,6%), hyperactivité psychomotrice (3,3%), trouble du sommeil (3,3%) et agressivité (3,3%). Les résultats de sécurité obtenus chez les jeunes enfants concordent avec le profil de tolérance du lévétiracétam chez les enfants et les adolescents de 4 à 16 ans.
Au cours d'un essai clinique chez des enfants (4 à 16 ans), des effets indésirables sont survenus chez 55,4% des patients pédiatriques du groupe lévétiracétam et chez 40,2% de ceux du groupe placebo; ces effets ont été estimés sévères chez 0% des patients pédiatriques du groupe lévétiracétam et chez 1% de ceux du groupe placebo.
Les effets indésirables les plus fréquents chez la population pédiatrique ont été la somnolence, l'hostilité, la nervosité, la labilité émotionnelle, l'agitation, l'asthénie, l'anorexie et les céphalées.
Par ailleurs, des symptômes psychopathologiques ont été observés, tels qu'agitation, dépersonnalisation, hyperkinésie, troubles de la personnalité. De tels événements comportementaux et psychopathologiques sont survenus plus souvent chez les enfants que chez les adultes (38,6% vs 18,6%).
Une étude de sécurité dans la population pédiatrique, étude de «non infériorité», en double aveugle, contrôlée contre placebo, a évalué les effets cognitifs et neuropsychologiques du lévétiracétam chez des enfants âgés de 4 à 16 ans et souffrant de crises partielles. Le lévétiracétam s'est avéré équivalent au placebo quant à la différence par rapport aux valeurs initiales du «Leiter-R Attention and Memory, Memory Screen Composite score» dans la population de patients «per protocole». Les résultats se rapportant au comportement et à l'état émotionnel indiquent une aggravation du comportement agressif chez les patients traités par le lévétiracétam. Ce résultat a été déterminé dans des conditions standardisées en utilisant une échelle de mesure validée (CBCL – Achenbach Child Behavior CheckList). Cependant, les participants à l'étude traités par le lévétiracétam dans l'étude de suivi à long terme en ouvert n'ont présenté, en moyenne, aucune aggravation du comportement et de l'état émotionnel; les résultats portant sur le comportement agressif n'étaient en particulier pas plus mauvais que les valeurs initiales.
Les effets indésirables observés au cours d'essais cliniques (adultes, adolescents,enfants et nourrissons à partir d'un mois) et issus de l'expérience post-commercialisation sont listés en fonction des classes d'organes et par fréquence dans le tableau suivant. Pour les essais cliniques, la fréquence d'effets indésirables est définie comme suit: très fréquents: ≥1/10; fréquents: ≥1/100 à <1/10; occasionnels: ≥1/1000 à <1/100; rares: ≥1/10'000 à <1/1'000; très rares: <1/10'000, cas isolés inclus.
Les données de pharmacovigilance sont insuffisantes pour en estimer l'incidence dans la population traitée.
Infections et infestations
Très fréquents: nasopharyngite.
Rare: infection.
Affections hématologiques et du système lymphatique
Peu fréquents: thrombocytopénie.
Expérience après commercialisation: pancytopénie (une aplasie médullaire a été constatée dans quelques cas), agranulocytose, leucopénie, neutropénie..
Affections du système immunitaire
Expérience après commercialisation: exanthème médicamenteux avec éosinophilie et symptômes systémiques (syndrome d'hypersensibilité médicamenteuse [SHM] ou syndrome DRESS [Drug Reaction with Eosinophilia and Systemic Symptoms], voir «Mises en gare et précautions»), réactions anaphylactiques.
Troubles du métabolisme et de la nutrition
Fréquents: anorexie.
Peut fréquent: prise de poids.
Expérience après commercialisation: perte de poids, hyponatrémie.
Affections psychiatriques
Fréquents: dépression, hostilité, agressivité, insomnies, nervosité, irritabilité.
Peu fréquent: labilité émotionnelle/sautes d'humeur, agitation.
Rare: troubles de la personnalité, pensées anormales.
Expérience après commercialisation: trouble du comportement, colère, accès de panique, anxiété, état de confusion, hallucinations, troubles psychotiques, pensées suicidaires, tentative de suicide, suicide.
Affections du système nerveux
Très fréquents: somnolence, céphalée.
Fréquents: convulsions, torpeur, tremblement, troubles de l'équilibre.
Peu fréquent: amnésie, troubles de la coordination/ataxie. troubles de l'attention, altération de la mémoire.
Rare: hyperkinésie
Expérience après commercialisation: choréoathétose, dyskinésie, paresthésie, léthargie, troubles de la marche.
Affections oculaires
Peu fréquents: diplopie, vue trouble.
Affections de l'oreille et du labyrinthe
Fréquents: vertige.
Affections respiratoires, thoraciques et médiastinales
Fréquents: toux.
Affections gastro-intestinales
Fréquents: douleurs abdominales, diarrhée, dyspepsie, nausée, vomissements.
Expérience après commercialisation: pancréatite.
Affections hépatobiliaires
Expérience après commercialisation: insuffisance hépatique, hépatite, anomalies des tests de la fonction hépatique.
Affections du rein et des voies urinaires
Expérience après commercialisation: insuffisance rénale aiguë.
Affections de la peau et du tissu sous-cutané
Fréquents: éruption cutanée.
Peut fréquents: eczéma, prurit.
Expérience après commercialisation: nécrolyse épidermique toxique, syndrome de Stevens-Johnson (voir «Mises en garde et précautions»), érythème multiforme et alopéciedans plusieurs cas d'alopécie, une amélioration a été observée après l'arrêt du lévétiracétam), angio-œdème.
Affections musculo-squelettiques et du tissu conjonctif
Peut fréquents: myalgie.
Expérience après commercialisation: faiblesse musculaire, rhabdomyolyse et augmentation du taux de créatine phosphokinase dans le sang1.
Troubles généraux et anomalies au site d'administration
Très fréquents: asthénie, fatigue
Lésions, intoxications et complications liées aux procédures
Peu fréquents: blessures.
Description d'effets indésirables sélectionnés:
1La rhabdomyolyse et l'augmentation du taux de créatine phosphokinase dans le sang sont significativement plus fréquentes chez les patients japonais que chez les patients non japonais.
Surdosage
Symptômes
Lors d'un surdosage de lévétiracétam, des cas de somnolence, agitation, agression, troubles de la conscience, dépression respiratoire et coma ont été observés.
Mesures à prendre en cas de surdosage
On ne connaît pas d'antidote spécifique au lévétiracétam. Le traitement d'un surdosage est symptomatique et peut comprendre une hémodialyse. Le taux d'extraction par dialyse atteint 60% pour le lévétiracétam et 74% pour son métabolite.
Propriétés/Effets
Code ATC: N03AX14
Le principe actif lévétiracétam est un dérivé de la pyrrolidone (S-énantiomère de l'éthyl-2-oxo-1-pyrrolidine-acétamide). Sa structure chimique n'est pas apparentée aux antiépileptiques connus.
Mécanisme d'action
Le mécanisme d'action du lévétiracétam n'est pas encore complètement élucidé, mais semble être différent de celui des antiépileptiques connus. Des essais in vitro et in vivo suggèrent que le lévétiracétam ne modifie ni les caractéristiques cellulaires de base, ni la neurotransmission normale.
Des études in vitro montrent que le lévétiracétam influence le taux intraneuronal de Ca2+ en inhibant partiellement le flux de Ca2+ médié par les canaux de type N et en diminuant la libération de Ca2+ de ses réserves intraneuronales. Il inverse en outre la diminution des flux médiés par GABA et glycine induits par le zinc et les β-carbolines. Par ailleurs, des études in vitro montrent que le lévétiracétam se lie à un site spécifique dans le tissu cérébral de rongeurs. Il s'agit de la protéine 2A de la vésicule synaptique qui semble être impliquée dans la fusion vésiculaire et l'exocytose de neurotransmetteurs.
Le lévétiracétam et ses analogues présentent un degré d'affinité de liaison à la protéine vésiculaire synaptique 2A en corrélation avec la puissance de la protection anticonvulsive dans le modèle d'épilepsie des souris audiogènes. Cette observation suggère que l'interaction entre le lévétiracétam et la protéine 2A de la vésicule synaptique pourrait contribuer au mécanisme d'action antiépileptique de la substance.
Pharmacodynamique
Le lévétiracétam n'agit pas dans les modèles de screening classiques pour anticonvulsivants. Il offre toutefois une bonne protection contre les crises dans un grand nombre de modèles animaux de crises partielles ou primaires généralisées, associée à une marge de sécurité particulièrement importante entre les doses thérapeutiques et celles pouvant déclencher des effets secondaires.
Efficacité clinique
Traitement adjuvant de crises partielles avec et sans généralisation secondaire chez les adultes, les adolescents, les enfants et les nourrissons épileptiques nés à terme à partir de 1 mois
L'efficacité et la sécurité du lévétiracétam a été étudiée chez plus de 3000 patients et volontaires. La preuve principale d'efficacité a été fournie par trois essais cliniques randomisés et contrôlés contre placebo chez 904 patients adultes. Les participants étaient atteints d'épilepsie réfractaire dont les crises avec ou sans généralisation secondaire survenaient malgré un traitement de fond par une posologie stable de deux antiépileptiques standard au maximum. Dans cette population de patients, un bénéfice cliniquement significatif du lévétiracétam a été démontré. Le traitement adjuvant par lévétiracétam aux doses journalières de 1000 à 3000 mg a pu diminuer significativement la fréquence de crises par rapport au placebo chez les patients atteints d'épilepsie réfractaire partielle. Cette diminution était de 17% et 40% de la valeur initiale en comparaison avec 6-7% sous placebo. La réponse dans le groupe actif se situait entre 22 et 42% (placebo 10-16%).
Chez les patients pédiatriques(de 1 mois à moins de 4 ans), l'efficacité du lévétiracétam a été établie au cours d'une étude en double aveugle, contrôlée contre placebo, incluant 116 patients avec une durée de traitement de 5 jours. Au cours de cette étude, les patients ont reçu une dose quotidienne de 20 mg/kg, 25 mg/kg, 40 mg/kg ou 50 mg/kg de solution buvable, conformément à la recommandation posologique en fonction de l'âge. Dans cette étude, une dose de 20 mg/kg/jour allant jusqu'à 40 mg/kg/jour a été utilisée pour les nourrissons de 1 mois à moins de 6 mois et une dose de 25 mg/kg/jour allant jusqu'à 50 mg/kg/jour a été utilisée pour les nourrissons et les enfants de 6 mois à moins de 4 ans. La dose quotidienne totale a été administrée en deux prises.
Le critère principal d'efficacité a été le taux en pourcentage de patients répondeurs chez lesquels de la fréquence des crises partielles quotidiennes a diminué d'au moins 50%, par rapport aux valeurs initiales, cette fréquence ayant été évaluée par une lecture centralisée en aveugle sur une vidéo-EEG de 48 heures. L'analyse de l'efficacité a porté sur 109 patients ayant eu au moins une vidéo-EEG de 24 heures pendant la période de référence et pendant la période d'évaluation. 43,6% des patients traités par le lévétiracétam et 19,6% des patients sous placebo ont été considérés comme répondeurs. Les résultats sont concordants et homogènes dans tous les groupes d'âge. Lors de la poursuite du traitement à long terme, 8,6% des patients étaient libres de crise pendant au moins 6 mois et 7,8% pendant au moins 1 an.
Chez les enfants et les adolescents (de 4 à 16 ans), l'efficacité du lévétiracétam a été évaluée dans une étude en double aveugle, contrôlée contre placebo, chez 198 patients et avec une durée de traitement de 14 semaines. Dans cette étude, les patients ont reçu le lévétiracétam à une dose fixe de 60 mg/kg/jour (répartie en 2 prises).
44,6% des patients traités par le lévétiracétam et 19,6% des patients ayant reçu le placebo ont présenté une réduction de 50% ou plus de la fréquence hebdomadaire des crises partielles par rapport à la valeur initiale. Avec un traitement maintenu à long terme, 11,4% des patients étaient libres de crise depuis au moins 6 mois et 7,2% des patients depuis au moins 1 an.
En association dans le traitement des crises myocloniques de l'adulte et de l'adolescent à partir de 12 ans présentant une épilepsie myoclonique juvénile
L'efficacité du lévétiracétam a été établie lors d'une étude en double aveugle contrôlée versus placebo sur 16 semaines chez des patients de 12 ans et plus souffrant d'épilepsie généralisée idiopathique et présentant des crises myocloniques dans différents syndromes épileptiques. La majorité des patients avaient une épilepsie myoclonique juvénile. Dans cette étude, le lévétiracétam était administré à la posologie de 3000 mg/jour répartis en deux prises. 58,3% des patients traités par lévétiracétam et 23,3% des patients sous placebo ont présenté au moins une réduction de 50% du nombre de jours avec crises myocloniques par semaine. Avec un traitement maintenu à long terme, 28,6% des patients étaient libres de crises myocloniques pendant au moins 6 mois et 21,0% étaient libres de crises myocloniques pendant au moins un an.
En association dans le traitement des crises généralisées tonico-cloniques primaires de l'adulte et de l'adolescent à partir de 12 ans présentant une épilepsie généralisée idiopathique
L'efficacité du lévétiracétam a été démontrée dans une étude double aveugle contrôlée versus placebo sur 24 semaines incluant des adultes, des adolescents et un nombre limité d'enfants souffrant d'épilepsie généralisée idiopathique avec crises généralisées tonico-cloniques primaires (GTCP) dans différents syndromes épileptiques (épilepsie myoclonique juvénile, épilepsie-absences de l'adolescent, épilepsie-absences de l'enfant, épilepsie avec crises grand mal du réveil).
Dans cette étude, la dose de lévétiracétam était de 3000 mg par jour pour l'adulte et l'adolescent et de 60 mg/kg/jour chez l'enfant et a été répartie en 2 prises quotidiennes égales. 72,2% des patients traités par le lévétiracétam et 45,2% des patients sous placebo avaient une diminution de la fréquence des crises GTCP de 50% ou plus par semaine.
Avec un traitement maintenu à long terme, 47,4% des patients étaient libres de crises tonico-cloniques pendant au moins 6 mois et 31,5% pendant au moins un an.
Monothérapie de crises partielles avec ou sans généralisation secondaire chez des patients épileptiques à partir de 16 ans
L'efficacité du lévétiracétam en monothérapie a été démontrée dans un essai clinique de non-infériorité par rapport à la carbamazépine à libération contrôlée (controlled release, CR) selon un plan en double aveugle et groupes parallèles chez 576 patients dès 16 ans dont l'épilepsie avait été diagnostiquée nouvellement ou récemment. Les patients devaient présenter, soit des crises partielles non provoquées, soit des crises généralisées cloniques-toniques. Ils étaient randomisés pour recevoir 400-1200 mg de carbamazépine CR ou 1000-3000 mg de lévétiracétam par jour. La durée du traitement pouvait aller jusqu'à 121 semaines en fonction de la réponse thérapeutique. 73,0% des patients sous lévétiracétam et 72,8% de ceux sous carbamazépine CR n'ont pas présenté de crise pendant six mois; la différence absolue calculée entre les traitements était de 0,2% (IC95%: -7,8; 8,2). Plus de la moitié des patients sont restés exempts de crises pendant 12 mois (56,6% des patients sous lévétiracétam et 58,5% sous carbamazépine CR).
Passage à une monothérapie
Chez 36 de 69 patients (adultes) (52%) atteints d'épilepsie focale qui avaient bien répondu à un traitement adjuvant par lévétiracétam, cet effet était encore manifeste pendant 12 semaines après le passage à une monothérapie sous lévétiracétam.
Pharmacocinétique
Le profil pharmacocinétique est caractérisé par une linéarité de dose associée à une faible variabilité intra- et interindividuelle. La clairance ne change pas après une administration répétée. Il n'existe aucune preuve de variabilité significative liée au sexe, à l'origine ethnique, ou au cycle nycthéméral. Le profil pharmacocinétique de volontaires sains et de patients épileptiques est comparable.
Du fait de l'absorption complète et linéaire du lévétiracétam, les taux plasmatiques peuvent être prédits à partir de la dose orale administrée (mg/kg de poids corporel). Il n'est donc pas nécessaire de surveiller les taux plasmatiques de lévétiracétam.
Adultes (≥18 ans) et adolescents (12-17 ans)
Absorption
Le lévétiracétam est rapidement absorbé après son administration orale, la concentration plasmatique maximale (Cmax) est atteinte env. 1,3 heures après la prise. La biodisponibilité orale absolue atteint presque 100%. Dans le cas d'une administration biquotidienne, l'état d'équilibre est atteint en 2 jours. La concentration plasmatique maximale (Cmax) s'élève à 31 µg/ml après une dose unique de 1000 mg et à 43 µg /ml après une dose répétée de 1000 mg deux fois par jour. L'absorption n'est pas influencée par la prise de nourriture.
Distribution
Ni le lévétiracétam ni son métabolite principal ne sont significativement liés aux protéines plasmatiques (<10%). Le volume de distribution du lévétiracétam atteint presque 0,5-0,7 l/kg, valeur très proche du volume du liquide intra- et extracellulaire.
Une corrélation significative entre les concentrations salivaire et plasmatique a été démontrée (le rapport entre les concentrations salivaire et plasmatique se situait entre 1 et 1,6).
Métabolisme
La voie principale de métabolisation est l'hydrolyse enzymatique du groupe acétamide du lévétiracétam (24% de la dose) vers un métabolite inactif. Les isoenzymes du cytochrome P450 hépatique n'y participent pas.
L'hydrolyse du groupe acétamide a lieu dans divers tissus et dans le sang complet, mais pas dans le plasma. Par ailleurs, deux autres métabolites mineurs ont été identifiés. L'un est formé par hydroxylation du cycle pyrrolidine (1,6% de la dose), l'autre par l'ouverture de ce cycle (0,9% de la dose). D'autres produits de dégradation non identifiés représentent 0,6% de la dose.
Une interconversion des énantiomères n'a été observée in vivo ni pour le lévétiracétam ni pour son principal métabolite inactif.
Elimination
La demi-vie plasmatique est de 7,2 heures. La clairance corporelle totale est en moyenne de 0,96 ml/min/kg.
L'élimination se fait principalement par voie urinaire (env. 95%), 0,3% seulement de la dose sont éliminés dans les fèces. L'excrétion rénale cumulée du lévétiracétam et de son métabolite principal au cours des premières 48 heures s'élève à respectivement 66% et 24% de la dose administrée. La clairance rénale du lévétiracétam est de 0,6 ml/min/kg, celle du métabolite de 4,2 ml/min/kg. Ces valeurs indiquent que le lévétiracétam est excrété par filtration glomérulaire, puis réabsorbé dans les tubules, alors que le métabolite subit une filtration glomérulaire et en plus une sécrétion active au niveau tubulaire. L'élimination du lévétiracétam est en corrélation avec la clairance de la créatinine.
Cinétique pour certains groupes de patients
Patients âgés
Chez les patients âgés, la demi-vie du lévétiracétam est prolongée d'env. 40%, atteignant 10-11 heures, ce qui est en rapport avec la diminution de la fonction rénale dans ce groupe de personnes (voir «Posologie/Mode d'emploi»).
Enfants (4–12 ans)
Après l'administration d'une dose unique de 20 mg/kg à des enfants épileptiques (6-12 ans), la demi-vie du lévétiracétam est de 6,0 heures. La clairance corporelle totale est d'environ 30% supérieure à celle des épileptiques adultes.
Après l'administration orale répétée (20 à 60 mg/kg/jour), le lévétiracétam a été rapidement absorbé chez les enfants épileptiques (4 à 12 ans). Les concentrations plasmatiques maximales ont été observées 0,5–1,0 heure après la prise. La demi-vie d'élimination se situe à environ 5 heures. La clairance corporelle totale est de 1,1 ml/min/kg.
Nourrissons nés à terme et enfants (de 1 mois à moins de 4 ans)
Après administration unique d'une dose (20 mg/kg) de solution buvable 100 mg/ml à des enfants épileptiques (âgés de 1 mois à 4 ans) le lévétiracétam était rapidement absorbé et le pic de concentration plasmatique était observé approximativement une heure après l'administration. Les résultats pharmacocinétiques indiquaient que la demi-vie était plus courte (5,3 heures) que chez l'adulte (7,2 heures) et la clairance apparente plus rapide (1,5 ml/min/kg) que chez l'adulte (0,96 ml/min/kg).
Dans les analyses pharmacocinétiques de population réalisées chez des patients de 1 mois à 16 ans, le poids corporel s'est révélé significativement corrélé à la clairance corporelle apparente (augmentation de la clairance parallèle à l'augmentation du poids corporel) et au volume apparent de distribution. L'âge aussi a eu une influence sur ces deux paramètres. Cet effet était particulièrement prononcé pour les nourrissons, a diminué avec l'avancée en âge, pour devenir négligeable vers 4 ans.
Dans les deux analyses pharmacocinétiques de population, il a été observé une augmentation d'environ 20% de la clairance corporelle apparente du lévétiracétam lorsqu'il a été co-administré à un antiépileptique inducteur enzymatique.
Insuffisants rénaux
La clairance corporelle totale du lévétiracétam et de son métabolite principal est en corrélation avec la clairance de la créatinine. Il est donc recommandé d'adapter la dose journalière d'entretien de Levetiracetam DESITIN en fonction de la clairance de la créatinine des patients atteints d'insuffisance rénale modérée à sévère (voir «Posologie/Mode d'emploi»).
Chez les patients adultes anuriques atteints d'affections rénales au stade terminal, la demi-vie est d'environ 25 heures entre deux séances de dialyse et de 3,1 heures pendant la dialyse. Lors d'une dialyse classique de 4 heures, 51% de la dose de lévétiracétam sont éliminés du plasma.
Insuffisants hépatiques
Chez les patients dont la fonction hépatique n'est que légèrement ou modérément atteinte, la clairance du lévétiracétam est pratiquement inchangée. Elle est en revanche diminuée de plus de 50% chez la plupart des patients atteints d'insuffisance hépatique sévère en raison d'une atteinte simultanée de la fonction rénale (voir «Posologie/Mode d'emploi»).
Données précliniques
Sur la base d'études conventionnelles de tolérance pharmacologique, de génotoxicité et de cancérogénicité, les données précliniques ne révèlent aucun risque particulier pour l'homme. Les études effectuées chez la souris et le rat n'ont indiqué aucun potentiel carcinogène du lévétiracétam.
Les effets secondaires survenus chez le rat et dans une moindre mesure chez la souris après exposition aux doses utilisées en thérapeutique humaine et qui, n'ont pas été observés dans les essais cliniques mais pourraient être pertinents pour l'utilisation clinique, concernaient des modifications hépatiques suggérant une réaction d'adaptation, comme p.ex. augmentation du poids du foie, hypertrophie centrolobulaire, infiltration adipeuse et élévation des enzymes hépatiques plasmatiques.
Dans des études toxicologiques de reproduction chez le rat avec des taux de principe actif analogues ou supérieurs à ceux en usage chez l'homme, le lévétiracétam s'est avéré toxique pour le développement (augmentation des modifications squelettiques/anomalies mineures du squelette, croissance retardée, mortalité accrue des jeunes animaux). Chez le lapin, après des doses toxiques pour la mère, on a observé des effets nuisibles sur l'embryon (mort de l'embryon, augmentation des anomalies du squelette et des malformations). Le taux de principe actif ne produisant pas encore d'effet toxique chez le lapin est environ de 4 à 5 fois supérieur au taux de principe actif chez l'homme.
Les études menées chez le rat et le chien nouveau-nés et juvéniles n'ont pas mis en évidence d'effets indésirables sur aucun des paramètres standard d'évaluation du développement ou de la maturation à des doses allant jusqu'à 1800 mg/kg/jour. L'exposition des animaux était nettement supérieure à celle obtenue chez l'être humain après administration de la dose maximale recommandée.
Remarques particulières
Influence sur les méthodes de diagnostic
Aucune influence du lévétiracétam sur des méthodes de diagnostic n'est connue.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «À utiliser jusqu'au» sur le récipient. Après ouverture du flacon, utiliser la solution dans les 4 mois.
Remarques concernant le stockage
Minipacks avec mini-comprimés pelliculés:
Conserver à 15-30 °C dans l'emballage original et hors de portée des enfants.
Solution:
Conserver à 15-30 °C dans l'emballage original et hors de portée des enfants.
Numéro d’autorisation
62069
61848
(Swissmedic).
Titulaire de l’autorisation
Desitin Pharma Sàrl, 4410 Liestal
Mise à jour de l’information
Décembre 2018
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.




 Deutsch
Deutsch French
French Italian
Italian