Firmagon Trockensub 80 mg with solvent in prefilled syringe Set
Firmagon Trockensub 80 mg mit Solvens in Fertigspritze Set
-
263.61 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: FERRING AG
- Product Code: 5666436
- ATC-code L02BX02
- EAN 7680594550032
Ingredients:
Mannitol, Trockensubstanz, Lösungsmittel, pro vitro, Degarelix 80 mg , Degarelix acetat 88.2 mg.

Description
Zusammensetzung
Wirkstoffe
Degarelixum ut degarelixi acetas
Hilfsstoffe
Praeparatio cryodesiccata: mannitolum (E421)
Solvens: aqua ad injectabilia
Darreichungsform und Wirkstoffmenge pro Einheit
Lyophilisat und Lösungsmittel zur Herstellung einer Injektionssuspension zur subkutanen Anwendung.
Durchstechflaschen mit 120 mg Degarelix (als Acetat)
Lösungsmittel: Vorgefüllte Spritze mit 3 ml
1 ml Injektionslösung enthält 40 mg Degarelix
Durchstechflaschen mit 80 mg Degarelix (als Acetat)
Lösungsmittel: Vorgefüllte Spritze mit 4.2 ml
1 ml Injektionslösung enthält 20 mg Degarelix
Indikationen/Anwendungsmöglichkeiten
Zur Behandlung von Patienten mit fortgeschrittenem hormonabhängigem Prostatakarzinom. Als alternative Behandlung, wenn Orchiektomie oder Östrogengaben für den Patienten entweder nicht indiziert oder nicht zumutbar sind.
Dosierung/Anwendung
Dosierung für erwachsene Männer
Die Anwendung sollte nur unter Überwachung eines in der Tumortherapie erfahrenen Arztes erfolgen.
Firmagon ist ausschliesslich für die Subkutangabe vorgesehen und darf nicht intravenös verabreicht werden.
Nach einer ersten Dosis (Initialdosis) von 2 an getrennten Bauchstellen erfolgenden subkutanen Injektionen von je 120 mg (3 ml) werden im Abstand von jeweils einem Monat weitere 80 mg (4 ml) subkutan in die Bauchhaut verabreicht.
Die therapeutische Wirkung von Firmagon sollte durch Kontrolle der klinischen Parameter überwacht werden und bei Besserung der Kastrationsbeschwerden oder bei nicht adäquatem Tumoransprechen sollten die Testosteronspiegel kontrolliert werden. Weiterhin sollte das prostataspezifische Antigen (PSA) im Serum überwacht werden.
Zu Therapiebeginn ist keine Antiandrogengabe erforderlich.
Firmagon wird durch subkutane Injektion im Bauchbereich verabreicht. Die Injektionsstelle sollte regelmässig gewechselt werden. Die Injektion sollte dort erfolgen, wo der Patient keinem Druck ausgesetzt ist, d.h. nicht zu nahe an Hosenbund oder Gürtel und auch nicht in der Nähe der Rippen.
Spezielle Dosierungsanweisungen
Patienten mit höherem Lebensalter oder Leber- bzw. Niereninsuffizienz
Bei älteren Patienten oder Patienten mit geringer bis mässiger Leber- oder Nierenfunktionseinschränkung muss die Dosis nicht angepasst werden (siehe Abschnitt Pharmakokinetik). Patienten mit schwerer Leber- oder Niereninsuffizienz wurden bisher noch nicht untersucht, und bei ihnen ist daher Vorsicht geboten.
Firmagon ist bei Frauen nicht untersucht und darf daher hier nicht angewandt werden (siehe Kontraindikationen).
Kinder und Jugendliche
Es gibt keine entsprechende Indikation für Kinder und Jugendliche (siehe Kontraindikationen).
Kontraindikationen
Überempfindlichkeit gegen Degarelix oder einen der sonstigen Bestandteile.
Bei Frauen und pädiatrischen Patienten ist die Verabreichung von Firmagon kontraindiziert.
Warnhinweise und Vorsichtsmassnahmen
Beeinträchtigung des QT/QTc-Intervalls
Bei der Langzeitandrogendeprivation kommt es in ca. 20% der Patienten zu einer Verlängerung des QT-Intervalls (siehe Eigenschaften/Wirkungen). Der behandelnde Arzt sollte sorgfältig abwägen, ob bei Patienten mit QT-Ausgangswerten >450 ms (beispielsweise kongenitale QT-Prolongation) oder Patienten mit einer Vorgeschichte bzw. Risikofaktoren für Torsade de pointes die Vorteile einer Androgendeprivation das mögliche Risiko überwiegen.
Eine Komedikation mit die QT Zeit-verlängernden Substanzen (wie beispielsweise Antiarrhythmika der Klasse IA [z.B. Chinidin, Procainamid] und der Klasse III [z.B. Amiodaron, Sotalol]) ist zu vermeiden. Weitere Informationen zur klinischen Wirksamkeit siehe Kapitel Eigenschaften/Wirkungen.
Veränderung der Knochendichte:
In den klinischen Studien mit Degarelix erfolgte keine Untersuchung der Knochendichte. Unter Behandlung mit GnRH-Agonisten sowie bei Patienten nach Orchiektomie wurde jedoch über eine Abnahme der Knochendichte berichtet. Es ist davon auszugehen, dass auch eine Langzeit-Testosteronsuppression mit Degarelix einen Einfluss auf die Knochendichte hat.
Interaktionen
Es wurden keine klinischen Studien zu möglichen Wechselwirkungen mit anderen Wirkstoffen durchgeführt.
Degarelix ist kein Substrat für das CYP450-System des Menschen, und in vitro konnte keine wesentliche Induktion bzw. Hemmung von CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 oder CYP3A4/5 nachgewiesen werden. Darüber hinaus gab es keine Wechselwirkungen von Degarelix mit getesteten relevanten Efflux- und Arzneistoffaufnahmetransportern. Somit sind klinisch relevante pharmakokinetische Interaktionen mit anderen Wirkstoffen unwahrscheinlich.
Schwangerschaft/Stillzeit
Schwangeren und Stillenden darf Firmagon nicht verabreicht werden (siehe Kontraindikationen). Bedingt durch die pharmakologischen Eigenschaften kann es bei Gabe von Firmagon während der Schwangerschaft zur Schädigung des Fötus kommen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Firmagon hat einen geringen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Es wurden keine Studien zur Wirkung von Firmagon auf die Fahrtüchtigkeit und Fähigkeit zum Bedienen von Maschinen durchgeführt.
Als unerwünschte Wirkungen wurden jedoch häufig Müdigkeit und Schwindelgefühle beobachtet, welche die Verkehrstüchtigkeit und die Fähigkeit, Maschinen zu bedienen, beeinträchtigen können.
Unerwünschte Wirkungen
Die meisten unerwünschten Wirkungen, welche unter Degarelix beobachtet wurden, stellen eine Folge der Testosteronsuppression dar.
Als häufigste Nebenwirkungen fanden sich in der vergleichenden Phase III Studie (n=409) Hitzewallungen und Gewichtszunahme (bei 25% bzw. 7%, physiologische Auswirkungen der Testosteronsuppression). Weiterhin traten sehr häufig Reaktionen an der Injektionsstelle auf, diese umfassten im Wesentlichen Schmerzen und Erythem bei 28% bzw. 17% der Patienten, und Schwellung (6%), Verhärtung (4%) sowie Knotenbildung (3%). Diese Ereignisse traten häufiger zu Beginn der Behandlung auf. Sehr selten traten schwerwiegende Reaktionen an der Injektionsstelle auf, wie Infektionen, Abszesse oder Nekrose, die eine chirurgische Behandlung oder Drainage erforderten.
Nachfolgend werden die unerwünschten Wirkungen angegeben, welche in den Phase II- und III-Studien beobachtet wurden. In diesen Studien waren insgesamt 1259 Patienten gegenüber Degarelix exponiert, entsprechend einer Gesamtexposition von 1781 Patientenjahren. Von diesen waren 803 Patienten während einem Jahr oder mehr, 359 Patienten während 2 Jahren und mehr und 153 Patienten während 3 Jahren oder mehr gegenüber Degarelix exponiert.
Bei der Bewertung von unerwünschten Wirkungen werden folgende Häufigkeiten zugrunde gelegt: Sehr häufig ≥1/10, Häufig ≥1/100 und <1/10, Gelegentlich ≥1/1000 und <1/100, Selten ≥1/10'000 und <1/1000. Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach zunehmendem Schweregrad angegeben.
Erkrankungen des Blutes und des Lymphsystems
Häufig: Anämie.
Selten: neutropenisches Fieber.
Erkrankungen des Immunsystems
Selten: Überempfindlichkeitsreaktionen, wie Anaphylaxie, Angioödem.
Stoffwechsel- und Ernährungsstörungen
Häufig: Gewichtszunahme.
Gelegentlich: Hyperglykämie/Diabetes mellitus, erhöhte Cholesterinwerte, Gewichtsverlust, verminderter Appetit, Veränderungen des Serumkalzium.
Selten: Hyperkaliämie.
Psychiatrische Erkrankungen
Häufig: Schlaflosigkeit.
Gelegentlich: reduzierte Libido, Depression, psychische Störungen.
Sehr selten: Ängstlichkeit, Stimmungsschwankungen.
Erkrankungen des Nervensystems
Häufig: Schwindel, Kopfschmerzen.
Gelegentlich: Hypästhesien.
Augenerkrankungen
Gelegentlich: Verschwommensehen.
Herzerkrankungen
Gelegentlich: Palpitationen, Herzrhythmusstörungen (inkl. Vorhofflimmern), QT-Verlängerung.
Selten: Myokardinfarkt, kongestive Herzinsuffizienz.
Gefässerkrankungen
Sehr häufig: Hitzewallungen (31%).
Gelegentlich: Hypertonie, vasovagale Reaktion (inkl. Hypotonie).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Dyspnoe.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Diarrhoe.
Gelegentlich: Obstipation, abdominale Schmerzen, Mundtrockenheit, Erbrechen.
Leber- und Gallenerkrankungen
Häufig: Transaminasenanstieg.
Gelegentlich: erhöhte Bilirubinwerte, Erhöhung der alkalischen Phosphatase.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Hyperhidrose (inkl. Nachtschweiss), Hautausschlag.
Gelegentlich: Erythem, Pruritus, Urtikaria, Hautknötchen, Alopezie.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Muskelschmerzen.
Gelegentlich: Arthralgie, Muskelschwäche, Gelenkschwellung/-Steifheit, Muskelkrämpfe, Osteopenie/ Osteoporose.
Selten: Rhabdomyolyse.
Erkrankungen der Nieren und Harnwege
Gelegentlich: vermehrter Harndrang, Pollakisurie, Nykturie, Dysurie, Inkontinenz, Nierenfunktionsstörung.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Häufig: Gynäkomastie, erektile Dysfunktion, Hodenatrophie.
Gelegentlich: Brustschmerzen, Reizung der Genitalien, Hodenschmerzen, Unterleibsschmerzen, Ejakulationsstörungen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Reaktionen an der Injektionsstelle (26%) (z.B. Schmerzen, Erythem, Schwellung).
Häufig: Müdigkeit, Fieber, Schüttelfrost, grippeähnliche Symptome.
Gelegentlich: Unwohlsein, peripheres Ödem.
Sehr selten: schwerwiegende Reaktionen an der Injektionsstelle, wie Infektionen, Abszesse oder Nekrose.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es wurden keine Fälle von Überdosierung berichtet.
Bei einer Überdosierung ist der Patient zu überwachen, falls erforderlich sind entsprechende unterstützende Massnahmen einzuleiten.
Eigenschaften/Wirkungen
ATC-Code
L02BX02
Wirkungsmechanismus
Degarelix ist ein selektiver GnRH-Rezeptorenantagonist, der kompetitiv und reversibel an die GnRH-Rezeptoren der Hypophyse bindet und dadurch rasch die Freisetzung der Gonadotropine blockiert. Als Folge kommt es zur hormonellen Kastration.
Eine Einzeldosis Firmagon 240 mg, gefolgt von einer monatlichen Erhaltungsdosis von 80 mg, bewirkt einen raschen Abfall von LH und FSH sowie nachfolgend des Testosterons. Der Plasmaspiegel des Dihydrotestosteron (DHT) fällt ähnlich ab wie das Testosteron.
Im Gegensatz zu GnRH-Agonisten induziert der GnRH-Antagonist Degarelix keinen initialen Anstieg des LH und des Testosterons.
Mit Degarelix wurden die Testosteronwerte unterhalb des Kastrationsspiegels von 0,5 ng/ml gesenkt, und unter der monatlichen Erhaltungsdosis von 80 mg wird bei 97% der Patienten eine anhaltende Testosteronsuppression über ein Jahr gezeigt. Der mittlere Testosteronspiegel nach einjähriger Behandlung betrug 0,087 ng/ml [Quartilsdifferenz 0,06 – 0,15] n=167.
Pharmakodynamik
Siehe Rubrik «Wirkungsmechanismus»
.Klinische Wirksamkeit
Die Wirksamkeit von Degarelix wurde in einer randomisierten, offenen, dreiarmigen Phase III-Studie an n=620 Patienten im Alter von 47-98 Jahren über 1 Jahr untersucht. Die Gabe von Degarelix in einer Erstdosis von 240 mg gefolgt von monatlichen Dosen von 160 mg bzw. 80 mg jeweils subkutan wurde verglichen mit Leuprorelin 7,5 mg/ Monat intramuskulär. Von den randomisierten Patienten wiesen 31% ein lokales, 29% ein lokal fortgeschrittenes und 20% ein metastasierendes Prostatakarzinom auf; in 7% war der Metastasenstatus nicht bekannt, und 13% waren prostatektomiert oder bestrahlt worden.
Insgesamt 504 Patienten (81%) beendeten die Studie. Im Degarelix- Behandlungsarm mit 240 mg/80 mg brachen 41 Patienten (20%) die Studie ab, in der Leuprorelin-Gruppe 32 Patienten (16%). Primärendpunkt war der Nachweis, dass Degarelix zu einer Testosteron-Suppression (auf <0,5 ng/ml) führt, welche über 12 Monate anhält. Unter Degarelix wurde dies in 97,2% (93,5; 98,8%), unter Leuprorelin in 96,4% (92,5, 98,2%) erreicht. Die Differenz zwischen Degarelix (beide Arme) und Leuprorelin betrug 1,9% (97,5% CI: -1,8; 5,7); damit waren die Kriterien der non-inferiority erfüllt.
Bei keinem der mit Degarelix behandelten Patienten kam es zu einem Testosteronanstieg; bis Tag 3 fiel der Testosteronspiegel im Mittel um 94% ab.
Als Sekundärendpunkt wurde unter anderem der PSA-Wert untersucht. Zwei Wochen nach Applikation von Degarelix fiel das PSA um 64% ab, nach einem Monat um 85%, nach drei Monaten um 95% und blieb während der gesamten einjährigen Behandlungszeit supprimiert (Reduktion gegenüber dem Ausgangswert um ca. 97%). An Tag 14 und Tag 28 war der PSA-Wert unter Degarelix (240mg/80 mg) signifikant niedriger als unter Leuprorelin (p<0.001). Ab Tag 56 fanden sich keine signifikanten Unterschiede mehr zwischen Degarelix und dem Komparator. Die Tumorgrösse wurde in den klinischen Studien nicht direkt bestimmt.
Testosteron-Reversibilität
In einer Studie, die Patienten mit steigendem PSA nach lokalisierter Behandlung (vor allem radikale Prostatektomie und Bestrahlung) einschloss, wurde Firmagon über sieben Monate verabreicht, gefolgt von einer siebenmonatigen Überwachungsperiode. Die Zeit bis zur Erholung der Testosteronwerte (>0,5 ng/ml, über Kastrationsspiegel) nach Beendigung der Behandlung betrug im Median 112 Tage (gezählt ab Beginn der Überwachungsperiode, d.h. 28 Tage nach der letzten Injektion). Die mediane Zeit bis zum Erreichen eines Testosteronwertes >1,5 ng/ml (über der Untergrenze des Normbereichs) lag bei 168 Tagen.
Wirkung auf das Prostatavolumen
Eine dreimonatige Behandlung mit Degarelix (240/80 mg Dosierungsschema) führte bei Patienten, die vor der Strahlentherapie eine Hormontherapie benötigten oder Patienten, bei denen eine medikamentöse Kastration vorgesehen war, zu einer 37%igen Reduktion des Prostatavolumens, gemessen mit transrektalem Ultraschall (TRUS). Die Reduktion des Prostatavolumens entsprach der von Goserelin in Verbindung mit Antiandrogen zur Flare-up-Prophylaxe.
QT Zeit
In der Vergleichsstudie mit Firmagon und Leuprorelin wurden in regelmässigen Abständen EKG's angefertigt. Beide Wirkstoffe zeigten bei etwa 20% der Patienten eine Verlängerung der QT-/QTc-Intervalle auf über 450 ms. Zwischen Baseline und Studienende betrug die mittlere Verlängerung 12,3 ms (3,2%) für Firmagon und 16,7 ms (3,5%) für Leuprorelin.
Eine vollständige Untersuchung der QT-Zeit ergab, dass Degarelix keine inhärenten Auswirkungen auf das QT/QTc Intervall hat. Das Fehlen eines inhärenten Effekts von Degarelix auf die kardiale Repolarisation (QTcF), Herzfrequenz, AV-Überleitung, kardiale Depolarisation und die Morphologie von T- oder U-Wellen wurde in einer Population von gesunden Männern (N=80) bestätigt, die eine i.v. Degarelix-Infusion über 60 Minuten erhielten, die zu einem mittleren Cmax von 222 ng/ml führte. Dies ist ungefähr das 3-4-fache des während der Prostatakrebsbehandlung erreichten Cmax.
Antikörper gegen Degarelix
Nach einjähriger Behandlung mit Firmagon kam es bei 10% der Patienten und nach bis zu 5,5-jähriger Behandlung bei 29% der Patienten zur Entwicklung von Antikörpern gegen Degarelix. Es liegen keine Hinweise vor, dass die Sicherheit und Wirksamkeit der Therapie mit Firmagon durch die Bildung von Antikörpern nach einer Behandlung von bis zu 5,5 Jahren beeinträchtigt wird. Antikörper-Befunde bei einer Behandlungsdauer von mehr als einem Jahr liegen nicht vor.
Pharmakokinetik
Absorption
Nach Subkutangabe bildet Firmagon ein Depot, aus dem Degarelix in den Kreislauf freigesetzt wird.
Für die Initialdosis von 240 mg wird die Cmax mit 53,4 ng/ml nach 1-2 Tagen erreicht. Im steady state beträgt der mediane Degarelix-Talspiegel 10,9 ng/ml.
Distribution
Das Verteilungsvolumen beim gesunden älteren Mann beträgt etwa 1 l/kg. Die Plasmaproteinbindung wird auf rund 90% geschätzt.
Metabolismus
Degarelix wird in der Leber zu Peptiden abgebaut und hauptsächlich in den Faeces in Form von Peptidfragmenten ausgeschieden. Im Plasma sind keine relevanten Metaboliten nachweisbar.
Elimination
Etwa 20% der Dosis werden unverändert über die Niere ausgeschieden. Die Clearance beim gesunden älteren Mann beträgt etwa 35-50 ml/h/kg. Die Elimination erfolgt biphasisch mit einer terminalen Halbwertszeit von ungefähr 43 Tagen für die Initialdosis und 28 Tagen für die Erhaltungsdosis.
Kinetik spezieller Patientengruppen
Nierenfunktionsstörungen
An Patienten mit eingeschränkter Nierenfunktion wurden keine Untersuchungen durchgeführt.
Leberfunktionsstörungen
Patienten mit gering- bis mässiggradiger Einschränkung der Leberfunktion zeigten gegenüber Gesunden keine relevante Erhöhung der Exposition. Degarelix wurde bei Patienten mit schwerer Leberinsuffizienz (Child Pugh C) nicht untersucht.
Ältere Patienten
Die populationspharmakokinetische Analyse der Patienten mit Prostatakarzinom zeigte nur geringe Veränderungen der Clearance von Degarelix in Abhängigkeit von Alter und Gewicht.
Präklinische Daten
In Reproduktionsstudien führte Degarelix bei männlichen Tieren zu einer reversiblen Infertilität, welche durch die pharmakologische Wirkung bedingt ist.
Reproduktionsstudien mit Degarelix bei weiblichen Tieren zeigten Ergebnisse, wie sie von den pharmakologischen Eigenschaften zu erwarten wären. Das Arzneimittel führte zu einer dosisabhängigen Verlängerung des Zeitraums bis zur Paarung und Trächtigkeit, einem Abfall der Anzahl der Corpora lutea, einer Zunahme der Prä- und Postimplantationsverluste, einem Anstieg der Abortrate, einer Zunahme der frühzeitigen Embryonal-/Fetalverluste, einem Anstieg der Rate vorzeitiger Geburten und zu einer Verlängerung der Geburtsdauer.
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Reproduktionstoxizität, Genotoxizität und zum kanzerogenen Potenzial lassen die Daten keine besonderen Gefahren für den Menschen erkennen.
Aus den Untersuchungen zur akuten, subakuten und chronischen Toxizität bei Ratten und Affen nach Subkutangabe von Degarelix ergab sich keine Zielorgantoxizität. Bei hochdosierter Subkutangabe von Degarelix kam es bei den Tieren zu wirkstoffbedingter lokaler Reizung.
Degarelix zeigte kein mutagenes Potenzial.
Sonstige Hinweise
Inkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nach der Rekonstitution (siehe Beschreibung weiter unten) sollte das Produkt sofort injiziert werden.
Die Zubereitung enthält kein Konservierungsmittel. Chemische und physikalische in-use Stabilität wurde für 1 Stunde bei 25 °C gezeigt. Aus mikrobiologischen Gründen ist die gebrauchsfertige Zubereitung unmittelbar nach Anbruch zu verwenden.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Bei Raumtemperatur (15-25 °C) lagern.
Nicht einfrieren.
Hinweise für die Handhabung
Es wird nicht empfohlen, das Arzneimittel in einer anderen Dosis zu verabreichen. Die aufbereitete Suspension sollte eine klare Lösung ohne ungelöste Partikel bilden.
Zubereitung des verwendungsfertigen Arzneimittels
WICHTIGER HINWEIS
Nach Einbringen des sterilen Wassers in die Durchstechflasche mit dem Lyophilisat:
•Die Durchstechflasche niemals schütteln
Gebrauchsanweisung für Zubereitung des verwendungsfertigen Arzneimittels:
Firmagon 120 mg – Initialdosis:
Die Packung enthält zwei Sätze des Lyophilisat plus 2 Fertigspritzen mit Lösungsmittel, die zur subkutanen Injektion rekonstituiert werden müssen. Daher muss jeder der nachstehenden Schritte ein zweites Mal durchgeführt werden.
Nach der Rekonstitution beträgt die Konzentration 40 mg/ml.
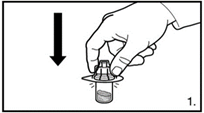
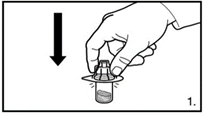
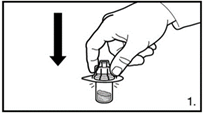
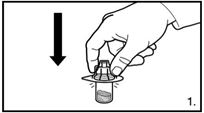
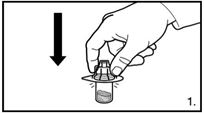
| 1. Die Verpackung des Durchstechflaschen-Adapters entfernen. Den Adapter auf die Lyophilisat-Durchstechflasche stecken. Hierzu den Adapter herunterdrücken, bis die Spitze den Gummistopfen durchdringt und der Adapter einrastet. |
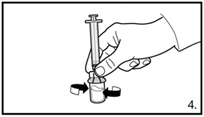
2. Die vorgefüllte Spritze vorbereiten, indem die Kolbenstange angebracht wird. | |
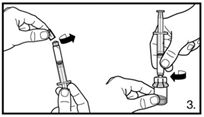
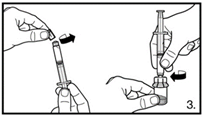
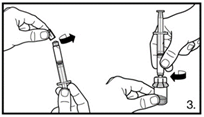
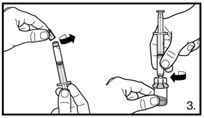
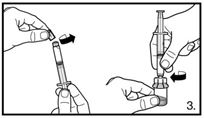
| 3. Die Abdeckkappe von der vorgefüllten Spritze entfernen. Die Spritze auf den Adapter der Lyophilisat-Durchstechflasche schrauben. Das sterile Wasser für Injektionszwecke vorsichtig in die Durchstechflasche mit dem lyophilisierten Pulver drücken. |
| 4. Die Spritze auf dem Adapter lassen und die Flasche ganz vorsichtig schwenken. Die Durchstechflasche solange drehen, bis die Flüssigkeit klar erscheint und keine ungelösten Pulveranteile oder Partikel mehr aufweist. Falls Pulver oberhalb der Flüssigkeit an der Durchstechflasche haftet, kann die Durchstechflasche leicht gekippt werden. NICHT SCHÜTTELN, DAMIT SICH KEIN SCHAUM BILDET. Ein Ring kleiner Luftblasen auf der Flüssigkeits-oberfläche ist unproblematisch. Obwohl sich die meisten Durchstechflaschen wesentlich schneller ansetzen lassen, dauert die Herstellung der Suspension in manchen Fällen bis zu 15 Minuten. |
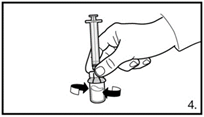
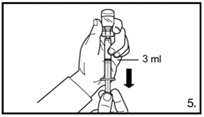
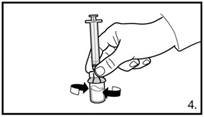
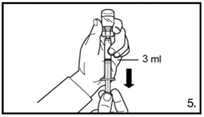
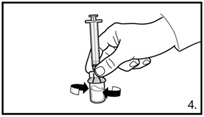
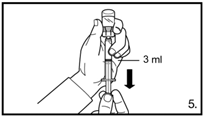
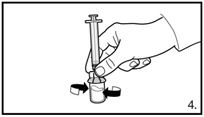
| 5. Die Durchstechflasche umdrehen und senkrecht halten. 3.0 ml Firmagon 120 mg Lösung in die Spritze aufziehen (Markierung auf der Spritze). Es muss sichergestellt sein, dass die exakte Menge aufgezogen wird. Möglicherweise muss dazu die Durchstechflasche leicht geneigt werden. Vorsichtig eventuell vorhandene Luftblasen entfernen. |
6. Die Spritze vom Durchstechflaschen-Adapter entfernen und die Kanüle mit dem orangen Konus (25G / 0,5 x 25 mm) zur tiefen Subkutaninjektion auf die Spritze stecken. Vorsichtig eventuell vorhandene Luftblasen entfernen. | |
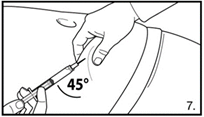
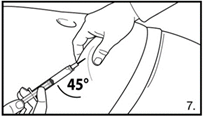
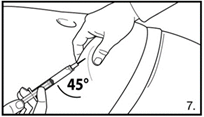
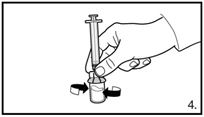
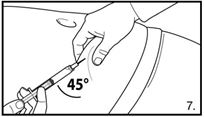
| 7. Die Bauchhaut samt dem Subkutangewebe packen und anheben. Eine tiefe Subkutaninjektion durchführen. Hierzu die Kanüle in einem Winkel von mindestens 45° tief einbringen. Nicht direkt in eine Vene spritzen. Den Kolben vorsichtig zurückziehen, um zu überprüfen, dass kein Blut angesaugt wird. Sollte in der Spritze Blut zu sehen sein, darf das Arzneimittel nicht weiter verwendet werden. In diesem Fall Vorgang abbrechen und Kanüle sowie Spritze verwerfen. Eine neue Dosis für den Patienten herstellen. 3.0 ml Firmagon 120 mg direkt nach der Herstellung injizieren. Die Rekonstitution für die zweite Dosis wiederholen. Für die zweite Injektion eine andere Stelle wählen und 3.0 ml aus der zweiten Durchstechflasche injizieren. |
8. Bitte beachten: Die Injektionen sollten dort erfolgen, wo der Patient keinem Druck ausgesetzt ist, d.h. nicht zu nahe am Hosenbund oder Gürtel und auch nicht in der Nähe der Rippen. | |
Gebrauchsanweisung: Firmagon 80 mg
Die Packung enthält 1 Satz des Lyophilisat plus 1 Fertigspritze mit Lösungsmittel, die zur subkutanen Injektion rekonstituiert werden müssen.
Nach der Rekonstitution beträgt die Konzentration 20 mg/ml.
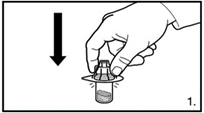
| 1. Die Verpackung des Durchstechflaschen-Adapters entfernen. Den Adapter auf die Lyophilisat-Durchstechflasche stecken. Hierzu den Adapter herunterdrücken, bis die Spitze den Gummistopfen durchdringt und der Adapter einrastet. |
2. Die vorgefüllte Spritze vorbereiten, indem die Kolbenstange angebracht wird. | |
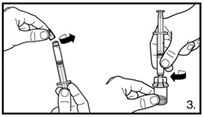
| 3. Die Abdeckkappe von der vorgefüllten Spritze entfernen. Die Spritze auf den Adapter der Lyophilisat-Durchstechflasche schrauben. Das sterile Wasser für Injektionszwecke vorsichtig in die Durchstechflasche mit dem lyophilisierten Pulver drücken. |
| 4. Die Spritze auf dem Adapter lassen und die Flasche ganz vorsichtig schwenken. Die Durchstechflasche solange drehen, bis die Flüssigkeit klar erscheint und keine ungelösten Pulveranteile oder Partikel mehr aufweist. Falls Pulver oberhalb der Flüssigkeit an der Durchstechflasche haftet, kann die Durchstechflasche leicht gekippt werden. NICHT SCHÜTTELN, DAMIT SICH KEIN SCHAUM BILDET. Ein Ring kleiner Luftblasen auf der Flüssigkeits-oberfläche ist unproblematisch. Obwohl sich die meisten Durchstechflaschen wesentlich schneller ansetzen lassen, dauert die Herstellung der Suspension in manchen Fällen bis zu 15 Minuten. |
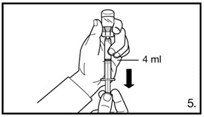
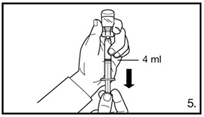
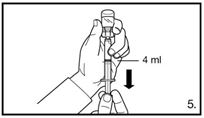
| 5. Die Durchstechflasche umdrehen und senkrecht halten. 4.0 ml Firmagon 80 mg Lösung in die Spritze aufziehen (Markierung auf der Spritze). Es muss sichergestellt sein, dass die exakte Menge aufgezogen wird. Möglicherweise muss dazu die Durchstechflasche leicht geneigt werden. Vorsichtig eventuell vorhandene Luftblasen entfernen. |
6. Die Spritze vom Durchstechflaschen-Adapter entfernen und die Kanüle mit dem orangen Konus (25G / 0,5 x 25 mm) zur tiefen Subkutaninjektion auf die Spritze stecken. Vorsichtig eventuell vorhandene Luftblasen entfernen. | |
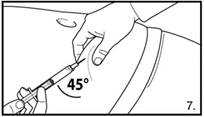
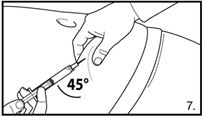
| 7. Die Bauchhaut samt dem Subkutangewebe packen und anheben. Eine tiefe Subkutaninjektion durchführen. Hierzu die Kanüle in einem Winkel von mindestens 45° tief einbringen. Nicht direkt in eine Vene spritzen. Den Kolben vorsichtig zurückziehen, um zu überprüfen, dass kein Blut angesaugt wird. Sollte in der Spritze Blut zu sehen sein, darf das Arzneimittel nicht weiter verwendet werden. In diesem Fall Vorgang abbrechen und Kanüle sowie Spritze verwerfen. Eine neue Dosis für den Patienten herstellen. 4.0 ml Firmagon 80 mg direkt nach der Herstellung injizieren. |
8. Bitte beachten: Die Injektionen sollten dort erfolgen, wo der Patient keinem Druck ausgesetzt ist, d.h. nicht zu nahe am Hosenbund oder Gürtel und auch nicht in der Nähe der Rippen. | |
Entsorgung
Keine besonderen Anforderungen für die Beseitigung. Ungebrauchte Ware oder Abfall muss im Einklang mit lokalen Vorschriften entsorgt werden.
Zulassungsnummer
59455 (Swissmedic)
Zulassungsinhaberin
Ferring AG, 6340 Baar
Stand der Information
Mai 2020
Composizione
Principi attivi
Degarelixum ut degarelixi acetas
Sostanze ausiliarie
Praeparatio cryodesiccata: mannitolum (E421)
Solvens: aqua ad injectabilia
Forma farmaceutica e quantità di principio attivo per unità
Liofilizzato e solvente per sospensione iniettabile per uso sottocutaneo.
Flaconcini con 120 mg di degarelix (sotto forma di acetato)
Solvente: siringa preriempita con 3 ml
1 ml di soluzione iniettabile contiene 40 mg di degarelix
Flaconcini con 80 mg di degarelix (sotto forma di acetato)
Solvente: siringa preriempita con 4.2 ml
1 ml di soluzione iniettabile contiene 20 mg di degarelix
Indicazioni/Possibilità d'impiego
Trattamento di pazienti con carcinoma prostatico avanzato ormone-dipendente. Come trattamento alternativo quando l'orchiectomia o la somministrazione di estrogeni non è indicata o non è accettabile per il paziente.
Posologia/Impiego
Posologia negli uomini adulti
Usare soltanto sotto la supervisione di un medico esperto nella terapia oncologica.
Firmagon è esclusivamente per uso sottocutaneo e non deve essere somministrato per via endovenosa.
Dopo una prima dose (dose iniziale) di 2 iniezioni sottocutanee da 120 mg (3 ml) ciascuna, effettuate nell'addome in sedi distinte, somministrare altri 80 mg (4 ml) per via sottocutanea nella cute dell'addome a distanza di un mese.
L'effetto terapeutico di Firmagon deve essere monitorato mediante il controllo dei parametri clinici e dopo il miglioramento dei disturbi legati alla castrazione o in caso di risposta tumorale inadeguata devono essere controllati i livelli di testosterone. Inoltre, deve essere monitorato l'antigene prostatico specifico (PSA) nel siero.
All'inizio della terapia non è necessario somministrare antiandrogeni.
Firmagon va somministrato mediante iniezione sottocutanea nell'addome. La sede di iniezione va cambiata regolarmente. Effettuare l'iniezione in aree non soggette a pressione, cioè non troppo vicino all'elastico dei pantaloni o alla cintura e non in prossimità delle costole.
Istruzioni posologiche speciali
Pazienti in età avanzata o con insufficienza epatica o renale
Nei pazienti anziani o nei pazienti con disturbi da lievi a moderati della funzionalità epatica o renale, la dose non deve essere modificata (vedere rubrica Farmacocinetica). Non sono ancora stati studiati pazienti con insufficienza epatica o renale severa, e pertanto in questi pazienti è richiesta prudenza.
Nelle donne, Firmagon non è stato studiato e quindi non deve essere usato (vedere Controindicazioni).
Bambini e adolescenti
Non esiste alcuna indicazione per bambini e adolescenti (vedere Controindicazioni).
Controindicazioni
Ipersensibilità al degarelix o a uno qualsiasi degli altri componenti.
Nelle donne e nei pazienti pediatrici, la somministrazione di Firmagon è controindicata.
Avvertenze e misure precauzionali
Compromissione dell'intervallo QT/QTc
Nella deprivazione androgenica a lungo termine, nel 20% circa dei pazienti si osserva un prolungamento dell'intervallo QT (vedere Proprietà/effetti). Il medico curante deve valutare con attenzione se, nei pazienti con valori QT al basale >450 ms (ad esempio prolungamento congenito del QT) o nei pazienti con anamnesi o fattori di rischio per torsione di punta, i benefici della deprivazione androgenica superino il potenziale rischio.
Evitare un trattamento concomitante con sostanze che prolungano il tempo QT (quali gli antiaritmici di classe IA [ad es. chinidina, procainamide] e di classe III [ad es. amiodarone, sotalolo]). Per ulteriori informazioni sull'efficacia clinica, vedere rubrica Proprietà/effetti.
Alterazioni della densità ossea
Negli studi clinici con degarelix non è stata misurata la densità ossea. Tuttavia, sotto trattamento con agonisti di GnRH e in pazienti sottoposti a orchiectomia è stata segnalata una riduzione della densità ossea. Si prevede che anche la soppressione a lungo termine del testosterone con degarelix abbia effetti sulla densità ossea.
Interazioni
Non sono stati condotti studi clinici su possibili interazioni con altri principi attivi.
Degarelix non è un substrato del sistema del CYP450 umano e in vitro non è stata osservata alcuna induzione o inibizione significativa di CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 o CYP3A4/5. Inoltre, non sono state osservate interazioni tra degarelix e i trasportatori rilevanti deputati all'efflusso e all'assorbimento dei farmaci che sono stati studiati. Pertanto, sono improbabili interazioni farmacocinetiche clinicamente rilevanti con altri principi attivi.
Gravidanza/Allattamento
Firmagon non deve essere somministrato a donne in gravidanza e durante l'allattamento (vedere Controindicazioni). A causa delle sue proprietà farmacologiche, la somministrazione di Firmagon durante la gravidanza può causare danni fetali.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Firmagon ha un effetto limitato sulla capacità di guidare veicoli o sulla capacità di utilizzare macchine.
Non sono stati effettuati studi sugli effetti di Firmagon sulla capacità di guidare veicoli e sulla capacità di utilizzare macchine.
Tuttavia, come effetti indesiderati sono stati comunemente osservati stanchezza e sensazione di capogiro, che possono compromettere la capacità di guidare veicoli e la capacità di utilizzare macchine.
Effetti indesiderati
La maggior parte degli effetti indesiderati osservati con degarelix è dovuta alla soppressione del testosterone.
Gli effetti collaterali più comuni osservati nello studio comparativo di fase III (n=409) sono stati vampate di calore e aumento di peso (rispettivamente nel 25% e 7%, effetti fisiologici della soppressione del testosterone). Inoltre, molto comunemente si sono manifestate reazioni nella sede di iniezione, comprendenti soprattutto dolore ed eritema, rispettivamente nel 28% e 17% dei pazienti, gonfiore (6%), indurimento (4%) e formazione di noduli (3%). Questi eventi sono stati più frequenti all'inizio del trattamento. Molto raramente si sono manifestate reazioni gravi nella sede di iniezione, quali infezioni, ascessi o necrosi, che hanno richiesto un trattamento chirurgico o un drenaggio.
Di seguito sono riportati gli effetti indesiderati osservati negli studi di fase II e III. In questi studi, un totale di 1259 pazienti è stato esposto a degarelix, per un'esposizione totale di 1781 anni-paziente. Di questi, 803 pazienti sono stati esposti a degarelix per un anno o più, 359 pazienti sono stati esposti per 2 anni o più e 153 pazienti sono stati esposti per 3 anni o più.
Gli effetti indesiderati sono classificati in base alle seguenti frequenze: molto comune ≥1/10, comune ≥1/100 e <1/10, non comune ≥1/1000 e <1/100, raro ≥1/10'000 e <1/1000. All'interno di ciascuna classe di frequenza, gli effetti indesiderati sono riportati in ordine crescente di gravità.
Patologie del sistema emolinfopoietico
Comune: anemia.
Raro: febbre neutropenica.
Disturbi del sistema immunitario
Raro: reazioni di ipersensibilità quali anafilassi, angioedema.
Disturbi del metabolismo e della nutrizione
Comune: aumento di peso.
Non comune: iperglicemia/diabete mellito, aumento del colesterolo, perdita di peso, riduzione dell'appetito, alterazioni del calcio sierico.
Raro: iperkaliemia.
Disturbi psichiatrici
Comune: insonnia.
Non comune: riduzione della libido, depressione, disturbi psichici.
Molto raro: ansietà, sbalzi d'umore.
Patologie del sistema nervoso
Comune: capogiro, cefalea.
Non comune: ipoestesia.
Patologie dell'occhio
Non comune: visione offuscata.
Patologie cardiache
Non comune: palpitazioni, aritmie cardiache (incl. fibrillazione atriale), prolungamento del QT.
Raro: infarto miocardico, insufficienza cardiaca congestizia.
Patologie vascolari
Molto comune: vampate di calore (31%).
Non comune: ipertensione, reazione vasovagale (incl. ipotensione).
Patologie respiratorie, toraciche e mediastiniche
Non comune: dispnea.
Patologie gastrointestinali
Comune: nausea, diarrea.
Non comune: stipsi, dolore addominale, secchezza della bocca, vomito.
Patologie epatobiliari
Comune: aumento delle transaminasi.
Non comune: aumento della bilirubina, aumento della fosfatasi alcalina.
Patologie della cute e del tessuto sottocutaneo
Comune: iperidrosi (incl. sudorazione notturna), eruzione cutanea.
Non comune: eritema, prurito, orticaria, noduli cutanei, alopecia.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Comune: dolore muscolare.
Non comune: artralgia, debolezza muscolare, gonfiore/rigidità articolare, crampi muscolari, osteopenia/ osteoporosi.
Raro: rabdomiolisi.
Patologie renali e urinarie
Non comune: aumentata urgenza urinaria, pollachiuria, nicturia, disuria, incontinenza, disturbi della funzionalità renale.
Patologie dell'apparato riproduttivo e della mammella
Comune: ginecomastia, disfunzione erettile, atrofia dei testicoli.
Non comune: dolore al petto, irritazione dei genitali, dolore ai testicoli, dolore al basso ventre, disturbi dell'eiaculazione.
Patologie sistemiche e condizioni relative alla sede di somministrazione
Molto comune: reazioni nella sede di iniezione (26%) (ad es. dolore, eritema, gonfiore).
Comune: stanchezza, febbre, brividi, sintomi simil-influenzali.
Non comune: malessere, edema periferico.
Molto raro: reazioni gravi nella sede di iniezione quali infezioni, ascessi o necrosi.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-benefico del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Non sono stati riportati casi di sovradosaggio.
In caso di sovradosaggio, il paziente deve essere controllato e, se necessario, devono essere adottate opportune misure di supporto.
Proprietà/Effetti
Codice ATC
L02BX02
Meccanismo d'azione
Degarelix è un antagonista selettivo dei recettori di GnRH che si lega in modo competitivo e reversibile ai recettori di GnRH dell'ipofisi, bloccando rapidamente il rilascio di gonadotropine. Di conseguenza, induce una castrazione ormonale.
Una dose singola di Firmagon di 240 mg, seguita da una dose di mantenimento mensile di 80 mg, induce una rapida riduzione di LH e FSH e, di conseguenza, del testosterone. I livelli plasmatici di diidrotestosterone (DHT) si riducono in modo analogo a quelli del testosterone.
Al contrario degli agonisti di GnRH, l'antagonista di GnRH degarelix non induce un aumento iniziale di LH e testosterone.
Con degarelix, i livelli di testosterone sono stati ridotti al di sotto del livello di castrazione di 0.5 ng/ml, e con la dose di mantenimento mensile di 80 mg si ottiene una soppressione duratura del testosterone per la durata di un anno nel 97% dei pazienti. I livelli medi di testosterone dopo un trattamento di un anno sono stati di 0.087 ng/ml [differenza interquartile 0.06 – 0.15] n=167.
Farmacodinamica
Vedere rubrica «Meccanismo d'azione»
Efficacia clinica
L'efficacia di degarelix è stata valutata in uno studio randomizzato, in aperto, a tre bracci, di fase III, condotto su n=620 pazienti di età compresa tra 47 e 98 anni, della durata di 1 anno. La somministrazione di degarelix a una dose iniziale di 240 mg seguita da dosi mensili di 160 mg o 80 mg per via sottocutanea è stata confrontata con leuprorelina 7.5 mg/mese per via intramuscolare. Dei pazienti randomizzati, il 31% presentava un carcinoma prostatico locale, il 29% un carcinoma prostatico locale avanzato e il 20% un carcinoma prostatico metastatico; nel 7% lo stato delle metastasi non era noto e il 13% era stato sottoposto a prostatectomia o terapia radiante.
Un totale di 504 pazienti (81%) ha terminato lo studio. Nel braccio di trattamento con degarelix 240 mg/80 mg, 41 pazienti (20%) hanno interrotto lo studio, nel gruppo con leuprorelina 32 pazienti (16%). L'endpoint primario era la dimostrazione che degarelix induce una soppressione del testosterone (a <0.5 ng/ml) della durata di 12 mesi. Con degarelix, questa è stata raggiunta nel 97.2% (93.5; 98.8%), con leuprorelina nel 96.4% (92.5; 98.2%). La differenza tra degarelix (entrambi i bracci) e leuprorelina è stata dell'1.9% (IC 97.5%: -1.8; 5.7); pertanto, i criteri di non inferiorità sono stati soddisfatti.
In nessuno dei pazienti trattati con degarelix è stato osservato un aumento del testosterone; fino al giorno 3, i livelli di testosterone si sono ridotti in media del 94%.
Come endpoint secondario è stato studiato, tra altri, il PSA. Due settimane dopo la somministrazione di degarelix, il PSA è diminuito del 64%, dopo un mese dell'85%, dopo tre mesi del 95% ed è rimasto soppresso per l'intero periodo di trattamento di un anno (riduzione del 97% circa rispetto al valore basale). Ai giorni 14 e 28, con degarelix (240 mg/80 mg) i valori di PSA erano significativamente più bassi rispetto a quelli osservati con leuprorelina (p<0.001). Dal giorno 56 non sono più state riscontrate differenze significative tra degarelix e il comparatore. Le dimensioni del tumore non sono state direttamente determinate negli studi clinici.
Reversibilità del testosterone
In uno studio comprendente pazienti con valori crescenti di PSA dopo trattamento locale (soprattutto prostatectomia radicale e terapia radiante), Firmagon è stato somministrato per sette mesi, seguito da un periodo di monitoraggio di sette mesi. Il tempo mediano al recupero dei valori di testosterone (>0.5 ng/ml, sopra il livello di castrazione) dopo il termine del trattamento è stato di 112 giorni (dall'inizio del periodo di monitoraggio, cioè 28 giorni dopo l'ultima iniezione). Il tempo mediano al raggiungimento di valori di testosterone >1.5 ng/ml (sopra il livello inferiore della norma) è stato di 168 giorni.
Effetto sul volume della prostata
In pazienti che necessitavano di una terapia ormonale prima della terapia radiante o in pazienti per i quali era prevista la castrazione farmacologica, un trattamento di tre mesi con degarelix (schema posologico 240/80 mg) ha portato a una riduzione del 37% del volume della prostata, determinato mediante ecografia transrettale (TRUS). La riduzione del volume della prostata era equivalente a quella ottenuta con goserelina in associazione con antiandrogeni per la profilassi delleriacutizzazioni.
Tempo QT
Nello studio comparativo con Firmagon e leuprorelina sono stati effettuati ECG a intervalli regolari. Con entrambi i principi attivi è stato osservato un prolungamento degli intervalli QT/QTc a oltre 450 ms nel 20% circa dei pazienti. Tra il basale e il termine dello studio, il prolungamento medio è stato di 12.3 ms (3.2%) per Firmagon e 16.7 ms (3.5%) per leuprorelina.
Un'analisi completa del tempo QT ha evidenziato che degarelix non ha effetti inerenti sull'intervallo QT/QTc. L'assenza di un effetto inerente di degarelix su ripolarizzazione cardiaca (QTcF), frequenza cardiaca, conduzione AV, depolarizzazione cardiaca e morfologia +++delle onde T o U è stata confermata in una popolazione di uomini sani (N=80) che hanno ricevuto un'infusione e.v. di degarelix di 60 minuti, che ha portato a una Cmax media di 222 ng/ml. Ciò corrisponde a circa 3-4 volte la Cmax raggiunta durante il trattamento del carcinoma prostatico.
Anticorpi anti-degarelix
Anticorpi anti-degarelix sono stati riscontrati nel 10% dei pazienti dopo un anno di trattamento con Firmagon e nel 29% dei pazienti dopo un massimo di 5.5 anni di trattamento. Non esistono dati che indichino che la sicurezza e l'efficacia della terapia con Firmagon siano compromesse dalla formazione di anticorpi dopo un trattamento di durata massima di 5.5 anni. Non sono disponibili dati relativi agli anticorpi dopo un trattamento di durata superiore a un anno.
Farmacocinetica
Assorbimento
Dopo somministrazione sottocutanea, Firmagon forma un deposito che rilascia degarelix nella circolazione.
Con la dose iniziale di 240 mg, la Cmax di 53.4 ng/ml viene raggiunta dopo 1-2 giorni. Allo stato stazionario, le concentrazioni di valle mediane di degarelix sono di 10.9 ng/ml.
Distribuzione
Il volume di distribuzione negli uomini anziani sani è di circa 1 l/kg. Il legame stimato con le proteine plasmatiche è del 90% circa.
Metabolismo
Degarelix viene degradato a peptidi nel fegato ed escreto prevalentemente nelle feci sotto forma di frammenti peptidici. Nel plasma non sono rilevabili metaboliti di rilievo.
Eliminazione
Il 20% circa della dose viene escreto immodificato per via renale. La clearance negli uomini anziani sani è di circa 35-50 ml/h/kg. L'eliminazione è bifasica, con un'emivita terminale di circa 43 giorni per la dose iniziale e 28 giorni per la dose di mantenimento.
Cinetica di gruppi di pazienti speciali
Disturbi della funzionalità renale
Non sono stati condotti studi su pazienti con compromissione della funzionalità renale.
Disturbi della funzionalità epatica
In pazienti con compromissione da lieve a moderata della funzionalità epatica non è stato osservato alcun aumento rilevante dell'esposizione rispetto ai soggetti sani. Degarelix non è stato studiato in pazienti con insufficienza epatica severa (Child Pugh C).
Pazienti anziani
L'analisi farmacocinetica di popolazione dei pazienti con carcinoma prostatico ha evidenziato solo variazioni limitate della clearance di degarelix in dipendenza dall'età e dal peso.
Dati preclinici
In studi sulla riproduzione, degarelix ha indotto un'infertilità reversibile negli animali di sesso maschile, dovuta all'effetto farmacologico.
Gli studi sulla riproduzione condotti con degarelix in animali di sesso femminile hanno mostrato i risultati attesi sulla base delle caratteristiche farmacologiche. Il medicamento ha portato a un prolungamento dose-dipendente del tempo all'accoppiamento e alla gestazione, a una riduzione del numero di corpi lutei, a un aumento delle perdite pre- e post-impianto, a un aumento del tasso di aborti, a un aumento delle perdite embrio-fetali precoci, a un aumento del tasso di parti prematuri e a un prolungamento del parto.
I dati degli studi convenzionali su farmacologia di sicurezza, tossicità per somministrazione ripetuta, tossicità per la riproduzione, genotossicità e potenziale cancerogeno non evidenziano alcun rischio particolare per l'essere umano.
Dagli studi sulla tossicità acuta, subacuta e cronica nel ratto e nella scimmia dopo somministrazione sottocutanea di degarelix non è emersa alcuna tossicità per organi bersaglio. Dopo somministrazione sottocutanea di dosi elevate di degarelix, gli animali hanno manifestato irritazioni locali dovute al principio attivo.
Degarelix non ha mostrato alcun potenziale mutageno.
Altre indicazioni
Incompatibilità
Poiché per questo medicamento non sono stati condotti studi di compatibilità, non lo si deve somministrare in combinazione con altri medicamenti.
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Stabilità dopo apertura
Dopo la ricostituzione (vedere descrizione più avanti), il prodotto deve essere iniettato immediatamente.
Il preparato non contiene conservanti. La stabilità chimico-fisica in uso è stata dimostrata per 1 ora a una temperatura di 25 °C. Per ragioni microbiologiche, il preparato pronto all'uso deve essere utilizzato immediatamente dopo l'apertura.
Indicazioni particolari concernenti l'immagazzinamento
Conservare fuori dalla portata dei bambini.
Conservare a temperatura ambiente (15-25 °C).
Non congelare.
Indicazioni per la manipolazione
Si sconsiglia di somministrare il medicamento a una dose diversa. La sospensione preparata deve presentarsi come soluzione limpida senza particelle indisciolte.
Preparazione del medicamento pronto all'uso
AVVERTENZA IMPORTANTE
Dopo il trasferimento di acqua sterile nel flaconcino contenente il liofilizzato:
•Non agitare mai il flaconcino
Istruzioni per la preparazione del medicamento pronto all'uso:
Firmagon 120 mg – dose iniziale:
La confezione contiene due unità di liofilizzato e 2 siringhe preriempite con solvente, da ricostituire prima dell'iniezione sottocutanea. Pertanto, ciascuno dei seguenti passaggi deve essere eseguito due volte.
Dopo ricostituzione, la concentrazione è di 40 mg/ml.
| 1. Rimuovere la confezione dell'adattatore per flaconcino. Applicare l'adattatore sul flaconcino contenente il liofilizzato. A questo scopo, premere l'adattatore verso il basso fino a perforare il tappo di gomma con la punta e a bloccare in sede l'adattatore. |
2. Preparare la siringa preriempita applicando lo stantuffo. | |
| 3. Rimuovere il cappuccio della siringa preriempita. Avvitare la siringa sull'adattatore del flaconcino contenente il liofilizzato. Trasferire l'acqua per preparazioni iniettabili nel flaconcino contenente la polvere liofilizzata premendo con attenzione. |
| 4. Lasciare la siringa inserita sull'adattatore e ruotare il flaconcino molto delicatamente. Ruotare il flaconcino fino a che il liquido appaia limpido e privo di polvere o particelle indisciolte. Se della polvere aderisce al flaconcino al di sopra del liquido, il flaconcino può essere inclinato leggermente. NON AGITARE PER EVITARE LA FORMAZIONE DI SCHIUMA. Un anello di bollicine d'aria sulla superficie del liquido non costituisce un problema. Benché nella maggior parte dei casi la preparazione della sospensione nel flaconcino sia molto più rapida, in alcuni casi può durare fino a 15 minuti. |
| 5. Capovolgere il flaconcino e tenerlo verticale. Aspirare 3.0 ml di soluzione Firmagon 120 mg nella siringa (tacca sulla siringa). Accertarsi di aspirare la quantità esatta. Eventualmente occorre inclinare leggermente il flaconcino. Rimuovere con attenzione eventuali bolle d'aria. |
6. Rimuovere la siringa dall'adattatore del flaconcino e applicare la cannula con il cono arancione (25G / 0.5 x 25 mm) per iniezione sottocutanea profonda sulla siringa. Rimuovere con attenzione eventuali bolle d'aria. | |
| 7. Prendere tra le dita e sollevare una piega cutanea sull'addome insieme al tessuto sottocutaneo. Praticare un'iniezione sottocutanea profonda. A questo scopo, inserire la cannula in profondità con un angolo di almeno 45°. Non iniettare direttamente in una vena. Ritirare delicatamente lo stantuffo e controllare che non venga aspirato sangue. Se si nota la presenza di sangue nella siringa, il medicamento non deve essere utilizzato. In tal caso, interrompere la procedura ed eliminare la cannula e la siringa. Preparare una nuova dose per il paziente. Iniettare 3.0 ml di Firmagon 120 mg direttamente dopo la preparazione. Ripetere la ricostituzione per la seconda dose. Scegliere una sede diversa per la seconda iniezione e iniettare 3.0 ml del secondo flaconcino. |
8. Attenzione: effettuare l'iniezione in aree non soggette a pressione, cioè non troppo vicino all'elastico dei pantaloni o alla cintura e non in prossimità delle costole. | |
Istruzioni per l'uso: Firmagon 80 mg
La confezione contiene 1 unità di liofilizzato e 1 siringa preriempita con solvente, da ricostituire per l'iniezione sottocutanea.
Dopo ricostituzione, la concentrazione è di 20 mg/ml.
| 1. Rimuovere la confezione dell'adattatore per flaconcino. Applicare l'adattatore sul flaconcino contenente il liofilizzato. A questo scopo, premere l'adattatore verso il basso fino a perforare il tappo di gomma con la punta e a bloccare in sede l'adattatore. |
2. Preparare la siringa preriempita applicando lo stantuffo. | |
| 3. Rimuovere il cappuccio della siringa preriempita. Avvitare la siringa sull'adattatore del flaconcino contenente il liofilizzato. Trasferire l'acqua per preparazioni iniettabili nel flaconcino contenente la polvere liofilizzata premendo con attenzione. |
| 4. Lasciare la siringa inserita sull'adattatore e ruotare il flaconcino molto delicatamente. Ruotare il flaconcino fino a che il liquido appaia limpido e privo di polvere o particelle indisciolte. Se della polvere aderisce al flaconcino al di sopra del liquido, il flaconcino può essere inclinato leggermente. NON AGITARE PER EVITARE LA FORMAZIONE DI SCHIUMA. Un anello di bollicine d'aria sulla superficie del liquido non costituisce un problema. Benché nella maggior parte dei casi la preparazione della sospensione nel flaconcino sia molto più rapida, in alcuni casi può durare fino a 15 minuti. |
| 5. Capovolgere il flaconcino e tenerlo verticale. Aspirare 4.0 ml di soluzione Firmagon 80 mg nella siringa (tacca sulla siringa). Accertarsi di aspirare la quantità esatta. Eventualmente occorre inclinare leggermente il flaconcino. Rimuovere con attenzione eventuali bolle d'aria. |
6. Rimuovere la siringa dall'adattatore del flaconcino e applicare la cannula con il cono arancione (25G / 0.5 x 25 mm) per iniezione sottocutanea profonda sulla siringa. Rimuovere con attenzione eventuali bolle d'aria. | |
| 7. Prendere tra le dita e sollevare una piega cutanea sull'addome insieme al tessuto sottocutaneo. Praticare un'iniezione sottocutanea profonda. A questo scopo, inserire la cannula in profondità con un angolo di almeno 45°. Non iniettare direttamente in una vena. Ritirare delicatamente lo stantuffo e controllare che non venga aspirato sangue. Se si nota la presenza di sangue nella siringa, il medicamento non deve essere utilizzato. In tal caso, interrompere la procedura ed eliminare la cannula e la siringa. Preparare una nuova dose per il paziente. Iniettare 4.0 ml di Firmagon 80 mg direttamente dopo la preparazione. |
8. Attenzione: effettuare l'iniezione in aree non soggette a pressione, cioè non troppo vicino all'elastico dei pantaloni o alla cintura e non in prossimità delle costole. | |
Smaltimento
Nessuna istruzione particolare per lo smaltimento. Smaltire gli eventuali residui o i rifiuti in conformità con le norme locali vigenti.
Numero dell'omologazione
59455 (Swissmedic)
Titolare dell’omologazione
Ferring AG, 6340 Baar
Stato dell'informazione
Maggio 2020
Composition
Principes actifs
Degarelixum ut degarelixi acetas
Excipients
Praeparatio cryodesiccata: mannitolum (E421)
Solvens: aqua ad injectabilia
Forme pharmaceutique et quantité de principe actif par unité
Lyophilisat et solvant pour la préparation d'une suspension injectable par voie sous-cutanée.
Flacons de 120 mg de dégarélix (sous forme d'acétate)
Solvant: Seringue préremplie avec 3 ml
1 ml de solution injectable contient 40 mg de dégarélix
Flacons de 80 mg de dégarélix (sous forme d'acétate).
Solvant: Seringue préremplie avec 4,2 ml.
1 ml de solution injectable contient 20 mg de dégarélix
Indications/Possibilités d’emploi
Pour le traitement de patients atteints d'un cancer de la prostate hormono-dépendant à un stade avancé. A titre d'alternative, lorsqu'une castration ou l'administration d'œstrogènes ne sont pas indiquées ou sont difficiles à imposer au patient.
Posologie/Mode d’emploi
Posologie pour un homme adulte
L'utilisation ne devrait se faire que sous la surveillance d'un cancérologue expérimenté.
Firmagon est destiné exclusivement à un usage sous-cutané; il ne doit pas être administré par voie i.v.
Après une dose initiale de 2 injections s.c. de 120 mg (3ml) chacune en deux sites abdominaux différents, on procédera à un mois d'intervalle à de nouvelles injections s.c. de 80 mg (4 ml) dans la peau de l'abdomen.
L'effet thérapeutique de Firmagon devra être vérifié par le contrôle des paramètres cliniques; en cas d'amélioration des douleurs consécutives à la castration ou lorsque la réponse tumorale est inadéquate, on contrôlera le taux de testostérone. On devrait également surveiller le PSA (antigène spécifique de la prostate) sérique.
Au début du traitement, point n'est besoin d'administrer de l'antiandrogène.
Firmagon est administré par injection s.c. abdominale. On changera régulièrement de site d'injection. Les injections doivent être réalisées dans une partie du corps non exposée à la pression, par exemple à distance de la taille, de la ceinture ou des côtes.
Instructions posologiques particulières
Patients âgés ou insuffisants hépatiques resp. rénaux
Chez les patients âgés ou chez les patients présentant une insuffisance hépatique ou rénale faible ou modérée, on n'aura pas besoin d'ajuster la dose (voir la section Pharmacocinétique). Les patients atteints d'une insuffisance hépatique ou rénale sévère n'ont pas encore été étudiés; on usera donc de prudence en leur administrant Firmagon.
Firmagon n'ayant pas été étudié chez la femme, il ne doit pas lui être administré (voir les Contre-indications).
Enfants et adolescents
Il n'existe pas d'indication correspondante chez l'enfant et l'adolescent (voir les Contre-indications).
Contre-indications
Hypersensibilité au dégarélix ou à l'un des constituants du produit.
Chez la femme et chez le patient pédiatrique, l'administration de Firmagon est contre-indiquée.
Mises en garde et précautions
Altération de l'intervalle QT/QTc
Lors de la privation au long cours d'androgène, un allongement de l'intervalle QT survient chez env. 20% des patients (voir Propriétés/Effets). Le médecin traitant devra évaluer soigneusement si les avantages d'une déprivation androgénique l'emportent sur le risque éventuel chez les patients présentant des valeurs initiales QT >450 ms (par exemple prolongation congénitale de QT) ou chez les patients ayant des antécédents ou des facteurs de risque de torsade de pointes.
Une comédication comportant des substances allongeant l'intervalle QT (comme par exemple les antiarythmiques de la classe IA [p.ex. quinidine, procaïnamide] et de la classe III [p.ex. amiodarone, sotalol]) est à éviter. Pour d'autres informations concernant l'efficacité clinique, voir la rubrique Propriétés/Effets.
Modifications de la densité osseuse
Les essais cliniques du dégarélix n'ont pas étudié la densité osseuse. Chez des patients sous traitement par des agonistes de la GnRH ainsi que chez des orchiectomisés, une diminution de la densité osseuse a été observée. Il convient d'en déduire qu'une suppression à long terme de la testostérone par dégarélix peut aussi influencer la densité osseuse.
Interactions
On ne dispose pas d'études cliniques sur les interactions avec d'autres principes actifs.
Le dégarélix n'est pas un substrat pour le système CYP450 de l'être humain; in vitro, on n'a pas pu démontrer d'induction resp. d'inhibition de CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 ou CYP3A4/5. Par ailleurs, aucune interaction de dégarélix avec les transporteurs pertinents testés d'efflux et d'absorption de médicaments n'a été observée. Ainsi, il apparaît que des interactions pharmacocinétiques cliniquement significatives avec d'autres principes actifs sont improbables.
Grossesse/Allaitement
Firmagon ne doit pas être administré aux femmes enceintes ou allaitantes (voir Contre-indications).
En raison des propriétés pharmacologiques, l'administration de Firmagon en cours de grossesse peut léser le fœtus.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Firmagon a une légère influence sur l'aptitude à la conduite ou l'utilisation de machines.
Aucune étude n'a été réalisée quant à l'effet de Firmagon sur l'aptitude à la conduite et à l'utilisation de machines.
Toutefois, au titre d'effets indésirables, fatigue et sensations de vertige ont été fréquemment observées qui pourraient diminuer l'aptitude à la conduite et à l'utilisation de machines.
Effets indésirables
La plupart des effets indésirables observés sous dégarélix sont la conséquence de la suppression de la testostérone.
Les effets secondaires les plus fréquents lors de l'essai comparatif de phase III (n= 409) ont été les bouffées de chaleur (25%) et la prise de poids (7%), effets physiologiques de la suppression de la testostérone. Par ailleurs, les réactions au site d'injection étaient très fréquentes chez les patients, surtout douleurs (28%) et érythème (17%), ainsi que tuméfaction (6%), induration (4%) et formation d'une nodosité (3%). Ces événements étaient plus fréquents en début de traitement. De très rares cas de réactions graves au site d'injection ont été rapportés telles qu'une infection, un abcès ou une nécrose, nécessitant un traitement chirurgical ou un drainage.
Les effets indésirables figurant ci-dessous ont été observés dans les essais cliniques de phase II et III, au cours desquels 1259 patients en tout ont été exposés au dégarélix, soit une durée d'exposition totale de 1781 années-patients. Parmi ces patients, 803 ont été exposés pendant un an ou plus au dégarélix, 359 pendant 2 ans et plus et 153 pendant 3 ans et plus.
Lors de l'évaluation des effets indésirables, les fréquences sont définies de la manière suivante: très fréquent ≥1/10, fréquent ≥1/100 et <1/10, occasionnel ≥1/1000 et <1/100, rare ≥1/10'000 et <1/1000. Dans chaque groupe de fréquence, les effets secondaires figurent par ordre de gravité.
Affections hématologiques et du système lymphatique
Fréquent: anémie.
Rare: fièvre neutropénique.
Affections du système immunitaire
Rare: réactions d'hypersensibilité telles qu'anaphylaxie, angiœdème.
Troubles du métabolisme et de la nutrition
Fréquent: prise de poids.
Occasionnel: hyperglycémie/diabète, taux de cholestérol élevé, perte de poids, perte d'appétit, modification du calcium sérique.
Rare: hyperkaliémie.
Affections psychiatriques
Fréquent: insomnie.
Occasionnel: libido diminuée, dépression, troubles psychiques.
Très rares: anxiété, variations d'humeur.
Affections du système nerveux
Fréquent: vertiges, céphalées.
Occasionnel: hypoesthésies.
Affections oculaires
Occasionnel: vision trouble.
Affections cardiaques
Occasionnel: palpitations, arythmies (y compris fibrillation auriculaire), allongement QT.
Rare: infarctus du myocarde, insuffisance cardiaque congestive.
Affections vasculaires
Très fréquent: bouffées de chaleur (31%).
Occasionnel: hypertension, réaction vasovagale (hypotension comprise).
Affections respiratoires, thoraciques et médiastinales
Occasionnel: dyspnée.
Affections gastro-intestinales
Fréquent: nausées, diarrhée.
Occasionnel: constipation, douleurs abdominales, sécheresse buccale, vomissements.
Affections hépatobiliaires
Fréquent: augmentation des transaminases.
Occasionnel: élévation du taux de bilirubine, augmentation de la phosphatase alcaline.
Affections de la peau et du tissu sous-cutané
Fréquent: hyperhidrose (sudation nocturne incluse), éruption cutanée.
Occasionnel: érythème, prurit, urticaire, nodosités, alopécie.
Affections musculosquelettiques et du tissu conjonctif
Fréquent: douleurs musculaires.
Occasionnel: arthralgie, faiblesse musculaire, tuméfaction/raideur articulaire, crampes musculaires, ostéopénie/ostéoporose.
Rare: rhabdomyolyse.
Affections du rein et des voies urinaires
Occasionnel: urgence mictionnelle plus fréquente, pollakiurie, nycturie, dysurie, incontinence, trouble de la fonction rénale.
Affections des organes de reproduction et du sein
Fréquent: gynécomastie, dysfonction érectile, atrophie testiculaire.
Occasionnel: douleurs de la poitrine, irritation des organes génitaux, douleurs testiculaires, douleurs abdominales, troubles éjaculatoires.
Troubles généraux et anomalies au site d'administration
Très fréquent: réactions au site d'injection (26%) (p.ex. douleurs, érythème, tuméfaction).
Fréquent: fatigue, fièvre avec frissons, symptômes para grippaux.
Occasionnel: malaise, œdème périphérique.
Très rare: réactions graves au site d'injection, telles qu'infections, abcès ou nécrose.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Aucun cas de surdosage n'a été rapporté à ce jour.
En présence d'un surdosage, on surveillera le patient en prenant le cas échéant les mesures de soutien qui conviennent.
Propriétés/Effets
Code ATC
L02BX02
Mécanisme d'action
Le dégarélix est un antagoniste sélectif des récepteurs de la GnRH, qui se fixe de manière compétitive et réversible sur les récepteurs de la GnRH de l'hypophyse, bloquant de la sorte rapidement la libération des gonadotrophines. Il s'ensuit une castration hormonale.
Une dose unique de Firmagon 240 mg, suivie d'une dose d'entretien mensuelle de 80 mg, permet une baisse rapide de la LH et de la FSH, puis de la testostérone. Le taux plasmatique de la dihydrotestostérone (DHT) diminue de façon analogue à celui de la testostérone.
Contrairement aux agonistes de la GnRH, le dégarélix, un antagoniste de la GnRH, n'induit pas une augmentation initiale de la LH et de la testostérone.
Sous dégarélix, les taux de testostérone ont été abaissés au-dessous du taux de castration de 0,5 ng/ml; on a montré que la dose d'entretien mensuelle de 80 mg entraîne chez 97% des patients une suppression durable de la testostérone sur un an. Le taux moyen de testostérone après un an de traitement est de 0,087 ng/ml (intervalle interquartile 0,06–0,15), n= 167.
Pharmacodynamique
Voir la rubrique « Mécanisme d'action ».
Efficacité clinique
L'efficacité du dégarélix a été étudiée pendant un an au cours d'un essai clinique de phase III randomisé, ouvert, en trois bras, chez n= 620 patients de 47 à 98 ans. Le dégarélix en administration sous-cutanée à la dose initiale de 240 mg suivie de doses mensuelles de 160 mg ou 80 mg, a été comparé à la leuproréline intramusculaire à raison de 7,5 mg/mois. Le carcinome de la prostate était local chez 31% des patients randomisés, local avancé chez 29% et métastatique chez 20%; chez 7%, l'état métastatique n'était pas connu, et 13% avaient été prostatectomisés ou irradiés.
Un total de 504 patients (81%) a terminé l'étude. Dans le bras de traitement sous dégarélix 240 mg/80 mg, 41 patients (20%) ont abandonné l'étude, contre 32 patients (16%) dans le groupe de la leuproréline. Le critère principal de jugement était la preuve que le médicament entraînait une suppression de la testostérone (à <0,5 ng/ml) durant plus de 12 mois. Sous dégarélix, ce critère a été rempli à 97,2% (93,5; 98,8%), sous leuproréline à 96,4% (92,5; 98,2%). La différence entre le dégarélix (deux bras) et la leuproréline était de 1,9% (IC 97,5%: –1,8; 5,7); de la sorte, les critères de non-infériorité étaient satisfaits.
Chez aucun des patients traités par le dégarélix, on n'a relevé une élévation de la testostérone; au jour 3, le taux de testostérone avait chuté en moyenne de 94%.
Le taux de PSA entre autres servait de critère secondaire de jugement. Deux semaines après l'application du dégarélix, le PSA avait diminué de 64%, après un mois de 85% et après trois mois de 95% pour rester supprimé pendant toute la durée d'un an du traitement (diminution d'env. 97% de la valeur initiale). Aux jours 14 et 28, le taux de PSA sous dégarélix (240 mg/80 mg) se situait significativement plus bas que sous leuproréline (p <0,001). Au jour 56, on n'observait plus de différence entre le dégarélix et le comparateur. La grosseur de la tumeur n'a pas été mesurée directement pendant les essais cliniques.
Réversibilité de la sécrétion de testostérone
Dans une étude ayant inclus des patients avec PSA en progression après traitement local (principalement prostatectomie et radiothérapie), Firmagon a été administré pendant sept mois, suivi par une période de surveillance de sept mois. Le temps médian écoulé jusqu'à la normalisation des valeurs de la testostérone (>0,5 ng/ml, au dessus du seuil de castration) après l'arrêt du traitement était 112 jours (calculé à partir du début de la période de surveillance, soit 28 jours après la dernière injection). La durée médiane pour atteindre un taux sérique de testostérone >1,5 ng/ml (au dessus de la limite inférieure des taux normaux) était de 168 jours.
Effet sur le volume de la prostate
Un traitement de trois mois avec dégarélix (240/80 mg schéma posologique) a entraîné une réduction de 37% du volume de la prostate, mesuré par échographie transrectale (TRUS) chez des patients nécessitant une hormonothérapie avant la radiothérapie ou chez des patients chez lesquels une castration médicale était prévue. La réduction du volume de la prostate était similaire à celle atteinte avec la goséréline, associée à un antiandrogène, pour prévenir le flare-up.
Temps QT
Dans l'étude comparant Firmagon à la leuproréline, des ECG ont été réalisés périodiquement. Des intervalles QT/QTc supérieurs à 450 ms ont été observés chez environ 20% des patients avec les deux traitements. Entre l'inclusion et la fin de l'étude, l'allongement médian a été de 12,3 ms (3,2%) avec Firmagon et de 16,7 ms (3,5%) avec la leuproréline.
Une investigation approfondie de l'intervalle QT a montré qu'il n'y avait pas d'effet intrinsèque de dégarélix sur l'intervalle QT/QTc. L'absence d'effets intrinsèques de dégarélix sur la repolarisation cardiaque (QTcF), le rythme cardiaque, la conduction auriculo-ventriculaire, la dépolarisation cardiaque, et la morphologie de l'onde T ou de l'onde U a été confirmée dans une population des volontaires sains (N = 80) ayant reçu une perfusion i.v. de dégarélix de 60 minutes, atteignant une Cmax moyenne de 222 ng/ml. Ceci représente approximativement 3 à 4 fois la Cmax obtenue pendant le traitement du cancer de la prostate.
Anticorps contre le dégarélix
L'apparition d'anticorps anti-dégarélix a été observée chez 10% des patients au cours du traitement par Firmagon d'une durée d'un an et des anticorps anti-dégarélix ont été observés chez 29% des patients traités par dégarélix pendant une durée pouvant aller jusqu' à 5,5 ans. On ne dispose pas d'indications démontrant que la sécurité d'emploi et l'efficacité de Firmagon soient altérées par la formation d'anticorps après 5,5 années de traitement. Des résultats concernant les anticorps n'ont pas été examinés au-delà d'un an de traitement.
Pharmacocinétique
Absorption
Après administration sous-cutanée, Firmagon constitue un dépôt d'où le dégarélix est introduit dans la circulation.
Avec la dose initiale de 240 mg, une Cmax de 53,4 ng/ml est atteinte en 1–2 jours. A l'état d'équilibre, la concentration médiane minimale est de 10,9 ng/ml.
Distribution
Chez l'homme âgé en bonne santé, le volume de distribution est d'environ 1 l/kg. La liaison aux protéines plasmatiques est évaluée à environ 90%.
Métabolisme
Le dégarélix est dégradé en peptides dans le foie; il est éliminé principalement dans les fèces sous forme de fragments peptidiques. On ne détecte pas de métabolites significatifs dans le plasma.
Élimination
Environ 20% de la dose sont excrétés par les reins sous forme de dégarélix inchangé. Chez l'homme âgé en bonne santé, la clairance est d'environ 35–50 ml/h/kg. L'élimination s'effectue en deux phases avec une demi-vie terminale d'environ 43 jours pour la dose initiale et de 28 jours pour la dose d'entretien.
Cinétique pour certains groupes de patients
Troubles de la fonction rénale
Aucune étude n'a été effectuée chez les patients à fonction rénale diminuée.
Troubles de la fonction hépatique
Les patients dont la fonction hépatique était légèrement ou moyennement diminuée n'ont pas présenté une augmentation notable de l'exposition par rapport aux personnes saines. Le dégarélix n'a pas été étudié chez les insuffisants hépatiques sévères (Child Pugh C).
Patients âgés
L'analyse pharmacocinétique de la population de patients atteints de carcinome de la prostate n'a montré que de faibles différences de clairance du dégarélix en fonction de l'âge et du poids.
Données précliniques
Dans les études de reproduction, le dégarélix a entraîné chez les animaux mâles une infertilité qui est due à l'effet pharmacologique.
Des études de reproduction portant sur le dégarélix chez l'animal femelle ont donné les résultats auxquels on pouvait s'attendre vu les propriétés pharmacologiques du médicament. Celui-ci a allongé de manière dose-dépendante le temps s'écoulant jusqu'à l'accouplement et à la grossesse tout en réduisant le nombre des corps jaunes et en augmentant les pertes pré- et postimplantatoires, en augmentant le taux des avortements, des pertes précoces d'embryons et de fœtus, des naissances précoces et en augmentant la durée des accouchements.
Basées sur les études conventionnelles traitant de la pharmacologie sécuritaire, de la toxicité de doses répétées, de la toxicité de reproduction, de la génotoxicité et du potentiel cancérogène, les données ne fournissent aucune indication particulière relative à des dangers courus par l'être humain.
Les études de la toxicité aiguë, subaiguë et chronique chez le rat et le singe après l'administration s.c. de dégarélix n'ont pas révélé de toxicité pour les organes-cibles. De fortes doses s.c. de dégarélix ont provoqué chez l'animal une irritation locale due au principe actif.
Le dégarélix n'a pas montré de potentiel mutagène.
Remarques particulières
Incompatibilités
Aucune étude de tolérance n'ayant été effectuée, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Stabilité après ouverture
Après la reconstitution (voir la description ci-dessous), le produit doit être injecté sur-le-champ.
La préparation ne contient pas de conservateur. Sa stabilité chimique et physique « in use » a été démontrée pendant 1 heure à 25 °C. Pour des raisons microbiologiques, la préparation prête à l'emploi doit être utilisée immédiatement après ouverture.
Remarques particulières concernant le stockage
Conserver hors de portée des enfants.
Conserver à température ambiante (15-25 °C).
Ne pas congeler.
Remarques concernant la manipulation
On évitera d'administrer le médicament à une posologie différente. La suspension préparée devrait former une solution limpide sans particules non dissoutes.
Préparation du médicament prêt à l'emploi
REMARQUE IMPORTANTE
Après avoir introduit l'eau stérile dans le flacon concernant le lyophilisat:
– Ne jamais secouer le flacon.
Mode d'emploi pour la préparation du médicament prêt à l'emploi:
Firmagon 120 mg – dose initiale
L'emballage contient deux sets de lyophilisat et 2 seringues préremplies avec solvant devant être reconstitué pour l'injection sous-cutanée. Cela signifie que chacune des étapes suivantes doit être effectuée deux fois.
Après reconstitution, la concentration est de 40 mg/ml.
| 1. Enlever l'emballage des adaptateurs pour flacons. Fixer l'adaptateur sur le flacon perforable de lyophilisat. A cette fin, exercer une pression sur l'adaptateur jusqu'à ce que la pointe perce le bouchon en caoutchouc, et qu'un déclic indique la mise en place de l'adaptateur. |
2.Préparer la seringue préremplie en fixant la tige de piston. | |
| 3.Retirer le capuchon de protection de la seringue préremplie. Visser la seringue sur l'adaptateur du flacon perforable de lyophilisat. Comprimer doucement l'eau stérile pour préparations injectables dans le flacon perforable contenant la poudre lyophilisée. |
| 4 Laisser la seringue sur l'adaptateur et faire tourner très prudemment le flacon jusqu'à ce que la solution apparaisse limpide et ne présente ni reste de poudre ni particule. Si de la poudre reste sur la paroi du flacon au-dessus du liquide, le flacon peut être incliné légèrement. NE PAS AGITER POUR EVITER LA FORMATION DE MOUSSE. Un anneau de petites bulles d'air à la surface du liquide ne pose pas problème. Dans la plupart des cas, la préparation de la suspension est rapide, mais peut parfois durer jusqu'à 15 minutes. |
| 5. Retourner le flacon et le tenir à la verticale, prélever avec la seringue 3,0 ml de solution Firmagon 120 mg (marquage sur la seringue). Il faut s'assurer de prélever le volume exact. Si nécessaire, le flacon peut s'incliner légèrement à cet effet. Eliminer avec précaution d'éventuelles bulles d'air. |
6. Retirer la seringue de l'adaptateur du flacon et placer sur elle l'aiguille à cône orange (25G/0,5× 25 mm) pour injection sous-cutanée profonde. Eliminer avec précaution d'éventuelles bulles d'air. | |
| 7. Saisir la peau de l'abdomen avec le tissu sous-cutané et la soulever. Pratiquer une injection sous-cutanée profonde. Pour ce faire, insérer profondément l'aiguille à un angle d'au moins 45°. Surtout ne pas injecter dans une veine. Retirer le piston avec précaution pour vérifier l'absence de sang. Si du sang devait apparaître dans la seringue, le médicament ne doit pas être appliqué. Dans ce cas, interrompre le processus et éliminer l'aiguille et la seringue. Préparer une nouvelle dose pour le patient. Injecter 3,0 ml de Firmagon 120 mg immédiatement après la préparation. Répéter la reconstitution pour la deuxième dose. Choisir un autre site pour la deuxième injection et injecter 3,0 ml provenant du deuxième flacon. |
8. À noter: Les injections doivent être pratiquées là où le patient n'est pas exposé à des pressions, c'est-à-dire pas trop près de la taille, de la ceinture et pas non plus à proximité des côtes. | |
Mode d'emploi de Firmagon 80 mg
L'emballage contient 1 set de lyophilisat et 1 seringue préremplie avec solvant devant être reconstitué avant l'injection sous-cutanée.
Après reconstitution, la concentration est de 20 mg/ml.
| 1. Enlever l'emballage des adaptateurs pour flacons. Fixer l'adaptateur sur le flacon perforable de lyophilisat. A cette fin, exercer une pression sur l'adaptateur jusqu'à ce que la pointe perce le bouchon en caoutchouc, et qu'un déclic indique la mise en place de l'adaptateur. |
2. Préparer la seringue préremplie en fixant la tige de piston. | |
| 3. Retirer le capuchon de protection de la seringue préremplie. Visser la seringue sur l'adaptateur du flacon perforable de lyophilisat. Comprimer doucement l'eau stérile pour préparations injectables dans le flacon perforable contenant la poudre lyophilisée. |
| 4. Laisser la seringue sur l'adaptateur et faire tourner très prudemment le flacon jusqu'à ce que la solution apparaisse limpide et ne présente ni reste de poudre ni particule. Si de la poudre reste sur la paroi du flacon au-dessus du liquide, le flacon peut être incliné légèrement. NE PAS AGITER POUR EVITER LA FORMATION DE MOUSSE. Un anneau de petites bulles d'air à la surface du liquide ne pose pas problème. Dans la plupart des cas, la préparation de la suspension est rapide, mais peut parfois durer jusqu'à 15 minutes. |
| 5. Retourner le flacon et le tenir à la verticale, prélever avec la seringue 4,0 ml de solution Firmagon 80 mg (marquage sur la seringue). Il faut s'assurer de prélever le volume exact. Si nécessaire, le flacon peut s'incliner légèrement à cet effet. Eliminer avec précaution d'éventuelles bulles d'air. |
6. Retirer la seringue de l'adaptateur du flacon et placer sur elle l'aiguille à cône orange (25G/0,5× 25 mm) pour injection sous-cutanée profonde. Eliminer avec précaution d'éventuelles bulles d'air. | |
| 7. Saisir la peau de l'abdomen avec le tissu sous-cutané et la soulever. Pratiquer une injection sous-cutanée profonde. Pour ce faire, insérer profondément l'aiguille à un angle d'au moins 45°. Surtout ne pas injecter dans une veine. Retirer le piston avec précaution pour vérifier l'absence de sang. Si du sang devait apparaître dans la seringue, le médicament ne doit pas être appliqué. Dans ce cas, interrompre le processus et éliminer l'aiguille et la seringue. Préparer une nouvelle dose pour le patient. Injecter 4,0 ml de Firmagon 80 mg immédiatement après la préparation. |
8. À noter: Les injections doivent être pratiquées là où le patient n'est pas exposé à des pressions, c'est-à-dire pas trop près de la taille, de la ceinture et pas non plus à proximité des côtes. | |
Élimination
Il n'y a pas d'exigences particulières d'élimination. Les produits non utilisés ou les déchets doivent être éliminés conformément aux prescriptions locales.
Numéro d’autorisation
59455 (Swissmedic)
Titulaire de l’autorisation
Ferring AG, 6340 Baar
Mise à jour de l’information
Mai 2020
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

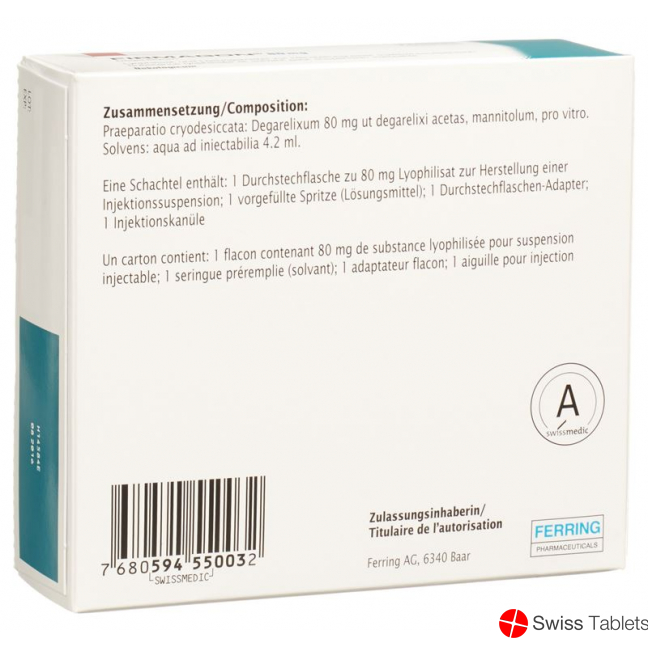
 Deutsch
Deutsch French
French Italian
Italian