Implanon NXT implant buy online
Implanon NXT Implant
-
663.96 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: MERCK SHARP & DOHME AG
- Product Code: 5669937
- ATC-code G03AC08
- EAN 7680612980025
Ingredients:
Bariumsulfat 15 mg, Magnesium stearat, Etonogestrel 68 mg , Ethylen-Vinylacetat-Copolymer.

Description
Was ist Implanon NXT und wann wird es angewendet?
Auf Verschreibung des Arztes oder der Ärztin.
Implanon NXT ist ein Empfängnisverhütungsmittel, das vom Arzt bzw. der Ärztin mit einem Applikator direkt unter die Haut eingesetzt (implantiert) wird. Implanon NXT besteht aus einem kleinen, biologisch nicht abbaubaren, biegsamen Kunststoffstäbchen (Länge 4 cm; Durchmesser 2 mm). Das Stäbchen enthält als Wirkstoff 68 mg Etonogestrel, ein weibliches Geschlechtshormon, das in die Gruppe der Gestagene gehört. Nach der Implantation gibt Implanon NXT Etonogestrel in kleinsten Mengen langsam und kontinuierlich in die Blutbahn ab und entfaltet so seine empfängnisverhütende Wirkung. Diese beruht einerseits auf einer Hemmung des Eisprungs (Ovulation), andererseits auf einer Verdickung des Gebärmutterhalsschleims, wodurch das Aufsteigen von Spermien in die Gebärmutter erschwert wird. Es gibt einzelne Berichte über ungewollte Schwangerschaften, wobei in den meisten Fällen ein falsches Einsetzen bzw. Nichteinsetzen des Implantats die Ursache dafür war.
Neben dem Wirkstoff Etonogestrel enthält das Stäbchen Bariumsulfat, damit man es durch Röntgen nachweisen kann.
Implanon NXT kann jederzeit wieder entfernt werden. Es sollte jedoch spätestens nach 3 Jahren wieder entfernt und gegebenenfalls durch ein neues Implantat ersetzt werden. Bei Frauen mit einem Körpergewicht >80 kg kann ein früheres Ersetzen des Implantats notwendig sein. Nach dem Entfernen von Implanon NXT stellen sich der normale Zyklus und damit die Fruchtbarkeit rasch wieder ein, in der Regel innerhalb eines Monats.
Was sollte dazu beachtet werden?
Implanon NXT gewährt keinen Schutz vor einer HIV-Infektion (AIDS) oder anderen sexuell übertragbaren Krankheiten.
Vor dem Einsetzen von Implanon NXT wird Ihr Arzt bzw. Ihre Ärztin eine sorgfältige Eigen- und Familienanamnese (Abklärung von eigenen Krankheiten und Krankheiten in der Familie) erheben und eine allgemeine und gynäkologische Untersuchung durchführen. Eine Schwangerschaft ist auszuschliessen.
Während der Anwendung von Implanon NXT wird Ihr Arzt bzw. Ihre Ärztin Sie zu regelmässigen Kontrolluntersuchungen auffordern.
Wann darf Implanon NXT nicht angewendet werden?
Ihr Arzt bzw. Ihre Ärztin entscheidet, ob Sie Implanon NXT anwenden können oder aber aus medizinischen Gründen nicht verwenden dürfen.
Implanon NXT darf nicht angewendet werden
- bei vermuteter oder bestehender Schwangerschaft,
- bei nicht ärztlich abgeklärten, ungewöhnlichen Scheidenblutungen,
- bei bestehenden oder vermuteten geschlechtshormonabhängigen Krebserkrankungen (Brustkrebs oder Krebs der Genitalorgane),
- bei bestehenden Blutgerinnseln z.B. in den Beinen (Thrombose) oder Lungen (Embolie), im Herz (Herzinfarkt) oder Gehirn (Hirnschlag),
- bei früheren oder bestehenden schweren Lebererkrankungen und sich die Leberfunktion noch nicht normalisiert hat,
- bei früheren oder bestehenden gut- oder bösartigen Lebertumoren,
- sowie bei bekannter oder vermuteter Überempfindlichkeit auf einen der Inhaltsstoffe von Implanon NXT.
Wann ist bei der Anwendung von Implanon NXT Vorsicht geboten?
Informieren Sie bitte Ihren Arzt bzw. Ihre Ärztin, wenn Sie an einem der nachfolgend aufgeführten Zustände leiden oder gelitten haben, da Implanon NXT in diesen Fällen mit entsprechender Vorsicht angewendet werden sollte. Ihr Arzt bzw. Ihre Ärztin wird Sie diesbezüglich informieren:
Erstmaliges Auftreten oder Verschlimmern der folgenden Erscheinungen während einer früheren Schwangerschaft oder Hormonbehandlung: Gelbverfärbung von Haut oder Augen (Gelbsucht) oder schwerer Juckreiz; Gallensteine; Porphyrie (eine Stoffwechselstörung der Leber); systemischer Lupus erythematodes (SLE: eine Autoimmunkrankheit, die zahlreiche Körperstellen befällt); hämolytisch-urämisches Syndrom (eine unbestimmte Störung des Blutes, die zu Nierenversagen führt); Chorea (eine neurologische Störung); Depressionen; Schwangerschafts-Herpes (durch Herpesviren verursachter Bläschenausschlag); Verschlechterung des Hörvermögens (Otosklerose) und (erbliches) Angioödem (wiederkehrende Schwellungen von Haut, Schleimhaut oder inneren Organen).
Gelegentlich kann ein Chloasma (hellgelbe bis dunkelbraune Schwangerschaftsflecken, vor allem im Gesicht) auftreten, speziell bei Frauen, bei denen dies bereits während einer früheren Schwangerschaft oder Hormonbehandlung der Fall war. Trifft dies bei Ihnen zu, so vermeiden Sie eine direkte Einwirkung von Sonnenlicht und ultravioletter Strahlung.
Informieren Sie bitte Ihren Arzt bzw. Ihre Ärztin bei
- Zuckerkrankheit; Implanon NXT kann den Blutzuckerspiegel beeinflussen.
- Bluthochdruck; der Blutdruck kann unter Anwendung von Implanon NXT ansteigen.
- Erhöhten Blutfettwerten.
Thrombose
Bei Frauen, die kombinierte hormonale Empfängnisverhütungsmittel anwenden, besteht ein erhöhtes Risiko für Gerinnselbildung in den Venen und Arterien (venöse und arterielle thromboembolische Krankheiten), welche zu schweren Gesundheitsschäden führen kann. Ein Blutgerinnsel kann ein Blutgefäss verstopfen (z.B. eine tiefe Venenthrombose im Bein). Wenn sich dieses Gerinnsel von der Venenwand loslöst, kann es weiterwandern und die Lungenarterien verstopfen, was zu einer sogenannten Lungenembolie führt. Blutgerinnsel können sehr selten auch in den Blutgefässen des Herzens auftreten (was zu einem Herzinfarkt führen kann). Blutgerinnsel oder aufgeplatzte Blutgefässe im Gehirn können einen Schlaganfall verursachen. Das Thromboserisiko bei Einnahme kombinierter hormonaler Empfängnisverhütungsmittel ist aber kleiner als bei einer Schwangerschaft. Das Risiko bei einem rein gestagenen Verhütungsmittel, wie es Implanon NXT ist, ist nicht bekannt. Nach Markteinführung wurde bei Anwenderinnen von Etonogestrel-Implantaten über Gerinnselbildungen wie Thrombosen der tiefen Beinvenen, Lungenembolien, Herzinfarkte und Schlaganfälle berichtet. Wenn Sie mögliche Zeichen einer Thrombose bemerken, sollten Sie unverzüglich Ihren Arzt bzw. Ihre Ärztin aufsuchen (vgl. auch den Abschnitt «Informieren Sie Ihren Arzt bzw. Ihre Ärztin unverzüglich, wenn...»).
Krebs
Frauen, die ein kombiniertes hormonales Empfängnisverhütungsmittel anwenden, haben ein leicht erhöhtes Risiko, an einem Brustkrebs zu erkranken im Vergleich zu Frauen, die kein kombiniertes hormonales Empfängnisverhütungsmittel anwenden. Nach Absetzen des hormonalen Empfängnisverhütungsmittels geht das geringfügig erhöhte Risiko während eines Zeitraumes von ca. 10 Jahren allmählich wieder auf das ursprüngliche Risiko zurück. Es ist nicht bekannt, ob der Unterschied durch das kombinierte hormonale Empfängnisverhütungsmittel verursacht wird. Möglicherweise wurden diese Frauen sorgfältiger und öfter untersucht, so dass der Brustkrebs früher erkannt wurde. Für Implanon NXT liegen nicht genügend Daten vor, um zum Brustkrebsrisiko genaue Aussagen zu machen. Tasten Sie Ihre Brüste regelmässig ab und informieren Sie Ihren Arzt bzw. Ihre Ärztin, wenn Sie einen Knoten in der Brust ertasten.
In seltenen Fällen wurde über gutartige und (sehr selten) bösartige Lebertumore berichtet. Informieren Sie Ihren Arzt/Ihre Ärztin sofort, wenn Sie starke Bauchschmerzen verspüren.
Eierstockzysten
Bei der Anwendung niedrigdosierter hormonaler Kontrazeptiva wie Implanon NXT können sich die Eizellen in den Eierstöcken entwickeln und zu Follikel werden, die grösser als bei einem normalen Zyklus sind. Sie werden dann Eierstockzysten genannt. Diese verschwinden in der Regel von alleine. Manchmal können sie leichte Unterleibsbeschwerden verursachen. Nur selten ergeben sich daraus schwerwiegendere Probleme.
Psychiatrische Erkrankungen
Manche Frauen, die hormonelle Verhütungsmittel wie Implanon NXT anwenden, berichten über Depression oder depressive Verstimmung. Depressionen können schwerwiegend sein und gelegentlich zu Selbsttötungsgedanken führen. Wenn bei Ihnen Stimmungsschwankungen und depressive Symptome auftreten, lassen Sie sich so rasch wie möglich von einem Arzt/einer Ärztin medizinisch beraten.
Veränderungen des menstruellen Blutungsmusters
Während der Verwendung von Implanon NXT kann es zu Blutungsunregelmässigkeiten (häufigere oder länger anhaltende Blutungen) kommen oder die Blutung kann auch ganz ausbleiben. Dies bedeutet nicht, dass Implanon NXT für Sie nicht geeignet ist, oder Sie nicht vor einer Schwangerschaft schützt. Im Allgemeinen müssen Sie in diesen Fällen nichts unternehmen. Bei sehr starker oder sehr lang anhaltender Blutung muss jedoch der Arzt bzw. die Ärztin unterrichtet werden. Das individuelle Blutungsmuster während der ersten drei Monate der Behandlung zeigt üblicherweise den zukünftigen Verlauf Ihrer Menstruation unter Implanon NXT.
Ereignisse im Zusammenhang mit dem Einsetzen und dem Entfernen
In seltenen Fällen kann es vorkommen, dass sich das Implantat von der ursprünglichen Implantationsstelle im Arm fortbewegt, falls es inkorrekt eingesetzt wurde oder durch äussere Einwirkung bedingt (z.B. Manipulieren am Implantat oder Kontaktsport). In diesen Fällen kann die Auffindung des Implantats schwieriger sein, und die Entfernung kann einen grösseren Einschnitt oder eine operative Entfernung im Spital erfordern. Falls das Implantat nicht gefunden werden kann und es keine Anzeichen dafür gibt, dass es ausgestossen wurde, können die Verhütung und das Risiko für Gestagen-bedingte unerwünschte Wirkungen länger anhalten, als Sie es wünschen.
In seltenen Fällen wurden Implantate in der Pulmonalarterie gefunden (ein Blutgefäss in der Lunge). Falls das Implantat nicht im Arm gefunden werden kann, wird Ihr Arzt bzw. Ihre Ärztin gegebenenfalls mittels Röntgen oder anderen bildgebenden Verfahren Ihren Brustkorb untersuchen. Falls das Implantat im Brustkorb gefunden wird, kann eine Operation nötig sein.
Es gab auch Berichte über Implantate, die im Arm der Patientin gebrochen sind. Das Entfernen von Implanon NXT kann dadurch erschwert sein und einen grösseren Einschnitt erfordern. Falls das Implantat nicht gefunden wird und es keinen Hinweis darauf gibt, dass es ausgestossen wurde, kann die Verhütung und das Risiko für Gestagen-bedingte unerwünschte Wirkungen länger anhalten als Sie es wünschen.
Wenn das Implantat in Ihrem Arm bricht oder sich verbiegt, sollte die Wirksamkeit des Implantates nicht vermindert sein. Kontaktieren Sie Ihren Arzt bzw. Ihre Ärztin, wenn Sie Fragen haben.
Andere Situationen
Bei einem Körpergewicht >80 kg könnte die Wirksamkeit von Implanon NXT im 3. Anwendungsjahr vermindert sein.
Das im Implanon NXT enthaltene Hormon kann die Ergebnisse bestimmter Blutuntersuchungen beeinflussen. Informieren Sie deshalb Ihren Arzt oder Ihre Ärztin, dass Sie Implanon NXT anwenden, wenn bei Ihnen eine Blutuntersuchung durchgeführt wird.
Informieren Sie Ihren Arzt bzw. Ihre Ärztin unverzüglich, wenn
- sich irgendeine Veränderung Ihres Gesundheitszustandes einstellt, insbesondere solche die in dieser Packungsbeilage beschrieben sind (siehe auch «Wann darf Implanon NXT nicht angewendet werden?» und «Wann ist bei der Anwendung von Implanon NXT Vorsicht geboten?»). Vergessen Sie dabei die Vorkommnisse in Ihrem unmittelbaren Familienkreis nicht;
- Sie plötzliche oder heftige Bauchschmerzen oder Gelbsucht haben (könnte auf Leberprobleme oder Gallensteine hindeuten);
- Sie einen Knoten in der Brust spüren;
- Sie einen plötzlichen heftigen Magenschmerz oder Schmerzen im Unterbauch spüren (könnte auf eine Schwangerschaft ausserhalb der Gebärmutter (Eileiter-Schwangerschaft) oder eine Eierstockzyste (kleine flüssigkeitsgefüllte Bläschen) hindeuten);
- Sie Verdacht auf eine Schwangerschaft haben;
- Sie mögliche Zeichen einer Thrombose bemerken, wie z.B.
- starke Schmerzen oder Schwellung in einem Bein;
- plötzliche stechende, unerklärliche Schmerzen oder Enge im Brustkorb;
- Atembeschwerden wie Atemnot;
- ungewöhnlichen Husten, besonders wenn dieser blutig ist;
- plötzliche starke Schmerzen in der Brust mit möglicher Ausstrahlung in den linken Arm;
- extremes Schwächegefühl;
- erstmaliges Auftreten einer Migräne oder jegliche ungewohnt starke und anhaltende oder häufiger auftretende Kopfschmerzen;
- plötzliche Seh-, Hör- oder andere Wahrnehmungsstörungen oder plötzliche Sprachstörungen;
- plötzliche Kraftlosigkeit/Gefühllosigkeit des Gesichtes, eines Armes oder Beines, vor allem einer Körperhälfte;
- motorische Störungen;
- Schwindel;
- Verlust des Bewusstseins mit oder ohne Krämpfe;
- erheblicher Blutdruckanstieg;
- Epileptische Anfälle zunehmen;
- sich Ihr Asthma verschlechtert;
- sich Ihre Herz- oder Nierenfunktionsstörungen verschlechtern;
- unübliche, starke Scheidenblutungen auftreten (dieses Symptom könnte auf Gebärmutterkrebs hindeuten);
- eine Operation geplant ist oder bei Bettlägerigkeit oder eingeschränkter Bewegungsmöglichkeit nach einem Unfall oder einer Operation;
- Überempfindlichkeitsreaktionen auftreten;
- Sie glauben, dass sich das Implantat von der ursprünglichen Stelle wegbewegt hat oder dass es ausgestossen wurde (siehe auch «Wie verwenden Sie Implanon NXT?»).
Wechselwirkungen mit anderen Arzneimitteln
Gewisse Arzneimittel können die empfängnisverhütende Wirkung von Implanon NXT beeinträchtigen: z.B. Arzneimittel gegen Epilepsie (z.B. Barbiturate, Phenytoin, Carbamazepin, Oxcarbazepin, Topiramat, Felbamat, Primidon), Arzneimittel gegen Tuberkulose (Rifampicin, Rifabutin), Arzneimittel gegen HIV (z.B. Ritonavir, Nelfinavir, Nevirapin, Efavirenz), gegen Hepatitis-C-Virus-Infektionen (z.B. Boceprevir, Telaprevir), Arzneimittel gegen Bluthochdruck in den Blutgefässen der Lunge (Bosentan), Arzneimittel gegen eine spezielle Art der übermässigen Schläfrigkeit (Modafinil) sowie Johanniskraut-Präparate (Hypericum) gegen depressive Verstimmungen.
Informieren Sie immer Ihren Arzt/Ihre Ärztin, der/die Ihnen Implanon NXT verschreibt, darüber, welche Arzneimittel oder pflanzlichen Mittel Sie bereits anwenden. Informieren Sie auch jeden anderen Arzt/Ärztin oder Zahnarzt/Zahnärztin, der/die Ihnen ein weiteres Medikament verschreibt (oder den abgebenden Apotheker/Apothekerin), dass Sie Implanon NXT anwenden. Wenn Sie Arzneimittel oder pflanzliche Präparate einnehmen, die die Wirksamkeit von Implanon NXT beeinträchtigen könnten, können Sie mit Ihrem Arzt/Ihrer Ärztin entscheiden, das Implantat im Arm zu lassen; in diesem Fall sollten Sie eine zusätzliche nicht-hormonelle Verhütungsmethode (z.B. Kondom) anwenden. Da die Wirkung eines anderen Arzneimittels auf Implanon NXT bis zu 28 Tage nach Beendigung der Einnahme anhalten kann, ist es notwendig, die zusätzliche nicht-hormonelle Verhütungsmethode so lange anzuwenden.
Einige Arzneimittel sowie Grapefruitsaft können die Wirkstoffkonzentration von Implanon NXT im Blut erhöhen. Das kann zum vermehrten Auftreten von Nebenwirkungen führen. Informieren Sie Ihren Arzt oder Ihre Ärztin, wenn Sie eines der folgenden Arzneimittel oder Grapefruitsaft einnehmen:
- Antipilzmittel, die Wirkstoffe wie z.B. Itraconazol, Voriconazol, oder Fluconazol enthalten,
- Bestimmte Antibiotika (sogenannte Markolide), die als Wirkstoff Clarithromycin oder Erythromycin enthalten,
- Bestimmte Arzneimittel zur Behandlung von Herz-Kreislauferkrankungen (mit den Wirkstoffen Diltiazem oder Verapamil).
Implanon NXT kann die Aktivität von Arzneimitteln (z.B. Cyclosporin, ein Arzneimittel zur Hemmung eines Teils der natürlichen Abwehrreaktion nach Organtransplantationen) verstärken oder auch die Wirkung anderer Arzneimittel vermindern (z.B. Lamotrigin, ein Arzneimittel gegen Epilepsie). Letzteres könnte zu einer erhöhten Häufigkeit von Krampfanfällen führen, weshalb Ihr Arzt/Ihre Ärztin zu Beginn der Anwendung von Implanon NXT, und wenn Sie Implanon NXT absetzen, die Lamotrigin-Blutspiegel überwachen wird. Es können aber auch weitere Arzneimittel betroffen sein, wie Schmerzmittel, Antidepressiva, Antimalariamittel, Beruhigungsmittel, Herzmedikamente, Cortison-Präparate, Blutgerinnungshemmer und Asthmamittel.
Bei langfristiger Einnahme eines der oben genannten Arzneimittel, könnte Ihnen das Entfernen von Implanon NXT von Ihrem Arzt/Ihrer Ärztin oder Ihrem Zahnarzt/Zahnärztin empfohlen werden. Ihr Arzt/Ihre Ärztin wird Ihnen dann eine andere Verhütungsmethode, die zusammen mit diesen Arzneimitteln angewendet werden kann, empfehlen.
Einfluss auf Fahrtüchtigkeit und Fähigkeit zur Maschinenbedienung
Es ist unwahrscheinlich, dass Implanon NXT die Fahrtüchtigkeit und die Fähigkeit, Werkzeuge und Maschinen zu bedienen, beeinflusst.
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie an anderen Krankheiten leiden, Allergien haben oder andere Arzneimittel (auch selbstgekaufte!) einnehmen.
Darf Implanon NXT während einer Schwangerschaft oder in der Stillzeit angewendet werden?
Implanon NXT darf während der Schwangerschaft oder bei Verdacht auf eine Schwangerschaft nicht angewendet werden. Vor der Anwendung von Implanon NXT muss eine Schwangerschaft ausgeschlossen werden.
Implanon NXT hat keinen Einfluss auf die Menge oder Qualität der Muttermilch, aber es gehen kleine Mengen des Wirkstoffes von Implanon NXT in die Muttermilch über. Es ist dadurch kein Risiko für die Gesundheit des gestillten Kindes bekannt. Implanon NXT kann während der Stillzeit auf Verschreibung Ihres Arztes/Ihrer Ärztin hin verwendet werden. Die Entwicklung und das Wachstum des Kindes sollten in diesem Falle sorgfältig beobachtet werden.
Wie verwenden Sie Implanon NXT?
Bitte informieren Sie Ihren Arzt/Ihre Ärztin, wenn Sie schwanger sind oder schwanger sein könnten (z.B. wenn Sie im aktuellen Menstruationszyklus ungeschützten Geschlechtsverkehr hatten), bevor Implanon NXT eingesetzt wird.
Implanon NXT darf nur von einem Arzt bzw. einer Ärztin, der bzw. die mit der Handhabung des Arzneimittels vertraut ist, implantiert bzw. entfernt werden.
Ihr Arzt bzw. Ihre Ärztin bestimmt den geeignetsten Zeitpunkt des Einsetzens (Implantation) von Implanon NXT. Dieser ist abhängig von Ihrem Monatszyklus sowie der Methode der Empfängnisverhütung, die Sie momentan anwenden.
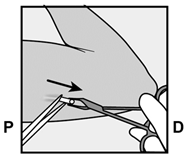
Um eine Schwangerschaft auszuschliessen, sollte Implanon NXT zwischen dem 1. und 5. Tag Ihrer normalen Regelblutung eingesetzt werden. Wenn das Implantat nach dem fünften Tag der Menstruation eingesetzt wird, sollten Sie in den ersten 7 Tagen nach dem Einsetzen eine zusätzliche Verhütungsmethode (z.B. ein Kondom) anwenden. Im Zweifelsfall fragen Sie Ihren Arzt bzw. Ihre Ärztin. Es wird auf der Innenseite des nicht dominanten Oberarms (d.h. Rechtshänderinnen: linker Arm) direkt unter die Haut eingeführt. Das Einsetzen von Implanon NXT erfolgt mit einem Applikator unter örtlicher Betäubung (Lokalanästhesie) und wird ähnlich wie eine Blutentnahme empfunden.
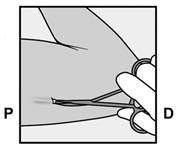
Am Ende der Einlage wird Ihr Arzt bzw. Ihre Ärztin Sie auffordern, das Implantat unter Ihrer Haut zu ertasten. Ein korrekt eingelegtes Implantat sollte eindeutig durch Sie und Ihren Arzt bzw. Ihre Ärztin ertastbar sein, und Sie sollten beide Enden zwischen Ihrem Daumen und Finger fühlen können. Man sollte sich bewusst sein, dass das Ertasten nicht als 100%ige Bestätigung für das Vorhandensein des Implantats geeignet ist. Falls das Implantat nicht ertastet werden kann, kann es sein, dass das Implantat nicht oder tief eingesetzt wurde. Im Falle des geringsten Zweifels müssen Sie ein barrierebildendes Verhütungsmittel (z.B. Kondom) benützen bis der Arzt bzw. die Ärztin und Sie sich absolut sicher sind, dass das Implantat eingesetzt wurde. Der Arzt bzw. die Ärztin muss möglicherweise Röntgen, Ultraschall oder Magnetresonanztomographie anwenden, oder eine Blutprobe entnehmen, um sicher zu gehen, dass das Implantat sich in Ihrem Arm befindet. Wenn der Arzt bzw. die Ärztin das nicht tastbare Implantat gefunden hat, sollte dieses entfernt werden.
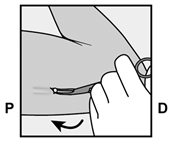
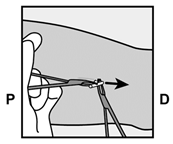
Implanon NXT sollte spätestens 3 Jahre nach dem Einsetzen entfernt und gegebenenfalls ersetzt werden. Es kann aber auch jederzeit früher entfernt werden (z.B. nach Absprache mit dem Arzt bzw. der Ärztin bei Frauen mit höherem Körpergewicht). Auch das Entfernen und Ersetzen von Implanon NXT erfolgt unter Lokalanästhesie.
Nach dem Entfernen von Implanon NXT müssen Sie bereits am Tag darauf mit der Verwendung einer anderen zuverlässigen Methode der Empfängnisverhütung beginnen, wenn Sie nicht schwanger werden möchten. Ihr Arzt bzw. Ihre Ärztin wird Ihnen eine Anwenderinnen-Karte mitgeben, auf der folgende Informationen aufgeführt sind: Datum des Einsetzens; Datum, an dem Implanon NXT spätestens wieder entfernt oder ersetzt werden muss; Name des Arztes/der Ärztin, der/die Implanon NXT eingesetzt hat; Arm, in welchem Implanon NXT eingesetzt wurde; Chargen-Nummer des Arzneimittels.
Wenn Sie das Implanon NXT ersetzen möchten, kann sofort nach der Entfernung des vorherigen Implantats ein neues Implantat eingesetzt werden. Das neue Implantat kann in den gleichen Arm und an der gleichen Stelle wie das vorherige Implantat eingesetzt werden, sofern sich diese an der korrekten Position befindet. Ihr Arzt/Ihre Ärztin wird Sie beraten.
Welche Nebenwirkungen kann Implanon NXT haben?
Bitte sprechen Sie mit Ihrem Arzt bzw. Ihrer Ärztin über alle Nebenwirkungen, insbesondere ernsthafte oder lang andauernde Beschwerden, oder über Änderungen Ihres Gesundheitszustandes, als deren Ursache Sie Implanon NXT vermuten.
Die schwerwiegendsten Nebenwirkungen im Zusammenhang mit der Anwendung von hormonalen Empfängnisverhütungsmittel sind in der Rubrik «Wann ist bei der Einnahme von Implanon NXT Vorsicht geboten?» beschrieben.
Folgende Nebenwirkungen können bei der Anwendung von Implanon NXT auftreten:
Sehr häufig (betrifft mehr als einen von 10 Anwendern)
Akne, Kopfschmerzen, Gewichtszunahme, Empfindlichkeit und Schmerzen in den Brüsten, vaginale Infektion, unregelmässige Blutungen.
Häufig (betrifft 1 bis 10 von 100 Anwendern)
Stimmungsschwankungen, depressive Verstimmungen, Nervosität, Verminderung des Geschlechtstriebes, Schwindel, Veränderungen des Appetits, Bauchschmerzen, Übelkeit, Blähungen, Haarausfall, schmerzhafte Monatsblutungen (Dysmenorrhoe), Amenorrhoe (Ausbleiben der Monatsblutung), kleine flüssigkeitsgefüllte Bläschen in den Eierstöcken (= Zysten), grippeartige Beschwerden, Hitzewallungen, Gewichtsabnahme, Schmerzen, Müdigkeit, Schmerzen und Reaktionen an der Implantationsstelle, wie Schwellung, Rötung, Juckreiz, Bluterguss.
Gelegentlich (betrifft 1 bis 10 von 1000 Anwendern)
Ängstlichkeit, Schlaflosigkeit, Schläfrigkeit, Migräne, Entzündung der Rachenschleimhaut, Schnupfen, Durchfall, Verstopfung, Erbrechen, Hautreaktionen wie Ausschlag, Juckreiz, Juckreiz im Genitalbereich, allergische Reaktionen, vermehrte Körperbehaarung, Rückenschmerzen, Gelenk-, Muskel- und Knochenschmerzen, Harnwegsinfekte, Schmerzen beim Wasserlassen, Brustvergrösserung, Brustsekret-Bildung, vaginaler Ausfluss, Fieber, Flüssigkeitsansammlung in den Geweben.
Ausserdem wurde selten ein Blutdruckanstieg beobachtet. Nach Markteinführung wurde über allergische Reaktionen berichtet. Suchen Sie sofort einen Arzt bzw. eine Ärztin auf, falls Sie Anzeichen einer schweren allergischen Reaktion verspüren, wie Schwellung des Gesichts, der Zunge oder des Rachens, Schluckbeschwerden oder Nesselsucht (z.B. auch Verschlimmerung bestehender oder angeborener Beschwerden) sowie Atembeschwerden auftreten.
Während dem Einsetzen oder Entfernen von Implanon NXT kann ein Bluterguss und in seltenen Fällen Schmerzen, eine Schwellung, Jucken oder eine Infektion auftreten. Bei der Implantationsstelle kann sich gelegentlich eine Hülle aus Bindegewebe, eine Narbe oder ein Abszess bilden. Ein taubes Gefühl oder Empfinden von Gefühllosigkeit kann auftreten. In seltenen Fällen wurde berichtet, dass Implantate in einem Blutgefäss aufgefunden wurden, einschliesslich einem Blutgefäss in der Lunge, was mit Symptomen wie Kurzatmigkeit, Husten und/oder Aushusten von Blut oder Schleim mit Blutspuren einhergehen kann. In seltenen Fällen wurde von Schwangerschaft ausserhalb der Gebärmutter (sogenannte ektopische Schwangerschaft) berichtet.
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?
Lagerungshinweis
Bei 2-30 °C in der Originalpackung aufbewahren.
Ausser Reichweite von Kindern aufbewahren.
Weitere Hinweise
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Implanon NXT enthalten?
Wirkstoffe
1 Implanon NXT Implantat enthält 68 mg Etonogestrel.
Hilfsstoffe
Der Wirkstoff Etonogestrel ist in Kunststoff (Ethylen-Vinylacetat-Copolymer, enthält Magnesiumstearat) eingebettet und versiegelt. Das Implantat ist durch Zusatz von Bariumsulfat im Röntgenbild sichtbar.
Zulassungsnummer
61298 (Swissmedic).
Wo erhalten Sie Implanon NXT? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Packungen zu 1 Implantat, eingesetzt in die Kanüle eines Einweg-Applikators.
Zulassungsinhaberin
MSD MERCK SHARP & DOHME AG, Luzern
Diese Packungsbeilage wurde im April 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
S-CCDS-MK8415-IPTx-072019/MK8415-CHE-2019-020602
Qu’est-ce que l’Implanon NXT et quand doit-il être utilisé?
Selon prescription du médecin.
Implanon NXT est un contraceptif que le médecin introduit (implante) directement sous la peau à l'aide d'un applicateur. Implanon NXT se compose d'un petit bâtonnet synthétique souple non biodégradable (longueur 4 cm; diamètre 2 mm). Le principe actif contenu dans ce bâtonnet est 68 mg d'étonogestrel, une hormone sexuelle féminine qui fait partie de la classe des progestatifs. Après l'implantation, Implanon NXT libère de très faibles quantités d'étonogestrel dans la circulation sanguine, de façon lente et continue, exerçant ainsi son effet contraceptif. Ce dernier repose d'une part sur une inhibition de l'ovulation et d'autre part sur un épaississement de la glaire du col utérin, ce qui rend plus difficile l'ascension des spermatozoïdes dans l'utérus. On a signalé quelques rares cas de grossesse non désirée; dans la majorité de ces cas, l'implant n'avait pas été implanté correctement ou même n'avait pas été implanté du tout.
À part le principe actif étonogestrel, le bâtonnet contient du sulfate de baryum qui permet de le détecter aux rayons X.
Implanon NXT peut être retiré à tout moment. Toutefois, il devrait être retiré au plus tard trois ans après l'implantation et éventuellement le remplacer par un nouvel implant. Chez les femmes dont le poids corporel dépasse 80 kg, le remplacement de l'implant peut s'avérer nécessaire avant ce délai. Après le retrait d'Implanon NXT, le cycle menstruel normal et, donc, la fertilité se rétablissent rapidement, généralement en l'espace d'un mois.
De quoi faut-il tenir compte en dehors du traitement?
Implanon NXT ne protège pas contre une infection par le VIH (sida) ou contre d'autres maladies sexuellement transmissibles.
Avant l'implantation d'Implanon NXT, votre médecin étudiera soigneusement vos antécédents médicaux personnels et familiaux (c'est-à-dire vos maladies personnelles et celles de votre famille) et pratiquera un examen général et gynécologique. Il faut exclure l'éventualité d'une grossesse.
Votre médecin vous demandera de vous soumettre régulièrement à des examens de contrôle pendant l'utilisation d'Implanon NXT.
Quand Implanon NXT ne doit-il pas être utilisé?
Votre médecin déterminera si vous pouvez utiliser Implanon NXT ou si vous ne devez pas l'utiliser pour des raisons médicales.
Il ne faut pas utiliser Implanon NXT dans les situations suivantes:
- grossesse suspectée ou confirmée,
- saignements vaginaux anormaux pour lesquels aucun diagnostic médical n'a été posé,
- présence confirmée ou suspectée d'un cancer dépendant des hormones sexuelles (cancer du sein ou cancer des organes génitaux),
- présence de caillots de sang p.ex. dans les jambes (thrombose), dans les poumons (embolie), dans le cœur (infarctus du myocarde) ou dans le cerveau (accident vasculaire cérébral),
- présence ou antécédent de maladies graves du foie, si la fonction hépatique n'est pas encore revenue à la normale,
- présence ou antécédent de tumeurs bénignes ou malignes du foie,
- et hypersensibilité connue ou suspectée à l'un des composants d'Implanon NXT.
Quelles sont les précautions à observer lors de l’utilisation d’Implanon NXT?
Si vous souffrez actuellement ou avez souffert par le passé de l'une des maladies indiquées ci-dessous, informez-en votre médecin étant donné que, dans ces cas, Implanon NXT devrait être utilisé avec prudence. Votre médecin vous donnera toutes les informations à ce propos:
Apparition ou aggravation des phénomènes suivants pendant une grossesse antérieure ou pendant un traitement hormonal précédent: coloration jaune de la peau ou des yeux (jaunisse) ou démangeaisons intenses; calculs biliaires; porphyrie (une perturbation métabolique du foie); lupus érythémateux disséminé (en abrégé LED; il s'agit d'une maladie auto-immune qui touche de nombreux organes du corps); syndrome hémolytique et urémique (une anomalie non définie du sang qui provoque une insuffisance rénale); chorée (une maladie neurologique); dépressions; herpès pendant la grossesse (éruption cutanée due à des virus herpétiques et constituée de petites vésicules); dégradation de l'audition (otosclérose); angio-œdème (héréditaire) (une maladie caractérisée par des gonflements récurrents de la peau, des muqueuses ou d'organes internes).
On peut parfois noter un chloasma (taches de grossesse, jaune clair à brun foncé, siégeant surtout sur le visage), en particulier chez les femmes qui ont déjà présenté un tel phénomène pendant une grossesse antérieure ou un traitement hormonal précédent. Si tel est votre cas, vous devez éviter de vous exposer au rayonnement solaire naturel et aux rayons ultraviolets.
Veuillez informer votre médecin dans les cas suivants:
- Diabète: Implanon NXT peut influer sur la glycémie.
- Hypertension artérielle: la pression artérielle peut augmenter pendant l'utilisation d'Implanon NXT.
- Augmentation des taux sanguins de graisses.
Thrombose
Les femmes utilisant un contraceptif hormonal combiné ont un risque accru de développer des caillots sanguins dans les veines et les artères (maladies thromboemboliques veineuses ou artérielles), ce qui peut entraîner de graves dommages de santé. Un caillot sanguin (thrombus) peut obturer un vaisseau sanguin (p.ex. thrombose veineuse profonde dans un membre inférieur). Si ce caillot se détache de la paroi veineuse, il peut être véhiculé dans la circulation jusqu'aux poumons, y boucher une artère pulmonaire et provoquer ainsi une embolie pulmonaire. Dans de très rares cas, des caillots sanguins peuvent aussi être présents dans les vaisseaux sanguins du cœur (où ils peuvent provoquer un infarctus du myocarde). La présence de caillots sanguins ou une rupture de vaisseaux sanguins dans le cerveau peuvent provoquer un accident vasculaire cérébral. Le risque de thrombose est cependant plus faible dans le cadre de l'utilisation de contraceptifs hormonaux combinés que dans le cadre d'une grossesse. Le risque associé à un contraceptif purement progestatif tel qu'Implanon NXT est inconnu. Après la commercialisation, on a rapporté des cas de formation de caillots sanguins – par exemple thromboses des veines profondes des membres inférieurs, embolies pulmonaires, infarctus du myocarde et accidents vasculaires cérébraux – chez des utilisatrices d'implants à l'étonogestrel. Si vous remarquez des signes éventuels de thrombose, vous devriez immédiatement consulter votre médecin (voir également le paragraphe «Informez immédiatement votre médecin si...»).
Cancer
Les femmes utilisant un contraceptif hormonal combiné ont un risque légèrement accru de cancer du sein par rapport aux femmes n'utilisant aucun contraceptif hormonal combiné. Après l'arrêt de l'utilisation du contraceptif hormonal, la légère augmentation du risque revient graduellement au niveau initial en l'espace d'une dizaine d'années. On ignore si la différence est due au contraceptif hormonal combiné. Il est possible que ces femmes aient été examinées plus souvent et plus soigneusement, et que les cas de cancer du sein aient ainsi été identifiés plus tôt. On ne dispose pas de données suffisantes sur Implanon NXT pour formuler des affirmations précises sur le risque de cancer du sein. Palpez régulièrement vos seins et informez votre médecin si vous y remarquez un nodule.
On a rapporté dans de rares cas des tumeurs du foie de nature bénigne ou (très rarement) maligne. Informez immédiatement votre médecin si vous ressentez de fortes douleurs abdominales.
Kystes ovariens
Lors de l'utilisation de contraceptifs hormonaux faiblement dosés tels qu'Implanon NXT, les ovules contenus dans les ovaires peuvent se développer et se transformer en follicules plus volumineux que lors d'un cycle normal. On les appelle alors des «kystes de l'ovaire». Ces derniers disparaissent en général spontanément. Ils peuvent parfois provoquer de légères douleurs dans le bas-ventre. Il est rare qu'ils occasionnent des complications plus graves.
Affections psychiatriques
Certaines femmes qui utilisent des contraceptifs hormonaux comme Implanon NXT signalent des dépressions ou des humeurs dépressives. Les dépressions peuvent être graves et occasionnellement entraîner des pensées suicidaires. Si vous présentez des fluctuations d'humeur et des symptômes dépressifs, faites-vous conseiller le plus rapidement possible par un médecin.
Modifications du profil de saignements menstruels
Pendant l'utilisation d'Implanon NXT, les règles peuvent être irrégulières (augmentation de la fréquence ou de la durée des saignements), voire disparaître complètement. Cela ne signifie pas qu'Implanon NXT ne vous convient pas ou n'exerce pas son effet contraceptif. Dans ces situations, il n'y a généralement aucune mesure particulière à prendre. Toutefois, en cas de saignements très intenses ou très prolongés, vous devez consulter votre médecin. Le profil individuel de saignements pendant les trois premiers mois du traitement reflète généralement le déroulement futur de vos menstruations sous Implanon NXT.
Événements liés à l'insertion et au retrait de l'implant
Il peut arriver, dans de rares cas, que l'implant s'éloigne de son point d'implantation initial dans le bras, soit parce qu'il a été mal inséré, soit sous l'effet d'actions extérieures (p.ex. manipulations au niveau de l'implant ou sports de contact). Il peut alors être plus difficile de retrouver l'implant et son retrait peut nécessiter une incision plus importante, voire une opération à l'hôpital. Si l'implant est introuvable et si aucun indice ne suggère qu'il a été expulsé, il est possible que la contraception et le risque d'effets indésirables dus au progestatif persistent plus longtemps que souhaité.
Dans de rares cas, des implants ont été retrouvés dans l'artère pulmonaire (vaisseau sanguin situé dans le poumon). Si l'implant est introuvable dans votre bras, votre médecin examinera votre cage thoracique par radiographie ou par une autre méthode d'imagerie. Si l'implant est retrouvé dans votre cage thoracique, une opération pourra être nécessaire.
Des cas de rupture de l'implant dans le bras de patientes ont également été rapportés. Cela peut rendre son retrait plus difficile et exiger une incision plus importante. Si l'implant n'est pas retrouvé et si aucun indice ne suggère qu'il a été expulsé, il est possible que la contraception et le risque d'effets indésirables dus au progestatif persistent plus longtemps que souhaité.
Si l'implant se casse ou se plie à l'intérieur de votre bras, son efficacité ne devrait pas être diminuée. Consultez votre médecin si vous avez des questions.
Autres situations
Si votre poids corporel est supérieur à 80 kg, il se peut que l'efficacité d'Implanon NXT soit diminuée pendant la troisième année d'utilisation.
L'hormone contenue dans Implanon NXT peut influencer les résultats de certaines analyses de sang. Informez par conséquent votre médecin que vous utilisez Implanon NXT, s'il vous prescrit une analyse de sang.
Informez immédiatement votre médecin si
- il apparaît une modification quelconque de votre état de santé, en particulier les phénomènes décrits dans cette notice (voir aussi «Quand Implanon NXT ne doit-il pas être utilisé?» et «Quelles sont les précautions à observer lors de l'utilisation d'Implanon NXT?»). En cela, n'oubliez pas les événements survenus dans votre entourage familial proche;
- vous présentez des douleurs abdominales soudaines ou violentes ou une jaunisse (ce qui pourrait traduire des troubles hépatiques ou des calculs biliaires);
- vous sentez un nodule dans le sein;
- vous éprouvez une douleur brusque et violente à l'estomac ou une douleur dans le bas-ventre (cela pourrait indiquer une grossesse extra-utérine [dans la trompe de Fallope] ou un kyste de l'ovaire [petites vésicules remplies de liquide]);
- vous pensez que vous êtes peut-être enceinte;
- vous constatez des signes évocateurs d'une thrombose, p.ex.
- vives douleurs ou gonflement d’une seule jambe,
- douleurs lancinantes inexpliquées ou sentiment d’oppression dans la cage thoracique apparaissant soudainement,
- problèmes respiratoires, par exemple détresse respiratoire,
- toux inhabituelle, surtout si elle s’accompagne de crachats sanglants,
- survenue soudaine de fortes douleurs thoraciques éventuellement irradiant dans le bras gauche,
- extrême sensation de faiblesse,
- migraine se manifestant pour la première fois ou maux de tête prolongés d’intensité inhabituelle ou se produisant plus fréquemment,
- troubles soudains de la vision, de l’audition ou autres troubles sensoriels apparaissant brusquement, ou troubles soudains du langage,
- apparition soudaine d’un manque de force/d’une insensibilité du visage, d’un bras ou d’une jambe, surtout dans une seule moitié du corps,
- troubles moteurs,
- vertiges,
- perte de conscience avec ou sans convulsions,
- augmentation considérable de la pression artérielle;
- des crises d'épilepsie s'aggravent;
- votre asthme s'aggrave;
- votre insuffisance cardiaque ou rénale s'aggrave;
- des saignements vaginaux inhabituellement intenses apparaissent (ce symptôme peut indiquer un cancer de l'utérus);
- une opération est prévue ou en cas d'alitement ou de réduction de la mobilité suite à un accident ou à une opération;
- des réactions d'hypersensibilité se manifestent;
- vous pensez que l'implant s'est déplacé de son site d'implantation initial ou a été expulsé (voir aussi «Comment utiliser Implanon NXT?»).
Interactions avec d'autres médicaments
Certains médicaments peuvent perturber l'effet contraceptif d'Implanon NXT: p.ex. des antiépileptiques (p.ex. barbituriques, phénytoïne, carbamazépine, oxcarbazépine, topiramate, felbamate, primidone), des antituberculeux (rifampicine, rifabutine), des médicaments contre le VIH (p.ex. ritonavir, nelfinavir, névirapine, éfavirenz), des médicaments contre les infections par le virus d'hépatite C (p.ex. bocéprévir, télaprévir), des médicaments contre l'hypertension dans les vaisseaux sanguins des poumons (bosentan), des médicaments contre un certain type particulier de somnolence excessive (modafinil), ainsi que des préparations de millepertuis (Hypericum) utilisées contre des humeurs dépressives.
Informez toujours votre médecin qui vous prescrit l'Implanon NXT, des médicaments et des produits à base de plantes que vous utilisez déjà. Informez également tout autre médecin ou dentiste qui vous prescrit un autre médicament (ou le pharmacien qui vous le remet) que vous utilisez Implanon NXT. Si vous prenez des médicaments ou des produits à base de plantes, qui pourraient affecter l'efficacité d'Implanon NXT, vous pouvez décider avec votre médecin de laisser l'implant dans votre bras; auquel cas vous devriez utiliser une méthode contraceptive non hormonale supplémentaire (p.ex. un préservatif). Puisque l'effet d'un autre médicament sur Implanon NXT peut durer jusqu'à 28 jours après la fin de l'utilisation, il est nécessaire d'utiliser la méthode contraceptive non hormonale supplémentaire aussi longtemps.
Certains médicaments ainsi que le jus de pamplemousse peuvent entraîner une augmentation de la concentration sanguine d'Implanon NXT. Cela peut entraîner la multiplication des effets secondaires. Informez votre médecin si vous prenez l'un des médicaments suivants ou du jus de pamplemousse:
- Antifongiques contenant p.ex. de l'itraconazole, du voriconazole, ou du fluconazole,
- Certains antibiotiques appelés macrolides contenant de la clarithromycine ou de l'érythromycine,
- Certains médicaments pour le traitement de maladies cardio-vasculaires (contenant du diltiazem ou du vérapamil).
Implanon NXT peut renforcer l'activité de médicaments (p.ex. ciclosporine, un médicament utilisé pour inhiber en partie les réactions immunitaires naturelles après une greffe d'organe) ou bien réduire l'effet d'autres médicaments (p.ex. lamotrigine, un antiépileptique). Ce dernier pourrait augmenter la fréquence des épisodes convulsifs, c'est pourquoi votre médecin doit surveiller le taux sanguin de lamotrigine au début de l'utilisation d'Implanon NXT et lorsque vous arrêtez l'utilisation d'Implanon NXT. D'autres médicaments peuvent également être concernés: des médicaments contre la douleur, des antidépresseurs, des médicaments contre la malaria, des calmants, des médicaments pour le cœur, des médicaments contenant de la cortisone, des anticoagulants et des médicaments contre l'asthme.
Dans le cas d'une utilisation prolongée de l'un des médicaments mentionnés ci-dessus, il se peut que votre médecin ou votre dentiste vous recommande un retrait d'Implanon NXT. Votre médecin vous recommandera dans ce cas une autre méthode de contraception compatible avec votre traitement médicamenteux.
Effet sur l'aptitude à la conduite et l'utilisation de machines
Il est peu probable qu'Implanon NXT affecte l'aptitude à la conduite et à l'utilisation d'outils et de machines.
Veuillez informer votre médecin ou votre pharmacien si vous souffrez d'une autre maladie, vous êtes allergique ou vous prenez déjà d'autres médicaments (même en automédication!).
Implanon NXT peut-il être utilisé pendant la grossesse ou l’allaitement?
Il ne faut pas utiliser Implanon NXT pendant la grossesse ou en cas de suspicion de grossesse. Avant l'utilisation d'Implanon NXT, il faut exclure l'éventualité d'une grossesse.
Implanon NXT n'a pas d'influence sur la quantité ou la qualité du lait maternel, mais de faibles quantités du principe actif d'Implanon NXT passent dans le lait maternel. Il n'en résulte aucun risque connu pour la santé de l'enfant allaité. Implanon NXT peut être utilisé pendant l'allaitement sur prescription de votre médecin. Dans ce cas, le développement et la croissance de l'enfant devraient être soigneusement surveillés.
Comment utiliser Implanon NXT?
Avant la mise en place d'Implanon NXT, vous devez informer votre médecin si vous êtes enceinte ou pourriez l'être (p.ex. si vous avez eu des rapports sexuels non protégés au cours du cycle menstruel actuel).
Implanon NXT doit toujours être implanté ou retiré par un médecin familiarisé avec le mode d'emploi du médicament.
C'est votre médecin qui fixera la date la mieux appropriée de mise en place (implantation) d'Implanon NXT. Celle-ci dépend de votre cycle menstruel et de la méthode contraceptive que vous utilisez actuellement.
Pour exclure une grossesse, Implanon NXT devrait être implanté entre le premier et le cinquième jour de vos règles normales. Si l'implant est inséré après le cinquième jour de vos règles, vous devriez utiliser une méthode contraceptive supplémentaire (p.ex. un préservatif) pendant les 7 premiers jours après l'insertion. En cas de doute, demandez à votre médecin. Implanon NXT est inséré directement sous la peau, sur la face interne du bras non dominant (c.-à-d. du bras gauche chez les droitières). L'implantation d'Implanon NXT est effectuée à l'aide d'un applicateur sous anesthésie locale et fait le même effet qu'une prise de sang.
Après avoir inséré l'implant, votre médecin vous demandera de le palper sous la peau. Si l'implant est correctement inséré, vous et votre médecin devriez pouvoir nettement le palper sous la peau et vous devriez sentir ses deux extrémités entre votre pouce et un doigt. Il faut savoir que la palpation ne prouve pas à 100% la présence de l'implant. Si l'implant n'est pas palpable, il se peut qu'il n'ait pas été inséré ou qu'il l'ait été profondément. Si vous avez le moindre doute, utilisez une méthode de contraception barrière (p.ex. préservatif) jusqu'à ce que le médecin soit absolument certain que l'implant a été inséré. Le médecin pourra utiliser la radiographie, l'échographie ou l'imagerie par résonance magnétique, ou encore une prise de sang pour s'assurer que l'implant se trouve bien dans votre bras. Quand il aura retrouvé l'implant non palpable, celui-ci devra être retiré.
Implanon NXT devrait être retiré au plus tard 3 ans après l'implantation et, le cas échéant, le remplacer par un nouvel implant. On peut cependant aussi le retirer plus tôt, à tout moment (p.ex. chez les femmes de poids corporel important, après entente avec le médecin). Le retrait et le remplacement d'Implanon NXT sont également effectués sous anesthésie locale.
Après le retrait d'Implanon NXT, vous devez commencer à utiliser une autre méthode contraceptive fiable dès le lendemain si vous ne souhaitez pas de grossesse. Votre médecin vous remettra une carte d'utilisatrice mentionnant les informations suivantes: date d'implantation; date limite de retrait ou de remplacement d'Implanon NXT; nom du médecin qui a implanté Implanon NXT; bras dans lequel Implanon NXT a été implanté; numéro de lot du médicament.
Si vous souhaitez remplacer Implanon NXT, un nouvel implant peut être inséré immédiatement après le retrait de l'implant précédent. Le nouvel implant peut être placé dans le même bras, au même endroit que l'implant précédent, dans la mesure où celui-ci est correctement positionné. Votre médecin vous conseillera.
Quels effets secondaires Implanon NXT peut-il provoquer?
Veuillez informer votre médecin de tous les effets secondaires, en particulier des symptômes sévères ou persistants ou des modifications de votre état de santé si vous soupçonnez Implanon NXT d'en être à l'origine. Les effets secondaires les plus sévères liés à l'utilisation des contraceptifs hormonaux sont décrits dans la rubrique «Quelles sont les précautions à observer lors de l'utilisation d'Implanon NXT?».
Lors de l'utilisation d'Implanon NXT, les effets secondaires suivants sont possibles:
Très fréquents (concerne plus d'une utilisatrice sur 10)
Acné, maux de tête, prise de poids, sensibilité et douleur dans les seins, infection vaginale, irrégularité des règles;
Fréquents (concerne 1 à 10 utilisatrices sur 100)
Fluctuations de l'humeur, humeur dépressive, nervosité, diminution de la libido, vertiges, modification de l'appétit, douleurs abdominales, nausées, ballonnement intestinal, chute de cheveux, règles douloureuses (dysménorrhée), aménorrhée (absence de règles), apparition de petites vésicules remplies de liquide dans les ovaires (= kystes), symptômes de type grippal, bouffées de chaleur, perte de poids, douleurs, fatigue, douleurs et réactions au site d'implantation (p.ex. gonflement, rougeur, démangeaisons, hématome);
Occasionnels (concerne 1 à 100 utilisatrices sur 1000)
Anxiété, insomnie, somnolence, migraine, inflammation de la muqueuse de la gorge, rhume, diarrhée, constipation, vomissements, réactions cutanées telles qu'éruption, démangeaisons, démangeaisons dans la région génitale, réactions allergiques, augmentation de la pilosité du corps, douleurs dorsales, douleurs articulaires, musculaires et osseuses, infections urinaires, douleurs en urinant, augmentation du volume des seins, écoulement mammaire, écoulement vaginal, fièvre, accumulation de liquide dans les tissus.
Rarement, on a aussi observé une augmentation de la pression artérielle. Des réactions allergiques ont été rapportées depuis la mise sur le marché. Consultez immédiatement un médecin si vous ressentez des signes d'une grave réaction allergique tels qu'un gonflement du visage, de la langue ou de la gorge, des difficultés à avaler ou une urticaire (p.ex. aggravation de troubles de ce type préexistants ou congénitaux) ainsi que des troubles respiratoires.
Pendant l'implantation ou le retrait d'Implanon NXT, on peut noter un hématome et, rarement, des douleurs, un gonflement, des démangeaisons ou une infection. Occasionnellement, il peut se former une enveloppe de tissu conjonctif, une cicatrice ou un abcès au niveau du site d'implantation. Une sensation d'engourdissement ou de perte de la sensibilité est possible. Dans de rares cas, l'implant a été retrouvé dans un vaisseau sanguin, y compris un vaisseau sanguin dans le poumon, ce qui peut être associé à des symptômes tels qu'un essoufflement, une toux et/ou une expectoration du sang ou mucus avec des traces de sang. De rares cas de grossesse extra-utérine (grossesse ectopique) ont également été rapportés.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
À quoi faut-il encore faire attention?
Remarques concernant le stockage
Conserver à 2-30 °C dans l'emballage original.
Tenir hors de la portée des enfants.
Remarques complémentaires
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien. Ces personnes disposent de l'information détaillée destinée aux professionnels.
Que contient Implanon NXT?
Principes actifs
1 implant Implanon NXT contient 68 mg d'étonogestrel.
Excipients
Le principe actif étonogestrel est enrobé d'une matière synthétique (copolymère éthylène-acétate de vinyle, contient du stéarate de magnésium) et scellé. L'implant est visible sur l'image radiographique grâce à l'ajout de sulfate de baryum.
Numéro d’autorisation
61298 (Swissmedic)
Où obtenez-vous Implanon NXT? Quels sont les emballages à disposition sur le marché?
En pharmacie, uniquement sur ordonnance médicale.
Emballages de 1 implant, placé dans la canule d'un applicateur à usage unique.
Titulaire de l’autorisation
MSD MERCK SHARP & DOHME AG, Lucerne
Cette notice d'emballage a été vérifiée pour la dernière fois en avril 2020 par l'autorité de contrôle des médicaments (Swissmedic).
S-CCDS-MK8415-IPTx-072019/MK8415-CHE-2019-020602
Che cos'è Implanon NXT e quando si usa?
Su prescrizione medica.
Implanon NXT è un contraccettivo che viene inserito (impiantato) dal medico tramite un applicatore direttamente sotto la pelle. Implanon NXT è costituito da un piccolo bastoncino di materiale plastico (4 cm di lunghezza; 2 mm di diametro) flessibile e non biodegradabile, che contiene 68 mg del principio attivo etonogestrel, un ormone sessuale femminile appartenente al gruppo dei progestinici. Una volta impiantato, Implanon NXT rilascia lentamente e costantemente una quantità minima di etonogestrel nel circolo sanguigno, svolgendo così un'azione contraccettiva dovuta sia all'inibizione dell'ovulazione, sia all'aumento della viscosità del muco cervicale, che rende più difficile agli spermatozoi raggiungere l'utero. Con questo metodo contraccettivo sono stati registrati casi isolati di gravidanze indesiderate, ma nella maggior parte dei casi la responsabilità è da ascrivere ad un impianto scorretto o mancato del dispositivo.
Oltre al principio attivo etonogestrel, il bastoncino contiene anche solfato di bario, che lo rende rilevabile sulle radiografie.
Implanon NXT può essere rimosso in qualsiasi momento, ma dovrebbe essere rimosso ed eventualmente sostituito con un nuovo impianto al più tardi dopo tre anni. Per le pazienti con peso corporeo superiore a 80 kg può essere necessario sostituire l'impianto anche prima. Dopo la rimozione di Implanon NXT, il normale ciclo mestruale e, dunque, la fertilità si ristabiliscono in breve tempo, di regola entro un mese.
Di che cosa occorre inoltre tener conto durante il trattamento?
Implanon NXT non offre alcuna protezione contro l'infezione da HIV (AIDS) o contro altre malattie sessualmente trasmissibili.
Prima di impiantare Implanon NXT il medico raccoglierà un'anamnesi completa, sia personale che familiare (storia delle proprie malattie e delle malattie della famiglia) ed eseguirà una visita medica generale e ginecologica. È necessario escludere che vi sia una gravidanza in corso.
Durante l'uso di Implanon NXT il medico la inviterà a sottoporsi a visite di controllo ad intervalli regolari.
Quando non si può usare Implanon NXT?
Sarà il suo medico a decidere se può usare Implanon NXT o se invece deve evitarne l'uso per ragioni mediche.
Implanon NXT non deve essere usato in caso di
- gravidanza accertata o presunta,
- insoliti sanguinamenti vaginali non diagnosticati,
- accertati o sospetti tumori dipendenti dagli ormoni sessuali (cancro al seno o cancro degli organi genitali),
- esistenza di coaguli nei vasi sanguigni, che interessano p.es. le gambe (trombosi) o i polmoni (embolia), il cuore (infarto cardiaco) o il cervello (ictus),
- gravi malattie epatiche in atto o passate, quando la funzione epatica non si è ancora normalizzata,
- tumori epatici benigni o maligni precedenti o in atto,
- accertata o sospetta ipersensibilità a uno qualsiasi dei componenti di Implanon NXT.
Quando è richiesta prudenza nell'uso di Implanon NXT?
Informi il suo medico se soffre o ha sofferto di una delle condizioni elencate di seguito, perché in questo caso l'uso di Implanon NXT dovrebbe essere oggetto di particolare cautela. Il suo medico la informerà a proposito dei punti seguenti.
Prima comparsa o peggioramento delle seguenti condizioni durante una gravidanza o un trattamento ormonale precedente: colorazione giallastra di pelle od occhi (itterizia) o prurito grave; calcoli biliari; porfiria (disturbo metabolico epatico); lupus eritematoso sistemico (LES: malattia autoimmune che colpisce numerose parti del corpo); sindrome uremico-emolitica (disturbo ematico non definito che porta all'insufficienza renale); corea (disturbo neurologico); depressioni; herpes gravidico (eruzione cutanea con vescicole causata dal virus dell'herpes); peggioramento dell'udito (otosclerosi) e angioedema ereditario (gonfiori ricorrenti di cute, mucose od organi interni).
Occasionalmente può manifestarsi cloasma (macchie gravidiche di colore da giallo chiaro a marrone scuro, soprattutto sul viso), particolarmente in donne nelle quali si è già manifestato durante una gravidanza o un trattamento ormonale precedente. Se ciò è accaduto anche a lei, eviti di esporsi direttamente ai raggi solari e alle radiazioni ultraviolette.
Informi il suo medico se presenta una delle condizioni elencate di seguito.
- Diabete: Implanon NXT può influenzare la glicemia (livello di zucchero nel sangue).
- Ipertensione arteriosa: l'uso di Implanon NXT può provocare un aumento della pressione sanguigna.
- Aumento del livello di grassi nel sangue.
Trombosi
Le donne che usano contraccettivi ormonali combinati presentano un aumento del rischio di formazione di coaguli di sangue nelle vene e nelle arterie (malattie tromboemboliche venose ed arteriose), che possono causare danni gravi alla salute. Un coagulo di sangue può ostruire un vaso sanguigno (causando per es. una trombosi venosa profonda in una gamba). Se il coagulo di sangue si stacca dalla parete vascolare, può migrare e arrivare ad ostruire una delle arterie polmonari, causando la cosiddetta embolia polmonare. In casi molto rari i coaguli di sangue possono formarsi anche nei vasi sanguigni del cuore e causare un infarto cardiaco. Coaguli di sangue o rottura di vasi sanguigni nel cervello possono provocare un ictus. Il rischio di trombosi durante l'uso di contraccettivi ormonali combinati è però minore che durante la gravidanza. Il rischio legato ad un contraccettivo a base di solo progestinico, come Implanon NXT, non è noto. Dopo l'introduzione sul mercato, fra le utilizzatrici di impianti a base di etonogestrel sono stati segnalati casi di formazione di coaguli di sangue sfocianti in trombosi venosa profonda delle gambe, embolia polmonare, infarto cardiaco e ictus. Se nota possibili segni di trombosi dovrebbe immediatamente informare il medico (cfr. anche il paragrafo «Informi immediatamente il medico, se...»).
Cancro
Le donne che usano un contraccettivo ormonale combinato presentano un leggero aumento del rischio di sviluppare un cancro al seno rispetto alle donne che non usano alcun contraccettivo ormonale combinato. Una volta interrotto l'uso del contraccettivo ormonale, il livello leggermente aumentato di rischio rientra gradualmente nella normalità entro un periodo di circa 10 anni. Non è noto se la differenza sia causata dal contraccettivo ormonale combinato. È anche possibile che queste donne siano state semplicemente visitate più spesso e più accuratamente e che perciò il cancro al seno sia stato diagnosticato più precocemente. Per Implanon NXT non sono disponibili dati sufficienti per potersi pronunciare con precisione riguardo al rischio di cancro al seno. Si consiglia perciò di eseguire periodicamente l'autopalpazione del seno e di informare il medico se si palpa un nodulo del seno.
In rari casi sono stati segnalati tumori epatici benigni e (molto raramente) maligni. Informi il medico immediatamente se avverte forti dolori addominali.
Cisti ovariche
Con l'uso di contraccettivi ormonali a basso dosaggio come Implanon NXT è possibile che nelle ovaie si sviluppino dei follicoli (piccole cavità che contengono l'ovulo) più grossi che in un ciclo normale. In questo caso vengono chiamati cisti ovariche. Di solito scompaiono da sole, ma talvolta possono provocare lievi disturbi all'addome inferiore. Solo raramente sono causa di problemi più gravi.
Disturbi psichiatrici
Alcune donne che usano contraccettivi ormonali tra cui Implanon NXT riferiscono depressione o umore depresso. Le depressioni possono essere gravi e a volte portare a pensieri suicidari. Se si manifestano sbalzi d'umore e sintomi depressivi, chieda al più presto consiglio a un medico.
Variazioni nell'andamento delle mestruazioni
Durante l'uso di Implanon NXT si possono verificare irregolarità mestruali (mestruazioni più frequenti o più prolungate) oppure le mestruazioni possono scomparire del tutto. Ciò non significa che Implanon NXT non sia adatto a lei o che non la protegga da una gravidanza. Generalmente in questi casi non è necessario alcun intervento. In caso di mestruazioni molto abbondanti o molto persistenti è necessario però informare il medico. L'andamento delle mestruazioni nei primi tre mesi del trattamento rispecchia solitamente quello che si instaurerà nel corso dell'uso di Implanon NXT.
Eventi correlati all'inserimento e alla rimozione
In rari casi può accadere che l'impianto si sposti rispetto al punto originale di inserimento nel braccio, perché è stato inserito in maniera sbagliata o per influenze esterne (p.es. manipolazione dell'impianto o sport da contatto). In questi casi, il rinvenimento dell'impianto può essere più difficile e la rimozione può richiedere un'incisione più ampia o il ricovero ospedaliero per un intervento chirurgico. Se non si riesce a trovare l'impianto e non ci sono segni di un'espulsione, l'effetto contraccettivo e il rischio di effetti indesiderati da progestinici possono durare più a lungo di quanto desiderato.
In casi rari, gli impianti sono stati rinvenuti nell'arteria polmonare (un vaso sanguigno all'interno del polmone). Se non si riesce a individuare l'impianto all'interno del braccio, il medico potrebbe controllare il torace mediante esame radiografico o altre tecniche diagnostiche per immagini. Se l'impianto si trova nel torace, potrebbe essere necessario un intervento chirurgico.
Ci sono state anche segnalazioni di impianti che si sono rotti nel braccio della paziente. Ciò può rendere più difficile l'asportazione e richiedere un'incisione più ampia. Nel caso in cui non sia possibile localizzare l'impianto, ma non ci siano segni che sia stato espulso, la contraccezione e il rischio di effetti indesiderati da progestinici possono perdurare oltre il desiderato.
Se l'impianto nel suo braccio si rompe o si piega, l'efficacia dell'impianto non dovrebbe diminuire. Contatti il suo medico per eventuali domande in proposito.
Altre situazioni
Se il peso corporeo è superiore a 80 kg, l'efficacia di Implanon NXT durante il terzo anno di uso potrebbe risultare ridotta.
L'ormone contenuto in Implanon NXT può influenzare i risultati di alcuni esami del sangue. Al momento di sottoporsi a un esame del sangue, informi pertanto il suo medico che usa Implanon NXT.
Informi immediatamente il medico, se
- si verifica un qualsiasi cambiamento nel suo stato di salute, in particolare quelli descritti in questo foglietto illustrativo (v. anche «Quando non si può usare Implanon NXT?» e «Quando è richiesta prudenza nell'uso di Implanon NXT?»). Non dimentichi di comunicare anche eventuali eventi riguardanti la stretta cerchia famigliare;
- avverte dolori addominali forti o improvvisi, oppure soffre di itterizia (potrebbe essere un segno di disturbi epatici o di calcoli biliari);
- percepisce un nodulo nel seno;
- avverte un dolore improvviso e lancinante allo stomaco oppure dolore al basso ventre (potrebbe essere il segno di una gravidanza extrauterina [gravidanza tubarica] o di cisti ovarica [piccola cavità piena di liquido]);
- sospetta che sia in corso una gravidanza;
- nota possibili segni di trombosi, come per es.
- forte dolore o gonfiore ad una gamba,
- fitte dolorose improvvise e inspiegabili oppure senso di costrizione al torace,
- difficoltà respiratorie, ad esempio affanno,
- tosse insolita, in particolare con emissione di sangue,
- forti dolori improvvisi al torace con possibile irradiazione al braccio sinistro,
- estrema debolezza,
- prima comparsa di un'emicrania oppure qualsiasi dolore di testa insolitamente forte e persistente o con frequenza aumentata,
- improvvisi disturbi alla vista o all'udito o altri disturbi della percezione, o disturbi del linguaggio improvvisi,
- improvvisa debolezza o insensibilità del viso, di un braccio o di una gamba, in particolare sullo stesso lato del corpo,
- disturbi motori,
- vertigini,
- perdita di conoscenza con o senza convulsioni,
- forte aumento della pressione sanguigna,
- aumenta la frequenza degli attacchi epilettici;
- la sua asma peggiora;
- eventuali problemi della funzione cardiaca o renale peggiorano;
- si manifestano insoliti ed intensi sanguinamenti vaginali (questo potrebbe essere un segno di tumore all'utero);
- è previsto un intervento chirurgico oppure in caso di degenza a letto o mobilità limitata dopo un incidente o un intervento chirurgico;
- si manifestano reazioni di ipersensibilità;
- ritiene che l'impianto si sia spostato dalla posizione iniziale o sia stato espulso (v. anche «Come usare Implanon NXT?»).
Interazioni con altri medicamenti
Alcuni medicamenti possono compromettere l'efficacia contraccettiva di Implanon NXT: p.es. medicamenti contro l'epilessia (p.es. barbiturici, fenitoina, carbamazepina, oxcarbazepina, topiramato, felbamato, primidone), medicamenti contro la tubercolosi (rifampicina, rifabutina), medicamenti contro il virus HIV (p.es. ritonavir, nelfinavir, nevirapina, efavirenz), medicamenti contro le infezioni da virus dell'epatite C (p.es boceprevir, telaprevir), medicamenti contro l'ipertensione arteriosa polmonare (bosentan), medicamenti contro una particolare forma di sonnolenza eccesiva (modafinil) come pure preparati a base di erba di S. Giovanni (iperico) contro degli stati depressivi.
Informi sempre il medico che prescrive l'Implanon NXT sui medicamenti o prodotti a base di erbe che sta già prendendo. Informi anche tutti gli altri medici o dentisti che prescrivono altri medicamenti (o il farmacista dispensante) del fatto che sta usando Implanon NXT. Se assume medicamenti o prodotti a base di erbe che potrebbero influenzare l'efficacia d'Implanon NXT, può decidere con il suo medico di lasciare l'impianto nel braccio; nel qual caso dovrebbe usare un metodo contraccettivo non ormonale supplementare (p.es. preservativo). Poiché l'effetto di un altro medicamento su Implanon NXT può durare fino a 28 giorni dopo la fine dell'uso, è necessario usare il metodo contraccettivo non ormonale supplementare per tutto questo tempo.
Alcuni medicamenti e il succo di pompelmo possono far aumentare la concentrazione del principio attivo d'Implanon NXT nel sangue. Ciò può far aumentare la frequenza di comparsa di effetti collaterali. Informi il suo medico se assume uno dei seguenti medicamenti o succo di pompelmo:
- antimicotici contenenti principi attivi come p.es. itraconazolo, voriconazolo o fluconazolo,
- certi antibiotici (cosiddetti macrolidi) contenenti il principio attivo claritromicina o eritromicina,
- certi medicamenti per il trattamento di malattie cardiovascolari (contenenti i principi attivi diltiazem o verapamil).
Implanon NXT può intensificare l'attività di medicamenti (p.es. della ciclosporina, un medicamento per sopprimere in parte la naturale reazione immunitaria dopo i trapianti di organo) o anche ridurre l'effetto di altri medicamenti (p.es. della lamotrigina, un medicamento contro l'epilessia). Quest'ultimo potrebbe portare ad un aumento della frequenza di crisi convulsive. Per questo motivo, all'inizio e al termine dell'uso d'Implanon NXT, il suo medico controllerà i livelli di lamotrigina nel sangue. Possono tuttavia anche esserne interessati altri medicamenti quali antidolorifici, antidepressivi, antimalarici, calmanti, medicamenti per il cuore, cortisonici, anticoagulanti e antiasmatici.
Se uno dei medicamenti citati sopra deve essere assunto a lungo termine, il suo medico o il suo dentista potrebbe consigliarle di rimuovere Implanon NXT. Il suo medico le consiglierà un altro metodo contraccettivo che può essere usato in combinazione con questi medicamenti.
Effetto sulla capacità di condurre un veicolo e sulla capacità di utilizzare macchine
È improbabile che Implanon NXT influenzi la capacità di condurre veicoli e di utilizzare attrezzi o macchine.
Informi il suo medico o il suo farmacista nel caso in cui soffra di altre malattie, soffra di allergie o assuma altri medicamenti (anche se acquistati di sua iniziativa!).
Si può usare Implanon NXT durante la gravidanza o l'allattamento?
Implanon NXT non deve essere usato né durante la gravidanza né in caso di gravidanza presunta. Prima di usare Implanon NXT deve essere escluso che vi sia una gravidanza in corso.
Implanon NXT non ha alcun influsso sulla quantità o la qualità del latte materno. Tuttavia, piccole quantità del principio attivo di Implanon NXT passano nel latte materno. Non è noto alcun rischio per la salute del lattante derivante da questa circostanza. Implanon NXT può essere usato durante il periodo di allattamento previa prescrizione medica, e in questo caso è opportuno monitorare attentamente lo sviluppo e la crescita del bambino.
Come usare Implanon NXT?
Prima dell'impianto di Implanon NXT informi il medico se è incinta o se potrebbe esserlo (p.es. se ha avuto rapporti non protetti durante l'attuale ciclo mestruale).
Implanon NXT può essere impiantato o rimosso unicamente da un medico che abbia esperienza nell'uso del medicamento.
Sarà il medico a determinare il momento più adatto all'inserimento (impianto) di Implanon NXT, che dipende dal suo ciclo mestruale e dal metodo di contraccezione che sta usando attualmente.
Per escludere la possibilità di una gravidanza, Implanon NXT dovrebbe essere impiantato fra il 1° e il 5° giorno del normale ciclo mestruale. Se l'impianto viene inserito dopo il quinto giorno della mestruazione, dovrebbe usare un metodo contraccettivo aggiuntivo (p.es. il preservativo) nei primi 7 giorni dall'inserimento. In caso di dubbio si rivolga al medico. Il bastoncino viene inserito sul lato interno del braccio non dominante (per le destrimano: braccio sinistro), direttamente sotto la pelle. L'inserimento di Implanon NXT viene effettuato in anestesia locale tramite un applicatore e provoca una sensazione simile a quella di un prelievo di sangue.
Alla fine dell'inserimento, il medico le chiederà di palpare l'impianto sotto la cute. Un impianto inserito correttamente dovrebbe essere chiaramente palpabile sia dal medico sia da lei: dovrebbe essere possibile avvertire le due estremità tra pollice e indice. Bisogna sapere che la palpazione non costituisce una conferma al 100% della presenza dell'impianto. Se l'impianto non può essere palpato, è possibile che esso non sia stato inserito o che sia stato inserito in profondità. In caso del minimo dubbio, bisogna usare un contraccettivo di barriera (p.es. preservativo), fino a quando sia il medico, sia lei sarete assolutamente sicuri che l'impianto è stato inserito. È possibile che il medico debba condurre un esame radiologico, ecografico o di risonanza magnetica, oppure prelevare un campione di sangue, per accertarsi che l'impianto si trovi nel suo braccio. Dopo che il medico ha trovato l'impianto che non poteva essere palpato, questo andrebbe rimosso.
Implanon NXT dovrebbe essere rimosso, ed eventualmente sostituito, al più tardi 3 anni dopo l'impianto, ma può anche essere rimosso anticipatamente in qualsiasi momento (per es. previa consultazione con il medico nel caso di pazienti di elevato peso corporeo). Anche la rimozione e la sostituzione di Implanon NXT viene effettuata in anestesia locale.
Dopo la rimozione di Implanon NXT, se non desidera una gravidanza, deve iniziare a usare sin dal giorno successivo un altro metodo contraccettivo affidabile. Il suo medico le consegnerà una scheda per l'utilizzatrice contenente le seguenti informazioni: data dell'inserimento; data entro la quale deve avvenire la rimozione o la sostituzione dell'impianto Implanon NXT; nome del medico che ha inserito Implanon NXT; braccio nel quale è stato inserito Implanon NXT; numero di lotto del medicamento.
Se desidera proseguire l'uso di Implanon NXT, il nuovo impianto può essere effettuato già al momento della rimozione di quello vecchio, nello stesso braccio e nello stesso punto di quello vecchio, se questo si trova nella posizione corretta. Il suo medico la consiglierà in proposito.
Quali effetti collaterali può avere Implanon NXT?
Informi il medico di tutti gli effetti collaterali, in particolare dei disturbi seri o duraturi, e di tutte le alterazioni del suo stato di salute che ritiene siano state causate da Implanon NXT. Gli effetti collaterali più gravi relativi all'assunzione di contraccettivi ormonali sono descritti nella rubrica «Quando è richiesta prudenza nell'uso di Implanon NXT?».
Con l'uso di Implanon NXT possono manifestarsi i seguenti effetti collaterali:
Molto comune (riguarda più di 1 utilizzatrice su 10)
acne, mal di testa, aumento di peso, sensibilità e dolore al seno, infezione vaginale, mestruazioni irregolari;
Comune (riguarda da 1 a 10 utilizzatrici su 100)
variazioni dell'umore, umore depresso, nervosismo, diminuzione della libido, vertigini, alterazioni dell'appetito, dolori addominali, nausea, meteorismo, caduta di capelli, mestruazioni dolorose (dismenorrea), amenorrea (assenza di mestruazioni), formazione di piccole cisti (cavità piene di liquido) nelle ovaie, disturbi di tipo influenzale, vampate di calore, perdita di peso, dolori, stanchezza, dolore e reazioni nel punto di inserimento (p.es. gonfiore, arrossamento, prurito, ecchimosi);
Non comune (riguarda da 10 a 100 utilizzatrici su 1000)
ansietà, insonnia, sonnolenza, emicrania, infiammazione della mucosa della gola, raffreddore, diarrea, stipsi, vomito, reazioni cutanee come esantema, prurito, prurito nella regione genitale, reazioni allergiche, irsutismo (eccessivo sviluppo di peli), mal di schiena, dolori articolari, muscolari ed ossei, infezioni delle vie urinarie, dolore durante la minzione, ingrossamento del seno, formazione di secreto mammario, secrezione vaginale, febbre, accumulo di liquido nei tessuti.
Oltre a ciò, in casi rari è stato osservato un aumento della pressione sanguigna. Dopo l'introduzione sul mercato, sono state riportate delle reazioni allergiche. Si rivolga immediatamente al medico, se manifesta segni di una reazione allergica grave quali gonfiore del viso, della lingua o della gola, disturbi della deglutizione od orticaria (per es. anche aggravamento di disturbi preesistenti o congeniti) e disturbi respiratori.
L'inserimento o la rimozione di Implanon NXT può causare un ematoma e in casi rari possono manifestarsi dolore, gonfiore, prurito o infezioni. Nel punto dove è stato effettuato l'impianto può formarsi occasionalmente una capsula di tessuto connettivo, una cicatrice o un ascesso, e si può avvertire intorpidimento o mancanza di sensibilità. In rari casi, è stato riportato il rinvenimento dell'impianto in un vaso sanguigno, compreso in un vaso sanguigno polmonare, che possono essere associati a dei sintomi tale respiro corto, tosse e/o espettorazione di sangue o muco con tracce di sangue. In rari casi, è stata riportata una gravidanza al di fuori dell'utero (cosiddetta gravidanza ectopica).
Se osserva effetti collaterali, si rivolga al suo medico, farmacista, soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Indicazione di stoccaggio
Conservare a 2-30 °C nella scatola originale.
Tenere fuori dalla portata dei bambini.
Ulteriori indicazioni
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Implanon NXT?
Principi attivi
Un impianto di Implanon NXT contiene 68 mg di etonogestrel.
Sostanze ausiliarie
Il principio attivo etonogestrel è alloggiato in materiale plastico (copolimero di etilene vinilacetato, contiene stearato di magnesio) e sigillato. L'impianto contiene solfato di bario, che lo rende visibile sulle radiografie.
Numero dell'omologazione
61298 (Swissmedic)
Dove è ottenibile Implanon NXT? Quali confezioni sono disponibili?
In farmacia, esclusivamente dietro presentazione della prescrizione medica.
Confezioni da un impianto, contenuto nell'ago di un applicatore monouso.
Titolare dell’omologazione
MSD MERCK SHARP & DOHME AG, Lucerna
Questo foglietto illustrativo è stato controllato l'ultima volta nel aprile 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
S-CCDS-MK8415-IPTx-072019/MK8415-CHE-2019-020602
Zusammensetzung
Wirkstoffe
Etonogestrel
Hilfsstoffe
Bariumsulfat, Magnesiumstearat, Ethylen-Vinylacetat-Copolymer pro praeparatione.
Darreichungsform und Wirkstoffmenge pro Einheit
Implantat (Länge: 4 cm, Durchmesser: 2 mm) mit 68 mg Etonogestrel für die subkutane Anwendung.
Indikationen/Anwendungsmöglichkeiten
Hormonale Kontrazeption.
Dosierung/Anwendung
Vor dem Einsetzen bzw. Entfernen des Implantats sind die Instruktionen in der Rubrik «Sonstige Hinweise/Hinweise für die Handhabung/Einsetzen von Implanon NXT bzw. Entfernen von Implanon NXT» sorgfältig durchzulesen und zu befolgen. Das Einsetzen sowie das Entfernen von Implanon NXT sollte nur durch einen Arzt, der mit der Technik des Implantierens und Entfernens von Implanon NXT vertraut ist, unter strikter Berücksichtigung der üblichen aseptischen Arbeitstechnik erfolgen.
Versuchen Sie nicht, den Eingriff durchzuführen, wenn Sie nicht sicher sind, welche Schritte für ein sicheres Einsetzen und eine sichere Entfernung des Implantates erforderlich sind.
Wichtig: Vor der Verwendung von Implanon NXT ist eine Schwangerschaft auszuschliessen.
Implanon NXT ist ein hormonales Langzeit-Kontrazeptivum. Das Implantat wird mithilfe eines Applikators subkutan eingesetzt. Die Anwenderin sollte darüber informiert werden, dass das Implantat jederzeit auf ihr Ersuchen hin wieder entfernt werden kann. Spätestens nach 3 Jahren soll Implanon NXT in jedem Falle entfernt werden, da eine ausreichende kontrazeptive Wirksamkeit bei längerer Anwendung nicht nachgewiesen ist. Bei Frauen mit höherem Körpergewicht sollte ein früheres Ersetzen des Implantats in Erwägung gezogen werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Wird Implanon NXT nach dem Entfernen sofort durch ein neues Implantat ersetzt, wird der kontrazeptive Schutz nicht unterbrochen. Falls die Anwenderin Implanon NXT nicht mehr verwenden möchte, aber keine Schwangerschaft wünscht, sollte ein anderes Verhütungsmittel empfohlen werden.
Werden die nachfolgend angegebenen Empfehlungen zum Zeitpunkt der Implantation eingehalten, sind jeweils keine zusätzlichen Kontrazeptionsmassnahmen notwendig. Erfolgt die Implantation hingegen später als bei den jeweiligen Empfehlungen (s.u.) angegeben, so sollte die Anwenderin dazu angehalten werden, während der ersten 7 Tage nach Insertion des Implantates zusätzlich ein barrierebildendes Kontrazeptivum zu benutzen. Hat bereits Geschlechtsverkehr stattgefunden, muss vor der Insertion von Implanon NXT eine Schwangerschaft ausgeschlossen werden.
Zeitpunkt der Implantation
- Keine vorgängige Verwendung hormonaler Kontrazeptiva (im vergangenen Monat): Die Implantation von Implanon NXT sollte am Tag 1 bis 5 des natürlichen Zyklus der Frau vorgenommen werden (auch wenn die Blutung noch anhält), wobei als Tag 1 der erste Tag ihrer Monatsblutung gezählt wird.
- Wechsel von einem kombinierten hormonalen Kontrazeptivum (kombinierten oralen Kontrazeptivum (COC), Vaginalring oder Transdermal-Pflaster): Implanon NXT sollte vorzugsweise am Tag nach der Einnahme der letzten wirkstoffhaltigen Tablette des bisher verwendeten COC oder am Tag der Entfernung des Vaginalrings oder Transdermal-Pflasters implantiert werden, spätestens aber am Tag nach dem üblichen tablettenfreien, ringfreien oder pflasterfreien Intervall bzw. der Placebophase.
- Wechsel von einem Gestagenmonopräparat (Gestagenmonopille, Injektionspräparat, Implantat) oder von einem hormonfreisetzenden Intrauterinsystem (IUS):
Gestagenmonopille: Die Implantation von Implanon NXT kann an jedem beliebigen Tag des Monats erfolgen. Das Implantat sollte innerhalb von 24 Stunden nach Einnahme der letzten Tablette eingesetzt werden.
Injektionskontrazeptivum: Das Implantat sollte am Tage der Fälligkeit der nächsten Injektion eingesetzt werden.
Implantat oder IUS: Implanon NXT soll am Tag des Entfernens des bisherigen Implantats bzw. des IUS eingesetzt werden. - Nach einem Abort im 1. Trimenon:
Implanon NXT sollte innerhalb von 5 Tagen eingesetzt werden. Im Falle einer späteren Insertion sollte während der ersten 7 Tage zusätzlich ein barrierebildendes Kontrazeptivum verwendet werden. - Nach einer Geburt oder einem Abort im 2. Trimenon:
Implanon NXT sollte 21-28 Tage nach der Geburt oder dem Abort im zweiten Trimenon implantiert werden. Wird das Implantat später eingesetzt, sollte die Frau dazu angehalten werden, während der ersten 7 Tage nach der Implantation ein zusätzliches, barrierebildendes Kontrazeptivum zu benutzen. Hat bereits Geschlechtsverkehr stattgefunden, sollte vor der Implantation eine Schwangerschaft ausgeschlossen oder die erste natürliche Menstruation der Frau abgewartet werden. Stillende Frauen, siehe Kapitel «Schwangerschaft, Stillzeit».
Spezielle Dosierungsanweisungen
Patientinnen mit Leberfunktionsstörungen
Implanon NXT darf bei Frauen mit Leberinsuffizienz nicht angewendet werden.
Patientinnen mit Nierenfunktionsstörungen
Implanon NXT wurde bei Frauen mit Niereninsuffizienz nicht untersucht, und es können keine Dosierungsempfehlungen gemacht werden.
Kinder und Jugendliche
Die Wirksamkeit und Sicherheit von Implanon NXT wurde an erwachsenen Frauen untersucht. Für Jugendliche wird, falls indiziert, die gleiche Dosierung wie bei Erwachsenen empfohlen.
Ältere Patientinnen
Nach der Menopause besteht keine Indikation.
Kontraindikationen
Gestagenhaltige Kontrazeptiva dürfen unter folgenden Umständen nicht angewendet werden:
- Akute venöse oder arterielle thromboembolische Erkrankungen (z.B. tiefe Venenthrombose, Lungenembolie, Myokardinfarkt, zerebrovaskulärer Insult);
- Erwiesene oder vermutete Sexualhormon-sensitive Tumore;
- Ungeklärte vaginale Blutungen;
- Bestehende oder vorausgegangene schwere Lebererkrankung, solange abnorme Leberfunktionsparameter bestehen;
- Bestehende oder vorausgegangene benigne oder maligne Lebertumore;
- Erwiesene oder vermutete Schwangerschaft;
- Überempfindlichkeit gegenüber einer der Komponenten von Implanon NXT.
Tritt eine dieser Situationen bzw. Erkrankungen nach Implantation von Implanon NXT erstmals auf, so muss das Implantat unverzüglich entfernt werden.
Warnhinweise und Vorsichtsmassnahmen
Vor der Verwendung von Implanon NXT ist eine Schwangerschaft auszuschliessen.
Vor einer erstmaligen oder erneuten Verwendung von Implanon NXT sollte eine komplette Anamnese (inkl. Familienanamnese) und eine gynäkologische und allgemeine Untersuchung inkl. Blutdruckmessung vorgenommen werden, wobei insbesondere die Kontraindikationen und Vorsichtsmassnahmen zu beachten sind. Ausserdem sollte die Anwenderin angewiesen werden, die Packungsbeilage aufmerksam zu lesen und den dort erwähnten Ratschlägen zu folgen.
Der Arzt soll vorgängig mit der Anwenderin die Vor- und Nachteile von Implanon NXT im Vergleich zu anderen kontrazeptiven Methoden diskutieren.
Die Anwenderin ist darauf hinzuweisen, dass Implanon NXT keinen Schutz vor einer HIV-Infektion (AIDS) oder anderen sexuell übertragbaren Krankheiten bietet. 3 Monate nach dem Einsetzen von Implanon NXT sollte eine erste Kontrolluntersuchung inkl. Blutdruckmessung durchgeführt sowie die Anwenderin über evtl. aufgetretene unerwünschte Wirkungen bzw. Beschwerden befragt werden. Die Häufigkeit und Art der weiteren regelmässigen Kontrolluntersuchungen sollten unter Berücksichtigung individueller und medizinischer Gesichtspunkte erfolgen.
Gründe für das sofortige Entfernen von Implanon NXT
Bei einer der oben genannten Kontraindikationen oder bei
- Auftreten von Ikterus, Hepatitis oder generalisiertem Pruritus
- erstmaligem Auftreten oder Zunahme von Häufigkeit oder Intensität migräneartiger oder ungewohnt starker Kopfschmerzen
- Hinweisen für thromboembolische Erkrankungen (einschliesslich Myokardinfarkt oder Schlaganfall)
- akuten Seh-, Hör- oder Sprachstörungen oder sonstigen sensorischen Ausfällen sowie bei anderen Symptomen, welche auf eine zerebrale Ischämie hindeuten
- stärkerem Blutdruckanstieg
- längerdauernder Immobilisierung (z.B. nach Unfällen oder grösseren chirurgischen Eingriffen)
- schwere depressive Zustände
- Zunahme epileptischer Anfälle
- nachgewiesenem therapieinduziertem Wachstum vorbestehender Tumore muss Implanon NXT sofort entfernt werden.
Beim Vorliegen eines der im folgenden beschriebenen Umstände muss der Nutzen eines hormonalen Kontrazeptivums individuell gegen die möglichen Risiken abgewogen und mit der Frau vor deren Entscheid zur Verwendung von Implanon NXT besprochen werden. Die Frau muss dazu aufgefordert werden, ihren Arzt zu unterrichten, falls einer der nachstehend aufgeführten Umstände erstmalig auftreten oder sich verschlimmern sollte. Der Arzt sollte dann über die weitere Anwendung von Implanon NXT entscheiden.
Thrombotische Ereignisse
Implanon NXT sollte bei Patientinnen mit Thrombophlebitis oder thromboembolischen Erkrankungen in der Anamnese mit Vorsicht angewendet werden. Epidemiologische Studien zeigen ein erhöhtes Risiko venöser und arterieller thromboembolischer Erkrankungen (wie z.B. tiefe Venenthrombose, Lungenembolie, Myokardinfarkt oder Apoplexie) bei der Anwendung kombinierter hormonaler Kontrazeptiva (CHC).
Bei Raucherinnen, die CHC anwenden, besteht ein erhöhtes Risiko für arterielle und venöse Thromboembolien. Das Risiko nimmt mit zunehmendem Alter und steigendem Zigarettenkonsum zu. Frauen, die 35 Jahre oder älter sind, sollten deshalb nicht rauchen, wenn sie hormonale Kontrazeptionsmethoden anwenden. Auch das Vorliegen einer Adipositas (BMI >30 kg/m2) sowie eine positive Familienanamnese erhöhen das Risiko für thromboembolische Ereignisse.
Die klinische Relevanz dieser Studienergebnisse für Etonogestrel bei alleiniger Anwendung als Kontrazeptivum ohne Kombination mit einer estrogenen Komponente ist unbekannt. Nach der Markteinführung wurde bei Frauen, die Etonogestrel Implantate verwendet haben, über schwere Fälle venöser und arterieller thromboembolischer Ereignisse berichtet, darunter tiefe Venenthrombosen, Lungenembolien (einige letal), Myokardinfarkte und Schlaganfälle.
Bei Auftreten möglicher Symptome thromboembolischer Ereignisse sollten entsprechende diagnostische und therapeutische Massnahmen eingeleitet werden.
Erste Anzeichen venöser thromboembolischer Ereignisse können sein: starke Schmerzen oder Schwellung in einem Bein, ungewohnt stechende Schmerzen unklarer Ursache beim Atmen oder Husten, Kurzatmigkeit, Schmerz oder Engegefühl in der Brust.
Erste Anzeichen arterieller thromboembolischer Ereignisse können sein: plötzliche starke Schmerzen in der Brust, eventuell mit Ausstrahlung in den (linken) Arm, plötzliche Atemnot, extremes Schwächegefühl, erstmaliges Auftreten einer Migräne oder jegliche ungewöhnliche, schwere und anhaltende Kopfschmerzen; plötzliche Taubheit oder Kraftlosigkeit des Gesichtes, eines Armes oder Beines, vor allem einer Körperhälfte; motorische Störungen, plötzlicher teilweiser oder vollständiger Visusverlust; Diplopie; unartikulierte Sprache oder Aphasie; Schwindel; Bewusstseinsverlust mit oder ohne fokale Krampfanfälle; deutlicher Blutdruckanstieg.
Im Falle einer bestätigten Thrombose sollte das Implantat entfernt und geeignete alternative, nichthormonale Kontrazeptionsmethoden in Betracht gezogen werden. Ebenso sollte bei Langzeit-Immobilisation, bedingt durch einen chirurgischen Eingriff oder eine Erkrankung, das Implantat entfernt und frühestens 2 Wochen nach vollständiger Mobilisierung wieder mit einer hormonalen Kontrazeption begonnen werden. Frauen mit thromboembolischen Erkrankungen in der Anamnese sollten darauf hingewiesen werden, dass die Möglichkeit eines Wiederauftretens erhöht ist.
Bei der Nutzen-Risiko-Abwägung bezüglich vaskulärer Risiken sollte beachtet werden, dass durch angemessene Behandlung bestehender Krankheiten das damit verbundene Thromboserisiko verringert werden kann und dass eine Schwangerschaft im Vergleich zur Anwendung von Implanon NXT ein höheres Risiko birgt.
Tumorerkrankungen
Das Risiko für Mammakarzinome steigt mit dem Alter. Während der Anwendung von (kombinierten) hormonalen Kontrazeptiva (CHC) ist das Risiko der Diagnose eines Mammakarzinoms leicht erhöht. Nach Absetzen der CHC nimmt das erhöhte Risiko kontinuierlich innerhalb von 10 Jahren ab. Es hängt nicht von der Dauer der Anwendung ab, sondern vom Alter der Anwenderin. Die zu erwartende Anzahl der diagnostizierten Fälle pro 10000 Frauen, die CHC anwenden (bis zu 10 Jahren nach Absetzen), verglichen mit der Anzahl Fälle bei Frauen, die nie während der gleichen Periode ein CHC angewendet haben, wurde für die jeweiligen Altersgruppen berechnet und ist in der nachfolgenden Tabelle aufgeführt:
Altersgruppe | Zu erwartende Fälle bei Anwenderinnen von CHC | Zu erwartende Fälle bei Nicht-Anwenderinnen |
|---|---|---|
16-19 Jahre | 4,5 | 4 |
20-24 Jahre | 17,5 | 16 |
25-29 Jahre | 48,7 | 44 |
30-34 Jahre | 110 | 100 |
35-39 Jahre | 180 | 160 |
40-44 Jahre | 260 | 230 |
Das Risiko für Anwenderinnen von Gestagen-Mono-Präparaten ist möglicherweise mit jenem für Anwenderinnen von CHC vergleichbar, jedoch ist die verfügbare Datenlage zu Gestagen-Mono-Präparaten zu gering, um diesbezügliche Berechnungen zu erstellen. Mammakarzinome bei Frauen, die ein CHC angewendet haben, waren zum Zeitpunkt der Diagnosestellung tendenziell weniger weit fortgeschritten als bei Frauen, die nie ein CHC angewendet hatten. Der Grund für das erhöhte Risiko bei den CHC-Anwenderinnen könnte eine frühzeitige Diagnose, biologische Effekte des CHC oder eine Kombination der beiden sein. Solange ein biologischer Effekt nicht ausgeschlossen werden kann, sollte eine individuelle Nutzen-Risiko-Analyse bei Frauen mit vorbestehendem Mammakarzinom sowie bei Frauen, bei denen ein Mammakarzinom während der Anwendung von Implanon NXT diagnostiziert wird, durchgeführt werden.
In seltenen Fällen wurden nach Anwendung hormonaler Wirkstoffe, wie sie Implanon NXT enthält, gutartige, noch seltener bösartige Lebertumore beobachtet, die vereinzelt zu lebensgefährlichen intraabdominalen Blutungen geführt haben. Wenn starke Oberbauchbeschwerden, eine Lebervergrösserung oder Anzeichen einer intraabdominalen Blutung auftreten, sollte ein Lebertumor in die differentialdiagnostischen Überlegungen einbezogen werden.
Fehlerhafte Lokalisation des Implantates/gebrochene Implantate/Abstossung des Implantates
Es liegen Berichte über eine Expulsion oder Migration des Implantats im Arm, weg von der ursprünglichen Insertionsstelle, vor die im Zusammenhang mit einer tiefen Insertion (siehe auch «Sonstige Hinweise», Abschnitt Einsetzen von Implanon NXT) oder äusseren Einwirkung (z.B. Manipulieren am Implantat oder Kontaktsport) stehen können. Bei der Mehrzahl der betroffenen Patientinnen erfolgte die Migration innerhalb des Armes, in seltenen Fällen auch in der Brustwand. Selten wurde nach der Markteinführung aber auch über Implantate berichtet, die innerhalb der Blutgefässe des Arms oder in der Pulmonalarterie aufgefunden wurden.
In einigen Fällen, bei denen das Implantat innerhalb der Pulmonalarterie gefunden wurde, wurde über Schmerzen im Thorax und/oder respiratorische Symptome (wie Husten, Dyspnoe, oder Hämoptysen) berichtet; andere Fälle waren asymptomatisch.
Falls das Implantat innerhalb des Arms von der Insertionsstelle abgewandert ist, kann die Lokalisierung schwieriger sein, und das Entfernen kann einen operativen Eingriff (ggf. in einem Operationssaal) erfordern (siehe auch «Sonstige Hinweise», Abschnitt Entfernen von Implanon NXT). Eine intravaskuläre Lokalisation des Implantates erfordert einen endovaskulären oder operativen Eingriff zur Entfernung.
Falls das Implantat zu einem beliebigen Zeitpunkt nicht ertastet werden kann, sollte es lokalisiert werden, und eine baldige Entfernung ist empfehlenswert. Falls das Implantat nicht entfernt wird, können Kontrazeption und Risiko gestagenabhängiger unerwünschter Wirkungen über die von der Anwenderin gewünschte Zeitdauer hinaus anhalten.
Es gibt Berichte über Implantate, die im Arm der Patientin gebrochen sind oder verbogen wurden. Basierend auf in vitro Daten kann die Freisetzungsrate von Etonogestrel leicht erhöht sein, wenn das Implantat gebrochen oder verbogen ist. Es wird nicht erwartet, dass die erhöhte Freisetzungsrate klinisch relevante Auswirkungen hat. Bei der Entfernung eines gebrochenen Implantates ist sicherzustellen, dass es vollständig entfernt wurde (siehe «Sonstige Hinweise», Abschnitt Entfernen von Implanon NXT).
Eine Abstossung des Implantats kann besonders dann auftreten, wenn die Implantation nicht gemäss den Instruktionen («Sonstige Hinweise», Abschnitt Einsetzen von Implanon NXT) durchgeführt wurde, oder als Folge einer lokalen Entzündung.
Follikelentwicklung/Risiko für ektopische Schwangerschaften
Wie bei allen niedrigdosierten hormonalen Kontrazeptiva kann eine Follikelentwicklung auftreten, und der Follikel kann gelegentlich grösser werden, als dies bei einem normalen Zyklus der Fall ist. Im Allgemeinen verschwinden diese vergrösserten Follikel spontan. Sie sind oft asymptomatisch, werden jedoch in einigen Fällen mit leichten Abdominalschmerzen in Verbindung gebracht und bedingen in seltenen Fällen einen chirurgischen Eingriff.
Das Risiko einer ektopischen Schwangerschaft ist unter herkömmlichen Gestagen-Monopräparaten höher als bei Anwendung von CHC, was mit den häufig auftretenden Ovulationen und der verlangsamten Tubenperistaltik unter der Anwendung von Gestagen-Monopräparaten in Verbindung gebracht wurde. Unabhängig von der Tatsache, dass Implanon NXT die Ovulation weitgehend unterdrückt, sollte eine ektopische Schwangerschaft in die Differentialdiagnose eingeschlossen werden, wenn die Anwenderin während der Verwendung von Implanon NXT über persistierende Amenorrhoe oder Schmerzen im Unterbauch klagt.
Depressive Störungen
Depressionen bzw. depressive Verstimmungen sind als mögliche unerwünschte Wirkungen bei der Anwendung von Sexualhormonen, einschliesslich hormonaler Kontrazeptiva, bekannt (s. a. Rubrik «Unerwünschte Wirkungen»). Solche Störungen können bereits kurz nach Beginn der Behandlung auftreten. Eine Depression kann schwerwiegend verlaufen und stellt einen Risikofaktor für Suizide bzw. suizidales Verhalten dar. Anwenderinnen hormonaler Kontrazeptiva sollen daher über mögliche Symptome depressiver Störungen informiert werden. Der Anwenderin soll dringend geraten werden, sich umgehend an einen Arzt zu wenden, falls sie unter der Anwendung des Kontrazeptivums Stimmungsschwankungen oder andere Symptome einer Depression bemerkt. Anwenderinnen mit einer schweren Depression in der Anamnese sollen sorgfältig überwacht werden. Falls es unter der Anwendung von Implanon NXT erneut zu schweren depressiven Zuständen kommt, muss das Arzneimittel abgesetzt werden.
Veränderungen des Blutungsmusters
Während der Verwendung von Implanon NXT kann es zu einem veränderten Blutungsmuster kommen. Häufigere oder länger anhaltende Blutungen wurden bei ca. 1 von 5 Frauen beobachtet. Andere Frauen haben nur noch gelegentlich Blutungen oder gar keine Blutungen mehr (die Amenorrhoe-Rate lag in den Studien bei ca. 20%). Das individuelle Blutungsmuster während der ersten drei Monate der Behandlung ist im Allgemeinen prädiktiv für den zukünftigen Verlauf der Menstruation unter Implanon NXT. Information, Beratung und die Benützung eines Menstruations-Kalenders können die Akzeptanz eines veränderten Blutungsmusters verbessern. Die Evaluierung von Vaginalblutungen sollte auf einer ad hoc-Basis vorgenommen werden und gleichzeitig eine Untersuchung einschliessen, um gynäkologische Erkrankungen oder eine Schwangerschaft auszuschliessen.
Sonstige Vorsichtsmassnahmen
- Die Behandlung mit Gestagenen kann zu Flüssigkeitsretention und Gewichtszunahme führen. Patientinnen mit vorbestehenden Erkrankungen, die dadurch verschlimmert werden können (z.B. Asthma, Migräne, Herz- oder Nierenfunktionsstörungen, Epilepsie), müssen sorgfältig überwacht werden.
- Beim Auftreten von akuten oder chronischen Leberfunktionsstörungen kann die Implantatentfernung erforderlich sein. Deshalb sollte die Anwenderin an einen Spezialisten überwiesen werden.
- Die Anwendung von Implanon NXT sollte unterbrochen werden, wenn ein konstant erhöhter Blutdruck bzw. eine erhebliche Blutdruckerhöhung, die nicht auf eine antihypertensive Therapie anspricht, vorliegt.
- Diabetikerinnen, die mit der Anwendung von Implanon NXT beginnen, sollten sorgfältig überwacht werden, da Hinweise für eine Beeinflussung der Glukosetoleranz vorliegen.
- Einige Gestagene können den LDL-Spiegel erhöhen und die Kontrolle einer Hyperlipidämie erschweren. Frauen mit vorbestehender Hyperlipidämie sollten daher sorgfältig überwacht werden.
- Die folgenden Erkrankungen wurden sowohl während einer Schwangerschaft als auch während der Anwendung von Sexualsteroiden beobachtet, wobei ein Zusammenhang mit einer Gestagenanwendung nicht sicher erwiesen ist: Ikterus und/oder Pruritus in Verbindung mit Cholestase, Cholelithiasis; Porphyrie; systemischer Lupus erythematodes; hämolytisch-urämisches Syndrom; Sydenham'sche Chorea; Herpes gestationis; otosklerosebedingter Hörverlust, Induktion oder Verstärkung eines Angioödems.
- Gelegentlich kann ein Chloasma auftreten, speziell bei Frauen, die ein Chloasma gravidarum hatten. Frauen, die dazu neigen, ein Chloasma zu entwickeln, sollten während der Verwendung von Implanon NXT Sonnenlichtexposition und andere ultraviolette Strahlung meiden.
- Die kontrazeptive Wirkung von Implanon NXT ist abhängig vom Plasmaspiegel von Etonogestrel, welcher in umgekehrter Relation zum Körpergewicht steht und mit der Zeit absinkt. Die klinische Erfahrung bei schwereren Frauen (>80 kg) ist beschränkt. Es kann nicht ausgeschlossen werden, dass der kontrazeptive Schutz während des dritten Anwendungsjahres bei diesen Frauen vermindert ist.
Interaktionen
Anmerkung: Die Fachinformationen von gleichzeitig angewendeten Arzneimitteln sollten zu Rate gezogen werden, um mögliche Interaktionen auszuschliessen.
Wirkung anderer Arzneimittel auf die Pharmakokinetik von Implanon NXT
Nachfolgende Interaktionen wurden in der Literatur beschrieben (hauptsächlich mit kombinierten hormonalen Kontrazeptiva, vereinzelt aber auch mit reinen Gestagen-Kontrazeptiva).
Enzyminduktoren
Interaktionen zwischen hormonalen Kontrazeptiva und Arzneimitteln, welche mikrosomale Enzyme (insbesondere Cytochrom-P450-Enzyme) induzieren und dadurch eine erhöhte Clearance von Sexualhormonen verursachen können, können zu einer Verminderung der kontrazeptiven Wirksamkeit von Implanon NXT sowie zu Blutungsstörungen führen. Dies gilt z.B. für Barbiturate, Bosentan, Carbamazepin, Felbamat, Modafinil, Oxcarbazepin, Phenytoin, Primidon, Rifabutin, Rifampicin, Topiramat sowie für Arzneimittel, welche Johanniskraut (Hypericum perforatum) enthalten.
Eine Enzyminduktion kann bereits nach einigen Tagen der Behandlung auftreten. Die maximale Enzyminduktion wird im Allgemeinen nach 2-3 Wochen beobachtet und kann nach dem Absetzen während mindestens 4 oder mehr Wochen andauern.
Frauen, die kurzfristig mit einem dieser Arzneimittel behandelt werden, sollten darauf hingewiesen werden, dass die Wirksamkeit von Implanon NXT reduziert sein kann. Wenn entschieden wird, die Kontrazeption mit Implanon NXT fortzusetzen, sollte die Anwenderin dazu aufgefordert werden, vorübergehend zusätzlich eine nicht-hormonale Kontrazeptionsmethode anzuwenden. Die Barrieremethode sollte während der gleichzeitigen Anwendung der Begleitmedikation sowie für weitere 28 Tage nach deren Absetzen verwendet werden.
Bei Langzeitbehandlung mit Arzneimitteln, welche zu einer Enzyminduktion in der Leber führen, sollten alternative (nicht-hormonale) Kontrazeptionsmethoden angewendet werden.
Darüber hinaus ist bekannt, dass verschiedene Inhibitoren der HIV/HCV-Protease (z.B. Nelfinavir, Boceprevir, Telaprevir) und der Nichtnukleosidischen Reverse-Transkriptase (z.B. Efavirenz, Nevirapin) sowie deren Kombinationen zu einer Erniedrigung oder einer Erhöhung der Plasmakonzentrationen von Gestagenen führen können. Diese Veränderungen können in einigen Fällen klinisch relevant sein. Beispielsweise wurde in einer publizierten Studie mit einer Efavirenz-haltigen Therapie bei HIV-positiven Patientinnen gegenüber Frauen ohne antiretrovirale Therapie eine um 54% niedrigere Cmax und eine um 63% niedrigere AUC von Etonogestrel gezeigt.
Insbesondere sind Proteaseinhibitoren wie Ritonavir oder Nelfinavir (einschliesslich deren Kombinationen) zwar als starke Inhibitoren von CYP3A4 bekannt, können jedoch bei gleichzeitiger Anwendung mit Steroidhormonen enzyminduzierende Eigenschaften aufweisen und dadurch die Plasmaspiegel von Gestagenen reduzieren.
Enzyminhibitoren
Starke und mässige CYP3A4-Inhibitoren wie Azol-Antimykotika (Itraconazol, Voriconazol, Posaconazol, Fluconazol), Makrolid-Antibiotika (Clarithromycin, Erythromycin), Diltiazem, Verapamil und Grapefruitsaft können die Plasmakonzentrationen von Gestagenen wie Etonogestrel erhöhen und dadurch zum vermehrten Auftreten unerwünschter Wirkungen führen.
Wirkung hormonaler Kontrazeptiva auf die Pharmakokinetik anderer Arzneimittel
Hormonale Kontrazeptiva können – durch verschiedene Interaktionsmechanismen – auch die Pharmakokinetik einiger anderer Arzneimittel beeinflussen. Sie können die hepatischen mikrosomalen Enzyme hemmen oder die hepatische Konjugation, insbesondere die Glukuronidierung, induzieren. Entsprechend können die Plasma- und Gewebekonzentrationen anderer Arzneimittel entweder erhöht (z.B. Cyclosporin) oder erniedrigt (z.B. Lamotrigin, siehe unten) werden. Weiter kann auch die pharmakologische Wirkung folgender Arzneimittelgruppen beeinflusst werden: Analgetika, Antidepressiva, Antidiabetika, Antimalariamittel, einige Benzodiazepine, einige β-Blocker, Kortikosteroide orale Antikoagulantien und Theophyllin. Bei der Anwendung solcher Arzneimittel sollte die Patientin daher engmaschig überwacht werden. Allerdings sind die aus diesen Interaktionen resultierenden Veränderungen der Plasmaspiegel nicht in allen Fällen klinisch relevant.
Eine Interaktionsstudie mit dem Antiepileptikum Lamotrigin und einem kombinierten oralen Kontrazeptivum (30 µg Ethinylestradiol/150 µg Levonorgestrel) zeigte eine klinisch relevante Steigerung der Lamotrigin-Clearance mit einer entsprechenden signifikanten Abnahme der Lamotrigin-Plasmaspiegel, wenn diese Arzneimittel gleichzeitig verabreicht wurden. Eine derartige Senkung der Plasmakonzentrationen kann mit einer reduzierten Anfallskontrolle einhergehen. Es ist nicht bekannt, in wieweit diese Befunde auf ein subdermales Gestagen-Monopräparat wie Implanon NXT übertragbar sind.
Schwangerschaft/Stillzeit
Schwangerschaft
Dieses Arzneimittel ist kontraindiziert für schwangere Frauen. Vor Beginn der Anwendung des Arzneimittels ist eine Schwangerschaft auszuschliessen. Bei Eintreten oder Vermutung einer Schwangerschaft ist Implanon NXT unverzüglich zu entfernen. Tierexperimentelle Untersuchungen haben gezeigt, dass sehr hohe Dosen von gestagenhaltigen Substanzen eine virilisierende Wirkung auf die weiblichen Föten zu Folge haben (siehe «Präklinische Daten»). Umfangreiche epidemiologische Studien ergaben weder Hinweise auf ein erhöhtes Risiko von Geburtsschäden bei Kindern, deren Mütter vor der Schwangerschaft CHCs angewendet haben, noch auf teratogene Effekte in Fällen, in denen Frauen in Unkenntnis ihrer Schwangerschaft rein gestagenhaltige Kontrazeptiva angewendet haben. Obwohl dies wahrscheinlich auf alle CHC's zutrifft, ist es nicht klar, ob dies bei Implanon NXT auch der Fall ist.
Pharmacovigilance-Daten mit verschiedenen etonogestrel- und desogestrelhaltigen kombinierten Kontrazeptiva (Etonogestrel ist ein Metabolit von Desogestrel) haben ebenfalls kein erhöhtes Risiko gezeigt.
Stillzeit
Wie andere Gestagen-Mono-Präparate zur Kontrazeption hat auch Implanon NXT keinen negativen Einfluss auf Menge und Qualität (Proteine, Laktose oder Konzentrationen an Fett) der Muttermilch. Es werden jedoch kleine Mengen Etonogestrel in die Muttermilch ausgeschieden. Basierend auf einer durchschnittlichen Milchaufnahme von 150ml/kg pro Tag beträgt die durchschnittliche Etonogestrel-Aufnahme des Neugeborenen - nach einer einmonatigen Etonogestrel Freisetzung - ca. 27 ng/kg pro Tag. Dies entspricht ca. 0,2% der absoluten Tagesdosis, die von der Mutter aufgenommen wird (2,2% wenn pro kg KG berechnet). Der Etonogestrel-Spiegel in der Muttermilch sinkt mit der Zeit. Es liegen Langzeit-Daten bei 38 Kindern vor, bei deren Müttern zwischen der 4. und 8. Woche nach der Geburt ein Implantat eingesetzt wurde. Die Kinder wurden während durchschnittlich 14 Monaten gestillt und über 36 Monate überwacht. Das Wachstum, die physische und psychische Entwicklung wurden beobachtet und mit Säuglingen, deren Mütter ein IUD (n=33) benutzten, verglichen. Es wurden keine Unterschiede festgestellt. Trotzdem sollten Entwicklung und Wachstum des Kindes sorgfältig beobachtet werden. Basierend auf den zur Verfügung stehenden Daten kann Implanon NXT während der Stillzeit angewendet werden, sollte aber frühestens 4 Wochen nach der Geburt eingesetzt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Basierend auf dem pharmakodynamischen Profil wird angenommen, dass Implanon NXT keinen bzw. keinen relevanten Einfluss auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen hat.
Unerwünschte Wirkungen
Die schwerwiegendsten unerwünschten Wirkungen im Zusammenhang mit der Anwendung hormonaler Kontrazeptiva sind in der Rubrik «Warnhinweise und Vorsichtsmassnahmen» beschrieben.
Nachfolgend sind die unerwünschten Wirkungen nach Organsystem und Häufigkeit aufgeführt, welche in klinischen Studien und/oder während der Marktüberwachung unter der Anwendung von Implanon NXT beobachtet wurden. Häufigste unerwünschte Wirkungen waren dabei: Kopfschmerzen, Akne, Vaginitis, Gewichtszunahme, Brustspannen und Brustschmerzen sowie unregelmässige Blutungen. In klinischen Studien waren Blutungsveränderungen der häufigste Grund für einen Behandlungsabbruch (rund 11%).
Das Einsetzen oder Entfernen des Implantats kann blaue Flecken, Jucken, eine leichte lokale Irritation oder Schmerzen verursachen. An der Implantationsstelle können Parästhesien auftreten. Ausserdem kann sich eine Narbe oder ein Abszess bilden bzw. eine Fibrose entwickeln.
Über Fälle einer Migration oder Expulsion des Implantates wurde berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1000, <1/100); nicht bekannt (basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann nicht abgeschätzt werden).
Infektionen und parasitäre Erkrankungen
Gelegentlich: Pharyngitis, Rhinitis, Harnwegsinfekte.
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeitsreaktionen.
Nicht bekannt: anaphylaktische Reaktionen, Angioödem (einschliesslich Verschlechterung eines hereditären Angioödems).
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Gewichtszunahme (14%).
Häufig: Veränderungen des Appetits, Gewichtsabnahme.
Psychiatrische Erkrankungen
Häufig: Stimmungsschwankungen, verminderte Libido, depressive Verstimmungen, Nervosität.
Gelegentlich: Ängstlichkeit, Schlaflosigkeit, Schläfrigkeit.
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (25%).
Häufig: Schwindel.
Gelegentlich: Migräne.
Gefässerkrankungen
Häufig: Hitzewallungen
Selten: klinisch relevanter Blutdruckanstieg.
Erkrankungen des Gastrointestinaltrakts
Häufig: Abdominalschmerzen, Übelkeit, Flatulenz.
Gelegentlich: Erbrechen, Obstipation, Diarrhoe.
Erkrankungen der Haut und des Unterhautzellgewebes
Sehr häufig: Akne (14%).
Häufig: Alopezie.
Gelegentlich: Hypertrichose, Hautausschlag, Pruritus.
Nicht bekannt: Seborrhoe, Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Rückenschmerzen, Arthralgien, Myalgien, muskuloskeletale Schmerzen.
Erkrankungen der Nieren- und Harnwege
Gelegentlich: Dysurie.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Sehr häufig: Veränderungen des uterinen Blutungsmusters, Vaginitis (15%), Brustschmerzen und -empfindlichkeit (13%).
Häufig: Dysmenorrhoe, Amenorrhoe, Ovarialzysten.
Gelegentlich: genitaler Fluor, vulvovaginale Beschwerden, Galaktorrhoe, Brustvergrösserung, genitaler Pruritus.
Nicht bekannt: ektopische Schwangerschaft.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Schmerzen und andere Reaktionen an der Implantationsstelle (z.B. Erythem, Schwellungen, Pruritus, leichte Irritation, Hämatom; siehe «Eigenschaften/Wirkungen»), Müdigkeit, grippeartige Symptome, Schmerzen.
Gelegentlich: Fieber, Ödeme.
Unter Anwendung anderer hormonaler Kontrazeptiva wurde darüber hinaus unter anderem über folgende unerwünschte Wirkungen berichtet (vgl. «Warnhinweise und Vorsichtsmassnahmen»): venöse und arterielle thromboembolische Erkrankungen, arterielle Hypertonie, hormonabhängige Tumore (z.B. Lebertumore oder Brustkrebs), Chloasma.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es sind keine Daten über eine Überdosis von Etonogestrel verfügbar.
Generell ist über schwerwiegende schädigende Wirkungen im Falle einer Überdosis von hormonalen Kontrazeptiva noch nicht berichtet worden.
Das vorhandene Implantat ist vor dem Einsetzen eines neuen stets zu entfernen.
Eigenschaften/Wirkungen
ATC-Code
G03AC08
Wirkungsmechanismus
Implanon NXT ist Etonogestrel-haltiges Implantat zur subkutanen Anwendung. Etonogestrel (= 3-Ketodesogestrel) ist der biologisch aktive Metabolit von Desogestrel, einem in oralen Kontrazeptiva häufig eingesetzten Gestagen. Es ist strukturell von 19-Nortestosteron abgeleitet und weist eine hohe Bindungsaffinität zu den Gestagenrezeptoren der Zielorgane auf.
Im Gegensatz zu herkömmlichen rein gestagenhaltigen Kontrazeptiva beruht die kontrazeptive Wirkung von Etonogestrel primär auf einer Hemmung der Ovulation, wobei die ovarielle Aktivität nicht vollständig unterdrückt wird. Ovulationen wurden in den ersten zwei Jahren der Anwendung nie, im dritten Jahr bei 4,3% der Anwenderinnen beobachtet. Neben der Unterdrückung der Ovulation bewirkt Etonogestrel auch eine Reduktion der Endometriumsdicke und eine Viskositätserhöhung des Zervixschleimes, was die Passage von Spermien hemmt.
Pharmakodynamik
Keine Angaben.
Klinische Wirksamkeit
In den klinischen Studien an Frauen im Alter von 18-40 Jahren mit einer Exposition über insgesamt 36'555 Zyklen wurden keine Schwangerschaften beobachtet, jedoch liegen aus der Marktbeobachtung Meldungen über ungewollte Schwangerschaften vor. Obwohl kein direkter Vergleich erfolgte, scheint die kontrazeptive Wirkung mit derjenigen der kombinierten oralen Kontrazeptiva mindestens vergleichbar zu sein.
Dieser hohe Schutz vor Schwangerschaft wird u.a. erreicht, weil die kontrazeptive Wirkung von Implanon NXT nicht von der Einhaltung eines Behandlungsschemas durch die Anwenderin abhängig ist.
Die kontrazeptive Wirkung von Etonogestrel ist reversibel, was sich in einer raschen Normalisierung des Menstruationszyklus (i.d.R. innerhalb eines Monats) nach der Entfernung des Implantats zeigt.
Klinische Sicherheit
In einer klinischen Studie, in der die Prüfärzte die Implantationsstelle nach dem Einsetzen von Implanon NXT beurteilen sollten, wurden bei 8,6% der Frauen Reaktionen an der Implantationsstelle beschrieben. Am häufigsten waren dabei während und kurz nach der Insertion auftretende Erytheme an der Implantationsstelle; sie traten bei 3,3% der Frauen auf. Zusätzlich wurde über Hämatome (3,0%), blaue Flecken (2,0%), Schmerzen (1,0%) und Schwellungen (0,7%) berichtet.
Die Wirkung von Etonogestrel auf die Knochendichte (n=44) wurde mit einer nicht-hormonalen Spirale (n=29) während zwei Jahren verglichen. Es wurden keine unerwünschten Wirkungen auf die Knochendichte beobachtet. Es wurden keine klinisch relevanten Wirkungen auf den Lipidmetabolismus beobachtet.
Gestagenhaltige Kontrazeptiva können die Insulinresistenz und Glukosetoleranz ungünstig beeinflussen (siehe «Warnhinweise und Vorsichtsmassnahmen»). Klinische Studien zeigen ausserdem, dass bei Anwenderinnen von Implanon NXT Dysmenorrhö-Beschwerden oft vermindert sind.
Pharmakokinetik
Absorption
Nach dem Einsetzen des Implantats wird Etonogestrel rasch absorbiert. Ovulationshemmende Plasmakonzentrationen werden innerhalb 1 Tages erreicht. Die absolute Bioverfügbarkeit von Etonogestrel beträgt ca. 95%. Die maximalen Plasmaspiegel (zwischen 472 und 1270 pg/ml) werden innerhalb von 1 bis 13 Tagen erreicht.
Die Wirkstofffreisetzung aus dem Implantat sinkt mit der Zeit und beträgt während den Wochen 5-6 ungefähr 60-70 µg Etonogestrel pro Tag und nimmt bis Ende des ersten Jahres auf rund 35-45 µg, bis Ende des zweiten Jahres auf rund 30-40 µg und bis Ende des dritten Jahres auf rund 25-30 µg Etonogestrel pro Tag ab.
Aus diesem Grund nehmen die Plasmakonzentrationen während der ersten Monate schnell ab. Am Ende des ersten Jahres wird eine durchschnittliche Konzentration von rund 200 pg/ml (150-261 pg/ml) gemessen, die bis Ende des dritten Jahres langsam auf 156 pg/ml (111-202 pg/ml) absinkt. Die Plasmaspiegel von Etonogestrel sind gewichtsabhängig. Die gefundene Variabilität kann somit teilweise auf Unterschiede im Körpergewicht zurückgeführt werden.
Distribution
Etonogestrel wird zu 95,5-99% an Plasmaproteine, vorwiegend an Albumin und in geringerem Masse auch an SHBG gebunden. Das Verteilungsvolumen beträgt rund 220 l. Bei stillenden Frauen wird für Etonogestrel eine Milch/Serum-Ratio von 0,44-0,50 gemessen (siehe «Schwangerschaft, Stillzeit»).
Metabolismus
Etonogestrel wird über das hepatische mikrosomale Enzymsystem hydroxyliert, reduziert und zu Sulfaten und Glukuroniden konjugiert. Die Hydroxylierung wird durch CYP3A4 katalysiert.
Elimination
Nach intravenöser Verabreichung von Etonogestrel beträgt die durchschnittliche Eliminationshalbwertzeit rund 25 Stunden. Die Plasmaclearance liegt bei zirka 7,5 l/Stunde. Beide Werte bleiben während der 3-jährigen Anwendungsdauer von Implanon NXT konstant.
Die Ausscheidung von Etonogestrel und dessen Metaboliten, in Form von freien Steroiden oder als Konjugate, erfolgt über den Urin und die Fäzes (Verhältnis 1,5:1).
Kinetik spezieller Patientengruppen
Es liegen keine Daten zur Pharmakokinetik bei Frauen mit Leber- oder Niereninsuffizienz vor.
Präklinische Daten
Präklinische Untersuchungen mit Etonogestrel zur Toxizität nach wiederholter Gabe, zur Genotoxizität und zum karzinogenen Potential ergaben keine eindeutigen Hinweise auf besondere Risiken für den Menschen. Gestagenartige Substanzen zeigten im Tierexperiment einen embryoletalen Effekt und, in hohen Dosen, eine virilisierende Wirkung auf weibliche Feten. Reproduktionstoxikologische Studien mit Etonogestrel in Ratten und Kaninchen ergaben keinen Hinweis auf eine teratogene Wirkung.
Sonstige Hinweise
Beeinflussung diagnostischer Methoden
Berichte zu den CHCs haben gezeigt, dass kontrazeptive Steroide die Ergebnisse bestimmter Labortests beeinflussen können, wie biochemische Parameter von Leber, Schilddrüse, Nebennieren- und Nierenfunktion, Plasmaspiegel von (Träger-) Proteinen (z.B. kortikosteroidbindendes Globulin) und Lipid/Lipoproteinfraktionen, Parameter des Kohlehydratmetabolismus sowie Koagulations- und Fibrinolyseparameter. Diese Veränderungen bewegen sich im Allgemeinen innerhalb des Normbereichs. Inwiefern diese Veränderungen auch bei Gestagen-Mono-Präparaten auftreten, ist nicht bekannt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum eingesetzt werden.
Besondere Lagerungshinweise
Bei 2-30 °C in der Originalpackung aufbewahren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Das Einsetzen und Entfernen bzw. Ersetzen von Implanon NXT darf nur durch einen mit der Technik vertrauten Arzt erfolgen. Der Eingriff muss unter aseptischen Bedingungen und unter Verwendung des mitgelieferten Applikators erfolgen. Dieser enthält das Implantat in einer Nadel.
Ärzte, die noch nie ein Implanon NXT eingesetzt haben, sollten zuerst eine durch die Vertriebsfirma organisierte Schulung besuchen. Ärzte, die nur wenig Erfahrung mit der subkutanen Implantation haben, sollten die dazu notwendige Technik unter der Anleitung eines erfahrenen Kollegen erlernen.
Grundlage für die erfolgreiche Anwendung und Entfernung von Implanon NXT ist die korrekte und vorsichtige subdermale Insertion des Implantats gemäss untenstehender Anleitung.
Bei allen Fragen oder Unklarheiten sowie bei Schwierigkeiten bei Einsetzen, Lokalisieren oder Entfernen des Implantates wenden Sie sich bitte an die lokale Niederlassung der Zulassungsinhaberin. Dies gilt insbesondere, wenn Sie mit der Technik (noch) nicht vertraut sind.
Es wurde über einige Fälle berichtet, bei denen Implanon nicht zum korrekten Zeitpunkt (Tag), nicht korrekt oder gar nicht eingesetzt wurde. Dies führte unter anderem zu ungewollten Schwangerschaften. Das Vorkommen solcher Ereignisse kann minimiert werden, wenn die nachfolgenden Instruktionen für das Einsetzen von Implanon NXT sowie die Angaben unter «Dosierung/Anwendung», Zeitpunkt der Implantation strikt befolgt werden. Die korrekte Lokalisation des Implantats sollte sofort nach dem Einsetzen mittels Palpation – sowohl durch den Arzt als auch durch die Anwenderin – überprüft werden. Falls das Implantat nicht palpiert werden kann oder wenn nicht sicher ist, dass das Implantat eingesetzt wurde, sollte die Angaben unter Wenn das Stäbchen nach der Insertion nicht tastbar ist (siehe unten) befolgt werden.
Einsetzen von Implanon NXT
Um sicherzustellen, dass das Implantat direkt unter der Haut eingesetzt wird, sollte der Arzt so positioniert sein, dass er das Vorrücken der Nadel sieht, indem er den Applikator von der Seite und nicht von oberhalb des Armes betrachtet. Von der Seite her können die Einstichstelle und die Bewegung der Nadel direkt unter der Haut deutlich gesehen werden.
Das Implantat sollte an der Innenseite des nicht dominanten Oberarms subdermal direkt unter die Haut eingesetzt werden. Ein Implantat, das tiefer als subdermal eingesetzt wird (nachfolgend als «tiefe Insertion» bezeichnet), ist möglicherweise nicht tastbar, und Lokalisierung und/oder Entfernung können erschwert sein (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei tiefer Insertion kann es zu Gefäss- oder Nervenverletzungen kommen. Tiefe bzw. nicht korrekte Insertionen wurden mit Parästhesien (infolge Nervenverletzung) und Migration des Implantats in Verbindung gebracht (bei Einsetzen in die Faszie oder in den Muskel). In seltenen Fällen kam es zu einer intravaskulären Insertion.
Bitten Sie die Anwenderin, auf dem Rücken liegend ihren nicht-dominanten Arm am Ellbogen zu beugen und so nach aussen zu drehen, dass ihre Hand unter ihrem Kopf liegt (oder so nahe wie möglich) (Abb. 1). | Abb. 1
| ||
| Legen Sie die Einstichstelle fest. Sie sollte an der Innenseite des nicht- dominanten Oberarms über dem Trizeps etwa 8-10 cm oberhalb des medialen Epicondylus des Humerus und 3-5 cm hinter dem (bzw. unterhalb des) Sulcus zwischen Bizeps und Trizeps liegen (Abb. 2a, 2b, und 2c). Durch Wahl dieser Lokalisation sollen die grossen Blutgefässe und Nerven vermieden werden, die innerhalb und um den Sulcus herum liegen. Wenn es nicht möglich ist, das Implantat an dieser Stelle einzusetzen (z.B. bei Frauen mit dünnen Armen), sollte es so weit wie möglich hinter dem Sulcus eingesetzt werden. | ||
Markieren Sie mit einem chirurgischen Stift 2 Punkte: zuerst den Punkt der Einstichstelle, dann einen weiteren Punkt 5 cm proximal zur ersten Markierung (zur Schulter hin) (Abb. 2a und 2b). Die zweite Markierung (sog. «Führungsmarkierung») wird später die Insertionsrichtung angeben. | Abb. 2a
P, proximal (zur Schulter hin); D, distal (zum Ellbogen hin) | ||
Abb. 2b
| |||
Abb. 2c
Querschnitt des linken Oberarms, vom Ellbogen her gesehen Medial (Innenseite des Arms) Lateral (Aussenseite des Arms) | |||
Nachdem Sie den Arm markiert haben, vergewissern Sie sich nochmals, dass sich die Stelle am richtigen Ort auf der Innenseite des Arms befindet. Reinigen Sie die Haut von der Einstichstelle bis zur Leitmarkierung mit einer antiseptischen Lösung. Anästhesieren Sie den Bereich der Einstichstelle (z.B. mit einem anästhesierenden Spray oder mit 2 ml Lidocain (1%) direkt unter die Haut entlang des geplanten Implantationskanals). Entnehmen Sie den sterilen Applikator, welcher das Implantat in einer Nadel enthält, aus seiner Blisterverpackung. Der Applikator sollte nicht verwendet werden, falls die Sterilität fraglich ist. | |||
Halten Sie den Applikator oberhalb der Nadel im Bereich der strukturierten Oberfläche und entfernen Sie die transparente Schutzkappe, indem Sie sie horizontal in Pfeilrichtung von der Nadel abziehen (Abb. 3). Wenn sich die Kappe nicht leicht lösen lässt, sollte der Applikator nicht benutzt werden. Sie sollten das weissgefärbte Implantat sehen, wenn Sie in die Spitze der Nadel schauen. Berühren Sie auf keinen Fall den violetten Schieber, bevor Sie die Nadel vollständig subdermal platziert haben, weil dies zum Zurückziehen der Nadel und zur vorzeitigen Freisetzung des Implantats führen würde. Falls der violette Schieber vorzeitig ausgelöst wird, beginnen Sie die Insertion nochmals mit einem neuen Applikator. | Abb. 3
| ||
Dehnen Sie die Haut im Bereich der Einstichstelle mit Ihrer freien Hand in Richtung Ellbogen (Abb. 4). Das Implantat sollte subdermal direkt unter die Haut eingesetzt werden (siehe «Warnhinweise und Vorsichtsmassnahmen»). Um sicherzustellen, dass das Implantat direkt unter der Haut eingesetzt wird, sollten Sie sich so positionieren, dass Sie das Vorrücken der Nadel sehen, indem Sie den Applikator von der Seite und nicht von oberhalb des Armes betrachten (siehe Abb. 6). | Abb. 4
| ||
Durchstechen Sie die Haut mit der Nadelspitze in einem leichten Winkel von weniger als 30° (Abb. 5a). | Abb. 5a
| ||
| Führen Sie die Nadel ein, bis die Abschrägung (abgeschrägte Öffnung der Spitze) knapp unter der Haut (und nicht weiter) liegt (Abb. 5b). Falls Sie die Nadel über die Abschrägung hinaus eingeführt haben, ziehen Sie sie so weit wieder heraus, bis nur noch die Abschrägung unter der Haut liegt. | Abb. 5b
| |
Senken Sie den Applikator in eine nahezu horizontale Position ab. Um die subdermale Positionierung zu erleichtern, heben Sie die Haut mit der Nadelspitze an, während Sie die Nadel in voller Länge hineinschieben (Abb. 6). Eventuell spüren Sie einen leichten Widerstand, üben Sie aber nicht zu viel Druck aus. Wenn die Nadel nicht in voller Länge inseriert wird, wird das Implantat nicht korrekt eingesetzt. Wenn die Nadelspitze aus der Haut herauskommt bevor die Einführung der Nadel vollständig ist, sollte die Nadel zurückgezogen und wieder in die subkutane Position gebracht werden, bevor der Insertionsvorgang abgeschlossen wird. | Abb. 6
| ||
Belassen Sie den Applikator in dieser Position mit vollständig eingeführter Nadel (Abb. 7). Falls nötig, können Sie den Applikator mit Ihrer freien Hand stabilisieren. | Abb. 7
| ||
Entsichern Sie jetzt den violetten Schieber, indem Sie ihn leicht herunterdrücken (Abb. 8a). Bewegen Sie den Schieber bis zum Anschlag ganz zurück, ohne dabei den Applikator zu bewegen ( | Abb. 8a
| ||
Abb. 8b
| |||
Abb. 8c
| |||
Wenn der Applikator während dieses Vorgangs nicht in der gleichen Position gehalten oder der violette Schieber nicht vollständig bis zum Anschlag zurückgezogen wird, wird das Implantat nicht korrekt eingesetzt. Falls das Implantat aus der Insertionsstelle herausragt, entfernen Sie das Implantat und führen Sie an der gleichen Einstichstelle mit einem neuen Applikator einen neuen Eingriff durch. Drücken Sie ein eventuell hervorstehendes Implantat auf keinen Fall zurück in die Inzision. | |||
Bringen Sie einen kleinen Pflasterverband über der Insertionsstelle an. Kontrollieren Sie immer sofort durch Palpation das Vorhandensein des Implantats im Arm der Anwenderin. Durch Ertasten der beiden Implantat-Enden im Abstand von 4 cm sollten Sie in der Lage sein, das Vorhandensein des Stäbchens zu bestätigen (Abb.9). Siehe auch Wenn das Stäbchen nach der Insertion nicht tastbar ist. | Abb. 9
| ||
Bitten Sie die Anwenderin, das Implantat zu ertasten. Legen Sie einen Druckverband an, um Hämatomen vorzubeugen. Die Anwenderin kann den Druckverband nach 24 Stunden und den kleinen Pflasterverband über der Einstichstelle nach 3-5 Tagen entfernen. In der Implanon NXT-Packung befindet sich eine Anwenderinnenkarte mit der Chargennummer. Notieren Sie auf dieser Karte Datum und Lokalisation (linker oder rechter Arm) der Insertion von Implanon NXT sowie den geplanten (spätesten) Entfernungstermin und geben Sie sie der Anwenderin zur Aufbewahrung. Die ebenfalls in der Packung enthaltenen Klebeetiketten erleichtern die Dokumentation der Chargennummer in der Patientenakte. Der Applikator ist nur zum einmaligen Gebrauch bestimmt und muss nach Benutzung fachgerecht entsorgt werden. | |||
Wenn das Stäbchen nach der Insertion nicht tastbar ist: Wenn Sie das Implantat nicht ertasten können oder Zweifel an seinem Vorhandensein haben, kann es sein, dass das Implantat nicht oder (zu) tief eingesetzt wurde.
| |||
Entfernen von Implanon NXT
Die Entfernung des Implantats sollte unter aseptischen Bedingungen von einem mit der Technik vertrauten Arzt vorgenommen werden. Zum Entfernen des Implantates ist eine kleine Inzision in die Haut erforderlich.
Vor Beginn der Entfernung sollte die exakte Lage des Implantats durch Palpation bestimmt werden. Wenn das Implantat nicht tastbar ist, überprüfen Sie anhand der Anwenderinnenkarte oder der Krankenakte, welcher Arm das Implantat enthält. Wenn das Implantat nicht palpiert werden kann, liegt es möglicherweise tiefer oder ist abgewandert. Falls das Implantat innerhalb des Armes abgewandert ist, kann die Lokalisierung schwieriger sein, und das Entfernen kann einen kleinen operativen Eingriff mit einer grösseren Inzision oder einen operativen Eingriff in einem Operationssaal erfordern (siehe auch unten: Lokalisierung und Entfernung eines nicht tastbaren Implantates).
Berücksichtigen Sie dabei, dass es in der Nähe von Gefässen und Nerven liegen kann. Die Entfernung von nicht palpierbaren Implantaten sollte daher nur von einem Arzt durchgeführt werden, der sowohl Erfahrung mit der Lokalisierung und Entfernung von tief gesetzten Implantaten hat als auch mit der Anatomie des Arms vertraut ist. Falls das Implantat nicht ertastet werden kann: siehe Lokalisierung und Entfernung eines nicht tastbaren Implantats.
Entfernen eines tastbaren Implantats
Die Patientin soll auf dem Rücken liegen. Der Arm sollte mit gebeugtem Ellbogen und der Hand unter dem Kopf (oder so nah wie möglich) positioniert werden (siehe Abb. 1). Lokalisieren Sie das Implantat durch Palpation. Drücken Sie das der Schulter am nächsten liegende Ende des Implantats nach unten (Abb. 10), um es zu stabilisieren; es sollte eine Wölbung erscheinen, die auf die Spitze des Implantats hinweist, die dem Ellbogen am nächsten liegt. Wenn die Spitze nicht hervortritt, kann die Entfernung des Implantats schwieriger sein und sollte nur von Ärzten durchgeführt werden, die mit der Entfernung tiefer liegender Implantate vertraut sind. Markieren Sie das distale Ende (d.h. dem Ellbogen am nächsten), z.B. mit einem chirurgischen Stift. Reinigen Sie die Stelle mit einer antiseptischen Lösung. | Abb. 10
P, proximal (zur Schulter hin); D, distal (zum Ellbogen hin) | |||
Applizieren Sie eine Lokalanästhesie, z.B. mit 0,5-1 ml Lidocain 1% an jener Stelle, an welcher die Inzision geplant ist (Abb. 11). Das Anästhetikum soll direkt unter das Implantat gespritzt werden, damit dieses möglichst nahe an der Hautoberfläche bleibt. Eine Injektion des Lokalanästhetikums über dem Implantat kann die Entfernung erschweren. | Abb. 11
| |||
Fixieren Sie das Implantat während des Eingriffs, indem Sie das der Schulter am nächsten liegende Ende nach unten drücken (Abb. 12). Nehmen Sie beginnend über der dem Ellbogen am nächsten liegenden Implantatsspitze parallel zum Implantat eine longitudinale Inzision von 2 mm in Richtung des Ellbogens vor. Achten Sie darauf, dass Sie die Spitze des Implantats nicht einschneiden. | Abb. 12
| |||
Die Spitze des Implantats sollte aus dem Schnitt herausragen. Ist dies nicht der Fall, schieben Sie das Implantat sachte in Richtung der Inzision vor, bis dessen Ende sichtbar wird. Fassen Sie das Implantat mit einer Klemme und entfernen sie es (Abb. 13). | Abb. 13
| |||
Entfernen Sie ggf. anhaftendes Gewebe mittels stumpfer Dissektion vorsichtig von der Spitze des Implantats. Falls die Implantatspitze trotz stumpfer Dissektion nicht freigelegt werden kann, inzidieren Sie die Gewebehülle und entfernen Sie das Implantat dann mittels Klemme (Abb. 14, 15). | Abb. 14
| |||
Abb. 15
| ||||
| Ist das Implantat noch nicht sichtbar, führen Sie oberflächlich eine Klemme (vorzugsweise gebogene Mosquito-Klemme, mit den Spitzen nach oben gerichtet) in die Inzision ein (Abb. 16). Greifen Sie das Implantat vorsichtig und wechseln Sie diese Klemme dann in die andere Hand (Abb. 17). Legen Sie mit einer zweiten Klemme vorsichtig das Gewebe um das Implantat frei und greifen Sie das Implantat (Abb. 18). Nun kann das Implantat entfernt werden. Wenn das Implantat nicht erfasst werden kann, stoppen Sie den Eingriff und verweisen Sie die Patientin an einen Arzt, der mit komplizierten Implantat-Entfernungen vertraut ist, oder wenden Sie sich an die lokale Niederlassung der Zulassungsinhaberin. | |||
Abb. 16
| Abb. 17
| Abb. 18
| ||
Es gibt Berichte über Implantate, die im Arm der Patientin gebrochen sind, wobei in einigen Fällen über eine schwierige Entfernung des gebrochenen Implantats berichtet wurde. Vergewissern Sie sich durch Messung seiner Länge, dass das gesamte Implantat mit einer Länge von 4 cm entfernt wurde. Falls nur ein Teil des Implantates entfernt wurde (d.h. das gewonnene Objekt kürzer als 4 cm ist) muss die Inzision ggf. erweitert werden, um auch den verbliebenen Rest des Implantats zu entfernen. Zum Auffinden des Rests kann die Anwendung eines bildgebenden Verfahrens erforderlich sein. Nachdem Sie das Implantat entfernt haben, bedecken Sie den Einschnitt mit einem sterilen Wundverschlusspflaster. Legen Sie zur Vorbeugung von Hämatomen einen Druckverband an. Die Anwenderin kann den Druckverband nach 24 Stunden und das Pflaster nach 3-5 Tagen entfernen. | ||||
Lokalisierung und Entfernung eines nicht tastbaren Implantats
Über eine Migration des Implantats wurde gelegentlich berichtet, meist betraf diese eine geringe Verschiebung von der ursprünglichen Position (siehe auch «Warnhinweise und Vorsichtsmassnahmen»). Ein Implantat, das (zu) tief eingesetzt wurde oder abgewandert ist, kann möglicherweise nicht ertastet werden, so dass für die Lokalisierung die unten beschriebenen bildgebenden Verfahren erforderlich sein können.
Ein nicht tastbares Implantat sollte immer zuerst lokalisiert werden, bevor eine Entfernung versucht wird. Geeignete Methoden zur Lokalisation sind Sonographie mit einem hochfrequenten linearen Wandler (10 MHz oder höher), Röntgen in zwei Ebenen, Computertomographie oder MRI. Sobald das Implantat im Arm lokalisiert wurde, sollte es, ggf. unter sonographischer Führung, von einem Arzt entfernt werden, der sowohl Erfahrung mit der Entfernung von tief gesetzten Implantaten hat als auch mit der Anatomie des Arms vertraut ist.
Falls das Implantat nach umfassenden Lokalisierungsversuchen nicht im Arm gefunden werden kann, sollte eine Untersuchung des Thorax mit bildgebenden Verfahren in Betracht gezogen werden, da über seltene Fälle einer Migration in pulmonale Gefässe berichtet wurde. Falls das Implantat im Thoraxbereich aufgefunden wird, kann ein operativer oder endovaskulärer Eingriff zur Entfernung erforderlich sein; in diesem Fall sollte ein mit der Thorax-Anatomie vertrauter Spezialist konsultiert werden.
Falls eine Lokalisierung des Implantats mit den genannten bildgebenden Verfahren nicht möglich ist, kann der Etonogestrelgehalt im Blut bestimmt werden, um das Vorhandensein des Implantats zu verifizieren.
Das Entfernen von tief eingesetzten Implantaten muss unter besonderer Vorsicht durchgeführt werden, um Schäden an tieferen neuronalen oder vaskulären Strukturen zu vermeiden. Nicht palpierbare und tief eingesetzte Implantate sollten durch Ärzte entfernt werden, die mit der Anatomie des Arms und der Entfernung von tief eingesetzten Implantaten vertraut sind.
Von einem explorativen chirurgischen Eingriff ohne Kenntnis der genauen Implantat-Position wird dringend abgeraten.
Ersetzen von Implanon NXT
Wenn die weitere Implanon NXT-Anwendung gewünscht wird, kann ein neues Implantat sofort nach Entfernung des bisherigen Implantats eingesetzt werden. Die Technik des Ersetzens entspricht im Wesentlichen der unter Einsetzen von Implanon NXT beschriebenen.
Das neue Implantat kann in den gleichen Arm durch die gleiche Inzision, die zur Entfernung des bisherigen Implantats gemacht wurde, eingesetzt werden, sofern diese sich an der korrekten Stelle, d.h. 8-10 cm oberhalb des medialen Epicondylus des Humerus und 3-5 cm hinter dem (unterhalb des) Sulcus, befindet (siehe Abschnitt Einsetzen von Implanon NXT). In diesem Fall anästhesieren Sie die Insertionsstelle entlang des geplanten Insertionskanals (z.B. mit 2 ml Lidocain 1%) direkt unter die Haut beginnend an der Inzision und folgen Sie dann den nachfolgenden Schritten der Anleitung zum Einsetzen des Implantats.
Zulassungsnummer
61298 (Swissmedic).
Zulassungsinhaberin
MSD MERCK SHARP & DOHME AG, Luzern.
Stand der Information
April 2020
S-CCDS-MK8415-IPTx-072019/MK8415-CHE-2020-021725
Composition
Principes actifs
Étonogestrel
Excipients
Sulfate de baryum, stéarate de magnésium, copolymère éthylène-acétate de vinyle pro praeparatione
Forme pharmaceutique et quantité de principe actif par unité
Implant (d'une longueur de 4 cm et d'un diamètre de 2 mm) contenant 68 mg d'étonogestrel pour application sous-cutanée.
Indications/Possibilités d’emploi
Contraception hormonale.
Posologie/Mode d’emploi
Avant l'implantation ou le retrait de l'implant, il faut lire soigneusement et suivre les instructions de la rubrique «Remarques particulières/Remarques concernant la manipulation/Mise en place d'Implanon NXT ou Retrait d'Implanon NXT». L'implantation comme le retrait d'Implanon NXT doivent toujours être effectués par un médecin familiarisé avec la technique d'implantation et de retrait d'Implanon NXT et dans le strict respect des techniques d'asepsie habituelles.
N'essayez pas d'effectuer l'intervention si vous n'êtes pas certain des étapes nécessaires à l'implantation et au retrait en toute sécurité de l'implant.
Important: avant l'utilisation d'Implanon NXT, une grossesse doit être exclue.
Implanon NXT est un contraceptif hormonal d'effet prolongé. L'implant est inséré par voie sous-cutanée à l'aide d'un applicateur. Il faut informer l'utilisatrice que l'implant peut lui être retiré à tout moment si elle le souhaite. Il faut systématiquement retirer Implanon NXT au plus tard au bout de 3 ans, car une efficacité contraceptive suffisante n'est pas prouvée lors d'utilisation prolongée. Chez les femmes de poids corporel important, le remplacement de l'implant devrait toutefois être envisagé avant ce délai (voir «Mises en garde et précautions»).
Si, après le retrait, on remplace Implanon NXT immédiatement par un nouvel implant, la protection contraceptive n'est pas interrompue. Si l'utilisatrice ne souhaite plus employer Implanon NXT, mais n'envisage pas d'être enceinte, il faut lui recommander une autre méthode de contraception.
Si les recommandations concernant le moment de l'implantation indiquées ci-après sont respectées, aucune mesure contraceptive supplémentaire n'est nécessaire. Si, au contraire, l'implantation a lieu à une date postérieure à ce qui est indiqué dans les recommandations correspondantes (voir ci-dessous), il faut demander à l'utilisatrice d'utiliser un contraceptif barrière supplémentaire durant les 7 premiers jours après insertion de l'implant. Si un rapport sexuel a déjà eu lieu, une grossesse doit être exclue avant l'insertion d'Implanon NXT.
Moment de l'implantation
- Pas d'utilisation antérieure de contraceptifs hormonaux (au cours du mois écoulé): L'implantation d'Implanon NXT devrait être effectuée entre le jour 1 et le jour 5 du cycle naturel de la femme (même si les saignements continuent), le jour 1 étant le premier jour de ses règles.
- Remplacement d'un contraceptif hormonal combiné (contraceptif oral combiné (COC), anneau vaginal ou dispositif transdermique): Implanon NXT devrait être implanté de préférence le lendemain de la prise du dernier comprimé actif du COC précédent ou le jour du retrait de l'anneau vaginal ou du dispositif transdermique, et en tout cas au plus tard le lendemain de la période habituellement sans prise de comprimé, sans anneau ou sans dispositif transdermique ou de la phase sous placebo.
- Remplacement d'une préparation uniquement progestative (pilule progestative, produit injectable, implant) ou d'un dispositif intra-utérin (DIU) libérant une hormone:
Pilule progestative: l'implantation d'Implanon NXT peut avoir lieu à n'importe quel jour du mois. L'implant devrait être mis en place dans les 24 heures suivant la prise du dernier comprimé.
Contraceptif injectable: l'implant devrait être mis en place à la date qui était prévue pour l'injection suivante.
Implant ou DIU: Implanon NXT doit être mis en place le jour du retrait de l'implant ou du DIU utilisé jusque-là. - Après un avortement survenu pendant le premier trimestre de la grossesse:
Implanon NXT devrait être implanté dans les 5 jours. En cas d'implantation plus tardive, une méthode de contraception barrière supplémentaire doit être utilisée durant les 7 premiers jours. - Après un accouchement ou après un avortement survenu pendant le deuxième trimestre de la grossesse:
- Implanon NXT devrait être implanté 21 à 28 jours après l'accouchement ou après l'avortement survenu pendant le deuxième trimestre de la grossesse. Si l'implantation est effectuée à une date ultérieure, il faut demander à la femme d'utiliser une méthode de contraception barrière supplémentaire pendant les 7 jours suivant l'implantation. S'il y a déjà eu un rapport sexuel, il faut exclure une grossesse avant l'implantation ou bien attendre les premières règles spontanées de la femme pour effectuer l'implantation. Pour les femmes qui allaitent, voir la rubrique «Grossesse, Allaitement».
Instructions posologiques particulières
Patientes présentant des troubles de la fonction hépatique
Implanon NXT ne doit pas être utilisé par les femmes souffrant d'insuffisance hépatique.
Patientes présentant des troubles de la fonction rénale
Implanon NXT n'a pas été étudié chez des femmes souffrant d'insuffisance rénale et il est impossible de formuler des recommandations posologiques.
Enfants et adolescentes:
L'efficacité et la sécurité d'Implanon NXT ont été étudiées chez des femmes adultes. Si Implanon NXT est indiqué chez des adolescentes, la posologie recommandée est la même que chez l'adulte.
Patientes âgées
Il n'y a pas d'indication après la ménopause.
Contre-indications
Les contraceptifs contenant des progestatifs ne doivent pas être utilisés dans les situations suivantes:
- maladies thromboemboliques veineuses ou artérielles aiguës (p.ex. thrombose veineuse profonde, embolie pulmonaire, infarctus du myocarde, AVC);
- présence confirmée ou suspectée de tumeurs sensibles aux hormones sexuelles;
- hémorragies vaginales d'origine indéterminée;
- maladie hépatique grave, présente ou passée, tant que subsistent des paramètres anormaux de la fonction hépatique;
- tumeurs hépatiques bénignes ou malignes, présentes ou passées;
- grossesse confirmée ou suspectée;
- hypersensibilité à l'un des composants d'Implanon NXT.
Si l'une de ces situations ou maladies survient pour la première fois après l'implantation d'Implanon NXT, il faut immédiatement retirer l'implant.
Mises en garde et précautions
Avant d'utiliser Implanon NXT, il faut s'assurer que la femme n'est pas enceinte.
Avant l'utilisation du premier implant Implanon NXT ou des implants suivants, les antécédents médicaux complets (y compris les antécédents familiaux) et un examen gynécologique et général comportant une mesure de la pression artérielle devraient être pratiqués, en tenant tout particulièrement compte des contre-indications et des précautions. L'utilisatrice devrait être également instruite de lire attentivement la notice et de respecter les conseils qu'elle contient.
Avant l'utilisation, le médecin doit discuter avec l'utilisatrice des avantages et inconvénients d'Implanon NXT comparativement à d'autres méthodes contraceptives.
Il faut signaler à l'utilisatrice le fait qu'Implanon NXT ne protège ni contre une infection par le VIH (sida), ni contre les autres maladies sexuellement transmissibles. Trois mois après l'implantation d'Implanon NXT, il faut pratiquer un premier examen de contrôle comprenant une mesure de la pression artérielle et interroger l'utilisatrice sur les effets indésirables ou troubles éventuellement survenus. Pour fixer la fréquence et la nature des examens de contrôle réguliers suivants, le médecin doit tenir compte de la situation individuelle et médicale.
Situations dans lesquelles il faut immédiatement retirer Implanon NXT
Il faut immédiatement retirer Implanon NXT quand il existe l'une des contre-indications susmentionnées et dans les situations suivantes:
- survenue d'un ictère, d'une hépatite ou d'un prurit généralisé,
- apparition pour la première fois ou augmentation de la fréquence ou de l'intensité de maux de tête de type migraineux ou de maux de tête inhabituellement intenses,
- signes d'une maladie thromboembolique (y compris infarctus du myocarde ou AVC),
- troubles aigus de la vision, de l'ouïe ou de la parole ou autres déficits sensoriels ou symptômes évoquant une ischémie cérébrale,
- augmentation importante de la pression artérielle,
- immobilisation prolongée (p.ex. après des accidents ou des interventions chirurgicales majeures),
- états dépressifs graves,
- accroissement de crises d'épilepsie,
- croissance objectivée de tumeurs préexistantes, induite par le traitement.
En présence de l'une des situations décrites ci-après, il faut mettre en balance, au cas par cas, le bénéfice de l'emploi d'un contraceptif hormonal et les risques possibles et en discuter avec la femme, avant qu'elle ne prenne sa décision quant à l'utilisation d'Implanon NXT. Il faut lui demander de consulter son médecin si l'un des phénomènes mentionnés ci-après apparaît pour la première fois ou s'aggrave. Le médecin devrait alors déterminer s'il convient ou non de poursuivre l'utilisation d'Implanon NXT.
Événements thrombotiques
Implanon NXT devrait être utilisé avec prudence chez les femmes qui ont des antécédents de thrombophlébite ou de maladies thromboemboliques. Des études épidémiologiques montrent une augmentation du risque de maladies thromboemboliques veineuses et artérielles (p.ex. thrombose veineuse profonde, embolie pulmonaire, infarctus du myocarde ou accident vasculaire cérébral) en cas d'utilisation de contraceptifs hormonaux combinés (CHC).
Les fumeuses utilisant un CHC présentent un risque accru de thromboembolies artérielles et veineuses. Ce risque augmente avec l'âge et avec la consommation de cigarettes. Les femmes à partir de 35 ans ne doivent donc pas fumer si elles utilisent une contraception hormonale. De même, une obésité (IMC >30 kg/m2) et des antécédents familiaux positifs entraînent un risque accru de complications thromboemboliques.
On ignore la signification clinique de ces résultats d'étude pour l'étonogestrel utilisé seul à titre contraceptif, sans association avec un estrogène. Après la commercialisation, on a rapporté chez des femmes porteuses d'implants à l'étonogestrel des cas sévères de complications thromboemboliques veineuses et artérielles, dont des thromboses veineuses profondes, des embolies pulmonaires (parfois létales), des infarctus du myocarde et des accidents vasculaires cérébraux.
À l'apparition de symptômes éventuels d'une complication thromboembolique, les mesures correspondantes de diagnostic et de traitement doivent être instaurées.
Les premiers signes d'une complication thromboembolique veineuse peuvent être de fortes douleurs ou le gonflement d'une jambe, des douleurs lancinantes inhabituelles et inexpliquées en respirant ou en toussant, un souffle court, des douleurs thoraciques ou une sensation d'oppression thoracique.
Les premiers signes d'une complication thromboembolique artérielle peuvent être l'apparition soudaine de fortes douleurs thoraciques irradiant éventuellement dans le bras (gauche), une soudaine détresse respiratoire, une extrême sensation de faiblesse, une première survenue de migraine ou toute autre survenue inhabituelle de maux de tête sévères et prolongés, un soudain engourdissement ou manque de force au niveau du visage, d'un bras ou d'une jambe (surtout dans une moitié du corps), des troubles moteurs, une perte soudaine, partielle ou totale, de la vision, une diplopie, un langage inarticulé ou une aphasie, des vertiges, une perte de conscience avec ou sans crise de convulsions focales, une nette augmentation de la pression artérielle.
Dans le cas d'une thrombose confirmée, l'implant doit être retiré et une méthode de contraception non hormonale être envisagée à la place. De même, en cas d'immobilisation prolongée, motivée par une opération ou une maladie, il faut retirer l'implant et respecter un délai d'au moins 2 semaines après la mobilisation complète de la patiente avant de réinstaurer une contraception hormonale. Les femmes qui ont des antécédents de maladies thromboemboliques doivent être informées du risque éventuellement accru de récidive de celles-ci.
Pour l'évaluation du rapport bénéfices-risques vasculaires, il faut songer qu'un traitement approprié de maladies préexistantes permet de réduire le risque de thromboses qui leur est associé et qu'une grossesse s'accompagne d'un risque plus élevé que l'utilisation d'Implanon NXT.
Cancers
Le risque de carcinome mammaire augmente avec l'âge. Pendant l'utilisation de contraceptifs hormonaux (combinés) (CHC), le risque de diagnostic d'un carcinome mammaire est légèrement augmenté, mais il diminue continuellement au cours des 10 ans suivant l'arrêt de l'utilisation de ces produits. Ce risque ne dépend pas de la durée d'utilisation, mais de l'âge de l'utilisatrice. Le nombre attendu de cas de carcinome mammaire diagnostiqués pour 10 000 femmes qui utilisent des CHC (jusqu'à 10 ans après l'arrêt de l'utilisation), comparé au nombre de cas chez les femmes qui n'ont jamais utilisé de CHC pendant la même période, a été calculé dans les diverses tranches d'âge. Le tableau ci-dessous indique les résultats:
Tranche d'âge | Cas attendus chez les utilisatrices de CHC | Cas attendus chez les non-utilisatrices | ||
16-19 ans | 4,5 | 4 | ||
20-24 ans | 17,5 | 16 | ||
25-29 ans | 48,7 | 44 | ||
30-34 ans | 110 | 100 | ||
35-39 ans | 180 | 160 | ||
40-44 ans | 260 | 230 | ||
Le risque pour les femmes utilisant des produits contenant uniquement un progestatif est probablement comparable au risque pour les utilisatrices de CHC. Les données disponibles concernant les produits contenant uniquement un progestatif sont toutefois insuffisantes pour que l'on puisse fournir des estimations chiffrées à ce propos. Les carcinomes mammaires avaient tendance à être moins évolués au moment du diagnostic chez les femmes qui utilisaient un CHC que chez les femmes qui n'avaient jamais utilisé de CHC. L'augmentation du risque chez les utilisatrices de CHC pourrait s'expliquer par un diagnostic précoce, par des effets biologiques des CHC ou par une combinaison des deux facteurs. Tant qu'un effet biologique ne peut pas être exclu, une analyse du rapport bénéfice/risque individuelle devrait être effectuée chez les femmes qui ont des antécédents de carcinome mammaire ou chez lesquelles un tel carcinome est diagnostiqué pendant l'utilisation d'Implanon NXT.
Après l'utilisation de principes actifs hormonaux tels que celui qui est contenu dans Implanon NXT, on a observé, dans de rares cas, des tumeurs hépatiques bénignes et, plus rarement encore, des tumeurs malignes qui ont, exceptionnellement, provoqué des hémorragies intra-abdominales mettant la vie de la patiente en danger. En conséquence, s'il apparaît de vives douleurs dans le haut de l'abdomen, une augmentation du volume du foie ou des signes d'hémorragie intra-abdominale, la possibilité d'une tumeur du foie devrait être envisagée lors du diagnostic différentiel.
Défaut de localisation de l'implant/rupture de l'implant/rejet de l'implant:
Des cas d'expulsion de l'implant ou de migration dans le bras à distance du point d'insertion ont été rapportés. Ils peuvent être liés à une insertion profonde (voir aussi «Remarques particulières», paragraphe Mise en place d'Implanon NXT) ou à une action externe (p.ex. manipulation au niveau de l'implant ou sports de contact). L'implant a migré dans le bras de la patiente dans la plupart des cas rapportés, mais il est parvenu jusqu'à la paroi thoracique dans de rares cas. De rares cas de migration de l'implant dans les vaisseaux sanguins du bras, voire dans l'artère pulmonaire, ont été rapportés depuis la mise sur le marché.
Dans les quelques cas où l'implant a été retrouvé dans l'artère pulmonaire, des douleurs thoraciques et/ou des symptômes respiratoires (tels que toux, dyspnée ou hémoptysies) ont été rapportés; d'autres cas sont cependant restés asymptomatiques.
Si l'implant a migré dans le bras à partir de son point d'insertion, il peut être plus difficile à localiser et son retrait peut nécessiter un geste chirurgical (éventuellement au bloc opératoire; voir aussi «Remarques particulières», paragraphe Retrait d'Implanon NXT). Une localisation intravasculaire de l'implant nécessite une intervention endovasculaire ou chirurgicale pour le retrait.
Si, à un moment quelconque, l'implant n'est plus palpable, il devrait être localisé et il est conseillé de le retirer rapidement. Si l'implant n'est pas retiré, la contraception et le risque d'effets indésirables d'origine progestative peuvent persister plus longtemps que ne le souhaite la patiente.
Des cas d'implants cassés ou pliés dans le bras de patientes ont été rapportés. Selon les données in vitro, une telle détérioration de l'implant peut entraîner une légère augmentation du taux de libération d'étonogestrel, sans toutefois que des répercussions cliniques significatives soient à craindre. Lors du retrait d'un implant cassé, il importe de vérifier que tous les fragments ont été extraits (voir «Remarques particulières», paragraphe Retrait d'Implanon NXT).
Un rejet de l'implant est possible, surtout quand l'implantation n'a pas été effectuée selon les instructions («Remarques particulières», paragraphe Mise en place d'Implanon NXT) ou en raison d'une inflammation locale.
Développement d'un follicule/risque de grossesse extra-utérine:
Comme avec tous les contraceptifs hormonaux faiblement dosés, un follicule peut se développer et parfois devenir plus gros que lors d'un cycle normal. En général, ces follicules hypertrophiques disparaissent spontanément. Ils sont souvent asymptomatiques, mais s'accompagnent parfois de légères douleurs abdominales et exigent rarement une intervention chirurgicale.
Le risque de grossesse ectopique est plus élevé avec les produits classiques contenant uniquement un progestatif qu'avec les CHC, phénomène qui a été mis en rapport avec les ovulations fréquentes et le ralentissement du péristaltisme tubaire lors de l'utilisation de progestatifs purs. Même si Implanon NXT inhibe presque totalement l'ovulation, il faut toujours évoquer l'éventualité d'une grossesse ectopique lors du diagnostic différentiel quand une femme se plaint d'une aménorrhée ou de douleurs pelviennes persistantes pendant l'utilisation d'Implanon NXT.
Troubles dépressifs
Les dépressions et humeurs dépressives sont connues comme étant des effets indésirables potentiels lors de l'utilisation d'hormones sexuelles, y compris de contraceptifs hormonaux (voir aussi la rubrique «Effets indésirables»). De tels troubles peuvent survenir peu de temps après le début du traitement. Une dépression peut être grave et représente un facteur de risque de suicide ou de comportement suicidaire. Les utilisatrices de contraceptifs hormonaux doivent donc être informées des symptômes possibles de troubles dépressifs. Il faut impérativement conseiller à l'utilisatrice de s'adresser immédiatement à un médecin si elle remarque des fluctuations d'humeur ou d'autres symptômes de dépression lorsqu'elle utilise un contraceptif. Les utilisatrices ayant des antécédents de dépression sévère doivent être surveillées attentivement. En cas de réapparition d'états dépressifs graves au cours de l'utilisation de Implanon NXT, le traitement doit être interrompu.
Changements du profil de saignements:
Pendant l'utilisation d'Implanon NXT, on peut noter des changements du profil de saignements. Une augmentation de la fréquence ou de la durée des saignements est observée chez 1 femme sur 5 environ. D'autres femmes n'ont qu'occasionnellement ou plus du tout de saignements (dans le cadre des études, le taux d'aménorrhée si situait autour de 20%). Le profil individuel de saignements au cours des trois premiers mois de traitement est généralement prédictif de l'évolution de la menstruation par la suite avec Implanon NXT. Le médecin peut améliorer l'acceptabilité de la modification du profil de saignements en informant les patientes, en les conseillant et en leur recommandant d'utiliser un calendrier de saignement. L'évaluation des saignements vaginaux devrait être effectuée sur une base ad hoc et en même temps inclure des examens permettant d'exclure l'éventualité de maladies gynécologiques ou d'une grossesse.
Autres précautions:
- Le traitement par des progestatifs peut induire une rétention liquidienne et une prise de poids. Il faut soigneusement surveiller les patientes atteintes de maladies préexistantes qui risqueraient de s'aggraver de ce fait (p.ex. asthme, migraine, troubles de la fonction cardiaque ou rénale, épilepsie).
- Il peut être nécessaire de retirer l'implant s'il apparaît des perturbations aiguës ou chroniques de la fonction hépatique. C'est pourquoi l'utilisatrice devrait être adressée à un spécialiste.
- L'utilisation d'Implanon NXT devrait être interrompue si la pression artérielle est en permanence augmentée ou en cas d'hypertension importante, réfractaire au traitement antihypertenseur.
- Quand des femmes diabétiques commencent à utiliser Implanon NXT, elles devraient être surveillées attentivement, car il semble qu'Implanon NXT influence la tolérance au glucose.
- Certains progestatifs peuvent élever le taux de LDL et rendre plus difficile le contrôle d'une hyperlipidémie. Les femmes présentant une hyperlipidémie préexistante devraient donc être surveillées attentivement.
- Les maladies suivantes ont été observées aussi bien pendant la grossesse que pendant l'utilisation de stéroïdes sexuels, sans que la relation avec l'utilisation de progestatifs soit formellement établie: ictère et/ou prurit associé à une cholestase, cholélithiase; porphyrie; lupus érythémateux disséminé; syndrome hémolytique et urémique; chorée de Sydenham; herpès gestationnel; perte de l'audition due à une otospongiose, induction ou aggravation d'un angio-œdème.
- On peut parfois observer un chloasma, surtout chez les femmes qui ont des antécédents de chloasma pendant la grossesse. Pendant l'utilisation d'Implanon NXT, les femmes sujettes au chloasma devraient éviter de s'exposer à la lumière du soleil et à tout autre rayonnement ultraviolet.
- L'effet contraceptif d'Implanon NXT dépend de la concentration plasmatique d'étonogestrel, laquelle est inversement proportionnelle au poids corporel et diminue au fil du temps. L'expérience clinique acquise chez des femmes de poids corporel important (plus de 80 kilos) est limitée. Il n'est pas exclu que la fiabilité contraceptive soit diminuée chez ces femmes pendant la troisième année d'utilisation.
Interactions
Note: Les informations professionnelles des médicaments utilisés simultanément devraient être consultées afin d'exclure des interactions éventuelles.
Effet d'autres médicaments sur la pharmacocinétique d'Implanon NXT
La littérature décrit les interactions suivantes (essentiellement avec des contraceptifs hormonaux combinés mais aussi, très rarement, avec des contraceptifs purement progestatifs):
Inducteurs enzymatiques
Les interactions entre les contraceptifs hormonaux et les médicaments induisant les enzymes microsomales (notamment les enzymes du cytochrome P450) et pouvant donc conduire à une augmentation de la clairance des hormones sexuelles, peuvent entraîner une diminution de l'effet contraceptif d'Implanon NXT et des troubles hémorragiques. Ceci vaut par exemple pour les barbituriques, le bosentan, la carbamazépine, le felbamate, le modafinil, l'oxcarbazépine, la phénytoïne, la primidone, la rifabutine, la rifampicine, le topiramate ainsi que pour les médicaments contenant du millepertuis (Hypericum perforatum).
Une induction enzymatique peut se produire déjà après quelques jours de traitement. L'induction enzymatique maximale est en général observée après 2 à 3 semaines et peut persister pendant au moins 4 semaines ou plus après l'arrêt de ces médicaments.
Les femmes traitées pendant une courte durée par un de ces médicaments, devraient être averties que l'efficacité d'Implanon NXT peut être réduite. S'il est décidé de poursuivre la contraception avec Implanon NXT, l'utilisatrice devrait être invitée à utiliser temporairement une méthode de contraception non hormonale supplémentaire. La méthode barrière devrait être utilisée pendant l'utilisation concomitante des médicaments et encore pendant 28 jours après l'arrêt du traitement.
En cas de traitement de longue durée par des médicaments qui entraînent une induction enzymatique hépatique, des méthodes contraceptives alternatives (non hormonales) devraient être utilisées.
On sait en outre que divers inhibiteurs des protéases du VIH/VHC (p.ex. nelfinavir, bocéprévir, télaprévir) et de la transcriptase inverse non nucléosidique (p.ex. éfavirenz, névirapine) ainsi que leurs combinaisons peuvent entraîner une baisse ou une élévation des concentrations plasmatiques des progestatifs. Ces changements peuvent avoir un effet clinique dans quelques cas. Par exemple, une étude publiée sur le traitement par de l'éfavirenz de patientes positives au VIH comparées à des femmes sans traitement antirétroviral a mis en évidence une Cmax de l'étonogestrel plus basse de 54% et une AUC diminuée de 63%.
Les inhibiteurs de protéase tels que le ritonavir ou le nelfinavir (y compris leurs combinaisons) sont des inhibiteurs puissants du CYP3A4 notoires, mais ils peuvent avoir un effet inducteur enzymatique s'ils sont co-administrés avec des hormones stéroïdiennes et peuvent ainsi réduire le taux plasmatique de progestatifs.
Inhibiteurs enzymatiques
Les inhibiteurs puissants et modérés du CYP3A comme les antifongiques azolés (itraconazole, voriconazole, posaconazole, fluconazole), les macrolides (clarithromycine, érythromycine), le diltiazem, le vérapamil et le jus de pamplemousse peuvent augmenter les taux plasmatiques des progestatifs comme l'étonogestrel et entraîner des effets indésirables plus nombreux.
Effet des contraceptifs hormonaux sur la pharmacocinétique d'autres médicaments
Les contraceptifs hormonaux peuvent, par différents mécanismes d'interaction, influer également sur la pharmacocinétique de certains autres médicaments. Ils peuvent inhiber les enzymes hépatiques microsomaux ou induire la conjugaison hépatique, en particulier la glucuroconjugaison. Les concentrations plasmatiques et tissulaires d'autres médicaments peuvent par conséquent être soit augmentées (p.ex. la ciclosporine) soit diminuées (p.ex. la lamotrigine, voir ci-dessous). Par ailleurs, l'effet pharmacologique des groupes médicamenteux suivants peut également être influencé: analgésiques, antidépresseurs, antidiabétiques, antimalariques, certaines benzodiazépines, certains bêtabloquants, corticostéroïdes, anticoagulants oraux et théophylline. C'est pourquoi, en cas d'utilisation de tels médicaments, il faut étroitement surveiller la patiente. Cependant, les modifications des taux plasmatiques résultant de ces interactions ne sont pas toujours cliniquement pertinentes.
Une étude d'interactions avec la lamotrigine, un anti-épileptique, et un contraceptif oral combiné (30 μg d'éthinylestradiol/150 μg de lévonorgestrel) a mis en évidence une augmentation cliniquement significative de la clairance de la lamotrigine avec une diminution significative des taux plasmatiques de lamotrigine lors de l'administration simultanée de ces médicaments. Une telle diminution des concentrations plasmatiques peut se manifester par un moins bon contrôle des crises épileptiques. On ne sait pas dans quelle mesure ces résultats peuvent être appliqués à une préparation uniquement progestative sous-cutanée comme Implanon NXT.
Grossesse/Allaitement
Grossesse
Ce médicament est contre-indiqué chez les femmes enceintes. Avant de commencer à l'utiliser, il faut donc s'assurer que la femme n'est pas enceinte. Si une grossesse débute ou est suspectée, il faut immédiatement retirer Implanon NXT. Des expérimentations animales ont montré que les doses très fortes de produits contenant des progestatifs exerçaient un effet virilisant sur les fœtus de sexe féminin (voir «Données précliniques»). Des études épidémiologiques de grande ampleur n'ont indiqué ni augmentation du risque d'anomalie à la naissance chez les enfants dont la mère avait utilisé des CHC avant la grossesse, ni effets tératogènes dans les cas où des femmes, ignorant qu'elles étaient enceintes, avaient utilisé des contraceptifs purement progestatifs. Bien que cela vaille sans doute pour tous les CHC, on ignore s'il en va de même pour Implanon NXT.
Les données de la pharmacovigilance concernant divers contraceptifs combinés contenant de l'étonogestrel ou du désogestrel (l'étonogestrel est un métabolite du désogestrel) n'ont pas non plus montré d'augmentation du risque.
Allaitement
Comme d'autres produits contraceptifs contenant uniquement un progestatif, Implanon NXT n'a pas d'effet défavorable sur la quantité et la qualité (protéines, lactose ou concentrations de lipides) du lait maternel. Toutefois, de petites quantités d'étonogestrel sont sécrétées dans ce dernier. Sur la base d'une absorption moyenne de lait de 150 ml/kg par jour, la quantité moyenne d'étonogestrel absorbée par le nouveau-né – après un mois de libération d'étonogestrel – est d'environ 27 ng/kg par jour, ce qui représente à peu près 0,2% de la dose quotidienne absolue absorbée par la mère (2,2% quand le calcul est effectué par kilo de poids). Le taux d'étonogestrel dans le lait maternel diminue avec le temps. Il existe des données recueillies à long terme auprès de 38 enfants dont la mère avait reçu un implant entre la quatrième et la huitième semaine après la naissance. Ces enfants ont été allaités pendant une durée moyenne de 14 mois et suivis pendant 36 mois. Leur croissance et leur développement physique et psychique ont été observés et comparés à ceux de nourrissons dont la mère avait utilisé un DIU (n=33). Cette étude n'a pas montré de différence entre les deux groupes. Néanmoins, le développement et la croissance de l'enfant devraient être soigneusement surveillés. À la lumière des données disponibles, Implanon NXT peut être utilisé pendant l'allaitement, mais il faut respecter un délai d'au moins 4 semaines entre l'accouchement et l'implantation.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Étant donné le profil pharmacodynamique d'Implanon NXT, on suppose que ce produit n'a aucune influence ou une influence négligeable sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirables
Les effets indésirables les plus graves en rapport avec la prise de contraceptives hormonaux sont décrits dans la rubrique «Mises en garde et précautions».
Les effets indésirables observés lors de l'utilisation d'Implanon NXT pendant les études cliniques et/ou au cours de la surveillance post-commercialisation sont énumérés ci-dessous par systèmes d'organes et fréquence. Les effets indésirables les plus fréquents ont été les suivants: maux de tête, acné, vaginite, prise de poids, sensation de tension mammaire, douleurs mammaires ainsi qu'irrégularités des saignements. Dans le cadre des études cliniques, les modifications des saignements étaient la raison la plus fréquente d'arrêt du traitement (environ 11%).
L'implantation ou le retrait de l'implant peuvent causer des ecchymoses, un prurit, une légère irritation locale ou des douleurs. Des paresthésies peuvent survenir au point d'implantation. Une cicatrice, un abcès ou une fibrose peuvent aussi se former.
Des cas de migration ou d'expulsion de l'implant ont été rapportés (voir «Mises en garde et précautions»).
Très fréquents (≥1/10); fréquents (≥1/100, <1/10); occasionnels (≥1/1000, <1/100); fréquence inconnue (indications principalement basées sur des signalements spontanés après la mise sur le marché, estimation exacte de la fréquence impossible).
Infections et infestations
Occasionnels: Pharyngite, rhinite, infections urinaires.
Affections du système immunitaire
Occasionnels: Réactions d'hypersensibilité.
Fréquence inconnue: Réactions anaphylactiques, angio-œdème (y compris aggravation d'un angio-œdème héréditaire).
Troubles du métabolisme et de la nutrition
Très fréquents: Prise de poids (14%).
Fréquents: Modification de l'appétit, perte de poids.
Affections psychiatriques
Fréquents: Fluctuations de l'humeur, diminution de la libido, humeur dépressive, nervosité.
Occasionnels: Anxiété, insomnie, somnolence.
Affections du système nerveux
Très fréquents: Maux de tête (25%).
Fréquents: Vertiges.
Occasionnels: Migraine.
Affections vasculaires
Fréquents: Bouffées de chaleur.
Rares: Augmentation de la pression artérielle cliniquement significative.
Affections gastro-intestinales
Fréquents: Douleurs abdominales, nausées, flatulences.
Occasionnels: Vomissements, constipation, diarrhée.
Affection de la peau et du tissu sous-cutané
Très fréquents: Acné (14%)
Fréquents: Alopécie.
Occasionnels: Hypertrichose, éruption cutanée, prurit.
Fréquence inconnue: Séborrhée, urticaire.
Affections musculosquelettiques et du tissu conjonctif
Occasionnels: Douleurs dorsales, arthralgies, myalgies et douleurs musculosquelettiques.
Affections du rein et des voies urinaires
Occasionnels: Dysurie.
Affections des organes de reproduction et du sein
Très fréquents: Changements du profil de saignements utérins, vaginite (15%), douleurs et sensibilité mammaires (13%).
Fréquents: Dysménorrhée, aménorrhée, kystes de l'ovaire.
Occasionnels: Leucorrhée, gêne vulvovaginale, galactorrhée, augmentation du volume mammaire, prurit génital.
Fréquence inconnue: Grossesse ectopique.
Troubles généraux et anomalies au site d'administration
Fréquents: Douleurs et autres réactions au site d'implantation (p.ex. érythème, gonflement, prurit, légère irritation, hématome; voir «Propriétés/Effets»), fatigue, symptômes de type grippal, douleurs.
Occasionnels: Fièvre, œdèmes.
On a rapporté par ailleurs les effets indésirables suivants en rapport avec l'utilisation d'autres contraceptifs hormonaux (voir «Mises en garde et précautions»): maladies thromboemboliques veineuses et artérielles, hypertension artérielle, tumeurs hormono-dépendantes (p.ex. tumeurs du foie ou cancer du sein) et chloasma.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Il n'y a pas d'informations concernant les effets d'un surdosage en étonogestrel.
D'une manière générale, on n'a pas encore signalé d'effets néfastes graves en cas de surdosage en contraceptifs hormonaux.
Avant de poser un nouvel implant, il faut toujours retirer l'ancien.
Propriétés/Effets
Code ATC
G03AC08
Mécanisme d'action
Implanon NXT est un implant contenant de l'étonogestrel destiné à une utilisation sous-cutanée. L'étonogestrel (= 3-cétodésogestrel) est le métabolite biologiquement actif du désogestrel, un progestatif fréquemment utilisé dans les contraceptifs oraux. Sur le plan structurel, il s'agit d'un dérivé de la 19-nortestostérone doté d'une haute affinité de liaison pour les récepteurs des progestatifs des organes cibles.
À la différence des contraceptifs purement progestatifs classiques, l'étonogestrel exerce son effet contraceptif essentiellement en inhibant l'ovulation sans bloquer totalement l'activité ovarienne. On n'a jamais observé d'ovulations pendant les deux premières années d'utilisation; pendant la troisième année, des ovulations ont été observées chez 4,3% des utilisatrices. L'étonogestrel provoque non seulement une inhibition de l'ovulation, mais aussi une diminution de l'épaisseur de l'endomètre et une augmentation de la viscosité de la glaire cervicale, ce qui empêche le passage des spermatozoïdes.
Pharmacodynamique
Aucune information.
Efficacité clinique
Dans les études cliniques réalisées auprès de femmes âgées de 18 à 40 ans avec une exposition de 36'555 cycles au total, aucune grossesse n'a été observée. En revanche, il existe des rapports de grossesses non désirées dans le cadre de la surveillance post-commercialisation. Bien qu'il n'y ait pas eu de comparaison directe, il semble que l'effet contraceptif d'Implanon NXT soit au moins comparable à celui des contraceptifs oraux combinés.
Cette grande fiabilité contraceptive tient entre autres au fait que l'effet contraceptif d'Implanon NXT ne dépend pas de la bonne observance d'un schéma de traitement par l'utilisatrice.
L'effet contraceptif de l'étonogestrel est réversible, ce qui se traduit par une normalisation rapide du cycle menstruel (généralement en l'espace d'un mois) après le retrait de l'implant.
Sécurité clinique
Lors d'une étude clinique dans laquelle les médecins investigateurs devaient évaluer le site d'implantation après la mise en place d'Implanon NXT, des réactions au site d'implantation ont été décrites chez 8,6% des femmes. Parmi ces réactions, la plus fréquente était l'érythème apparaissant sur le site d'implantation pendant ou peu de temps après l'insertion chez 3,3% des femmes. Des hématomes (3,0%), des ecchymoses (2,0%), des douleurs (1,0%) et des gonflements (0,7%) ont également été rapportés.
L'effet de l'étonogestrel sur la densité osseuse (n=44) a été comparé à celui d'un DIU non hormonal (n=29) pendant deux ans. Aucun effet indésirable sur la densité osseuse n'a été observé. On n'a pas constaté d'effets cliniquement notables sur le métabolisme lipidique.
Les contraceptifs contenant des progestatifs peuvent avoir un effet néfaste sur la résistance à l'insuline et sur la tolérance au glucose (voir «Mises en garde et précautions»). Les études cliniques ont par ailleurs montré que les symptômes de dysménorrhée étaient souvent atténués chez les femmes utilisant Implanon NXT.
Pharmacocinétique
Absorption
Après l'insertion de l'implant, l'étonogestrel est rapidement absorbé. Des concentrations plasmatiques inhibant l'ovulation sont atteintes en l'espace d'un jour. La biodisponibilité absolue de l'étonogestrel est d'environ 95%. Les concentrations plasmatiques maximales (qui sont comprises entre 472 et 1270 pg/ml) sont atteintes en l'espace de 1 à 13 jours.
La libération du principe actif à partir de l'implant diminue au fil du temps. Pendant les semaines 5 et 6, elle est d'environ 60-70 µg d'étonogestrel par jour; elle diminue ensuite à environ 35-45 µg à la fin de la première année, puis à environ 30-40 µg à la fin de la deuxième année et enfin à environ 25-30 µg d'étonogestrel par jour à la fin de la troisième année.
C'est pourquoi les concentrations plasmatiques diminuent rapidement pendant les premiers mois. À la fin de la première année, la concentration moyenne est d'environ 200 pg/ml (150-261 pg/ml); elle diminue lentement à 156 pg/ml (111-202 pg/ml) à la fin de la troisième année. Les concentrations plasmatiques d'étonogestrel dépendent du poids. La variabilité observée peut donc être imputée, au moins en partie, à des différences de poids corporel.
Distribution
L'étonogestrel est lié aux protéines plasmatiques à hauteur de 95,5-99%, cette liaison se faisant essentiellement à l'albumine mais aussi, dans une moindre mesure, à la SHBG. Le volume de distribution est d'environ 220 l. Chez les femmes qui allaitent, le rapport concentration d'étonogestrel dans le lait/concentration sérique est de 0,44-0,50 (voir «Grossesse, Allaitement»).
Métabolisme
L'étonogestrel est hydroxylé par le système des enzymes microsomiales hépatiques, puis réduit et conjugué en sulfates et glucuronides. L'hydroxylation est catalysée par l'isoenzyme CYP3A4.
Élimination
Après l'administration intraveineuse d'étonogestrel, la demi-vie d'élimination est en moyenne d'environ 25 heures. La clairance plasmatique est d'environ 7,5 l/heure. Ces deux paramètres restent constants pendant les 3 ans d'utilisation d'Implanon NXT.
L'excrétion de l'étonogestrel et de ses métabolites, sous forme de stéroïdes libres ou de conjugués, se fait dans les urines et dans les selles (dans la proportion de 1,5:1).
Cinétique pour certains groupes de patientes
Il n'existe pas de données concernant la pharmacocinétique chez les femmes souffrant d'insuffisance hépatique ou rénale.
Données précliniques
Les études précliniques menées avec l'étonogestrel sur la toxicité en administration répétée, la génotoxicité et le potentiel cancérogène n'ont pas révélé clairement de risque particulier pour l'être humain. Dans les expérimentations animales, des substances de type progestatif ont eu un effet embryolétal et, à fortes doses, un effet virilisant sur les fœtus femelles. Les études visant à évaluer la toxicité de l'étonogestrel sur la reproduction chez le rat et le lapin n'ont montré aucun signe d'effet tératogène.
Remarques particulières
Influence sur les méthodes de diagnostic
Des rapports concernant les CHC ont montré que les stéroïdes contraceptifs pouvaient modifier les résultats de certains examens de laboratoire, notamment: paramètres biochimiques de la fonction hépatique, thyroïdienne, surrénalienne et rénale, taux plasmatiques de protéines (de transport) (par exemple globuline fixant les corticoïdes) et lipides/fractions des lipoprotéines, paramètres du métabolisme glucidique et paramètres de la coagulation et de la fibrinolyse. En général, ces modifications restent comprises dans la fourchette de la normale. On ignore si les produits contenant uniquement un progestatif induisent aussi ces modifications.
Conservation
Ce médicament ne doit pas être implanté au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver à 2-30 °C dans l'emballage original.
Tenir hors de la portée des enfants.
Remarques concernant la manipulation
L'implantation comme le retrait ou le remplacement d'Implanon NXT doivent être effectués uniquement par un médecin familiarisé avec ces techniques. L'intervention doit avoir lieu dans des conditions d'asepsie et au moyen de l'applicateur fourni. Celui-ci contient l'implant dans une aiguille.
Les médecins qui n'ont encore jamais implanté Implanon NXT doivent d'abord suivre une formation organisée par le distributeur. Les médecins qui n'ont que peu d'expérience de l'implantation sous-cutanée doivent apprendre la technique nécessaire sous la direction d'un confrère expérimenté.
Le succès de la mise en place et du retrait d'Implanon NXT repose sur une insertion sous-cutanée de l'implant, effectuée correctement et avec précaution, conformément aux instructions figurant ci-dessous.
En cas de question ou de doute ainsi que de difficultés lors de l'implantation, de la localisation ou du retrait de l'implant, veuillez-vous adresser à la filiale locale du titulaire de l'autorisation. Ceci s'applique en particulier si vous n'êtes pas (encore) familiarisé avec la technique.
On a signalé quelques cas dans lesquels Implanon NXT n'avait pas été implanté au moment opportun (le bon jour), n'avait pas été correctement implanté ou ne l'avait pas été du tout, ce qui a provoqué, entre autres, des grossesses non désirées. On peut minimiser le risque de tels incidents en respectant strictement les instructions ci-dessous de Mise en place d'Implanon NXT ainsi que les informations sous «Posologie/Mode d'emploi», Moment de l'implantation. Immédiatement après l'implantation, aussi bien le médecin que l'utilisatrice devraient vérifier la localisation correcte de l'implant par palpation. Si l'implant n'est pas palpable ou s'il n'est pas sûr qu'il ait été inséré, suivre les instructions données ci-dessous au point Si l'implant n'est pas palpable après l'insertion.
Mise en place d'Implanon NXT
Pour garantir que l'implant est inséré directement sous la peau, le médecin devrait être positionné de manière à voir l'avancement de l'aiguille en observant l'applicateur par le côté et non par-dessus du bras. Par le côté, le point d'insertion et le mouvement de l'aiguille directement sous la peau sont clairement visibles.
L'implant devrait être inséré en sous-cutané directement sous la peau au niveau de la face interne du bras non dominant. Un implant inséré plus profondément que le plan dermique (appelé «insertion profonde» ci-après) peut ne pas être palpable et sa localisation et/ou son retrait peuvent être difficiles (voir «Mises en garde et précautions»).
Si l'implant a été placé profondément, des vaisseaux ou nerfs de la patiente peuvent être lésés. Des insertions profondes ou incorrectes ont été associées à des paresthésies (dues à des lésions nerveuses) et à des migrations de l'implant (lors d'une mise en place dans un fascia ou un muscle). Dans de rares cas, l'implant a été inséré dans un vaisseau.
Priez l'utilisatrice de s'allonger sur le dos, de plier son bras non dominant au niveau du coude et de tourner celui-ci vers l'extérieur, de façon à ce que sa main se trouve sous sa tête (ou aussi près que possible) (Fig. 1). | Fig. 1
| |
| Déterminez le site d'insertion. Il doit se situer sur la face interne du haut du bras non dominant, au niveau du triceps, environ 8 à 10 cm au-dessus de l'épicondyle médial de l'humérus et 3 à 5 cm derrière (resp. sous) le sillon entre le biceps et le triceps (Fig. 2a, 2b et 2c). Le choix de cette localisation permet d'éviter les gros vaisseaux et nerfs qui se situent à l'intérieur et autour du sillon. S'il n'est pas possible d'insérer l'implant à cet endroit (p.ex. chez les femmes ayant des bras fins), il devrait être implanté aussi loin que possible derrière le sillon. | |
Marquez deux points à l'aide d'un marqueur chirugical: d'abord le point d'insertion et ensuite un deuxième point proximal à 5 cm du premier (en direction de l'épaule) (Fig. 2a et b). La deuxième marque (dite «marque repère») indiquera par la suite la direction d'insertion. | Fig. 2a
P, proximal (en direction de l'épaule); D, distal (en direction du coude) | |
Fig. 2b
| ||
Fig. 2c
Section transversale du haut du bras gauche, vue du coude Médial (face interne du bras) Latéral (face externe du bras) | ||
Une fois que vous avez marqué le bras, assurez-vous encore une fois que le site se trouve au bon endroit sur la face interne du bras. Nettoyez la peau du site d'insertion jusqu'à la marque repère avec une solution antiseptique. Anesthésiez la zone d'insertion (par exemple avec un spray anesthésiant ou avec 2 ml d'une solution de lidocaïne à 1% directement sous la peau, le long du canal d'implantation prévu). Retirez l'applicateur stérile – qui contient l'implant dans une aiguille – de son emballage thermoformé. L'applicateur ne devrait pas être utilisé en cas de doute sur sa stérilité. | ||
Tenez l'applicateur au-dessus de l'aiguille, au niveau de la zone à surface structurée, et retirez le capuchon protecteur transparent de l'aiguille en le tirant horizontalement dans le sens de la flèche (Fig. 3). Si le capuchon ne peut pas être retiré aisément, l'applicateur ne devrait pas être utilisé. Vous devriez voir l'implant (de couleur blanche) en regardant dans la pointe de l'aiguille. Ne touchez en aucun cas la manette coulissante violette avant d'avoir entièrement placé l'aiguille en position sous-cutanée: cela provoquerait une rétraction de l'aiguille et une libération prématurée de l'implant. Si la manette coulissante violette est libérée prématurément, recommencez la procédure d'insertion avec un nouvel applicateur. | Fig. 3
| |
De votre main libre, tendez la peau autour du site d'insertion en direction du coude (Fig. 4). L'implant devrait être inséré en sous-cutané directement sous la peau (voir «Mises en garde et précautions»). Pour garantir que l'implant est inséré directement sous la peau, vous devriez vous positionner de manière à voir l'avancement de l'aiguille en observant l'applicateur par le côté et non par-dessus du bras (voir Fig. 6). | Fig. 4
| |
Avec la pointe de l'aiguille, transpercez la peau à un angle aigu de moins de 30° (Fig. 5a). | Fig. 5a
| |
| Introduisez l'aiguille jusqu'à ce que le biseau (ouverture biseautée de la pointe) se trouve juste sous la peau (et pas plus loin) (Fig. 5b). Si vous avez introduit l'aiguille au-delà du biseau, retirez-la à nouveau jusqu'à ce que seul le biseau soit encore sous la peau. | Fig. 5b
|
Amenez l'applicateur en position presque horizontale. Pour faciliter le positionnement sous-cutané, soulevez la peau avec la pointe de l'aiguille pendant que vous poussez l'aiguille sur toute sa longueur (Fig. 6). Vous sentirez éventuellement une légère résistance, mais vous ne devez pas exercer trop de force. Si l'aiguille n'a pas été introduite sur toute sa longueur, l'implant ne sera pas correctement placé. Si la pointe de l'aiguille dépasse de la peau avant l'insertion complète de l'aiguille, l'aiguille devrait être retirée et remise en position sous-cutanée avant de pouvoir achever l'insertion. | Fig. 6
| |
Maintenez l'applicateur dans cette position avec son aiguille entièrement insérée (Fig. 7). Si nécessaire, vous pouvez stabiliser l'applicateur avec votre main libre. | Fig. 7
| |
Déverrouillez maintenant la manette coulissante violette en la pressant légèrement vers le bas (Fig. 8a). Faites glisser la partie coulissante en arrière jusqu'à la butée sans toutefois bouger l'applicateur ( | Fig. 8a
| |
Fig. 8b
| ||
Fig. 8c
| ||
Si l'applicateur n'est pas maintenu dans la même position lors de cette étape ou si la manette coulissante violette n'est pas entièrement tirée en arrière jusqu'à la butée, l'implant ne sera pas inséré correctement. Si l'implant dépasse du site d'insertion, retirez l'implant et effectuez une nouvelle intervention au même site d'insertion avec un nouvel applicateur. Ne repoussez en aucun cas un implant éventuellement saillant dans l'incision. | ||
Appliquez un petit pansement adhésif sur le site d'insertion. Contrôlez toujours immédiatement par palpation la présence de l'implant dans le bras de l'utilisatrice.En palpant les deux extrémités de l'implant, espacées de 4 cm, vous devriez être en mesure de confirmer la présence du bâtonnet (Fig. 9). Voir aussi Si l'implant n'est pas palpable après l'insertion. | Fig. 9
| |
Priez l'utilisatrice de palper l'implant. Posez un bandage compressif afin de prévenir la formation d'un hématome. L'utilisatrice pourra retirer le bandage compressif au bout de 24 h et le petit pansement adhésif au bout de 3 à 5 jours. L'emballage d'Implanon NXT contient une carte d'utilisatrice indiquant le numéro du lot. Notez sur cette carte la date et la localisation (bras droit ou gauche) d'insertion d'Implanon NXT ainsi que la date prévue (au plus tard) pour le retrait de l'implant. Remettez la carte à l'utilisatrice pour qu'elle la conserve. Les étiquettes autoadhésives également contenues dans l'emballage facilitent la documentation du numéro de lot dans le dossier de la patiente. L'applicateur est destiné à un usage unique et doit être éliminé ensuite correctement en accord avec les réglementations applicables. | ||
Si l'implant n'est pas palpable après l'insertion: Si l'implant n'est pas palpable ou si vous avez des doutes quant à sa présence, il est possible qu'il n'ait pas été inséré ou qu'il l'ait été (trop) profondément:
| ||
Retrait d'Implanon NXT
Le retrait de l'implant devrait être effectué dans des conditions d'asepsie par un médecin familiarisé avec ces techniques. Une petite incision dans la peau est nécessaire pour retirer l'implant.
Avant de retirer l'implant, il convient de vérifier sa localisation exacte par palpation. Si l'implant n'est pas palpable, vérifiez à l'aide de la carte d'utilisatrice ou du dossier de la patiente dans quel bras se trouve l'implant. Si l'implant n'est pas palpable, cela signifie probablement qu'il est inséré plus profondément ou qu'il a migré. Si l'implant a migré vers l'intérieur du bras, il peut être difficile de le localiser et son retrait peut nécessiter une petite intervention chirurgicale avec une incision plus étendue, voire une opération au bloc opératoire (voir aussi ci-dessous Localisation et retrait d'un implant non palpable).
Tenez compte du fait qu'il peut se trouver à proximité de vaisseaux et de nerfs. Le retrait d'un implant non palpable devrait par conséquent être effectué exclusivement par un médecin familiarisé avec la localisation et le retrait d'implants insérés profondément ainsi qu'avec l'anatomie du bras. Si l'implant ne peut pas être palpé: voir Localisation et retrait d'un implant non palpable.
Retrait d'un implant palpable
| La patiente doit être allongée sur le dos. Son bras devrait être plié au niveau du coude et sa main positionnée sous sa tête (ou aussi près que possible) (Fig. 1). Localisez l'implant par palpation. Pressez l'extrémité de l'implant la plus proche de l'épaule (Fig. 10) vers le bas afin de le stabiliser; un renflement indiquant la pointe de l'implant la plus proche du coude devrait apparaître. Si la pointe ne se soulève pas, le retrait de l'implant peut s'avérer plus difficile et devrait être effectué exclusivement par un médecin familier du retrait d'implants insérés plus profondément. Marquez l'extrémité distale (à savoir la plus proche du coude), p.ex. avec un marqueur chirurgical. Nettoyez le site avec une solution antiseptique. | Fig. 10
P, proximal (en direction de l'épaule); D, distal (en direction du coude) | ||
Effectuez une anesthésie locale, p.ex. avec 0,5 à 1 ml de solution de lidocaïne à 1%, au site prévu pour l'incision (Fig. 11). L'anesthésique doit être injecté directement sous l'implant pour que celui-ci reste le plus près possible de la surface de la peau. Une injection de l'anesthésique local au-dessus de l'implant peut compliquer le retrait. | Fig. 11
| |||
Immobilisez l'implant pendant l'intervention en poussant son extrémité la plus proche de l'épaule vers le bas (Fig. 12). Pratiquez une incision longitudinale de 2 mm en direction du coude, parallèlement à l'implant, en partant de la pointe de l'implant la plus proche du coude. Veillez à ne pas inciser la pointe de l'implant. | Fig. 12
| |||
La pointe de l'implant doit maintenant dépasser de l'incision. Si ça n'est pas le cas, poussez doucement l'implant vers l'incision jusqu'à ce que son extrémité devienne visible. Saisissez l'implant à l'aide d'une pince et retirez-le (Fig. 13). | Fig. 13
| |||
Retirez avec précaution les éventuels tissus adhérents de la pointe de l'implant par dissection mousse. Si la pointe de l'implant ne peut être dégagée en dépit de la dissection mousse, incisez l'enveloppe tissulaire et retirez l'implant à l'aide d'une pince (Fig. 14 et 15). | Fig. 14
| |||
Fig. 15
| ||||
| Si l'implant n'est pas encore visible, introduisez une pince en surface (de préférence une pince Mosquito courbe, la pointe dirigée vers le haut) dans l'incision (Fig. 16). Saisissez prudemment l'implant, puis faites passer cette pince dans l'autre main (Fig. 17). À l'aide d'une deuxième pince, dégagez avec précaution le tissu entourant l'implant et saisissez l'implant (Fig. 18). L'implant peut alors être retiré. S'il est impossible de saisir l'implant, arrêtez l'intervention et adressez la patiente à un médecin familiarisé avec les retraits d'implants compliqués ou consultez la filiale locale du titulaire de l'autorisation. | |||
Fig. 16 | Fig. 17
| Fig. 18 | ||
Des cas d'implants cassés dans le bras des patientes ont été rapportés. Dans certains cas, une difficulté de retrait de l'implant cassé a été signalée. Assurez-vous, en mesurant sa longueur, que vous avez retiré la totalité de l'implant, d'une longueur de 4 cm. Si une partie seulement de l'implant a été retirée (c'est-à-dire si l'élément obtenu mesure moins de 4 cm), l'incision doit, le cas échéant, être agrandie pour retirer également la partie de l'implant restée sous la peau. Il peut être nécessaire d'utiliser une méthode d'imagerie pour trouver la partie restante. Après avoir retiré l'implant, appliquez un pansement adhésif stérile sur le site d'incision. Posez un bandage compressif pour prévenir la formation d'hématomes. L'utilisatrice pourra retirer le bandage compressif au bout de 24 h et le pansement au bout de 3 à 5 jours. | ||||
Localisation et retrait d'un implant non palpable
Des cas de migration de l'implant ont été rapportés occasionnellement. Il s'agissait la plupart du temps d'un petit déplacement par rapport à la position initiale (voir «Mises en garde et précautions»). Un implant inséré (trop) profondément ou qui a migré peut ne pas être palpable et il faut alors utiliser, pour le localiser, les méthodes d'imagerie citées ci-dessous.
Un implant non palpable devrait toujours être localisé avant de tenter de le retirer. Les méthodes appropriées pour la localisation englobent l'échographie avec traducteur linéaire à haute fréquence (10 MHz ou supérieure), la radiographie bidimensionnelle, la tomodensitométrie ou l'IRM. Dès que l'implant a été localisé dans le bras, il devrait être retiré si nécessaire sous contrôle échographique par un médecin familiarisé avec la localisation et le retrait d'implants insérés profondément ainsi qu'avec l'anatomie du bras.
Si l'implant est introuvable dans le bras malgré des tentatives exhaustives de localisation, un examen du thorax par imagerie devrait être envisagé, car de rares cas de migration dans les vaisseaux pulmonaires ont été rapportés. Si l'implant est retrouvé dans le thorax, une intervention chirurgicale ou endovasculaire peut être nécessaire pour le retirer. Il faut alors faire appel à un spécialiste connaissant bien l'anatomie thoracique.
Si l'implant ne peut pas être localisé par les méthodes d'imagerie citées, le taux d'étonogestrel dans le sang peut être déterminé afin de confirmer la présence de l'implant.
Le retrait d'implants insérés profondément doit être effectué avec une prudence particulière afin d'éviter de léser des structures nerveuses ou vasculaires profondes. Les implants non palpables et insérés profondément devraient être retirés par des médecins familiarisés avec l'anatomie du bras et le retrait d'implants insérés profondément.
Il est vivement déconseillé de procéder à une intervention chirurgicale exploratrice sans connaissance de la position précise de l'implant.
Remplacement d'Implanon NXT
Si la patiente souhaite poursuivre l'utilisation d'Implanon NXT, un nouvel implant peut être mis en place immédiatement après le retrait de l'ancien implant. La technique de remplacement correspond pour l'essentiel à celle décrite sous Mise en place d'Implanon NXT.
Le nouvel implant peut être inséré dans le même bras, à travers l'incision pratiquée pour son retrait, dans la mesure où celle-ci se trouve au bon emplacement, c-à-d. 8 à 10 cm au-dessus de l'épicondyle médial de l'humerus et 3 à 5 cm derrière (sous) le sillon (voir le paragraphe Mise en place d'Implanon NXT). Dans ce cas, anesthésiez le site d'insertion le long du canal d'insertion prévu (p.ex. avec 2 ml d'une solution de lidocaïne à 1%) directement sous la peau, en commençant au niveau de l'incision. Suivez ensuite les instructions pour la mise en place de l'implant.
Numéro d’autorisation
61298 (Swissmedic).
Titulaire de l’autorisation
MSD MERCK SHARP & DOHME AG, Lucerne
Mise à jour de l’information
Avril 2020
S-CCDS-MK8415-IPTx-072019/MK8415-CHE-2020-021725
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


 Deutsch
Deutsch French
French Italian
Italian











 , Abb. 8b). Das Implantat ist nun an seiner subdermalen Insertionsstelle, und die Nadel wird im Innern des Applikators verriegelt. Der Applikator kann jetzt entfernt werden (Abb. 8c).
, Abb. 8b). Das Implantat ist nun an seiner subdermalen Insertionsstelle, und die Nadel wird im Innern des Applikators verriegelt. Der Applikator kann jetzt entfernt werden (Abb. 8c).















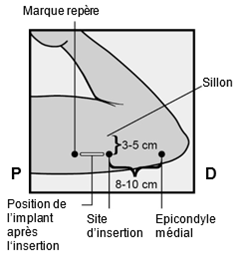
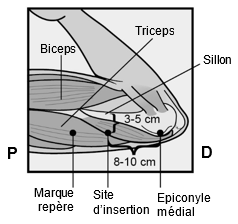
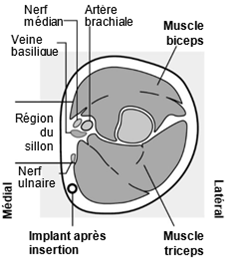
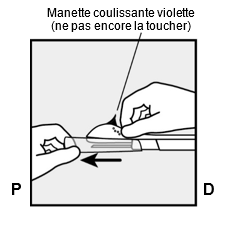
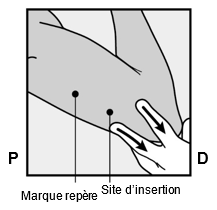
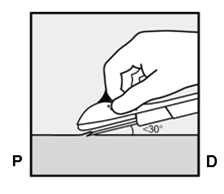

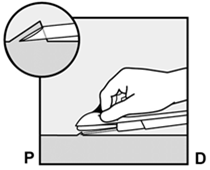
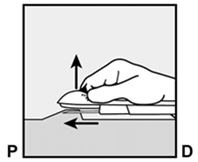

 , Fig. 8b). L'implant est à présent dans sa position d'insertion sous-cutanée, tandis que l'aiguille est verrouillée à l'intérieur de l'applicateur. L'applicateur peut alors être retiré (Fig. 8c).
, Fig. 8b). L'implant est à présent dans sa position d'insertion sous-cutanée, tandis que l'aiguille est verrouillée à l'intérieur de l'applicateur. L'applicateur peut alors être retiré (Fig. 8c).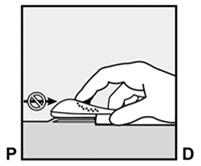
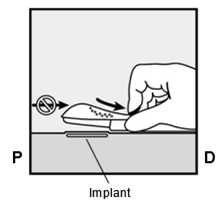
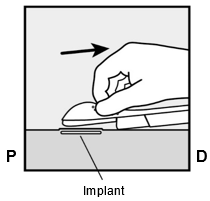
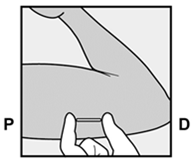

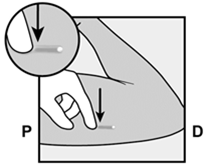
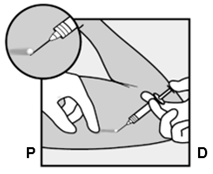
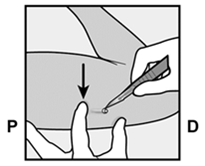
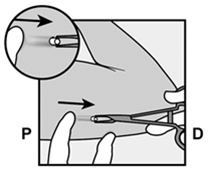
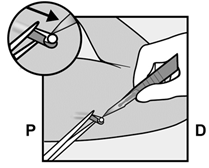 c
c