A Kenacort Solubile Inj Lös 10 mg / 0.25 ml Amp 5 pcs
Kenacort A Solubile Inj Lös 10 mg/0.25ml Amp 5 Stk
-
49.79 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: DERMAPHARM AG
- Product Code: 5612713
- ATC-code H02AB08
- EAN 7680387742132
Ingredients:
Citronensäure, Triamcinolon acetonid 10 mg , Natrium 0.8 mg, Macrogol 300, Triamcinolon acetonid dihydrogenphosphat dikalium 13.6 mg, Natriumcitrat-2-Wasser, Natronlauge zur pH-Wert-Einstellung.

Description
Zusammensetzung
Wirkstoff
Triamcinolonacetonid, als Triamcinolon-acetonid-21-Phosphat, Dikaliumsalz.
Hilfsstoffe
Natriumcitrat-Dihydrat, Macrogol 300, Citronensäure und Natriumhydroxid (zur pH-Einstellung), Wasser für Injektionszwecke.
Kenacort-A Solubile 10 mg, Injektionslösung enthält 0,80 mg Natrium pro 0.25 ml Ampulle.
Kenacort-A Solubile 40 mg, Injektionslösung enthält 3,14 mg Natrium pro 1 ml Ampulle.
Kenacort-A Solubile 80 mg, Injektionslösung enthält 6,28 mg Natrium pro 2 ml Ampulle/Spritze.
Darreichungsform und Wirkstoffmenge pro Einheit
1 OPC-Ampulle à 0,25 ml Injektionslösung Kenacort-A Solubile enthält 13,6 mg Triamcinolon-acetonid-21-Phosphat, Dikaliumsalz (= 10 mg Triamcinolonacetonid).
1 OPC-Ampulle à 1 ml Injektionslösung Kenacort-A Solubile enthält 54,4 mg Triamcinolonacetonid-21-Phosphat, Dikaliumsalz (= 40 mg Triamcinolonacetonid).
1 OPC-Ampulle oder Fertigspritze à 2 ml Injektionslösung Kenacort-A Solubile enthält 108,8 mg Triamcinolon-acetonid-21-Phosphat, Dikaliumsalz (= 80 mg Triamcinolonacetonid).
Indikationen/Anwendungsmöglichkeiten
Alle Indikationen einer Therapie mit Glukokortikoiden, wenn eine möglichst schnell einsetzende Wirkung erzielt werden soll oder wenn eine orale Behandlung nicht durchführbar ist.
Schwere Allergien, Überempfindlichkeitsreaktionen auf Arzneimittel, Röntgenkontrastmittel-Unverträglichkeiten (auch zur Prophylaxe); bedrohliche Ödeme wie z.B. Glottis-, Quincke-Ödem, Lungenödem, Hirnödem, Apoplexie; kardiogener Schock, Schock infolge von Verbrennungen, traumatischer Schock, anaphylaktischer Schock bzw. anaphylaktoide Reaktionen sowie Schocklunge; Transfusionszwischenfälle; akute schwere Dermatosen, akute Blutkrankheiten.
Bei thyreotoxischen und Addison-Krisen muss zusätzlich zu Kenacort-A Solubile ein Kortikoid mit mineralokortikotroper Wirkung verabreicht werden.
Dosierung/Anwendung
Hinweise
Kenacort-A Solubile ist spritzfertig und wird langsam intravenös appliziert. Wenn in Notfällen eine intravenöse Injektion nicht möglich ist, kann ausnahmsweise eine intramuskuläre Injektion erfolgen; der Wirkungseintritt ist jedoch im Vergleich zur intravenösen Verabreichung verzögert oder - im Schock - fraglich. Die intramuskuläre Injektion kann schmerzhaft sein und lokale Irritationen hervorrufen.
Die Dosierung richtet sich nach der Schwere des Krankheitsbildes und dem Ansprechen auf die Therapie.
Parenterale Arzneimittel sind vor Gebrauch visuell zu prüfen. Nur klare Lösungen ohne Partikel dürfen verwendet werden.
Übliche Dosierung
Erwachsene
Im Allgemeinen werden bei Erwachsenen ein- bis mehrmals täglich 10-80 mg und mehr verabreicht.
Bei akut bedrohlichen Zuständen, wie z.B. Quincke-Ödem, Insektenstich-Allergie, werden 80 bis 160 mg und mehr appliziert. Bei Schockzuständen werden initial 5 ml Kenacort-A Solubile (200 mg) appliziert; nach 30 Minuten kann nachinjiziert werden.
Bei lebensbedrohlichen Situationen, z.B. Herz-Kreislaufschock, thyreotoxischer oder Addison-Krise, bildet die intravenöse Kortikoidgabe nur einen Teil der Notfalltherapie. Weitere notwendige Massnahmen, wie Adrenalin i.v., Bluttransfusion und Elektrolyt-Ersatz sowie gegebenenfalls Desoxycorticosteron-Injektionen und Reanimation müssen gleichzeitig eingeleitet werden.
Spezielle Dosierungsanweisungen
Kinder und Jugendliche
Die Anwendung bei Kindern und Jugendlichen wird nur bei strenger Indikationsstellung (s. «Indikationen/Anwendungsmöglichkeiten») empfohlen und sollte möglichst kurz dauern (s. «Warnhinweise und Vorsichtsmassnahmen»).
Kontraindikationen
Überempfindlichkeit gegenüber Triamcinolonacetonid-21-Phosphat oder einem anderen Inhaltsstoff; systemische Mykosen. Bei kurzdauernder Anwendung im Notfall bestehen keine Kontraindikationen.
Kenacort-A Solubile soll bei einer über die Notfalltherapie hinausgehenden länger dauernden systemischen Anwendung nicht angewandt werden, wenn folgende Erkrankungen bestehen: psychiatrische Erkrankungen in der Anamnese, Herpes simplex und Herpes zoster, insbesondere Herpes corneae; Varizellen und frische Vakzinationskomplikationen. Insbesondere müssen Kinder, die unter einer Kortikoidtherapie stehen, vor Ansteckung mit Varizellen und Herpes geschützt werden (siehe «Warnhinweise und Vorsichtsmassnahmen»). Etwa 8 Wochen vor bis 2 Wochen nach Schutzimpfungen. Amöbeninfektionen, systemische Mykosen, Magen-Darm-Ulcera. Poliomyelitis mit Ausnahmen der bulbärencephalitischen Form, Lymphome nach BCG-Impfung; Osteoporose, Eng- und Weitwinkelglaukom.
Warnhinweise und Vorsichtsmassnahmen
Mögliche Komplikationen einer Kortikosteroidtherapie sind von der Höhe der Dosierung und der Dauer der Therapie abhängig. Deshalb sollten für jeden Patienten hinsichtlich Dosierung und Behandlungsdauer Nutzen und Risiko individuell beurteilt werden (siehe «Dosierung/Anwendung»).
Endokrine Effekte
Bei Patienten, die während der Kortikosteroidtherapie zusätzlich ungewöhnlichen Belastungen ausgesetzt sind (z.B. Operation, schweres Trauma, schwere Infektion), muss die Kortikosteroiddosis erhöht werden.
Bei postmenopausalen und geriatrischen Patienten sollte wegen des erhöhten Risikos einer Osteoporose eine systemische Behandlung mit Glukokortikoiden nur bei strenger Indikationsstellung und nach sorgfältiger Nutzen-Risiko-Abwägung durchgeführt werden.
Immunsuppressive Effekte/Erhöhte Empfindlichkeit gegenüber Infektionen
Unter gleichzeitiger Anwendung des in der Therapie von HIV-Infektionen eingesetzten Wirkstoffes Cobicistat, einem potenten CYP3A-Inhibitor und Inhibitor mehrerer Transportproteine, zusammen mit Glukokortikoiden wurde über eine vermehrte Steroid-Toxizität bis hin zu Fällen eines Cushing-Syndroms berichtet. Triamcinolon sollte daher nur nach sorgfältiger Nutzen-Risiko-Abwägung zusammen mit Cobicistat angewendet werden. In diesem Fall ist der Patient sorgfältig auf mögliche unerwünschte Steroid-Wirkungen zu überwachen. Die Wahl eines alternativen Steroids mit CYP3A-unabhängigem Metabolismus sollte in Erwägung gezogen werden.
Die Anwendung von Triamcinolon zusammen mit anderen potenten CYP3A4-Inhibitoren sollte ebenfalls unter besonderer Vorsicht erfolgen. Ggf. muss die Steroiddosis angepasst werden.
Bei bestehenden Infektionskrankheiten muss die Behandlung mit Kortikoiden unter ausreichendem antibiotischem Schutz durchgeführt werden.
Patienten unter Kortikosteroidtherapie sollten nicht geimpft werden, um das Risiko neurologischer Komplikationen und eine ungenügende Impfantwort zu vermeiden.
Bei Patienten mit latenter Tuberkulose oder Tuberkulinreaktivität ist bei gesicherter Indikation für eine Therapie mit Kortikosteroiden eine engmaschige Kontrolle erforderlich, da tuberkulöse Erkrankungen unter Kortikosteroiden wieder aufbrechen können. Bei einer Langzeittherapie sollten solche Patienten eine Chemotherapie erhalten. Bei Patienten mit aktiver fulminanter Tuberkulose oder Miliartuberkulose darf Kenacort-A Solubile nur in Kombination mit einer geeigneten tuberkulostatischen Therapie verabreicht werden.
Varizellen, die während einer systemischen Behandlung mit Kortikosteroiden auftreten, können eine schwere Verlaufsform annehmen und insbesondere bei Kindern letal enden. Sie erfordern eine sofortige Behandlung, z.B. mit Aciclovir i.v. Bei Risikopatienten ist eine Prophylaxe mit Aciclovir oder eine passive Immunprophylaxe mit Varizella-zoster-Immunglobulin angezeigt.
Anwendung bei Kindern
Bei Kindern erfordert eine Langzeitbehandlung mit Glukokortikoiden wegen des Risikos eines vorzeitigen Epiphysenschlusses eine besonders sorgfältige Nutzen-Risiko-Abwägung.
Andere Erkrankungen, bei welchen Korticosteroide nur mit besonderer Vorsicht angewendet werden sollten
Kortikosteroide sollen bei folgenden Erkrankungen prinzipiell nur mit Vorsicht gegeben werden: Ulcusanamnese, unspezifische Colitis ulcerosa mit drohender Perforation, Abszesse oder andere eitrige Entzündungen, Divertikulitis, frische Darmanastomosen, Neigung zu thrombotischen bzw. thromboembolischen Erkrankungen, schwere Herzinsuffizienz, metastasierende Karzinome, Myasthenia gravis, Niereninsuffizienz, akute Glomerulonephritis, chronische Nephritis.
Hinweis für Diabetiker
Ein bestehender Diabetes mellitus kann sich unter einer Kortikoidtherapie verschlechtern bzw. ein latenter Diabetes kann manifest werden. Daher sollte der Glukosestoffwechsel regelmässig kontrolliert werden.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Ampulle bzw. Fertigspritze, d. h. es ist nahezu «natriumfrei».
Interaktionen
Es wird empfohlen, auch die Fachinformation der gleichzeitig verabreichten Arzneimittel zu konsultieren.
Pharmakokinetische Interaktionen
Einfluss anderer Arzneimittel auf die Pharmakokinetik von Triamcinolonacetonid
Triamcinolonacetonid wird unter wesentlicher Beteiligung von CYP3A4 metabolisiert. Der Metabolismus kann daher durch Induktoren und Inhibitoren dieses Enzyms in relevanter Weise beeinflusst werden.
Einfluss von Triamcinolonacetonid auf die Pharmakokinetik anderer Arzneimittel
Glukokortikoide können CYP3A4 sowohl induzieren als auch inhibieren und dadurch die Plasmakonzentrationen anderer CYP3A4-Substrate erhöhen oder erniedrigen. Beispiele hierfür sind: Aprepitant, Fosaprepitant, Ethinylestradiol, Norethisteron und Protease-Inhibitoren.
Glukokortikoide können bei längerdauernder hoher Dosierung die Elimination von Salicylaten beschleunigen und dadurch deren Wirksamkeit reduzieren. Umgekehrt kann bei Reduktion der Kortikosteroid-Dosis die Toxizität von Salicylaten verstärkt sein.
Pharmakodynamische Interaktionen
Acetylsalicylsäure und nichtsteroidale Entzündungshemmer (NSAID)
Die ulzerogene Wirkung dieser Substanzen kann verstärkt werden.
Immunsuppressiva
Durch den synergistischen Effekt anderer Immunsuppressiva (wie z.B. Methotrexat) kann eine tiefere Kortikosteroid-Dosis ausreichend sein.
Anticholinergika
Atropin und andere Anticholinergika können einen bereits gesteigerten Augeninnendruck weiter erhöhen.
Sympathomimetika
Die Wirkung von Salbutamol ist erhöht sowie auch potentiell die Toxizität.
Neuromuskuläre Blocker
Kortikosteroide können die Wirkung von nicht-depolarisierenden neuromuskulären Blockern (z.B. Pancuronium, Vecuronium) beeinflussen. Berichtet wurde über eine Antagonisierung der neuromuskulären Blockade sowie bei gleichzeitiger Anwendung hoher Dosen über akute Myopathien.
Cholinesterasehemmer
Bei gleichzeitiger Anwendung von Triamcinolonacetonid und Cholinesterasehemmern wie Neostigmin oder Pyridostigmin kann eine Myasthenie-Krise auftreten.
Antikoagulantien
Die Wirkung von Heparin oder oralen Antikoagulantien kann gesteigert oder reduziert sein. Die Blutgerinnung ist zu kontrollieren und ggf. die Antikoagulantien-Dosis anzupassen.
Herzglykoside
Die Toxizität von Digitalis-Glykosiden wird durch die gleichzeitige Gabe von Triamcinolonacetonid potenziert.
Antidiabetika
Aufgrund des diabetogenen Effekts der Glukokortikoide müssen bei Diabetikern die Glukose-Spiegel überwacht werden. Gegebenenfalls ist die Antidiabetika-Dosierung anzupassen.
Antihypertensiva
Die antihypertensive Wirkung wird durch den mineralkortikoiden Effekt der Kortikoide teilweise reduziert, was zu erhöhten Blutdruckwerten führen kann.
Arzneimittel mit Einfluss auf den Kaliumhaushalt
Bei Verabreichung von Kortikosteroiden zusammen mit Arzneimitteln, welche die Kaliumausscheidung steigern (z.B. Furosemid, Hydrochlorothiazid, Amphotericin B, Betasympathomimetika oder Xanthin-Derivaten), besteht ein erhöhtes Risiko einer Hypokaliämie. Der Kaliumspiegel muss daher überwacht und ggf. Kalium substituiert werden.
Psychopharmaka
Die Wirkung von Anxiolytika und Antipsychotika kann vermindert werden. Gegebenenfalls ist die Dosis der ZNS-aktiven Substanz anzupassen.
Zytostatika
Die Wirksamkeit von Cyclophosphamid kann reduziert sein.
Impfstoffe
Lebendvirus-Impfstoffe, wie z.B. Poliomyelitis-, BCG-, Mumps-, Masern-, Röteln- und Pocken-Impfstoffe, können wegen der immunsupprimierenden Wirkung der Kortikosteroide verstärkt toxisch sein. Disseminierte virale Infektionen können auftreten. Bei Totvirus-Impfstoffen kann die Impfantwort reduziert sein.
Enzyminduktoren
Bei gleichzeitiger Gabe zusammen mit CYP3A4-Induktoren wird der Metabolismus von Triamcinolonacetonid beschleunigt, wodurch die Wirksamkeit reduziert sein kann. Dies gilt z.B. für Barbiturate, Carbamazepin, Phenytoin, Primidon und Rifampicin sowie für Präparate, welche Johanniskraut (Hypericum perforatum) enthalten. Eine Erhöhung der Triamcinolon-Dosis kann in diesen Fällen erforderlich sein.
CYP3A4-Substrate
Auch durch die gleichzeitige Gabe anderer CYP3A4-Substrate kann die hepatische Clearance von Triamcinolonacetonid beeinflusst werden.
Enzyminhibitoren
Bei gleichzeitiger Gabe zusammen mit potenten oder moderaten CYP3A-Inhibitoren ist der Metabolismus von Triamcinolonacetonid reduziert, was zu vermehrten unerwünschten Wirkungen bis hin zu Symptomen eines Cushing-Syndroms führen kann. Dies gilt z.B. für Cobicistat (siehe «Warnhinweise und Vorsichtsmassnahmen»), Protease-Inhibitoren (v.a. Ritonavir), Azol-Antimykotika (Itraconazol, Voriconazol, Posaconazol, Fluconazol), Makrolid-Antibiotika (Clarithromycin, Erythromycin), Diltiazem, Isoniazid und Verapamil.
Auch Sexualhormone (z.B. Ethinylestradiol, Norethisteron) können die Clearance von Glukokortikoiden beeinflussen. Insbesondere können Östrogene die Wirkung von Kortikosteroiden verstärken. Bei therapeutischen Dosierungen dieser Hormone (z.B. in hormonalen Kontrazeptiva) ist jedoch eine klinisch relevante Inhibition von CYP-Enzymen durch Sexualhormone unwahrscheinlich.
Gegenseitige Interaktionen
Bei gleichzeitiger Gabe von Triamcinolonacetonid-21-Phosphat zusammen mit Cyclosporin wird der Metabolismus gegenseitig inhibiert. Deshalb können unerwünschte Wirkungen beider Substanzen verstärkt auftreten. Insbesondere wurden vermehrt Konvulsionen beobachtet.
Schwangerschaft/Stillzeit
Schwangerschaft
Tierstudien haben unerwünschte Effekte auf den Foeten gezeigt (Teratogenität, Embryotoxizität), und es existieren keine kontrollierten Humanstudien.
Bei einer Langzeittherapie während der Schwangerschaft sind deshalb z.B. intrauterine Wachstumsstörungen nicht auszuschliessen, und bei einer Behandlung zum Ende der Schwangerschaft besteht für den Foeten die Gefahr einer Nebennierenrindenatrophie. Daher sollte Kenacort-A Solubile, wie alle Glukokortikoide, während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig notwendig.
Die Patientin sollte informiert werden, bei einer vermuteten oder eingetretenen Schwangerschaft unverzüglich den Arzt zu verständigen.
Neugeborene, deren Mütter während der Schwangerschaft ein Kortikosteroid in höheren Dosen erhalten haben, sollen sorgfältig auf Zeichen einer Nebennierenrindeninsuffizienz und auf die Notwendigkeit einer ausschleichenden Substitutionstherapie überwacht werden.
Stillzeit
Da Triamcinolonacetonid in die Muttermilch übertritt und u.a. die NNR-Funktion und das Wachstum des Säuglings beeinträchtigen kann, sollte in diesen Fällen abgestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Aufgrund von unerwünschten Wirkungen wie Schwindel ist beim Lenken von Fahrzeugen und Bedienen von Maschinen Vorsicht geboten.
Unerwünschte Wirkungen
Die nachfolgend aufgeführten unerwünschten Wirkungen sind typisch für systemisch verabreichte Kortikosteroide und können demzufolge auch unter Kenacort-A Solubile auftreten. Sie sind von Dosis und Behandlungsdauer sowie von Alter, Geschlecht und Grunderkrankung des Patienten abhängig.
Infektionen und parasitäre Erkrankungen
Maskierung von Infektionen, Aktivierung latenter Infektionen, opportunistische Infektionen.
Erkrankungen des Blutes und des Lymphsystems
Vaskulitis, Erhöhung des Thromboserisikos.
Erkrankungen des Immunsystems
Überempfindlichkeitsreaktionen inklusive Anaphylaxie, supprimierte Reaktionen auf Hauttests.
Endokrine Erkrankungen
Entwicklung eines cushingoiden Zustandes, Suppression der Hypophysen-Nebennierenrinden-Achse (die bis zu einem Jahr und länger andauern kann und für den Patienten in Stress- und Belastungssituationen ein lebensbedrohliches Risiko darstellt), verminderte Kohlehydrattoleranz (Manifestation eines latenten Diabetes mellitus, erhöhter Bedarf an Insulin oder oralen Antidiabetika bei Diabetikern; siehe auch «Interaktionen»), Wachstumshemmung im Kindesalter.
Stoffwechsel- und Ernährungsstörungen
Negative Stickstoffbilanz infolge Eiweisskatabolismus, Natrium- und Flüssigkeitsretention, Kaliumverlust, hypokaliämische Alkalose.
Psychiatrische Erkrankungen
Schlaflosigkeit, psychische Alterationen (Depressionen).
Erkrankungen des Nervensystems
Erhöhter intrakranieller Druck mit Papillenödem (Pseudotumor cerebri), Konvulsionen, Schwindelanfälle, Kopfschmerzen.
Augenerkrankungen
Posteriorer subkapsulärer Katarakt, erhöhter intraokulärer Druck, Glaukom, Exophthalmus.
Herzerkrankungen
Hypertonie, Herzinsuffizienz bei disponierten Patienten.
Erkrankungen des Gastrointestinaltrakts
Peptische Ulzera mit möglicher Blutung und Perforation, Magenblutung, Pankreatitis, Oesophagitis, Darmperforation.
Leber- und Gallenerkrankungen
Erhöhung der Alanin-Transaminase (ALT, SGPT), Aspartat-Aminotransferase (AST, SGOT) und Alkalin-Phosphatasen wurden nach Kortikosteroid-Behandlungen beobachtet. Diese Veränderungen sind im Allgemeinen gering und nicht mit einem klinischen Syndrom verbunden. Sie sind nach dem Absetzen der Therapie reversibel.
Erkrankungen der Haut und des Unterhautzellgewebes
Verzögerte und/oder beeinträchtigte Wundheilung, Petechien, Ekchymosen, dünne und empfindliche Haut.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Steroid-Myopathie, Muskelatrophie, starke Arthralgien, Osteoporose, pathologische Frakturen, Wirbelkompressionsfrakturen, aseptische Knochennekrose.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Menstruationsstörungen.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Die akute Toxizität von Glukokortikoiden ist gering, und eine akute Überdosierung bzw. Intoxikation von Triamcinolonacetonid-21-Phosphat ist bei vorschriftsmässiger Anwendung wenig wahrscheinlich. Für den Fall einer Überdosierung gibt es kein spezifisches Antidot. Gegebenenfalls ist eine symptomatische Behandlung angezeigt.
Eigenschaften/Wirkungen
ATC-Code:
H02AB08
Wirkungsmechanismus
Kenacort-A Solubile enthält das wasserlösliche Dikaliumsalz von Triamcinolonacetonid-21-Phosphat. Dieses Glukokortikoid mit geringer mineralokortikoider Wirkung kann intravenös appliziert werden. Die Wirkung von Triamcinolonacetonid-21-Phosphat beruht wie die aller Glukokortikoide auf der über den Zellkern verlaufenden Anregung der Synthese spezifischer Proteine in der Zelle. Diese sind für die eigentlichen vielfältigen biologischen Wirkungen verantwortlich, die den physiologischen Anpassungen des Organismus an Stress-Situationen dienen. Einige therapeutisch erwünschte Effekte werden erst bei unphysiologisch hoher (pharmakologischer) Dosierung erreicht. Dazu gehören insbesondere die antiphlogistische und die immunsuppressive (antiallergische) Wirkung. Aufgrund des Wirkmechanismus tritt die volle pharmakologische Wirkung der Glukokortikoide verzögert (mehrere Stunden nach oraler oder parenteraler Verabreichung) ein, und sie hält länger an, als dies der Plasmahalbwertszeit entspricht.
Die relative antiphlogistische Äquivalenzdosis von Triamcinolonacetonid im Vergleich zu anderen Glukokortikoiden beträgt: 10 mg Triamcinolonacetonid = 6 mg Betamethason = 8 mg Dexamethason = 32 mg Methylprednisolon = 40 mg Prednison bzw. Prednisolon = 200 mg Cortison.
Pharmakodynamik
Klinische Wirksamkeit
Keine Angaben.
Pharmakokinetik
Absorption
Nach intravenöser Verabreichung von Kenacort-A Solubile wird Triamcinolonacetonid-21-Phosphat, Dikaliumsalz, innerhalb von etwa 2 Minuten zu dem pharmakodynamisch aktiven Triamcinolonacetonid hydrolysiert. Maximale Plasmawerte werden innerhalb der ersten 5 Minuten erreicht.
Distribution
Triamcinolonacetonid liegt im Plasma zu einem wesentlichen Teil als nicht-proteingebundener und somit aktiver Wirkstoff vor. Der an Plasmaproteine gebundene Anteil kann bis zu 80% betragen.
Triamcinolonacetonid geht in die Muttermilch über, doch ist nicht bekannt, ob es die Placenta- oder die Blut-Hirn-Schranke passiert. Bei anderen Glukokortikoiden ist dies der Fall.
Metabolismus
Triamcinolonacetonid wird, überwiegend in der Leber, unter wesentlicher Beteiligung des Cytochrom P450-Isoenzyms CYP3A4 metabolisiert. Hauptmetaboliten sind das pharmakologisch inaktive 6ß-Hydroxytriamcinolonacetonid sowie die C21-Carbonsäuren von Triamcinolonacetonid und 6ß-Hydroxytriamcinolonacetonid. Eine Hydrolyse zu Triamcinolon spielt kaum eine Rolle.
Elimination
Nach anfangs raschem Abfall des Plasmaspiegels verlangsamt sich die Elimination. Unter Berücksichtigung der ersten 4-6 Stunden liegt die Eliminationshalbwertszeit bei 85-88 Minuten.
Die Ausscheidung der Metaboliten erfolgt hauptsächlich über die Faeces.
Die Halbwertszeit der Elimination des aktiven Triamcinolonacetonid beträgt nach i.v.-Verabreichung ca. 90 Minuten.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Bei schwerer Leberinsuffizienz ist die Metabolisierung von Glukokortikoiden verzögert, und erwünschte und unerwünschte Wirkungen von Kenacort können daher verstärkt sein. Zur Pharmakokinetik von Triamcinolon bzw. Triamcinolonacetonid bei leichter bis mässiger Leberinsuffizienz liegen keine Daten vor.
Nierenfunktionsstörungen
Zur Pharmakokinetik von Triamcinolon bzw. Triamcinolonacetonid bei Patienten mit eingeschränkter Nierenfunktion liegen keine Daten vor.
Ältere Patienten
Die Pharmakokinetik von Triamcinolon bzw. Triamcinolonacetonid wurde bei Patienten ≥65 Jahre nicht spezifisch untersucht.
Kinder und Jugendliche
Zur Pharmakokinetik von Triamcinolon bzw. Triamcinolonacetonid in der pädiatrischen Population liegen nur limitierte Daten vor. Bei Neugeborenen ist die Triamcinolon-Clearence geringer als bei Kindern und Erwachsenen.
Schwangerschaft
In der Schwangerschaft ist die Eliminationshalbwertszeit von Glukokortikoiden verlängert.
Andere Situationen
- Bei Hypoalbuminämie und Hyperbilirubinämie kann es zu unerwünscht hohen Konzentrationen an nicht proteingebundenem (d.h. pharmakologisch aktivem) Wirkstoff kommen.
- Bei Vorliegen einer Hypothyreose ist die Metabolisierung von Glukokortikoiden verzögert, und die erwünschten und unerwünschten Wirkungen von Kenacort können daher verstärkt sein.
Präklinische Daten
Mutagenität
Untersuchungen zum mutagenen Potential wurden nicht durchgeführt.
Langzeituntersuchungen am Tier auf ein tumorerzeugendes Potential liegen nicht vor.
Reproduktionstoxizität
Die embryotoxischen Eigenschaften von Triamcinolon wurden an drei Nagerspezies (Ratte, Maus, Hamster), am Kaninchen und an drei nichtmenschlichen Primatenspezies (Rhesus, Pavian, Kapuziner) untersucht. Bei den Nagern und beim Kaninchen traten Gaumenspalten und intrauterine Wachstumsstörungen auf, wobei teratogene Effekte z.B. bei der Ratte durch Dosen im humantherapeutischen Bereich ausgelöst wurden. Bei den Affenspezies wurde eine Störung der Knorpelbildung des Chondrocraniums beobachtet, die zu Schädelanomalien (Enzephalozele) und Gesichtsdysmorphien führte. Zudem traten Fehlbildungen des Thymus und intrauterine Wachstumsstörungen auf. Über die Sicherheit einer Anwendung beim Menschen liegen keine Erfahrungen vor.
Sonstige Hinweise
Beeinflussung diagnostischer Methoden
Der Nitroblau-Tetrazol-Test für bakterielle Infektionen kann unter der Wirkung von Glukokortikoiden falsch-negative Resultate liefern.
Folgende Laborwerte können erniedrigt gefunden werden: BSG, Gerinnungszeit (Lee White); Plasmaspiegel von Harnsäure, Kalium, TSH, Thyroxin, T3, Testosteron; Urinwerte von 17-Ketosteroiden.
Folgende Laborwerte können erhöht gefunden werden: Plasmaspiegel von Natrium, Chlorid, Glukose, Cholesterin; Urinwerte von Kalzium, Kreatinin, Glukose (bei Prädisposition).
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15–25 °C) lagern und ausser Reichweite von Kindern aufbewahren. Vor Licht schützen.
Parenterale Arzneimittel sind vor Gebrauch visuell zu prüfen. Nur klare Lösungen ohne Partikel dürfen verwendet werden.
Zulassungsnummer
38774 (Swissmedic).
Zulassungsinhaberin
Dermapharm AG, Hünenberg.
Stand der Information
Juni 2020.
Composizione
Principo attivo
Triamcinolone acetonide, come triamcinolone acetonide-21-fosfato (sale dipotassico).
Sostanze ausiliarie
Sodio citrato diidrato, Macrogol 300, acido citrico e sodio idrossido (per l’aggiustamento del pH), acqua per preparazioni iniettabili
Kenacort-A Solubile 10 mg, soluzione iniettabile contiene 0,80 mg di sodio per fiala da 0,25 ml.
Kenacort-A Solubile 40 mg, soluzione iniettabile contiene 3,14 mg di sodio per fiala da 1 ml.
Kenacort-A Solubile 80 mg, soluzione iniettabile contiene 6,28 mg di sodio per fiala/siringa da 2 ml.
Forma farmaceutica e quantità di principio attivo per unità
1 fiala OPC da 0,25 ml di soluzione iniettabile di Kenacort-A Solubile contiene:
13,6 mg di triamcinolone acetonide-21-fosfato, sale dipotassico (= 10 mg di triamcinolone acetonide)
1 fiala OPC da 1 ml di soluzione iniettabile Kenacort-A Solubile contiene:
54,4 mg di triamcinolone acetonide-21-fosfato, sale dipotassico (= 40 mg di triamcinolone acetonide)
1 fiala OPC da o siringa preriempita da 2 ml di soluzione iniettabile di Kenacort-A Solubile contiene:
108,8 mg di triamcinolone acetonide-21-fosfato, sale dipotassico (= 80 mg di triamcinolone acetonide)
Indicazioni/Possibilità d'impiego
Tutte le indicazioni di una terapia con glucocorticoidi, qualora si debba ottenere un effetto il più rapido possibile o qualora non sia possibile un trattamento orale.
Gravi allergie, reazioni di ipersensibilità al medicamento, intolleranze a mezzi di contrasto radiologici (anche per profilassi); edemi pericolosi come ad es. edemi della glottide, edema di Quincke, edema polmonare, edema cerebrale, apoplessia; shock cardiogenico, shock a seguito di ustioni, shock traumatico, shock anafilattico o reazioni anafilattoidi nonché shock polmonare; incidenti da trasfusioni; dermatosi gravi acute; malattie del sangue acute.
In caso di crisi tireotossiche e di Addison, in aggiunta a Kenacort-A Solubile occorre somministrare un corticoide con effetto mineralcorticotropo.
Posologia/Impiego
Indicazioni
Kenacort-A Solubile è pronto per essere iniettato e si somministra lentamente per via endovenosa. Se, in caso di emergenza, non è possibile praticare un'iniezione endovenosa, può eccezionalmente essere somministrata un'iniezione intramuscolare; tuttavia, rispetto alla somministrazione endovenosa, l'insorgenza d'azione è ritardata o – in caso di shock – dubbia. L'iniezione intramuscolare può essere dolorosa e può provocare irritazioni locali.
La posologia dipende dalla gravità del quadro clinico e dalla risposta alla terapia.
I medicamenti parenterali devono essere ispezionati visivamente prima dell'uso. Si devono usare solo soluzioni limpide prive di particelle.
Posologia abituale
Adulti
Negli adulti si somministrano generalmente 10-80 mg una o più volte al giorno.
In caso di condizioni che costituiscono una minaccia acuta come ad es. edema di Quincke, allergia da puntura d'insetto, si somministrano da 80 a 160 mg e più. In condizioni di shock si somministrano inizialmente 5 ml di Kenacort-A Solubile (200 mg); dopo 30 minuti è possibile procedere a una seconda iniezione.
In situazioni rischiose per la vita, ad es. shock cardiovascolare, crisi tireotossica o di Addison, la somministrazione endovenosa di corticoidi è solo una parte della terapia d'urgenza. Al contempo occorre avviare ulteriori misure necessarie quali adrenalina e.v., trasfusione ematica e sostituzione degli elettroliti nonché eventualmente iniezioni di desossicorticosterone e rianimazione.
Istruzioni posologiche speciali
Bambini e adolescenti
L'utilizzo nei bambini e negli adolescenti viene raccomandato esclusivamente nel rigoroso rispetto dell'indicazione (vedere «Indicazioni/Possibilità d'impiego») e dovrebbe durare il meno possibile (vedere «Avvertenze e misure precauzionali»).
Controindicazioni
Ipersensibilità a triamcinolone acetonide-21-fosfato o a qualsiasi altro ingrediente; micosi sistemiche. Non sussistono controindicazioni per un utilizzo di breve durata in caso d'emergenza.
Kenacort-A Solubile non deve essere utilizzato per via sistemica per periodi prolungati, superiori per durata alla terapia d'urgenza, in presenza delle seguenti patologie: disturbi psichiatrici in anamnesi, herpes simplex ed herpes zoster, in particolare herpes della cornea, varicelle e complicanze di una recente vaccinazione. Soprattutto i bambini in terapia con corticosteroidi devono essere protetti dal contagio con varicelle ed herpes (vedere «Avvertenze e misure precauzionali»). Indicativamente nel periodo compreso tra 8 settimane prima e fino a 2 settimane dopo vaccinazioni protettive. Infezioni da amebe, micosi sistemiche, ulcera gastrointestinale. Poliomielite ad eccezione della forma bulbare, linfomi dopo vaccinazione con BCG, osteoporosi, glaucoma ad angolo stretto e ad angolo aperto.
Avvertenze e misure precauzionali
Le possibili complicanze di una terapia con corticosteroidi dipendono dall'entità della posologia e dalla durata della terapia. Pertanto, per ogni paziente si dovrebbe valutare su base individuale il rapporto beneficio-rischio relativamente alla posologia e alla durata del trattamento (vedere «Posologia/impiego»).
Effetti endocrini
In pazienti che durante la terapia con corticosteroidi sono esposti anche a sollecitazioni inusuali (ad es. intervento chirurgico, trauma grave, infezione grave), occorre aumentare la dose della terapia con corticosteroidi.
In pazienti in post-menopausa e in pazienti geriatrici, a causa dell'aumentato rischio di osteoporosi, un trattamento sistemico con glucocorticoidi dovrebbe essere effettuato esclusivamente nel rigoroso rispetto dell'indicazione e in seguito a un'attenta valutazione del rapporto rischio-beneficio.
Effetti immunosoppressivi/Aumentata sensibilità alle infezioni
Durante l'utilizzo concomitante di glucocorticoidi e del principio attivo cobicistat, impiegato nella terapia delle infezioni da HIV, che è un potente inibitore del CYP3A e un inibitore di diverse proteine di trasporto, è stata segnalata un'aumentata tossicità da steroidi fino a casi di sindrome di Cushing. Pertanto il triamcinolone dovrebbe essere utilizzato insieme a cobicistat solo dopo un'attenta valutazione del rapporto rischio-beneficio. In questo caso, il paziente deve essere monitorato attentamente per possibili effetti indesiderati da steroidi. Si dovrebbe valutare la scelta di uno steroide alternativo con metabolismo indipendente dal CYP3A.
Si consiglia particolare cautela anche nell'utilizzo di triamcinolone con altri potenti inibitori del CYP3A4. La dose di steroide deve essere eventualmente aggiustata.
In caso di malattie infettive in atto, il trattamento con corticoidi deve essere effettuato sotto sufficiente protezione antibiotica.
I pazienti in terapia con corticosteroidi non dovrebbero essere vaccinati per evitare il rischio di complicanze neurologiche e un'insufficiente risposta vaccinale.
In pazienti con tubercolosi latente o reattività alla tubercolina, in caso di indicazione confermata per una terapia con corticosteroidi è necessario uno stretto controllo poiché le malattie tubercolari trattate con corticosteroidi possono riacutizzarsi. Nel caso di una terapia a lungo termine, i pazienti dovrebbero ricevere una chemioterapia. In pazienti con tubercolosi fulminante o tubercolosi miliare attiva, Kenacort-A Solubile deve essere somministrato solo in combinazione con una terapia tubercolostatica appropriata.
Le varicelle che si manifestano durante un trattamento sistemico con corticosteroidi possono evolvere in forma grave e, soprattutto nei bambini, avere esito fatale. Richiedono un trattamento immediato, ad es. con aciclovir e.v. In pazienti a rischio è indicata una profilassi con aciclovir o un'immunoprofilassi passiva con immunoglobulina anti-varicella zoster.
Utilizzo nei bambini
Nei bambini, un trattamento a lungo termine con glucocorticoidi richiede una valutazione particolarmente accurata del rapporto rischio-beneficio a causa del rischio di una prematura chiusura delle epifisi.
Altre malattie nelle quali l'utilizzo di corticosteroidi richiede particolare cautela
In linea di principio, nelle seguenti malattie i corticosteroidi devono essere somministrati con cautela: anamnesi di ulcera, colite ulcerosa aspecifica con minaccia di perforazione, ascessi o altre infiammazioni purulente, diverticolite, anastomosi intestinali recenti, propensione a malattie trombotiche o tromboemboliche, insufficienza cardiaca grave, carcinomi metastatici, miastenia gravis, insufficienza renale, glomerulonefrite acuta, nefrite cronica.
Indicazione per i diabetici
Nel corso di una terapia con corticosteroidi, un diabete mellito in atto può peggiorare o un diabete latente può manifestarsi. Pertanto, il metabolismo del glucosio dovrebbe essere controllato regolarmente.
Sodio
Questo medicamento contiene meno di 1 mmol (23 mg) di sodio per fiala o siringa preriempita, cioè è essenzialmente «senza sodio».
Interazioni
Si raccomanda di consultare anche l'Informazione professionale dei medicamenti somministrati in concomitanza.
Interazioni farmacocinetiche
Effetti di altri medicamenti sulla farmacocinetica di triamcinolone acetonide
Il triamcinolone acetonide viene metabolizzato con il coinvolgimento sostanziale del CYP3A4. Pertanto il metabolismo può essere influenzato in maniera rilevante da induttori e inibitori di questo enzima.
Effetto di triamcinolone acetonide sulla farmacocinetica di altri medicamenti
I glucocorticoidi possono sia indurre sia inibire il CYP3A4 e pertanto aumentare o ridurre le concentrazioni plasmatiche di altri substrati del CYP3A4. Esempi sono: aprepitant, fosaprepitant, etinilestradiolo, noretisterone e inibitori della proteasi.
Se somministrati a posologie elevate per periodi prolungati, i glucocorticoidi possono accelerare l'eliminazione dei salicilati e ridurne pertanto l'efficacia. Vice versa, se la dose dei corticosteroidi viene ridotta, la tossicità dei salicilati può essere potenziata.
Interazioni farmacodinamiche
Acido acetilsalicilico e antinfiammatori non steroidei (FANS)
L'effetto ulcerogeno di queste sostanze può essere potenziato.
Immunosoppressori
Per via dell'effetto sinergico di altri immunosoppressori (come ad es. metotrexato) può essere sufficiente una più bassa dose di corticosteroidi.
Anticolinergici
L'atropina e altri anticolinergici possono innalzare ulteriormente un'aumentata pressione intraoculare.
Simpaticomimetici
L'effetto del salbutamolo, come anche in via potenziale la tossicità, è aumentato.
Bloccanti neuromuscolari
I corticosteroidi possono influenzare l'effetto di bloccanti neuromuscolari non depolarizzanti (ad es. pancuronio, vecuronio). Sono state riferite un'antagonizzazione del blocco neuromuscolare nonché, in caso di utilizzo concomitante di dosi elevate, miopatie acute.
Inibitori della colinesterasi
In caso di utilizzo concomitante di triamcinolone acetonide e di inibitori della colinesterasi come neostigmina o piridostigmina può subentrare una crisi miastenica.
Anticoagulanti
L'effetto dell'eparina o di anticoagulanti orali può essere aumentato o ridotto. Occorre controllare la coagulazione del sangue ed ev. aggiustare la dose degli anticoagulanti.
Glicosidi cardiaci
La tossicità dei glicosidi digitalici viene potenziata dalla somministrazione concomitante di triamcinolone acetonide.
Antidiabetici
Per via dell'effetto diabetogeno dei glucocorticoidi, nei diabetici occorre monitorare i livelli di glucosio. Se del caso, si deve aggiustare la posologia degli antidiabetici.
Antipertensivi
L'effetto antipertensivo viene in parte ridotto dall'effetto mineralcorticoide dei corticoidi, il che può provocare un aumento dei valori della pressione arteriosa.
Medicamenti con effetto sul bilancio del potassio
Se i corticosteroidi vengono somministrati in concomitanza con medicamenti che aumentano l'escrezione del potassio (ad es. furosemide, idroclorotiazide, amfotericina B, beta-simpaticomimetici o derivati della xantina) sussiste un aumentato rischio di ipokaliemia. Pertanto occorre monitorare il livello di potassio avviando ev. una sostituzione del potassio.
Psicofarmaci
L'effetto di ansiolitici e antipsicotici può essere ridotto. Se del caso, si deve aggiustare la dose della sostanza attiva sul SNC.
Citostatici
L'efficacia della ciclofosfamide può essere ridotta.
Vaccini
I vaccini con virus vivi come ad es. i vaccini per poliomielite, BCG, parotite, morbillo, rosolia e varicella, possono mostrare un'aumentata tossicità per via dell'effetto immunosoppressivo dei corticosteroidi. Possono manifestarsi infezioni virali disseminate. In caso di vaccini con virus inattivati la risposta immunitaria può essere ridotta.
Induttori enzimatici
In caso di somministrazione concomitante con induttori del CYP3A4, il metabolismo di triamcinolone acetonide viene accelerato per cui l'efficacia può essere ridotta. Ciò vale ad es. per i barbiturici, la carbamazepina, la fenitoina, il primidone e la rifampicina nonché per i preparati contenenti erba di S. Giovanni (Hypericum perforatum). In questi casi può essere necessario aumentare la dose di triamcinolone.
Substrati del CYP3A4
La clearance epatica di triamcinolone acetonide può essere influenzata anche dalla somministrazione concomitante di altri substrati del CYP3A4.
Inibitori enzimatici
In caso di somministrazione concomitante con potenti o moderati inibitori del CYP3A, il metabolismo di triamcinolone acetonide è ridotto, il che può provocare maggiori effetti indesiderati fino ai sintomi di una sindrome di Cushing. Ciò vale ad es. per cobicistat (vedere «Avvertenze e misure precauzionali»), inibitori della protesi (soprattutto ritonavir), antimicotici azolici (itraconazolo, voriconazolo, posaconazolo, fluconazolo), antibiotici macrolidi (claritromicina, eritromicina), diltiazem, isoniazide e verapamil.
Anche gli ormoni sessuali (ad es. etinilestradiolo, noretisterone) possono influenzare la clearance dei glucocorticoidi. In particolare, gli estrogeni possono potenziare l'effetto dei corticosteroidi. Alle posologie terapeutiche di questi ormoni (ad es. nei contraccettivi ormonali) è tuttavia improbabile che gli ormoni sessuali un'inibizione clinicamente rilevante di enzimi del CYP.
Interazioni reciproche
Se il triamcinolone acetonide-21-fosfato viene somministrato in concomitanza con ciclosporina, si verifica un'inibizione reciproca del metabolismo. Pertanto gli effetti indesiderati di entrambe le sostanze possono presentarsi potenziati. In particolare è stato osservato un aumento degli episodi di convulsioni.
Gravidanza/Allattamento
Gravidanza
Gli studi sugli animali hanno mostrato effetti indesiderati sullo sviluppo fetale (teratogenicità, embriotossicità) e non esistono studi controllati sull'uomo.
Pertanto, in una terapia di lungo corso durante la gravidanza non sono da escludere ad es. disturbi della crescita intrauterina, e in caso di trattamento a fine gravidanza sussiste il rischio di un'atrofia corticosurrenale per i feti. Pertanto, come tutti i glucocorticoidi, Kenacort-A Solubile non dovrebbe essere usato durante la gravidanza, a meno che ciò non sia inequivocabilmente necessario.
La paziente dovrebbe essere avvisata che deve informare immediatamente il medico in caso di gravidanza sospetta o confermata.
I neonati le cui madri hanno ricevuto un corticosteroide a dosi elevate durante la gravidanza devono essere monitorati attentamente per segni di un'insufficienza corticosurrenalica e per la necessità di una terapia sostitutiva a scalare.
Allattamento
Poiché triamcinolone acetonide viene escreto nel latte materno e, tra l'altro, può compromettere la funzionalità corticosurrenale e la crescita del lattante, in questi casi si dovrebbe interrompere l'allattamento.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono stati effettuati studi a riguardo.
A causa di effetti indesiderati come capogiri, è richiesta cautela nella guida di veicoli e nell'impiego di macchine.
Effetti indesiderati
Gli effetti indesiderati elencati di seguito sono tipici dei corticosteroidi in somministrazione sistemica e possono pertanto manifestarsi anche con Kenacort-A Solubile. Sono dipendenti dalla dose e dalla durata del trattamento nonché dall'età, dal sesso e dalla malattia di base del paziente.
Infezioni e infestazioni
Mascheramento di infezioni, attivazione di infezioni latenti, infezioni opportunistiche.
Patologie del sistema emolinfopoietico
Vasculite, aumento del rischio di trombosi.
Disturbi del sistema immunitario
Reazioni di ipersensibilità incluse anafilassi, reazioni soppresse ai test cutanei.
Patologie endocrine
Sviluppo di una condizione cushingoide, soppressione dell'asse ipofisi-surrene (che può persistere fino a un anno e oltre e rappresenta un rischio di vita per il paziente in condizioni di stress e sollecitazioni), ridotta tolleranza ai carboidrati (manifestarsi di un diabete mellito latente, aumentato fabbisogno di insulina o antidiabetici orali nei diabetici; vedere anche «Interazioni»), inibizione della crescita in età infantile
Disturbi del metabolismo e della nutrizione
Bilancio negativo dell'azoto in seguito a catabolismo proteico, ritenzione idrica e di sodio, perdita di potassio, alcalosi ipokaliemica.
Disturbi psichiatrici
Insonnia, alterazioni psichiche (depressioni).
Patologie del sistema nervoso
Aumentata pressione intracranica con edema papillare (pseudotumor cerebri), convulsioni, capogiri, cefalea.
Patologie dell'occhio
Cataratta sottocapsulare posteriore, pressione intraoculare elevata, glaucoma, esoftalmo.
Patologie cardiache
Ipertensione, insufficienza cardiaca in pazienti predisposti.
Patologie gastrointestinali
Ulcera peptica con possibile sanguinamento e perforazione, sanguinamento gastrico, pancreatite, esofagite, perforazione intestinale.
Patologie epatobiliari
Dopo trattamenti con corticosteroidi è stato osservato un aumento di alanina transaminasi (ALT, SGPT), aspartato aminoransferasi (AST, SGOT) e fosfatasi alcalina. Queste alterazioni sono generalmente basse e non associate a una sindrome clinica. Dopo l'interruzione della terapia sono reversibili.
Patologie della cute e del tessuto sottocutaneo
Ritardo e/o compromissione della guarigione delle ferite, petecchie, ecchimosi, cute sottile e sensibile.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Miopatia steroidea, atrofia muscolare, forti artralgie, osteoporosi, fratture patologiche, fratture vertebrali da compressione, necrosi ossea asettica.
Patologie dell'apparato riproduttivo e della mammella
Disturbi mestruali.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
La tossicità acuta dei glucocorticoidi è bassa e un sovradosaggio acuto o un'intossicazione acuta da triamcinolone acetonide-21-fosfato in caso di utilizzo conforme alle prescrizioni è poco probabile. Non esiste un antidoto specifico per il caso di sovradosaggio. È eventualmente indicato un trattamento sintomatico.
Proprietà/Effetti
Codice ATC
H02AB08
Meccanismo d'azione
Kenacort-A Solubile contiene il sale dipotassico idrosolubile di triamcinolone acetonide-21-fosfato. Questo glucocorticoide con debole effetto mineralcorticoide può essere somministrato per via endovenosa. Come per tutti i glucocorticoidi, l'effetto di triamcinolone acetonide-21-fosfato si basa sulla stimolazione, a livello di nucleo cellulare, della sintesi di proteine specifiche nella cellula. Queste sono responsabili degli effettivi molteplici effetti biologici che aiutano l'organismo ad adattarsi fisiologicamente alle situazioni di stress. Alcuni effetti desiderati dal punto di vista terapeutico vengono raggiunti solo a una posologia (farmacologica) non elevata a livello fisiologico, in particolare l'effetto antiflogistico e l'effetto immunosoppressivo (antiallergico). A fronte del meccanismo d'azione, il pieno effetto farmacologico dei glucocorticoidi insorge in ritardo (diverse ore dopo somministrazione orale o parenterale) e persiste per un periodo superiore all'emivita plasmatica.
La dose equivalente antiflogistica di triamcinolone acetonide corrispondente ad altri glucocorticoidi è: 10 mg di triamcinolone acetonide = 6 mg di betametasone = 8 mg di desametasone = 32 mg di metilprednisolone = 40 mg di prednisone o prednisolone = 200 mg di cortisone.
Farmacodinamica
Efficacia clinica
Nessuna informazione.
Farmacocinetica
Assorbimento
Dopo somministrazione endovenosa di Kenacort-A Solubile, triamcinolone acetonide-21-fosfato, sale dipotassico, viene idrolizzato in triamcinolone acetonide farmacologicamente attivo entro circa 2 minuti. I livelli plasmatici massimi vengono raggiunti nei primi 5 minuti.
Distribuzione
Triamcinolone acetonide è presente nel plasma in parte rilevante in forma non legata alle proteine e pertanto come principio attivo. La percentuale legata alle proteine plasmatiche può arrivare all'80%.
Triamcinolone acetonide viene escreto nel latte materno ma non è noto se passi la barriera placentare o la barriera ematoencefalica, come nel caso di altri glucocorticoidi.
Metabolismo
Triamcinolone acetonide viene metabolizzato prevalentemente a livello epatico, con il coinvolgimento sostanziale dell'isoenzima CYP3A4 del citocromo P450. I principali metaboliti sono 6ß-idrossi-triamcinolone acetonide, che è farmacologicamente inattivo, e gli acidi carbossilici C21 di triamcinolone acetonide e di 6ß-idrossi-triamcinolone acetonide. Un'idrolisi in triamcinolone non svolge pressoché alcun ruolo.
Eliminazione
Dopo un calo inizialmente rapido del livello plasmatico, l'eliminazione rallenta. Tenendo conto delle prime 4-6 ore, l'emivita di eliminazione è di 85-88 minuti.
I metaboliti vengono escreti principalmente tramite le feci.
L'emivita di eliminazione del triamcinolone acetonide attivo dopo somministrazione e.v. è di ca. 90 minuti.
Cinetica di gruppi di pazienti speciali
Funzionalità epatica
In caso di insufficienza epatica grave, il metabolismo dei glucocorticoidi è ritardato, pertanto gli effetti desiderati e indesiderati di Kenacort possono essere potenziati. Non sono disponibili dati sulla farmacocinetica di triamcinolone o triamcinolone acetonide in caso di insufficienza epatica da lieve a moderata.
Funzionalità renale
Non sono disponibili dati sulla farmacocinetica di triamcinolone o triamcinolone acetonide in pazienti con compromissione della funzionalità renale.
Pazienti anziani
La farmacocinetica di triamcinolone o di triamcinolone acetonide in pazienti di età ≥65 anni non è stata esaminata in modo specifico.
Bambini e adolescenti
I dati sulla farmacocinetica di triamcinolone o di triamcinolone acetonide nella popolazione pediatrica sono limitati. Nei neonati la clearance di triamcinolone è inferiore rispetto ai bambini e agli adulti.
Gravidanza
In gravidanza, l'emivita di eliminazione dei glucocorticoidi è prolungata.
Altre situazioni
- In caso di ipoalbuminemia e iperbilirubinemia, le concentrazioni di principio attivo non legato alle proteine (ovvero farmacologicamente attivo) possono aumentare a livelli indesiderati.
- In presenza di ipotiroidismo, il metabolismo dei glucocorticoidi è ritardato, pertanto gli effetti desiderati e indesiderati di Kenacort possono essere potenziati.
Dati preclinici
Mutagenicità
Non sono stati effettuati studi sul potenziale mutageno.
Non sono disponibili studi a lungo termine sugli animali che indichino un potenziale tumorigenico.
Tossicità per la riproduzione
Le proprietà embriotossiche di triamcinolone sono state esaminate in tre specie di roditori (ratto, topo, criceto), nel coniglio e in tre specie di primati non umani (scimmie rhesus, cappuccine, babbuini). Nei roditori e nel coniglio si sono verificati palatoschisi e disturbi della crescita intrauterina, con effetti teratogeni provocati, ad es. nel ratto, da dosi comprese nell'intervallo terapeutico per l'uomo. Nelle specie di scimmie è stato osservato un disturbo della formazione della cartilagine del condrocranio che ha causato anomalie craniche (encefalocele) e dismorfie del muso. Si sono verificate inoltre malformazioni del timo e disturbi della crescita intrauterina. Non sono disponibili esperienze sulla sicurezza di un utilizzo nell'uomo.
Altre indicazioni
Influenza su metodi diagnostici
Il test del nitroblu tetrazolio per le infezioni batteriche può restituire risultati falsi negativi sotto l'effetto dei glucocorticoidi.
I seguenti valori di laboratorio possono risultati più bassi: BSG, tempo di coagulazione (Lee White); livelli plasmatici di acido urico, potassio, TSH, tiroxina, T3, testosterone; valori urinari dei 17-chetosteroidi.
I seguenti valori di laboratorio possono risultati più alti: livelli plasmatici di sodio, cloruro, glucosio, colesterolo; valori urinari di calcio, creatinina, glucosio (in caso di predisposizione).
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni particolari concernenti l'immagazzinamento
Conservare a temperatura ambiente (15-25 °C) e fuori dalla portata dei bambini. Proteggere dalla luce.
I medicamenti parenterali devono essere ispezionati visivamente prima dell'uso. Si devono usare solo soluzioni limpide prive di particelle.
Numero dell'omologazione
38774 (Swissmedic)
Titolare dell’omologazione
Dermapharm AG, Hünenberg
Stato dell'informazione
Giugno 2020
Composition
Principe actif
Acétonide de triamcinolone, sous forme de 21-phosphate d’acétonide de triamcinolone, sel dipotassique.
Excipients
Citrate de sodium dihydraté, Macrogol 300, acide citrique et hydroxyde de sodium (pour ajustement du pH), eau pour préparations injectables.
Kenacort-A Solubile 10 mg, Solution injectable contient 0,80 mg de sodium par ampoule de 0,25 ml.
Kenacort-A Solubile 40 mg, Solution injectable contient 3,14 mg de sodium par ampoule de 1 ml.
Kenacort-A Solubile 80 mg, Solution injectable contient 6,28 mg de sodium par ampoule/seringue préremplie de 2 ml.
Forme pharmaceutique et quantité de principe actif par unité
1 ampoule OPC à 0,25 ml de solution injectable de Kenacort-A Solubile contient:
13,6 mg de 21-phosphate d'acétonide de triamcinolone, sel dipotassique
(= 10 mg d'acétonide de triamcinolone)
1 ampoule OPC à 1 ml de solution injectable de Kenacort-A Solubile contient: 54,4 mg de 21-phosphate d'acétonide de triamcinolone, sel dipotassique
(= 40 mg d'acétonide de triamcinolone)
1 ampoule OPC ou 1 seringue préremplie à 2 ml de solution injectable de Kenacort-A Solubile contient:
108,8 mg de 21-phosphate d'acétonide de triamcinolone, sel dipotassique
(= 80 mg d'acétonide de triamcinolone)
Indications/Possibilités d’emploi
Toutes les indications d'un traitement par glucocorticoïdes, lorsqu'un effet rapide est souhaité ou lorsqu'une administration orale n'est pas praticable.
Allergies sévères, réactions d'hypersensibilité aux médicaments, incompatibilités aux produits de contraste (aussi à titre prophylactique); œdèmes à risque vital tels que p.ex. œdème glottique, œdème de Quincke, œdème pulmonaire, œdème cérébral, apoplexie, choc cardiogénique, choc suite à des brûlures, choc traumatique, choc anaphylactique ou réactions anaphylactoïdes et choc par embolie pulmonaire, incidents de transfusion, dermatoses sévères aiguës, maladies du sang aiguës.
En cas de crise thyréotoxique ou de crise d'Addison, un corticoïde à activité minéralocorticotrope doit être administré en plus de Kenacort-A Solubile.
Posologie/Mode d’emploi
Indications
Kenacort-A Solubile est prêt à l'emploi et doit être injecté lentement par voie intraveineuse. En cas d'urgence, lorsqu'une injection intraveineuse n'est pas possible, une injection intramusculaire peut exceptionnellement être pratiquée. Par rapport à une administration intraveineuse, le début de l'effet sera cependant retardé; en cas de choc, l'effet sera incertain. L'injection intramusculaire peut être douloureuse et provoquer des irritations locales.
La posologie dépend de la sévérité du tableau clinique et de la réponse au traitement.
Les médicaments à usage parentéral doivent être inspectés visuellement avant utilisation. Seules les solutions limpides sans particules doivent être utilisées.
Posologie usuelle
Adultes
En général, 10 à 80 mg ou plus sont administrés une fois ou plusieurs fois par jour aux adultes.
Dans des situations graves aiguës, telles que p.ex. œdème de Quincke, allergie à des piqûres d'insectes, 80 à 160 mg ou plus sont administrés. En cas d'état de choc, 5 ml de Kenacort-A Solubile (200 mg) sont administrés dans un premier temps; une seconde injection peut être administrée 30 minutes plus tard.
En cas de situations constituant une menace vitale, p.ex. choc cardiocirculatoire, crise thyréotoxique ou crise d'Addison, l'administration intraveineuse de corticoïde ne constitue qu'une partie du traitement d'urgence. Des mesures supplémentaires nécessaires, telles que de l'adrénaline par voie i.v., une transfusion sanguine et une compensation des électrolytes, ainsi que le cas échéant des injections de désoxycorticostérone et une réanimation doivent simultanément être pratiquées.
Instructions posologiques particulières
Enfants et adolescents
L'utilisation chez l'enfant et l'adolescent n'est recommandée qu'en cas d'indication stricte (voir «Indications/Possibilités d'emploi») et doit être d'une durée la plus courte possible (voir «Mises en garde et précautions»).
Contre-indications
Hypersensibilité au 21-phosphate d'acétonide de triamcinolone ou à un autre composant; mycoses systémiques. En cas d'utilisation à court terme dans les situations d'urgence, il n'existe aucune contre-indication.
Kenacort-A Solubile ne doit pas être utilisé pour une administration systémique de longue durée dépassant un traitement d'urgence en présence des maladies suivantes: antécédents de troubles psychiatriques, Herpès simplex et Herpès zoster, en particulier Herpès cornea, varicelle et complications de vaccination récentes. Plus particulièrement, les enfants sous corticothérapie doivent être immunisés contre la varicelle et l'herpès (voir «Mises en garde et précautions»). Environ huit semaines avant et jusqu'à deux semaines après une vaccination préventive. Infections amibiennes, mycoses systémiques, ulcères gastro-duodénaux. Poliomyélite à l'exception de la forme bulbo-encéphalique, lymphomes suite à une vaccination BCG; ostéoporose, glaucome à angle fermé et à angle ouvert.
Mises en garde et précautions
Les éventuelles complications d'une corticothérapie dépendent de la posologie et de la durée du traitement. C'est pourquoi les bénéfices et les risques relatifs à la posologie et à la durée du traitement doivent être estimés individuellement (voir «Posologie/Mode d'emploi»).
Effets endocriniens
Chez les patients, qui sont en outre soumis à un stress inhabituel pendant la corticothérapie (p.ex. opération, traumatisme sévère, infection sévère), la dose de corticostéroïde doit être augmentée.
En raison du risque accru d'ostéoporose, un traitement systémique par des glucocorticoïdes ne doit être instauré chez les patientes ménopausées et les patients gériatriques qu'en cas d'indication stricte et seulement après une évaluation rigoureuse du rapport bénéfice/risque.
Effets immunosuppresseurs/Sensibilité accrue aux infections
En cas d'administration concomitante d'une substance utilisée dans le traitement du VIH, le cobicistat, qui est un inhibiteur puissant du CYP3A et de plusieurs protéines de transport, et de glucocorticoïdes, des cas d'intoxication aux stéroïdes allant jusqu'au syndrome de Cushing ont été rapportés. La triamcinolone ne doit donc être utilisée avec le cobicistat qu'après évaluation rigoureuse du rapport bénéfice/risque. Dans ce cas, le patient doit être étroitement surveillé pour détecter toute réaction indésirable potentielle aux stéroïdes. Le recours à un autre stéroïde dont le métabolisme est indépendant du CYP3A doit être envisagé.
L'utilisation de la triamcinolone en association avec d'autres inhibiteurs puissants du CYP3A4 nécessite également une prudence toute particulière. Le cas échéant, la dose de stéroïde doit être adaptée.
En présence de maladies infectieuses, le traitement par les corticoïdes doit être effectué sous couverture antibiotique suffisante.
Les patients sous corticothérapie ne doivent pas être vaccinés, afin d'éviter le risque de complications neurologiques et une réponse insuffisante à la vaccination.
Chez les patients présentant une tuberculose latente ou une réactivité à la tuberculine, une surveillance rigoureuse est nécessaire en cas d'indication justifiée aux corticostéroïdes, car la maladie tuberculeuse peut à nouveau se manifester lors d'un traitement par les corticostéroïdes. Lors d'un traitement à long terme, ces patients doivent recevoir une chimiothérapie. Kenacort-A Solubile ne peut être administré aux patients souffrant de tuberculose fulminante active ou de tuberculose miliaire qu'en association avec un traitement tuberculostatique approprié.
Les varicelles, qui apparaissent pendant un traitement systémique par les corticostéroïdes, peuvent évoluer de manière grave, voire létale, en particulier chez les enfants. Elles exigent un traitement immédiat, p.ex. par l'aciclovir i.v. Une prophylaxie par l'aciclovir ou une immunoprophylaxie passive par des immunoglobulines contre la varicelle-zona est indiquée chez les patients à risque.
Utilisation chez l'enfant
En raison du risque de fermeture épiphysaire prématurée, un traitement par les glucocorticoïdes à long terme chez l'enfant nécessite une évaluation particulièrement attentive du rapport bénéfice/risque.
Autres maladies où les corticostéroïdes doivent être utilisés avec une prudence toute particulière
Les corticostéroïdes doivent être administrés uniquement avec prudence en présence des maladies suivantes: antécédents d'ulcère, colite ulcéreuse non spécifique avec menace de perforation, abcès ou autre inflammation purulente, diverticulite, anastomose intestinale récente, tendance aux maladies thrombotiques ou thrombo-emboliques, insuffisance cardiaque sévère, carcinomes métastatiques, myasthénie, insuffisance rénale, glomérulonéphrite aiguë, néphrite chronique.
Information pour les diabétiques
Sous corticothérapie, un diabète sucré préexistant peut s'aggraver et un diabète latent peut se manifester. C'est pourquoi le métabolisme du glucose doit être régulièrement contrôlé.
Sodium
Ces médicaments contiennent moins de 1 mmol (23 mg) de sodium par ampoule ou seringues avec cône Luer prêtes à l’emploi, c.-à-d. qu’ils sont essentiellement «sans sodium».
Interactions
Il est recommandé de consulter également l'information professionnelle des médicaments administrés en concomitance.
Interactions pharmacocinétiques
Effet d'autres médicaments sur la pharmacocinétique de l'acétonide de triamcinolone
L'acétonide de triamcinolone est métabolisé principalement par la voie du CYP3A4. Son métabolisme peut donc être influencé de manière significative par des inducteurs et des inhibiteurs de cette enzyme.
Effet de l'acétonide de triamcinolone sur la pharmacocinétique d'autres médicaments
Les glucocorticoïdes peuvent aussi bien être des inducteurs que des inhibiteurs du CYP3A4 et par conséquent augmenter ou abaisser les concentrations plasmatiques d'autres substrats du CYP3A4. C'est le cas notamment de l'aprépitant, du fosaprépitant, de l'éthinylœstradiol, de la noréthistérone et des inhibiteurs de la protéase.
Lors d'une administration prolongée à hautes doses, les glucocorticoïdes peuvent accélérer l'élimination des salicylates et réduire ainsi leur efficacité. Inversement, une réduction de la dose de corticostéroïde peut renforcer la toxicité des salicylates.
Interactions pharmacodynamiques
Acide acétylsalicylique et anti-inflammatoires non stéroïdiens (NSAID)
L'effet ulcérogène de ces substances peut être renforcé.
Immunosuppresseurs
En raison de l'effet synergique d'autres immunosuppresseurs (tels que le méthotrexate), une dose de corticostéroïde plus faible peut être suffisante.
Anticholinergiques
L'atropine et d'autres anticholinergiques peuvent augmenter une pression intra-oculaire déjà élevée.
Sympathomimétiques
L'effet ainsi que potentiellement la toxicité du salbutamol sont augmentés.
Curares
Les corticostéroïdes peuvent influencer l'effet des curares non dépolarisants (pancuronium, vécuronium). Une antagonisation du bloc neuromusculaire a été observée, ainsi que des myopathies aiguës en cas d'administration concomitante de doses élevées.
Inhibiteurs de la cholinestérase
En cas d'administration concomitante d'acétonide de triamcinolone et d'inhibiteurs de la cholinestérase tels que la néostigmine ou la pyridostigmine, une crise de myasthénie peut survenir.
Anticoagulants
L'action de l'héparine ou des anticoagulants oraux peut être augmentée ou réduite. La coagulation sanguine doit être contrôlée et le cas échéant la dose d'anticoagulants adaptée.
Glycosides cardiaques
La toxicité des glycosides digitaliques est potentialisée par l'administration concomitante d'acétonide de triamcinolone.
Antidiabétiques
En raison de l'effet diabétogène des glucocorticoïdes, les taux de glucose doivent être surveillés chez les diabétiques. Le cas échéant, la posologie des antidiabétiques doit être adaptée.
Antihypertenseurs
L'effet antihypertenseur est partiellement diminué par l'activité minéralocorticoïde des corticoïdes, ce qui peut conduire à une pression artérielle élevée.
Médicaments influant sur la kaliémie
En cas d'administration de corticoïdes en association avec des médicaments qui augmentent l'élimination du potassium (p.ex. furosémide, hydrochlorothiazide, amphotéricine B, bêtasympathomimétiques ou dérivés de la xanthine), il existe un risque accru d'hypokaliémie. La kaliémie doit donc être surveillée et le cas échéant une substitution du potassium est indiquée.
Psychotropes
L'effet des anxiolytiques et des antipsychotiques peut être diminué. Le cas échéant, la dose de la substance active sur le SNC doit être adaptée.
Cytostatiques
L'efficacité du cyclophosphamide peut être réduite.
Vaccins
Les vaccins vivants, tels que les vaccins contre la poliomyélite, le BCG, les oreillons, la rougeole, la rubéole et la variole, peuvent avoir une toxicité accrue en raison de l'effet immunodépresseur des corticostéroïdes. Des infections virales disséminées peuvent survenir. Dans le cas des vaccins inactivés, la réponse vaccinale peut être réduite.
Inducteurs enzymatiques
En cas d'administration concomitante d'inducteurs du CYP3A4, le métabolisme de l'acétonide de triamcinolone est accéléré, ce qui peut réduire son efficacité. C'est le cas notamment pour les barbituriques, la carbamazépine, la phénytoïne, la primidone et la rifampicine, ainsi que pour les préparations à base de millepertuis (Hypericum perforatum). Une augmentation de la dose de triamcinolone peut être nécessaire dans ces cas.
Substrats du CYP3A4
L'administration concomitante d'autres substrats du CYP3A4 peut influer sur la clairance hépatique de l'acétonide de triamcinolone.
Inhibiteurs enzymatiques:
En cas d'administration concomitante d'inhibiteurs puissants ou modérés du CYP3A, le métabolisme de l'acétonide de triamcinolone est réduit, ce qui peut entraîner des effets indésirables accrus, voire les symptômes d'un syndrome de Cushing. C'est le cas par exemple pour le cobicistat (voir «Mises en garde et précautions»), les inhibiteurs de la protéase (surtout le ritonavir), les antifongiques azolés (itraconazole, voriconazole, posaconazole, fluconazole), les antibiotiques de types macrolides (clarithromycine, érythromycine), le diltiazem, l'isoniazide et le vérapamil.
De même, les hormones sexuelles (éthinylœstradiol, noréthistérone) peuvent influer sur la clairance des glucocorticoïdes. Les œstrogènes en particulier peuvent renforcer l'action des corticostéroïdes. À des doses thérapeutiques (p.ex. dans les contraceptifs hormonaux), une inhibition clinique significative des enzymes CYP par ces hormones sexuelles est cependant peu probable.
Interactions mutuelles
L'administration concomitante de 21-phosphate d'acétonide de triamcinolone et de cyclosporine entraîne une inhibition métabolique mutuelle. C'est pourquoi les effets indésirables des deux substances peuvent être renforcés. On observe en particulier une augmentation des convulsions.
Grossesse/Allaitement
Grossesse
Les études animales ont révélé des effets indésirables sur le fœtus (tératogénicité, embryotoxicité), et aucune étude contrôlée n'a été menée chez l'homme.
En cas de thérapie au long cours pendant la grossesse, on ne peut exclure notamment des troubles du développement intra-utérin, et en cas de traitement en fin de grossesse, il existe pour le fœtus un risque d'atrophie corticosurrénalienne.
Kenacort-A Solubile, comme tous les glucocorticoïdes, ne doit donc pas être utilisé pendant la grossesse, sauf en cas de nécessité absolue.
La patiente doit être instruite d'informer son médecin sans délai en cas de suspicion de grossesse ou de grossesse avérée.
Les nouveau-nés, dont les mères ont reçu un corticostéroïde à dose élevée pendant la grossesse, doivent être examinés attentivement pour rechercher des signes éventuels d'insuffisance corticosurrénalienne et pour déterminer la nécessité d'un traitement de substitution à doses régressives.
Allaitement
Comme l'acétonide de triamcinolone passe dans le lait maternel et peut altérer entre autres la fonction corticosurrénalienne et la croissance, il faut dans ce cas interrompre l'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée.
La prudence est de rigueur lors de la conduite de véhicules et l'utilisation de machines en raison d'effets indésirables tels que les vertiges.
Effets indésirables
Les effets indésirables ci-dessous sont caractéristiques des corticostéroïdes administrés par voie systémique et peuvent donc survenir également sous Kenacort-A Solubile. Ils dépendent de la dose et de la durée du traitement, ainsi que de l'âge, du sexe et de la maladie de base du patient.
Infections et infestations
Infections masquées, activation d'infections latentes, infections opportunistes.
Affections hématologiques et du système lymphatique
Vascularite, augmentation du risque de thrombose
Affections du système immunitaire
Réactions d'hypersensibilité y compris anaphylaxie, suppression des réactions aux tests cutanés.
Affections endocriniennes
Développement d'un état cushingoïde, blocage de l'axe hypophyso-surrénalien (pouvant persister jusqu'à un an ou plus et représentant un risque mettant en danger la vie du patient en situation de stress ou de surcharge émotionnelle), tolérance glucidique réduite (manifestation d'un diabète sucré latent, besoin accru en insuline ou en antidiabétiques oraux chez les diabétiques; voir également «Interactions»), inhibition de la croissance chez l'enfant.
Troubles du métabolisme et de la nutrition
Bilan azoté négatif dû au catabolisme protéique, rétention hydrosodée, perte potassique, alcalose hypokaliémique.
Affections psychiatriques
Insomnie, altérations psychiques (dépressions).
Affections du système nerveux
Augmentation de la pression intracrânienne avec œdème papillaire (pseudo-tumeur cérébrale), convulsions, accès de vertige, céphalées.
Affections oculaires
Cataracte subcapsulaire postérieure, augmentation de la pression intra-oculaire, glaucome, exophtalmie.
Affections cardiaques
Hypertension, insuffisance cardiaque chez les patients prédisposés
Affections gastro-intestinales
Ulcères peptiques, éventuellement associés à une hémorragie et une perforation, hémorragie gastrique, pancréatite, œsophagite, perforation intestinale.
Affections hépatobiliaires
Une augmentation de l'alanine-aminotransférase (ALT, SGPT), de l'aspartate-aminotransférase (AST, SGOT) et des phosphatases alcalines a été observée après un traitement par les corticostéroïdes. Ces modifications sont généralement mineures et ne sont pas associées à un syndrome clinique. Elles sont réversibles après l'arrêt du traitement.
Affections de la peau et du tissu sous-cutané
Cicatrisation retardée et/ou entravée, pétéchies et ecchymoses, peau fine et fragile.
Affections musculosquelettiques, du tissu conjonctif et des os
Myopathie due aux stéroïdes, atrophie musculaire, fortes arthralgies, ostéoporose, fractures pathologiques, fractures par tassement vertébral, nécrose osseuse aseptique.
Affections des organes de reproduction et du sein
Troubles de la menstruation.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
La toxicité aiguë des glucocorticoïdes est faible, et un surdosage aigu ou une intoxication au 21-phosphate d'acétonide de triamcinolone est peu probable en cas d'utilisation conforme aux instructions. Aucun antidote spécifique n'existe en cas de surdosage. Le cas échéant, un traitement symptomatique est indiqué.
Propriétés/Effets
Code ATC
H02AB08
Mécanisme d'action
Kenacort-A Solubile contient le sel dipotassique du 21-phosphate d'acétonide de triamcinolone, qui est soluble dans l'eau. Ce glucocorticoïde possède une faible activité minéralocorticoïde et peut être administré sous forme intraveineuse. Comme c'est le cas pour tous les glucocorticoïdes, l'effet du sel dipotassique du 21-phosphate d'acétonide de triamcinolone repose sur la stimulation, via le noyau cellulaire, de la synthèse de protéines spécifiques dans la cellule. Ces protéines sont en fait responsables des effets biologiques multiples qui permettent à l'organisme de s'adapter physiologiquement aux situations de stress. Certains effets thérapeutiques souhaités ne sont atteints qu'à des posologies élevées (pharmacologiques) non physiologiques. Ces effets comprennent en particulier les effets antiphlogistiques et immunosuppresseurs (anti-allergiques). En raison du mécanisme d'action, la pleine activité pharmacologique des glucocorticoïdes est différée (plusieurs heures après l'administration orale ou parentérale) et dure plus longtemps que le laisse prévoir la valeur de la demi-vie plasmatique.
La dose équivalente relative antiphlogistique, comparée aux autres glucocorticoïdes est la suivante: 10 mg d'acétonide de triamcinolone = 6 mg de bétaméthasone = 8 mg de dexaméthasone = 32 mg de méthylprednisolone = 40 mg de prednisone ou prednisolone = 200 mg de cortisone.
Pharmacodynamique
Efficacité clinique
Aucune donnée disponible.
Pharmacocinétique
Absorption
Après administration intraveineuse de Kenacort-A Solubile, le 21-phosphate d'acétonide de triamcinolone, sel dipotassique est hydrolysé en acétonide de triamcinolone pharmacodynamiquement actif en 2 minutes environ. Les concentrations plasmatiques maximales sont atteintes au cours des 5 premières minutes.
Distribution
La majeure partie de l'acétonide de triamcinolone se retrouve dans le plasma sous forme non liée aux protéines, et donc déjà sous forme active. La proportion liée aux protéines plasmatiques peut atteindre jusqu'à 80%.
L'acétonide de triamcinolone passe dans le lait maternel, mais on ignore s'il traverse la barrière placentaire ou la barrière hémato-encéphalique comme c'est le cas pour d'autres glucocorticoïdes.
Métabolisme
L'acétonide de triamcinolone est métabolisé principalement dans le foie, essentiellement par la voie de l'isoenzyme CYP3A4 du cytochrome P4450. Ses métabolites principaux sont le 6ß-hydroxy-triamcinolone-acétonide et les acides carboxyliques C21 de l'acétonide de triamcinolone et du 6ß-hydroxy-triamcinolone-acétonide. Une hydrolyse en triamcinolone ne joue quasiment aucun rôle.
Élimination
Après une chute initiale rapide du taux plasmatique, l'élimination ralentit. Au cours des premières 4 à 6 heures, la demi-vie d'élimination est de 85 - 88 minutes.
L'élimination des métabolites a principalement lieu par les fèces.
Suite à une administration i.v., la demi-vie d'élimination de l'acétonide de triamcinolone actif est d'environ 90 minutes.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
En cas d'insuffisance hépatique sévère, le métabolisme des glucocorticoïdes est ralenti, et les effets désirables et indésirables de Kenacort peuvent donc être renforcés. Aucune donnée n'est disponible sur la pharmacocinétique de la triamcinolone ou de l'acétonide de triamcinolone en cas d'insuffisance hépatique légère à modérée.
Troubles de la fonction rénale
Aucune donnée n'est disponible sur la pharmacocinétique de la triamcinolone ou de l'acétonide de triamcinolone chez les patients présentant une altération de la fonction rénale.
Patients âgés
La pharmacocinétique de la triamcinolone ou de l'acétonide de triamcinolone chez les patients ≥65 ans n'a pas été spécifiquement étudiée.
Enfants et adolescents
Les données sur la pharmacocinétique de la triamcinolone ou de l'acétonide de triamcinolone dans la population pédiatrique sont limitées. Chez le nouveau-né, la clairance de la triamcinolone est plus faible que chez l'enfant et l'adulte.
Grossesse
Pendant la grossesse, la demi-vie d'élimination des glucocorticoïdes est prolongée.
Autres situations
- En cas d'hypo-albuminémie et d'hyperbilirubinémie, les concentrations de la substance non liée aux protéines (c.-à-d. pharmacologiquement active) peuvent être anormalement élevées.
- En présence d'une hypothyréose, le métabolisme des glucocorticoïdes est ralenti, et les effets désirables et indésirables de Kenacort peuvent donc être renforcés.
Données précliniques
Mutagénicité
Aucune étude sur le potentiel mutagène n'a été menée. Aucune étude au long cours sur le potentiel cancérogène n'a été effectuée chez l'animal.
Toxicité sur la reproduction
Les propriétés embryotoxiques de la triamcinolone ont été étudiées chez 3 espèces de rongeurs (rat, souris, hamster), chez le lapin et chez 3 espèces de primates non humains (singe rhésus, babouin, capucin). Des fentes palatines et des troubles de la croissance intra-utérine sont apparus chez les rongeurs et le lapin, et les effets tératogènes chez le rat p.ex. ont été induits à des doses thérapeutiques humaines. Chez les espèces de singes, des troubles de la formation des cartilages du chondrocrâne ont été observés qui ont entraîné des anomalies du crâne (encéphalocèle) et des dysmorphies du visage. De plus, des malformations du thymus et des troubles de la croissance intra-utérine ont été observés. Aucune expérience sur la sécurité d'emploi chez l'être humain n'est disponible.
Remarques particulières
Influence sur les méthodes de diagnostic
Le test au nitro-bleu de tétrazole pour les infections bactériennes peut donner des résultats faussement négatifs dus à l'action des glucocorticoïdes.
Les paramètres suivants peuvent être diminués: VS, temps de coagulation (Lee White); taux plasmatique d'acide urique, potassium, TSH, thyroxine, T3, testostérone; taux urinaires de 17-cétostéroïdes.
Les paramètres suivants peuvent être augmentés: taux plasmatiques de sodium, chlorure, glucose, cholestérol; taux urinaires de calcium, créatinine, glucose (en cas de prédisposition).
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver à température ambiante (15–25 °C). Tenir hors de portée des enfants. À protéger de la lumière.
Les médicaments à usage parentéral doivent être inspectés visuellement avant utilisation. Seules les solutions limpides sans particules doivent être utilisées.
Numéro d’autorisation
38774 (Swissmedic)
Titulaire de l’autorisation
Dermapharm AG, Hünenberg.
Mise à jour de l’information
Juin 2020.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

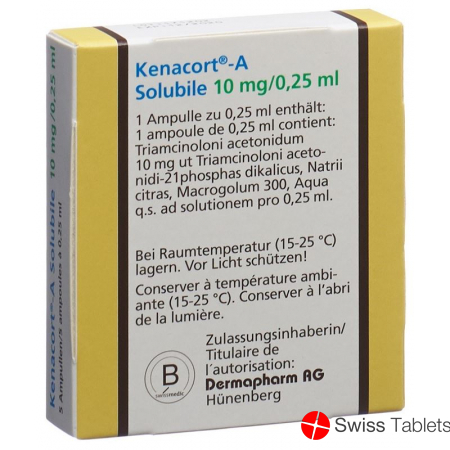

 Deutsch
Deutsch French
French Italian
Italian