Zolmitriptan Helvepharm Schmelztabletten 2.5mg 6 Stück buy online
Zolmitriptan Helvepharm Schmelztabl 2.5 mg 6 Stk
-
47.70 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: HELVEPHARM AG
- Product Code: 5404127
- ATC-code N02CC03
- EAN 7680616460028
Ingredients:
Aspartam, Vanillin, Butylhydroxyanisol (E320), Aromatica, Zolmitriptan 2.5 mg .

Variants
Description
Was ist Zolmitriptan Zentiva und wann wird es angewendet?
Zolmitriptan Zentiva gehört zu einer Gruppe von Arzneimitteln, die Serotonin-Agonisten genannt wird und auf Bereiche im Gehirn wirkt, die bei einem Migräneanfall betroffen sind. Zolmitriptan Zentiva lindert die migränebedingten Kopfschmerzen innerhalb einer Stunde und bessert andere Symptome wie Übelkeit, Erbrechen, Licht- und Lärmempfindlichkeit. Zolmitriptan Zentiva wird zur Behandlung von Migräneanfällen eingesetzt.
Zolmitriptan Zentiva darf nur auf Verschreibung und unter ständiger Kontrolle des Arztes oder der Ärztin eingenommen werden.
Wann darf Zolmitriptan Zentiva nicht angewendet werden?
Zolmitriptan Zentiva darf nicht eingenommen werden bei Überempfindlichkeit gegenüber dem Wirkstoff Zolmitriptan oder dem Süssstoff Aspartam, welcher in Zolmitriptan Zentiva Schmelztabletten enthalten ist oder gegenüber anderen Hilfsstoffen, bei unbehandeltem Bluthochdruck, nach einem Herzinfarkt oder bei bekannten Durchblutungsstörungen des Herzens (Angina pectoris), des Gehirns und der Gliedmassen.
Wann ist bei der Einnahme von Zolmitriptan Zentiva Vorsicht geboten?
Dieses Arzneimittel kann die Reaktionsfähigkeit, die Fahrtüchtigkeit und Fähigkeit, Werkzeuge oder Maschinen zu bedienen, beeinträchtigen!
Informieren Sie Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie an Krankheiten leiden wie z.B. Epilepsie, schwere Leber- und/oder Nierenfunktionsstörungen, Bluthochdruck oder Herzkrankheiten einschliesslich Angina pectoris, Herzinfarkt und Wolff-Parkinson-White-Syndrom.
Eine längere Anwendung von Schmerzmitteln jeder Art bei Kopfschmerzen kann diese verstärken. Ein übermässiger Gebrauch von Medikamenten sollte bei Patienten, die trotz (oder wegen) der regelmässigen Einnahme von Kopfschmerzmitteln häufig oder täglich Kopfschmerzen haben, in Betracht gezogen werden. Informieren Sie Ihren Arzt oder ihre Ärztin, eventuell muss die Behandlung in diesem Fall abgebrochen werden.
In seltenen Fällen kann eine lebensbedrohliche Erkrankung, ein sogenanntes «Serotonin-Syndrom» auftreten, wenn Triptane wie Zolmitriptan Zentiva zusammen mit anderen Arzneimitteln mit serotonerger Wirkung angewendet werden. Dazu gehören bestimmte Arzneimittel gegen Depressionen (z.B. sogenannte selektive Serotonin-Wiederaufnahme-Hemmer oder selektive Serotonin/Noradrenalin-Wiederaufnahme-Hemmer, sog. MAO-Hemmer, L-Tryptophan, Lithium, trizyklische Antidepressiva u.a.). Informieren Sie Ihren Arzt bzw. Ihre Ärztin, wenn Sie mit diesen Arzneimitteln behandelt werden. Das «Serotonin-Syndrom» kann folgende Symptome umfassen: Gesteigerte Erregbarkeit der Muskeleigenreflexe, Muskelzuckungen, Zittern, Unruhe, Angst, Halluzinationen, Reizbarkeit bis zum Verwirrtheitszustand und zur Bewusstlosigkeit, schneller Herzschlag, Blutdruckschwankungen, Übelkeit, Erbrechen, Fieber und Durchfall. Informieren Sie Ihren Arzt oder Ihre Ärztin, wenn nach Einnahme von Zolmitriptan Zentiva eines dieser Symptome auftritt.
Zolmitriptan Zentiva soll bei Kindern nicht angewendet werden, da keine Erfahrungen bei diesen Patienten vorliegen.
Die Wirksamkeit konnte bei Jugendlichen im Alter zwischen 12 und 17 Jahren nicht nachgewiesen werden. Daher soll Zolmitriptan Zentiva in dieser Altersgruppe nicht angewendet werden.
Zolmitriptan Zentiva soll nicht zur Vorbeugung von Migräne verwendet werden.
Sie sollten nach Einnahme von Zolmitriptan Zentiva innerhalb von 24 Stunden keine anderen Migränemedikamente, die ebenfalls zu der Gruppe der Serotonin-Agonisten gehören, anwenden.
Falls Sie ergotaminhaltige Medikamente einnehmen, sollten Sie 24 Stunden warten bevor Sie Zolmitriptan Zentiva einnehmen. Nach Einnahme von Zolmitriptan Zentiva sollten Sie innerhalb von 6 Stunden keine ergotaminhaltigen Medikamente einnehmen.
Bei gleichzeitiger Anwendung von Triptanen und pflanzlichen Zubereitungen, die Johanniskraut enthalten (Hypericum perforatum), können unerwünschte Wirkungen häufiger auftreten.
Die Zolmitriptan Zentiva Schmelztabletten enthalten 2.5 mg Aspartam pro Schmelztablette. Aspartam ist eine Quelle für Phenylalanin. Es kann schädlich sein, wenn Sie eine Phenylketonurie (PKU) haben, eine seltene angeborene Erkrankung, bei der sich Phenylalanin anreichert, weil der Körper es nicht ausreichend abbauen kann.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Schmelztablette, d.h. es ist nahezu «natriumfrei».
Informieren Sie auch Ihren Arzt oder Apotheker bzw. Ihre Ärztin oder Apothekerin, wenn Sie an anderen Krankheiten leiden, Allergien haben oder andere Arzneimittel (auch selbst gekaufte!) einnehmen!
Darf Zolmitriptan Zentiva während einer Schwangerschaft oder in der Stillzeit eingenommen werden?
Wenn Sie schwanger sind, es werden möchten oder wenn Sie Ihr Kind stillen, sollten Sie Zolmitriptan Zentiva nur nach Rücksprache mit Ihrem Arzt oder Ihrer Ärztin anwenden.
Wie verwenden Sie Zolmitriptan Zentiva?
Falls Ihr Arzt oder Ihre Ärztin es nicht anders verordnet hat, gelten für Erwachsene folgende Dosierungsrichtlinien:
Bei einem akuten Migräneanfall 1 Schmelztablette auf der Zunge zergehen lassen. Zolmitriptan Zentiva wirkt unabhängig davon, wann Sie die Tablette während des Anfalls einnehmen. Es ist jedoch ratsam, Zolmitriptan Zentiva so früh wie möglich nach dem Auftreten der Migränekopfschmerzen einzunehmen. Falls Sie nach 2 Stunden immer noch starke Migränekopfschmerzen haben, oder wenn die Migräne innerhalb von 24 Stunden erneut auftritt, nehmen Sie eine weitere Schmelztablette ein.
Haben Sie einmal mehr Zolmitriptan Zentiva als vorgeschrieben eingenommen, kontaktieren Sie Ihren Arzt bzw. Ihre Ärztin oder suchen Sie das nächste Krankenhaus auf.
Innerhalb von 24 Stunden sollten nicht mehr als 4 Schmelztabletten eingenommen werden.
Zolmitriptan Zentiva soll bei Kindern und Jugendlichen unter 18 Jahren nicht angewendet werden, da die Sicherheit und Wirksamkeit bei dieser Patientengruppe nicht nachgewiesen ist.
Art der Einnahme von Zolmitriptan Zentiva
Zolmitriptan Zentiva Schmelztablette ist eine schnell schmelzende Tablette. Sie wird auf die Zunge gelegt, worauf sie sich sofort auflöst und dann mit dem Speichel geschluckt wird. Flüssigkeitszufuhr ist für die Einnahme der Zolmitriptan Zentiva Schmelztabletten nicht notwendig.
Die Zolmitriptan Zentiva Schmelztablette auf der Zunge zergehen lassen.
Zolmitriptan Zentiva Schmelztablette eignet sich für Patienten, die unter Übelkeit leiden bzw. während einer Migräne nicht in der Lage sind, Flüssigkeit zu sich zu nehmen oder Schwierigkeiten beim Schlucken von normalen Tabletten haben.
Ändern Sie nicht von sich aus die verschriebene Dosierung. Wenn Sie glauben, das Arzneimittel wirke zu schwach oder zu stark, so sprechen Sie mit Ihrem Arzt oder Apotheker bzw. mit Ihrer Ärztin oder Apothekerin.
Welche Nebenwirkungen kann Zolmitriptan Zentiva haben?
Häufig wurden Kopfschmerzen, Schläfrigkeit, Schwindel, Herzklopfen, Wärmegefühl, Kribbeln in den Fingern und Zehen, gesteigerte Berührungsempfindlichkeit, Schwächegefühl, Muskelschmerzen, Bauchschmerzen, Übelkeit, Erbrechen, trockener Mund, Schluckstörungen, ein Gefühl von Beengung, Schwere, Schmerz oder Druck im Brust-Halsbereich oder in den Gliedmassen beobachtet. Gelegentlich wurde über vermehrte und/oder häufigere Harnausscheidung, Herzrasen und vorübergehenden Blutdruckanstieg berichtet.
Selten können allergische Reaktionen (Nesselsucht, Schwellungen der Haut, Schleimhaut und der inneren Organe) auftreten.
Sehr selten wurden vorübergehende Verengungen der Herzgefässe, Herzinfarkt, blutiger Durchfall, häufiger Harndrang, Milzinfarkt und Darminfarkt beobachtet.Falls Sie eine dieser Nebenwirkungen feststellen, ist es wichtig, dass Sie sich unverzüglich an Ihren Arzt oder Ihre Ärztin wenden.
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker bzw. Ihre Ärztin, Apothekerin. Dies gilt insbesondere auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Was ist ferner zu beachten?
Bewahren Sie Zolmitriptan Zentiva in der Originalverpackung nicht über 30 °C und ausserhalb der Reichweite von Kindern auf.
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Weitere Auskünfte erteilt Ihnen Ihr Arzt oder Apotheker bzw. Ärztin oder Apothekerin. Diese Personen verfügen über die ausführliche Fachinformation.
Was ist in Zolmitriptan Zentiva enthalten?
Wirkstoffe
Zolmitriptan Zentiva Schmelztabletten enthalten als Wirkstoff 2,5 mg Zolmitriptan.
Hilfsstoffe
Mannitol, mikrokristalline Cellulose, Croscarmellose-Natrium, hochdisperses Siliciumdioxid, Magnesiumstearat, Aspartam (E 951), Orangenaroma.
Zulassungsnummer
61646 (Swissmedic).
Wo erhalten Sie Zolmitriptan Zentiva? Welche Packungen sind erhältlich?
In Apotheken nur gegen ärztliche Verschreibung.
Zolmitriptan Zentiva Schmelztabletten zu 2,5 mg in Packungen zu 3, 6 und 12 Schmelztabletten.
Zulassungsinhaberin
Helvepharm AG, Frauenfeld.
Diese Packungsbeilage wurde im April 2020 letztmals durch die Arzneimittelbehörde (Swissmedic) geprüft.
Qu'est-ce que Zolmitriptan Zentiva et quand doit-il être utilisé?
Zolmitriptan Zentiva appartient à un groupe de médicaments appelés «agonistes de la sérotonine» et il agit sur les régions du cerveau qui sont touchées lors d'une crise de migraine. Zolmitriptan Zentiva soulage en l'espace d'une heure les maux de tête dus à une migraine et il améliore les autres symptômes tels que nausées, vomissements, intolérance à la lumière et intolérance au bruit. Zolmitriptan Zentiva est utilisé pour le traitement des crises migraineuses.
Zolmitriptan Zentiva ne doit être pris que sur prescription médicale et sous surveillance permanente d'un médecin.
Quand Zolmitriptan Zentiva ne doit-il pas être utilisé?
Il ne faut pas prendre Zolmitriptan Zentiva en cas d'hypersensibilité au principe actif (zolmitriptan) ou à l'édulcorant (aspartam) contenu dans Zolmitriptan Zentiva comprimés orodispersibles ou aux autres excipients, en cas d'hypertension artérielle non traitée, après un infarctus du myocarde ou s'il existe des troubles avérés de l'irrigation du coeur (angine de poitrine), du cerveau et des membres.
Quelles sont les précautions à observer lors de la prise de Zolmitriptan Zentiva?
Ce médicament peut affecter les réactions, l'aptitude à la conduite et l'aptitude à utiliser des outils ou des machines!
Si vous souffrez de maladies telles que par exemple épilepsie, perturbations graves de la fonction du foie et/ou des reins, hypertension artérielle ou maladies cardiaques, notamment angine de poitrine, infarctus du myocarde et syndrome de Wolff-Parkinson-White, signalez-le à votre médecin ou à votre pharmacien.
L'utilisation prolongée de tout type de traitement antalgique pour soulager des céphalées peut entraîner une aggravation de celles-ci. Si une telle aggravation apparait ou est suspectée, un avis médical est nécessaire et le traitement doit être interrompu. Le diagnostic de céphalée par abus médicamenteux doit être suspecté chez les patients présentant des céphalées fréquentes ou quotidiennes malgré (ou à cause de) l'utilisation régulière de médicaments contre les céphalées.
Dans des rares cas, une maladie potentiellement mortelle, un syndrome appelé «syndrome sérotoninergique» peut apparaître lorsqu'un triptane comme Zolmitriptan Zentiva est administré en même temps que d'autres médicaments à effet sérotoninergique. Parmi ces médicaments se trouvent entre autres certains médicaments contre la dépression (par ex. les médicaments appelés inhibiteurs sélectifs de la recapture de la sérotonine ou inhibiteurs sélectifs de la recapture de la sérotonine/noradrénaline, les médicaments appelés inhibiteurs de la MAO, le L-tryptophane, le lithium, les antidépresseurs tricycliques). Veuillez informer votre médecin si vous suivez un traitement par ces médicaments. Le «syndrome sérotoninergique» peut inclure les symptômes suivants: accentuation de l'excitabilité des réflexes musculaires proprioceptifs, tressaillements musculaires, tremblements, agitation, anxiété, hallucinations, irritabilité allant jusqu'à l'état confusionnel et à la perte de connaissance, accélération du rythme cardiaque, fluctuations de la tension artérielle, nausée, vomissements, fièvre et diarrhée. Veuillez informer votre médecin si l'un de ces symptômes devait apparaître après l'administration de Zolmitriptan Zentiva.
Il ne faut pas donner Zolmitriptan Zentiva aux enfants, car on n'a pas l'expérience de ce médicament chez ces patients. L'efficacité n'est pas démontrée chez les adolescents de 12 à 17 ans. Par conséquent, Zolmitriptan Zentiva ne doit pas être utilisé chez ce groupe de patients.
Il ne faut pas employer Zolmitriptan Zentiva pour la prévention de la migraine.
Dans les 24 heures suivant la prise de Zolmitriptan Zentiva, vous ne devez pas utiliser d'autres antimigraineux appartenant également à la classe des agonistes de la sérotonine.
Si vous prenez des médicaments contenant de l'ergotamine, vous devez attendre 24 heures avant de prendre Zolmitriptan Zentiva. Inversement, il ne faut pas prendre de médicaments contenant de l'ergotamine dans les 6 heures suivant la prise de Zolmitriptan Zentiva.
La fréquence des effets indésirables peut être augmentée lors de l'utilisation concomitante de triptans et de préparations contenant du millepertuis (Hypericum perforatum).
Les comprimés orodispersibles Zolmitriptan Zentiva contient 2,5 mg d'aspartam par comprimé orodispersible. L'aspartam contient une source de phénylalanine. Peut être dangereux pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l'accumulation de phénylalanine ne pouvant être éliminée correctement.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé orodispersible, c.-à-d. qu'il est essentiellement «sans sodium».
Veuillez aussi informer votre médecin ou votre pharmacien si vous souffrez d'une autre maladie, vous êtes allergique, vous prenez déjà d'autres médicaments (même en automédication)!
Zolmitriptan Zentiva peut-il être pris pendant la grossesse ou l'allaitement?
Si vous êtes enceinte, si vous souhaitez une grossesse ou si vous allaitez votre enfant, vous ne devez prendre Zolmitriptan Zentiva qu'avec l'accord de votre médecin.
Comment utiliser Zolmitriptan Zentiva?
Sauf prescription contraire du médecin, les posologies recommandées pour les adultes sont les suivantes:
En cas de crise migraineuse aiguë, faire fondre un comprimé orodispersibles sur la langue. Zolmitriptan Zentiva est efficace indépendamment de la phase de la crise migraineuse à laquelle vous le prenez. Il est toutefois préférable de le prendre aussi rapidement que possible après l'apparition des douleurs migraineuses. Si vous présentez encore de violents maux de tête deux heures plus tard ou si la migraine réapparaît dans les 24 heures, reprenez un comprimé orodispersibles.
Si vous avez pris Zolmitriptan Zentiva à une dose dépassant la dose prescrite, consultez votre médecin ou l'hôpital le plus proche.
Vous ne devez pas prendre plus de 4 comprimés orodispersibles en l'espace de 24 heures.
Zolmitriptan Zentiva ne doit pas être utilisé chez les enfants et les adolescents de moins de 18 ans, étant donné que la sécurité et l'efficacité ne sont pas démontrées chez ce groupe de patients.
Mode d'emploi de Zolmitriptan Zentiva
Les comprimés orodispersibles de Zolmitriptan Zentiva se dissolvent rapidement. Le patient place le comprimé sur la langue, après quoi celui-ci se dissout immédiatement et est ensuite dégluti avec la salive. Il est inutile de prendre du liquide en même temps que les comprimés orodispersibles de Zolmitriptan Zentiva.
Faire fondre le comprimé orodispersible de Zolmitriptan Zentiva sur la langue.
Zolmitriptan Zentiva comprimés orodispersibles convient bien pour les patients qui souffrent de nausées, qui ne sont pas en mesure de prendre du liquide pendant une migraine ou qui ont des difficultés pour déglutir les comprimés classiques.
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires Zolmitriptan Zentiva peut-il provoquer?
Des manifestations comme céphalées, somnolence, vertige, palpitations, sensation de chaleur, fourmillements dans les doigts et les orteils, sensation accrue au toucher, sensation de faiblesse, douleurs musculaires, douleurs abdominales, nausées, vomissements, sécheresse buccale, des troubles de la déglutition, sensation d'oppression, de lourdeur, douleur ou oppression au niveau du thorax et du cou ou dans les membres ont été fréquemment observées. On a rapporté occasionnellement des mictions accrues et/ou plus fréquentes, un rythme cardiaque accéléré et une montée transitoire de la tension artérielle.
Dans des rares cas, réaction allergique (urticaire, gonflement de la peau, des muqueuses et d'organes internes), peuvent apparaître.
Dans des cas très rares, un rétrécissement transitoire des vaisseaux cardiaques, un infarctus du myocarde, une diarrhée sanguinolente, un besoin fréquent d'uriner, un infarctus de la rate et un infarctus de I'intestin ont été observés. Si vous constatez un de ces effets secondaires, il est important que vous consultiez immédiatement votre médecin.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou votre pharmacien. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
À quoi faut-il encore faire attention?
Conservez Zolmitriptan Zentiva dans l'emballage d'origine et à une température ne dépassant pas 30 °C. Tenir hors de la portée des enfants.
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien, qui disposent d'une information détaillée destinée aux professionnels.
Que contient Zolmitriptan Zentiva?
Principes actifs
Les comprimés orodispersibles de Zolmitriptan Zentiva contiennent 2,5 mg de zolmitriptan comme principe actif.
Excipients
Mannitol, cellulose microcristalline, croscarmellose sodique, silice colloïdale anhydre, stéarate de magnésium, aspartam (E951), arôme orange.
Numéro d'autorisation
61646 (Swissmedic).
Où obtenez-vous Zolmitriptan Zentiva? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Zolmitriptan Zentiva comprimés orodispersibles à 2,5 mg: Boîtes de 3, 6 et 12 comprimés orodispersibles
Titulaire de l'autorisation
Helvepharm AG, Frauenfeld.
Cette notice d'emballage a été vérifiée pour la dernière fois en avril 2020 par l'autorité de contrôle des médicaments (Swissmedic).
Che cos'è Zolmitriptan Zentiva e quando si usa?
Zolmitriptan Zentiva appartiene ad un gruppo di medicamenti chiamati agonisti della serotonina, che agiscono in ambiti del cervello interessati in caso di crisi emicraniche. Nel giro di un'ora Zolmitriptan Zentiva allevia le cefalee dovute all'emicrania e migliora altri sintomi quali nausea, vomito, sensibilità alla luce ed al rumore. Zolmitriptan Zentiva si usa per curare le crisi emicraniche. Zolmitriptan Zentiva si può usare solo su prescrizione e sotto il continuo controllo del medico.
Quando non si può assumere Zolmitriptan Zentiva?
Zolmitriptan Zentiva non deve essere assunto in caso di ipersensibilità al principio attivo zolmitriptan o all'edulcorante aspartame, che è contenuto in Zolmitriptan Zentiva compresse orodispersibili, o ad uno degli altri eccipienti, in caso di ipertensione arteriosa non trattata, dopo un infarto cardiaco o in presenza di disturbi conosciuti dell'irrorazione sanguigna del cuore (angina pectoris), del cervello e degli arti.
Quando è richiesta prudenza nella somministrazione di Zolmitriptan Zentiva?
Questo medicamento può ridurre la capacità di reazione, la capacità di condurre un veicolo e la capacità di utilizzare attrezzi o macchine!
Informi il medico o il farmacista se soffre di malattie quali ad esempio epilessia, gravi disfunzioni del fegato e/o dei reni, ipertensione arteriosa o malattie del cuore comprese l'angina pectoris, l'infarto cardiaco e la sindrome di Wolff-Parkinson-White.
L'uso prolungato di qualsiasi antidolorifico per il trattamento della cefalea può peggiorare la situazione. Se questa situazione si verifica o si sospetta, occorre consultare il medico e sospendere il trattamento. La diagnosi di cefalea da abuso di farmaci deve essere sospettata nei pazienti che hanno cefalea frequente o quotidiana malgrado (o a causa di) uso regolare di farmaci per il trattamento della cefalea.
In rari casi, può comparire una malattia potenzialmente fatale, una cosiddetta «sindrome da serotonina», quando i triptani come Zolmitriptan Zentiva vengono utilizzati in combinazione con altri farmaci serotoninergici. Di questi fanno parte determinati medicamenti contro la depressione (p.es. i cosiddetti inibitori selettivi della ricaptazione della serotonina o gli inibitori selettivi della ricaptazione della serotonina/noradrenalina, i cosiddetti MAO-inibitori, L-triptofano, il litio, gli antidepressivi triciclici). Informi il suo medico se Lei è in terapia con questi medicamenti. La «sindrome da serotonina» può comprendere i seguenti sintomi: aumentata eccitabilità dei riflessi muscolari propriocettivi, spasmi muscolari, tremore, agitazione, ansia, allucinazioni, irritabilità fino a stati confusionali ed a perdita di conoscenza, battito cardiaco accelerato, oscillazioni della pressione arteriosa, nausea, vomito, febbre e diarrea. Informi il suo medico, se dopo l'assunzione di Zolmitriptan Zentiva compare uno di questi sintomi.
Zolmitriptan Zentiva non deve essere usato nei bambini perché non si dispone di esperienze riguardanti pazienti in questa fascia d'età. Negli adolescenti di età compresa fra i 12 e i 17 anni non è stato possibile stabilire l'efficacia di Zolmitriptan Zentiva e pertanto Zolmitriptan Zentiva non deve essere usato in questa fascia di età.
Zolmitriptan Zentiva non va usato per la prevenzione dell'emicrania.
Nelle 24 ore successive all'assunzione di Zolmitriptan Zentiva non deve usare nessun altro medicamento contro l'emicrania appartenente al gruppo degli agonisti della serotonina.
Se prende dei medicamenti contenenti ergotamina aspetti 24 ore prima di assumere Zolmitriptan Zentiva. Dopo aver preso Zolmitriptan Zentiva, per 6 ore non prenda farmaci contenenti ergotamina.
Gli effetti indesiderati possono essere più comuni durante l'uso concomitante di triptani e preparati erbali contenenti l'erba di San Giovanni (Hypericum perforatum).
Le Zolmitriptan Zentiva compresse orodispersibile contiene 2,5 mg di aspartame per compressa orodispersibile. Aspartame è una fonte di fenilalanina. Può esserle dannosoa se è affetto da fenilchetonuria, una rara malattia genetica che causa l'accumulo di fenilalanina perché il corpo non riesce a smaltirla correttamente.
Questo medicamento contiene meno di 1 mmol (23 mg) di sodio per compressa orodispersibile, cioè essenzialmente «senza sodio».
Informi il suo medico o il suo farmacista nel caso in coi: soffre di altre malattie, soffre di allergie o assume altri medicamenti (anche se acquistati di sua iniziativa)!
Si può assumere Zolmitriptan Zentiva durante la gravidanza o l'allattamento?
Se è incinta, prevede una gravidanza oppure allatta può prendere Zolmitriptan Zentiva solo dopo aver consultato il suo medico.
Come usare Zolmitriptan Zentiva?
Salvo diversa prescrizione del suo medico, per gli adulti valgono le seguenti linee guida posologiche:
In caso di attacco emicranico acuto lasciare sciogliere sulla lingua 1 compressa orodispersibile. Zolmitriptan Zentiva agisce indipendentemente dal momento in cui lo prende durante la crisi. È però consigliabile impiegare Zolmitriptan Zentiva il più presto possibile dopo che si è manifestata la cefalea emicranica. Se dopo 2 ore ha ancora forti cefalee emicraniche o se I'emicrania ricompare entro 24 ore prenda un'altra compressa orodispersibile.
Se le accade di aver assunto più Zolmitriptan Zentiva di quanto prescritto prenda contatto col suo medico o si rechi all'ospedale più vicino.
Non più di 4 compresse orodispersibile possono essere prese nelle 24 ore.
Zolmitriptan Zentiva non deve essere usato in bambini e adolescenti al di sotto di 18 anni, poiche in questo gruppo di pazienti non sono state stabilite la sua sicurezza e la sua efficacia.
Come assumere Zolmitriptan Zentiva
Zolmitriptan Zentiva compresse orodispersibili è una compressa che si scioglie velocemente. Viene messa sulla lingua dove si scioglie immediatamente e in seguito viene deglutita con la saliva. Per le Zolmitriptan Zentiva compresse orodispersibili non è necessario un apporto di liquidi.
Lasciare sciogliere la compressa Zolmitriptan Zentiva compresse orodispersibili sulla lingua.
Zolmitriptan Zentiva compresse orodispersibili è indicato per i pazienti che soffrono di nausea e per coloro che durante una crisi emicranica non sono in grado di assumere liquidi oppure che hanno difficoltà a deglutire le compresse normali.
Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che I'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
Quali effetti collaterali può avere Zolmitriptan Zentiva?
Frequentemente sono stati osservati mal di testa, sonnolenza, vertigini, palpitazioni cardiache, sensazione di calore, formicolii nelle dita delle mani e dei piedi, aumentata sensibilità al contatto, debolezza generale, dolori muscolari, dolori addominali, nausea, vomito, secchezza della bocca, disturbi della deglutizione, sensazione di costrizione, pesantezza, dolore o pressione nella zona del petto e del collo o negli arti.
Occasionalmente sono stati osservati aumento del flusso di urina, tachicardia e aumento passeggero della pressione sanguigna.
Raramente possono apparire reazioni allergiche (orticaria e gonfiori a livello di cute, mucose e organi interni).
In casi molto rari sono stati osservati un restringimento passeggero dei vasi sanguigni cardiaci, un infarto del miocardio, una diarrea sanguinolenta, un bisogno di urinare frequente, un infarto alla milza e all'intestino.
Se osserva uno di questi effetti collaterali, è importante che consulti immediatamente il suo medico. Se osserva effetti collaterali, si rivolga al suo medico o farmacista, soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Di che altro occorre tener conto?
Conservi Zolmitriptan Zentiva nella confezione originale, a temperatura non superiore a 30 °C e fuori dalla portata dei bambini.
II medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
II medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Cosa contiene Zolmitriptan Zentiva?
Principi attivi
Zolmitriptan Zentiva compresse orodispersibili contengono come principio attivo 2,5 mg di zolmitriptan.
Sostanze ausiliarie
Mannitolo, cellulosa microcristallina, croscermellosa sodica, silice colloidale anidra, magnesio stearato, aspartame (E951), aroma d' arancia.
Numero dell'omologazione
61646 (Swissmedic).
Dov'è ottenibile Zolmitriptan Zentiva? Quali confezioni sono disponibili?
In farmacia, dietro presentazione della prescrizione medica.
Zolmitriptan Zentiva compresse orodispersibili da 2,5 mg in confezioni da 3, 6 e 12 compresse orodispersibili.
Titolare dell'omologazione
Helvepharm AG, Frauenfeld.
Questo foglietto illustrativo è stato controllato l'ultima volta nel aprile 2020 dall'autorità competente in materia di medicamenti (Swissmedic).
Zusammensetzung
Wirkstoff: Zolmitriptanum.
Hilfsstoffe
Mannitolum, Cellulosum microcristallinum, Aspartamum (E 951) 2.5 mg, Aromatica (Orange), Carmellosum natricum conexum corresp. Natrium 0.935 mg, Silica colloidalis anhydrica, Magnesii stearas.
Darreichungsform und Wirkstoffmenge pro Einheit
1 Zolmitriptan Zentiva Schmelztablette enthält 2,5 mg Zolmitriptanum.
Indikationen/Anwendungsmöglichkeiten
Akutbehandlung von Migräneanfällen mit oder ohne Aura.
Dosierung/Anwendung
Zolmitriptan Zentiva Schmelztablette ist eine schnell schmelzende Tablette, welche mit dem Speichel geschluckt wird. Das Trinken von Wasser ist bei der Einnahme von Zolmitriptan Zentiva Schmelztabletten nicht notwendig.
Zolmitriptan Zentiva Schmelztabletten sind geeignet, wenn kein Wasser zur Verfügung steht und erlauben somit jederzeit eine frühe Einnahme bei einer Migräneattacke. Zolmitriptan Zentiva Schmelztabletten ist auch für Patienten geeignet, die an Übelkeit leiden und während einer Migräne nicht in der Lage sind, Flüssigkeiten zu sich zu nehmen oder mit dem Schlucken von konventionellen Filmtabletten Schwierigkeiten haben.
Die Zolmitriptan Zentiva Schmelztabletten auf der Zunge zergehen lassen.
Erwachsene
Die empfohlene Dosis von Zolmitriptan Zentiva zur Behandlung eines Migräneanfalls ist 2,5 mg.
Falls die Symptome persistieren oder innerhalb von 24 Stunden wieder auftreten, kann eine zweite Dosis wirksam sein. Diese darf frühestens 2 Stunden nach der Initialdosis eingenommen werden.
Eine deutliche Wirkung manifestiert sich 1 Stunde nach Verabreichung.
Die Wirkung von Zolmitriptan Zentiva ist grundsätzlich unabhängig vom Einnahmezeitpunkt während des Anfalls. Es ist jedoch ratsam, Zolmitriptan Zentiva so früh wie möglich nach dem Auftreten der Migränekopfschmerzen einzunehmen.
Innerhalb von 24 Stunden dürfen nicht mehr als 10 mg (= 4 Schmelztabletten) eingenommen werden.
Maximale Einzeldosis: 1 Tablette.
Zolmitriptan Zentiva wirkt auch bei Migräneanfällen im Zusammenhang mit hormonellen Veränderungen während der Menstruation.
Zolmitriptan Zentiva ist nicht indiziert für die Migräneprophylaxe.
Die Wirksamkeit von Zolmitriptan Zentiva wird nicht von Geschlecht, Alter (siehe nachfolgend «Kinder» und «Ältere Patienten»), Anfallsdauer, Nausea, welche vor der Behandlung vorliegt, oder von zusätzlichen Migräneprophylaktika beeinträchtigt.
Kinder (<12 Jahre)
Es sind keine Daten zur Anwendung von Zolmitriptan bei Kindern verfügbar. Zolmitriptan Zentiva soll in dieser Altersgruppe nicht angewendet werden.
Jugendliche (12–17 Jahre)
Die Wirksamkeit von Zolmitriptan bei Patienten zwischen 12 und 17 Jahren konnte in einer placebokontrollierten klinischen Studie nicht nachgewiesen werden. Daher soll Zolmitriptan Zentiva in dieser Altersgruppe nicht angewendet werden.
Ältere Patienten
Die Sicherheit und Wirksamkeit von Zolmitriptan bei Patienten über 65 Jahren ist nicht systematisch untersucht worden.
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit leichter oder mässiger Leberinsuffizienz ist eine Dosisanpassung nicht erforderlich (siehe «Pharmakokinetik»). Bei Patienten mit schwerer Leberinsuffizienz wird eine maximale Dosis von 5 mg innerhalb von 24 Stunden empfohlen.
Patienten mit eingeschränkter Nierenfunktion
Bei Patienten mit einer Kreatinin Clearance >15 ml/min (siehe «Pharmakokinetik») ist keine Dosisanpassung notwendig.
Kontraindikationen
Zolmitriptan Zentiva ist bei Patienten mit bekannter Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung des Medikamentes kontraindiziert.
Zolmitriptan Zentiva soll nicht zur Behandlung von hemiplegischer oder Basiliaris-Migräne verwendet werden.
Zolmitriptan Zentiva ist bei Patienten mit folgender Anamnese kontraindiziert:
Bei ischämischen Herzerkrankungen, Myokardinfarkt in der Vorgeschichte, koronaren Vasospasmen (Prinzmetal-Angina) oder unzureichend eingestellter Hypertonie.
Warnhinweise und Vorsichtsmassnahmen
Zolmitriptan Zentiva soll nur bei klar diagnostizierter Migräne eingesetzt werden.
Wie bei anderen Therapien der akuten Migräne sollten bei Patienten, bei welchen vorher noch nie eine Migräne diagnostiziert wurde und bei Migränikern mit atypischen Symptomen andere potentiell schwere neurologische Leiden vor der Verabreichung von Zolmitriptan Zentiva ausgeschlossen werden. Es gibt Berichte von Patienten, denen ein 5HT1B/1D-Agonist zur Behandlung von schweren Kopfschmerzen verabreicht wurde, die sich später als Begleiterscheinung einer sich entwickelnden neurologischen Schädigung (Hirndurchblutungsstörungen, Subarachnoidalblutung) erwiesen. Diesbezüglich sollte beachtet werden, dass bei Migränikern ein erhöhtes Risiko für gewisse zerebrovaskuläre Erkrankungen wie z.B. Hirndurchblutungsstörungen, CVA (Cerebrovascular accident), TIA (transitorische ischämische Attacke), zerebrale oder subarachnoidale Blutungen bestehen kann.
Wenn der Patient auf die erste Behandlung mit der Normaldosierung nicht anspricht, sollte die Diagnose erneut überprüft werden bevor eine 2. Dosis verabreicht wird.
Wie andere 5HT1B/1D-Agonisten sollte Zolmitriptan Zentiva nur mit Vorsicht an Patienten verabreicht werden, welche in ihrer Anamnese Epilepsie oder strukturelle Hirnschädigungen aufweisen, die ihre Konvulsionsschwelle herabsetzen.
Wie andere 5HT1B/1D-Agonisten sollte Zolmitriptan Zentiva nicht an Patienten verabreicht werden, bei denen, ohne vorherige Abklärung, die Möglichkeit einer nicht diagnostizierten Herzkrankheit besteht. Dies gilt insbesondere für Frauen in der Postmenopause, Männer über 40 Jahre und Patienten mit Risikofaktoren für eine koronare Herzkrankheit.
Nach der Verabreichung von Zolmitriptan wurde ein Schwere-, Druck- oder Engegefühl im Brustraum beobachtet. In klinischen Studien wurden diese Symptome jedoch nicht von Arrythmien oder ischämischen Änderungen im EKG begleitet.
Treten unter der Behandlung Symptome auf, die auf eine ischämische Herzkrankheit hindeuten, sollten vor der Fortsetzung der Therapie entsprechende Untersuchungen durchgeführt werden.
5HT1B/1D-Agonisten sollten nicht an Patienten mit symptomatischem Wolff-Parkinson-White-Syndrom oder mit Arrhythmien infolge anderer akzessorischer Erregungsleitungsstörungen verabreicht werden.
Wie mit anderen 5HT1B/1D-Agonisten wurde über vorübergehenden Blutdruckanstieg bei Patienten mit oder ohne Hypertonie berichtet; sehr selten trat dieser Blutdruckanstieg in Zusammenhang mit signifikanten klinischen Ereignissen auf.
Über lang andauernde Gefäss-Spasmen wurde bei Ergotaminen berichtet. Da diese Effekte additiv sein können, wird eine gleichzeitige Einnahme von Ergotamin und 5HT1B/1D-Agonisten nicht empfohlen.
Bei der gleichzeitigen Einnahme von Triptanen mit anderen Arzneimitteln mit serotonerger Wirkung kann es in seltenen Fällen zu einem Serotonin-Syndrom als lebensbedrohliche unerwünschte Arzneimittelwirkung kommen. Das Serotonin-Syndrom ist charakterisiert durch unterschiedliche Kombinationen einzelner Symptome, die typischerweise folgende Symptome umfassen können: Hyperreflexie, Tremor, Myoklonie, mentale Veränderungen wie Unruhe, Angst, Halluzinationen, Reizbarkeit bis zu Delirium und Koma, sowie Tachykardie, Blutdruckschwankungen, Hyperthermie, Übelkeit, Erbrechen, Durchfall. Das Serotonin-Syndrom kann auftreten, wenn zwei oder mehrere Arzneimittel mit serotonerger Wirkung gleichzeitig eingenommen werden oder eine Dosis erhöht wird (vgl. Rubrik «Interaktionen»).
Wenn die gleichzeitige Behandlung mit Zolmitriptan Zentiva und einem SSRI oder SNRI erforderlich ist, wird eine sorgfältige Überwachung des Patienten empfohlen, insbesondere zu Beginn der Behandlung und bei Dosissteigerungen.
Nach Absetzen der serotonergen Arzneimittel tritt gewöhnlich eine rasche Besserung ein. Die Behandlung des Serotonin-Syndroms hängt von Art und Schweregrad der Symptome ab.
Die längere Anwendung jeglicher Art von Schmerzmitteln gegen Kopfschmerzen kann diese verschlimmern. Wenn dies der Fall ist oder vermutet wird, sollte die Behandlung abgebrochen werden. Die Diagnose von Kopfschmerz bei Medikamentenübergebrauch (Medication Overuse Headache) sollte bei Patienten in Betracht gezogen werden, die an häufigen oder täglichen Kopfschmerzen leiden, obwohl (oder gerade weil) sie regelmässig Arzneimittel gegen Kopfschmerzen einnehmen.
Die gleichzeitige Verabreichung von Moclobemid, einem selektiven MAO-A-Hemmer, führt zu einem 3fachen Anstieg der AUC des aktiven Metaboliten und zu einer 26%igen Erhöhung der AUC von Zolmitriptan (siehe auch «Interaktionen»). Für Patienten, die einen selektiven MAO-A-Hemmer oder einen nicht selektiven MAO-Hemmer erhalten, wird deshalb als maximale Dosis 5 mg innerhalb von 24 Stunden empfohlen.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Schmelztablette, d.h. es ist nahezu «natriumfrei».
Dieses Arzneimittel enthält 2.5 mg Aspartam pro Schmelztablette. Aspartam ist eine Quelle für Phenylalanin. Patienten mit Phenylketonurie sollten informiert werden, dass Zolmitriptan Zentiva Schmelztabletten Phenylalanin (als Bestandteil des Aspartams) enthalten. Eine Schmelztablette enthält 1.405 mg Phenylalanin.
Interaktionen
Bei der gleichzeitigen Einnahme von Triptanen mit anderen Arzneimitteln mit mehr oder weniger ausgeprägter serotonerger Wirkung wie «Selektive Serotonin-Wiederaufnahme-Hemmer» (SSRI's), (z.B. Fluoxetin, Paroxetin, Sertralin) «Selektive Serotonin/Noradrenalin-Wiederaufnahme-Hemmer» (SNRI's), (z.B. Venlafaxin, Duloxetin), MAO-Hemmer, L-Tryptophan, Lithium, trizyklische Antidepressiva u.a. kann es in seltenen Fällen zu einem Serotonin-Syndrom als lebensbedrohliche unerwünschte Arzneimittelwirkung kommen (vgl. Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Es gibt keine Anzeichen für pharmakokinetische Interaktionen mit Coffein, Metoclopramid, Selegilin, Fluoxetin (20 mg/24 h), Ergotamin, Dihydroergotamin, Paracetamol oder Pizotifen. Ausser Fluoxetin wurden keine anderen SSRI's untersucht.
Nebenwirkungen können bei gleichzeitiger Anwendung von Triptanen und pflanzlichen Präparaten, die Johanniskraut (Hypericum perforatum) enthalten, häufiger auftreten.
Es bestehen geringe pharmakokinetische Interaktionen mit Rifampicin und Propranolol, die jedoch klinisch nicht signifikant sind. Bei gleichzeitiger Verabreichung von Propranolol (160 mg/Tag) über 1 Woche können Cmax und AUC von Zolmitriptan um das 1,5fache erhöht sein. Cmax und AUC des N-Desmethyl-Metaboliten können um 30% resp. 15% vermindert sein. Nach gleichzeitiger Verabreichung von Propranolol mit Zolmitriptan wurden keine interaktiven Wirkungen auf den Blutdruck oder auf die Pulsfrequenz festgestellt.
Zolmitriptan wird durch das Cytochrom-P450-System, vor allem durch CYP1A2, metabolisiert.
Anschliessend an die Verabreichung von Cimetidin, einem generalisierten Inhibitor des System P450 wurde die Halbwertszeit und die AUC von Zolmitriptan und seines aktiven Metaboliten etwa verdoppelt. Bei Patienten, die Cimetidin einnehmen, wird deshalb eine Tagesmaximaldosis von 5 mg Zolmitriptan empfohlen.
Basierend auf dem allgemeinen Interaktionsprofil von Zolmitriptan kann eine Interaktion mit spezifischen Hemmstoffen des P450 Isoenzymes CYP1A2 nicht ausgeschlossen werden. Deshalb wird auch bei gleichzeitiger Anwendung von Substanzen dieser Klasse (z.B. Fluvoxamin und Quinolone) die gleiche Tagesmaximaldosis empfohlen.
Der inaktive Hauptmetabolit von Zolmitriptan, das Indolessigsäure-Derivat (2161W92), entsteht aus dem aktiven N-Desmethyl-Metaboliten (N-Desmethyl-Zolmitriptan) durch Aktivität der MAO-A. Dies wurde nachgewiesen durch gleichzeitige Gabe von Moclobemid, einem selektiven Hemmstoff der MAO-A, die zu einer Verdreifachung der AUC des aktiven Metaboliten N-Desmethyl-Zolmitriptan führte, während die Zolmitriptanspiegel nur minimal (Erhöhung der AUC um 26%) beeinflusst wurden. Deshalb sollte bei gleichzeitiger Einnahme eines MAO-A-Hemmers nicht mehr als 5 mg Zolmitriptan Zentiva innerhalb 24 Stunden verabreicht werden.
Die Untersuchungen an Probanden mit Zolmitriptan und Ergotaminen haben keinen Hinweis auf wesentliche pharmakokinetische oder klinisch signifikante Interaktionen ergeben. Im Hinblick auf die Möglichkeit einer additiven vasokonstriktorischen Wirkung, sollte die gleichzeitige Behandlung mit Ergotamin-Derivaten jedoch vermieden werden. Deshalb sollte während eines Zeitraumes von 24 Stunden vor und 6 Stunden nach Gabe eines 5HT1B/1D-Agonisten kein ergotaminhaltiges Präparat eingenommen werden.
Andere 5HT1B/1D-Agonisten sollten nicht innerhalb von 24 Stunden nach der Verabreichung von Zolmitriptan Zentiva eingenommen werden.
Schwangerschaft/Stillzeit
Die Sicherheit von Zolmitriptan bei schwangeren Frauen ist nicht untersucht worden. In Tierversuchen sind keine teratogenen Wirkungen festgestellt worden. Einige Ergebnisse aus Studien zur Embryotoxizität deuten jedoch auf verminderte Lebensfähigkeit der Embryonen hin. Zolmitriptan Zentiva darf in der Schwangerschaft nicht angewendet werden, es sei denn, dies sei eindeutig erforderlich.
Tierstudien haben gezeigt, dass Zolmitriptan sich auch in die Muttermilch verteilt. Deshalb sollte Zolmitriptan nur mit Vorsicht an stillende Mütter verabreicht werden. Für die Sicherheit des Säuglings sollte während 24 Stunden nach der Einnahme von Zolmitriptan Zentiva nicht gestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Zolmitriptan Zentiva kann die Fähigkeit der Patienten, ein Fahrzeug zu lenken oder eine Maschine zu bedienen, herabsetzen. Es sollte berücksichtigt werden, dass Schläfrigkeit auftreten kann.
Unerwünschte Wirkungen
Unerwünschte Wirkungen sind typischerweise leicht bis mässig stark, vorübergehend und gehen ohne zusätzliche Behandlung spontan zurück.
Mögliche unerwünschte Wirkungen treten oft in den ersten vier Stunden auf und sind auch nach mehrmaliger Gabe nicht gehäuft feststellbar.
Diese unerwünschten Wirkungen können häufig (>1/100, <1/10), gelegentlich (>1/1'000, <1/100), selten (>1/10'000, <1/1'000) oder sehr selten (<1/10'000) auftreten.
Erkrankungen des Immunsystems
Selten: Überempfindlichkeitsreaktionen, inklusive Anaphylaxie und anaphylaktoide Reaktionen.
Erkrankungen des Nervensystems
Häufig: Schwindel, Kopfschmerzen, Schläfrigkeit, Wärmegefühl, Parästhesie und Hyperästhesie.
Herzerkrankungen/Gefässerkrankungen
Häufig: Herzklopfen.
Gelegentlich: Tachykardie, vorübergehender Blutdruckanstieg.
Sehr selten: Myokardinfarkt, Angina pectoris, schwere kardiale Ereignisse bei Patienten ohne zugrundeliegende Herzerkrankung, koronare Vasospasmen.
Erkrankungen des Gastrointestinaltrakts
Häufig: Bauchschmerzen, Nausea, Erbrechen, Mundtrockenheit, Dysphagie.
Sehr selten: blutige Diarrhoe, gastrointestinaler Infarkt oder Nekrose, gastrointestinale ischämische Ereignisse inklusive ischämischer Kolitis, Milzinfarkt.
Erkrankungen der Haut und des Unterhautgewebes
Selten: Urtikaria, Angioödem.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Muskelschwäche, Myalgie.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Polyurie, erhöhte Harnfrequenz.
Sehr selten: vermehrter Harndrang.
Allgemeine Erkrankungen
Häufig: Asthenie, Schwere-, Enge-, Schmerz- oder Druckgefühl in Hals, Nacken, Kiefer, Extremitäten und Thorax.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Bei Freiwilligen, welche eine orale Dosis von 50 mg erhalten hatten, wurde gewöhnlich eine Sedierung festgestellt.
Die Eliminationshalbwertszeit von Zolmitriptan beträgt 2,5 bis 3 Stunden (siehe «Pharmakokinetik»). Aus diesem Grund sollten Patienten, welche eine Überdosis eingenommen haben, während mindestens 15 Stunden oder solange die Symptome und Anzeichen andauern, überwacht werden.
Es gibt kein spezifisches Antidot für Zolmitriptan. Bei schweren Fällen einer Intoxikation werden Intensivmassnahmen empfohlen. Dies schliesst ein Öffnen der Atemwege, die Sicherstellung einer ausreichenden Sauerstoffzufuhr und der Ventilation, sowie die Überwachung und Unterstützung des Herzkreislaufsystems ein.
Der Einfluss einer Hämo- oder Peritoneal-Dialyse auf die Serumkonzentrationen von Zolmitriptan ist nicht bekannt.
Eigenschaften/Wirkungen
ATC-Code: N02CC03
Pharmakodynamik
In präklinischen Studien konnte gezeigt werden, dass Zolmitriptan ein selektiver Agonist der rekombinierten 5HT1D und 5HT1B Rezeptorsubtypen an humanen Gefässen ist. Zolmitriptan ist ein hochaffiner 5HT1B/1D Rezeptoragonist mit bescheidener Affinität zu den 5HT1A Rezeptoren. Zolmitriptan besitzt weder eine signifikante Affinität (aufgrund von Radioligand-Studien) noch eine pharmakologische Aktivität auf folgende Rezeptoren: 5HT2, 5HT3, 5HT4, alpha1-, alpha2-, beta1-adrenergen, H1-, H2-histaminischen, muskarinischen, dopaminergen1-, dopaminergen2-Rezeptoren.
Die schmerzempfindlichen Strukturen des menschlichen Gehirns sind die Blutgefässe und das Gefässsystem der Dura mater, welche von den afferenten Trigeminusfasern innerviert werden. Im Tiermodell bewirkt die Verabreichung von Zolmitriptan aufgrund seiner agonistischen Aktivität auf die vaskulären 5HT1 Rezeptoren eine Vasokonstriktion verbunden mit einer blockierten Freisetzung des Calcitonin-Gene-Related-Peptids (CGRP), des vasoaktiven, intestinalen Peptids (VIP) sowie der Substanz P. Diese zwei Mechanismen – Vasokonstriktion und Hemmung der Neuropeptid-Freisetzung führen zur Abschwächung des Migräneanfalls, was sich in einer Schmerzlinderung innerhalb 1 Stunde und in einer Besserung der Migräne-Begleitsymptome wie Nausea, Erbrechen, Photo- und Phonophobie zeigt.
Zusätzlich zu diesen peripheren Wirkungen besitzt Zolmitriptan auch zentralnervöse Wirkungen, so dass sowohl die peripheren wie auch die Migränezentren im Hirnstamm erreicht werden. Dies könnte die stete Wirkung über mehrere Anfälle beim gleichen Patienten erklären. Die Vasodilatation wird durch die Aktivierung eines Reflexbogens erzeugt, was über trigeminale, orthodrome Fasern und über die parasympathische Innervation der zerebralen Zirkulation mit Hilfe der VIP-Freisetzung als wichtigsten Auslösetransmitter vermittelt wird. Zolmitriptan hemmt diesen Reflexbogen und die Freisetzung von VIP.
Klinische Wirksamkeit
In 4 randomisierten, doppelblinden und placebokontrollierten Studien wurde die Wirksamkeit von 1 mg, 2,5 mg und 5 mg Zolmitriptan in der akuten Behandlung der Migräne geprüft. Das Ansprechen der Therapie mit Zolmitriptan – definiert als Rückgang schwerer oder mittelschwerer Kopfschmerzen zu leichten oder keinen Kopfschmerzen – wurde 1, 2 und 4 Stunden nach Einnahme beurteilt. Eine Untersuchung der Wirkung von Zolmitriptan auf Begleitsymptome der Migräne wie Nausea, Licht- und Lärmempfindlichkeit erfolgte ebenfalls. Bei sämtlichen Studien wurde die Wirksamkeit von Zolmitriptan in der Behandlung akuter Migräneattacken mit Placebo verglichen.
Die Ansprechraten 2 Stunden nach Einnahme von Zolmitriptan waren signifikant höher als bei Placebo (mit Ausnahme jener Patienten, die 1 mg Zolmitriptan eingenommen haben).
In zwei Studien, in welchen die Dosis von 1 mg Zolmitriptan evaluiert wurde, lagen die Ansprechraten nach 2 Stunden bei Dosen von 2,5 mg und 5 mg Zolmitriptan signifikant höher im Vergleich mit der 1 mg Dosierung. Zwischen den Dosierungsgruppen 2,5 mg und 5 mg Zolmitriptan gab es jedoch keine statistisch signifikanten Unterschiede im primären Endpunkt (= Ansprechrate nach 2 Stunden). Die Resultate der erwähnten Studien sind in der nachfolgenden Tabelle zusammengefasst.
Ansprechraten 2 Stunden nach Verabreichung von Zolmitriptan in placebo-kontrollierten Studien
Studie | Zolmitriptan-Dosierungen | |||
|---|---|---|---|---|
Placebo | 1 mg | 2,5 mg | 5 mg | |
006 | 15% (3/20) | 27% (6/22) | – | 62% (13/21) |
008 | 19% (17/88) | NA | – | 66% (118/179) |
0017 | 34% (41/121) | 53% (66/125) | 65% (169/260) | 67% (163/245) |
0042 | 36% (33/92) | – | 62% (110/178) | – |
Total | 29% (94/321) | 49% (72/147) | 64% (279/438) | 66% (294/445) |
Im Vergleich mit Placebo führte Zolmitriptan bei Patienten mit Migräne-assoziierter Nausea, Licht- und Lärmempfindlichkeit zu einer deutlichen Besserung dieser Begleitsymptome.
Pharmakokinetik
Absorption
Nach oraler Verabreichung wird Zolmitriptan beim Menschen schnell und gut resorbiert (64%). Die durchschnittliche absolute Bioverfügbarkeit der Ausgangssubstanz beträgt ungefähr 40%, bei Frauen ist sie etwas höher.
Bei einmaliger Gabe an Gesunden verhielten sich AUC und Cmax von Zolmitriptan und seinem aktiven Metaboliten N-Desmethyl-Zolmitriptan im Dosierungsbereich von 2,5–50 mg proportional zur Dosis. Die Absorption verläuft schnell; Cmax wird innerhalb 2–2,8 Stunden erreicht und anschliessend bleiben die Plasmakonzentrationen während 4–6 Stunden erhalten. Die Absorption von Zolmitriptan wird durch die Nahrungsaufnahme nur wenig beeinflusst. Es besteht kein Hinweis auf Kumulation bei wiederholter Anwendung von Zolmitriptan.
Distribution
Nach oraler Gabe von 2,5 mg ergibt sich ein Verteilungsvolumen von 7,0 l/kg. Die Plasmaproteinbindung ist gering und beträgt ungefähr 25%.
Metabolismus
Zolmitriptan unterliegt einer ausgedehnten hepatischen Biotransformation. Zolmitriptan wird durch das Cytochrom-P450-System, vor allem durch CYP1A2, metabolisiert. Es entstehen vor allem drei Metabolite des Zolmitriptan: ein Indolessigsäurederivat (der Hauptmetabolit im Plasma und im Urin), ein N-Oxid- und ein N-Desmethyl-Derivat. Nur der N-Desmethyl-Metabolit (N-Desmethyl-Zolmitriptan) ist aktiv. Er wird über das Monoaminoxidase A (MAO-A) Enzymsystem abgebaut und hat sich im Tiermodell im Vergleich zu Zolmitriptan als 2–6-mal potenter erwiesen. Plasmakonzentrationen von N-Desmethyl-Zolmitriptan sind ungefähr halb so gross wie die der Ausgangssubstanz, weshalb eine Beteiligung dieses Metaboliten an der therapeutischen Wirkung von Zolmitriptan anzunehmen ist.
Elimination
Anschliessend an die hepatische Biotransformation werden die Metaboliten mit dem Urin ausgeschieden. Über 60% einer einzigen Dosis wird im Urin (vor allem als Indolacetat) und ungefähr 30% in den Fäzes (vor allem als unverändertes Zolmitriptan) eliminiert.
Nach i.v. Applikation beträgt die durchschnittliche Plasmaclearance ungefähr 10 ml/min/kg, wovon 1/3 auf die renale Clearance entfallen. Die renale Clearance ist grösser als die glomeruläre Filtration, weshalb eine renale tubuläre Sekretion angenommen werden kann.
Die durchschnittliche Eliminationshalbwertszeit von Zolmitriptan beträgt 2,5–3 Stunden. Die Halbwertszeit seiner Metaboliten ist ähnlich, was auf eine von der Bildungsrate limitierte Elimination schliessen lässt.
Kinetik spezieller Patientengruppen
Bei Patienten mit mittelschwerer bis schwerer Niereninsuffizienz ist die renale Clearance von Zolmitriptan und seinen Metaboliten im Vergleich mit Gesunden 7–8-mal vermindert, obwohl die AUC der Ausgangssubstanz und des aktiven Metaboliten nur wenig erhöht ist (16% bzw. 35%). Eine Kumulation der unwirksamen Metaboliten bei wiederholter Gabe ist möglich. Die Halbwertszeit stieg um 1 Stunde auf 3–3,5 Stunden an. Diese Parameter lagen im Bereich, wie dies bei Gesunden beobachtet worden war.
Der Metabolismus von Zolmitriptan ist bei Leberinsuffizienz proportional zum Schweregrad der Insuffizienz eingeschränkt. Im Vergleich zu Gesunden waren AUC und Cmax von Zolmitriptan bei Patienten mit mässiger Leberinsuffizienz um 94% bzw. 50% erhöht, bei Patienten mit schwerer Leberinsuffizienz um 226% bzw. 47%. Die Plasmaspiegel der Metaboliten, inklusive des aktiven Metaboliten, waren reduziert. Bei Patienten mit mässiger Leberinsuffizienz waren AUC und Cmax des aktiven Metaboliten N-Desmethyl-Zolmitriptan um 33% bzw. 44% erniedrigt und bei Patienten mit schwerer Leberinsuffizienz um 82% bzw. 90%.
Die Halbwertszeit von Zolmitriptan beträgt bei gesunden Probanden 4,7 Stunden, bei Patienten mit mässiger Leberinsuffizienz 7,3 Stunden und bei Patienten mit schwerer Leberinsuffizienz 12 Stunden. Die Halbwertszeit des aktiven Metaboliten N-Desmethyl-Zolmitriptan beträgt bei gesunden Probanden 5,7 Stunden, bei Patienten mit mässiger Leberinsuffizienz 7,5 Stunden und bei Patienten mit schwerer Leberinsuffizienz 7,8 Stunden.
Die Pharmakokinetik von Zolmitriptan bei gesunden, älteren Menschen war mit derjenigen bei jungen Gesunden vergleichbar.
Präklinische Daten
In einer oralen Teratogenitätsstudie an Ratten und Kaninchen, zeigten sich bei den maximal verträglichen Dosen von 1200 mg/kg/Tag bzw. 30 mg/kg/Tag keine Anzeichen von Teratogenität aber eine gewisse Embryotoxizität.
Aus etlichen Studien zur Genotoxizität kann geschlossen werden, dass Zolmitriptan wahrscheinlich kein genetisches Risiko für den Menschen darstellt.
Karzinogenitätsstudien an Ratten und Mäusen, die mit den höchsten als sinnvoll erschienenen Dosen durchgeführt wurden, gaben keinen Hinweis auf eine Verursachung von Tumoren.
Reproduktionsstudien an Ratten mit Dosen limitiert durch Toxizität für die Muttertiere zeigten keinen Effekt auf die Fertilität.
Sonstige Hinweise
Haltbarkeit
Das Medikament darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Zolmitriptan Zentiva Schmelztabletten sind in der Originalpackung, nicht über 30 °C und ausser Reichweite von Kindern aufzubewahren.
Zulassungsnummer
61646 (Swissmedic).
Zulassungsinhaberin
Helvepharm AG, Frauenfeld.
Stand der Information
April 2020.
Composizione
Principio attivo: Zolmitriptanum.
Sostanze ausiliarie
Mannitolum, Cellulosum microcristallinum, Aspartamum (E 951) 2.5 mg, Aromatica (Orange), Carmellosum natricum conexum corresp. Natrium 0.935 mg, Silica colloidalis anhydrica, Magnesii stearas.
Forma farmaceutica e quantità di principio attivo per unità
1 compressa orodispersibile di Zolmitriptan Zentiva contiene 2,5 mg di zolmitriptan.
Indicazioni/Possibilità d'impiego
Trattamento acuto degli attacchi di emicrania con o senza aura
Posologia/Impiego
Zolmitriptan Zentiva compressa orodispersibile è una compressa che si scioglie rapidamente e che viene deglutita con la saliva. Non è necessario bere dell'acqua per l'assunzione di Zolmitriptan Zentiva compresse orodispersibili.
Le compresse orodispersibili di Zolmitriptan Zentiva sono adatte quando non si ha a disposizione l'acqua e consentono così in qualsiasi momento un'assunzione precoce in caso di attacco di emicrania. Zolmitriptan Zentiva compresse orodispersibili è indicato anche per i pazienti che soffrono di nausea e non sono in grado di assumere liquidi durante l'emicrania o che hanno difficoltà a deglutire le compresse rivestite convenzionali.
Lasciare sciogliere la compressa orodispersibile di Zolmitriptan Zentiva sulla lingua.
Adulti
La dose di Zolmitriptan Zentiva raccomandata per il trattamento di un attacco di emicrania è di 2,5 mg.
Qualora i sintomi persistano o ricompaiano entro 24 ore, può essere efficace una seconda dose. Essa può essere assunta dopo almeno due ore dalla dose iniziale. Una netta efficacia si manifesta 1 ora dopo la somministrazione.
L'efficacia di Zolmitriptan Zentiva è sostanzialmente indipendente dal momento dell'assunzione durante l'attacco. Si consiglia tuttavia di assumere Zolmitriptan Zentiva il prima possibile dall'inizio della cefalea emicranica.
Nell'arco di 24 ore non possono essere assunti più di 10 mg (=4 compresse orodispersibili).
Dose singola massima: 1 compressa.
Zolmitriptan Zentiva è efficace anche nei casi di attacchi di emicrania correlati ad alterazioni ormonali durante la mestruazione.
Zolmitriptan Zentiva non è indicato per la profilassi dell'emicrania.
L'efficacia di Zolmitriptan Zentiva non è influenzata da sesso, età (vedere qui di seguito «Bambini» e «Pazienti anziani»), durata dell'attacco, nausea precedente la somministrazione o da altri medicamenti per la profilassi dell'emicrania.
Bambini (<12 anni)
Non sono disponibili dati sull'impiego di zolmitriptan nei bambini. Zolmitriptan Zentiva non deve essere quindi impiegato in questa fascia d'età.
Adolescenti (12-17 anni)
L'efficacia di zolmitriptan in pazienti di età compresa fra 12 e 17 anni non è stata dimostrata in uno studio clinico controllato con placebo. Pertanto, Zolmitriptan Zentiva non deve essere impiegato in questa fascia d'età.
Pazienti anziani
La sicurezza e l'efficacia di zolmitriptan in pazienti di età superiore a 65 anni non sono state valutate sistematicamente.
Pazienti con disturbi della funzionalità epatica
Nei pazienti con insufficienza epatica lieve o moderata non è necessario alcun aggiustamento del dosaggio (vedere «Farmacocinetica»). Nei pazienti con insufficienza epatica grave si raccomanda una dose massima di 5 mg nelle 24 ore.
Pazienti con disturbi della funzionalità renale
Nei pazienti con un clearance della creatinina >15 ml/min (vedi «Farmacocinetica») non è necessario alcun aggiustamento del dosaggio.
Controindicazioni
Zolmitriptan Zentiva è controindicato nei pazienti con ipersensibilità nota al principio attivo o a una delle sostanze ausiliarie in base alla composizione del medicamento.
Zolmitriptan Zentiva non deve essere impiegato per il trattamento dell'emicrania emiplegica o basilare.
Zolmitriptan Zentiva è controindicato nei pazienti con la seguente anamnesi:
In caso di cardiopatie ischemiche, storia di infarto miocardico, vasospasmi coronarici (angina di Prinzmetal) o ipertensione non sufficientemente controllata.
Avvertenze e misure precauzionali
Zolmitriptan Zentiva deve essere impiegato esclusivamente dopo diagnosi certa di emicrania.
Come con altre terapie dell'emicrania acuta, prima di somministrare Zolmitriptan Zentiva in pazienti non diagnosticati precedentemente come emicranici ed in pazienti emicranici che presentino sintomi atipici, vanno escluse altre patologie neurologiche potenzialmente serie.
Esistono segnalazioni di pazienti che hanno ricevuto gli agonisti dei recettori 5HT1B/1D per il trattamento di cefalee severe che si sono rivelate successivamente come manifestazione collaterale di un danno neurologico in sviluppo (disturbi della perfusione cerebrale, emorragia subaracnoidea). Occorre rilevare che i soggetti emicranici possono essere a rischio di determinate malattie cerebrovascolari, quali ad esempio disturbi della perfusione cerebrale, accidenti cerebrovascolari (ACV), TIA (attacco ischemico transitorio), emorragie cerebrali o subaracnoidee.
Se il paziente non risponde al primo trattamento con il dosaggio normale, è necessario verificare nuovamente la diagnosi prima di somministrare la seconda dose.
Come con altri agonisti dei recettori 5HT1B/1D, Zolmitriptan Zentiva deve essere somministrato con cautela a pazienti con anamnesi di epilessia o lesioni cerebrali strutturali che abbassano la loro soglia convulsiva.
Come con altri agonisti dei recettori 5HT1B/1D, Zolmitriptan Zentiva non deve essere somministrato, senza effettuare prima una valutazione, a pazienti per i quali sussista la possibilità di una cardiopatia non diagnosticata. Ciò vale soprattutto per donne in post-menopausa, uomini di età superiore a 40 anni e pazienti con fattori di rischio di una patologia coronarica.
Dopo la somministrazione di zolmitriptan sono state osservate sensazione di pesantezza, oppressione o costrizione al torace. Negli studi clinici, questi sintomi non erano tuttavia accompagnati da aritmie o da alterazioni ischemiche nell'ECG.
Se durante il trattamento compaiono sintomi indicativi di una cardiopatia ischemica, devono essere eseguiti adeguati accertamenti prima di proseguire la terapia.
Gli agonisti dei recettori 5HT1B/1D non devono essere somministrati a pazienti con sindrome di Wolff-Parkinson-White sintomatica o con aritmie associate ad altre vie accessorie della conduzione cardiaca.
Come con altri agonisti dei recettori 5HT1B/1D, sono stati descritti aumenti transitori della pressione arteriosa in pazienti con o senza storia di ipertensione; molto raramente questi incrementi pressori sono comparsi assieme a eventi clinici significativi.
Con l'ergotamina sono stati riferiti vasospasmi di lunga durata. Poiché questi effetti possono sommarsi, si sconsiglia l'assunzione concomitante di ergotamina e agonisti dei recettori 5HT1B/1D.
L'assunzione concomitante di triptani con altri medicamenti ad azione serotoninergica può causare in rari casi la sindrome serotoninergica come effetto farmacologico indesiderato potenzialmente letale.
La sindrome serotoninergica è caratterizzata da diverse combinazioni di singoli sintomi che possono comprendere tipicamente i seguenti sintomi: iperreflessia, tremore, mioclonia, alterazioni mentali come irrequietezza, paura, allucinazioni, irritabilità fino al delirio e al coma, nonché tachicardia, oscillazioni della pressione arteriosa, ipertermia, nausea, vomito, diarrea.
La sindrome serotoninergica può insorgere quando si assumono due o più medicamenti ad azione serotoninergica o quando si aumenta la dose (vedere la rubrica «Interazioni»).
Se è necessario il trattamento concomitante con Zolmitriptan Zentiva e un SSRI o un SNRI, si raccomanda di tenere il paziente sotto attenta osservazione, in particolare all'inizio del trattamento e in caso di aumenti di dose.
Dopo sospensione del medicamento ad azione serotoninergica si ottiene abitualmente un rapido miglioramento. Il trattamento della sindrome serotoninergica dipende dal tipo e dal grado di severità dei sintomi.
L'uso prolungato di qualsiasi antidolorifico per il trattamento della cefalea può peggiorare la sindrome. Se questa situazione si verifica o si sospetta, occorre sospendere il trattamento. La diagnosi di cefalea da abuso di medicamenti (Medication Overuse Headache) deve essere presa in considerazione nei pazienti con cefalea frequente o quotidiana, malgrado (o a causa di) uso regolare di medicamenti per il trattamento della cefalea.
La somministrazione concomitante di moclobemide, un inibitore selettivo delle MAO-A, causa un incremento di 3 volte dell'AUC del metabolita attivo e un incremento (26%) dell'AUC di zolmitriptan (vedere anche «Interazioni»). Pertanto, nei pazienti in terapia con un inibitore selettivo delle MAO-A o con un inibitore non selettivo delle MAO, si raccomanda un'assunzione massima di 5 mg nelle 24 ore.
Questo medicamento contiene meno di 1 mmol di sodio (23 mg) per compressa orodispersibile, cioè è praticamente «privo di sodio»).
Questo medicamento contiene 2,5 mg di aspartame per ciascuna compressa orodispersibile. L'aspartame è una fonte di fenilalanina. I pazienti con fenilchetonuria devono essere informati che Zolmitriptan Zentiva compresse orodispersibili contiene fenilalanina (come componente dell'aspartame). Una compressa orosolubile contiene 1,405 mg di fenilalanina.
Interazioni
L'assunzione concomitante di triptani con altri medicamenti ad azione serotoninergica più o meno accentuata, fra i quali gli «inibitori selettivi della ricaptazione della serotonina» (SSR), (per es. fluoxetina, paroxetina, sertralina), gli «inibitori selettivi della ricaptazione della serotonina/noradrenalina (SNR) (per es. vanlafaxina, duloxetina), gli inibitori delle MAO, L-triptofano, litio, gli antidepressivi triciclici, può causare in rari casi la sindrome serotoninergica come effetto farmacologico indesiderato potenzialmente letale (vedere la rubrica «Avvertenze e misure precauzionali»).
Non vi sono segni di interazioni farmacocinetiche con caffeina, metoclopramide, selegilina, fluoxetina (20 mg/24 h), ergotamina, diidroergotamina, paracetamolo o pizotifene. Non sono stati valutati altri SSRI oltre alla fluoxetina.
Possono insorgere frequentemente effetti collaterali nell'uso concomitante di triptani e preparati vegetali contenenti l'erba di S. Giovanni (Hypericum perforatum).
Esistono minime interazioni farmacocinetiche clinicamente non significative con rifampicina e propranololo. La somministrazione concomitante di propranololo (160 mg/giorno) per una settimana può causare un aumento di 1,5 volte della Cmax e dell'AUC di zolmitriptan. La Cmax e l'AUC del metabolita N-demetilato possono subire una riduzione risp. del 30% e del 15%. Dopo somministrazione concomitante di propranololo con zolmitriptan non si sono riscontrate interazioni sulla pressione arteriosa né sulla frequenza cardiaca.
Zolmitriptan viene metabolizzato attraverso il sistema del citocromo P450, soprattutto attraverso il CYP1A2.
Dopo somministrazione di cimetidina, un inibitore generale del sistema P450, l'emivita e l'AUC di zolmitriptan e del suo metabolita attivo sono risultate pressoché raddoppiate. Pertanto, nei pazienti che assumono cimetidina, si raccomanda una dose massima giornaliera di 5 mg di zolmitriptan.
In base al profilo di interazione di zolmitriptan, non può essere esclusa un'interazione con specifici inibitori dell'isoenzima CYP1A2 del P450. Pertanto, anche in caso di impiego concomitante di sostanze di questa classe (ad es. fluvoxamina e chinoloni) si raccomanda la stessa dose massima giornaliera.
Il metabolita inattivo principale di zolmitriptan, il derivato dell'acido indolacetico (2161W92), deriva dal metabolita attivo N-demetilato (N-demetil-zolmitriptan) attraverso l'attività della MAO-A. Ciò è stato dimostrato attraverso la somministrazione concomitante di moclobemide, un inibitore selettivo della MAO-A che ha causato una triplicazione dell'AUC del metabolita attivo N-demetil-zolmitriptan, mentre i livelli di zolmitriptan sono state solo minimamente influenzate (aumento del 26% dell'AUC). Pertanto, in caso di assunzione concomitante di un inibitore della MAO-A, non si deve superare la dose massima di 5 mg di Zolmitriptan Zentiva nelle 24 ore.
Le analisi su volontari condotte con zolmitriptan ed ergotamina non hanno evidenziato alcuna interazione farmacocinetica o clinicamente significativa. Tuttavia, in considerazione della possibilità di un'azione vasocostrittiva additiva, si deve evitare il trattamento concomitante con derivati dell'ergotamina. Pertanto, nelle 24 ore precedenti e nelle 6 ore successive alla somministrazione di un agonista del recettore 5HT1B/1D, non si deve assumere alcun preparato contenente ergotamina.
Non si devono assumere altri agonisti del recettore 5HT1B/1D nelle 24 ore successive alla somministrazione di Zolmitriptan Zentiva.
Gravidanza/Allattamento
La sicurezza di zolmitriptan nelle donne in gravidanza non è stata valutata. Negli studi sugli animali non sono stati riscontrati effetti teratogeni. Alcuni risultati da studi sull'embriotossicità suggeriscono tuttavia una ridotta capacità vitale degli embrioni. Zolmitriptan Zentiva non deve essere utilizzato in gravidanza, se non assolutamente necessario.
Gli studi sugli animali hanno dimostrato che zolmitriptan passa nel latte materno. Zolmitriptan deve essere quindi impiegato con cautela nelle madri che allattano al seno. Per la sicurezza del lattante, non si deve allattare durante le 24 ore successive all'assunzione di Zolmitriptan Zentiva.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Zolmitriptan Zentiva può ridurre la capacità di condurre veicoli o impiegare macchine. Occorre tenere presente che può indurre sonnolenza.
Effetti indesiderati
Gli effetti indesiderati sono tipicamente lievi o moderati, transitori e regrediscono spontaneamente senza trattamento aggiuntivo.
I potenziali effetti indesiderati insorgono spesso nelle prime quattro ore e non aumentano dopo somministrazione ripetuta.
Questi effetti collaterali possono essere classificati come «comune» (>1/100, <1/10), «non comune» (>1/1'000, <1/100), «raro» (>1/10'000, <1/1'000) o «molto raro» (<1/10'000).
Disturbi del sistema immunitario
Raro: reazioni di ipersensibilità, incluse anafilassi e reazioni anafilattoidi.
Patologie del sistema nervoso
Comune: vertigini, cefalea, sonnolenza, sensazione di calore, parestesia e iperestesia.
Patologie cardiache/Patologie vascolari
Comune: palpitazioni
Non comune: tachicardia, aumento transitorio della pressione arteriosa.
Molto raro: infarto miocardico, angina pectoris, eventi cardiaci gravi in pazienti senza cardiopatia sottostante, vasospasmi coronarici.
Patologie gastrointestinali
Comune: dolori addominali, nausea, vomito, secchezza delle fauci, disfagia.
Molto raro: diarrea sanguinolenta, infarto o necrosi gastrointestinale, eventi ischemici gastrointestinali inclusa la colite ischemica, infarto splenico.
Patologie della cute e del tessuto sottocutaneo
Raro: orticaria, angioedema.
Patologie del sistema muscoloscheletrico e del tessuto connettivo:
Comune: debolezza muscolare, mialgia.
Patologie renali e urinarie
Non comune: poliuria, frequenza urinaria aumentata.
Molto raro: urgenza urinaria.
Patologie sistemiche:
Comune: astenia, senso di pesantezza, costrizione, dolore o compressione alla gola, al collo, agli arti o al torace.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Nei soggetti che hanno ricevuto una dose orale di 50 mg è stata riscontrata comunemente sedazione.
L'emivita di eliminazione di zolmitriptan è compresa fra 2,5 e 3 ore (vedere «Farmacocinetica»). Pertanto, i pazienti che hanno assunto un dosaggio eccessivo devono essere monitorati per almeno 15 ore o finché persistono i segni e sintomi.
Non esiste un antidoto specifico per zolmitriptan. In caso di intossicazione grave, si raccomandano procedure di terapia intensiva, inclusa l'instaurazione ed il mantenimento della pervietà delle vie aeree, il supporto di un'adeguata ossigenazione e ventilazione, il monitoraggio ed il supporto del sistema cardiovascolare.
Non si conosce l'effetto dell'emodialisi e della dialisi peritoneale sulla concentrazione sierica di zolmitriptan.
Proprietà/Effetti
Codice ATC:N02CC03
Farmacodinamica
Negli studi preclinici è stato dimostrato che lo zolmitriptan è un agonista selettivo dei sottotipi dei recettori ricombinanti 5HT1D e 5HT1B nei vasi umani. Zolmitriptan presenta un'elevata affinità per i recettori 5HT1B/1D e una modesta affinità per i recettori 5HT1A. Zolmitriptan non possiede affinità significativa (secondo gli studi con radioligandi) né attività farmacologica nei confronti dei seguenti recettori: recettori 5HT2, 5HT3, 5HT4, alfa1-, alfa2-, beta1- adrenergeni, H1-, H2-istaminici, muscarinici, dopaminergici1, dopaminergici2.
Le strutture sensibili al dolore del cervello umano sono i vasi e il sistema vascolare della dura madre innervati dalle fibre afferenti del trigemino. Nei modelli animali, la somministrazione di zolmitriptan, come agonista con effetti sui recettori vascolari 5HT1, causa vasocostrizione con inibizione del rilascio di neuropeptidi (peptide correlato al gene della calcitonina (CGRP), peptide intestinale vasoattivo (VIP) e Sostanza P). Questi due meccanismi, la vasocostrizione e l'inibizione del rilascio di neuropeptidi, portano a un indebolimento dell'attacco emicranico, che si traduce in un'attenuazione del dolore entro 1 ora e in un miglioramento dei sintomi che accompagnano l'emicrania come nausea, vomito, fotofobia e fonofobia.
Oltre a questi effetti periferici, zolmitriptan possiede anche effetti sul sistema nervoso centrale, per cui vengono raggiunti sia i centri periferici sia i centri dell'emicrania nel tronco encefalico. Ciò potrebbe spiegare l'effetto costante nel corso di molteplici attacchi nello stesso paziente. La vasodilatazione deriva dall'attivazione di un arco riflesso che viene trasmesso attraverso le fibre trigeminali ortodromiche e attraverso l'innervazione parasimpatica della circolazione cerebrale con l'ausilio del rilascio di VIP come importante trasmettitore. Zolmitriptan inibisce questo arco riflesso e il rilascio di VIP.
Efficacia clinica
In 4 studi randomizzati, in doppio cieco, controllati con placebo, è stata valutata l'efficacia di 1 mg, 2,5 mg e 5 mg di zolmitriptan nel trattamento acuto dell'emicrania. La risposta alla terapia con zolmitriptan, definita come regressione della cefalea da grave/moderata a lieve/assente, è stata valutata dopo 1, 2 e 4 ore dall'assunzione. Si è valutato anche l'effetto di zolmitriptan sui sintomi che accompagnano l'emicrania come nausea, fotofobia e fonofobia. In tutti gli studi si è confrontata l'efficacia di zolmitriptan nel trattamento degli attacchi acuti di emicrania con il placebo.
I tassi di risposta 2 ore dopo l'assunzione di zolmitriptan erano significativamente più alti rispetto al placebo (ad eccezione di quei pazienti che avevano assunto 1 mg di zolmitriptan).
In due studi, nei quali è stata valutata la dose da 1 mg di zolmitriptan, i tassi di risposta dopo 2 ore erano significativamente più elevati nel gruppo trattato con il dosaggio di 2,5 e 5 mg di zolmitriptan rispetto al gruppo trattato con il dosaggio di 1 mg. Fra i gruppi di dosaggio 2,5 e 5 mg di zolmitriptan non sussistevano tuttavia differenze statisticamente significative nell'endpoint primario (=tassi di risposta dopo 2 ore). I risultati degli studi menzionati sono riassunti nella seguente tabella.
Tassi di risposta 2 ore dopo la somministrazione di zolmitriptan negli studi controllati
Studio | Dosaggi di zolmitriptan | |||
Placebo | 1 mg | 2,5 mg | 5 mg | |
006 | 15% | 27% | – | 62% |
008 | 19% | NA | – | 66% |
0017 | 34% | 53% | 65% | 67% |
0042 | 36% | – | 62% | – |
Totale | 29% | 49% | 64% | 66% |
Rispetto al placebo, nei pazienti con nausea, fotofobia e fonofobia correlate all'emicrania, zolmitriptan ha prodotto un miglioramento consistente di questi effetti collaterali.
Farmacocinetica
Assorbimento
Nell'essere umano, zolmitriptan viene rapidamente e ben assorbito (64%) dopo somministrazione orale. La biodisponibilità assoluta media della sostanza originaria è pari a circa il 40%, nelle donne lievemente più elevata.
Nella somministrazione di una dose singola a soggetti sani, l'AUC e la Cmax di zolmitriptan e del suo metabolita attivo N-demetil-zolmitriptan sono state proporzionali alla dose nell'ambito di un intervallo posologico compreso fra 2,5 e 50 mg. L'assorbimento di zolmitriptan è rapido; la Cmax si raggiunge entro 2-2,8 ore, dopodiché le concentrazioni plasmatiche di zolmitriptan vengono mantenute fino a 4-6 ore dopo la somministrazione.
L'assorbimento di zolmitriptan non è influenzato dall'assunzione di cibo. Non vi è stata evidenza di accumulo dopo somministrazione ripetuta di zolmitriptan.
Distribuzione
Dopo somministrazione orale di 2,5 mg si ottiene un volume di distribuzione di 7,0 l/kg. Il legame con le proteine plasmatiche è basso e pari a circa 25%.
Metabolismo
Zolmitriptan è soggetto a una biotrasformazione epatica estesa. Zolmitriptan viene metabolizzato attraverso il sistema del citocromo P450, soprattutto attraverso il CYP1A2. Si formano soprattutto tre metaboliti di zolmitriptan: un derivato dell'acido indolacetico (il metabolita principale nel plasma e nelle urine), un derivato N-ossidato e un derivato N-demetilato. Solo il metabolita N-demetilato (N-demetil-zolmitriptan) è attivo. Questo viene metabolizzato dal sistema enzimatico della monoaminossidasi A (MAO-A) e si è rivelato 2-6 volte più potente nel modello animale rispetto a zolmitriptan. Le concentrazioni plasmatiche di N-demetill-zolmitriptan sono circa la metà della sostanza originaria, pertanto si può ritenere che questo metabolita contribuisca all'effetto terapeutico di zolmitriptan.
Eliminazione
Dopo la biotrasformazione epatica, i metaboliti vengono escreti nelle urine. Più del 60% di una dose singola viene escreto nelle urine (principalmente sotto forma di acido indolacetico) e circa il 30% viene escreto nelle feci (soprattutto come zolmitriptan immodificato).
Dopo somministrazione e.v., la clearance plasmatica media è pari a circa 10 ml/min/kg, di cui un terzo è rappresentato dalla clearance renale. La clearance renale è più elevata della velocità di filtrazione glomerulare, suggerendo la presenza di secrezione tubulare renale.
L'emivita media di eliminazione di zolmitriptan è compresa fra 2,5 e -3 ore. L'emivita dei suoi metaboliti è simile, suggerendo che la loro eliminazione sia un processo limitato dalla velocità di formazione.
Cinetica di gruppi di pazienti speciali
Nei pazienti con insufficienza renale moderata o grave, la clearance renale di zolmitriptan e dei suoi metaboliti rispetto ai soggetti sani è di 7-8 volte inferiore, sebbene l'AUC della sostanza originaria e del metabolita attivo siano solo lievemente più elevate (risp. 16% e 35%). L'accumulo di metaboliti non attivi è possibile in caso di somministrazione ripetuta. L'emivita è aumentata di 1 ora a 3-3,5 ore. Questi parametri si collocavano nell'intervallo osservato nei soggetti sani.
Il metabolismo di zolmitriptan è limitato in caso di insufficienza epatica proporzionalmente alla gravità dell'insufficienza. Rispetto ai soggetti sani, l'AUC e la Cmax di zolmitriptan nei pazienti con insufficienza epatica moderata erano aumentate risp. del 94% e del 50%, nei pazienti con insufficienza epatica grave risp. del 226% e del 47%. I livelli plasmatici dei metaboliti, incluso il metabolita attivo, erano ridotti. Nei pazienti con insufficienza epatica moderata, l'AUC e la Cmax del metabolita attivo N-demetil-zolmitriptan erano risp. del 33% e del 44% più basse e nei pazienti con insufficienza epatica grave risp. dell'82% e del 90%
L'emivita di zolmitriptan nei soggetti sani è di 4,7 ore, nei pazienti con insufficienza epatica moderata di 7,3 ore e nei pazienti con insufficienza epatica grave di 12 ore. L'emivita del metabolita attivo N-demetil-zolmitriptan nei soggetti sani è di 5,7 ore, nei pazienti con insufficienza epatica moderata di 7,5 ore e nei pazienti con insufficienza epatica grave di 7,8 ore.
La farmacocinetica di zolmitriptan nei pazienti anziani sani era simile a quella dei soggetti sani giovani.
Dati preclinici
In uno studio sulla teratogenicità per via orale su ratti e conigli, alle dosi massime tollerate risp. di 1200 mg/kg/giorno e di 30 mg/kg/giorno non si sono riscontrati segni di teratogenicità ma una certa embriotossicità.
Da diversi studi sulla genotossicità si può desumere che zolmitriptan non rappresenta probabilmente alcun rischio genetico per l'uomo.
Gli studi di cancerogenicità condotti su ratti e topi alle dosi massime considerate opportune non hanno suggerito la formazione di tumori.
Gli studi condotti sui ratti a dosi limitate dalla tossicità per le madri animali non hanno dimostrato effetti sulla fertilità.
Altre indicazioni
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni particolari concernenti l'immagazzinamento
Conservi Zolmitriptan Zentiva nella confezione originale, a temperatura non superiore a 30 °C e fuori dalla portata dei bambini.
Numero dell'omologazione
61646 (Swissmedic).
Titolare dell’omologazione
Helvepharm AG, Frauenfeld.
Stato dell'informazione
Aprile 2020.
Composition
Principe actif: Zolmitriptanum.
Excipients
Mannitolum, Cellulosum microcristallinum, Aspartamum (E 951) 2.5 mg, Aromatica (Orange), Carmellosum natricum conexum corresp. sodium 0.935 mg, Silica colloidalis anhydrica, Magnesii stearas.
Forme pharmaceutique et quantité de principe actif par unité
1 comprimé orodispersible de Zolmitriptan Zentiva contient 2,5 mg de zolmitriptan.
Indications/Possibilités d’emploi
Traitement aigu des crises migraineuses avec ou sans aura.
Posologie/Mode d’emploi
Zolmitriptan Zentiva comprimé orodispersible est un comprimé à dissolution rapide qui est dégluti avec la salive. Il est inutile de boire de l'eau lors de la prise de Zolmitriptan Zentiva comprimés orodispersibles.
Les comprimés orodispersibles de Zolmitriptan Zentiva sont utilisables quand le patient ne dispose pas d'eau et ils permettent donc une prise précoce, à tout moment, en cas de crise migraineuse. Zolmitriptan Zentiva comprimés orodispersibles convient aussi pour les patients qui souffrent de nausées, qui ne sont pas en mesure de prendre du liquide pendant une migraine ou qui ont du mal à déglutir les comprimés pelliculés classiques.
Faire fondre le comprimé orodispersible de Zolmitriptan Zentiva sur la langue.
Adultes
La dose de Zolmitriptan Zentiva recommandée pour le traitement d'une crise migraineuse est de 2,5 mg.
Si les symptômes persistent ou réapparaissent en l'espace de 24 heures, une deuxième dose peut être utilisée, mais au plus tôt deux heures après la dose initiale.
Une action nette se manifeste 1 heure après l'administration.
L'action de Zolmitriptan Zentiva est en principe indépendante du moment de la prise pendant la crise migraineuse. Il est cependant conseillé de prendre Zolmitriptan Zentiva aussitôt que possible après la survenue des douleurs migraineuses.
Il ne faut pas prendre plus de 10 mg (=4 comprimés orodispersibles) en l'espace de 24 heures.
Dose unitaire maximale: 1 comprimé.
Zolmitriptan Zentiva agit également en cas de crises migraineuses liées à des modifications hormonales au cours des règles.
Zolmitriptan Zentiva ne convient pas pour le traitement préventif des migraines.
L'efficacité de Zolmitriptan Zentiva n'est pas influencée par le sexe, l'âge (voir plus loin «Enfants» et «Patients âgés»), la durée de la crise, des nausées existant avant le traitement ou par l'adjonction de mesures préventives anti-migraineuses.
Enfants (<12 ans)
Il n'y a pas de données concernant l'utilisation du zolmitriptan chez l'enfant. Il ne faut pas utiliser Zolmitriptan Zentiva chez les enfants.
Adolescents (12 à 17 ans)
L'efficacité de zolmitriptan chez les patients de 12 à 17 ans n'a pas été démontrée dans une étude clinique contrôlée contre placebo. Par conséquent, Zolmitriptan Zentiva ne doit pas être utilisé chez ce groupe de patients.
Patients âgés
Ni la sécurité d'emploi, ni l'efficacité de zolmitriptan n'ont été systématiquement étudiées chez des patients de plus de 65 ans.
Insuffisance hépatique
Chez les patients souffrant d'insuffisance hépatique légère ou modérée, aucune adaptation de la dose n'est nécessaire (voir «Pharmacocinétique»). Chez les patients souffrant d'insuffisance hépatique sévère, on recommande une dose maximale de 5 mg par 24 heures.
Insuffisance rénale
Chez les patients présentant une clairance de la créatinine supérieure à 15 ml/min (voir «Pharmacocinétique»), aucune adaptation de la dose n'est nécessaire.
Contre-indications
Zolmitriptan Zentiva est contre-indiqué en cas d'hypersensibilité connue au principe actif ou à l'un des excipients conformément à la composition.
Zolmitriptan Zentiva ne doit pas être utilisé pour le traitement des migraines hémiplégiques ou basilaires.
L'usage de Zolmitriptan Zentiva est contre-indiqué chez les patients qui ont les antécédents suivants:
Cardiopathies ischémiques, antécédents d'infarctus du myocarde, spasmes vasculaires coronaires (angor de Prinzmetal) ou hypertension artérielle mal équilibrée.
Mises en garde et précautions
Zolmitriptan Zentiva ne doit être utilisé qu'en cas de migraine clairement diagnostiquée.
Comme dans le cas des autres traitements contre les migraines aiguës, il faut exclure d'autres affections neurologiques potentiellement graves avant d'administrer Zolmitriptan Zentiva chez les patients n'ayant auparavant jamais souffert de migraine et chez les migraineux présentant des symptômes atypiques. On a rapporté le cas de patients traités par un agoniste des récepteurs 5HT1B/1D pour des céphalées graves qui, ultérieurement, se sont révélées être un signe d'accompagnement d'une lésion neurologique (troubles de l'irrigation cérébrale, hémorragie sous-arachnoïdienne). A ce propos, il convient de tenir compte du fait que les migraineux peuvent être exposés à un risque accru de certaines affections vasculaires cérébrales, telles que troubles de l'irrigation sanguine cérébrale, accident vasculaire cérébral, épisode ischémique transitoire ou hémorragie cérébrale ou sous-arachnoïdienne.
Si le patient ne répond pas au premier traitement par la dose habituelle, il faut reconsidérer le diagnostic avant d'administrer une deuxième dose.
A l'instar des autres agonistes 5HT1B/1D, Zolmitriptan Zentiva doit être administré avec prudence chez les patients présentant des antécédents d'épilepsie ou de lésions structurelles cérébrales qui abaissent le seuil épileptogène.
Comme les autres agonistes 5HT1B/1D, il ne faut pas administrer Zolmitriptan Zentiva à des patients susceptibles de présenter une maladie cardiaque non diagnostiquée sans en avoir exclu l'existence. Cela s'applique particulièrement aux femmes ménopausées, aux hommes de plus de 40 ans et aux patients présentant des facteurs de risque de cardiopathie coronaire.
Après l'administration de zolmitriptan, on a observé une sensation de pesanteur, d'oppression ou de striction thoracique. Toutefois, dans les études cliniques, ces symptômes ne s'accompagnaient pas d'arythmies ou de signes électrocardiographiques d'ischémie.
S'il apparaît des symptômes évocateurs d'une cardiopathie ischémique pendant le traitement, il convient de procéder aux examens appropriés avant la poursuite du traitement.
Il ne faut pas administrer d'agonistes 5HT1B/1D aux patients souffrant d'un syndrome de Wolff-Parkinson-White symptomatique ou d'arythmies consécutives à d'autres troubles de la conduction en rapport avec des voies accessoires.
Tout comme avec d'autres agonistes 5HT1B/1D, une augmentation passagère de la pression artérielle a été observée chez des patients souffrant d'hypertension ou non; dans de très rares cas, cette augmentation de la pression artérielle est survenue dans le contexte d'autres événements cliniques significatifs.
Des spasmes vasculaires prolongés ont été signalés avec les dérivés de l'ergotamine. Etant donné que ces effets peuvent s'additionner, il faut éviter l'administration simultanée d'ergotamine et d'agonistes 5HT1B/1D.
Dans des rares cas, un syndrome sérotoninergique prenant la forme d'un effet indésirable dangereux pour le pronostic vital peut apparaître lors de l'administration concomitante de triptanes et d'autres médicaments à effet sérotoninergique. Le syndrome sérotoninergique est caractérisé par l'association variée de certains symptômes qui peuvent typiquement inclure les symptômes suivants: hyperréflexie, tremblements, myoclonies, modifications de l'état psychique comme agitation, anxiété, hallucinations, irritabilité évoluant vers un délire et un coma ainsi que tachycardie, fluctuations de la tension artérielle, hyperthermie, nausée, vomissements, diarrhée. Le syndrome sérotoninergique peut apparaître lorsque deux ou plusieurs médicaments à effet sérotoninergique sont administrés en même temps ou si une posologie est augmentée (voir rubrique «Interactions»).
Si un traitement associant le Zolmitriptan Zentiva et un ISRS/IRSN s'avère nécessaire, une surveillance étroite du patient est conseillée, particulièrement lors de l'instauration du traitement, en cas d'augmentation des doses.
L'arrêt des médicaments sérotoninergiques entraîne généralement une amélioration rapide. Le traitement du syndrome sérotoninergique dépend du type et de la sévérité des symptômes.
L'utilisation prolongée de tout type de traitement antalgique pour soulager des céphalées peut entraîner une aggravation de celles-ci. Si une telle aggravation apparait ou est suspectée, le traitement doit être interrompu. Le diagnostic de céphalée par abus médicamenteux (Medication Overuse Headache) doit être suspecté chez les patients présentant des céphalées fréquentes ou quotidiennes malgré (ou à cause de) l'utilisation régulière de médicaments contre les céphalées.
L'administration simultanée de moclobémide, un inhibiteur sélectif de la MAO-A, multiplie par trois l'AUC du métabolite actif et augmente de 26% l'AUC du zolmitriptan (voir aussi «Interactions»). Par conséquent, la dose maximale recommandée chez les patients prenant un inhibiteur sélectif de la MAO-A ou un inhibiteur non sélectif de la MAO est de 5 mg par 24 heures.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé orodispersible, c.-à-d. qu'il est essentiellement «sans sodium».
Ce médicament contient 2.5 mg d'aspartam par comprimé orodispersible. L'aspartam contient une source de phénylalanine. Les patients souffrant de phénylcétonurie doivent être informés du fait que les comprimés orodispersibles de Zolmitriptan Zentiva contiennent de la phénylalanine (un constituant de l'aspartam). Un comprimé orodispersible de Zolmitriptan Zentiva contient 1,405 mg de phénylalanine.
Interactions
Dans des rares cas, un syndrome sérotoninergique peut apparaître prenant la forme d'un effet indésirables dangereux pour le pronostic vital lors de l'administration concomitante de triptanes et d'autres médicaments à effet sérotoninergique plus ou moins prononcé comme entre autres les «inhibiteurs sélectifs de la recapture de la sérotonine» (SSRI), (par ex. fluoxétine, paroxétine, sertraline), les «inhibiteurs sélectifs de la recapture de la sérotonine/noradrénaline» (SNRI) (par ex. venlafaxine, duloxétine), les inhibiteurs de la MAO, le L-tryptophane, le lithium, les antidépresseurs tricycliques (voir rubrique «Mises en garde et précautions»).
Rien ne suggère des interactions pharmacocinétiques avec la caféine, le métoclopramide, la sélégiline, la fluoxétine (20 mg/24 heures), l'ergotamine, la dihydroergotamine, le paracétamol ou le pizotifène. Aucun ISRS autre que la fluoxétine n'a été étudié.
La fréquence des effets indésirables peut être augmentée lors de l'utilisation concomitante de triptans et de préparations contenant du millepertuis (Hypericum perforatum).
Il existe de discrètes interactions pharmacocinétiques avec la rifampicine et le propranolol, mais elles ne sont toutefois pas cliniquement significatives. En cas d'administration simultanée de propranolol (160 mg/jour) durant 1 semaine, la Cmax et l'AUC du zolmitriptan peuvent être multipliées par 1,5. La Cmax et l'AUC du métabolite N-déméthylé peuvent diminuer de 30% et 15% respectivement. Après administration simultanée de propranolol et de zolmitriptan, aucune interaction n'a été constatée du point de vue de la pression artérielle ou du pouls.
Le zolmitriptan est métabolisé par le système du cytochrome P450, essentiellement par l'iso-enzyme CYP1A2.
Après l'administration de cimétidine, un inhibiteur global du système P450, la demi-vie et l'AUC du zolmitriptan et de son métabolite actif ont été environ doublées. C'est pourquoi, pour les patients qui prennent de la cimétidine, la dose journalière maximale recommandée est de 5 mg de zolmitriptan.
Compte tenu du profil général des interactions du zolmitriptan, une interaction avec les inhibiteurs spécifiques de l'iso-enzyme CYP1A2 du cytochrome P450 ne peut pas être exclue. C'est pourquoi, lors de l'utilisation concomitante de substances de cette classe (par exemple fluvoxamine et quinolones), la dose journalière maximale recommandée est également de 5 mg de zolmitriptan.
Le principal métabolite inactif du zolmitriptan, le dérivé de l'acide indolacétique (2161W92), est formé à partir du métabolite N-déméthylé actif (N-déméthylé-zolmitriptan) par l'activité de la MAO-A. Cela a été démontré par l'administration simultanée de moclobémide, un inhibiteur sélectif de la MAO-A, qui a triplé l'AUC du métabolite actif N-déméthylé-zolmitriptan, alors que les taux de zolmitriptan n'ont été que très peu influencés (augmentation de l'AUC de 26%). C'est pourquoi, en cas de prise concomitante d'un inhibiteur de la MAO-A, il ne faut pas utiliser plus de 5 mg de zolmitriptan par 24 heures.
Les études menées avec zolmitriptan et des ergotamines chez des volontaires n'ont pas fourni d'indice suggérant des interactions pharmacocinétiques importantes ou cliniquement significatives. Au vu de la possibilité d'un effet vasoconstricteur additif, il faut néanmoins éviter l'administration simultanée de dérivés de l'ergotamine. Par conséquent, il ne faut pas administrer des préparations contenant de l'ergotamine au cours des 24 heures qui précèdent et des 6 heures qui suivent l'administration d'un agoniste 5HT1B/1D.
Il ne faut pas utiliser d'autres agonistes 5HT1B/1D dans les 24 heures qui suivent l'administration de Zolmitriptan Zentiva.
Grossesse/Allaitement
La sécurité d'emploi du zolmitriptan n'a pas été étudiée chez la femme enceinte. Les essais chez l'animal n'ont montré aucun effet tératogène. Toutefois, quelques résultats issus d'études sur l'embryotoxicité indiquent une diminution de la survie des embryons. Zolmitriptan Zentiva ne doit pas être administré durant la grossesse, sauf en cas de nécessité absolue.
Des études animales montrent que le zolmitriptan diffuse aussi dans le lait maternel. En conséquence, le zolmitriptan sera administré uniquement avec prudence chez la femme qui allaite. Pour la sécurité du nourrisson, ne pas allaiter pendant les 24 heures suivant la prise de Zolmitriptan Zentiva.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Zolmitriptan Zentiva peut diminuer la capacité des patients à conduire un véhicule ou à manipuler une machine. Il faut prendre en compte la possibilité de survenue de somnolence.
Effets indésirables
Les effets indésirables sont généralement légers à modérés et transitoires et ils disparaissent spontanément sans traitement supplémentaire.
Les possibles effets indésirables apparaissent souvent dans les quatre premières heures et leur fréquence n'augmente pas après plusieurs administrations.
Ces effets indésirables peuvent apparaître de manière fréquente (>1/100, <1/10), occasionnel (>1/1'000, <1/100), rare (>1/10'000, <1/1'000) ou très rare (<1/10'000):
Affections du système immunitaire
Rares: Réactions d'hypersensibilité, y compris anaphylaxie et réactions anaphylactoïdes.
Affections du système nerveux
Fréquents: Vertiges, céphalées, somnolence, sensation de chaleur, paresthésies et hyperesthésie.
Affections cardiaques/affections vasculaires
Fréquents: Palpitations.
Occasionnels: Tachycardie, augmentation passagère de la pression artérielle.
Très rares: Infarctus du myocarde, angine de poitrine, événements cardiaques graves chez des patients sans cardiopathie sous-jacente, spasmes vasculaires coronaires.
Affections gastro-intestinales
Fréquents: Douleurs abdominales, nausées, vomissements, sécheresse de la bouche, dysphagie.
Très rares: Diarrhée sanguinolente, infarctus gastro-intestinal ou nécrose, complications gastro-intestinales ischémiques, y compris colite ischémique et infarctus splénique.
Affections de la peau et du tissu sous-cutané
Rares: Urticaire, angio-oedème.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: Faiblesse musculaire, myalgies.
Affections du rein et des voies urinaires
Occasionnels: Polyurie, augmentation de la fréquence des mictions.
Très rares: Besoin impérieux d'uriner.
Troubles généraux
Fréquents: Asthénie, sensation de lourdeur, de striction, de douleur ou de pression dans le cou, la nuque, les mâchoires, les membres et le thorax.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Chez des volontaires ayant reçu une dose orale de 50 mg, on a constaté en général une sédation.
La demi-vie d'élimination du zolmitriptan est de 2,5 à 3 heures (voir «Pharmacocinétique»). C'est pourquoi, les patients ayant pris une dose excessive doivent être surveillés durant au moins 15 heures ou aussi longtemps que les symptômes ou les signes de surdosage persistent.
On ne dispose d'aucun antidote spécifique du zolmitriptan. Il est recommandé de prendre des mesures de soins intensifs en cas d'intoxication grave. Celles-ci comportent l'ouverture des voies respiratoires, l'assurance d'un apport d'oxygène suffisant et de la ventilation ainsi que la surveillance et le soutien du système cardio-vasculaire.
L'influence d'une hémodialyse ou d'une dialyse péritonéale sur les concentrations sériques de zolmitriptan n'est pas connue.
Propriétés/Effets
Code ATC: N02CC03
Pharmacodynamie
Lors d'études précliniques, il a pu être démontré que le zolmitriptan est un agoniste sélectif des sous-types de récepteurs recombinés 5HT1D et 5HT1B des vaisseaux humains. Le zolmitriptan est un agoniste hautement spécifique des récepteurs 5HT1B/1D avec une affinité modeste pour les récepteurs 5HT1A. Il ne possède ni une affinité significative (sur la base des études effectuées avec un radioligand) ni une activité pharmacologique pour les récepteurs suivants: 5HT2, 5HT3, 5HT4, alpha1-, alpha2-, bêta1-adrénergiques, H1-, H2-histaminiques, muscariniques, dopaminergiques1, dopaminergiques2.
Les structures du cerveau humain sensibles à la douleur sont les vaisseaux sanguins et le système vasculaire de la dure-mère, innervés par les fibres afférentes trigéminées. Dans le modèle animal, l'administration de zolmitriptan provoque une vasoconstriction en raison de son activité agoniste sur les récepteurs vasculaires 5HT1. Cette vasoconstriction est liée au blocage de la libération du peptide lié au gène de la calcitonine (CGRP), du peptide intestinal vasoactif (VIP) ainsi que de la substance P. Ces deux mécanismes, vasoconstriction et inhibition de la libération des neuropeptides, affaiblissent la crise migraineuse, ce qui se traduit par une atténuation des douleurs et une amélioration des symptômes d'accompagnement de la migraine, tels que nausées, vomissements, photophobie et phonophobie.
Outre ces effets périphériques, le zolmitriptan agit sur le système nerveux central, de sorte qu'il touche à la fois les zones périphériques et les centres migraineux du tronc cérébral. Cela pourrait expliquer la constance de son action sur plusieurs crises chez le même patient. La vasodilatation est due à l'activation d'un arc réflexe qui passe par les fibres orthodromiques trigéminales et l'innervation parasympathique de la circulation cérébrale par la libération du VIP, le plus important médiateur du déclenchement de la migraine. Le zolmitriptan inhibe cet arc réflexe et la libération du VIP.
Efficacité clinique
Quatre études randomisées menées en double insu comparativement à un placebo ont permis d'évaluer l'efficacité de 1 mg, 2,5 mg et 5 mg de zolmitriptan pour le traitement aigu de la migraine. La réponse au traitement par zolmitriptan était définie par la transformation des céphalées sévères ou moyennement sévères en céphalées légères ou par la disparition de la céphalée. Cette réponse a été évaluée 1, 2 et 4 heures après la prise. Les investigateurs ont également évalué l'effet de zolmitriptan sur les symptômes associés à la migraine, à savoir nausées, photophobie et phonophobie. Dans toutes ces études, l'efficacité de zolmitriptan pour le traitement des crises migraineuses aiguës a été comparée à celle d'un placebo.
Les taux de réponse ont été significativement plus élevés 2 heures après la prise de zolmitriptan qu'après la prise du placebo (sauf chez les patients qui avaient pris 1 mg de zolmitriptan).
Dans deux études dans lesquelles l'effet de la dose de 1 mg de zolmitriptan a été évalué, les taux de réponse au bout de 2 heures ont été significativement plus élevés avec les doses de 2,5 et 5 mg de zolmitriptan qu'avec la dose de 1 mg. Il n'y avait toutefois pas de différences statistiquement significatives entre 2,5 mg et 5 mg de zolmitriptan, sur le plan du principal critère d'évaluation (= taux de réponse deux heures après la prise). Le tableau ci-après récapitule les résultats des études susmentionnées.
Taux de réponse 2 heures après la prise de zolmitriptan, dans des études menées comparativement à un placebo
Etude | Doses de zolmitriptan | |||
|---|---|---|---|---|
Placebo | 1 mg | 2,5 mg | 5 mg | |
006 | 15% (3/20) | 27% (6/22) | – | 62% (13/21) |
008 | 19% (17/88) | Sans objet | – | 66% (118/179) |
0017 | 34% (41/121) | 53% (66/125) | 65% (169/260) | 67% (163/245) |
0042 | 36% (33/92) | – | 62% (110/178) | – |
Total | 29% (94/321) | 49% (72/147) | 64% (279/438) | 66% (294/445) |
Chez les patients présentant des symptômes associés à la migraine (nausées, photophobie et phonophobie), zolmitriptan a induit une nette amélioration de ces symptômes, comparativement au placebo.
Pharmacocinétique
Absorption
Après administration orale chez l'être humain, le zolmitriptan est rapidement et bien absorbé (64%). La biodisponibilité absolue de la substance de départ est en moyenne de l'ordre de 40% chez l'homme et est quelque peu plus élevée chez la femme.
Lors d'une administration unique chez des sujets sains, les AUC et la Cmax du zolmitriptan et de son métabolite actif N-déméthylé-zolmitriptan sont proportionnelles à la dose pour une posologie de 2,5 à 50 mg. L'absorption se modifie plus rapidement; la Cmax est atteinte en l'espace de 2 à 2,8 heures et les concentrations plasmatiques sont ensuite maintenues durant 4–6 heures. L'absorption du zolmitriptan n'est que faiblement influencée par la prise d'aliments. Il n'existe aucun indice d'accumulation lors de prise répétée de zolmitriptan.
Distribution
Après administration orale de 2,5 mg, le volume de distribution est de 7,0 l/kg. Le taux de liaison aux protéines plasmatiques est faible (environ 25%).
Métabolisme
Le zolmitriptan est soumis à une importante biotransformation hépatique. Il est métabolisé par le système du cytochrome P450, essentiellement par l'iso-enzyme CYP1A2. Trois métabolites principaux du zolmitriptan sont formés: un dérivé de l'acide indolacétique (le principal métabolite dans le plasma et l'urine), un dérivé N-oxydé et un dérivé N-déméthylé. Seul le métabolite N-déméthylé (N-déméthylé-zolmitriptan) est actif. Il est décomposé par le système enzymatique de la monoamine oxydase A (MAO-A) et s'est révélé être 2–6 fois plus puissant que le zolmitriptan chez l'animal. Les concentrations plasmatiques du N-déméthylé-zolmitriptan représentent environ 50% de celles de la molécule mère. On peut donc penser que ce métabolite contribue à l'effet thérapeutique de zolmitriptan.
Elimination
Après la biotransformation hépatique, les métabolites sont éliminés dans l'urine. Plus de 60% d'une dose unique sont éliminés dans l'urine (surtout sous forme d'indolacétate) et 30% environ dans les fèces (surtout sous forme de zolmitriptan inchangé).
Après administration i.v., la clairance plasmatique moyenne est d'environ 10 ml/min/kg, dont 1/3 revient à la clairance rénale. La clairance rénale étant supérieure à la filtration glomérulaire, on peut admettre l'existence d'une sécrétion tubulaire rénale.
La demi-vie d'élimination moyenne du zolmitriptan est de 2,5–3 heures et celle de ses métabolites est analogue, ce qui permet de déduire que l'élimination est limitée par la formation des métabolites.
Cinétique pour certains groupes de patients
Chez les patients présentant une insuffisance rénale modérée à sévère, la clairance rénale du zolmitriptan et de ses métabolites est 7 à 8 fois plus faible que chez les sujets sains, bien que l'AUC de la molécule mère et du métabolite actif ne soit que peu augmentée (respectivement 16% et 35%). Une accumulation des métabolites inactifs lors d'administrations répétées est possible. La demi-vie d'élimination a augmenté d'une heure, et est passée à 3–3,5 heures. Ces paramètres s'inscrivaient dans la même fourchette que celle observée chez les individus sains.
En cas d'insuffisance hépatique, le métabolisme du zolmitriptan diminue proportionnellement au degré de gravité de l'insuffisance. Par rapport aux personnes saines, l'AUC et la Cmax du zolmitriptan étaient augmentées de 94% et 50%, respectivement, chez les patients présentant une insuffisance hépatique modérée, et de 226% et 47%, respectivement, en cas d'insuffisance hépatique sévère. Les taux plasmatiques des métabolites, y compris du métabolite actif, étaient réduits. Chez les patients présentant une insuffisance hépatique modérée, l'AUC et la Cmax du métabolite actif N-déméthylé-zolmitriptan étaient diminuées de 33% et 44%, respectivement; cette diminution était respectivement de 82% et 90% en cas d'insuffisance hépatique sévère.
La demi-vie du zolmitriptan est de 4,7 heures chez les sujets sains, de 7,3 heures en cas d'insuffisance hépatique modérée et de 12 heures en cas d'insuffisance hépatique sévère. La demi-vie du métabolite actif N-déméthylé-zolmitriptan est de 5,7 heures chez les sujets sains, de 7,5 heures en cas d'insuffisance hépatique modérée et de 7,8 heures en cas d'insuffisance hépatique sévère.
La pharmacocinétique du zolmitriptan chez des personnes âgées en bonne santé s'est avérée comparable à celle de sujets jeunes en bonne santé.
Données précliniques
Dans une étude de tératogénicité menée par voie orale chez des rats et lapins, la dose maximale tolérée (qui était respectivement de 1200 mg/kg/jour et de 30 mg/kg/jour) n'a provoqué aucun effet tératogène.
Les nombreuses études sur la génotoxicité permettent de conclure que zolmitriptan ne présente vraisemblablement aucun risque génétique pour l'être humain.
Les études de cancérogénicité menées chez le rat et la souris, aux doses maximales jugées indiquées, n'ont montré aucun signe de tumorigénicité.
Les études de reproduction menées chez le rat avec des doses limitées par la toxicité n'ont montré aucun effet sur la fertilité.
Remarques particulières
Conservation
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Conservez Zolmitriptan Zentiva comprimés orodispersibles dans l'emballage d'origine, à une température ne dépassant pas 30 °C et hors de la portée des enfants.
Numéro d’autorisation
61646 (Swissmedic).
Titulaire de l’autorisation
Helvepharm AG, Frauenfeld.
Mise à jour de l’information
Avril 2020.
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


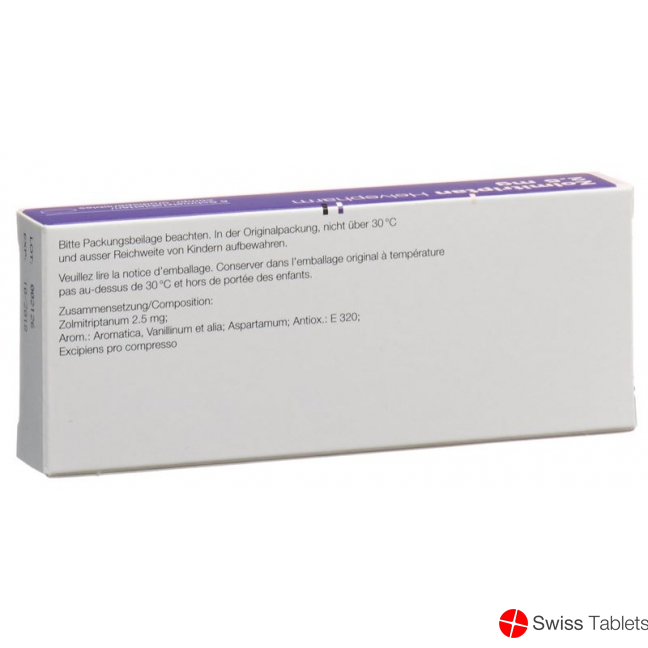
 Deutsch
Deutsch French
French Italian
Italian







