Evicel Lösung 2x 1ml Set buy online
Evicel Lös 2x1ml Set
-
389.55 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: JOHNSON & JOHNSON AG
- Product Code: 5140131
- ATC-code B02BC30
- EAN 7680612780014
Ingredients:
Mannitol, Natriumchlorid, Blutgerinnungsfaktor IIa human (Thrombin human) 800-1200 UI, Albumin human, Glycin, Blutgerinnungsfaktor I (human) 50-90 mg, Arginin hydrochlorid, Natrium acetat-3-Wasser, Calciumchlorid-2-Wasser, Natriumcitrat-2-Wasser, Wasser für Injektionszwecke 1 ml.

Description
AMZV
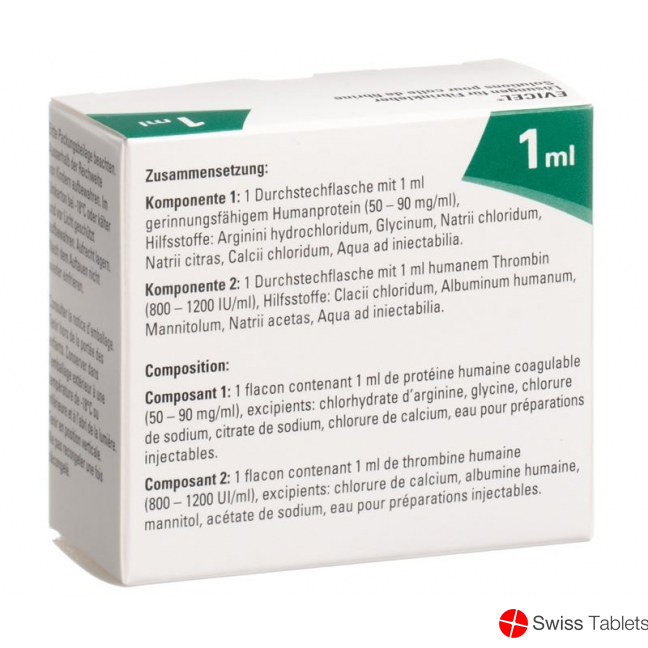
Zusammensetzung
Lösungen für Fibrinkleber
Komponente 1
Wirkstoff: Gerinnungsfähiges humanes Protein (vorwiegend Fibrinogen und Fibronectin).
Hilfsstoffe: Arginini hydrochloridum, Glycinum, Natrii chloridum, Natrii citras, Calcii chloridum, Aqua ad iniectabilia.
Komponente 2
Wirkstoffe: Humanes Thrombin.
Hilfsstoffe: Calcii chloridum, Albuminum humanum, Mannitolum, Natrii acetas, Aqua ad iniectabilia.
Galenische Form und Wirkstoffmenge pro Einheit
EVICEL Humaner Fibrinkleber-Kit für die Chirurgie umfasst eine Zweikomponentenpackung, die eine Fibrinogenlösung und eine Thrombin-Lösung sowie eine Packung mit dem Set zur Applikation enthält.
Die beiden Komponenten setzen sich wie folgt zusammen:
Komponente 1
Fibrinogenlösung:
Wirkstoff: Gerinnungsfähiges humanes Protein (vorwiegend Fibrinogen und Fibronectin) 50-90 mg, Gesamtproteinmenge 80-120 mg.
Hilfsstoffe: Arginini hydrochloridum 18,5-22,5 mg, Glycinum 7-9 mg, Natrii chloridum 6,9-7,1 mg, Natrii citras 2,2-3,1 mg, Calcii chloridum 0,14-0,16 mg, Aqua ad iniectabilia ad 1 ml.
Komponente 2
Thrombin-Lösung:
Wirkstoffe: Humanes Thrombin 800-1200 IU, Calcii chloridum 5,6-6,2 mg.
Hilfsstoffe: Albuminum humanum 5,0-6,5 mg, Mannitolum 18,5-20,5 mg, Natrii acetas 2,5-2,7 mg, Aqua ad iniectabilia ad 1 ml.
Indikationen/Anwendungsmöglichkeiten
Indikationen
EVICEL wird zur unterstützenden Behandlung in der Chirurgie zur Verbesserung der Blutstillung eingesetzt, wenn chirurgische Standardmassnahmen unzureichend sind.
EVICEL ist ausserdem als Nahtunterstützung zur Hämostase in der Gefässchirurgie und für die Nahtversiegelung beim Verschliessen der Dura Mater indiziert.
Dosierung/Anwendung
Die Verwendung von EVICEL ist erfahrenen Chirurgen vorbehalten, die auf die Anwendung von EVICEL geschult wurden.
Bei der Applikation von Evicel muss der Druck innerhalb des vom Hersteller des Sprühapplikators empfohlenen Bereichs liegen (s. «Warnhinweise und Vorsichtsmassnahmen»).
Dosierung
Die zu applizierende Menge EVICEL und die Anwendungshäufigkeit sollte sich stets nach der klinischen Situation des Patienten richten.
Die zu applizierende Dosis orientiert sich unter anderem an Faktoren wie der Art des chirurgischen Eingriffes, der Grösse der Behandlungsbedürftigen Fläche, der Art der beabsichtigten Anwendung sowie der Anzahl der Anwendungen.
Die Anwendung des Produktes muss vom behandelnden Arzt an die individuellen Bedürfnisse des Patienten angepasst werden. In kontrollierten klinischen gefässchirurgischen Studien wurden im Einzelfall Dosen von bis zu 4 ml verwendet, für die Abdichtung von Nahtlinien beim Verschluss der Dura mater Dosen von bis zu 8 ml, in der Retroperitoneal oder Intraabdominalchirurgie hingegen im Einzelfall Dosen von bis zu 10 ml. Für manche Eingriffe (z.B. bei traumatischen Verletzungen der Leber) werden gegebenenfalls grössere Volumen benötigt.
Die anfängliche Produktmenge, die auf eine bestimmte anatomische Stelle oder Gewebeoberfläche appliziert werden soll, muss ausreichend sein, um die gesamte behandlungsbedürftige Gewebefläche vollständig zu bedecken. Die Anwendung kann bei Bedarf wiederholt werden.
EVICEL wird in kurzen Stössen (0,1-0,2 ml) auf das Gewebe aufgesprüht oder tropfenweise aufgebracht, so dass eine gleichmässig dünne Schicht entsteht.
Erwachsene:
Die übliche Dosierung beträgt 5 bis 10 ml des kombinierten Produktes. Es dürfen nicht mehr als 20 ml verabreicht werden.
Spezielle Dosierungsanweisungen:
Kinder und Jugendliche:
Die vorliegenden Daten reichen nicht aus, um die Sicherheit und Wirksamkeit von EVICEL bei Kindern zu belegen.
Anwendung
Zur epiläsionalen Anwendung.
Zur Vermeidung der Gefahr einer lebensbedrohlichen Luft- oder Gasembolie darf EVICEL nur mit unter Druck stehendem CO2-Gas aufgesprüht werden.
Vor dem Auftragen von EVICEL muss die Wundoberfläche mittels Standardtechniken getrocknet werden (z.B. intermittierende Anwendung von Kompressen, Tupfern, Absauggeräten).
Das Produkt darf nur gemäss den Anweisungen und mit den dafür empfohlenen Geräten rekonstituiert und verabreicht werden.
Im Absatz «Sprayapplikation» finden sich spezielle Sprayempfehlungen zum erforderlichen Druck und Abstand vom Gewebe für das jeweilige chirurgische Verfahren sowie zur Länge der Applikationsspitze.
Kontraindikationen
- EVICEL darf nicht intravaskulär angewendet werden.
- Überempfindlichkeit gegen die Wirkstoffe oder einen der der Hilfsstoffe.
- Eine Spray-Applikation von EVICEL darf nicht bei endoskopischen Verfahren eingesetzt werden. Für Laparoskopie siehe entsprechenden Abschnitt bei Warnhinweise und Vorsichtsmassnahmen
- EVICEL darf nicht für die Abdichtung der Nahtlinie in der Dura mater verwendet werden, wenn nach dem Vernähen Spalten von mehr als 2 mm verbleiben.
- EVICEL darf nicht als Kleber für die Fixierung von Dura-Patches verwendet werden.
- EVICEL darf nicht als Versiegler verwendet werden, wenn die Dura mater nicht vernäht werden kann.
Warnhinweise und Vorsichtsmassnahmen
- Nur zur epiläsionalen Anwendung. Nicht intravaskulär anwenden.
- Wenn das Produkt versehentlich intravaskulär angewendet wird, können lebensbedrohliche thromboembolische Komplikationen auftreten.
- Vor der Anwendung von EVICEL ist darauf zu achten, dass Teile des Körpers, die sich ausserhalb des gewünschten Anwendungsbereiches befinden, ausreichend geschützt (d.h. bedeckt) sind, um zu verhindern, dass der Fibrinkleber auf Stellen appliziert wird, wo er nicht erwünscht ist.
- Zur Unterstützung der Anwendung dieses Produktes als Gewebekleber, bei der endoskopischen Anwendung zur Behandlung von Blutungen oder bei gastrointestinalen Anastomosen liegen noch keine ausreichenden Daten vor.
- Die gleichzeitige Verwendung von Evicel zur Abdichtung von Dura-Nahtlinien mit Implantaten aus synthetischen Materialien oder Dura-Patches wurde bislang nicht in klinischen Studien untersucht.
- Die Verwendung von EVICEL bei Patienten, die sich innerhalb von 7 Tagen nach der Operation einer Strahlentherapie unterziehen, wurde nicht untersucht.
- Es ist nicht bekannt, ob eine Strahlentherapie in der frühen postoperativen Phase die Wirksamkeit von Fibrinklebern beeinträchtigen könnte, wenn sie für die Abdichtung von Nahtlinien beim Verschluss der Dura mater verwendet werden.
- Vor der Applikation von EVICEL zur Abdichtung der Dura-Nahtlinie sollte eine vollständige Blutstillung erreicht werden.
- Die Verwendung von EVICEL als Versiegler bei transphenoidalen oder otoneurochirurgischen Verfahren wurde bislang nicht untersucht.
- Bei der Verwendung eines Sprühapplikators mit Druckregler zur Verabreichung von Evicel sind lebensbedrohliche Luft- oder Gasembolien aufgetreten. Diese Zwischenfälle scheinen in Zusammenhang zu stehen mit der Anwendung des Sprühapplikators bei höheren als den empfohlenen Drücken und/oder in zu geringem Abstand von der Gewebeoberfläche.
- Die Spray-Applikation von EVICEL darf nur verwendet werden, wenn der Sprühabstand exakt beurteilt werden kann, besonders während einer Laparoskopie. Der Sprühabstand vom Gewebe und der Druck müssen innerhalb der vom Hersteller empfohlenen Bereiche liegen. (siehe Tabelle im Abschnitt «Sprayapplikation»). Beim Aufsprühen von EVICEL sollten Veränderungen von Blutdruck, Puls, Sauerstoffsättigung und exspiratorischem CO2 wegen der Gefahr einer möglichen Luft- oder Gasembolie überwacht werden.
- Bei der Verwendung von separaten Zubehörspitzen mit diesem Produkt muss die Gebrauchsanweisung der Spitzen befolgt werden. EVICEL sollte als dünne Schicht aufgetragen werden. Eine zu dicke Schicht kann die Wirksamkeit des Produktes und den Wundheilungsprozess negativ beeinflussen.
- Wie bei jedem proteinhaltigen Produkt sind auch bei EVICEL Überempfindlichkeitsreaktionen möglich. Anzeichen für Überempfindlichkeitsreaktionen sind Quaddeln, generalisierte Urtikaria, Engegefühl in der Brust, Keuchatmung, Hypotonie und anaphylaktischer Schock. Wenn diese Symptome auftreten, muss die Anwendung des Fibrinklebers sofort abgebrochen werden.
- Im Fall eines Schockzustandes sind die gängigen medizinischen Massnahmen der Schockbehandlung durchzuführen.
- Standardmethoden zur Prävention von Infektionskrankheiten durch Arzneimittel, die aus menschlichem Blut oder Plasma hergestellt werden, beinhalten eine strenge Spenderauswahl, ein Testen der Einzelspenden und Plasmapools auf spezifische Infektionsmarker und die Einbeziehung wirksamer Inaktivierungs- und Eliminationsschritte in den Herstellungsprozess. Trotz dieser Massnahmen kann bei der Anwendung von Arzneimitteln, die aus menschlichem Blut oder Plasma hergestellt sind, die Möglichkeit einer Übertragung von Infektionserregern nicht vollständig ausgeschlossen werden. Dies gilt auch für unbekannte oder neu aufgetretene Viren sowie andere Krankheitserreger.
- Die eingesetzten Massnahmen gelten als wirksam gegen behüllte Viren, wie z.B. HIV, HCV und HBV.
- Die eingesetzten Massnahmen sind jedoch gegen unbehüllte Viren, wie z.B. HAV und Parvovirus B19, möglicherweise von begrenzter Wirksamkeit.
- Infektionen mit dem Parvovirus B19 können vor allem für Schwangere (Infektion der Feten) und für Menschen mit Immunschwäche oder gesteigerter Erythropoese (z.B. hämolytische Anämie) gefährlich sein.
Es wird dringend empfohlen, bei jeder Anwendung von EVICEL die Bezeichnung und die Chargennummer des Produktes zu dokumentieren, um eine Verbindung zwischen dem Patienten und der Produktcharge herstellen zu können.
Interaktionen
Formale Interaktionsstudien wurden nicht durchgeführt. Wie vergleichbare Arzneimittel oder Thrombinlösungen kann der Fibrinkleber nach Exposition gegenüber alkohol-, jod- oder schwermetallhaltigen Lösungen (wie z.B. antiseptischen Lösungen) denaturiert werden. Solche Substanzen müssen daher vor dem Auftragen des Fibrinklebers weitestgehend entfernt werden.
Schwangerschaft/Stillzeit
Zur Sicherheit von Fibrinklebern/Hämostatika während der Schwangerschaft oder Stillzeit wurden bisher keine kontrollierten klinischen Studien durchgeführt. Tierexperimentelle Studien reichen zur Beurteilung der Sicherheit im Hinblick auf die Fortpflanzung, die Entwicklung des Embryos oder Feten, den Verlauf der Schwangerschaft und die peri- und postnatale Entwicklung nicht aus. Das Produkt sollte Schwangeren und stillenden Müttern deshalb nur bei strenger Indikationsstellung verabreicht werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Nicht relevant.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Bei Patienten, die mit Fibrinkleber/Hämostatika behandelt wurden, können in seltenen Fällen Überempfindlichkeitsreaktionen oder allergische Reaktionen auftreten (z.B. Angioödem, Brennen und Stechen an der Applikationsstelle, Bronchospasmus, Schüttelfrost, Hitzewallungen, Gesichtsrötung (Flush), generalisierte Urtikaria, Kopfschmerz, Nesselausschlag, Hypotonie, Lethargie, Übelkeit, Ruhelosigkeit, Tachykardie, Engegefühl in der Brust, Kribbeln, Erbrechen, Keuchatmung). In vereinzelten Fällen schritten diese Reaktionen zu einem schweren anaphylaktischen Schock fort. Solche Reaktionen treten besonders dann auf, wenn das Präparat mehrmals angewendet oder Patienten verabreicht wird, bei denen eine Überempfindlichkeit gegen die Bestandteile des Präparats bekannt ist.
In seltenen Fällen kann es zur Bildung von Antikörpern gegen die Bestandteile von Fibrinklebern/Hämostatika kommen.
Die versehentliche intravaskuläre Injektion kann zu einem thromboembolischen Ereignis und disseminierter intravasaler Gerinnung (DIG) führen. Ferner besteht auch ein Risiko für eine anaphylaktische Reaktion (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Bei der Verwendung von Spraygeräten mit Druckreglern zur Verabreichung von EVICEL sind lebensbedrohliche Luft- und Gasembolien aufgetreten. Diese Zwischenfälle stehen offensichtlich in Zusammenhang mit der Anwendung des Spraygeräts bei höheren als den empfohlenen Drücken und/oder zu geringem Abstand von der Gewebeoberfläche.
Zur Sicherheit in Bezug auf übertragbare Erreger siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen».
Die untenstehende Übersicht entspricht der Systemorganklassifizierung der MedDRA-Terminologie (SOC und bevorzugte Begriffe).
Die Häufigkeiten wurden nach der folgenden Regel beurteilt: sehr häufig (≥1/10); häufig (≥1/100 bis <1/10); gelegentlich (≥1/1000 bis <1/100); selten (≥1/10'000 bis <1/1000); sehr selten (<1/10'000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Die folgenden Nebenwirkungen, die bei retroperitonealen oder intraabdominalen Eingriffen und in der Neurochirurgie auftraten, traten häufig auf (definert als ≥1/100, <1/10). Die Häufigkeit aller Nebenwirkungen in der Gefässchirurgie war «gelegentlich» (definiert als >1/1000<1/100).
Nebenwirkungen in der Studie zur Retroperitoneal- oder Intraabdominalchirurgie
Infektionen und parasitäre Erkrankungen
Häufig: Abdominaler Abszess.
Nebenwirkungen in der Studie zur Gefässchirurgie
Infektionen und parasitäre Erkrankungen
Gelegentlich: Transplantatinfektion, Staphylococcus-Infektion.
Gefässerkrankungen
Gelegentlich: Hämatome.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Periphere Ödeme.
Untersuchungen
Gelegentlich: Erniedrigte Hämoglobinwerte.
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Gelegentlich: Blutungen an der Einschnittstelle, Verschlussereignis bei Gefässtransplantat, Wunde, postoperative Hämatome, postoperative Komplikationen mit der Wunde.
Nebenwirkungen in der Studie zur Neurochirurgie
Infektionen und parasitäre Erkrankungen
Häufig: Meningitis.
Erkrankungen des Nervensystems
Häufig: Intrakranielle Hypotonie (Liquor-Leckage), Liquor-Rhinorrhoe, Kopfschmerzen, Hydrocephalus, subdurales Hygrom.
Gefässerkrankungen
Häufig: Hämatome.
Nebenwirkungen in der Studie der Retroperitoneal- oder Intraabdominalchirurgie
Bei den 135 Patienten, die sich einer retroperitonealen oder intraabdominalen Operation unterzogen (67 Patienten wurden mit EVICEL und 68 Patienten mit einem Kontrollpräparat behandelt), stand nach Einschätzung der Prüfer keine Nebenwirkung in ursächlichem Zusammenhang mit der Studienbehandlung. Der Sponsor beurteilte jedoch drei (3) schwerwiegende Nebenwirkungen (ein abdominaler Abszess in der EVICEL-Gruppe und ein abdominaler und ein Beckenabszess in der Kontrollgruppe) als möglicherweise mit der Studienbehandlung in Zusammenhang stehend.
Nebenwirkungen in der Studie der Gefässchirurgie
In einer kontrollierten Studie mit 147 Patienten, die ein Gefässtransplantat erhielten (75 Patienten in der EVICEL- und 72 Patienten in der Kontrollgruppe), trat bei insgesamt 16 Patienten während der Beobachtungsdauer eine Transplantatthrombose/ein Verschlussereignis auf. Die Ereignisse waren in beiden Behandlungsarmen gleich verteilt mit jeweils 8 Ereignissen in der EVICEL- und der Kontrollgruppe.
Es wurde nach Zulassung eine nicht-interventionelle Unbedenklichkeitsstudie mit 300 Patienten durchgeführt, die sich einer Gefässoperation unter Verwendung von EVICEL unterzogen. Die Überwachung der Sicherheit konzentrierte sich auf spezifische Nebenwirkungen der Transplantatdurchgängigkeit, thrombotische Ereignisse und Blutungen. Während der Studie wurden keine Nebenwirkungen berichtet.
Nebenwirkungen in der Studie der Neurochirurgie
In einer kontrollierten Studie mit 139 Patienten, die sich einem neurochirurgischen Wahleingriff unterzogen (89 Patienten in der Evicel--und 50 in der Kontrollgruppe), traten bei insgesamt 7 behandelten Patienten neun unerwünschte Ereignisse auf, die möglicherweise mit EVICEL in Zusammenhang standen. Dazu gehörten intrakranielle Hypotonie (Liquor-Leckage), Liquor-Rhinorrhoe, Meningitis, Kopfschmerzen, Hydrocephalus, subdurales Hygrom und Hämatom.
Eine postoperative Liquor-Leckage trat innerhalb von 30 Tagen nach OP bei 4/89 (4,5%) der mit EVICEL behandelten Patienten (zwei Fälle von Liquor-Leckage mit gestörter Wundheilung und zwei Fälle von Rhinorrhoe) und bei 1/50 (2,0%) der mit zusätzlichen Nähten behandelten Patienten auf.
Überdosierung
Es wurden keine Fälle von Überdosierung mit EVICEL berichtet.
Eigenschaften/Wirkungen
ATC-Code: B02BC
Wirkungsmechanismus/Pharmakodynamik
Die Fibrin-Reaktion leitet die letzte Phase der physiologischen Blutgerinnung ein. Die Umwandlung von Fibrinogen in Fibrin erfolgt durch Spaltung des Fibrinogens in Fibrinmonomere und Fibrinopeptide. Die Fibrinmonomere vernetzen sich und bilden ein Fibringerinnsel. Faktor XIIIa, die durch Thrombin aktivierte Form von Faktor XIII, stabilisiert das Fibringerinnsel. Für die Umwandlung von Fibrinogen und für die Vernetzung von Fibrin sind Calciumionen notwendig.
Mit fortschreitender Wundheilung, induziert Plasmin eine erhöhte fibrinolytische Aktivität, was den Abbau von Fibrin zu Fibrinabbauprodukten einleitet.
Klinische Wirksamkeit
Hämostase und Nahtunterstützung wurden in klinischen Studien aufgezeigt mit insgesamt 147 Patienten (von denen 75 mit EVICEL und 72 als Kontrolle behandelt wurden), die sich einer Gefässoperation mit PTFE-Implantaten unterzogen, und mit insgesamt 135 Patienten (von denen 66 mit EVICEL und 69 mit einem Kontrollpräparat behandelt wurden), die sich einer retroperitonealen oder intraabdominalen Operation unterzogen.
Die Wirksamkeit von EVICEL zur Abdichtung von Nahtlinien beim Verschluss der Dura mater wurde bei 139 Patienten (89 mit EVICEL behandelt und 50 Kontrollen) nachgewiesen, die sich Kraniotomie-/Kraniektomie-Eingriffen unterzogen.
Kinder und Jugendliche
Die vorliegenden Daten reichen nicht aus, um die Sicherheit und Wirksamkeit von EVICEL bei Kindern zu belegen. Von den 135 Patienten, die sich einer retroperitonealen oder intraabdominalen Operation unterzogen und in der kontrollierten Studie mit EVICEL teilnahmen, waren 4 der mit EVICEL behandelten Patienten 16 Jahre und jünger. Davon waren 2 Kinder im Alter von 2 bzw. 5 Jahren und 2 waren Jugendliche im Alter von 16 Jahren. Für Altersgruppen unter 2 Jahren liegen derzeit keine Daten vor.
Pharmakokinetik
EVICEL ist nur zur epiläsionalen Anwendung bestimmt. Die intravaskuläre Anwendung ist kontraindiziert und demzufolge wurden auch keine pharmakokinetischen Studien mit intravaskulärer Verabreichung am Menschen durchgeführt.
Studien an Kaninchen untersuchten die Absorption und Elimination von Thrombin bei Auftragung auf die Schnittfläche der Leber nach einer partiellen Hepatektomie. Mit Hilfe von 125I-Thrombin wurde nachgewiesen, dass eine langsame Absorption der biologisch inaktiven Peptide erfolgt, die beim Abbau von Thrombin entstehen, wobei nach 6-8 Stunden (Tmax) die Maximalkonzentration Cmax von 1-2% der applizierten Dosis im Plasma erreicht wurde.
Fibrinkleber/Hämostatika werden in derselben Weise metabolisiert wie endogenes Fibrin, nämlich durch Fibrinolyse und Phagozytose.
Präklinische Daten
Studien an Bakterien zur Bestimmung der Mutagenität waren negativ für Thrombin allein, den wirksamen Bestandteil biologischen Ursprungs (mit Fibrinogen, Citrat, Glycin, Tranexamsäure und Argininhydrochlorid), TnBP allein und Triton X-100 allein in allen getesteten Konzentrationen. Alle Konzentrationen der Kombination aus TnBP und Triton X-100 testeten ausserdem negativ in Assays zur Bestimmung der Mutagenität, Chromosomenaberrationen und Induktion von Mikrokernen in Säugerzellen.
Nach lokaler Anwendung verläuft der Übergang von Thrombin ins Plasma langsam und besteht in der Hauptsache aus Thrombinabbauprodukten, die eliminiert werden.
Es sind keine toxikologischen Effekte aufgrund der bei der Virusinaktivierung verwendeten Detergensreagenzien des Lösungsmittels (TnBP und Triton X-100) zu erwarten, weil die Restmengen unter 5 µg/ml liegen.
In Neurotoxizitätsstudien mit EVICEL bestätigte sich, dass die subdurale Anwendung bei Kaninchen nicht mit Anzeichen einer Neurotoxizität einherging. Verhaltensneurologische Beobachtungen über einen Zeitraum von 14±1 Tagen lieferten keine auffälligen Befunde. Es wurden keine grösseren makroskopischen Anzeichen einer lokalen Unverträglichkeit und keine behandlungsbedingten makroskopischen Auffälligkeiten festgestellt. Die Liquoranalyse ergab keine auffälligen Hinweise auf eine Entzündung.
Sonstige Hinweise
Inkompatibilitäten
EVICEL darf nicht mit anderen Arzneimitteln vermischt werden und sollte stets mit dem zum Lieferumfang gehörigen Applikationsset angewendet werden.
Haltbarkeit
Jede der Komponenten von EVICEL (Fibrinogen- und Thrombin-Lösung) ist mit einem Verfalldatum versehen. Das Kombinationsset ist ebenfalls mit einem Verfalldatum versehen, das sich an dem kürzeren der beiden Verfalldaten der Komponenten orientiert.
Innerhalb der 24-monatigen Haltbarkeitsdauer können die ungeöffneten Durchstechflaschen nach dem Auftauen an einem lichtgeschützten Ort bei 2-8 °C für bis zu 30 Tage aufbewahrt werden, ohne dass sie während dieser Zeit wieder eingefroren werden. Das neue Haltbarkeitsdatum bei 2-8 °C ist auf dem Karton zu vermerken. Nach Ablauf dieses Zeitraums muss das Produkt verwendet oder entsorgt werden.
Bei Raumtemperatur unter 25 °C können die Durchstechflaschen bis zu 24 Stunden aufbewahrt werden. Sind die Fibrinogen- und Thrombin-Lösung in das Applikationsset aufgezogen, sollten sie sofort appliziert werden. EVICEL nach Erreichen der Raumtemperatur nicht wieder einfrieren. Unverbrauchte Arzneimittelreste müssen entsorgt werden.
Lagerungshinweise
Die Glasflaschen müssen aufrechtstehend aufbewahrt werden.
Im Umkarton bei -18 °C oder kälter und vor Licht geschützt aufbewahren.
Nach dem Auftauen nicht wieder einfrieren.
Hinweise für die Handhabung
Auftauen:
Die Durchstechflaschen sind nach einer der folgenden Methoden aufzutauen:
- Bei 2-8 °C (Kühlschrank): Die Durchstechflaschen tauen innerhalb von einem Tag auf oder
- Bei 20-25 °C (Raumtemperatur): Die Durchstechflaschen tauen innerhalb von einer Stunde auf oder
- 37 °C (z.B. Wasserbad unter Anwendung einer aseptischen Technik oder durch Anwärmen der Durchstechflaschen in der Hand): Die Durchstechflaschen sollten innerhalb von 10 Minuten auftauen und dürfen nicht länger als 10 Minuten bzw. bis zum vollständigen Auftauen bei dieser Temperatur verbleiben. Die Temperatur darf 37 °C nicht übersteigen.
Vor dem Gebrauch muss das Produkt eine Temperatur von 20-30 °C angenommen haben.
Vorbereitung
Die Lösungen sind klar oder leicht opaleszierend. Lösungen, die trüb sind oder Ablagerungen enthalten, dürfen nicht verwendet werden.
EVICEL sollte mit dem EVICEL-Applikator (mit CE-Kennzeichnung) und wahlweise mit einer Zubehörspitze für diesen Applikator aufgetragen werden. In der Applikator- und der Zubehörpackung befinden sich Broschüren mit ausführlichen Gebrauchsanleitungen für EVICEL in Verbindung mit dem Applikator und dem optionalen Zubehör. Die als Zubehör erhältliche Applikationsspitze sollte nur von Personen eingesetzt werden, die über entsprechende Erfahrungen in der laparoskopischen, der laparoskopieassistierten, der thorakoskopischen, sowie der offenen Chirurgie verfügen.
Den Inhalt der beiden Durchstechflaschen in den Applikator aufziehen und dabei die Gebrauchsanleitungen aus der Applikatorpackung befolgen. Beide Spritzen sollten mit den gleichen Volumen gefüllt sein und dürfen keine Luftblasen enthalten. Für die Zubereitung von EVICEL sind keine Nadeln erforderlich.
Applikation durch Aufträufeln
Die Spitze des Applikators muss möglichst nahe an die Gewebeoberfläche herangeführt werden, aber das Gewebe darf während der Applikation nicht berührt werden. Die Lösung wird tropfenweise auf den zu behandelnden Bereich geträufelt. Die Tropfen müssen sich einzeln von der Spitze des Applikators lösen. Wenn die Spitze des Applikators verstopft ist, kann die Katheterspitze um 0,5 cm zurückgeschnitten werden.
Sprayapplikation
Zur Vermeidung der Gefahr einer lebensbedrohlichen Luft- oder Gasembolie darf EVICEL nur mit unter Druck stehendem CO2-Gas aufgesprüht werden (siehe nachfolgende Tabelle).
Den kurzen Luftschlauch am Applikationsset an den männlichen Luer Lock-Anschluss am langen Luftschlauch anschliessen. Den weiblichen Luer Lock-Anschluss des Luftschlauchs (mit dem bakteriostatischen Filter) an einen Luftregulator anschliessen. Der Luftregulator ist entsprechend den Anweisungen des Herstellers zu verwenden.
Bei der Applikation von EVICEL mit einem Spraygerät müssen Druck und ein Abstand vom Gewebe verwendet werden, die beide innerhalb der vom Hersteller empfohlenen Bereiche liegen:
Operation | Zu verwendendes Sprayset | Zu verwendende Applikatorspitzen | Zu verwendender Druckregler | Empfohlener Abstand vom Zielgewebe | Empfohlener Spraydruck |
|---|---|---|---|---|---|
Offene Operation | Evicel Applikator | 6 cm gelbe flexible Spitze | Omrix Druckregler | 10-15 cm (4-6 Zoll) | 20-25 psi/ 1,4-1,7 bar |
Laparoskopische Verfahren | 35 cm schwarze starre Spitze | 4-10 cm (1,6-4 Zoll) | 15-20 psi/ 1,0-1,4 bar |
Das Produkt sollte in kurzen Stössen (0,1-0,2 ml) auf die Gewebeoberfläche aufgesprüht werden, so dass eine gleichmässige, dünne Schicht entsteht. EVICEL bildet einen durchsichtigen Film auf der Applikationsfläche.
Während des Aufsprühens von Evicel sollten, aufgrund des möglichen Auftretens von Luft- oder Gasembolien, Änderungen des Blutdruckes, Pulses, der Sauerstoffsättigung und der endexspiratorischen CO2-Konzentration überwacht werden.
Entsorgung
Unverbrauchte Reste des Arzneimittels oder Abfälle sind entsprechend den lokalen Vorschriften zu entsorgen.
Zulassungsnummer
61278 (Swissmedic).
Zulassungsinhaberin
Janssen-Cilag AG, Zug ZG.
Stand der Information
Dezember 2017.
OEMéd
Composition
Solutions pour colle de fibrine
Composant 1
Principe actif: Protéine humaine coagulable (principalement fibrinogène et fibronectine).
Excipients: Arginini hydrochloridum, Glycinum, Natrii chloridum, Natrii citras, Calcii chloridum, Aqua ad iniectabilia.
Composant 2
Principe actif: Thrombine humaine.
Excipients: Calcii chloridum, Albuminum humanum, Mannitolum, Natrii acetas, Aqua ad iniectabilia.
Forme galénique et quantité de principe actif par unité
EVICEL colle de fibrine chirurgicale d'origine humaine, consiste en une boîte comprenant deux composants, une solution de fibrinogène et de thrombine, ainsi qu'un dispositif pour administration locale.
Leur composition est la suivante:
Composant 1
Solution de fibrinogène:
Principe actif: Protéine humaine coagulable (principalement fibrinogène et fibronectine) 50-90 mg, quantité totale de protéine 80-120 mg.
Excipients: Arginini hydrochloridum 18,5-22,5 mg, Glycinum 7-9 mg, Natrii chloridum 6,9-7,1 mg, Natrii citras 2,2-3,1 mg, Calcii chloridum 0,14-0,16 mg, Aqua ad iniectabilia ad 1 ml.
Composant 2
Solution de thrombine:
Principe actif: Thrombine humaine 800-1200 IU, Calcii chloridum 5,6-6,2 mg.
Excipients: Albuminum humanum 5,0-6,5 mg, Mannitolum 18,5-20,5 mg, Natrii acetas 2,5-2,7 mg, Aqua ad iniectabilia ad 1 ml.
Indications/Possibilités d’emploi
Indications
EVICEL est utilisé comme traitement adjuvant en chirurgie pour améliorer l'hémostase quand les techniques chirurgicales conventionnelles sont insuffisantes.
EVICEL est également indiqué comme renforcement de suture pour l'hémostase en chirurgie vasculaire et pour l'étanchement de la suture lors de la fermeture de la dure-mère.
Posologie/Mode d’emploi
L'utilisation d'EVICEL est réservée aux chirurgiens expérimentés ayant été formés à l'utilisation d'EVICEL.
Lors de l'application d'EVICEL, il faut s'assurer que la pression se situe dans les limites de pression recommandées par le fabricant du dispositif d'application par pulvérisation (voir «Mises en garde et précautions»).
Posologie
La quantité d'EVICEL à appliquer ainsi que la fréquence d'application doivent toujours être déterminées en fonction de la situation clinique du patient.
La dose à appliquer est déterminée, entre autres, en fonction de facteurs comme le type d'intervention chirurgicale, la taille des surfaces à traiter, le type d'utilisation envisagée ainsi que le nombre d'utilisations.
L'utilisation du produit doit être adaptée aux besoins individuels du patient par le médecin traitant. Lors d'études cliniques contrôlées en chirurgie vasculaire, des doses allant jusqu'à 4 ml ont été utilisées dans des cas isolés et jusqu'à 8 ml pour l'étanchement des lignes de suture lors de la fermeture de la dure-mère, tandis qu'en chirurgie rétropéritonéale ou intra-abdominale, des doses allant jusqu'à 10 ml ont été utilisées dans des cas isolés. Pour certaines interventions (p.ex. traumatismes hépatiques), des volumes plus importants peuvent s'avérer nécessaires.
La quantité initiale de produit à appliquer sur une zone anatomique définie ou à la surface des tissus doit être suffisante pour recouvrir complètement la surface nécessitant un traitement. Le traitement peut être renouvelé au besoin.
Il convient de vaporiser EVICEL par petits jets (0,1-0,2 ml) sur les tissus ou de l'utiliser goutte à goutte afin d'obtenir une couche fine régulière.
Adultes:
La dose habituelle du produit combiné est de 5 à 10 ml. Il est recommandé de ne pas administrer plus de 20 ml.
Indications spéciales pour le dosage:
Enfants et adolescents:
Les données disponibles sont insuffisantes pour établir la sécurité et l'efficacité d'EVICEL chez l'enfant.
Administration
Pour application épilésionnelle.
Pour prévenir le risque d'embolie aérienne ou gazeuse potentiellement fatale, EVICEL ne doit être pulvérisé qu'à l'aide de CO2 sous pression.
Avant de pulvériser EVICEL, la surface de la plaie doit être séchée au moyen de techniques standards (p.ex. utilisation intermittente de compresses, tampons, appareils d'aspiration).
Reconstituer et administrer le produit uniquement selon les instructions et à l'aide des appareils recommandés.
Des recommandations spéciales sur la pression et la distance de pulvérisation nécessaires pour le procédé chirurgical respectif ainsi que sur la longueur de l'embout figurent au paragraphe «Application par pulvérisation».
Contre-indications
- Il convient de ne pas utiliser EVICEL par voie intra-vasculaire.
- Hypersensibilité aux principes actifs ou à l'un des excipients.
- EVICEL ne doit pas être appliqué par pulvérisation lors d'un procédé endoscopique. Pour la laparoscopie, voir le paragraphe «Mises en garde et précautions».
- S'il persiste des déhiscences de plus de 2 mm après la suture des berges de la dure-mère, EVICEL ne doit pas être utilisé pour assurer l'étanchéité de la ligne de suture.
- EVICEL ne doit pas être utilisé comme colle pour la fixation de patchs pour dure-mère.
- EVICEL ne doit pas être utilisé comme colle si la dure-mère ne peut être suturée.
Mises en garde et précautions
- Pour application épilésionnelle uniquement. Ne pas utiliser par voie intravasculaire.
- Des complications thromboemboliques mettant en jeu le pronostic vital peuvent se produire si le produit est involontairement utilisé en intravasculaire.
- Avant l'utilisation d'EVICEL, il convient de veiller à ce que certaines parties du corps se trouvant hors de la zone d'application souhaitée soient convenablement protégées (c.à.d. couvertes), afin d'éviter que la colle de fibrine soit appliquée sur des zones où elle n'est pas souhaitée.
- Les données existantes pour étayer l'utilisation de ce produit comme adhésif tissulaire, dans le traitement d'hémorragies par application via un endoscope ou dans le cadre d'anastomoses gastro-intestinales sont encore insuffisantes.
- L'utilisation concomitante d'EVICEL avec des implants en matières synthétiques ou patchs pour dure-mère afin d'assurer l'étanchéité de la ligne de suture durale n'a jusqu'ici pas été évaluée dans des études cliniques.
- L'utilisation d'EVICEL chez des patients recevant une radiothérapie dans les 7 jours suivant l'intervention chirurgicale n'a pas été évaluée.
- Dans la phase post-opératoire précoce, l'effet de la radiothérapie sur l'efficacité de la colle de fibrine, lorsqu'elle est utilisée pour assurer l'étanchéité de la ligne de suture après fermeture de la dure-mère, n'est pas connu.
- Une hémostase complète doit être obtenue avant l'application d'EVICEL pour assurer l'étanchéité de la ligne de suture durale.
- L'utilisation d'EVICEL comme colle dans les chirurgies par voie transphénoïdale et les procédures oto-neurochirugicales n'a jusqu'ici pas été étudiée.
- Des embolies aériennes ou gazeuses potentiellement fatales sont survenues lors de l'utilisation d'un dispositif d'application par pulvérisation muni d'un régulateur de pression pour administrer EVICEL. Ces événements semblent liés à l'utilisation d'un dispositif d'application par pulvérisation à des pressions supérieures à celles recommandées et/ou à une distance trop proche de la surface des tissus.
- EVICEL ne peut être appliqué par pulvérisation que lorsque la distance de pulvérisation peut être évaluée avec exactitude, notamment pendant une laparoscopie. La distance de pulvérisation et la pression doivent se situer dans les limites de pression recommandées par le fabricant (voir tableau au paragraphe «Application par pulvérisation»). Lors de la pulvérisation d'EVICEL, les variations de la pression artérielle, du pouls, de la saturation en oxygène et du taux de CO2 télé-expiratoire doivent être contrôlées en raison du risque d'embolie gazeuse ou aérienne.
- En cas d'utilisation d'embouts séparés avec ce produit, les instructions d'utilisation de l'embout doivent être respectées. EVICEL doit être appliqué en couche mince. Une couche trop épaisse peut compromettre l'efficacité du produit et le processus de cicatrisation.
- Comme pour tous les produits contenant des protéines, les réactions d'hypersensibilité à l'EVICEL sont possibles. Les signes d'une réaction d'hypersensibilité sont l'apparition de plaques d'urticaire, d'une urticaire généralisée, de sensations d'oppression dans la poitrine, de halètements, d'hypotonie ou de choc anaphylactique. Si ces symptômes surviennent, il convient d'interrompre immédiatement l'utilisation de la colle de fibrine.
- En cas d'état de choc, les mesures médicales usuelles permettant de traiter les chocs doivent être appliquées.
- Les mesures usuelles de prévention des maladies infectieuses par les médicaments issus du sang ou du plasma humain comprennent une sélection rigoureuse des donneurs, le dépistage des échantillons et des pools de plasma afin de détecter les éventuels marqueurs d'infection spécifiques, et l'inclusion de procédures efficaces d'inactivation et d'élimination au cours du processus de fabrication. En dépit de ces mesures, l'utilisation de médicaments fabriqués à partir du sang ou du plasma humain, ne permet pas d'exclure totalement le risque de transmission d'agents infectieux. Cela s'applique également pour les virus inconnus ou pour les nouveaux virus ainsi que pour d'autres agents pathogènes.
- Les mesures utilisées sont également efficaces sur les virus enveloppés comme le VIH, le VHC et le VHB.
- Les mesures utilisées sont peut-être toutefois d'efficacité limitée contre les virus non enveloppés comme le VHA ou le parvovirus B19.
- Les infections par le parvovirus B19 sont surtout dangereuses pour les femmes enceintes (infection du fœtus) et pour les personnes présentant une faiblesse du système immunitaire ou une élévation de l'érythropoïèse (par exemple, anémie hémolytique).
Il est vivement recommandé, lors de chaque utilisation d'EVICEL, de noter la désignation et le numéro de charge du produit afin de pouvoir établir un lien entre les patients et la charge du produit.
Interactions
Des études formelles d'interaction n'ont pas été réalisées. Tout comme les produits comparables ou les solutions de thrombine, la colle de fibrine peut être dénaturée après exposition à des solutions contenant de l'alcool, de l'iode ou des métaux lourds (ex: solutions antiseptiques). La majeure partie de ces substances doit être éliminée avant l'application de la colle de fibrine.
Grossesse/Allaitement
Aucune étude clinique contrôlée relative à la sécurité d'utilisation de la colle de fibrine/hémostatique au cours de la grossesse ou de l'allaitement n'a été effectuée à ce jour. Les expérimentations animales sont insuffisantes pour évaluer la sécurité d'utilisation par rapport à la reproduction, le développement de l'embryon ou du fœtus, l'évolution de la grossesse et le développement péri et post-natales. C'est pour cela qu'il convient de n'administrer ce produit aux femmes enceintes et allaitant qu'en cas de très forte indication.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Ne s'applique pas.
Effets indésirables
Résumé du profil de sécurité
Chez les patients traités par colle de fibrine/hémostatique, des réactions d'hypersensibilité ou des réactions allergiques peuvent survenir dans de rares cas (par exemple, angio-œdème, brûlures et picotements sur le site d'application, spasme bronchique, frissons, bouffées de chaleur, rougeur faciale (flush), urticaire généralisée, céphalées, plaques d'urticaire, hypotonie, léthargie, nausées, agitation, tachycardie, sensation d'oppression au niveau de la poitrine, picotements, vomissements, halètements). Dans des cas isolés, ces réactions conduisent à un choc anaphylactique grave. De telles réactions surviennent surtout lorsque le produit est utilisé plusieurs fois ou administré plusieurs fois à un patient dont on connaît la sensibilité à l'un des composants du produit.
Dans de rares cas, la formation d'anticorps contre certains composants de la colle de fibrine/hémostatique peut se produire.
L'administration intra-vasculaire accidentelle peut provoquer un accident thromboembolique et une coagulation intra-vasale disséminée (CIVD). En outre, il existe un risque de réaction anaphylactique (voir «Mises en garde et précautions»).
Des embolies aériennes et gazeuses potentiellement fatales sont survenues lors de l'utilisation de dispositifs d'application par pulvérisation munis d'un régulateur de pression pour administrer EVICEL. Ces accidents sont manifestement en rapport avec l'utilisation du dispositif à des pressions supérieures à celles recommandées et/ou à une distance trop proche de la surface des tissus.
Pour la sécurité relative aux agents transmissibles, voir le paragraphe «Mises en garde et précautions».
La vue d'ensemble ci-dessous correspond à la classification des organes du système de terminologie MedDRA (SOC et termes préférentiels).
Les fréquences ont été évaluées selon la règle suivante: très fréquent (≥1/10); fréquent (≥1/100 à <1/10); occasionnel (≥1/1'000 à <1/100); rare (≥1/10'000 à <1/1'000); très rare (<1/10'000); inconnu (la fréquence ne peut pas être estimée sur la base des données disponibles). Les effets indésirables suivants survenus lors d'interventions rétropéritonéales ou intra-abdominales et en neurochirurgie étaient fréquents (≥1/100 et <1/10). L'incidence de tous les effets indésirables en chirurgie vasculaire était définie comme occasionnelle (≥1/1'000 et <1/100).
Effets indésirables dans l'étude en chirurgie rétropéritonéale ou intra-abdominale
Infections et infestations
Fréquents: abcès abdominal.
Effets indésirables dans l'étude en chirurgie vasculaire
Infections et infestations
Occasionnels: infection du greffon, infection à staphylocoques.
Troubles vasculaires
Occasionnels: hématome.
Troubles généraux et anomalies au site d'administration
Occasionnels: œdème périphérique.
Investigations
Occasionnels: baisse du taux d'hémoglobine.
Lésions, intoxications et complications liées aux procédures
Occasionnels: hémorragies au site d'incision, occlusion du greffon vasculaire, plaie, hématome postopératoire, complications cicatricielles postopératoires.
Effets indésirables dans l'étude en neurochirurgie
Infections et infestations
Fréquents: méningite.
Affections du système nerveux
Fréquents: hypotension intracrânienne (perte de liquide céphalorachidien [LCR]), rhinorrhée de LCR, maux de tête, hydrocéphalie, hygroma sous-dural.
Troubles vasculaires
Fréquents: hématome.
Effets indésirables dans l'étude en chirurgie rétropéritonéale ou intra-abdominale
Chez 135 patients ayant subi une intervention rétropéritonéale ou intra-abdominale (67 patients traités par EVICEL et 68 patients traités par un produit contrôle), aucun effet indésirable n'a été considéré par les investigateurs comme ayant un lien de causalité avec le traitement faisant l'objet de l'étude. Le promoteur a cependant jugé que trois (3) effets indésirables sévères (un abcès abdominal dans le groupe EVICEL, et un abcès abdominal et un abcès pelvien dans le groupe contrôle) étaient susceptibles d'avoir un lien de causalité avec le traitement de l'étude.
Effets indésirables dans l'étude en chirurgie vasculaire
Dans une étude contrôlée, réalisée chez 147 patients ayant reçu un greffon vasculaire (75 patients dans le groupe EVICEL et 72 patients dans le groupe contrôle), une thrombose/occlusion du greffon est survenue chez 16 patients au total pendant la durée d'observation. Ces événements sont apparus avec la même fréquence dans les deux bras thérapeutiques, 8 cas ayant été signalés dans le groupe traité par EVICEL et 8 cas dans le groupe contrôle.
Suite à l'approbation, une étude de sécurité non interventionnelle a été réalisée chez 300 patients recevant EVICEL lors d'une opération de chirurgie vasculaire. La surveillance de la sécurité s'est focalisée sur les effets indésirables spécifiques de la perméabilité de la greffe, les événements thrombotiques et les saignements. Aucun effet indésirable n'a été signalé au cours de l'étude.
Effets indésirables dans l'étude en neurochirurgie
Dans une étude contrôlée sur 139 patients subissant des interventions de neurochirurgie non urgentes (89 patients traités par EVICEL et 50 patients dans le groupe contrôle), 7 patients au total ont présenté neuf effets indésirables qui ont été considérés comme possiblement liés à EVICEL. Ces effets comprenaient: hypotension intracrânienne (perte de LCR), rhinorrhée de LCR, méningite, maux de tête, hydrocéphalie, hygroma sous-dural et hématome.
Les pertes de LCR post-opératoires se sont produites dans les 30 jours suivant l'intervention chez 4 patients sur 89 (4,5%) traités par EVICEL (deux cas de perte de LCR avec mauvaise cicatrisation des plaies et deux cas de rhinorrhée) et chez 1 patient sur 50 (2,0%) traité avec des sutures supplémentaires.
Surdosage
Aucun cas de surdosage à EVICEL n'est connu.
Propriétés/Effets
Code ATC: B02BC
Mécanismes d'action/pharmacodynamie
La réaction de la fibrine dirige la dernière phase de la coagulation physiologique. La transformation du fibrinogène en fibrine se produit grâce à la division du fibrinogène en monomère de fibrine et peptide de fibrine. Les monomères de fibrine s'agglomèrent et forment un caillot de fibrine. Le facteur XIIIa, la forme du facteur XIII activée par la thrombine s'étend sur le caillot de fibrine. Les ions de calcium sont nécessaires pour la transformation du fibrinogène et pour le développement du réseau de fibrine.
Avec la progression de la cicatrisation, la plasmine induit une activité fibrinolytique plus importante qui conduit à la décomposition de la fibrine en produits de décomposition de la fibrine.
Efficacité clinique
L'hémostase et le renforcement de suture ont été démontrés dans des études cliniques réalisées chez au total 147 patients (75 patients traités par EVICEL et 72 patients dans le groupe contrôle) ayant subi une intervention chirurgicale vasculaire avec greffon PTFE et chez au total 135 patients (66 patients traités par EVICEL et 69 patients dans le groupe contrôle) ayant subi une intervention chirurgicale rétropéritonéale ou intra-abdominale.
L'efficacité d'EVICEL pour assurer l'étanchéité de la ligne de suture lors de la fermeture de la dure-mère a été démontrée chez 139 patients (89 patients traités par EVICEL et 50 patients du groupe contrôle) subissant des procédures de craniotomie/craniectomie.
Enfants et adolescents
Les données disponibles sont insuffisantes pour démontrer la sécurité et l'efficacité d'EVICEL chez l'enfant. Parmi les 135 patients ayant subi une opération rétropéritonéale ou intra-abdominale et ayant participé à l'étude contrôlée menée avec EVICEL, 4 patients traités par EVICEL avaient 16 ans ou moins. Deux d'entre eux étaient des enfants âgés de 2 et 5 ans et 2 étaient des adolescents de 16 ans. Aucune donnée n'est actuellement disponible pour des groupes d'âge de moins de 2 ans.
Pharmacocinétique
EVICEL est uniquement destiné à une application épilésionnelle. L'utilisation intra-vasculaire est contre-indiquée. En conséquence, aucune étude pharmacocinétique avec administration intra-vasculaire n'a été effectuée sur l'homme.
Des études ont été faites sur des lapins afin d'évaluer l'absorption puis l'élimination de la thrombine par application de EVICEL sur la section du foie après hépatectomie partielle. L'utilisation de 125I-thrombin a démontré une lente absorption de peptides biologiquement inactifs provenant de la dégradation de la thrombine, avec un Cmax plasmatique apparaissant après 6 à 8 heures, et ne représentant que 1-2% de la dose appliquée.
La colle de fibrine/hémostatique est métabolisée comme la fibrine endogène, c'est-à-dire par fibrinolyse et phagocytose.
Données précliniques
Des études de mutagénicité réalisées sur des bactéries ont été négatives pour la thrombine seule, le composant biologique actif (contenant du fibrinogène, du citrate, de la glycine, de l'acide tranexamique et du chlorhydrate d'arginine), le TnBP seul et le Triton X-100 seul, pour toutes les concentrations testées. Toutes les concentrations de la combinaison de TnBP et de Triton X-100 testées étaient également négatives dans les essais réalisés pour rechercher une mutagénicité, des aberrations chromosomiques et l'induction de micronoyaux dans les cellules de mammifères.
Après application locale, le passage de la thrombine dans le plasma est lent et consiste principalement en produits de dégradation de la thrombine qui sont éliminés.
Aucun effet toxicologique dû aux réactifs détergents du solvant (TnBP et Triton X-100) utilisés pour l'inactivation virale n'est attendu, car les taux résiduels sont inférieurs à 5 μg/ml.
Des études de neurotoxicité réalisées avec EVICEL ont confirmé qu'une administration sous-durale chez le lapin n'était associée à aucun signe de neurotoxicité. L'observation des manifestations neurocomportementales pendant 14±1 jours n'a montré aucun résultat anormal. Aucun signe macroscopique majeur d'intolérance locale ni aucune anomalie macroscopique liée au traitement n'ont été observés. L'analyse du liquide céphalo-rachidien n'a révélé aucun signe important d'inflammation.
Remarques particulières
Incompatibilités
EVICEL ne doit pas être mélangé avec d'autres produits pharmaceutiques et doit toujours être appliqué avec les accessoires fournis.
Stabilité
Chaque composant d'EVICEL (solution de fibrinogène et de thrombine) a une date de péremption. Le set de produit combiné est également pourvu d'une date de péremption, qui est la date de péremption la plus courte des 2 composants.
Durant les 24 mois de stockage, les flacons non ouverts peuvent être conservés après la décongélation jusqu'à 30 jours, entre 2 et 8 °C et à l'abri de la lumière, sans être congelés à nouveau pendant cette période. La nouvelle date de péremption entre 2 et 8 °C doit être inscrite sur l'emballage. Après expiration de ce délai, le produit doit être utilisé ou jeté.
À température ambiante inférieure à 25 °C, les flacons peuvent être conservés jusqu'à 24 heures. Une fois les solutions de fibrinogène et de thrombine aspirées dans le dispositif d'application, elles doivent être utilisées immédiatement. Ne pas congeler à nouveau EVICEL après avoir atteint la température ambiante. Tout médicament restant doit être éliminé.
Remarques concernant le stockage
Les flacons ampoules doivent être entreposés en position verticale.
Conserver dans l'emballage extérieur à une température de -18° C ou inférieure et à l'abri de la lumière.
Ne pas recongeler après décongélation.
Remarques concernant la manipulation
Décongélation:
Les flacons ampoules doivent être décongelés de l'une des manières suivantes:
- à 2-8 °C (au réfrigérateur): les flacons ampoules décongèlent en 1 jour ou
- à 20-25 °C (température ambiante): les flacons ampoules décongèlent en une heure ou
- à 37 °C (p.ex. au bain-marie, en utilisant une technique aseptique, ou en réchauffant les flacons ampoules dans la main): les flacons ampoules doivent être décongelés en 10 minutes et ne doivent pas être laissés à cette température pendant plus de 10 minutes ou jusqu'à ce qu'ils soient entièrement décongelés. La température ne doit pas dépasser 37 °C.
Avant utilisation, le produit doit être amené à une température comprise entre 20 et 30 °C.
Préparation
Les solutions sont limpides ou légèrement opalescentes. Ne pas utiliser de solutions troubles ou qui présentent des dépôts.
EVICEL doit être appliqué en utilisant le dispositif d'application EVICEL (avec marquage CE), avec recours optionnel à un embout pour ce dispositif. Des brochures contenant des instructions détaillées pour l'utilisation d'EVICEL conjointement avec le dispositif d'application et l'embout optionnel sont fournies dans les emballages du dispositif d'application et de l'embout. L'embout disponible en accessoire ne doit être utilisé que par des personnes expérimentées en chirurgie laparoscopique, chirurgie assistée par laparoscopie, chirurgie thoracoscopique et chirurgie ouverte.
Aspirer le contenu des deux flacons ampoules dans le dispositif d'application en suivant les instructions d'utilisation jointes à l'emballage du dispositif. Les deux seringues doivent être remplies avec des volumes égaux et ne doivent pas contenir de bulles d'air. La préparation d'EVICEL ne nécessite pas d'aiguilles.
Application par instillation
La pointe de l'applicateur doit se trouver le plus près possible de la surface à traiter, toutefois, il convient de ne pas toucher les tissus pendant l'application. La solution est instillée sur la zone à traiter en goutte à goutte. Les gouttes doivent se détacher une à une de la pointe de l'applicateur. Lorsque la pointe de l'applicateur est bouchée, il est possible de recouper la pointe du cathéter d'environ 0,5 cm.
Application par pulvérisation
Pour prévenir le risque d'embolie aérienne ou gazeuse potentiellement fatale, EVICEL ne doit être pulvérisé qu'avec du CO2 sous pression (voir tableau ci-dessous).
Raccorder le tuyau d'air court du set d'application au raccord Luer Lock du tuyau d'air le plus long. Raccorder la prise Luer Lock femelle du tuyau d'air (avec le filtre bactériostatique) sur un régulateur d'air. Le régulateur d'air doit être utilisé conformément aux indications du fabricant.
Lors de l'utilisation d'EVICEL à l'aide d'un dispositif d'application par pulvérisation, il faut s'assurer que la pression et la distance de pulvérisation se situent dans les limites recommandées par le fabricant.
Opération | Set d'application par pulvérisation à utiliser | Embout à utiliser | Régulateur de pression à utiliser | Distance recommandée par rapport aux tissus cibles | Pression de pulvérisation recommandée |
|---|---|---|---|---|---|
Opération à ciel ouvert | Dispositif d'application d'EVICEL | Embout jaune souple de 6 cm | Régulateur de pression d'Omrix | 10-15 cm (4-6 pouces) | 20-25 psi/1,4-1,7 bar |
Procédé laparoscopique | Embout noir rigide de 35 cm | 4-10 cm (1,6-4 pouces) | 15-20 psi/1,0-1,4 bar |
Il convient de vaporiser EVICEL par petits jets (0,1-0,2 ml) sur les tissus afin d'obtenir une couche fine régulière. EVICEL forme un film transparent sur la surface d'application.
Pendant la pulvérisation d'EVICEL, les variations de la pression artérielle, du pouls, de la saturation en oxygène et du taux de CO2 télé-expiratoire doivent être contrôlés en raison du risque d'embolie gazeuse ou aérienne
Élimination
Il convient d'éliminer les restes de produits non utilisés ou les déchets conformément à la réglementation locale.
Numéro d’autorisation
61278 (Swissmedic).
Titulaire de l’autorisation
Janssen-Cilag AG, Zug, ZG.
Mise à jour de l’information
Décembre 2017.
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


 Deutsch
Deutsch French
French







