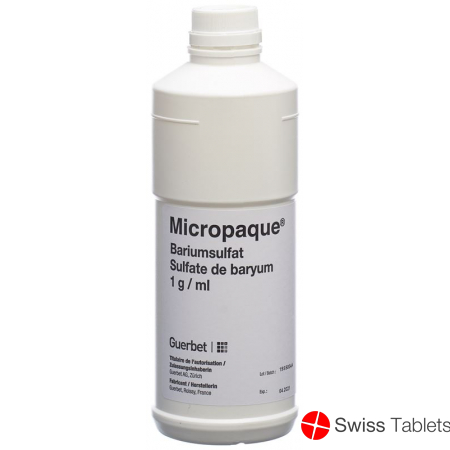
Micropaque Suspension 500ml buy online
Micropaque Susp Fl 500 ml
-
38.04 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: GUERBET AG
- Product Code: 4989433
- ATC-code V08BA01
- EAN 7680302410412
Ingredients:
Bariumsulfat 100 g, Schwefelsäure, Vanillin, Kalium sorbat (E202), Zuckercouleur (E150), Ethylvanillin, Xanthan, Aromatica, Methylparaben-Natrium (E219), Propylparahydroxybenzoat Natrium (E217), Saccharin natrium-2-Wasser, Carmellose natrium, Natriumcitrat-2-Wasser.

Description
AMZV
Zusammensetzung
Wirkstoff: Bariumsulfat
Hilfsstoffe: Carmellose-Natrium (E 466), Xanthangummi (E 415), Natriumcitrat dihydrat, Saccharin natrium (E 954), Schwefelsäure, gereinigtes Wasser, Aromatica: Vanille-Caramel-Aroma (E 150 mit Vanillin und Ethylvanilline) und Konservierungsmittel: Kaliumsorbat (E 202), Natrium propyl-4-hydroxy-benzoat (E 217), Natrium methyl-4-hydroxy-benzoat (E 219).
Galenische Form und Wirkstoffmenge pro Einheit
Bariumsulfat-Suspension zur oralen oder rektalen Anwendung.
Flaschen mit 500 ml Inhalt mit 100 g Bariumsulfat auf 100 ml Volumen (=100% G/V) entsprechend 1 g Bariumsulfat / ml.
Natriumgehalt pro 100 ml Suspension: 352 mg = 15.3 mmol Na+
Kaliumgehalt pro 100 ml Suspension: 34 mg = 0.87 mmol K+
Indikationen/Anwendungsmöglichkeiten
Kontrastierung des Oesophagus, des Magens, des Duodenums oder zur radiologischen Untersuchung des Kolons mit der Prallfüll- oder Doppelkontrasttechnik, Dünndarmpassage.
Dosierung/Anwendung
Die Untersuchung erfolgt mit Vorteil nach der Darmreinigung im Nüchternstatus. Bei Dickdarm-Untersuchungen sollte der Patient bereits 3 Tage vor der Untersuchung mit einer schlackenfreien, ballaststoffarmen Diät beginnen. Vor Gebrauch die Flasche zwei- bis dreimal leicht Schwenken unter Vermeidung von Luftblasenbildung. Anschliessend kurz stehen lassen.
Die Dosierung in den verschiedenen Anwendungsgebieten richtet sich nach dem Patientenstatus, der klinischen Fragestellung und der Untersuchungstechnik. Unsere Empfehlungen basierend auf der klinischen Erfahrung sind:
Oesophagus
Micropaque Suspension unverdünnt in gewünschter Menge
Magen und Duodenum
Schleimhautrelief: 50 ml unverdünnter Micropaque Suspension
Prallfüllung: 200 ml Micropaque Suspension mit 100–150 ml Wasser verdünnen.
Konzentration G/V= 57 – 66,7%
Dünndarm
Dünndarmpassage: 200 ml der Micropaque Suspension mit 300 ml Wasser verdünnen, oral mit Hilfe einer Duodenalsonde verabreichen. Konzentration G/V = 40%
Enteroclysma: 300 ml der Micropaque Suspension mit 600 ml Wasser verdünnen, mit Hilfe einer Duodenalsonde verabreichen. Konzentration G/V = 33%. Optimale Flussrate: 75 ml/min. Eine erste Übersichtsaufnahme zur Beurteilung der Dünndarmperistaltik erfolgt nach 300 ml.
Kolon
Bariumeinlauf mit Prallfüllung und Schleimhautdarstellung:
Doppelkontrast nach Welin: 1 bis 3 Teile Micropaque Suspension mit 1 Teil Wasser verdünnen. 400 ml reichen gewöhnlich, Konzentration G/V = 50–75%.
Prallfüllung: 1 Teil Micropaque Suspension auf 2 Teile Wasser. 1,5-2 Lt reichen gewöhnlich.
Konzentration G/V = 33%.
Spezielle Dosierungsanweisungen
Pädiatrie:
Die Dosierung ist vom Alter und Gewicht des Kindes abhängig. Die individuellen Erfordernisse sind vom Radiologen aufgrund seiner Erfahrung und unter Berücksichtigung der Besonderheiten der kinderradiologischen Diagnostik festzulegen.
Ältere Patienten (65 Jahre und älter):
Es liegen keine besonderen Dosierungsempfehlungen oder –anpassungen vor. Die erhöhte Gefahr des Verschluckens und Aspirationsgefahr müssen berücksichtigt werden.
Verdünnung der Suspension (siehe «Sonstige Hinweise»)
Kontraindikationen
Bei Neugeborenen ist von einer oralen Anwendung auf Grund der Gefahr des sich Verschluckens und der Aspirationsgefahr abzusehen.
Es gelten die gleichen Kontraindikationen wie bei allen Bariumsulfatuntersuchungen:
•Bestätigter oder Verdacht auf Darmperforation oder –verschluss, Atresie, einschliesslich Pylorusstenose;
•Verdacht auf Peritonitis;
•Verdacht auf Fisteln im Verdauungstrakt;
•Ösophagotracheal- bzw. Bronchialfisteln;
•Intestinalen Fisteln, wenn eine Verbindung zum Mediastinum, zur Pleura- oder Peritonealhöhle besteht;
•Frische Verletzungen und Verätzungen des Ösophagus-Magen-Darm-Traktes oder gastrointestinalen Blutungen;
•Ischämie der Darmwand:
•Nekrotisierender Enterokolitis;
•Postoperativer Nahtinsuffizienz. Unmittelbar vor bzw. bis zu 7 Tage nach einem ösophagealen oder gastrointestinalen chirurgischen Eingriff, einschliesslich endoskopischer Exzisionsverfahren, Schlingenpolypektomie oder Kolonbiopsie mit Kauterisierung (Hot-Biopsie) darf kein Bariumsulfat verabreicht werden. Wenn postoperativ undichte Stellen zu erwarten sind, darf das Arzneimittel nicht verwendet werden. Während und bis zu vier Wochen nach einer zervikalen, thorakalen oder abdominalen Strahlentherapie darf das Arzneimittel nicht verwendet werden.
•Bei einer bekannten Unverträglichkeit auf einen der Inhaltstoffe
•Toxisches Megakolon
Bei oraler Anwendung zusätzlich: Schluckstörungen oder eingeschränkte Vigilanz mit Aspirationsgefahr.
Bei rektaler Anwendung zusätzlich: Kolektasie oder Pneumoperitonitis
Aufgrund des Glucose- und Saccharosezusatzes im Vanille-Caramel-Aroma ist Micropaque Suspension bei Fructoseintoleranz, Malabsorption von Glucose oder Galactose sowie bei Mangel an Saccharase-isomaltase kontraindiziert.
Warnhinweise und Vorsichtsmassnahmen
Die Suspension ist nur für die orale oder rektale Verabreichung bestimmt.
Besondere Vorsicht ist bei Schluckstörungen, insbesondere bei Kleinkindern oder älteren Patienten mit eingeschränkter Vigilanz zur Verhinderung einer Aspiration des Bariumsulfats angezeigt.
Im Zusammenhang mit der Gabe von Bariumsulfat sind schwere unerwünschte Wirkungen einschliesslich Aspiration, Intravasation, Perforation, Anaphylaxie beschrieben worden, die lebensbedrohlich sein können. Bei jeder Untersuchung müssen deshalb die personellen Voraussetzungen für eine Notfalltherapie erfüllt sein, das notwendige Material verwendungsbereit und die an der Untersuchung beteiligten mit sämtlichen Notfallmassnahmen vertraut zu sein. Bei Aspiration, Intravasation oder Perforation ist eine sofortige fachärztliche Intervention erforderlich. Zur Vermeidung potentiell schwerwiegender Nebenwirkungen muss darauf geachtet werden, dass Bariumsulfat nicht in parenterale Bereiche wie Gewebe, Gefässraum, Körperhöhlen eindringt oder in die Atemwege gelangt.
Eine Doppelkontrastuntersuchung des Kolons wird von älteren und/oder übergewichtigen Patienten mit eingeschränkter Mobilität gelegentlich schlecht vertragen.
Risikofaktor: Überempfindlichkeit
Patienten mit einer bekannten Überempfindlichkeit auf Bariumsulfatpräparate oder einen der Inhaltsstoffe weisen ein erhöhtes Hypersensitivitätsrisiko auf. Micropaque enthält Konservierungsstoffe (Parahydroxybenzoate) sowie Aromastoffe, die Überempfindlichkeitsreaktionen auslösen können.
Risikofaktor: Asthma
Bariumsulfat wie auch andere Kontrastmittel können die Symptome eines bestehenden Asthmas verstärken. Allgemein ist der klinische Einsatz von Micropaque nach sorgfältiger Nutzen-Risiko-Abwägung zu treffen.
Perforationsgefahr
Wegen des erhöhten Risikos einer Perforation ist eine sorgfältige Nutzen-Risiko-Abwägung erforderlich bei Patienten mit Ösophagusatresie oder hochgradigen Stenosen, speziell distal des Magens, sowie bei Zuständen und Erkrankungen, die mit einer erhöhten Perforationsgefahr verbunden sein können, wie z.B. bei bekannten intestinalen Fisteln und Karzinomen, entzündlichen Darmerkrankungen, Divertikulitis und Divertikulose sowie parasitären Erkrankungen.
Im Falle einer Ösophagusatresie ist eine Opazifikation der Aussackung so weit wie möglich zu vermeiden. Wenn Sie dennoch durchgeführt wird, sollte die kleinste Menge Kontrastmittel verwendet und dann entfernt werden.
Gelangt Bariumsulfat in das Retroperitoneum oder Mediastinum führt dies möglicherweise kaum zu unmittelbaren Symptomen, aber ein verzögerter endotoxische Schock kann 12 Stunden später eintreten und ist häufig tödlich.
Bei einer Darmperforation kann der Übergang von Bariumsulfat in die Bauchhöhle die Ursache für Abszesse, Entzündungen, Peritonitis, Granulome und Adhäsionen mit möglicherweise tödlichem Ausgang und der Notwendigkeit einer Operation sein.
Aspirationsgefahr
Bei Patienten mit Atem- und Schluckproblemen, einschliesslich Dysphagie und verminderter Aufmerksamkeit, ist wegen des Aspirationsrisikos Vorsicht geboten.
Bei Patienten, die anfällig für Aspirationen sind (Säuglinge, ältere Menschen und Schlaganfallpatienten), sollte die Untersuchung mit einer geringen oralen Dosis begonnen werden. Erbrechen nach der oralen Gabe von Bariumsulfat kann zu einer Aspirationspneumonitis führen. Bei der oralen Gabe der Bariumsulfatsuspensionen an Säuglinge mit Hilfe eines Fläschen und bei der Verabreichung grosser Mengen über einen Katheter ist eine Aspiration in den Tracheobronchialbaum möglich. Ein Herz- und Atemstillstand mit tödlichem Ausgang kann nach einer Aspiration bei Säuglingen entstehen. Eine Aspiration kleinerer Mengen kann Atemwegsentzündungen und Pneumonie zur Folge haben.
Bei Patienten mit Lebensmittelaspiration in der Anamnese wird von einer oralen Bariumgabe abgeraten. Falls bei solchen Patienten eine Untersuchung mit Bariumsulfat unbedingt notwendig ist, muss mit grosser Vorsicht vorgegangen werden. Bei einer Aspiration in den Kehlkopf muss die Verabreichung des Arzneimittels sofort eingestellt werden.
Gefahr einer Flüssigkeitsüberlastung
Aufgrund der Wasserabsorption bei Bariumsulfatsuspensionen kann es zu Flüssigkeitsüberlastung kommen. Kinder und Patienten mit beeinträchtigter Nierenfunktion, sowie Kinder mit Morbus Hirschsprung sind am anfälligsten für Wasserintoxikation. Bei Kindern mit Morbus Hirschsprung sollte das Kolon nicht vollständig gefüllt und nur die für die Diagnose unbedingt erforderliche Dosis verwendet werden.
Intravasationsgefahr
Bariumsulfat kann über die Darmwand in die venöse Drainage des Dickdarms übertreten und als «Bariumembolie» in den Kreislauf gelangen. Intravasation kommt nur selten vor, kann aber zu möglicherweise lebensbedrohlichen Komplikationen wie systemischen oder pulmonalen Embolien, disseminierter intravaskulärer Gerinnung, Septikämie und anhaltender schwerwiegender Hypotonie führen. Das Risiko einer Intravasation ist höher bei älteren Patienten, bei denen die Darmwände dünner sind, sowie bei kolorektalen Erkrankungen wie Colitis, Divertikulitis oder intestinalen Obstruktionen mit erhöhtem intraluminalem Druck. Eine Intravasation sollte bei allen Patienten, die während oder kurz nach der Bariumuntersuchung kollabieren oder denen es danach unwohl wird in Erwägung gezogen werden.
Fäkalom, Barolithe, Obstruktionsgefahr
Barolithe bestehen aus eingedicktem Bariumsulfat mit Stuhl. Sie sind oft asymptomatisch, können aber auch Bauchschmerzen, Appendizitis, Darmobstruktion oder Darmperforation auslösen. Bei Patienten mit vorbestehender Obstipation, Magenentleerungsstörung, Kolonstenose, Darmverschluss, Divertikulose, Kolonatonie, Elektrolytdisbalance, Dehydrierung oder auch älteren Patienten ist wegen der erhöhten Obstruktions- oder Barium-Fäkalomsrisikos besondere Vorsicht geboten.
Bariumsulfat kann zudem in Kolondivertikeln zurückgehalten werden und dort infektiöse Prozesse fördern. Barolithe oder Bariumfäkalome sollten zur Vermeidung weiterer Darmwandschäden möglichst entfernt werden.
Bariumsulfat kann eine bereits bestehende Obstipation verschlechtern. Deshalb und zur Verhinderung eines Barolithen sollte vor und einige Tage nach der Untersuchung eine angemessene Hydrierung sichergestellt werden. Die Verwendung von Abführmitteln (vor allem bei Obstipation) kann in Betracht gezogen werden.
Weitere Vorsichtsmassnahmen
Nach der Gabe von Bariumsulfat können vasovagale Reaktionen, Synkopen, Herzarrhythmien oder kardiovaskuläre Nebenwirkungen auftreten. Diese sind meist unvorhersehbar, so dass der Patient weitere 10 bis 30 Minuten beobachtet werden sollte.
Bei Patienten mit beeinträchtigter Nierenfunktion, Kaliumdiät oder unter Natrium-kontrollierter Diät sind Na (352 mg Na+/100ml) und / oder die Kaliumzusätze (34 mg K+/100 ml) zu berücksichtigen.
Interaktionen
Bariumsulfat kann bestimmte Wirkstoffe absorbieren und damit deren intestinale Resorption verändern. Deshalb muss bei der Komedikation mit Arzneimitteln enger therapeutischer Breite besondere Vorsicht eingehalten werden.
Die länger dauernde rektale Ausscheidung von Bariumsulfat führt zur Präsenz von röntgendichten Rückständen, die mit anderen radiologischen Untersuchungen wie Urographien oder Computertomographie interferieren können, wenn derartige Untersuchungen in den darauf folgenden Tagen durchgeführt werden.
Schwangerschaft/Stillzeit
Es gibt klare Hinweise für Risiken des menschlichen Fötus infolge von Röntgenuntersuchungen. Zu Bariumsulfat liegen keine tierexperimentellen oder kontrollierten Studien vor. Das Präparat sollte deshalb während der Schwangerschaft nicht angewendet werden, ausser es wäre unbedingt nötig.
Stillzeit: Da Bariumsulfat im Gastrointestinaltrakt nicht resorbiert wird, kann es auch nicht in die Muttermilch übertreten. Deshalb kann das Stillen nach einer Röntgenuntersuchung mit Micropaque Suspension ohne Unterbruch fortgesetzt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden diesbezüglich keine klinischen Studien durchgeführt.
Unerwünschte Wirkungen
Die Häufigkeit der Nebenwirkungen wird wie folgt beschrieben:
sehr häufig (≥10%), häufig (≥1%, <10%), gelegentlich (≥0.1%, <1%),
selten ( ≥0.01%, <0.1%), sehr selten (<0.01%)
Störungen des Blut- und Lymphsystems:
Einzelfälle von Intravasation: Disseminierte intravaskuläre Gerinnung, tiefe Venenembolien.
Störungen des Immunsystems:
Sehr selten: anaphylaktische oder anaphylaktoide Reaktion, Schock, Überempfindlichkeit auf einen der Inhaltsstoffe.
Störungen des Nervensystems:
Einzelfälle von Praesyncope.
Atmunsorgane:
Sehr selten: Pneumopathien nach akzidenteller Inhalation oder Aspiration nach Erbrechen des Kontrastmittels mit Gefahr einer pulmonalen Fibrose oder Fremdkörpergranulom Bildung. Aspirationspenumonie, Lungenfibrose.
Gastrointestinale Störungen:
Sehr selten: Diarrhoe, abdominale Krämpfe, Appendizits, Darmverschluss, Bariumsulfat-Kotsteine (Barolithen), die zu einer Obstruktion des Dickdarms führen können.
Bei akzidenteller Darmperforation auf Grund der hohen Haftfähigkeit des Bariumsulfats, Abszess, Peritonitis, Adhäsionen, Granulome oder Fremdkörperreaktionen mit möglichem letalem Ausgang. Chirurgische Massnahmen müssen unverzüglich erfolgen.
Selten; Übelkeit, Verstopfung, Erbrechen, Flatulenz, Darmdistension.
Funktionsstörungen der Haut und des Unterhautzellgewebes:
Sehr selten, akut wie verzögert: Urtikaria, generalisierter Ausschlag.
Einzelfälle mit extraluminalem Austritt und damit systemischer Verteilung von Bariumsulfat potentiell letal verlaufend wurden berichtet. Intravasales Bariumsulfat kann tiefe Venenembolien, Schock, Atemnot oder eine disseminierte Koagulopathie auslösen.
Unerwünschte Wirkungen bei Kindern:
Allgemein muss mit der gleichen Art von Nebenwirkungen wie bei Erwachsenen gerechnet werden. Aus den vorliegenden Daten kann ihre Häufigkeit nicht beurteilt werden.
Überdosierung
Die angegebenen Dosierungsempfehlungen nicht überschreiten.
Bei oraler Überdosierung besteht die Gefahr einer Obstipation mit Bauchschmerzen und im Extremfall Ausbildung von Barolithen. Die Therapie besteht in hohen Reinigungseinläufen und/oder salinischen Abführmitteln.
Die rektale Verwendung grosser Mengen von hypotonen Bariumsulfat-Suspensionen kann den Elektrolythaushalt stören. Dies lässt sich durch die Ergänzung von Natriumchlorid verhindern. Falls erforderlich kann der Elektrolythaushalt durch eine spezifische Infusionstherapie wieder hergestellt werden.
Eigenschaften/Wirkungen
ATC-Code: V08BA01
Bariumsulfat wird bereits seit längerem als Röntgen-Kontrastgeber des Verdauungstrakts verwendet. Dank der hohen Atommasse von 137 des Bariums wird die Absorption von Röntgenstrahlen deutlich verstärkt. Sowohl oral als auch rektal angewendet überzieht es den Verdauungstrakt mit einer feinen Schicht und erlaubt damit dessen radiologische Untersuchung.
Ausserdem kann der Verdauungstrakt besser gegenüber seinen Nachbarorganen abgegrenzt werden (besonders wichtig im Falle einer neoplastischen Ausdehnung).
Micropaque ist eine stabile aus Bariumsulfatpartikeln bestehende Suspension mit einem Teilchendurchmesser von 1 µm. Dank den besonderen physikalischen Eigenschaften der Micropaque Suspension fügt sich diese jeder kleinen Schleimhautfalte an und erlaubt so die Sichtbarmachung selbst kleinster Läsionen.
Pharmakokinetik
Bariumsulfat, praktisch wasserunlöslich, wird nicht im Verdauungstrakt absorbiert. Es wird chemisch unverändert rektal wieder ausgeschieden. Nach oraler Aufnahme wird das Bariumsulfat bei normaler Darmmotilität im allgemeinen in 24 Stunden eliminiert. Nach rektaler Applikation wird das Bariumsulfat praktisch vollständig mit dem Entleeren des Einlaufs eliminiert.
Präklinische Daten
Bariumsulfat besitzt als unlösliches Salz praktisch keine pharmakologischen Wirkungen. Dank Absorption der Röntgenstrahlen dient es zur Visualisierung des G.-I. Traktes respektive seiner Schleimhautoberflächen. Lokal wurden bei der Ratte und der Maus keine Veränderungen an den Schleimhäuten des Magens oder Darms gesehen. Untersuchungen zur Reproduktionstoxikologie sowie Mutagenität oder Kanzerogenität liegen keine vor.
Sonstige Hinweise
Haltbarkeit
Das Präparat darf nur bis zu dem auf der Packung mit «EXP» bezeichnetem Verfalldatum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15-25 °C) und ausser Reichweite von Kindern aufbewahren.
Falls die Suspension sedimentiert muss die Flasche kräftig geschüttelt werden. Nach der Resuspension sollte die Suspension eine Weile stehengelassen werden bis die Luftblasen vollkommen verschwunden sind.
Hinweise für die Handhabung
Verdünnen der Suspension.
Ist das Verdünnen der Suspension erforderlich, wird die entsprechende Menge an Trinkwasser vor der Anwendung zugesetzt und ca. für 1 Minute intensiv durchmischt. Beim Mischen ist insbesondere bei der Verwendung von Rührgeräten darauf zu achten, dass keine Luftblasen eingerührt werden.
Soll die Suspension mit Körpertemperatur verabreicht werden, wird empfohlen, erwärmtes Trinkwasser zuzusetzen. Das Wasser darf wegen der Temperaturempfindlichkeit bestimmter Hilfsstoffe eine Temperatur von 60 °C nicht überschreiten. Vor der Applikation sollte die Temperatur kontrolliert werden.
Zulassungsnummer
30241 (Swissmedic)
Zulassungsinhaberin
Guerbet AG, Zürich
Herstellerin
Guerbet, Roissy, France
Stand der Information
Februar 2013
OEMéd
Composition
Principe actif: sulfate de baryum
Excipients: carmellose sodique (E 466), gomme xanthane (E 415), citrate de sodium dihydraté, saccharine sodique (E 954), acide sulfurique, eau purifiée, Arômes: arôme vanille-caramel (E 150 avec vanilline et éthylvanilline). Conservateurs: sorbate de potassium (E202), parahydroxybenzoate de propyle sodé (E 217), parahydroxybenzoate de méthyle sodé (E 219)
Forme galénique et quantité de principe actif par unité
Suspension de sulfate de baryum destinée à l'administration orale ou rectale.
Flacon avec un volume de 500 ml contenant 100 g de sulfate de baryum dans 100 ml (= 100% p/v) correspondant à 1 g de sulfate de baryum. / ml.
Teneur en sodium pour 100 ml de suspension: 352 mg = 15.3 mmol Na+
Teneur en potassium pour 100 ml de suspension: 34 mg = 0.87 mmol K+
Indications/Possibilités d’emploi
Opacification de l'œsophage, de l'estomac, du duodénum ou pour l'exploration radiologique du côlon en double contraste ou en réplétion, transit du grêle.
Posologie/Mode d’emploi
L'examen sera réalisé à jeun après lavement. Le patient devra suivre un régime sans résidu 3 jours avant l'examen du gros intestin. Avant utilisation agiter 2 ou 3 fois le flacon en évitant la formation de bulles d'air. Laissez reposer un moment avant l'examen.
Le dosage des différents types d'examens dépend de l'état du patient, de la pathologie recherchée et de la technique d'exploration. Nos recommandations se basent sur l'expérience clinique du produit et sont les suivantes:
Oesophage
Micropaque Suspension pur en quantité appropriée.
Estomac et duodénum
Relief de la muqueuse: 50 ml de Micropaque Suspension pur
En réplétion: diluer 200 ml de Micropaque Suspension avec 100-150 ml d'eau. Concentration p/v= 57-66,7%.
Intestin grêle
Transit du grêle: diluer 200 ml de Micropaque Suspension avec 300 ml d'eau, application orale à l'aide d'une sonde duodénale. Concentration p/v= 40%.
Entéroclyse: diluer 300 ml de Micropaque Suspension avec 600 ml d'eau, application à l'aide d'une sonde duodénale. Débit optimal: 75 ml/min. Première observation du péristaltisme jéjunal après 300 ml.
Côlon
Lavement baryté avec remplissage complet et dessin de la muqueuse.
En double contraste, modifié selon Welin: diluer 1 à 3 volumes de Micropaque Suspension avec 1 volume d'eau. 400 ml au total suffisent généralement. Concentration p/v= 50-75%.
En réplétion: diluer 1 volume de Micropaque Suspension avec 2 volumes d'eau. 1,5 à 2 l suffisent généralement. Concentration p/v= 33%.
Posologie pour populations particulières
Pédiatrie:
Chez l'enfant, la dose dépend de l'âge et du poids. Les quantités adéquates seront déterminées par le radiologue en fonction de son expérience et de la prise en compte des particularités lors d'exploration radiologique en pédiatrie.
Sujets âgés (65 ans et plus):
Aucune adaptation posologique est nécessaire. On doit néanmoins veiller au danger d'aspiration et au trouble de la déglutition.
Dilution de la suspension (voir “Remarques particulières”).
Contre-indications
Chez le nouveau-né il est recommandé de ne pas utiliser le produit par voie orale à cause du danger d'aspiration et du trouble de la déglutition.
Les mêmes contre-indications comme pour toutes les explorations à base de sulfate de baryum:
•Perforation ou occlusion intestinale avérée ou suspectée, y compris sténose du pylore
•Peritonite suspectée
•Fistule suspectée dans le tube digestif
•Fistules œsophagiennes ou bronchiales
•Fistules intestinales, lorsqu'il existe une connexion avec le médiastin, la cavité pleurale ou péritonéale.
•Plaies récentes ou érosions de l'œsophage ou du tube digestif ou hémorragie gastro-intestinale
•Ischémie de la paroi intestinale
•Entérocolite nécrotisante
•Lâchage de suture postopératoire. Le sulfate de baryum ne doit pas être administré immédiatement avant, et jusqu'à 7 jours après une intervention chirurgicale gastro-intestinale, y compris en cas de résection endoscopique, de polypectomie à l'anse, ou de biopsie à chaud du côlon. Le médicament ne doit pas être utilisé si des fuites postopératoires sont prévisibles. Ne pas utiliser le produit en cours de radiothérapie du cou, du thorax ou de l'abdomen et jusqu'à 4 semaines après la radiothérapie.
•Hypersensibilité à la substance active ou à l'un des excipients
•Mégacôlon toxique
De plus, lors d'une administration orale: troubles de la déglutition ou diminution de la vigilance avec danger d'aspiration.
De plus, lors d'une administration rectale: colectasie ou pneumopéritonite.
En raison de l'ajout de glucose et de saccharose dans l'arôme vanille-caramel, Micropaque suspension est contre-indiqué lors d'une intolérance au fructose, malabsorption de glucose ou de galactose ainsi que lors de carence en saccharase-isomaltase.
Mises en garde et précautions
La suspension est uniquement destinée à l'administration orale ou rectale.
Il convient de surveiller particulièrement les enfants en bas âge ainsi que les sujets âgés souffrant de troubles de la déglutition, car il existe un risque d'aspiration.
Des effets indésirables graves associés à l'administration de produits à base de sulfate de baryum ont été rapportés: aspiration, intravasation, perforation, anaphylaxie pouvant mettre en jeu le pronostic vital. C'est pourquoi avant chaque examen, les conditions nécessaires à une réanimation d'urgence, à savoir le personnel soignant et le matériel requis, devront être réunies. Des mesures médicales spécifiques d'urgence doivent être prises en cas d'aspiration, d'intravasation ou de perforation.
Pour prévenir les effets indésirables graves, il convient d'empêcher le passage du sulfate de baryum dans les régions parentérales telles que les tissus, l'espace intravasculaire ou les cavités corporelles, ainsi que les voies respiratoires.
L'examen du côlon en double contraste est parfois difficilement supporté chez les sujets âgés ou pléthoriques difficilement mobilisables.
Facteur de risque: hypersensibilité
Les patients ayant déjà présenté une réaction lors d'une précédente administration de sulfate de baryum sont exposés à un risque accru de nouvelle réaction. Micropaque contient des agents conservateurs (parahydroxybenzoate de méthyle sodé et de propyle sodé) ainsi que des arômes pouvant déclencher des réactions d'hypersensibilité.
Facteur de risque: asthme
L'administration de sulfate de baryum peut aggraver les symptômes d'un asthme préexistant. La décision d'administrer du sulfate de baryum doit être prise après une évaluation approfondie du rapport bénéfice/risque.
Facteur de risque: perforation
Compte tenu du risque accru de perforation, le rapport bénéfice/risque doit être soigneusement évalué chez les patients souffrant d'atrésie de l'œsophage ou de sténose sévère (spécifiquement en aval de l'estomac), ainsi que chez les patients souffrant d'affections et de pathologies impliquant un risque accru de perforation tels qu'un carcinome intestinal, des fistules intestinales, une maladie inflammatoire de l'intestin, une diverticulose, une diverticulite et une parasitose. En cas d'atrésie de l'œsophage, l'opacification de la poche doit être évitée autant que possible. Si elle est pratiquée, la plus petite quantité possible de produit de contraste doit être administrée puis réaspirée.
Des fuites de baryum dans le rétropéritoine ou dans le médiastin peuvent se manifester par quelques symptômes immédiats, mais un choc endotoxique retardé, qui se révèle fréquemment fatal, peut survenir 12 heures plus tard. En cas de perforation intestinale, le passage du sulfate de baryum dans la cavité abdominale peut être à l'origine d'abcès, d'inflammations, de péritonites, de granulomes et d'adhérences dont l'évolution peut être fatale et qui nécessitent un recours à la chirurgie.
Facteur de risque: aspiration
Il convient de surveiller particulièrement les patients souffrant de troubles respiratoires et de troubles de la déglutition tels que la dysphagie, ainsi que des troubles de la vigilance, car il existe un risque d'aspiration. Chez les patients prédisposés à l'aspiration (nouveau-nés, sujets âgés et ayant subi un AVC), la procédure doit débuter par une faible dose orale.
Les vomissements après l'administration orale de sulfate de baryum peuvent provoquer une pneumonie d'aspiration. L'aspiration dans l'arbre trachéobronchique peut survenir lors de l'administration de suspension buvable de sulfate de baryum en bouteille à des nourrissons et lors de l'administration de quantités importantes par cathéter. Chez les nourrissons, l'aspiration peut entraîner un arrêt cardio-respiratoire avec issue fatale. L'aspiration de petites quantités peut occasionner une inflammation des voies respiratoires et une pneumopathie.
Le baryum ne doit pas être administré à des patients ayant des antécédents de fausse route alimentaire. Si l'utilisation du baryum est absolument nécessaire chez ces patients, une prudence particulière s'impose. Dans le cas de passage dans le larynx, l'administration du produit doit être immédiatement interrompue.
Facteur de risque: surcharge liquidienne
Une surcharge liquidienne due à l'absorption de l'eau contenue dans les suspensions de sulfate de baryum ont été rapportées. Les enfants et patients insuffisants rénaux ainsi que les enfants atteints de la maladie de Hirschsprung sont plus exposés à une intoxication par l'eau. Chez les enfants atteints de la maladie de Hirschsprung, il est préférable de ne pas remplir entièrement le côlon, mais d'utiliser uniquement le liquide requis pour le diagnostic.
Facteur de risque: intravasation
Le sulfate de baryum peut traverser la paroi intestinale et pénétrer dans le drainage veineux du côlon, permettant ainsi à une embolie barytée d'atteindre le système circulatoire. L'intravasation est très rare, mais peut avoir des complications fatales: embolie systémique et pulmonaire, coagulation intravasculaire disséminée, septicémie et hypotension artérielle sévère persistante. Le risque d'intravasation est plus fréquent chez les patients âgés dont les parois rectale et vaginale sont plus fines ainsi que chez les patients souffrant d'affections colorectales, chez qui la pression intraluminale est plus forte que la résistance de la paroi du côlon en cas de colite, de diverticulite et d'occlusion intestinale. Ce diagnostic est à prendre en compte pour tous les patients qui s'évanouissent pendant ou après l'administration du baryum et pour les patients souffrant de malaises dans les premières heures suivant l'examen.
Fécalome baryté, risque d'occlusion
Les fécalomes barytés se développent à partir de baryum compacté dans les fèces.
Ils sont souvent asymptomatiques, mais peuvent provoquer douleurs abdominales, appendicite, occlusion ou perforation intestinale. Une prudence d'utilisation s'impose en cas de constipation préexistante, de troubles de la vidange gastrique, sténose colique, diverticulose et atonie du côlon, de déséquilibre électrolytique, de déshydratation et en raison du risque de constipation et de fécalome baryté, notamment chez les persone âgées.
Le sulfate de baryum peut être retenu dans des diverticules coliques où il peut entretenir ou intensifier des infections. Pour éviter que la paroi intestinale soit endommagée, il convient d'extraire les fécalomes barytés.
Pour éviter que le sulfate de baryum aggrave une constipation préexistante et la formation de fécalome baryté, on s'assurera du bon état d'hydratation avant et après l'examen. L'utilisation de laxatifs est à envisager (particulièrement en cas de constipation).
Autres précautions d'emploi
L'administration du sulfate de baryum peut provoquer des réactions vaso-vagales, des épisodes de syncope, de l'arythmie et d'autres complications cardiovasculaires. Ces réactions sont en général imprévisibles et sont mieux prises en charge si le patient reste en observation 10 à 30 minutes après l'examen.
Chez les patients souffrant d'une insuffisance rénale, suivant un régime pauvre en potassium ou en sodium, il faudra considérer les suppléments de sodium (352 mg Na+/100ml) et/ou de potassium (34 mg K+/100ml).
Interactions
Le sulfate de baryum peut absorber certaines molécules et par conséquent modifier leur absorption digestive. Une prudence d'utilisation s'impose lorsque le sulfate de baryum est administré de manière concomitante avec d'autres médicaments à index thérapeutique étroit.
L'élimination lente de la baryte amène la présence de résidus opaques qui peuvent être gênants pour d'autres radiographies comme une urographie ou un examen tomodensitométrique dans les jours qui suivent.
Grossesse/Allaitement
Des indices clairs mettent en évidence les risques courus par le fœtus humain lors d'exploration radiologique. Aucune étude animale ou contrôlée n'existe avec le sulfate de baryum. C'est pourquoi le médicament ne doit pas être administré durant la grossesse, sauf nécessité absolue.
Allaitement: Parce qu'il n'est pas absorbé au niveau du tube digestif, le sulfate de baryum ne peut pas passer dans le lait maternel. Il n'est donc pas nécessaire d'interrompre l'allaitement à la suite d'un examen radiologique avec Micropaque suspension.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée.
Effets indésirables
La fréquence des effets indésirables est indiquée comme suit:
très fréquent (≥10%), fréquent (≥1%, <10%), occasionnel (≥0.1%, <1%),
rare ( ≥0.01%, <0.1%), très rare (<0.01%)
Troubles de la circulation sanguine et lymphatique:
Cas isolés d'intravasation: coagulation intravasculaire disséminée, embolies veineuses profondes.
Troubles du système immunitaire:
Très rare: réactions anaphylactiques et anaphylactoïdes, choc, hypersensibilité à l'un des composants.
Troubles du système nerveux:
Cas isolés de présyncope.
Troubles respiratoires:
Très rare: pneumopathie après inhalation accidentelle ou aspiration après vomissement du produit de contraste avec un danger de fibrose pulmonaire ou de formation de granulome.
Troubles gastro-intestinaux:
Très rare: diarrhée, crampes abdominales, appendicite, occlusion intestinale, fécalome baryté, qui peut conduire à une obstruction de l'intestin.
En cas de perforation intestinale, le passage du sulfate de baryum dans la cavité abdominale peut être à l'origine d'abcès, de péritonites, de granulomes et d'adhérences dont l'évolution peut être fatale et qui nécessitent un recours à la chirurgie.
Rare: nausées, constipation, vomissement, flatulence, distension abdominale.
Troubles cutanés et des tissus sous-cutanés:
Très rares, immédiats ou retardés: urticaire, prurit, rash generalisé.
En cas de passage extra luminal du sulfate de baryum, d'exceptionnels cas d'intravasation s'accompagnant d'une diffusion systémique de sulfate de baryum et potentiellement fatals peuvent survenir. L'intravasation du sulfate de baryum peut être responsable d'embolies veineuses profondes, choc, détresse respiratoire et coagulation intra-vasculaire disséminée.
Effets secondaires chez l'enfant:
D'une manière générale, la nature prévisible des effets indésirables est la même que celle des effets rapportés chez les adultes. Leur fréquence ne peut être estimée à partir des données disponibles.
Surdosage
Ne pas dépasser la dose prescrite.
Le surdosage par voie orale implique un risque de constipation avec, dans certains cas extrêmes, la formation de fécalomes barytés. Le traitement est constitué de lavements évacuateurs et/ou de laxatifs salins.
L'utilisation par voie rectale de grandes quantités de suspensions de sulfate de baryum hypotonique peut perturber l'équilibre électrolytique. L'ajout de chlorure de sodium dans le liquide de lavement permet de prévenir ce déséquilibre. Si nécessaire, l'homéostasie électrolytique peut être rétablie en mettant en place un traitement spécifique par perfusion intraveineuse
Propriétés/Effets
Code ATC: V08BA01
Le sulfate de baryum est utilisé depuis plusieurs années comme opacifiant radiologique du tube digestif. Le baryum de masse atomique 137 a la propriété d'accroître fortement l'absorption des rayons X. Utilisé indifféremment par voie orale ou rectale, il tapisse le tube digestif d'une fine couche, permettant ainsi son exploration radiologique. De plus, le tube digestif est mieux délimité par rapport à ses organes voisins (principalement important lors de bilans d'extension néoplasique).
Micropaque est une suspension stable de particules de sulfate de baryum dont le diamètre est de 1 micron. Les propriétés physiques de la suspension confèrent à Micropaque une aptitude particulière à épouser les moindres replis de la muqueuse, permettant ainsi la mise en évidence de lésions même très petites.
Pharmacocinétique
Le sulfate de baryum, pratiquement insoluble dans l'eau, n'est pas résorbé au niveau du tractus digestif. Il est excrété dans les selles sans modification chimique. Après administration orale, le sulfate de baryum est généralement excrété dans les 24 heures lors de mobilité intestinale normale. Après administration rectale, le sulfate de baryum est excrété pratiquement en totalité lors de l'expulsion du lavement.
Données précliniques
En tant que sel insoluble, le sulfate de baryum ne possède pratiquement aucun effet pharmacologique. Parce qu'il absorbe les rayons X, il est utilisé pour la représentation du tube digestif, spécialement de la surface de la muqueuse. Aucune modification de la muqueuse gastrique ou intestinale n'a été observée après application locale chez le rat et la souris. Aucune étude sur la toxicologie de reproduction, ni sur la mutagénicité ou la cancérogénicité n'est disponible.
Remarques particulières
Stabilité
Le produit ne doit pas être utilisé au-delà de la date de péremption figurant après la mention «EXP».
Remarques concernant le stockage
Conserver à température ambiante (15-25 °C) et hors de portée des enfants.
Si la suspension a sédimenté, agiter vigoureusement le flacon. Laisser ensuite reposer la suspension reconstituée jusqu'à disparition complète des bulles d'air. Remarques concernant la manipulation
Dilution de la suspension.
S'il s'avère nécessaire de diluer la suspension, il faut ajouter l'eau potable juste avant l'utilisation et agiter vigoureusement pendant environ 1 minute. Lors du mélange et surtout si on utilise des appareils à remuer, veillez à ce qu'il n'y ait pas de formation de bulles d'air.
Si la suspension est administrée à température corporelle, il est recommandé de rajouter de l'eau potable réchauffée. La température ne peut pas dépasser 60 °C à cause de certaines substances qui y sont sensibles. Veuillez contrôler la température avant administration de la suspension.
Numéro d’autorisation
30241 (Swissmedic)
Titulaire de l’autorisation
Guerbet SA, Zurich, Suisse
Fabricant
Guerbet, Roissy, France
Mise à jour de l’information
Février 2013
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French