Cervarix Impfstoff Injektionssuspension Fertigspritze 0.5ml buy online
Cervarix Impfstoff Inj Susp Fertspr 0.5 ml
-
315.88 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: GLAXO SMITHKLINE AG
- Product Code: 4513328
- ATC-code J07BM02
- EAN 7680578140013
Ingredients:
Natriumchlorid, Natrium 1.82 mg, Aluminium (Al3+) 0.5 mg, Natrium dihydrogenphosphat-2-Wasser, Papillomavirus (human) HPV Typ 16, L1-Protein 20 mcg, Papillomavirus (human) HPV Typ 18, L1-Protein 20 mcg, Papillomavirus (human)-Adsorbat-Impfstoff, rekombiniert, bivalent , 3-O-Desacyl-4’-monophosphoryl-Lipid A 50 mcg, Aluminiumhydroxid zur Adsorption, wasserhaltiges (Ph.Eur.).

Description
Zusammensetzung
Wirkstoffe
L1 Proteine des humanen Papillomavirus der Typen 16 und 18.
Hilfsstoffe
Adjuvans:
3-O-Desacyl-4'-Monophosphoryl-Lipid-A (MPL), wasserhaltiges Aluminiumhydroxid.
Andere Hilfsstoffe:
Natriumchlorid, Natriumdihydrogenphosphatdihydrat, Wasser für Injektionszwecke.
Eine Impfdosis enthält 1,82 mg Natrium.
Darreichungsform und Wirkstoffmenge pro Einheit
Injektionssuspension in Fertigspritze.
Eine Impfdosis (0,5 mL) enthält:
Rekombinantes L1 Protein1
des humanen Papillomavirus Typ 16 (HPV-16) 20 µg
Rekombinantes L1 Protein1
des humanen Papillomavirus Typ 18 (HPV-18) 20 µg
3-O-Desacyl-4'-Monophosphoryl-Lipid-A (MPL)2 50 µg
Wasserhaltiges Aluminiumhydroxid (Al(OH)3)2 0,5 mg Al3+
Andere Hilfsstoffe gemäss «Zusammensetzung»
1 L1-Protein in Form von nicht-infektiösen virusartigen Partikeln (virus-like particles, VLPs) hergestellt mittels rekombinanter DNA-Technologie unter Verwendung des Baculovirus-Expressionssystems, für das Hi-5 Rix4446-Zellen, die aus Trichoplusia ni gewonnen werden, verwendet werden.
2 urheberrechtlich geschütztes AS04-Adjuvans von GlaxoSmithKline (siehe «Eigenschaften/Wirkungen»).
Cervarix liegt als weisslich trübe Injektionssuspension in Fertigspritzen vor.
Indikationen/Anwendungsmöglichkeiten
Cervarix ist ein Impfstoff zur Anwendung bei Mädchen und Frauen ab einem Alter von 10 Jahren zur Prävention von prämalignen Läsionen der Cervix und von Cervixkarzinomen, die durch die Typen 16 und 18 des humanen Papillomavirus (HPV) verursacht werden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»).
Cervarix sollte gemäss den offiziellen Impfempfehlungen angewendet werden.
Dosierung/Anwendung
Übliche Dosierung
Die empfohlene Dosis beträgt 0,5 ml.
Das Impfschema richtet sich nach dem Alter des Impflings.
Ab einem Alter von 10 Jahren bis einschliesslich 14 Jahren zum Zeitpunkt der ersten Injektion kann Cervarix nach einem Impfschema mit entweder 2 oder 3 Dosen verabreicht werden.
Ab einem Alter von 15 Jahren wird ausschliesslich das Impfschema mit 3 Dosen empfohlen.
- 2-Dosen-Schema:
Das Impfschema besteht aus 2 Impfungen, die im Monat 0, 6 verabreicht werden (siehe «Eigenschaften/Wirkungen»). Wenn ein flexibles Impfschema notwendig ist, kann die zweite Dosis auch 5 bis 7 Monate nach der ersten Dosis verabreicht werden.
- 3-Dosen-Schema:
Das Impfschema besteht aus 3 Dosen, die im Monat 0, 1, 6 verabreicht werden.
Wenn im 2-Dosenschema bei Mädchen im Alter von 10 bis 14 Jahren die zweite Impfstoffdosis früher als 5 Monate nach der ersten Dosis verabreicht wird, sollte immer eine dritte Dosis gegeben werden.
Es ist noch nicht bekannt, ob eine Auffrischimpfung erforderlich ist (siehe «Eigenschaften/Wirkungen»).
Es wird empfohlen, dass die Personen, die bereits eine Dosis Cervarix erhalten haben, die komplette Impfserie mit Cervarix abschliessen.
Anwendung bei Mädchen unter 10 Jahren:
Cervarix wird nicht zur Anwendung bei Mädchen unter 10 Jahren empfohlen, da keine ausreichenden Daten zur Unbedenklichkeit und Immunogenität in dieser Altersgruppe vorliegen.
Art der Anwendung
Cervarix wird intramuskulär injiziert, vorzugsweise in den Deltamuskel (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»).
Kontraindikationen
Cervarix sollte nicht bei bekannter Überempfindlichkeit gegenüber einem der Bestandteile des Impfstoffes verabreicht werden (siehe «Zusammensetzung»).
Die Verabreichung von Cervarix sollte im Falle einer akuten, schweren, mit Fieber einhergehenden Erkrankung auf einen späteren Zeitpunkt verschoben werden. Leichte Infekte, wie eine Erkältung, stellen im Allgemeinen jedoch keine Kontraindikation für eine Impfung dar.
Warnhinweise und Vorsichtsmassnahmen
Cervarix darf unter keinen Umständen intravaskulär oder intradermal injiziert werden! Zur subkutanen Verabreichung liegen keine Daten vor.
Zur Einhaltung der guten klinischen Praxis sollten vor der Impfung eine Überprüfung der Anamnese (insbesondere unter Berücksichtigung früherer Impfungen und dem möglichen Auftreten unerwünschter Wirkungen) und eine ärztliche Untersuchung durchgeführt werden.
Wie bei allen injizierbaren Impfstoffen sollte für den seltenen Fall einer anaphylaktischen Reaktion nach der Impfung jederzeit eine angemessene medizinische Behandlung und Überwachung sofort verfügbar sein.
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmassen begleitet sein. Es ist wichtig, Massnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Wie alle Impfstoffe, die intramuskulär verabreicht werden, ist Cervarix mit Vorsicht an Personen mit Thrombozytopenie oder einer anderen Blutgerinnungsstörung zu verabreichen, da es bei diesen Personen nach einer intramuskulären Gabe zu Blutungen kommen kann.
Wie bei jedem Impfstoff kann es sein, dass nicht bei allen Geimpften eine schützende Immunantwort aufgebaut wird.
Cervarix vermittelt keinen Schutz vor allen onkogenen HPV-Typen. Cervarix schützt nur vor Erkrankungen, die durch die HPV-Typen 16 und 18 und in einem begrenzten Ausmass durch bestimmte verwandte Typen verursacht werden. Deshalb sollten geeignete Massnahmen zum Schutz vor sexuell übertragbaren Krankheiten beibehalten werden (siehe «Eigenschaften/Wirkungen»).
Eine therapeutische Wirkung wurde für Cervarix nicht nachgewiesen. Der Impfstoff ist daher nicht zur Behandlung von Cervixkarzinomen oder intraepithelialen Neoplasien der Cervix (CIN) indiziert. Der Impfstoff ist ebenfalls nicht dafür vorgesehen, die Progression anderer bereits bestehender HPV-assoziierter Läsionen oder existierender HPV-Infektionen (unabhängig vom HPV-Typ) zu verhindern.
Die Impfung ist kein Ersatz für Routineuntersuchungen zur Gebärmutterhalskrebs-Früherkennung. Da kein Impfstoff 100% wirksam ist und Cervarix nicht vor allen onkogenen HPV-Typen oder bereits existierenden HPV-Infektionen schützt, bleiben Routineuntersuchungen zur Gebärmutterhalskrebs-Vorsorge weiterhin sehr wichtig und sollten entsprechend den nationalen Empfehlungen durchgeführt werden.
Abgesehen von südafrikanischen Frauen mit einer asymptomatischen HIV-Infektion, für die wenige Daten zur Verfügung stehen (siehe «Eigenschaften/Wirkungen»), liegen zur Anwendung von Cervarix bei Personen mit eingeschränkter Immunantwort, wie Patienten, die eine immunsuppressive Behandlung erhalten, keine Daten vor. Wie bei anderen Impfstoffen kann es sein, dass bei diesen Personen keine ausreichende Immunantwort induziert wird.
Die Dauer der Schutzwirkung ist noch nicht vollständig bekannt. Die Notwendigkeit und der Zeitpunkt von Auffrischimpfungen wurden nicht untersucht. Eine anhaltende Schutzwirkung für mindestens 6,4 Jahre nach der ersten Dosis wurde beobachtet. Zurzeit sind Langzeitstudien im Gange, um die Dauer der Schutzwirkung zu ermitteln (siehe «Eigenschaften/Wirkungen»).
Es liegen keine Daten zur Unbedenklichkeit, Immunogenität oder Wirksamkeit vor, wenn Cervarix während der Impfserie mit anderen HPV-Impfstoffen ausgetauscht wird.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Impfdosis, d.h. es ist nahezu «natriumfrei».
Interaktionen
In allen klinischen Studien wurden Personen, die innerhalb von 3 Monaten vor der ersten Impfdosis Immunglobuline oder Blutprodukte erhalten hatten, ausgeschlossen.
Gemeinsame Verwendung mit anderen Impfstoffen:
Cervarix kann zeitgleich mit einem Kombinations-Auffrischungsimpfstoff gegen Diphtherie (d), Tetanus (T) und Pertussis (azellulär = pa), mit oder ohne inaktivierten Poliomyelitis (IPV) (dTpa-, dTpa-IPV-Impfstoffe) verabreicht werden, ohne dass es zu einer klinisch relevanten Beeinträchtigung der Antikörperantwort auf eine der in beiden Impfstoffen enthaltenen Komponenten kommt. Nach Verabreichung von Cervarix einen Monat nach Gabe eines dTpa-IPV-Kombinationsimpfstoffes zeigte sich im Vergleich zu der alleinigen Verabreichung von Cervarix eine Tendenz zu niedrigeren Antikörpertitern (GMTs) gegen anti-HPV-16 und anti-HPV-18. Die klinische Bedeutung dieser Beobachtung ist nicht bekannt.
Cervarix kann gleichzeitig mit einem kombinierten Hepatitis A (inaktiviert)- und Hepatitis B (rDNA)-Impfstoff (HAB-Impfstoff) oder gleichzeitig mit einem Hepatitis B (rDNA)-Impfstoff verabreicht werden.
Bei der gleichzeitigen Verabreichung von Cervarix und Twinrix (HAB-Impfstoff) zeigte sich keine klinisch relevante Beeinträchtigung der Antikörperantwort auf die HPV- und Hepatitis A-Antigene. Die geometrischen Mitteltiter der Anti-HBs-Antikörper waren bei der gleichzeitigen Verabreichung signifikant niedriger; die klinische Bedeutung dieser Beobachtung ist nicht bekannt, da die Seroprotektionsraten unverändert blieben. Der Anteil der Personen mit einem Anti-HBs-Antikörpertiter von ≥10 mI.E./ml betrug 98,3% bei der gleichzeitigen Verabreichung von Cervarix und Twinrix und 100% bei der alleinigen Verabreichung von Twinrix.
Den Einfluss von Cervarix auf die Responderraten und Anti-HBs-Antikörpertiter nach gleichzeitiger Verabreichung von Engerix-B zeigt die folgende Tabelle.
Cervarix mit Engerix-B | Cervarix alleine | |
|---|---|---|
Anti-HPV-16 (EL.U./ml) ELISA | 19'819,8 (N=207) | 21'712,6 (N=200) |
Anti-HPV-18 (EL.U./ml) ELISA | 8'835,1 (N=200) | 8'838,6 (N=202) |
Cervarix mit Engerix-B | Cervarix alleine | |
Anteil Probanden mit einer anti-HBs Antikörperkonzentration ≥10 mIU/ml ELISA | 97,9% (n=190) | 100% (n=181) |
Anteil Probanden mit einer anti-HBs Antikörperkonzentration ≥100 mIU/ml ELISA | 88,7% (n=172) | 97,2% (n=176) |
Absolute anti-HBs Antikörperkonzentration (mlU/ml) ELISA (untere und obere Grenze des 95%-Konfidenzintervalls) | 1'280,9 | 3'107,7 |
N=Anzahl Probanden mit Antikörperergebnissen vor Verabreichung der Impfungen
n=Anzahl Probanden, die nach Verabreichung der Impfungen den angegebenen Hepatitis B Schutz-Schwellenwert erreicht haben.
Wenn Cervarix zeitgleich mit einem anderen injizierbaren Impfstoff angewendet wird, sollten die Impfstoffe stets an verschiedenen Injektionsstellen verabreicht werden.
Gemeinsame Anwendung mit hormonellen Kontrazeptiva:
In klinischen Studien zur Wirksamkeit verwendeten ungefähr 60% der Frauen, die Cervarix erhielten, hormonelle Kontrazeptiva. Es liegen keine Hinweise vor, dass die Anwendung von hormonellen Kontrazeptiva eine Auswirkung auf die Wirksamkeit von Cervarix besitzt.
Gemeinsame Anwendung mit systemischen immunsuppressiven Medikamenten:
Wie bei anderen Impfstoffen kann die Impfung mit Cervarix bei Patienten unter immunsupressiver Therapie möglicherweise zu einer nicht ausreichenden Immunantwort führen.
Schwangerschaft/Stillzeit
Schwangerschaft
Die Wirkung von Cervarix auf die embryonal-foetale, perinatale und postnatale Entwicklung und das Überleben wurde bei Ratten untersucht. Diese Untersuchungen ergaben keinen Hinweis auf direkte oder indirekte schädigende Wirkungen bezüglich Fruchtbarkeit, Schwangerschaft, embryonale/foetale Entwicklung, Geburt oder postnatale Entwicklung.
Es wurden Daten von schwangeren Frauen aus klinischen Studien, Schwangerschaftsregistern und epidemiologischen Untersuchungen retrospektiv bezüglich der Fragestellung analysiert, ob die Impfung mit Cervarix einen Einfluss auf das Risiko abnormer Schwangerschaftsausgänge in Bezug auf die Neugeborenen (z.B. Geburtsfehler, Spontanaborte usw.) hat. Es gab keine Hinweise auf ein erhöhtes Risiko von kongenitalen Missbildungen bei den Neugeborenen.
Die Post-Marketing Schwangerschaftsstudie (PASS) EPI-HPV-018 VS UK DB untersuchte u.a. Schwangerschaftsereignisse, die bei einer Cervarix Impfung im Zeitraum 45 Tage bevor bis 30 Tage nach der letzten Periodenblutung auftraten, im Vergleich zu einer Kontrollgruppe von Frauen, deren letzte Cervarix Dosis mindestens 120 Tage bis 18 Monate vor der Schwangerschaft zurück lag. Für die primäre Analyse bezüglich irgendeiner Dosis Cervarix im Zeitraum 45 Tage bevor und 30 Tage nach der letzten Periodenblutung wurde mit einer HR von 1,3 (95%-CI 0,7-2,1) kein signifikantes Ergebnis bezüglich Spontanaborten gefunden. Eine explorative Analyse mit 2 Dosen Cervarix im definierten Zeitraum führte mit einer HR von 2,55 (95%-CI 1,09-5,93) zu einer signifikanten Erhöhung des Risikos für Spontanaborte bei der Cervarix Impfung im Zeitraum 45 Tage vor bis 30 Tage nach der letzten Periodenblutung.
Diese Daten reichen nicht aus, um zu beurteilen, ob die Impfung mit Cervarix sich auf das Risiko eines Spontanaborts oder eines anderen Ereignisses auswirkt.
Schwangere sowie Frauen, die eine Schwangerschaft planen, sollten daher erst nach Ende der Schwangerschaft geimpft werden.
Eine Analyse der nach Impfung aufgetretenen Schwangerschaften im klinischen Studienprogramm von Cervarix (insgesamt 10'476) ergab ein relatives Risiko von 1,60 (95%-CI 0,99-2,61) für einen spontanen vorzeitigen Schwangerschaftsabbruch, wenn die Impfung mit Cervarix in den 60 Tagen vor Eintritt der Schwangerschaft erfolgte (317 nach Cervarix, 316 nach Kontrolle, Daten aus kontrollierten Studien). Es zeigten sich keine Unterschiede zwischen den Gruppen bezüglich kongenitaler Missbildungen der Neugeborenen. Die mit Cervarix durchgeführten Studien waren nicht primär statistisch geplant, um einen Einfluss von Cervarix auf nachfolgende Schwangerschaften zu untersuchen. Bei innerhalb der nächsten 2 Monate geplanten Schwangerschaften sollte auf die Impfung mit Cervarix vorbeugend verzichtet werden.
Stillzeit
Die Wirkung von Cervarix auf das gestillte Kind nach Verabreichung an die Mutter wurde nicht in klinischen Studien untersucht. Cervarix sollte während der Stillzeit nur dann angewendet werden, wenn die Vorteile gegenüber den möglichen Risiken überwiegen.
Serologische Daten bei Ratten sprechen für eine Übertragung von Antikörpern gegen HPV-16 und HPV-18 mit der Muttermilch im Verlauf der Stillzeit. Es ist jedoch nicht bekannt, ob durch die Impfung induzierte Antikörper auch beim Menschen in die Muttermilch ausgeschüttet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt.
Unerwünschte Wirkungen
In klinischen Studien mit Mädchen und Frauen im Alter von 10 bis 72 Jahren (zum Zeitpunkt der Aufnahme in die Studie waren 79,2% im Alter von 10 bis 25 Jahren) wurde Cervarix an 16'142 Probanden verabreicht, 13'811 Probanden erhielten die Kontrolle. Diese Probanden wurden hinsichtlich schwerwiegender Nebenwirkungen über die gesamte Studiendauer beobachtet. In einer vorab definierten Untergruppe von Probanden (Cervarix = 8'130 versus Kontrolle = 5'786) wurden die Nebenwirkungen über einen Zeitraum von 30 Tagen nach jeder Impfung untersucht.
Die häufigste Nebenwirkung, die nach der Verabreichung des Impfstoffes beobachtet wurde, war Schmerzen an der Injektionsstelle (bei 78% aller Impfdosen). Die Mehrzahl der lokalen Reaktionen war mild oder mässig und nicht langanhaltend.
Verglichen mit Dosis 1 wurde Schmerz weniger häufig nach Dosis 2 und 3 gemeldet, wohingegen sich bei Rötung und Schwellung eine leicht erhöhte Inzidenz zeigte nach der 2. und 3. Dosis. Für die allgemeinen unerwünschten Nebenwirkungen zeigte sich keine Zunahme der Häufigkeiten bei den Folgedosen.
Die Nebenwirkungen aus klinischen Studien, bei denen zumindest ein möglicher Zusammenhang zur Impfung gesehen wird, werden nach Häufigkeiten aufgeführt.
Häufigkeiten werden wie folgt angegeben: sehr häufig (≥1/10); häufig (≥1/100 bis <1/10); gelegentlich (≥1/1'000 bis <1/100); selten (≥1/10'000 bis <1/1'000); sehr selten (<1/10'000).
Infektionen und parasitäre Erkrankungen
Gelegentlich: Infektionen der oberen Atemwege.
Erkrankungen des Blutes und des Lymphsystems.
Gelegentlich: Lymphadenopathie (in Einzelfällen generalisiert und schwerwiegend).
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (29,5%).
Gelegentlich: Schwindel.
Erkrankungen des Gastrointestinaltrakts
Häufig: Gastrointestinale Symptome, einschliesslich Übelkeit, Erbrechen, Durchfall und Bauchschmerzen.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Juckreiz/Pruritus, Hautausschlag, Urtikaria.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Myalgie (28,1%).
Häufig: Arthralgie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Reaktionen an der Injektionsstelle, wie Schmerzen (78,0%), Rötung (29,6%), Schwellung (25,8%); Müdigkeit (33,1%).
Häufig: Fieber (≥38 °C).
Gelegentlich: andere Reaktionen an der Injektionsstelle, wie Verhärtung, lokale Parästhesie
Das Nebenwirkungsprofil war bei Probanden mit vorangegangener oder bestehender HPV-Infektion vergleichbar mit dem bei Probanden, bei denen keine onkogene HPV-DNA nachgewiesen wurde oder die seronegativ für HPV-16- und HPV-18-Antikörper waren.
Eine gepoolte Nebenwirkungsdatenbank (Stand 30. April 2007), welche sämtliche kontrollierten und unkontrollierten Studien mit den Daten der Frauen von 10 bis 25 Jahren enthielt, wurde nach medizinischen Anhaltspunkten für mögliche neu aufgetretene Autoimmunerkrankungen durchsucht. Insgesamt war die Inzidenz potentieller und tatsächlich neu aufgetretener Autoimmunerkrankungen während der 4,3-jährigen Nachbeobachtungszeit (median 3 Jahre) in der Cervarix-Gruppe mit 0,8% (95/12'533) vergleichbar mit der Inzidenz in der gepoolten Kontrollgruppe (0,8%; 87/10'730). Am häufigsten waren Hypothyroidismus (Cervarix-Gruppe 0,2% (n=30); Kontrollgruppe 0,3% (n=28)), Hyperthyroidismus (Cervarix-Gruppe 0,1% (n=14); Kontrollgruppe 0,1% (n=15)), Psoriasis (Cervarix-Gruppe 0,1% (n=8); Kontrollgruppe 0,1% (n=11)), entzündliche Darmerkrankungen (inkl. M. Crohn, Colitis ulcerosa, Proctitis ulcerosa) (Cervarix-Gruppe 0,1% (n=8); Kontrollgruppe 0,0% (n=4)), Arthritis (Cervarix-Gruppe 0,1% (n=9); Kontrollgruppe 0,0% (n=4)) und rheumatoide Arthritis (Cervarix-Gruppe 0,0% (n=4); Kontrollgruppe 0,0% (n=3)). Es liegen keine Hinweise für einen kausalen Zusammenhang vor. Es liegen neuere gepoolte Daten an mehr exponierten Frauen zu möglichen neu aufgetretenen Autoimmunkrankheiten vor. Aufgrund methodischer Limitationen sind diese aktualisierten Daten bisher zur Aufführung in der Fachinformation nicht geeignet.
Unerwünschte Wirkungen nach Markteinführung
Da diese Ereignisse spontan berichtet werden, ist eine verlässliche Abschätzung der Häufigkeit nicht möglich.
Erkrankungen des Blutes und des Lymphsystems
Lymphadenopathie.
Erkrankungen des Immunsystems
Allergische Reaktionen (einschliesslich anaphylaktische und anaphylaktoide Reaktionen), Angioödem.
Erkrankungen des Nervensystems
Synkopen oder vasovagale Reaktionen auf die Injektion, manchmal begleitet von tonisch-klonischen Bewegungen (siehe «Warnhinweise und Vorsichtsmassnahmen»)
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es existieren keine ausreichenden Daten.
Eigenschaften/Wirkungen
ATC-Code
J07BM02
Wirkungsmechanismus
Cervarix ist ein nicht-infektiöser, rekombinanter Impfstoff, der aus hochgereinigten, virusähnlichen Partikeln (VLPs) des Hauptkapsidproteins L1 der onkogenen HPV-Typen 16 und 18 hergestellt wird.
Da die VLPs keine virale DNA enthalten, können sie keine Zellen infizieren, sich vermehren oder Erkrankungen verursachen. Tierexperimentelle Studien haben gezeigt, dass die Wirksamkeit der L1-VLP-Impfstoffe hauptsächlich durch die Ausbildung einer humoralen Immunantwort vermittelt wird.
Mehr als 100 verschiedene HPV-Typen wurden beim Menschen bei mukokutanen Infektionen nachgewiesen. Diese verursachen überwiegend gutartige Läsionen wie z.B. benigne Hautwarzen. Mehr als 40 HPV-Typen infizieren Schleimhäute einschliesslich des anogenitalen Gewebes (Cervix, Vagina, Vulva, Urethra, Penis, Rektum und Anus). Die Lebenszeitprävalenz für mindestens eine anogenitale HPV-Infektion beträgt bei Frauen ca. 80%, wobei die anogenitalen HPV-Infektionen zum grössten Teil spontan reversibel sind. Die anogenitalen HPV-Infektionen werden u.a. eingeteilt in onkogene Typen (high-risk) und Niedrigrisiko-Typen (low-risk). Zu den onkogenen HPV zählen 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 und 82. Zu den low-risk Typen zählen 6, 11, 40, 42, 43, 44, 54, 61, 70, 72 und 81. Die low-risk Typen können gutartige oder niedrig maligne Veränderungen der Zytologie oder Histologie der Cervix sowie einige Typen auch Genitalwarzen hervorrufen. Sie werden nur sehr selten beim Immunkompetenten in höhergradigen Läsionen gefunden. Neben ebenfalls Auslösung von niedrig malignen Veränderungen der Zytologie oder Histologie der Cervix verursachen die onkogenen Typen zusätzlich höhergradige prämaligne Läsionen und werden in manifesten Cervixkarzinomen gefunden (siehe dazu Tabelle 1, Baseline HPV-Verteilung in der Studie HPV-008). Bei Betrachtung des relativen Anteils von HPV 16 und 18 an niedrig malignen Läsionen, an höher malignen präkanzerösen Läsionen bis hin zu manifesten Cervixkarzinomen kommt es zur deutlichen relativen Zunahme des Anteils von HPV 16 und 18 an der Gesamtheit der höher malignen Läsionen, was die besondere pathogenetische Bedeutung von HPV 16 und 18 für das manifeste Cervixkarzinom herausstellt. HPV 16 und 18 sind an der Entstehung von ca. 70% aller Cervixkarzinome weltweit beteiligt. HPV 16, 18, 31, 33 und 45 stellen die häufigsten in Cervixkarzinomen nachgewiesenen HPV dar.
Ein weiterer in Fall-Kontroll-Studien signifikanter unabhängiger Kofaktor für die Entstehung eines Plattenepithelkarzinoms der Cervix stellt das Rauchen dar, weil durch das Rauchen die Abheilung der sehr häufigen asymptomatischen, spontan reversiblen HPV-Infektionen verzögert wird (vgl. «Eigenschaften/Wirkungen», Einfluss des Rauchens auf die Antikörper-Entwicklung nach Impfung mit Cervarix in der Studie HPV-008).
Pharmakodynamik
Impfstoff-induzierte Immunogenität
Ein minimaler Antikörperspiegel, der mit einem Schutz assoziiert wird gegen CIN Grad 2 oder 3 oder gegen eine persistierende Infektion, hervorgerufen durch einen der im Impfstoff enthaltenen HPV-Typen, ist für HPV-Impfstoffe nicht definiert.
Die Antikörper-Antwort auf HPV-16 und HPV-18 wurde mit einem typspezifischen ELISA gemessen, für den gezeigt wurde, dass er mit dem Pseudovirion-basierten Neutralisationstest korreliert.
Die Immunogenität, die durch 3 Dosen Cervarix hervorgerufen wird, wurde bei 5'303 Mädchen/Frauen im Alter von 10 bis 55 Jahren untersucht.
In klinischen Studien betrug die Serokonversionsrate für die beiden HPV-Typen 16 und 18 bei ursprünglich seronegativen Probanden einen Monat nach der dritten Dosis mehr als 99%. Die durch den Impfstoff induzierten geometrischen Mittelwerte (GMT) für IgG waren weit über den Titern, die bei Frauen mit vorangegangenen Infektionen, bei denen die HPV-Infektion ausgeheilt war (natürliche Infektion), beobachtet wurden. Ursprünglich seropositive und seronegative Probanden erreichten vergleichbare Titer nach der Impfung.
Die Studie 001/007 mit Frauen im Alter von 15 bis 25 Jahren zum Zeitpunkt der Impfung untersuchte die Immunantwort gegen HPV-16 und HPV-18 bis zu 76 Monate nach der ersten Impfdosis.
Die durch den Impfstoff induzierten geometrischen Mittelwerte (GMT) für IgG gegen HPV-16 und HPV-18 waren im Monat 7 am höchsten und fielen bis zum Monat 18 auf ein Plateau ab, das bis zum Ende der Nachbeobachtungsphase im Monat 76 konstant blieb. Am Ende der Nachbeobachtungsphase im Monat 76 waren die GMTs für HPV-16 und HPV-18 noch mindestens 11-fach höher als bei vormals infizierten Frauen, bei denen die HPV-Infektion ausgeheilt ist. Mehr als 98% der Frauen waren zu diesem Zeitpunkt noch seropositiv für beide Antigene.
In der klinischen Studie 008 war die Immunogenität im Monat 7 vergleichbar mit der Immunantwort, die in der Studie 001/007 beobachtet wurde.
Im Rahmen von zwei explorativen Analysen an Subgruppen wurde der Einfluss des Rauchens auf die Antikörperentwicklung nach Impfung mit 3 Dosen Cervarix im Monat 7 (1 Monat nach der 3. Dosis) bestimmt. Dabei wurden die ELISA-Antikörpermessungen gegen HPV-16 und HPV-18 mit dem anamnestischen Raucherstatus als auch mit Cotinin-Messungen im Serum korreliert. Konsistent zeigten sich bei allen Analysen niedrigere ELISA Antikörpertiter gegen HPV-16 und HPV-18 sowohl bei positiver Raucheranamnese als auch bei positivem Cotinin-Nachweis im Serum. Daten zur klinischen Wirksamkeit in Abhängigkeit von Raucherstatus liegen nicht vor. Es ist nicht belegt, dass die Höhe der ELISA Antikörper gegen HPV-16 und HPV-18 mit der klinischen Wirksamkeit von HPV-Impfstoffen korreliert. Die gefundenen Daten unterstützen indirekt die epidemiologischen Beobachtungen von häufigeren Plattenepithelkarzinomen der Cervix bei Raucherinnen (siehe oben HPV-Epidemiologie).
In einer anderen klinischen Studie (Studie 014) mit Frauen im Alter von 15 bis 55 Jahren waren alle Probanden nach der dritten Dosis (im Monat 7) seropositiv für HPV-16 und HPV-18. Jedoch waren die GMTs bei Frauen über 25 Jahren niedriger. Trotzdem blieben alle Probandinnen während der ganzen Nachbeobachtungsphase (bis Monat 18) für beide HPV-Typen seropositiv. Die Antikörperspiegel blieben eine Zehnerpotenz über denen nach einer natürlichen Infektion.
Übertragbarkeit der Wirksamkeitsdaten von Cervarix von jungen, erwachsenen Frauen auf Mädchen
In zwei klinischen Studien (HPV-012 und -013), die bei Mädchen im Alter von 10 bis 14 Jahren durchgeführt wurden, waren alle Probanden nach der dritten Dosis (im Monat 7) seropositiv für HPV-Typ 16 und 18. Die GMTs waren mindestens 2-fach höher als bei Frauen im Alter von 15 bis 25 Jahren.
In einer laufenden klinischen Studie (HPV-070) mit Mädchen im Alter von 9 bis 14 Jahren unter einem Impfschema mit 2 Dosen (0,6 Monate) wurde bei allen Probandinnen nach der zweiten Dosis (Monat 7) eine Serokonversion bezüglich der HPV-Typen 16 und 18 festgestellt und die Immunantwort (ELISA GMT) nach 2 Dosen bei Mädchen zwischen 9 und 14 Jahren hat sich ein Monat nach der letzten Dosis (Monat 7) gegenüber der Immunantwort nach 3 Dosen bei Frauen zwischen 15 und 25 Jahren als nichtunterlegen erwiesen (primärer Endpunkt bei Monat 7: sequenzielle statistische Testung für Serokonversion und ELISA GMT).
(Sekundäre Endpunkte: ELISA GMT mit sequenzieller statistischer Testung nach den Monaten 12, 18, 24 und 36 sowie zusätzlich Bestimmung von zellulärer Immunität und neutralisierenden Antikörpern jeweils nach den Monaten 7, 12, 24 und 36).
Bisher ist keine Korrelation für den Schutz für HPV definiert.
Auf Grundlage dieser Immunogenitätsdaten kann abgeleitet werden, dass die Wirksamkeit von Cervarix auf Mädchen im Alter von 10 bis 14 Jahren übertragbar ist.
Immunogenität bei Frauen ab 26 Jahren
In der Phase III-Studie (HPV-015) an Frauen ab 26 Jahren waren zum 48-Monats-Erhebungszeitpunkt, d.h. 42 Monate nach Abschluss des vollständigen Impfschemas, 100% der ursprünglich für Anti-HPV-16-Antikörper seronegativen Frauen und 99,4% der ursprünglich für Anti-HPV-18-Antikörper seronegativen Frauen seropositiv. Alle zu Beginn seropositiven Frauen blieben seropositiv für Antikörper gegen HPV-16 und HPV-18. Die Antikörpertiter waren im Monat 7 am höchsten und fielen bis zum Monat 18 auf ein Plateau ab, das bis zum Monat 48 konstant blieb.
Immunogenität bei HIV-infizierten Frauen
In der monozentrischen, südafrikanischen Phase I/II Studie HPV-020 erhielten 60 von 120 HIV-positiven 18 bis 25 Jahre alten Probandinnen Cervarix (Einschlussbedingung ≥200 CD4-Zellen pro mm3, davon ca. 43% ≥500 CD4-Zellen pro mm3, 78,7% der HIV-positiven Frauen erhielten alle vorgesehenen Dosen Cervarix). 42 von 60 HIV-positiven Probandinnen mit Cervarix wurden über 12 Monate nachkontrolliert (diese 42 Probanden hatten überwiegend keine antiretrovirale Therapie). Die Baseline Belastung (serologisch gemessen) mit vorher durchgemachten bzw. vorbestehenden HPV 16 und 18 Infektionen betrug 52,3% für gleichzeitige Infektionen mit HPV 16 und 18, sowie 79,4% für Infektionen mit mindestens einem der beiden HPV-Typen 16 und/oder 18. Die 42 Probandinnen waren nach der dritten Dosis (im Monat 7) seropositiv für HPV-16 und HPV-18, wobei die Seropositivität für HPV-16 und HPV-18 bis zum Monat 12 aufrecht erhalten blieb. Die GMTs (mittlere geometrische Antikörpertiter) waren in der HIV-positiven Gruppe mit ca. 44% (anti-HPV 16) und mit ca. 53% (anti-HPV 18) im Vergleich zu einer HIV-negativen mit Cervarix geimpften Kontrollgruppe von 22 Probanden vermindert. Es gibt keine klinisch definierten Schutzschwellen für anti-HPV Antikörpertiter. Es ist unbekannt, ob die Impfung mit Cervarix von HIV-positiven Personen mit ≥200 CD4-Zellen zu einer klinischen Schutzwirkung vor höhergradigen histologischen Läsionen CIN2+ und manifesten Zervixkarzinomen führt.
Die Sicherheit von Cervarix bei den 48 bezüglich Sicherheit über 12 Monate vollständig nachkontrollierten HIV-infizierten Frauen im Alter von 18 bis 25 Jahren kann zum jetzigen Zeitpunkt noch nicht abschliessend beurteilt werden.
Klinische Wirksamkeit
Prophylaktische Wirksamkeit:
Klinische Wirksamkeit bei Frauen im Alter von 15 bis 25 Jahren:
Die Wirksamkeit von Cervarix wurde anhand von zwei kontrollierten, doppelblinden, randomisierten klinischen Studien (HPV-001/007 und HPV-008) untersucht, an denen insgesamt 19'778 Frauen und Mädchen im Alter von 15 bis 25 Jahren (bei Studienbeginn) teilnahmen.
Zervikale intraepitheliale Neoplasien (CIN) Grad 2 und 3 oder zervikale Adenokarzinoma in situ (AIS) sind die möglichen Vorstufen eines Plattenepithelzellkarzinoms, resp. eines Adenokarzinoms der Cervix. Es konnte gezeigt werden, dass mit ihrer Diagnose und Entfernung Krebs verhindert werden kann. Im klinischen Entwicklungsprogramm von Cervarix dienten CIN2/3 und AIS (präkanzeröse Läsionen) somit als Surrogatmarker zur Prävention von Gebärmutterhalskrebs. In klinischen Studien zur Untersuchung der Wirksamkeit von Cervarix wurden als Endpunkte die Anzahl Fälle von CIN2/3 und AIS assoziiert mit HPV-16, HPV-18 und anderen onkogenen HPV-Typen gewählt. Persistierende Infektionen über einen Zeitraum von 6 und 12 Monaten zählten zu den sekundären Endpunkten.
Die klinische Studie HPV-001/007 schloss nur Frauen ein mit einem Negativbefund in zervikalen Proben für onkogene HPV-DNA (HPV-16, -18, -31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66 und -68), mit einem seronegativen Befund für Antikörper gegen HPV-16 und HPV-18, sowie mit einem zytologischen Normalbefund. Dies sind typische Eigenschaften für ein Kollektiv, das voraussichtlich keine bestehende HPV-Infektion und vor der Impfung keinen Kontakt mit onkogenen HPV-Typen gehabt hat («HPV-naiv»). Im erweiterten Follow-up dieser Studie wurde Langzeit-Wirksamkeit, Langzeit-Immunogenizität und langfristige Sicherheit untersucht. Bisher liegen Ergebnisse für bis zu 6,4 Jahre vor.
In der klinischen Studie HPV-008 wurden Frauen aufgenommen, unabhängig vom zytologischen Status, vom HPV-DNA-Status und vom serologischen Status. Diese Studie spiegelt somit eine Population von HPV-naiven (keine aktuelle Infektion, keine vorherige Exposition) oder nicht-naiven Frauen (mit bestehenden HPV-Infektionen und/oder vorheriger Exposition). Vor der Impfung wurden Proben für Tests auf onkogene HPV-DNA (HPV-16, -18, -31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66 und -68) entnommen, sowie serologisch auf Antikörper gegen HPV-16 und HPV-18 getestet (siehe Tabelle 1).
In beiden Studien erfolgte die Testung mittels SPF10-LiPA25 PCR, um im gesammelten Biopsiematerial nach HPV-DNA von onkogenen HPV-Typen zu suchen.
Prophylaktische Wirksamkeit gegen HPV-Typen 16 und 18
Studie HPV-008 war eine kontrollierte, randomisierte, doppelblinde Studie. Hier erhielten 18'665 gesunde Frauen im Alter von 15 bis 25 Jahren Cervarix oder einen Hepatitis A-Impfstoff als Kontrolle in einem 3 Dosenschema (0, 1, 6 Monate). Von den Frauen waren 54,8% kaukasischer, 31,5% asiatischer, 7,1% hispanischer, 3,7% afrikanischer und 2,9% von einer anderen ethnischen Herkunft.
In dieser Studie wurden die Frauen unabhängig von ihrem HPV-DNA-Status bei Studienbeginn randomisiert und geimpft. Frauen, bei denen zu Beginn der Impfserie HPV-16- oder HPV-18-DNA in Cervix-Proben nachgewiesen werden konnte, galten als aktuell mit dem entsprechenden HPV-Typen infiziert. Wenn keine HPV-DNA mittels PCR nachgewiesen werden konnte, galten die Frauen als HPV-DNA negativ. Des Weiteren wurden die Cervix-Proben nach zytologischen Auffälligkeiten untersucht und die Frauen wurden bei Studienbeginn serologisch auf anti-HPV-16- und anti-HPV-18-Antikörper getestet. Frauen mit nachweisbaren anti-HPV-Antikörpern im Serum wurden als seropositiv charakterisiert und galten als Frauen mit einer vorherigen HPV-Exposition. Frauen, die seropositiv für HPV-16 oder HPV-18 waren, aber DNA-negativ für den entsprechenden HPV-Typen waren, galten als Frauen, bei denen eine natürliche Infektion wieder ausgeheilt war («geklärte» Infektion). Frauen ohne Antikörper gegen HPV-16 und HPV-18 galten als seronegativ. Zu Studienbeginn vor Verabreichung der Impfung waren 72,9% der Frauen naiv bezüglich vorbestehenden HPV-Infektionen (kein Virus-DNA-Nachweis in der PCR, kein serologischer Nachweis von Antikörpern gegen HPV-16 und HPV-18). Für Frauen mit einem positiven HPV-DNA-Nachweis in der PCR Baseline vor der Impfung war die Verteilung der gefundenen HPV-Typen wie in Tabelle 1 gezeigt.
Tabelle 1: Baseline HPV-DNA-Status (onkogene HPV-Typen, Total Vaccinated Cohort)
Cervarix N=9'319 | Kontrollgruppea N=9'325 | Gesamt N=18'644 | |||||
|---|---|---|---|---|---|---|---|
DNA Status | n | % | n | % | n | % | |
DNA 16 | DNA neg | 8'779 | 94,4 | 8'819 | 94,8 | 17'598 | 94,6 |
DNA pos | 521 | 5,6 | 483 | 5,2 | 1'004 | 5,4 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 18 | DNA neg | 9'084 | 97,7 | 9'085 | 97,7 | 18'169 | 97,7 |
DNA pos | 216 | 2,3 | 217 | 2,3 | 433 | 2,3 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 31 | DNA neg | 9'073 | 97,6 | 9'112 | 98,0 | 18'185 | 97,8 |
DNA pos | 227 | 2,4 | 190 | 2,0 | 417 | 2,2 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 33 | DNA neg | 9'208 | 99,0 | 9'212 | 99,0 | 18'420 | 99,0 |
DNA pos | 92 | 1,0 | 90 | 1,0 | 182 | 1,0 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 35 | DNA neg | 9'226 | 99,2 | 9'243 | 99,4 | 18'469 | 99,3 |
DNA pos | 74 | 0,8 | 59 | 0,6 | 133 | 0,7 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 39 | DNA neg | 9'100 | 97,8 | 9'123 | 98,1 | 18'223 | 98,0 |
DNA pos | 200 | 2,2 | 179 | 1,9 | 379 | 2,0 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 45 | DNA neg | 9'227 | 99,2 | 9'214 | 99,1 | 18'441 | 99,1 |
DNA pos | 73 | 0,8 | 88 | 0,9 | 161 | 0,9 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 51 | DNA neg | 8'925 | 96,0 | 8'913 | 95,8 | 17'838 | 95,9 |
DNA pos | 375 | 4,0 | 389 | 4,2 | 764 | 4,1 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 52 | DNA neg | 8'982 | 96,6 | 8'967 | 96,4 | 17'949 | 96,5 |
DNA pos | 318 | 3,4 | 335 | 3,6 | 653 | 3,5 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 56 | DNA neg | 9'140 | 98,3 | 9'145 | 98,3 | 18'285 | 98,3 |
DNA pos | 160 | 1,7 | 157 | 1,7 | 317 | 1,7 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 58 | DNA neg | 9'177 | 98,7 | 9'200 | 98,9 | 18'377 | 98,8 |
DNA pos | 123 | 1,3 | 102 | 1,1 | 225 | 1,2 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 59 | DNA neg | 9'201 | 98,9 | 9'216 | 99,1 | 18'417 | 99,0 |
DNA pos | 99 | 1,1 | 86 | 0,9 | 185 | 1,0 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 66 | DNA neg | 9'090 | 97,7 | 9'078 | 97,6 | 18'168 | 97,7 |
DNA pos | 210 | 2,3 | 224 | 2,4 | 434 | 2,3 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA 68 | DNA neg | 9'134 | 98,2 | 9'142 | 98,3 | 18'276 | 98,2 |
DNA pos | 166 | 1,8 | 160 | 1,7 | 326 | 1,8 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA HR-HPVb | DNA neg für 14 HR-HPV | 7'402 | 79,6 | 7'447 | 80,1 | 14'849 | 79,8 |
DNA pos für mindestens einen der 14 HR-HPV | 1'898 | 20,4 | 1'855 | 19,9 | 3'753 | 20,2 | |
k.A. | 19 | - | 23 | - | 42 | - | |
DNA HRW-HPVc | DNA neg für 12 HR-HPV | 7'748 | 83,3 | 7'766 | 83,5 | 15'514 | 83,4 |
DNA pos für mindestens einen der 12 HR-HPV | 1'552 | 16,7 | 1'536 | 16,5 | 3'088 | 16,6 | |
k.A. | 19 | - | 23 | - | 42 | - | |
k.A. = keine Angaben
a Hepatitis A-Impfstoff
b HR-HPV = High-risk (onkogene) HPV-Typen: HPV-16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 und 68
c HRW-HPV = Alle High-risk (onkogenen) HPV-Typen ohne HPV-16 und HPV-18
Die Wirksamkeitsendpunkte beinhalteten eine histologische Beurteilung von präkanzerösen und dysplastischen Läsionen (CIN Grad 1, 2 oder 3), sowie Adenocarcinoma in situ (AIS). Die mediane Beobachtungszeit nach der ersten Dosis betrug ungefähr 39 Monate. Virologische Endpunkte (HPV-DNA in Cervix-Proben mittels PCR untersucht) beinhalteten 6 bzw. 12 Monate persistierende Infektion (definiert als mindestens 2 positive Ergebnisse für denselben HPV-Typen während einer minimalen Beobachtungsdauer von 5 bzw. 10 Monaten).
Die «ATP-Kohorte» (According To Protocol) für die Bestimmung der Wirksamkeit gegen HPV-16 und HPV-18 umfasste alle Frauen, für die Wirksamkeitsergebnisse vorlagen, welche alle 3 Impfstoff-Dosen erhalten hatten, und welche bei Studienbeginn HPV-16- und/oder HPV-18-DNA-negativ und -seronegativ waren und nach 6 Monaten je nach zu analysierendem Typen HPV-16-DNA und/oder HPV-18-DNA negativ waren. Das Zählen der Fälle in der ATP-Kohorte begann am Tag 1 nach der dritten Impfdosis. Diese Kohorte umfasste Frauen mit normaler Zytologie oder geringgradigen Änderungen (zytologische Veränderungen wie z.B. atypische Plattenepithelzellen unbekannter Signifikanz (ASC-US) oder geringgradige intraepitheliale Läsionen (LSIL)) bei Studienbeginn. Frauen mit hochgradig veränderter Zytologie waren von dieser Kohorte ausgeschlossen.
Die «TVC-Kohorte» (Total Vaccinated Cohort) für die Wirksamkeitsanalysen umfasste alle Frauen, für die Wirksamkeitsergebnisse vorlagen, welche mindestens eine Dosis eines Impfstoffes erhalten hatten, unabhängig von ihrem HPV-DNA-Status, ihrer Zytologie und ihrem Serostatus bei Impfbeginn. Das Zählen der Fälle in der TVC-Kohorte begann am Tag 1 nach der ersten Dosis.
Die «TVC-naive Kohorte» ist eine Untergruppe der Total Vaccinated Cohort, welche bei Beginn der Impfserie eine normale Zytologie hatte, HPV-DNA-negativ für 14 onkogene HPV-Typen war und seronegativ für HPV-16 und HPV-18.
Die finale Analyse der HPV-008-Studie war als primärer Endpunkt im Studiendesign ereignisabhängig, d.h. sie wurde durchgeführt, wenn mindestens 36 Fälle von mit HPV-16/18-assoziierten CIN2+-Läsionen in der ATP-Kohorte beobachtet worden waren. Die mittlere Beobachtungsdauer betrug ca. 39 Monate nach der ersten Dosis.
Die Studienabschlussanalyse wurde nach Ablauf des vierjährigen Beobachtungszeitraums (d.h. 48 Monate nach der ersten Dosis) durchgeführt und berücksichtigte alle Probandinnen der TVC-Kohorte (Total Vaccinated Cohort).
Cervarix erwies sich als wirksam bei der Prävention von präkanzerösen Läsionen oder AIS, welche mit HPV-16 und HPV-18 assoziiert sind (Tabelle 2).
Tabelle 2: Wirksamkeit von Cervarix gegen histopathologische Läsionen assoziiert mit HPV-16 oder HPV-18 in Frauen von 15 bis 25 Jahren (ATP-Kohortea, Studie HPV-008)
Studienabschlussanalyse über 48 Monatec | |||
|---|---|---|---|
HPV-16/18-Endpunkt | Cervarix (N=7'338) | Kontrollgruppeb (N=7'305) | % Wirksamkeit (95% KI) |
Anzahl Fälled | Anzahl Fälle | ||
CIN2+ | 5 | 97 | 94,9 |
CIN3+ | 2 | 24 | 91,7 |
a Frauen mit normaler Zytologie, ASC-US oder LSIL bei Impfbeginn, welche 3 Impfstoff-Dosen erhielten. Sie waren seronegativ und HPV-DNA-negativ bei Studienbeginn, sowie HPV-DNA-negativ nach 6 Monaten für den entsprechenden HPV-Typen (N).
b Die Kontrollgruppe erhielt einen Hepatitis A-Impfstoff mit 720 I.E. Antigen und 500 µg Al(OH)3.
c Mittlere Nachbeobachtung von 40 Monaten nach der 3. Dosis
d Einschliesslich 4 Fälle CIN2+ und 2 Fälle CIN3+, in welchen ein weiterer HPV-Typ zusammen mit HPV-16 oder HPV-18 in der Läsion nachgewiesen werden konnte.
Bei der Ereignis-getriggerten Analyse (primärer Endpunkt) betrug die Wirksamkeit gegen CIN2+ 92,9% (96,1% KI: 79,9; 98,3) und gegen CIN3+ 80% (96,1% KI: 0,3; 98,1). Das hier angegebene 96,1% Konfidenzintervall (KI) berücksichtigt eine statistische Anpassung aufgrund der vorher durchgeführten Interimsanalyse. Zusätzlich wurde eine statistisch signifikante Wirksamkeit des Impfstoffes gegen CIN2+, die mit den einzelnen HPV-Typen 16 und 18 assoziiert waren, gezeigt.
Einige der CIN3+- und CIN2+-Läsionen enthielten mehrere onkogene Typen (einschliesslich HPV-Typen, die nicht im Impfstoff enthalten sind). Die Verteilung der Infektionen mit multiplen HPV-Typen zeigt Tabelle 3. Die vorliegenden Daten machen einen verstärkenden Einfluss von HPV-Mehrfachinfektionen mit HPV-16 und/oder HPV-18 auf häufigere bzw. schnellere Progression einer asymptomatischen Infektion zur präkanzerösen histologischen Läsion wahrscheinlich.
Tabelle 3: Häufigkeit von Infektionen mit einem einzigen HPV-Typ und von Ko-Infektionen mit zwei oder mehr HPV-Typen bei Fällen von inzidenten Infektionen in jeder Behandlungsgruppe
Anzahl Mehrfachinfektionen | Kontrollgruppe (Hepatitis A) | Cervarix | Gesamt |
|---|---|---|---|
1 | 178 | 237 | 415 |
2 | 155 | 171 | 326 |
3 | 109 | 112 | 221 |
4 | 70 | 46 | 116 |
5 | 28 | 23 | 51 |
6 | 21 | 11 | 32 |
7 | 10 | 4 | 14 |
8 | 4 | 1 | 5 |
9 | 1 | 0 | 1 |
10 | 1 | 0 | 1 |
11 | 0 | 1 | 1 |
Gesamt | 577 | 606 | 1'183 |
Zusätzlich konnte zum Zeitpunkt der Studienabschlussanalyse nach 48 Monaten eine statistisch signifikante Wirksamkeit des Impfstoffes gegen CIN2/3 oder AIS individuell für HPV-16 und HPV-18 gezeigt werden.
Frauen, die bereits vor der Impfung mit einem HPV-Typen infiziert waren (HPV-16 oder HPV-18), waren vor Erkrankungen geschützt, die durch den anderen HPV-Typen verursacht wurden.
Die Wirksamkeit von Cervarix gegen inzidente, 6 und 12 Monate persistierende Infektion mit HPV-16 und HPV-18 wurde auch untersucht (siehe Tabelle 4).
Tabelle 4: Wirksamkeit des Impfstoffes gegen virologische und zytologische Endpunkte im Zusammenhang mit HPV-16 oder HPV-18 (ATP-Kohorte, Studie HPV-008)
Studienabschlussanalyse über 48 Monate | |||||
|---|---|---|---|---|---|
HPV-16/18-Endpunkt | Cervarix | Kontrollgruppe | % Wirksamkeit (95% KI) | ||
N | Anzahl Fälle | N | Anzahl Fälle | ||
Virologische Endpunkte | |||||
Inzidente Infektion | 7'337 | 280 | 7'311 | 1'276 | 79,6 |
Persistierende Infektion (6 Monate) | 7'182 | 35 | 7'137 | 588 | 94,3 |
Persistierende Infektion (12 Monate) | 7'082 | 26 | 7'038 | 354 | 92,9 |
Zytologische Endpunkte | |||||
Zytologische Veränderungen (≥ ASC-US) | 7'334 | 55 | 7'305 | 575 | 90,7 |
Die Wirksamkeit betrug bei der Ereignis-getriggerten Analyse 94,3% (96,1% KI: 91,5; 96,3) gegen eine 6-Monate-persistierende Infektion, 91,4% (96,1% KI: 89,4; 95,4) gegen eine 12-Monate-persistierende Infektion und 89,0% (96,1% KI: 84,9; 92,1) gegen zytologische Veränderungen (≥ ASC-US).
Die Immunantwort nach einer natürlich erworbenen Infektion verleiht keinen zuverlässigen Schutz vor erneuter Infektion. Bei den Frauen, die bei Beginn der Impfserie seropositiv und DNA-negativ für HPV-16 oder HPV-18 und nach 6 Monaten (nach der 3. Dosis) weiterhin DNA-negativ waren, reduzierte Cervarix die Inzidenz von 12 Monate persistierenden Infektionen in der 48-Monate-Analyse um 94,0% (76,7; 99,3). Jedoch war die Zahl der CIN2/3- oder AIS-Fälle zu gering, um eine Wirksamkeit gegen histopathologische Endpunkte in dieser Gruppe zu bestimmen.
Studie HPV-001/007: In der zweiten kontrollierten, randomisierten, doppelblinden Studie bei 1'113 Frauen von 15 bis 25 Jahren wurde die Wirksamkeit von Cervarix bei der Prävention von HPV-16- oder HPV-18-Infektionen (Neuinfektionen und persistierende Infektionen) mit einer Kontrollimpfung aus Aluminiumhydroxid verglichen. Die Studienpopulation war naiv (keine bestehende HPV-Infektion zum Zeitpunkt der Impfung und vor der Impfung kein Kontakt mit HPV-16 und HPV-18, d.h. totale Kohorte). Insgesamt 776 Frauen wurden in die erweiterte Follow-up-Studie aufgenommen, um die Langzeit-Wirksamkeit, Immunogenizität und Sicherheit von Cervarix zu untersuchen. Diese Frauen sind nun bis zu 6,4 Jahre nachbeobachtet worden.
In der Studie HPV-001/007, mit einer Beobachtungszeit von bis zu 6,4 Jahren (median 5,9 Jahre), lag in HPV-naiven Frauen von 15 bis 25 Jahren die Wirksamkeit von Cervarix gegen mit HPV-16 oder HPV-18 assoziierte CIN2/3 oder AIS bei 100% (98,7% KI: 28,4; 100). Die Wirksamkeit gegen 12 Monate persistierende Infektion von HPV-16 oder HPV-18 betrug ebenfalls 100% (98,7% KI: 74,4; 100). Das Konfidenzintervall in dieser finalen Analyse basiert auf statistischer Anpassung aufgrund vorheriger Analysen.
Wirksamkeit gegen HPV-Typen 16 und 18, unabhängig von bestehenden HPV-Infektionen oder vorheriger Exposition mit HPV-16 oder HPV-18
Die Studie HPV-008 schloss Frauen ein ungeachtet ihres HPV-DNA-Status (aktuelle Infektionen) und Serostatus (vorherige Exposition) bezüglich der Impfstoff-Typen HPV-16 oder HPV-18 bei Studienbeginn. Die Wirksamkeitsanalyse beinhaltete Läsionen, welche bei den Frauen unabhängig vom DNA-Status und Serostatus auftraten und beinhaltete auch HPV-Infektionen, welche schon vor der Impfung bestanden (siehe oben Tabelle 1) und solche, die ab der 1. Impfdosis erworben wurden. In dieser Gruppe, welche HPV-naive (ohne aktuelle Infektion und ohne vorherige Exposition) und nicht-HPV-naive Frauen umfasst, war Cervarix wirksam in der Prävention von präkanzerösen Läsionen oder AIS, welche mit HPV-16 oder HPV-18 assoziiert waren.
In Frauen, welche HPV-DNA-positiv waren, unabhängig vom Serostatus bei Impfbeginn, gab es keine klare Evidenz einer Wirksamkeit gegen mit HPV-16 oder HPV-18 assoziierte präkanzeröse Läsionen oder AIS (Tabelle 5).
Tabelle 5: Wirksamkeit von Cervarix gegen mit HPV-16 oder HPV-18 assoziierte Erkrankungen in Frauen von 15 bis 25 Jahren, unabhängig von aktueller oder vorheriger Exposition mit einem der Impf-Serotypen (Studie HPV-008)
Cervarix | Kontrollgruppe | % Wirksamkeit | |||
|---|---|---|---|---|---|
N | Anzahl Fällea | N | Anzahl Fällea | ||
HPV-16 oder HPV-18 DNA-positiv bei Studienbeginnc | 641 | 90 | 592 | 92 | -- |
a Fälle = histopathologisch mit HPV-16 und/oder HPV-18 assoziierte Fälle von CIN 1/2/3 und AIS
b das in dieser finalen Analyse wiedergegebene 96,1% Konfidenzintervall basiert auf statistischer Anpassung aufgrund vorheriger durchgeführter Interimsanalysen.
c Untergruppe der TVC: umfasst alle geimpften Frauen (mindestens eine Dosis), die bei Studienbeginn HPV-DNA-positiv waren für HPV-16 und HPV-18, unabhängig vom Serostatus bei Impfbeginn. Das Zählen der Fälle begann an Tag 1 nach der ersten Impfdosis.
Die Wirksamkeit des Impfstoffes gegen hochgradige Cervixläsionen, die mit HPV-16/18 assoziiert sind, in der gesamten geimpften Kohorte (TVC) am Ende der Studie nach 48 Monaten wird in Tabelle 6 gezeigt.
Tabelle 6: Wirksamkeit des Impfstoffes gegen hochgradige Zervixläsionen, die mit HPV-16/18 assoziiert sind (TVC-Kohortea, Studie HPV-008)
HPV-16/18-Endpunkt | Studienabschlussanalyse nach 48 Monatenb | ||
|---|---|---|---|
Cervarix (N=8'694) | Kontrollgruppe (N=8'708) | % Wirksamkeit (95% KI) | |
n | n | ||
CIN2+ | 90 | 228 | 60,7% |
CIN3+ | 51 | 94 | 45,7% |
N = Anzahl der Frauen in jeder Gruppe
n = Anzahl der Fälle
a TVC-Kohorte: umfasst alle geimpften Frauen, die mindestens eine Impfdosis erhalten hatten, ungeachtet ihres HPV-DNA-Status, der Zytologie und des Serostatus zu Studienbeginn. Diese Kohorte enthält Frauen mit vorbestehenden Infektionen/Läsionen.
b Mittlere Nachbeobachtung von 44 Monaten nach der 1. Dosis
Die Wirksamkeit des Impfstoffes gegen virologische Endpunkte (inzidente Infektion, persistierende Infektion über einen Zeitraum von 6 und 12 Monaten) im Zusammenhang mit HPV-16/18 in der TVC-Kohorte am Ende der Studie wird in Tabelle 7 gezeigt.
Tabelle 7: Wirksamkeit des Impfstoffes gegen virologische Endpunkte im Zusammenhang mit HPV-16/18 (TVC-Kohortea, Studie HPV-008)
HPV-16/18-Endpunkt | Studienabschlussanalyse nach 48 Monatenb | ||
|---|---|---|---|
Cervarix | Kontrollgruppe | % Wirksamkeit | |
n/N | n/N | ||
Inzidente Infektion | 1'133/9'316 | 2'334/9'319 | 54,6% |
Persistierende Infektion (6 Monate) | 504/8'863 | 1'227/8'870 | 60,9% |
Persistierende Infektion (12 Monate) | 335/8'648 | 767/8'671 | 57,5% |
N = Anzahl der Frauen in jeder Gruppe
n = Anzahl der Fälle
a TVC-Kohorte: umfasst alle geimpften Frauen, die mindestens eine Impfdosis erhalten hatten, ungeachtet ihres HPV-DNA-Status, der Zytologie und des Serostatus zu Studienbeginn.
b mittlere Nachbeobachtung von 44 Monaten nach der 1. Dosis
Allgemeine Auswirkungen des Impfstoffes auf die Krankheitslast durch HPV-Infektionen aller Subtypen
Wirksamkeit unabhängig vom HPV-Typ, unabhängig von aktuellen oder vorherigen Infektionen mit Impfstoff-HPV-Typen oder nicht im Impfstoff enthaltenen HPV-Typen
Studie HPV-008: Die Schutzwirkung von Cervarix gegen die Gesamtkrankheitslast von HPV-assoziierten Erkrankungen der Cervix resultiert aus einer Kombination von prophylaktischer Wirksamkeit gegen HPV-16, HPV-18, der Reduzierung von HPV-Mehrfachinfektionen mit HPV-16 und HPV-18 und nicht-Impfstoff-HPV-Typen sowie deren Beitrag zur Krankheitslast.
In der «TVC»-Kohorte und in der «TVC-naiven» Kohorte, die alle geimpften Frauen umfasst, wurde die Wirksamkeit des Impfstoffes gegen CIN3+, CIN2+ und CIN1+ gezeigt (Tabelle 8). Der Einfluss von Cervarix auf die Reduktion lokaler Cervixtherapien (loop electrosurgical excision procedure (LEEP), Cold Knife Conization und Lasereingriffe) hat sich bei diesen Kohorten ebenfalls gezeigt (Tabelle 8).
Die Fallzahlbestimmung für die TVC-Kohorte und TVC-naive Kohorte begann am Tag 1 nach der ersten Dosis.
Die TVC-naive Kohorte ist eine Untergruppe der TVC-Kohorte, die Frauen mit normaler Zytologie umfasst, und die zu Studienbeginn HPV-DNA-negativ für 14 onkogene HPV-Typen (HPV-16, -18, -31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66, -68) und seronegativ für HPV-16 und HPV-18 waren.
Tabelle 8: Wirksamkeit des Impfstoffes unabhängig vom HPV-DNA-Typ in der Läsion und vom serologischen Status zu Studienbeginn (Studie HPV-008)
Studienabschlussanalyse nach 48 Monatenc | ||||||
|---|---|---|---|---|---|---|
Cervarix | Kontrollgruppe | % Wirksamkeit | ||||
N | Anzahl Fälle | N | Anzahl Fälle | |||
CIN3+ | TVC naivea | 5'466 | 3 | 5'452 | 44 | 93,2 |
TVCb | 8'694 | 86 | 8'708 | 158 | 45,6 | |
CIN2+ | TVC naivea | 5'466 | 61 | 5'452 | 172 | 64,9 |
TVCb | 8'694 | 287 | 8'708 | 428 | 33,1 | |
CIN1+ | TVC naivea | 5'466 | 174 | 5'452 | 346 | 50,3 |
TVCb | 8'694 | 579 | 8'708 | 798 | 27,7 | |
Operative Eingriffe an der Cervix | TVC naivea | 5'466 | 43 | 5'452 | 143 | 70,2 |
TVCb | 8'694 | 230 | 8'708 | 344 | 33,2 | |
Überweisungen zur Kolposkopie | TVC naivea | 5'466 | 672 | 5'452 | 933 | 29,0 (21,6; 35,8) |
TVCb | 8'694 | 1'634 | 8'708 | 1'908 | 14,8 (8.9; 20,3) | |
Zytologische Veränderungen (≥ ASC-US) | TVC naivea | 5'466 | 1'133 | 5'452 | 1'437 | 23,2 (16,9; 29,0) |
TVCb | 8'694 | 2'414 | 8'708 | 2'718 | 12,2 (7,2; 16,9) | |
a «TVC naive»: umfasst alle geimpften Frauen (die mindestens eine Impfdosis erhalten haben), welche bei Studienbeginn eine normale Zytologie hatten, HPV-DNA-negativ für 14 onkogene HPV-Typen sowie seronegativ für HPV-16 und HPV-18 waren.
b «TVC»: umfasst alle geimpften Frauen (die mindestens eine Impfdosis erhalten haben), ungeachtet ihres HPV-DNA-Status, der Zytologie und des Serostatus zu Studienbeginn.
c Mittlere Nachbeobachtung von 44 Monaten nach der 1. Dosis
Kreuzprotektive Wirksamkeit
Die Wirksamkeit von Cervarix bezüglich Kreuzprotektion gegen histopathologische und virologische Endpunkte (persistente Infektion) wurde in der Studie HPV-008 für 12 nicht im Impfstoff enthaltene onkogene HPV-Typen (HPV-31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66, -68) untersucht. Die Studie war nicht zur Beurteilung der Wirksamkeit gegen Erkrankungen ausgelegt, die durch die einzelnen HPV-Typen verursacht wurden. Die Analyse zum primären Endpunkt war durch multiple Ko-Infektionen in den CIN2+-Läsionen beeinflusst (siehe Tabelle 3). Anders als histopathologische Endpunkte sind virologische Endpunkte weniger durch multiple Infektionen beeinflussbar.
Ein Teil der Kreuzprotektion beruht auf der wirksamen Verhinderung von Mehrfachinfektionen mit HPV-16 und/oder HPV-18. Mehrfachinfektionen mit HPV-16 und/oder HPV-18 zeigen eine schnellere bzw. häufigere Progression von lokalen Infektionen zu manifesten prämalignen histologischen Läsionen.
Die Wirksamkeit des Impfstoffes gegen persistierende Infektion über einen Zeitraum von 6 Monaten und CIN 2/3 oder AIS (CIN2+) wird für die nicht im Impfstoff enthaltenen onkogenen HPV-Typen in Tabelle 9 gezeigt (ATP-Kohorte), inkl. Einschluss von Mehrfachinfektionen mit HPV-16 und HPV-18.
Tabelle 9: Wirksamkeit des Impfstoffes gegen nicht im Impfstoff enthaltene onkogene HPV-Typen bei Einschluss von Mehrfachinfektionen mit HPV-16 und HPV-18 (ATP-Kohortea, Studie HPV-008)
Studienabschlussanalyse nach 48 Monaten | ||||||
|---|---|---|---|---|---|---|
HPV-Typ | Persistierende Infektion (6 Monate) | CIN2+ | ||||
Cervarix | Kontrolle | % Wirksamkeit (95% KI) | Cervarix | Kontrolle | % Wirksamkeit (95% KI) | |
n | n | n | n | |||
HPV-16-verwandte Typen (A9-Spezies)b | ||||||
HPV-31 | 58 | 247 | 76,8% (69,0; 82,9) | 5 | 40 | 87,5% (68,3; 96,1) |
HPV-33 | 65 | 117 | 44,8% (24,6; 59,9) | 13 | 41 | 68,3% (39,7; 84,4) |
HPV-35 | 67 | 56 | -19,8% (<0; 17,2) | 3 | 8 | 62,5% (<0; 93,6) |
HPV-52 | 346 | 374 | 8,3% (<0; 21,0) | 24 | 33 | 27,6% (<0; 59,1) |
HPV-58 | 144 | 122 | -18,3% (<0; 7,7) | 15 | 21 | 28,5% (<0; 65,7) |
HPV-18-verwandte Typen (A7-Spezies)b | ||||||
HPV-39 | 175 | 184 | 4,8% (<0; 23,1) | 4 | 16 | 74,9% (22,3; 93,9) |
HPV-45 | 24 | 90 | 73,6% (58,1; 83,9) | 2 | 11 | 81,9% (17,0; 98,1) |
HPV-59 | 73 | 68 | -7,5% (<0; 23,8) | 1 | 5 | 80,0% (<0; 99,6) |
HPV-68 | 165 | 169 | 2,6% (<0; 21,9) | 11 | 15 | 26,8% (<0; 69,6) |
Andere Typenb | ||||||
HPV-51 | 349 | 416 | 16,6% (3,6; 27,9) | 21 | 46 | 54,4% (22,0; 74,2) |
HPV-56 | 226 | 215 | -5,3% (<0; 13,1) | 7 | 13 | 46,1% (<0; 81,8) |
HPV-66 | 211 | 215 | 2,3% (<0; 19,6) | 7 | 16 | 56,4% (<0; 84,8) |
Alle high-risk (onkogenen) HPV-Typen ohne HPV-16 und HPV-18 | ||||||
HRW-HPV | 1'399 | 1'556 | 11,2% (4,5; 17,5) | 88 | 165 | 46,8% (30,7; 59,4) |
n = Anzahl der Fälle
a ATP-Kohorte: umfasst Frauen, die 3 Impfdosen erhielten und die im Monat 0 und Monat 6 HPV-DNA-negativ für den relevanten HPV-Typ waren.
b Typen sind in numerischer Reihenfolge und nicht nach Häufigkeit geordnet.
Die Grenzwerte des Konfidenzintervalls zur Wirksamkeit des Impfstoffes wurden folgendermassen berechnet: Wenn der untere Grenzwert des Konfidenzintervalls kleiner 0 ist, ist die Wirksamkeit nicht statistisch signifikant.
Die Wirksamkeit gegen CIN3 wurde nur für HPV-31 nachgewiesen und es gibt keinen Beleg für die Wirksamkeit gegen AIS für irgendeinen der HPV-Typen.
Klinische Wirksamkeit bei Frauen ab 26 Jahren:
Die Wirksamkeit von Cervarix wurde im Rahmen einer doppelblinden, randomisierten klinischen Phase III-Studie (HPV-015) an insgesamt 5'778 Frauen ab 26 Jahren untersucht. Die Studie wurde in Ländern der Regionen Nord- und Lateinamerika, Asien-Pazifik und Europa durchgeführt. Auch Frauen mit anamnestisch bekannter HPV-Erkrankung bzw. -Infektion wurden eingeschlossen (15%). Eine Zwischenanalyse wurde durchgeführt, nachdem alle Teilnehmerinnen die 48-Monats-Visite absolviert hatten. Die finale Analyse wurde nach Studienabschluss durchgeführt (Frauen über 84 Monate nachverfolgt).
Die primären Wirksamkeitsanalysen wurden in der ATP-Kohorte und der TVC-Kohorte durchgeführt.
In der TVC-Kohorte war die Baseline Verteilung der vorbestehenden HPV-16 und HPV-18 Infektionen wie in der Tabelle 10 dargestellt.
Tabelle 10: Baseline HPV-DNA-Status und serologischer Status (Total Vaccinated Cohort)
Cervarix N=2'877 | Kontrollgruppe N=2'870 | Gesamt N=5'747 | |||||
|---|---|---|---|---|---|---|---|
n | % | n | % | n | % | ||
HPV-16 Serologischer und DNA-Status | DNA neg und sero neg | 1'920 | 66,7 | 1'907 | 66,4 | 3'827 | 66,6 |
DNA neg und sero pos | 847 | 29,4 | 844 | 29,4 | 1'691 | 29,4 | |
DNA pos und sero neg | 32 | 1,1 | 25 | 0,9 | 57 | 1,0 | |
DNA pos und sero pos | 49 | 1,7 | 66 | 2,3 | 115 | 2,0 | |
k.A. | 29 | - | 28 | - | 57 | - | |
HPV-18 Serologischer und DNA-Status | DNA neg und sero neg | 2'019 | 70,2 | 1'999 | 69,7 | 4'018 | 69,9 |
DNA neg und sero pos | 785 | 27,3 | 783 | 27,3 | 1'568 | 27,3 | |
DNA pos und sero neg | 13 | 0,5 | 14 | 0,5 | 27 | 0,5 | |
DNA pos und sero pos | 19 | 0,7 | 16 | 0,6 | 35 | 0,6 | |
k.A. | 41 | - | 58 | - | 99 | - | |
Kontrollgruppe: erhielt ein Al(OH)3 enthaltendes Placebo
N = Anzahl der Probandinnen
n = Anzahl der Probandinnen in einer bestimmten Kategorie
% = n/Anzahl der Probandinnen mit verfügbaren Resultaten x 100
k.A. = keine Angaben, kein Sero- oder DNA-Status bei Baseline vorhanden
Die Daten zur Wirksamkeit des Impfstoffs sind in den folgenden zwei Tabellen zusammengefasst.
Tabelle 11: Wirksamkeit des Impfstoffs gegen mit HPV 16/18 assoziierte 6 Monate persistierende Infektion und/oder CIN1+ bei der ATP- und der TVC-Kohorte nach 48 Monaten
HPV-16/18-Endpunkt | ATP-Kohortea | TVC-Kohorteb | ||||
|---|---|---|---|---|---|---|
Cervarix | Kontrolle | % Wirksamkeit (97,7%-KI) | Cervarix | Kontrolle | % Wirksamkeit (97,7%-KI) | |
n/N | n/N | n/N | n/N | |||
Persistierende Infektion (6 Monate) und/oder CIN1+ | 7/1'898 | 36/1'854 | 81,1% (52,1; 94,0) | 90/2'772 | 158/2'779 | 43,9% (23,9; 59,0) |
Persistierende Infektion (6 Monate) | 6/1'859 | 34/1'822 | 82,9% (53,8; 95,1) | 71/2'767 | 132/2'776 | 47,0% (25,4; 62,7) |
N = Anzahl der Probandinnen in jeder Gruppe
n = Anzahl der Fälle
CIN1+ = CIN1, CIN2, CIN3 oder AIS
a ATP-Kohorte: umfasst Frauen, die 3 Impfdosen erhielten, im Monat 0 DNA-negativ und seronegativ und im Monat 6 DNA-negativ für den relevanten HPV-Typ (HPV-16 und/oder HPV-18) waren.
b TVC-Kohorte: umfasst alle Frauen, die mindestens eine Impfdosis erhalten haben, unabhängig vom HPV-DNA- und Serostatus bei Monat 0. Enthält 15% Frauen mit anamnestisch bekannter HPV-Erkrankung/Infektion.
Die Wirksamkeit des Impfstoffs gegen eine 6 Monate persistierende Infektion betrug 79,1% (97,7%-KI [27,6; 95,9]) für HPV-31 und 76,9% (97,7%-KI [18,5; 95,6]) für HPV-45 in der ATP-Kohorte.
Die Wirksamkeit des Impfstoffes gegen eine 6 Monate persistierende Infektion betrug 23,2% (97,7% KI [-23,3; 52,5]) für HPV-31 und 67,7% (97,7% KI [35,9; 84,9]) für HPV-45 in der TVC-Kohorte.
Die Kreuzprotektionsraten sind durch das Auftreten von multiplen HPV-Infektionen beeinflusst (Bias durch Mischinfektionen).
Tabelle 12: Langzeitwirksamkeit in der Studie HPV-015 bei Frauen ≥26 Jahre, die über insgesamt 84 Monate nachverfolgt werden konnten
Auf HPV-16/18 Infektionen bezogene Endpunkte nach 84 Monaten | ||||||
|---|---|---|---|---|---|---|
Kombinierter HPV-16/18-Endpunkt | ATP-Kohortea ohne Baseline und ohne nach 6 Monaten HPV PCR positive Frauen und mit Baseline negativer HPV Serologie für HPV 16 und HPV 18 | TVC-Kohorteb inkl. Baseline HPV PCR positive und HPV Serologie positiven Frauen für HPV 16 und HPV 18 | ||||
Cervarix | Kontrolle | % Wirksamkeit (97,7%-KI) | Cervarix | Kontrolle | % Wirksamkeit (97,7%-KI) | |
n/N | n/N | n/N | n/N | |||
CIN2+ | 1/1'852 | 6/1'818 | 83,7 (-46,5-99,7) | 33/2'733 | 51/2'735 | 35,8 (-4,0-61,0) |
CIN/VIN/VaIN | 2/1'852 | 14/1'818 | 86,0 (35,3-98,7) | 38/2'733 | 72/2'735 | 47,8 (19,9-66,6) |
Auf sämtliche HPV Infektionen bezogene Endpunkte nach 84 Monaten | ||||||
|---|---|---|---|---|---|---|
Sämtliche HPV-Typen Endpunkt | TVC naïve Kohortec ohne Baseline HPV PCR positive Frauen und mit Baseline negativer HPV Serologie | TVC-Kohorteb inkl. Baseline HPV PCR positive und HPV Serologie positiven Frauen | ||||
Cervarix | Kontrolle | % Wirksamkeit (97,7%-KI) | Cervarix | Kontrolle | % Wirksamkeit (97,7%-KI) | |
n/N | n/N | n/N | n/N | |||
CIN2+ | 13/1'202 | 14/1'213 | 6,6 (-124,3-61,4) | 103/2'733 | 108/2'735 | 5,2 (-27,4-29,4) |
CIN/VIN/VaIN | 37/1'202 | 58/1'213 | 36,2 (-0,3-60,0) | 198/2'733 | 244/2'735 | 19,9 (2,0-34,7) |
ASC-US+ | 214/1'202 | 253/1'213 | 16,7 (-1,5-31,6) | 655/2'727 | 743/2'732 | 14,4 (4,2-23,5) |
Lokale Therapie im Bereich der Cervix | 12/1'202 | 18/1'213 | 32,9 (-53,5-71,9) | 88/2'733 | 110/2'735 | 20,6 (-7,8-41,7) |
Überweisungen zur Kolposkopie | 127/1'202 | 141/1'213 | 9,55 (-17,43-30,39) | 506/2'734 | 560/2'736 | 11,01 (-1,25-21,8) |
a ATP-Kohorte: umfasst Frauen, die 3 Impfdosen erhielten, im Monat 0 DNA-negativ und seronegativ und im Monat 6 DNA-negativ für den relevanten HPV-Typ (HPV-16 und/oder HPV-18) waren.
b TVC-Kohorte: umfasst alle Frauen, die mindestens eine Impfdosis erhalten haben, unabhängig vom HPV-DNA- und Serostatus zu Studienbeginn. Diese Kohorte enthält Frauen mit vorbestehenden Infektionen/Läsionen.
c TVC naïve Kohorte: umfasst alle geimpften Frauen, die mindestens eine Impfdosis erhalten haben und bei Studienbeginn eine normale Zytologie hatten, seronegativ für HPV-16 und HPV-18 und HPV DNA-negativ für alle onkogenen HPV-Typen waren.
CIN2+ = CIN2, CIN3 oder AIS
ASC-US = atypische Plattenepithelzellen unbekannter Signifikanz
VIN = intraepitheliale Neoplasie der Vulva
VaIN = intraepitheliale vaginale Neoplasie
Bei Frauen mit vorbestehenden HPV 16 bzw. 18 Infektionen konnte bei keinem einzigen Endpunkt eine Wirksamkeit gegen die in Cervarix enthaltenen HPV-Typen 16 bzw. 18 nachgewiesen werden.
In einem immunologischen Subset konnte kein sicher protektiver Schwellenwert für anti-HPV 16 und 18 Antikörper nachgewiesen werden.
Pharmakokinetik
Eine Beurteilung der pharmakokinetischen Eigenschaften ist für Impfstoffe nicht erforderlich.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische Daten
Karzinogenität, Mutagenität
Es wurden keine diesbezüglichen Untersuchungen mit Cervarix durchgeführt. Das Adjuvans MPL hat sich jedoch in den Standardmutagenitätstests als nicht mutagen erwiesen.
Reproduktionstoxizität
Tierstudien, bei denen weibliche Ratten Cervarix verabreicht erhielten, ergaben keine Hinweise auf direkte oder indirekte schädigende Wirkungen bezüglich Fruchtbarkeit, Schwangerschaft, embryonale/fötale Entwicklung, Geburtsvorgang oder postnatale Entwicklung.
Tiertoxikologie und/oder -pharmakologie
Den nicht-klinischen Daten aus den üblichen Studien zu akuter Toxizität und Toxizität nach Gabe von wiederholten Dosismengen, lokaler Verträglichkeit und kardiovaskulärer/respiratorischer Verträglichkeit sind keine Hinweise über besondere Gefährdungen für den Menschen zu entnehmen.
Sonstige Hinweise
Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf Cervarix nicht mit anderen Impfstoffen in derselben Spritze vermischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8 °C), vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahren. Nicht einfrieren!
In Stabilitätsuntersuchungen erwies sich Cervarix ausserhalb des Kühlschranks bei Temperaturen von bis zu +37 °C für die Dauer von 1 Tag und bei Temperaturen von +8 °C bis +25 °C für 3 Tage als stabil.
Hinweise für die Handhabung
Bei Lagerung kann sich ein feines weisses Sediment mit klarem, farblosem Überstand bilden. Dies ist jedoch kein Anzeichen einer Qualitätsminderung.
Vor der Verabreichung sollte der Inhalt der Spritze sowohl vor als auch nach dem Aufschütteln visuell auf das Vorhandensein von Fremdteilchen und/oder ein abnormes Erscheinungsbild untersucht werden.
Falls Hinweise auf einen der vorgenannten Punkte festgestellt werden, ist der Impfstoff zu verwerfen.
Der Impfstoff ist vor der Verabreichung gut zu schütteln.
Anleitung für die Verabreichung des Impfstoffes in einer Fertigspritze
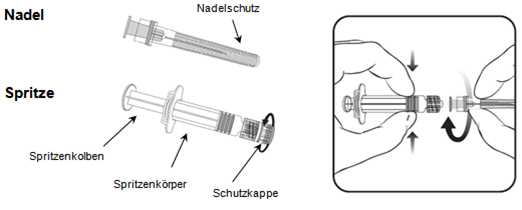
Nadel
- Halten Sie den Spritzenkörper in einer Hand (nicht am Spritzenkolben festhalten), drehen Sie die Spritzenkappe gegen den Uhrzeigersinn ab.
- Um die Nadel an der Spritze zu befestigen, drehen Sie die Nadel im Uhrzeigersinn bis zum Anschlag in die Spritze hinein (siehe Abbildung).
- Entfernen Sie den Nadelschutz, der gelegentlich etwas fest sitzen kann.
- Verabreichen Sie den Impfstoff.
Nicht verwendeter Impfstoff und Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Zulassungsnummer
57814 (Swissmedic)
Zulassungsinhaberin
GlaxoSmithKline AG, 3053 Münchenbuchsee
Herstellerin
GlaxoSmithKline Biologicals S.A., B-1330 Rixensart
Stand der Information
Dezember 2019
Composition
Principes actifs
Protéine L1 de papillomavirus humain (HPV) des types 16 et 18.
Excipients
Adjuvant:
3-O-désacyl-4'-monophosphoryl-lipide-A (MPL), hydroxyde d'aluminium hydraté.
Autres excipients:
Chlorure de sodium, dihydrogénophosphate de sodium dihydraté, eau pour préparations injectables.
Une dose de vaccin contient 1,82 mg de sodium.
Forme pharmaceutique et quantité de principe actif par unité
Suspension injectable en seringue préremplie.
Une dose de vaccin (0,5 mL) contient:
Protéine L1 recombinante1
de papillomavirus humain de type 16 (HPV-16) 20 µg
Protéine L1 recombinante1
de papillomavirus humain de type 18 (HPV-18) 20 µg
3-O-désacyl-4'-monophosphoryl-lipide-A (MPL)2 50 µg
Hydroxyde d'aluminium hydraté (Al(OH)3)2 0,5 mg Al3+
Autres excipients comme indiqué sous «Composition»
1 Protéine L1 sous forme de pseudoparticules virales non infectieuses (virus-like particles, VLP), produites par la technologie de l'ADN recombinant en utilisant un système d'expression de baculovirus et les cellules Hi-5 Rix4446 dérivées de Trichoplusia ni.
2 Adjuvant AS04 déposé de GlaxoSmithKline (voir «Propriétés/Effets»).
Cervarix est disponible sous la forme d'une suspension injectable blanchâtre trouble en seringues préremplies.
Indications/Possibilités d’emploi
Cervarix est un vaccin pour la prévention des lésions précancéreuses du col de l'utérus et du cancer du col de l'utérus dus aux papillomavirus humains (HPV) de types 16 et 18 chez les jeunes filles et les femmes à partir de l'âge de 10 ans (voir «Mises en garde et précautions» et «Propriétés/Effets»).
Cervarix doit être administré selon les recommandations officielles de vaccination.
Posologie/Mode d’emploi
Posologie usuelle
La dose recommandée est de 0,5 ml.
Le schéma de vaccination dépend de l'âge de la personne à vacciner.
A partir de l'âge de 10 ans jusqu'à 14 ans au moment de la première injection, Cervarix peut être administré selon un schéma de vaccination à 2 ou 3 doses.
A partir de l'âge de 15 ans, seul le schéma de vaccination à 3 doses est recommandé.
- Schéma à 2 doses:
Le schéma de vaccination comprend 2 vaccinations administrées aux mois 0, 6 (voir «Propriétés/Effets»). Si un schéma vaccinal flexible est nécessaire, la deuxième dose peut être aussi administrée 5 à 7 mois après la première dose.
- Schéma à 3 doses:
Le schéma de vaccination comprend 3 doses administrées aux mois 0, 1, 6.
Dans le schéma à 2 doses pour les jeunes filles âgées de 10 à 14 ans, si la deuxième dose de vaccin est administrée moins de 5 mois après la première dose, une troisième dose doit toujours être administrée.
La nécessité d'une vaccination de rappel n'a pas été établie (voir «Propriétés/Effets»).
Il est recommandé aux sujets ayant reçu une dose de Cervarix de terminer le schéma de vaccination complet avec Cervarix.
Utilisation chez les filles de moins de 10 ans:
Cervarix n'est pas recommandé chez les filles de moins de 10 ans en raison de l'insuffisance de données de tolérance et d'immunogénicité dans cette population.
Mode d'administration
Cervarix est injecté par voie intramusculaire, de préférence dans le muscle deltoïde (voir «Mises en garde et précautions» et «Interactions»).
Contre-indications
Cervarix ne doit pas être administré en cas d'hypersensibilité connue à l'un des composants du vaccin (voir «Composition»).
L'administration de Cervarix doit être différée chez les sujets souffrant d'une maladie fébrile aiguë sévère. Cependant, la présence d'une infection mineure telle qu'un rhume ne constitue généralement pas une contre-indication à la vaccination.
Mises en garde et précautions
Cervarix ne doit en aucun cas être injecté par voie intravasculaire ou intradermique. Il n'existe pas de données sur l'administration sous-cutanée.
Pour respecter les bonnes pratiques cliniques, il convient de faire précéder la vaccination d'une anamnèse (en particulier en tenant compte des vaccinations antérieures et de la survenue éventuelle d'effets indésirables) et d'effectuer un examen médical.
Comme pour tous les vaccins injectables, un traitement médical approprié et une surveillance doivent être disponibles à tout moment dans le rare cas où surviendrait une réaction anaphylactique après la vaccination.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l'injection. Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Comme les autres vaccins administrés par voie intramusculaire, Cervarix doit être administré avec précaution chez les sujets présentant une thrombocytopénie ou un trouble de la coagulation, en raison d'un risque de saignement chez ces sujets lors de l'administration intramusculaire.
Comme pour tout vaccin, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
Cervarix ne confère pas de protection contre tous les types d'HPV oncogènes. Cervarix protège uniquement contre les maladies dues aux HPV des types 16 et 18 et, dans une certaine mesure, contre celles dues à certains types d'HPV apparentés. Par conséquent, les mesures de précaution appropriées contre les maladies sexuellement transmissibles doivent continuer à être prises (voir «Propriétés/Effets»).
Cervarix n'a pas démontré d'effet thérapeutique. Le vaccin n'est donc pas indiqué pour le traitement du cancer du col de l'utérus ou des néoplasies intraépithéliales cervicales (CIN). En outre, le vaccin n'est pas destiné à prévenir la progression d'autres lésions préexistantes, associées aux HPV ou d'autres infections à HPV déjà présentes (quel que soit le type d'HPV).
La vaccination ne remplace pas le dépistage régulier du cancer du col de l'utérus. Aucun vaccin n'étant efficace à 100% et Cervarix ne protégeant pas contre tous les types d'HPV oncogènes ou contre des infections à HPV déjà existantes, le dépistage régulier du cancer du col de l'utérus reste très important et doit s'effectuer selon les recommandations nationales.
A l'exception de femmes sud-africaines atteintes d'une infection asymptomatique par le VIH, pour lesquelles on dispose d'un faible nombre de données (voir «Propriétés/Effets»), il n'existe aucune donnée sur l'utilisation de Cervarix chez les sujets présentant une altération de la réponse immunitaire, tels que les patients recevant un traitement immunosuppresseur. Comme avec d'autres vaccins, une réponse immunitaire suffisante peut ne pas être obtenue chez ces sujets.
La durée de la protection n'a pas encore été totalement établie. Le calendrier et la nécessité de dose(s) de rappel n'ont pas été étudiés. Une protection durable pendant au moins 6,4 ans après la première dose a été observée. Des études à long terme sont actuellement en cours pour déterminer la durée de la protection (voir «Propriétés/Effets»).
Il n'existe pas de données de tolérance, d'immunogénicité ou d'efficacité sur l'interchangeabilité de Cervarix avec d'autres vaccins HPV.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose de vaccin, c.-à-d. qu'il est pratiquement «sans sodium».
Interactions
Dans toutes les études cliniques, les sujets qui avaient reçu des immunoglobulines ou des produits sanguins au cours des 3 mois précédant la première dose de vaccin ont été exclus.
Utilisation concomitante avec d'autres vaccins:
Cervarix peut être administré simultanément avec un vaccin combiné de rappel diphtérique (d), tétanique (T) et coquelucheux (acellulaire, pa) avec ou sans valence poliomyélitique inactivée (IPV) (vaccins dTpa, dTpa-IPV), sans qu'il y ait d'interférence cliniquement pertinente avec la réponse en anticorps à l'un des composants contenus dans chaque vaccin. Une tendance à des titres en anticorps anti-HPV-16 et anti-HPV-18 plus faibles (GMTs) a été observée lors de l'administration de Cervarix un mois après l'administration du vaccin combiné dTpa-IPV comparativement à l'administration de Cervarix seul. La signification clinique de cette observation n'est pas connue.
Cervarix peut être administré de façon concomitante avec un vaccin combiné contre l'hépatite A (vaccin inactivé) et l'hépatite B (ADNr) (vaccin hépatite A/hépatite B) ou avec un vaccin contre l'hépatite B (ADNr).
L'administration concomitante de Cervarix et de Twinrix (vaccin hépatite A/hépatite B) n'a montré aucune interférence cliniquement significative sur la réponse en anticorps aux antigènes HPV et hépatite A. La moyenne géométrique des titres en anticorps anti-HBs était significativement plus faible après cette administration simultanée, mais la signification clinique de cette observation n'est pas connue étant donné que les taux de séroprotection sont restés inchangés. Le pourcentage de sujets ayant atteint un titre en anticorps anti-HBs ≥10 mUI/ml a été de 98,3% après vaccination concomitante de Cervarix et de Twinrix et de 100% après vaccination par Twinrix seul.
Le tableau ci-dessous montre l'influence de Cervarix sur les taux de réponse et les titres d'anticorps anti-HBs après l'administration concomitante d'Engerix-B.
Cervarix avec Engerix-B | Cervarix seul | |
|---|---|---|
Anti-HPV-16 (EL.U/ml) ELISA | 19'819,8 (N=207) | 21'712,6 (N=200) |
Anti-HPV-18 (EL.U/ml) ELISA | 8'835,1 (N=200) | 8'838,6 (N=202) |
Cervarix avec Engerix-B | Cervarix seul | |
Pourcentage des sujets avec une concentration d'anticorps anti-HBs ≥10 mUI/ml ELISA | 97,9% (n=190) | 100% (n=181) |
Pourcentage des sujets avec une concentration d'anticorps anti-HBs ≥100 mUI/ml ELISA | 88,7% (n=172) | 97,2% (n=176) |
Concentration absolue d'anticorps anti-HBs (mUI/ml) ELISA (limite inférieure et supérieure de l'intervalle de confiance à 95%) | 1'280,9 | 3'107,7 |
N = nombre de sujets avec des résultats d'anticorps avant l'administration des vaccins
n = nombre de sujets ayant atteint la valeur seuil protectrice indiquée contre l'hépatite B après l'administration des vaccins.
Si Cervarix est co-administré avec un autre vaccin injectable, les vaccins doivent toujours être administrés en des sites d'injection différents.
Utilisation avec des contraceptifs hormonaux:
Dans les études cliniques d'efficacité, environ 60% des femmes ayant reçu Cervarix prenaient des contraceptifs hormonaux. Il n'a pas été démontré que la contraception hormonale a un impact sur l'efficacité de Cervarix.
Utilisation avec des traitements immunosuppresseurs systémiques:
Comme avec d'autres vaccins, la vaccination par Cervarix chez les patients sous traitement immunosuppresseur peut induire une réponse immunitaire insuffisante.
Grossesse/Allaitement
Grossesse
L'effet de Cervarix sur le développement embryonnaire/fœtal, périnatal et postnatal et la survie a été étudié chez le rat. Ces études n'ont révélé aucune toxicité directe ou indirecte ayant une incidence sur la fertilité, la grossesse, le développement embryonnaire/fœtal, l'accouchement ou le développement postnatal.
Des données de femmes enceintes, issues d'études cliniques, de registres de grossesses et d'études épidémiologiques, ont été analysées rétrospectivement pour examiner si la vaccination par Cervarix a une influence sur le risque d'issues anormales de grossesse pour les nouveau-nés (p.ex. anomalies congénitales, avortements spontanés, etc.). Un risque accru de malformations congénitales chez les nouveau-nés n'a pas été constaté.
L'étude post-marketing (PASS) EPI-HPV-018 VS UK DB sur la grossesse a évalué entre autres les événements de la grossesse survenus lors d'une vaccination avec Cervarix dans la période comprise entre 45 jours avant jusqu'à 30 jours après les dernières menstruations, par rapport à un groupe témoin de femmes ayant reçu leur dernière dose de Cervarix au moins 120 jours à 18 mois avant la grossesse. L'analyse primaire pour une dose quelconque de Cervarix administrée dans la période comprise entre 45 jours avant et 30 jours après les dernières menstruations n'a montré aucun résultat significatif concernant les avortements spontanés, avec un HR de 1,3 (IC à 95% 0,7-2,1). Une analyse exploratoire avec 2 doses de Cervarix dans la période définie a révélé une augmentation significative du risque d'avortements spontanés en cas de vaccination par Cervarix administrée dans la période comprise entre 45 jours avant jusqu'à 30 jours après les dernières menstruations, avec un HR de 2,55 (IC à 95% 1,09-5,93).
Ces données ne sont pas suffisantes pour évaluer si la vaccination par Cervarix a un impact sur le risque d'avortement spontané ou d'autres événements.
C'est pourquoi les femmes enceintes et les femmes prévoyant une grossesse ne doivent être vaccinées qu'après la fin de la grossesse.
Une analyse des grossesses survenues après vaccination dans le programme d'études cliniques de Cervarix (au total 10'476) a révélé un risque relatif d'interruption prématurée de grossesse spontanée de 1,60 (IC à 95% 0,99-2,61) lorsque l'administration de Cervarix a eu lieu dans les 60 jours précédant le début de la grossesse (317 après Cervarix, 316 après le contrôle, données d'études contrôlées). Aucune différence en termes de malformations congénitales des nouveau-nés n'a été mise en évidence entre les groupes. Les études réalisées avec Cervarix n'étaient pas destinées en premier lieu à déterminer statistiquement l'impact de Cervarix sur les grossesses suivant la vaccination. A titre préventif, il faut renoncer à la vaccination par Cervarix en cas de grossesses prévues dans les deux mois suivants.
Allaitement
L'effet de Cervarix sur les nourrissons allaités après vaccination de leurs mères n'a pas été évalué dans des études cliniques. Cervarix ne doit être utilisé pendant l'allaitement que si les avantages potentiels l'emportent sur les risques éventuels.
Les données sérologiques chez le rat suggèrent une transmission des anticorps anti-HPV-16 et anti-HPV-18 par le lait maternel au cours de l'allaitement. Cependant, on ignore si les anticorps induits par la vaccination sont également excrétés dans le lait maternel humain.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Des études sur les effets sur l'aptitude à la conduite et à l'utilisation de machines n'ont pas été réalisées.
Effets indésirables
Dans les études cliniques chez des filles et des femmes âgées de 10 à 72 ans (parmi lesquelles 79,2% étaient âgées de 10 à 25 ans au moment de l'inclusion dans l'étude), Cervarix a été administré à 16'142 sujets tandis que 13'811 sujets ont reçu le produit de contrôle. Ces sujets ont été suivis pendant toute la durée de l'étude pour détecter les effets secondaires graves. Dans un sous-groupe prédéfini de sujets (Cervarix = 8'130 versus contrôle = 5'786), les effets indésirables ont été examinés durant les 30 jours suivant chaque injection.
L'effet indésirable le plus fréquemment observé après l'administration du vaccin était une douleur au site d'injection (pour 78% de l'ensemble des doses). La majorité de ces réactions locales était d'intensité légère à modérée et de courte durée.
Une douleur a été moins fréquemment rapportée après les 2ème et 3ème doses qu'après la 1ère dose, tandis que l'incidence de la rougeur et la tuméfaction était légèrement augmentée après les 2ème et 3ème doses. Aucune augmentation de la fréquence des effets indésirables généraux n'a été constatée lors des doses suivantes.
Les effets indésirables observés dans les études cliniques et considérés comme pouvant avoir un lien avec la vaccination ont été classés selon leur fréquence.
Les fréquences sont définies comme suit: très fréquent (≥1/10), fréquent (≥1/100 et <1/10), occasionnel (≥1/1'000 et <1/100); rare (≥1/10'000 et <1/1'000); très rare (<1/10'000).
Infections et infestations
Occasionnels: infections des voies respiratoires supérieures.
Affections hématologiques et du système lymphatique
Occasionnels: lymphadénopathie (généralisée et sévère dans des cas isolés).
Affections du système nerveux
Très fréquents: céphalées (29,5%).
Occasionnels: vertiges.
Affections gastro-intestinales
Fréquents: symptômes gastro-intestinaux, dont nausées, vomissements, diarrhée et douleurs abdominales.
Affections de la peau et du tissu sous-cutané
Fréquents: démangeaisons/prurit, éruption cutanée, urticaire.
Affections musculosquelettiques et du tissu conjonctif
Très fréquents: myalgie (28,1%).
Fréquents: arthralgie.
Troubles généraux et anomalies au site d'administration
Très fréquents: réactions locales au site d'injection, telles que douleurs (78,0%), rougeur (29,6%), gonflement (25,8%); fatigue (33,1%).
Fréquents: fièvre (≥38 °C).
Occasionnels: autres réactions au site d'injection telles qu'induration, paresthésie locale.
Le profil de tolérance observé chez les sujets avec une infection à HPV (antérieure ou en cours) était semblable à celui observé chez les sujets qui avaient un test ADN négatif pour les HPV oncogènes ou qui étaient séronégatifs pour les anticorps anti-HPV-16 et anti-HPV-18.
Une recherche de nouveaux cas de maladies auto-immunes possibles a été effectuée d'après des critères médicaux dans une base de données sur les effets indésirables (état au 30 avril 2007) regroupant toutes les études, contrôlées ou non, avec les données de femmes de 10 à 25 ans. Au total, l'incidence des nouveaux cas d'affections auto-immunes potentielles ou réelles pendant la durée de suivi de 4,3 ans (médiane de 3 ans) était comparable dans le groupe Cervarix (0,8%; 95/12'533) et dans le groupe contrôle cumulé (0,8%; 87/10'730). Les affections auto-immunes les plus fréquentes étaient une hypothyroïdie (groupe Cervarix 0,2% (n=30); groupe contrôle 0,3% (n=28)), une hyperthyroïdie (groupe Cervarix 0,1% (n=14); groupe contrôle 0,1% (n=15)), un psoriasis (groupe Cervarix 0,1% (n=8); groupe contrôle 0,1% (n=11)), des maladies inflammatoires de l'intestin (dont maladie de Crohn, colite ulcéreuse, proctite ulcéreuse) (groupe Cervarix 0,1% (n=8); groupe contrôle 0,0% (n=4)), une arthrite (groupe Cervarix 0,1% (n=9); groupe contrôle 0,0% (n=4)) et une polyarthrite rhumatoïde (groupe Cervarix 0,0% (n=4); groupe contrôle 0,0% (n=3)). Aucun lien de causalité n'a pu être établi. Il existe des données cumulées plus récentes sur les éventuels nouveaux cas de maladies auto-immunes pour un plus grand nombre de femmes exposées. Ces données actualisées ne sont pour l'instant pas appropriées pour être mentionnées dans l'information professionnelle en raison de limitations méthodologiques.
Effets indésirables après commercialisation
Etant donné que ces événements ont été notifiés de façon spontanée, il n'est pas possible d'estimer leur fréquence de manière fiable.
Affections hématologiques et du système lymphatique
Lymphadénopathie.
Affections du système immunitaire
Réactions allergiques (incluant des réactions anaphylactiques et anaphylactoïdes), œdème de Quincke.
Affections du système nerveux
Syncopes ou réactions vaso-vagales à l'injection, parfois accompagnées de mouvements tonico-cloniques (voir «Mises en garde et précautions»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Il n'existe pas de données suffisantes.
Propriétés/Effets
Code ATC
J07BM02
Mécanisme d'action
Cervarix est un vaccin recombinant non infectieux, préparé à partir de pseudoparticules virales (VLPs) hautement purifiées de la protéine principale L1 de la capside des HPV oncogènes de types 16 et 18.
Etant donné que les VLP ne contiennent pas d'ADN viral, elles ne peuvent pas infecter les cellules, ni se multiplier, ni provoquer de maladies. Les études chez l'animal ont montré que l'efficacité des vaccins VLP L1 résulte principalement d'une réponse immunitaire à médiation humorale.
Plus de 100 types d'HPV différents ont été mis en évidence chez les personnes atteintes d'infections mucocutanées. Ils provoquent principalement des lésions bénignes, telles que des verrues cutanées bénignes. Plus de 40 types d'HPV infectent les muqueuses, y compris les tissus anogénitaux (col de l'utérus, vagin, vulve, urètre, pénis, rectum et anus). La prévalence au cours de la vie d'au moins une infection anogénitale à HPV s'élève à 80% chez les femmes, ces infections sont en grande partie spontanément réversibles. Les infections anogénitales à HPV sont classées entre autres dans la catégorie des types oncogènes (high risk) et la catégorie des types à bas risque (low risk). Les HPV oncogènes sont les types 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 et 82. Les types à bas risque englobent les types 6, 11, 40, 42, 43, 44, 54, 61, 70, 72 et 81. Les types à bas risque peuvent occasionner des modifications cytologiques ou histologiques du col de l'utérus bénignes ou de faible malignité et certains types sont responsables des verrues génitales. Ils ne sont que très rarement observés chez les personnes immunocompétentes dans des lésions de plus haut grade. En plus de pouvoir également provoquer des modifications cytologiques et histologiques de faible malignité, les types d'HPV oncogènes sont à l'origine de lésions précancéreuses de haut grade et sont constatés dans des carcinomes du col utérin avérés (voir le tableau 1, distribution initiale des HPV dans l'étude HPV-008). En observant la part relative des HPV 16 et 18 dans les lésions de faible malignité, les lésions précancéreuses de plus haut grade et les carcinomes du col utérin avéré, il ressort une nette augmentation relative de la part des HPV 16 et 18 sur la totalité des lésions de haute malignité, ce qui met en évidence l'importante pathogénicité des HPV de type 16 et 18 en termes de carcinomes cervicaux avérés. Les HPV 16 et HPV 18 sont responsables d'environ 70% des cancers du col de l'utérus dans le monde. Les HPV 16, 18, 31, 33 et 45 sont les types les plus fréquemment constatés dans les cas de carcinomes du col utérin.
Un autre co-facteur indépendant et significatif dans des études cas-témoins pour l'apparition d'un carcinome épidermoïde, est le tabagisme, car celui-ci ralentit la guérison des infections à HPV très souvent asymptomatiques et spontanément réversibles (voir sous «Propriété/Effets», Impact du tabagisme sur la production d'anticorps après vaccination par Cervarix dans l'étude HPV-008).
Pharmacodynamique
Immunogénicité induite par le vaccin
Il n'a pas été défini pour les vaccins HPV de taux minimum d'anticorps protecteurs contre les CIN de grade 2 ou 3 ou contre l'infection persistante due aux types HPV contenus dans le vaccin.
La réponse en anticorps anti-HPV-16 et anti-HPV-18 a été mesurée en utilisant un test ELISA spécifique à chaque type et pour lequel une corrélation au test de neutralisation basé sur le pseudovirion a été montrée.
L'immunogénicité induite par 3 doses de Cervarix a été évaluée chez 5'303 jeunes filles et femmes âgées de 10 à 55 ans.
Dans les études cliniques, plus de 99% des sujets initialement séronégatifs ont eu une séroconversion aux HPV à la fois de types 16 et 18 un mois après la troisième dose. La moyenne géométrique des titres (GMT) en IgG induites par le vaccin était largement au-dessus des titres observés chez les femmes qui avaient été précédemment infectées et chez lesquelles l'infection à HPV était guérie (infection naturelle). Les sujets initialement séropositifs et séronégatifs ont atteint des titres similaires après vaccination.
L'étude 001/007 (incluant des femmes âgées de 15 à 25 ans au moment de la vaccination) a évalué la réponse immunitaire contre les HPV-16 et les HPV-18 jusqu'à 76 mois après la première dose.
La moyenne géométrique des titres (GMT) en IgG induites par le vaccin pour HPV-16 et HPV-18 présentait un pic au mois 7 et diminuait ensuite pour atteindre un plateau au mois 18, restant constant jusqu'à la fin du suivi (mois 76). A la fin de la période de suivi (mois 76), les GMT pour HPV-16 et HPV-18 étaient encore au moins 11 fois supérieures aux titres observés chez les femmes précédemment infectées et chez qui l'infection à HPV était guérie. Plus de 98% des femmes étaient encore séropositives pour les deux antigènes à ce moment-là.
Dans l'étude clinique 008, l'immunogénicité au mois 7 était comparable à la réponse immunitaire observée dans l'étude 001/007.
Dans le cadre de deux analyses exploratoires chez des sous-groupes, l'impact du tabagisme sur la production d'anticorps après la vaccination avec 3 doses de Cervarix a été évalué au mois 7 (1 mois après la 3ème dose). Les mesures d'anticorps anti-HPV-16 et anti-HPV-18 réalisées par technique ELISA ont été corrélées au statut tabagique ainsi qu'aux mesures de cotinine dans le sérum. Dans toutes les analyses, des faibles titres d'anticorps anti-HPV-16 et anti-HPV-18 mesurés par ELISA se sont révélés cohérents aussi bien chez les sujets ayant des antécédents de tabagisme ainsi que chez les sujets présentant un test sérologique positif pour la cotinine. On ne dispose pas de données concernant l'efficacité clinique en fonction du statut tabagique. Il n'est pas prouvé que la concentration en anticorps anti-HPV-16 et anti-HPV-18 (test ELISA) corrèle avec l'efficacité clinique des vaccins anti-HPV. Les données disponibles confirment indirectement les observations épidémiologiques qui indiquent une augmentation de l'incidence des carcinomes épidermoïdes chez les fumeuses (voir les données épidémiologiques sur HPV ci-dessus).
Dans une autre étude clinique (étude 014) chez des femmes âgées de 15 à 55 ans, la séroconversion a été obtenue chez tous les sujets vis-à-vis des types HPV-16 et -18 après la troisième dose (au mois 7). Les GMT étaient cependant moins élevées chez les femmes de plus de 25 ans. Néanmoins, tous les sujets sont restés séropositifs vis-à-vis des deux types tout au long de la phase de suivi (jusqu'au mois 18), maintenant des taux d'anticorps à des niveaux dix fois plus élevés que ceux observés après une infection naturelle.
Extrapolation de l'efficacité de Cervarix des jeunes femmes adultes aux adolescentes
Dans deux études cliniques (HPV-012 et HPV-013) réalisées chez des jeunes filles âgées de 10 à 14 ans, la séroconversion a été obtenue chez tous les sujets vis-à-vis des types HPV-16 et -18 après la troisième dose (au mois 7), avec une GMT au moins 2 fois plus élevée que celle des femmes âgées de 15 à 25 ans.
Dans une étude clinique en cours (HPV-070), réalisée chez des jeunes filles âgées de 9 à 14 ans ayant reçu un schéma de vaccination à 2 doses (0, 6 mois), une séroconversion a été obtenue chez tous les sujets vis-à-vis des types HPV 16 et 18 après la deuxième dose (au mois 7) et la réponse immunitaire (GMT ELISA) chez les jeunes filles âgées de 9 à 14 ans après 2 doses s'est avérée, un mois après la dernière dose (au mois 7), non inférieure à la réponse immunitaire après 3 doses chez les femmes âgées de 15 à 25 ans (critère d'évaluation primaire au mois 7: test statistique séquentiel pour la séroconversion et GMT ELISA).
(Critères d'évaluation secondaires: GMT ELISA avec test statistique séquentiel après les mois 12, 18, 24 et 36 ainsi que détermination supplémentaire de l'immunité cellulaire et des anticorps neutralisants après les mois 7, 12, 24 et 36).
Aucune corrélation n'est actuellement définie pour la protection contre le HPV.
Ces données d'immunogénicité permettent d'affirmer que l'efficacité de Cervarix s'applique aux jeunes filles âgées de 10 à 14 ans.
Immunogénicité chez les femmes âgées de 26 ans et plus
Dans l'étude de phase III (HPV-015) chez des femmes âgées de 26 ans et plus, au mois 48, c'est-à-dire 42 mois après la réalisation complète du schéma de vaccination, 100% des femmes initialement séronégatives pour les anticorps anti-HPV-16 et 99,4% des femmes initialement séronégatives pour les anticorps anti-HPV-18 sont devenues séropositives. Toutes les femmes initialement séropositives sont restées séropositives pour les anticorps à la fois anti-HPV-16 et anti-HPV-18. Les titres en anticorps ont atteint leur maximum au mois 7 puis ont progressivement diminué jusqu'au mois 18 pour atteindre un plateau qui restait stable jusqu'au mois 48.
Immunogénicité chez les femmes séropositives pour le VIH
Dans l'étude HPV-020 monocentrique de phase I/II réalisée en Afrique du Sud, 60 femmes sur 120 âgées de 18 à 25 ans et séropositives pour le VIH ont reçu Cervarix (critère d'inclusion: ≥200 cellules CD4 par mm3; environ 43% des participantes présentaient ≥500 cellules CD4 par mm3; 78,7% des femmes séropositives pour le VIH ont reçu toutes les doses prévues de Cervarix). 42 sur 60 participantes séropositives pour le VIH traitées par Cervarix ont été suivies sur 12 mois (ces 42 participantes n'avaient en majorité reçu aucun traitement antirétroviral). La charge initiale (constatée par dosage sérologique) due à des infections à HPV de types 16 et 18 antérieures ou préexistantes était de 52,3% pour les co-infections à HPV 16 et 18 et de 79,4% pour les infections par au moins un des deux types de HPV (16 et/ou 18). Après la troisième dose (au mois 7), les 42 participantes présentaient une séropositivité pour le HPV-16 et le HPV-18, avec persistance de la séropositivité pour les HPV 16 et 18 jusqu'au mois 12. Les GMTs (moyennes géométriques des titres d'anticorps) étaient plus faibles d'environ 44% (anti-HPV 16) et d'environ 53% (anti-HPV 18) dans le groupe séropositif pour le VIH par rapport au groupe de contrôle de 22 sujets VIH-négatifs vaccinés par Cervarix. Il n'existe pas de seuil de protection cliniquement défini pour les titres d'anticorps anti-HPV. On ignore si la vaccination par Cervarix chez les personnes séropositives pour le VIH qui présentent ≥200 cellules CD4 est cliniquement efficace pour protéger contre les lésions histologiques de haut grade CIN2+ et les cancers avérés du col utérin.
La sécurité de Cervarix chez les 48 femmes de 18 à 25 ans infectées par le VIH qui ont fait l'objet d'un suivi complet en matière de sécurité durant 12 mois n'est pas encore évaluable de façon définitive.
Efficacité clinique
Efficacité prophylactique:
Efficacité clinique chez les femmes âgées de 15 à 25 ans:
L'efficacité de Cervarix a été évaluée dans deux études cliniques randomisées, contrôlées, en double aveugle (HPV-001/007 et HPV-008) qui ont inclus un total de 19'778 femmes et jeunes filles âgées de 15 à 25 ans (au début de l'étude).
Les néoplasies intraépithéliales cervicales (CIN) de grade 2 et 3 ou les adénocarcinomes in situ du col utérin (AIS) sont les stades précurseurs potentiels d'un cancer épidermoïde ou d'un adénocarcinome du col utérin. Il a été démontré que leur diagnostic et leur ablation permettaient de prévenir un cancer. Dans le cadre du programme de développement clinique de Cervarix, les CIN2/3 et les AIS (lésions précancéreuses) ont ainsi été utilisés comme marqueurs de substitution pour la prévention du cancer du col de l'utérus. Dans les études cliniques sur l'évaluation de l'efficacité de Cervarix, le nombre de cas de CIN2/3 et d'AIS associés au HPV-16, au HPV-18 et à d'autres types d'HPV oncogènes, ont été choisis comme critères d'évaluation. Les infections persistantes sur 6 et 12 mois figuraient parmi les critères d'évaluation secondaires.
L'étude clinique HPV-001/007 n'a inclus que des femmes ayant un test d'ADN négatif dans les échantillons cervicaux pour les HPV oncogènes (HPV-16, -18, -31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66 et -68), séronégatives pour les anticorps anti-HPV-16 et anti-HPV-18 et présentant une cytologie normale. Ces caractéristiques sont typiques d'une population qui ne présente vraisemblablement aucune infection à HPV existante et n'a pas été en contact avec des types d'HPV oncogènes avant la vaccination («naïve d'HPV»). L'efficacité, l'immunogénicité et la sécurité à long terme ont été évaluées dans le suivi élargi de cette étude. A ce jour, on dispose de résultats pour une durée de 6,4 ans.
Dans l'étude clinique HPV-008, des femmes ont été incluses quels que soient leur statut cytologique et leur statut HPV (ADN ou sérologie). Cette étude reflète ainsi une population de femmes naïves d'HPV (ni infection en cours, ni exposition antérieure) et de femmes non naïves (avec des infections à HPV existantes et/ou une exposition antérieure). Avant la vaccination, des échantillons ont été prélevés pour réaliser des tests d'ADN pour les HPV oncogènes (HPV-16, -18, -31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66 et -68) et faire une recherche sérologique d'anticorps anti-HPV-16 et anti-HPV-18 (voir tableau 1).
Dans les deux études, le test d'ADN pour les types d'HPV oncogènes dans le matériel de biopsie collecté a été réalisé avec la PCR SPF10-LiPA25.
Efficacité prophylactique contre les types d'HPV 16 et 18
L'étude HPV-008 était une étude contrôlée, randomisée, en double aveugle. Au total, 18'665 femmes saines âgées de 15 à 25 ans ont reçu Cervarix ou un vaccin contre l'hépatite A comme contrôle, selon un schéma à 3 doses (0, 1, 6 mois). 54,8% des femmes étaient d'origine caucasienne, 31,5% d'origine asiatique, 7,1% d'origine hispanique, 3,7% d'origine africaine et 2,9% d'une autre origine ethnique.
Dans cette étude, les femmes ont été randomisées et vaccinées sans tenir compte de leur statut HPV (ADN) au début de l'étude. Les femmes chez lesquelles l'ADN du HPV-16 ou du HPV-18 a été mis en évidence dans les échantillons cervicaux au début de la série de vaccins, ont été considérées comme actuellement infectées par le type d'HPV correspondant. Si aucun ADN d'HPV n'a été mis en évidence par PCR, les femmes ont été considérées comme ayant un test d'ADN négatif pour HPV. En outre, des anomalies cytologiques ont été recherchées dans les échantillons cervicaux et une sérologie HPV-16 et HPV-18 a été pratiquée chez les femmes au début de l'étude. Les femmes chez lesquelles des anticorps anti-HPV ont été décelés dans le sérum, ont été caractérisées comme séropositives et considérées comme ayant déjà été exposées au HPV. Les femmes séropositives pour le HPV-16 ou le HPV-18, mais ayant un test d'ADN négatif pour le type de HPV correspondant ont été considérées comme ayant eu une infection naturelle guérie (infection «résolue»). Les femmes n'ayant pas d'anticorps anti-HPV-16 et anti-HPV-18 ont été considérées comme séronégatives. Au début de l'étude, avant vaccination, 72,9% des femmes étaient naïves c'est-à-dire sans infections HPV existantes (ADN viral négatif à la PCR, pas de mise en évidence sérologique d'anticorps anti-HPV-16 et anti-HPV-18). Le tableau 1 présente la distribution des types d'HPV détectés chez les femmes ayant un test d'ADN par PCR positif avant la vaccination.
Tableau 1: Statut initial ADN HPV (types d'HPV oncogènes, Total Vaccinated Cohort)
Cervarix N=9'319 | Groupe contrôlea N=9'325 | Total N=18'644 | |||||
|---|---|---|---|---|---|---|---|
Statut ADN | n | % | n | % | n | % | |
ADN 16 | ADN nég. | 8'779 | 94,4 | 8'819 | 94,8 | 17'598 | 94,6 |
ADN pos. | 521 | 5,6 | 483 | 5,2 | 1'004 | 5,4 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 18 | ADN nég. | 9'084 | 97,7 | 9'085 | 97,7 | 18'169 | 97,7 |
ADN pos. | 216 | 2,3 | 217 | 2,3 | 433 | 2,3 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 31 | ADN nég. | 9'073 | 97,6 | 9'112 | 98,0 | 18'185 | 97,8 |
ADN pos. | 227 | 2,4 | 190 | 2,0 | 417 | 2,2 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 33 | ADN nég. | 9'208 | 99,0 | 9'212 | 99,0 | 18'420 | 99,0 |
ADN pos. | 92 | 1,0 | 90 | 1,0 | 182 | 1,0 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 35 | ADN nég. | 9'226 | 99,2 | 9'243 | 99,4 | 18'469 | 99,3 |
ADN pos. | 74 | 0,8 | 59 | 0,6 | 133 | 0,7 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 39 | ADN nég. | 9'100 | 97,8 | 9'123 | 98,1 | 18'223 | 98,0 |
ADN pos. | 200 | 2,2 | 179 | 1,9 | 379 | 2,0 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 45 | ADN nég. | 9'227 | 99,2 | 9'214 | 99,1 | 18'441 | 99,1 |
ADN pos. | 73 | 0,8 | 88 | 0,9 | 161 | 0,9 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 51 | ADN nég. | 8'925 | 96,0 | 8'913 | 95,8 | 17'838 | 95,9 |
ADN pos. | 375 | 4,0 | 389 | 4,2 | 764 | 4,1 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 52 | ADN nég. | 8'982 | 96,6 | 8'967 | 96,4 | 17'949 | 96,5 |
ADN pos. | 318 | 3,4 | 335 | 3,6 | 653 | 3,5 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 56 | ADN nég. | 9'140 | 98,3 | 9'145 | 98,3 | 18'285 | 98,3 |
ADN pos. | 160 | 1,7 | 157 | 1,7 | 317 | 1,7 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 58 | ADN nég. | 9'177 | 98,7 | 9'200 | 98,9 | 18'377 | 98,8 |
ADN pos. | 123 | 1,3 | 102 | 1,1 | 225 | 1,2 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 59 | ADN nég. | 9'201 | 98,9 | 9'216 | 99,1 | 18'417 | 99,0 |
ADN pos. | 99 | 1,1 | 86 | 0,9 | 185 | 1,0 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 66 | ADN nég. | 9'090 | 97,7 | 9'078 | 97,6 | 18'168 | 97,7 |
ADN pos. | 210 | 2,3 | 224 | 2,4 | 434 | 2,3 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN 68 | ADN nég. | 9'134 | 98,2 | 9'142 | 98,3 | 18'276 | 98,2 |
ADN pos. | 166 | 1,8 | 160 | 1,7 | 326 | 1,8 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN HPV HRb | ADN nég. pour 14 HPV HR | 7'402 | 79,6 | 7'447 | 80,1 | 14'849 | 79,8 |
ADN pos. pour au moins 1 des 14 HPV HR | 1'898 | 20,4 | 1'855 | 19,9 | 3'753 | 20,2 | |
n.c. | 19 | - | 23 | - | 42 | - | |
ADN HPV HRWc | ADN nég. pour 12 HPV HR | 7'748 | 83,3 | 7'766 | 83,5 | 15'514 | 83,4 |
ADN pos. pour au moins 1 des 12 HPV HR | 1'552 | 16,7 | 1'536 | 16,5 | 3'088 | 16,6 | |
n.c. | 19 | - | 23 | - | 42 | - | |
n.c. = non communiqué
a vaccin contre l'hépatite A
b HPV HR = types d'HPV high risk (oncogènes): HPV-16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 et 68
c HPV HRW = tous les types d'HPV high risk (oncogènes), excepté HPV-16 et HPV-18
Les critères d'efficacité comprenaient une évaluation histologique des lésions précancéreuses et dysplasiques (CIN de grade 1, 2 ou 3) et des adénocarcinomes in situ (AIS). La durée médiane d'observation après la première dose a été d'environ 39 mois. Les critères virologiques (recherche de l'ADN d'HPV dans les échantillons cervicaux par PCR) incluaient une infection persistante à 6 ou 12 mois (définie comme au moins 2 résultats positifs pour le même type d'HPV pendant une durée minimale d'observation de 5 ou 10 mois selon le cas).
La «cohorte ATP» (According To Protocol) pour la détermination de l'efficacité contre le HPV-16 et le HPV-18 incluait toutes les femmes pour lesquelles des résultats d'efficacité étaient disponibles, qui avaient reçu les 3 doses du vaccin et qui, au début de l'étude, avaient un test d'ADN négatif pour le HPV-16 et/ou le HPV-18, étaient séronégatives pour ces deux types et qui, après 6 mois, avaient un test d'ADN négatif pour le HPV-16 et/ou le HPV-18 selon le type à analyser. Le dénombrement des cas dans la cohorte ATP a commencé au jour 1 après la troisième dose vaccinale. Cette cohorte incluait des femmes présentant une cytologie normale ou des modifications minimes (modifications cytologiques telles qu'atypie de cellules malpighiennes de signification indéterminée (ASC-US) ou lésions intra-épithéliales de bas grade (LSIL)) au début de l'étude. Les femmes présentant des anomalies cytologiques de grade élevé ont été exclues de cette cohorte.
La «cohorte TVC» (Total Vaccinated Cohort) pour les analyses d'efficacité a inclus toutes les femmes pour lesquelles des résultats d'efficacité étaient disponibles, qui avaient reçu au moins une dose du vaccin, quels que soient leur statut HPV (ADN ou sérologie) et leur cytologie au début de l'étude. Le dénombrement de cas dans la cohorte TVC a commencé au jour 1 après la première dose.
La «cohorte TVC naïve» est un sous-groupe de la Total Vaccinated Cohort, laquelle, au début de la série de vaccins, avait une cytologie normale et un test d'ADN négatif pour 14 types d'HPV oncogènes et était séronégative pour HPV-16 et HPV-18.
L'analyse finale de l'étude HPV-008 prévue dans la méthodologie de l'étude comme critère principal était liée aux événements survenus, c'est-à-dire qu'elle fut réalisée lorsqu'au moins 36 cas de lésions CIN2+ associées aux HPV16/18 furent observés dans la cohorte ATP. La durée médiane d'observation a été de 39 mois après la première dose.
L'analyse de fin d'étude a été effectuée au terme de la période d'observation de 4 ans (soit 48 mois après la première dose) et a englobé tous les sujets de la cohorte TVC (Total Vaccinated Cohort).
Cervarix s'est avéré efficace dans la prévention des lésions précancéreuses ou des AIS associés au HPV-16 et au HPV-18 (tableau 2):
Tableau 2: Efficacité de Cervarix contre les lésions histopathologiques associées au HPV-16 ou au HPV-18 chez des femmes âgées de 15 à 25 ans (cohorte ATPa, étude HPV-008)
Analyse de fin d'étude sur 48 moisc | |||
|---|---|---|---|
Critère d'évaluation HPV-16/18 | Cervarix (N=7'338) | Contrôleb (N=7'305) | % efficacité (IC à 95%) |
Nombre de casd | Nombre de cas | ||
CIN2+ | 5 | 97 | 94,9 |
CIN3+ | 2 | 24 | 91,7 |
a Femmes ayant une cytologie normale, des ASC-US ou LSIL au début de la vaccination, et ayant reçu 3 doses de vaccin. Elles étaient séronégatives et avaient un test d'ADN négatif au début de l'étude ainsi qu'un test d'ADN négatif 6 mois après pour le type d'HPV correspondant (N).
b Le groupe de contrôle a reçu un vaccin contre l'hépatite A contenant 720 UI d'antigène et 500 µg d'Al(OH)3.
c Durée médiane de suivi de 40 mois après la 3ème dose
d Y compris 4 cas de CIN2+ et 2 cas de CIN3+, dans lesquels un autre type de HPV a été mis en évidence dans la lésion en même temps que le HPV-16 ou le HPV-18
Dans l'analyse liée aux événements survenus (critère d'évaluation primaire), l'efficacité était de 92,9% (IC à 96,1%: 79,9; 98,3) contre les CIN2+ et de 80% (IC à 96,1%: 0,3; 98,1) contre les CIN3+. L'intervalle de confiance (IC) à 96,1% indiqué ici tient compte d'un ajustement statistique en raison de l'analyse intermédiaire préalable. En outre, une efficacité statistiquement significative du vaccin contre les CIN2+ associées au HPV-16 ou au HPV-18 a été démontrée.
Certaines des lésions CIN2+ et CIN3+ contenaient plusieurs types oncogènes (incluant des types d'HPV autres que ceux contenus dans le vaccin). Le tableau 3 présente la répartition des infections multiples à plusieurs types d'HPV. Les données disponibles confirment la probabilité que les infections multiples à HPV-16 et/ou à HPV-18 augmentent la fréquence et la vitesse de progression d'une infection asymptomatique vers une lésion précancéreuse histologique.
Tableau 3: Fréquence des infections par un seul type d'HPV et des co-infections par deux types de HPV ou plus dans les cas d'infection nouvelle dans chaque groupe
Nombre d'infections multiples | Groupe contrôle (hépatite A) | Cervarix | Total |
|---|---|---|---|
1 | 178 | 237 | 415 |
2 | 155 | 171 | 326 |
3 | 109 | 112 | 221 |
4 | 70 | 46 | 116 |
5 | 28 | 23 | 51 |
6 | 21 | 11 | 32 |
7 | 10 | 4 | 14 |
8 | 4 | 1 | 5 |
9 | 1 | 0 | 1 |
10 | 1 | 0 | 1 |
11 | 0 | 1 | 1 |
Total | 577 | 606 | 1'183 |
En outre, une efficacité statistiquement significative du vaccin contre les CIN2/3 ou les AIS a été démontrée séparément pour le HPV-16 et le HPV-18 au moment de l'analyse de fin d'étude après 48 mois.
Les femmes déjà infectées par un type d'HPV (HPV-16 ou HPV-18) avant la vaccination, ont été protégées contre les maladies provoquées par l'autre type d'HPV.
L'efficacité de Cervarix contre une nouvelle infection à HPV-16 et HPV-18, une infection persistante à 6 et 12 mois a également été évaluée (voir le tableau 4).
Tableau 4: Efficacité du vaccin eu égard aux critères virologiques et cytologiques associés au HPV-16 ou au HPV-18 (cohorte ATP, étude HPV-008)
Analyse de fin d'étude sur 48 mois | |||||
|---|---|---|---|---|---|
Critère HPV-16/18 | Cervarix | Groupe contrôle | % efficacité (IC à 95%) | ||
N | Nombre de cas | N | Nombre de cas | ||
Critères virologiques | |||||
Infection nouvelle | 7'337 | 280 | 7'311 | 1'276 | 79,6 |
Infection persistante (6 mois) | 7'182 | 35 | 7'137 | 588 | 94,3 |
Infection persistante (12 mois) | 7'082 | 26 | 7'038 | 354 | 92,9 |
Critères cytologiques | |||||
Modifications cytologiques (≥ ASC-US) | 7'334 | 55 | 7'305 | 575 | 90,7 |
Dans l'analyse déclenchée par les événements, l'efficacité était de 94,3% (IC à 96,1%: 91,5; 96,3) contre les infections persistantes à 6 mois, de 91,4% (IC à 96,1%: 89,4; 95,4) contre les infections persistantes à 12 mois et de 89,0% (IC à 96,1%: 84,9; 92,1) contre les modifications cytologiques (≥ ASC-US).
La réponse immunitaire après une infection naturelle ne procure pas de protection fiable contre une nouvelle infection. Chez les femmes qui, au début de la série de vaccins, étaient séropositives et présentaient un test d'ADN négatif pour HPV-16 ou HPV-18 et qui, après 6 mois (après la 3ème dose), présentaient toujours un test d'ADN négatif, Cervarix a réduit l'incidence des infections persistantes à 12 mois de 94,0% (76,7; 99,3) dans l'analyse réalisée sur 48 mois. Toutefois, le nombre de cas de CIN2/3 ou d'AIS a été trop faible pour déterminer son efficacité contre les critères histopathologiques dans ce groupe.
Etude HPV-001/007: Dans la deuxième étude contrôlée, randomisée, en double aveugle, réalisée chez 1'113 femmes âgées de 15 à 25 ans, l'efficacité de Cervarix dans la prévention des infections à HPV-16 ou à HPV-18 (nouvelles infections et infections persistantes) a été comparée à un vaccin contrôle à base d'hydroxyde d'aluminium. La population de l'étude était naïve (sans infection à HPV au moment de la vaccination et sans contact avec l'HPV-16 ou avec l'HPV-18 avant la vaccination, c.-à-d. cohorte totale). Au total, 776 femmes ont été incluses dans l'étude de suivi élargie pour évaluer l'efficacité, l'immunogénicité et l'innocuité à long terme de Cervarix. Ces femmes ont été suivies pendant une durée atteignant maintenant jusqu'à 6,4 ans.
Dans l'étude HPV-001/007, comportant une durée d'observation allant jusqu'à 6,4 ans (médiane de 5,9 ans), l'efficacité de Cervarix contre les CIN2/3 ou les AIS associés au HPV-16 ou au HPV-18 a été de 100% (IC à 98,7%: 28,4; 100) chez les femmes naïves d'HPV âgées de 15 à 25 ans. L'efficacité contre l'infection à HPV-16 ou à HPV-18 persistante à 12 mois a également été de 100% (IC à 98,7%: 74,4; 100). L'intervalle de confiance dans cette analyse finale repose sur un ajustement statistique en raison d'analyses antérieures.
Efficacité contre les types d'HPV 16 et 18, indépendamment d'infections à HPV en cours ou d'une exposition antérieure au HPV-16 ou au HPV-18
L'étude HPV-008 incluait des femmes quelque soit leur statut ADN HPV (infections actuelles) et leur statut sérologique (exposition antérieure) au début de l'étude pour les types HPV-16 ou HPV-18 contenus dans le vaccin. L'analyse d'efficacité incluait les lésions survenues chez les femmes quel que soit leur statut HPV (ADN et sérologie) ainsi que les infections à HPV déjà présentes avant la vaccination (voir tableau 1 ci-dessus) et celles acquises à partir de la 1ère dose vaccinale. Dans ce groupe incluant des femmes naïves d'HPV (sans infection actuelle et sans exposition antérieure) et des femmes non naïves d'HPV, Cervarix a été efficace dans la prévention des lésions précancéreuses ou des AIS associés au HPV-16 ou au HPV-18.
Il n'y a eu aucune preuve évidente d'une efficacité contre les lésions précancéreuses ou les AIS associés au HPV-16 ou au HPV-18 chez les femmes ayant un test d'ADN positif pour l'HPV, quel que soit leur statut sérologique au début de l'étude (tableau 5).
Tableau 5: Efficacité de Cervarix contre les maladies associées au HPV-16 ou au HPV-18 chez des femmes âgées de 15 à 25 ans, sans tenir compte d'une exposition actuelle ou antérieure à l'un des sérotypes du vaccin (étude HPV-008)
Cervarix | Groupe contrôle | % efficacité | |||
|---|---|---|---|---|---|
N | Nombre de casa | N | Nombre de casa | ||
ADN HPV-16 ou HPV-18 positif au début de l'étudec | 641 | 90 | 592 | 92 | -- |
a Cas = cas histopathologiques de CIN1/2/3 et d'AIS associés au HPV-16 et/ou au HPV-18
b L'intervalle de confiance de 96,1% indiqué dans cette analyse finale repose sur un ajustement statistique en raison d'analyses intermédiaires préalables.
c Sous-groupe de la TVC: comprend toutes les femmes vaccinées (au moins une dose) qui avaient un test d'ADN positif pour le HPV-16 et le HPV-18 au début de l'étude, quel que soit leur statut sérologique au début de la vaccination. Le dénombrement des cas a commencé au jour 1 après la première dose vaccinale.
L'efficacité du vaccin contre les lésions cervicales de haut grade associées au HPV-16/18 dans la cohorte totale vaccinée (TVC) à la fin de l'étude après 48 mois est présentée dans le tableau 6.
Tableau 6: Efficacité du vaccin contre les lésions cervicales de haut grade associées au HPV-16/18 (cohorte TVCa, étude HPV-008)
Critère HPV-16/18 | Analyse de fin d'étude après 48 moisb | ||
|---|---|---|---|
Cervarix (N=8'694) | Contrôle (N=8'708) | % efficacité (IC à 95%) | |
n | n | ||
CIN2+ | 90 | 228 | 60,7% |
CIN3+ | 51 | 94 | 45,7% |
N = nombre de femmes dans chaque groupe
n = nombre de cas
a Cohorte TVC: inclut toutes les femmes vaccinées ayant reçu au moins une dose de vaccin, quels que soient leur statut ADN HPV, leur cytologie et leur statut sérologique au début de l'étude. Cette cohorte inclut les femmes ayant des infections/lésions préexistantes.
b Durée médiane de suivi de 44 mois après la 1ère dose vaccinale
L'efficacité du vaccin contre les critères virologiques (infection nouvelle, infection persistante à 6 ou 12 mois) associés au HPV-16/18 dans la cohorte TVC à la fin de l'étude est présentée dans le tableau 7.
Tableau 7: Efficacité du vaccin contre les critères virologiques associés au HPV-16/18 (cohorte TVCa, étude HPV-008)
Critère HPV-16/18 | Analyse de fin d'étude après 48 moisb | ||
|---|---|---|---|
Cervarix | Groupe contrôle | % efficacité | |
n/N | n/N | ||
Infection nouvelle | 1'133/9'316 | 2'334/9'319 | 54,6% |
Infection persistante (6 mois) | 504/8'863 | 1'227/8'870 | 60,9% |
Infection persistante (12 mois) | 335/8'648 | 767/8'671 | 57,5% |
N = nombre de femmes dans chaque groupe
n = nombre de cas
a cohorte TVC: inclut toutes les femmes vaccinées ayant reçu au moins une dose de vaccin, quels que soient leur statut ADN HPV, leur cytologie et leur statut sérologique au début de l'étude.
b Durée médiane de suivi de 44 mois après la 1ère dose vaccinale
Impact global du vaccin sur le poids des infections à HPV de tous sous-types
Efficacité indépendamment du type d'HPV, d'infections en cours ou antérieures avec des types d'HPV contenus dans le vaccin ou d'autres types non contenus dans le vaccin
Etude HPV-008: L'effet protecteur de Cervarix contre le poids global des maladies du col de l'utérus associées au HPV résulte de la combinaison de son efficacité prophylactique contre l'HPV-16 et l'HPV-18, de la réduction des infections multiples avec l'HPV-16 et l'HPV-18 et des types d'HPV non contenus dans le vaccin et de ses effets sur la contribution de ceux-ci au poids de la maladie.
Dans la cohorte «TVC» et la cohorte «TVC naïve» qui inclut toutes les femmes vaccinées, le vaccin s'est avéré efficace contre les CIN3+, les CIN2+ et les CIN1+ (tableau 8). L'influence de Cervarix sur la réduction de la fréquence des traitements locaux du col utérin (loop electrosurgical excision procedure (LEEP), Cold Knife Conization et traitement laser) a également été démontrée dans ces deux cohortes (tableau 8).
Le dénombrement des cas dans la cohorte TVC et la cohorte TVC naïve a débuté au jour 1 après la première dose vaccinale.
La cohorte TVC naïve est un sous-groupe de la cohorte TVC qui inclut les femmes ayant une cytologie normale et qui présentaient un test ADN négatif pour 14 types d'HPV oncogènes (HPV-16, -18, -31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66, -68) au début de l'étude et étaient séronégatives pour HPV-16 et HPV-18.
Tableau 8: Efficacité du vaccin indépendamment du type d'HPV dans la lésion et du statut sérologique au début de l'étude (étude HPV-008)
Analyse de fin d'étude après 48 moisc | ||||||
|---|---|---|---|---|---|---|
Cervarix | Groupe contrôle | % efficacité | ||||
N | Nombre de cas | N | Nombre de cas | |||
CIN3+ | TVC naïvea | 5'466 | 3 | 5'452 | 44 | 93,2 |
TVCb | 8'694 | 86 | 8'708 | 158 | 45,6 | |
CIN2+ | TVC naïvea | 5'466 | 61 | 5'452 | 172 | 64,9 |
TVCb | 8'694 | 287 | 8'708 | 428 | 33,1 | |
CIN1+ | TVC naïvea | 5'466 | 174 | 5'452 | 346 | 50,3 |
TVCb | 8'694 | 579 | 8'708 | 798 | 27,7 | |
Interventions chirurgicales sur le col de l'utérus | TVC naïvea | 5'466 | 43 | 5'452 | 143 | 70,2 |
TVCb | 8'694 | 230 | 8'708 | 344 | 33,2 | |
Transferts pour une colposcopie | TVC naïvea | 5'466 | 672 | 5'452 | 933 | 29,0 (21,6; 35,8) |
TVCb | 8'694 | 1'634 | 8'708 | 1'908 | 14,8 (8,9; 20,3) | |
Modifications cytologiques (≥ ASC-US) | TVC naïvea | 5'466 | 1'133 | 5'452 | 1'437 | 23,2 (16,9; 29,0) |
TVCb | 8'694 | 2'414 | 8'708 | 2'718 | 12,2 (7,2; 16,9) | |
a «TVC naïve»: inclut toutes les femmes vaccinées (ayant reçu au moins une dose vaccinale) qui, au début de l'étude, avaient une cytologie normale, présentaient un test d'ADN négatif pour 14 types de HPV oncogènes et étaient séronégatives pour HPV-16 et HPV-18.
b «TVC»: inclut toutes les femmes vaccinées (ayant reçu au moins une dose vaccinale), quels que soient leur statut HPV (ADN et sérologie) et leur cytologie au début de l'étude.
c Durée médiane de suivi de 44 mois après la 1ère dose vaccinale
Efficacité due à une protection croisée
L'efficacité de Cervarix en termes de protection croisée vis-à-vis des critères histopathologiques et virologiques (infection persistante) a été évaluée dans l'étude HPV-008 pour les 12 types d'HPV oncogènes non contenus dans le vaccin (HPV-31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66, -68). L'étude n'était pas conçue pour évaluer l'efficacité contre les maladies dues aux différents types d'HPV. L'analyse du critère principal a été biaisée par des co-infections multiples dans les lésions CIN2+ (voir tableau 3). Contrairement aux critères histopathologiques, les critères virologiques sont moins biaisés par des infections multiples.
La protection croisée repose en partie sur la prévention efficace des infections multiples à HPV-16 et/ou HPV-18. Les infections multiples à HPV-16 et HPV-18 montrent une augmentation de la fréquence et de la vitesse de progression d'infections locales vers des lésions histologiques précancéreuses avérées.
L'efficacité du vaccin contre l'infection persistante à 6 mois et contre les CIN2/3 ou les AIS (CIN2+) associés aux types d'HPV oncogènes non contenus dans le vaccin est présentée dans le tableau 9 (cohorte ATP), incluant les infections multiples avec l'HPV-16 et l'HPV-18.
Tableau 9: Efficacité du vaccin contre les types d'HPV non contenus dans le vaccin, incluant les infections multiples avec l'HPV-16 et l'HPV-18 (cohorte ATPa, étude HPV-008)
Analyse de fin d'étude après 48 mois | ||||||
|---|---|---|---|---|---|---|
Type d'HPV | Infection persistante (6 mois) | CIN2+ | ||||
Cervarix | Contrôle | % efficacité (IC à 95%) | Cervarix | Contrôle | % efficacité (IC à 95%) | |
n | n | n | n | |||
Types apparentés au HPV-16 (espèce A9)b | ||||||
HPV-31 | 58 | 247 | 76,8% (69,0; 82,9) | 5 | 40 | 87,5% (68,3; 96,1) |
HPV-33 | 65 | 117 | 44,8% (24,6; 59,9) | 13 | 41 | 68,3% (39,7; 84,4) |
HPV-35 | 67 | 56 | -19,8% (<0; 17,2) | 3 | 8 | 62,5% (<0; 93,6) |
HPV-52 | 346 | 374 | 8,3% (<0; 21,0) | 24 | 33 | 27,6% (<0; 59,1) |
HPV-58 | 144 | 122 | -18,3% (<0; 7,7) | 15 | 21 | 28,5% (<0; 65,7) |
Types apparentés au HPV-18 (espèce A7)b | ||||||
HPV-39 | 175 | 184 | 4,8% (<0; 23,1) | 4 | 16 | 74,9% (22,3; 93,9) |
HPV-45 | 24 | 90 | 73,6% (58,1; 83,9) | 2 | 11 | 81,9% (17,0; 98,1) |
HPV-59 | 73 | 68 | -7,5% (<0; 23,8) | 1 | 5 | 80,0% (<0; 99,6) |
HPV-68 | 165 | 169 | 2,6% (<0; 21,9) | 11 | 15 | 26,8% (<0; 69,6) |
Autres typesb | ||||||
HPV-51 | 349 | 416 | 16,6% (3,6; 27,9) | 21 | 46 | 54,4% (22,0; 74,2) |
HPV-56 | 226 | 215 | -5,3% (<0; 13,1) | 7 | 13 | 46,1% (<0; 81,8) |
HPV-66 | 211 | 215 | 2,3% (<0; 19,6) | 7 | 16 | 56,4% (<0; 84,8) |
Tous les types d'HPV à haut risque (oncogènes), excepté HPV-16 et HPV-18 | ||||||
HPV HRW | 1'399 | 1'556 | 11,2% (4,5; 17,5) | 88 | 165 | 46,8% (30,7; 59,4) |
n = nombre de cas
a Cohorte ATP: inclut les femmes ayant reçu 3 doses et qui présentaient un test d'ADN négatif pour le type d'HPV analysé au mois 0 et au mois 6.
b Les types d'HPV sont classés par ordre numérique et non en fonction de leur fréquence.
Les limites de l'intervalle de confiance encadrant les valeurs de l'efficacité du vaccin ont été calculées de la manière suivante: quand la limite inférieure de l'intervalle de confiance est inférieure à 0, l'efficacité n'est pas considérée comme statistiquement significative.
L'efficacité contre les CIN3 a seulement été démontrée pour l'HPV-31 et il n'y avait aucune preuve d'efficacité contre les AIS quel que soit le type d'HPV.
Efficacité clinique chez les femmes âgées de 26 ans et plus:
L'efficacité de Cervarix a été évaluée dans un essai clinique en double aveugle, randomisé de phase III (HPV-015) qui a inclus un total de 5'778 femmes âgées de 26 ans et plus. L'étude a été réalisée dans des pays d'Amérique du Nord et d'Amérique Latine, de la région Asie Pacifique et d'Europe. Des femmes ayant des antécédents de maladie/infection due à l'HPV ont également été incluses (15%). Une analyse intermédiaire a été réalisée une fois que tous les sujets avaient effectué la visite de l'étude au 48ème mois. L'analyse finale a été réalisée à la fin de l'étude (suivi des femmes pendant 84 mois).
Les analyses principales d'efficacité ont été réalisées sur la cohorte ATP et la cohorte TVC.
Dans la cohorte TVC, les infections à HPV-16 et HPV-18 préexistantes étaient réparties avant le début de l'étude comme décrit dans le tableau 10.
Tableau 10: Statut ADN HPV et statut sérologique de base (Total Vaccinated Cohort)
Cervarix N=2'877 | Groupe contrôle N=2'870 | Total N=5'747 | |||||
|---|---|---|---|---|---|---|---|
n | % | n | % | n | % | ||
HPV-16 Statut sérologique et ADN | ADN nég et séro nég | 1'920 | 66,7 | 1'907 | 66,4 | 3'827 | 66,6 |
ADN nég et séro pos | 847 | 29,4 | 844 | 29,4 | 1'691 | 29,4 | |
ADN pos et séro nég | 32 | 1,1 | 25 | 0,9 | 57 | 1,0 | |
ADN pos et séro pos | 49 | 1,7 | 66 | 2,3 | 115 | 2,0 | |
Pas de données | 29 | - | 28 | - | 57 | - | |
HPV-18 Statut sérologique et ADN | ADN nég et séro nég | 2'019 | 70,2 | 1'999 | 69,7 | 4'018 | 69,9 |
ADN nég et séro pos | 785 | 27,3 | 783 | 27,3 | 1'568 | 27,3 | |
ADN pos et séro nég | 13 | 0,5 | 14 | 0,5 | 27 | 0,5 | |
ADN pos et séro pos | 19 | 0,7 | 16 | 0,6 | 35 | 0,6 | |
Pas de données | 41 | - | 58 | - | 99 | - | |
Groupe contrôle: a reçu un placebo contenant Al(OH)3
N = nombre de sujets
n = nombre de sujets dans une catégorie particulière
% = n/nombre de sujets avec résultats disponibles x 100
Pas de données = pas de statut sérologique ou ADN disponible au début de l'étude
Les données sur l'efficacité du vaccin sont résumées dans les deux tableaux suivants.
Tableau 11: Efficacité du vaccin contre une infection persistante à 6 mois et/ou CIN1+ associées à l'HPV-16/18 dans les cohortes ATP et TVC à 48 mois
Critère HPV-16/18 | Cohorte ATPa | Cohorte TVCb | ||||
|---|---|---|---|---|---|---|
Cervarix | Contrôle | % efficacité (IC à 97,7%) | Cervarix | Contrôle | % efficacité (IC à 97,7%) | |
n/N | n/N | n/N | n/N | |||
Infection persistante (6 mois) et/ou CIN1+ | 7/1'898 | 36/1'854 | 81,1% (52,1; 94,0) | 90/2'772 | 158/2'779 | 43,9% (23,9; 59,0) |
Infection persistante (6 mois) | 6/1'859 | 34/1'822 | 82,9% (53,8; 95,1) | 71/2'767 | 132/2'776 | 47,0% (25,4; 62,7) |
N = nombre de sujets dans chaque groupe
n = nombre de cas
CIN1+ = CIN1, CIN2, CIN3 ou AIS
a Cohorte ATP: inclut les femmes ayant reçu 3 doses de vaccin, avec un test d'ADN négatif et une sérologie négative au mois 0 et un test d'ADN négatif au mois 6 pour le type d'HPV considéré (HPV-16 et/ou HPV-18).
b Cohorte TVC: inclut les femmes ayant reçu au moins une dose de vaccin, quels que soient le test ADN et le statut sérologique au mois 0. Inclut 15% de femmes avec des antécédents de maladie/infection due à l'HPV.
L'efficacité du vaccin contre l'infection persistante à 6 mois était de 79,1% (IC à 97,7% [27,6; 95,9]) pour HPV-31 et de 76,9% (IC à 97,7% [18,5; 95,6]) pour HPV-45 dans la cohorte ATP.
L'efficacité du vaccin contre l'infection persistante à 6 mois était de 23,2% (IC à 97,7% [-23,3; 52,5]) pour HPV-31 et de 67,7% (IC à 97,7% [35,9; 84,9]) pour HPV-45 dans la population TVC.
Les taux de protection croisée sont influencés par la survenue d'infections HPV multiples (biais dû aux infections multiples).
Tableau 12: Efficacité à long terme dans l'étude HPV-015 chez les femmes ≥26 ans qui ont pu être suivies sur 84 mois au total
Critères en rapport avec les infections aux HPV-16/18 après 84 mois | ||||||
|---|---|---|---|---|---|---|
Critère combiné HPV-16/18 | Cohorte ATPa sans femmes avec PCR HPV positive à la baseline et après 6 mois et avec une sérologie HPV négative pour HPV 16 et HPV 18 à la baseline | Cohorte TVCb incl. des femmes avec une PCR HPV positive et une sérologie HPV positive pour HPV 16 et HPV 18 | ||||
Cervarix | Contrôle | % efficacité (IC à 97,7%) | Cervarix | Contrôle | % efficacité (IC à 97,7%) | |
n/N | n/N | n/N | n/N | |||
CIN2+ | 1/1'852 | 6/1'818 | 83,7 (-46,5-99,7) | 33/2'733 | 51/2'735 | 35,8 (-4,0-61,0) |
CIN/VIN/VaIN | 2/1'852 | 14/1'818 | 86,0 (35,3-98,7) | 38/2'733 | 72/2'735 | 47,8 (19,9-66,6) |
Critères en rapport avec les infections dues à l'ensemble des HPV après 84 mois | ||||||
|---|---|---|---|---|---|---|
Critère pour l'ensemble des types d'HPV | Cohorte TVC naïvec sans femmes avec une PCR HPV positive à la baseline et avec une sérologie HPV négative à la baseline | Cohorte TVCb incl. des femmes avec une PCR HPV positive et une sérologie HPV positive | ||||
Cervarix | Contrôle | % efficacité (IC à 97,7%) | Cervarix | Contrôle | % efficacité (IC à 97,7%) | |
n/N | n/N | n/N | n/N | |||
CIN2+ | 13/1'202 | 14/1'213 | 6,6 (-124,3-61,4) | 103/2'733 | 108/2'735 | 5,2 (-27,4-29,4) |
CIN/VIN/VaIN | 37/1'202 | 58/1'213 | 36,2 (-0,3-60,0) | 198/2'733 | 244/2'735 | 19,9 (2,0-34,7) |
ASC-US+ | 214/1'202 | 253/1'213 | 16,7 (-1,5-31,6) | 655/2'727 | 743/2'732 | 14,4 (4,2-23,5) |
Traitement local au niveau du col de l'utérus | 12/1'202 | 18/1'213 | 32,9 (-53,5-71,9) | 88/2'733 | 110/2'735 | 20,6 (-7,8-41,7) |
Transferts pour une colposcopie | 127/1'202 | 141/1'213 | 9,55 (-17,43-30,39) | 506/2'734 | 560/2'736 | 11,01 (-1,25-21,8) |
a Cohorte ATP: inclut les femmes ayant reçu 3 doses de vaccin, avec un test d'ADN négatif et une sérologie négative au mois 0 et un test d'ADN négatif au mois 6 pour le type d'HPV considéré (HPV-16 et/ou HPV-18).
b Cohorte TVC: inclut les femmes ayant reçu au moins une dose de vaccin, quels que soient le test ADN et le statut sérologique au début de l'étude. Cette cohorte inclut des femmes avec des infections/lésions préexistantes.
c Cohorte TVC naïve: inclut toutes les femmes vaccinées ayant reçu au moins une dose vaccinale et qui, au début de l'étude, avaient une cytologie normale, étaient séronégatives pour HPV-16 et HPV-18 et présentaient un test d'ADN négatif pour HPV-16 et HPV-18 et pour tous les types d'HPV oncogènes.
CIN2+ = CIN2, CIN3 ou AIS
ASC-US = cellules malpighiennes atypiques de signification indéterminée
VIN = néoplasie intraépithéliale vulvaire
VaIN = néoplasie intraépithéliale vaginale
Chez les femmes ayant des infections préexistantes au HPV 16 ou 18, une efficacité contre les types d'HPV 16 ou 18 contenus dans Cervarix n'a pu être démontrée pour aucun des critères de l'étude.
Dans un sous-groupe immunologique, une valeur seuil indicative d'une protection certaine n'a pas pu être mise en évidence pour les anticorps anti-HPV 16 et 18.
Pharmacocinétique
Une évaluation des propriétés pharmacocinétiques n'est pas requise pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniques
Carcinogénicité, mutagénicité
Aucune étude correspondante n'a été réalisée avec Cervarix. L'adjuvant MPL s'est toutefois avéré non mutagène dans les tests standards de mutagénicité.
Toxicité sur la reproduction
Les expérimentations animales dans lesquelles Cervarix a été administré à des rats femelles, n'ont révélé aucune toxicité directe ou indirecte ayant une incidence sur la fertilité, la grossesse, le développement embryonnaire/fœtal, la parturition ou le développement postnatal.
Toxicologie et/ou pharmacologie animale:
Les données non cliniques issues des études habituelles de toxicité aiguë et de toxicité après administration de plusieurs doses de vaccin, de tolérance locale et de tolérance cardiovasculaire/respiratoire n'ont pas révélé de risque particulier pour l'être humain.
Remarques particulières
Incompatibilités
Aucune étude de compatibilité n'ayant été effectuée, Cervarix ne doit pas être mélangé avec d'autres vaccins dans la même seringue.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants. Ne pas congeler!
Dans des études de stabilité, Cervarix s'est avéré stable hors du réfrigérateur pendant 1 jour à des températures allant jusqu'à +37 °C et pendant 3 jours à des températures comprises entre +8 °C et +25 °C.
Remarques concernant la manipulation
Durant le stockage, un léger dépôt blanc avec un surnageant limpide et incolore peut se former. Cela n'est toutefois pas un signe de détérioration.
Avant d'administrer le vaccin, il convient d'inspecter visuellement le contenu de la seringue avant et après l'avoir agitée, pour déceler la présence éventuelle de particules étrangères et/ou un aspect anormal.
En cas de constat de l'un de ces éléments, jeter le vaccin.
Le vaccin doit être bien agité avant utilisation.
Instructions pour l'administration du vaccin dans une seringue préremplie
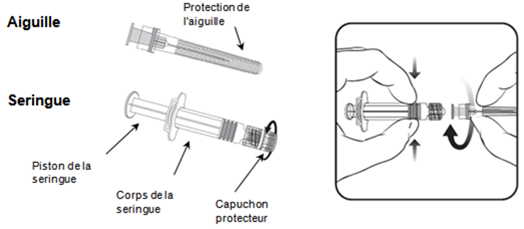
- Tenez le corps de la seringue d'une main (sans tenir le piston) et enlevez le capuchon de la seringue en le tournant dans le sens contraire des aiguilles d'une montre.
- Pour fixer l'aiguille à la seringue, vissez l'aiguille sur la seringue en la tournant dans le sens des aiguilles d'une montre jusqu'à la butée (voir l'illustration).
- Retirez la protection de l'aiguille (elle peut éventuellement résister un peu).
- Administrez le vaccin.
Les résidus de vaccin non utilisés et les déchets doivent être éliminés conformément à la réglementation nationale.
Numéro d’autorisation
57814 (Swissmedic)
Titulaire de l’autorisation
GlaxoSmithKline AG, 3053 Münchenbuchsee
Fabricant
GlaxoSmithKline Biologicals S.A., B-1330 Rixensart
Mise à jour de l’information
Décembre 2019
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French