Berirab Injektionslösung 300 Ie/2ml Fertigspritze 2ml buy online
Berirab Inj Lös 300 IE/2ml Fertspr 2 ml
-
650.95 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: CSL BEHRING AG
- Product Code: 4314505
- ATC-code J06BB05
- EAN 7680006870031
Ingredients:
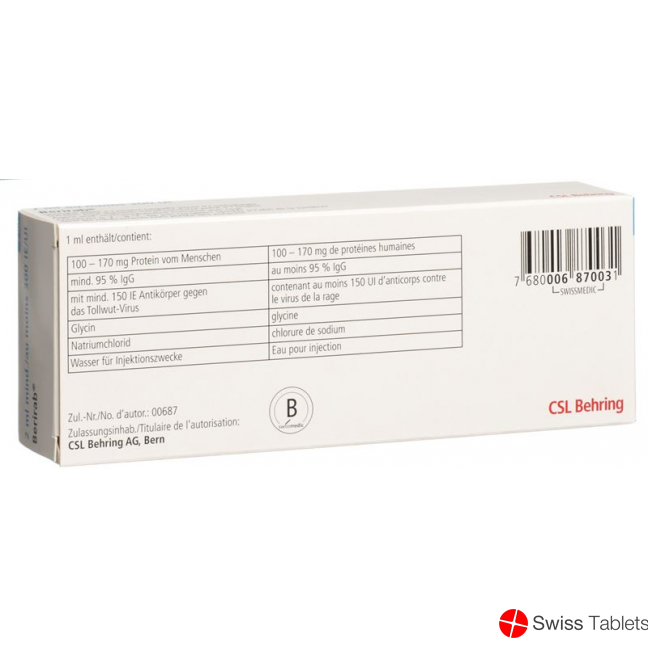
Natriumchlorid, Immunglobulin human 200-340 mg, Glycin, Tollwut-Immunglobulin vom Menschen 300 UI .

Description
AMZV
Zusammensetzung
Wirkstoff: Tollwut-Immunglobulin vom Menschen.
Hilfsstoffe: Aminoessigsäure (Glycin), Natriumchlorid, Wasser für Injektionszwecke.
Galenische Form und Wirkstoffmenge pro Einheit
Berirab ist eine klare Injektionslösung der Immunglobulinfraktion von Humanplasma zur intramuskulären Anwendung. Die Farbe kann von farblos über schwach gelb, und im Laufe der Haltbarkeitsdauer bis zu hellbraun variieren. Berirab enthält pro 1 ml Lösung 100–170 mg Humanproteine, wovon mindestens 95% Immunglobuline (Ig) sind. Diese enthalten mindestens 150 IE/ml Antikörper gegen Tollwut-Virus.
Indikationen/Anwendungsmöglichkeiten
Prophylaxe der Tollwut nach vermuteter Exposition durch
- Kratz- oder Bisswunden oder andere Verletzungen verursacht durch Tollwut-verdächtige Tiere.
- Kontamination der Schleimhäute mit infektiösem Gewebe oder Speichel von Tollwut-verdächtigen Tieren.
- Kontakt von Schleimhäuten oder frischen Hautverletzungen mit Rabies-Lebendimpfstoffen, z.B. Impfstoffködern.
Tollwut-Immunglobulin vom Menschen muss immer in Kombination mit einem Tollwut-Impfstoff verabreicht werden.
Nationale und/oder WHO-Empfehlungen zum Schutz vor Tollwut sollen beachtet werden.
Dosierung/Anwendung
Dosierung
Die Tollwut-Prophylaxe nach vermuteter Ansteckung besteht aus der Gabe einer Dosis Immunglobulin und einer vollständigen Tollwut-Impfung. Das Tollwut-Immunglobulin und die erste Dosis des Tollwut-Impfstoffs sollten so schnell wie möglich nach der Ansteckung erfolgen. Die weiteren Impfungen richten sich nach allgemeinen Richtlinien und den Angaben des Herstellers.
Einmalige Gabe von 20 IE Berirab pro kg Körpergewicht in Verbindung mit der simultanen Impfstoffgabe.
Wegen der Gefahr einer Interferenz mit der Antikörperbildung bedingt durch die Impfbehandlung darf weder die empfohlene Dosis erhöht, noch Tollwut-Immunglobulin wiederholt verabreicht werden. Dies gilt auch bei einem verspäteten Beginn der Simultanprophylaxe.
Art der Anwendung
Tollwut-Immunglobulin vom Menschen wird intramuskulär verabreicht.
Für weitere Informationen zur Art der Anwendung s. Abschnitt «Sonstige Hinweise - Hinweise für Handhabung».
Von der Gesamtmenge des Tollwut-Immunglobulins soll soviel wie möglich tief in und um die Wunde herum instilliert werden. Die verbleibende Menge wird intramuskulär, vorzugsweise in den M. vastus lateralis am liegenden Patienten verabreicht.
Bei grösseren Gesamtdosen ist eine Aufteilung auf verschiedene Körperstellen zweckmässig. Das gilt für Dosen von mehr als 2 ml bei Kindern bis zu 20 kg Körpergewicht und mehr als 5 ml bei Personen mit höherem Körpergewicht.
Bei der Simultanprophylaxe sollen das Immunglobulin und der Impfstoff an kontralateralen Körperhälften verabreicht werden.
Die Immunprophylaxe ist unverzüglich durchzuführen, auch wenn der Infektionsverdacht beim Tier noch nicht geklärt ist. Wunden sollten möglichst nicht primär genäht werden. Möglicherweise kontaminierte Körperstellen und alle Wunden sind unverzüglich und grosszügig mit Seife oder Detergenzien zu reinigen, mit Wasser gründlich zu spülen und mit 70%igem Alkohol oder einem Jodpräparat zu behandeln; dies gilt auch bei einer Kontamination mit Impfflüssigkeit eines Impfstoffköders.
Bei Vorliegen einer Gerinnungsstörung, bei der intramuskuläre Injektionen kontraindiziert sind, darf Berirab subkutan verabreicht werden. Danach soll die Injektionsstelle sorgfältig mittels Tupfer komprimiert werden.
Es wird darauf hingewiesen, dass keine Daten zur klinischen Wirksamkeit bei subkutaner Verabreichung vorliegen.
Kontraindikationen
Da eine Tollwuterkrankung ein lebensbedrohliches Risiko darstellt, gibt es keine Kontraindikationen zur Verabreichung von Berirab.
Warnhinweise und Vorsichtsmassnahmen
Es muss sichergestellt werden, dass Berirab nicht in ein Blutgefäss injiziert wird, da es sonst zur Entwicklung einer Schocksymptomatik kommen könnte.
Echte Überempfindlichkeitsreaktionen sind selten. Berirab enthält einen kleinen Anteil von IgA. Bei Patienten mit IgA-Mangel kann es zu einer IgA-Antikörperbildung kommen. Dadurch kann bei der Verabreichung von Blutprodukten mit IgA-Anteil eine anaphylaktische Reaktion auftreten.
Selten kann humanes Tollwut-Immunglobulin einen Abfall des Blutdruckes mit anaphylaktischen Reaktionen bewirken, selbst bei Patienten, die eine Behandlung mit Immunglobulin vom Menschen zuvor vertragen hatten. Therapeutische Massnahmen richten sich nach Art und Schweregrad der Nebenwirkung. Im Falle eines Schocks sind die aktuellen medizinischen Standardmassnahmen anzuwenden.
Nach Gabe von Berirab wird eine Nachbeobachtungszeit von mind. 20 Minuten empfohlen.
Besonders bei unbeabsichtigter i.v.-Gabe sind die Patienten längerfristig (etwa 1 Stunde) zu überwachen.
Wichtige Informationen über bestimmte sonstige Bestandteile von Berirab:
Dieses Arzneimittel enthält weniger als 1 mmol Natrium bei einer Normdosierung von 20 IE/kg KG. Selbst bei einem Patienten mit einem Körpergewicht von 100 kg KG ist der Grenzwert von 1 mmol unterschritten, so dass die Lösung als praktisch «natriumfrei» gilt.
Virale Sicherheit
Berirab wird aus humanem Plasma hergestellt. Standardmassnahmen zur Verhinderung von Infektionen durch den Einsatz von aus Blut oder Blutplasma hergestellten Arzneimitteln schliessen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker sowie effektive Schritte zur Inaktivierung/Eliminierung von Viren im Herstellverfahren ein. Dennoch kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Möglichkeit der Übertragung von Krankheitserregern nicht vollständig ausgeschlossen werden. Dasselbe gilt auch für bislang unbekannte Viren oder neu aufgetretene Viren und andere Pathogene.
Die getroffenen Massnahmen werden als wirksam angesehen für umhüllte Viren wie z. B. HIV, HBV und HCV, und für die nicht-umhüllten Viren HAV und Parvovirus B19.
Aufgrund klinischer Erfahrungen kann davon ausgegangen werden, dass bei der Verabreichung von Immunglobulinen keine Übertragung von Hepatitis A oder Parvovirus B19 erfolgt. Ausserdem kann der Antikörpergehalt einen wichtigen Beitrag zur Virussicherheit liefern.
Es wird empfohlen, bei jeder Verabreichung von Berirab an einen Patienten Name und Chargennummer des Präparates zu dokumentieren, um einen Zusammenhang zwischen Patient und Produktecharge herzustellen.
Interaktionen
Impfungen mit abgeschwächten Virus-Lebend-Impfstoffen
Die Gabe von Immunglobulinen kann für einen Zeitraum von bis zu drei Monaten die Wirksamkeit von Impfungen mit Virus-Lebend-Impfstoffen wie z.B. gegen Masern, Röteln, Mumps und Varizellen beeinträchtigen.
Nach Verabreichung von Berirab sollte ein Zeitraum von mindestens drei Monaten vergehen, bevor eine Impfung mit Virus-Lebend-Impfstoffen durchgeführt wird. Im Falle von Masern kann die Beeinträchtigung bis zu vier Monaten anhalten. Deshalb sollten Patienten, die Masernimpfungen erhalten, ihren Antikörperstatus prüfen lassen.
Auswirkungen auf serologische Untersuchungen sind unter Kap. «Sonstige Hinweise» beschrieben.
Schwangerschaft/Stillzeit
Kontrollierte klinische Prüfungen mit Berirab in der Schwangerschaft sind nicht durchgeführt worden. Die klinische Erfahrung mit Immunglobulinen lässt erkennen, dass keine schädigenden Wirkung auf den Verlauf der Schwangerschaft, den Fötus und das Neugeborene zu erwarten ist.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Auswirkungen auf die Fähigkeit zur aktiven Teilnahme am Strassenverkehr oder die Fähigkeit, Maschinen zu bedienen, beobachtet.
Unerwünschte Wirkungen
Die folgenden Standard-Kategorien von Häufigkeiten werden verwendet:
Sehr häufig: ≥1/10;
häufig: ≥1/100 und <1/10;
gelegentlich: ≥1/1.000 und <1/100;
selten: ≥1/10.000 und <1/1.000;
sehr selten: <1/10.000 (einschliesslich gemeldete Einzelfälle).
| MedDRA Systemorganklasse | Unerwünschte Wirkung | Häufigkeit |
|---|---|---|
| Erkrankungen des Immunsystems | Überempfindlichkeitsreaktionen, anaphylaktischer Schock | Selten |
| Erkrankungen des Nervensystems | Kopfschmerzen | Selten |
| Herzerkrankungen | Kreislaufreaktionen (insbesondere auch bei unbeabsichtigter intravasaler Gabe) | Selten |
| Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | Gelenkschmerzen, Rückenschmerzen | Selten |
| Erkrankungen des Gastrointestinaltrakts | Übelkeit, Erbrechen | Selten |
| Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Schüttelfrost, Fieber, Unwohlsein, örtliche Schmerzen, Druckempfindlichkeit oder Schwellungen an der Injektionsstelle | Selten |
Allergische Reaktionen einschliesslich Blutdruckabfall, Atemnot, Hautreaktionen, in Einzelfällen bis hin zum lebensbedrohlichen anaphylaktischen Schock, können auftreten selbst wenn Patienten keine Hypersensitivität bei früheren Immunglobulin-Gaben zeigten.
Informationen zu Infektionsrisiko siehe auch Kap. «Warnhinweise und Vorsichtsmassnahmen».
Überdosierung
Folgen von Überdosierung sind nicht bekannt.
Die Dosis soll aber keinesfalls erhöht werden (Interferenz mit der Impfstoffgabe, s. Kapitel «Dosierung/Anwendung»).
Eigenschaften/Wirkungen
ATC-Code: J06BB05
Berirab wird aus gepooltem, humanem Plasma von gesunden Spendern, welche Antikörper gegen das Tollwut-Virus haben, gewonnen. Information über die Testung der Spenden und Plasmapools sind in Kapitel «Warnhinweise und Vorsichtsmassnahmen» beschrieben.
Berirab enthält überwiegend Immunglobulin G (IgG) mit einem spezifischen hohen Gehalt an Antikörpern gegen das Tollwut-Virus.
Der Herstellungsprozess von Berirab beinhaltet verschiedene Schritte, die zur Eliminierung/Inaktivierung von Viren beitragen. Dazu gehören die Herstellung nach einer modifizierten Cohn-Fraktionierung und die Hitzebehandlung des Präparates in wässriger Lösung bei 60 °C über 10 Stunden.
Pharmakokinetik
Humanes Tollwut Immunglobulin zur intramuskulären Anwendung ist im Blutkreislauf des Patienten nach 2 bis 3 Tagen bioverfügbar. Die Halbwertszeit beträgt durchschnittlich 3 bis 4 Wochen und kann von Patient zu Patient variieren.
IgG und IgG-Komplexe werden in den Zellen des retikuloendothelialen Systems abgebaut.
Präklinische Daten
Der in Berirab enthaltene arzneilich wirksame Bestandteil Tollwut-Immunglobulin wird aus humanem Plasma gewonnen und verhält sich wie körpereigene Plasmabestandteile.
Die einmalige intramuskuläre Verabreichung von Immunglobulin an verschiedene Tierspezies gab keine Hinweise auf toxische Auswirkungen auf die Labortiere. Präklinische Studien mit wiederholten Dosisgaben (chronische Toxizität, Kanzerogenität, Reproduktionstoxizität) können in herkömmlichen Tiermodellen nicht sinnvoll durchgeführt werden, da aufgrund der Verabreichung heterologer Proteine Antikörper gebildet werden.
Sonstige Hinweise
Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf Berirab nicht mit anderen Arzneimitteln, Lösungs- oder Verdünnungsmitteln vermischt werden.
Beeinflussung diagnostischer Methoden
Bei der Beurteilung von serologischen Testergebnissen muss berücksichtigt werden, dass es nach Injektion eines Immunglobulins durch einen vorübergehenden Anstieg passiv übertragener Antikörper zu irreführenden positiven Testergebnissen kommen kann.
Die passive Übertragung von Antikörpern gegen Erythrozytenantigene, z.B. A, B und D kann einige serologische Tests auf Erythrozyten-Alloantikörper (z.B. den Coombs-Test) verfälschen.
Haltbarkeit
Berirab darf nach Ablauf des auf Packung und Behältnis angegebenen Verfalldatums nicht mehr angewendet werden. Nach Öffnung der Ampullen ist die Lösung sofort zu verwenden.
Besondere Lagerungshinweise
Berirab im Kühlschrank (2–8 °C) lagern. Nicht einfrieren! In der geschlossenen Faltschachtel aufbewahren, um den Inhalt vor Licht zu schützen. Arzneimittel für Kinder unzugänglich aufbewahren!
Hinweise für die Handhabung
Trübe Lösungen oder Lösungen mit Rückständen (Partikeln/Niederschlägen) sind nicht zu verwenden. Berirab ist gebrauchsfertig und sollte vor der Anwendung auf Körpertemperatur gebracht werden.
Abfallmaterial oder nicht verwendete Arzneimittel sind entsprechend den lokalen Anforderungen zu entsorgen.
Zulassungsnummer
00687 (Swissmedic).
Zulassungsinhaberin
CSL Behring AG, Bern.
Stand der Information
April 2014.
OEMéd
Composition
Principe actif: Immunoglobuline humaine rabique.
Excipients: acide aminoacétique (glycine), chlorure de sodium, eau pour injection.
Forme galénique et quantité de principe actif par unité
Berirab est une solution limpide dérivée de la fraction d'immunoglobulines de plasma humain, pour administration intramusculaire. La couleur peut varier de limpide, à jaune pâle et elle peut virer au brun clair durant la période de conservation. Berirab contient 100 à 170 mg de protéines humaines par ml de solution, dont au moins 95% sont des immunoglobulines (Ig). Ces dernières contiennent au moins 150 UI/ml d'anticorps contre le virus rabique.
Indications/Possibilités d’emploi
Prophylaxie de la rage après une exposition supposée à:
- des griffures ou morsures ou autres lésions causées par des animaux présumés enragés.
- une contamination des muqueuses avec du tissu contagieux ou par de la salive d'animaux présumés enragés.
- un contact des muqueuses ou de lésions de la peau récentes, avec des vaccins à virus rabiques vivants comme par ex. des appâts vaccinaux.
L'administration d'immunoglobulines humaines rabiques se fait uniquement en combinaison avec une vaccination rabique.
Les directives nationales et/ou de l'Organisation Mondiale de la Santé pour la protection contre la rage sont à observer.
Posologie/Mode d’emploi
Posologie
Les mesures de prophylaxie de la rage après une contamination supposée consistent à administrer une dose d'immunoglobulines rabiques en combinaison avec une vaccination complète antirabique.
Les injections d'immunoglobulines rabiques et de la première dose du vaccin sont à faire le plus vite possible après la contamination. Pour l'administration des doses suivantes du vaccin, suivre rigoureusement les directives générales données par le fabricant.
La posologie unique de 20 UI/kg de poids corporel de Berirab se fait simultanément et en combinaison avec la dose de vaccin antirabique.
A cause du danger d'interaction durant la formation d'anticorps lors de traitement par vaccination antirabique, il ne faut ni augmenter la dose recommandée ni répéter l'administration d'immunoglobulines rabiques.
Ceci est aussi valable lors du commencement tardif de la prophylaxie simultanée.
Mode d'emploi
L'immunoglobuline humaine rabique est administrée par voie intramusculaire.
Pour de plus amples informations sur le mode emploi, voir au chapitre «Remarques particulières» sous «Remarques concernant la manipulation».
Il est recommandé d'administrer autant que possible la dose totale d'immunoglobulines rabiques, par infiltration profonde dans et autour de la plaie.
La quantité résiduelle est administrée par voie intramusculaire au patient en position allongée, de préférence dans le M. vastus lateralis.
Pour l'application de doses élevées, il est recommandé de répartir la dose sur divers sites d'injection.
Ceci est valable pour des doses de plus de 2 ml chez les enfants ayant un poids corporel jusqu'à 20 kilos et une dose de plus de 5 ml chez les personnes plus lourdes.
Lors de la prophylaxie simultanée, l'immunoglobuline et le vaccin doivent être administrés de manière controlatérale sur des sites d'injections opposés.
Il convient de commencer la prophylaxie immunitaire immédiatement, même si le soupçon de l'infection chez l'animal n'a pas encore été confirmé.
Les plaies ne doivent si possible pas être cousues en premier lieu. Les parties du corps pouvant être éventuellement contaminées et toutes les plaies doivent être immédiatement et abondamment lavées avec du savon ou un détergent. Rincer minutieusement avec de l'eau et désinfecter avec une solution d'alcool à 70% ou une préparation à partir d'iode. Ceci est aussi valable lors de contamination avec des solutions de vaccination ou des appâts vaccinaux.
Berirab peut être administré par voie sous-cutanée lorsque les injections intramusculaires sont contre-indiquées en raison de dysfonctionnements de la coagulation.
Les sites d'injections doivent ensuite bien être comprimés à l'aide de compresse. Soulignons qu'il n'existe aucunes données concernant l'efficacité clinique lors d'application sous-cutanée.
Contre-indications
Vu que toute évolution de l'infection rabique constitue un risque majeur pouvant mettre la vie du patient en danger, il n'existe aucune contre-indication pour l'administration de Berirab.
Mises en garde et précautions
Il faut s'assurer de ne pas administrer Berirab par voie intravasculaire, car le patient peut développer des symptômes du choc.
Les véritables réactions d'hypersensibilité sont rares. Berirab contient une faible quantité en IgA. Une formation d'anticorps IgA peut survenir chez les patients présentant un déficit en IgA. L'administration de produits sanguins à faible quantité d'IgA peut provoquer dans ces cas une réaction anaphylactique.
L'immunoglobuline anti-rabique humaine peut dans de rares cas provoquer une chute de tension avec réaction anaphylactique, même si les patients ont bien toléré un traitement ultérieur aux immunoglobulines humaines.
Les mesures thérapeutiques dépendent du type et de la sévérité des effets secondaires. En cas de choc, suivre les directives médicales actuelles pour le traitement d'un choc.
Après l'administration de Berirab, une période d'observation d'au moins 20 minutes est recommandée. Les patients doivent être surveillés plus longtemps (environ 1 heure) dans les cas d'application intraveineuse involontaire.
Information importante sur certains composants de Berirab:
Cette préparation contient moins de 1 mmol de sodium pour un dosage normal de 20 UI/kg de poids corporel. Comme la valeur limite de 1 mmol n'est pas atteinte même chez un patient de plus de 100 kg de poids corporel, la solution passe pour «pauvre en sel».
Sécurité virale
Berirab est produit à partir de plasma humain. Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs, la recherche des marqueurs spécifiques d'infection sur chaque don et sur les pools de plasma et l'inclusion dans le procédé de fabrication d'étapes efficaces pour l'inactivation/l'élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou à d'autres types d'agents infectieux.
Les mesures mises en place sont considérées comme efficaces vis-à-vis des virus enveloppés tels que par ex. le VIH, le VHB et le VHC, ainsi que vis‑à‑vis des virus non enveloppés tels que par ex. le VHA et le parvovirus B19. L'expérience clinique ne rapporte aucune transmission par les immunoglobulines, du virus de l'hépatite A ni du parvovirus B19. De plus, les anticorps présents contribuent fortement à la sécurité virale.
Il est recommandé d'enregistrer le nom de la préparation et le numéro du lot lors de chaque administration de Berirab à un patient, pour établir un rapport entre le patient et le numéro du lot de la préparation.
Interactions
Vaccinations avec des vaccins à virus vivants atténués
L'efficacité des vaccins à virus vivants atténués, tels que les vaccins contre la rougeole, la rubéole, les oreillons et la varicelle, peut être réduite pendant un laps de temps pouvant aller jusqu'à 3 mois après l'administration d'immunoglobulines.
Après l'administration de Berirab, il faut attendre au moins 3 mois avant d'inoculer un vaccin à virus vivants atténués.
Dans le cas du vaccin contre la rougeole, l'efficacité peut être réduite jusqu'à 4 mois après la vaccination. Pour cette raison, un contrôle des anticorps protecteurs post-vaccinaux est nécessaire pour les patients qui reçoivent ce vaccin.
Les répercussions sur les tests sérologiques sont décrites au chapitre «Remarques particulières».
Grossesse/Allaitement
A ce jour, aucune étude clinique contrôlée n'a été menée avec Berirab pendant la grossesse. Les expériences cliniques menées avec des immunoglobulines n'ont démontré aucune influence négative sur le cours de la grossesse ou sur le fœtus ou le nouveau-né.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune restriction sur l'aptitude à la conduite ou à l'utilisation de machines n'est connue à ce jour.
Effets indésirables
Les catégories standard de fréquences suivantes sont utilisées:
Très fréquent ≥1/10
Fréquent ≥1/100 à <1/10
Peu fréquent ≥1/1000 à <1/100
Rare ≥1/10 000 à <1/1000
Très rare <1/10 000 (y compris les annonces spontanées)
| Classe de systèmes d'organes | Terme préférentiel | Fréquence |
| Troubles du système immunitaire | Réactions d'hypersensibilité, choc anaphylactique | Rare |
| Troubles du système nerveux | Céphalées | Rare |
| Troubles cardiaques | Réactions circulatoires (en particulier aussi lors d'administration involontaire intravasculaire) | Rare |
| Troubles musculosquelettiques, du tissu conjonctif et des os | Arthralgies et maux de dos | Rare |
| Troubles gastro-intestinaux | Nausées, vomissements | Rare |
| Troubles généraux et accidents liés au site d'administration | Frissons, fièvre, indisposition, douleurs locales, sensibilité à la pression, enflures au site d'injection | Rare |
Des réactions allergiques y compris chute de pression sanguine, détresse respiratoire, réactions cutanées, et dans des cas isolés, un choc anaphylactique mettant la vie en danger, peuvent survenir même lorsque les patients n'ont pas présenté d'hypersensibilité aux immunoglobulines lors d'administrations antérieures;
Pour de plus amples informations sur le risque d'infection, voir sous chapitre «Mises en garde et précautions».
Surdosage
Aucun symptôme dû à un surdosage n'est connu.
Il ne faut en aucun cas augmenter la dose (interactions avec le dosage du vaccin, voir aussi sous chap. «Posologie/Mode d'emploi»).
Propriétés/Effets
Code ATC: J06BB05
Berirab est produit à partir de pools de plasma humain provenant de donneurs sains ayant des anticorps contre le virus de la rage. L'information sur le dépistage des dons et des pools de plasma se trouve au chapitre «Mises en garde et précautions».
Berirab contient des immunoglobulines normales humaines G (principalement des anticorps IgG) avec un taux particulièrement élevé d'anticorps contre le virus de la rage.
Le procédé de fabrication de Berirab comporte plusieurs étapes qui contribuent à l'élimination/l'inactivation des virus. Parmi celles-ci il y a le fractionnement selon une méthode modifiée de Cohn et le traitement par la chaleur de la préparation en solution aqueuse pendant 10 heures à 60 °C.
Pharmacocinétique
L'immunoglobuline antirabique humaine est biodisponible dans le circuit sanguin du receveur après environ 2 à 3 jours après l'application intramusculaire. La demi-vie est de 3 à 4 semaines en moyenne et peut varier d'un patient à l'autre.
Les IgG et les complexes IgG sont dégradés dans les cellules du système réticulo-endothélial.
Données précliniques
Les immunoglobulines rabiques contenues comme principe actif dans Berirab sont extraits du plasma humain et se comportent comme un constituant physiologique du plasma humain.
Aucune toxicité sur les animaux de laboratoire n'a été démontrée lors d'administration intramusculaire unique d'immunoglobulines à diverses espèces animales.
Des études précliniques avec des doses répétées (toxicité chronique, effet carcinogène, effet toxique sur la reproduction) ne peuvent pas être réalisées de façon raisonnable dans les modèles animaux traditionnels, parce que l'apport de protéines hétérologues conduit au développement d'anticorps.
Remarques particulières
Incompatibilités
Aucune étude d'incompatibilité n'ayant été effectuée, ne pas mélanger Berirab à d'autres médicaments, solvants ou diluants.
Influence sur les méthodes diagnostiques
Lors de l'évaluation de résultats d'analyses sérologiques, on observera que les résultats des analyses peuvent être faussement positifs parce que l'injection d'une d'immunoglobuline provoque une augmentation momentanée des anticorps transférés passivement.
La transmission passive d'anticorps dirigés contre des antigènes érythrocytaires, par ex. A, B et D, peut perturber les examens sérologiques tels que le test d'alloanticorps de la surface érythrocytaire (par ex. le test de Coombs).
Stabilité
Berirab ne peut être utilisé au-delà de la date de péremption imprimée sur l'emballage et le récipient. Les ampoules ouvertes sont à utiliser immédiatement.
Remarques concernant le stockage
Berirab est à conserver au réfrigérateur (2-8 °C). Ne pas surgeler! Conserver dans le carton d'origine fermé à l'abri de la lumière. Tenir hors de portée des enfants!
Remarques concernant la manipulation
Ne pas utiliser des solutions troubles ou des solutions présentant des dépôts (particules/précipités). Berirab est prêt à l'emploi et doit être administré à température corporelle.
Le matériel à jeter ou les solutions non utilisées sont à mettre au rebut suivant les dispositions légales locales.
Numéro d’autorisation
00687 (Swissmedic).
Titulaire de l’autorisation
CSL Behring AG, Bern.
Mise à jour de l’information
Avril 2014.
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


 Deutsch
Deutsch French
French







