Buscopan Inject Injektionslösung 20mg/ml 5 Ampullen 1ml buy online
Buscopan Inject Inj Lös 20 mg/ml 5 Amp 1 ml
-
31.38 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: SANOFI-AVENTIS
- Product Code: 4071089
- ATC-code A03BB01
- EAN 7680173520258
Ingredients:

Description
AMZV
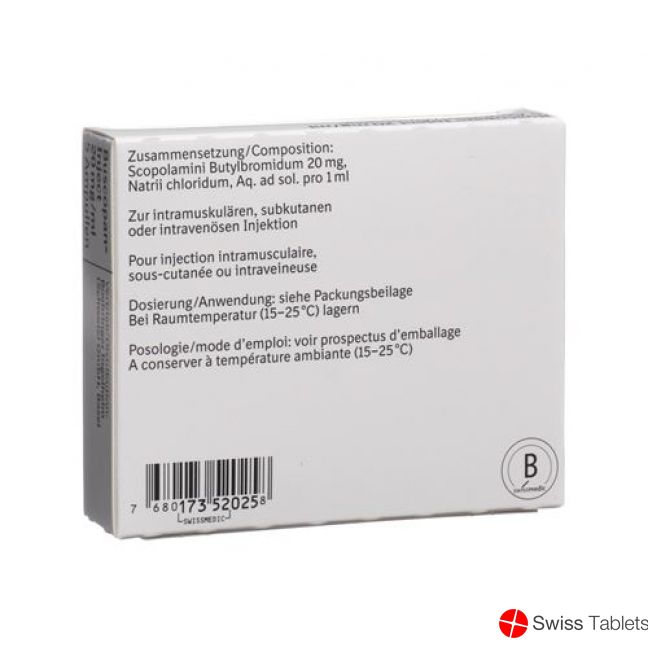
Zusammensetzung
Wirkstoff: Scopolamini butylbromidum.
Hilfsstoffe: Natrii chloridum, Aqua ad iniectabilia.
Galenische Form und Wirkstoffmenge pro Einheit
1 Ampulle (1 ml) enthält: 20 mg Scopolaminbutylbromid.
Indikationen/Anwendungsmöglichkeiten
Krämpfe und Motilitätsstörungen des Magendarmtrakts, spastische Obstipation, Krämpfe und Dyskinesien der Gallen- und Harnwege, Spasmen der muskulären Weichteile unter der Geburt, dysmenorrhoeische Beschwerden. Bei diagnostischen Massnahmen wie Röntgen und Endoskopien (i.v.).
Dosierung/Anwendung
Erwachsene und Schulkinder über 12 Jahre
Mehrmals täglich 1–2 Ampullen (20–40 mg) langsam i.v., i.m. oder s.c. Die Tagesdosis von 100 mg soll nicht überschritten werden.
Kinder über 6 Jahre
In schweren Fällen mehrmals täglich 0,3–0,6 mg/kg Körpergewicht langsam i.v., i.m. oder s.c.
Die Tagesdosis von 1,5 mg/kg Körpergewicht soll nicht überschritten werden.
Buscopan Inject sollte nicht auf einer kontinuierlichen täglichen Basis oder über einen längeren Zeitraum hinweg angewendet werden, ohne die Ursache der Beschwerden abgeklärt zu haben.
Kontraindikationen
Buscopan Inject ist kontraindiziert bei:
- Patienten mit bekannter Überempfindlichkeit gegenüber Scopolaminbutylbromid oder einem anderen Bestandteil des Arzneimittels;
- unbehandeltem Engwinkelglaukom;
- Prostatahyperplasie mit Harnretention;
- mechanischen Stenosen im Magendarmtrakt;
- paralytischem oder obstruktivem Ileus;
- Megakolon;
- Tachykardie;
- Myasthenia gravis.
Die intramuskuläre Verabreichung von Buscopan Inject Ampullen ist kontraindiziert bei Patienten, die mit Antikoagulanzien behandelt werden, da intramuskulär Hämatome auftreten können. Bei diesen Patienten kann das Präparat subkutan oder intravenös verabreicht werden.
Warnhinweise und Vorsichtsmassnahmen
Bei Patienten mit kardialen Vorerkrankungen ist bei der parenteralen Anwendung von Buscopan Vorsicht geboten. Diese Patienten sollen monitoriert werden.
Falls starke Abdominalschmerzen ungeklärter Herkunft bestehen bleiben, sich verschlechtern oder zusammen mit anderen Symptomen wie Fieber, Übelkeit, Erbrechen, Veränderungen beim Stuhlgang, schmerzhafter Spannung der Bauchdecke, erniedrigtem Blutdruck, Ohnmacht oder Blut im Stuhl auftreten, müssen geeignete diagnostische Massnahmen ergriffen werden, um die Ursache der Beschwerden gründlich abzuklären.
Angesichts des potentiellen Risikos von anticholinergen Komplikationen ist Vorsicht geboten bei Patienten, die zu Engwinkelglaukom, Obstruktionen des Darms und der ableitenden Harnwege sowie zu Tachyarrhythmie (z.B. Hyperthyreose, Herzinsuffizienz) neigen.
Die Verabreichung von Anticholinergika kann bei Patienten mit unerkanntem und deshalb unbehandeltem Engwinkelglaukom zu einer Erhöhung des Augeninnendrucks führen. Die Patienten sollten unverzüglich einen Augenarzt konsultieren, falls sie nach Injektionen von Buscopan Inject Augenschmerzen und Augenrötungen mit Beeinträchtigungen des Sehvermögens beobachten sollten.
Nach parenteraler Verabreichung von Buscopan Inject traten Fälle von Anaphylaxie mit Episoden von Schock auf. Wie bei allen Arzneimitteln, welche solche Reaktionen auslösen können, sollten die Patienten nach einer Buscopan Inject Injektion überwacht werden.
Interaktionen
Anticholinerge Wirkungen von Arzneimitteln wie tri- und tetrazyklische Antidepressiva, Antihistaminika, Antipsychotika, Chinidin, Amantadin, Disopyramid und anderen Anticholinergika (z.B. Tiotropium, Ipratropium, atropinähnliche Verbindungen) können durch Buscopan Inject verstärkt werden.
Bei gleichzeitiger Behandlung mit Dopaminantagonisten wie Metoclopramid können sich die Wirkungen der beiden Arzneimittel auf den Magendarmtrakt antagonisieren.
Die tachykardisierenden Effekte von Beta-Adrenergika können durch Buscopan Inject verstärkt werden.
Schwangerschaft/Stillzeit
Schwangerschaft
Tierexperimentelle Untersuchung ergaben keine Hinweise auf direkte oder indirekte Reproduktionstoxizität (siehe «Präklinische Daten»).
Kontrollierte Studien bei schwangeren Frauen liegen nicht vor. Die Anwendung von Buscopan Inject sollte vorsichtshalber während der Schwangerschaft vermieden werden.
Stillzeit
Es ist nicht bekannt, ob Scopolamin und seine Metaboliten in die Muttermilch übergehen. Buscopan Inject sollte deshalb während des Stillens nicht angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es sind keine entsprechenden Studien durchgeführt worden.
Die Patienten sollten darüber informiert werden, dass bei einer Behandlung mit Buscopan Inject unerwünschte Wirkungen wie Akkommodationsstörungen und Schwindelgefühle auftreten können.
Wegen möglicher Akkommodationsstörungen nach parenteraler Verabreichung von Buscopan Inject sollten die Patienten erst nach Normalisierung des Visus ein Fahrzeug lenken oder Maschinen bedienen.
Unerwünschte Wirkungen
Viele der erwähnten unerwünschten Wirkungen können den anticholinergen Eigenschaften von Buscopan zugeordnet werden. Die anticholinergen Nebenwirkungen von Buscopan sind im Allgemeinen mild und vorübergehend.
Die folgende Liste der Nebenwirkungen basiert auf der Analyse von gepoolten, Placebo-kontrollierten Studien mit insgesamt 185 Patienten unter Buscopan Inject sowie von Post-Marketing Studien:
Verwendete Häufigkeitsangaben: «häufig» (<1/10, ≥1/100), nicht bekannt* (kann nicht bestimmt werden).
Erkrankungen des Immunsystems
Häufigkeit nicht bekannt*: Überempfindlichkeitsreaktionen, anaphylaktische Reaktionen und anaphylaktischer Schock einschliesslich fatalen Folgen, Dyspnoe, Hautreaktionen wie Urticaria, Rash, Erythem, Pruritus.
Augenerkrankungen
Häufig: Akkommodationsstörungen.
Häufigkeit nicht bekannt*: Mydriasis, Erhöhung des Augeninnendrucks.
Herzerkrankungen
Häufig: Tachykardie.
Gefässerkrankungen
Häufig: Schwindel.
Häufigkeit nicht bekannt*: Blutdruckabfall, Flushing.
Erkrankungen des Gastrointestinaltrakts
Häufig: Hemmung der Speichelsekretion.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufigkeit nicht bekannt*: Dyshidrose.
Erkrankungen der Nieren und Harnwege
Häufigkeit nicht bekannt*: Harnretention.
* Diese Nebenwirkung wurde währende der Post-Marketing Phase beobachtet. Eine genaue Häufigkeitsschätzung ist nicht möglich, da die unerwünschte Wirkung in den klinischen Studien (insgesamt 185 Patienten) nicht auftrat.
Überdosierung
Symptome
Im Falle einer Überdosierung können anticholinerge Symptome wie Harnretention, Mundtrockenheit, Hautrötungen, Tachykardie, Hemmung der gastrointestinalen Motilität, vorübergehende Sehstörungen auftreten.
Behandlung
Im Bedarfsfall sollen Parasympathomimetika verabreicht werden. Bei Glaukompatienten sollte unverzüglich ophthalmologischer Rat eingeholt werden.
Kardiovaskuläre Komplikationen sind nach den üblichen therapeutischen Grundsätzen zu behandeln.
Massnahmen bei Atemlähmung: Intubation, künstliche Beatmung. Bei Harnverhalten kann evtl. eine Katheterisierung nötig werden.
Ausserdem sind je nach Bedarf geeignete unterstützende Massnahmen angezeigt.
Eigenschaften/Wirkungen
ATC-Code: A03BB01
Buscopan Inject besitzt eine krampflösende Wirkung auf die glatte Muskulatur des Magendarmtrakts, der Gallengänge und des Urogenitaltrakts.
Die periphere anticholinerge Wirkung erfolgt auf Grund einer visceralen Ganglienblockade sowie auf einer antimuskarinischen Aktivität.
Pharmakokinetik
Absorption
Nach intravenöser Verabreichung wird Scopolaminbutylbromid rasch (t½α = 4 Min., t½β = 29 Min.) in die Gewebe verteilt. Als quaternäre Ammoniumverbindung ist Scopolaminbutylbromid hochpolar und wird deshalb nach oraler oder rektaler Verabreichung nur teilweise resorbiert (8% bzw. 3%).
Distribution
Das Verteilungsvolumen (Vss) beträgt 128 l (entspricht circa 1,7 l/kg).
Wegen seiner hohen Affinität zu Muskarin- und Nikotinrezeptoren wird Scopolaminbutylbromid hauptsächlich in die Muskelzellen des Abdomens und der Pelvis sowie in die intramuralen Ganglien der Unterleibsorgane verteilt.
Die Plasmaproteinbindung (Albumin) von Scopolaminbutylbromid beträgt ca. 4%.
Tierexperimentelle Studien zeigen, dass Scopolaminbutylbromid die Blut-Hirn-Schranke nicht passiert, jedoch sind keine klinischen Daten für diesen Effekt verfügbar.
Metabolismus
Die hydrolytische Spaltung der Esterbindung ist der hauptsächliche Metabolisierungsweg.
Der Anteil an unverändertem aktivem Wirkstoff im Urin beträgt ca. 50%.
Die renal ausgeschiedenen Metaboliten werden nur in geringem Ausmass an die Muskarinrezeptoren gebunden, was einen Beitrag zur Wirkung von Scopolaminbutylbromid unwahrscheinlich macht.
Elimination
Die Halbwertszeit der terminalen Phase (t½γ) beträgt ungefähr 5 Stunden. Die Gesamt-Clearance nach i.v. Verabreichung beträgt 1,2 l/Min.
Klinische Studien mit radiomarkiertem Scopolaminbutylbromid zeigen, dass nach intravenöser Verabreichung 42% bis 61% der radioaktiven Dosis über die Nieren ausgeschieden wird und 28% bis 37% über die Fäzes.
Präklinische Daten
Scopolaminbutylbromid hat akut oral und intravenös eine geringe Toxizität.
In Toxizitätsstudien mit wiederholter oraler Dosis über 4 Wochen tolerierten Ratten 500 mg/kg gut. Bei 2000 mg/kg lähmte Scopolaminbutylbromid die gastrointestinale Funktion durch seine Wirkung auf die Ganglia parasympathica der viszeralen Zone, was zu Obstipationen führte.
Elf von 50 Ratten starben. Hämatologie und Klinische Chemie zeigten keine dosisabhängigen Veränderungen.
Ratten tolerierten 200 mg/kg über 26 Wochen, während bei 250 und 1000 mg/kg die gastrointestinalen Funktionen gehemmt wurden und Todesfälle auftraten.
Während einer Studie an Hunden mit wiederholter oraler Verabreichung (Kapseln) über 39 Wochen wurden bei Dosen bis zu 30 mg/kg keine unerwünschten Wirkungen beobachtet (NOAEL). Die Mehrheit der klinischen Befunde konnte den akuten Wirkungen von Scopolaminbutylbromid bei hohen Dosierungen (200 mg/kg) zugeordnet werden. Es wurden keine unerwünschten histopathologischen Veränderungen beobachtet.
Ampullen
Eine wiederholte intravenöse Dosis von 1 mg/kg wurde bei Ratten über 4 Wochen gut vertragen. Bei 3 mg/kg, traten sofort nach der Injektion Konvulsionen auf. Ratten, denen man 9 mg/kg appliziert hatte, starben aufgrund eines Respirationsstillstandes.
Alle Hunde, welche man intravenös über 5 Wochen mit 2× 1, 2× 3 oder 2× 9 mg/kg behandelt hat, zeigten eine dosisabhängige Mydriase. Zusätzlich wurde in der Behandlungsgruppe 2× 9 mg/kg Ataxia, Speichelfluss, erniedrigtes Körpergewicht und geringere Nahrungsaufnahme beobachtet. Die Lösungen wurden lokal gut vertragen.
Die Dosis von 10 mg/kg wurde nach wiederholter i.m. Injektion gut toleriert, jedoch waren die Muskelläsionen an der Injektionsstelle gegenüber denen der Kontroll-Ratten klar erhöht. Bei 60 und 120 mg/kg war die Mortalität hoch und die lokalen Läsionen waren dosisabhängig erhöht.
In speziellen Studien zur lokalen Verträglichkeit wurde eine wiederholte i.m. Injektion von 15 mg/kg Buscopan Inject über 28 Tage bei Hunden und Affen untersucht. Nur bei Hunden wurden kleine fokale Nekrosen an der Injektionsstelle beobachtet. Buscopan Inject wurde in den Arterien und Venen von Kaninchenohren gut vertragen.
Scopolaminbutylbromid war bei oralen Dosen von bis zu 200 mg/kg in der Nahrung von Ratten sowie bei 200 mg/kg im Futter oder 50 mg/kg s.c. bei Kaninchen weder embryotoxisch noch teratogen. Die Fertilität wurde bei einer Dosierung bis zu 200 mg/kg p.o. nicht beeinträchtigt.
Wie andere kationische Wirkstoffe interagiert Scopolaminbutylbromid in vitro mit dem Cholin-Transport-System in den Epithelzellen der menschlichen Plazenta. Ein Transfer von Scopolaminbutylbromid in das fetale Kompartiment wurde nicht nachgewiesen.
Suppositorien
Scopolaminbutylbromid Suppositorien wurden lokal gut vertragen.
Scopolaminbutylbromid weist im Ames-Test, im in vitro Genmutations-Assay in V79 Säugerzellen (HPRT Test) und im in vitro Chromosomenaberrations-Test mit humanen peripheren Lymphozyten kein mutagenes oder klastogenes Potenzial auf.
Im in vivo Knochenmarks-Micronucleus Assay an Ratten war Scopolaminbutylbromid negativ.
Es wurden keine in vivo Karzinogenitäts-Studien durchgeführt. Jedoch zeigte Scopolaminbutylbromid in zwei Studien über 26 Wochen mit oraler Verabreichung von Dosen bis zu 1000 mg/kg an Ratten kein tumorigenes Potential.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Buscopan Inject bei Raumtemperatur (15–25 °C) lagern.
Hinweise für die Handhabung
Nach Anbruch der Ampulle ist die Restlösung zu verwerfen.
Zulassungsnummer
17352 (Swissmedic).
Zulassungsinhaberin
sanofi-aventis (schweiz) ag, 1214 Vernier/GE.
Stand der Information
Mai 2018.
OEMéd
Composition
Principe actif: Scopolamini butylbromidum.
Excipients: Natrii chloridum, Aqua ad iniectabilia.
Forme galénique et quantité de principe actif par unité
1 ampoule (1 ml) contient: 20 mg de bromure de butylscopolamine.
Indications/Possibilités d’emploi
Spasmes et troubles de la motilité du tractus gastrointestinal, constipation spasmodique, spasmes et dyskinésies des voies biliaires et urinaires, spasmes de la musculature lisse pendant l'accouchement, troubles dysménorrhéiques. Lors de mesures diagnostiques comme radiographies et endoscopies (i.v.).
Posologie/Mode d’emploi
Adultes et enfants d'âge scolaire au-delà de 12 ans
1–2 ampoules (20–40 mg), plusieurs fois par jour, par voie s.c., i.m. ou i.v. lente. La dose journalière de 100 mg ne doit pas être dépassée.
Enfants au-delà de 6 ans
Dans les cas graves, 0,3–0,6 mg/kg de poids corporel, plusieurs fois par jour, par voie s.c., i.m. ou i.v. lente.
La dose journalière de 1,5 mg/kg de poids corporel ne doit pas être dépassée.
Buscopan Inject ne devrait pas être utilisé sur une base quotidienne continue ou sur une période de temps prolongée sans que la cause des douleurs n'ait été clarifiée.
Contre-indications
Buscopan Inject est contre-indiqué en cas de:
- hypersensibilité au bromure de butylscopolamine ou à un autre constituant du médicament;
- glaucome à angle fermé non traité;
- adénome prostatique avec rétention urinaire;
- sténoses mécaniques du tractus gastro-intestinal;
- iléus paralytique ou obstructif;
- mégacôlon;
- tachycardie;
- myasthénie grave.
L'administration intramusculaire de Buscopan Inject est contre-indiquée chez les patients traités par des anticoagulants en raison d'un risque d'hématomes intramusculaires. Chez ces patients, l'administration peut se faire par voie sous-cutanée ou intraveineuse.
Mises en garde et précautions
La prudence est de mise lors de l'administration parentérale de Buscopan à des patients ayant une cardiopathie préexistante. Il convient de surveiller ces patients.
Si de fortes douleurs abdominales d'origine inexpliquée persistent, s'aggravent ou surviennent conjointement avec d'autres symptômes, tels que de la fièvre, des nausées, des vomissements, des modifications des selles, une tension douloureuse au niveau de la paroi abdominale, une diminution de la tension artérielle, une perte de connaissance ou du sang dans les selles, des mesures diagnostiques appropriées doivent être prises pour élucider complètement leur cause.
Vu les risques potentiels de complications anticholinergiques, la prudence est de mise chez les patients ayant tendance aux affections suivantes: glaucome à angle fermé, obstructions de l'intestin et des voies urinaires ainsi que tachyarythmie (par ex. hyperthyroïdie, insuffisance cardiaque).
L'administration d'anticholinergiques peut conduire à une augmentation de la pression intraoculaire chez des patients ne se sachant pas atteints d'un glaucome à angle fermé, et de ce fait non traité. Les patients constatant des douleurs oculaires ou des rougeurs des yeux avec modification de l'acuité visuelle après injection de Buscopan Inject, doivent consulter sans tarder un ophtalmologue.
Des cas d'anaphylaxie avec des épisodes de choc sont apparus après administration parentérale de Buscopan Inject. Comme avec tous les médicaments pouvant déclencher de telles réactions, il convient de surveiller les patients après une injection de Buscopan Inject.
Interactions
Les effets anticholinergiques de médicaments tels que les antidépresseurs tri- et tétracycliques, les antihistaminiques, les antipsychotiques, la quinidine, l'amantadine, le disopyramide et d'autres anticholinergiques (par ex. le tiotropium, l'ipratropium, substances apparentées à l'atropine) peuvent être potentialisés par Buscopan Inject.
Un traitement concomitant avec des antagonistes de la dopamine, comme le métoclopramide, peut avoir comme résultat d'annuler les effets des 2 préparations sur le tractus gastrointestinal.
Buscopan Inject peut aussi renforcer les effets de tachycardie des bêta-adrénergiques.
Grossesse/Allaitement
Grossesse
Les études expérimentales animales n'ont montré aucun indice de toxicité directe ou indirecte sur la reproduction (voir aussi «Données précliniques»).
Des études contrôlées chez la femme enceinte ne sont pas disponibles. L'emploi de Buscopan Inject devra être évité par mesure de précaution pendant la grossesse.
Allaitement
On ignore si la scopolamine et ses métabolites passent dans le lait maternel. Buscopan Inject ne devrait donc pas être utilisé pendant l'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée.
Les patients doivent être informés que lors d'un traitement sous Buscopan Inject, des effets indésirables comme des troubles de l'accommodation et des sensations de vertige peuvent survenir.
Après administration par voie parentérale de Buscopan Inject, et du fait de la possibilité de troubles de l'accommodation, les patients ne doivent conduire un véhicule ou une machine qu'après normalisation de la vision.
Effets indésirables
Bon nombre des effets indésirables mentionnés peuvent être attribués aux propriétés anticholinergiques de Buscopan. Les effets indésirables anticholinergiques de Buscopan sont habituellement légers et transitoires.
La liste suivante des effets indésirables se base sur l'analyse d'études combinées, contrôlées contre placebo avec un total de 185 patients sous Buscopan Inject ampoules ainsi que d'études post-marketing.
Indications de fréquence utilisées: «fréquent» (<1/10, ≥1/100), fréquence non connue* (ne peut être déterminée).
Affections du système immunitaire
Fréquence non connue*: réactions d'hypersensibilité, réactions anaphylactiques et choc anaphylactique y compris d'évolution fatale, dyspnée, réactions cutanées telles qu'urticaire, rash, érythème, prurit.
Affections oculaires
Fréquent: troubles de l'accommodation.
Fréquence non connue*: mydriase, augmentation de la pression intraoculaire.
Affections cardiaques
Fréquent: tachycardie.
Affections vasculaires
Fréquent: vertiges.
Fréquence non connue*: baisse de tension, flush.
Affections gastro-intestinales
Fréquent: inhibition de la sécrétion salivaire.
Affections de la peau et du tissu sous-cutané
Fréquence non connue*: dyshidrose.
Affections du rein et des voies urinaires
Fréquence non connue*: rétention urinaire.
* Cet effet indésirable a été observé pendant la phase de post-marketing. Une estimation précise de la fréquence n'est pas possible, étant donné que cet effet indésirable n'est pas apparu au cours des études cliniques (total de 185 patients).
Surdosage
Symptômes
Dans le cas d'un surdosage, les symptômes anticholinergiques suivants peuvent apparaître: rétention urinaire, sécheresse de la bouche, rougeurs cutanées, tachycardie, blocage de la motilité gastrointestinale et troubles passagers de la vision.
Traitement
Si nécessaire, il faut administrer des parasympathomimétiques. Chez les patients atteints de glaucome, il convient de consulter un médecin ophtalmologiste immédiatement.
Des complications cardiovasculaires sont à traiter d'après les méthodes thérapeutiques usuelles.
Mesures lors de paralysie respiratoire: intubation, respiration artificielle. Lors de rétention urinaire, la pose d'un cathéter peut s'avérer nécessaire.
De plus des mesures de soutien sont à appliquer selon le cas.
Propriétés/Effets
Code ATC: A03BB01
Buscopan Inject exerce une activité spasmolytique sur les muscles lisses du tube digestif, des voies biliaires et des voies urogénitales.
L'effet périphérique anticholinergique se base sur un blocage ganglionnaire viscéral ainsi que sur une activité antimuscarinique.
Pharmacocinétique
Absorption
Après administration intraveineuse, le bromure de butylscopolamine est rapidement distribué dans les tissus (t½α = 4 min; t½β = 29 min). Le bromure de butylscopolamine, en tant que dérivé d'ammonium quaternaire, est très polaire et n'est de ce fait que partiellement résorbé après administration orale ou rectale (8% et 3%).
Distribution
Le volume de distribution (Vss) est de 128 l (correspond à environ 1,7 l/kg).
En raison de son affinité élevée pour les récepteurs muscariniques et nicotiniques, le bromure de butylscopolamine est distribué principalement dans les cellules musculaires de l'abdomen et du pelvis, ainsi que dans les ganglions intramuraux des organes du bas-ventre.
La liaison aux protéines plasmatiques (albumine) du bromure de butylscopolamine est d'environ 4%.
Des expérimentations animales ont montré que le bromure de butylscopolamine ne franchissait pas la barrière hémato-encéphalique, mais aucune donnée clinique n'est disponible pour cet effet.
Métabolisme
L'hydrolyse de la liaison ester est la principale voie de métabolisation.
La proportion de principe actif non modifié retrouvé dans l'urine est d'environ 50%.
Les métabolites excrétés par voie rénale ne se fixent que faiblement aux récepteurs muscariniques, ce qui rend improbable leur contribution à l'effet du bromure de butylscopolamine.
Elimination
La demi-vie de la phase terminale (t½γ) est d'environ 5 heures. La clearance totale après administration i.v. est de 1,2 l/min.
Des études cliniques réalisées avec du bromure de butylscopolamine radiomarqué ont montré qu'après une administration par voie intraveineuse, 42% à 61% de la dose radioactive étaient excrétés par les reins et 28% à 37% par les selles.
Données précliniques
Le bromure de butylscopolamine présente une faible toxicité aiguë par voie orale et intraveineuse.
Dans les études de toxicité avec des doses orales répétées pendant plus de 4 semaines, les rats ont bien toléré des doses de 500 mg/kg. Aux doses de 2000 mg/kg, par son activité sur les ganglions parasympathiques de la zone viscérale, le bromure de butylscopolamine a paralysé la fonction gastrointestinale entraînant ainsi de la constipation.
Onze rats sur 50 sont décédés. L'hématologie et la chimie clinique n'ont montré aucune modification dose-dépendante.
Des rats ont toléré des doses de 200 mg/kg pendant plus de 26 semaines, tandis qu'avec des doses de 250 et 1000 mg/kg, les fonctions gastrointestinales étaient inhibées et des cas de décès sont apparus.
Lors d'une étude réalisée sur des chiens qui ont été soumis à une administration orale répétée (gélules) pendant 39 semaines, aucun effet indésirable n'a été observé à des doses allant jusqu'à 30 mg/kg (NOAEL). La majorité des résultats cliniques a pu être attribuée aux effets aigus du bromure de butylscopolamine à des posologies élevées (200 mg/kg). Aucune modification histopathologique indésirable n'a été notée.
Ampoules
Une dose intraveineuse répétée de 1 mg/kg pendant 4 semaines, a été bien supportée chez les rats. Aux doses de 3 mg/kg, des convulsions sont apparues immédiatement après l'injection. Les rats auxquels des doses de 9 mg/kg ont été administrées sont morts de paralysie respiratoire.
Tous les chiens traités par voie intraveineuse durant 5 semaines avec 2× 1, 2× 3 ou 2× 9 mg/kg ont présenté une mydriase dose-dépendante. De plus, dans le groupe 2× 9 mg/kg des cas d'ataxie, de salivation, de perte de poids corporel et de diminution de la prise de nourriture ont été observés. Les solutions ont été localement bien supportées.
La dose de 10 mg/kg a été bien tolérée après injection i.m. répétée, cependant les lésions musculaires au point d'injection étaient nettement augmentées par rapport à celles des rats de contrôle. Aux doses de 60 et 120 mg/kg, la mortalité était élevée et les lésions locales étaient augmentées de manière dose-dépendante.
Dans des études spéciales relatives à la tolérance locale, une injection i.m. répétée de 15 mg/kg de Buscopan Inject pendant 28 jours a été étudiée chez le chien et le singe. De petites nécroses focales au point d'injection ont été observées uniquement chez le chien. Buscopan Inject a été bien toléré au niveau des artères et des veines des oreilles de lapin.
Le bromure de butylscopolamine n'était ni embryotoxique ni tératogène avec des doses orales jusqu'à 200 mg/kg dans l'alimentation des rats et 200 mg/kg p.o. ou 50 mg/kg en s.c. chez le lapin. La fertilité n'était pas influencée par des doses allant jusqu'à 200 mg/kg p.o.
À l'instar d'autres principes actifs cationiques, le bromure de butylscopolamine interagit, in vitro, avec le système de transport de la choline dans les cellules épithéliales du placenta humain. Un transfert du bromure de butylscopolamine dans le compartiment fœtal n'a pas été démontré.
Suppositoires
Les suppositoires de bromure de butylscopolamine étaient localement bien tolérés.
Le bromure de butylscopolamine n'a pas présenté de potentiel mutagène ni clastogène dans le test d'Ames, dans l'essai in vitro de mutation génétique dans les cellules V79 de mammifères (test HPRT) et dans le test in vitro d'aberration chromosomique avec des lymphocytes périphériques humains.
Le bromure de butylscopolamine s'est avéré négatif au test in vivo du micronoyau sur la moelle osseuse pratiqué sur des rats.
Des études in vivo de cancérogénicité n'ont pas été réalisées. Cependant, le bromure de butylscopolamine n'a pas montré de potentiel tumorigène dans deux études réalisées sur 26 semaines, avec administration par voie orale de doses allant jusqu'à 1'000 mg/kg à des rats.
Remarques particulières
Stabilité
Le médicament ne doit être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Conserver Buscopan Inject à température ambiante (15–25 °C).
Remarques concernant la manipulation
Le reste de solution des ampoules entamées est à jeter.
Numéro d’autorisation
17352 (Swissmedic).
Titulaire de l’autorisation
sanofi-aventis (suisse) sa, 1214 Vernier/GE.
Mise à jour de l’information
Mai 2018.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.




 Deutsch
Deutsch French
French