Pentavac Trockensub+susp+nadeln Fertigspritzen 10 Stück buy online
Pentavac Trockensubstanz+Suspension+Nadeln Fertspr 10 Stk
-
693.77 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: SANOFI-AVENTIS
- Product Code: 3940382
- ATC-code J07CA06
- EAN 7680006130029
Ingredients:
Formaldehyd 10 mcg, Neomycin, Tetanus-Adsorbat-Impfstoff , Diphtherie-Adsorbat-Impfstoff , Poliomyelitis-Impfstoff inaktiviert, trivalent , Saccharose 42.5 mg, Streptomycin, Trometamol, Phenoxyethanol 2.5 mcl, Aluminium, Diphtherie-Toxoid min. 30 UI, Polymyxin-B-sulfat, Tetanus-Toxoid min. 40 UI, Poliomyelitisviren Typ 1 inaktiviert (Mahoney) 40 U , Wasser für Injektionszwecke 0.5 ml, Pertussis Toxoid 25 mcg, Hämagglutinin, filamentöses (B. pertussis) 25 mcg, Pertussis acellulär Adsorbat Impfstoff , Haemophilus influenzae b Polysaccharide (PRP) 10 mcg, Diphtherie-Tetanus-azellulärer Pertussis-inaktivierter Poliomyelitis-Adsorbatimpfstoff und Hib-Konjugatimpfstoff (DTPa-I, Poliomyelitisviren Typ 2 inaktiviert (MEF-1) 8 U, Poliomyelitisviren Typ 3 inaktiviert (Saukett) 32 U, Haemophilus influenzae B-Saccharid-T-Konjugat-Impfstoff, Medium 199, Aluminiumhydroxid zur Adsorption, wasserhaltiges (Ph.Eur.).

Description
AMZV
Zusammensetzung
Wirkstoffe: 1 Impfdosis besteht aus Lyophilisat, rekonstituiert mit 0,5 ml Suspension.
0,5 ml rekonstituierte Impfstoffsuspension enthält:
Diphtherietoxoid | mind. 201 I.E.* |
Tetanustoxoid | mind. 401 I.E.* |
Bordetella pertussis Antigene: | |
Gereinigtes Pertussistoxoid | 25 µg |
Gereinigtes filamentöses Hämagglutinin | 25 µg |
Inaktivierte Polioviren: | |
Typ 1 | 40 D.E.** |
Typ 2 | 8 D.E.** |
Typ 3 | 32 D.E.** |
Haemophilus influenzae Typ b-Polysaccharide (Polyribosylribitolphosphat) konjugiert an Tetanustoxoid (Hib-(PRP-T) | 10 µg |
1 als untere Konfidenzgrenze (p = 0,95)
Wirtssystem für den inaktivierten Poliomyelitis-Impfstoff: Vero-Zellen.
* Internationale Einheiten.
** D-Antigen-Einheiten gemäss WHO oder entsprechende D-Antigenmenge, bestimmt durch eine geeignete immunchemische Methode.
Hilfsstoffe: DTPa-IPV-Suspension: 0,30 mg Aluminiumhydroxid als Adjuvans, 10 µg Formaldehyd, 2,5 µl Phenoxyethanol und 2,5 µl Ethanol. Spuren von Medium 199, Glutaraldehyd, Neomycin, Streptomycin und Polymyxin B.
HIB-Lyophilisat: 0,6 mg Trometamol und 42,5 mg Saccharose.
Galenische Form und Wirkstoffmenge pro Einheit
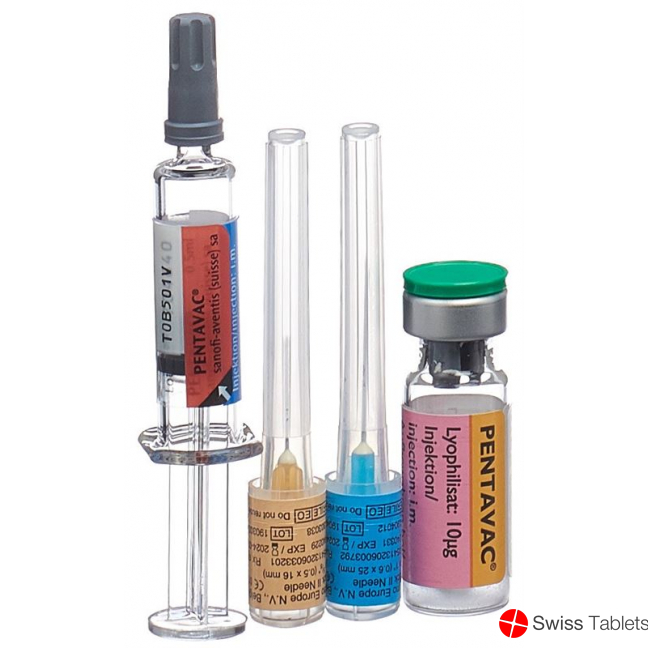
Fertigspritze mit Suspension (0,5 ml) und Fläschchen mit Lyophilisat.
Indikationen/Anwendungsmöglichkeiten
Pentavac wird zur Grundimmunisierung bei Kleinkindern ab dem vollendeten 2. Lebensmonat (bis zum 2. Geburtstag) angewendet, sowie zur Auffrischimpfung (4. Dosis) bei Kindern, welche bereits 3 Impfdosen (= Grundimmunisierung) erhalten haben.
Pentavac sollte entsprechend den offiziellen Impfempfehlungen angewendet werden.
Dosierung/Anwendung
Übliche Dosierung
Es gelten die folgenden Empfehlungen, wobei jeweils eine Impfdosis von 0,5 ml verabreicht wird:
Grundimmunisierung
1. Dosis im Alter von 2 Monaten.
2. Dosis im Alter von 4 Monaten.
3. Dosis im Alter von 6 Monaten.
Auffrischimpfung
Eine 4. Dosis wird im 2. Lebensjahr bei Kindern ab dem vollendeten 12. bis zum vollendeten 24. Lebensmonat, vorzugsweise im Alter zwischen 15 und 18 Monaten verabreicht.
Die Auffrischimpfung kann mit Pentavac erfolgen, auch wenn die Grundimmunisierung zuvor mit anderen Einzel- oder Kombinations-Impfstoffen gegen Tetanus, Diphtherie, Pertussis, Poliomyelitis oder Haemophilus-influenzae-b-Erkrankungen durchgeführt wurde.
Verabreichung mit anderen (kombinierten) Impfstoffen
Pentavac kann gleichzeitig mit dem Masern-Mumps-Röteln-Impfstoff (MMR II) an zwei verschiedenen Injektionsstellen verabreicht werden.
Obwohl noch keine Daten zur gleichzeitigen Anwendung von Pentavac mit anderen Impfstoffen vorliegen, ist anzunehmen, dass Pentavac zur simultanen Injektion an kontralateralen Injektionsstellen geeignet ist.
Anwendung
Zubereitung der gebrauchsfertigen Pentavac-Suspension:
Der gefriergetrocknete Haemophilus-influenzae-Typ-b-Impfstoff wird durch Mischen mit 0,5 ml Suspension DTPa-IPV in der Fertigspritze rekonstituiert. Solange schütteln, bis das Lyophilisat vollständig gelöst ist. Die Suspension hat nach Rekonstitution ein weisslich-trübes Aussehen. Der gebrauchsfertige Pentavac Impfstoff ist unverzüglich zu injizieren.
Die Rekonstitution der Trockensubstanz (Hib-(PRP-T)-Komponente) darf ausschliesslich in der beigefügten Impfstoffsuspension (DTPa-IPV-Komponente) erfolgen. Ein Mischen mit hierfür nicht vorgesehenen Komponenten, Chargen oder anderen Impfstoffen ist nicht zulässig.
Pentavac wird intramuskulär injiziert. Die Injektion erfolgt antero-lateral in den Oberschenkel bei Kleinkindern und in den Deltamuskel bei Kindern. Eine intravasale Injektion ist unbedingt zu vermeiden. Vor der Injektion ist durch Aspiration zu prüfen, dass die Nadel nicht intravasal liegt. Nicht intradermal injizieren.
Bei gleichzeitiger Verabreichung anderer injizierbarer Impfstoffe getrennte (kontralaterale) Injektionsstellen wählen.
Kontraindikationen
- Bekannte Überempfindlichkeit gegen einen der Bestandteile des Impfstoffes oder Überempfindlichkeit nach früherer Anwendung eines monovalenten Diphtherie-, Tetanus-, Pertussis-, Polio- oder Haemophilus-influenzae-Typ-b-Impfstoffes oder in einer Kombination.
- Schwerwiegende Nebenwirkungen im zeitlichen Zusammenhang mit einer früheren Impfung sind bis zur Klärung der Ursache eine Kontraindikation gegen eine nochmalige Impfung mitdem gleichen Impfstoff oder einem Impfstoff, der die gleichen Impfstoffe enthält.
- beginnende Enzephalopathie.
- Enzephalopathie innerhalb von 7 Tagen nach früherer Pertussisimpfung (mit Ganzzell-Pertussisimpfstoff oder azellulärem Pertussisimpfstoff) in der Anamnese.
- Wie bei anderen Impfstoffen soll die Impfung bei Personen mit fieberhaften Erkrankungen oder akuten Infektionen verschoben werden.
Warnhinweise und Vorsichtsmassnahmen
Früher aufgetretene Krämpfe, die nicht im Zusammenhang mit Impfungen stehen, sind keine Kontraindikation. Es wird jedoch in solchen Fällen empfohlen, als vorbeugende Massnahme Antiepileptika und/oder Antipyretika nach der Impfung zu verabreichen.
Da jede Impfdosis Spuren an Glutaraldehyd, Neomycin, Streptomycin und Polymyxin B (aus der Herstellung) enthalten kann, soll die Impfung bei Personen mit Überempfindlichkeit auf diese Substanzen unter spezieller Vorsicht erfolgen.
Vor jeder Injektion eines biologischen Wirkstoffs müssen alle bekannten Vorsichtsmassnahmen getroffen werden, die der Prävention einer allergischen, oder irgendeiner anderen Reaktion dienen.
Wie bei allen injizierbaren Impfstoffen sollte für eine allfällige anaphylaktische Reaktion nach der Impfung eine angemessene medizinische Behandlung zur Verfügung stehen.
Die Immunogenität des Impfstoffes kann bei Kindern unter immunsuppressiver Behandlung oder bei Immunschwäche reduziert sein. Es wird deshalb empfohlen, mit der Impfung bis nach Abschluss einer solchen Behandlung oder bis zum Ende der Krankheit zu warten. Bei Kindern mit chronischer Immunschwäche, wie HIV-Infektion, wird die Impfung mit Pentavac dennoch empfohlen, selbst wenn die Antikörperantwort limitiert sein kann.
Ist nach früherer Impfung mit einem Tetanustoxoid enthaltenden Impfstoff ein Guillain-Barré-Syndrom oder eine Neuritis des Armplexus aufgetreten, muss die Entscheidung zur Verabreichung eines Tetanustoxoid enthaltenden Impfstoffs auf der Grundlage einer sorgfältigen Abwägung des möglichen Nutzens und der möglichen Risiken erfolgen, beispielsweise mit der Frage, ob die Grundimmunisierung abgeschlossen ist. In der Regel ist eine Impfung bei Säuglingen mit nicht abgeschlossener Grundimmunisierung (d.h. wenn weniger als drei Dosen geimpft wurden) sinnvoll.
Bei Durchführung der Grundimmunisierungsreihe bei sehr unreifen Frühgeborenen (Geburt ≤28. Gestationswoche) und besonders bei solchen mit nicht ausgereiftem Atemapparat in der Anamnese sind das potenzielle Risiko einer Apnoe und die Notwendigkeit einer Atmungsüberwachung für 48-72 Std. zu bedenken. Da der Nutzen der Impfung bei dieser Säuglingsgruppe hoch ist, sollte die Impfung Frühgeborenen nicht vorenthalten und nicht auf geschoben werden.
Wie bei allen injizierbaren Impfstoffen ist bei Anwendung des Impfstoffs bei Patienten mit Thrombozytopenie oder einer Blutungsstörung Vorsicht angezeigt, da nach intramuskulärer Verabreichung an solche Patienten Blutungen eintreten können.
Vor jeder Impfung mit PENTAVAC muss eine sorgfältige Anamnese erhoben werden. Die zu impfende Person bzw. deren Eltern oder Erziehungsberechtigte sollten zur persönlichen und Familienanamnese sowie zum bisherigen Gesundheitszustand befragt werden. Dazu gehören auch Fragen zu früheren Impfungen, zu danach eventuell aufgetretenen Nebenwirkungen sowie zum aktuellen Gesundheitszustand.
Bei Personen, die nach früheren Impfungen mit ähnlichen Antigenkomponenten innerhalb von 48 Stunden schwere Nebenwirkungen entwickelt haben, darf PENTAVAC nur nach sorgfältiger Nutzen-Risiko-Abwägung angewendet werden.
Pentavac sollte nicht gegeben werden, wenn innerhalb von 48 Stundden nach einer vorangegangenen Impfung mit einem Pertussis Impfstoff oder einem Pertussis Antigenhaltigen Kombinationsimpfstoff die folgenden Symptome auftraten:
- Fieber ≥40 °C ohne sonst erkennbare Ursache;
- anhaltendes untröstliches Schreien über mehr als 3 Stunden;
- Krampfanfälle mit oder ohne Hyperthermie (innerhalb von 3 Tagen nach der Impfung);
- allergische Reaktionen;
- Kollaps oder schockähnlicher Zustand (Hypoton-hyporesponsive Episode).
Gegebenenfalls sind diese Kinder nur mit DT- und Polio-Impfstoff zu impfen.
Das Tetanus-Protein, welches im konjugierten Haemophilus-influenzae-Typ-b-Impfstoff enthalten ist, kann unter keinen Umständen die übliche Tetanus-Schutzimpfung ersetzen.
Interaktionen
Bei Patienten unter immunsuppressiver Behandlung oder mit Immunschwäche kann der Impferfolg beeinträchtigt oder vollständig unterdrückt sein (siehe auch unter «Warnhinweise und Vorsichtsmassnahmen»). Ansonsten wurde über keine signifikanten klinischen Interaktionen mit anderen Behandlungen oder biologischen Präparaten berichtet. Pentavac kann gleichzeitig mit einerMasern-Mumps-Röteln Impfung (MMR-Impfstoff) verabreicht werden, jedoch sind zwei separate Injektionsstellen zu verwenden.
Gelegentlich wurde nach Erhalt eines Konjugatimpfstoffes gegen Haemophilus-influenzae-Typ-b eine Antigenurie (PRP-Antigen) festgestellt. Daher ist der Antigennachweis im Urin in den zwei Wochen nach der Immunisierung bei Verdacht auf Infektion mit Haemophilus-influenzae-Typ-b nicht zwingend von gesichertem diagnostischem Wert.
Schwangerschaft/Stillzeit
Nicht zutreffend. Pentavac wird nur bei Kindern angewendet.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Nicht zutreffend. Pentavac ist nur für die Anwendung in der Pädiatrie bestimmt.
Unerwünschte Wirkungen
Die unerwünschten Wirkungen sind nach Häufigkeitsgruppen entsprechend folgender Konvention aufgeführt:
Sehr häufig (≥1/10)
Häufig (≥1/100 bis <1/10)
Gelegentlich ( ≥1/1000 bis <1/100)
Selten (≥1/10 000 bis 1/1000)
Sehr selten (<1/10 000)
Daten aus klinischen Studien
In klinischen Studien mit Kindern, die mit Pentavac grundimmunisiert wurden, waren die am häufigsten beobachteten Nebenwirkungen Lokalreaktionen an der Injektionsstelle, ungewöhnliches Schreien, Reizbarkeit und Fieber. Diese Anzeichen und Symptome traten in der Regel innerhalb von 48 Stunden nach der Impfung auf und bilden sich spontan zurück, ohne eine besondere Behandlung zu erfordern.
Nach der Grundimmunisierung erhöht sich tendenziell die Häufigkeit von Reaktionen an der Injektionsstelle nach Verabreichung der Auffrischimpfung deutlich.
Störungen des Nervensystems
Sehr häufig: Schläfrigkeit (Benommenheit) (16.0%)
Gastrointestinale Störungen
Sehr häufig: Erbrechen (17.3%)
Häufig: Diarrhoe
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Anorexie (Störungen des Nahrungsaufnahmeverhaltens, 18.2%)
Allgemeine Störungen und Reaktionen an der Applikationsstelle
Sehr häufig: Rötung an der Injektionsstelle (27.1%), Pyrexie (Fieber) ≥38 °C (25.0%), Schmerzen an der Injektionsstelle (34.7%), Schwellung an der Injektionsstelle (19.1%)
Häufig: Verhärtung an der Injektionsstelle.
Gelegentlich: Rötung und Schwellung ≥5 cm an der Injektionsstelle, Pyrexie (Fieber) ≥39 °C
Selten: Pyrexie >40 °C (hohes Fieber). Nach der Impfung mit Konjugatimpfstoffen mit Haemophilus-influenzae-Typ-b können ödematöse Reaktionen an einem oder beiden unteren Gliedmassen auftreten, zumeist bei der Grundimmunisierung und innerhalb der ersten Stunden nach der Injektion. Begleitend können Symptome wie Zyanose, Rötung, transiente Purpura und heftiges Schreien auftreten. Alle Reaktionen bilden sich innerhalb von 24 Stunden ohne Folgen zurück.
Psychiatrische Störungen
Sehr häufig: Nervosität (Reizbarkeit) (23.6%), ungewöhnliches Schreien (27.0%)
Häufig: Schlafstörungen
Gelegentlich: Anhaltendes untröstliches Schreien
Daten aus der Anwendungsbeobachtung
Spontanmeldungen zufolge sind bei Anwendung des handelsüblichen Präparats folgende weitere unerwünschte Wirkungen aufgetreten. Diese Wirkungen sind sehr selten gemeldet worden, dennoch können die genauen Inzidenzraten nicht präzise berechnet werden, so dass deren Häufigkeit als «unbekannt» klassifiziert wird.
Störungen des Nervensystems
Krämpfe mit oder ohne Fieber. Muskelhypotonie oder hypoton-hyporesponsive Episoden (HHE)
Funktionsstörungen der Haut und des Unterhautzellgewebes
Ausschlag, Nesselsucht (Urtikaria)
Allgemeine Störungen und Reaktionen an der Applikationsstelle
Bei Kindern sind grossflächige (>50 mm) Reaktionen an der Injektionsstelle aufgetreten, einschliesslich umfangreicher Gliedmassenschwellungen ab der Injektionsstelle bis hinter ein Gelenk oder beide Gelenke. Solche Reaktionen setzen innerhalb von 24-72 Stunden nach der Impfung ein, können mit Erythem, Wärmeentwicklung, Empfindlichkeit oder Schmerzen an der Injektionsstelle einhergehen und bilden sich spontan innerhalb von 3-5 Tagen zurück. Das Risiko scheint von der Anzahl früherer Dosen Pertussis-Impfstoffe (insbesondere azellulär) abzuhängen, wobei das Risiko nach der 4. und 5. Dosis grösser ist.
Störungen des Immunsystems
Anaphylaktische Reaktionen wie Gesichtsödem, Quincke-Ödem oder Schock.
Potenzielle unerwünschte Ereignisse (d.h. unerwünschte Ereignisse, die bei anderen Impfstoffen auftraten, welche mindestens einen der antigenen Inhaltsstoffe von PENTAVAC enthielten).
Nach Verabreichung von Impfstoffen mit Tetanustoxoid sind Plexus-brachialis Neuritis und Guillain-Barré-Syndrom aufgetreten.
Zusätzliche Angaben zu besonderen Populationen:
Apnoe bei sehr unreifen Frühgeborenen (≤28. Gestationswoche) (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Auftreten sehr häufiger Nebenwirkungen (%) in klinischen Studien nach der Impfung (Grundimmunisierung (≥2664 Dosen) und Auffrischimpfung (828 Dosen)
Lokale und systemische Nebenwirkungen | |
|---|---|
Lokal | |
Rötung | 27.1 |
Schwellung (≥2 cm) | 19.1 |
Schmerzen | 34.7 |
Allgemein | |
Fieber (≥38 °C) | 25.0 |
Ungewöhnliches Schreien | 27.0 |
Reizbarkeit | 23.6 |
Schläfrigkeit | 16.0 |
Erbrechen | 17.3 |
Anorexie | 18.2 |
Überdosierung
Nicht dokumentiert.
Eigenschaften/Wirkungen
ATC-Code: J07CA06
Pharmakodynamik
Pentavac ist ein kombinierter Impfstoff und enthält detoxifiziertes und gereinigtes Diphterie- und Tetanus-Toxoid, azelluläres Pertussistoxoid, bestehend aus den beiden Antigenen Pertussis-Toxoid (PT) und filamentöses Haemagglutinin (FHA) von B. pertussis, inaktivierte Poliomyelitis-Viren der Typen I, II und III, sowie an Tetanustoxoid konjugiertes Kapselpolysaccharid von Hämophilus-influenzae-Typ-b. Die Diphtherie- und Tetanus-Toxine werden mit Formaldehyd detoxifiziert.
Poliomyelitis-Viren der Typen I, II und III werden in VERO-Zellen kultiviert und danach mit Formaldehyd inaktiviert und gereinigt.
Die azellulären Pertussis-Impfstoff-Komponenten (PT und FHA) werden aus Bordetella pertussis-Bakterien gewonnen und gereinigt. Das Pertussis-Toxin (PT) wird mit Glutaraldehyd detoxifiziert (Ptxd). FHA ist nativ. Pertussis-Toxoid (PTxd) und FHA sind die wichtigsten Komponenten von B. pertussis, die den Schutz vor Erkrankung gewährleisten.
Das Lyophilisat enthält gereinigte Polysaccharide der Kapsel von Haemophilus-influenzae-Typ-b (PRP), gebunden an Tetanus-Protein (PRP-T). Durch die kovalente Bindung von PRP an Tetanus-Protein wird die vorher T-Zell-unabhängige Immunantwort in eine T-Zell-abhängige umgewandelt, mit Induktion eines immunologischen Gedächtnisses und spezifischer Anti-PRP-IgG.
Immunantwort nach Grundimmunisierung
Nach der Grundimmunisierung mit 3 Dosen Pentavac entwickelten alle Kleinkinder Antikörpertiter von mehr als 0,01 I.E./ml gegen Diphtherie und Tetanus.
Gegen Pertussis erreichten mehr als 88% der Kleinkinder einen 4fachen Anstieg der PT- und FHA-Antikörpertiter einen Monat nach der dritten Impfung (Grundimmunisierung). Da es für Pertussis kein serologisches Korrelat für die Schutzwirkung gibt, wird ein vierfacher Anstieg des Antikörpertiters als Zeichen für eine Serokonversion angesehen.
Mindestens 99% der Kinder hatten nach 3 Impfungen einen schützenden Antikörpertiter gegen alle drei Poliomyelitis-Typen.
Die Anti-PRP-Antikörpertiter lagen bei mindestens 92% der Kleinkinder über 0,15 µg/ml und bei mehr als 67% über 1 µg/ml 1 Monat nach der Grundimmunisierung.
Immunantwort auf die Boosterimpfung
Nach Anwendung eines Boosters (4. Impfung) mit Pentavac im 2. Lebensjahr zeigten alle Kinder, die zuvor mit einem Ganzkeimimpfstoff, Pentavac oder einem anderen azellulären Pertussis-Impfstoff grundimmunisiert wurden, hohe Antikörpertiter gegen alle Antigene.
Mehr als 97% der Kinder hatten einen Antikörpertiter von mind. 0,1 I.E./ml gegen Diphtherie. Alle Kinder erreichten einen Antikörpertiter von mind. 0,1 I.E./ml gegen Tetanus, hatten einen im Durchschnitt 5fachen Anstieg der Antikörpertiter gegen die Pertussisantigene PT und FHA und schützende Titer gegen die drei Poliovirustypen. Mehr als 99% der Kinder entwickelten Antikörpertiter gegen Haemophilus-influenzae-Typ-b von mehr als 1 µg/ml.
Pharmakokinetik
Entfällt.
Präklinische Daten
Daten aus tierexperimentellen Studien mit Einzeldosen und Mehrfachdosen und Studien zur lokalen Toleranz lieferten keine unerwarteten Befunde und keine Hinweise auf Toxizität in Zielorganen.
Sonstige Hinweise
Pentavac darf nicht mit anderen Impfstoffen oder parenteral zu verabreichenden Arzneimitteln gemischt oder in derselben Spritze verwendet werden.
Haltbarkeit
36 Monate. Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden
Pentavac besteht aus zwei Teilkomponenten: einem Fläschchen mit Hib-(PRP-T)-Trockensubstanz sowie einer Fertigspritze mit DTPa-IPV Suspension, die zum Auflösen der Hib-(PRP-T)-Trockensubstanz verwendet wird. Aus produktionstechnischen Gründen wird für jede dieser Teilkomponenten ein eigenes Verfalldatum auf den jeweiligen Primärbehältnissen angegeben. Das Verfalldatum des rekonstituierten Produktes Pentavac richtet sich nach dem jeweils kürzeren Verfalldatum der beiden Teilkomponenten und ist auf der Faltschachtel mit Monat und Jahr aufgedruckt. Nach Ablauf des auf der Faltschachtel angegebenen Verfalldatums darf der Impfstoff nicht mehr angewendet werden.
Besondere Lagerungshinweise
Pentavac soll im Kühlschrank bei +2 °C bis +8 °C aufbewahrt werden.
Nicht einfrieren. Vor Licht geschützt aufbewahren.
Eine Aufbewahrung über oder unter der empfohlenen Temperatur vermindert die Wirksamkeit des Impfstoffes. Pentavac darf nicht eingefroren werden. Versehentlich falsch gelagerter oder eingefrorener Impfstoff ist zu verwerfen.
Zulassungsnummer
00613 (Swissmedic).
Zulassungsinhaberin
sanofi-aventis (schweiz) ag, 1214 Vernier/GE.
Stand der Information
März 2015.
OEMéd
Composition
Principes actifs: 1 dose vaccinale est composée d'un lyophilisat, reconstitué avec 0,5 ml de suspension.
0,5 ml de suspension vaccinale reconstituée contient:
Anatoxine diphtérique | au moins 201 U.I.* |
Anatoxine tétanique | au moins 401 U.I.* |
Antigènes de Bordetella pertussis: | |
Anatoxine coquelucheuse purifiée | 25 µg |
Hémagglutinine filamenteuse purifiée | 25 µg |
Virus poliomyélitiques inactivés: | |
Type 1 | 40 D.E.** |
Type 2 | 8 D.E.** |
Type 3 | 32 D.E.** |
Polyoside Haemophilus influenzae type b (polyribosyl ribitol phosphate) conjugué à la protéine tétanique (Hib-(PRP- T) | 10 µg |
1 comme limite de confiance inférieure (p = 0,95)
Système hôte pour le vaccin poliomyélitique inactivé: cellules VERO.
* Unités internationales.
** Unités d'antigène D selon l'OMS ou quantité d'antigène D équivalente déterminée selon une méthode immunochimique appropriée.
Excipients: Suspension de DTPa-IPV: 0,30 mg d'hydroxyde d'aluminium comme adjuvant; 10 μg de formaldéhyde, 2,5 μl de 2-phénoxyéthanol et 2,5 μl éthanol. Traces du milieu 199, glutaraldéhyde néomycine, de streptomycine et de polymyxine B.
Lyophilisat de HIB: 0,6 mg de trométamol et 42,5 mg de saccharose.
Forme galénique et quantité de principe actif par unité
Seringue préremplie de suspension (0,5 ml) et flacon de lyophilisat.
Indications/Possibilités d’emploi
Pentavac est utilisé pour l'immunisation de base chez le petit enfant dès le 2ème mois de vie (jusqu'à 2 ans) et de rappel (4e dose) chez les enfants ayant déjà reçu 3 doses vaccinales (= immunisation de base).
Pentavac doit être utilisé conformément aux recommandations vaccinales officielles.
Posologie/Mode d’emploi
Posologie usuelle
Les recommandations suivantes sont applicables, une dose de vaccin de 0,5 ml étant appliquée à chaque administration:
Immunisation de base
1ère dose à l'âge de 2 mois.
2e dose à l'âge de 4 mois.
3e dose à l'âge de 6 mois.
Vaccination de rappel
Une 4e dose est administrée au cours de la 2e année de vie chez les enfants âgés de 12 à 24 mois révolus, de préférence entre 15 et 18 mois.
La vaccination de rappel peut se faire avec Pentavac, même si l'immunisation de base a été auparavant faite par un vaccin monovalent ou combiné tétanique, diphtérique, coquelucheux, poliomyélitique ou contre les infections à Haemophilus influenzae type b.
Administration en même temps que d'autres vaccins (combinés)
Pentavac peut être administré en même temps que le vaccin contre la rougeole, la rubéole et la parotidite (MMR II) en utilisant deux sites d'injection différents.
Bien qu'il n'existe encore aucune donnée relative à l'emploi simultané de Pentavac et d'autres vaccins, on suppose que Pentavac convient à l'injection simultanée à des sites d'injection controlatéraux.
Mode d'emploi correct
Préparation de la suspension Pentavac prête à l'emploi:
Le vaccin Haemophilus influenzae type b lyophilisé est reconstitué en mélangeant 0,5 ml de la suspension DTPa-IPV dans la seringue préremplie. Agiter jusqu'à dissolution complète du lyophilisat. Après la reconstitution, la suspension présente un aspect trouble blanchâtre. Le vaccin Pentavac prêt à l'emploi doit être injecté immédiatement.
La reconstitution de la substance sèche (composant Hib-(PRP-T)) doit se faire uniquement avec la suspension vaccinale jointe (composant DTPa-IPV). Un mélange avec des composants ou numéros de lots non prévus, ou avec d'autres vaccins n'est pas permis.
Pentavac est injecté par voie intramusculaire. L'injection est réalisée sur la face antéro-latérale de la cuisse chez le petit enfant et dans le muscle deltoïde chez l'enfant. Eviter absolument l'injection intravasculaire. Contrôler par une aspiration avant l'injection si l'aiguille est dans un vaisseau. Ne pas administrer par voie intradermique.
Choisir des sites d'injection différents (controlatéraux) lors de l'administration simultanée d'autres vaccins injectables.
Contre-indications
- Hypersensibilité connue à l'un des composants du vaccin ou hypersensibilité après administration antérieure d'un vaccin monovalent ou combiné diphtérique, tétanique, coquelucheux, poliomyélitique ou Haemophilus influenza type b.
- Les effets indésirables sévères consécutifs à une vaccination antérieure sont, jusqu'à élucidation de la cause, une contre-indication à une nouvelle vaccination avec le même vaccin ou avec un vaccin ayant les mêmes composants.
- Encéphalopathie débutante.
- Antécédents d'encéphalopathie dans les 7 jours après une vaccination antérieure contre la coqueluche (avec un vaccin anticoquelucheux à cellules entières ou acellulaire).
- Comme pour d'autres vaccins, la vaccination chez les personnes souffrant d'affections fébriles ou d'infections aiguës doit être reportée.
Mises en garde et précautions
Des convulsions apparues dans le passé mais qui ne sont pas associées à une vaccination ne constituent pas une contre-indication. Dans ces cas, il est toutefois recommandé d'administrer à titre préventif des antiépileptiques et/ou des antipyrétiques après la vaccination.
Etant donné que chaque dose de vaccin est susceptible de contenir des traces de glutaraldéhyde, néomycine, de streptomycine et de polymyxine B (issues de la fabrication), la vaccination de personnes présentant une hypersensibilité à ces substances requiert une prudence particulière.
Avant chaque injection d'un principe actif biologique, il convient de prendre toutes les précautions connues destinées à prévenir une réaction allergique ou toute autre réaction.
Comme pour tous les vaccins injectables, un traitement médical approprié doit être disponible en cas d'éventuelle réaction anaphylactique apparaissant après la vaccination.
L'immunogénicité du vaccin peut être réduite chez les enfants sous traitement immunosuppresseur ou souffrant d'une immunodéficience. Par conséquent, il est recommandé d'attendre la fin d'un tel traitement ou la guérison de la maladie avant de réaliser la vaccination.
Chez les enfants présentant une immunodéficience chronique, telle qu'une infection à VIH, la vaccination par Pentavac est néanmoins recommandée, même si la réponse en anticorps peut être limitée.
En cas de survenue d'un syndrome de Guillain-Barré ou d'une névrite du plexus brachial après une vaccination antérieure avec une anatoxine tétanique, la décision d'administrer un vaccin contenant une anatoxine tétanique doit reposer sur une évaluation soigneuse des bénéfices potentiels et des risques éventuels, par exemple sur la question de savoir si l'immunisation de base est achevée ou non. La vaccination est en règle générale judicieuse chez les nourrissons dont l'immunisation de base n'est pas achevée (c.-à-d. lorsque moins de trois doses ont été injectées).
Le risque potentiel d'apnée et la nécessité d'une surveillance respiratoire pendant 48 à 72 heures doivent être soigneusement pris en compte lors de la réalisation de la série d'injections pour l'immunisation de base chez les prématurés très immatures (naissance ≤28e semaine de grossesse), en particulier chez ceux ayant des antécédents d'immaturité de l'appareil respiratoire. En raison du bénéfice élevé de la vaccination chez ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
Comme avec tous les vaccins injectables, la prudence est recommandée lors de l'utilisation du vaccin chez des patients présentant une thrombopénie ou un trouble hémorragique car des hémorragies peuvent survenir après une administration intramusculaire chez de tels patients.
Une anamnèse soigneuse doit être recueillie avant chaque vaccination avec PENTAVAC. Il convient d'interroger la personne à vacciner, ses parents ou ses représentants légaux sur ses antécédents personnels et familiaux ainsi que sur son état de santé passé. Les questions doivent également porter sur les vaccinations antérieures, les éventuels effets indésirables survenus par la suite, ainsi que l'état de santé actuel.
Chez les personnes ayant développé des effets indésirables sévères dans les 48 heures après des vaccinations antérieures avec des composants antigéniques similaires, PENTAVAC ne doit être utilisé qu'après une évaluation soigneuse du rapport bénéfice-risque.
Pentavac ne doit pas être administré lorsque les symptômes suivants sont survenus dans les 48 heures après une vaccination antérieure avec un vaccin anticoquelucheux ou avec un vaccin combiné contenant des antigènes de B. pertussis:
- une fièvre supérieure ou égale à 40 °C sans autre cause reconnaissable;
- des cris continus et inconsolables durant plus de 3 heures;
- des convulsions avec ou sans hyperthermie (dans les 3 jours après la vaccination);
- des réactions allergiques;
- un collapsus ou un état rappelant le choc (épisode d'hypotonie-hyporéactivité).
Le cas échéant, ces enfants devront recevoir uniquement le vaccin DT et poliomyélitique.
La protéine tétanique contenue dans le vaccin conjugué Haemophilus influenzae type b, ne peut en aucun cas remplacer le vaccin usuel contre le tétanos.
Interactions
Le succès de la vaccination peut être altéré ou complètement supprimé chez les patients sous traitement immunosuppresseur ou présentant une immunodéficience (voir également sous «Mises en garde et précautions»). A part cela, aucune interaction cliniquement significative avec d'autres traitements ou d'autres préparations biologiques n'a été signalée.
Pentavac peut être administré en même temps qu'une vaccination rougeole-oreillons-rubéole (vaccin ROR), mais deux sites d'injection séparés doivent être utilisés.
Après la réception d'un vaccin conjugué contre l'Haemophilus-influenzae de type b, une antigénurie (antigène PRP) a occasionnellement été constatée. En cas de suspicion d'une infection à Haemophilus-influenzae de type b, la détection d'antigènes dans les urines dans les deux semaines après l'immunisation n'a donc pas obligatoirement une valeur diagnostique certaine.
Grossesse/Allaitement
Non pertinent. Pentavac est utilisé uniquement chez les enfants.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Non pertinent. Pentavac est utilisé uniquement chez les enfants.
Effets indésirables
Les effets indésirables sont mentionnés par groupes de fréquence définis selon la convention suivante:
Très fréquents (≥1/10)
Fréquents (≥1/100 et <1/10)
Occasionnels (≥1/1000 et <1/100)
Rares (≥1/10 000 et <1/1000)
Très rares (<1/10 000)
Données issues d'études cliniques
Dans les études cliniques réalisées chez des enfants ayant reçu l'immunisation de base par Pentavac, les effets indésirables observés le plus fréquemment ont été des réactions locales au site d'injection, des cris inhabituels, une irritabilité et de la fièvre. Ces signes et symptômes sont généralement survenus dans les 48 heures après la vaccination et ont disparu spontanément sans nécessiter de traitement particulier.
Après l'immunisation de base, la fréquence des réactions au site d'injection a tendance à augmenter nettement après administration de la vaccination de rappel.
Troubles du système nerveux
Très fréquents: somnolence (obnubilation) (16.0%)
Troubles gastro-intestinaux
Très fréquents: vomissements (17.3%)
Fréquents: diarrhée
Troubles du métabolisme et de la nutrition
Très fréquents: anorexie (troubles du comportement alimentaire, 18.2%)
Troubles généraux et accidents liés au site d'administration
Très fréquents: rougeur au site d'injection (27.1%), pyrexie (fièvre) ≥38 °C (25.0%), douleurs au site d'injection (34.7%), gonflement au site d'injection (19.1%)
Fréquents: induration au site d'injection.
Occasionnels: rougeur et gonflement ≥5 cm au site d'injection, pyrexie (fièvre) ≥39 °C
Rares: pyrexie >40 °C (fièvre élevée). Après la vaccination avec des vaccins conjugués comportant l'Haemophilus-influenzae de type b, des réactions œdémateuses au niveau de l'un ou des deux membres inférieurs peuvent survenir, le plus souvent lors de l'immunisation de base et dans les premières heures après l'injection. Des symptômes accompagnateurs tels que cyanose, rougeur, purpura transitoire et cris violents peuvent survenir. Toutes ces réactions disparaissent en l'espace de 24 heures sans séquelle.
Troubles psychiatriques
Très fréquents: nervosité (irritabilité) (23.6%), cris inhabituels (27.0%)
Fréquents: troubles du sommeil
Occasionnels: cris persistants inconsolables
Données issues de la surveillance
Selon des rapports spontanés, les autres effets indésirables mentionnés ci-dessous sont survenus lors de l'utilisation du produit commercialisé. Ces effets ont été signalés très rarement, mais comme les taux d'incidence exacts ne peuvent pas être calculés précisément, leur fréquence est classée comme «inconnue».
Troubles du système nerveux
Convulsions avec ou sans fièvre. Hypotonie musculaire ou épisodes d'hypotonie-hyporéactivité (EHH)
Troubles cutanés et des tissus sous-cutanés
Éruption, urticaire
Troubles généraux et accidents liés au site d'administration
Des réactions étendues (>50 mm) au site d'injection sont survenues chez l'enfant, y compris des gonflements plus importants des membres, pouvant s'étendre du site d'injection au-delà d'une ou de deux articulations. De telles réactions apparaissent dans les 24 à 72 heures après la vaccination, peuvent s'accompagner d'érythème, de développement de chaleur, de sensibilité ou de douleurs au site d'injection et disparaissent spontanément en 3 à 5 jours. Le risque semble dépendre du nombre de doses antérieures de vaccins contre la coqueluche (en particulier acellulaires), le risque étant plus élevé après la 4e et la 5e dose.
Troubles du système immunitaire
Réactions anaphylactiques telles qu'œdème facial, œdème de Quincke ou choc.
Effets indésirables potentiels (c.-à-d. effets indésirables survenus avec d'autres vaccins contenant au moins l'un des composants antigéniques de PENTAVAC).
Des névrites du plexus brachial et un syndrome de Guillain-Barré sont survenus après l'administration de vaccins contenant l'anatoxine tétanique.
Indications supplémentaires concernant les populations particulières:
Apnée chez des prématurés très immatures (≤28e semaine de grossesse) (voir rubrique «Mises en garde et précautions»).
Survenue d'effets indésirables très fréquents (%) dans des études cliniques après la vaccination (immunisation de base (≥2664 doses) et rappel (828 doses)
Effets indésirables locaux et systémiques | |
|---|---|
Locaux | |
Rougeur | 27.1 |
Gonflement (≥2 cm) | 19.1 |
Douleurs | 34.7 |
Généraux | |
Fièvre (≥38 °C) | 25.0 |
Cris inhabituels | 27.0 |
Irritabilité | 23.6 |
Somnolence | 16.0 |
Vomissements | 17.3 |
Anorexie | 18.2 |
Surdosage
Non pertinent.
Propriétés/Effets
Code ATC: J07CA06
Pharmacodynamie
Pentavac est un vaccin combiné qui contient les anatoxines diphtérique et tétanique détoxifiées et purifiées, l'anatoxine coquelucheuse acellulaire que forment les deux antigènes anatoxine coquelucheuse et hémagglutinine filamenteuse (HF) de B. pertussis, les virus poliomyélitiques des types I, II et III inactivés ainsi que le polysaccharide capsulaire d'Haemophilus influenza type b conjugué à l'anatoxine tétanique. Les anatoxines diphtérique et tétanique sont détoxifiées au formaldéhyde.
Les virus poliomyélitiques des types I, II et III sont cultivés sur cellules VERO puis inactivés au formaldéhyde et purifiés.
Les composantes acellulaires du vaccin coquelucheux (anatoxine coquelucheuse et HF) sont extraites à partir de bactéries Bordetella pertussis et purifiées. La toxine coquelucheuse est détoxifiée à l'aide de glutaraldéhyde. L'HF est native. L'anatoxine coquelucheuse détoxifiée et l'HF sont les composantes principales de B. pertussis et confèrent la protection contre la maladie.
Le lyophilisat contient des polysaccharides purifiés à partir de la capsule d'Haemophilus influenzae type b (PRP) conjugués à la protéine tétanique (PRP-T). La liaison covalente entre le PRP et la protéine tétanique transforme la réponse immunitaire auparavant indépendante des cellules T en une réponse dépendante des cellules T, avec induction de la mémoire immunologique et d'IgG anti-PRP spécifiques.
Réponse immunitaire après immunisation de base
Après l'immunisation de base effectuée avec 3 doses de Pentavac, tous les petits enfants possédaient des titres d'anticorps antidiphtérie et anti-tétanos supérieurs à 0,01 U.I./ml.
En ce qui concerne la coqueluche, plus de 88% des petits enfants montraient un titre d'anticorps anti-coqueluche et anti-FH quadruplé un mois après la troisième vaccination (immunisation de base). Parce qu'une corrélation entre le taux sérologique et la protection vaccinale n'existe pas pour la coqueluche, une augmentation du taux d'anticorps d'un facteur 4 est considéré comme témoin de la séroconversion.
Après 3 vaccinations, 99% au moins des enfants possédaient un titre protecteur d'anticorps anti-poliomyélite des 3 types.
Les titres d'anticorps anti-PRP étaient supérieurs à 0,15 μg/ml chez au moins 92% des petits enfants et supérieurs à 1 μg/ml chez plus de 67% d'entre eux un mois après l'immunisation de base.
Réponse immunitaire au vaccin de rappel
Après administration d'un rappel avec Pentavac (4e vaccination) au cours de la deuxième année de vie, tous les enfants ayant bénéficié auparavant d'une immunisation de base avec un vaccin à base de germes entiers, avec Pentavac ou un autre vaccin acellulaire coquelucheux, possédaient des titres élevés d'anticorps contre tous les antigènes.
Plus de 97% des enfants possédaient un titre d'anticorps anti-diphtérie d'au moins 0,1 U.I./ml. Tous les enfants ont atteint un titre d'anticorps anti-tétanos d'au moins 0,1 U.I./ml, le titre de leurs anticorps coquelucheux contre l'anatoxine coquelucheuse et l'HF a été multiplié par 5 en moyenne et ils possédaient des titres protecteurs contre les trois types de poliovirus. Plus de 99% des enfants possédaient des titres d'anticorps contre Haemophilus influenzae type b supérieurs à 1 μg/ml.
Pharmacocinétique
Non disponibles.
Données précliniques
Les données issues des expérimentations animales réalisées avec des doses uniques et multiples et des études sur la tolérance locale n'ont révélé aucune observation inattendue et aucun indice de toxicité dans les organes cibles.
Remarques particulières
Ne pas mélanger Pentavac à d'autres vaccins ou à d'autres médicaments administrés par voie parentérale, ni l'administrer par la même seringue.
Stabilité
36 mois. Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage. .
Pentavac est formé par 2 composantes partielles: un flacon de substance sèche Hib-(PRP-T) et une seringue préremplie de suspension DTPa-IPV, destinée à la dissolution de la substance sèche Hib-(PRP-T). Pour des raisons techniques de production, chaque composante partielle a sa propre date de péremption mentionnée sur le récipient primaire. La date de péremption du produit Pentavac reconstitué est mentionnée sur la boîte en carton par l'indication du mois et de l'année; elle est déterminée par la date de péremption la plus courte de l'une des composantes partielles. Le vaccin ne doit plus être utilisé passé la date de péremption mentionnée sur la boîte en carton.
Remarques concernant le stockage
Conserver Pentavac au réfrigérateur, à une température entre +2 °C et +8 °C.
Ne pas congeler. Conserver à l'abri de la lumière.
Un stockage à une température supérieure ou inférieure à la température recommandée diminue l'efficacité du vaccin. Pentavac ne doit pas être surgelé. Un vaccin mal conservé ou surgelé par inadvertance doit être éliminé.
Numéro d’autorisation
00613 (Swissmedic).
Titulaire de l’autorisation
sanofi-aventis (schweiz) sa, 1214 Vernier/GE.
Mise à jour de l’information
Mars 2015.
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.



 Deutsch
Deutsch French
French







