Leuprorelin Sandoz Injektionspräparat 5mg Fertigspritze buy online
Leuprorelin Sandoz 3 Monate Implant 5 mg Fertspr
-
497.88 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: SANDOZ PHARMACEUT. AG
- Product Code: 3805856
- ATC-code L02AE02
- EAN 7680571410014
Ingredients:

Description
Zusammensetzung
Wirkstoff: Leuprorelinum ut leuprorelini acetas.
Hilfsstoffe: Acidum polylacticum pro praeparatione.
Galenische Form und Wirkstoffmenge pro Einheit
Eine Fertigspritze mit einem Implantat enthält 5 mg Leuprorelinum ut leuprorelini acetas.
Indikationen/Anwendungsmöglichkeiten
Symptomatische Behandlung des fortgeschrittenen hormonabhängigen Prostatakarzinoms. Als alternative Behandlung, wenn Orchiektomie oder Östrogengaben entweder für den Patienten nicht indiziert oder nicht zumutbar sind.
Dosierung/Anwendung
Übliche Dosierung
Die empfohlene Dosierung beträgt 5 mg Leuprorelin als Einzeldosis alle 3 Monate.
Art der Anwendung
Das Implantat wird subkutan in die Bauchhaut eingeschoben. Die Injektionsstelle an der Bauchhaut ist bei jeder Applikation zu wechseln.
Die Anwendung von Leuprorelin Sandoz ist nur bei erwachsenen Männern zulässig und sollte nur unter Überwachung eines in der Tumortherapie erfahrenen Arztes bzw. einer Ärztin erfolgen.
Für die Initialphase der Behandlung sollte die zusätzliche Gabe eines geeigneten Antiandrogens erwogen werden, um so die möglichen Folgeerscheinungen des anfänglichen Testosteronanstiegs und die vorübergehende Verschlechterung der klinischen Symptomatik abzuschwächen.
Die Antwort auf Leuprorelinacetat soll mittels Messung des Serum-Testosteronspiegels und des prostataspezifischen Antigens verfolgt werden.
Spezielle Dosierungsempfehlungen
Kinder/Jugendliche: Die Wirksamkeit und Sicherheit von Leuprorelin Sandoz 3 Monate bei Kindern und Jugendlichen wurde nicht untersucht.
Ältere Patienten: Eine Dosisanpassung in Abhängigkeit vom Alter ist nicht erforderlich.
Leber- und Niereninsuffizienz: eine Dosisanpassung ist nicht erforderlich (vgl. «Pharmakokinetik»)
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff, ähnliche Nona- oder Dekapeptide, oder dem Hilfsstoff gemäss Zusammensetzung.
Bei nachgewiesener Hormonunabhängigkeit des Karzinoms ist Leuprorelin Sandoz nicht indiziert.
Warnhinweise und Vorsichtsmassnahmen
Hypersensibilitätsreaktionen:
Während der Behandlung mit GnRH-Agonisten wurden allergische und anaphylaktische Reaktionen beobachtet. Diese können lokale Überempfindlichkeitsreaktionen an der Injektionsstelle sowie systemische Symptome beinhalten.
Bei ausgeprägten lokalen Reaktionen kann die Resorption von Leuprorelin aus dem Depot beeinträchtigt sein. In einem solchen Fall sollte der Testosteronspiegel bestimmt werden.
Hypophysenapoplexie:
Während der Marktüberwachung wurde nach Verabreichung von Gonadotropin-Releasing-Hormon (GnRH)-Agonisten selten über Hypophysenapoplexie berichtet (sekundäres klinisches Syndrom, eines Hypophysen-Infarktes). In den meisten dieser Fälle wurde ein Hypophysenadenom diagnostiziert. Die Mehrheit dieser Hypophysenapoplexie-Fälle traten innerhalb von 2 Wochen, einige Fälle innerhalb der ersten Stunde, nach Verabreichung der ersten Dosis auf. In diesen Fällen zeigte sich die Hypophysenapoplexie durch plötzliche Kopfschmerzen, Erbrechen, visuelle Veränderungen, Ophthalmoplegie, einen veränderten mentalen Status und manchmal einen kardiovaskulären Kollaps. Sofortige medizinische Betreuung war erforderlich.
Bei bekanntem Hypophysenadenom sollte aus diesem Grund ein GnRH-Agonist nicht gegeben werden.
Depression und Suizidrisiko: Bei Patienten, welche mit GnRH-Agonisten behandelt werden, besteht ein erhöhtes Risiko für das Auftreten von Depressionen (welche schwerwiegend verlaufen können).
Patienten mit vorbestehenden Depressionen können suizidgefährdet sein.
Knochendichte/Frakturrisiko: Während eines hypo-östrogenen Zustands können Veränderungen der Knochendichte auftreten.
Die Abnahme der Knochendichte kann nach Absetzen von Leuprorelin Sandoz 3 Monate reversibel sein.
Durch den Mangel an Androgenen, welcher aus der Behandlung des Prostatakarzinoms resultiert, kann das Frakturrisiko erhöht sein.
Krampfanfälle: Im Rahmen der Marktüberwachung wurde über das Auftreten von Krampfanfällen berichtet. Teilweise handelte es sich dabei um Patienten, welche andere Risikofaktoren für Krampfanfälle aufwiesen (wie z.B. Epilepsie-Anamnese, intrakranielle Tumoren, Komedikation mit Arzneimitteln, für welche ein Risiko für Krampfanfälle bekannt ist). Es liegen jedoch auch Meldungen von Patienten ohne derartige Risikofaktoren vor.
Kardiovaskuläre Risikofaktoren/Erkrankungen:
Unter der Behandlung mit GnRH-Agonisten wurde über ein erhöhtes Risiko für Diabetes mellitus und/oder kardiovaskuläre Ereignisse berichtet. Insbesondere wurde in mehreren grossen epidemiologischen Studien bei Prostatakarzinom-Patienten ein um etwa 20% erhöhtes Risiko für Myokardinfarkt und Schlaganfall beobachtet. Bei Patienten mit Vorliegen weiterer Risikofaktoren für kardiovaskuläre Ereignisse (z.B. Hypertonie, Hyperlipidämie) bzw. mit bereits bestehenden kardiovaskulären Erkrankungen sollte daher eine besonders sorgfältige Nutzen-Risiko-Abwägung erfolgen.
Vor Einleitung einer Behandlung mit Leuprorelin sollten Blutdruck, Blutglucose und Lipidprofil bestimmt werden. Während der Behandlung sollten die Patienten bezüglich dieser Risikofaktoren sowie bezüglich möglicher Symptome, welche die Entwicklung einer kardiovaskulären Erkrankung vermuten lassen, überwacht werden. Bereits bestehende Risikofaktoren (Diabetes, Hypercholesterinämie, Hypertonie) sollten adäquat, d.h. entsprechend der jeweiligen Guidelines, behandelt werden.
Effekte auf das QT-Intervall:
Eine Androgendeprivation kann das QT-Intervall verlängern. Bei Patienten mit einer Vorgeschichte oder einem Risiko für eine QT-Verlängerung und bei Patienten, welche gleichzeitig Arzneimittel erhalten, die eine QT-Verlängerung bewirken können (siehe «Interaktionen»), sollte das Nutzen-Risiko-Verhältnis, inklusive der Möglichkeit eines Auftreten von Torsades de pointes abgewogen werden, bevor eine Behandlung mit Leuprorelinacetat begonnen wird.
Im Zusammenhang mit der Anwendung von GnRH-Agonisten wurde darüber hinaus bei Männern über ein erhöhtes Risiko für einen plötzlichen Herztod berichtet.
Bei ausgeprägten lokalen Reaktionen kann die Resorption von Leuprorelin aus dem Depot beeinträchtigt sein. In einem solchen Fall sollte der Hormonspiegel bestimmt werden.
Prostatakarzinom
Während der ersten Wochen der Behandlung mit Leuprorelin Sandoz 3 Monate kommt es zu einem kurzfristigen Anstieg des Serumtestosteronspiegels, was zu einer vorübergehenden Verschlechterung der Krankheitssymptome führen kann, wie Zunahme von Knochenschmerzen (können symptomatisch behandelt werden), Muskelschwäche in den Beinen oder Lymphödeme.
In Einzelfällen wurde über Harnwegsobstruktionen und Kompressionen der Wirbelsäule berichtet, die zur Paralyse (eventuell mit fatalem Ausgang) führen können. Patienten mit drohenden neurologischen Komplikationen, Wirbelsäulenmetastasen oder Harnwegsobstruktion sollten daher während der ersten Behandlungswochen unter ständiger, möglichst stationärer Überwachung stehen.
Die zusätzliche Gabe eines geeigneten Antiandrogens kann in der Initialphase der Behandlung in Betracht gezogen werden, um mögliche Folgeerscheinungen des initialen Testosteronspiegelanstiegs und eine Verschlechterung der klinischen Symptomatik abzuschwächen.
Die anfängliche Zunahme der Beschwerden bildet sich üblicherweise spontan zurück, ohne dass Leuprorelin Sandoz 3 Monate abgesetzt werden muss. Nachfolgend kommt es zu Symptomen des Testosteronentzugs (vgl. «Unerwünschte Wirkungen»).
Um ein Escape in der 2. Hälfte des Behandlungsintervalls auszuschliessen, insbesondere wenn die erwartete klinische und biochemische Wirkung nicht erreicht scheint (z.B. bei Besserung der Kastrationsnebenwirkungen oder Hinweisen auf Tumorprogression), sind periodische Bestimmungen der Serum-Testosteronspiegel und des prostataspezifischen Antigens anzuraten. Nach chirurgischer Kastration bewirkt Leuprorelin Sandoz keine weitere Absenkung des Testosteronspiegels.
Interaktionen
Bis jetzt keine bekannt.
Es wurden keine Interaktionsstudien mit Leuprorelin Sandoz durchgeführt. Der Metabolismus von Leuprorelinacetat lässt Interaktionen jedoch selten erwarten, da Leuprorelin überwiegend durch Peptidasen und nicht über das Cytochrom P450 abgebaut wird und nur eine geringe Plasmaproteinbindung von ca. 46% aufweist.
Prostatakrebs
Da eine Androgen-Deprivation eine QT-Verlängerung verursachen kann, sollte die gleichzeitige Verabreichung von Leuprorelinacetat mit Arzneimitteln, welche eine QT-Intervallverlängerung oder Torsades de pointes hervorrufen können, wie Antiarrhythmika der Klasse IA (z.B. Chinidin, Disopyramid) oder der Klasse III (z.B. Amiodaron, Sotalol, Dofetilid, Ibutilid), Methadon, Moxifloxacin, Antipsychotika, etc., sorgfältig abgewogen werden. Siehe «Warnhinweise und Vorsichtsmassnahmen», Effekte auf das QT-Intervall.
Schwangerschaft/Stillzeit
Es gibt keine Indikation von Leuprorelin Sandoz bei Frauen.
Leuprorelin ist kontraindiziert während der Schwangerschaft.
Es ist nicht bekannt, ob Leuprorelin in der Muttermilch ausgeschieden wird.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Leuprorelin Sandoz 3 Monate kann das Reaktionsvermögen herabsetzen, so dass die Fähigkeit zur aktiven Teilnahme am Strassenverkehr oder zum Bedienen von Maschinen beeinträchtigt werden könnte. Dies gilt in verstärktem Mass im Zusammenhang mit Alkohol.
Unerwünschte Wirkungen
Eine Therapie mit Leuprorelinacetat führt anfangs zu einem kurzfristigen Anstieg des Serumtestosteronspiegels, was zu einer vorübergehenden Verstärkung bestimmter Krankheitssymptome führen kann (Auftreten oder Zunahme von Knochenschmerzen, Harnwegsobstruktion und deren Folgen, Rückenmarkskompressionen, Muskelschwäche in den Beinen, Lymphödeme). Diese Zunahme der Beschwerden geht üblicherweise spontan zurück, ohne dass Leuprorelin Sandoz 3 Monate abgesetzt werden muss.
Die häufigsten unerwünschten Wirkungen bei Erwachsenen unter einer Behandlung mit Leuprorelinacetat sind Vasodilatation (57%) und Hitzewallungen (52%), vermehrtes Schwitzen (42%), verringerte Libido (47%) sowie Potenzstörungen (45%) und Gewichtszunahme (22%).
Nachfolgend werden die unerwünschten Wirkungen nach Organsystem angegeben, welche in klinischen Studien und während der Marktüberwachung unter Behandlung mit Leuprorelinacetat-Depotpräparaten beobachtet wurden. Die Häufigkeit sind dabei wie folgt definiert: sehr häufig (≥1/10); häufig (≥1/100 bis <1/10); gelegentlich (≥1/1000 bis <1/100); selten (≥1/10'000 bis <1/1000); sehr selten (<1/10'000), nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar.
Infektionen und parasitäre Erkrankungen:
Häufig: Infektionen der Atemwege, Pharyngitis, Harnwegsinfekt, Bronchitis.
Gelegentlich: Candidose, Pilzinfektion auf der Haut, Rhinitis.
Nicht bekannt: Pneumonie.
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen):
Nicht bekannt: Karzinome der Haut/Ohren.
Erkrankungen des Blutes und des Lymphsystems:
Häufig: Anämie.
Gelegentlich: erhöhte Retikulozyten.
Nicht bekannt: Erhöhung oder Erniedrigung der Leukozytenwerte, erniedrigte Thrombozytenzahl, verlängerte Prothrombinzeit, verlängerte partielle Thromboplastinzeit.
Erkrankungen des Immunsystems:
Gelegentlich: Überempfindlichkeitsreaktionen (z.B. mit Fieber, Pruritus, Eosinophilie, Hautauschlag).
Nicht bekannt: anaphylaktische Reaktionen.
Endokrine Erkrankungen:
Nicht bekannt: Hypophyseninfarkt (vgl. «Warnhinweise und Vorsichtsmassnahmen»), Schilddrüsenvergrösserung.
Stoffwechsel- und Ernährungsstörungen:
Sehr häufig: Gewichtszunahme (22%).
Häufig: Anorexie, gesteigerter Appetit, verminderter Appetit, Gewichtsabnahme, Hyperglykämie, vermehrtes Durstgefühl, Hypercalciämie.
Gelegentlich: Hypoglykämie, Dehydration.
Nicht bekannt: Diabetes mellitus, Harnstofferhöhung, Hyperurikämie, Hyperlipidämie (Gesamtcholesterol, LDL-Cholesterol, Triglyceride), Hyperphosphatämie, Hypoproteinämie, erhöhtes Kreatinin, Hypokaliämie, erhöhtes BUN.
Psychiatrische Erkrankungen:
Sehr häufig: verringerte Libido (47%), Schlaflosigkeit.
Häufig: Schlafstörungen, Angst, Schläfrigkeit, Stimmungsschwankungen, Depression, Nervosität, emotionale Labilität.
Gelegentlich: Wahnvorstellungen.
Nicht bekannt: gesteigerte Libido, Suizidalität.
Erkrankungen des Nervensystems:
Häufig: Parästhesien, Hypästhesien, Tremor, Kopfschmerzen, Schwindel.
Gelegentlich: Geschmacksstörungen, Gedächtnisstörungen (Amnesie), Gangstörung.
Nicht bekannt: Lethargie, periphere Neuropathie, neuromuskuläre Störungen, Benommenheit, Neuromyopathie, Bewusstseinverlust, transitorische ischämische Attacke, Apoplexie.
Sehr selten wurde das Auftreten von Krampfanfällen berichtet.
Augenerkrankungen:
Häufig: Sehstörungen (z.B Verschwommensehen), Amblyopie.
Nicht bekannt: trockene Augen, sonstige ophtalmologische Störungen.
Erkrankungen des Ohrs und des Labyrinths:
Häufig: Tinnitus, Ohrenschmerzen.
Nicht bekannt: Hörstörungen, beeinträchtigtes Hörvermögen.
Herzerkrankungen:
Häufig: Angina pectoris, Tachykardie, Arrhythmien, ventrikuläre Extrasystolen.
Gelegentlich: Herzinsuffizienz, Bradykardie
Nicht bekannt: QT-Verlängerungen (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»), EKG-Veränderungen (z.B. Zeichen einer myokardialen Ischämie), Herzgeräusche, Palpitationen, Myokardinfarkt, AV-Block, plötzlicher Herztod (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Gefässerkrankungen:
Sehr häufig: Hitzewallungen (52%), Vasodilatation (57%).
Häufig: Thrombophlebitis, Lymphödem, Hypertonie, Synkope.
Gelegentlich: periphere Zirkulationsstörung
Nicht bekannt: Thrombose, Lungenembolie, Hypotonie, Varikosenschmerz, Schlaganfall.
Ausserdem existiert ein Einzelfallbericht über einen Patienten mit einer Thrombose der zentralen Netzhautarterie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums:
Häufig: Husten, Dyspnoe, Epistaxis, Hämoptysen, Asthma bronchiale, akutes Lungenödem, Lungenemphysem.
Gelegentlich: chronisch-obstruktive Lungenerkrankung.
Nicht bekannt: Pleurareiben, Lungeninfiltration, Lungenfibrose, Nasennebenhöhlenverstopfung, pleurale Effusion, interstitielle Lungenerkrankung.
Erkrankungen des Gastrointestinaltrakts:
Häufig: Mundtrockenheit, Flatulenz, Obstipation, Diarrhö, Übelkeit, Erbrechen, Abdominalschmerzen, Gastritis.
Nicht bekannt: gastroduodenale Ulcera, Dysphagie, gastrointestinale Blutung, rektale Polypen, peptische Ulcera, harte Knötchen im Rachen
Leber- und Gallenerkrankungen:
Sehr häufig: Erhöhung der AST (20%), Erhöhung der LDH im Serum (29%).
Häufig: Leberfunktionsstörungen (z.B. Erhöhung der ALT, Erhöhung der Gamma-GT).
Gelegentlich: hepatozelluläre Schädigung, cholestatische Hepatitis.
Nicht bekannt: schwere Leberschädigung, Hyperbilirubinämie, Ikterus.
Erkrankungen der Haut und des Unterhautzellgewebes:
Häufig: trockene Haut, Hautauschlag (einschliesslich makulopapulösem Exanthem), Pruritus, Urtikaria, Haarveränderungen (insbesondere Zu- oder Abnahme der Körperbehaarung), Alopezie, Ekchymosen, Pigmentierungsstörungen.
Gelegentlich: Photosensitivitätsreaktionen, trockene Schleimhäute.
Nicht bekannt: Dermatitis, Hautläsionen, Knötchen.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen:
Sehr häufig: Knochenschmerzen (14%).
Häufig: Gelenkschmerzen (Arthralgien), Rückenschmerzen, Muskelschwäche, Schmerzen in den Extremitäten, Myalgie, Muskelkrämpfe.
Nicht bekannt: Reduktion der Knochendichte, Beckenfibrose, Gelenkstörungen (Arthropathie), Paralyse, Spinalfraktur, ankylosierende Spondylitis, Tenosynovitis, Knochenschwellung, Gliederschmerzen.
Bei einer Langzeittherapie (6–12 Monate) wurde darüber hinaus über eine Osteoporose berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen der Nieren und Harnwege:
Sehr häufig: Nykturie (17%).
Häufig: Dysurie, Pollakisurie, Hämaturie.
Gelegentlich: Harninkontinenz, Polyurie, Miktionsstörungen, Harnretention, Proteinurie.
Nicht bekannt: vermehrter Harndrang, Spasmen der Harnblase, Harnwegsobstruktion
Erkrankungen der Geschlechtsorgane und der Brustdrüse:
Sehr häufig: Potenzstörungen (45%).
Häufig: Gynäkomastie, Hodenatrophie, PSA-Erhöhung.
Sehr selten: Brustschmerzen/-spannung/-überempfindlichkeit, Penisschwellung.
Nicht bekannt: Prostataschmerzen, Hodenschmerz.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Sehr häufig: vermehrtes Schwitzen (42%), Reaktionen an der Injektionsstelle (13%), z.B. Rötungen, Schmerzen, Ödeme, Juckreiz, Infektionen, die sich in der Regel auch bei fortgesetzter Behandlung zurückbilden, Müdigkeit/Asthenie (13%), periphere Ödeme (12%).
Häufig: Entzündungen an der Injektionsstelle (inkl. Abszesse), Frösteln, generelle Schmerzen, Schwellung (Schläfenknochen), Hypersensitivitätsreaktionen, Fieber, Unwohlsein, Schweissausbrüche, Nachtschweiss, Schüttelfrost und generelle grippeartige Symptome.
Überdosierung
Intoxikationssymptome wurden bisher nicht beobachtet.
In klinischen Studien mit Leuprorelinacetat-Depotpräperaten wurden bei Erwachsenen Dosen bis zu 20 mg/Tag über zwei Jahre verabreicht. Die unerwünschten Wirkungen unter dieser hohen Dosierung unterschieden sich nicht von jenen unter Applikation von 1 mg/Tag.
Im Fall einer Überdosierung sollte der Patient überwacht werden. Gegebenenfalls sind symptomatische und supportive Massnahmen unter ärztlicher Kontrolle angezeigt.
Eigenschaften/Wirkungen
ATC-Code: L02AE02
Wirkungsmechanismus und Pharmakodynamik
Der Wirkstoff Leuprorelinacetat ist ein synthetisches Analogon des natürlich vorkommenden Gonadotropin-Releasing-Hormons (GnRH), das die Freisetzung der gonadotropen Hormone LH und FSH aus dem Hypophysenvorderlappen kontrolliert. Diese Hormone stimulieren ihrerseits die testikuläre Steroidsynthese.
Im Gegensatz zum physiologischen GnRH, das pulsatil vom Hypothalamus freigesetzt wird, blockiert Leuprorelinacetat bei therapeutischer Daueranwendung die GnRH-Rezeptoren der Hypophyse kontinuierlich und verursacht nach einer initialen kurzfristigen Stimulation deren Down-Regulation. Bei Erwachsenen kommt es als Folge nach drei bis vier Wochen zu einer reversiblen hypophysären Suppression der Freisetzung der gonadotropen Hormone LH und FSH mit nachfolgendem Abfall der Serumkonzentration von Testosteron und dessen Metabolit Dihydrotestosteron. Der Abfall des Dihydrotestosteronspiegels führt zu einer Wachstumsehmmung des karzinomatös veränderten Prostatagewebes, welches normalerweise durch dieses stimuliert wird.
Die kontinuierliche Applikation von Leuprorelinacetat führt zu einer Abnahme der Anzahl und/oder der Empfindlichkeit (sogenannte «down regulation») der in der Hypophyse vorhandenen Rezeptoren und in der Folge zu Abfall der LH-, FSH- und DHT-Spiegel. Der Testosteronspiegel wird dabei in den Kastrationsbereich abgesenkt.
Langzeitstudien
Die Datenlage zur Verabreichung von 2 Injektionen Leuprorelin Sandoz 3 Monate ist beschränkt; es liegen keine Daten zu mehr als 2 Injektionen vor.
Die therapeutische Wirksamkeit von zwei aufeinander folgenden Dosierungen von Leuprorelin Sandoz 3 Monate wurde in zwei Phase III-Studien an Patienten mit fortgeschrittenem Prostatakarzinom mit einem Intervall von 12 Wochen (Studie 005) bzw. 16 Wochen (Studie 006) evaluiert.
Die Studien wurden an insgesamt 34 Patienten (18 Patienten in Studie 005 und 16 Patienten in Studie 006) durchgeführt. Die Daten dieser Patientengruppe standen für eine Auswertung der Sicherheit und ITT-Analyse (intention to treat) zur Verfügung. In die PP-Analyse (per protocol) wurden 30 Patienten einbezogen, jeweils 15 Patienten aus Studie 005 und 15 Patienten aus Studie 006.
Tabelle 1: Studienpopulation der Leuprorelin Sandoz 3 Monate Studien mit Zweifach-Applikation
Population | Anzahl Patienten | |
Studie 005 | Studie 006 | |
Gesamtheit der behandelten Patienten = intention to treat (ITT) | 18 | 16 |
Schwerwiegende Abweichungen vom Protokoll | 3 | 1 |
Per protocol Population = Anzahl Patienten mit zwei Applikationen (% ITT) | 15 (83) | 15 (94) |
Anteil der Patienten mit erfolgreicher Testosteronsuppression nach acht Wochen
Es ergeben sich vergleichbare Wirksamkeitsraten in beiden Studien (005 und 006) mit einer Suppressionsrate von 100% in der PP-Gruppe. In der ITT-Gruppe konnte nur bei einem einzelnen Patienten in Studie 005 keine Suppression festgestellt werden.
Patienten mit Testosteronwerten ≤0,5 ng/ml in der 12. bzw. 16. Woche sowie der 24. bzw. 32. Woche
Tabelle 2: Patienten mit Testosteronwerten ≤0,5 ng/ml in der 12. bzw. 16. Woche sowie der 24. bzw. 32. Woche (Studien 005 und 006)
Behandlung | N | Anzahl Patienten | 95% CI | |||
Erfolgreich | Nicht Erfolgreich | [%] | ||||
PP | N | % | N | % | ||
Studie 005/Woche 12 | 15 | 14 | 93 | 1 | 7 | 68,1 bis 99,8 |
Studie 005/Woche 24 | 15 | 14 | 93 | 1 | 7 | 68,1 bis 99,8 |
Studie 006/Woche 16 | 15 | 15 | 100 | 0 | 0 | 78,2 bis 100 |
Studie 006/Woche 32 | 15 | 15 | 100 | 0 | 0 | 78,2 bis 100 |
ITT | N | % | N | % | ||
Studie 005/Woche 12 | 18 | 15 | 83 | 3 | 17 | 58,6 bis 96,4 |
Studie 005/Woche 24 | 18 | 14 | 78 | 4 | 22 | 52,4 bis 93,6 |
Studie 006/Woche 16 | 16 | 15 | 94 | 1 | 6 | 69,8 bis 99,8 |
Studie 006/Woche 32 | 16 | 15 | 94 | 1 | 6 | 69,8 bis 99,8 |
In einer Postmarketing-Studie wurde der Therapieverlauf von 3 Injektionen mit Leuprorelin-1-Monatsdepot oder 3-Monatsdepot dokumentiert. In die Studiendatenbank gingen 818 Patientendokumentationen ein, die alle für die statistische Analyse herangezogen werden konnten. Folgende Aufnahmebedingungen mussten erfüllt sein: 1) Vorliegen eines fortgeschrittenen hormonabhängigen Prostatakarzinoms und 2) Vorbehandlung mit Leuprorelin bzw. einem anderen GnRH-Agonisten.
Der therapeutische Effekt von Leuprorelin wurde anhand der Veränderung der PSA- und Testosteronwerte nach 3 Applikationen beurteilt. Als Response wurden Serum-Testosteron-Werte ≤0,5 ng/ml und PSA-Werte ≤4 ng/ml angesehen.
Tabelle 3: Anzahl (%) der Patienten mit PSA-Werten ≤4 ng/ml
Untersuchungszeitpunkt | Auswertung 1 | Auswertung 2 | ||||
N | n | % | N | n | % | |
U1 | 773 | 411 | 53,2 | 644 | 342 | 53,1 |
U2 | 644 | 512 | 79,5 | 644 | 512 | 79,5 |
U3 | 736 | 626 | 85,1 | 644 | 549 | 85,2 |
Tabelle 4: Anzahl (%) der Patienten mit Serum-Testosteron-Werten ≤0,5 ng/ml
Untersuchungszeitpunkt | Auswertung 1 | Auswertung 2 | ||||
N | n | % | N | n | % | |
U1 | 288 | 145 | 50,3 | 225 | 113 | 50,2 |
U2 | 225 | 162 | 72,0 | 225 | 162 | 72,0 |
U3 | 257 | 203 | 79,0 | 225 | 180 | 80,0 |
Pharmakokinetik
Absorption
Nach der Injektion des Implantats wird Leuprorelinacetat kontinuierlich aus dem Milchsäurepolymer über einen Zeitraum bis zu 182 Tagen (26 Wochen) freigesetzt. Das Polymer wird dabei wie chirurgisches Nahtmaterial resorbiert.
Nach Applikation einer subkutanen Einzeldosis von Leuprorelin Sandoz 3 Monate bei gesunden Probanden wurden innerhalb von 2 Stunden maximale Leuprorelin-Serumspiegel von 5216 pg/ml (5,2 ng/ml) gemessen, nach 24 Stunden noch 20% von Cmax und nach 21 Tagen nur noch 5 oder 6% von Cmax.
Die AUC betrug während einer 3-monatigen Behandlung mit Leuprorelin Sandoz 3 Monate 32,4 ng/ml*d. Nachweisbare Spiegel im Serum können bis 182 Tage (26 Wochen) nach Applikation vorliegen.
Distribution/Metabolismus/Elimination
Distribution, Metabolismus und Elimination von Leuprorelinacetat wurden im Menschen nicht vollständig abgeklärt.
Bei wiederholter Gabe kommt es zu einer anhaltenden Senkung des Testosteronspiegels in den Kastrationsbereich, ohne dass der Testosteronspiegel wie nach erstmaliger Injektion einen vorübergehenden Anstieg zeigt.
Kinetik spezieller Patientengruppen
Kinder/ Jugendliche: Es liegen keine Daten zur Pharmakokinetik von Leuprorelin Sandoz 3 Monate bei Kindern und Jugendlichen vor.
Ältere Patienten: Die Pharmakokokinetik bei älteren Patienten unterscheidet sich nicht in relevanter Weise von jener bei jüngeren Erwachsenen.
Leber- und Niereninsuffizienz: Bei Patienten mit eingeschränkter Nierenfunktion wurden teilweise höhere Serumspiegel an Leuprorelinacetat gemessen, bei Patienten mit eingeschränkter Leberfunktion dagegen verminderte Werte. Die klinische Signifikanz dieser Beobachtung ist unbekannt.
Präklinische Daten
Mutagenität
Untersuchungen zur Mutagenität (in vitro und in vivo) haben keine Zeichen eines mutagenen Potentials von Leuprorelin erkennen lassen.
Karzinogenität
In Karzinogenitätsstudien wurden Mäuse und Ratten während 2 Jahren mit Leuprorelin behandelt. Nach 24 Monaten konnte bei Ratten nach subkutaner Verabreichung von 0,6 bis 4 mg/kg eine dosisabhängige Zunahme von gutartigen hypophysären Hyperplasien und Adenomen beobachtet werden. Weiterhin wurde eine dosisunabhängige Zunahme von Adenomen der Hodenzwischenzellen bei männlichen Tieren festgestellt. Bei Mäusen verursachten Dosierungen bis zu 60 mg/kg, welche ebenfalls während 2 Jahren verabreicht wurden, keine durch Leuprorelin induzierte Tumore oder Anomalien der Hypophyse.
Reproduktionstoxizität
Untersuchungen mit subkutaner Verabreichung von Leuprorelin an Ratten bei Dosen bis 10 µg/kg und an Kaninchen bei Dosen bis 1 µg/kg haben keine Hinweise auf ein teratogenes Potential ergeben. Embryotoxische/embryoletale Wirkungen wurden bei der Ratte bei einer Dosis von 10 µg/kg und beim Kaninchen bei Dosen über 0,1 µg/kg beobachtet.
Sonstige Hinweise
Inkompatibilitäten
Bis jetzt keine bekannt.
Beeinflussung diagnostischer Methoden
Abnormale Leberfunktionstests.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung, im verschlossenen Sterilbeutel, nicht über 30 °C und ausser Reichweite von Kindern lagern.
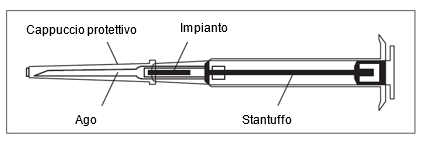
Hinweise für die Handhabung
| ||
| ||
| ||
Bitte beachten: Der Kolben lässt sich zur Injektion des Implantats nur dann nach vorne schieben, wenn er zuvor vollständig zurückgezogen wurde! | ||
| ||
| ||
|
| |
|
| |
| ||
|
| |
Zulassungsnummer
57141 (Swissmedic).
Zulassungsinhaberin
Sandoz Pharmaceuticals AG, Risch; Domizil: Rotkreuz.
Stand der Information
Mai 2019.
Composizione
Principio attivo: Leuprorelinum ut leuprorelini acetas.
Sostanze ausiliarie: Acidum polylacticum pro praeparatione.
Forma farmaceutica e quantità di principio attivo per unità
Una siringa preriempita con un impianto contiene 5 mg di Leuprorelinum ut leuprorelini acetas.
Indicazioni/Possibilità d'impiego
Trattamento sintomatico del carcinoma della prostata ormono-dipendente avanzato. Come trattamento alternativo se l'orchiectomia o l'impiego di estrogeni non sono indicati per il paziente o non sono accettabili.
Posologia/Impiego
Posologia abituale
La dose raccomandata è 5 mg di leuprorelina in dose singola ogni 3 mesi.
Modo di somministrazione
L'impianto viene inserito sotto la cute (per via sottocutanea) nella regione addominale, scegliendo ogni volta una sede di iniezione diversa.
L'uso di Leuproréline Sandoz è destinato esclusivamente ai pazienti adulti di sesso maschile e deve avvenire esclusivamente sotto la supervisione di un medico esperto nella terapia dei tumori.
Per la fase iniziale del trattamento, deve essere presa in considerazione la somministrazione concomitante di un antiandrogeno appropriato al fine di attenuare le possibili conseguenze dell'aumento iniziale del livello di testosterone e il transitorio peggioramento della sintomatologia clinica.
La risposta al trattamento con leuprorelina acetato viene controllata misurando il livello di testosterone sierico e di antigene prostatico specifico (PSA).
Istruzioni posologiche speciali
Bambini/adolescenti: l'efficacia e la sicurezza di Leuproréline Sandoz 3 mesi nei bambini e adolescenti non sono state studiate.
Pazienti anziani: non è necessario alcun aggiustamento della dose in funzione dell'età.
Insufficienza epatica e renale: non è necessario alcun aggiustamento della dose (vedere «Farmacocinetica»)
Controindicazioni
Ipersensibilità al principio attivo, sotto forma di nonapeptide o decapeptide, o alla sostanza ausiliaria secondo la composizione.
Leuproréline Sandoz non è indicato in presenza di accertata ormonoindipendenza del carcinoma.
Avvertenze e misure precauzionali
Reazioni di ipersensibilità
Durante il trattamento con agonisti del GnRH sono state osservate reazioni allergiche e anafilattiche. Queste possono comprendere reazioni di ipersensibilità nella sede di iniezione e sintomi sistemici.
Se le reazioni locali sono marcate, ciò può compromettere l'assorbimento della leuprorelina dal depot. In tal caso si deve controllare il livello di testosterone.
Apoplessia ipofisaria:
Nell'ambito del monitoraggio post-commercializzazione, dopo somministrazione di agonisti dell'ormone di rilascio delle gonadotropine (GnRH) raramente sono stati riferiti casi di apoplessia ipofisaria (sindrome clinica secondaria di un infarto dell'ipofisi). Nella maggior parte dei casi è stato diagnosticato un adenoma ipofisario. Questi casi di apoplessia ipofisaria si sono manifestati per lo più nell'arco di 2 settimane, alcuni nell'arco della prima ora, dopo somministrazione della prima dose. In tali casi, l'apoplessia ipofisaria si è manifestata con improvvisa comparsa di cefalea, vomito, disturbi visivi, oftalmoplegia, alterazione dello stato mentale e talvolta collasso cardiovascolare. È stato necessario consultare immediatamente un medico.
Per questo motivo, in presenza di adenoma ipofisario noto, non si deve somministrare un agonista del GnRH.
Depressione e rischio di suicidio: nei pazienti in trattamento con agonisti del GnRH sussiste un rischio più elevato di insorgenza di depressione (che può essere grave).
I pazienti con preesistente depressione possono essere a rischio di suicidio.
Densità ossea/rischio di fratture ossee: la presenza di bassi livelli di estrogeno può alterare la densità ossea.
La riduzione della densità ossea dopo sospensione della terapia con Leuproréline Sandoz 3 mesi può essere reversibile.
Il deficit di androgeni conseguente al trattamento del carcinoma prostatico può aumentare il rischio di fratture ossee.
Crisi convulsive: in ambito della sorveglianza post–commercializzazione sono stati segnalati casi di crisi convulsive. In parte si è trattato di pazienti con altri fattori di rischio per crisi convulsive (come, ad esempio, epilessia pregressa, tumori intracranici, trattamento concomitante con medicamenti con rischio noto per crisi convulsive). Tuttavia, sono stati riferiti anche casi di pazienti senza tali fattori di rischio.
Fattori di rischio cardiovascolari/per malattie cardiovascolari
Durante la terapia con agonisti del GnRH è stato riferito un aumentato rischio di diabete mellito e/o di eventi cardiovascolari. In particolare, diversi studi epidemiologici su popolazioni numerose di pazienti affetti da carcinoma della prostata hanno rilevato un aumento di circa il 20% del rischio di infarto miocardico e ictus. Nei pazienti con presenza di altri fattori di rischio cardiovascolare (ad es. ipertensione, iperlipidemia) e con patologie cardiovascolari pregresse, prima di iniziare il trattamento con leuprorelina si deve valutare con particolare attenzione il rapporto rischio-beneficio.
Prima di iniziare il trattamento con leuprorelina si deve effettuare un controllo della pressione arteriosa, dei livelli ematici di glicemia e del profilo lipidico. Durante il trattamento, i pazienti devono essere tenuti sotto sorveglianza per tali fattori di rischio e anche per l'insorgenza di possibili sintomi di sospetta malattia cardiovascolare. Un trattamento adeguato, vale a dire in conformità con le rispettive linee guida, è richiesto in presenza di preesistenti fattori di rischio (diabete, ipercolesterolemia, ipertensione).
Effetti sull'intervallo QT
La terapia di deprivazione androgenica può prolungare l'intervallo QT. Nei pazienti con prolungamento dell'intervallo QT nell'anamnesi o con fattori di rischio per tale anomalia cardiaca, come anche nei pazienti in terapia con medicamenti concomitanti che possono prolungare l'intervallo QT (vedere «Interazioni»), prima di iniziare il trattamento con leuprorelina acetato si deve valutare il rapporto rischio-beneficio, inclusa la possibilità di insorgenza di torsioni di punta.
Con riferimento all'impiego di agonisti del GnRH, negli uomini è stato riferito anche un maggior rischio di morte cardiaca improvvisa.
Se le reazioni locali sono marcate, ciò può compromettere l'assorbimento della leuprorelina dal depot. In tal caso si deve controllare il livello dell'ormone.
Carcinoma della prostata
Nel corso delle prime settimane di trattamento con Leuproréline Sandoz 3 mesi, si ha un incremento, di breve durata, del testosterone sierico, che può causare a sua volta un transitorio peggioramento della sintomatologia clinica, come ad esempio aumentato dolore osseo (può essere instaurato un trattamento di tipo sintomatico), debolezza muscolare agli arti inferiori o linfedema.
Sono stati riferiti singoli casi di ostruzione delle vie urinarie e compressione midollare, che può contribuire alla paralisi (potenzialmente letale). Ciò giustifica, quindi, un costante monitoraggio, meglio se in condizioni di ricovero, dei pazienti con rischio di complicanze neurologiche, metastasi vertebrali od ostruzione delle vie urinarie durante le prime settimane di trattamento.
Nelle prime fasi del trattamento si può considerare l'associazione di un antiandrogeno idoneo per contrastare le possibili conseguenze dell'iniziale innalzamento della testosteronemia e un peggioramento della sintomatologia clinica.
L'iniziale peggioramento dei disturbi regredisce di solito spontaneamente senza la necessità di sospendere il trattamento con Leuproréline Sandoz 3 mesi. Successivamente si hanno i sintomi della soppressione della secrezione testosteronica (vedere «Effetti indesiderati»).
Per escludere il fenomeno del cosiddetto «escape» nella seconda metà del periodo di trattamento, in particolare quando non si raggiunge apparentemente l'effetto clinico e biochimico atteso (ad es. miglioramento degli effetti collaterali della castrazione o segni di progressione del tumore), è consigliabile controllare periodicamente i livelli di testosterone sierico e del PSA. Secondariamente alla castrazione chirurgica, Leuproréline Sandoz non induce alcun ulteriore abbassamento della testosteronemia.
Interazioni
Non sono note al momento interazioni.
Non sono stati condotti studi di interazione tra Leuproréline Sandoz e altri medicamenti. Tuttavia, tenuto conto del metabolismo della leuprorelina acetato, si prevedono solo raramente interazioni, poiché la leuprorelina è degradata dalle peptidasi e non dal citocromo P450 e mostra solo una modesta formazione di proteine plasmatiche (circa il 46%).
Carcinoma della prostata
Poiché il trattamento di deprivazione androgenica può indurre un prolungamento dell'intervallo QT, l'uso concomitante di leuprorelina acetato con altri medicamenti noti per prolungare l'intervallo QT o in grado di indurre torsioni di punta, come gli antiaritmici di classe IA (ad es. chinidina, disopiramide) o di classe III (ad es. amiodarone, sotalolo, dofetilide, ibutilide), metadone, moxifloxacina, antipsicotici, ecc. richiede un'attenta valutazione. Vedere «Avvertenze e misure precauzionali», Effetti sull'intervallo QT.
Gravidanza/Allattamento
Non vi è alcuna indicazione circa l'uso di Leuproréline Sandoz nelle donne.
Leuprorelin è controindicato per l'utilizzo in gravidanza.
Non è noto se la leuprorelina venga escreta nel latte materno.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Leuproréline Sandoz 3 mesi può rallentare i riflessi, per cui potrebbe alterare la capacità di avere un ruolo attivo nella circolazione stradale o di usare macchine. Ciò vale in maggior misura in concomitanza all'assunzione di alcool.
Effetti indesiderati
La terapia con leuprorelina acetato induce inizialmente un incremento, di breve durata, del testosterone sierico, che può causare a sua volta un transitorio peggioramento della sintomatologia clinica (insorgenza o peggioramento di dolore osseo, ostruzione delle vie urinarie e relative conseguenze, compressioni midollari, debolezza muscolare agli arti inferiori, linfedema). Questo peggioramento dei disturbi regredisce di solito spontaneamente senza la necessità di sospendere il trattamento con Leuproréline Sandoz 3 mesi.
Gli effetti indesiderati più comuni osservati negli adulti trattati con leuprorelina acetato sono vasodilatazione (57%) e vampate di calore (52%), aumento della sudorazione (42%), diminuzione della libido (47%), disfunzione erettile (45%) e aumento ponderale (22%).
Si riportano di seguito gli effetti indesiderati classificati per sistemi e organi, che sono stati osservati negli studi clinici e durante la sorveglianza post-commercializzazione in corso di terapia con formulazioni depot contenenti leuprorelina acetato. La frequenza è definita come: molto comune (≥1/10), comune (≥1/100 fino a <1/10), non comune (≥1/1000 fino a <1/100), raro (≥1/10'000 fino a <1/1000), molto raro (<1/10'000), non nota: la frequenza non può essere definita sulla base dei dati disponibili.
Infezioni ed infestazioni:
Comune: infezioni delle vie respiratorie, faringite, infezioni delle vie urinarie, bronchite.
Non comune: candidosi, micosi cutanea, rinite.
Non nota: polmonite.
Tumori benigni, maligni e non specificati (cisti e polipi compresi):
Non nota: carcinomi della cute/orecchio.
Patologie del sistema emolinfopoietico:
Comune: anemia.
Non comune: innalzamento dei reticolociti.
Non nota: innalzamento o diminuzione dei livelli dei leucociti, diminuzione dei livelli dei trombociti, prolungamento del tempo di protrombina, prolungamento del tempo di tromboplastina parziale.
Disturbi del sistema immunitario:
Non comune: reazioni di ipersensibilità (ad es. con febbre, prurito, eosinofilia, eruzione cutanea).
Non nota: reazioni anafilattiche.
Patologie endocrine:
Non nota: infarto dell'ipofisi (vedere «Avvertenze e misure precauzionali»), iperplasia tiroidea.
Disturbi del metabolismo e della nutrizione:
Molto comune: aumento ponderale (22%).
Comune: anoressia, aumento dell'appetito, riduzione dell'appetito, calo ponderale, iperglicemia, aumento della sete, ipercalcemia.
Non comune: ipoglicemia, disidratazione.
Non nota: diabete mellito, aumento dell'urea, iperuricemia, iperlipidemia (colesterolo totale, colesterolo LDL, trigliceridi), iperfosfatemia, ipoproteinemia, innalzamento della creatinina, ipopotassiemia, innalzamento del BUN.
Disturbi psichiatrici:
Molto comune: diminuzione della libido (47%), insonnia.
Comune: disturbi del sonno, ansia, sonnolenza, sbalzi d'umore, depressione, nervosismo, labilità emotiva.
Non comune: deliri.
Non nota: aumento della libido, suicidalità.
Patologie del sistema nervoso:
Comune: parestesie, ipoestesie, tremore, cefalea, vertigini.
Non comune: disgeusia, disturbi del pensiero (amnesia), disturbo della deambulazione.
Non nota: letargia, neuropatia periferica, disturbi neuromuscolari, stordimento, neuromiopatia, perdita di coscienza, attacchi ischemici transitori, apoplessia.
Molto raramente è stata riferita l'insorgenza di crisi convulsive.
Patologie dell'occhio:
Comune: disturbi visivi (ad es. vista annebbiata), ambliopia.
Non nota: sindrome dell'occhio secco, altri disturbi oftalmologici.
Patologie dell'orecchio e del labirinto:
Comune: tinnito, dolore alle orecchie.
Non nota: disturbi uditivi, compromissione dell'udito.
Patologie cardiache:
Comune: angina pectoris, tachicardia, aritmie, extrasistole ventricolari.
Non comune: insufficienza cardiaca, bradicardia.
Non nota: prolungamento dell'intervallo QT (vedere «Avvertenze e misure precauzionali» e «Interazioni»), alterazioni all'ECG (ad es. segni di ischemia miocardica), rumori cardiaci, palpitazioni, infarto miocardico, blocco atrioventricolare, morte cardiaca improvvisa (cfr. «Avvertenze e misure precauzionali»).
Patologie vascolari:
Molto comune: vampate di calore (52%), vasodilatazione (57%).
Comune: tromboflebite, linfedema, ipertensione, sincope.
Non comune: disturbo circolatorio periferico.
Non nota: trombosi, embolia polmonare, ipotensione, dolore lungo una vena varicosa, ictus.
È stato, inoltre, riferito il caso di un paziente con trombosi dell'arteria centrale della retina.
Patologie respiratorie, toraciche e mediastiniche:
Comune: tosse, dispnea, epistassi, emottisi, asma bronchiale, edema polmonare acuto, enfisema polmonare.
Non comune: broncopneumopatia cronica ostruttiva.
Non nota: pleurite, infiltrato polmonare, fibrosi polmonare, ostruzione dei seni paranasali, effusione pleurica, malattia polmonare interstiziale.
Patologie gastrointestinali:
Comune: secchezza delle fauci, flatulenza, costipazione, diarrea, nausea, vomito, dolore addominale, gastrite.
Non nota: ulcera gastroduodenale, disfagia, emorragia gastrointestinale, polipi rettali, ulcera peptica, noduli duri in gola.
Patologie epatobiliari:
Molto comune: innalzamento dell'AST (20%), innalzamento dell'LDH nel siero (29%).
Comune: disturbi della funzione epatica (ad es. innalzamento dell'ALT, innalzamento della gamma GT).
Non comune: danno epatocellulare, epatite colestatica.
Non nota: danno epatico grave, iperbilirubinemia, ittero.
Patologie della cute e del tessuto sottocutaneo:
Comune: cute secca, eruzione cutanea (incluso esantema maculopapuloso), prurito, orticaria, modificazioni dei capelli (in particolare maggiore crescita o caduta dei peli), alopecia, ecchimosi, disturbi della pigmentazione.
Non comune: reazioni di fotosensibilità, secchezza delle mucose.
Non nota: dermatite, lesioni cutanee, noduli.
Patologie del sistema muscoloscheletrico e del tessuto connettivo:
Molto comune: dolore osseo (14%).
Comune: dolore articolare (artralgie), dolori alla schiena, debolezza muscolare, dolore localizzato agli arti, mialgia, crampi muscolari.
Non nota: riduzione della densità ossea, fibrosi pelvica, disturbi articolari (artropatia), paralisi, frattura spinale, spondilite anchilosante, tenosinovite, gonfiore osseo, dolore articolare.
Nel corso di una terapia a lungo termine (6–12 mesi) è stata riferita inoltre l'insorgenza di osteoporosi (vedere «Avvertenze e misure precauzionali»).
Patologie renali e urinarie:
Molto comune: nicturia (17%).
Comune: disuria, pollachiuria, ematuria.
Non comune: incontinenza urinaria, poliuria, disturbi della minzione, ritenzione urinaria, proteinuria.
Non nota: aumento della minzione, spasmi vescicali, ostruzione delle vie urinarie.
Patologie dell'apparato riproduttivo e della mammella:
Molto comune: disfunzione erettile (45%).
Comune: ginecomastia, atrofia del testicolo, innalzamento del livello di PSA.
Molto raro: dolore/tensione/ipersensibilità delle mammelle, edema penieno.
Non nota: dolore prostatico, dolore localizzato al testicolo.
Patologie sistemiche e condizioni relative alla sede di somministrazione:
Molto comune: aumento della sudorazione (42%), reazioni nella sede di iniezione (13%), ad es. arrossamenti, dolore, edema, prurito, infezioni, che di solito regrediscono anche se si prosegue il trattamento, stanchezza/astenia (13%), edemi periferici (12%).
Comune: infiammazioni nella sede di iniezione (inclusi ascessi), brividi, dolore generalizzato, gonfiore (ossa temporali), reazioni di ipersensibilità, febbre, malessere, sudorazione, sudorazione notturna e sintomi simil-influenzali generici.
Posologia eccessiva
Non sono stati finora osservati sintomi di intossicazione.
Negli studi clinici con formulazioni depot contenenti leuprorelina acetato sono state somministrate a pazienti adulti dosi fino a 20 mg/die per un periodo di due anni. Gli effetti indesiderati osservati con un dosaggio così elevato non sono diversi da quelli riscontrati con la somministrazione di 1 mg/die.
In caso di sovradosaggio, il paziente deve essere monitorato. Se necessario si devono consigliare terapie sintomatiche e di supporto sotto controllo medico.
Proprietà/Effetti
Codice ATC: L02AE02
Meccanismo d'azione e farmacodinamica
La leuprorelina acetato è un analogo sintetico dell'ormone naturale di rilascio delle gonadotropine (GnRH), che regola il rilascio degli ormoni gonadotropi LH e FSH dai lobi anteriori dell'ipofisi. Questi ormoni stimolano, a loro volta, la sintesi degli steroidi testicolari.
A differenza del GnRH fisiologico, che viene secreto in maniera pulsatile dall'ipotalamo, la leuprorelina acetato utilizzata a lungo termine a scopo terapeutico induce il blocco continuo dei recettori del GnRH dell'ipofisi causando in questo modo un'iniziale stimolazione, di breve durata, della loro sottoregolazione. Negli adulti, dopo tre-quattro settimane, ciò determina una soppressione ipofisaria reversibile del rilascio degli ormoni gonadotropi LH e FSH con conseguente diminuzione del livello sierico del testosterone e del suo metabolita, il diidrotestosterone. La diminuzione del livello di diidrotestosterone inibisce la crescita del tessuto prostatico evolutosi in carcinomatoso, che normalmente viene stimolata da tale processo.
Il proseguimento del trattamento con leuprorelina acetato induce una diminuzione nel numero e/o nella sensibilità (cosiddetta «down regulation») dei recettori presenti nell'ipofisi e, conseguentemente, una diminuzione dei livelli di LH, FSH e DHT. Il livello di testosterone scende, quindi, a valori equivalenti a quelli osservati dopo castrazione.
Studi a lungo termine
I dati disponibili sulla somministrazione di 2 iniezioni di Leuproréline Sandoz 3 mesi sono limitati e non sono disponibili dati per il trattamento con più di 2 iniezioni.
L'efficacia terapeutica di due dosi consecutive di Leuproréline Sandoz 3 mesi è stata valutata nell'ambito di due studi di fase III su pazienti affetti da carcinoma prostatico avanzato con un intervallo tra le somministrazioni di 12 (studio 005) e 16 settimane (studio 006).
Gli studi sono stati condotti su un totale di 34 pazienti (18 nello studio 005 e 16 nello studio 006). I dati relativi a questo gruppo di pazienti sono disponibili per una valutazione della sicurezza e per l'analisi ITT (intention to treat). All'analisi PP (per protocol) sono stati ammessi 30 pazienti, equamente ripartiti tra lo studio 005 e lo studio 006.
Tabella 1: Popolazione partecipante agli studi con due somministrazioni di Leuproréline Sandoz 3 mesi
Popolazione | Numero di pazienti | |
Studio 005 | Studio 006 | |
Totale dei pazienti trattati = intention to treat (ITT) | 18 | 16 |
Gravi deviazioni rispetto al protocollo | 3 | 1 |
Popolazione per protocol (PP) = numero di pazienti che hanno ricevuto due somministrazioni (% ITT) | 15 (83) | 15 (94) |
Percentuale di pazienti con riuscita soppressione della secrezione testosteronica dopo otto settimane
Le percentuali di efficacia sono comparabili in entrambi gli studi (005 e 006) con una soppressione della secrezione testosteronica del 100% nel gruppo PP. Nel gruppo ITT non è stato possibile stabilire alcuna soppressione solamente in un paziente dello studio 005.
Pazienti con livelli di testosterone ≤0,5 ng/ml alle settimane 12 e 16 e 24 e 32 settimana.
Tabella 2: Pazienti con livelli di testosterone ≤0,5 ng/ml alle settimane 12 e 16 e 24 e 32 settimana. (studi 005 e 006)
Trattamento | N | Numero di pazienti | IC 95% | |||
Successo | Insuccesso | [%] | ||||
PP | N | % | N | % | ||
Studio 005/settimana 12 | 15 | 14 | 93 | 1 | 7 | 68,1−99,8 |
Studio 005/settimana 24 | 15 | 14 | 93 | 1 | 7 | 68,1−99,8 |
Studio 006/settimana 16 | 15 | 15 | 100 | 0 | 0 | 78,2−100 |
Studio 006/settimana 32 | 15 | 15 | 100 | 0 | 0 | 78,2−100 |
ITT | N | % | N | % | ||
Studio 005/settimana 12 | 18 | 15 | 83 | 3 | 17 | 58,6−96,4 |
Studio 005/settimana 24 | 18 | 14 | 78 | 4 | 22 | 52,4−93,6 |
Studio 006/settimana 16 | 16 | 15 | 94 | 1 | 6 | 69,8−99,8 |
Studio 006/settimana 32 | 16 | 15 | 94 | 1 | 6 | 69,8−99,8 |
In uno studio post-commercializzazione è stata riferita l'esperienza con la terapia a base di 3 iniezioni di leuprorelina depot 1 mese o 3 mesi. Nel database dello studio sono confluiti i dati di 818 pazienti che sono stati tutti considerati per l'analisi statistica. I criteri di ammissione sono stati i seguenti: 1) presenza di carcinoma prostatico ormono-dipendente avanzato e 2) precedente trattamento con leuprorelina o con un altro agonista del GnRH.
L'effetto terapeutico della leuprorelina è stato valutato sulla base della variazione dei livelli di PSA e di testosterone dopo 3 somministrazioni. Sono stati considerati come risposta valori di testosterone sierico ≤0,5 ng/ml e valori di PSA ≤4 ng/ml.
Tabella 3: Numero (%) di pazienti con valori di PSA ≤4 ng/ml
Fase dello studio | Valutazione 1 | Valutazione 2 | ||||
N | a | % | N | a | % | |
U1 | 773 | 411 | 53,2 | 644 | 342 | 53,1 |
U2 | 644 | 512 | 79,5 | 644 | 512 | 79,5 |
U3 | 736 | 626 | 85,1 | 644 | 549 | 85,2 |
Tabella 4: Numero (%) di pazienti con valori di testosterone sierico ≤0,5 ng/ml
Fase dello studio | Valutazione 1 | Valutazione 2 | ||||
N | a | % | N | a | % | |
U1 | 288 | 145 | 50,3 | 225 | 113 | 50,2 |
U2 | 225 | 162 | 72,0 | 225 | 162 | 72,0 |
U3 | 257 | 203 | 79,0 | 225 | 180 | 80,0 |
Farmacocinetica
Assorbimento
Dopo l'iniezione dell'impianto, la leuprorelina acetato viene rilasciata in modo costante per un massimo di 182 giorni (26 settimane) dal polimero dell'acido lattico, che in questo modo viene assorbito come fosse un materiale di sutura.
Entro 2 ore dopo la somministrazione di una singola dose sottocutanea di Leuproréline Sandoz 3 mesi in soggetti sani è stato riscontrato un picco sierico di leuprorelina di 5216 pg/ml (5,2 ng/ml) cui ha fatto seguito dopo 24 ore ancora una Cmax del 20% e dopo 21 giorni una Cmax di appena il 5−6%.
Durante un trattamento di 3 mesi con Leuproréline Sandoz 3 mesi l'AUC è stata di 32,4 ng/ml*d. Livelli misurabili nel siero possono essere presenti fino a 182 giorni (26 settimane) dopo la somministrazione.
Distribuzione/metabolismo/eliminazione
Distribuzione, metabolismo ed eliminazione di leuprorelina acetato nell'uomo non sono ancora del tutto chiari.
Il proseguimento della terapia comporta un abbassamento del testosterone sierico a livelli equivalenti a quelli osservati dopo castrazione, senza che il valore del testosterone evidenzi un temporaneo innalzamento come dopo l'iniezione iniziale.
Cinetica di gruppi di pazienti speciali
Bambini/adolescenti: non sono disponibili dati relativi alle proprietà farmacocinetiche di Leuproréline Sandoz 3 mesi in bambini e adolescenti.
Pazienti anziani: la farmacocinetica nei pazienti anziani non mostra differenze rilevanti rispetto a quella che si osserva negli adulti più giovani.
Insufficienza epatica e renale: i livelli sierici di leuprorelina acetato sono risultati in parte più elevati nei pazienti con disturbi della funzionalità renale e più bassi in quelli con disturbi della funzionalità epatica. Non si conosce la significatività di quest'osservazione.
Dati preclinici
Mutagenicità
Gli studi sulla mutagenicità (in vitro e in vivo) non hanno fornito alcuna prova circa il potenziale mutageno.
Cancerogenicità
In alcuni studi sulla cancerogenicità, topi e ratti sono stati trattati con la leuprorelina per 2 anni. Nei ratti, la somministrazione sottocutanea di 0,6−4 mg/kg per 24 mesi ha prodotto un incremento dose-dipendente di iperplasie e adenomi ipofisari benigni. Un incremento dose-indipendente è stato osservato anche con riferimento agli adenomi delle cellule interstiziali del testicolo. Nei topi, la somministrazione di dosi fino a 60 mg/kg per un periodo di 2 anni non ha favorito l'insorgenza di tumori né di anomalie dell'ipofisi riconducibili alla leuprorelina.
Tossicità per la riproduzione
Nel corso di studi sulla tossicità riproduttiva con somministrazione sottocutanea di leuprorelina nei ratti (fino a 10 µg/kg) e nei conigli (fino a 1 µg/kg) non è stata dimostrata alcuna prova con riferimento al potenziale teratogeno. Effetti embriotossici/embrioletali sono stati osservati nei ratti con una dose di 10 µg/kg e nei conigli con dosi superiori a 0,1 µg/kg.
Altre indicazioni
Incompatibilità
Non sono note al momento interazioni.
Influenza su metodi diagnostici
Alterazioni delle prove di funzionalità epatica.
Stabilità
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni particolari concernenti l'immagazzinamento
Conservare nella confezione originale, nella busta sterile chiusa, non al di sopra di 30 °C e fuori dalla portata dei bambini.
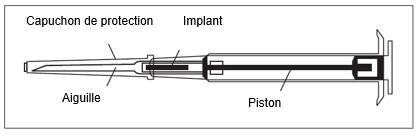
Indicazioni per la manipolazione
| ||
| ||
| ||
Attenzione: lo stantuffo può essere spinto in avanti per iniettare l'impianto solo se in precedenza è stato tirato completamente indietro nella posizione di fermo! | ||
| ||
| ||
|
| |
|
| |
| ||
|
| |
Numero dell'omologazione
57141 (Swissmedic).
Titolare dell’omologazione
Sandoz Pharmaceuticals AG, Risch; domicilio: Rotkreuz.
Stato dell'informazione
Maggio 2019.
Composition
Principe actif: Leuprorelinum ut leuprorelini acetas.
Excipients: Acidum polylacticum pro praeparatione.
Forme galénique et quantité de principe actif par unité
1 seringue préremplie avec un implant contient 5 mg Leuprorelinum ut leuprorelini acetas.
Indications/Possibilités d’emploi
Traitement symptomatique des carcinomes prostatiques évolués, hormono-dépendants. A titre d'alternative, lorsqu'une orchidectomie ou l'administration d'oestrogènes n'est pas indiquée ou difficile à imposer au patient.
Posologie/Mode d’emploi
Posologie usuelle
Il est recommandé d'administrer 5 mg de leuproréline en dose unique et ce, toutes les 3 mois.
Mode d'emploi
L'implant est injecté en sous-cutané dans la région abdominale. Changer le point d'injection – mais toujours au niveau de la région abdominale – à l'occasion de chaque application.
L'administration de Leuproréline Sandoz n'est autorisée que chez les hommes adultes et ne doit se faire que sous la surveillance d'un médecin expérimenté en oncologie.
A la phase initiale du traitement, il convient d'envisager l'administration complémentaire d'un anti-androgène approprié afin d'atténuer les conséquences éventuelles de l'élévation initiale de la testostérone et l'aggravation temporaire des symptômes cliniques.
Il faut suivre la réponse à l'acétate de leuproréline en mesurant les taux sériques de testostérone et d'antigène prostatique spécifique.
Recommandations posologiques spéciales
Enfants/adolescents: L'efficacité et la sécurité d'emploi de Leuproréline Sandoz 3 mois n'ont pas été évaluées chez l'enfant et l'adolescent.
Patients âgés: Une adaptation de la dose en fonction de l'âge n'est pas nécessaire.
Insuffisance hépatique et rénale: Une adaptation de la dose n'est pas nécessaire (cf. «Pharmacocinétique»).
Contre-indications
Hypersensibilité au principe actif, aux nonapeptides ou décapeptides similaires ou à l'un des excipients selon composition.
Leuproréline Sandoz n'est pas indiqué si le carcinome s'avère non hormono-dépendant.
Mises en garde et précautions
Réactions d'hypersensibilité:
Des réactions allergiques et anaphylactiques ont été observées lors de traitement par des agonistes de la GnRH. Celles-ci peuvent comprendre des réactions d'hypersensibilité au point d'injection ainsi que des symptômes systémiques.
Les réactions locales marquées peuvent amoindrir la résorption de la leuproréline à partir du dépôt. Dans un tel cas, il convient de déterminer le taux de testostérone.
Apoplexie hypophysaire:
Dans le cadre de la pharmacovigilance (surveillance post-commercialisation), de rares cas d'apoplexie hypophysaire (un syndrome clinique secondaire à un infarctus de l'hypophyse) ont été rapportés à la suite de l'administration d'agonistes de la gonadoréline (GnRH). Un adénome hypophysaire a été diagnostiqué dans la plupart de ces cas. La majorité de ces cas d'apoplexie hypophysaire se sont produits en l'espace de 2 semaines – et certains même en l'espace d'une heure – après l'administration de la première dose. Chez ces patients, l'apoplexie hypophysaire s'est manifestée par des céphalées brutales, des vomissements, des anomalies visuelles, une ophtalmoplégie, un état mental altéré et parfois un collapsus cardio-vasculaire. Un traitement médical immédiat était nécessaire.
Par conséquent, les patients souffrant d'un adénome hypophysaire connu ne doivent pas être traités par un agoniste de la GnRH.
Dépression et risque suicidaire: Le risque de dépression (qui peut être sévère) est accru chez les patients traités par des agonistes de la GnRH.
Les patients souffrant de dépression préexistante peuvent présenter un risque suicidaire.
Densité osseuse/risque de fracture: Des modifications de la densité osseuse peuvent survenir pendant un état de déficit en œstrogènes. La diminution de la densité osseuse peut être réversible après l'arrêt de Leuproréline Sandoz 3 mois.
Le risque de fracture peut être accru chez l'homme, également en raison du déficit en androgènes résultant du traitement du carcinome de la prostate.
Convulsions: Dans le cadre de la pharmacovigilance, on a rapporté la survenue de convulsions. Il s'agissait à cet égard en partie de patients qui présentaient d'autres facteurs de risque de convulsions (comme par exemple, anamnèse d'épilepsie, tumeur intracrânienne, comédication avec des médicaments pour lesquels un risque de convulsions est connu). Toutefois, il existe également des rapports de patients qui ne présentent pas ces facteurs de risque.
Facteurs de risque cardio-vasculaire/maladies cardio-vasculaires:
Sous traitement par agonistes de la GnRH, on a rapporté un risque accru de diabète sucré et/ou d'événements cardio-vasculaires. En particulier, dans plusieurs études épidémiologiques importantes chez des patients présentant un cancer de la prostate, on a observé un risque accru de 20% environ d'infarctus du myocarde et d'accident vasculaire cérébral. Chez les patients chez lesquels d'autres facteurs de risque cardio-vasculaire (par exemple, hypertension artérielle, hyperlipidémie) existent ou qui présentent des maladies cardio-vasculaires préexistantes, une évaluation soigneuse du rapport bénéfice/risque doit être effectuée.
Avant l'instauration d'un traitement par la leuproréline, la pression artérielle, la glycémie et le profil lipidique doivent être déterminés. Pendant le traitement, une surveillance s'impose chez les patients pour lesquels ces facteurs de risque ainsi que les symptômes pouvant y être liés laissent présumer du développement d'une maladie cardio-vasculaire. Des facteurs de risque déjà présents (diabète sucré, hypercholestérolémie, hypertension artérielle) doivent être traités de façon appropriée, c'est-à-dire selon chacune des directives correspondantes.
Effets sur l'intervalle QT:
La privation androgénique peut prolonger l'intervalle QT. Chez les patients présentant des antécédents ou des facteurs de risques de l'allongement de l'intervalle QT ainsi que chez les patients recevant de manière concomitante des médicaments susceptibles d'allonger l'intervalle QT (voir «Interactions»), il faut évaluer le rapport bénéfice-risque en tenant compte du risque potentiel de torsades de pointe avant d'initier un traitement par acétate de leuproréline.
De plus, en relation avec l'utilisation d'agonistes de la GnRH, on a rapporté chez l'homme un risque accru de mort subite d'origine cardiaque. En cas de réaction locale prononcée, la résorption de la leuproréline à partir du dépôt peut être diminuée. Dans ce cas, le taux de testostérone doit être déterminé.
Cancer de la prostate
Un traitement par Leuproréline Sandoz 3 mois entraîne pendant les premières semaines de traitement une augmentation de courte durée du taux sérique de testostérone, qui peut être accompagnée par une intensification passagère de certains symptômes de la maladie, comme par exemple des douleurs osseuses (qui peuvent être traitées de façon symptomatique), une faiblesse musculaire dans les membres inférieurs ou un lymphœdème.
Dans des cas isolés, on a rapporté la survenue d'une obstruction des voies urinaires et d'une compression de la colonne vertébrale pouvant entraîner une paralysie, accompagnée éventuellement d'une issue fatale. Les patients qui présentent un risque de complications neurologiques, des métastases vertébrales ou une obstruction des voies urinaires doivent de ce fait, autant que possible, rester sous observation constante à l'hôpital pendant les premières semaines du traitement.
On peut envisager l'administration supplémentaire d'un anti-androgène adapté lors de la première phase du traitement pour atténuer les éventuelles manifestations consécutives à la hausse initiale du taux de testostérone et une aggravation des symptômes cliniques.
L'augmentation initiale des douleurs rétrocède spontanément généralement sans arrêt du traitement par Leuproréline Sandoz 3 mois. Par la suite, surviennent des symptômes liés au sevrage de la testostérone (cf. «Effets indésirables»).
Des évaluations périodiques du taux sérique de testostérone et de l'antigène prostatique spécifique sont conseillées pour exclure un échappement dans la deuxième moitié de l'intervalle de traitement, en particulier lorsque l'effet clinique et l'effet biochimique attendus ne semblent pas être atteints (par exemple en cas d'amélioration des effets indésirables de la castration ou signes d'une progression tumorale).
Après castration chirurgicale, Leuproréline Sandoz ne provoque pas de diminution supplémentaire du taux de testostérone.
Interactions
Aucune interaction connue à ce jour.
On n'a pas étudié les interactions possibles avec Leuproréline Sandoz. Toutefois, compte tenu du métabolisme de l'acétate de leuropréline, on peut penser que les interactions sont rares, étant donné que la leuproréline est essentiellement métabolisée par des peptidases et non par le cytochrome P 450 et que son taux de liaison aux protéines plasmatiques est faible, env. 46%.
Cancer de la prostate
Puisqu'une privation androgénique peut entraîner une prolongation de l'intervalle QT, il faut soigneusement évaluer le risque d'une administration concomitante d'acétate de leuproréline et de médicaments pouvant provoquer des torsades de pointes comme les antiarythmiques de la classe IA (p.ex. quinidine, disopyramide) ou de la classe III (p.ex. amiodarone, sotalol, dofétilide, ibutilide), la méthadone, la moxifloxacine, les antipsychotiques, etc. Voir «Mises en garde et précautions», effets sur l'intervalle QT.
Grossesse/Allaitement
Il n'existe pas d'indication de Leuproréline Sandoz chez les femmes.
La leuproréline est contre-indiquée lors de la grossesse.
On ignore si la leuproréline est excrétée dans le lait maternel.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Comme Leuproréline Sandoz 3 mois peut diminuer la capacité de réaction, le traitement peut entraver l'aptitude à la conduite automobile ou la manipulation de machines. Ce risque est accru en cas de consommation concomitante d'alcool.
Effets indésirables
En début de traitement par acétate de leuproréline, on observe une augmentation passagère du taux sérique de testostérone ou d'œstradiol, ce qui peut donner lieu à une majoration transitoire de certains symptômes (apparition ou accentuation des douleurs osseuses, obstruction des voies urinaires et leur conséquence, compression de la moelle dorsale, fatigue musculaire des membres inférieurs, lymphoedème). Cette accentuation des troubles régresse habituellement spontanément sans aucune nécessité d'arrêter Leuproréline Sandoz 3 mois.
Les effets indésirables les plus fréquents sous traitement par acétate de leuproréline sont la vasodilatation (57%) et les bouffées de chaleur (52%), l'hypersudation (42%), la baisse de la libido (47%), les signes d'incapacité sexuelle (45%) et la prise de poids (22%).
Les effets indésirables observés dans le cadre d'études cliniques et pendant la surveillance du marché sous traitement par des préparations dépôt à base d'acétate de leuproréline sont présentés ci-après par discipline médicale. Les fréquences sont définies comme suit: très fréquent (≥1/10); fréquent (de ≥1/100 à <1/10); peu fréquent (de ≥1/1000 à <1/100), rare (de ≥1/10'000 à <1/1000); très rare (<1/10000), fréquence indéterminée: ne peut être estimée sur la base des données disponibles.
Infections et infestations:
Fréquent: infections des voies aériennes, pharyngite, infection urinaire, bronchite.
Peu fréquent: candidose, mycose de la peau, rhinite.
Fréquence indéterminée: pneumonie.
Tumeurs bénignes, malignes et non spécifiques (incl. kystes et polypes):
Fréquence indéterminée: carcinomes de la peau/de l'oreille.
Affections hématologiques et du système lymphatique:
Fréquent: anémie.
Peu fréquent: augmentation des réticulocytes.
Fréquence indéterminée: augmentation ou baisse des valeurs leucocytaires, baisse de la numération thrombocytaire, prolongation des temps de prothrombine et de céphaline activée.
Affections du système immunitaire:
Peu fréquent: réactions d'hypersensibilité (par ex. fièvre, prurit, éosinophilie, éruption cutanée).
Fréquence indéterminée: réactions anaphylactiques.
Affections endocriniennes:
Fréquence indéterminée: infarctus hypophysaire (voir «Mises en garde et précautions»), hypertrophie thyroïdienne.
Troubles du métabolisme et de la nutrition:
Très fréquent: prise de poids (22%).
Fréquent: anorexie, augmentation de l'appétit, perte d'appétit, perte de poids, hyperglycémie, accentuation de la sensation de soif, hypercalcémie.
Peu fréquent: hypoglycémie, déshydratation.
Fréquence indéterminée: diabète, élévation de l'urée, hyperuricémie, hyperlipidémie (cholestérol global, cholestérol LDL, triglycérides), hyperphosphatémie, hypoprotéinémie, élévation de la créatinine, hypokaliémie, élévation de l'AUS.
Affections psychiatriques:
Très fréquent: baisse de la libido (47%), insomnie.
Fréquent: troubles du sommeil, angoisse, somnolence, changements d'humeur, dépression, nervosité, labilité émotionnelle.
Peu fréquent: pensées délirantes.
Fréquence indéterminée: augmentation de la libido, suicidalité.
Affections du système nerveux:
Fréquent: paresthésies, hyperesthésies, tremblements, céphalées, vertiges.
Peu fréquent: troubles du goût, troubles de la mémoire (amnésie), troubles de la marche
Fréquence indéterminée: léthargie, neuropathie périphérique, troubles neuromusculaires, étourdissements, neuromyopathie, perte de conscience, accident ischémique transitoire, apoplexie.
Très peu de cas de convulsions ont été déclarés.
Affections oculaires:
Fréquent: troubles de la vue (par ex. vision trouble), amblyopie.
Fréquence indéterminée: sécheresse oculaire, autres troubles ophtalmologiques.
Affections de l'oreille et du labyrinthe:
Fréquent: acouphènes, douleurs auriculaires.
Fréquence indéterminée: troubles auditifs, troubles de l'audition.
Affections cardiaques:
Fréquent: angine de poitrine, tachycardie, arythmies, extrasystoles ventriculaires.
Peu fréquent: insuffisance cardiaque, bradycardie.
Fréquence indéterminée: allongements de l'intervalle QT (voir «Mises en garde et précautions» et «Interactions»), modifications de l'ECG (par ex. signes d'ischémie myocardique), souffle cardiaque, palpitations, infarctus du myocarde, bloc AV, mort subite d'origine cardiaque (cf. «Mises en garde et précautions»).
Affections vasculaires:
Très fréquent: bouffées de chaleur (52%), vasodilatation (57%).
Fréquent: thrombophlébite, œdème lymphatique, hypertension, syncope.
Peu fréquent: trouble de la circulation périphérique.
Fréquence indéterminée: thrombose, embolie pulmonaire, hypotension, douleur variqueuse, accident vasculaire cérébral.
Par ailleurs, un seul cas de patient ayant développé une thrombose de l'artère centrale de la rétine a été signalé.
Affections respiratoires, thoraciques et médiastinales:
Fréquent: toux, dyspnée, épistaxis, hémoptysies, asthme bronchique, œdème pulmonaire aigu, emphysème pulmonaire.
Peu fréquent: bronchopneumopathie chronique obstructive.
Fréquence indéterminée: frottement pleural, infiltration pulmonaire, fibrose pulmonaire, obstruction des sinus, effusion pleurale, pneumopathie interstitielle.
Affections gastro-intestinales:
Fréquent: sécheresse buccale, flatulences, constipation, diarrhées, nausées, vomissements, douleurs abdominales, gastrite.
Fréquence indéterminée: ulcère gastroduodénal, dysphagie, hémorragie gastro-intestinale, polypes rectaux, ulcères peptiques, nodosités dures dans la gorge.
Affections hépatobiliaires:
Très fréquent: élévation des ASAT (20%), élévation du LDH dans le sérum (29%).
Fréquent: troubles de la fonction hépatique (par ex. élévation des ALAT, élévation des gamma-GT).
Peu fréquent: lésion hépatocellulaire, hépatite cholestatique.
Fréquence indéterminée: sévère lésion hépatique, hyperbilirubinémie, ictère.
Affections de la peau et du tissu sous-cutané:
Fréquent: sécheresse cutanée, éruption cutanée (y compris exanthème maculopapuleux), prurit, urticaire, modifications de la pilosité (en particulier augmentation ou diminution de la pilosité corporelle), alopécie, ecchymoses, troubles de la pigmentation.
Peu fréquent: réactions de photosensibilité, sécheresse muqueuse.
Fréquence indéterminée: dermatite, lésions cutanées, nodosités.
Affections musculo-squelettiques et du tissu conjonctif:
Très fréquent: douleurs osseuses (14%).
Fréquent: douleurs articulaires (arthralgies), maux de dos, faiblesse musculaire, douleurs aux extrémités, myalgie, crampes musculaires.
Fréquence indéterminée: perte de densité osseuse, fibrose du bassin, troubles articulaires (arthropathie), paralysie, fracture spinale, spondylarthrite ankylosante, ténosynovite, gonflement osseux, douleurs dans les membres.
En outre, une ostéoporose a été signalée dans le cadre d'un traitement au long cours (6 à 12 mois) (voir «Mises en garde et précautions»).
Affections du rein et des voies urinaires:
Très fréquent: nycturie (17%).
Fréquent: dysurie, pollakiurie, hématurie.
Peu fréquent: incontinence urinaire, polyurie, troubles de la miction, rétention urinaire, protéinurie.
Fréquence indéterminée: miction impérieuse accrue, spasmes de la vessie, obstruction des voies urinaires.
Affections des organes de reproduction et du sein
Très fréquent: signes d'incapacité sexuelle (45%).
Fréquent: gynécomastie, atrophie testiculaire, élévation de l'ASP.
Très rare: douleurs/tension/hypersensibilité dans les seins, gonflement pénien.
Fréquence indéterminée: douleurs dans la région prostatique, douleur testiculaire.
Troubles généraux et anomalies au site d'administration:
Très fréquent: hypersudation (42%), réactions au point d'injection (13%), par ex. rougeurs, douleurs, œdèmes, démangeaisons, infections qui se résorbent également en général en cas de poursuite du traitement, fatigue/asthénie (13%), œdème périphérique (12%)
Fréquent: inflammations au point d'injection (dont des abcès), grelottements, douleurs généralisées, gonflement (os temporal), réactions d'hypersensibilité, fièvre, malaise, accès de transpiration, transpiration nocturne, frissons et symptômes pseudo-grippaux généraux.
Surdosage
On n'a pas observé à ce jour de signes d'intoxication.
Dans les études cliniques avec des préparations dépôt de l'acétate leuproréline des doses allant jusqu'à 20 mg/jour pendant 2 ans ont été administrées. Les effets indésirables de ces doses ne sont pas différents de ceux notés lors d'une administration de 1 mg/jour.
En cas de surdosage, le patient doit être surveillé. Le cas échéant, des mesures thérapeutiques symptomatiques et de soutien sont indiquées sous contrôle médical.
Propriétés/Effets
Code ATC: L02AE02
Mécanisme d'action et Pharmacodynamie
L'acétate de leuproréline, le principe actif, est un analogue de synthèse de de l'hormone de libération des gonadotrophines hypophysaires (Gonadotropin-Releasing-Hormon, GnRH) qui contrôle la libération de la LH et de la FSH, hormones gonadotropes, du lobe antérieur de l'hypophyse. Ces hormones stimulent à leur tour la synthèse testiculaire des stéroïdes.
A l'opposé de la GnRH physiologique, libérée de façon pulsatile par l'hypothalamus, l'acétate de leuproréline, utilisé en thérapeutique de façon continue, bloque en permanence les récepteurs à la GnRH et provoque, après une stimulation initiale brève sa régulation négative. Chez les adultes, le résultat après trois à quatre semaines est une suppression réversible dans l'hypophyse de la libération des hormones gonadotrophines LH et FSH avec diminution subséquente des concentrations sériques de testostérone et de son métabolite dihydrotestostérone. La baisse du niveau de dihydrotestostérone conduit à une inhibition de la croissance du tissu prostatique modifié par le carcinome, qui est normalement stimulé par ce biais.
L'administration continuelle d'acétate de leuproréline conduit à une diminution du nombre et/ou de la sensibilité (appelée «régulation négative») des récepteurs présents dans l'hypophyse et donc à une diminution de la concentration en LH, FSH et DHT. La concentration en testostérone est ainsi réduite à des taux observés après castration.
Etudes de longue durée
Les données actuelles disponibles relatives à l'administration de 2 injections de Leuproréline Sandoz 3 mois sont limitées; on ne dispose pas de données relatives à plus de 2 injections.
L'efficacité thérapeutique de deux doses successives de Leuproréline Sandoz 3 mois a été évaluée dans le cadre de deux études de phase III chez des patients atteints d'un cancer de la prostate au stade avancé à un intervalle de 12 semaines (étude 005) resp. 16 semaines (étude 006).
Les études ont été menées sur un total de 34 patients (18 patients dans l'étude 005 et 16 patients dans l'étude 006). Les données de ces groupes de patients étaient disponibles pour une évaluation de la sécurité et de l'analyse ITT (intention to treat). 30 patients ont été associés à l'analyse PP (per protocol), respectivement 15 patients de l'étude 005 et 15 patients de l'étude 006.
Tableau 1: Population des études Leuproréline Sandoz 3 mois avec double administration
Population | Nombre de patients | |
Etude 005 | Etude 006 | |
Totalité des patients traités = intention to treat (ITT) | 18 | 16 |
Ecarts graves par rapport au protocole | 3 | 1 |
Per protocol Population = Nombre de patients avec deux administrations (% ITT) | 15 (83) | 15 (94) |
Fraction des patients avec suppression efficace de la testostérone après huit semaines
Il en résulte des taux d'efficacité comparables dans les deux études (005 et 006) avec un taux de suppression de 100% dans le groupe PP. Dans le groupe ITT, un seul patient dans l'étude 005 ne présentait pas de suppression.
Patients avec taux de testostérone de ≤0,5 ng/ml durant la 12ème resp. 16ème semaine ainsi que durant la 24ème resp. 32ème semaine
Tableau 2: Patients avec taux de testostérone de ≤0,5 ng/ml durant la 12ème resp. 16ème semaine ainsi que durant la 24ème resp. 32ème semaine (005 et 006)
Traitement | N | Nombre de patients | 95% CI | |||
efficace | Pas efficace | [%] | ||||
PP | N | % | N | % | ||
Etude 005/semaine 12 | 15 | 14 | 93 | 1 | 7 | 68,1 à 99,8 |
Etude 005/semaine 24 | 15 | 14 | 93 | 1 | 7 | 68,1 à 99,8 |
Etude 006/semaine 16 | 15 | 15 | 100 | 0 | 0 | 78,2 à 100 |
Etude 006/semaine 32 | 15 | 15 | 100 | 0 | 0 | 78,2 à 100 |
ITT | N | % | N | % | ||
Etude 005/semaine 12 | 18 | 15 | 83 | 3 | 17 | 58,6 à 96,4 |
Etude 005/semaine 24 | 18 | 14 | 78 | 4 | 22 | 52,4 à 93,6 |
Etude 006/semaine 16 | 16 | 15 | 94 | 1 | 6 | 69,8 à 99,8 |
Etude 006/semaine 32 | 16 | 15 | 94 | 1 | 6 | 69,8 à 99,8 |
Une étude postmarketing a été consacrée au déroulement thérapeutique de 3 injections de leuproréline sous forme de dépôt d'1 ou de 3 mois. La base de données de l'étude regroupait 818 documentations relatives à des patients, pouvant toutes être utilisées pour l'analyse statistique. Les documentations devaient satisfaire aux conditions suivantes pour être retenues: 1) présence d'un carcinome prostatique hormono-dépendant avancé et 2) traitement préalable par leuproréline ou autre agoniste de la GnRH.
L'évaluation de l'effet thérapeutique de la leuproréline a pris pour critère l'évolution des taux de testostérone et de PSA suite à 3 administrations de produit. La réponse au traitement a été définie comme suit: taux de testostérone sérique ≤0,5 ng/ml et taux de PSA ≤4 ng/ml.
Tableau 3: Nombre (%) de patients présentant des taux de PSA ≤4 ng/ml
Date de l'examen | Evaluation 1 | Evaluation 2 | ||||
N | n | % | N | n | % | |
U1 | 773 | 411 | 53,2 | 644 | 342 | 53,1 |
U2 | 644 | 512 | 79,5 | 644 | 512 | 79,5 |
U3 | 736 | 626 | 85,1 | 644 | 549 | 85,2 |
Tableau 4: Nombre (%) de patients présentant des taux de testostérone sérique ≤0,5 ng/ml
Date de l'examen | Evaluation 1 | Evaluation 2 | ||||
N | n | % | N | n | % | |
U1 | 288 | 145 | 50,3 | 225 | 113 | 50,2 |
U2 | 225 | 162 | 72,0 | 225 | 162 | 72,0 |
U3 | 257 | 203 | 79,0 | 225 | 180 | 80,0 |
Pharmacocinétique
Absorption
Après injection de l'implant, l'acétate de leuproréline est libéré de façon continue du polymère d'acide lactique, sur une durée jusqu'à 182 jours (26 semaines). Le polymère est résorbé comme un matériel de suture chirurgical.
Après l'application d'une dose sous-cutanée unique de Leuproréline Sandoz 3 mois chez des volontaires sains, une concentration sérique maximale de leuproréline de 5216 pg/ml (5,2 ng/ml) a été observée dans les deux heures. Cette concentration sérique après 24 h était égale à 20% de la Cmax et à 5 ou 6% de la Cmax après 21 jours.
L'ASC pendant le traitement de 3 mois par Leuproréline Sandoz 3 mois a été de 32,4 ng/ml*j. La concentration sérique a encore pu être détectée jusqu'à 182 jours (26 semaines) après l'administration.
Distribution/Métabolisme/Elimination
La distribution, le métabolisme et l'élimination de l'acétate de leuproréline chez l'homme ne sont pas parfaitement élucidés.
Lors d'une administration répétée, on observe une baisse persistante des taux de testostérone jusqu'à des taux équivalents à ceux observés après une castration, sans que ce taux ne s'élève transitoirement, comme après la première injection.
Cinétique pour certains groupes de patients
Enfants/adolescents: On ne dispose d'aucune donnée sur la pharmacocinétique de Leuproréline Sandoz 3 mois chez l'enfant et l'adolescent.
Patients âgés: La pharmacocinétique chez le patient âgé ne diffère pas significativement de celle des jeunes adultes.
Insuffisances hépatiques et rénales: On a parfois mesuré des taux sériques plus élevés chez des patients présentant une insuffisance rénale, alors que les taux étaient abaissés chez les patients présentant une insuffisance hépatique. La signification clinique de cette observation est inconnue.
Données précliniques
Mutagénicité
Les essais de mutagénicité (in vitro et in vivo) n'ont mis en évidence aucun signe de potentiel mutagène de la leuproréline.
Carcinogénicité
Des souris et des rats ont été traités avec la leuproréline pendant deux ans au cours d'essais de carcinogénicité. Au bout de 24 mois, on a pu observer, chez les rats ayant reçu par voie sous-cutanée 0,6 à 4 mg/kg de leuproréline, une augmentation dépendante de la dose d'hyperplasies hypophysaires bénignes et d'adénomes. De plus, une augmentation indépendante de la dose d'adénomes des cellules testiculaires interstitielles chez des rats mâles a été constatée. Chez les souris, des doses de leuproréline allant jusqu'à 60 mg/kg, également administrées pendant deux ans, n'ont entraîné aucune tumeur ni anomalie hypophysaire.
Toxicité pour la reproduction
Des études portant sur l'administration sous-cutanée de doses de leuproréline allant jusqu'à 10 µg/kg à des rates et allant jusqu'à 1 µg/kg à des lapines n'ont pas mis en évidence de signes d'un potentiel tératogène. Des effets embryotoxiques/embryolétals ont été observés chez les rates à une dose de 10 µg/kg et chez les lapines à des doses supérieures à 0,1 µg/kg.
Remarques particulières
Incompatibilités
Aucune incompatibilité connue à ce jour.
Influence sur les méthodes de diagnostic
Anomalies aux tests de la fonction hépatique.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Conserver dans l'emballage original, dans le sachet stérile fermé, pas au-dessus de 30 °C et hors de la portée des enfants.
Remarques concernant la manipulation
| ||
| ||
| ||
Remarque: Le piston ne peut être poussé vers l'avant pour l'injection que lorsqu'il a été auparavant complètement tiré vers l'arrière! | ||
| ||
| ||
|
| |
|
| |
| ||
|
| |
Numéro d’autorisation
57141 (Swissmedic).
Titulaire de l’autorisation
Sandoz Pharmaceuticals SA, Risch; domicile: Rotkreuz.
Mise à jour de l’information
Mai 2019.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.




 Deutsch
Deutsch French
French Italian
Italian