Leuprorelin Sandoz Injektionspräparat 3.6mg Fertigspritze buy online
Leuprorelin Sandoz 1 Monat Implant 3.6 mg Fertspr
-
230.58 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: SANDOZ PHARMACEUT. AG
- Product Code: 3805750
- ATC-code L02AE02
- EAN 7680574490020
Ingredients:

Description
Zusammensetzung
Wirkstoff: Leuprorelinum ut leuprorelini acetas.
Hilfsstoffe: Copoly(dl-lactidum-glycolidum) pro praeparatione.
Galenische Form und Wirkstoffmenge pro Einheit
Eine Fertigspritze mit einem Implantat enthält 3,6 mg Leuprorelinum ut leuprorelini acetas.
Indikationen/Anwendungsmöglichkeiten
Symptomatische Behandlung des fortgeschrittenen hormonabhängigen Prostatakarzinoms. Als alternative Behandlung, wenn Orchiektomie oder Östrogengaben entweder für den Patienten nicht indiziert oder nicht zumutbar sind.
Dosierung/Anwendung
Übliche Dosierung
Die empfohlene Dosierung beträgt 3,6 mg Leuprorelin als Einzeldosis alle 4 Wochen.
Art der Anwendung
Das Implantat wird subkutan in die Bauchhaut eingeschoben. Die Injektionsstelle an der Bauchhaut ist jeden Monat zu wechseln.
Die Anwendung von Leuprorelin Sandoz ist nur bei erwachsenen Männern zulässig und sollte nur unter Überwachung eines in der Tumortherapie erfahrenen Arztes bzw. einer Ärztin erfolgen. Für die Initialphase der Behandlung sollte die zusätzliche Gabe eines geeigneten Antiandrogens erwogen werden, um so die möglichen Folgeerscheinungen des anfänglichen Testosteronanstiegs und die vorübergehende Verschlechterung der klinischen Symptomatik abzuschwächen.
Die Antwort auf Leuprorelinacetat soll mittels Messung des Serum-Testosteronspiegels und des prostataspezifischen Antigens verfolgt werden.
Spezielle Dosierungsempfehlungen
Kinder/Jugendliche: Die Anwendung und Sicherheit von Leuprorelin Sandoz 1 Monat bei Kindern und Jugendlichen ist bisher nicht geprüft worden.
Ältere Patienten: Eine Dosisanpassung in Abhängigkeit vom Alter ist nicht erforderlich.
Leber- und Niereninsuffizienz: eine Dosisanpassung ist nicht erforderlich (vgl. «Pharmakokinetik»).
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff, ähnliche Nona- oder Dekapeptide oder dem Hilfsstoff gemäss Zusammensetzung.
Bei nachgewiesener Hormonunabhängigkeit des Karzinoms ist Leuprorelin Sandoz nicht indiziert.
Warnhinweise und Vorsichtsmassnahmen
Hypersensibilitätsreaktionen
Über vereinzelte Fälle von Anaphylaxie wurde berichtet. Allergische Reaktionen in Form von Überempfindlichkeitsreaktionen an der Injektionsstelle sowie systemische Reaktionen wurden beobachtet.
Bei ausgeprägten lokalen Reaktionen kann die Resorption von Leuprorelin aus dem Depot beeinträchtigt sein. In einem solchen Fall sollte der Testosteronspiegel bestimmt werden.
Hypophysenapoplexie
Während der Marktüberwachung wurde nach der Verabreichung von Gonadotropin-Releasing-Hormon (GnRH)-Agonisten selten über Hypophysenapoplexie berichtet (sekundäres klinisches Syndrom eines Hypophysen-Infarktes). In den meisten dieser Fälle wurde ein Hypophysenadenom diagnostiziert. Die Mehrheit dieser Hypophysenapoplexie-Fälle traten innerhalb von 2 Wochen, einige innerhalb der ersten Stunde, nach Verabreichung der ersten Dosis auf. In diesen Fällen zeigte sich die Hypophysenapoplexie durch plötzliche Kopfschmerzen, Erbrechen, visuelle Veränderungen, Ophthalmoplegie, einen veränderten mentalen Status und manchmal einen kardiovaskulären Kollaps. Sofortige medizinische Betreuung war erforderlich.
Bei bekanntem Hypophysenadenom sollte aus diesem Grund ein GnRH-Agonist nicht gegeben werden.
Suizidrisiko: Bei Patienten, welche mit GnRH-Agonisten behandelt werden, besteht ein erhöhtes Risiko für das Auftreten von Depressionen (welche schwerwiegend verlaufen können). Patienten mit vorbestehenden Depressionen können suizidgefährdet sein.
Knochendichte/Frakturrisiko: Während eines hypo-östrogenen Zustands können Veränderungen der Knochendichte auftreten. Die Abnahme der Knochendichte kann nach Absetzen von Leuprorelin Sandoz 1 Monat reversibel sein. Durch den Mangel an Androgenen, welcher aus der Behandlung des Prostatakarzinoms resultiert, kann das Frakturrisiko erhöht sein.
Krampfanfälle: Im Rahmen der Marktüberwachung wurde über das Auftreten von Krampfanfällen berichtet. Teilweise handelte es sich dabei um Patienten, welche andere Risikofaktoren für Krampfanfälle aufwiesen (wie z.B. Epilepsie-Anamnese, intrakranielle Tumoren, Komedikation mit Arzneimitteln, für welche ein Risiko für Krampfanfälle bekannt ist). Es liegen jedoch auch Meldungen von Patienten ohne derartige Risikofaktoren vor.
Kardiovaskuläre Risikofaktoren/Erkrankungen
Unter der Behandlung mit GnRH-Agonisten wurde über ein erhöhtes Risiko für Diabetes mellitus und/oder kardiovaskuläre Ereignisse berichtet. Insbesondere wurde in mehreren grossen epidemiologischen Studien bei Prostatakarzinom-Patienten ein um etwa 20% erhöhtes Risiko für Myokardinfarkt und Schlaganfall beobachtet. Bei Patienten mit Vorliegen weiterer Risikofaktoren für kardiovaskuläre Ereignisse (z.B. Hypertonie, Hyperlipidämie) bzw. mit bereits bestehenden kardiovaskulären Erkrankungen sollte daher eine besonders sorgfältige Nutzen-Risiko-Abwägung erfolgen.
Vor Einleitung einer Behandlung mit Leuprorelin sollten Blutdruck, Blutglucose und Lipidprofil bestimmt werden. Während der Behandlung sollten die Patienten bezüglich dieser Risikofaktoren sowie bezüglich möglicher Symptome, welche die Entwicklung einer kardiovaskulären Erkrankung vermuten lassen, überwacht werden. Bereits bestehende Risikofaktoren (Diabetes, Hypercholesterinämie, Hypertonie) sollten adäquat, d.h entsprechend der jeweiligen Guidelines, behandelt werden.
Effekte auf das QT-Intervall
Eine Androgendeprivation kann das QT-Intervall verlängern. Bei Patienten mit einer Vorgeschichte oder einem Risiko für eine QT-Verlängerung und bei Patienten, welche gleichzeitig Arzneimittel erhalten, die eine QT-Verlängerung bewirken können (siehe unter «Interaktionen»), sollte das Nutzen-Risiko-Verhältnis, inklusive der Möglichkeit eines Auftreten von Torsades de pointes abgewogen werden, bevor eine Behandlung mit Leuprorelinacetat begonnen wird.
Im Zusammenhang mit der Anwendung von GnRH-Agonisten wurde darüber hinaus bei Männern über ein erhöhtes Risiko für einen plötzlichen Herztod berichtet.
Prostatakarzinom
Eine Therapie mit Leuprorelinacetat führt anfangs zu einem kurzfristigen Anstieg der Serumtestosteronspiegel, was mit einer vorübergehenden Verstärkung bestimmter Krankheitssymptome einhergehen kann (z.B. Muskelschwäche, Zunahme oder Neuauftreten von Knochenschmerzen, Harnwegsobstruktion, Rückenmarkskompression, Ödeme). Patienten mit drohenden neurologischen Komplikationen, Wirbelsäulenmetastasen oder Harnwegsobstruktion sollten daher während der ersten Behandlungswochen unter ständiger, möglichst stationärer Überwachung stehen.
Die zusätzliche Gabe eines geeigneten Antiandrogens kann in der Initalphase der Behandlung in Betracht gezogen werden, um mögliche Folgeerscheinungen des initialen Testosteronspiegelanstiegs und eine Verschlechterung der klinischen Symptomatik abzuschwächen.
Die anfängliche Zunahme der Beschwerden bildet sich üblicherweise spontan zurück, ohne dass Leuprorelin Sandoz 1 Monat abgesetzt werden muss. Nachfolgend kommt es zu Symptomen des Testosteronentzugs (vgl. «Unerwünschte Wirkungen»).
Die Antwort auf Leuprorelinacetat soll mittels Messungen der Serum-Testosteronspiegel und des prostataspezifischen Antigens verfolgt werden.
Nach chirurgischer Kastration bewirkt Leuprorelin Sandoz keine weitere Absenkung des Testosteronspiegels.
Interaktionen
Bis jetzt keine bekannt.
Es wurden keine Interaktionsstudien mit Leuprorelin Sandoz durchgeführt. Der Metabolismus von Leuprorelinacetat lässt Interaktionen jedoch selten erwarten, da Leuprorelin überwiegend durch Peptidasen und nicht über das Cytochrom P450 abgebaut wird und nur eine geringe Plasmaproteinbindung von ca. 46% aufweist.
Prostatakrebs
Da eine Androgen-Deprivation eine QT-Verlängerung verursachen kann, sollte die gleichzeitige Verabreichung von Leuprorelinacetat mit Arzneimitteln, welche eine QT-Intervallverlängerung oder Torsades de pointes hervorrufen können, wie Antiarrhythmika der Klasse IA (z.B. Chinidin, Disopyramid) oder der Klasse III (z.B. Amiodaron, Sotalol, Dofetilid, Ibutilid), Methadon, Moxifloxacin, Antipsychotika, etc., sorgfältig abgewogen werden. Siehe «Warnhinweise und Vorsichtsmassnahmen», Effekte auf das QT-Intervall.
Schwangerschaft/Stillzeit
Es gibt keine Indikation von Leuprorelin Sandoz bei Frauen.
Leuprorelin ist kontraindiziert während der Schwangerschaft.
Es ist nicht bekannt, ob Leuprorelin in die Muttermilch ausgeschieden wird.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Leuprorelin Sandoz 1 Monat kann das Reaktionsvermögen herabsetzen, so dass die Fähigkeit zur aktiven Teilnahme am Strassenverkehr oder zum Bedienen von Maschinen beeinträchtigt werden könnte. Dies gilt in verstärktem Mass im Zusammenhang mit Alkohol.
Unerwünschte Wirkungen
Eine Therapie mit Leuprorelinacetat führt anfangs zu einem kurzfristigen Anstieg des Serumtestosteronspiegels, was zu einer vorübergehenden Verstärkung bestimmter Krankheitssymptome führen kann (Auftreten oder Zunahme von Knochenschmerzen, Harnwegsobstruktion und deren Folgen, Rückenmarkskompressionen, Muskelschwäche in den Beinen, Lymphödeme). Diese Zunahme der Beschwerden geht üblicherweise spontan zurück, ohne dass Leuprorelin Sandoz 1 Monat abgesetzt werden muss.
Die häufigsten unerwünschten Wirkungen unter der Behandlung mit Leuprorelinacetat sind Vasodilatation (57%) und Hitzewallungen (52%), vermehrtes Schwitzen (42%), verringerte Libido (47%) sowie Potenzstörungen (45%) und Gewichtszunahme (22%).
Nachfolgend werden die unerwünschten Wirkungen nach Organsystem angegeben, welche in den klinischen Studien und während der Marktüberwachung unter Behandlung mit Leuprorelinacetat-Depotpräperaten beobachtet wurden. Die Häufigkeit sind dabei wie folgt definiert: sehr häufig (≥1/10); häufig (≥1/100 bis <1/10); gelegentlich (≥1/1000 bis <1/100); selten (≥1/10'000 bis <1/1000); sehr selten (<1/10'000), nicht bekannt: ausschliesslich aus Meldungen während der Marktüberwachung, genaue Häufigkeit kann nicht angegeben werden.
Infektionen und parasitäre Erkrankungen:
Häufig: Infektionen der Atemwege, Pharyngitis, Harnwegsinfektionen, Bronchitis.
Gelegentlich: Candidose, Pilzinfektion auf der Haut, Rhinitis.
Nicht bekannt: Pneumonie.
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen):
Nicht bekannt: Karzinome der Haut/Ohren.
Erkrankungen des Blutes und des Lymphsystems:
Häufig: Anämie.
Gelegentlich: erhöhte Retikulozyten.
Nicht bekannt: Erhöhung oder Erniedrigung der Leukozytenwerte, erniedrigte Thrombozytenzahl, verlängerte Prothrombin- und partielle Thromboplastinzeit.
Erkrankungen des Immunsystems:
Gelegentlich: Überempfindlichkeitsreaktionen (z.B. mit Fieber, Pruritus, Eosinophilie, Hautauschlag).
Nicht bekannt: anaphylaktische Reaktionen.
Endokrine Erkrankungen:
Nicht bekannt: Hypophyseninfarkt (vgl. «Warnhinweise und Vorsichtsmassnahmen»), Schilddrüsenvergrösserung.
Stoffwechsel- und Ernährungsstörungen:
Sehr häufig: Gewichtszunahme (22%).
Häufig: Anorexie, gesteigerter Appetit, verminderter Appetit, Gewichtsabnahme, Hyperglykämie, vermehrtes Durstgefühl, Hypercalciämie.
Gelegentlich: Hypoglykämie, Dehydration.
Nicht bekannt: Diabetes mellitus, Harnstofferhöhung, Hyperurikämie, Hyperlipidämie (Gesamtcholesterol, LDL-Cholesterol, Triglyceride), Hyperphosphatämie, Hypoproteinämie, erhöhtes Kreatinin, Hypokaliämie, erhöhtes BUN.
Psychiatrische Erkrankungen:
Sehr häufig: verringerte Libido (47%).
Häufig: Schlafstörungen, Angst, Schläfrigkeit, Stimmungsschwankungen, Depression, Nervosität, emotionale Labilität.
Gelegentlich: Wahnvorstellungen.
Nicht bekannt: gesteigerte Libido, Suizidalität.
Erkrankungen des Nervensystems:
Häufig: Parästhesien, Hypästhesie, Tremor, Kopfschmerzen, Schwindel.
Gelegentlich: Geschmacksstörungen, Gedächtnisstörungen, Amnesie, Gangstörung.
Nicht bekannt: Lethargie, periphere Neuropathie, neuromuskuläre Störungen, Benommenheit, Neuromyopathie, Bewusstseinverlust, transitorische ischämische Attacke, Apoplexie.
Sehr selten wurde das Auftreten von Krampfanfällen berichtet..
Augenerkrankungen:
Häufig: Sehstörungen (z.B verschwommenes Sehen), Amblyopie.
Nicht bekannt: trockene Augen, sonstige ophtalmologische Störungen.
Erkrankungen des Ohrs und des Labyrinths:
Häufig: Tinnitus, Ohrenschmerzen.
Nicht bekannt: Hörstörungen, beeinträchtigtes Hörvermögen.
Herzerkrankungen:
Häufig: Angina pectoris, Tachykardie, Arrhythmien, ventrikuläre Extrasystolen.
Gelegentlich: Herzinsuffizienz, Bradykardie.
Nicht bekannt: QT-Verlängerungen (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»), EKG-Veränderungen (z.B. Zeichen einer myokardialen Ischämie), Herzgeräusche, Palpitationen, Myokardinfarkt, AV-Block, plötzlicher Herztod (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Gefässerkrankungen:
Sehr häufig: Hitzewallungen (52%), Vasodilatation (57%).
Häufig: Thrombophlebitis, Lymphödem, Hypertonie, Synkope.
Gelegentlich: periphere Zirkulationsstörung
Nicht bekannt: Thrombose, Lungenembolie, Hypotonie, Varikosenschmerz, Schlaganfall.
Ausserdem existiert ein Einzelfallbericht über einen Patienten mit einer Thrombose der zentralen Netzhautarterie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums:
Häufig: Husten, Dyspnoe, Epistaxis, Hämoptysenis, Asthma bronchiale, akutes Lungenödem, Lungenemphysem.
Gelegentlich: chronisch-obstruktive Lungenerkrankung.
Nicht bekannt: Pleurareiben, Lungeninfiltration, Lungenfibrose, Nasennebenhöhlenverstopfung, pleurale Effusion, interstitielle Lungenerkrankung.
Erkrankungen des Gastrointestinaltrakts:
Häufig: Mundtrockenheit, Flatulenz, Obstipation, Diarrhö, Übelkeit, Erbrechen, Abdominalschmerzen, Gastritis.
Nicht bekannt: gastroduodenale Ulcera, Dysphagie, gastrointestinale Blutungen, rektale Polypen, peptische Ulcera, harte Knötchen im Rachen.
Leber- und Gallenerkrankungen:
Sehr häufig: Erhöhung der AST (20%), Erhöhung der LDH im Serum (29%).
Häufig: Leberfunktionsstörungen (z.B. Erhöhung der ALT, Erhöhung der Gamma GT).
Gelegentlich: hepatozelluläre Schädigung, cholestatische Hepatitis.
Nicht bekannt: schwere Leberschädigung, Hyperbilirubinämie, Ikterus.
Erkrankungen der Haut und des Unterhautzellgewebes:
Häufig: trockene Haut, Hautauschlag (einschliesslich makulopapulösem Exanthem), Pruritus, Urtikaria, Haarveränderungen (insbesondere Zu- oder Abnahme der Körperbehaarung), Alopezie, Ekchymose, Pigmentierstörungen.
Gelegentlich: Photosensitivitätsreaktionen, trockene Schleimhäute.
Nicht bekannt: Dermatitis, Hautläsionen, Knötchen.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen:
Sehr häufig: Knochenschmerzen (14%).
Häufig: Gelenkschmerzen (Arthralgien), Rückenschmerzen, Muskelschwäche, Schmerzen in den Extremitäten, Myalgie, Muskelkrämpfe.
Nicht bekannt: Reduktion der Knochendichte, Beckenfibrose, Gelenkstörungen (Arthropathie), Paralyse, Spinalfraktur, ankylosierende Spondylitis, Tenosynovitis, Knochenschwellung, Gliederschmerzen.
Bei einer Langzeittherapie (6−12 Monate) wurde darüber hinaus über eine Osteoporose berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen der Nieren und Harnwege:
Sehr häufig: Nykturie (17%).
Häufig: Dysurie, Pollakisurie, Hämaturie.
Gelegentlich: Harninkontinenz, Polyurie, Miktionsstörungen, Harnretention, Proteinurie.
Nicht bekannt: vermehrter Harndrang, Spasmen der Harnblase, Harnwegsobstruktion.
Erkrankungen der Geschlechtsorgane und der Brustdrüse:
Sehr häufig: Potenzstörungen (45%).
Häufig: Gynäkomastie, Hodenatrophie, PSA-Erhöhung.
Sehr selten: Brustschmerzen/-spannung /-überempfindlichkeit, Penisschwellung.
Nicht bekannt: Prostataschmerzen, Hodenschmerz.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Sehr häufig: vermehrtes Schwitzen (42%), Reaktionen an der Injektionsstelle (13%), z.B. Rötungen, Schmerzen, Ödeme, Juckreiz, Infektionen, die sich in der Regel auch bei fortgesetzter Behandlung zurückbilden, Müdigkeit/Asthenie (13%), periphere Ödeme (12%).
Häufig: Entzündungen an der Injektionsstelle (inkl. Abszesse), Frösteln, generelle Schmerzen, Schwellung (Schläfenknochen), Hypersensitivitätsreaktionen, Fieber, Unwohlsein, Schweissausbrüche, Nachtschweiss, Schüttelfrost und generelle grippeartige Symptome.
In einer Phase I Studie mit 15 Probanden, welche Leuprorelin Sandoz erhielten, wurden folgende Nebenwirkungen (Häufigkeit >1) festgestellt (siehe Tabelle 1):
Tabelle 1: Häufigste Nebenwirkungen der Phase I Studie
Symptome | Anzahl Fälle |
Abnahme der Libido | 13 |
Hitzewallungen | 9 |
Kopfschmerzen | 6 |
Schwitzen | 6 |
In den Phase II und III Studien mit 52 Patienten, welche Leuprorelin Sandoz erhielten, wurden folgende Nebenwirkungen festgestellt (siehe Tabelle 2):
Tabelle 2: Häufigste Nebenwirkungen der Phase II und III Studien
Nach Organklassen | Anzahl Patienten |
Allgemeine Erkrankungen (Hitzewallungen) | 16 |
Herzerkrankungen | 3 |
Erkrankungen der Nieren und Harnwege | 2 |
Beschwerden am Verabreichungsort | 1 |
Überdosierung
Intoxikationssymptome wurden bisher nicht beobachtet.
In klinischen Studien wurden bei Erwachsenen Dosen bis zu 20 mg/Tag über zwei Jahre verabreicht. Die unerwünschten Wirkungen unter dieser hohen Dosierung unterschieden sich nicht von jenen unter Applikation von 1 mg/Tag.
Eigenschaften/Wirkungen
ATC-Code: L02AE02
Wirkungsmechanismus und Pharmakodynamik
Der Wirkstoff Leuprorelinacetat ist ein synthetisches Analogon des natürlich vorkommenden Gonadotropin-Releasing-Hormons (GnRH), das die Freisetzung der gonadotropen Hormone LH und FSH aus dem Hypophysenvorderlappen kontrolliert. Diese Hormone stimulieren ihrerseits die testikuläre Steroidsynthese.
Im Gegensatz zum physiologischen GnRH, das pulsatil vom Hypothalamus freigesetzt wird, blockiert Leuprorelinacetat bei therapeutischer Daueranwendung die GnRH-Rezeptoren der Hypophyse kontinuierlich und verursacht nach einer initialen kurzfristigen Stimulation deren Down-Regulation. Bei Erwachsenen kommt es als Folge nach drei bis vier Wochen zu einer reversiblen hypophysären Suppression der Freisetzung der gonadotropen Hormone LH und FSH mit gleichzeitigem Abfall des Testosterons auf Kastrationsniveau.
Dieser Zustand mit tiefen Testosteron- bzw. Östrogenspiegeln bleibt während der gesamten Therapiedauer erhalten. Dies führt zu einer Wachstumshemmung von hormonabhängigen Tumoren wie des Prostatakarzinoms. Im Verlauf der Behandlung tritt dadurch eine Besserung der Symptomatik ein.
Bei wiederholter Gabe kommt es zu einer anhaltenden Senkung des Testosteronspiegels in den Kastrationsbereich, ohne dass der Testosteronspiegel wie nach erstmaliger Injektion einen vorübergehenden Anstieg zeigt.
Mit Leuprorelin Sandoz wurden 2 Studien durchgeführt. Bei der ersten Studie handelt es sich um eine randomisierte Phase III Studie, in der die Wirksamkeit und Sicherheit von Leuprorelin Sandoz bei Patienten mit fortgeschrittenem Prostatakrebs mit Lucrin Depot verglichen wurde. Die zweite Studie ist eine offene Phase II Studie, in der die Wirksamkeit und Sicherheit von Leuprorelin Sandoz an Patienten mit fortgeschrittenem Prostatakrebs untersucht wurde. Insgesamt wurden 52 Patienten mit Leuprorelin Sandoz behandelt.
Pharmakokinetik
Absorption
Leuprorelinacetat wird nach Injektionen des Implantats kontinuierlich aus dem Copolymer, bestehend aus Glykolsäure und Milchsäure im Verhältnis 1:1, über den Zeitraum von einem Monat freigesetzt. Das Copolymer wird dabei wie chirurgisches Nahtmaterial resorbiert.
Innerhalb von 1 Stunde wurden Serumspiegel von 707 pg/ml gemessen. Nachweisbare Serumspiegel liegen für mehr als 4 Wochen vor.
In der Phase l Studie bei 15 gesunden Probanden waren nach zwei Injektionen von Leuprorelin Sandoz im Abstand von 28 Tagen Leuprorelinspiegel bis zu 39 Tage nach der zweiten Applikation nachweisbar. Zwischen Tag 42 und 49 nach der Zweitapplikation wurde ein Anstieg des Testosteronspiegels ausserhalb des Kastrationsbereichs beobachtet.
Distribution/Metabolismus/Elimination
Distribution, Metabolismus und Elimination von Leuprorelinacetat wurden im Menschen nicht vollständig abgeklärt.
Das Verteilungsvolumen beträgt 36 Liter, die totale Clearance liegt bei 139,6 ml/min. Die Halbwertszeit für die nicht retardierte Substanz beträgt 2,9 Stunden.
Bei wiederholter Gabe kommt es zu einer anhaltenden Senkung des Testosteronspiegels in den Kastrationsbereich, ohne dass der Testosteronspiegel wie nach erstmaliger Injektion einen vorübergehenden Anstieg zeigt.
Kinetik spezieller Patientengruppen
Kinder/Jugendliche: Es liegen keine Daten zur Pharmakokinetik von Leuprorelin Sandoz bei Kindern und Jugendlichen vor.
Ältere Patienten: Die Pharmakokokinetik bei älteren Patienten unterscheidet sich nicht in relevanter Weise von jener bei jüngeren Erwachsenen.
Leber- und Niereninsuffizienz: Bei Patienten mit eingeschränkter Nierenfunktion wurden teilweise höhere Serumspiegel an Leuprorelinacetat gemessen, bei Patienten mit eingeschränkter Leberfunktion dagegen verminderte Werte.
Die klinische Signifikanz dieser Beobachtung ist unbekannt.
Präklinische Daten
Mutagenität
Untersuchungen zur Mutagenität (in vitro und in vivo) haben keine Zeichen eines mutagenen Potentials von Leuprorelin erkennen lassen.
Karzinogenität
In Karzinogenitätsstudien wurden Mäuse und Ratten während 2 Jahren mit Leuprorelin behandelt. Nach 24 Monaten konnte bei Ratten nach subkutaner Verabreichung von 0,6 bis 4 mg/kg eine dosisabhängige Zunahme von gutartigen hypophysären Hyperplasien und Adenomen beobachtet werden. Weiterhin wurde eine dosisunabhängige Zunahme von Adenomen der Hodenzwischenzellen bei männlichen Tieren festgestellt. Bei Mäusen verursachten Dosierungen bis zu 60 mg/kg, welche ebenfalls während 2 Jahren verabreicht wurden, keine durch Leuprorelin induzierte Tumore oder Anomalien der Hypophyse.
Reproduktionstoxizität
Untersuchungen mit subkutaner Verabreichung von Leuprorelin an Ratten bei Dosen bis 10 µg/kg und an Kaninchen bei Dosen bis 1 µg/kg haben keine Hinweise auf ein teratogenes Potential ergeben. Embryotoxische/embryoletale Wirkungen wurden bei der Ratte bei einer Dosis von 10 µg/kg und beim Kaninchen bei Dosen über 0,1 µg/kg beobachtet.
Sonstige Hinweise
Inkompatibilitäten
Bis jetzt keine bekannt.
Beeinflussung diagnostischer Methoden
Bis jetzt keine bekannt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung, im verschlossenen Sterilbeutel, nicht über 30 °C und ausser Reichweite von Kindern lagern.
Hinweise für die Handhabung
| ||
| ||
| ||
| ||
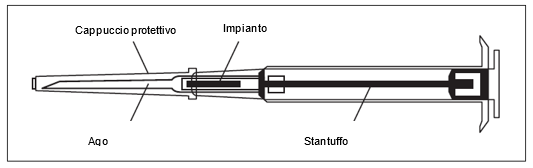
Bitte beachten: Der Kolben lässt sich zur Injektion des Implantats nur dann nach vorne schieben, wenn er zuvor vollständig zurückgezogen wurde! | ||
| ||
| ||
|
| |
|
| |
| ||
|
| |
Zulassungsnummer
57449 (Swissmedic).
Zulassungsinhaberin
Sandoz Pharmaceuticals AG, Risch; Domizil: Rotkreuz.
Stand der Information
Mai 2019.
Composizione
Principio attivo: Leuprorelinum ut leuprorelini acetas.
Sostanze ausiliarie: Copoly(dl-lactidum-glycolidum) pro praeparatione.
Forma farmaceutica e quantità di principio attivo per unità
Una siringa preriempita con un impianto contiene 3,6 mg di Leuprorelinum ut leuprorelini acetas.
Indicazioni/Possibilità d'impiego
Trattamento sintomatico del carcinoma ormono-dipendente avanzato della prostata. Come trattamento alternativo se l'orchiectomia o l'impiego di estrogeni non sono indicati per il paziente o non sono accettabili.
Posologia/Impiego
Posologia abituale
La dose raccomandata è 3,6 mg di leuprorelina in dose singola ogni 4 settimane.
Modo di somministrazione
L'impianto viene inserito sotto la cute (per via sottocutanea) nella regione addominale. La sede di iniezione nella regione addominale deve essere cambiato ogni mese.
L'uso di Leuproréline Sandozè destinato esclusivamente ai pazienti adulti di sesso maschile e deve avvenire esclusivamente sotto la supervisione di un medico esperto nella terapia dei tumori. Per la fase iniziale del trattamento, deve essere presa in considerazione la somministrazione concomitante di un antiandrogeno appropriato al fine di attenuare le possibili conseguenze dell'aumento iniziale del livello di testosterone e il transitorio peggioramento della sintomatologia clinica.
La risposta al trattamento con leuprorelina acetato viene controllata misurando il livello di testosterone sierico e di antigene prostatico specifico (PSA).
Istruzioni posologiche speciali
Bambini/adolescenti: l'efficacia e la sicurezza di Leuproréline Sandoz 1 mese nei bambini e adolescenti non sono state ancora studiate.
Pazienti anziani: non è necessario alcun aggiustamento della dose in funzione dell'età.
Insufficienza epatica e renale: non è necessario alcun aggiustamento della dose (vedere «Farmacocinetica»).
Controindicazioni
Ipersensibilità al principio attivo, sotto forma di nonapeptide o decapeptide, o alla sostanza ausiliaria secondo la composizione.
Leuproréline Sandoz non è indicato in presenza di accertata ormonoindipendenza del carcinoma.
Avvertenze e misure precauzionali
Reazioni di ipersensibilità
Sono stati riferiti singoli casi di reazioni anafilattiche. Sono state riferite reazioni allergiche sotto forma di reazioni di ipersensibilità nella sede di iniezione e di reazioni sistemiche.
Se le reazioni locali sono marcate, ciò può compromettere l'assorbimento della leuprorelina dal depot. In tal caso si deve controllare il livello di testosterone.
Apoplessia ipofisaria
Nell'ambito del monitoraggio post-commercializzazione, dopo somministrazione di agonisti dell'ormone di rilascio delle gonadotropine (GnRH) raramente sono stati riferiti casi di apoplessia ipofisaria (sindrome clinica secondaria di un infarto dell'ipofisi). Nella maggior parte dei casi è stato diagnosticato un adenoma ipofisario. La maggior parte dei casi di apoplessia ipofisaria si è manifestata per lo più nell'arco di 2 settimane, alcuni nell'arco della prima ora, dopo somministrazione della prima dose. In tali casi, l'apoplessia ipofisaria si è manifestata con improvvisa comparsa di cefalea, vomito, disturbi visivi, oftalmoplegia, alterazione dello stato mentale e talvolta collasso cardiovascolare. È stato necessario consultare immediatamente un medico.
Per questo motivo, in presenza di adenoma ipofisario noto, non si deve somministrare un agonista del GnRH.
Rischio di suicidio: nei pazienti in trattamento con agonisti del GnRH sussiste un rischio più elevato di insorgenza di depressione (che può essere grave). I pazienti con preesistente depressione possono essere a rischio di suicidio.
Densità ossea/rischio di fratture ossee: la presenza di bassi livelli di estrogeno può alterare la densità ossea. La riduzione della densità ossea dopo sospensione della terapia con Leuproréline Sandoz 1 mese può essere reversibile. Il deficit di androgeni conseguente al trattamento del carcinoma prostatico può aumentare il rischio di fratture ossee.
Crisi convulsive: in ambito della sorveglianza post-commercializzazione sono stati segnalati casi di crisi convulsive. In parte si è trattato di pazienti con altri fattori di rischio per crisi convulsive (come, ad esempio, epilessia pregressa, tumori intracranici, trattamento concomitante con medicamenti con rischio noto per crisi convulsive). Tuttavia, sono stati riferiti anche casi di pazienti senza tali fattori di rischio.
Fattori di rischio cardiovascolari/per malattie cardiovascolari
Durante la terapia con agonisti del GnRH è stato riferito un aumentato rischio di diabete mellito e/o di eventi cardiovascolari. In particolare, diversi studi epidemiologici su popolazioni numerose di pazienti affetti da carcinoma della prostata hanno rilevato un aumento di circa il 20% del rischio di infarto miocardico e ictus. Nei pazienti con presenza di altri fattori di rischio cardiovascolare (ad es. ipertensione, iperlipidemia) e con patologie cardiovascolari pregresse, prima di iniziare il trattamento con leuprorelina si deve valutare con particolare attenzione il rapporto rischio-beneficio.
Prima di iniziare il trattamento con leuprorelina si deve effettuare un controllo della pressione arteriosa, dei livelli ematici di glicemia e del profilo lipidico. Durante il trattamento, i pazienti devono essere tenuti sotto sorveglianza per tali fattori di rischio e anche per l'insorgenza di possibili sintomi di sospetta malattia cardiovascolare. In presenza di preesistenti fattori di rischio (diabete, ipercolesterolemia, ipertensione), si richiede un trattamento adeguato, vale a dire nel rispetto delle rispettive linee guida.
Effetti sull'intervallo QT
La terapia di deprivazione androgenica può prolungare l'intervallo QT. Nei pazienti con prolungamento dell'intervallo QT nell'anamnesi o con fattori di rischio per tale anomalia cardiaca, come anche nei pazienti in terapia con medicamenti concomitanti che possono prolungare l'intervallo QT (vedere «Interazioni»), prima di iniziare il trattamento con leuprorelina acetato si deve valutare il rapporto rischio-beneficio, inclusa la possibilità di insorgenza di torsioni di punta.
Con riferimento all'impiego di agonisti del GnRH, negli uomini è stato riferito anche un maggior rischio di morte cardiaca improvvisa.
Carcinoma della prostata
La terapia con leuprorelina acetato induce inizialmente un incremento, di breve durata, del testosterone sierico, che può causare a sua volta un transitorio peggioramento della sintomatologia clinica (ad es. debolezza muscolare, insorgenza o peggioramento di dolore osseo, ostruzione delle vie urinarie e relative conseguenze, compressioni midollari, edemi). Ciò giustifica, quindi, un costante monitoraggio, meglio se in condizioni di ricovero, dei pazienti con rischio di complicanze neurologiche, metastasi vertebrali od ostruzione delle vie urinarie durante le prime settimane di trattamento.
Nelle prime fasi del trattamento si può considerare l'associazione di un antiandrogeno idoneo per contrastare le possibili conseguenze dell'iniziale innalzamento della testosteronemia e un peggioramento della sintomatologia clinica.
L'iniziale peggioramento dei disturbi regredisce di solito spontaneamente senza la necessità di sospendere il trattamento con Leuproréline Sandoz 1 mese. Successivamente si hanno i sintomi della soppressione della secrezione testosteronica (vedere «Effetti indesiderati»).
La risposta al trattamento con leuprorelina acetato viene controllata misurando il livello di testosterone sierico e di antigene prostatico specifico (PSA).
Secondariamente alla castrazione chirurgica, Leuproréline Sandoz non induce alcun ulteriore abbassamento della testosteronemia.
Interazioni
Non sono note al momento interazioni.
Non sono stati condotti studi di interazione tra Leuproréline Sandoz e altri medicamenti. Tuttavia, tenuto conto del metabolismo della leuprorelina acetato, si prevedono solo raramente interazioni, poiché la leuprorelina è degradata dalle peptidasi e non dal citocromo P450 e mostra solo una modesta formazione di proteine plasmatiche (circa il 46%).
Carcinoma della prostata
Poiché il trattamento di deprivazione androgenica può indurre un prolungamento dell'intervallo QT, l'uso concomitante di leuprorelina acetato con altri medicamenti noti per prolungare l'intervallo QT o in grado di indurre torsioni di punta, come gli antiaritmici di classe IA (es. chinidina, disopiramide) o di classe III (es. amiodarone, sotalolo, dofetilide, ibutilide), metadone, moxifloxacina, antipsicotici, ecc. richiede un'attenta valutazione. Vedere «Avvertenze e misure precauzionali», Effetti sull'intervallo QT.
Gravidanza/Allattamento
Non vi è alcuna indicazione circa l'uso di Leuproréline Sandoz nelle donne.
Leuprorelina è controindicato per l'utilizzo in gravidanza.
Non è noto se la leuprorelina venga escreta nel latte materno.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Leuproréline Sandoz 1 mese può rallentare i riflessi, per cui potrebbe alterare la capacità di avere un ruolo attivo nella circolazione stradale o di usare macchine. Ciò vale in maggior misura in concomitanza all'assunzione di alcool.
Effetti indesiderati
La terapia con leuprorelina acetato induce inizialmente un incremento, di breve durata, del testosterone sierico, che può causare a sua volta un transitorio peggioramento della sintomatologia clinica (insorgenza o peggioramento di dolore osseo, ostruzione delle vie urinarie e relative conseguenze, compressioni midollari, debolezza muscolare agli arti inferiori, linfedema). Questo peggioramento dei disturbi regredisce di solito spontaneamente senza la necessità di sospendere il trattamento con Leuproréline Sandoz 1 mese.
Gli effetti indesiderati più comuni riscontrati con leuprorelina acetato sono vasodilatazione (57%) e vampate di calore (52%), aumento della sudorazione (42%), diminuzione della libido (47%), disfunzione erettile (45%) e aumento ponderale (22%).
Si riportano di seguito gli effetti indesiderati classificati per sistemi e organi, che sono stati osservati negli studi clinici e durante la sorveglianza post-commercializzazione in corso di terapia con formulazioni depot contenenti leuprorelina acetato. La frequenza è definita come: molto comune (≥1/10), comune (≥1/100 fino a <1/10), non comune (≥1/1000 fino a <1/100), raro (≥1/10'000 fino a <1/1000), molto raro (<1/10'000), non nota: non è possibile stabilire una frequenza esatta per questi effetti indesiderati esclusivamente sulla base di studi post-commercializzazione.
Infezioni ed infestazioni:
Comune: infezioni delle vie respiratorie, faringite, infezioni delle vie urinarie, bronchite.
Non comune: candidosi, micosi cutanea, rinite.
Non nota: polmonite.
Tumori benigni, maligni e non specificati (cisti e polipi compresi):
Non nota: carcinomi della cute/orecchio.
Patologie del sistema emolinfopoietico:
Comune: anemia.
Non comune: innalzamento dei reticolociti.
Non nota: innalzamento o diminuzione dei livelli dei leucociti, diminuzione dei livelli dei trombociti, prolungamento del tempo di protrombina e di tromboplastina parziale.
Disturbi del sistema immunitario:
Non comune: reazioni allergiche (es. con febbre, prurito, eosinofilia, eruzione cutanea).
Non nota: reazioni anafilattiche.
Patologie endocrine:
Non nota: infarto dell'ipofisi (vedere «Avvertenze e misure precauzionali»), iperplasia tiroidea.
Disturbi del metabolismo e della nutrizione:
Molto comune: aumento ponderale (22%).
Comune: anoressia, aumento dell'appetito, riduzione dell'appetito, calo ponderale, iperglicemia, aumento della sete, ipercalcemia.
Non comune: ipoglicemia, disidratazione.
Non nota: diabete mellito, aumento dell'urea, iperuricemia, iperlipidemia (colesterolo totale, colesterolo LDL, trigliceridi), iperfosfatemia, ipoproteinemia, innalzamento della creatinina, ipopotassiemia, innalzamento del BUN.
Disturbi psichiatrici:
Molto comune: diminuzione della libido (47%).
Comune: disturbi del sonno, ansia, sonnolenza, sbalzi d'umore, depressione, nervosismo, labilità emotiva.
Non comune: deliri.
Non nota: aumento della libido, suicidalità.
Patologie del sistema nervoso:
Comune: parestesie, ipoestesie, tremore, cefalea, vertigini.
Non comune: disgeusia, disturbi del pensiero, amnesia, disturbo della deambulazione.
Non nota: letargia, neuropatia periferica, disturbi neuromuscolari, stordimento, neuromiopatia, perdita di coscienza, attacchi ischemici transitori, apoplessia.
Molto raramente è stata riferita l'insorgenza di crisi convulsive.
Patologie dell'occhio:
Comune: disturbi visivi (ad es. vista annebbiata), ambliopia.
Non nota: sindrome dell'occhio secco, altri disturbi oftalmologici.
Patologie dell'orecchio e del labirinto:
Comune: tinnito, dolore alle orecchie.
Non nota: disturbi uditivi, compromissione dell'udito.
Patologie cardiache:
Comune: angina pectoris, tachicardia, aritmie, extrasistole ventricolari.
Non comune: insufficienza cardiaca, bradicardia.
Non nota: prolungamento dell'intervallo QT (vedere «Avvertenze e misure precauzionali» e «Interazioni»), alterazioni all'ECG (ad es. segni di ischemia miocardica), rumori cardiaci, palpitazioni, infarto miocardico, blocco atrioventricolare, morte cardiaca improvvisa (cfr. «Avvertenze e misure precauzionali»).
Patologie vascolari:
Molto comune: vampate di calore (52%), vasodilatazione (57%).
Comune: tromboflebite, linfedema, ipertensione, sincope.
Non comune: disturbo circolatorio periferico.
Non nota: trombosi, embolia polmonare, ipotensione, dolore lungo una vena varicosa, ictus.
È stato, inoltre, riferito il caso di un paziente con trombosi dell'arteria centrale della retina.
Patologie respiratorie, toraciche e mediastiniche:
Comune: tosse, dispnea, epistassi, emottisi, asma bronchiale, edema polmonare acuto, enfisema polmonare.
Non comune: broncopneumopatia cronica ostruttiva.
Non nota: pleurite, infiltrato polmonare, fibrosi polmonare, ostruzione dei seni paranasali, effusione pleurica, malattia polmonare interstiziale.
Patologie gastrointestinali:
Comune: secchezza delle fauci, flatulenza, costipazione, diarrea, nausea, vomito, dolore addominale, gastrite.
Non nota: ulcera gastroduodenale, disfagia, emorragie gastrointestinali, polipi rettali, ulcera peptica, noduli duri in gola.
Patologie epatobiliari:
Molto comune: innalzamento dell'AST (20%), innalzamento dell'LDH nel siero (29%).
Comune: disturbi della funzione epatica (es. innalzamento dell'ALT, innalzamento della gamma GT).
Non comune: danno epatocellulare, epatite colestatica.
Non nota: danno epatico grave, iperbilirubinemia, ittero.
Patologie della cute e del tessuto sottocutaneo:
Comune: cute secca, eruzione cutanea (incluso esantema maculopapuloso), prurito, orticaria, modificazioni dei capelli (in particolare maggiore crescita o caduta dei peli), alopecia, ecchimosi, disturbi della pigmentazione.
Non comune: reazioni di fotosensibilità, secchezza delle mucose.
Non nota: dermatite, lesioni cutanee, noduli.
Patologie del sistema muscoloscheletrico e del tessuto connettivo:
Molto comune: dolore osseo (14%).
Comune: dolore articolare (artralgie), dolori alla schiena, debolezza muscolare, dolore localizzato agli arti, mialgia, crampi muscolari.
Non nota: riduzione della densità ossea, fibrosi pelvica, disturbi articolari (artropatia), paralisi, frattura spinale, spondilite anchilosante, tenosinovite, gonfiore osseo, dolore articolare.
Nel corso di una terapia a lungo termine (6−12 mesi) è stata riferita inoltre l'insorgenza di osteoporosi (vedere «Avvertenze e misure precauzionali»).
Patologie renali e urinarie:
Molto comune: nicturia (17%).
Comune: disuria, pollachiuria, ematuria.
Non comune: incontinenza urinaria, poliuria, disturbi della minzione, ritenzione urinaria, proteinuria.
Non nota: aumento della minzione, spasmi vescicali, ostruzione delle vie urinarie.
Patologie dell'apparato riproduttivo e della mammella:
Molto comune: disfunzione erettile (45%).
Comune: ginecomastia, atrofia del testicolo, innalzamento del livello di PSA.
Molto raro: dolore/tensione/ipersensibilità delle mammelle, edema penieno.
Non nota: dolore prostatico, dolore localizzato al testicolo.
Patologie sistemiche e condizioni relative alla sede di somministrazione:
Molto comune: aumento della sudorazione (42%), reazioni nella sede di iniezione (13%), ad es. arrossamenti, dolore, edema, prurito, infezioni, che di solito regrediscono anche se si prosegue il trattamento, stanchezza/astenia (13%), edemi periferici (12%).
Comune: infiammazioni nella sede di iniezione (incl. ascessi), brividi, dolore generalizzato, gonfiore (ossa temporali), reazioni di ipersensibilità, febbre, malessere, sudorazione, sudorazione notturna e sintomi simil-influenzali generici.
Nell'ambito di uno studio di fase I, su 15 volontari trattati con Leuproréline Sandoz sono stati riscontrati i seguenti effetti collaterali (frequenza >1) (vedere Tabella 1):
Tabella 1: Effetti più comuni riscontrati nello studio di fase I
Sintomi | Numero di casi |
Diminuzione della libido | 13 |
Vampate di calore | 9 |
Cefalea | 6 |
Sudorazione | 6 |
Nell'ambito di studi di fase II e III, su 52 pazienti trattati con Leuproréline Sandoz sono stati riscontrati i seguenti effetti collaterali (vedere Tabella 2):
Tabella 2: Effetti più comuni riscontrati negli studi di fase II e III
Classificati per sistemi e organi | Numero di pazienti |
Patologie generali (vampate di calore) | 16 |
Patologie cardiache | 3 |
Patologie renali e urinarie | 2 |
Condizioni nella sede di somministrazione | 1 |
Posologia eccessiva
Non sono stati finora osservati sintomi di intossicazione.
Negli studi clinici sono state somministrate a pazienti adulti dosi fino a 20 mg/die per un periodo di due anni. Gli effetti indesiderati osservati con un dosaggio così elevato non sono diversi da quelli riscontrati con la somministrazione di 1 mg/die.
Proprietà/Effetti
Codice ATC: L02AE02
Meccanismo d'azione e farmacodinamica
La leuprorelina acetato è un analogo sintetico dell'ormone naturale di rilascio delle gonadotropine (GnRH), che regola il rilascio degli ormoni gonadotropi LH e FSH dai lobi anteriori dell'ipofisi. Questi ormoni stimolano, a loro volta, la sintesi degli steroidi testicolari.
A differenza del GnRH fisiologico, che viene secreto in maniera pulsatile dall'ipotalamo, la leuprorelina acetato utilizzata a lungo termine a scopo terapeutico induce il blocco continuo dei recettori del GnRH dell'ipofisi causando in questo modo un'iniziale stimolazione, di breve durata, della loro sottoregolazione. Negli adulti, dopo tre-quattro settimane, ciò determina a soppressione ipofisaria reversibile del rilascio degli ormoni gonadotropi LH e FSH con concomitante diminuzione del livello sierico del testosterone a livelli equivalenti a quelli osservati dopo castrazione.
Questa condizione con livelli molto bassi di testosterone ed estrogeni perdura per tutta la durata della terapia. Ciò ha l'effetto di inibire la crescita di tumori ormono-dipendenti come il carcinoma prostatico. Nel corso del trattamento ciò induce un miglioramento della sintomatologia.
Il proseguimento della terapia comporta un abbassamento del testosterone sierico a livelli equivalenti a quelli osservati dopo castrazione, senza che il valore del testosterone evidenzi un temporaneo innalzamento come dopo l'iniezione iniziale.
Con Leuproréline Sandoz sono stati condotti 2 studi. Il primo è uno studio randomizzato di fase III che ha confrontato l'efficacia e la sicurezza di Leuproréline Sandoz nei pazienti con carcinoma della prostata avanzato trattati con Lucrin formulazione depot. Il secondo è uno studio aperto di fase II che ha valutato l'efficacia e la sicurezza di Leuproréline Sandoz nei pazienti con carcinoma della prostata avanzato. Nel complesso sono stati trattati con Leuproréline Sandoz 52 pazienti.
Farmacocinetica
Assorbimento
Dopo l'iniezione dell'impianto, la leuprorelina acetato viene rilasciata in modo costante per circa un mese dal copolimero composto da acido glicolico e acido lattico in rapporto 1:1. Il copolimero viene assorbito in questo modo come fosse un materiale di sutura.
Nell'arco di un'ora sono stati misurati livelli sierici di 707 pg/ml. Livelli sierici misurabili persistono per più di 4 settimane.
Nello studio di fase I su 15 soggetti sani, dopo due iniezioni di Leuproréline Sandoz a distanza di 28 giorni l'una dall'altra, i livelli di leuprorelina sono stati misurabili fino a 39 giorni dopo la seconda somministrazione. Tra il giorno 42 e il giorno 49 dopo la seconda somministrazione il livello di testosterone è risultato più elevato rispetto al valore registrato dopo castrazione.
Distribuzione/metabolismo/eliminazione
Distribuzione, metabolismo ed eliminazione di leuprorelina acetato nell'uomo non sono ancora del tutto chiari.
Il volume di distribuzione è di 36 l, la clearance totale di 139,6 ml/min. L'emivita per la sostanza non retard è di 2,9 ore.
Il proseguimento della terapia comporta un abbassamento del testosterone sierico a livelli equivalenti a quelli osservati dopo castrazione, senza che il valore del testosterone evidenzi un temporaneo innalzamento come dopo l'iniezione iniziale.
Cinetica di gruppi di pazienti speciali
Bambini/adolescenti: non sono disponibili dati relativamente alle proprietà farmacocinetiche di Leuproréline Sandoz nei bambini e adolescenti.
Pazienti anziani: la farmacocinetica nei pazienti anziani non mostra differenze rilevanti rispetto a quella che si osserva negli adulti più giovani.
Insufficienza epatica e renale: i livelli sierici di leuprorelina acetato sono risultati in parte più elevati nei pazienti con disturbi della funzionalità renale e più bassi in quelli con disturbi della funzionalità epatica.
Non si conosce la significatività di quest'osservazione.
Dati preclinici
Mutagenicità
Gli studi sulla mutagenicità (in vitro e in vivo) non hanno fornito alcuna prova circa il potenziale mutageno.
Cancerogenicità
In alcuni studi sulla cancerogenicità, topi e ratti sono stati trattati con la leuprorelina per 2 anni. Nei ratti, la somministrazione sottocutanea di 0,6−4 mg/kg per 24 mesi ha prodotto un incremento dose-dipendente di iperplasie e adenomi ipofisari benigni. Un incremento dose-indipendente è stato osservato anche con riferimento agli adenomi delle cellule interstiziali del testicolo. Nei topi, la somministrazione di dosi fino a 60 mg/kg per un periodo di 2 anni non ha favorito l'insorgenza di tumori né di anomalie dell'ipofisi riconducibili alla leuprorelina.
Tossicità per la riproduzione
Nel corso di studi sulla tossicità riproduttiva con somministrazione sottocutanea di leuprorelina nei ratti (fino a 10 µg/kg) e nei conigli (fino a 1 µg/kg) non è stata dimostrata alcuna prova con riferimento al potenziale teratogeno. Effetti embriotossici/embrioletali sono stati osservati nei ratti con una dose di 10 µg/kg e nei conigli con dosi superiori a 0,1 µg/kg.
Altre indicazioni
Incompatibilità
Non sono note al momento interazioni.
Influenza su metodi diagnostici
Non sono note al momento interazioni.
Stabilità
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni particolari concernenti l'immagazzinamento
Conservare nella confezione originale, nella busta sterile chiusa, non al di sopra di 30 °C e fuori dalla portata dei bambini.
Indicazioni per la manipolazione
| ||
| ||
| ||
Attenzione: lo stantuffo può essere spinto in avanti per iniettare l'impianto solo se in precedenza è stato tirato completamente indietro nella posizione di fermo! | ||
| ||
| ||
|
| |
|
| |
| ||
|
| |
Numero dell'omologazione
57449 (Swissmedic)
Titolare dell’omologazione
Sandoz Pharmaceuticals AG, Risch; domicilio: Rotkreuz
Stato dell'informazione
Maggio 2019
Composition
Principe actif: Leuprorelinum ut leuprorelini acetas.
Excipients: Copoly(dl-lactidum-glycolidum) pro praeparatione.
Forme galénique et quantité de principe actif par unité
1 seringue préremplie avec un implant contient 3,6 mg Leuprorelinum ut leuprorelini acetas.
Indications/Possibilités d’emploi
Traitement symptomatique des carcinomes prostatiques évolués, hormono-dépendants. A titre d'alternative, lorsqu'une orchidectomie ou l'administration d'oestrogènes n'est pas indiquée ou difficile à imposer au patient.
Posologie/Mode d’emploi
Posologie usuelle
Il est recommandé d'administrer 3,6 mg de leuproréline en dose unique toutes les 4 semaines.
Mode d'emploi
L'implant est injecté en sous-cutané dans la région abdominale. Changer le point d'injection - mais toujours au niveau de la région abdominale - chaque mois.
L'administration de Leuproréline Sandoz n'est autorisée que chez les hommes adultes et ne doit se faire que sous la surveillance d'un médecin expérimenté en oncologie.
A la phase initiale du traitement, il convient d'envisager l'administration complémentaire d'un anti-androgène approprié afin d'atténuer les conséquences éventuelles de l'élévation initiale de la testostérone et l'aggravation temporaire des symptômes cliniques.
Il faut suivre la réponse à l'acétate de leuproréline en mesurant les taux sériques de testostérone et d'antigène prostatique spécifique.
Recommandations posologiques spéciales
Enfants/adolescents: L'efficacité et la sécurité d'emploi de Leuproréline Sandoz 1 mois n'ont pas été évaluées chez l'enfant et l'adolescent.
Patients âgés: Une adaptation de la dose en fonction de l'âge n'est pas nécessaire.
Insuffisance hépatique et rénale: Une adaptation de la dose n'est pas nécessaire (cf. «Pharmacocinétique»).
Contre-indications
Hypersensibilité au principe actif, aux nonapeptides ou décapeptides similaires ou à l'un des excipients selon composition.
Leuproréline Sandoz n'est pas indiqué si le carcinome s'avère non hormono-dépendant.
Mises en garde et précautions
Réactions d'hypersensibilité
Des cas isolés d'anaphylaxie ont été déclarés. Des réactions allergiques se manifestant par des réactions d'hypersensibilité au point d'injection et des réactions systémiques ont été observées.
Les réactions locales marquées peuvent amoindrir la résorption de la leuproréline à partir du dépôt. Dans un tel cas, il convient de déterminer le taux de testostérone.
Apoplexie hypophysaire
Dans le cadre de la surveillance post-marketing, de rares cas d'apoplexie hypophysaire (un syndrome clinique secondaire à un infarctus de l'hypophyse) ont été rapportés à la suite de l'administration d'analogues de la gonadoréline (GnRH). Un adénome hypophysaire a été diagnostiqué dans la plupart de ces cas. La majorité de ces cas d'apoplexie hypophysaire se sont produits en l'espace de 2 semaines – et certains même en l'espace d'une heure – après l'administration de la première dose. Chez ces patients, l'apoplexie hypophysaire s'est manifestée par des céphalées soudaines, des vomissements, des anomalies visuelles, une ophtalmoplégie, un état mental altéré et parfois un collapsus cardio-vasculaire. Un traitement médical immédiat était nécessaire.
Par conséquent, les patients souffrant d'un adénome hypophysaire connu ne doivent pas être traités par un agoniste de la GnRH.
Risque de suicide: Le risque de survenue de dépression (qui peut être grave) est accru chez les patients traités par des agonistes de la GnRH. Les patients souffrant de dépression préexistante peuvent présenter un risque suicidaire.
Densité osseuse/risque de fracture: Des modifications de la densité osseuse peuvent apparaître lors d'une situation hypo-œstrogénique. La baisse de la densité osseuse peut être réversible après l'arrêt de Leuproréline Sandoz 1 mois. La carence en androgènes résultant du traitement du carcinome de la prostate peut augmenter le risque de fracture.
Convulsions: Dans le cadre de la pharmacovigilance, on a rapporté la survenue de convulsions. Il s'agissait à cet égard en partie de patients qui présentaient d'autres facteurs de risque de convulsions (comme par exemple, anamnèse d'épilepsie, tumeur intracrânienne, comédication avec des médicaments pour lesquels un risque de convulsions est connu). Toutefois, il existe également des rapports de patients qui ne présentent pas ces facteurs de risque.
Facteurs de risque cardio-vasculaire/maladies cardio-vasculaires
Sous traitement par agonistes de la GnRH, on a rapporté un risque accru de diabète sucré et/ou d'événements cardio-vasculaires. En particulier, dans plusieurs études épidémiologiques importantes chez des patients présentant un cancer de la prostate, on a observé un risque accru de 20% environ d'infarctus du myocarde et d'accident vasculaire cérébral. Chez les patients chez lesquels d'autres facteurs de risque cardio-vasculaire (par exemple, hypertension artérielle, hyperlipidémie) existent ou qui présentent des maladies cardio-vasculaires préexistantes, une évaluation soigneuse du rapport bénéfice/risque doit être effectuée.
Avant l'instauration d'un traitement par la leuproréline, la pression artérielle, la glycémie et le profil lipidique doivent être déterminés. Pendant le traitement, une surveillance s'impose chez les patients pour lesquels ces facteurs de risque ainsi que les symptômes pouvant y être liés laissent présumer du développement d'une maladie cardio-vasculaire. Des facteurs de risque déjà présents (diabète sucré, hypercholestérolémie, hypertension artérielle) doivent être traités de façon appropriée, c'est-à-dire selon chacune des directives.
Effets sur l'intervalle QT
La privation androgénique peut prolonger l'intervalle QT. Chez les patients présentant des antécédents ou des facteurs de risques de l'allongement de l'intervalle QT ainsi que chez les patients recevant de manière concomitante des médicaments susceptibles d'allonger l'intervalle QT (voir «Interactions»), il faut évaluer le rapport bénéfice-risque en tenant compte du risque potentiel de torsades de pointe avant d'initier un traitement par acétate de leuproréline.
De plus, en relation avec l'utilisation d'agonistes de la GnRH, on a rapporté chez l'homme un risque accru de mort subite d'origine cardiaque.
Carcinome de la prostate
Un traitement par acétate de leuproréline entraîne initialement une augmentation de courte durée du taux sérique de testostérone, qui peut être accompagnée par une intensification passagère de certains symptômes de la maladie (par exemple faiblesse musculaire, augmentation ou apparition de douleurs osseuses, obstruction des voies urinaires, compression médullaire, œdème). Les patients qui présentent un risque de complications neurologiques, des métastases vertébrales ou une obstruction des voies urinaires doivent de ce fait, autant que possible, rester sous observation constante à l'hôpital pendant les premières semaines du traitement.
On peut envisager l'administration supplémentaire d'un anti-androgène adapté lors de la première phase du traitement pour atténuer les éventuelles manifestations consécutives à la hausse initiale du taux de testostérone et une aggravation des symptômes cliniques.
L'augmentation initiale des douleurs rétrocède spontanément, généralement sans arrêt du traitement par Leuproréline Sandoz. Par la suite, surviennent des symptômes liés au sevrage de la testostérone (cf. «Effets indésirables»).
La réponse à l'acétate de leuproréline doit être vérifiée à l'aide de mesures du taux sérique de testostérone et de l'antigène prostate spécifique.
Après castration chirurgicale, Leuproréline Sandoz n'entraîne aucune diminution supplémentaire du taux de testostérone.
Interactions
Aucune interaction connue à ce jour.
Aucune étude d'interaction n'a été réalisée avec Leuproréline Sandoz. Cependant, d'après le métabolisme de l'acétate de leuproréline, les interactions devraient être rares: en effet, la leuproréline est dégradée principalement par des peptidases et non pas par le cytochrome P 450, et la liaison aux protéines plasmatiques n'est que d'environ 46%
Cancer de la prostate
Puisqu'une privation androgénique peut entraîner une prolongation de l'intervalle QT, il faut soigneusement évaluer le risque d'une administration concomitante d'acétate de leuproréline et de médicaments pouvant provoquer des torsades de pointes comme les antiarythmiques de la classe IA (p.ex. quinidine, disopyramide) ou de la classe III (p.ex. amiodarone, sotalol, dofétilide, ibutilide), la méthadone, la moxifloxacine, les antipsychotiques, etc. Voir «Mises en garde et précautions», effets sur l'intervalle QT.
Grossesse/Allaitement
Il n'existe pas d'indication de Leuproréline Sandoz chez les femmes.
La leuproréline est contre-indiquée lors de la grossesse.
On ignore si la leuproréline est excrétée dans le lait maternel.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Comme Leuproréline Sandoz 1 mois peut diminuer la capacité de réaction, le traitement peut entraver l'aptitude à la conduite automobile ou la manipulation de machines. Ce risque est accru en cas de consommation concomitante d'alcool.
Effets indésirables
Un traitement par acétate de leuproréline conduit initialement à une élévation brève des taux sériques de testostérone, ce qui peut donner lieu à une majoration transitoire de certains symptômes (apparition ou accentuation des douleurs osseuses, obstruction des voies urinaires et leur conséquence, compression de la moelle dorsale, fatigue musculaire des membres inférieurs, lymphoedème). Cette accentuation des troubles régresse habituellement spontanément sans aucune nécessité d'arrêter Leuproréline Sandoz 1 mois.
Les effets indésirables les plus fréquents sous traitement par acétate de leuproréline sont: vasodilatation (57%) et bouffées de chaleur (52%), augmentation de la transpiration (42%), réduction de la libido (47%), troubles de la puissance sexuelle (45%) et prise de poids (22%).
Dans ce qui suit, figurent les effets indésirables observés sous traitement par des préparations dépôt d'acétate de leuproréline en fonction des systèmes d'organes pendant les études cliniques et l'observation du marché, la pharmacovigilance. Les fréquences sont définies comme suit: très fréquent (≥1/10), fréquent (de ≥1/100 à <1/10); occasionnel (de ≥1/1'000 à <1/100), rare (de ≥1/10'000 à <1/1'000), très rare (<1/10'000); non connu: à l'exclusion de rapports pendant la surveillance du marché, la fréquence précise ne peut pas être donnée.
Infections et infestations:
Fréquent: infections des voies aériennes, pharyngite, infections urinaires, bronchite.
Occasionnel: candidose, mycose de la peau, rhinite.
Non connu: pneumonie.
Tumeurs bénignes, malignes et non spécifiques (y compris kystes et polypes):
Non connu: carcinomes de la peau/de l'oreille.
Affections hématologiques et du système lymphatique:
Fréquent: anémie.
Occasionnel: augmentation des réticulocytes.
Non connu: augmentation ou baisse des valeurs leucocytaires, baisse de la numération thrombocytaire, prolongation des temps de prothrombine et de céphaline activée.
Affections du système immunitaire:
Occasionnel: réactions d'hypersensibilité (par ex. fièvre, prurit, éosinophilie, éruption cutanée).
Non connu: réactions anaphylactiques.
Affections endocriniennes:
Non connu: infarctus hypophysaire (cf. «Mises en garde et précautions»), hypertrophie thyroïdienne.
Troubles du métabolisme et de la nutrition:
Très fréquent: prise de poids (22%).
Fréquent: anorexie, augmentation de l'appétit, perte d'appétit, perte de poids, hyperglycémie, accentuation de la sensation de soif, hypercalcémie.
Occasionnel: hypoglycémie, déshydratation.
Non connu: diabète, élévation de l'urée, hyperuricémie, hyperlipidémie (cholestérol global, cholestérol LDL, triglycérides), hyperphosphatémie, hypoprotéinémie, élévation de la créatinine, hypokaliémie, élévation de l'AUS.
Affections psychiatriques:
Très fréquent: baisse de la libido (47%).
Fréquent: troubles du sommeil, angoisse, somnolence, changements d'humeur, dépression, nervosité, labilité émotionnelle.
Occasionnel: pensées délirantes.
Non connu: augmentation de la libido, suicidalité.
Affections du système nerveux:
Fréquent: paresthésies, hyperesthésies, tremblements, céphalées, vertiges.
Occasionnel: troubles du goût, troubles de la mémoire, amnésie, troubles de la marche.
Non connu: léthargie, neuropathie périphérique, troubles neuromusculaires, étourdissements, neuromyopathie, perte de conscience, accident ischémique transitoire, apoplexie.
Très peu de cas de convulsions ont été déclarés.
Affections oculaires:
Fréquent: troubles de la vue (par ex. vision trouble), amblyopie.
Non connu: sécheresse oculaire, autres troubles ophtalmologiques.
Affections de l'oreille et du labyrinthe:
Fréquent: acouphènes, douleurs auriculaires.
Non connu: troubles auditifs, troubles de l'audition.
Affections cardiaques:
Fréquent: angine de poitrine, tachycardie, arythmies, extrasystoles ventriculaires.
Occasionnel: insuffisance cardiaque, bradycardie.
Non connu: allongements de l'intervalle QT (voir «Mises en garde et précautions» et «Interactions»), modifications de l'ECG (par ex. signes d'ischémie myocardique), souffle cardiaque, palpitations, infarctus du myocarde, bloc AV, mort subite d'origine cardiaque (cf. «Mises en garde et précautions»).
Affections vasculaires:
Très fréquent: bouffées de chaleur (52%), vasodilatation (57%).
Fréquent: thrombophlébite, œdème lymphatique, hypertension, syncope.
Occasionnel: trouble de la circulation périphérique.
Non connu: thrombose, embolie pulmonaire, hypotension, douleur variqueuse, accident vasculaire cérébral.
Par ailleurs, un seul cas de patient ayant développé une thrombose de l'artère centrale de la rétine a été signalé.
Affections respiratoires, thoraciques et médiastinales:
Fréquent: toux, dyspnée, épistaxis, hémoptysie, asthme bronchique, œdème pulmonaire aigu, emphysème pulmonaire.
Occasionnel: bronchopneumopathie chronique obstructive.
Non connu: frottement pleural, infiltration pulmonaire, fibrose pulmonaire, obstruction des sinus, effusion pleurale, pneumopathie interstitielle.
Affections gastro-intestinales:
Fréquent: sécheresse buccale, flatulences, constipation, diarrhées, nausées, vomissements, douleurs abdominales, gastrite.
Non connu: ulcère gastroduodénal, dysphagie, hémorragies gastro-intestinales, polypes rectaux, ulcères peptiques, nodosités dures dans la gorge.
Affections hépatobiliaires:
Très fréquent: élévation des ASAT (20%), élévation du LDH dans le sérum (29%).
Fréquent: troubles de la fonction hépatique (par ex. élévation des ALAT, élévation des gamma-GT).
Occasionnel: lésion hépatocellulaire, hépatite cholestatique.
Non connu: sévère lésion hépatique, hyperbilirubinémie, ictère.
Affections de la peau et du tissu sous-cutané:
Fréquent: sécheresse cutanée, éruption cutanée (y compris exanthème maculopapuleux), prurit, urticaire, modifications de la pilosité (en particulier augmentation ou diminution de la pilosité corporelle), alopécie, ecchymose, troubles de la pigmentation.
Occasionnel: réactions de photosensibilité, sécheresse muqueuse.
Non connu: dermatite, lésions cutanées, nodosités.
Affections musculo-squelettiques et systémiques:
Très fréquent: douleurs osseuses (14%).
Fréquent: douleurs articulaires (arthralgies), maux de dos, faiblesse musculaire, douleurs aux extrémités, myalgie, crampes musculaires.
Non connu: perte de densité osseuse, fibrose du bassin, troubles articulaires (arthropathie), paralysie, fracture spinale, spondylarthrite ankylosante, ténosynovite, gonflement osseux, douleurs dans les membres.
En outre, une ostéoporose a été signalée dans le cadre d'un traitement au long cours (6 à 12 mois) (voir «Mises en garde et précautions»).
Affections du rein et des voies urinaires:
Très fréquent: nycturie (17%).
Fréquent: dysurie, pollakiurie, hématurie.
Occasionnel: incontinence urinaire, polyurie, troubles de la miction, rétention urinaire, protéinurie.
Non connu: miction impérieuse accrue, spasmes de la vessie, obstruction des voies urinaires.
Affections des organes de reproduction et du sein:
Très fréquent: signes d'incapacité sexuelle (45%).
Fréquent: gynécomastie, atrophie testiculaire, élévation de l'ASP.
Très rare: douleurs/tension/hypersensibilité dans les seins, gonflement pénien.
Non connu: douleurs dans la région prostatique, douleur testiculaire.
Troubles généraux et anomalies au site d'administration:
Très fréquent: hypersudation (42%), réactions au point d'injection (13%), par ex. rougeurs, douleurs, œdèmes, démangeaisons, infections qui se résorbent également en général en cas de poursuite du traitement, fatigue/asthénie (13%), œdème périphérique (12%)
Fréquent: inflammations au point d'injection (dont des abcès), grelottements, douleurs généralisées, gonflement (os temporal), réactions d'hypersensibilité, fièvre, malaise, accès de transpiration, transpiration nocturne, frissons et symptômes pseudo-grippaux généraux.
Dans le cadre d'une étude clinique de phase I, lors de laquelle 15 personnes ont reçu de la Leuproréline Sandoz, on a pu relever les effets secondaires suivants (fréquence >1) (voir tableau 1):
Tableau 1: incidence des effets indésirables les plus fréquents au cours de l'étude en phase I
Symptôme | Nombre de cas |
Diminution de la libido | 13 |
Bouffées de chaleur | 9 |
Céphalées | 6 |
Sueurs | 6 |
Au cours des études en phase II et III, réalisées cette fois auprès de 52 patients auxquels l'on a administré de la Leuproréline Sandoz, les effets secondaires suivants ont été relevés (voir tableau 2):
Tableau 2: incidence des effets indésirables les plus fréquents au cours des études en phases II et III
Classement par systèmes d'organes | Nombre de patients |
Troubles généraux (bouffées de chaleur) | 16 |
Affections cardiaques | 3 |
Affections du rein et des voies urinaires | 2 |
Anomalies au site d'administration | 1 |
Surdosage
On n'a pas observé à ce jour de signes d'intoxication.
Dans les études cliniques, des doses allant jusqu'à 20 mg/jour pendant 2 ans ont été administrées. Les effets indésirables de ces doses ne sont pas différents de ceux notés lors d'une administration de 1 mg/jour.
Propriétés/Effets
Code ATC: L02AE02
Mécanisme d'action et Pharmacodynamie
L'acétate de leuproréline, le principe actif, est un analogue de synthèse de l'hormone de libération des gonadotrophines hypophysaires (Gonadotropin-Releasing-Hormon, GnRH) qui contrôle la libération de la LH et de la FSH, hormones gonadotropes, du lobe antérieur de l'hypophyse. Ces hormones stimulent à leur tour la synthèse testiculaire des stéroïdes.
A l'opposé de la GnRH physiologique, libérée de façon pulsatile par l'hypothalamus, l'acétate de leuproréline, utilisé en thérapeutique de façon continue, bloque en permanence les récepteurs à la GnRH et provoque, après une stimulation initiale brève sa régulation négative. Chez les adultes, le résultat après trois à quatre semaines est une suppression réversible dans l'hypophyse de la libération des hormones gonadotrophines LH et FSH avec une baisse simultanée du taux de testostérone à des valeurs comparables à celles observées après une castration.
Cette diminution des taux de testostérone ou d'oestrogènes persiste de façon fiable pendant toute la durée du traitement. Il en résulte une inhibition du développement des tumeurs hormono-dépendantes telles que le cancer de la prostate. En conséquence, les symptômes s'améliorent sous traitement.
En cas d'administration répétée, on observe une diminution soutenue du taux de testostérone à des valeurs comparables à celles observées après une castration, sans que le taux de testostérone ne montre une augmentation passagère comme après une première injection.
La Leuproréline Sandoz a fait l'objet de 2 études. Pour la première étude clinique, il s'agissait d'une étude randomisée de phase III, lors de laquelle l'efficacité et la sécurité d'un traitement par Leuproréline Sandoz chez des patients présentant un carcinome prostatique métastasé ont été comparées au traitement par Lucrin Depot. La deuxième étude clinique ouverte était de phase II, au cours de laquelle l'efficacité et la sécurité de Leuproréline Sandoz, administrée aux patients souffrant d'un carcinome prostatique métastasé, étaient évaluées. Au total, 52 patients ont reçu le traitement par Leuproréline Sandoz.
Pharmacocinétique
Absorption
Après injection de l'implant, l'acétate de leuproréline est libéré de façon continue du copolymère, composé d'acide glycolique et d'acide lactique dans un rapport 1:1 pendant une durée d'un mois. Le copolymère est résorbé comme un au matériel de suture chirurgical.
Une heure après l'injection, des taux sériques de 707 pg/ml ont été mesurés. Des taux sériques peuvent encore être décelés plus de 4 semaines après la dernière injection.
Dans le cadre de l'étude clinique de phase I, on a constaté qu'après avoir procédé à deux injections de Leuproréline Sandoz dans un intervalle de 28 jours, le taux de leuproréline était encore décelable chez 15 personnes saines et ce, jusqu'à 39 jours après la deuxième administration. Une augmentation de la testostéronomie au-delà du seuil de castration a pu être observée entre le 42ème et le 49ème jour suivant la deuxième administration.
Distribution/Métabolisme/Elimination
La distribution, le métabolisme et l'élimination de l'acétate de leuproréline chez l'homme ne sont pas parfaitement élucidés.
Le volume de distribution est de 36 litres et la clairance totale de l'ordre de 139,6 ml/min. La demi-vie du principe actif est de 2,9 heures pour une présentation non retardée.
Lors d'une administration répétée, on observe une baisse persistante des taux de testostérone jusqu'à des taux équivalents à ceux observés après une castration, sans que ce taux ne s'élève transitoirement, comme après la première injection.
Cinétique pour certains groupes de patients
Enfants/adolescents: On ne dispose d'aucune donnée sur la pharmacocinétique de Leuproréline Sandoz chez l'enfant et l'adolescent.
Patients âgés: La pharmacocinétique chez le patient âgé ne diffère pas significativement de celle des jeunes adultes.
Insuffisances hépatiques et rénales: On a parfois mesuré des taux sériques plus élevés chez des patients présentant une insuffisance rénale, alors que les taux étaient abaissés chez les patients présentant une insuffisance hépatique. La signification clinique de cette observation est inconnue.
Données précliniques
Mutagénicité
Les essais de mutagénicité (in vitro et in vivo) n'ont mis en évidence aucun signe de potentiel mutagène de la leuproréline.
Carcinogénicité
Des souris et des rats ont été traités avec la leuproréline pendant deux ans au cours d'essais de carcinogénicité. Au bout de 24 mois, on a pu observer, chez les rats ayant reçu par voie sous-cutanée 0,6 à 4 mg/kg de leuproréline, une augmentation dépendante de la dose d'hyperplasies hypophysaires bénignes et d'adénomes. De plus, une augmentation indépendante de la dose d'adénomes des cellules testiculaires interstitielles chez des rats mâles a été constatée. Chez les souris, des doses de leuproréline allant jusqu'à 60 mg/kg, également administrées pendant deux ans, n'ont entraîné aucune tumeur ni anomalie hypophysaire.
Toxicité pour la reproduction
Des études portant sur l'administration sous-cutanée de doses de leuproréline allant jusqu'à 10 µg/kg à des rates et allant jusqu'à 1 µg/kg à des lapines n'ont pas mis en évidence de signes d'un potentiel tératogène. Des effets embryotoxiques/embryolétals ont été observés chez les rates à une dose de 10 µg/kg et chez les lapines à des doses supérieures à 0,1 µg/kg.
Remarques particulières
Incompatibilités
Aucune incompatibilité connue à ce jour.
Influence sur les méthodes de diagnostic
Aucune incompatibilité connue à ce jour.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques concernant le stockage
Conserver dans l'emballage original, dans le sachet stérile fermé, pas au-dessus de 30 °C et hors de la portée des enfants.
Remarques concernant la manipulation
| ||
| ||
| ||
| ||
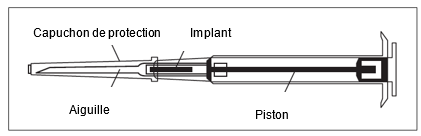
Remarque: Le piston ne peut être poussé vers l'avant pour l'injection que lorsqu'il a été auparavant complètement tiré vers l'arrière! | ||
| ||
| ||
|
| |
|
| |
| ||
|
| |
Numéro d’autorisation
57449 (Swissmedic).
Titulaire de l’autorisation
Sandoz Pharmaceuticals SA, Risch; domicile: Rotkreuz.
Mise à jour de l’information
Mai 2019.
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French Italian
Italian