Bondronat Infusionskonzentrat 6mg/6ml Durchstechflasche 6ml buy online
Bondronat Inf Konz 6 mg/6ml Durchstf 6 ml
-
368.81 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: FUTURE HEALTH PHARMA
- Product Code: 3042482
- ATC-code M05BA06
- EAN 7680574240014
Ingredients:
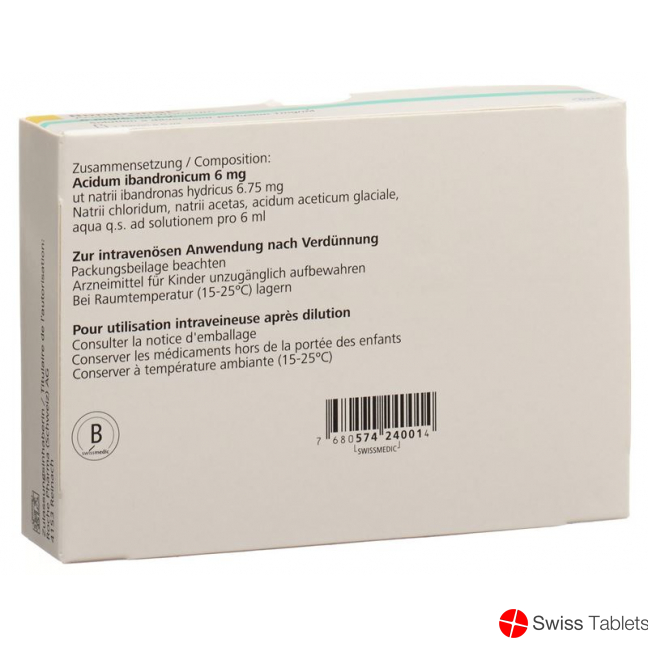
Natriumchlorid, Natrium 20.94 mg, Essigsäure, konzentrierte (Eisessig), Ibandronsäure 6 mg, Ibandronsäure natrium-1-Wasser, Natrium acetat-3-Wasser.

Description
Zusammensetzung
Wirkstoff: Acidum ibandronicum ut Natrii ibandronas hydricus.
Hilfsstoffe
Infusionslösungskonzentrat: Natrii chloridum, Natrii acetas, Acidum acetas glaciale, Aqua ad iniectabilia q.s. pro solutionem.
Galenische Form und Wirkstoffmenge pro Einheit
Infusionslösungskonzentrat
1 Durchstechflasche zu 6 ml enthält 6 mg Ibandronsäure (entspricht 6,75 mg Ibandronsäure, Mononatriumsalz).
Indikationen/Anwendungsmöglichkeiten
Infusionslösungskonzentrat 6 mg/6 ml
Behandlung von Patientinnen mit Knochenmetastasen bei Mammakarzinom.
Dosierung/Anwendung
Hypercalcämie
Übliche Dosierung
Vor der Behandlung mit Bondronat sollte bei Patienten ein angemessener Flüssigkeitsausgleich (Rehydratation) mit 0,9%-iger Natriumchloridlösung vorgenommen werden. Die Dosierung richtet sich nach dem Schweregrad der Hypercalcämie und nach der Art des Tumors. Im Allgemeinen benötigen Patienten mit osteolytischen Knochenmetastasen geringere Dosen als Patienten mit humoraler Hypercalcämie. Bei den meisten Patienten mit schwerer Hypercalcämie (albuminkorrigierte Serumcalciumspiegel* ≥3 mmol/l oder ≥12 mg/dl) ist eine Einmaldosis von 4 mg ausreichend. Bei Patienten mit mässiggradiger Hypercalcämie (albuminkorrigierte Serumcalciumspiegel <3 mmol/l oder <12 mg/dl) ist eine Dosis von 2 mg wirksam.
*Hinweis zur Berechnung albuminkorrigierter Serumcalciumspiegel:
Korrigierter Serumcalciumspiegel (mmol/l) = Serumcalcium (mmol/l) - [0,02 × Albumin (g/l)] + 0,8 oder
Korrigierter Serumcalciumspiegel (mg/dl) = Serumcalcium (mg/dl) + 0,8 × [4 - Albumin (g/dl)].
(Umrechnung des albuminkorrigierten Serumcalciumspiegelwertes von mmol/l in mg/dl: mmol/l - Wert mit Faktor 4 multiplizieren.)
In den meisten Fällen kann ein erhöhter Serumcalciumspiegel durch eine einmalige Infusion von Bondronat innerhalb von 7 Tagen in den Normbereich gesenkt werden. Die mittlere Dauer bis zum Rezidiv (Wiederanstieg des albuminkorrigierten Serumcalciumspiegels über 3 mmol/l) betrug bei einer Dosis von 2 mg bzw. 4 mg 18-19 Tage. Bei einer Dosis von 6 mg betrug die mediane Dauer bis zum Rezidiv 26 Tage. Bei Wiederauftreten der Hypercalcämie bzw. bei nicht ausreichender Wirkung kann die Behandlung wiederholt werden, wobei jedoch eine Gesamtdosis von 6 mg Bondronat pro hypercalcämische Episode - bis zum Vorliegen weitergehender klinischer Erfahrung - nicht überschritten werden darf.
Spezielle Dosierungsanweisungen
Da keine klinischen Daten vorliegen, können keine Dosisempfehlungen für Patienten mit schwerer Leberinsuffizienz gegeben werden. Bei diesen Patienten ist der potentielle Nutzen einer Verabreichung von Bondronat gegen die potentiellen Risiken abzuwägen.
Bei Patienten mit eingeschränkter Nierenfunktion sollte die Nierenfunktion nach Ermessen des Arztes kontrolliert werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Anweisungen für Applikationsart
Bondronat Infusionslösungskonzentrat wird nach Verdünnung als intravenöse Infusion über 2 Stunden verabreicht.
Hierzu sollte der Inhalt der Durchstechflaschen mit 500 ml isotonischer Kochsalzlösung oder 500 ml 5%-iger Glucoselösung verdünnt werden.
Da die intraarterielle Anwendung von Präparaten, die nicht ausdrücklich zur intraarteriellen Therapie empfohlen werden, zu Schäden führen kann, wird vorsorglich darauf hingewiesen, dass die intravenöse Infusion von Bondronat gewährleistet sein muss.
Knochenmetastasen bei Mammakarzinom
Intravenöse Anwendung
Die empfohlene Dosis beträgt 6 mg intravenös alle 3–4 Wochen.
Bondronat Infusionslösungskonzentrat wird nach Verdünnung als intravenöse Infusion verabreicht. Die Infusionsdauer beträgt mindestens 15 Minuten.
Hierzu sollte der Inhalt der Durchstechflaschen entweder mit 100 ml isotonischer Kochsalzlösung oder mit 100 ml 5%-iger Glucoselösung verdünnt werden (siehe «Sonstige Hinweise»).
Bondronat darf nur intravenös verabreicht werden, da eine intraarterielle oder eine paravenöse Applikation zu Gewebeschäden führen kann.
Spezielle Dosierungsanweisungen
Patientinnen mit Leberinsuffizienz
Eine Dosisanpassung ist nicht erforderlich.
Patientinnen mit Niereninsuffizienz
Infusionslösungskonzentrat
Bei Patientinnen mit leichter Niereninsuffizienz (CLCr ≥50 und <80 ml/min) ist keine Dosisanpassung erforderlich. Bei Patientinnen mit mittelschwerer Niereninsuffizienz (CLCr ≥30 und <50 ml/min) oder mit schwerer Niereninsuffizienz (CLCr <30 ml/min), die zur Prävention skelettaler Ereignisse im Falle von Brustkrebs und Knochenmetastasen behandelt werden, sollten die nachfolgenden Dosisempfehlungen befolgt werden.
Creatinin- Clearance (ml/min) | Dosierung/Infusionsdauer1 | Infusionsvolumen2 |
≥50, <80 | 6 mg/15 Minuten | 100 ml |
≥30,<50 | 4 mg/1 Stunde | 500 ml |
<30 | 2 mg/1 Stunde | 500 ml |
1 Verabreichung alle 3 bis 4 Wochen.
2 0.9% Kochsalzlösung oder 5% Glucoselösung.
Ältere Patientinnen
Bei älteren Patientinnen ist keine Dosisanpassung notwendig.
Kinder und Jugendliche
Die Wirksamkeit und Sicherheit ist bei Jugendlichen und Kindern unter 18 Jahren nicht untersucht worden.
Kontraindikationen
•Bei bekannter Überempfindlichkeit gegenüber dem Wirkstoff (Ibandronsäure) oder einem der Hilfsstoffe gemäss Zusammensetzung.
•Hypocalcämie.
•Während der Schwangerschaft und Stillzeit.
•Bei Kindern und Jugendlichen.
Warnhinweise und Vorsichtsmassnahmen
Vorsicht ist geboten bei bekannter Überempfindlichkeit gegenüber anderen Bisphosphonaten.
Bei Patienten, die mit intravenös verabreichter Ibandronsäure behandelt wurden, wurden Fälle von anaphylaktischen Reaktionen/anaphylaktischem Schock, einschliesslich tödlich verlaufenden Ereignissen, gemeldet.
Bei Verabreichung einer intravenösen Injektion von Bondronat sollten geeignete medizinische Unterstützungs- und Überwachungsmassnahmen bereitstehen. Bei Auftreten von anaphylaktischen oder anderen schweren Überempfindlichkeits-/allergischen Reaktionen ist die Injektion sofort abzubrechen und eine geeignete Behandlung einzuleiten.
In randomisierten placebokontrollierten klinischen Studien bei Patientinnen mit Brustkrebs bedingten metastatischen Knochenerkrankungen wurden unter Behandlung mit Bondronat keine Hinweise auf eine Beeinträchtigung der Nierenfunktion bei der Langzeittherapie beobachtet. Dennoch wird aufgrund der klinischen Beurteilung der jeweiligen Patientin empfohlen, während der Behandlung mit Bondronat die Nierenfunktion, Calcium-, Phosphat- und Magnesium- Serumspiegel zu überwachen.
Vor Beginn der Behandlung mit Bondronat sollten eine Hypocalcämie und andere Störungen des Mineralstoffwechsels wirksam behandelt werden. Bei allen Patientinnen ist eine ausreichende Aufnahme von Calcium und Vitamin D wichtig. Bei unzureichender Zufuhr mit der Nahrung sollte eine Calcium- und/oder Vitamin-D-Substitution stattfinden.
Beim Flüssigkeitsausgleich (Rehydrierung) ist bei Patientinnen mit erhöhtem Risiko einer Herzinsuffizienz wegen der Gefahr kardialer Dekompensation besondere Vorsicht geboten.
Es wurde nicht untersucht, ob Bondronat einen Einfluss auf Reaktionsvermögen, Urteilskraft und kognitive Fähigkeiten hat.
Bei mit Bisphosphonaten behandelten Patienten wurde über Osteonekrose des Kiefers (Osteonecrosis of the Jaw, ONJ) berichtet. Die meisten Fälle betrafen Krebspatienten, die sich zahnärztlichen Eingriffen unterzogen, einige traten jedoch bei Patienten mit postmenopausaler Osteoporose und anderen Diagnosen auf. Osteonekrosen des Kiefers stehen im Allgemeinen im Zusammenhang mit Zahnextraktionen und/oder lokalen Infektionen (einschliesslich Osteomyelitis). Bekannte Risikofaktoren für Osteonekrose des Kiefers umfassen Krebserkrankungen, Begleittherapien (z.B. Chemotherapie einschliesslich Angiogenese- Inhibitoren, Radiotherapie, Kortikosteroide) und Komorbiditäten (z.B. Anämie, Koagulopathie, Infektion, vorbestehende Zahnerkrankungen). Die meisten gemeldeten Fälle betrafen Patienten, die intravenös mit Bisphosphonaten behandelt wurden, doch einige kamen bei oral behandelten Patienten vor.
Bei Patienten, die während Bisphosphonattherapie eine Osteonekrose des Kiefers (ONJ) entwickeln, kann sich der Zustand durch Zahnchirurgie verschlimmern. Für Patienten, die zahnärztliche Eingriffe benötigen, sind keine Daten verfügbar, die andeuten, ob das Absetzen der Bisphosphonat-Behandlung das Risiko einer ONJ reduziert. Eine zahnärztliche Untersuchung mit geeigneten Vorsorgemassnahmen sollte vor einer Behandlung mit Bisphosphonaten bei Patienten mit gleichzeitigen Risikofaktoren (z.B. Krebs, Chemotherapie, Strahlentherapie, Kortikosteroide, schlechte Mundhygiene) erwogen werden. Die klinische Beurteilung des behandelnden Arztes sollte als Leitlinie des Behandlungsplans für den einzelnen Patienten dienen, unter individueller Nutzen/Risiko-Abschätzung.
Bei Patienten unter Bisphosphonattherapie, einschliesslich Ibandronsäure, wurde auch über Fälle von Osteonekrose an anderen orofazialen Stellen einschliesslich des äusseren Gehörgangs berichtet. Die Risikofaktoren sind ähnlich wie bei ONJ. Zu den zusätzlichen Risikofaktoren können wiederholte kleine Verletzungen gehören (z.B. gewohnheitsmässiger Gebrauch von Wattestäbchen). Die Möglichkeit einer Osteonekrose des äusseren Gehörgangs sollte in Betracht gezogen werden bei Patienten unter Bisphosphonat-Behandlung, die Ohrsymptome einschliesslich chronischer Ohrenentzündungen aufweisen.
Atypische Femurfrakturen
Unter der Therapie mit Bisphosphonaten wurden atypische subtrochanterische und diaphysäre Femurfrakturen berichtet, hauptsächlich bei Patienten, die über längere Zeit gegen Osteoporose behandelt wurden. Diese transversalen Frakturen oder kurzen Schrägfrakturen können an jeder Stelle entlang des Femurs von knapp unterhalb des Trochanter minor bis zu den Kondylen auftreten. Diese Frakturen treten nach einem minimalen Trauma oder ohne Trauma auf und manche Patienten verspüren bereits Wochen bis Monate vor der Ausbildung einer vollständigen Femurfraktur Schmerzen im Oberschenkel oder im Bereich der Leiste, oftmals verbunden mit röntgenologischen Merkmalen einer Stressfraktur. Die Frakturen treten häufig bilateral auf; daher sollte bei Patienten, die mit Bisphosphonaten behandelt werden und eine Femurschaftfraktur erleiden, auch der kontralaterale Femur untersucht werden. Auch wurde eine schlechte Heilung dieser Frakturen berichtet. Bei Patienten mit Verdacht auf eine atypische Femurfraktur sollte bis zu einer Beurteilung des Patienten auf der Grundlage einer individuellen Nutzen-Risiko- Bewertung ein Abbruch der Therapie mit Bisphosphonaten erwogen werden.
Diese Frakturen wurden auch bei Patienten mit Osteoporose berichtet, die nicht mit Bisphosphonaten behandelt wurden.
Interaktionen
Wechselwirkungen mit anderen Arzneimitteln
Bei gleichzeitiger Verabreichung von Ibandronsäure mit Melphalan/Prednisolon an Patientinnen mit multiplem Myelom wurden keine Wechselwirkungen beobachtet.
Interaktionsstudien bei Frauen in der Postmenopause haben gezeigt, dass kein Wechselwirkungspotenzial mit Tamoxifen oder einer Hormonersatztherapie (Östrogen) besteht.
Die intravenöse Gabe von Ranitidin bewirkt eine Zunahme der Bioverfügbarkeit von Ibandronsäure von etwa 20% (liegt innerhalb des Normalbereichs der Bioverfügbarkeit von Ibandronsäure). Es ist keine Dosisanpassung erforderlich, wenn Bondronat zusammen mit H2-Antagonisten oder anderen Arzneimitteln, die den pH-Wert des Magensafts erhöhen, verabreicht wird.
In klinischen Studien ist Bondronat gleichzeitig mit üblichen Krebsmedikamenten, Diuretika, Antibiotika und Analgetika verabreicht worden, ohne dass klinisch manifeste Wechselwirkungen aufgetreten wären.
Klinisch bedeutsame Wechselwirkungen mit anderen Arzneimitteln sind unwahrscheinlich. Ibandronsäure wird nur renal ausgeschieden und unterliegt keiner Biotransformation.
Vorsicht ist geboten, wenn Bisphosphonate zusammen mit Aminoglykosiden verabreicht werden, da beide Substanzgruppen zu einer Senkung des Serumcalciumspiegels über längere Zeiträume führen können. Auch auf eine möglicherweise gleichzeitig bestehende Hypomagnesiämie ist zu achten.
Schwangerschaft/Stillzeit
Schwangerschaft
Bondronat darf während der Schwangerschaft nicht angewendet werden. Es liegen keine hinreichenden Daten für die Anwendung von Ibandronsäure bei Schwangeren vor. Studien an Ratten haben eine geringfügige Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»). Das potenzielle Risiko für den Foetus ist nicht bekannt (siehe «Kontraindikationen»).
Stillzeit
Es ist nicht bekannt, ob Ibandronsäure beim Menschen in die Muttermilch ausgeschieden wird. Studien an laktierenden Ratten haben gezeigt, dass nach intravenöser Verabreichung niedrige Konzentrationen von Ibandronsäure in der Muttermilch zu finden sind. Bondronat darf während der Stillzeit nicht angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Folgende unerwünschte Wirkungen wurden beobachtet:
Organklasse | intravenöse Anwendung |
Infektionen | |
Infektion | häufig |
Orale Candidiasis | selten |
Blut- und Lymphsystem | |
Anämie | selten |
Lymphödem | selten |
Immunsystem | |
Überempfindlichkeit | sehr selten |
Bei Patienten, die mit Ibandronsäure behandelt wurden, wurden Fälle von anaphylaktischen Reaktionen/anaphylaktischem Schock, einschliesslich tödlich verlaufenden Ereignissen, gemeldet (siehe «Warnhinweise und Vorsichtsmassnahmen»). | sehr selten |
Es wurde über allergische Reaktionen, einschliesslich Asthma Exazerbationen, berichtet. | sehr selten |
Es wurden schwere unerwünschte Hautreaktionen, einschliesslich Stevens-Johnson-Syndrom, Erythema multiforme und bullöse Dermatose, berichtet. | sehr selten |
Endokrine Störungen | |
Parathormon erhöht | häufig |
Gewichtsverlust | selten |
Anstieg der alkalischen Phosphatase | selten |
Stoffwechsel- und Ernährungsstörungen | |
Hypocalcämie | häufig |
Hypophosphatämie | selten |
Psychiatrische Störungen | |
Angst | selten |
Amnesie | selten |
Nervensystem | |
Kopfschmerzen | häufig |
Benommenheit | häufig |
Dysgeusia | häufig |
Schlafstörungen | selten |
Zirkumorale Parästhesie | selten |
Hyperästhesie | selten |
Läsion der Nervenwurzel | selten |
Neuralgie | selten |
Migräne | selten |
Parosmie | selten |
Augen | |
Katarakt | häufig |
Uveitis, Iridoskleritis, Skleritis | sehr selten |
Unter der Behandlung mit Bisphosphonaten einschliesslich Ibandronsäure wurden entzündliche okulare Ereignisse wie zum Beispiel Uveitis, Iridoskleritis und Skleritis gemeldet. In einigen Fällen heilten diese Ereignisse nicht ab, bevor das Bisphosphonat abgesetzt wurde. | |
Ohr und Innenohr | |
Taubheit | selten |
Herz | |
Schenkelblock | häufig |
Herzklopfen | selten |
Myocardischämie | selten |
Gefässe | |
Hypertonie | selten |
Atmungsorgane | |
Lungenödem | selten |
Stridor | selten |
Bronchospasmen | sehr selten |
Gastrointestinale Störungen | |
Diarrhöe | häufig |
Dyspepsie | häufig |
Erbrechen | häufig |
Bauchschmerzen | häufig |
Pharyngitis | häufig |
Zahnerkrankung | häufig |
Dysphagie | selten |
Gastroenteritis | selten |
Stomatitis | selten |
Leber und Galle | |
Erhöhte Gamma-GT | häufig |
Cholelithiasis | selt |
Haut | |
Bläschen | häufig |
Ekchymose | häufig |
Cheilitis | selten |
Rash | selten |
Haarausfall | selten |
Angioneurotisches Ödem | sehr selten |
Muskelskelettsystem | |
Myalgie | häufig |
Arthralgie | häufig |
Knochenschmerzen | häufig |
Rigor | gelegentlich |
Beckenschmerzen | selten |
Atypische subtrochanterische und diaphysäre Femurfrakturen (Klasseneffekt der Bisphosphonate) wurden berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»). | selten |
Osteonekrose des Kiefers und anderer orofazialer Stellen, einschliesslich des äusseren Gehörgangs (siehe «Warnhinweise und Vorsichtsmassnahmen») | sehr selten |
Nieren und Harnwege | |
Erhöhtes Kreatinin | häufig |
Blasenentzündung | selten |
Harnstauung | selten |
Reproduktionssystem | |
Vaginitis | selten |
Allgemeine Störungen | |
Fieber | sehr häufig (11,1%) |
Asthenie | häufig |
Peripheres Ödem | häufig |
Übermässiger Durst | häufig |
«Flu-like» Syndrom | häufig |
Schmerzen an der Injektionsstelle | selten |
Hypothermie | selten |
Die verminderte Calcium-Ausscheidung im Urin geht häufig mit einer nicht behandlungsbedürftigen Abnahme des Serum-Phosphat-Spiegels einher. Der Serum-Calcium- Spiegel kann auf hypocalcämische Werte abfallen (berichtet bei ca. 3% der Patienten in klinischen Studien).
Bei Bisphosphonaten wurden bronchospastische Reaktionen bei Patientinnen mit Acetylsalicylsäure-sensitivem Asthma in Zusammenhang berichtet.
Überdosierung
Es liegen keine spezifischen Informationen über die Behandlung einer Überdosierung mit Bondronat vor.
Standard Hämodialyseverfahren resultieren in einer signifikanten Clearance der Ibandronsäure.
In präklinischen Untersuchungen wurden nach Gabe hoher Dosen von Bondronat toxische Schädigungen an Nieren und Leber beobachtet. Deshalb sollte bei Überdosierung die Nieren- und Leberfunktion kontrolliert werden.
Tritt eine klinisch bedeutsame Hypocalcämie auf, kann sie durch Infusion von Calciumgluconat behoben werden.
Eigenschaften/Wirkungen
ATC-Code: M05BA06
Wirkungsmechanismus/Pharmakodynamik
Bondronat gehört zu der Stoffklasse der Bisphosphonatverbindungen, welche gezielt am Knochen ansetzen. Ihre selektive Beeinflussung des Knochengewebes beruht auf der hohen Affinität gegenüber dem mineralischen Knochenanteil. Bisphosphonate bewirken eine Hemmung der Osteoklastenaktivität; der genaue Mechanismus ist noch nicht geklärt.
In vivo verhindert Ibandronsäure die experimentell erzeugte Knochenzerstörung, die durch den Ausfall der Gonadenfunktion, durch Retinoide, Tumore oder Tumorextrakte verursacht wird. Bei Ratten wurde die endogene Knochenresorption ebenfalls gehemmt, was im Vergleich zu unbehandelten Tieren zu einer erhöhten Knochenmasse führte.
Dadurch wird ein übersteigerter Knochenabbau verhindert und erhöhte Calciumspiegel werden normalisiert. Dosierungen, die wesentlich höher waren als die pharmakologisch wirksamen Dosen zeigten keine Wirkung auf die Mineralisation des Knochens. In klinischen Studien konnte nachgewiesen werden, dass der Hemmeffekt von Bondronat auf die tumorbedingte Osteolyse und insbesondere auf die tumorbedingte Hypercalcämie durch eine Verminderung des Serumcalciums und der Calciumausscheidung im Urin gekennzeichnet ist. Je nach Ausgangswerten des Serumcalciums, Dosierung und Tumortyp, wurde ein Absinken des Serumcalciumspiegels in den Normalbereich bei bis zu 100% der Patientinnen und Patienten erreicht.
Klinische Wirksamkeit
Behandlung der tumorinduzierten Hypercalcämie
Klinische Studien zur malignen Hypercalcämie zeigten, dass die hemmende Wirkung von Ibandronsäure auf die tumorinduzierte Osteolyse und insbesondere auf die tumorinduzierte Hypercalcämie durch eine Abnahme des Serumcalciums und der Calciumausscheidung im Urin gekennzeichnet ist.
Im empfohlenen Dosierungsbereich wurden bei Patienten mit Albumin-korrigierten Serumcalciumwerten ≥3,0 mmol/l nach adäquater Rehydratation die folgenden mittleren Responderraten mit den zugehörigen Konfidenzintervallen (KI) erhalten:
Dosis | 2 mg | 4 mg | 6 mg |
Ansprechrate | 54 (44-63) | 76 (62-86) | 78 (64-88) |
Bei diesen Patienten und Dosen betrug die mediane Dauer bis zum Erreichen normocalcämischer Werte 4 bis 7 Tage. Die mediane Dauer bis zum Rezidiv (Wiederanstieg Albumin-korrigierter Serumcalciumwerte über 3,0 mmol/l) betrug 18 bis 26 Tage.
Behandlung von Knochenmetastasen bei Mammakarzinom
Die Wirksamkeit von Ibandronat zur Therapie von Knochenmetastasen eines Mammakarzinoms wurde in einer randomisierten, placebokontrollierten Phase III-Studie an n=312 Patientinnen untersucht. Die Patientinnen erhielten über insgesamt 96 Wochen in 3 bis 4-wöchigen Intervallen jeweils 6 mg Ibandronat i.v. oder Placebo. Eingeschlossen waren Patientinnen mit Mammakarzinom und radiologisch bestätigten Knochenmetastasen. Primärendpunkt der Studie war die skelettale Morbiditätsrate pro Zeiteinheit (skeletal morbidity period rate, SMPR), bei welcher die Inzidenz vertebraler und nicht-vertebraler Frakturen, die Bestrahlung von Knochengewebe sowie eine eventuelle operative Therapie von Frakturen berücksichtigt wurden. Es zeigte sich ein statistisch signifikanter Vorteil von Ibandronat gegenüber Placebo (Reduktion der SMPR unter Ibandronat gegenüber Placebo: 0.29; p=0.004). Dies entsprach einer Risikoreduktion um 40%.
Die Befunde konnten durch zwei ähnliche Studien mit oraler Gabe von Ibandronat (50mg/Tag) bestätigt werden.
Zu den sekundären Endpunkten gehörten die Messung der Knochenschmerzen, der Lebensqualität sowie die Bestimmung der Knochenresorptionsmarker im Urin. Unter Bondronat verbesserten sich diese Messwerte gegenüber Placebo.
In einer Studie mit 130 Patientinnen mit metastasierendem Brustkrebs wurde die Sicherheit von Bondronat bei einer Infusionsdauer von einer Stunde mit derjenigen bei einer Infusionsdauer von 15 Minuten verglichen. In Bezug auf die Nierenfunktion wurden keine Unterschiede festgestellt. Das Nebenwirkungsprofil von Bondronat stimmte bei einer Infusionsdauer von 15 Minuten mit dem bekannten Sicherheitsprofil bei längeren Infusionszeiten überein; im Zusammenhang mit der Infusionsdauer von 15 Minuten sind keine neuen unerwünschten Wirkungen beobachtet worden.
Die Infusionsdauer von 15 Minuten ist bei Krebspatientinnen mit einer Creatinin-Clearance von <50 ml/min nicht untersucht worden.
Pharmakokinetik
Absorption
Die Plasmakonzentration von Ibandronsäure nimmt nach intravenöser Verabreichung von bis zu 6 mg proportional zur Dosis zu.
Distribution
Beim Menschen beträgt das terminale Verteilungsvolumen offenbar mindestens 90 l. Nach erstmaliger systemischer Exposition bindet Ibandronsäure rasch an das Knochengewebe. Die Menge, die das Knochengewebe erreicht, wird auf 40-50% der zirkulierenden Dosis geschätzt. Die Proteinbindung im Humanplasma beträgt bei therapeutischen Konzentrationen etwa 87%, so dass Wechselwirkungen mit anderen Arzneimitteln durch Verdrängung unwahrscheinlich sind.
Metabolismus
Es gibt keine Hinweise dafür, dass Ibandronsäure beim Menschen oder bei Tieren einem Metabolismus unterliegt.
Elimination
Der systemisch verfügbare Anteil von Ibandronsäure, der nicht vom Knochengewebe absorbiert wird, wird unverändert über die Nieren ausgeschieden.
Die terminale Halbwertzeit liegt im Bereich von 10-60 Stunden. Die anfänglichen Plasmaspiegel fallen rasch und erreichen 10% der maximalen Werte innerhalb von 3 bzw. 8 Stunden nach intravenöser Gabe.
Bei Patientinnen mit metastatischer Knochenerkrankung war nach 48 Wochen Behandlung mit Ibandronsäure, einmal alle 4 Wochen intravenös gegeben, keine systemische Akkumulation zu beobachten.
Die Gesamt-Clearance von Ibandronsäure ist mit durchschnittlichen Werten im Bereich von 84- 160 ml/min gering. Die renale Clearance (etwa 60 ml/min bei gesunden Frauen in der Postmenopause) macht 50-60% der Gesamt-Clearance aus und korreliert mit der Creatinin- Clearance. Es wird angenommen, dass der Unterschied zwischen der offensichtlichen Gesamt- Clearance und der renalen Clearance auf den Anteil zurückzuführen ist, der vom Knochengewebe aufgenommen wird.
Kinetik spezieller Patientengruppen
Patientinnen mit eingeschränkter Nierenfunktion
Bei Patientinnen mit leichter Niereninsuffizienz (Creatinin-Clearance CLcr >50-<80 ml/min) bzw. bei Patientinnen mit mässig gradiger Niereninsuffizienz (CLcr >30-<50 ml/min), die eine Einzeldosis von 6 mg intravenös (Infusionsdauer von 15 Minuten) erhielten, ist die AUC im Vergleich zu gesunden Probanden um 14% bzw. um 86% erhöht.
Patientinnen mit schwerer Niereninsuffizienz (CLcr ≤30 ml/min) wiesen 2–3 Mal höhere Plasmakonzentrationen auf als Patientinnen mit normaler Nierenfunktion (CLcr >90 ml/min) (s. «Dosierung/Anwendung, Spezielle Dosierungsanweisungen»).
Patientinnen mit Leberinsuffizienz
Für Patientinnen mit eingeschränkter Leberfunktion liegen keine pharmakokinetischen Daten zu Ibandronsäure vor. Die Leber spielt keine signifikante Rolle bei der Clearance von Ibandronsäure, da diese nicht metabolisiert, sondern durch einerseits intakt über die Niere ausgeschieden wird und andererseits in den Knochen aufgenommen wird. Deshalb ist eine Dosisanpassung bei Patienten mit eingeschränkter Leberfunktion nicht erforderlich.
Ältere Patientinnen
Es sollte berücksichtigt werden, dass die Nierenfunktion mit dem Alter abnimmt.
Pädiatrie
Es liegen keine Daten über die Anwendung von Bondronat bei Patientinnen unter 18 Jahren vor.
Geschlecht/Rasse
Es gibt bisher keinen Hinweis, dass Geschlecht, oder ethnische Zugehörigkeit die pharmakokinetischen Parameter beeinflussen.
Präklinische Daten
Wie bei anderen Bisphosphonaten wurde die Niere als primäres Zielorgan der systemischen Toxizität ermittelt. Bei Tieren wurden toxische Wirkungen in Dosen beobachtet, die über der Maximaldosis beim Menschen liegen.
Mutagenität/Karzinogenität
Es wurden keine Anzeichen für ein karzinogenes oder genotoxisches Potenzial beobachtet.
Reproduktionstoxizität
Bei oral mit Ibandronsäure behandelten Ratten und Kaninchen wurden keine Anzeichen für eine unmittelbare toxische oder teratogene Wirkung auf den Foetus beobachtet, und bei Ratten zeigten sich in einer extrapolierten Dosis, die weit über der beim Menschen zu erwartenden Exposition liegt, keine unerwünschten Wirkungen auf die Entwicklung der F1-Nachkommen. In Reproduktionsstudien an Ratten wurden die für die Wirkstoffklasse der Bisphosphonate zu erwartenden unerwünschten Wirkungen festgestellt. Hierzu gehören eine geringere Anzahl an Einnistungsstellen für die befruchteten Eizellen in der Gebärmutterschleimhaut, eine Beeinträchtigung des natürlichen Geburtsverlaufs (Dystokie) und eine Zunahme viszeraler Veränderungen (Nierenbecken-Harnleiter-Syndrom).
In Fertilitätsstudien beeinträchtigte Ibandronsäure in einer Dosis von 1,2 mg/kg/Tag i.v. die Fertilität von Rattenweibchen. Bei Verabreichung einer Dosis von 1,0 bis 16 mg/kg/Tag p.o. und 1,2 mg/kg/Tag i.v. nahm die Zahl der Nidationsstellen ab.
Teratogenität
Bei intravenös oder oral mit Ibandronsäure behandelten Ratten und Kaninchen wurden keine Anzeichen einer direkten fetalen Toxizität oder teratogener Effekte beobachtet.
Andere
Die unerwünschten Wirkungen von Ibandronsäure in Studien zur Reproduktionstoxizität bei Ratten entsprachen den Effekten, die man für diese Substanzklasse (Bisphosphonate) erwarten würde. Dazu gehören eine verringerte Anzahl der Nidationsstellen, eine Beeinträchtigung der natürlichen Geburt (Dystokie), eine Zunahme viszeraler Abweichungen (Nierenbecken- Harnleitersyndrom) sowie Zahnanomalien bei der ersten Filialgeneration (F1) von Ratten.
Sonstige Hinweise
Inkompatibilitäten
Um mögliche Unverträglichkeiten auszuschliessen, sollte Bondronat Infusionslösungskonzentrat nur mit isotonischer Kochsalzlösung oder mit 5%-iger Glucoselösung verdünnt werden. Bondronat darf nicht mit Calcium-haltigen Lösungen gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Verpackung mit «EXP» bezeichneten Datum verwendet werden.
Infusionslösungskonzentrat
Die verdünnten Infusionszubereitungen sind nicht konserviert. Die chemische und physikalische Stabilität der gebrauchsfertigen Lösung wurde bei 2-8 °C für 24 Stunden gezeigt. Aus mikrobiologischen Gründen ist die gebrauchsfertige Zubereitung unmittelbar nach der Verdünnung zu verwenden.
Besondere Lagerungshinweise
Infusionslösungskonzentrat
Bei Raumtemperatur (15-25 °C) lagern.
Das Infusionslösungskonzentrat ist zur einmaligen Anwendung bestimmt, nicht verwendete Reste sind zu verwerfen.
Hinweis zur Handhabung
Die Freisetzung pharmazeutischer Präparate in die Umwelt ist auf ein Minimum zu reduzieren. Das Arzneimittel sollte nicht ins Abwasser entsorgt werden und die Entsorgung im Haushaltsabfall ist zu vermeiden. Wählen Sie möglichst die anerkannten Sammelstellen Ihres Ortes.
Zulassungsnummer
57424 (Swissmedic).
Zulassungsinhaberin
Future Health Pharma GmbH, 8620 Wetzikon.
Stand der Information
Juli 2019
Composition
Principe actif: Acidum ibandronicum ut Natrii ibandronas hydricus.
Excipients
Concentré de solution pour perfusion: Natrii chloridum, Natrii acetas, Acidum acetas glaciale, Aqua ad iniectabilia q.s. pro solutionem.
Forme galénique et quantité de principe actif par unité
Concentré de solution pour perfusion
1 flacon de 6 ml contient 6 mg d'acide ibandronique (soit 6,75 mg d'acide ibandronique sous forme de sel monosodique).
Indications/Possibilités d’emploi
Concentré de solution pour perfusion 6 mg/6 ml
Traitement de patientes souffrant de métastases osseuses dues à un cancer du sein.
Posologie/Mode d’emploi
Hypercalcémie Posologie usuelle
Avant le traitement par Bondronat, réhydrater les patients avec une solution de chlorure de sodium à 0,9%. La posologie dépend de la sévérité de l'hypercalcémie et du type de tumeur. En règle générale, les patients présentant des métastases osseuses ostéolytiques nécessitent l'administration de doses plus faibles que les patients atteints d'hypercalcémie humorale. Chez la plupart des patients souffrant d'hypercalcémie sévère (calcémie* corrigée en fonction de l'albuminémie ≥3 mmol/l ou ≥12 mg/dl), une dose unique de 4 mg suffit. Chez les patients dont l'hypercalcémie est modérée (calcémie corrigée en fonction de l'albuminémie <3 mmol/l ou <12 mg/dl), une dose de 2 mg s'avère efficace.
*Remarque concernant le calcul de la calcémie corrigée en fonction de l'albuminémie: calcémie corrigée (mmol/l) = calcémie (mmol/l) - [0,02 × albumine (g/l)] + 0,8
ou
calcémie corrigée (mg/dl) = calcémie (mg/dl) + 0,8 x [4 - albumine (g/dl)].
(Conversion des valeurs de calcémie corrigée en fonction de l'albuminémie de mmol/l en mg/dl: multiplier par 4 la valeur exprimée en mmol/l.)
Dans la plupart des cas, une calcémie sérique élevée peut être ramenée à la normale en l'espace de 7 jours par une perfusion unique de Bondronat. Le délai moyen avant récidive (nouvelle montée de la calcémie sérique corrigée en fonction de l'albuminémie à plus de 3 mmol/l) a été de 18-19 jours pour une dose de 2 mg ou 4 mg. Le délai médian avant récidive a été de 26 jours pour une dose de 6 mg. Si l'hypercalcémie réapparaît ou si l'effet obtenu n'est pas suffisant, le traitement peut être répété, la dose totale de 6 mg de Bondronat par épisode hypercalcémique ne devant toutefois pas être dépassée – jusqu'à ce que l'on dispose d'une expérience clinique suffisante.
Instructions spéciales pour le dosage
Faute de données cliniques, il n'est pas possible de proposer de recommandations posologiques pour les patients atteints d'insuffisance hépatique sévère. Chez de tels patients, le bénéfice potentiel d'un traitement par Bondronat doit être pesé face aux risques encourus.
Chez les insuffisants rénaux traités par Bondronat, les contrôles de la fonction rénale sont laissés à l'appréciation du médecin (voir «Mises en garde et précautions»).
Instructions relatives au mode d'administration
Après dilution, administrer le concentré de solution pour perfusion de Bondronat par voie intraveineuse sur une durée de 2 heures.
A cet effet, diluer le contenu des flacons avec 500 ml de soluté isotonique de chlorure de sodium ou 500 ml de soluté glucosé à 5%.
Comme l'administration intra-artérielle de préparations qui ne sont pas expressément destinées à un traitement intra-artériel peut provoquer des dommages, il convient, à titre de précaution, de perfuser Bondronat par voie intraveineuse.
Métastases osseuses dues à un cancer du sein
Administration intraveineuse
La dose recommandée est de 6 mg par voie intraveineuse toutes les 3-4 semaines.
Après dilution, administrer le concentré de solution pour perfusion de Bondronat en perfusion intraveineuse. La durée de la perfusion est d'au moins 15 minutes.
A cet effet, diluer le contenu des flacons avec 100 ml de soluté isotonique de chlorure de sodium ou 100 ml de soluté glucosé à 5% (voir «Remarques particulières»).
Bondronat doit uniquement être perfusé par voie intraveineuse, car une administration intra- artérielle ou paraveineuse peut entraîner des lésions tissulaires.
Instructions spéciales pour le dosage
Patientes atteintes d'insuffisance hépatique
Un ajustement de la dose n'est pas nécessaire.
Patientes atteintes d'insuffisance rénale
Concentré de solution pour perfusion
Aucun ajustement posologique n'est nécessaire chez les patientes présentant une insuffisance rénale légère (CLCr ≥50 et <80 ml/min). Chez les patientes présentant une insuffisance rénale modérée (CLCr ≥30 et <50 ml/min) ou sévère (CLCr <30 ml/min), traitées en prévention d'événements squelettiques dans le cadre d'un cancer du sein avec métastases osseuses, les recommandations posologiques suivantes devront être respectés:
Clairance de la créatinine (ml/min) | Posologie/Durée de la perfusion1 | Volume de la perfusion2 |
≥50, <80 | 6 mg/15 minutes | 100 ml |
≥30, <50 | 4 mg/1 heure | 500 ml |
<30 | 2 mg/1 heure | 500 ml |
1 Administration toutes les 3 à 4 semaines.
2 Solution de chlorure de sodium à 0,9% ou solution de glucose à 5%.
Patientes âgées
Chez la patiente âgée, aucun ajustement de la dose n'est nécessaire.
Enfants et adolescents
L'efficacité et la sécurité d'emploi de Bondronat chez l'enfant et l'adolescent de moins de 18 ans n'ont fait l'objet d'aucune étude.
Contre-indications
•Hypersensibilité connue au principe actif (acide ibandronique) ou à l'un des excipients conformément à la composition.
•Hypocalcémie.
•Grossesse et allaitement.
•Enfants et adolescents.
Mises en garde et précautions
La prudence est de rigueur en cas d'hypersensibilité connue à l'égard d'autres bisphosphonates.
Chez des patients traités avec l'acide ibandronique par voie intraveineuse, des cas de réactions anaphylactiques/choc anaphylactique, y compris des événements avec issue mortelle, ont été rapportés.
Lorsque Bondronat est administré par voie intraveineuse, un soutien médical et des mesures de surveillance appropriés doivent être disponibles. En cas de réactions anaphylactiques ou d'autres réactions graves allergiques ou d'hypersensibilité, la perfusion doit être interrompue immédiatement et un traitement approprié instauré.
Les études cliniques randomisées, contrôlées versus placebo, réalisées chez des femmes souffrant de métastases osseuses dues à un cancer du sein n'ont pas mis en évidence de détérioration de la fonction rénale lors d'un traitement au long cours par Bondronat. Néanmoins, en fonction de l'état clinique de la patiente, la fonction rénale, la calcémie, la phosphatémie et la magnésémie doivent être surveillées chez les patientes traitées par Bondronat.
Avant le début du traitement par Bondronat, il convient de traiter efficacement une hypocalcémie ainsi que d'autres troubles éventuels du métabolisme minéral. Un apport suffisant de calcium et de vitamine D est essentiel chez toutes les patientes. En cas d'apport insuffisant par l'alimentation, une substitution en calcium et/ou en vitamine D est indiquée.
Au moment de la réhydratation, une prudence toute particulière est requise chez les patientes présentant un risque accru d'insuffisance cardiaque en raison du risque de décompensation cardiaque.
L'influence de Bondronat sur la capacité de réaction, le discernement et les facultés cognitives n'a pas été étudiée.
Une ostéonécrose de la mâchoire (ONM) a été rapportée chez des patients traités par des bisphosphonates. La plupart des cas concernaient des patients atteints de cancer ayant subi des interventions dentaires, mais certains cas sont survenus chez des patients atteints d'ostéoporose postménopausique et porteurs d'autres diagnostics. Les ostéonécroses de la mâchoire sont généralement en rapport avec des extractions dentaires et/ou des infections locales (dont une ostéomyélite). Les facteurs de risque connus d'une ostéonécrose de la mâchoire comprennent des affections cancéreuses, des traitements associés (p.ex. chimiothérapie, y compris inhibiteurs de l'angiogenèse, radiothérapie, corticostéroïdes) et des comorbidités (p.ex. anémie, coagulopathie, infection, affections dentaires préexistantes). La plupart des cas rapportés concernaient des patients ayant reçu un traitement intraveineux par des bisphosphonates, mais certains cas sont survenus chez des patients traités par voie orale.
Chez les patients développant une ostéonécrose de la mâchoire (ONM) pendant un traitement par bisphosphonates, une chirurgie dentaire peut entraîner une aggravation de leur état. Pour les patients nécessitant des interventions dentaires, on ne dispose d'aucune donnée indiquant si l'arrêt du traitement par les bisphosphonates réduit le risque d'ONM. Avant l'instauration d'un traitement par des bisphosphonates, un examen dentaire avec des mesures de précaution appropriées doit être envisagé chez les patients présentant des facteurs de risque simultanés (p.ex. cancer, chimiothérapie, radiothérapie, corticostéroïdes, mauvaise hygiène buccale). L'évaluation clinique par le médecin traitant doit servir de guide pour établir le plan thérapeutique de chaque patient, en tenant compte du rapport bénéfice-risque individuel.
Des cas d'ostéonécrose au niveau d'autres sites buccofaciaux, y compris le conduit auditif externe, ont également été rapportés chez des patients traités par des bisphosphonates, dont l'acide ibandronique. Les facteurs de risque sont similaires à ceux de l'ONM. De petites blessures répétées (p.ex. usage habituel de bâtonnets ouatés) peuvent figurer parmi les facteurs de risque supplémentaires. La possibilité d'une ostéonécrose du conduit auditif externe doit être envisagée chez les patients traités par des bisphosphonates qui présentent des symptômes auriculaires, y compris des otites chroniques.
Fractures atypiques du fémur
Des fractures fémorales atypiques, sous-trochantériennes et diaphysaires, ont été rapportées au cours du traitement par des bisphosphonates, essentiellement chez des patients ayant reçu un traitement antiostéoporotique prolongé. Ces fractures transversales ou obliques courtes peuvent survenir à un endroit quelconque le long du fémur, entre la région située immédiatement au- dessous du petit trochanter et les condyles. Ces fractures surviennent après un traumatisme minime ou en l'absence de traumatisme et certains patients ressentent déjà des semaines ou des mois avant la formation d'une fracture fémorale complète, des douleurs au niveau de la cuisse ou de l'aine, souvent associées à des signes radiologiques d'une fracture de stress. Les fractures sont souvent bilatérales; une fracture controlatérale doit donc être recherchée chez les patients qui sont traités par des bisphosphonates et souffrent d'une fracture du fût fémoral. Une mauvaise consolidation de ces fractures a également été rapportée. Chez les patients chez qui l'on suspecte une fracture atypique du fémur, il faut envisager l'arrêt du traitement par les bisphosphonates jusqu'à l'évaluation du patient basée sur le rapport bénéfice/risques individuel.
Ces fractures ont été également rapportées chez des patients ostéoporotiques non traités par des bisphosphonates.
Interactions
Interactions avec d'autres médicaments
Aucune interaction n'a été observée chez les patientes atteintes de myélome multiple lors de l'administration simultanée d'acide ibandronique et de melphalan/prednisolone.
Des études sur les interactions, réalisées chez des femmes postménopausées, ont montré qu'il n'existe aucun potentiel d'interaction avec le tamoxifène ou avec un traitement hormonal substitutif (estrogènes).
L'administration intraveineuse de ranitidine entraîne une augmentation d'environ 20% de la biodisponibilité de l'acide ibandronique (qui se situe toujours dans les limites de la normale). Aucun ajustement de la dose n'est nécessaire lorsque Bondronat est administré simultanément avec des antagonistes H2 ou d'autres médicaments qui augmentent le pH du suc gastrique.
Dans des études cliniques, Bondronat a été administré de façon concomitante avec des agents anticancéreux couramment utilisés, des diurétiques, des antibiotiques et des analgésiques et aucune interaction clinique n'a été observée.
Des interactions cliniquement significatives avec d'autres médicaments sont improbables. L'acide ibandronique est éliminé exclusivement par voie rénale et ne subit aucune biotransformation.
La prudence est de rigueur lorsque des bisphosphonates sont administrés en même temps que des aminosides, ces deux groupes de substances étant susceptibles d'entraîner une baisse de la calcémie sur une longue période. Surveiller également l'apparition simultanée éventuelle d'une hypomagnésémie.
Grossesse/Allaitement
Grossesse
Bondronat ne doit pas être utilisé durant la grossesse. On ne dispose pas de données suffisantes sur l'utilisation de l'acide ibandronique chez la femme enceinte. Des études chez le rat ont mis en évidence une faible toxicité sur la reproduction (voir «Données précliniques»). Le risque potentiel pour le fœtus n'est pas connu (voir «Contre-indications»).
Allaitement
On ignore si l'acide ibandronique passe dans le lait maternel chez la femme. Des études réalisées chez des rattes allaitantes ont montré la présence de faibles concentrations d'acide ibandronique dans le lait maternel après administration intraveineuse. Bondronat ne doit pas être utilisé pendant l'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée.
Effets indésirables
Les effets indésirables ci-après ont été observés:
Classe d'organes | Traitement intraveineux |
Infections | |
Infection | Fréquent |
Candidose buccale | Rare |
Troubles de la circulation sanguine et lymphatique | |
Anémie | Rare |
Lymphœdème | Rare |
Système immunitaire | |
Hypersensibilité | Très rare |
Des cas de réactions anaphylactiques/choc anaphylactique, y compris des événements avec issue mortelle, ont été rapportés chez des patients traités par l'acide ibandronique (voir «Mises en garde et précautions»). | Très rare |
Des réactions allergiques incluant des exacerbations asthmatiques ont été rapportées. | Très rare |
Des réactions cutanées indésirables graves ont été rapportées, incluant syndrome de Stevens-Johnson, érythème polymorphe et dermatose bulleuse. | Très rare |
Troubles endocriniens | |
Augmentation de la parathormone | Fréquent |
Perte de poids | Rare |
Augmentation de la phosphatase alcaline | Rare |
Troubles du métabolisme et de la nutrition | |
Hypocalcémie | Fréquent |
Hypophosphatémie | Rare |
Troubles psychiatriques | |
Anxiété | Rare |
Amnésie | Rare |
Troubles du système nerveux | |
Céphalées | Fréquent |
Etourdissements | Fréquent |
Dysgueusie | Fréquent |
Troubles du sommeil | Rare |
Paresthésies péribuccales | Rare |
Hyperesthésie | Rare |
Lésion des racines nerveuses | Rare |
Névralgie | Rare |
Migraine | Rare |
Parosmie | Rare |
Troubles oculaires | |
Cataracte | Fréquent |
Uvéite, iridosclérite, sclérite | Très rare |
Des événements oculaires inflammatoires, tels qu'une uvéite, une épisclérite et une sclérite ont été rapportés au cours du traitement par des bisphosphonates, dont l'acide ibandronique. Dans certains cas, ces événements n'ont pas guéri avant l'arrêt du bisphosphonate. | |
Troubles de l'oreille et du conduit auditif | |
Surdité | Rare |
Troubles cardiaques | |
Bloc de branche | Fréquent |
Palpitations | Rare |
Ischémie myocardique | Rare |
Troubles vasculaires | |
Hypertension | Rare |
Troubles respiratoires | |
Œdème pulmonaire | Rare |
Stridor | Rare |
Bronchospasmes | Très rare |
Troubles gastro-intestinaux | |
Diarrhée | Fréquent |
Dyspepsie | Fréquent |
Vomissements | Fréquent |
Douleurs abdominales | Fréquent |
Pharyngite | Fréquent |
Affection dentaire | Fréquent |
Dysphagie | Rare |
Gastro-entérite | Rare |
Stomatite | Rare |
Troubles hépato-biliaires | |
Elévation de la gamma-GT | Fréquent |
Cholélithiase | Rare |
Troubles cutanés | |
Vésicules | Fréquent |
Ecchymose | Fréquent |
Chéilite | Rare |
Rash | Rare |
Alopécie | Rare |
Œdème angioneurotique | Très rare |
Troubles musculosquelettiques | |
Myalgies | Fréquent |
Arthralgies | Fréquent |
Douleurs osseuses | Fréquent |
Rigidité | Occasionnel |
Douleurs pelviennes | Rare |
Des fractures fémorales sous-trochantériennes et diaphysaires atypiques (effet de classe des bisphosphonates) ont été rapportées (voir «Mises en garde et précautions»). | Rare |
Osteonécrose de la mâchoire et d'autres sites buccofaciaux, y compris du conduit auditif externe (voir «Mises en garde et précautions»). | Très rare |
Troubles rénaux et urinaires | |
Elévation de la créatinine | Fréquent |
Cystite | Rare |
Rétention urinaire | Rare |
Troubles des organes de la reproduction | |
Vaginite | Rare |
Troubles généraux | |
Fièvre | Très fréquent (11,1%) |
Asthénie | Fréquent |
Œdème périphérique | Fréquent |
Soif excessive | Fréquent |
Syndrome pseudo-grippal | Fréquent |
Douleurs au point d'injection | Rare |
Hypothermie | Rare |
La diminution de l'excrétion urinaire de calcium va souvent de pair avec une diminution de la phosphatémie, qui ne nécessite toutefois aucun traitement. La calcémie peut baisser jusqu'à des valeurs hypocalcémiques (rapportées chez environ 3% des patients dans les études cliniques).
Une relation a été évoquée entre le traitement par bisphosphonates et l'apparition de réactions bronchospastiques chez des patientes souffrant d'asthme déclenché par l'acide acétylsalicylique.
Surdosage
On ne dispose pas d'informations spécifiques concernant le traitement d'un surdosage par Bondronat.
Les procédés standards d'hémodialyse entraînent une clairance significative de l'acide ibandronique.
Au cours d'études précliniques, des lésions rénales et hépatiques toxiques ont été constatées après l'administration de doses élevées de Bondronat. Par conséquent, il convient de contrôler les fonctions rénale et hépatique en cas de surdosage.
Il est possible de remédier à une éventuelle hypocalcémie cliniquement significative par une perfusion de gluconate de calcium.
Propriétés/Effets
Code ATC: M05BA06
Mécanisme d'action/pharmacodynamie
Bondronat appartient à la classe des bisphosphonates qui exercent un effet ciblé sur les os. Leur action sélective sur le tissu osseux repose sur leur grande affinité pour la fraction osseuse minérale. Les bisphosphonates inhibent l'activité des ostéoclastes; leur mécanisme d'action exact n'est pas encore élucidé.
In vivo, l'acide ibandronique inhibe la destruction osseuse provoquée expérimentalement par la suppression des fonctions gonadiques, par des rétinoïdes, des tumeurs ou des extraits tumoraux. Chez le rat, la résorption osseuse endogène a également été inhibée, d'où une masse osseuse plus importante par rapport aux animaux non traités.
Cela a pour effet d'inhiber une ostéolyse excessive et de normaliser des taux de calcium élevés. Des doses significativement plus élevées que les doses pharmacologiquement efficaces n'ont montré aucun effet sur la minéralisation osseuse. Au cours des études cliniques, on a pu prouver que l'effet inhibiteur de Bondronat sur l'ostéolyse d'origine tumorale et, plus particulièrement, sur l'hypercalcémie d'origine tumorale, se caractérise par une diminution du calcium sérique et de l'excrétion urinaire de calcium. Selon les valeurs initiales du taux sérique de calcium, la posologie et le type de tumeur, le retour de la calcémie à des valeurs normales a été obtenu chez près de 100% des patients.
Efficacité clinique
Traitement de l'hypercalcémie d'origine tumorale
Les études cliniques menées dans l'hypercalcémie maligne ont démontré que l'action inhibitrice de l'acide ibandronique sur l'ostéolyse d'origine tumorale et, plus particulièrement, sur l'hypercalcémie d'origine tumorale, se caractérise par une diminution du calcium sérique et de l'excrétion urinaire de calcium.
Dans la fourchette posologique recommandée, les taux de réponse moyens suivants avec les intervalles de confiance (IC) correspondants ont été obtenus chez les patients qui avaient une calcémie corrigée en fonction de l'albuminémie ≥3,0 mmol/l après une hydratation adéquate:
Dose | 2 mg | 4 mg | 6 mg |
Taux de réponse (limite supérieure – inférieure de l'IC à 90%) | 54 (44-63) | 76 (62-86) | 78 (64-88) |
Chez ces patients et à ces doses, le délai médian jusqu'à la normalisation de la calcémie a été de 4 à 7 jours. Le délai médian avant récidive (retour de la calcémie corrigée en fonction de l'albuminémie à une valeur supérieure à 3,0 mmol/l) a été de 18 à 26 jours.
Traitement des métastases osseuses en cas de cancer du sein
L'efficacité de l'ibandronate dans le traitement des métastases osseuses d'un cancer du sein a été évaluée dans le cadre d'une étude de phase III randomisée, contrôlée versus placebo, menée chez n=312 patientes. Les patientes ont reçu 6 mg d'ibandronate par voie i.v. ou un placebo toutes les 3 à 4 semaines pendant 96 semaines au total. Les patientes incluses étaient atteintes d'un cancer du sein et de métastases osseuses confirmées radiologiquement. Le principal critère d'évaluation de l'étude était le taux de morbidité osseuse par période (skeletal morbidity period rate, SMPR), lequel prend en considération l'incidence des fractures vertébrales et non vertébrales, la radiothérapie osseuse et un éventuel traitement chirurgical de fractures. Un avantage statistiquement significatif a été observé pour l'ibandronate par rapport au placebo (réduction du SMPR sous ibandronate par rapport au placebo: 0,29; p=0,004). Ceci a correspondu à une réduction du risque de 40%.
Ces résultats ont été confirmés par deux études similaires avec administration orale d'ibandronate (50 mg/jour).
Les douleurs osseuses, la qualité de vie ainsi que les marqueurs urinaires de la résorption osseuse figuraient parmi les critères secondaires d'efficacité. Ces critères se sont tous améliorés sous Bondronat par rapport au placebo.
La sécurité de Bondronat lors d'une perfusion durant une heure a été comparée à celle lors d'une perfusion d'une durée de 15 minutes au cours d'une étude portant sur 130 patientes présentant un cancer du sein métastatique. Aucune différence n'a été constatée en ce qui concerne la fonction rénale. En outre, pour une durée de perfusion de 15 minutes, le profil d'effets indésirables de Bondronat a correspondu au profil de sécurité connu pour les durées de perfusion plus longues et aucun effet indésirable nouveau n'a été observé en relation avec la durée de perfusion de 15 minutes.
La durée de perfusion de 15 minutes n'a cependant pas été étudiée chez les patientes cancéreuses présentant une clairance de la créatinine <50 ml/min.
Pharmacocinétique
Absorption
La concentration plasmatique de l'acide ibandronique augmente proportionnellement à la dose après administration d'une dose intraveineuse allant jusqu'à 6 mg.
Distribution
Chez l'homme, le volume de distribution terminal est apparemment d'au moins 90 l. Après la première exposition systémique, l'acide ibandronique se lie rapidement au tissu osseux. On estime que 40-50% de la dose circulante atteignent le tissu osseux. La liaison aux protéines dans le plasma humain est d'environ 87% aux concentrations thérapeutiques, de sorte que des interactions par éviction avec d'autres médicaments sont improbables.
Métabolisme
On ne dispose d'aucune donnée laissant penser que l'acide ibandronique est métabolisé chez l'homme ou chez l'animal.
Elimination
La fraction d'acide ibandronique disponible au niveau systémique qui n'est pas absorbée par le tissu osseux est éliminée sous forme inchangée par voie rénale.
La demi-vie d'élimination terminale est de l'ordre de 10 à 60 heures. Toutefois, les taux plasmatiques initiaux diminuent rapidement et ne correspondent plus qu'à 10% des valeurs maximales 3 à 8 heures après l'administration intraveineuse.
Chez les patientes atteintes de métastases osseuses, on n'a observé aucune accumulation systémique après 48 semaines de traitement par l'acide ibandronique administré toutes les quatre semaines par voie intraveineuse.
Avec des valeurs moyennes de l'ordre de 84-160 ml/min, la clairance totale de l'acide ibandronique est faible. La clairance rénale (environ 60 ml/min chez la femme saine postménopausée) représente 50-60% de la clairance totale et est corrélée à la clairance de la créatinine. On suppose que la différence entre la clairance totale apparente et la clairance rénale correspond à la fraction absorbée par le tissu osseux.
Cinétique pour certains groupes de patients
Patientes atteintes d'insuffisance rénale
Chez les patientes présentant une insuffisance légère (CLCr >50 et <80 ml/min) et chez les patientes présentant une insuffisance rénale modérée (CLCr >30 et <50 ml/min) recevant une dose intraveineuse unique de 6 mg (durée de la perfusion 15 minutes), l'AUC est augmentée de 14% et 86% respectivement par rapport au sujet sain.
Les concentrations plasmatiques chez les patientes présentant une insuffisance rénale sévère (CLcr ≤30 ml/min) étaient 2-3 fois plus élevées que chez les patientes ayant une fonction rénale normale (CLcr >90 ml/min (voir «Posologie/Mode d'emploi, Instructions spéciales pour le dosage»).
Patientes atteintes d'insuffisance hépatique
On ne dispose d'aucune donnée pharmacocinétique sur l'acide ibandronique chez les patientes présentant une insuffisance hépatique. Le foie ne joue pas un rôle déterminant dans la clairance de l'acide ibandronique, car le principe actif n'est pas métabolisé. La clairance se fait par élimination rénale de la substance inchangée et par absorption de l'acide ibandronique dans le tissu osseux. C'est pourquoi aucun ajustement de la dose n'est nécessaire chez les insuffisants hépatiques.
Patientes âgées
Il convient de tenir compte du fait que la fonction rénale diminue avec l'âge.
Pédiatrie
On ne dispose d'aucune donnée sur l'utilisation de Bondronat chez des patientes de moins de 18 ans.
Sexe/race
A l'heure actuelle, on ne dispose d'aucun élément montrant que le sexe ou l'appartenance ethnique influencent les paramètres pharmacocinétiques.
Données précliniques
Comme pour les autres bisphosphonates, il a été déterminé que le rein est l'organe cible primaire de la toxicité systémique. Chez l'animal, des effets toxiques ont été observés à des doses supérieures à la dose maximale administrée chez l'homme.
Mutagénicité/Cancérogénicité
On n'a observé aucun signe évocateur d'un potentiel cancérogène ou génotoxique.
Toxicité sur la reproduction
L'administration par voie orale d'acide ibandronique chez le rat et le lapin n'a permis de mettre en évidence aucun effet toxique ou tératogène direct sur le fœtus. Chez le rat, l'administration d'une dose (calculée par extrapolation) nettement supérieure à l'exposition prévisible chez l'homme n'a montré aucun effet indésirable sur le développement de la descendance F1. Dans le cadre d'études sur la reproduction chez le rat, on a observé les effets indésirables escomptés pour la classe pharmaceutique à laquelle appartiennent les bisphosphonates. Font partie de ces effets indésirables: diminution du nombre de sites de nidation dans l'endomètre pour les ovules fécondés, influence négative sur l'accouchement naturel (dystocie) et augmentation des altérations viscérales (syndrome de la jonction pyélo-urétérale).
Dans des études portant sur la fertilité, l'acide ibandronique administré par voie intraveineuse à la dose de 1,2 mg/kg/jour a eu un effet délétère sur la fertilité des rattes. L'administration d'une dose située entre 1,0 et 16 mg/kg/jour par voie orale et d'une dose de 1,2 mg/kg/jour par voie intraveineuse a conduit à une diminution du nombre de sites de nidation.
Tératogénicité
Il n'a été mis en évidence ni effet toxique fœtal direct ni effet tératogène de l'acide ibandronique chez le rat et le lapin traités par voie intraveineuse ou orale.
Autres
Les effets indésirables de l'acide ibandronique dans les études de reproduction chez le rat ont été ceux attendus avec la classe des bisphosphonates. Ils incluent une réduction du nombre des sites de nidation, une interférence avec la mise bas naturelle (dystocie), une augmentation des anomalies viscérales (syndrome de la jonction pyélo-urétérale) et dentaires chez la génération F1 chez le rat.
Remarques particulières
Incompatibilités
Afin d'exclure d'éventuelles incompatibilités, ne diluer le concentré de solution pour perfusion de Bondronat qu'avec un soluté isotonique de chlorure de sodium ou un soluté glucosé à 5%. Ne pas mélanger Bondronat à des solutions contenant du calcium.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Concentré de solution pour perfusion
Les préparations pour perfusion diluées ne contiennent pas d'agent conservateur. Il a été attesté que la solution prête à l'emploi reste stable chimiquement et physiquement pendant 24 heures à 2-8 °C. Pour des raisons microbiologiques, la solution prête à l'emploi doit être utilisée immédiatement après la dilution.
Remarques particulières concernant le stockage
Concentré de solution pour perfusion
Conserver à température ambiante (15-25 °C).
Le concentré de solution pour perfusion est à usage unique; jeter tout reste de solution non utilisée.
Remarques concernant la manipulation
Le rejet des préparations pharmaceutiques dans l'environnement est à réduire au minimum. Les médicaments ne doivent pas être éliminés avec les eaux usées et il faut éviter de les éliminer avec les déchets ménagers. Choisissez dans la mesure du possible le lieu de collecte officiel correspondant à votre domicile.
Numéro d’autorisation
57424 (Swissmedic).
Titulaire de l’autorisation
Future Health Pharma GmbH, 8620 Wetzikon.
Mise à jour de l’information
Juillet 2019
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


 Deutsch
Deutsch French
French![Hexabrix Injektionslösung 320mg 10 Durchstechflaschen 100ml [!] Hexabrix Injektionslösung 320mg 10 Durchstechflaschen 100ml [!]](https://swiss-tablets.com/image/cache/placeholder-200x200.png)