Zoladex La Safesystem 10.8mg Fertigspritze buy online
Zoladex LA SafeSystem Implant 10.8 mg Fertspr
-
697.21 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: ASTRAZENECA AG
- Product Code: 2867973
- ATC-code L02AE03
- EAN 7680533710275
Ingredients:

Description
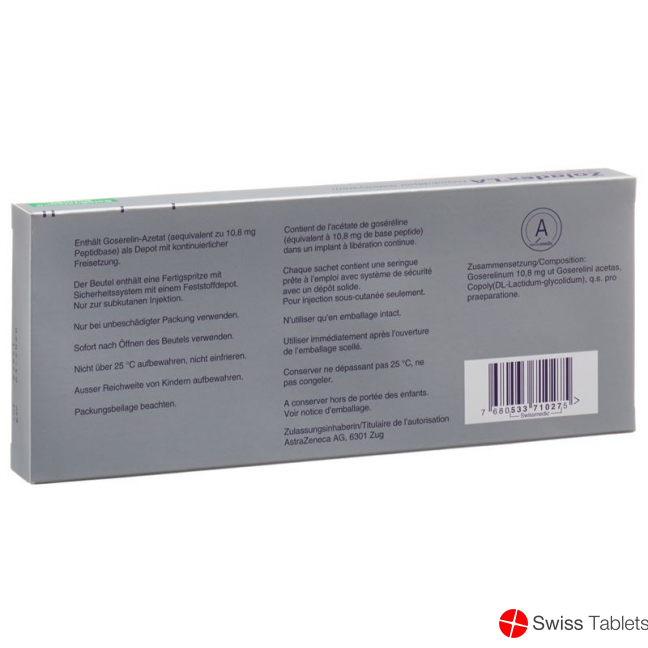
Zusammensetzung
Wirkstoffe
Goserelin 10,8 mg als Goserelinacetat.
Hilfsstoffe
Copolymer(DL-Milchsäure-Glykolsäure).
Darreichungsform und Wirkstoffmenge pro Einheit
Fertigspritze mit Implantat.
Steriles, weisses bis crèmefarbenes, zylindrisches Feststoffdepot zur subkutanen Anwendung in Form einer Fertigspritze mit Sicherheitssystem (SafeSystem) als vorabgefüllter Applikator. Die abbaubare Matrix besteht aus einem Milchsäure-Glykolsäure-Copolymer und enthält 11,3 mg Goserelinacetat (entsprechend 10,8 mg Peptidbase).
Indikationen/Anwendungsmöglichkeiten
Prostatakarzinom
Symptomatische Therapie des fortgeschrittenen, hormonabhängigen Prostatakarzinoms. Als alternative Behandlung, wenn Orchiektomie oder Östrogengaben für den Patienten entweder nicht indiziert oder nicht zumutbar sind.
Zoladex in Kombination mit Bicalutamid 50 mg, einem nichtsteroidalen Antiandrogen beim fortgeschrittenen, metastasierenden Prostatakarzinom (M1).
Adjuvante Hormontherapie beim lokal fortgeschrittenen Prostatakarzinom (Stadium T3-4 gemäss TNM Klassifikation) in Kombination mit externer Strahlentherapie.
Endometriose
Therapie sowohl der symptomatischen als auch der asymptomatischen, oft mit Infertilität einhergehenden Endometriose.
Uterusmyom
Zur präoperativen Vorbehandlung von anämischen Patientinnen mit Uterusmyomen, in Kombination mit einer Eisentherapie.
Dosierung/Anwendung
Vorsicht ist geboten beim Injizieren von Zoladex LA in die vordere Bauchwand aufgrund nahe darunterliegenden Arteria epigastrica inferior und ihrer Verzweigungen.
Bei Anwendung von Zoladex LA bei Patienten mit tiefem BMI und/oder gleichzeitigem Gebrauch von Antikoagulantien ist besondere Vorsicht geboten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Für die korrekte Anwendung von Zoladex LA beachten Sie die Instruktionen unter «Sonstige Hinweise».
Männer
Zoladex LA zu 10,8 mg wird alle 3 Monate subkutan unter die Bauchhaut injiziert.
Prostatakarzinom
Die Therapiedauer ist abhängig vom therapeutischen Effekt der Zoladex LA Therapie.
Beim fortgeschrittenen, metastasierenden Prostatakarzinom (M1) kann Zoladex LA mit einem nichtsteroidalen Antiandrogen Bicalutamid 50 mg (1x täglich 50 mg) kombiniert werden.
Bei der adjuvanten Hormontherapie in Kombination mit externer Strahlentherapie beim lokal fortgeschrittenen Prostatakarzinom beschränkt sich die klinische Erfahrung auf 36 Monate.
Frauen
Zoladex LA zu 10,8 mg wird alle 12 Wochen subkutan unter die Bauchhaut injiziert.
Endometriose
Die Dauer der Therapie muss für jede Patientin individuell ermittelt werden, beruhend auf dem Grad der Regression der Implantate und der Besserung der Symptomatik. Nötigenfalls können Laborwerte (Östradiol, Progesteron) zur Therapiekontrolle beigezogen werden. Allgemein wird mit einer Therapiedauer von 3-6 Monaten ein gutes Resultat erzielt.
Rezidivierende Endometriose
Der therapeutische Effekt wiederholter Therapiezyklen mit Zoladex LA muss gegen die erwartete Reduktion der Knochenmineraldichte abgewogen werden.
Uterusmyom
Zoladex LA wird einmalig als präoperative Vorbehandlung verabreicht; bei anämischen Patientinnen in Kombination mit einer Eisenbehandlung.
Spezielle Dosierungsanweisungen
Dosisanpassungen sind weder bei Patienten in fortgeschrittenem Alter noch bei solchen mit Nieren- oder Leberinsuffizienz notwendig.
Kontraindikationen
Zoladex LA ist kontraindiziert bei:
- Überempfindlichkeit gegenüber dem Wirkstoff Goserelin oder anderen LHRH-Analoga oder einem der Hilfsstoffe gemäss Zusammensetzung,
- nachgewiesener Hormonunabhängigkeit des Prostatakarzinoms,
- nicht abgeklärten Vaginalblutungen,
- während der Schwangerschaft und Stillzeit.
Warnhinweise und Vorsichtsmassnahmen
In Verbindung mit Zoladex LA wurden Verletzungen der Injektionsstelle wie Schmerzen, Hämatome, Hämorrhagien und vaskuläre Verletzungen berichtet. Betroffene Patienten sollen unter Behandlung mit Zoladex LA auf Anzeichen und Symptome einer abdominalen Hämorrhagie beobachtet werden. In seltenen Fällen führte die falsche Anwendung von Zoladex LA zu einer vaskulären Verletzung mit hämorrhagischem Schock und folgender Bluttransfusion und operativem Eingriff. Besondere Vorsicht ist geboten, wenn Zoladex LA bei Patienten mit tiefem BMI und/oder bei Komedikation mit Antikoagulantien (siehe «Dosierung/Anwendung») angewendet wird.
Während der Post-Marketing Phase traten seltene Fälle von Hypophysenapoplexie (ein klinisches Syndrom, infolge eines Hypophyseninfarktes) nach Verabreichung von GnRH-Agonisten auf. Bei der Mehrheit dieser Fälle war ein Hypophysenadenom diagnostiziert worden. Die meisten Fälle traten innerhalb von 2 Wochen nach der ersten Verabreichung auf, einige Fälle innerhalb der ersten Stunde. In diesen Fällen präsentiert sich Hypophysenapoplexie mit plötzlichen Kopfschmerzen, Erbrechen, Sehveränderungen, Ophthalmoplegie, veränderter mentaler Status und manchmal kardiovaskulärer Kollaps. Unverzügliche medizinische Intervention ist notwendig.
Bei bekanntem Hypophysenadenom sollte aus diesem Grund ein GnRH-Agonist nicht gegeben werden.
Bei einer Androgen-Entzugstherapie kann das QT-Intervall verlängert sein, auch wenn ein kausaler Zusammenhang mit Zoladex LA bisher nicht hergestellt werden konnte.
Bei Patienten mit einer QT-Verlängerung in der Vorgeschichte oder mit Risikofaktoren für eine QT-Verlängerung und bei Patienten, die gleichzeitig Arzneimittel erhalten, die das QT-Intervall verlängern können, muss der Arzt vor dem Behandlungsbeginn mit Zoladex LA das Nutzen-Risiko-Verhältnis einschliesslich des Potenzials für Torsade de Pointes abschätzen.
Männer
Unter Zoladex 3,6 mg wurde über einzelne Fälle von Ureterobstruktion und Rückenmarkskompression berichtet. Bei Patienten, die einem hohen Risiko für Ureterobstruktion und Rückenmarkskompression ausgesetzt sind oder bei welchen solche Komplikationen bereits vor Therapiebeginn vorhanden sind, ist eine Behandlung mit Zoladex LA gut abzuwägen und die Patienten sind während des ersten Therapiemonats gut zu beobachten. Falls infolge von Ureterobstruktion eine Nierenfunktionsstörung auftritt oder vorhanden ist, sollte wie üblich behandelt werden. Das gleiche gilt beim Vorhandensein oder Auftreten einer Rückenmarkskompression.
Im Fall eines klinischen Versagens der Therapie soll der Serumtestosteronspiegel bestimmt werden. Falls die Bestimmung auf eine ungenügende Suppression des Testosterons hinweist, muss eine andere Therapie (z.B. mit direkten Antiandrogenen) in Betracht gezogen werden.
Vorläufige publizierte Daten weisen auf eine geringere Reduktion der Knochenmineralisation hin, wenn LHRH-Agonisten in Kombination mit Biphosphonaten verabreicht werden als wenn LHRH-Agonisten alleine verabreicht werden. LHRH-Agonisten können zu einer Reduktion der Knochenmineralisation führen.
Bei Männern, die LHRH-Agonisten erhalten, wurde eine Reduktion der Glukose-Toleranz beobachtet. Dies kann einen Diabetes oder einen Verlust der glykämischen Kontrolle bei Patienten mit bereits existierendem Diabetes herbeiführen. Das sollte bei der Kontrolle des Glukose-Wertes berücksichtigt werden.
Frauen
Zoladex LA ist nur zur Behandlung der Endometriose und des Uterusmyoms indiziert. Für andere Indikationen wird auf die Arzneimittelfachinformation von Zoladex 3,6 mg verwiesen.
LHRH-Agonisten können zu einer Reduktion der Knochenmineralisation führen, welche nach Therapieende mit Zoladex mindestens teilweise reversibel ist.
Nach sechs Therapiemonaten mit Zoladex 3,6 mg wurde am lumbalen Wirbelkörper ein Substanzverlust von 4,6% gemessen, dieser war aber weitgehend reversibel.
Klinische Daten mit Zoladex 3,6 mg lassen vermuten, dass eine zusätzliche hormonelle Substitutionstherapie mit täglich verabreichten Östrogenen und Gestagenen in niedriger, osteoprotektiver Dosierung (z.B. 1-2 mg Östradiol bzw. Östradiolvalerat oder 0,625 mg konjugierte Östrogene und 5 mg Medroxyprogesteronacetat (MPA) oder 0,5-1 mg Norethisteron) den Knochendichteverlust und die vasomotorischen Symptome reduziert. Es besteht keine Erfahrung mit Hormonsubstitution bei Patientinnen, die mit Zoladex LA behandelt wurden.
Eine wirksame Behandlung soll sich innerhalb von 1-2 Monaten in einer Amenorrhoe äussern. Patientinnen sollen angewiesen werden, ihren Arzt über allfällig persistierende Menstruation zu informieren. Selten werden Schmierblutungen beobachtet.
Während der Behandlung mit LHRH-Analoga kann eine natürliche Menopause eintreten. In seltenen Fällen setzte die Menstruation auch bei jüngeren Frauen nach Absetzen der Therapie nicht wieder ein. Nach Ende der Behandlung kann die Menstruation bei einigen Patientinnen verzögert einsetzen (mehrere Monate bis über ein Jahr).
Die Verabreichung von Zoladex kann zu einem erhöhten Widerstand der Zervix führen. Die Zervix sollte deshalb vorsichtig dilatiert werden.
Bis heute liegen keine Erfahrungen vor über klinische Effekte von Therapiezyklen länger als 6 Monate bei Endometriose.
Kinder
Zoladex LA ist nicht für den Gebrauch bei Kindern bestimmt.
Interaktionen
Da eine Androgen-Entzugstherapie das QT-Intervall verlängern kann, sollte die gleichzeitige Anwendung von Zoladex LA mit Arzneimitteln, die bekanntermassen das QT-Intervall verlängern oder möglicherweise Torsade de Pointes induzieren, sorgfältig abgeschätzt werden (siehe «Warnhinweise und Vorsichtsmassnahmen»). Zu diesen Arzneimitteln gehören Antiarrhythmika der Klasse IA (z.B. Chinidin, Disopyramid) oder Klasse III (z.B. Amiodaron, Sotalol, Dofetilid, Ibutilid), sowie Methadon, Moxifloxacin, Antipsychotika und andere.
Weitere Interaktionen sind zurzeit nicht bekannt.
Schwangerschaft/Stillzeit
Reproduktionsstudien mit Zoladex 3,6 mg bei Tieren haben in hohen Dosen Anomalien (Zehen, Hirn) bei Ratte und Kaninchen gezeigt. Es liegen keine Studien über die Sicherheit von Zoladex LA bei schwangeren Frauen vor. Zoladex LA sollte daher nicht an Schwangere verabreicht werden. Eine potentielle Schwangerschaft sollte vor der Therapie ausgeschlossen werden. Während und nach einer Therapie mit Zoladex LA sollten nicht-hormonelle Kontrazeptiva solange eingesetzt werden, bis die Menstruation wieder einsetzt.
Die Verwendung von Zoladex LA während der Stillzeit wird nicht empfohlen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Zoladex LA hat keinen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Unerwünschte Wirkungen
Während der ersten Monate der Therapie können die unerwünschten Wirkungen stärker sein und eine symptomatische Therapie erfordern.
Die Häufigkeitsgruppen sind folgendermassen definiert: sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1'000, <1/100); selten (≥1/10'000, <1/1'000); sehr selten (<1/10'000); Häufigkeit aufgrund der vorhandenen Daten nicht bekannt.
Allgemein
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen)
Sehr selten: Hypophysentumor.
Erkrankungen des Immunsystems
Gelegentlich: Generalisierte Pruritus/Rush, Arzneimittelallergie, Angioödem, Urtikaria, allergische Dermatitis.
Selten: Anaphylaktische Reaktionen.
Endokrine Erkrankungen
Sehr häufig: Verminderung der Libido (55%).
Sehr selten: Hypophysenblutung.
Psychiatrische Erkrankungen
Sehr selten: psychotische Störungen.
Herzerkrankungen/Gefässerkrankungen
Häufig: Herzversagen, unregelmässiger Blutdruck.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: leichte Hautausschläge.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Reduktion der Knochenmineralisation.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Selten: Hämatome an der Injektionsstelle.
Untersuchungen
Häufig: Gewichtszunahme.
Männer
Zu Therapiebeginn führt Zoladex, wie andere LHRH-Analoga, zu einer kurzzeitigen Erhöhung des Serumtestosterons. Der anschliessende Abfall des Serumtestosteron-Spiegels kann zu unerwünschten Wirkungen führen.
Endokrine Erkrankungen
Sehr häufig: erektile Dysfunktion (61%).
Stoffwechsel- und Ernährungsstörungen
Häufig: Beeinträchtigung der Glukose-Toleranz.
Psychiatrische Erkrankungen
Häufig: Agitation, Angst Depression, Schlaflosigkeit, Konfusion, Nervosität.
Erkrankungen des Nervensystems
Sehr häufig: nicht-spezifische Parästhesien.
Gelegentlich: Rückenmarkskompression.
Herzerkrankungen/Gefässerkrankungen
Sehr häufig: Hitzewallungen (48%), Schweissausbrüche.
Häufig: Herzinfarkt.
Erkrankungen der Haut und des Unterhautgewebes
Häufigkeit nicht bekannt: Haarausfall.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Arthralgien, bei Patienten mit Knochenmetastasen zu Beginn der Therapie verstärkte Knochenschmerzen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen der Nieren und Harnwege
Gelegentlich: Ureterobstruktion.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Häufig: Gynäkomastie.
Gelegentlich: Schmerzempfindlichkeit der Brust.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: lokale Reaktionen, wie leichte Quetschungen an der Injektionsstelle.
Frauen
Bei der prämenopausalen Frau kann der Abfall der Serumöstrogen-Spiegel zu typischen klimakterischen Beschwerden (Menopausensymptomen) führen, wie sie auch nach einer Ovarektomie auftreten.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: Ödeme.
Psychiatrische Erkrankungen
Sehr häufig: Stimmungsveränderungen, Depressionen (47%).
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (59%).
Sehr selten: nicht-spezifische Parästhesien.
Herzerkrankungen/Gefässerkrankungen
Sehr häufig: Hitzewallungen (89%).
Erkrankungen der Haut und des Unterhautgewebes
Sehr häufig: Akne (28%).
Häufig: Haarausfall.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Arthralgien.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Sehr häufig: Vergrösserung der Brust (40%), vulvovaginale Trockenheit (58%).
Selten: Entstehung von Ovarialzysten, Schmierblutungen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: lokale Reaktionen (12,7%), wie leichte Quetschungen an der Injektionsstelle.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Beim Menschen liegen nur wenige Erfahrungen mit Überdosierung vor. In Fällen, bei denen Zoladex unabsichtlich nach einem zu kurzen Zeitintervall oder in einer zu hohen Dosis verabreicht wurde, sind keine klinisch relevanten unerwünschten Wirkungen beobachtet worden. Die Tierexperimente lassen vermuten, dass mit höheren Zoladex LA-Dosen keine anderen Wirkungen als die beabsichtigten therapeutischen Effekte auf die Konzentration der Geschlechtshormone und auf die Geschlechtsorgane auftreten dürften. Eine allfällige Überdosierung sollte symptomatisch behandelt werden.
Eigenschaften/Wirkungen
ATC-Code
L02AE03
Wirkungsmechanismus
Zoladex ist ein synthetisches Analogon des natürlich vorkommenden LHRH. Bei der ersten Anwendung bewirkt Zoladex LA eine kurzandauernde vermehrte Ausschüttung von LH und damit von Testosteron bei Männern und Östradiol bei Frauen. Bei Therapiebeginn kann es bei einigen Frauen zu Vaginalblutungen unterschiedlicher Dauer und Intensität kommen. Es wird vermutet, dass solche Blutungen durch den Östrogenentzug bedingt sind und spontan aufhören. Aufgrund der permanenten Hyperstimulation kommt es aber bald zu einer anhaltenden Suppression der hypophysären LH-Sekretion, was zu einem Abfall der Serumtestosteron- bzw. Serumöstradiolkonzentration führt.
Männer
Nach der ersten Injektion fallen die Testosteronkonzentrationen innerhalb von etwa 3 Wochen auf Werte, wie sie nach chirurgischer Kastration gemessen werden.
Diese Suppression wird aufrechterhalten, solange alle 3 Monate ein Zoladex LA injiziert wird. Nach Absetzen der Medikation ist die Suppression gewöhnlich reversibel.
Bei der Mehrzahl der Prostatakarzinom-Patienten führt diese Suppression zu einer Tumorregression und zur Besserung der Symptomatik. Zoladex LA hat gegenüber der Orchiektomie den Vorteil der Reversibilität und der geringeren psychischen Belastung für den Patienten.
Frauen
Nach der ersten Injektion fallen die Östradiolkonzentrationen nach rund 4 Wochen auf postmenopausale Werte. Diese Suppression wird aufrechterhalten, solange alle 12 Wochen ein Zoladex LA injiziert wird. Sie ist verantwortlich für die Wirksamkeit von Zoladex bei der Endometriose und beim Uterusmyom und führt bei der Mehrheit der Patientinnen zu einer Amenorrhoe.
Bei Patientinnen mit Endometriose wird eine Regression der Zahl und der Grösse der Implantate sowie eine Besserung der Symptomatik, inklusive Schmerz, erreicht.
Bei Frauen mit Myomen kann eine Degeneration des Myoms auftreten. Goserelinacetat in Kombination mit Eisen reduziert die Myome bei anämischen Frauen, verbessert den hämatologischen Status und die Symptomatik, einschliesslich Schmerzen. Die signifikante Grössenabnahme von Myomen erleichtert die Operation und verringert den Blutverlust.
Pharmakodynamik
Siehe auch unter «Wirkungsmechanismus».
Klinische Wirksamkeit
Keine Angaben.
Pharmakokinetik
Absorption
Die Bioverfügbarkeit von Goserelinacetat ist fast vollständig.
Nach einer einmaligen Applikation von 10,8 mg Zoladex LA wurde die maximale Serumkonzentration (mittlere cmax = 8-10 ng/ml) nach ca. 2 Stunden erreicht.
Distribution
Goserelinacetat ist nur wenig (ca. 25%) an Proteine gebunden und wird in verschiedene Verteilungsräume des Körpers verteilt.
Metabolismus
Goserelinacetat, ein an den Positionen 6(Butyl-Rest) und 10(Azgly-Rest) substituiertes Decapeptid, wird im Körper zu zwei Hauptmetaboliten hydrolysiert, dem Fragment mit den Aminosäuren 1 bis 7 und dem Fragment mit den Aminosäuren 5 bis 10.
Elimination
Die Elimination von Goserelinacetat ist eine Kombination von Metabolismus und renaler Exkretion. Die Metaboliten werden hauptsächlich über die Nieren ausgeschieden. Die Eliminationshalbwertszeit des Goserelinacetats im Serum beträgt etwa 2 bis 4 Stunden.
Wenn Zoladex LA gemäss den Dosierungsempfehlungen verabreicht wird, ist die Aufrechterhaltung wirksamer Serumkonzentrationen ohne Kumulation gewährleistet.
Kinetik spezieller Patientengruppen
Die Halbwertszeit ist bei Patienten mit verminderter Nierenfunktion erhöht, wobei diese Verlängerung bei dreimonatlicher Verabreichung des Depots nicht relevant ist und die Dosis nicht angepasst werden muss.
Bei Leberfunktionsstörungen wurde weder ein Einfluss auf die totale Körperclearance noch auf die Halbwertszeit festgestellt, weshalb sich eine Dosisanpassung erübrigt.
Präklinische Daten
Bei männlichen Ratten wurde nach Langzeitdosierung mit Zoladex LA eine erhöhte Inzidenz von benignen Hypophysentumoren beobachtet. Dieser Befund deckt sich mit der gleichen Beobachtung nach chirurgischer Kastration. Eine Relevanz für den Menschen ist nicht erwiesen.
Bei Mäusen führte die wiederholte Gabe von Dosen, die einem Mehrfachen der beim Menschen applizierten entsprachen, zu histologischen Veränderungen in verschiedenen Regionen des Verdauungstraktes. So wurden Pankreasinselzellhyperplasien, benigne Proliferationen am Pylorus des Magens und spontane Läsionen beobachtet. Eine klinische Relevanz für den Menschen ist nicht bekannt.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der versiegelten Packung aufbewahren.
Nicht über 25 °C lagern.
Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Bei Anwendung von Zoladex LA bei Patienten mit tiefem BMI und/oder gleichzeitigem Gebrauch von Antikoagulantien ist besondere Vorsicht geboten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Gebrauch nur wenn Verpackung unbeschädigt. Nach dem Öffnen sofort zu verwenden.
Zoladex wird subkutan injiziert
- Der Patient soll in eine bequeme leicht aufrechte Haltung gebracht werden.
Injektionsstelle desinfizieren.
HINWEIS: Beim Injizieren von Zoladex LA in die vordere Bauchwand ist aufgrund der darunterliegenden Arteria epigastrica inferior und ihrer Verzweigungen Vorsicht geboten. Sehr schlanke Patienten haben ein höheres Risiko für eine vaskuläre Verletzung. - Den Beutel sowie die Spritze auf Schäden kontrollieren. Entfernung der Spritze aus der Folie. Spritze in leichtem Winkel gegen das Licht halten und kontrollieren ob das Feststoffdepot sichtbar ist. (Abb. 1).
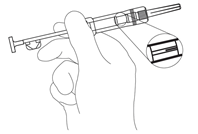 Abb. 1.
Abb. 1.
- Den Plastiksicherheitsbügel entfernen. (Abb. 2). Nadelhülle entfernen. Es ist nicht notwendig Luftblasen zu entfernen. Dadurch könnte das Feststoffdepot verschoben werden.
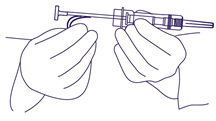 Abb. 2.
Abb. 2.
- Die Fertigspritze am Zylinder fassen und die Nadel in einem kleinen Winkel (30-45 Grad) in das subkutane Gewebe der vorderen Bauchwand unterhalb der Nabellinie einführen bis der Zylinder die Haut berührt (Abb. 3).
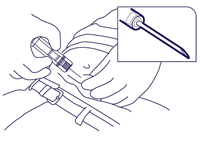 Abb. 3.
Abb. 3.
HINWEIS: Die Zoladex LA Spritze kann nicht zur Aspiration benützt werden. Sollte die Subkutannadel ein grosses Blutgefäss durchstechen, wird in der Spritzenkammer sofort Blut sichtbar. Wenn ein Gefäss durchstochen wurde, entfernen Sie die Spritze und beginnen Sie unverzüglich mit der Behandlung der entstandenen Blutung. Ist sichergestellt, dass der Patient hämodynamisch stabil ist, kann ein neues Zoladex Implantat mit einer neuen Spritze an einer anderen Injektionsstelle injiziert werden. Besondere Vorsicht ist geboten, wenn Zoladex bei Patienten mit tiefem BMI und/oder bei Komedikation mit Antikoagulantien.
- Die Nadel darf nicht in den Muskel oder das Peritoneum stechen. Falscher Griff und Einstechwinkel beim Einführen der Nadel (Abb. 4).
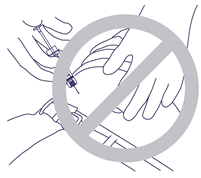 Abb. 4.
Abb. 4.
- Kolben vollständig hinunterdrücken, um das Feststoffdepot einzuführen und um das Sicherheitssystem zu aktivieren. Nach einem hörbaren «click» beginnt der Zylinder automatisch über die Nadel zu gleiten. Falls der Kolben nicht ganz hinuntergedrückt wird, kann sich das Sicherheitssystem nicht aktivieren.
HINWEIS: Die Nadel zieht sich nicht selber zurück. - Die Fertigspritze halten wie in (Abb. 5) abgebildet. Die Nadel zurückziehen, damit der Zylinder weiter über die Nadel gleitet bis die Nadel ganz bedeckt ist. Die Fertigspritze in einem geeigneten Behälter entsorgen.
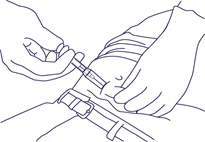 Abb. 5.
Abb. 5.
HINWEIS: Falls in seltenen Fällen das Zoladex LA Feststoffdepot operativ entfernt werden muss, kann es mit Ultraschall lokalisiert werden.
Zulassungsnummer
53371 (Swissmedic).
Zulassungsinhaberin
AstraZeneca AG, 6340 Baar.
Stand der Information
April 2020.
Composizione
Principi attivi
Goserelina 10,8 mg come goserelina acetato.
Sostanze ausiliarie
Copolimero (acido lattico-acido glicolico a bassa densità).
Forma farmaceutica e quantità di principio attivo per unità
Impianto in siringa preriempita.
Depot solido sterile, cilindrico, di colore da bianco a crema, per l'uso sottocutaneo in siringa preriempita con sistema di sicurezza (SafeSystem) in applicatore preriempito. La matrice degradabile è costituita da un copolimero di acido lattico-acido glicolico e contiene 11,3 mg di goserelina acetato (corrispondente a 10,8 mg di base peptidica).
Indicazioni/Possibilità d'impiego
Carcinoma prostatico
Terapia sintomatica del carcinoma prostatico ormono-dipendente in stadio avanzato. Come trattamento alternativo, qualora l'orchiectomia o la somministrazione di estrogeni non siano indicate o tollerabili per il paziente.
Zoladex in combinazione con bicalutamide 50 mg, un antiandrogeno non steroideo, nel trattamento del carcinoma prostatico metastatico in stadio avanzato (M1).
Terapia ormonale adiuvante nel carcinoma prostatico localmente avanzato (stadio T3-4 secondo la classificazione TNM) in combinazione con radioterapia esterna.
Endometriosi
Terapia dell'endometriosi sia sintomatica sia asintomatica spesso associata a infertilità.
Mioma uterino
Per il pretrattamento preoperatorio di pazienti anemiche con miomi uterini, in combinazione con una terapia marziale.
Posologia/Impiego
È richiesta cautela durante l'iniezione di Zoladex LA nella parete addominale anteriore a causa della prossimità con la sottostante arteria epigastrica inferiore e le sue ramificazioni.
È richiesta particolare cautela quando Zoladex LA viene utilizzato in pazienti con basso IMC e/o che usano in concomitanza anticoagulanti (cfr. «Avvertenze e misure precauzionali»).
Per l'uso corretto di Zoladex LA consultare le istruzioni riportate in «Altre indicazioni».
Uomini
Si effettua un'iniezione addominale sottocutanea di Zoladex LA da 10,8 mg ogni 3 mesi.
Carcinoma prostatico
La durata della terapia dipende dall'effetto terapeutico della terapia con Zoladex LA.
Nel carcinoma prostatico metastatico in stadio avanzato (M1), Zoladex LA può essere combinato con un antiandrogeno non steroideo come bicalutamide 50 mg (50 mg una volta al giorno).
L'esperienza clinica con la terapia ormonale adiuvante in combinazione con radioterapia esterna nel carcinoma prostatico localmente avanzato è limitata a 36 mesi.
Donne
Si effettua un'iniezione addominale sottocutanea di Zoladex LA da 10,8 mg ogni 12 settimane.
Endometriosi
La durata della terapia deve essere stabilita individualmente per ciascuna paziente sulla base del grado di regressione degli impianti e del miglioramento della sintomatologia. Se necessario è possibile fare riferimento ai valori di laboratorio (estradiolo, progesterone) per monitorare la terapia. Generalmente si ottengono buoni risultati con una terapia di 3-6 mesi.
Recidiva di endometriosi
L'effetto terapeutico di cicli ripetuti di Zoladex LA deve essere valutato in rapporto alla riduzione prevista della densità minerale ossea.
Mioma uterino
Zoladex LA viene somministrato un'unica volta come pretrattamento preoperatorio; in pazienti anemiche, in combinazione con una terapia marziale.
Istruzioni posologiche speciali
Non sono necessari aggiustamenti della dose né in pazienti in età avanzata né in pazienti con insufficienza renale o epatica.
Controindicazioni
Zoladex LA è controindicato in caso di:
- ipersensibilità al principio attivo goserelina o ad altri analoghi LHRH o a una qualsiasi delle sostanze ausiliarie secondo la composizione,
- documentata ormono-dipendenza del carcinoma prostatico,
- sanguinamenti vaginali a eziologia sconosciuta,
- durante la gravidanza e l'allattamento.
Avvertenze e misure precauzionali
In associazione a Zoladex LA sono state riferite lesioni in sede di iniezione quali dolori, ematomi, emorragie e lesioni vascolari. Nel corso del trattamento con Zoladex LA i pazienti interessati devono essere monitorati per la comparsa di segni e sintomi di emorragia addominale. In rari casi, l'utilizzo errato di Zoladex LA ha provocato una lesione vascolare con shock emorragico rendendo necessaria una trasfusione di sangue e un intervento chirurgico. È richiesta particolare cautela quando Zoladex LA viene utilizzato in pazienti con basso IMC e/o in terapia concomitante con anticoagulanti (cfr. «Posologia/impiego»).
Durante la fase post-marketing si sono verificati rari casi di apoplessia dell'ipofisi (sindrome clinica secondaria a un infarto ipofisario) a seguito della somministrazione di agonisti GnRH. Nella maggioranza di questi casi era stato diagnosticato un adenoma ipofisario. La maggior parte dei casi si è verificata nelle 2 settimane successive alla prima somministrazione, alcuni casi entro la prima ora. In questi casi l'apoplessia dell'ipofisi si manifesta con cefalee improvvise, vomito, alterazioni della vista, oftalmoplegia, stato mentale alterato e talvolta collasso cardiovascolare. È necessario un intervento medico immediato.
In presenza di adenoma ipofisario noto, non si devono pertanto somministrare agonisti GnRH.
Una terapia di deprivazione androgenica può prolungare l'intervallo QT, anche se finora non è stato possibile stabilire un nesso causale con Zoladex LA.
In pazienti con storia di prolungamento del QT o fattori di rischio per un prolungamento del QT e in pazienti che ricevono contemporaneamente medicamenti in grado di prolungare l'intervallo QT, prima di iniziare il trattamento con Zoladex LA il medico deve valutare il rapporto rischio-beneficio, incluso il potenziale di torsioni di punta.
Uomini
Con Zoladex 3,6 mg sono stati riferiti singoli casi di ostruzione ureterica e compressione del midollo spinale. Per i pazienti esposti a un rischio elevato di ostruzione ureterica e compressione del midollo spinale o che presentano tali complicanze già prima dell'inizio della terapia occorre valutare bene un trattamento con Zoladex LA ed effettuare un attento monitoraggio durante il primo mese di terapia. Se a seguito di un'ostruzione ureterica compare o è presente un disturbo della funzionalità renale, questo deve essere trattato come di consueto. Lo stesso vale anche in presenza o alla comparsa di compressione del midollo spinale.
In caso di fallimento clinico della terapia, occorre determinare il livello di testosterone sierico. Qualora la determinazione indichi un'insufficiente soppressione del testosterone, si deve prendere in considerazione un'altra terapia (ad es. con antiandrogeni diretti).
Dati preliminari pubblicati indicano una riduzione più contenuta della mineralizzazione ossea quando gli agonisti LHRH vengono somministrati in combinazione con bifosfonati rispetto a quando somministrati da soli. Gli agonisti LHRH possono portare a una riduzione della mineralizzazione ossea.
In uomini che ricevono agonisti LHRH è stata osservata una riduzione della tolleranza al glucosio che può provocare un diabete o una perdita del controllo glicemico in pazienti con diabete preesistente. Ciò va considerato in caso di controllo del valore del glucosio.
Donne
Zoladex LA è indicato esclusivamente per il trattamento dell'endometriosi e del mioma uterino. Per altre indicazioni si rimanda all'Informazione professionale di Zoladex 3,6 mg.
Gli agonisti LHRH possono portare a una riduzione della mineralizzazione ossea, che dopo la fine della terapia con Zoladex è quantomeno parzialmente reversibile.
Dopo sei mesi di terapia con Zoladex 3,6 mg, nei corpi vertebrali lombari è stata misurata una perdita di sostanza del 4,6% che tuttavia è risultata ampiamente reversibile.
Dati clinici su Zoladex 3,6 mg suggeriscono che una terapia di sostituzione ormonale aggiuntiva, con somministrazione giornaliera di estrogeni e progestinici a basso dosaggio con effetto osteoprotettivo (ad es. 1‑-2 mg di estradiolo o estradiolo valerato o 0,625 mg di estrogeni coniugati e 5 mg di medrossiprogesterone acetato (MPA) o 0,5-1 mg di noretisterone) riduce la perdita di densità ossea e i sintomi vasomotori. Non vi sono esperienze con la sostituzione ormonale in pazienti trattate con Zoladex LA.
Per essere efficace, il trattamento deve portare ad amenorrea nell'arco di 1-2 mesi. Occorre avvisare le pazienti che devono informare il medico di un'eventuale persistenza del ciclo mestruale. In rari casi si osservano sanguinamenti vaginali.
Durante il trattamento con analoghi LHRH può verificarsi una menopausa naturale. In rari casi il ciclo mestruale non è tornato dopo l'interruzione della terapia neppure in donne più giovani. Dopo la fine del trattamento, in alcune pazienti il ciclo mestruale può presentarsi in ritardo (da diversi mesi a oltre un anno).
La somministrazione di Zoladex può indurre un'aumentata resistenza della cervice. Pertanto va effettuata in via precauzionale la dilatazione della cervice.
Ad oggi non sono disponibili esperienze sugli effetti clinici di cicli di terapia superiori a 6 mesi per l'endometriosi.
Bambini
Zoladex LA non è destinato all'uso nei bambini.
Interazioni
Poiché un trattamento di deprivazione androgenica può prolungare l'intervallo QT, l'utilizzo concomitante di Zoladex LA con medicamenti noti per prolungare l'intervallo QT o che possono indurre torsioni di punta deve essere valutato attentamente (cfr. «Avvertenze e misure precauzionali»). A questi medicamenti appartengono antiaritmici di classe IA (ad es. chinidina, disopiramide) o di classe III (ad es. amiodarone, sotalolo, dofetilide, ibutilide), nonché metadone, moxifloxacina, antipsicotici e altri.
Non sono attualmente note altre interazioni.
Gravidanza/Allattamento
Studi sulla riproduzione con Zoladex 3,6 mg negli animali hanno mostrato anomalie (dita, cervello) nel ratto e nel coniglio, quando sono state somministrate dosi elevate. Non sono disponibili studi sulla sicurezza di Zoladex LA nelle gestanti. Pertanto Zoladex LA non deve essere somministrato durante la gravidanza. Prima di avviare la terapia si deve escludere una potenziale gravidanza. Durante e dopo la terapia con Zoladex LA si devono usare contraccettivi non ormonali fino alla ricomparsa del ciclo mestruale.
L'uso di Zoladex LA durante l'allattamento non è raccomandato.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Zoladex LA non ha effetti sulla capacità di guidare veicoli o sulla capacità di utilizzare macchine.
Effetti indesiderati
Durante i primi mesi di terapia gli effetti indesiderati possono essere più marcati e richiedere una terapia sintomatica.
Le categorie di frequenza sono definite come segue: molto comune (≥1/10); comune (≥1/100, <1/10); non comune (≥1/1'000, <1/100); raro (≥1/10'000, <1/1'000), molto raro (<1/10'000), frequenza non nota sulla base dei dati disponibili.
In generale
Tumori benigni, maligni e non specificati (cisti e polipi compresi)
Molto raro: tumore ipofisario.
Disturbi del sistema immunitario
Non comune: prurito generalizzato/eruzione cutanea, allergia a farmaco, angioedema, orticaria, dermatite allergica.
Raro: reazioni anafilattiche.
Patologie endocrine
Molto comune: riduzione della libido (55%).
Molto raro: emorragia dell'ipofisi.
Disturbi psichiatrici
Molto raro: disturbi psicotici.
Patologie cardiache/vascolari
Comune: insufficienza cardiaca, pressione arteriosa irregolare.
Patologie della cute e del tessuto sottocutaneo
Comune: eruzioni cutanee lievi.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Comune: riduzione della mineralizzazione ossea.
Patologie sistemiche e condizioni relative alla sede di somministrazione
Raro: ematomi in sede di iniezione.
Esami diagnostici
Comune: aumento ponderale.
Uomini
A inizio terapia Zoladex, come altri analoghi LHRH, determina un aumento del testosterone sierico di breve durata. La successiva riduzione del livello di testosterone sierico può provocare effetti indesiderati.
Patologie endocrine
Molto comune: disfunzione erettile (61%).
Disturbi del metabolismo e della nutrizione
Comune: compromissione della tolleranza al glucosio.
Disturbi psichiatrici
Comune: agitazione, ansia, depressione, insonnia, confusione, nervosismo.
Patologie del sistema nervoso
Molto comune: parestesie aspecifiche.
Non comune: compressione del midollo spinale.
Patologie cardiache/vascolari
Molto comune: vampate di calore (48%), attacchi di sudorazione.
Comune: infarto miocardico.
Patologie della cute e del tessuto sottocutaneo
Frequenza non nota: perdita di capelli.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Non comune: artralgie, dolore osseo più marcato a inizio terapia in pazienti con metastasi ossee (cfr. «Avvertenze e misure precauzionali»).
Patologie renali e urinarie
Non comune: ostruzione ureterica.
Patologie dell'apparato riproduttivo e della mammella
Comune: ginecomastia.
Non comune: dolorabilità della mammella.
Patologie sistemiche e condizioni relative alla sede di somministrazione
Comune: reazioni locali come lividure lievi in sede di iniezione.
Donne
Nella donna in premenopausa, la riduzione dei livelli di estrogeno sierico può determinare i disturbi tipici del climaterio (sintomi della menopausa) che si manifestano anche a seguito di un'ovariectomia.
Patologie del sistema emolinfopoietico
Non comune: edema.
Disturbi psichiatrici
Molto comune: alterazioni dell'umore, depressione (47%).
Patologie del sistema nervoso
Molto comune: cefalea (59%).
Molto raro: parestesie aspecifiche.
Patologie cardiache/vascolari
Molto comune: vampate di calore (89%).
Patologie della cute e del tessuto sottocutaneo
Molto comune: acne (28%).
Comune: perdita di capelli.
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Comune: artralgie.
Patologie dell'apparato riproduttivo e della mammella
Molto comune: aumento di volume mammario (40%), secchezza vulvovaginale (58%).
Raro: insorgenza di cisti ovariche, perdite vaginali.
Patologie sistemiche e condizioni relative alla sede di somministrazione
Molto comune: reazioni locali (12,7%) come lividure lievi in sede di iniezione.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-benefico del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Nell'essere umano sono disponibili solo poche esperienze di sovradosaggio. Nei casi in cui Zoladex è stato accidentalmente somministrato dopo un intervallo di tempo troppo breve o a una dose troppo elevata non si sono osservati effetti indesiderati clinicamente rilevanti. Gli studi sperimentali sugli animali suggeriscono che a dosi elevate di Zoladex LA non si dovrebbero verificare altri effetti oltre agli effetti terapeutici previsti sulla concentrazione degli ormoni sessuali e sull'apparato riproduttivo. Un eventuale sovradosaggio deve essere trattato in maniera sintomatica.
Proprietà/Effetti
Codice ATC
L02AE03
Meccanismo d'azione
Zoladex è un analogo sintetico dell'LHRH fisiologico. Al primo utilizzo Zoladex LA determina un'aumentata secrezione transitoria di LH e pertanto del testosterone negli uomini e dell'estradiolo nelle donne. All'inizio della terapia, in alcune donne possono verificarsi sanguinamenti vaginali di durata e intensità differenti. Si presume che tali sanguinamenti siano dovuti alla deprivazione estrogenica e cessino spontaneamente. In ragione dell'iperstimolazione permanente, si giunge tuttavia rapidamente a una soppressione persistente della secrezione di LH ipofisario, il che determina una riduzione della concentrazione di testosterone sierico e di estradiolo sierico.
Uomini
Dopo la prima iniezione, le concentrazioni di testosterone scendono entro circa 3 settimane a valori simili a quelli misurati dopo castrazione chirurgica.
Questa soppressione viene mantenuta, purché Zoladex LA venga iniettato ogni 3 mesi, e risulta generalmente reversibile dopo l'interruzione della terapia.
Nella maggior parte dei pazienti affetti da carcinoma prostatico questa soppressione porta a una regressione del tumore e al miglioramento della sintomatologia. Rispetto all'orchiectomia, Zoladex LA presenta il vantaggio della reversibilità e del minore onere psichico per il paziente.
Donne
Dopo la prima iniezione le concentrazioni di estradiolo diminuiscono a valori postmenopausali dopo circa 4 settimane. Questa soppressione viene mantenuta, purché Zoladex LA venga iniettato ogni 12 settimane. È responsabile dell'efficacia di Zoladex nell'endometriosi e nel mioma uterino e nella maggior parte delle pazienti determina amenorrea.
In pazienti con endometriosi si ottiene una regressione del numero e delle dimensioni degli impianti nonché un miglioramento della sintomatologia incluso il dolore.
In donne con miomi può verificarsi una degenerazione del mioma. Goserelina acetato in combinazione con ferro riduce i miomi in donne anemiche, migliora lo stato ematologico e la sintomatologia, incluso il dolore. La significativa riduzione di volume dei miomi facilita l'intervento e riduce la perdita di sangue.
Farmacodinamica
Cfr. anche «Meccanismo d'azione».
Efficacia clinica
Nessun dato.
Farmacocinetica
Assorbimento
La biodisponibilità di goserelina acetato è quasi completa.
Dopo un'unica somministrazione di 10,8 mg di Zoladex LA, la concentrazione sierica massima (Cmax media = 8-10 ng/ml) viene raggiunta dopo ca. 2 ore.
Distribuzione
Goserelina acetato è legata alle proteine solo in misura limitata (ca. 25%) e viene distribuita in diversi compartimenti dell'organismo.
Metabolismo
Goserelina acetato, un decapeptide con sostituzioni nelle posizioni 6 (residuo di butile) e 10 (residuo di azaglicina), viene idrolizzata nell'organismo in due metaboliti principali, il frammento con gli aminoacidi 1-7 e il frammento con gli aminoacidi 5-10.
Eliminazione
L'eliminazione di goserelina acetato è una combinazione di metabolismo ed escrezione renale. I metaboliti vengono escreti principalmente per via renale. L'emivita di eliminazione di goserelina acetato nel siero è di circa 2-4 ore.
Se Zoladex viene somministrato in base alle raccomandazioni posologiche, è garantito il mantenimento di concentrazioni sieriche efficaci senza accumulo.
Cinetica di gruppi di pazienti speciali
L'emivita nei pazienti con ridotta funzionalità renale è maggiore, per cui questo prolungamento non è rilevante in caso di somministrazione trimestrale del depot e non sono necessari aggiustamenti della dose.
In presenza di disturbi della funzionalità epatica non sono stati osservati effetti né sulla clearance corporea totale né sull'emivita, per cui non sono necessari aggiustamenti della dose.
Dati preclinici
Nei ratti maschi, dopo somministrazione a lungo termine di Zoladex LA è stata osservata un'aumentata incidenza di tumori ipofisari benigni. Questo dato è in linea con quanto osservato in seguito a castrazione chirurgica. Non è stata dimostrata una rilevanza per l'essere umano.
Nei topi la somministrazione ripetuta di dosi corrispondenti a un multiplo di quelle somministrate all'uomo ha causato alterazioni istologiche in regioni diverse del tratto digerente. Sono state quindi osservate iperplasia delle isole pancreatiche, proliferazioni benigne a livello di piloro gastrico e lesioni spontanee. Non è nota una rilevanza clinica per l'essere umano.
Altre indicazioni
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazioni particolari concernenti l'immagazzinamento
Conservare nella confezione sigillata.
Non conservare a temperature superiori a 25 °C.
Non congelare.
Conservare fuori dalla portata dei bambini.
Indicazioni per la manipolazione
È richiesta particolare cautela quando Zoladex LA viene utilizzato in pazienti con basso IMC e/o che usano in concomitanza anticoagulanti (cfr. «Avvertenze e misure precauzionali»).
Usare solo se il confezionamento è integro. Usare immediatamente dopo l'apertura.
Zoladex viene iniettato per via sottocutanea
- Porre il paziente in posizione comoda, leggermente sollevata.
Disinfettare la sede di iniezione.
NOTA: è richiesta cautela durante l'iniezione di Zoladex LA nella parete addominale anteriore a causa della sottostante arteria epigastrica inferiore e delle sue ramificazioni. I pazienti molto magri presentano un più alto rischio di lesione vascolare. - Controllare che la busta e la siringa non siano danneggiate. Estrarre la siringa dalla pellicola. Tenere la siringa leggermente piegata contro luce e controllare che il depot solido sia visibile. (Fig. 1).
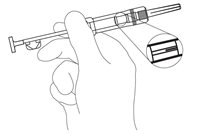 Fig. 1.
Fig. 1.
- Rimuovere la barretta di sicurezza in plastica. (Fig. 2). Rimuovere il sigillo di sicurezza in plastica. Non è necessario far fuoriuscire le bolle d'aria. Ciò potrebbe causare lo spostamento del depot solido.
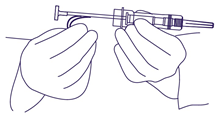 Fig. 2.
Fig. 2.
- Prendere la siringa preriempita per il cilindro e introdurre l'ago leggermente inclinato (con un angolo di 30-45 gradi) nel tessuto sottocutaneo della parete addominale anteriore al di sotto della linea dell'ombelico fino a toccare la pelle con il cilindro (Fig. 3).
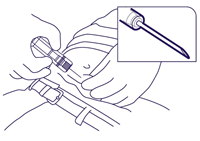 Fig. 3.
Fig. 3.
NOTA: la siringa di Zoladex LA non può essere usata per aspirare. Qualora l'ago sottocutaneo dovesse perforare un vaso sanguigno di grande calibro, comparirà immediatamente del sangue nella camera della siringa. Nel caso in cui sia stato perforato un vaso, estrarre la siringa e iniziare immediatamente a trattare l'emorragia che si è formata. Una volta garantita la stabilità emodinamica del paziente, è possibile iniettare un nuovo impianto di Zoladex con una nuova siringa in un'altra sede di iniezione. È richiesta particolare cautela quando Zoladex viene utilizzato in pazienti con basso IMC e/o in terapia concomitante con anticoagulanti.
- L'ago non deve forare il muscolo o il peritoneo. Presa e angolazione errate durante l'inserimento dell'ago (Fig. 4).
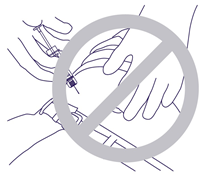 Fig. 4.
Fig. 4.
- Abbassare completamente lo stantuffo per introdurre il depot solido e attivare il sistema di sicurezza. Dopo un «clic» udibile, il cilindro inizia automaticamente a scivolare sull'ago. Se lo stantuffo non viene abbassato del tutto, il sistema di sicurezza non può attivarsi.
NOTA: l'ago non si ritrae da sé. - Tenere la siringa come mostrato in (Fig. 5). Ritirare l'ago cosicché il cilindro scivoli ulteriormente sopra l'ago fino a coprirlo interamente. Smaltire la siringa preriempita in un contenitore adatto.
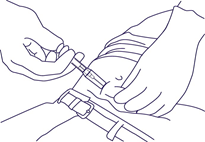 Fig. 5.
Fig. 5.
NOTA: nella rara eventualità che il depot solido di Zoladex LA debba essere rimosso chirurgicamente, può essere localizzato mediante sonografia.
Numero dell'omologazione
53371 (Swissmedic).
Titolare dell’omologazione
AstraZeneca AG, 6340 Baar.
Stato dell'informazione
Aprile 2020.
Composition
Principes actifs
Goséréline 10,8 mg en tant que d'acétate de goséréline.
Excipients
Copolymère(DL-acide lactique-acide glycolique).
Forme pharmaceutique et quantité de principe actif par unité
Implant en seringue préremplie.
Dépôt solide stérile cylindrique, de couleur blanc à blanc crème, pour injection sous-cutanée dans une seringue prête à l'emploi avec système de sécurité (SafeSystem) en tant qu'applicateur pré-rempli. La matrice dégradable se compose d'un copolymère d'acide lactique et d'acide glycolique et contient 11,3 mg d'acétate de goséréline (ce qui correspond à 10,8 mg de peptide base).
Indications/Possibilités d’emploi
Cancer de la prostate
Traitement symptomatique du cancer de la prostate avancé, hormonodépendant. Comme traitement alternatif, lorsqu'une orchidectomie ou l'administration d'estrogènes n'est pas indiquée ou souhaitable.
Zoladex en association au bicalutamide 50 mg, un anti-androgène non stéroïdien, dans le traitement du cancer de la prostate avancé métastatique (M1).
Traitement hormonal adjuvant du cancer de la prostate localement avancé (stade T3 à T4 de la classification TNM) en association à une radiothérapie externe.
Endométriose
Traitement de l'endométriose aussi bien symptomatique qu'asymptomatique, souvent accompagnée d'infertilité.
Myome utérin
Pour le traitement pré-opératoire des myomes utérins, en association à une thérapie martiale chez les patientes anémiques.
Posologie/Mode d’emploi
L'injection de Zoladex LA dans la paroi abdominale antérieure requiert de la prudence en raison de la proximité sous-jacente de l'artère épigastrique inférieure et de ses ramifications.
Une prudence particulière est de rigueur lors de l'utilisation de Zoladex LA chez des patients avec un IMC bas et/ou utilisant concomitamment des anticoagulants (voir «Mises en garde et précautions»).
Pour administrer correctement Zoladex LA, veuillez tenir compte des instructions figurant sous «Remarques particulières».
Hommes
Zoladex LA 10,8 mg est injecté tous les 3 mois par voie sous-cutanée dans la paroi abdominale.
Cancer de la prostate
La durée du traitement dépend de l'effet thérapeutique de Zoladex LA.
En cas de cancer prostatique avancé métastatique (M1), Zoladex LA peut être utilisé en association à un agent anti-androgénique non stéroïdien tel que le bicalutamide 50 mg (50 mg 1x par jour).
Dans le traitement adjuvant du cancer de la prostate localement avancé en association à une radiothérapie externe, l'expérience clinique se limite actuellement à 36 mois.
Femmes
Zoladex LA 10,8 mg est injecté toutes les 12 semaines par voie sous-cutanée dans la paroi abdominale.
Endométriose
La durée du traitement doit être déterminée individuellement pour chaque patiente, sur la base du degré de régression des tumeurs et de l'amélioration de la symptomatologie. Le cas échéant, il est possible de se référer aux valeurs de laboratoire (estradiol, progestérone) pour contrôler le traitement. Généralement, un bon résultat est obtenu après 3 à 6 mois de traitement.
Endométriose récidivante
L'effet thérapeutique de cycles répétés de traitement par Zoladex LA doit être mis en balance avec la diminution attendue de la densité minérale osseuse.
Myome utérin
Zoladex LA est administré sous forme de traitement pré-opératoire unique, associé à une thérapie martiale chez les patientes anémiques.
Instructions spéciales pour la posologie
Des adaptations de la dose ne sont pas nécessaires chez les patients âgés ni chez les patients souffrant d'insuffisance rénale ou hépatique.
Contre-indications
Zoladex LA est contre-indiqué dans les cas suivants:
- hypersensibilité au principe actif goséréline ou à d'autres analogues de la LHRH ou aux excipients selon la composition,
- indépendance hormonale prouvée du carcinome de la prostate,
- saignements vaginaux d'étiologie inconnue,
- pendant la grossesse et l'allaitement.
Mises en garde et précautions
Des blessures au site d'injection telles que douleurs, hématomes, hémorragies et lésions vasculaires ont été rapportées en lien avec Zoladex LA. Les patients concernés doivent être surveillés pendant le traitement par Zoladex LA afin de rechercher les signes et les symptômes d'une hémorragie abdominale. Dans de rares cas, l'utilisation erronée de Zoladex LA a provoqué une lésion vasculaire avec choc hémorragique nécessitant une transfusion sanguine et une intervention chirurgicale. Une prudence particulière est de rigueur lors de l'utilisation de Zoladex LA chez des patients avec un IMC bas et/ou utilisant concomitamment des anticoagulants (voir «Posologie/Mode d'emploi»).
Pendant la phase suivant la commercialisation, de rares cas d'apoplexie hypophysaire (un syndrome clinique dû à un infarctus hypophysaire) sont apparus après l'administration d'agonistes de la GnRH. Dans la majorité de ces cas, un adénome hypophysaire avait été diagnostiqué. La plupart des cas sont apparus durant les 2 semaines suivant la première administration, certains cas durant la première heure. Dans ces cas, l'apoplexie hypophysaire se manifeste par des céphalées soudaines, des vomissements, des altérations de la vision, une ophtalmoplégie, une modification de l'état mental et parfois un collapsus cardiovasculaire. Une intervention médicale immédiate est nécessaire.
En conséquence, un agoniste de la GnRH ne doit pas être administré en présence d'un adénome hypophysaire connu.
Lors du sevrage androgénique, un allongement de l'intervalle QT est possible, même si aucun rapport causal avec Zoladex LA n'a pu être établi jusqu'ici.
Chez les patients présentant un allongement de l'intervalle QT dans l'anamnèse ou des facteurs de risque d'allongement du QT, ainsi que chez les patients prenant concomitamment des médicaments susceptibles d'allonger l'intervalle QT, le médecin doit évaluer le rapport bénéfice-risque, y compris le potentiel de torsade de pointes, avant d'instaurer le traitement par Zoladex LA.
Hommes
De rares cas d'obstruction de l'uretère et de compression médullaire ont été signalés sous Zoladex 3,6 mg. Il y a lieu de bien peser le pour et le contre avant d'entreprendre un traitement par Zoladex LA chez des patients exposés à un risque élevé d'obstruction urétrale et de compression de la moelle épinière, ou chez lesquels ces complications préexistent avant le traitement; il importe de suivre ces patients de très près pendant le premier mois de traitement. En présence ou à l'apparition d'une insuffisance rénale due à une obstruction de l'uretère, un traitement standard doit être instauré. Il en va de même en présence ou à l'apparition d'une compression de la moelle épinière.
En cas d'échec thérapeutique, le taux sérique de testostérone doit être déterminé. Lorsque le résultat suggère une suppression insuffisante de la testostérone, il convient d'envisager un autre traitement (p.ex. impliquant des anti-androgènes directs).
Des données précédemment publiées montrent une réduction de la minéralisation osseuse moins importante lorsque les agonistes de la LH-RH sont administrés avec des bisphosphonates que s'ils sont administrés seuls.
Les agonistes de la LH-RH peuvent entraîner une réduction de la minéralisation osseuse.
Une réduction de la tolérance au glucose a été observée chez les hommes recevant des agonistes de la LH-RH. Ce phénomène peut entraîner un diabète ou une perte du contrôle glycémique chez les patients ayant déjà un diabète. Cet effet doit être pris en compte lors du contrôle de la glycémie.
Femmes
Zoladex LA est uniquement destiné au traitement de l'endométriose et du myome utérin. Pour toutes les autres indications, il convient de consulter l'information professionnelle de Zoladex 3,6 mg.
Les antagonistes de la LH-RH peuvent provoquer une diminution de la minéralisation osseuse qui, à la fin du traitement par Zoladex, est au moins partiellement réversible.
Une perte de substance de 4,6% des vertèbres lombaires a été mesurée après 6 mois de traitement, mais elle s'est avérée largement réversible après l'arrêt de l'administration de Zoladex 3,6 mg.
Selon les données cliniques disponibles portant sur Zoladex 3,6 mg, on suppose qu'un traitement hormonal substitutif comprenant des estrogènes et des progestatifs administrés quotidiennement à une posologie faible et ostéoprotectrice (p.ex. 1-2 mg d'estradiol ou de valérate d'estradiol ou 0,625 mg d'estrogènes conjugués et 5 mg d'acétate de médroxyprogestérone (AMP) ou 0,5-1 mg de noréthistérone) permet de réduire la perte de densité osseuse et les symptômes vasomoteurs. Aucune expérience n'a été acquise à ce jour sur l'effet clinique d'un traitement hormonal substitutif chez les patientes qui ont été traitées par Zoladex LA.
L'effet du traitement se manifeste après 1-2 mois par une aménorrhée. Les patientes doivent être informées qu'elles doivent signaler à leur médecin toute menstruation qui persisterait. Des spottings sont rarement observés.
Une ménopause naturelle peut se produire au cours d'un traitement par des analogues de la LH-RH. Dans de rares cas, la menstruation ne s'est pas rétablie après l'arrêt du traitement, même chez les jeunes femmes. À la fin du traitement, la menstruation peut avoir du retard chez quelques patientes (de plusieurs mois à plus d'un an).
L'administration de Zoladex peut provoquer une augmentation de la résistance du col utérin. Le col devrait par conséquent être dilaté avec précaution.
On ne dispose à ce jour d'aucune expérience relative aux effets cliniques des cycles de traitement de l'endométriose excédant 6 mois.
Enfants
Zoladex LA n'est pas destiné à être utilisé chez l'enfant.
Interactions
Comme le sevrage androgénique est susceptible d'allonger l'intervalle QT, il convient d'évaluer avec soin l'utilisation concomitante de Zoladex LA et de médicaments susceptibles d'allonger l'intervalle QT ou d'induire des torsades de pointes (voir «Mises en garde et précautions»). Parmi ces médicaments figurent les antiarythmiques de la classe IA (p.ex. quinidine, disopyramide) ou de la classe III (p.ex. amiodarone, sotalol, dofétilide, ibutilide), ainsi que la méthadone, la moxifloxacine, les antipsychotiques et autres.
Aucune interaction n'est connue à ce jour.
Grossesse/Allaitement
Des études de reproduction animale avec Zoladex 3,6 mg ont montré des anomalies (orteils, cerveau) à des doses élevées, chez le rat et le lapin. On ne dispose d'aucune étude sur la sécurité de Zoladex LA chez les femmes enceintes. Par conséquent, Zoladex LA ne doit pas être administré à des femmes enceintes. Toute possibilité de grossesse doit être exclue avant d'entreprendre le traitement. Pendant et après un traitement par Zoladex LA, des méthodes contraceptives non hormonales doivent être utilisées jusqu'au retour de la menstruation.
L'utilisation de Zoladex LA pendant la période d'allaitement n'est pas recommandée.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Zoladex LA n'a aucune influence sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirables
Au cours des premiers mois de traitement, les effets indésirables peuvent être plus intenses et nécessiter un traitement symptomatique.
La fréquence est définie de la manière suivante: très fréquent (≥1/10); fréquent (≥1/100, <1/10); occasionnel (≥1/1'000, <1/100); rare (≥1/10'000, <1/1'000); très rare (<1/10'000); fréquence inconnue sur la base des données disponibles.
Généralités
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes)
Très rare: tumeur hypophysaire.
Affections du système immunitaire
Occasionnel: prurit généralisé/rash, allergie médicamenteuse, angio-œdème, urticaire, dermatite allergique.
Rare: réactions anaphylactiques.
Affections endocriniennes
Très fréquent: diminution de la libido (55%).
Très rare: hémorragie hypophysaire.
Affections psychiatriques
Très rare: troubles psychotiques.
Affections cardiaques/Affections vasculaires
Fréquent: défaillance cardiaque, tension artérielle irrégulière.
Affections de la peau et du tissu sous-cutané
Fréquent: éruptions cutanées légères.
Affections musculosquelettiques et du tissu conjonctif
Fréquent: réduction de la minéralisation osseuse.
Troubles généraux et anomalies au site d'administration
Rare: hématomes au site d'injection.
Investigations
Fréquent: prise de poids.
Hommes
Zoladex provoque, à l'instar d'autres analogues de la LHRH, une augmentation passagère de la testostérone sérique au début du traitement. Par la suite, la baisse du taux de testostérone sérique entraîne souvent des effets indésirables.
Affections endocriniennes
Très fréquent: dysfonction érectile (61%).
Troubles du métabolisme et de la nutrition
Fréquent: altération de la tolérance au glucose.
Affections psychiatriques
Fréquent: agitation, anxiété, dépression, insomnie, confusion, nervosité.
Affections du système nerveux
Très fréquent: paresthésies non spécifiques.
Occasionnel: compression médullaire.
Affections cardiaques/Affections vasculaires
Très fréquent: bouffées de chaleur (48%), sueurs profuses.
Fréquent: infarctus du myocarde.
Affections de la peau et du tissu sous-cutané
Fréquence inconnue: chute des cheveux.
Affections musculosquelettiques et du tissu conjonctif
Occasionnel: arthralgies, douleurs osseuses accentuées en début de traitement chez des patients présentant des métastases osseuses (voir «Mises en garde et précautions»).
Affections du rein et des voies urinaires
Occasionnel: d'obstruction de l'uretère.
Affections des organes de reproduction et du sein
Fréquent: gynécomastie.
Occasionnel: sensibilité douloureuse des seins.
Troubles généraux et anomalies au site d'administration
Fréquent: réactions locales, comme légères meurtrissures au site d'injection.
Femmes
La baisse des concentrations sériques d'estrogène peut entraîner chez la femme préménopausée des troubles climactériques (symptômes ménopausiques) tels que ceux qui surviennent après une ovariectomie.
Affections hématologiques et du système lymphatique
Occasionnel: œdèmes.
Affections psychiatriques
Très fréquent: modifications de l'humeur, dépressions (47%).
Affections du système nerveux
Très fréquent: céphalées (59%).
Très rare: paresthésies non spécifiques.
Affections cardiaques/Affections vasculaires
Très fréquent: bouffées de chaleur (89%).
Affections de la peau et du tissu sous-cutané
Très fréquent: acné (28%).
Fréquent: chute des cheveux.
Affections musculosquelettiques et du tissu conjonctif
Fréquent: arthralgies.
Affections des organes de reproduction et du sein
Très fréquent: augmentation de la taille des seins (40%), sécheresse vulvo-vaginale (58%).
Rare: développement de kystes ovariens, spotting.
Troubles généraux et anomalies au site d'administration
Très fréquent: réactions locales (12,7%), comme légères meurtrissures au site d'injection.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
On ne dispose que de peu d'expérience en matière de surdosage chez l'homme.
Aucun effet indésirable cliniquement significatif n'a été observé dans les cas où Zoladex a été administré involontairement après un intervalle trop bref ou à une dose trop élevée. L'expérimentation animale permet de supposer que des doses élevées de Zoladex LA n'entraîneraient pas d'autres effets que les effets thérapeutiques escomptés sur la concentration des hormones sexuelles et sur les organes sexuels. Un surdosage devrait, le cas échéant, faire l'objet d'un traitement symptomatique.
Propriétés/Effets
Code ATC
L02AE03
Mécanisme d'action
Zoladex est un analogue synthétique de la LHRH naturelle. Lors de sa première utilisation, Zoladex LA augmente la LH, donc la testostérone chez les hommes et l'estradiol chez les femmes, mais cette augmentation n'est que de courte durée. On peut observer chez certaines femmes en début de traitement des hémorragies vaginales de durée et d'intensité variables. On pense que ces hémorragies sont provoquées par la privation en estrogènes et s'arrêter spontanément. Toutefois, par suite de l'hyperstimulation permanente, on observe bientôt une suppression durable de la sécrétion hypophysaire de LH, de sorte que le taux sérique de testostérone ou d'estradiol diminue.
Hommes
En l'espace d'environ 3 semaines après la première injection, les concentrations de testostérone chutent à des valeurs comparables à celles observées après une castration chirurgicale.
Cette suppression persiste aussi longtemps que l'on injecte un Zoladex LA tous les 3 mois. La suppression est généralement réversible à l'arrêt du traitement.
Chez la majorité des patients atteints de cancer de la prostate, cette suppression induit une régression de la tumeur et une amélioration de la symptomatologie. Par rapport à l'orchidectomie, Zoladex LA offre l'avantage pour le patient d'être un traitement réversible, mieux supporté psychologiquement.
Femmes
Après la première injection, les concentrations d'estradiol reviennent aux valeurs post-ménopausiques en l'espace de 4 semaines environ. Cette suppression persiste aussi longtemps que l'on injecte un Zoladex LA toutes les 12 semaines. Elle est responsable de l'efficacité de Zoladex lors d'endométriose et de myome utérin et provoque une aménorrhée chez la plupart des patientes.
Chez les patientes présentant une endométriose, une régression du nombre et de la taille des tumeurs ainsi qu'une amélioration de la symptomatologie, y compris des douleurs, sont obtenues.
Chez les femmes atteintes de myomes, une dégénérescende des myomes peut survenir.
En association au fer, l'acétate de goséréline réduit les myomes et améliore l'état hématologique et la symptomatologie, y compris les douleurs, chez les femmes anémiques. La réduction significative de la taille des myomes facilite l'opération et diminue l'hémorragie.
Pharmacodynamique
Voir aussi sous «Mécanisme d'action».
Efficacité clinique
Aucune information disponible.
Pharmacocinétique
Absorption
La biodisponibilité de l'acétate de goséréline est presque totale.
Suite à une application unique de Zoladex LA 10,8 mg, la concentration sérique maximale (cmax moyenne = 8-10 ng/ml) a été atteinte au bout d'env. 2 heures.
Distribution
L'acétate de goséréline n'est que faiblement lié aux protéines (env. 25%) et se distribue dans divers compartiments de l'organisme.
Métabolisme
L'acétate de goséréline, un décapeptide substitué aux positions 6(groupement butyl) et 10(groupement azgly), est hydrolysé dans le corps en deux métabolites principaux, le fragment avec les acides aminés 1 à 7 et le fragment avec les acides aminés 5 à 10.
Élimination
L'élimination de l'acétate de goséréline résulte à la fois de la transformation métabolique et de l'excrétion rénale. Les métabolites sont essentiellement excrétés par voie rénale. La demi-vie d'élimination de l'acétate de goséréline dans le sérum est d'environ 2 à 4 heures.
L'administration de Zoladex LA conformément aux recommandations posologiques garantit le maintien de concentrations sériques efficaces, sans accumulation.
Cinétique pour certains groupes de patients
En cas de fonction rénale diminuée, la demi-vie est allongée, mais cet allongement est négligeable en cas d'administration trimestrielle du dépôt et il n'est pas nécessaire d'ajuster la dose.
En cas de troubles de la fonction hépatique, ni la clairance corporelle totale ni la demi-vie ne sont modifiées, de sorte qu'il est inutile d'ajuster la dose.
Données précliniques
Chez des rats mâles, on a observé une augmentation de l'incidence des tumeurs bénignes de l'hypophyse après l'administration au long cours de Zoladex LA. Le même phénomène a été observé après castration chirurgicale. Il n'est pas établi que cette observation ait une signification pour l'homme.
Chez des souris, l'administration répétée de doses représentant plusieurs fois la dose utilisée chez l'homme a provoqué des altérations histologiques dans diverses régions de l'appareil digestif. Ainsi, on a observé des hyperplasies des cellules des îlots pancréatiques, des proliférations bénignes au niveau du pylore et des lésions spontanées. Il n'y a pas d'incidence clinique connue de cette observation pour l'homme.
Remarques particulières
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver dans l'emballage scellé.
Ne pas conserver au-dessus de 25 °C.
Ne pas congeler.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Une prudence particulière est de rigueur lors de l'utilisation de Zoladex LA chez des patients avec un IMC bas et/ou utilisant concomitamment des anticoagulants (voir «Mises en garde et précautions»).
N'utiliser que si l'emballage est intact. Utiliser immédiatement après l'ouverture.
Zoladex LA est injecté par voie sous-cutanée
- Le patient doit être confortablement installé, avec le buste légèrement relevé.
Désinfecter le site d'injection.
REMARQUE: L'injection de Zoladex LA dans la paroi abdominale antérieure requiert de la prudence en raison de la proximité sous-jacente de l'artère épigastrique inférieure et de ses ramifications. Le risque de lésion vasculaire est accru chez les patients très minces. - Vérifier que le sachet et la seringue sont intacts. Sortir la seringue de l'emballage. Tenir la seringue légèrement penchée contre la lumière et contrôler si le dépôt solide est bien visible (Fig. 1).
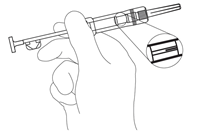 Fig. 1.
Fig. 1.
- Retirer la barrette de sécurité en plastique (Fig. 2). Retirer le capuchon de l'aiguille. Il n'est pas nécessaire d'éliminer les bulles d'air, car cela pourrait déplacer le dépôt solide.
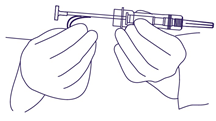 Fig. 2.
Fig. 2.
- Tenir la seringue prête à l'emploi par le cylindre et piquer avec un angle de 30 à 45 degrés dans le tissu sous-cutané de la paroi abdominale antérieure situé sous la ligne ombilicale. Enfoncer l'aiguille jusqu'à ce que le cylindre touche la peau (Fig. 3).
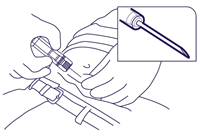 Fig. 3.
Fig. 3.
REMARQUE: La seringue Zoladex LA ne permet pas d'aspirer. Au cas où l'aiguille pour injection sous-cutanée a atteint un vaisseau sanguin de gros calibre, du sang apparaîtra immédiatement dans le corps de la seringue. Si un vaisseau a été transpercé, retirer la seringue et traiter immédiatement l'hémorragie. Une fois que l'état hémodynamique du patient est stable, un nouvel implant de Zoladex LA peut être injecté avec une nouvelle seringue à un nouveau site d'injection. Une prudence particulière est requise lors de l'utilisation de Zoladex LA chez des patients avec un IMC bas et/ou utilisant concomitamment des anticoagulants.
- L'aiguille ne doit pas pénétrer dans le muscle ni dans le péritoine. Mauvaise tenue de la seringue et angle incorrect lors de l'introduction de l'aiguille (Fig. 4).
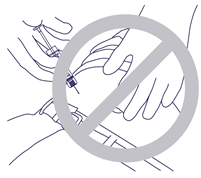 Fig. 4.
Fig. 4.
- Enfoncer complètement le piston pour faire pénétrer le dépôt solide et pour activer le système de sécurité. Après un «clic» bien audible, le cylindre commence automatiquement à recouvrir l'aiguille. Si le piston n'est pas complètement enfoncé, le système de sécurité ne peut pas être activé.
REMARQUE: L'aiguille ne se rétracte pas automatiquement. - Tenir la seringue comme illustré à la Fig. 5. Retirer l'aiguille pour que le cylindre continue à glisser sur l'aiguille jusqu'à la recouvrir entièrement. Éliminer la seringue dans un récipient approprié.
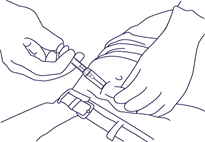 Fig. 5.
Fig. 5.
REMARQUE: Dans de rares cas, s'il s'avère nécessaire de retirer chirurgicalement le dépôt solide de Zoladex LA, il peut être localisé par échographie.
Numéro d’autorisation
53371 (Swissmedic).
Titulaire de l’autorisation
AstraZeneca AG, 6340 Baar.
Mise à jour de l’information
Avril 2020.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


 Deutsch
Deutsch French
French Italian
Italian