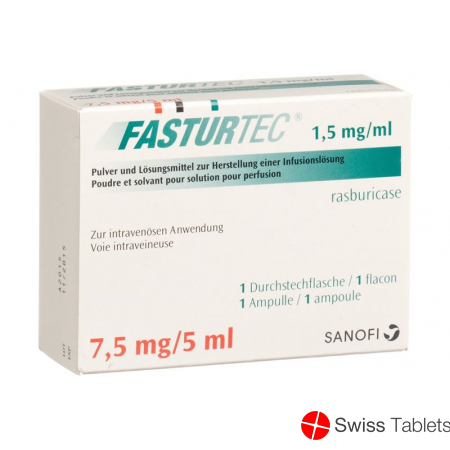
Fasturtec Trockensubstanz 7.5mg C Solv Durchstechflasche buy online
Fasturtec Trockensub 7.5 mg cum Solvens Durchstf
-
792.99 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: SANOFI-AVENTIS
- Product Code: 2823272
- ATC-code V03AF07
- EAN 7680557890045
Ingredients:
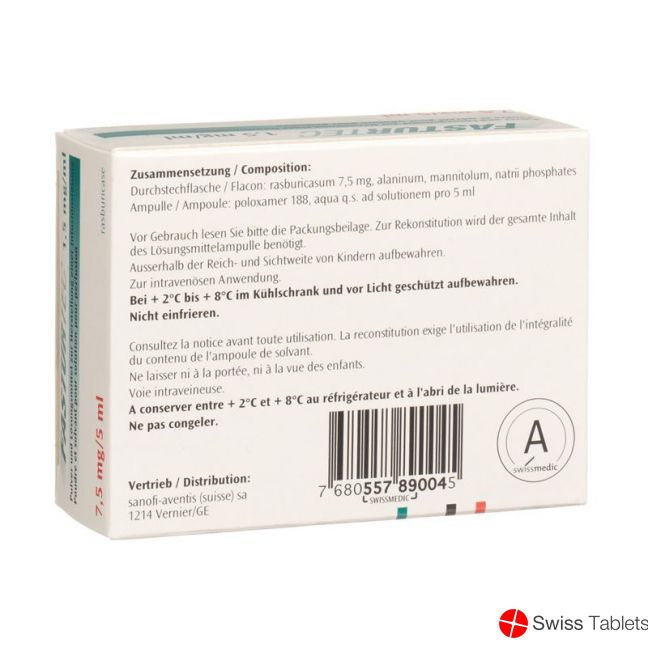
Mannitol, Natrium phosphate, Alanin, Trockensubstanz, Lösungsmittel, Poloxamer 188, Rasburicase 7.5 mg, pro vitro.

Description
AMZV
Zusammensetzung
Wirkstoff: Rasburicase (rekombinante Uratoxidase).
Hilfsstoffe:
Lyophilisat: Alanin, Mannitol, Natriumdihydrogenphosphat, Natriummonohydrogenphosphat.
Lösungsmittel: Poloxamer 188, Wasser für Injektionszwecke q.s. 1 ml oder 5 ml.
Galenische Form und Wirkstoffmenge pro Einheit
Lyophilisat und Lösungsmittel für Infusionslösung
Durchstichflasche zu 1.5 mg oder 7.5 mg:
1 mg entspricht mindestens 15 EAU*.
* 1 Enzymaktivitätseinheit (enzyme activity unit: EAU) entspricht der Enzymaktivität, die pro Minute unter den angegebenen Reaktionsbedingungen (+30 °C ± 1 °C, TEA Puffer pH=8,9) 1 µmol Harnsäure in Allantoin umwandelt.
Indikationen/Anwendungsmöglichkeiten
Therapie und Prophylaxe von akuter Hyperurikämie zur Vermeidung einer akuten Niereninsuffizienz, bei Patienten mit akuter Leukämie oder Non-Hodgkin Lymphom mit hoher Tumorlast und Risiko einer raschen Tumorlyse beim Beginn der Chemotherapie.
Die grösste Erfahrung liegt bei Kindern vor (alle Altersklassen).
Dosierung/Anwendung
Die Verabreichung von Fasturtec sollte unter Aufsicht eines in Chemotherapie von malignen hämatologischen Erkrankungen erfahrenen Arztes erfolgen.
Die empfohlene Fasturtec-Dosierung beträgt 0,20 mg/kg/Tag. Fasturtec wird einmal täglich als intravenöse Infusion über 30 Minuten in 50 ml einer 0,9%igen Kochsalzlösung verabreicht (siehe «Hinweise für die Handhabung»).
Die Behandlungsdauer durch Fasturtec kann bis zu 7 Tagen betragen. Die genaue Dauer muss auf der Überwachung der Harnsäureplasmaspiegel sowie auf einer klinischen Bewertung basieren.
Die Anwendung von Rasburicase erfordert keine Änderung des Anfangszeitpunkts oder Behandlungsschemas einer zytoreduktiven Chemotherapie. Fasturtec soll unmittelbar vor Beginn der Chemotherapie verabreicht werden.
Es liegen bisher nur sehr wenige Daten vor bei Patienten, die mehr als einen Therapiezyklus von Fasturtec erhielten, z.B. im Rahmen der Behandlung eines Rezidivs der malignen Grundkrankheit (siehe auch unter «Warnhinweise und Vorsichtsmassnahmen»).
Bei Patienten mit eingeschränkter Nieren- oder Leberfunktion ist keine Dosierungsanpassung erforderlich.
Kontraindikationen
Überempfindlichkeit gegen Uricase oder einen der Hilfsstoffe.
G6PD-Mangel und andere metabolische Störungen im Zellstoffwechsel, von denen bekannt ist, dass sie eine hämolytische Anämie auslösen können. Wasserstoffperoxid ist ein Nebenprodukt bei der Umwandlung von Harnsäure in Allantoin. Um einer möglichen durch Wasserstoffperoxid hervorgerufenen hämolytischen Anämie vorzubeugen, ist Rasburicase daher bei Patienten mit diesen Störungen kontraindiziert.
Warnhinweise und Vorsichtsmassnahmen
Wie andere Proteine kann auch Rasburicase beim Menschen allergische Reaktionen auslösen, einschliesslich Anaphylaxie und/oder anaphylaktische Schockzustände, die zum Tod führen können. Die klinische Erfahrung mit Fasturtec hat gezeigt, dass Patienten engmaschig auf das Auftreten allergischer Nebenwirkungen – vor allem allergische Hautreaktionen oder Bronchospasmus (siehe «Unerwünschte Wirkungen») – zu überwachen sind. Wenn eine schwere allergische oder anaphylaktische Reaktion auftritt, ist die Fasturtec-Therapie sofort und ständig abzusetzen und eine geeignete Behandlung einzuleiten.
Vorsicht ist geboten bei Patienten mit atopischen Allergien in der Anamnese.
Die klinischen Erfahrungen mit einer Wiederaufnahme der Behandlung sind begrenzt. Es wird also nicht empfohlen, eine neue Anwendung von Rasburicase durchzuführen.
Bei bereits behandelten Patienten und bei gesunden Probanden wurden nach Rasburicase-Gabe Anti-Rasburicase-Antikörper nachgewiesen.
Es wurde über einen Fall von Methämoglobinämie berichtet bei Patienten, die mit Rasburicase behandelt wurden. Bislang gibt es keine Daten die ermitteln konnten, ob Patienten mit einem Defizit an Methämoglobinreduktase oder an anderen oxydierenden Enzymen einem erhöhten Methämoglobinämierisiko ausgesetzt sind. Die Behandlung mit Rasburicase muss beim Auftreten einer Methämoglobinämie sofort und definitiv abgesetzt und eine geeignete Behandlung eingeleitet werden.
Es wurde über eine Hämolyse berichtet bei Patienten, die mit Rasburicase behandelt wurden. In einem solchen Fall muss die Behandlung mit Rasburicase sofort und definitiv abgesetzt und eine geeignete Behandlung eingeleitet werden.
Die Anwendung von Fasturtec führt zur Senkung des Harnsäurespiegels auf Werte unterhalb der Norm. Dadurch vermindert sich das Risiko, dass aufgrund der Hyperurikämie Harnsäurekristalle in den Nierentubuli ausgefällt werden und sich ein Nierenversagen entwickelt. Eine Tumorlyse kann ferner zu Hyperphosphatämie, Hyperkaliämie und Hypokalzämie führen. Fasturtec hat keine direkte Wirkung auf die Behandlung dieser metabolischen Störungen. Die Patienten müssen daher sorgfältig überwacht werden.
Es liegen keine Studien zur Anwendung von Fasturtec bei Patienten mit Hyperurikämie im Zusammenhang mit myeloproliferativen Erkrankungen vor.
Derzeit gibt es keine Daten, aufgrund derer der sequenzielle Einsatz von Rasburicase und Allopurinol empfohlen werden könnte.
Interaktionen
Studien zum Metabolismus wurden bisher nicht durchgeführt.
In-vitro findet durch Rasburicase keine Metabolisierung von 6‑Merkaptopurin, Zytarabin oder Methotrexat statt.
In präklinischen in-vivo-Studien hatte Rasburicase keinen Einfluss auf die Aktivität der folgenden Isoenzyme: CYP1A, CYP2A, CYP2B, CYP2C, CYP2E und CYP3A, was den Schluss zulässt, dass die Substanz kein Induktions- oder Hemmpotential besitzt. Es sind daher keine über das P450-System vermittelten klinisch relevanten Arzneimittelwechselwirkungen bei Patienten zu erwarten, wenn die empfohlene Dosierung bzw. das Dosierungsregime eingehalten wird.
Es wurden vereinzelte Fälle von Methämoglobinämie beobachtet, was auf eine Wechselwirkung mit Methämoglobinämie-Induktoren (Präparate auf Nitratderivatbasis, Nitrofurantoin, Sulfonamide, Lokalanästhetika, Vitamin-K-Analogstoffe) hinweist (siehe unter «Warnhinweise und Vorsichtsmassnahmen»).
Schwangerschaft/Stillzeit
Es liegen derzeit keine klinischen Daten zur Anwendung von Rasburicase bei schwangeren Frauen vor. Rasburicase hat bei Kaninchen teratogene Eigenschaften bei einer 10-, 50-, und 100fach höher als beim Menschen eingesetzten Dosis gezeigt, sowie bei Ratten bei einer 250fach höher eingesetzten Dosis.
Wegen des Vorhandenseins von endogener Uratoxidase bei den üblichen Versuchstieren besitzt die Studie am Tiermodell über die Wirkung von Rasburicase auf die Reproduktion und embryofetale Entwicklung begrenzte Aussagekraft.
Das potenzielle Risiko für den Menschen ist nicht bekannt. Fasturtec darf daher in der Schwangerschaft nur bei zwingender Indikation eingesetzt werden.
Es ist nicht bekannt, ob Rasburicase in die Muttermilch übergeht.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Einige der Nebenwirkungen sind in gewisser Weise eine Folge der Einleitung einer Induktionsbehandlung bei fortgeschrittenen malignen Erkrankungen. Es ist schwierig abzuschätzen, in welchem Ausmass diese Ereignisse tatsächlich durch Fasturtec bedingt sind.
Nebenwirkungen – darunter auch solche, die nach dem Inverkehrbringen gemeldet wurden –sind nachfolgend geordnet nach Organsystemen und Häufigkeiten aufgeführt. Die Häufigkeiten sind wie folgt definiert: Sehr häufig (>1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (<1/1000, ≥1/10'000), sehr selten (<1/10'000), Einzelfälle (Häufigkeit liegt unter der von «sehr selten»).
Erkrankungen des Blutes und des Lymphsystems:
Gelegentlich: Hämolyse, hämolytische Anämie, Methämoglobinämie. Da beim enzymatischen Abbau der Harnsäure zu Allantoin Wasserstoffperoxid entsteht, wurde bei bestimmten Risikogruppen, wie insbesondere Patienten mit G6PD-Mangel, eine hämolytische Anämie oder Methämoglobinämie beobachtet.
Erkrankungen des Immunsystems:
Symptome, die auf eine Überempfindlichkeit hindeuten und die als möglicherweise mit Fasturtec zusammenhängend eingestuft wurden, wurden bei 1,8% der behandelten Patienten berichtet. Dabei wurden alle Schweregrade beobachtet. Die Symptome umfassten:
Häufig: allergische Reaktionen, vor allem Hautrötungen (Rash) und Urtikaria.
Gelegentlich: Hypotonie (<1%), Bronchospasmen (<1%), schwere Überempfindlichkeitsreaktionen (<1%).
Selten: Rhinitis (<0,1%), Anaphylaxie und/oder anaphylaktische Schockzustände mit Sterberisiko (<0,1%).
Erkrankungen des Nervensystems:
Sehr häufig: Kopfschmerzen (25,7%; Grad 3/4: selten), Krämpfe.
Einzelfälle: unwillkürliche Muskelkontraktionen.
Erkrankungen des Gastrointestinaltrakts:
Sehr häufig: Durchfall (Grad 3/4: selten), Erbrechen (Grad 3-4: häufig), Übelkeit (Grad 3/4: häufig).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Sehr häufig: Fieber (Grad 3/4: häufig).
Überdosierung
Es wurden keine Fälle von Überdosierung mit Fasturtec berichtet. Entsprechend dem Wirkungsmechanismus von Fasturtec wird eine Überdosierung zu niedrigen oder nicht nachweisbaren Harnsäurekonzentrationen im Plasma und vermehrter Bildung von Wasserstoffperoxid führen. Bei Verdacht auf Überdosierung sollten die Patienten hinsichtlich Hämolyse überwacht und allgemeine unterstützende Massnahmen eingeleitet werden, da kein spezifisches Antidot für Fasturtec bekannt ist.
Eigenschaften/Wirkungen
ATC-Code: V03AF07
Wirkmechanismus:
Fasturtec ist ein rekombinantes Uratoxidase-Enzym, das von einem genetisch modifizierten Saccharomyces-cerevisiae-Stamm gebildet wird. Die cDNA, die für die Rasburicase kodiert, wurde aus einem Aspergillus- flavus-Stamm geklont. Bei Rasburicase handelt es sich um ein tetrameres Protein mit identischen Untereinheiten mit einer Molekülmasse von etwa 34 kDa.
Beim Menschen stellt die Harnsäure das Endprodukt beim Abbau der Purine dar. Der akute Anstieg des Harnsäurespiegels im Blut nach der Lyse einer grossen Anzahl maligner Zellen, wie dies bei bösartigen Erkrankungen und unter zytotoxischer Chemotherapie beobachtet wird, kann aufgrund der Ausfällung von Harnsäurekristallen in die Nierentubuli zu einer eingeschränkten Nierenfunktion und zu Nierenversagen führen. Rasburicase ist ein Urikolytikum, das die enzymatische Oxidation von Harnsäure in Allantoin, eine wasserlösliche Substanz, die leicht über die Nieren ausgeschieden wird, katalysiert.
Pharmakodynamik:
Die enzymatische Oxidation von Harnsäure führt zu einer stöchiometrischen Bildung von Wasserstoffperoxid. Der Anstieg des Wasserstoffperoxidspiegels über das normale Mass kann durch endogene Antioxidanzien normalisiert werden. Ein erhöhtes Hämolyserisiko besteht daher für Patienten mit G6PD-Mangel oder hereditärer Anämie.
Bei gesunden Probanden wurde im Dosisbereich von 0,05 mg/kg bis 0,20 mg/kg Fasturtec eine deutliche dosisabhängige Abnahme der Harnsäureplasmaspiegel beobachtet.
In einer randomisierten vergleichenden Phase-III-Studie zeigte Fasturtec im Vergleich zu Allopurinol bei Verabreichung der empfohlenen Dosierung (0,20 mg/kg) eine signifikant schnellere Wirkung. Vier Stunden nach Verabreichung der ersten Dosis wurde ein signifikanter Unterschied (p <0,0001) zwischen der mittleren prozentualen Veränderung der Harnsäurekonzentration im Plasma gegenüber dem Ausgangswert in der Fasturtec-Gruppe (-86,0%) und der der Allopurinol-Gruppe (-12,1%) beobachtet.
Die Zeit bis zur Normalisierung des Harnsäurespiegels bei Patienten mit Hyperurikämie beträgt für Fasturtec vier und für Allopurinol 24 Stunden. Die rasche Normalisierung des Harnsäurespiegels bei diesen Patienten ist zusätzlich verbunden mit einer Verbesserung der Nierenfunktion. Dies wiederum führt zu einer effizienten Ausscheidung der überschiessenden Serumphosphatmengen, wodurch eine erneute Verschlechterung der Nierenfunktion aufgrund einer Ausfällung von Kalzium-/Phosphorkristallen vermieden wird.
Die Erfahrung ist beschränkt auf Patienten (überwiegend Kinder) mit akuter Leukämie und Lymphomen (mit hoher Tumorlast), bei denen unter Chemotherapie eine starke Zellyse zu erwarten ist.
Klinische Erfahrungen bei mit Fasturtec erneut behandelten Patienten liegen derzeit nur in begrenztem Umfang vor. Bei mit diesem Wirkstoff behandelten Patienten und gesunden Probanden wurde die Entwicklung von Antikörpern gegen Rasburicase beobachtet.
Pharmakokinetik
Die pharmakokinetischen Studien wurden hauptsächlich bei Kindern und Jugendlichen durchgeführt.
Absorption
Die Exposition von Rasburicase - gemessen durch AUC0-24 und Cmax – zeigte bei Patienten eine tendenziell lineare Zunahme über einen begrenzten Dosisbereich (0,15 bis 0,20 mg/kg), bei gesunden Probanden wurde diese Linearität über einen grösseren Dosisbereich von 0,05 bis 0,20 mg/kg beobachtet.
Distribution
Bei Patienten lag das Verteilungssvolumen im Bereich von 110-127 ml/kg, was dem physiologischen Gefässvolumen vergleichbar ist. Rasburicase ist ein Protein und daher ist nicht zu erwarten, dass es an Proteine bindet.
Metabolismus
Der Metabolismus von Rasburicase wurde nicht untersucht. Es ist jedoch zu erwarten, dass die Verstoffwechslung von Fasturtec dem Abbauweg anderer Proteine entspricht (Peptidhydrolyse).
Elimination
Die Clearance von Rasburicase beträgt 3,5 ml/h/kg und die Eliminationshalbwertszeit ca. 19 Stunden. Die Clearance bei Kindern (um ca. 35%) und Jugendlichen ist im Vergleich zu Erwachsenen erhöht, was zu einer geringeren systemischen Exposition führt.
Während einer Behandlung über 5 Tage bei 1× täglicher Verabreichung kam es zu einer 1.3-fachen Akkumulation von Rasburicase.
Präklinische Daten
Basierend auf konventionellen Studien zur pharmakologischen Sicherheit, zur Toxizität bei wiederholter Gabe und zur Genotoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen. Die Interpretation präklinischer Studien ist durch das Vorhandensein von endogener Uratoxidase bei den üblichen Versuchstieren eingeschränkt.
Rasburicase hat bei Kaninchen teratogene Eigenschaften bei einer 10-, 50‑, und 100fach höher als beim Menschen eingesetzten Dosis gezeigt, sowie bei Ratten bei einer 250fach höher eingesetzten Dosis.
Sonstige Hinweise
Inkompatibilitäten
Das Arzneimittel darf nicht mit anderen Arzneimitteln gemischt werden.
Die Infusion der Rasburicaselösung und die Verabreichung von Chemotherapeutika müssen zur Vermeidung eventueller Wirkstoffunverträglichkeiten über getrennte Zugänge erfolgen. Ist die Verwendung eines eigenen Zugangs nicht möglich, muss der Zugang zwischen der Infusion der Chemotherapeutika und der Rasburicase mit physiologischer Kochsalzlösung gespült werden.
Die Infusion muss ohne Filter erfolgen.
Wegen möglicher Inkompatibilität darf Glukoselösung nicht als Verdünnungsmittel verwendet werden.
Rasburicase darf nur mit dem mitgelieferten Lösungsmittel rekonstituiert werden.
Stabilität
Hinweise zur Lagerung
Das Medikament darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Im Kühlschrank (+2 °C bis +8 °C) und lichtgeschützt lagern. Nicht einfrieren.
Das Konzentrat ist nach Rekonstitution unter kontrollierten und validierten aseptischen Bedingungen 24 Std. haltbar, wenn es bei +2 °C bis +8 °C gelagert wird.
Hinweise für die Handhabung
Herstellen der Lösung
Zu einem Durchstichfläschchen mit Rasburicase wird der Inhalt einer Lösungsmittelampulle gegeben, dann wird durch sehr vorsichtiges Schwenken gemischt. Die Zubereitung hat unter kontrollierten und validierten aseptischen Bedingungen zu erfolgen.
Nicht schütteln. Vor Anwendung visuell überprüfen. Die Lösung muss klar und frei von Schwebeteilchen sein. Das Arzneimittel ist nur zur einmaligen Anwendung bestimmt. Nicht verwendete Lösung ist zu verwerfen.
Aufbewahrung der hergestellten Lösung:
Siehe «Hinweise zur Lagerung».
Verdünnung vor Infusion
Die Verdünnung darf nur mit einer 0,9%-Natriumchlorid-Lösung erfolgen. Die erforderliche Lösungsmenge (entsprechend dem Körpergewicht des Patienten) ist auf ein Gesamtvolumen von 50 ml zu verdünnen. Die rekonstituierte Lösung enthält keine Konservierungsstoffe. Daher muss die verdünnte Infusionslösung unmittelbar nach Zubereitung verabreicht werden.
Infusion
Die Infusion der fertiggestellten Lösung sollte über einen Zeitraum von 30 Minuten erfolgen.
Die Infusion der Rasburicaselösung und die Verabreichung von Chemotherapeutika müssen zur Vermeidung eventueller Wirkstoffunverträglichkeiten über getrennte Zugänge erfolgen. Ist die Verwendung eines eigenen Zugangs nicht möglich, muss der Zugang zwischen der Infusion der Chemotherapeutika und der Rasburicase mit physiologischer Kochsalzlösung gespült werden.
Die Verabreichung von Fasturtec muss unter ärztlicher Aufsicht erfolgen.
Hinweise zum Umgang mit Blutproben bei einer Harnsäurekontrolle
Wenn der Harnsäurespiegel überwacht werden soll, muss das folgende Verfahren beim Umgang mit den Proben beachtet werden, um einen Abbau ex vivo zu vermeiden. Das Blut muss in vorgekühlte heparinbeschichtete Röhrchen abgenommen werden. Die Proben sind in ein Eis-/Wasserbad zu stellen. Die Plasmaproben sind durch Zentrifugation in einer vorgekühlten Zentrifuge (+4 °C) herzustellen. Schliesslich muss das Plasma im Eis-/Wasserbad aufbewahrt werden, die Harnsäurebestimmung muss innerhalb von 4 Stunden erfolgen.
Zulassungsnummer
55789 (Swissmedic).
Zulassungsinhaberin
sanofi-aventis (schweiz) ag, 1214 Vernier/GE.
Stand der Information
Juli 2015.
OEMéd
Composition
Principe actif: rasburicase (urate oxydase recombinante).
Excipients:
Poudre: alanine, mannitol, phosphate, disodique, phosphate monosodique.
Solvant: Poloxamer 188, eau pour préparations injectables q.s. 1 ml ou 5 ml.
Forme galénique et quantité de principe actif par unité
Poudre et solvant pour solution pour perfusion
1 flacon à 1.5 mg ou 7.5 mg:
1 mg correspond à au moins 15 EAU*.
* 1 unité d'activité enzymatique (enzyme activity unit: EAU) correspond à l'activité enzymatique qui convertit 1 µmol d'acide urique en allantoïne par minute, à +30 °C ± 1 °C, en milieu TEA tamponné à pH 8,9.
Indications/Possibilités d’emploi
Traitement et prophylaxie de l'hyperuricémie aiguë dans le but d'éviter une insuffisance rénale aiguë chez les patients atteints de leucémie aiguë ou du lymphome non-Hodgkinien à charge tumorale élevée et sujets à une lyse tumorale rapide en début de chimiothérapie.
La majeure partie de l'expérience a été rassemblée chez l'enfant (de toutes les classes d'âge).
Posologie/Mode d’emploi
L'administration de Fasturtec doit se réaliser sous la surveillance d'un médecin expérimenté dans la chimiothérapie de maladies hématologiques malignes.
La dose habituellement recommandée est de 0,20 mg/kg/jour. Fasturtec est administré une seule fois par jour sous forme de perfusion intraveineuse de 30 minutes après dilution dans 50 ml d'une solution injectable de chlorure de sodium à 0,9% (voir «Remarques concernant la manipulation»).
La durée du traitement par Fasturtec peut aller jusqu'à 7 jours, la durée exacte devant être basée sur la surveillance des niveaux plamatiques d'acide urique ainsi que sur une évaluation clinique.
L'administration de rasburicase n'impose aucune modification quant aux modalités d'administration de la chimiothérapie. Fasturtec doit être administré immédiatement avant le commencement de la chimiothérapie.
On ne dispose à ce jour que de très peu de données au sujet de patients soumis à plus d'un cycle thérapeutique de Fasturtec, par exemple dans le cadre d'un traitement d'une maladie primaire maligne récidivante (voir également «Mises en garde et précautions»).
Une adaptation du dosage n'est pas nécessaire chez les patients avec une fonction rénale ou hépatique altérée.
Contre-indications
Hypersensibilité aux uricases ou à l'un des excipients.
Déficit en G6PD et autres désordres métaboliques connus pour entraîner une anémie hémolytique. Le peroxyde d'hydrogène est produit lors de la conversion de l'acide urique en allantoïne. C'est pourquoi, afin de prévenir tout risque d'anémie hémolytique induite par le peroxyde d'hydrogène, la rasburicase est contre-indiquée chez les patients atteints de ces troubles métaboliques.
Mises en garde et précautions
La rasburicase, comme toutes les autres protéines, est susceptible d'induire chez l'homme des réactions allergiques, y compris l'anaphylaxie et/ou un choc anaphylactique pouvant entrainer le décès.
L'expérience clinique acquise avec Fasturtec montre que les patients doivent faire l'objet d'une surveillance étroite afin de déceler l'apparition d'événements indésirables de type allergique, notamment des réactions allergiques cutanées ou des bronchospasmes (voir «Effets indésirables»). En cas de réaction allergique ou anaphylactique sévère, le traitement par Fasturtec doit être interrompu immédiatement et de façon permanente et les mesures thérapeutiques appropriées mises en oeuvre.
Les patients ayant des antécédents d'atopie doivent faire l'objet d'une attention particulière.
A ce jour, les données sur les patients ré-exposés au Fasturtec sont limitées. Il n'est donc pas recommandé de procéder à une nouvelle administration de rasburicase. La formation d'anticorps anti-rasburicase a été observée chez des patients et des volontaires sains traités par rasburicase.
Une méthémoglobinémie a été rapportée chez des patients traités par rasburicase. A ce jour, il n'y a pas de données permettant de déterminer si les patients présentant un déficit en méthémoglobine réductase ou à d'autres enzymes à activité antioxydante, présentent un risque augmenté de méthémoglobinémie. La rasburicase doit être immédiatement et définitivement arrêtée chez les patients ayant développé une méthémoglobinémie et les mesures appropriées doivent être prises.
Une hémolyse a été rapportée chez des patients traités par rasburicase. Dans ce cas, la rasburicase doit être immédiatement et définitivement arrêtée et les mesures appropriées doivent être prises.
L'administration de Fasturtec réduit le niveau d'acide urique en deçà des valeurs normales. Grâce à ce mécanisme, Fasturtec réduit le risque d'insuffisance rénale par précipitation dans les tubules rénaux des cristaux d'acide urique, conséquence de l'hyperuricémie. La lyse tumorale peut également entraîner une hyperphosphorémie, une hyperkaliémie et une hypocalcémie. Fasturtec n'a pas d'efficacité directe dans le traitement de ces troubles métaboliques. Il convient donc de suivre ces patients attentivement.
Fasturtec n'a pas été étudié chez les patients avec une hyperuricémie dans le contexte de désordres myéloprolifératifs.
Il n'y a pas de données disponibles pour recommander l'utilisation séquentielle de la rasburicase et de l'allopurinol.
Interactions
Aucune étude de métabolisme n'a été réalisée à ce jour.
In-vitro, la rasburicase ne métabolise ni la 6-mercaptopurine, ni la cytarabine, ni le methotrexate.
Les études précliniques menées in-vivo ont montré que la rasburicase ne modifie pas l'activité des isoenzymes suivants: CYP1A, CYP2A, CYP2B, CYP2C, CYP2E et CYP3A, suggérant ainsi l'absence de tout potentiel inducteur ou inhibiteur. En conséquence, aucune interaction médicamenteuse cliniquement significative médiée par le cytochrome P450 n'est attendue chez les patients traités suivant la posologie et le schéma recommandés.
Des cas occasionnels de méthémoglobinémies ont été observés, ce qui suggère une interaction avec les inducteurs de méthémoglobinémie (préparations à base de dérivés nitrés, nitrofurantoïne, sulfamides, anesthésiques locaux, analogues de la vitamine K) (voir chapitre «Mises en garde et précautions»).
Grossesse/Allaitement
Aucune donnée clinique sur l'utilisation de la rasburicase chez la femme enceinte n'est disponible à ce jour. La rasburicase a montré une tératogénicité chez le lapin à des doses 10, 50 et 100 fois plus élevées que celles utilisées chez l'homme, et chez le rat à des doses 250 fois plus élevées que celles appliquées à l'homme.
En raison de la présence d'urate oxydase endogène chez les animaux de laboratoire habituels, l'étude sur le modèle animal des effets de la rasburicase sur la reproduction et le développement embryofœtal est entravée.
Les risques potentiels pour l'homme ne sont pas connus. Fasturtec ne doit pas être utilisé pendant la grossesse sauf en cas de nécessité absolue.
On ignore si la rasburicase est excrétée dans le lait maternel.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été réalisée
Effets indésirables
Certains des effets secondaires sont en quelque sorte une conséquence du traitement d'induction lors de maladies malignes avancées. Il est difficile d'évaluer dans quelle mesure ces incidents sont vraiment à imputer à Fasturtec.
Les effets indésirables, y compris ceux rapportés après la mise sur le marché, sont listés ci-dessous, par classe d'organe et par fréquence. Les fréquences sont définies comme: très fréquent (>1/10), fréquent (≥1/100, <1/10), occasionnel (≥1/1000, <1/100), rares (<1/1000, ≥1/10'000), très rares (<1/10'000), cas isolés (fréquence est inférieure à «très rares»).
Affections hématologiques et du système lymphatique:
Occasionnel: hémolyses, anémies hémolytiques, méthémoglobinémies. La transformation enzymatique d'acide urique en allantoïne produit du peroxyde d'hydrogène et des anémies hémolytiques ou des méthémoglobinémies ont être observées dans certaines populations à risque, notamment chez les patients atteints d'un déficit en G6PD.
Affections du système immunitaire
Les symptômes qui montrent une hypersensibilité pouvant être liée à Fasturtec ont été observés chez 1.8% des patients traités, tous grades confondus. Ces symptômes se manifestent comme suit:
Fréquents: réactions allergiques, incluant principalement des rougeurs (rash) et urticaire.
Occasionnels: hypotension (<1%), bronchospasme (<1%), réactions d'hypersensibilité sévères (<1%).
Rares: rhinite (<0.1%), anaphylaxie et/ou chocs anaphylactiques avec risque de décès (<0.1%).
Affections du système nerveux:
Très fréquents: Céphalées (25,7%; Grade 3/4: rare), convulsions.
Cas isolés: contractions involontaires des muscles.
Affections gastro-intestinales:
Très fréquents: diarrhées (Grade 3/4: rare), vomissements (grade 3/4: fréquent), nausées (Grade 3/4: fréquent).
Troubles généraux et anomalies liées au site d'administration
Très fréquents: Fièvre (Grade 3/4: fréquent).
Surdosage
Si l'on se réfère au mécanisme d'action de Fasturtec, un surdosage induirait des concentrations plasmatiques d'acide urique basses, voire non détectables, et une production augmentée de peroxyde d'hydrogène. En cas de suspicion de surdosage, des signes d'hémolyse doivent être recherchés et des traitements symptomatiques appropriés doivent être instaurés car aucun antidote spécifique de Fasturtec n'est connu.
Propriétés/Effets
Code ATC: V03AF07
Mécanisme d'action:
Fasturtec est une enzyme recombinante, l'urate oxydase, produite par une souche génétiquement modifiée de Saccharomyces cerevisiae. L'ADNc codant pour la rasburicase a été cloné à partir d'une souche d'Aspergillus flavus. La rasburicase est une protéine tétramérique constituée de sous-unités identiques ayant une masse moléculaire de l'ordre de 34 kDa.
Chez l'homme, l'acide urique représente le produit final du catabolisme des purines. L'augmentation immédiate de l'uricémie consécutive à la lyse d'un nombre important de cellules malignes observée dans les affections malignes et sous chimiothérapie cytotoxique peut entraîner une altération de la fonction rénale et une insuffisance rénale liées à la précipitation des cristaux d'acide urique dans les tubules rénaux. La rasburicase est un agent uricolytique qui catalyse l'oxydation enzymatique de l'acide urique en allantoïne, substance hydrosoluble, facilement excrétée par le rein.
Pharmacodynamique
L'oxydation enzymatique de l'acide urique conduit à la formation stoechiométrique de peroxyde d'hydrogène. L'augmentation du taux de peroxyde d'hydrogène au-delà du niveau usuel peut être normalisée par les antioxydants endogènes. Le risque accru d'hémolyse concerne donc les patients atteints d'un déficit en G6PD ou d'une anémie héréditaire.
Chez le volontaire sain, une diminution importante et dose-dépendante des taux plasmatiques d'acide urique a été constatée à des doses entre 0.05 mg/kg et 0.20 mg/kg de Fasturtec.
Une étude comparative randomisée de phase III révèle que Fasturtec, administré à la dose recommandée (0,20 mg/kg), exerce une action significativement plus rapide que l'allopurinol. Quatre heures après l'administration de la première dose, une différence significative (p<0,0001) a été observée entre le pourcentage moyen de variation des concentrations plasmatiques d'acide urique par rapport aux valeurs initiales du groupe traité par Fasturtec (-86,0%) et celui du groupe traité par allopurinol (-12,1%).
Le délai de normalisation de l'acide urique chez les patients présentant une hyperuricémie est de quatre heures pour Fasturtec et de 24 heures pour l'allopurinol. De plus, chez ces patients, cette rapide normalisation de l'uricémie s'accompagne d'une amélioration de la fonction rénale, qui permet alors une excrétion efficace de la charge en phosphates sériques et prévient ainsi toute nouvelle détérioration de la fonction rénale secondaire à la précipitation des cristaux de calcium/phosphore.
L'expérience dont on dispose se limite aux patients (essentiellement des enfants) atteints d'une leucémie aiguë et de lymphome (à charge tumorale élevée), chez qui il faut s'attendre à une lyse cellulaire importante sous chimiothérapie.
L'expérience clinique relative à la réintroduction du traitement par Fasturtec est limitée à ce jour. La formation d'anticorps anti-rasburicase a été observée chez des patients et des volontaires sains traités par ce principe actif.
Pharmacocinétique
Les études pharmacocinétiques ont surtout été effectuées chez les enfants et les adolescents.
Absorption
Une tendance à l'augmentation linéaire de l'exposition à la rasburicase, mesurée par la SSC0-24 et la Cmax, a été observée chez les patients dans une fourchette de dose limitée (0,15 à 0,20 mg/kg). Cette linéarité a également été observée chez le volontaire sain pour une fourchette de doses plus larges (0,05 à 0,20 mg/kg).
Distribution
Chez les patients, le volume de distribution varie de 110 à 127 ml/kg, ce qui est comparable au volume vasculaire plasmatique physiologique.
La rasburicase étant une protéine, elle ne se lie pas aux protéines.
Métabolisme
Le métabolisme de la rasburicase n'a pas été étudié. Toutefois, la dégradation métabolique de Fasturtec devrait emprunter les voies métaboliques communes aux autres protéines (hydrolyse peptidique).
Elimination
La clairance de la rasburicase est d'environ 3,5 ml/h/kg et la demi-vie d'élimination d'environ 19 heures. Les patients inclus dans les études de pharmacocinétique étaient principalement des enfants et des adolescents. La clairance est augmentée (environ 35%) chez les enfants et les adolescents en comparaison des adultes, conduisant à une exposition systémique plus faible.
Après administration d'une dose quotidienne pendant 5 jours, l'accumulation de rasburicase a été de 1.3 fois la dose administrée.
Données précliniques
Les données précliniques n'ont révélé aucun risque spécial pour les humains basés sur des études conventionnelles de pharmacologie de sécurité, de toxicité suite à des doses répétées et de génotoxicité. L'interprétation des études précliniques est entravée dû à la présence de l'urate oxydase endogène dans les modèles animaux standards.
Rasburicase a montré une tératogénicité chez le lapin à des doses 10, 50 et 100 fois plus élevées que celles utilisées chez l'homme, et chez le rat à des doses 250 fois plus élevées que celles appliquées à l'homme.
Remarques particulières
Incompatibilités
Ce médicament ne doit pas être mélangé avec d'autres médicaments.
Pour perfuser la solution de rasburicase, il est impératif d'utiliser une tubulure différente de celle employée pour administrer les agents de chimiothérapie, afin d'éviter tout risque d'incompatibilité médicamenteuse. Si la mise en place d'une tubulure différente est impossible, la tubulure doit être rincée avec du sérum physiologique entre chaque perfusion d'agents cytotoxiques et de rasburicase.
Ne pas utiliser de filtre pour perfuser.
Ne jamais utiliser de soluté glucosé pour diluer ce médicament en raison d'une incompatibilité potentielle.
La rasburicase doit être reconstituée exclusivement avec le solvant fourni.
Stabilité
Remarques concernant le stockage
Ce médicament ne peut être utilisé au-delà de la date imprimée sur l'emballage avec la mention «EXP».
A conserver entre +2 °C et +8 °C (au réfrigérateur) et à l'abri de la lumière. Ne pas congeler.
La solution reconstituée en conditions aseptiques contrôlées et validées peut être conservée pendant 24 h, à condition d'être entreposée entre +2 °C et +8 °C.
Remarques concernant la manipulation
Reconstitution de la préparation
Ajouter le contenu d'une ampoule de solvant dans le flacon contenant la rasburicase dans des conditions aseptiques contrôlées et validées, puis mélanger en agitant très doucement.
Ne pas secouer. Procéder à une vérification visuelle avant toute utilisation. Seules des solutions limpides exemptes de particules doivent être utilisées. Le médicament est à usage unique. Toute solution non utilisée doit être éliminée.
Conservation de la préparation reconstituée:
Cf. «Remarques concernant le stockage».
Dilution avant perfusion
La dilution doit être réalisée exclusivement avec du chlorure de sodium 0.9%. La quantité de rasburicase nécessaire calculée en fonction du poids corporel est diluée, afin d'obtenir un volume total de 50 ml. La préparation reconstituée étant exempte de conservateur, la solution pour perfusion doit être administrée immédiatement.
Perfusion
La solution finale doit être perfusée en 30 minutes.
Pour perfuser la solution de rasburicase, il est impératif d'utiliser une tubulure différente de celle mise en place pour administrer les agents de chimiothérapie, afin de prévenir tout risque d'incompatibilité médicamenteuse. Si la mise en place d'une tubulure différente est impossible, la tubulure doit être rincée avec du sérum physiologique entre chaque perfusion de cytotoxiques et de rasburicase.
Fasturtec doit impérativement être administré sous surveillance médicale.
Remarques concernant la manipulation des échantillons de sang lors d'un contrôle de l'acide urique
Lors de la surveillance de l'acide urique, il convient de respecter la procédure de manipulation des échantillons décrite ci-après afin d'éviter toute dégradation ex vivo. Le sang sera recueilli dans des tubes héparinés préalablement réfrigérés. Les échantillons doivent être immergés dans un bain d'eau et de glace. Les échantillons de plasma doivent être préparés par centrifugation dans une centrifugeuse préalablement refroidie (+4 °C). Enfin, le plasma doit être conservé dans un bain d'eau et de glace, le dosage de l'acide urique devant intervenir dans les 4 heures.
Numéro d’autorisation
55789 (Swissmedic).
Titulaire de l’autorisation
sanofi-aventis (suisse) sa, 1214 Vernier/GE.
Mise à jour de l’information
Septembre 2016.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French