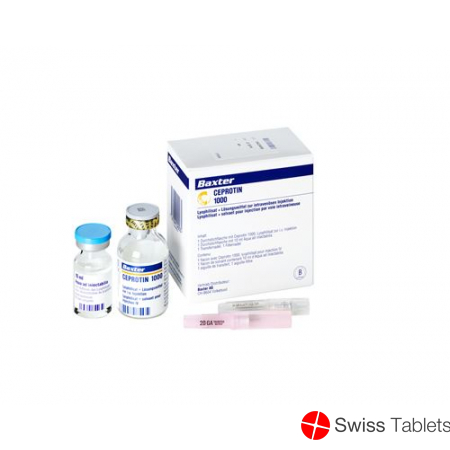
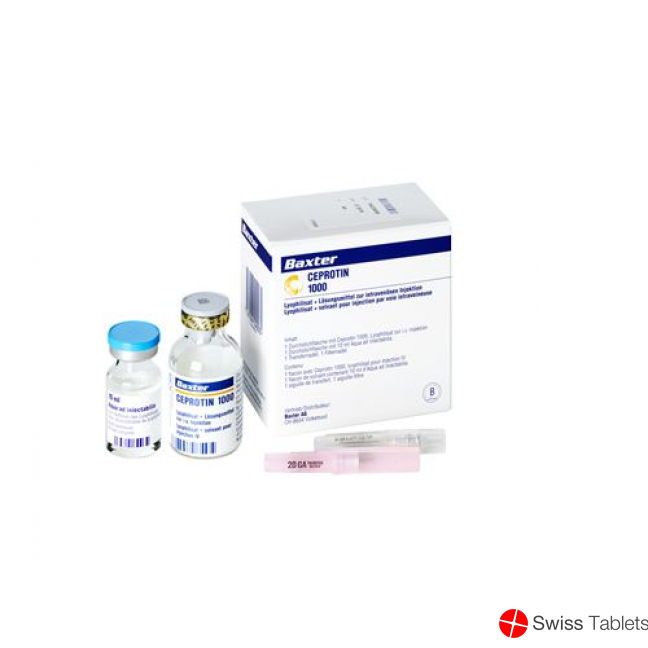
Ceprotin Trockensubstanz 1000 E C Solv Durchstechflasche buy online
Ceprotin Trockensub 1000 IE cum Solvens Durchstf
-
3,529.63 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: BAXTER AG
- Product Code: 2802330
- ATC-code B01AD12
- EAN 7680561240034
Ingredients:
Natriumchlorid, Albumin human, Trockensubstanz, Lösungsmittel, Protein C (human) 1000 UI, pro vitro, Natriumcitrat-2-Wasser.

Description
Zusammensetzung
Wirkstoff : Proteinum C humanum
Hilfsstoffe: Albuminum humanum, Natrii chloridum, Natrii citras
Lösungsmittel : Aqua ad iniectabilia
Galenische Form und Wirkstoffmenge pro Einheit
Lyophilisat und Lösungsmittel zur intravenösen Injektion nach Auflösen.
Ceprotin 500
Das Lyophilisat enthält nominell: 500 I.E.* / Fläschchen
Lösungsmittel: Aqua ad iniectabilia 5 ml
Ceprotin 1000
Das Lyophilisat enthält nominell: 1000 I.E.* / Fläschchen
Lösungsmittel: Aqua ad iniectabilia 10 ml
Nach Auflösen im mitgelieferten Lösungsmittel enthält Ceprotin nominell 100 I.E./ ml.
Die Wirksamkeit (I.E.) wird unter Anwendung eines chromogenen Substrats in Gegenüberstellung mit dem Internationalen Standard der World Health Organisation (WHO) ermittelt.
*1 Internationale Einheit (I.E.) Protein C entspricht der amidolytisch gemessenen Aktivität von Protein C in 1 ml Normalplasma.
Indikationen/Anwendungsmöglichkeiten
Ceprotin ist indiziert bei Purpura fulminans und Cumarin-induzierter Hautnekrose bei Patienten mit schwerem kongenitalem Protein-C-Mangel.
Des weiteren ist Ceprotin indiziert zur Kurzzeitprophylaxe bei Patienten mit schwerem kongenitalem Protein-C-Mangel, wenn einer oder mehrere der folgenden Faktoren zutreffen:
•bevorstehende Operation oder invasive Therapie
•zu Beginn einer Cumarintherapie
•wenn eine Cumarintherapie allein nicht ausreicht
•wenn eine Cumarintherapie nicht möglich ist
Dosierung/Anwendung
Die Behandlung mit Ceprotin sollte nur unter Aufsicht eines in der Substitutionstherapie mit Blutgerinnungsfaktoren/-inhibitoren erfahrenen Arztes und unter Überwachung der Protein-C-Aktivität erfolgen.
Dosierung
Die Dosierung sollte anhand der Laborergebnisse für jeden einzelnen Patienten bestimmt werden.
Anfänglich sollte eine Protein-C-Aktivität von 100% angestrebt und für die Dauer der Behandlung bei über 25% beibehalten werden.
Eine Initialdosis von 60 – 80 I.E./kg KG sollte für die Bestimmung der Recovery und der Halbwertszeit verabreicht werden. Vor und während der Behandlung mit Ceprotin wird die Bestimmung der Protein-C-Plasmaspiegel des Patienten mittels Messung der Protein-C-Aktivität unter Verwendung chromogener Substrate empfohlen.
Die Dosierung ist von den Ergebnissen der Laborbestimmung der Protein-C-Aktivität abhängig. Im Falle eines akuten thrombotischen Ereignisses, sollte die Protein-C-Aktivität bis zur Stabilisierung des Patienten, alle 6 Stunden, danach 2 mal täglich und stets unmittelbar vor der nächsten Infusion bestimmt werden. Es ist zu beachten, dass die Halbwertszeit von Protein C in bestimmten klinischen Situationen, wie z B. bei akuter Thrombose mit Purpura fulminans und Hautnekrose stark verkürzt sein kann.
Patienten, die in der Akutphase ihrer Erkrankung behandelt werden, können einen viel geringeren Anstieg der Protein-C-Aktivität aufweisen. Die grosse Bandbreite an individuellen Reaktionen zeigt, dass die Wirkung von Ceprotin auf die Blutgerinnungsparameter regelmässig überprüft werden sollte.
Kontrollierte klinische Studien mit Ceprotin an Neugeborenen und Kleinkindern mit schwerem kongenitalem Protein C Mangel wurden nicht durchgeführt. In mehreren kleinen retrospektiven und prospektiven Studien wurde Ceprotin jedoch bei Neugeborenen und Kleinkindern mit schwerem kongenitalem Protein C Mangel zur Prävention und Behandlung von Purpura fulminans und thrombotischen Erkrankungen eingesetzt. In diesen Studien wurden 14 Patienten in der Altersgruppe von 2 Tagen bis zum Jugendalter untersucht.
Weitere Erfahrungen mit Ceprotin schliessen Fallberichte und eine klinische Studie mit insgesamt 69 pädiatrischen Patienten mit erworbenem Protein C Mangel ein. Diese randomisierte, doppelblinde, placebo-kontrollierte Dosisfindungsstudie wurde in pädiatrischen Patienten mit erworbenem Protein C Mangel aufgrund einer Meningokokken-Sepsis (IMAG 112) durchgeführt. Die Resultate weisen darauf hin, dass Ceprotin von Kindern und Kleinkindern gut vertragen wird.
Die oben erwähnten publizierten Studien, in welchen 83 Patienten analysiert wurden, deuten darauf hin, dass die Dosierungsanweisungen für Erwachsene auch für Neugeborene und Kleinkinder gelten. In Ausnahmefällen, in denen eine intravenöse Verabreichung von Ceprotin nicht möglich war, konnte die subkutane Infusion von 250 – 350 I.E./kg normale Protein C Plasmawerte herstellen (siehe auch Kap. Eigenschaften / Wirkungen).
Spezielle Dosierungsanweisungen
Zur Behandlung von Patienten mit Nieren- und/oder Leberschäden liegen keine Daten vor, daher wird bei diesen Patienten eine engmaschige Kontrolle empfohlen.
Bei Umstellung auf eine Dauerprophylaxe mit oralen Antikoagulantien, darf die Protein-C-Substitution erst dann abgesetzt werden, wenn eine stabile Antikoagulation erreicht wurde (siehe Kapitel «Interaktionen»). Des weiteren ist es zu Beginn einer oralen Antikoagulationstherapie empfehlenswerter, mit einer niedrigen Dosis zu beginnen und diese langsam zu steigern, als eine standardisierte Anfangsdosis zu verwenden.
Bei Patienten, die Protein C prophylaktisch erhalten, können bei erhöhtem Thromboserisiko (z.B. Infektionen, Trauma oder chirurgischen Eingriffen) höhere Minimalspiegel im Blut angezeigt sein.
Bei Patienten mit kombiniertem schwerem kongenitalem Protein-C-Mangel und mit APC-Resistenz gibt es nur eingeschränkte klinische Daten zur Unbedenklichkeit und Wirksamkeit.
Art der Anwendung
Ceprotin wird intravenös verabreicht.
Es sind Einzelfälle beschrieben, in denen das Präparat nach subkutaner Verabreichung toleriert wurde.
In der Regel sollte Ceprotin mit einer maximalen Infusionsgeschwindigkeit von 2 ml/min verabreicht werden. Bei Kindern mit einem Körpergewicht von <10 kg, sollte eine Injektionsgeschwindigkeit von 0,2 ml/kg/min nicht überschritten werden.
Wie bei jedem anderen intravenösen proteinhaltigen Produkt sind allergische Überempfindlichkeitsreaktionen möglich. Die für die Behandlung von akuten und lebensbedrohlichen allergischen Symptomen notwendigen medizinischen Massnahmen müssen zur Verfügung stehen.
Kontraindikationen
Überempfindlichkeit gegen einen Inhaltsstoff des Präparates, gegen Maus-Protein oder Heparin, ausser zur Behandlung von lebensbedrohlichen thrombotischen Komplikationen.
Warnhinweise und Vorsichtsmassnahmen
Da das Risiko einer allergischen Überempfindlichkeitsreaktion nicht ausgeschlossen werden kann, sollten die Patienten auf deren erste Anzeichen, wie Ausschlag, generalisierte Urtikaria, Engegefühl in der Brust, Atemnot, Hypotension und Anaphylaxie, hingewiesen und angewiesen werden den Arzt unbedingt über das Auftreten dieser Symptome zu informieren. Beim Auftreten dieser Symptome ist die Verabreichung von Ceprotin unverzüglich zu unterbrechen.
Bei Auftreten von Schocksymptomen sollte die Behandlung nach den Regeln der modernen Schocktherapie erfolgen.
Wird das Präparat bei Patienten mit schwerem kongenitalem Protein-C-Mangel verwendet, können sich Antikörper gegen Protein C bilden, obwohl dies bislang nicht beobachtet wurde.
Ceprotin wird aus humanem Plasma hergestellt. Standardmassnahmen zur Verhinderung von Infektionen, die sich durch den Einsatz von Arzneimitteln ergeben, die aus Blut oder Blutplasma hergestellt werden, schliessen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker sowie den Einsatz effektiver Schritte zur Inaktivierung / Entfernung von Viren im Herstellungsverfahren ein. Dennoch kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Möglichkeit der Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für bislang unbekannte oder neu aufgetretene Viren und andere Pathogene.
Die ergriffenen Sicherheitsmassnahmen werden als wirksam gegen umhüllte Viren wie z.B. HIV, HBV und HCV sowie gegen das unbehüllte Hepatitis A Virus (HAV) betrachtet. Für Parvovirus B19 können die getroffenen Massnahmen von eingeschränktem Wert sein.
Parvovirus B19 Infektionen können schwerwiegende Folgen für schwangere Frauen (fötale Infektion) und für Personen mit Immunmangelkrankheiten oder gesteigerter Erythropoese (z.B. hämolytische Anämie) haben.
Für Patienten, die regelmässig Präparate aus menschlichem Blut oder Plasma erhalten, wird grundsätzlich eine Impfung gegen Hepatitis A und Hepatitis B empfohlen.
Es wird empfohlen, bei jeder Verabreichung von Ceprotin an einen Patienten den Namen und die Chargennummer des Präparates zu dokumentieren, um einen Zusammenhang zwischen Patient und Produktcharge herzustellen.
Da bei Verabreichung der maximalen Tagesdosis Ceprotin die Natriummenge von 200 mg überschritten werden kann, soll diese bei Personen, die eine natriumarme Diät einhalten müssen, mitberechnet werden.
Ceprotin kann Spuren von Heparin enthalten. Dadurch kann es zu Heparin-induzierten allergischen Reaktionen kommen, die mit einem raschen Absinken der Thrombozytenzahl einhergehen (Heparin-induzíerte Thrombozytopenie, HIT). Bei Patienten mit HIT können Symptome wie arterielle und venöse Thrombose, disseminierte intravasale Gerinnung (DIC), Purpura, Petechien und Melena auftreten. Bei Verdacht auf HIT sollte die Thrombozytenzahl unverzüglich bestimmt, und falls erforderlich, die Therapie mit Ceprotin abgebrochen werden. Die Diagnose einer HIT wird des weiteren dadurch erschwert, dass die Symptome bereits bei Patienten in der akuten Phase eines schweren kongenitalen Protein-C-Mangels vorhanden sein können. Patienten mit HIT sollten in Zukunft heparinhaltige Arzneimittel vermeiden.
Bei der klinischen Anwendung von Ceprotin haben sich verschiedene Blutungsepisoden gezeigt, für die eine begleitende Antikoagulantientherapie (z.B. Heparin) verantwortlich gemacht werden kann. Es kann aber nicht ganz ausgeschlossen werden, dass auch die Verabreichung von Ceprotin an diesen Blutungsepisoden mitwirkt.
Die Wirksamkeit bei Patienten mit erworbenem Protein-C-Mangel ist nicht in kontrollierten Studien belegt.
Interaktionen
Zur Zeit sind keine Wechselwirkungen mit anderen Arzneimitteln bekannt.
Bei Patienten, bei denen eine Therapie mit oralen Antikoagulantien der Gruppe der Vitamin-K-Antagonisten (z.B. Warfarin) begonnen wurde, kann eine vorübergehende Hyperkoagulabilität auftreten, bevor die gewünschte gerinnungshemmende Wirkung eintritt. Dieser vorübergehende Effekt erklärt sich dadurch, dass Protein C, selbst ein Vitamin-K-abhängiges Plasmaprotein, eine kürzere Halbwertszeit als die meisten Vitamin-K-abhängigen Proteine (z.B. Faktoren II, IX und X) hat. Demzufolge wird am Beginn der Behandlung die Aktivität von Protein C schneller herabgesetzt als die der gerinnungsfördernden Faktoren. Daher muss, bei Umstellung auf eine Therapie mit oralen Antikoagulantien, die Protein-C-Substitution bis zum Erreichen einer stabilen Antikoagulation fortgesetzt werden. Obwohl bei jedem Patienten am Beginn einer oralen Antikoagulationstherapie eine Warfarin-induzierte Hautnekrose auftreten kann, besteht für Personen mit angeborenem Protein-C-Mangel hierfür ein besonderes Risiko.
Schwangerschaft/Stillzeit
Obwohl die Anwendung von Ceprotin bei schwangeren Frauen mit Protein-C-Mangel kein Sicherheitsrisiko erkennen liess, liegen für die Anwendung während der Schwangerschaft keine Sicherheitsdaten aus kontrollierten klinischen Studien vor. Unter diesen Umständen soll das Medikament nur verabreicht werden, wenn der potentielle Nutzen das fötale Risiko übersteigt. Des weiteren gibt es keine Daten zum Übertritt von Protein C in die Muttermilch. Informationen zu Parvovirus B19 Infektionen siehe „Warnhinweise und Vorsichtsmassnahmen“.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Ceprotin hat keinen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Unerwünschte Wirkungen
Wie bei jedem intravenös verabreichten Produkt können Überempfindlichkeitsreaktionen auftreten. Patienten sollen über frühe Anzeichen einer Überempfindlichkeitreaktion, die Angioödem, Brennen und Stechen an der Injektionsstelle, Schüttelfrost, Rötung, Ausschlag, Pruritus, generalisierte Urtikaria, Kopfschmerzen, Nesselsucht, Blutdruckabfall, Lethargie, Übelkeit, Unruhe, Tachykardie, Engegefühl in der Brust, Kribbeln, Erbrechen, und Atemnot mit einschliessen, informiert werden. Die Patienten sollen angewiesen werden bei Auftreten dieser Symptome unverzüglich den Arzt zu kontaktieren (siehe „Warnhinweise und Vorsichtsmassnahmen“).
Während klinischer Studien mit Ceprotin wurden bei 1 der 67 eingeschlossenen Patienten insgesamt 3 Nebenwirkungen berichtet (Ausschlag und Pruritus (gruppiert unter Überempfindlichkeit) und Schwindelgefühl). Insgesamt wurden 6'375 Dosen Ceprotin verabreicht. Die im Zusammenhang stehenden Nebenwirkungen setzen sich wie folgt zusammen:
Systemorganklasse | Nebenwirkung | Bevorzugter Begriff | Häufigkeitskategorie pro Anzahl Infusionena |
Erkrankungen des Immunsystems | Überempfindlichkeit | Ausschlag Pruritus | selten selten |
Erkrankungen des Nervensystems | Schwindelgefühl | Schwindelgefühl | selten |
a CIOMS Häufigkeitskategorien: sehr häufig (≥10%); häufig (≥1% - <10%), gelegentlich (≥0.1% - <1%), selten (≥0.01% - <0.1%), sehr selten (<0.01%)
Folgende Nebenwirkungen wurden bei der spontanen Post-Marketing Überwachung berichtet:
Psychiatrische Erkrankungen
Unruhe
Erkrankungen der Haut und des Unterhautzellgewebes
Hyperhidrosis
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Reaktionen an der Injektionsstelle
Die Häufigkeit dieser Nebenwirkungen ist nicht bekannt.
Für Informationen zur Virussicherheit siehe „Warnhinweise und Vorsichtsmassnahmen“
Überdosierung
Bisher ist kein Fall einer Überdosierung nach der Gabe von Ceprotin berichtet worden.
Eigenschaften/Wirkungen
ATC-Code: B01AD12 (Antithrombotika)
Protein C ist ein Vitamin-K-abhängiges gerinnungshemmendes Glykoprotein, das in der Leber synthetisiert wird. Es wird durch den Thrombin/Thrombomodulin-Komplex an der Endotheloberfläche in aktives Protein C (APC) konvertiert. APC ist eine Serinprotease mit starker gerinnungshemmender Wirkung, insbesondere in Anwesenheit seines Cofaktors Protein S. Die Wirkung von APC beruht auf der Inaktivierung der aktivierten Faktoren V und VIII, die zu einer Verminderung der Bildung von Thrombin führt. Es konnte auch gezeigt werden, dass APC profibrinolytische und entzündungshemmende Eigenschaften aufweist.
Die intravenöse Verabreichung von Ceprotin gewährleistet den unmittelbaren jedoch temporären Anstieg des Protein-C-Plasmaspiegels.
Die Substitution von Protein C bei Patienten mit Protein-C-Mangel ermöglicht die Kontrolle oder – bei prophylaktischer Anwendung – die Vorbeugung von thrombotischen Komplikationen bei diesen Patienten.
12 Patienten mit einer Kurzzeitprophylaxe vor Operation bzw. invasiver Therapie und 7 Patienten mit einer Langzeitprophylaxe waren in den Wirksamkeitsstudien mit Ceprotin eingeschlossen.
In einer randomisierten, placebo-kontrollierten Studie an Kindern (N = 40; Bereich ½ bis 16 Jahre) mit Meningokokken-Sepsis und erworbenem Protein C Mangel zeigte sich Ceprotin als verträglich in einer täglichen Dosierung bis zu 600 IU/kg über drei Tage. Lediglich im Fall eines Patienten mit DIC und Sepsis und milder gastro-intestinaler Blutung wurde ein Zusammenhang mit Ceprotin nicht ausgeschlossen.
Wirksamkeit und Verträglichkeit von Ceprotin im erworbenen Protein C Mangel wurde in weiteren Einzelfallberichten und Fallserien dokumentiert.
Pharmakokinetik
Die pharmakokinetischen Daten wurden bei 21 asymptomatischen Personen mit homozygotem oder doppelt heterozygotem Protein-C-Mangel bestimmt. Die Plasmaaktivität von Protein C wurde mit einem chromogenen Testsystem bestimmt. Die individuelle Halbwertszeit lag bei 4,4 bis 15,8 Stunden im Kompartiment-Modell und bei 4,9 bis 14,7 Stunden im Nicht-Kompartiment-Modell. Die individuelle zunehmende Recovery lag zwischen 0.5 bis 1.76 [(I.E./dl)/I.E./kg)]. Die Patienten unterschieden sich signifikant in Alter, Körpergewicht und Plasmavolumen.
Bei Patienten mit akuten thrombotischen Erkrankungen kann sowohl der Anstieg der Protein C-Plasmaspiegel als auch die Halbwertszeit erheblich vermindert sein.
Präklinische Daten
Das im Ceprotin enthaltene Protein C stellt einen normalen Bestandteil des menschlichen Plasmas dar und wirkt wie endogenes Protein C. Tierexperimentelle Studien zum tumorigenen und mutagenen Potential wurden - insbesondere, da es sich hierbei um heterologe Empfänger handelt - nicht als notwendig angesehen.
Toxizitätsstudien nach einmaliger Anwendung zeigten, dass selbst Dosen, die ein mehrfaches der für die Anwendung am Menschen empfohlenen Dosis pro kg Körpergewicht (10 x) ausmachten, bei den Versuchstieren keine toxischen Wirkungen zur Folge hatten.
Im Ames-Test hat sich Ceprotin als nicht mutagen erwiesen.
Toxizitätsstudien nach wiederholter Gabe wurden nicht durchgeführt, da aus Erfahrung mit anderen Blutgerinnungspräparaten diese nur von eingeschränktem Wert sind. Die Unterschiede zwischen der Empfängerspezies und menschlichem Protein C würden unverzüglich zu einer Immunantwort mit Antikörperbildung führen.
Sonstige Hinweise
Inkompatibilitäten
Da Studien zur Inkompatibilität fehlen, darf Ceprotin nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Medikament darf nur bis zu dem auf dem Behälter mit ''EXP:'' bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei 2 °C bis 8 °C und vor Licht geschützt lagern. Nicht einfrieren.
Die gebrauchsfertige Lösung sollte unverzüglich verwendet werden.
Für Kinder unerreichbar aufbewahren.
Hinweise für die Handhabung
Das Lyophilisat wird unter Verwendung der sterilen Transfernadel im mitgelieferten Lösungsmittel (Aqua ad iniectabilia) vollständig gelöst, indem das Fläschchen unter leichtem Drehen geschwenkt wird.
Nach vollständiger Auflösung des Lyophilisats wird die Lösung durch eine sterile Filternadel in eine sterile Einwegspritze aufgezogen. Eine separate, ungebrauchte Filternadel muss zum Aufziehen des rekonstituierten Ceprotin aus jeder einzelnen Durchstichflasche verwendet werden. Die Lösung ist zu verwerfen, falls Schwebeteilchen sichtbar sind.
Die gebrauchsfertige Lösung sollte unverzüglich intravenös injiziert werden.
Nicht verwendete Lösung, leere Durchstichflaschen und verwendete Nadeln und Einwegspritzen sachgemäss entsorgen.
Zulassungsnummer
56124 (Swissmedic)
Zulassungsinhaberin
Takeda Pharma AG, 8152 Opfikon
Stand der Information
Oktober 2018
Composition
Principe actif : Proteinum C humanum
Excipients : Albuminum humanum, Natrii chloridum, Natrii citras
Solvant : Aqua ad iniectabilia
Forme galénique et quantité de principe actif par unité
Lyophilisat et solvant pour injection intraveineuse après reconstitution.
Ceprotin 500
Le lyophilisat contient nominalement: 500 UI* / Flacon
Solvant: Aqua ad iniectabilia 5 ml
Ceprotin1000
Le lyophilisat contient nominalement: 1000 UI* / Flacon
Solvant: Aqua ad iniectabilia 10 ml
Après reconstitution avec le solvant livré, Ceprotin contient nominalement 100 UI / ml.
L'activité (UI) est déterminée par une méthode avec substrat chromogénique par rapport au Standard International de l'Organisation Mondiale de la Santé (OMS).
* 1 Unité internationale (UI) de protéine C correspond à l'activité amidolytique de la protéine C mesurée dans 1 ml de plasma normal.
Indications/Possibilités d’emploi
Ceprotin est indiqué dans les purpura fulminans et les nécroses cutanées induites par la coumarine chez les patients atteints de déficit congénital sévère en protéine C.
De plus, Ceprotin est indiqué pour la prophylaxie à court terme chez les patients atteints de déficit congénital sévère en protéine C lorsque l'une ou plusieurs des conditions suivantes sont présentes:
•opération chirurgicale ou traitement invasif imminent
•instauration d'un traitement par la coumarine
•lorsque le traitement par la coumarine est insuffisant
•lorsque le traitement par la coumarine est impossible.
Posologie/Mode d’emploi
Le traitement par Ceprotin doit être instauré sous la responsabilité d'un médecin expert dans les traitements substitutifs avec des facteurs/inhibiteurs de la coagulation et lorsque le contrôle de l'activité de la protéine C est réalisable.
Posologie
La posologie doit être adaptée en fonction des résultats des dosages pour chaque patient.
Une activité en protéine C de 100% doit être atteinte initialement puis l'activité doit se maintenir au-dessus de 25% durant tout le traitement.
Une dose initiale de 60 à 80 UI/kg de poids corporel est conseillée pour déterminer la récupération et la demi-vie. Il est recommandé de mesurer l'activité en protéine C par une méthode avec substrat chromogénique pour déterminer la concentration plasmatique en protéine C du patient avant et pendant le traitement par Ceprotin.
La posologie doit être basée sur les résultats du dosage de l'activité en protéine C. Dans le cas d'une thrombose aiguë, ce dosage doit être réalisé toutes les six heures jusqu'à ce que le taux soit stable, puis deux fois par jour et toujours immédiatement avant la perfusion/injection suivante. Il faut garder en mémoire que la demi-vie de la protéine C peut être fortement diminuée dans certaines situations cliniques telles qu'une thrombose aiguë avec purpura fulminans et nécrose cutanée.
Les patients traités durant la phase aiguë de leur maladie peuvent montrer des augmentations plus faibles de l'activité de la protéine C. La grande variation des réponses individuelles nécessite que les effets de Ceprotin sur les paramètres de la coagulation soient vérifiés régulièrement.
Aucune étude clinique contrôlée n'a été réalisée avec Ceprotin sur la population néonatale ou pédiatrique présentant un déficit congénital sévère en protéine C.
Dans plusieurs petites études rétrospectives ou prospectives, Ceprotin a cependant été utilisé chez des nouveau-nés et des enfants en bas âge atteints d'un déficit congénital sévère en protéine C pour la prévention et le traitement du purpura fulminans et des affections thrombotiques. Dans ces études 14 patients âgés entre 2 jours et l'adolescence ont été recrutés.
D'autres informations sur Ceprotin proviennent des cas rapportés et d'une étude clinique couvrant un total de 69 patients pédiatriques avec un déficit acquis en protéine C. Cette étude contrôlée de dose, randomisée, en double aveugle contre placebo, a été conduite chez les patients pédiatriques dans l'indication de déficit acquis en protéine C dû à une infection méningococcique (IMAG 112). Les rapports suggèrent que Ceprotin est bien toleré chez les enfants et les nourrissons. Les études mentionnées ci-dessus et couvrant 83 patients, indiquent que les recommandations posologiques pour les adultes sont également valables pour les populations pédiatriques et néo-natales. Dans des cas exceptionnels, quand l'administration de Ceprotin n'était pas possible, une perfusion sous-cutanée de 250 – 350 UI/kg a permis d'obtenir un taux plasmatique normale en protéine C (c.f. « Propriétés / Effets »).
Instructions spéciales pour le dosage
Aucune expérience n'a été faite dans le traitement des patients atteints d'insuffisance rénale et/ou hépatique; il est par conséquent recommandé de surveiller plus attentivement ces patients.
Si le patient est mis sous traitement anticoagulant par voie orale en prophylaxie permanente, le traitement substitutif par la protéine C ne doit être arrêté que lorsqu'une anticoagulation stable est obtenue (voir sous ''Interactions''). En outre, lors de l'initiation du traitement anticoagulant par voie orale, il est recommandé de commencer par une dose faible et de l'ajuster progressivement, plutôt que d'utiliser une dose de charge standard.
Chez les patients recevant une administration prophylactique de protéine C, des taux plus élevés peuvent être nécessaires dans les cas de risques élevés de thromboses (tels qu'infection, traumatisme ou intervention chirurgicale).
Chez les patients avec un déficit congénital sévère en protéine C combiné à une résistance à la protéine C activée, les données cliniques permettant d'établir le rapport bénéfice/risque sont limitées.
Mode d'emploi
Ceprotin est injecté par voie intraveineuse.
Une tolérance de la préparation a été décrite dans des cas isolés après une administration sous-cutanée.
Ceprotin devrait être administré avec un débit de perfusion maximal de 2 ml par minute. Chez les enfants de moins de 10 kg, un débit de 0,2 ml/kg de poids corporel/min ne devrait pas être dépassé.
Comme avec tout produit protéique intraveineux, des réactions d'hypersensibilité de type allergique sont possibles. Les mesures médicales nécessaires à la prise en charge de réactions allergiques aiguës et menaçant la vie doivent donc être à disposition.
Contre-indications
Hypersensibilité à l'un des composants, aux protéines de souris ou à l'héparine, sauf lors de traitement de complications thrombotiques mettant en jeu le pronostic vital.
Mises en garde et précautions
Comme le risque de réactions d'hypersensibilité de type allergique ne peut être exclu, les patients doivent être informés de leurs signes précoces, comme exanthème, urticaire généralisée, oppression thoracique, dyspnée, hypotension et anaphylaxie et qu'ils sont tenus, en cas d'apparition de ces symptômes, d'en informer immédiatement le médecin.
L'administration de Ceprotin doit être, dès l'apparition des symptômes, immédiatement interrompue.
En cas de choc, suivre les règles médicales actuelles concernant le traitement du choc.
Si la préparation est utilisée chez les patients atteints d'un déficit congénital sévère en protéine C, des anticorps, inhibiteurs de la protéine C, peuvent se former. Ceci n'a cependant pas été observé à ce jour.
Ceprotin est produit à partir de plasma humain. Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection des donneurs, la recherche de marqueurs spécifiques d'infection sur chaque don et sur les pools de plasma et l'inclusion dans le procédé de fabrication d'étapes efficaces pour l'inactivation/élimination virale.
Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou autres types d'agents infectieux.
Les mesures de sécurité prises sont considérées comme efficaces contre les virus enveloppés tels que VIH, VHB et VHC ainsi que contre le virus non enveloppé de l'hépatite A (VHA). Les mesures prises peuvent être d'efficacité limitée vis-à-vis de virus non enveloppés tels que le parvovirus B19.
L'infection par le parvovirus B19 peut être grave chez les femmes enceintes (infection foetale) et chez les sujets immunodéprimés ou présentant une augmentation de la production de globules rouges (par ex. anémie hémolytique).
Pour les patients qui reçoivent régulièrement des préparations dérivées de sang ou de plasma humains, une vaccination contre l'hépatite A et l'hépatite B est recommandée par principe.
Lors de chaque administration de Ceprotin à un patient, il est recommandé de documenter le nom et le numéro de lot de la préparation pour pouvoir établir un rapport entre le patient et le lot du produit.
La quantité de sodium dans la dose maximale quotidienne pouvant dépasser 200 mg, cela doit être pris en compte chez les patients contrôlant leur apport alimentaire en sodium.
Ceprotin peut contenir des traces d'héparine. Des réactions allergiques induites par l'héparine éventuellement associées à une diminution rapide du nombre de thrombocytes peuvent donc se produire (thrombopénie induite par l'héparine, TIH). Chez les patients atteints de TIH, des symptômes tels que thrombose veineuse et artérielle, coagulation intravasculaire disséminée (CIVD), purpura, pétéchies et saignements intestinaux (méléna), peuvent apparaître. Si une TIH est suspectée, le nombre de thrombocytes doit être déterminé immédiatement et, si nécessaire, le traitement avec Ceprotin interrompu. Le diagnostique de la TIH est compliqué par le fait que ces symptômes peuvent déjà être présents dans la phase aiguë chez les patients atteints de déficit congénital sévère en protéine C. Les patients atteints de TIH devraient éviter, par la suite, d'utiliser des médicaments contenant de l'héparine.
Au cours de l'application clinique de Ceprotin, différents épisodes de saignement ont été observés pour lesquels l'utilisation concomitante de médicament anticoagulant (par ex. héparine) s'est finalement révélée en être la cause possible. Cependant, il ne peut pas être complètement exclu que l'administration de Ceprotin n'ait pas également contribuée à ces épisodes de saignement.
L'efficacité chez les patients atteints d'un déficit acquis en protéine C n'est pas démontrée dans des études cliniques contrôlées.
Interactions
Aucune interaction avec d'autres médicaments n'est connue à ce jour.
Chez les patients commençant un traitement par voie orale d'anticoagulants de la classe des antagonistes de la vitamine K (warfarine par ex.), une hypercoagulabilité transitoire peut apparaître avant que l'effet anticoagulant recherché ne soit apparent. Cet effet transitoire peut s'expliquer par le fait que la protéine C, elle-même protéine plasmatique vitamine K-dépendante, a une demie-vie plus courte que la plupart des protéines vitamine K-dépendantes (par ex. Facteurs II, IX et X). Par conséquent, dans la phase initiale du traitement, l'activité de la protéine C est plus rapidement diminuée que celle des facteurs procoagulants. C'est pourquoi, si le patient est mis sous anticoagulants par voie orale, le traitement substitutif par la protéine C doit être poursuivi jusqu'à stabilisation de l'anticoagulation. Bien que des nécroses cutanées induites par la warfarine puissent apparaître chez tout patient lors de l'instauration d'un traitement anticoagulant par voie orale, les sujets atteints de déficit congénital en protéine C présentent un risque particulier.
Grossesse/Allaitement
Bien que Ceprotin ait été utilisé de façon sûre dans le traitement de femmes enceintes atteintes d'un déficit en protéine C, son innocuité chez la femme enceinte n'a pas été établie au cours d'essais cliniques contrôlés. Dans ces conditions, le médicament ne devrait être administré que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Aucune information sur l'excrétion de protéine C dans le lait n'est disponible.
Informations sur les infections par le parvovirus B19 cf. «Mises en garde et précautions».
Effet sur l’aptitude à la conduite et l’utilisation de machines
Ceprotin n'a pas d'influence sur l'aptitude à la conduite ou à l'utilisation de machines.
Effets indésirables
Comme avec tout produit administré par voie intraveineuse, des réactions allergiques de type hypersensibilité sont possibles. Les patients doivent être informés des signes précoces de réactions d'hypersensibilité, tels que: œdème de Quincke, brûlures et démangeaisons au point d'injection, frissons, rougeurs, rash, prurit, urticaire généralisée, céphalées, urticaire, hypotension, léthargie, nausées, agitation, tachycardie, oppression thoracique, fourmillements, vomissements et respiration sifflante. Il faut recommander aux patients de contacter immédiatement leur médecin si ces symptômes apparaissent (cf. « Mise en garde et précautions »)
Au cours des études cliniques menées sur Ceprotin, un total de 3 effets indésirables (rash et prurit (classés en hypersensibilité) et étourdissement) ont été rapportés chez 1 des 67 patients enrôlés. Au total, 6'375 administrations de Ceprotin ont été effectuées. La distribution des effets indésirables relatifs est la suivante
Classes de systèmes d'organes | Effet indésirable | Terme préférentiel | Catégorie de Fréquence par perfusionsa |
Affections du Système immunitaire | Überempfindlichkeit | Rash Pruritus | Rare Rare |
Affections du système nerveux | Étourdissement | Étourdissement | Rare |
a Catégories de fréquence CIOMS: Très fréquent (>=10%), Fréquent (>=1%, <10%),
Peu fréquent (>=0,1%, <1%), Rare (>=0,01%, <0,1%), Très rare (<0,01%).
Après la mise sur le marché, les évènements suivants ont été rapportés:
Affections psychiatriques
Agitation
Affections de la peau et du tissu sous-cutané
Hyperhidrose
Troubles généraux et anomalies au site d'administration
Réaction au site de l'injection
La fréquence de ces effets indésirables est inconnue.
Pour toute information concernant la sécurité virale, cf. « Mises en garde et précautions ».
Surdosage
Aucun cas de surdosage suite à l'administration de Ceprotin n'a été rapporté à ce jour.
Propriétés/Effets
Code ATC: B01AD12 (Antithrombotique)
La protéine C est une glycoprotéine anticoagulante vitamine K-dépendante qui est synthétisée dans le foie. Elle est convertie par le complexe thrombine/thrombomoduline sur la surface endothéliale en protéine C activée (PCA). PCA est une sérine-protéase avec des effets anticoagulants particulièrement efficaces en présence de son cofacteur protéique S. PCA exerce son effet par l'inactivation des formes activées des facteurs V et VIII aboutissant à une diminution de la formation de thrombine. Il a été également montré que la PCA avait une activité profibrinolytique et anti-inflammatoire.
L'administration intraveineuse de Ceprotin entraîne une augmentation immédiate mais temporaire du taux plasmatique de la protéine C.
Le traitement substitutif par la protéine C chez les patients atteints d'un déficit en protéine C permet le contrôle ou - s'il s'agit d'un traitement prophylactique - la prévention des complications thrombotiques chez ces patients.
Les études d'efficacité avec Ceprotin ont inclus 12 patients pour un traitement prophylactique à court terme avant opération chirurgicale ou thérapie invasive et 7 patients pour un traitement prophylactique à long terme.
Dans une étude randomisée et contrôlée contre placebo, menée chez des enfants (N = 40; fourchette de ½ à 16 ans) atteints de septicémie à méningocoques et de déficit acquis en protéine C, Ceprotin s'est avéré bien toléré jusqu'à une posologie quotidienne de 600 UI/jour pendant trois jours. Il n'a pas été possible d'exclure un lien de causalité avec Ceprotin dans le seul cas d'un patient atteint de CIVD, de septicémie et d'hémorragie gastro-intestinale légère.
L'efficacité et la tolérance de Ceprotin dans le déficit acquis en protéine C ont été documentées dans d'autres rapports de cas isolés et séries de cas.
Pharmacocinétique
Les données pharmacocinétiques ont été établies sur 21 patients asymptomatiques présentant un déficit homozygote ou double hétérozygote en protéine C.
L'activité plasmatique de la protéine C a été mesurée par essai chromogénique.
Les demi-vies individuelles se sont situées entre 4,4 et 15,8 heures avec le modèle à compartiment et entre 4,9 et 14,7 heures avec le modèle sans compartiment. La récupération individuelle incrémentée variait de 0.5 à 1.76 [(UI/dL)/(UI/kg)]. Les patients différaient significativement en âge, poids corporel et volume plasmatique.
Chez les patients atteints de maladie thrombotique aiguë, l'augmentation du taux plasmatique de la protéine C ainsi que la demi-vie peuvent être considérablement réduites.
Données précliniques
La protéine C contenue dans Ceprotin est un constituant normal du plasma humain et agit comme la protéine C endogène. De ce fait, on a considéré que des études expérimentales sur l'effet cancérigène ou mutagène - en particulier chez les espèces hétérologues - n'étaient pas nécessaires.
Les études de toxicité par dose unique ont montré que même des doses égales à plusieurs fois la dose recommandée (10 fois) chez l'homme par kilogramme de poids corporel n'engendrent pas d'effets toxiques chez les animaux étudiés.
Le test d'AMES réalisé prouve que Ceprotin n'est pas mutagène.
Des études de toxicité répétées n'ont pas été réalisées. En effet, il a été démontré lors de développements précédents de facteurs de coagulation, qu'elles étaient de valeur limitée. L 'administration de protéine C humaine conduira immanquablement à une réponse immunitaire avec développement d'anticorps chez les espèces animales étudiées.
Remarques particulières
Incompatibilité
En l'absence d'études de compatibilité, Ceprotin ne doit pas être mélangé avec d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date de péremption indiquée avec la mention ''EXP''.
Remarques concernant le stockage
A conserver entre 2 °C et 8 °C et à l'abri de la lumière. Ne pas congeler.
La solution reconstituée doit être employée immédiatement.
Tenir hors de portée des enfants.
Remarques concernant la manipulation
En utilisant l'aiguille de transfert stérile, dissoudre complètement le lyophilisat avec le solvant fourni (Aqua ad iniectabilia). Agiter doucement par rotations le flacon jusqu'à dissolution complète du lyophilisat.
Après reconstitution complète, la solution est prélevée par l'intermédiaire de l'aiguille filtre stérile dans une seringue stérile à usage unique. Une aiguille filtre neuve doit être utilisée pour prélever chaque flacon de Ceprotin reconstitué. Eliminer la solution en cas de présence de particules en suspension.
La solution doit être utilisée par voie intraveineuse immédiatement après reconstitution.
Toute solution non utilisée, tout flacon vide ainsi que toute aiguille et seringue utilisées doivent être jetés de manière appropriée.
Numéro d’autorisation
56124 (Swissmedic)
Titulaire de l’autorisation
Takeda Pharma AG, 8152 Opfikon
Mise à jour de l’information
Octobre 2018
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French