Risperdal Consta Injektionssuspension 50mg Injektionskit buy online
Risperdal Consta Trockensub 50 mg mit Solvens Inj kit
-
356.83 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: JANSSEN-CILAG AG
- Product Code: 2569520
- ATC-code N05AX08
- EAN 7680560920050
Ingredients:
Natriumchlorid, Natriumhydroxid, Natrium 9.872 mg, Polyglactin (x:y), Trockensubstanz, Lösungsmittel, Carmellose natrium, Polysorbat 20, Dinatrium-hydrogenphosphat-2-Wasser, Risperidon 50 mg , Citronensäure wasserfreie.

Description
Zusammensetzung
Wirkstoffe
Risperidonum.
Hilfsstoffe
Wirkstoff-Pulver (Durchstechflasche): Poly (DL-Lactidum-co-glycolidum).
Lösung zur Suspendierung des Pulvers (Fertigspritze): Carmellosum natricum, Polysorbatum 20, Dinatrii phosphas dihydricus, Acidum citricum, Natrii chloridum, Natrii hydroxidum, Aqua ad iniectabilia q.s. ad solutionem pro 2 ml. Gesamtgehalt Natrium: 9.872 mg.
Darreichungsform und Wirkstoffmenge pro Einheit
Pulver und Lösungsmittel zur Herstellung einer Depot-Injektionssuspension in einer Fertigspritze
Risperdal Consta enthält Risperidon in Mikrosphären (Polymer-Kügelchen), welche das darin eingebettete Risperidon verzögert freisetzen.
Wirkstoff-Pulver zur Herstellung der Injektionssuspension (Durchstechflasche): Praeparatio sicca zu 25 mg, 37,5 mg oder 50 mg Risperidon.
Lösungsmittel zur Suspendierung des Pulvers (Fertigspritze): 2 ml.
Indikationen/Anwendungsmöglichkeiten
Erhaltungstherapie für psychotische Krankheiten aus dem Formenkreis der Schizophrenie nach Einleitung der Behandlung mit nicht retardierten Neuroleptika.
Dosierung/Anwendung
Übliche Dosierung
Erwachsene
Die empfohlene Dosierung beträgt 25 mg intramuskulär jede zweite Woche. Einige Patienten können von höheren Dosen von 37,5 mg oder 50 mg profitieren. 75 mg zeigten in klinischen Studien keinen zusätzlichen Nutzen, und zudem war eine leicht höhere Inzidenz an extrapyramidalen Nebenwirkungen zu beobachten. Höhere Dosen als 50 mg jede zweite Woche werden nicht empfohlen.
Achtung: Nach der 1. Injektion von Risperdal Consta kann ein klinisch wirksamer Effekt nicht sofort, sondern erst nach einer Latenzzeit von drei oder sogar vier Wochen erwartet werden. Daher muss zunächst in diesem Zeitraum für eine ausreichende Substitution mit anderen Antipsychotika gesorgt werden, oder falls möglich, Risperdal in oraler Form verabreicht werden. Bei Patienten, welche mit Depot-Neuroleptika behandelt werden, kann es angezeigt sein, vor dem Wechsel zu Risperdal Consta zunächst vorübergehend auf eine orale Behandlung umzustellen (wenn klinisch möglich).
Eine Dosiserhöhung darf nicht öfters als alle 4 Wochen erfolgen, da der Effekt nicht früher als 3 Wochen nach der ersten Injektion mit der höheren Dosis erwartet werden kann.
Spezielle Dosierungsanweisungen
Patienten mit Leber- und Nierenfunktionsstörungen
Der Einsatz von Risperdal Consta bei Patienten mit Leber- und Nierenerkrankungen wurde nicht untersucht.
Benötigt ein Patient mit einer Leber- oder Nierenerkrankung eine Behandlung mit Risperdal Consta, so wird empfohlen, während der ersten Woche eine Anfangsdosis von 0,5 mg Risperidon oral 2× täglich einzunehmen (als Tablette oder Lösung). In der 2. Woche kann die Tagesdosis auf 1 mg 2× täglich oder 2 mg 1× täglich erhöht werden. Wird eine orale Dosis von mindestens 2 mg gut vertragen, so kann eine Injektion von 25 mg Risperdal Consta alle 2 Wochen verabreicht werden.
Ältere Patienten
Die empfohlene Dosierung ist 25 mg intramuskulär jede zweite Woche. Nach der 1. Injektion von Risperdal Consta muss für die drei folgenden Wochen (Lag-Phase) für eine ausreichende Substitution mit anderen oralen Antipsychotika gesorgt werden (s. «Pharmakokinetik»).
Ältere Patienten mit psychotischen Symptomen im Rahmen einer dementiellen Erkrankung hatten unter der Behandlung mit atypischen Antipsychotika ein erhöhtes Mortalitätsrisiko. Risperdal Consta ist nicht zugelassen für die Behandlung von Patienten mit psychotischen Symptomen im Rahmen einer Demenzerkrankung.
Kinder und Jugendliche
Bei Kindern und Jugendlichen unter 18 Jahren liegen noch keine Erfahrungen vor.
Verabreichungsschema
Bei Patienten, die noch nie Risperidon erhalten haben, wird empfohlen vor dem Behandlungsbeginn mit Risperdal Consta die Verträglichkeit mit oralem Risperidon zu testen.
Art der Anwendung
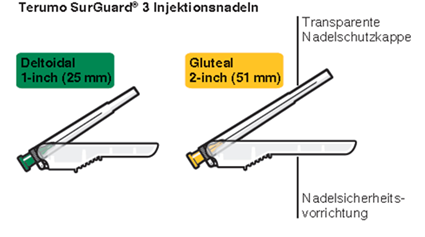
Risperdal Consta muss alle zwei Wochen durch tiefe intramuskuläre deltoide oder gluteale Injektion verabreicht werden. Dazu ist die adäquate Sicherheits-Injektionsnadel zu verwenden. Für die deltoide Injektion ist die 1-Inch-Nadel (25 mm) zu verwenden, wobei bei den Injektionen jeweils zwischen den beiden Armen abgewechselt werden sollte. Für die gluteale Injektion ist die 2-Inch-Nadel (51 mm) einzusetzen, wobei die Injektion alternierend jeweils in eine der Gesässbacken erfolgen sollte. Risperdal Consta darf nicht intravenös verabreicht werden (siehe «Warnhinweise und Vorsichtsmassnahmen», Abschnitt «Verabreichung»). Zubereitung und Verabreichung der Suspension siehe «Sonstige Hinweise»: «Hinweise für die Handhabung».
Kontraindikationen
Bekannte Überempfindlichkeit gegenüber Risperidonum oder andere Bestandteile des Arzneimittels.
Demente Patienten mit Parkinsonsymptomen im Sinne von Rigor, Bradykinese und parkinson'schen Haltungsstörungen.
Demente Patienten mit der wahrscheinlichen Diagnose einer Lewykörper-Demenz (neben den Symptomen einer Demenz mindestens zwei der folgenden drei Symptome: Parkinsonismus/visuelle Halluzinationen/Fluktuation im Verlauf).
Warnhinweise und Vorsichtsmassnahmen
Bei Patienten, die zuvor nie mit Risperidon behandelt wurden, wird empfohlen vor dem Einsatz von Risperdal Consta die Verträglichkeit mittels der oralen Form von Risperidon abzuklären.
Kinder und Jugendliche
Da bisher keine Erfahrungen vorliegen, darf Risperdal Consta Kindern und Jugendlichen unter 18 Jahren nicht verabreicht werden.
Ältere Patienten mit Demenz
Erhöhte Gesamtmortalität
Eine Meta-Analyse von 17 kontrollierten Studien mit atypischen Antipsychotika, Risperdal einschliessend, zeigte bei älteren, mit Antipsychotika behandelten Demenzpatienten eine im Vergleich zu Plazebo erhöhte Mortalität. Bei dieser Population betrug in plazebo-kontrollierten Studien mit oralem Risperdal die Mortalitätsrate 4,0% bei mit Risperdal behandelten Patienten und 3,1% bei der Plazebogruppe. Das mittlere Alter der verstorbenen Patienten betrug 86 Jahre (Altersspanne 67–100 Jahre).
Ein spezifisches Risikofaktorenprofil für die erhöhte Mortalität unter Risperdal ist nicht erkennbar. Vielmehr fanden sich Todesursachen, die in der Altersgruppe >65 Jahre typischerweise zu beobachten sind: kardiovaskuläre und zerebrovaskuläre Ereignisse, Tumore, Infektionen (z.B. Pneumonie) und Diabetes.
Erhöhte Mortalität bei gleichzeitiger Einnahme von Furosemid:
In plazebo-kontrollierten Studien bei älteren Patienten mit Demenz wurde bei der gleichzeitigen Behandlung mit Risperidon und Furosemid eine höhere Mortalitätsrate beobachtet (7.3%; mittleres Alter 89, Altersspanne 75–97 Jahre) als bei der alleinigen Behandlung mit Risperidon (3.1%; mittleres Alter 84, Altersspanne 70–96) oder Furosemid (4.1%; mittleres Alter 80, Altersspanne 67–90 Jahre). Die Erhöhung der Mortalitätsrate bei Patienten, die mit Risperidon plus Furosemid behandelt wurden, wurde in zwei von vier klinischen Studien beobachtet. Bei Patienten, die andere Diuretika als Begleitmedikation zu Risperidon einnahmen, wurde keine erhöhte Mortalitätsrate gefunden.
Es konnte kein eindeutiger pathophysiologischer Mechanismus zur Erklärung dieses Ergebnisses identifiziert werden. Auch war die Todesursache nicht einheitlich. Trotzdem sollte Vorsicht geübt und das Nutzen-Risiko-Verhältnis dieser Kombination oder der gleichzeitigen Behandlung mit anderen potenten Diuretika vor dem Gebrauch abgewogen werden.
Unabhängig von der Behandlung war Dehydratation ein allgemeiner Risikofaktor für die Mortalität und sollte daher bei älteren Demenzpatienten sorgfältig vermieden werden.
Vermehrte zerebrovaskuläre Ereignisse
In plazebo-kontrollierten Studien bei älteren Patienten mit Demenz war die Inzidenz von zerebrovaskulären Ereignissen (Insult und transitorischen ischämischen Attacken [TIA]), einschliesslich tödlichem Ausgang, bei den mit oralem Risperdal behandelten Patienten signifikant höher als im Vergleich zu den Patienten, die Placebo erhielten (mittleres Alter 85 Jahre; Altersspanne 73–97 Jahre).
Orthostatische Hypotonie
Die α1-lytische Wirkung von Risperidon kann vor allem während der anfänglichen Dosisanpassung zu (orthostatischer) Hypotonie führen. Vorsicht ist geboten bei Patienten mit bekannten Herz-Kreislauf-Krankheiten (z.B. Herzinsuffizienz, Myokardinfarkt, Überleitungsstörungen, Dehydratation, Hypovolämie oder zerebrovaskuläre Krankheiten) (s. «Unerwünschte Wirkungen»). Bei akut instabilen kardiovaskulären Situationen (wie z.B. bei akutem Myokardinfarkt) wird die Gabe von Risperdal Consta nicht empfohlen.
Bei einer persistierenden klinisch relevanten orthostatischen Hypotonie ist der Nutzen gegenüber dem Risiko der weiteren Behandlung mit Risperdal Consta abzuwägen.
Verlängerung des QT-Intervalls
In klinischen Studien wurde Risperidon nicht mit einer Verlängerung des QTc-Intervalls in Verbindung gebracht. Von QT-Verlängerung wurde sehr selten in der Postmarketing-Phase berichtet. Wie bei anderen Antipsychotika ist bei der Verschreibung von Risperidon bei Patienten mit bekannter kardiovaskulärer Erkrankung und/oder Bradykardie, Elektrolytstörungen (Hypokaliämie, Hypomagnesiämie) oder einer QT-Verlängerung in der Familienanamnese Vorsicht geboten. In Kombination mit anderen Arzneimitteln, die das QT-Intervall verlängern, ist ebenfalls Vorsicht geboten (s. «Interaktionen»).
Leukopenie, Neutropenie und Agranulozytose
Fälle von Leukopenie, Neutropenie und Agranulozytose sind unter der Anwendung von Antipsychotika (einschliesslich Risperdal Consta) in klinischen Studien und/oder seit Markteinführung berichtet worden. Agranulozytose wurde sehr selten (<1/10'000 Patienten) nach der Markteinführung beobachtet.
Patienten mit einer klinisch signifikanten Verminderung der Anzahl weisser Blutkörperchen in der Anamnese oder mit einer Arzneimittel induzierten Leukopenie/Neutropenie sollten während der ersten Monate der Therapie überwacht werden und das Abrechen der Therapie mit Risperdal Consta sollte beim ersten Anzeichen eines signifikanten Absinkens der weissen Blutkörperchen im Falle eines Fehlens anderer kausaler Faktoren erwogen werden.
Patienten mit klinisch signifikanter Neutropenie sollten sorgfältig hinsichtlich Fieber oder anderen Symptomen oder Anzeichen einer Infektion überwacht und sollten sofort behandelt werden, wenn solche Symptome oder Zeichen auftreten. Patienten mit ausgeprägter Neutropenie (absolute Neutrophilenzahl <1× 109/l) sollten die Therapie mit Risperdal Consta abbrechen und die weissen Blutkörperchen sollten bis zur Genesung überwacht werden.
Venöse Thromboembolie
Im Zusammenhang mit der Anwendung von Antipsychotika sind Fälle von venösen Thromboembolien (VTE) berichtet worden. Da Patienten, die mit Antipsychotika behandelt werden, häufig erworbene Risikofaktoren für VTE aufweisen, sollten alle möglichen Risikofaktoren für VTE vor und während der Behandlung mit Risperdal Consta identifiziert und Präventivmassnahmen ergriffen werden.
Tardive Dyskinesien/Extrapyramidale Symptome (EPS)
Arzneimittel mit antidopaminergen Eigenschaften wurden mit der Induktion von tardiver Dyskinesie in Zusammenhang gebracht, was sich durch rhythmische, unwillkürliche Bewegungen, v.a. der Zunge und/oder des Gesichtes äussern kann. Das Auftreten extrapyramidaler Symptome ist ein Risikofaktor für tardive Dyskinesien. Treten Zeichen und Symptome von tardiver Dyskinesie auf, soll das Absetzen aller Antipsychotika erwogen werden.
Extrapyramidale Symptome und Psychostimulanzien – Bei Patienten, die gleichzeitig sowohl Psychostimulanzien (z.B. Methylphenidat) als auch Risperidon erhalten, ist Vorsicht geboten, da bei der Anpassung eines Arzneimittels oder beider Arzneimittel extrapyramidale Symptome auftreten könnten. Es sollte ein Ausschleichen einer der Behandlungen oder beider Behandlungen erwogen werden (siehe «Interaktionen»).
Parkinson-Krankheit und Demenz mit Lewy-Körperchen
Vorsicht ist geboten, wenn Risperdal bei Patienten mit einer Parkinson-Krankheit oder Demenz mit Lewy-Körperchen verschrieben wird. Risperdal kann eine Verschlechterung der Parkinson-Krankheit bewirken. Beide Gruppen können ein erhöhtes Risiko für ein malignes neuroleptisches Syndrom und erhöhte Empfindlichkeit gegenüber Antipsychotika (z.B. Verwirrtheit, Affektabstumpfung, Gleichgewichtsstörung mit häufigen Stürzen, zusätzlich zu extrapyramidalen Symptomen) aufweisen.
Malignes neuroleptisches Syndrom
Unter Antipsychotika kommt es in seltenen Fällen zum malignen neuroleptischen Syndrom, das sich in Hyperthermie, Muskelrigidität, autonomer Instabilität, Bewusstseinsveränderungen und erhöhten Serum-Creatinphosphokinase-Spiegeln äussert. Zusätzliche Symptome können Myoglobinurie (Rhabdomyolyse) und akutes Nierenversagen sein. In diesem Fall sollten sämtliche antipsychotischen Arzneimittel einschliesslich Risperdal Consta abgesetzt werden. Nach der letzten Verabreichung von Risperdal Consta sind noch mindestens 6 Wochen Risperidon-Plasmaspiegel nachweisbar.
Überempfindlichkeitsreaktionen
Obwohl die Verträglichkeit von oral verabreichtem Risperidon vor Beginn der Behandlung mit Risperdal Consta abgeklärt werden sollte, sind während der Anwendungsbeobachtung nach der Markteinführung in sehr seltenen Fällen bei Patienten, die oral verabreichtes Risperidon zuvor toleriert hatten, anaphylaktische Reaktionen aufgetreten (siehe «Dosierung/Anwendung» und «Unerwünschte Wirkungen»). Zu Anaphylaxie-Symptomen zählen Hautausschlag, Nesselausschlag, peripheres Ödem, geschwollene Augen, geschwollene Zunge, geschwollenes Gesicht, starkes Schwitzen (Hyperhidrose), Atemnot und Blutdruckabfall (Hypotonie).
Patienten mit Überempfindlichkeit auf orales Risperidon, Paliperidon oder einen der sonstigen Bestandteile der Formulierung oder des Behältnisses sollten nicht mit Risperdal Consta behandelt werden (siehe «Kontraindikationen»).
Beim Auftreten von Überempfindlichkeitsreaktionen ist die Anwendung von Risperdal Consta zu beenden; allgemeine unterstützende Massnahmen je nach klinischer Indikation sind einzuleiten und der Patienten ist zu überwachen, bis die Anzeichen und Symptome abgeklungen sind (siehe «Kontraindikationen» und «Unerwünschte Wirkungen»).
Hyperglykämie und Diabetes mellitus
Während der Behandlung mit Risperdal Consta wurde über Hyperglykämie, Diabetes mellitus und Exazerbation eines vorbestehenden Diabetes berichtet. Die Beurteilung des Zusammenhanges zwischen der Anwendung atypischer Antipsychotika und Glukoseanomalien wird durch die Möglichkeit eines erhöhten Grundrisikos für Diabetes mellitus bei Schizophreniepatienten und die steigende Inzidenz von Diabetes mellitus in der Gesamtpopulation erschwert. Angesichts dieser Einflussfaktoren ist der Zusammenhang zwischen dem Einsatz atypischer Antipsychotika und unerwünschten Wirkungen, die mit Hyperglykämie zusammenhängen, nicht vollständig verstanden. Epidemiologische Studien deuten jedoch auf ein erhöhtes Risiko für ein Auftreten Hyperglykämie-bedingter unerwünschter Wirkungen bei Patienten unter Therapie mit atypischen Antipsychotika hin. Jeder Patient, der mit atypischen Antipsychotika, einschliesslich Risperdal Consta, behandelt wird, sollte bezüglich Symptomen einer Hyperglykämie und eines Diabetes mellitus überwacht werden.
Gewichtszunahme
Bei der Anwendung von Risperdal Consta ist von signifikanter Gewichtszunahme berichtet worden. Die regelmässige Beobachtung des Gewichtes ist daher empfehlenswert.
Priapismus
Berichten zufolge können eine α-adrenerge Blockade bewirkende Arzneimittel Priapismus hervorrufen. Von Priapismus wurde bei Risperdal nach der Markteinführung berichtet (s. Rubrik «Unerwünschte Wirkungen»).
Regulation der Körpertemperatur
Antipsychotika können die Fähigkeit des Körpers zur Senkung der Körperkerntemperatur beeinträchtigen. Vorsicht ist daher geboten, wenn Risperdal Consta Patienten verordnet wird, die Situationen ausgesetzt sind, die einen Anstieg der Körperkerntemperatur (z.B. anstrengende körperliche Aktivität, Exposition gegenüber extremer Wärme, gleichzeitige Anwendung von Arzneimitteln mit anticholinerger Wirkung oder Dehydrierung) ausgesetzt sind.
Antiemetische Wirkung
In präklinischen Versuchen mit Risperdon wurde eine antiemetische Wirkung verzeichnet. Falls diese Wirkung beim Menschen auftritt, könnte sie Zeichen und Symptome einer Überdosierung bestimmter Substanzen oder von Erkrankungen wie intestinaler Obstruktion, Reye-Syndrom und Gehirntumor maskieren.
Epileptische Anfälle
Wie alle Antipsychotika sollte auch Risperdal Consta bei Patienten mit anamnestisch bekannten epileptischen Anfällen oder anderen Zuständen, welche mit einer Senkung der Anfallsschwelle einhergehen können, vorsichtig angewendet werden.
Intraoperatives Floppy-Iris Syndrom
Bei Kataraktoperationen an Patienten unter Behandlung mit Arzneimitteln mit alpha1a-adrenerger antagonistischer Wirkung, einschliesslich Risperdal Consta, wurden Fälle von intraoperativem Floppy-Iris-Syndrom (IFIS) beobachtet.
Das IFIS kann das Risiko für Komplikationen am Auge während und nach der Operation erhöhen. Vor der Operation sollte dem Ophthalmochirurgen eine aktuelle oder vorangegangene Anwendung von Arzneimitteln mit alpha1a-adrenerger antagonistischer Wirkung mitgeteilt werden. Der mögliche Nutzen des Absetzens der Therapie mit Alpha1-Antagonisten vor der Kataraktoperation wurde nicht untersucht und ist gegenüber dem Risiko einer Unterbrechung der antipsychotischen Therapie abzuwägen.
Prolaktin-abhängige Tumoren
Risperdal Consta darf nur unter besonderer Vorsicht angewendet werden bei gleichzeitigem Vorliegen von Prolaktin-abhängigen Tumoren z.B. Prolaktinomen der Hypophyse und möglicherweise Prolaktin-abhängigen Tumoren, z.B. epithelialen Mamma-Tumoren.
Verabreichung
Es muss sorgfältig darauf geachtet werden, dass Risperdal Consta nicht versehentlich in ein Blutgefäss injiziert wird (siehe «Unerwünschte Wirkungen – Okklusion der retinalen Arterie»).
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Injektion, d.h. es ist nahezu «natriumfrei».
Interaktionen
Die Interaktionen von Risperdal Consta bei gleichzeitiger Anwendung anderer Arzneimittel wurden nicht systematisch untersucht. Die in dieser Rubrik beschriebenen Interaktionen basieren auf Studien mit oralem Risperidon.
Pharmakokinetische Interaktionen
Risperidon wird hauptsächlich durch CYP2D6 und in geringerem Umfang durch CYP3A4 metabolisiert. Sowohl Risperidon als auch sein aktiver Metabolit 9-Hydroxyrisperidon sind Substrate von P-Glykoprotein (P-gp). Modifikatoren der CYP2D6-Aktivität oder starke Hemmer oder Induktoren der Aktivität von CYP3A4 und/oder P-gp können sich auf die Pharmakokinetik der aktiven antipsychotischen Fraktion von Risperidon auswirken.
Pharmakodynamische Interaktionen
Zentral wirkende Arzneimittel und Alkohol
In Anbetracht der primären ZNS-Wirkungen von Risperdal sollte eine kombinierte Anwendung mit anderen zentral wirkenden Arzneimitteln oder Alkohol mit Vorsicht erfolgen.
Levodopa und Dopamin-Agonisten
Risperidon kann die Wirkung von Levodopa und anderen Dopamin-Agonisten vermindern. Wenn diese Kombination als notwendig erachtet wird, insbesondere im Endstadium der Parkinson-Krankheit, soll die niedrigste effektive Dosis bei jeder Behandlung verordnet werden.
Psychostimulanzien
Die Anwendung von Psychostimulanzien (z.B. Methylphenidat) in Kombination mit Risperidon kann bei Veränderung einer Behandlung oder beider Behandlungen zum Auftreten extrapyramidaler Symptome führen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Arzneimittel mit hypotensiver Wirkung
Nach der Markteinführung wurde bei gleichzeitiger Anwendung von Risperidon und Antihypertensiva klinisch signifikante Hypotonie beobachtet.
Arzneimittel mit bekannter QT-verlängernder Wirkung
Bei Verschreibung von Risperdal Consta mit Arzneimitteln, die bekanntermassen das QT-Intervall verlängern, ist Vorsicht angezeigt.
Enzyminduktoren
CYP3A4- und/oder P-gp-Induktoren
Bei gemeinsamer Anwendung von Risperdal Consta und einem starken CYP3A4- und/oder P-gp-Induktor kann sich die Plasmakonzentration der aktiven antipsychotischen Fraktion von Risperidon verringern. Bei Einleitung oder Beendigung der Begleitanwendung von Carbamazepin oder eines anderen starken CYP3A4- und/oder P-gp-Induktors sollte die Dosierung von Risperdal Consta vom Arzt neu beurteilt werden.
Enzyminhibitoren
Starke CYP2D6-Inhibitoren
Bei gemeinsamer Anwendung von Risperdal Consta und einem starken CYP2D6-Inhibitor kann sich die Plasmakonzentration von Risperidon erhöhen, die aktive antipsychotische Fraktion ist diesbezüglich jedoch weniger stark betroffen. Starke CYP2D6-Inhibitoren in höheren Dosen können die Konzentration der aktiven antipsychotischen Fraktion von Risperidon erhöhen (z.B. Paroxetin, siehe nachstehend). Bei Einleitung oder Beendigung der Begleitanwendung von Paroxetin, Bupropion, oder eines anderen starken CYP2D6-Inhibitors, vor allem in höheren Dosen, sollte die Dosierung von Risperdal Consta vom Arzt neu beurteilt werden.
CYP3A4- und/oder P-gp-Inhibitoren
Bei gemeinsamer Anwendung von Risperdal Consta und einem starken CYP3A4- und/oder P‑gp-Inhibitor kann sich die Plasmakonzentration der aktiven antipsychotischen Fraktion von Risperidon erheblich erhöhen. Bei Einleitung oder Beendigung der Begleitanwendung von Itraconazol oder eines anderen starken CYP3A4- und/oder P-gp-Inhibitors sollte die Dosierung von Risperdal Consta vom Arzt neu beurteilt werden.
Andere Interaktionen
Stark proteingebundene Substanzen
Bei gemeinsamer Anwendung von Risperdal Consta und Arzneistoffen, die in hohem Mass proteingebunden sind, findet bei keinem der Wirkstoffe eine klinisch bedeutsame Verdrängung von den Plasmaproteinen statt.
Bei Anwendung von Begleitmedikamenten sind die Angaben zur Art der Metabolisierung und zur etwaigen Notwendigkeit einer Dosisanpassung in der jeweiligen Arzneimittelinformation zu beachten.
Pädiatrische Patienten
Interaktionsstudien wurden nur bei Erwachsenen durchgeführt. Die Relevanz der Ergebnisse dieser Studien für pädiatrische Patienten ist nicht bekannt.
Beispiele
Nachstehend sind Beispiele für Arzneimittel aufgeführt, die potentiell mit Risperidon interagieren bzw. nachweislich nicht mit Risperidon interagieren:
Wirkung von Risperdal Consta auf andere Arzneimittel
Antikonvulsiva:
- Risperidon hat keinen klinisch bedeutsamen Einfluss auf die Pharmakokinetik von Valproat oder Topiramat.
Lithium:
- Risperidon hat keinen klinisch bedeutsamen Einfluss auf die Pharmakokinetik von Lithium.
Wirkung anderer Arzneimittel auf Risperdal Consta
Antibakterielle Substanzen:
- Erythromycin, ein mässiger CYP3A4-Inhibitor, bewirkt keine Veränderung der Pharmakokinetik von Risperidon und der aktiven antipsychotischen Fraktion.
- Rifampicin, ein starker CYP3A4-Induktor und P-gp-Induktor, verringert die Plasmakonzentration der aktiven antipsychotischen Fraktion.
Anticholinesterasen:
- Die Cholinesterase-Inhibitoren Galantamin und Donepezil, die beide Substrate von CYP2D6 und CYP3A4 sind, haben keinen klinisch bedeutsamen Einfluss auf die Pharmakokinetik von Risperidon und der aktiven antipsychotischen Fraktion.
Antikonvulsiva:
- Carbamazepine ein starker CYP3A4-Induktor und P-gp-Induktor, verringert die Plasmakonzentration der aktiven antipsychotischen Fraktion von Risperidon.
- Topiramat hat eine mässige Verringerung der Bioverfügbarkeit von Risperidon zur Folge, aber keinen Einfluss auf die Bioverfügbarkeit der aktiven antipsychotischen Fraktion. Diese Interaktion ist daher wahrscheinlich nicht klinisch bedeutsam.
Antimykotika:
- Itraconazol, ein starker CYP3A4-Inhibitor und P-gp-Inhibitor, erhöhte in der Dosierung von 200 mg/Tag und bei Risperidon-Dosen von 2 bis 8 mg/Tag die Plasmakonzentration der aktiven antipsychotischen Fraktion um etwa 70%.
- Ketoconazol, ein starker CYP3A4-Inhibitor und P-gp-Inhibitor, erhöhte in der Dosierung von 200 mg/Tag die Plasmakonzentration von Risperidon und verringerte die Plasmakonzentration von 9-Hydroxyrisperidon.
Antipsychotika:
- Phenothiazine können zu einer Erhöhung der Plasmakonzentration von Risperidon führen, haben aber keinen Einfluss auf die Plasmakonzentration der aktiven antipsychotischen Fraktion.
- Für Aripiprazol, ein Substrat von CYP2D6 und CYP3A4, besteht keine ausreichende klinische Evidenz um einen möglichen Effekt von Risperdal auf die Pharmakokinetik von Aripiprazol und seinem aktiven Metaboliten Dehydroaripiprazol beurteilen zu können.
Virostatika:
- Proteaseinhibitoren: Es sind keine formalen Studiendaten verfügbar. Da Ritonavir aber ein starker CYP3A4-Inhibitor und ein schwacher CYP2D6-Inhibitor ist, besteht bei Ritonavir und Ritonavir-geboosteten Proteaseinhibitoren die Möglichkeit einer Erhöhung der Konzentration der aktiven antipsychotischen Fraktion von Risperidon.
Betablocker:
- Einige Betablocker können zu einer Erhöhung der Plasmakonzentration von Risperidon führen, haben aber keinen Einfluss auf die Plasmakonzentration der aktiven antipsychotischen Fraktion.
Kalziumkanalblocker:
- Verapamil, ein mässiger Inhibitor von CYP3A4 und Inhibitor von P-gp, erhöht die Plasmakonzentration von Risperidon und der aktiven antipsychotischen Fraktion.
Digitalis-Glykoside:
- Risperidon hat keinen klinisch bedeutsamen Einfluss auf die Pharmakokinetik von Digoxin.
Diuretika:
- Furosemid: Es sind die Angaben im Abschnitt Warnhinweise und Vorsichtsmassnahmen in Bezug auf die erhöhte Sterblichkeit bei älteren Patienten mit Demenz, die eine Begleitbehandlung mit Furosemid erhalten, zu beachten.
Gastrointestinale Arzneimittel:
- H2-Rezeptor-Antagonisten: Cimetidin und Ranitidin, die beide schwache Inhibitoren von CYP2D6 und CYP3A4 sind, erhöhten die Bioverfügbarkeit von Risperidon, die der aktiven antipsychotischen Fraktion jedoch nur marginal.
SSRI und trizyklische Antidepressiva:
- Fluoxetin, ein starker CYP2D6-Inhibitor, erhöht die Plasmakonzentration von Risperidon, die aktive antipsychotische Fraktion ist diesbezüglich jedoch weniger stark betroffen.
- Paroxetin, ein starker CYP2D6-Inhibitor, erhöht die Plasmakonzentration von Risperidon, bei Dosierungen bis zu 20 mg/Tag ist die aktive antipsychotische Fraktion diesbezüglich jedoch weniger stark betroffen. Bei höheren Paroxetin-Dosen kann sich die Konzentration der aktiven antipsychotischen Fraktion von Risperidon jedoch in einer dosisabhängigen Weise erhöhen.
- Trizyklische Antidepressiva können zu einer Erhöhung der Plasmakonzentration von Risperidon führen, haben aber keinen Einfluss auf die Plasmakonzentration der aktiven antipsychotischen Fraktion. Amitriptylin hat keinen Einfluss auf die Pharmakokinetik von Risperidon oder der aktiven antipsychotischen Fraktion.
- Sertralin, ein schwacher Inhibitor von CYP2D6, und Fluvoxamin, ein schwacher Inhibitor von CYP3A4, bewirken bei Dosierungen bis zu 100 mg/Tag keine klinisch signifikanten Veränderungen der Konzentration der aktiven antipsychotischen Fraktion von Risperidon. Bei Sertralin- oder Fluvoxamindosen über 100 mg/Tag kann sich die Konzentration der aktiven antipsychotischen Fraktion von Risperidon jedoch erhöhen.
Schwangerschaft/Stillzeit
Schwangerschaft
Die Sicherheit von Risperidon bei Anwendung während einer Schwangerschaft wurde nicht untersucht.
Eine retrospektive observative Kohortenstudie auf der Grundlage einer US-Datenbank mit abgerechneten Gesundheitsversorgungsleistungen verglich das Risiko angeborener Fehlbildungen bei Lebendgeburten zwischen Frauen mit und solchen ohne Anwendung von Antipsychotika im ersten Schwangerschaftstrimenon. Das Risiko angeborener Fehlbildungen bei Anwendung von Risperidon war nach Anpassung im Hinblick auf Störvariablen in der Datenbank gegenüber der Nichtanwendung von Antipsychotika erhöht (relatives Risiko = 1,26, 95%-KI: 1,02-1,56). Es wurde kein biologischer Mechanismus identifiziert, der diese Feststellung erklären konnte, und in präklinischen Studien wurden keine teratogenen Wirkungen beobachtet. Auf der Grundlage der Ergebnisse dieser observativen Einzelstudie wurde kein Kausalzusammenhang zwischen der Risperidonexposition in utero und den angeborenen Fehlbildungen erkannt.
Risperidon zeigte in tierexperimentellen Studien zwar keine direkte Reproduktionstoxizität, es wurden aber einige indirekte Prolaktin- und ZNS-vermittelte Wirkungen beobachtet (s. Rubrik «Präklinische Daten»).
Risperdal Consta darf nicht während der Schwangerschaft angewendet werden, es sei denn, es ist absolut erforderlich. Ist während der Schwangerschaft ein Absetzen der Behandlung erforderlich, so soll dies nicht abrupt geschehen.
Drittes Trimenon
Bei Neugeborenen, deren Mütter während des dritten Trimesters der Schwangerschaft Antipsychotika (einschliesslich Risperidon) einnahmen, besteht nach der Geburt das Risiko für extrapyramidale und/oder Entzugssymptome. Diese Symptome bei Neugeborenen können Agitation, ungewöhnlich erhöhten oder verminderten Muskeltonus, Tremor, Schläfrigkeit, Schwierigkeiten beim Atmen oder Probleme beim Füttern einschliessen. Diese Komplikationen können einen unterschiedlichen Schweregrad aufweisen. Bei einigen Fällen waren sie selbst limitierend, in anderen Fällen benötigten die Neugeborenen eine Überwachung auf der Intensivstation oder eine längere Hospitalisation.
Stillzeit
In tierexperimentellen Studien wurden Risperidon und 9-Hydroxy-Risperidon mit der Milch ausgeschieden. Es wurde auch gezeigt, dass Risperidon und 9-Hydroxy-Risperidon in die Muttermilch des Menschen übergeht. In einem Einzelfall wurde gemessen, dass 4,3% der aktiven antipsychotischen Fraktion (Bezug mütterliche Dosis) in der Muttermilch erscheinen. Deshalb sollten Mütter, die mit Risperidon behandelt werden, nicht stillen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Risperdal Consta kann sich nachteilig auf Tätigkeiten auswirken, die Konzentration und geistige Wachsamkeit erfordern. Den Patienten ist deshalb nahezulegen, keine Fahrzeuge zu lenken und komplizierte Maschinen zu bedienen, bis ihre individuelle Reaktionsfähigkeit abgeklärt ist und der behandelnde Arzt die entsprechende Einschätzung mit dem Patienten besprochen und erläutert hat.
Unerwünschte Wirkungen
Die am häufigsten berichteten Nebenwirkungen (Häufigkeit ≥1/10) sind: Schlaflosigkeit, Angst, Kopfschmerz, Infektion der oberen Atemwege, Parkinsonismus und Depression.
Paliperidon ist der aktive Metabolit von Risperidon. Daher sind die Nebenwirkungsprofile beider Substanzen (ihre oralen und die injizierbaren Formulierungen einschliessend) von gegenseitiger Relevanz. Nachstehend findet sich eine vollständige Auflistung der in klinischen Studien und nach Markteinführung berichteten Nebenwirkungen mit Risperidon und/oder Paliperidon. Hierbei werden die folgenden Begriffe und Häufigkeiten verwendet: sehr häufig (≥1/10), häufig (≥1/100 bis <1/10), gelegentlich (≥1/1000 bis <1/100), selten (≥1/10'000 bis <1/1000) sehr selten (<1/10'000) sowie nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Nebenwirkungen nach Systemorganklasse und Häufigkeit:
Infektionen und parasitäre Erkrankungen
Sehr häufig: Infektionen der oberen Atemwege.
Häufig: Pneumonie, Bronchitis, Sinusitis, Harnwegsinfektion, Influenza.
Gelegentlich: Infektion der Atemwege, Cystitis, Infektion des Ohres, Augeninfektion, Tonsillitis, Onychomykosis, Cellulitis, Infektion, lokalisierte Infektion, virale Infektion, Acarodermatitis, subkutaner Abszess.
Erkrankungen des Blutes und des Lymphsystems
Häufig: Anämie.
Gelegentlich: Abnahme der Anzahl weisser Blutkörperchen, Thrombozytopenie, Abnahme des Hämatokrits.
Selten: Neutropenie.
Nicht bekannt: Agranulozytose, Abnahme der Anzahl eosinophiler Granulozyten.
Erkrankungen des Immunsystems
Gelegentlich: Hypersensitivität.
Nicht bekannt: anaphylaktische Reaktion.
Endokrine Erkrankungen
Häufig: Hyperprolaktinämiea.
Selten: inadäquate Sekretion des antidiuretischen Hormons.
Stoffwechsel- und Ernährungsstörungen
Häufig: Hyperglykämie, Gewichtszunahme, verstärkter Appetit, Gewichtsabnahme, verminderter Appetit.
Gelegentlich: Diabetes mellitusb, Anorexie, Triglyceride erhöht, Cholesterin erhöht, Glukosurie.
Selten: Hypoglykämie, Polydipsie.
Sehr selten: diabetische Ketoazidose.
Nicht bekannt: Wasser-Intoxikation, Hyperinsulinämie, diabetisches Koma.
Psychiatrische Erkrankungen
Sehr häufig: Schlaflosigkeitc, Depression, Angst.
Häufig: Schlafstörung, Agitation, verminderte Libido.
Gelegentlich: Manie, Verwirrung, Anorgasmie, Albträume.
Selten: Katatonie, Somnambulismus, abgestumpfter Affekt.
Nicht bekannt: Schlafbezogene Essstörung (unkontrollierte Essenseinnahme beim Schlafwandeln).
Erkrankungen des Nervensystems
Sehr häufig: Parkinsonismusc, Kopfschmerz.
Häufig: Akathisiec, Somnolenz, Dystoniec Schwindel, Dyskinesiec, Tremor.
Gelegentlich: Zerebrovaskuläre Ischämie, Bewusstseinsverlust, Konvulsionenc, Synkope, tardive Dyskinesia, psychomotorische Hyperaktivität, Gleichgewichtsstörung, Haltungsschwindel, Störung der Aufmerksamkeit, Dysarthrie, Störung der Geschmacksempfindung, Hypästhesie, Parästhesie.
Selten: malignes neuroleptisches Syndrom, Verminderung des Bewusstseinsgrades, Kopfzittern.
Nicht bekannt: Fehlende Stimulusresponse.
Augenerkrankungen
Häufig: Verschwommensehen.
Gelegentlich: Konjunktivitis, trockenes Auge, Tränensekretion verstärkt, okuläre Hyperämie.
Selten: Störung der Augenbewegung, Augenrollen, Photophobie.
Nicht bekannt: Okklusion der retinalen Arterie, Glaukom, Verkrustung des Augenlidrandes, Floppy-Iris Syndrom (intraoperativ).
Erkrankungen des Ohrs und des Labyrinths
Gelegentlich: Vertigo, Tinnitus, Ohrenschmerz.
Herzerkrankungen
Häufig: Tachykardie.
Gelegentlich: Vorhofflimmern, atrioventrikulärer Block, Erregungsleitungsstörung, verlängertes QT-Intervall im Elektrokardiogramm, Baradykardie, anormales Elektrokardiogramm, Palpitationen.
Selten: Sinusarrhythmien.
Nicht bekannt: posturales orthostatisches Tachykardiesyndrom.
Gefässerkrankungen
Häufig: Hypotonie, Hypertonie.
Gelegentlich: Orthostatische Hypotonie.
Selten: Lungenembolie, tiefe Venenthrombose.
Nicht bekannt: Flush.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Dyspnoe, pharyngolaryngealer Schmerz, Husten, nasale Verstopfung.
Gelegentlich: Hyperventilation, Atemwegsobstruktion, Keuchen, Epistaxis.
Selten: Schlaf-Apnoe-Syndrom, Aspirationspneumonie, Lungenstauung, Lungenrasseln, Dysphonie, Atemstörung.
Erkrankungen des Gastrointestinaltrakts
Häufig: abdominelle Beschwerden, Erbrechen, Übelkeit, Obstipation, Gastroenteritis, Diarrhö, Dyspepsie, Mundtrockenheit, Zahnschmerz.
Gelegentlich: Stuhlinkontinenz, Dysphagie, Flatulenz.
Selten: Pankreatitis, intestinale Obstruktion.
Sehr selten: Ileus.
Nicht bekannt: geschwollene Zunge, Faekulom, Cheilitis.
Leber- und Gallenerkrankungen
Häufig: Transaminasen erhöht, erhöhte Gamma-Glutamyl-Transferase-Werte.
Gelegentlich: Leberenzymwerte erhöht.
Selten: Ikterus.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Hautausschlag.
Gelegentlich: Pruritus, Alopezie, Ekzem, trockene Haut, Erythem, Hautverfärbung, Akne, seborrhoische Dermatitis.
Selten: Arzneimittelexanthem, Urticaria, Hyperkeratose, Hauterkrankungen, Hautläsion.
Sehr selten: Angioödem.
Nicht bekannt: Stevens-Johnson-Syndrom/Toxische epidermale Nekrolyse.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Muskelkrämpfe, muskuloskelletale Schmerzen, Rückenschmerz, Arthralgie.
Gelegentlich: erhöhter Kreatinphosphokinase-Wert, Gelenksteifigkeit, Anschwellen der Gelenke, Muskelschwäche, Nackenschmerzen.
Selten: Rhabdomyolyse, anomale Haltung.
Erkrankungen der Nieren und Harnwege
Häufig: Harninkontinenz.
Gelegentlich: Pollakisurie, Harnretention, Dysurie.
Schwangerschaft, Wochenbett- und perinatale Erkrankungen
Sehr selten: Extrapyramidalmotorische Symptome und/oder Entzugserscheinungen beim Neugeborenen.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Häufig: erektile Dysfunktion, Amenorrhö, Galaktorrhoe.
Gelegentlich: Ejakulationsstörung, verspätete Menstruation, Menstruationsstörungc, Gynäkomastie, sexuelle Dysfunktion, Brustbeschwerden, vaginaler Ausfluss.
Selten: Brustdrüsenschwellung, Absonderung aus der Brustdrüse.
Nicht bekannt: Priapismus.
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Häufig: Sturz.
Gelegentlich: verabreichungsbedingter Schmerz.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Ödemc, Pyrexie, Brustkorbbeschwerden, Asthenie, Fatigue, Schmerz, Schmerz an der Injektionsstelle, Sturz.
Gelegentlich: Gesichtsödem, Schüttelfrost, erhöhte Körpertemperatur, anormaler Gang, Durst, Krankheitsgefühl, anormales Gefühl, Induration.
Selten: Hypothermie, Unbehagen.
Sehr selten: Anaphylaktische Reaktion nach Injektion mit Risperdal Consta bei Patienten welche zuvor orales Risperidon toleriert haben.
Nicht bekannt: verminderte Körpertemperatur, peripheres Kältegefühl, Arzneimittelentzugsyndrom.
a Eine Hyperprolaktinämie kann in einigen Fällen zu Gynäkomastie, Menstruationsstörungen, Amenorrhoe und Galaktorrhoe führen.
b In Placebo-kontrollierten Studien wurde Diabetes mellitus bei 0,18% der mit Risperidon behandelten Patienten berichtet, im Vergleich lag die Rate in der Placebo-Gruppe bei 0,11%. Die Gesamtinzidenz aus allen klinischen Studien betrug 0,43% bei allen mit Risperidon behandelten Patienten.
c Schlaflosigkeit beinhaltet: initiale Schlafstörung, Durchschlafstörungen;
Parkinsonismus beinhaltet: Akinese, Bradykinesie, Zahnradphänomen, Speichelausfluss, extrapyramidalmotorische Symptome, pathologischer Glabella-Reflex, Muskelsteifigkeit, Muskelverspannungen, muskuloskelettale Steifheit;
Akathisie beinhaltet: Hyperkinesie, Restless-legs-Syndrom, Ruhelosigkeit;
Dystonie beinhaltet: Blepharospasmus, zervikale Spasmen, Emprosthotonus, Gesichtskrampf, Muskelhypertonus, Laryngospasmus, unwillkürliche Muskelkontraktionen, Myotonie, Oculogyration, Opisthotonus, oropharyngealer Krampf, Pleurothotonus, Risus sardonicus, Tetanie, Zungenlähmung, Zungenkrampf, Torticollis, Trismus;
Dyskinesie beinhaltet: Athetose, Chorea, choreoathetoide Bewegungen, Bewegungsstörungen, Muskelzucken, Myoklonus;
Konvulsionen beinhaltet: Grand-mal-Anfälle;
Ödeme beinhaltet: generalisierte Ödeme, periphere Ödeme, Ödem mit eindrückbaren Dellen («pitting edema»);
Menstruationsstörungen beinhaltet: unregelmässige Menstruation, Oligomenorhoe.
Beschreibung ausgewählter Nebenwirkungen
Klasseneffekte
Verlängerung des QT-Intervals
Wie bei anderen Antipsychotika, wurden nach Markteinführung sehr selten Fälle einer QT-Verlängerung unter Risperidon berichtet. Andere klassenbezogene kardiale Effekte, die unter Antipsychotika, die das QT-Intervall verlängern, berichtet wurden, umfassen ventrikuläre Arrhythmie, Kammerflimmern, ventrikuläre Tachykardie, plötzlichen Tod, Herzstillstand und Torsades de Pointes. (s. Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Gewichtszunahme
In einer 12-wöchigen, plazebokontrollierten Doppelblindstudie kam es bei 9% der Patienten, die mit Risperdal Consta behandelt wurden, im Vergleich zu 6% der Patienten, die mit Placebo behandelt wurden, zu einer Gewichtszunahme von ≥7% des Körpergewichts am Endpunkt der Studie. Während der 1-jährigen offenen Studie zu Risperdal Consta lagen die Änderungen des Körpergewichts bei einzelnen Patienten im Allgemeinen innerhalb von ±7% des Ursprungsgewichtes; bei 25% der Patienten kam es zu einer Zunahme des Körpergewichts von ≥7%.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Hierzu liegen nur Erfahrungen mit der oralen Form vor:
Anzeichen und Symptome
Die zu erwartenden Symptome bestehen in einer Ausweitung der bekannten pharmakologischen Wirkungen. Dazu gehören Benommenheit und Sedierung, Tachykardie und Hypotonie sowie extrapyramidale Symptome. Bei Überdosierungen wurden seltene Fälle von QT-Verlängerungen beobachtet und Konvulsionen beobachtet. Fälle von Torsade de pointes wurden im Zusammenhang mit einer gleichzeitigen Überdosierung von Risperdal und Paroxetin berichtet.
Behandlung
Bei Überdosierung sind die Atemwege freizumachen und freizuhalten und es muss für eine ausreichende Sauerstoffzufuhr und Beatmung gesorgt werden. Herz und Kreislauf müssen sofort überwacht werden. Eine kontinuierliche EKG-Kontrolle ist erforderlich, um allfällige Arrhythmien feststellen zu können.
Es gibt kein spezifisches Gegenmittel für Risperdal Consta. Es sind deshalb geeignete Massnahmen vorzubereiten. Im Falle einer akuten Überdosierung ist die Möglichkeit einer mehrfachen Medikamentenbeteiligung in Betracht zu ziehen. Hypotonie und Kreislaufkollaps sind mit geeigneten Massnahmen, wie intravenöse Infusion und/oder sympathomimetische Arzneimittel zu behandeln. Bei schweren extrapyramidalen Symptomen ist ein Anticholinergikum zu verabreichen. Eine genaue medizinische Überwachung sollte bis zur Erholung des Patienten fortgesetzt werden.
Eigenschaften/Wirkungen
ATC-Code
N05AX08
Wirkungsmechanismus
Risperdal Consta (Risperidon) ist ein Antipsychotikum, das einer neuen Klasse – den Benzisoxazol-Derivaten – angehört. Es weist eine hohe Affinität zu den dopaminergen D2- und den serotonergen 5HT2-Rezeptoren auf. Risperidon besetzt auch die α1-adrenergen sowie mit geringerer Affinität die histaminergen H1- und die adrenergen α2-Rezeptoren. Risperidon besitzt keine Affinität zu den cholinergen Rezeptoren. Obwohl Risperidon ein potenter D2-Antagonist ist, was bekanntlich eine Verminderung der positiven Symptome der Schizophrenie bewirkt, dämpft es die motorische Aktivität weniger stark und löst in geringerem Masse Katalepsie aus als die klassischen Neuroleptika. Durch den ausgewogenen zentralen Serotonin- und Dopaminantagonismus wird die Wahrscheinlichkeit extrapyramidaler Nebenwirkungen gesenkt und die therapeutische Wirkung auch auf die negativen und affektiven Symptome der Schizophrenie ausgedehnt.
Die Wirksamkeit von Risperdal Consta (25 mg und 50 mg) bei der Behandlung psychotischer Störungen (Schizophrenie, schizoaffektive Störungen) wurde in einer 12-wöchigen, Placebo kontrollierten Studie bei psychotischen stationären und ambulanten Patienten, welche die Kriterien für Schizophrenie gemäss DSM-IV erfüllten gezeigt.
Eine 12-wöchige Vergleichsstudie bei Schizophreniepatienten mit einer stabilen Symptomatik belegte, dass Risperdal Consta gleich effektiv war wie die orale Tablettenformulierung.
Die Wirkung und Sicherheit von Risperdal Consta bei Langzeitbehandlung (50 Wochen) wurde in einer offenen Studie bei psychotischen stationären und ambulanten Patienten mit einer stabilen Symptomatik untersucht, welche die DSM-IV-Kriterien für Schizophrenie oder schizoaffektive Störungen erfüllten. Während dieser Zeit blieb die Wirkung von Risperdal Consta erhalten. (Diese Studie hatte keine Vergleichsgruppe.)
Pharmakodynamik
Siehe Wirkungsmechanismus
Klinische Wirksamkeit
Siehe Wirkungsmechanismus
Pharmakokinetik
Freisetzung
Nach einmaliger intramuskulärer Verabreichung von Risperdal Consta wird anfangs eine kleine Menge Wirkstoff (<1% der Dosis) freigesetzt, worauf eine 3-wöchige Lag-Phase folgt. Die Hauptfreisetzung beginnt von der 3. Woche an. Die freigegebene Menge wird während der 4–6. Woche aufrechterhalten und nimmt von der 7. Woche an wieder ab. Während der ersten 3 Wochen der Therapie mit Risperdal Consta muss deshalb ein zusätzliches Antipsychotikum gegeben werden. In den klinischen Studien wurden während der ersten drei Wochen Risperidon-Tabletten eingesetzt.
Die Kombination des Freisetzungsprofils und des Injektionsintervalls (intramuskuläre Injektion jede zweite Woche) führt zur Erhaltung therapeutischer Plasmakonzentrationen. Therapeutische Konzentrationen bestehen bis 4–6 Wochen nach der letzten Injektion.
Die Elimination ist 7–8 Wochen nach der letzten Risperdal Consta-Gabe abgeschlossen.
Absorption
Risperidon wird nach erfolgter Freisetzung vollständig resorbiert.
Distribution
Risperidon wird rasch verteilt. Das scheinbare Verteilungsvolumen (Vd) beträgt 1–2 l/kg. Die Plasmaproteinbindung an Albumin und saurem α1-Glykoprotein von Risperidon beläuft sich auf 88%, diejenige des aktiven Metaboliten von 9-Hydroxy-Risperidon auf 77%.
Die nach wiederholter intramuskulärer Injektion von 25 mg bzw. 50 mg Risperdal Consta im Intervall von 2 Wochen erhaltenen mittleren minimalen und maximalen Plasmakonzentrationen der aktiven antipsychotischen Fraktion betrugen 9,9 und 19,2 ng/ml bzw. 17,9 und 45,5 ng/ml. Die Pharmakokinetik von Risperidon ist linear im Dosisintervall 25–50 mg bei einem Injektionsintervall von zwei Wochen. In der Langzeitanwendung (12 Monate) wurde bei Patienten, die alle zwei Wochen eine Injektion von 25–50 mg erhielten, keine Akkumulation von Risperidon beobachtet.
Die erwähnten Studien wurden mit glutealer intramuskulärer Injektion durchgeführt. Deltoide und gluteale intramuskuläre Injektionen mit derselben Dosis sind bioäquivalent und daher austauschbar.
Metabolismus
Risperidon wird vorwiegend in der Leber über CYP 2D6 metabolisiert. Es wird hauptsächlich zu 9-Hydroxy-Risperidon, welches eine ähnliche pharmakologische Wirkung wie Risperidon aufweist, abgebaut. Risperidon und 9-Hydroxy-Risperidon bilden zusammen die aktive antipsychotische Fraktion.
Das CYP 2D6 weist einen genetischen (Debrisoquin/Dextromethorphan) Polymorphismus auf. Schnelle Metabolisierer konvertieren Risperidon schnell in 9-Hydroxy-Risperidon, während dem langsame Metabolisierer dies langsamer tun. Schnelle Metabolisierer haben deshalb tiefere Risperidon- und höhere 9-Hydroxy-Risperidon-Konzentrationen im Plasma als langsame Metabolisierer. Da Risperidon und 9-Hydroxy-Risperidon etwa die gleiche antipsychotische Aktivität besitzen, ist die Summe ihrer Konzentrationen massgebend. Aus diesem Grunde wurden bei langsamen und schnellen Metabolisierern keine klinisch relevanten Unterschiede beobachtet.
Ein weniger wichtiger Abbauweg ist die N-Dealkylierung, die wahrscheinlich über CYP3A4 erfolgt.
Elimination
Die Clearance der aktiven antipsychotischen Fraktion bzw. von Risperidon beträgt 5,0 bzw. 13,7 l/h bei schnellen Metabolisierern (bezüglich CYP 2D6) und 3,2 bzw. 3,3 l/h bei langsamen Metabolisierern.
Kinetik spezieller Patientengruppen
Nach oraler Einnahme einer Einmaldosis wurden bei älteren und niereninsuffizienten Patienten höhere aktive Plasmaspiegel (Cmax war ca. 1,1 bzw. 1,5 mal höher und die AUC war ca. 1,5 bzw. 2,5 mal höher) beobachtet. Dies reflektiert vermutlich eine bei älteren Patienten um 30% und bei niereninsuffizienten Patienten eine um 60% verminderte Clearance der aktiven antipsychotischen Fraktion. Die Risperidon-Plasmakonzentrationen lagen bei Patienten mit Leberinsuffizienz im normalen Bereich, jedoch war die mittlere freie Risperidonfraktion im Plasma um etwa 35% erhöht.
Spezifische pharmakokinetische Studien mit Risperdal Consta liegen bei diesen Patientengruppen nicht vor. Pharmakokinetische Analysen deuten jedoch darauf hin, dass bei der empfohlenen Dosierung von 25 mg jede 2. Woche, die Plasmakonzentrationen bei älteren Patienten (>65 Jahre) und bei Patienten mit leichter bis moderater Niereninsuffizienz innerhalb des bei Erwachsenen beobachteten Bereiches liegen. Die Analysen beruhen auf den in den Phase-III-Studien mit Risperdal Consta ermittelten Wirkstoffkonzentrationen (s. «Spezielle Dosierungsanweisungen»).
Zusammenhang zwischen Pharmakokinetik und Pharmakodynamik
In keiner der Phase-III-Studien, in welchen die Wirksamkeit und Sicherheit untersucht wurden, ergab sich ein Zusammenhang zwischen den Plasmakonzentrationen der aktiven antipsychotischen Fraktion und der Änderung der Gesamtpunktzahl nach PANSS (Positive and Negative Syndrome Scale) bzw. ESRS (Extrapyramidal Symptom Rating Scale).
Präklinische Daten
In Toxizitätsstudien mit wiederholter Verabreichung an Ratten und Hunde wurden hauptsächlich pharmakologische Effekte, wie Sedation und Prolaktin-vermittelte Wirkungen auf die Brustdrüsen und Genitalien, beobachtet.
Mutagenität
Risperidon war nicht genotoxisch in den Standardtests.
Karzinogenität
Wie für einen potenten D2-Antagonisten zu erwarten, zeigte sich in einer intramuskulären Karzinogenitätsstudie an Ratten bei 40 mg/kg eine Prolaktin-vermittelte erhöhte Inzidenz von endokrinen Tumoren des Pankreas, der Hypophyse und des Nebennierenmarks. Brustdrüsenkarzinome traten bei 5 und 40 mg/kg auf. Hypercalcämie, von welcher postuliert wird, das sie zu einer erhöhten Inzidenz von Tumoren des Nebennierenmarks führt, wurde in beiden Dosisgruppen beobachtet. Bei männlichen Ratten traten tubuläre Nierenadenome auf. Bei der niedrigen Dosierung, der NaCl 0,9%- oder der Mikrosphären-Kontrollgruppe traten keine Nierentumore auf. Der Mechanismus für die Entstehung der Nierentumore bei mit Risperdal Consta behandelten Ratten ist unbekannt. Bei den oralen Karzinogenitätsstudien an Ratten oder bei oraler Verabreichung von Risperidon an Mäusen trat keine behandlungsabhängige Erhöhung der Nierentumorinzidenz auf.
Reproduktionstoxizität
Obwohl bei Risperidon in tierexperimentellen Studien keine direkten Reproduktionsstörungen festgestellt wurden, wurden indirekte, durch Prolaktin vermittelte Effekte beobachtet.
Risperidon zeigte keine teratogenen Effekte bei Ratten und Kaninchen.
Bei Ratten wurden negative Effekte auf das Paarungsverhalten, das Geburtsgewicht und das Überleben des Nachwuchses beobachtet. Verhaltensstörungen beim Nachwuchs sind nicht untersucht worden.
Sonstige Hinweise
Inkompatibilitäten
Risperdal Consta darf – ausser mit der mitgelieferten Lösung zur Herstellung der Suspension – mit keiner anderen Lösung und keinem anderen Arzneimittel gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Die chemische und physikalische Stabilität der Suspension ist bei 25 °C während 24 Stunden nach der Zubereitung gewährleistet. Aus mikrobiologischen Gesichtspunkten sollte die Suspension aber sofort nach der Zubereitung eingesetzt werden. Wird die Suspension nicht sofort verabreicht, liegt die Verantwortung für die Lagerungszeit und Lagerbedingungen beim Anwender. Diese sollte normalerweise 6 Stunden bei 25 °C nicht überschreiten, ausser wenn die Zubereitung unter kontrollierten und validierten aseptischen Bedingungen erfolgte.
Besondere Lagerungshinweise
Die gesamte Packung im Kühlschrank (2-8 °C) lagern.
Sofern kein Kühlschrank zur Verfügung steht, kann Risperdal Consta bei Temperaturen, die 25 °C nicht überschreiten, während maximal 7 Tagen vor der Applikation aufbewahrt werden. Nicht Temperaturen über 25 °C aussetzen.
Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren!
Hinweise für die Handhabung
Bei Risperdal Consta ist ein schrittweises Einhalten der «Hinweise für die Handhabung» wichtig, um eine erfolgreiche Verabreichung sicherzustellen und um Schwierigkeiten beim Einsatz des Kits zu vermeiden.
Die Mikrosphären mit verzögerter Wirkstofffreisetzung (Pulver in der Durchstechflasche) von Risperdal Consta dürfen nur in der mitgelieferten Lösung aus der Fertigspritze suspendiert werden. Zur Injektion darf nur die passende der Packung beiliegende Injektionsnadel für gluteale (2-Inch-Nadel, 51 mm) oder deltoide (1-Inch-Nadel, 25 mm) Injektion verwendet werden. Wechseln Sie keines der Elemente des Injektionskits aus.
Um sicherzustellen, dass die vorgesehene Risperidondosis freigesetzt wird, muss der gesamte Inhalt der Durchstechflasche verabreicht werden. Bei partieller Verabreichung des Inhalts wird evtl. nicht die beabsichtigte Risperidondosis freigesetzt. Es wird empfohlen die Verabreichung sofort nach der Rekonstitution vorzunehmen.
Nehmen Sie die Risperdal Consta Packung aus dem Kühlschrank und warten Sie mit der Herstellung der Suspension ca. 30 Minuten, bis sie Raumtemperatur angenommen hat.
Inhalt des Injektionskits
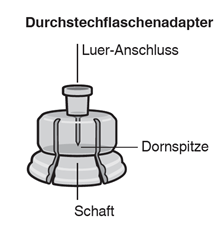
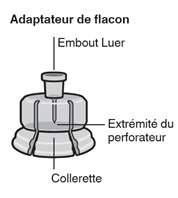
- Eine Durchstechflasche mit Mikrosphären mit verzögerter Wirkstofffreisetzung.
- Eine Fertigspritze mit Lösungsmittel.
- Einen Durchstechflaschenadapter zum Aufsetzen der Fertigspritze (Verbindungsstück zur Herstellung der Suspension).
- Zwei Terumo SurGuard®-3 Injektionsnadeln zur intramuskulären Injektion (eine 21G UTW 1-Inch Sicherheits-Injektionsnadel (25 mm) mit Nadel-Schutzeinheit zur deltoiden Injektion und eine 20G TW 2–Inch Sicherheits-Injektionsnadel (51 mm) mit Nadel- Schutzeinheit zur glutealen Injektion).
Gebrauchsanweisung, Handhabung und Entsorgung
Wichtige Hinweise
Für eine erfolgreiche Verabreichung von Risperdal Consta befolgen Sie bitte diese Schritt-für-Schritt Gebrauchsanweisung genau.
30 Minuten warten
Nehmen Sie die Einzelpackung aus dem Kühlschrank und lassen Sie sie mindestens 30 Minuten bei Raumtemperatur stehen, bevor Sie mit der Rekonstitution beginnen.
Nicht auf eine andere Weise erwärmen.
Mitgelieferte Bestandteile verwenden
Die in der Einzeldosispackung enthaltenen Bestandteile sind speziell für den Gebrauch mit Risperdal Consta bestimmt. Risperdal Consta darf nur mit dem in der Einzeldosispackung mitgelieferten Lösungsmittel rekonstituiert werden.
Tauschen Sie KEINE Bestandteile dieser Einzeldosispackung aus.
Rekonstituierte Suspension nicht aufbewahren.
Dosis nach der Rekonstitution so schnell wie möglich verabreichen, um ein Absetzen zu vermeiden.
Korrekte Dosierung
Um sicherzustellen, dass die vorgesehene Dosis Risperdal Consta zugeführt wird, muss der gesamte Inhalt der Durchstechflasche verabreicht werden.
MEDIZINPRODUKT ZUM EINMALIGEN GEBRAUCH
Nicht wiederverwenden. Bei Medizinprodukten sind spezifische Materialeigenschaften erforderlich, damit sie wie vorgesehen funktionieren. Diese Eigenschaften wurden nur für den einmaligen Gebrauch geprüft. Versuche, das Medizinprodukt für eine anschliessende Wiederverwendung aufzubereiten, können die Integrität des Produktes nachteilig beeinflussen oder zu einer verminderten Funktionsfähigkeit führen.
Schritt 1. Bestandteile zusammensetzen
Nehmen Sie die Einzeldosispackung aus dem Kühlschrank und lassen Sie sie mindestens 30 Minuten bei Raumtemperatur stehen, bevor Sie mit der Rekonstitution beginnen. Nicht auf andere Weise erwärmen.
Durchstechflaschenadapter mit der Durchstechflasche verbinden
Kappe von der Durchstechflasche entfernen
Entfernen Sie die farbige Kappe von der Durchstechflasche. Wischen Sie die Oberseite des grauen Stopfens mit einem Alkoholtupfer ab. Lassen Sie ihn an der Luft trocknen. Den grauen Gummistopfen nicht entfernen (Fig. A).
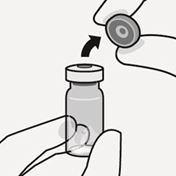
Fig. A
Vorbereitung des Durchstechflaschenadapters
Halten Sie den sterilen Blister wie gezeigt (Fig. B). Ziehen Sie das Schutzpapier ab. Die Vorrichtung nicht aus dem Blister herausnehmen. Der Dorn darf zu keinem Zeitpunkt berührt werden. Dies würde zu einer Kontamination führen.
Fig. B
Durchstechflaschenadapter mit der Durchstechflasche verbinden
Stellen Sie die Durchstechflasche auf eine feste Fläche und halten Sie sie im unteren Bereich fest. Halten Sie den Durchstechflaschenadapter mittig über den grauen Gummistopfen. Drücken Sie den Durchstechflaschenadapter gerade nach unten auf die Oberseite der Durchstechflasche, bis sie sicher einrastet (Fig. C).
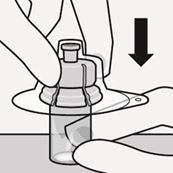
Fig. C
Setzen Sie den Durchstechflaschenadapter nicht schräg auf, da sonst Lösungsmittel beim Überführen in die Durchstechflasche austreten kann (Fig. D).
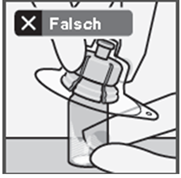
Fig. D
Fertigspritze mit dem Durchstechflaschenadapter verbinden
Sterile Blister entfernen
Nehmen Sie den Durchstechflaschenadapter erst dann aus dem sterilen Blister, wenn Sie bereit sind, die weisse Kappe von der Fertigspritze zu entfernen. Halten Sie die Durchstechflasche aufrecht, um ein Auslaufen zu verhindern. Halten Sie die Durchstechflasche im unteren Bereich und ziehen Sie den sterilen Blister nach oben ab.
Nicht schütteln.
Nicht den freiliegenden Luer-Anschluss auf den Durchstechflaschenadapter berühren. Dies würde zu einer Kontamination führen (Fig. E).

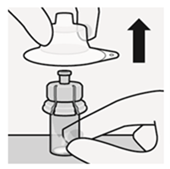
Fig. E
Richtig halten
Halten Sie die Spritze an der weissen Manschette an der Spitze. Halten Sie die Spritze beim Zusammensetzen nicht am Glaszylinder (Fig. F).
Fig. F
Kappe entfernen
Halten Sie die weisse Manschette und knicken Sie die weisse Kappe ab.
Die Spitze der Spritze nicht berühren. Dies würde zu einer Kontamination führen.
Wenn die Kappe entfernt worden ist, sieht die Spritze wie in Fig. G aus. Die abgebrochene Kappe kann entsorgt werden.
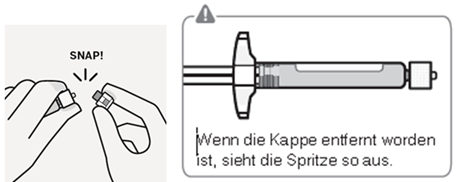
Fig. G
Spritze mit dem Durchstechflaschenadapter verbinden
Halten Sie den Durchstechflaschenadapter an der Ummantelung in Position.
Halten Sie die Spritze an der weissen Manschette und führen Sie dann die Spitze in den Luer-Anschluss auf den Durchstechflaschenadapter ein (Fig. H).
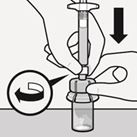
Fig. H
Die Spritze nicht am Glaszylinder festhalten. Dies kann dazu führen, dass sich die weisse Manschette lockert oder ablöst. Die Spritze mit einer kräftigen Drehbewegung im Uhrzeigersinn mit dem Durchstechflaschenadapter verbinden, bis sie fest sitzt. Nicht überdrehen. Ein Überdrehen kann ein Abbrechen der Spritzenspitze zur Folge haben.
Schritt 2 Mikrosphären rekonstituieren
Lösungsmittel injizieren
Injizieren Sie das gesamte Lösungsmittel aus der Spritze in die Durchstechflasche.
Der Inhalt der Durchstechflasche steht nun unter Druck. Halten Sie den Spritzenkolben mit dem Daumen weiterhin gedrückt (Fig. I).
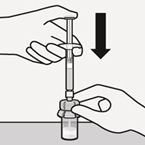
Fig. I
Mikrosphären im Lösungsmittel suspendieren
Während Sie den Spritzenkolben weiterhin gedrückt halten, schütteln Sie Spritze und Durchstechflasche mindestens 10 Sekunden lang kräftig (Fig. J).
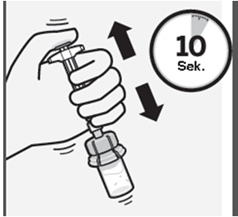
Fig. J
Prüfen Sie die Suspension. Sobald eine gute Durchmischung erreicht ist, erscheint die Suspension homogen, dickflüssig und milchig. Die Mikrosphären werden in der Flüssigkeit sichtbar. Fahren Sie sofort mit dem nächsten Schritt fort, damit sich die Suspension nicht absetzt.
Suspension in die Spritze überführen
Drehen Sie die Durchstechflasche auf den Kopf. Ziehen Sie den Spritzenkolben langsam zurück, um den gesamten Inhalt aus der Durchstechflasche in die Spritze aufzuziehen (Fig. K).
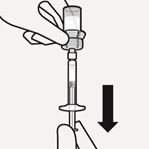
Fig. K
Durchstechflaschenadapter entfernen
Halten Sie die weisse Manschette der Spritze und drehen Sie sie von dem Durchstechflaschenadapter ab. Ziehen Sie den abziehbaren Abschnitt des Etiketts der Durchstechflasche an der Perforation ab. Bringen Sie das abgezogene Etikett zur Kennzeichnung an der Spritze an (Fig. L).
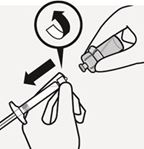
Fig. L
Entsorgen Sie die Durchstechflasche und den Durchstechflaschenadapter sachgemäss.
Schritt 3 Nadel befestigen
Geeignete Nadel auswählen
Wählen Sie die Nadel entsprechend der Injektionsstelle (gluteal oder deltoidal) aus (Fig. M).
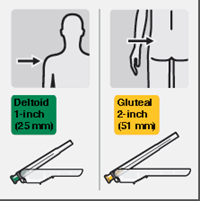
Fig. M
Nadel befestigen
Ziehen Sie die Blisterpackung zur Hälfte auf und benützen Sie diese wie abgebildet (Fig. N) zum Fassen der Nadel an der Basis.
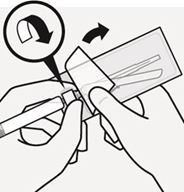
Fig. N
Während Sie die weisse Manschette der Spritze festhalten, befestigen Sie den Luer-Anschluss der Nadel mit einer kräftigen Drehbewegung im Uhrzeigersinn an der Spritze, bis sie fest sitzt.
Den Luer-Anschluss der Nadel nicht berühren. Dies würde zu einer Kontamination führen.
Mikrosphären resuspendieren
Entfernen Sie den Blister vollständig. Schütteln Sie unmittelbar vor der Injektion die Spritze noch einmal kräftig, da sich einige Mikrosphären abgesetzt haben können (Fig. O).
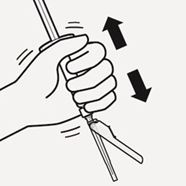
Fig. O
Schritt 4. Dosis injizieren
Transparente Nadelschutzkappe entfernen
Bewegen Sie die Nadelsicherheitsvorrichtung wie gezeigt zurück. Halten Sie anschliessend die weisse Manschette der Spritze fest und ziehen Sie vorsichtig die transparente Nadelschutzkappe gerade ab (Fig. P).
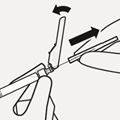
Fig. P
Die Transparente Nadelschutzkappe nicht abdrehen, da sich dadurch die Luer-Verbindung lockern kann.
Luftblasen entfernen
Halten Sie die Nadel aufrecht und klopfen Sie sanft, um Luftblasen nach oben steigen zu lassen. Drücken Sie den Spritzenkolben langsam und vorsichtig nach oben, um die Luft zu entfernen (Fig. Q).
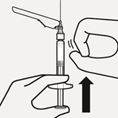
Fig. Q
Injizieren
Injizieren Sie sofort den gesamten Inhalt der Spritze intramuskulär (i.m.) in den Gluteal- oder den Deltoidmuskel des Patienten. Die gluteale Injektion sollte in das obere äussere Viertel der Glutealregion erfolgen (Fig. R).
Fig. R
Nicht intravenös verabreichen.
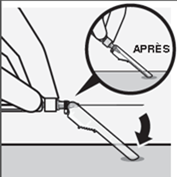
Nadel in der Sicherheitsvorrichtung sichern
Halten Sie die Nadelsicherheitsvorrichtung einhändig in einem 45-Grad-Winkel gegen eine feste, ebene Fläche. Drücken Sie sie mit einer kräftigen, schnellen Bewegung nach unten, bis die Nadel vollständig in der Nadelsicherheitsvorrichtung eingerastet ist (Fig. S).
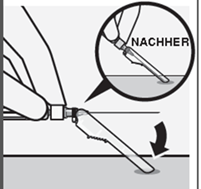
Fig. S
Vermeiden Sie Nadelstichverletzungen:
- Benutzen Sie nicht beide Hände.
- Lösen Sie nicht absichtlich die Nadelsicherheitsvorrichtung und gebrauchen Sie sie nicht unsachgemäss.
- Versuchen Sie nicht die Nadel gerade zu biegen oder die Sicherheitsvorrichtung einzurasten, wenn die Nadel verbogen oder beschädigt ist.
Sachgemässe Entsorgung der Nadeln
Überzeugen Sie sich, dass die Nadelsicherheitsvorrichtung vollständig eingerastet ist. Entsorgen Sie Spritze und Nadel in einem vorschriftsmässigen Spritzenbehälter.
Entsorgen Sie auch die in der Einzeldosispackung mitgelieferte ungebrauchte Nadel (Fig. T).

Fig. T
Zulassungsnummer
56092 (Swissmedic).
Zulassungsinhaberin
Janssen-Cilag AG, Zug, ZG.
Stand der Information
September 2020
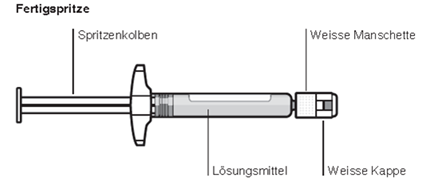
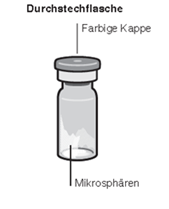
Inhalt der Einzeldosispackung
Composition
Principes actifs
Risperidonum.
Excipients
Poudre de principe actif (flacon): Poly (DL-lactidum-co-glycolidum).
Solution pour la mise en suspension de la poudre (seringue pré-remplie): Carmellosum natricum, polysorbatum 20, dinatrii phosphas dihydricus, acidum citricum, natrii chloridum, natrii hydroxidum, aqua ad injectabilia q.s. ad solutionem pro 2 ml. Teneur totale en sodium: 9,872 mg.
Forme pharmaceutique et quantité de principe actif par unité
Poudre et solvant pour la reconstitution d'une suspension injectable à libération prolongée dans une seringue pré-remplie
Risperdal Consta contient de la rispéridone incorporée dans des microsphères (billes de polymère), qui la libèrent de façon retardée.
Poudre de principe actif pour la reconstitution de la suspension injectable (flacon): Praeparatio sicca à 25 mg, 37,5 mg ou 50 mg de rispéridone.
Solvant pour la mise en suspension de la poudre (seringue pré-remplie): 2 ml.
Indications/Possibilités d’emploi
Traitement d'entretien des maladies psychotiques de type schizophrénique, après instauration du traitement par un neuroleptique à libération non retardée.
Posologie/Mode d’emploi
Posologie habituelle
Adultes
La posologie recommandée est de 25 mg en intramusculaire toutes les deux semaines. Certains patients pourront tirer bénéfice d'un dosage plus élevé de 37,5 mg ou de 50 mg. Un dosage de 75 mg n'a montré aucun bénéfice supplémentaire dans les études cliniques, de plus on a observé une incidence légèrement plus élevée d'effets secondaires extrapyramidaux. Les posologies supérieures à 50 mg toutes les deux semaines ne sont pas recommandées.
Attention: Après la 1re injection de Risperdal Consta, un effet clinique thérapeutique ne peut pas être attendu immédiatement, mais seulement après une période de latence de trois ou même quatre semaines. Il est donc nécessaire de compléter la couverture antipsychotique avec un autre antipsychotique pendant cette période ou, si c'est possible, en administrant Risperdal sous forme orale. Lorsque les patients sont déjà traités par un neuroleptique retard, il peut s'avérer judicieux de les placer transitoirement sous traitement oral avant de passer à Risperdal Consta (si le tableau clinique le permet).
Les augmentations de dosage ne doivent pas être effectuées avant 4 semaines, car l'effet de la première injection avec le dosage augmenté met au moins 3 semaines à se manifester.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique ou de la fonction rénale
L'emploi de Risperdal Consta n'a pas été étudié chez les insuffisants hépatiques ou rénaux.
Le schéma suivant est recommandé pour les insuffisants hépatiques ou rénaux nécessitant un traitement par Risperdal Consta: commencer par de la rispéridone orale (sous forme de comprimés ou de solution) à raison de 0,5 mg 2×/jour la 1re semaine, puis passer à 1 mg 2×/jour ou 2 mg 1×/jour la 2e semaine. On peut passer à une injection de Risperdal Consta 25 mg toutes les 2 semaines si le patient tolère bien la dose orale journalière d'au moins 2 mg.
Patients âgés
La posologie recommandée est de 25 mg en intramusculaire toutes les 2 semaines. Après la 1re injection de Risperdal Consta, il est nécessaire de compléter la couverture antipsychotique avec un antipsychotique oral pendant les trois semaines suivantes (phase de latence, voir «Pharmacocinétique»).
Des patients âgés atteints de symptômes psychotiques dans le cadre d'une démence ont eu un risque de mortalité accru sous traitement par des antipsychotiques atypiques. Risperdal Consta n'est pas autorisé pour traiter les patients souffrant de symptômes psychotiques liés à une démence.
Enfants et adolescents
Aucune expérience n'est encore disponible chez les enfants et les adolescents de moins de 18 ans.
Schéma d'administration
Chez les patients qui n'ont encore jamais reçu de rispéridone, il est recommandé de tester la tolérance à la rispéridone orale avant de commencer le traitement par Risperdal Consta.
Mode d'administration
Risperdal Consta doit être administré toutes les deux semaines par injection intramusculaire profonde au niveau du muscle deltoïde ou du muscle fessier. Utiliser à cette fin l'aiguille d'injection adaptée munie d'un dispositif de protection. Pour l'injection au niveau du deltoïde, utiliser l'aiguille de 1 pouce (25 mm) en alternant à chaque fois les injections entre les deux bras. Pour l'injection dans le muscle fessier, utiliser l'aiguille de 2 pouces (51 mm), en alternant l'injection entre chacune des deux fesses. Risperdal Consta ne doit pas être administré par voie intraveineuse (voir «Mises en garde et précautions», paragraphe «Administration»). Pour la préparation et l'administration de la suspension, voir «Remarques particulières»: «Remarques concernant la manipulation».
Contre-indications
Hypersensibilité connue à la rispéridone ou à l'un des excipients.
Patients atteints de démence avec symptômes parkinsoniens tels que rigidité musculaire, bradykinésie et troubles posturaux de type parkinsonien.
Patients atteints de démence avec une suspicion d'une démence à corps de Lewy (outre les symptômes typiques de la démence, présence d'au moins deux des trois symptômes suivants: parkinsonisme, hallucinations visuelles, évolution fluctuante).
Mises en garde et précautions
Lorsqu'un patient n'a jamais reçu de rispéridone, il est recommandé d'effectuer un test de tolérance à la rispéridone par voie orale avant de le traiter par Risperdal Consta.
Enfants et adolescents
Faute d'expériences en la matière, Risperdal Consta ne doit pas être administré aux enfants ni aux adolescents de moins de 18 ans.
Patients âgés atteints de démence
Augmentation de la mortalité globale
Une méta-analyse de 17 études contrôlées menées avec des antipsychotiques atypiques y compris Risperdal a montré une mortalité augmentée chez les patients âgés atteints de démence sous antipsychotiques par rapport à ceux sous placebo. Pour cette population, le taux de mortalité dans les études contrôlées par placebo était de 4,0% chez les patients traités par Risperdal administré par voie orale et de 3,1% dans le groupe placebo. Les patients décédés avaient une moyenne d'âge de 86 ans (intervalle 67–100 ans).
Un profil de facteurs de risque spécifique pour la mortalité accrue sous Risperdal n'est pas identifiable. Par contre, les motifs de décès étaient habituels pour le groupe d'âge >65 ans: évènements cardiovasculaires et cérébro-vasculaires, tumeurs, infections (p.ex. pneumonie) et diabète.
Augmentation de la mortalité lors d'administration simultanée de furosémide:
Dans les études contrôlées par placebo menées chez des patients âgés atteints de démence, une augmentation du taux de mortalité a été observée lors d'un traitement simultané par la rispéridone et le furosémide (7,3%; âge moyen 89 ans, intervalle 75–97 ans) comparée à un traitement par rispéridone seule (3,1%; âge moyen 84 ans, intervalle 70–96 ans) ou furosémide seul (4,1%; âge moyen 80 ans, intervalle 67– 90 ans). L'augmentation du taux de mortalité chez les patients traités par rispéridone plus furosémide a été observée dans deux des quatre études cliniques. Aucune augmentation du taux de mortalité n'a été observée chez les patients ayant pris d'autres diurétiques en association à la rispéridone.
Aucun mécanisme physiopathologique évident n'a été identifié pouvant expliquer ce résultat. De même, la cause des décès n'était pas uniforme. Toutefois, la prudence est de mise et le rapport bénéfice/risque de cette association ou du traitement simultané avec d'autres diurétiques puissants doit être évalué avant l'utilisation.
Indépendamment du traitement, une déshydratation était un facteur général de risque pour la mortalité. En conséquence, elle sera soigneusement évitée chez les patients âgés atteints de démence.
Augmentation des accidents vasculaires cérébraux
Dans les études contrôlées par placebo et menées auprès de patients âgés atteints de démence, l'incidence des accidents cérébro-vasculaires (accidents vasculaires cérébraux et accidents ischémiques transitoires [AIT]) y compris ceux avec issue fatale, a été significativement plus élevée chez les patients traités par Risperdal administré par voie orale que chez les patients sous placebo (âge moyen 85 ans; intervalle 73–97 ans).
Hypotension orthostatique
En raison de son activité α1-lytique, la rispéridone peut entraîner une hypotension (orthostatique), notamment durant le premier ajustement posologique. La prudence s'impose chez les patients atteints d'une maladie cardio-vasculaire confirmée (p.ex. insuffisance cardiaque, infarctus du myocarde, trouble de la conduction, déshydratation, hypovolémie ou maladie vasculaire cérébrale) (voir «Effets indésirables»). L'administration de Risperdal Consta n'est pas recommandée en présence d'un état cardio-vasculaire instable aigu (comme p.ex. lors d'infarctus du myocarde aigu).
En présence d'une hypotension orthostatique persistante et cliniquement manifeste, une évaluation bénéfice/risque s'impose avant de poursuivre le traitement par Risperdal Consta.
Allongement de l'intervalle QT
Dans les études cliniques, la rispéridone n'a pas été associée à un allongement de l'intervalle QTc. Après le lancement, on a très rarement signalé un allongement du QT. Comme pour d'autres antipsychotiques, la prudence est recommandée lorsqu'on prescrit la rispéridone chez les patients atteints d'une maladie cardio-vasculaire et/ou d'une bradycardie, de troubles électrolytiques connus (hypokaliémie, hypomagnésémie) ou présentant un allongement du QT dans leur anamnèse familiale. La prudence est également de rigueur en association avec d'autres médicaments qui allongent l'intervalle QT (voir «Interactions»).
Leucopénie, neutropénie et agranulocytose
Des cas de leucopénie, de neutropénie et d'agranulocytose ont été rapportés lors de l'utilisation d'antipsychotiques (y compris Risperdal Consta) au cours d'études cliniques et/ou depuis la commercialisation. Une agranulocytose a très rarement été observée (<1/10'000 patients) depuis la commercialisation.
Les patients présentant une diminution cliniquement significative du nombre de globules blancs dans les antécédents ou une leucopénie/neutropénie induite par un médicament doivent être surveillés pendant les premiers mois du traitement. L'arrêt du traitement par Risperdal Consta doit être envisagé dès les premiers signes d'une diminution significative des globules blancs, s'il n'existe pas d'autres facteurs étiologiques.
Les patients présentant une neutropénie cliniquement significative doivent être étroitement surveillés afin de déceler une fièvre ou d'autres symptômes ou signes d'une infection et doivent être immédiatement traités en cas d'apparition de tels symptômes ou signes. Chez les patients présentant une neutropénie marquée (nombre absolu de neutrophiles <1× 109/l), il convient d'arrêter le traitement par Risperdal Consta et de contrôler les globules blancs jusqu'à leur normalisation.
Thromboembolie veineuse
Des cas de thromboembolies veineuses (TEV) ont été rapportés en rapport avec l'utilisation d'antipsychotiques. Étant donné que les patients traités par antipsychotiques présentent fréquemment des facteurs de risques acquis de TEV, il convient d'identifier tous les éventuels facteurs de risque de TEV avant et pendant le traitement par Risperdal Consta et de prendre les mesures de précaution nécessaires.
Dyskinésie tardive/symptômes extrapyramidaux (EPS)
Les médicaments ayant des propriétés antidopaminergiques ont été impliqués dans l'induction d'une dyskinésie tardive, qui peut se manifester par des mouvements rythmiques involontaires, surtout de la langue et/ou du visage. L'apparition de symptômes extrapyramidaux est un facteur de risque de dyskinésies tardives. Si des signes ou symptômes d'une dyskinésie tardive apparaissent, il faut envisager l'interruption de la prise de tous les antipsychotiques.
Symptômes extrapyramidaux et psychostimulants – La prudence est recommandée chez les patients recevant en même temps des psychostimulants (par ex. du méthylphénidate) et de la rispéridone, car des symptômes extrapyramidaux sont susceptibles de survenir lors de l'ajustement de l'un des médicaments ou des deux médicaments. Une diminution progressive de la posologie de l'un des traitements ou des deux traitements doit être envisagée (voir «Interactions»).
Maladie de Parkinson et démence à corps de Lewy
La prudence est recommandée lorsque Risperdal est prescrit à des patients ayant une maladie de Parkinson ou une démence à corps de Lewy. Risperdal peut provoquer une aggravation de la maladie de Parkinson. Ces deux groupes peuvent présenter un risque accru de syndrome malin des neuroleptiques et une sensibilité accrue aux antipsychotiques (p.ex. avec confusion, émoussement affectif, trouble de l'équilibre avec chutes fréquentes, en plus des symptômes extrapyramidaux).
Syndrome malin des neuroleptiques
Dans de rares cas, les antipsychotiques peuvent provoquer un syndrome malin des neuroleptiques, qui se manifeste par une hyperthermie, une rigidité musculaire, une dystonie neurovégétative, des troubles de la conscience et une élévation des taux sériques de la créatine phosphokinase. D'autres symptômes peuvent être une myoglobinurie (rhabdomyolyse) et une défaillance rénale aiguë. Dans un tel cas, arrêter tous les médicaments antipsychotiques, y compris Risperdal Consta. La rispéridone est encore détectable dans le plasma pendant 6 semaines au moins après la dernière injection de Risperdal Consta.
Réactions d'hypersensibilité
Bien que la tolérance à la rispéridone administrée par voie orale doive être évaluée avant le début du traitement par Risperdal Consta, de très rares cas de réactions anaphylactiques sont survenus pendant la surveillance post-commercialisation chez des patients ayant préalablement bien toléré la rispéridone administrée par voie orale (voir «Posologie/Mode d'emploi» et «Effets indésirables»). Les symptômes d'anaphylaxie comprennent éruption cutanée, urticaire, œdème périphérique, tuméfaction des yeux, tuméfaction de la langue, tuméfaction du visage, forte sudation (hyperhidrose), détresse respiratoire et chute de la tension artérielle (hypotension).
Les patients présentant une hypersensibilité à la rispéridone orale, à la palipéridone ou à l'un des autres composants de la formulation ou du récipient ne doivent pas être traités par Risperdal Consta (voir «Contre-indications»).
L'apparition de réactions d'hypersensibilité impose l'arrêt de l'utilisation de Risperdal Consta; des mesures de soutien générales doivent être instaurées en fonction de l'indication clinique et le patient doit être surveillé jusqu'à la disparition des signes et des symptômes (voir «Contre-indications» et «Effets indésirables»).
Hyperglycémie et diabète sucré
Une hyperglycémie, un diabète sucré et l'exacerbation d'un diabète préexistant ont été rapportés pendant le traitement par Risperdal Consta. L'évaluation de la relation entre l'utilisation d'antipsychotiques atypiques et des anomalies du glucose est compliquée par la possibilité d'une élévation du risque de fond de diabète chez les patients schizophrènes et par l'incidence croissante du diabète dans la population générale. Vu ces facteurs de confusion, le rapport entre l'utilisation d'antipsychotiques atypiques et la survenue d'effets indésirables reliés à une hyperglycémie n'est pas complètement élucidé. Les études épidémiologiques suggèrent cependant qu'il existe un risque accru de survenue d'effets indésirables liés à une hyperglycémie chez les patients traités par des antipsychotiques atypiques. Les patients traités par des antipsychotiques atypiques, y compris par Risperdal Consta, doivent être surveillés à la recherche de symptômes d'une hyperglycémie et d'un diabète.
Prise de poids
Une prise de poids significative a été rapportée lors de l'utilisation de Risperdal Consta. Une surveillance régulière du poids est donc recommandée.
Priapisme
Selon certains rapports, les antagonistes des récepteurs α-adrénergiques peuvent provoquer un priapisme. Un priapisme a été rapporté avec Risperdal depuis la commercialisation (voir rubrique «Effets indésirables»).
Régulation de la température corporelle
Les antipsychotiques peuvent altérer la capacité de l'organisme à diminuer la température corporelle centrale. La prudence est donc recommandée lorsque Risperdal Consta est prescrit à des patients exposés à des situations pouvant contribuer à une augmentation de la température corporelle centrale (p.ex. activité physique fatigante, exposition à une chaleur extrême, administration simultanée de médicaments à effet anticholinergique ou déshydratation).
Effet antiémétique
Les essais précliniques réalisés avec la rispéridone ont révélé un effet antiémétique. L'apparition de cet effet chez l'être humain pourrait masquer les signes et les symptômes d'un surdosage de certaines substances ou de maladies telles qu'occlusion intestinale, syndrome de Reye ou tumeur cérébrale.
Crises épileptiques
Comme tous les antipsychotiques, Risperdal Consta doit être utilisé avec prudence chez les patients ayant des antécédents de crises épileptiques ou présentant d'autres états pouvant s'accompagner d'une diminution du seuil épileptogène.
Syndrome de l'iris hypotonique peropératoire
Des cas de syndrome d'iris hypotonique peropératoire (IFIS) ont été observés lors d'opérations de la cataracte chez des patients traités par des médicaments dotés d'un effet antagoniste sur les récepteurs α1a-adrénergiques, y compris Risperdal Consta.
L'IFIS peut augmenter le risque de complications oculaires pendant et après l'intervention. Avant l'intervention, le chirurgien ophtalmologue doit être informé de la prise actuelle ou antérieure de médicaments dotés d'un effet antagoniste sur les récepteurs α1a-adrénergiques. Le bénéfice potentiel de l'interruption du traitement par les antagonistes α1 avant l'opération de la cataracte n'a pas été étudié et doit être évalué par rapport au risque d'une interruption du traitement antipsychotique.
Tumeurs prolactinodépendantes
Risperdal Consta doit être utilisé uniquement avec prudence chez les patients présentant une tumeur prolactinodépendante (p.ex. prolactinome hypophysaire) ou vraisemblablement prolactinodépendante (p.ex. tumeurs épithéliales du sein).
Administration
Il faut faire très attention à ce que Risperdal Consta ne soit pas injecté par mégarde dans un vaisseau sanguin (voir «Effets indésirables – occlusion de l'artère rétinienne»).
Ce médicament contient moins de 1 mmol (23 mg) de sodium par injection, c.-à-d. qu'il est essentiellement «sans sodium».
Interactions
Les interactions de Risperdal Consta lors de l'utilisation concomitante d'autres médicaments n'ont pas fait l'objet d'études systématiques. Les interactions décrites dans cette rubrique reposent sur des études réalisées avec la rispéridone orale.
Interactions pharmacocinétiques
La rispéridone est essentiellement métabolisée par le CYP2D6 et dans une moindre mesure par le CYP3A4. La rispéridone et son métabolite actif, la 9-hydroxyrispéridone, sont des substrats de la glycoprotéine P (P-gp). Les substances qui modifient l'activité du CYP2D6 ou les inhibiteurs ou inducteurs puissants de l'activité du CYP3A4 et/ou de la P-gp peuvent influencer la pharmacocinétique de la fraction antipsychotique active de la rispéridone.
Interactions pharmacodynamiques
Médicaments à effet central et alcool
Compte tenu des effets primaires de Risperdal sur le SNC, la co-administration avec d'autres médicaments à action centrale ou avec de l'alcool requiert de la prudence.
Lévodopa et agonistes de la dopamine
La rispéridone peut diminuer l'action de la lévodopa et d'autres agonistes de la dopamine. Si cette association est considérée comme nécessaire, notamment au stade terminal de la maladie de Parkinson, la dose efficace la plus faible doit être prescrite lors de chaque traitement.
Psychostimulants
L'utilisation de psychostimulants (p.ex. méthylphénidate) en combinaison avec la rispéridone peut, en cas de modification de l'un des traitements ou des deux traitements, entraîner l'apparition de symptômes extrapyramidaux (voir «Mises en garde et précautions»).
Médicaments hypotenseurs
Une hypotension cliniquement significative a été observée après la commercialisation lors de l'utilisation concomitante de la rispéridone et d'antihypertenseurs.
Médicaments connus pour allonger l'intervalle QT
La prudence est de rigueur lors de la prescription de Risperdal Consta avec des médicaments connus pour allonger l'intervalle QT.
Inducteurs enzymatiques
Inducteurs du CYP3A4 et/ou de la P-gp
L'utilisation concomitante de Risperdal Consta et d'un inducteur puissant du CYP3A4 et/ou de la P‑gp peut diminuer la concentration plasmatique de la fraction antipsychotique active de la rispéridone. Lors de l'instauration ou de l'arrêt de la co-administration de la carbamazépine ou d'un autre inducteur puissant du CYP3A4 et/ou de la P‑gp, le médecin doit réévaluer la posologie de Risperdal Consta.
Inhibiteurs enzymatiques
Inhibiteurs puissants du CYP2D6
L'utilisation concomitante de Risperdal Consta et d'un inhibiteur puissant du CYP2D6 peut augmenter la concentration plasmatique de rispéridone, mais la fraction antipsychotique active est moins fortement touchée. À fortes doses, les inhibiteurs puissants du CYP2D6 peuvent augmenter la concentration de la fraction antipsychotique active de la rispéridone (p.ex. paroxétine, voir ci-dessous). Lors de l'instauration ou de l'arrêt de la co-administration de paroxétine, de bupropion ou d'un autre inhibiteur puissant du CYP2D6, surtout s'ils sont administrés à fortes doses, le médecin doit réévaluer la posologie de Risperdal Consta.
Inhibiteurs du CYP3A4 et/ou de la P-gp
L'utilisation concomitante de Risperdal Consta et d'un inhibiteur puissant du CYP3A4 et/ou de la P‑gp peut entraîner une augmentation importante de la concentration plasmatique de la fraction antipsychotique active de la rispéridone. Lors de l'instauration ou de l'arrêt de la co-administration d'itraconazole ou d'un autre inhibiteur puissant du CYP3A4 et/ou de la P‑gp, le médecin doit réévaluer la posologie de Risperdal Consta.
Autres interactions
Substances fortement liées aux protéines
Lors de l'utilisation concomitante de Risperdal Consta et de médicaments fortement liés aux protéines, aucun des principes actifs ne fait l'objet d'un déplacement cliniquement significatif de sa liaison aux protéines plasmatiques.
Lors de l'utilisation de médicaments associés, il convient de respecter les indications portant sur les voies métaboliques et sur l'éventuelle nécessité d'un ajustement posologique figurant dans l'information professionnelle correspondante.
Patients pédiatriques
Des études d'interactions n'ont été réalisées que chez l'adulte. La pertinence des résultats de ces études pour les patients pédiatriques n'est pas connue.
Exemples
Des exemples de médicaments interagissant potentiellement avec la rispéridone ou n'interagissant pas de manière avérée avec la rispéridone sont répertoriés ci-dessous:
Effet de Risperdal Consta sur d'autres médicaments
Anticonvulsivants:
- La rispéridone n'a pas d'influence cliniquement significative sur la pharmacocinétique du valproate ou du topiramate.
Lithium:
- La rispéridone n'a pas d'influence cliniquement significative sur la pharmacocinétique du lithium.
Effet d'autres médicaments sur Risperdal Consta
Substances antibactériennes:
- L'érythromycine, un inhibiteur modéré du CYP3A4, ne modifie pas la pharmacocinétique de la rispéridone et de la fraction antipsychotique active.
- La rifampicine, un inducteur puissant du CYP3A4 et un inducteur de la P-gp, diminue la concentration plasmatique de la fraction antipsychotique active.
Anticholinestérases:
- La galantamine et le donépézil, deux inhibiteurs de la cholinestérase qui sont des substrats du CYP2D6 et du CYP3A4, n'ont pas d'influence cliniquement significative sur la pharmacocinétique de la rispéridone et de la fraction antipsychotique active.
Anticonvulsivants:
- La carbamazépine, un inducteur puissant du CYP3A4 et un inducteur de la P-gp, diminue la concentration plasmatique de la fraction antipsychotique active de la rispéridone.
- Le topiramate diminue modérément la biodisponibilité de la rispéridone, mais n'a pas d'influence sur la biodisponibilité de la fraction antipsychotique active. Cette interaction n'est donc vraisemblablement pas cliniquement significative.
Antimycosiques:
- L'itraconazole, un inhibiteur puissant du CYP3A4 et un inhibiteur de la P-gp, administré à une posologie de 200 mg/jour, a entraîné une augmentation d'environ 70% des concentrations plasmatiques de la fraction antipsychotique active, à des doses de rispéridone de 2 à 8 mg/jour.
- Le kétoconazole, un inhibiteur puissant du CYP3A4 et un inhibiteur de la P-gp, administré à une posologie de 200 mg/jour, a augmenté la concentration plasmatique de la rispéridone et a diminué la concentration plasmatique de la 9-hydroxyrispéridone.
Antipsychotiques:
- Les phénothiazines peuvent augmenter la concentration plasmatique de la rispéridone, mais n'ont pas d'influence sur la concentration plasmatique de la fraction antipsychotique active.
- Pour l'aripiprazole, un substrat du CYP2D6 et du CYP3A4, il n'existe pas de preuve clinique suffisante permettant d'évaluer un effet éventuel de Risperdal sur la pharmacocinétique de l'aripiprazole et de son métabolite actif, le déhydro-aripiprazole.
Virostatiques:
- Inhibiteurs de la protéase: aucune donnée tirée d'études formelles n'est disponible. Cependant, comme le ritonavir est un inhibiteur puissant du CYP3A4 et un inhibiteur faible du CYP2D6, le ritonavir et les inhibiteurs de la protéase potentialisés par le ritonavir sont susceptibles d'augmenter la concentration de la fraction antipsychotique active de la rispéridone.
Bêtabloquants:
- Certains bêtabloquants peuvent augmenter la concentration plasmatique de la rispéridone, mais n'ont pas d'influence sur la concentration plasmatique de la fraction antipsychotique active.
Inhibiteurs des canaux calciques:
- Le vérapamil, un inhibiteur modéré du CYP3A4 et un inhibiteur de la P-gp, augmente la concentration plasmatique de la rispéridone et de la fraction antipsychotique active.
Glycosides digitaliques:
- La rispéridone n'a pas d'influence cliniquement significative sur la pharmacocinétique de la digoxine.
Diurétiques:
- Furosémide: tenir compte des indications figurant à la rubrique «Mises en garde et précautions» en ce qui concerne la mortalité accrue chez les patients âgés atteints de démence recevant simultanément un traitement par le furosémide.
Médicaments gastro-intestinaux:
- Antagonistes des récepteurs H2: la cimétidine et la ranitidine, deux inhibiteurs faibles du CYP2D6 et du CYP3A4, ont augmenté la biodisponibilité de la rispéridone, mais seulement de manière marginale celle de la fraction antipsychotique active.
ISRS et antidépresseurs tricycliques:
- La fluoxétine, un inhibiteur puissant du CYP2D6, augmente la concentration plasmatique de la rispéridone, mais la fraction antipsychotique active est moins fortement touchée.
- La paroxétine, un inhibiteur puissant du CYP2D6, augmente la concentration plasmatique de la rispéridone, mais à des posologies allant jusqu'à 20 mg/jour, la fraction antipsychotique active est moins fortement touchée. À des doses plus élevées de paroxétine, la concentration de la fraction antipsychotique active de la rispéridone peut cependant augmenter de manière dose-dépendante.
- Les antidépresseurs tricycliques peuvent augmenter la concentration plasmatique de la rispéridone, mais n'ont pas d'influence sur la concentration plasmatique de la fraction antipsychotique active. L'amitriptyline n'a pas d'influence sur la pharmacocinétique de la rispéridone ou de la fraction antipsychotique active.
- La sertraline, un inhibiteur faible du CYP2D6, et la fluvoxamine, un inhibiteur faible du CYP3A4, n'entraînent pas de variations cliniquement significatives de la concentration de la fraction antipsychotique active de la rispéridone, à des posologies allant jusqu'à 100 mg/jour. Cependant, à des doses de sertraline ou de fluvoxamine supérieures à 100 mg/jour, la concentration de la fraction antipsychotique active de la rispéridone peut augmenter.
Grossesse/Allaitement
Grossesse
La sécurité de la rispéridone pour l'utilisation pendant la grossesse n'a pas été étudiée.
Une étude de cohorte rétrospective d'observation, basée sur une banque de données américaine comportant des prestations de soins de santé remboursées, avait comparé le risque de malformations congénitales chez les enfants nés vivants chez des femmes ayant utilisé des antipsychotiques ou non au cours du premier trimestre de la grossesse. Lors de cette étude, une évaluation concrète de la palipéridone, le métabolite actif de la rispéridone, n'avait pas été effectuée. Après ajustement prenant en compte les variantes confondantes dans la banque de données, le risque de malformations congénitales en cas d'utilisation de rispéridone était augmenté par rapport à la non utilisation d'antipsychotiques (risque relatif = 1,26, IC 95%: 1,02-1,56). Aucun mécanisme biologique susceptible d'expliquer cette constatation n'avait pu être identifié et, lors des études précliniques, aucun effet tératogène n'avait été observé. En se fondant sur les résultats de cette unique étude d'observation, aucune relation causale entre l'exposition in utero à la rispéridone et les malformations congénitales n'a été mise en évidence.
Bien que les expérimentations animales n'aient pas mis en évidence de toxicité directe pour la reproduction, quelques effets indirects médiés par la prolactine et par le SNC ont été observés (voir rubrique «Données précliniques»).
Risperdal Consta ne doit pas être administré pendant la grossesse, sauf en cas de nécessité absolue. Si un arrêt du traitement s'avère nécessaire pendant la grossesse, celui-ci devra ne pas être brutal.
Troisième trimestre
Les nouveau-nés dont les mères ont pris des antipsychotiques (dont la rispéridone) pendant le troisième trimestre de la grossesse présentent un risque de symptômes extrapyramidaux et/ou de symptômes de sevrage après la naissance. Ces symptômes chez le nouveau-né peuvent comprendre: agitation, augmentation ou diminution inhabituelle du tonus musculaire, tremblements, somnolence, difficultés respiratoires ou problèmes d'alimentation. Ces complications peuvent avoir un degré de sévérité variable. Dans certains cas, ils ont été autolimitants; dans d'autres cas, les nouveau-nés ont nécessité une surveillance en service de soins intensifs ou une hospitalisation prolongée.
Allaitement
Les études expérimentales effectuées chez l'animal ont montré que la rispéridone et la 9-hydroxyrispéridone sont excrétées dans le lait. Le passage de la rispéridone et de la 9-hydroxyrispéridone dans le lait maternel humain a été démontré. Dans un seul cas, 4,3% de la fraction active (par rapport à la dose de la mère) ont été mesurés dans le lait maternel. En conséquence, les mères traitées par la rispéridone ne devraient pas allaiter.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Risperdal Consta peut influencer négativement toute activité demandant de la concentration et de la vigilance. En conséquence, les patients seront avisés de ne pas conduire un véhicule ou manier des machines compliquées avant que leur capacité de réaction individuelle ait été clarifiée et que le médecin traitant ait parlé de cette évaluation avec eux et la leur ait expliquée.
Effets indésirables
Les effets indésirables les plus fréquemment rapportés (fréquence ≥1/10) sont: insomnie, anxiété, céphalées, infection des voies respiratoires supérieures, parkinsonisme et dépression.
La palipéridone est le métabolite actif de la rispéridone. Les profils d'effets indésirables de ces deux substances (y compris leurs formulations orales et injectables) ont de ce fait une importance réciproque. Ci-après se trouve une liste complète des effets indésirables qui ont été rapportés avec la rispéridone et/ou la palipéridone dans le cadre d'études cliniques et depuis la mise sur le marché. Les termes et fréquences suivantes sont utilisés: très fréquents (≥1/10), fréquents (≥1/100 à <1/10), occasionnels (≥1/1000 à <1/100), rares (≥1/10'000 à <1/1000), très rares (<1/10'000) ainsi que fréquence inconnue (la fréquence ne peut pas être estimée sur la base des données disponibles).
A l'intérieur de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Effets indésirables par classe de systèmes d'organes et par fréquence
Infections et infestations
Très fréquents: infections des voies respiratoires supérieures.
Fréquents: pneumonie, bronchite, sinusite, infection urinaire, grippe.
Occasionnels: infection des voies respiratoires, cystite, infection de l'oreille, infection oculaire, amygdalite, onychomycose, cellulite, infection, infection localisée, infection virale, acrodermatite, abcès sous-cutané.
Affections hématologiques et du système lymphatique
Fréquents: anémie.
Occasionnels: diminution de nombre de globules blancs, thrombopénie, diminution de l'hématocrite.
Rares: neutropénie.
Fréquence inconnue: agranulocytose, diminution de nombre de granulocytes éosinophiles.
Affections du système immunitaire
Occasionnels: hypersensibilité.
Fréquence inconnue: réaction anaphylactique.
Affections endocriniennes
Fréquents: hyperprolactinémiea.
Rares: sécrétion inadéquate de l'hormone antidiurétique.
Troubles du métabolisme et de la nutrition
Fréquents: hyperglycémie, prise de poids, augmentation de l'appétit, perte de poids, baisse de l'appétit.
Occasionnels: diabèteb, anorexie, augmentation des triglycérides, augmentation du cholestérol, glycosurie.
Rares: hypoglycémie, polydipsie.
Très rares: acidocétose diabétique.
Fréquence inconnue: intoxication à l'eau, hyperinsulinémie, coma diabétique.
Affections psychiatriques
Très fréquents: insomniec, dépression, anxiété.
Fréquents: troubles du sommeil, agitation, diminution de la libido.
Occasionnels: manie, confusion, anorgasmie, cauchemars.
Rares: catatonie, somnambulisme, émoussement affectif.
Fréquence inconnue: troubles du comportement alimentaire liés au sommeil (ingestion de nourriture incontrôlée lors des crises de somnambulisme).
Affections du système nerveux
Très fréquents: parkinsonismec, céphalées.
Fréquents: akathisiec, somnolence, dystoniec, vertiges, dyskinésiec, tremblements.
Occasionnels: ischémie cérébro-vasculaire, perte de connaissance, convulsionsc, syncopes, dyskinésie tardive, hyperactivité psychomotrice, troubles de l'équilibre, vertige positionnel, troubles de l'attention, dysarthrie, dysgueusie, hypoesthésie, paresthésie.
Rares: syndrome malin des neuroleptiques, diminution du degré de conscience, tremblements de la tête.
Fréquence inconnue: absence de réponse aux stimuli.
Affections oculaires
Fréquents: vision floue.
Occasionnels: conjonctivite, sécheresse oculaire, sécrétion lacrymale accrue, hyperhémie oculaire.
Rares: troubles de la motricité oculaire, révulsion oculaire, photophobie.
Fréquence inconnue: occlusion de l'artère rétinienne, glaucome, croûtes du bord des paupières, syndrome de l'iris hypotonique peropératoire.
Affections de l'oreille et du labyrinthe
Occasionnels: vertiges, acouphènes, otalgie.
Affections cardiaques
Fréquents: tachycardie.
Occasionnels: fibrillation auriculaire, bloc auriculo-ventriculaire, troubles de la conduction, allongement de l'intervalle QT à l'électrocardiogramme, bradycardie, anomalies à l'électrocardiogramme, palpitations.
Rares: arythmies sinusales.
Fréquence inconnue: syndrome de tachycardie orthostatique posturale.
Affections vasculaires
Fréquents: hypotension, hypertension.
Occasionnels: hypotension orthostatique.
Rares: embolie pulmonaire, thrombose veineuse profonde.
Fréquence inconnue: flush.
Affections respiratoires, thoraciques et médiastinales
Fréquents: dyspnée, douleurs pharyngo-laryngées, toux, nez bouché.
Occasionnels: hyperventilation, obstruction des voies respiratoires, respiration haletante, épistaxis.
Rares: syndrome d'apnées du sommeil, pneumonie d'aspiration, congestion pulmonaire, râle pulmonaire, dysphonie, trouble respiratoire.
Affections gastro-intestinales
Fréquents: gêne abdominale, vomissements, nausées, constipation, gastroentérite, diarrhée, dyspepsie, sécheresse buccale, douleur dentaire.
Occasionnels: incontinence fécale, dysphagie, flatulence.
Rares: pancréatite, obstruction intestinale.
Très rare: iléus.
Fréquence inconnue: gonflement de la langue, fécalome, chéilite.
Affections hépatobiliaires
Fréquents: augmentation des transaminases, augmentation du taux de gamma-glutamyl transférase.
Occasionnels: augmentation du taux des enzymes hépatiques.
Rares: ictère.
Affections de la peau et du tissu sous-cutané
Fréquents: éruption cutanée.
Occasionnels: prurit, alopécie, eczéma, sécheresse cutanée, érythème, coloration de la peau, acné, dermatite séborrhéique.
Rares: exanthème médicamenteux, urticaire, hyperkératose, maladies cutanées, lésion cutanée.
Très rares: angio-œdème.
Fréquence inconnue: syndrome de Stevens-Johnson/nécrolyse épidermique toxique.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: crampes musculaires, douleurs musculosquelettiques, douleur dorsale, arthralgie.
Occasionnels: augmentation du taux de créatine phosphokinase, raideur articulaire, gonflement des articulations, faiblesse musculaire, douleurs de la nuque.
Rares: rhabdomyolyse, posture anormale.
Affections du rein et des voies urinaires
Fréquents: incontinence urinaire.
Occasionnels: pollakiurie, rétention urinaire, dysurie.
Affections gravidiques, puerpérales et périnatales
Très rares: symptômes extrapyramidaux moteurs et/ou phénomènes de sevrage chez le nouveau-né.
Affections des organes de reproduction et du sein
Fréquents: dysfonction érectile, aménorrhée, galactorrhée.
Occasionnels: trouble de l'éjaculation, retard des règles, trouble menstruelc, gynécomastie, dysfonction sexuelle, gêne des seins, pertes vaginales.
Rares: gonflement des glandes mammaires, écoulement mammaire.
Fréquence inconnue: priapisme.
Lésions, intoxications et complications liées aux interventions
Fréquents: chute.
Occasionnels: douleur liée à l'administration.
Troubles généraux et anomalies au site d'administration
Fréquents: œdèmec, pyrexie, gêne thoracique, asthénie, fatigue, douleurs, douleurs au site d'injection, chute.
Occasionnels: œdème facial, frissons, augmentation de la température corporelle, démarche anormale, soif, sensation de maladie, sensation anormale, induration.
Rares: hypothermie, gêne.
Très rares: Réaction anaphylactique après une injection de Risperdal Consta chez des patients qui ont déjà toléré la rispéridone orale.
Fréquence inconnue: diminution de la température corporelle, sensation de froid périphérique, syndrome de sevrage médicamenteux.
a Une hyperprolactinémie peut dans certains cas provoquer une gynécomastie, des troubles menstruels, une aménorrhée et une galactorrhée.
b Des études contrôlées contre placebo ont fait état d'un diabète sucré chez 0,18% des patients traités par la rispéridone contre 0,11% des patients traités par placebo. L'incidence globale de toutes les études cliniques était de 0,43% chez tous les patients ayant reçu de la rispéridone.
c L'insomnie comprend: trouble de l'endormissement, insomnie du milieu de la nuit;
Le parkinsonisme comprend: akinésie, bradykinésie, phénomène de la roue dentée, salivation, symptômes extrapyramidaux moteurs, réflexe fronto-orbiculaire pathologique, raideur musculaire, contractures musculaires, raideur musculosquelettique;
L'akathisie comprend: hyperkinésie, syndrome des jambes sans repos, agitation;
La dystonie comprend: blépharospasme, spasmes cervicaux, emprosthotonos, crampe faciale, hypertonie musculaire, laryngospasme, contractions musculaires involontaires, myotonie, crise oculogyre, opisthotonos, crampe oropharyngée, pleurothotonos, rictus sardonique, tétanie, paralysie de la langue, crampe de la langue, torticolis, trismus;
La dyskinésie comprend: athétose, chorée, mouvements choréoathétosiques, troubles moteurs, secousses musculaires, myoclonie;
Les convulsions comprennent: crises de grand mal;
Les œdèmes comprennent: œdèmes généralisés, œdèmes périphériques, œdème prenant le godet («pitting edema»);
Les troubles menstruels comprennent: règles irrégulières, oligoménorrhée.
Description de certains effets indésirables
Effets de classe
Allongement de l'intervalle QT
Comme pour d'autres antipsychotiques, de très rares cas d'allongement du QT sous rispéridone ont été rapportés après la commercialisation. D'autres effets de classe cardiaques rapportés sous antipsychotiques allongeant l'intervalle QT incluent une arythmie ventriculaire, une fibrillation ventriculaire, une tachycardie ventriculaire, une mort subite, un arrêt cardiaque et des torsades de pointes (voir rubrique «Mises en garde et précautions»).
Prise de poids
Dans une étude contrôlée contre placebo, en double aveugle, d'une durée de 12 semaines, une prise de poids de ≥7% du poids corporel a été constatée en fin d'étude chez 9% des patients traités avec Risperdal Consta par rapport à une augmentation de 6% chez les patients traités par placebo. Durant une étude ouverte d'une année consacrée à Risperdal Consta, les modifications du poids corporel chez quelques patients se situaient en général dans une fourchette de ±7% du poids initial; chez 25% des patients a été enregistrée une prise de poids de ≥7%.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Les cas de surdosage documentés sont limités à la formulation orale:
Signes et symptômes
Les symptômes escomptés sont le résultat d'une amplification des effets pharmacologiques connus. Ils se présentent sous forme de somnolence, de sédation, de tachycardie, d'hypotension et de symptômes extrapyramidaux. Rarement, le surdosage a donné lieu à un prolongement de l'intervalle QT et à des convulsions. Des cas de torsades de pointes ont été rapportés en rapport avec un surdosage simultané de Risperdal et de paroxétine.
Traitement
En cas de surdosage, libérer les voies aériennes et les garder dégagées, assurer un apport suffisant en oxygène et appliquer une ventilation assistée. Surveillance immédiate des fonctions cardiaques et vasculaires. Contrôle ECG permanent, pour détecter une éventuelle arythmie.
Il n'existe pas d'antidote spécifique à Risperdal Consta. Par conséquent, préparer les mesures adéquates. En cas d'intoxication aiguë, prendre en compte la possibilité d'une polyintoxication. Une hypotension et un collapsus circulatoire doivent être traités par les mesures adéquates, comme une perfusion intraveineuse et/ou des médicaments sympathomimétiques. Administrer un anticholinergique en cas de symptômes extrapyramidaux sévères. Maintenir le patient sous étroite surveillance médicale jusqu'à ce qu'il ait récupéré.
Propriétés/Effets
Code ATC
N05AX08
Mécanisme d'action
Risperdal Consta (rispéridone) est un antipsychotique appartenant à une nouvelle classe: les dérivés du benzisoxazole. Il présente une forte affinité pour les récepteurs D2-dopaminergiques et 5HT2-sérotoninergiques. La rispéridone occupe également les récepteurs α1-adrénergiques et, avec une moindre affinité, les récepteurs H1-histaminiques et α2-adrénergiques. La rispéridone ne possède aucune affinité pour les récepteurs cholinergiques. Bien qu'elle soit un puissant antagoniste des récepteurs D2, une caractéristique connue pour influencer favorablement les symptômes positifs de la schizophrénie, la rispéridone diminue moins fortement l'activité motrice et provoque moins souvent une catalepsie que les neuroleptiques classiques. En raison de son antagonisme équilibré des systèmes sérotoninergique et dopaminergique centraux, elle risque moins de provoquer des effets secondaires extrapyramidaux et peut également agir sur les symptômes négatifs et affectifs de la schizophrénie.
L'efficacité de Risperdal Consta (25 mg et 50 mg) dans le traitement des troubles psychotiques (schizophrénie, troubles schizo-affectifs) a été démontrée dans une étude contrôlée contre placebo, d'une durée de 12 semaines, menée auprès de patients psychotiques hospitalisés et ambulatoires et répondant aux critères de schizophrénie du DSM-IV.
Une étude comparative de 12 semaines, menée auprès de patients schizophrènes avec symptomatologie stable, a démontré que l'efficacité de Risperdal Consta était semblable à celle de la formulation orale sous forme de comprimés.
L'efficacité et la sécurité d'emploi de Risperdal Consta lors d'un traitement à long terme (50 semaines) ont fait l'objet d'une étude ouverte menée auprès de patients psychotiques stabilisés, hospitalisés et ambulatoires, répondant aux critères de schizophrénie ou de troubles schizo-affectifs du DSM-IV. L'effet de Risperdal Consta s'est maintenu sur toute la durée de l'étude. (Cette étude n'a pas inclus de groupe de comparaison.)
Pharmacodynamique
Voir Mécanisme d'action
Efficacité clinique
Voir Mécanisme d'action
Pharmacocinétique
Libération du principe actif
Après administration intramusculaire unique de Risperdal Consta, une faible quantité de principe actif est initialement libérée (<1% de la dose). Il s'ensuit une phase de latence de 3 semaines. La libération du principe actif entre dans sa phase principale dès la 3e semaine. Le débit du principe actif reste constant de la 4e à la 6e semaine, et commence à décliner dès la 7e semaine. C'est pourquoi l'administration d'un antipsychotique supplémentaire s'impose au cours des 3 premières semaines de traitement par Risperdal Consta. Lors des essais cliniques, des comprimés de rispéridone ont assuré cette couverture antipsychotique pendant les trois premières semaines.
L'association du profil de libération du principe actif et de l'intervalle entre les injections (injection i.m. toutes les 2 semaines) assure le maintien de taux plasmatiques thérapeutiques. Le taux de principe actif demeure dans l'intervalle thérapeutique 4 à 6 semaines après la dernière injection.
L'élimination se termine 7 à 8 semaines après la dernière injection de Risperdal Consta.
Absorption
Une fois libérée, la rispéridone est entièrement absorbée.
Distribution
La rispéridone se distribue rapidement dans l'organisme. Son volume de distribution apparent (Vd) varie entre 1 et 2 l/kg. La liaison à l'albumine et à l'α1-glycoprotéine acide de la rispéridone s'élève à 88%, celle de son métabolite actif, la 9-hydroxyrispéridone, s'élève à 77%.
Les concentrations plasmatiques minimales et maximales moyennes de la fraction active, obtenues après injections intramusculaires de Risperdal Consta répétées toutes les 2 semaines, sont de 9,9 et 19,2 ng/ml pour le dosage à 25 mg, et de 17,9 et 45,5 ng/ml pour le dosage à 50 mg. La rispéridone présente une pharmacocinétique linéaire dans l'intervalle des dosages situés entre 25 et 50 mg administrés toutes les deux semaines par injections. Les injections de 25 à 50 mg toutes les deux semaines lors d'une utilisation à long terme (12 mois) n'ont occasionné aucune accumulation de rispéridone.
Les études mentionnées ont été menées sur l'injection dans le muscle fessier. Les injections intramusculaires au niveau du muscle deltoïde et du muscle fessier, de dose identique, sont bioéquivalentes et de ce fait sont interchangeables.
Métabolisme
La rispéridone est essentiellement métabolisée dans le foie par le CYP 2D6. Elle est essentiellement dégradée en 9-hydroxyrispéridone, qui exerce une action pharmacologique comparable à celle de la rispéridone. La rispéridone et la 9-hydroxyrispéridone forment ensemble la fraction antipsychotique active.
Le CYP 2D6 présente un polymorphisme génétique (débrisoquine/dextrométhorphane). La transformation de la rispéridone en 9-hydroxyrispéridone est rapide chez les métaboliseurs rapides et lente chez les métaboliseurs lents. C'est pourquoi, chez les métaboliseurs rapides, les taux plasmatiques de rispéridone sont plus bas et ceux de la 9-hydroxyrispéridone plus élevés que chez les métaboliseurs lents. Comme la rispéridone et la 9-hydroxyrispéridone possèdent à peu près la même activité antipsychotique, c'est la somme de leurs concentrations qui est déterminante. C'est pourquoi aucune différence cliniquement pertinente n'a été observée entre les métaboliseurs rapides et les métaboliseurs lents.
La voie de métabolisation par N-désalkylation, qui s'effectue probablement par le CYP3A4, est moins importante.
Élimination
La clairance de la fraction antipsychotique active et de la rispéridone se monte à 5,0 l/h et 13,7 l/h chez les métaboliseurs rapides (concernant le CYP 2D6) et à 3,2 l/h et 3,3 l/h chez les métaboliseurs lents.
Cinétique pour certains groupes de patients
Après administration orale d'une dose unique à des patients âgés et à des insuffisants rénaux, une élévation des taux plasmatiques de la fraction antipsychotique active (la Cmax était environ 1,1 et 1,5 fois plus élevée et l'AUC environ 1,5 et 2,5 fois plus élevée) a été observée. Cela reflète probablement une diminution de la clairance de la fraction antipsychotique active de 30% chez le patient âgé et de 60% chez le patient avec insuffisance rénale. Les concentrations plasmatiques de la rispéridone étaient dans la norme chez les patients ayant une insuffisance hépatique mais la fraction libre moyenne de la rispéridone dans le plasma était augmentée d'environ 35%.
Ces populations de patients n'ont pas fait l'objet d'études pharmacocinétiques spécifiques avec Risperdal Consta. Certaines analyses pharmacocinétiques indiquent cependant que, à la posologie recommandée de 25 mg toutes les 2 semaines, les concentrations plasmatiques chez les patients âgés (>65 ans) et chez les insuffisants rénaux légers à modérés se situent à l'intérieur de l'intervalle observé chez l'adulte normal. Les analyses reposent sur les concentrations de principe actif communiquées dans les études de phase III avec Risperdal Consta (voir «Instructions spéciales pour la posologie»).
Relation entre pharmacocinétique et pharmacodynamique
Aucune des études de phase III, destinées à évaluer l'efficacité et la sécurité d'emploi de Risperdal Consta, n'a décelé de relation entre taux plasmatiques de la fraction antipsychotique active et variation des scores PANSS total (Positive and Negative Syndrome Scale) et ESRS (Extrapyramidal Symptom Rating Scale).
Données précliniques
Lors d'études de toxicité avec administrations répétées chez des rats et des chiens, ce sont principalement des effets pharmacologiques, tels que sédation et effets médiés par la prolactine sur les glandes mammaires et les organes génitaux, qui ont été observés.
Mutagénicité
La rispéridone n'était pas génotoxique dans les tests standards.
Carcinogénicité
Comme prévu pour un puissant antagoniste D2, une étude de carcinogénicité effectuée sur des rats ayant reçu des doses i.m. de 40 mg/kg a relevé une incidence accrue de néoplasies endocriniennes du pancréas, de l'hypophyse et de la médullosurrénale, médiée par la prolactine. Des carcinomes mammaires se sont déclarés aux doses de 5 et 40 mg/kg. L'hypercalcémie observée dans les deux groupes de dosage pourrait avoir contribué à la hausse de l'incidence des tumeurs médullosurrénales. Des rats mâles ont présenté un adénome tubulaire rénal. Aucune tumeur rénale n'est apparue au dosage le plus faible, dans le groupe de contrôle avec NaCl 0,9% ou celui avec microsphères. Le mécanisme par lequel les rats traités par Risperdal Consta ont développé une tumeur rénale reste inconnu. Les études de carcinogénicité de la rispéridone orale sur le rat et la souris n'ont relevé aucune hausse de l'incidence des tumeurs rénales liées au traitement.
Toxicité sur la reproduction
Bien qu'au cours des études sur la rispéridone chez l'animal aucun trouble direct sur la reproduction n'ait été constaté, des effets indirects médiés par la prolactine ont été observés.
La rispéridone n'a entraîné aucun effet tératogène chez le rat et chez le lapin.
Chez le rat, des effets négatifs sur le comportement d'accouplement, le poids à la naissance et la survie de la progéniture ont été observés. D'éventuels troubles comportementaux de la progéniture n'ont pas fait l'objet d'études.
Remarques particulières
Incompatibilités
Risperdal Consta ne doit être mélangé à aucune autre solution ni à aucun autre médicament que la solution pour suspension fournie.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Stabilité après ouverture
La stabilité chimique et physique de la suspension à une température de 25 °C est garantie pendant 24 heures après la préparation. D'un point de vue microbiologique, il est cependant préférable d'utiliser la suspension immédiatement après sa préparation. Si la suspension n'est pas administrée immédiatement après reconstitution, l'utilisateur prend lui-même la responsabilité de la durée et des conditions de conservation. De manière générale, il est déconseillé de dépasser 6 heures à 25 °C, sauf si la reconstitution s'est déroulée dans des conditions d'asepsie contrôlées et validées.
Remarques particulières concernant le stockage
Conserver l'intégralité du conditionnement au réfrigérateur (2-8 °C).
En l'absence de réfrigérateur, Risperdal Consta peut être conservé pendant 7 jours au maximum avant administration à une température ne dépassant pas 25 °C. Ne pas exposer à une température supérieure à 25 °C.
Conserver le récipient dans son emballage en carton pour le protéger de la lumière.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Il est important de respecter, étape par étape, les «Remarques concernant la manipulation», afin de garantir une administration réussie de Risperdal Consta et d'éviter des difficultés lors de l'emploi du kit.
Les microsphères à libération retardée de principe actif (poudre dans le flacon) de Risperdal Consta doivent uniquement être mises en suspension avec la solution jointe (seringue pré-remplie). Concernant l'injection, seule l'aiguille à injection correspondante pour injection dans le muscle fessier (aiguille 2 pouces, 51 mm) ou injection dans le muscle deltoïde (aiguille 1 pouce, 25 mm) présente dans l'emballage doit être utilisée. Ne remplacez aucun des éléments du kit d'injection.
Pour s'assurer que la dose de rispéridone prévue est libérée, l'ensemble du contenu du flacon doit être administré. En cas d'administration incomplète du contenu, la dose de rispéridone prévue risque de ne pas être libérée. Il est recommandé d'administrer le produit immédiatement après la reconstitution.
Sortez l'emballage de Risperdal Consta du réfrigérateur et attendez env. 30 minutes qu'il soit à température ambiante avant de reconstituer la suspension.
Contenu du kit d'injection
- Un flacon contenant des microsphères à libération retardée de principe actif.
- Une seringue pré-remplie contenant le solvant.
- Un adaptateur pour flacon perforable destiné à fixer la seringue pré-remplie (raccord pour la reconstitution de la suspension).
- Deux aiguilles Terumo SurGuard®-3 pour injection intramusculaire (une aiguille à injection 21G UTW 1 pouce (25 mm) munie d'un dispositif de protection de l'aiguille pour injection au niveau du deltoïde, et une aiguille d'injection 20G TW 2 pouces (51 mm) munie d'un dispositif de protection de l'aiguille pour injection dans le muscle fessier).
Instructions d'emploi, manipulation et élimination
Remarques importantes
Afin de garantir une administration réussie de Risperdal Consta, veuillez suivre ces instructions d'emploi étape par étape.
Attendre 30 min
Sortez le conditionnement unitaire du réfrigérateur et laissez-le à température ambiante pendant au moins 30 minutes avant de commencer la reconstitution.
Ne pas le réchauffer d'une autre manière.
Utiliser les éléments fournis
Les éléments contenus dans ce conditionnement unitaire sont spécialement conçus pour l'emploi de Risperdal Consta. Risperdal Consta doit uniquement être reconstitué avec le solvant fourni dans le conditionnement unitaire.
Ne substituer AUCUN des éléments de ce conditionnement unitaire.
Ne pas conserver la suspension reconstituée.
Après la reconstitution, administrer la dose aussi rapidement que possible afin d'éviter la formation d'un sédiment.
Dosage correct
Pour s'assurer que la dose de Risperdal Consta prévue est délivrée, la totalité du contenu du flacon doit être administrée.
DISPOSITIF MÉDICAL À USAGE UNIQUE
Ne pas réutiliser. Les dispositifs médicaux exigent des caractéristiques spécifiques du matériau pour fonctionner comme prévu. Ces caractéristiques ont été vérifiées pour un usage unique. Toute tentative visant à retraiter le dispositif médical pour une réutilisation ultérieure peut nuire à l'intégrité du produit ou altérer sa fonction.
1re étape Assemblage des éléments
Sortez le conditionnement unitaire du réfrigérateur et laissez-le à température ambiante pendant au moins 30 minutes avant de commencer la reconstitution. Ne pas le réchauffer d'une autre manière.
Connexion de l'adaptateur pour flacon perforable avec le flacon
Retrait du capuchon du flacon
Retirez la capsule colorée du flacon. Nettoyez le dessus du bouchon gris avec un tampon d'alcool. Laissez sécher à l'air. Ne pas retirer le bouchon en caoutchouc gris (Fig. A).
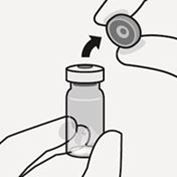
Fig. A
Préparation de l'adaptateur pour flacon perforable
Tenez le blister stérile comme indiqué (Fig. B). Retirez le papier protecteur. Ne pas sortir le dispositif du blister. Ne toucher à aucun moment le perforateur. Ceci provoquerait une contamination.
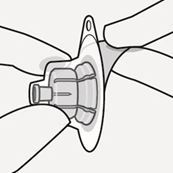
Fig. B
Connexion de l'adaptateur pour flacon perforable avec le flacon
Posez le flacon sur une surface dure et tenez-le par sa base. Tenez l'adaptateur pour flacon perforable au-dessus du centre du bouchon en caoutchouc gris. Enfoncez l'adaptateur pour flacon perforable verticalement sur le dessus du flacon jusqu'à ce qu'il soit bien enclenché (Fig. C).
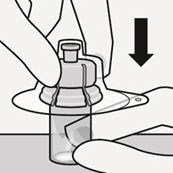
Fig. C
Ne mettez pas l'adaptateur pour flacon perforable en biais, car le solvant pourrait fuir lors du transfert dans le flacon (Fig. D).
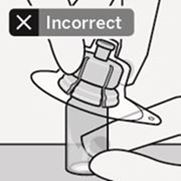
Fig. D
Connexion de la seringue pré-remplie à l'adaptateur pour flacon perforable
Retrait du blister stérile
Ne sortez l'adaptateur pour flacon perforable du blister stérile que lorsque vous êtes prêt à retirer le capuchon blanc de la seringue pré-remplie. Tenez le flacon verticalement pour empêcher toute fuite. Tenez le flacon par sa base et retirez le blister stérile vers le haut.
Ne pas agiter.
Ne pas toucher l'embout Luer exposé sur l'adaptateur pour flacon perforable. Ceci provoquerait une contamination (Fig. E).
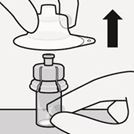

Fig. E
Maintien correct
Tenez la seringue par l'anneau blanc situé à son extrémité. Ne tenez pas la seringue par le cylindre en verre lors de l'assemblage (Fig. F)
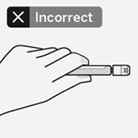
Fig. F
Retrait du capuchon
Tenez l'anneau blanc et cassez net le capuchon blanc.
Ne pas toucher l'extrémité de la seringue. Ceci provoquerait une contamination.
L'aspect de la seringue après le retrait du capuchon est illustré dans la Fig. G. Le capuchon rompu peut être éliminé.
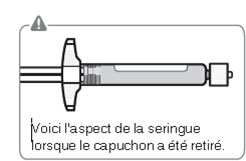
Fig. G.
Connexion de la seringue avec l'adaptateur pour flacon perforable
Maintenez l'adaptateur pour flacon perforable en position, en le tenant par la collerette.
Tenez la seringue par l'anneau blanc et introduisez le perforateur dans l'embout Luer situé sur l'adaptateur pour flacon perforable (Fig. H).
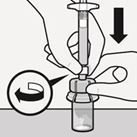
Fig. H
Ne tenez pas la seringue par le cylindre en verre. Ceci pourrait provoquer le desserrement ou le détachement de l'anneau blanc. Connectez la seringue à l'adaptateur pour flacon perforable en tournant fermement dans le sens des aiguilles d'une montre jusqu'à ce qu'elle soit bien fixée. Ne pas serrer trop fortement. Un serrage excessif peut entrainer la rupture de l'extrémité de la seringue.
2e étape Reconstitution des microsphères
Injection du solvant
Injectez la totalité du solvant de la seringue dans le flacon.
Le contenu du flacon est alors sous pression. Maintenez le piston enfoncé avec le pouce (Fig. I).
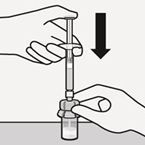
Fig. I
Mise en suspension des microsphères dans le solvant
Tout en maintenant le piston enfoncé, agitez vigoureusement la seringue et le flacon pendant au moins 10 secondes (Fig. J).
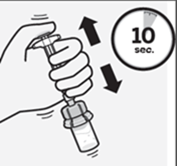
Fig. J
Examinez la suspension. Dès que le mélange est correct, la suspension prend un aspect homogène, visqueux et laiteux. Les microsphères deviennent visibles dans le liquide. Passez immédiatement à l'étape suivante afin que la suspension ne sédimente pas.
Transfert de la suspension dans la seringue
Retournez le flacon à l'envers. Tirez lentement sur le piston pour aspirer la totalité du contenu du flacon dans la seringue (Fig. K).
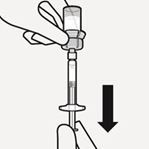
Fig. K
Retrait de l'adaptateur pour flacon perforable
Tenez la seringue par l'anneau blanc et dévissez-la de l'adaptateur pour flacon perforable. Déchirez la partie détachable de l'étiquette du flacon le long des perforations. Apposez cette étiquette sur la seringue dans un but d'identification (Fig. L).
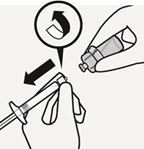
Fig. L
Éliminez le flacon et l'adaptateur pour flacon perforable selon les normes en vigueur.
3e étape Fixation de l'aiguille
Choix de l'aiguille appropriée
Choisissez l'aiguille correspondant au site d'injection (muscle fessier ou deltoïde) (Fig. M).
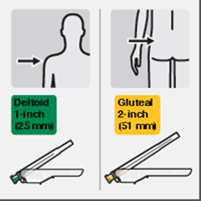
Fig. M
Fixation de l'aiguille
Retirez à moitié le blister et utilisez celui-ci pour saisir l'aiguille par sa base, comme illustré (Fig. N).
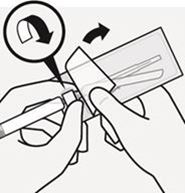
Fig. N
Tout en tenant l'anneau blanc de la seringue, fixez l'embout Luer de l'aiguille sur la seringue en tournant fermement son extrémité dans le sens des aiguilles d'une montre, jusqu'à ce qu'elle soit bien fixée.
Ne pas toucher l'embout Luer de l'aiguille. Ceci provoquerait une contamination.
Remise en suspension des microsphères
Retirez complètement le blister. Immédiatement avant l'injection, agitez encore une fois vigoureusement la seringue, car quelques microsphères pourraient avoir sédimenté (Fig. O).
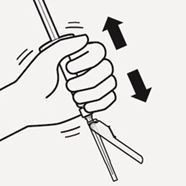
Fig. O
4e étape Injection de la dose
Retrait du capuchon protecteur transparent de l'aiguille
Rabattez le dispositif de sécurité de l'aiguille vers l'arrière, comme indiqué. Puis tenez l'anneau blanc de la seringue et retirez prudemment le capuchon protecteur transparent de l'aiguille en tirant dans l'axe (Fig. P).
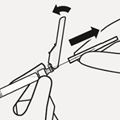
Fig. P
Ne pas dévisser le capuchon protecteur transparent de l'aiguille, car l'embout Luer pourrait se désolidariser.
Élimination des bulles d'air
Tenez l'aiguille verticalement et tapotez doucement pour faire remonter les bulles d'air. Poussez lentement et prudemment sur le piston pour faire sortir l'air (Fig. Q).
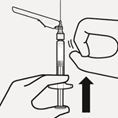
Fig. Q
Injection
Injectez immédiatement tout le contenu de la seringue en intramusculaire (i.m.) dans le muscle fessier ou deltoïde du patient. L'injection dans le muscle fessier s'effectue dans le quart supéro-externe de la région fessière (Fig. R).
Fig. R
Ne pas administrer par voie intraveineuse.
Recouvrir l'aiguille avec le dispositif de sécurité
Tenez le dispositif de sécurité de l'aiguille d'une main, à un angle de 45 degrés contre une surface dure et plane. Appuyez-le vers le bas par un mouvement rapide et vigoureux jusqu'à ce que l'aiguille s'enclenche complètement dans le dispositif de sécurité de l'aiguille (Fig. S).
Fig. S
Évitez les blessures par piqûre d'aiguille:
N'utilisez pas les deux mains.
Ne détachez pas intentionnellement le dispositif de sécurité de l'aiguille et ne l'utilisez pas de manière incorrecte.
N'essayez pas de redresser l'aiguille ou d'enclencher le dispositif de sécurité si l'aiguille est courbée ou endommagée.
Élimination correcte des aiguilles
Assurez-vous que le dispositif de sécurité de l'aiguille est complètement enclenché. Éliminez la seringue et l'aiguille dans un collecteur de seringues conforme à la réglementation.
Éliminez également l'aiguille non utilisée, fournie dans le conditionnement unitaire (Fig. T).

Fig. T
Numéro d’autorisation
56092 (Swissmedic).
Titulaire de l’autorisation
Janssen-Cilag AG, Zug, ZG.
Mise à jour de l’information
Septembre 2020
Éléments fournis dans le conditionnement unitaire
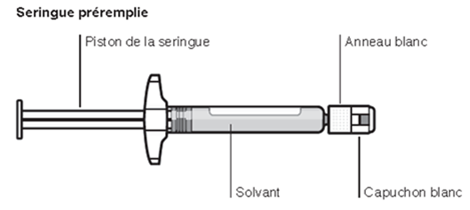
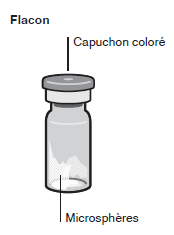
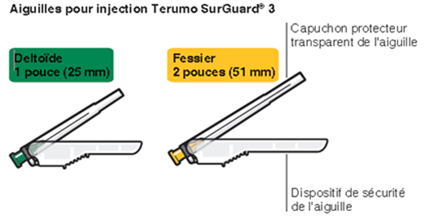
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


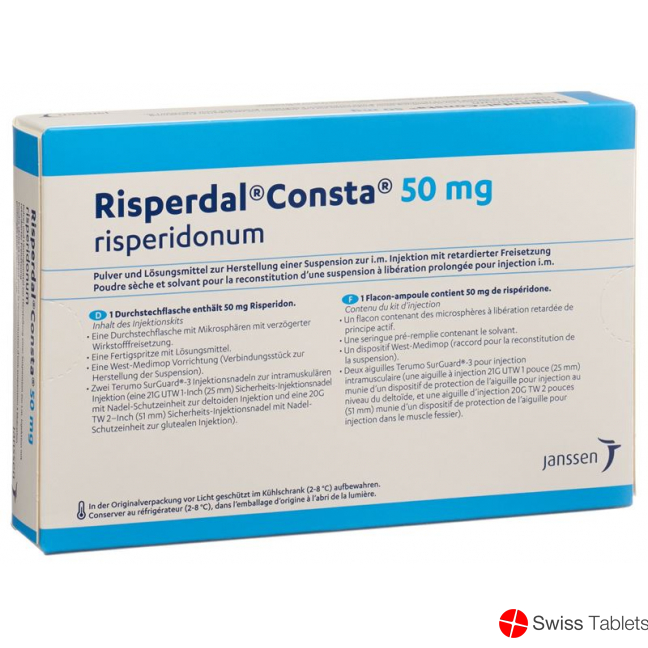
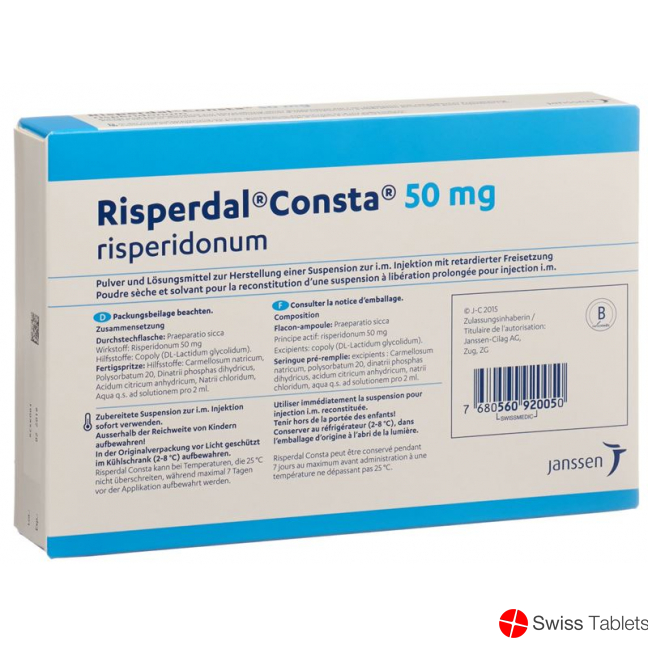
 Deutsch
Deutsch French
French