Granocyte Trockensubstanz 33.6 Mio E C Solv 5 Stück buy online
Granocyte Trockensub 33.6 Mio IE mit Solvens 5 Stk
-
881.13 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: SANOFI-AVENTIS
- Product Code: 2343678
- ATC-code L03AA10
- EAN 7680521702060
Ingredients:
Arginin 10 mg, Phenylalanin 10 mg, Mannitol 25 mg, Natriumchlorid 1.4 mg, Methionin 1 mg, Trockensubstanz, Lösungsmittel, Wasser für Injektionszwecke 1 ml, Polysorbat 20 0.1 mg, Lenograstim 263 mcg , pro vitro, Salzsäure zur pH-Wert-Einstellung.

Description
Zusammensetzung
Wirkstoffe
Lenograstim (rHuG-CSF) (rHuG-CSF bedeutet: rekombinierter humaner Granulozyten-Kolonien-stimulierender Faktor).
Hilfsstoffe
L-argininum 10 mg, L-phenylalaninum 10 mg, L-methioninum 1 mg, Mannitolum 25 mg, Polysorbatum 20 0,1 mg, Acidum Hydrochloridum q.s. pH 6,5, Natrii Chloridum ca. 0,6 mg resp. 1,4 mg.
Lösungsmittel: Aqua ad iniectabilia 1,0 ml.
Darreichungsform und Wirkstoffmenge pro Einheit
Stechampullen mit Lyophilisat: Lenograstim (rHuG-CSF) 13,4 Mio.I.E.* (105 µg) resp. 33,6 Mio.I.E.* (263 µg).
*Die Einheiten werden mit Hilfe der biologischen GNFS-60 in-vitro Methode im Vergleich zum internationalen Standard der WHO für humanen G-CSF bestimmt. 1 µg rHuG-CSF entspricht 0,128 Mio. I.E.
Indikationen/Anwendungsmöglichkeiten
- Verkürzung der Dauer und Reduktion der Schwere von Neutropenien bei Patienten, die wegen einer malignen Erkrankung mit einer stark myelosuppressiven, zytotoxischen Chemotherapie behandelt werden, ausgenommen bei chronischer myeloischer Leukämie und Myelodysplasie.
- Verkürzung der Dauer von Neutropenien bei hochdosierter zytotoxischer Chemotherapie mit anschliessender autologer/allogener Knochenmarktransplantation.
- Mobilisierung peripherer Vorläuferzellen (PBPCs) für die autologe Transplantation allein oder nach myelosuppressiver Chemotherapie.
- Mobilisierung peripherer Vorläuferzellen (PBPCs) bei gesunden Spendern für die allogene Transplantation.
Als Anwendungsmöglichkeit:
Verkürzung der Dauer von Neutropenien bei Patienten mit de novo schwerer idiopathischer aplastischer Anämie unter Immuno-Suppression mit Antilymphozytenglobulin und Ciclosporin. Der Effekt auf klinische Endpunkte (Infekte, Mortalität) ist nicht belegt.
Dosierung/Anwendung
Eine Behandlung mit Granocyte darf nur in Zusammenarbeit mit in der G-CSF Therapie erfahrenen Onkologen und Hämatologen durchgeführt werden.
Dosisanpassung/Titration
Granocyte 13 wird bei Patienten mit einer Körperoberfläche bis zu 0,7 m2 und Granocyte 34 von mehr als 0,7 m2 verwendet.
Die empfohlene Dosierung von Granocyte:
- bei Knochenmarktransplantation,
- nach stark myelosuppressiver zytotoxischer Chemotherapie,
- zur PBPC-Mobilisierung nach myelosuppressiver Chemotherapie,
- bei schwerer idiopathischer aplastischer Anämie unter Immuno-Suppression mit Antilymphozytenglobulin und Ciclosporin (die Dosis ist täglich als subkutane Injektion über maximal die ersten 6 Monate der immunosuppressiven Therapie zu verabreichen) beträgt 19,2 Mio.I.E. (150 µg)/m2/Tag entsprechend einer Dosis von 0,64 Mio.I.E. (5 µg) kg und pro Tag:
Die empfohlene Dosierung von Granocyte als Monotherapie für die PBPC-Mobilisierung beträgt 1,28 Mio.I.E. (10 µg)/kg/Tag.
Erwachsene
Bei Knochenmarktransplantation:
Die empfohlene Dosis Granocyte beträgt 19,2 Mio.I.E. (150 µg)/m2/Tag entsprechend 0,64 Mio.I.E. (5 µg) pro kg und pro Tag und wird 1-mal täglich verabreicht. Die Behandlung beginnt am Tag nach der Transplantation und wird entweder als i.v. Infusion über 30 Minuten – Granocyte 13 wird in 50 ml isotonischer NaCl-Lösung und Granocyte 34 in 100 ml verdünnt – oder als subkutane Injektion verabreicht (siehe «Hinweise für die Handhabung»). Die tägliche Verabreichung wird über den erwarteten Nadir (tiefster Wert an neutrophilen Granulozyten) hinaus fortgesetzt, bis die Neutrophilenzahl bei ≥1x 109/l an 3 aufeinanderfolgenden Tagen liegt. Falls nötig, kann Granocyte an bis zu 28 aufeinanderfolgenden Tagen gegeben werden. Erfahrungsgemäss normalisiert sich die Neutrophilenzahl bei 50% der Patienten bis zum 14. Tag nach der Knochenmarktransplantation.
Nach stark myelosuppressiver, zytotoxischer Chemotherapie:
Die empfohlene Dosis Granocyte wird – beginnend am Tag nach Abschluss der Chemotherapie – täglich als subkutane Injektion verabreicht. Die tägliche Verabreichung wird über den erwarteten Nadir (tiefster Wert an neutrophilen Granulozyten) hinaus fortgesetzt, bis die Neutrophilenzahl bei ≥1 x 109/l an 3 aufeinanderfolgenden Tagen liegt. Dies wird in der Regel 8-14 Tage nach Behandlungsbeginn erreicht. Falls nötig kann Granocyte an bis zu 28 aufeinanderfolgenden Tagen gegeben werden. Selbst wenn innerhalb der ersten 2 Tage der Behandlung ein vorübergehender Anstieg der Neutrophilenzahl beobachtet wird, so wird unter fortgesetzter Behandlung der nachfolgende Nadir in der Regel früher erreicht, und die Zahl der Neutrophilen erholt sich schneller.
Zur PBPC-Mobilisierung nach myelosuppressiver Chemotherapie:
Die empfohlene Dosis Granocyte von 19,2 Mio.I.E. (150 µg)/m2/Tag, entsprechend 0,64 Mio.I.E. (5 µg) pro kg und Tag wird – beginnend am Tag nach der Beendigung der Chemotherapie – als tägliche subkutane Injektion verabreicht, bis der erwartete Nadir überschritten ist und die Neutrophilenzahl wieder im Normbereich liegt, was einen Abbruch der Behandlung mit Granocyte erlaubt.
Die Leukapherese sollte während des Zeitraums durchgeführt werden, in dem die Leukozytenzahl nach dem Nadir steigt oder nach Bestimmen der CD34+ Zellen im Blut mit einer validierten Methode. Für Patienten, die sich vorher keiner umfangreichen Chemotherapie unterzogen haben, reicht oft schon eine Leukapherese aus, um den empfohlenen Minimalertrag (> 2,0 x 106 CD34+ Zellen/kg) zu erreichen.
Zur PBPC-Mobilisierung mit Granocyte als Monotherapie (ohne Chemotherapie):
Die empfohlene Dosis Granocyte von 38,4 Mio.I.E. (300 µg)/m2/Tag entsprechend einer Dosis von 1,28 Mio.I.E. (10 µg) pro kg und pro Tag ist täglich als subkutane Injektion über 4 bis 6 Tage zu verabreichen. Die Leukapherese sollte zwischen Tag 5 und Tag 7 durchgeführt werden. Bei Patienten, die sich vorher nicht einer umfangreichen Chemotherapie unterzogen haben, ist eine Leukapherese oft ausreichend, um den empfohlenen Minimalertrag (≥2,0 x 106 CD34+ Zellen/kg) zu bekommen.
Zur PBPC-Mobilisierung bei gesunden Spendern für die allogene Transplantation:
Die empfohlene Dosis Granocyte von 38,4 Mio.I.E. (300 µg)/m2/Tag entsprechend einer Dosis von 1,28 Mio.I.E. (10 µg) pro kg und pro Tag ist täglich als subkutane Injektion über 4 bis 6 Tage zu verabreichen. Die Leukapherese sollte zwischen Tag 5 und Tag 7 durchgeführt werden. Dieses Vorgehen erlaubt das Sammeln von ≥3 x 106 CD34+ Zellen pro kg Körpergewicht, wobei dieser Wert bei 83% der Fälle nach einer Leukapherese und bei 97% nach zwei Leukapheresen erreicht wird.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Ältere Patienten
Klinische Studien mit Granocyte haben gezeigt, dass für ältere Patienten keine spezielle Dosierungsempfehlung notwendig ist.
Es bestehen Hinweise, dass bei älteren Personen die Mobilisierung von PBPC's schwieriger ist bzw. für die allogene Transplantation höhere Dosen an G-CSF benötigt werden.
Kinder und Jugendliche
Die Wirksamkeit, Verträglichkeit und Sicherheit von Granocyte konnte bei Kindern ab 2 Jahren mit Knochenmarktransplantationen belegt werden.
Kontraindikationen
Granocyte ist kontraindiziert bei Patienten oder gesunden Spendern mit bekannter Überempfindlichkeit gegen den Wirkstoff oder andere Bestandteile des Präparates (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Granocyte soll nicht bei gleichzeitiger Chemotherapie verabreicht werden.
Granocyte soll nicht dazu verwendet werden, um bei anerkannten Chemotherapieschemata die Dosierung zu steigern und/oder die Zeitintervalle zu verkürzen.
Die Wirksamkeit und Sicherheit von Granocyte bei Patienten mit Myelodysplasie oder chronischer myeloischer Leukämie wurde nicht untersucht. Deshalb soll Granocyte bei Vorliegen dieser Krankheiten nicht angewendet werden.
Warnhinweise und Vorsichtsmassnahmen
Relative Kontraindikationen
Malignes Zellwachstum:
In vitro können Granulozyten-Kolonien-stimulierende Faktoren das Wachstum von Zellen myeloischen Ursprungs fördern. Ähnliche Effekte können aber auch bei gewissen Zellen nicht-myeloischen Ursprungs beobachtet werden.
Es besteht somit das theoretische Risiko der Stimulation eines malignen Klons mit Übergang in ein myelodysplastisches Syndrom bzw. akute Leukämie oder in eine paroxysmale nächtliche Hämoglobinurie bei erfolgreich behandelter schwerer aplastischer Anämie.
Der klinische Nutzen von Granocyte bei Patienten mit akuter myeloischer Leukämie, die jünger als 55 Jahre sind, wurde nicht eindeutig geklärt.
Besondere Vorsicht ist bei der diagnostischen Unterscheidung der Blastentransformation einer chronischen myeloischen Leukämie von einer akuten myeloischen Leukämie geboten.
Da in klinischen Studien bisher nicht gezeigt werden konnte, ob Granocyte das Fortschreiten von myelodysplastischen Syndromen zu akuter myeloischer Leukämie beeinflusst, sollte Granocyte nur mit Vorsicht bei prämalignen myeloischen Zuständen angewendet werden. Da in Ausnahmefällen die Zellen gewisser Tumoren G-CSF-Rezeptoren exprimieren können, ist Vorsicht geboten, falls unter rHuG-CSF-Therapie unerwartet ein Wiederanwachsen eines Tumors beobachtet wird.
Leukozytose:
Es wurden keine Leukozytenwerte von über 50 x 109/l beobachtet bei Patienten, die in klinischen Studien nach einer Knochenmarktransplantation mit Granocyte (0,64 Mio.I.E. resp. 5 µg/kg/Tag) behandelt worden sind.
Bei weniger als 5% der Patienten unter zytotoxischer Chemotherapie und einer Granocyte-Dosierung von 0,64 Mio.I.E. (5 µg)/kg/Tag wurden Leukozytenkonzentrationen von 70 x 109/l und mehr gesehen. Über Nebenwirkungen, die direkt mit einem solchen Grad an Leukozytose in Verbindung stehen, wurde nicht berichtet. In Anbetracht der mit einer schweren Leukozytose verbundenen möglichen Risiken, sollten während einer Therapie mit Granocyte regelmässige Kontrollen des weissen Blutbildes erfolgen. Bei Leukozytenwerten von mehr als 50 x 109/l nach überwundenem Nadir (tiefster Wert an neutrophilen Granulozyten), sollte Granocyte sofort abgesetzt werden.
Mobilisierung von PBPC's bei gesunden Spendern zur allogenen Transplantation:
Wenn die Leukozyten auf über 70 x 109/l ansteigen, muss abgewogen werden, ob die Mobilisierung fortgesetzt oder abgebrochen wird, da die Mobilisierung nicht einfach abgesetzt werden kann, wenn der Empfänger schon konditioniert ist.
Pulmonale Symptome:
Selten (>0,01% und <0,1%) kann es zu pulmonalen Nebenwirkungen wie interstitieller Pneumonie, Lungenödem, Dyspnoe, Lungeninfiltraten oder Lungenfibrose kommen.
Das Auftreten von pulmonalen Symptomen (wie Husten, Fieber und Dyspnoe) in Verbindung mit radiologischen Hinweisen (wie pulmonale Infiltrate) sowie bei Verschlechterung der Lungenfunktion kann erstes Anzeichen eines bevorstehenden Atemstillstands oder eines akuten Atemnotsyndroms sein.
Die Behandlung mit Granocyte sollte umgehend unterbrochen werden und eine angemessene Therapie eingeleitet werden.
Nach Markteinführung wurde bei gesunden Spendern und bei den Patienten über pulmonale unerwünschte Ereignisse (Hämoptyse, pulmonale Hämorrhagie, Lungeninfiltrate, Dyspnoe und Hypoxie) berichtet. Im Falle von erwarteten oder bestätigten pulmonalen unerwünschten Ereignissen sollte der Abbruch der Therapie mit Granocyte erwogen und eine angemessene medizinische Versorgung sichergestellt werden.
Bei Knochenmarktransplantation:
Die Thrombozyten Wiedergewinnung sollte besonders überwacht beobachtet werden, da in einer doppelblinden Placebo-kontrollierten Studie die mittlere Thrombozytenzahl geringer war als in das Placebo Vergleichsgruppe. Die Auswirkung von Granocyte auf die Häufigkeit und Schwere von akuten und chronischen Abstossungsreaktionen (Graft versus Host Disease) konnte nicht eindeutig geklärt werden.
Bei begonnener zytotoxischer Chemotherapie:
Die Anwendung von Granocyte wird nicht empfohlen 24h vor Beginn der Chemotherapie bis 24 Stunden nach Beendigung der Chemotherapie.
Risiken bei erhöhten Dosierungen während einer Chemotherapie:
Die Wirksamkeit und Sicherheit von Granocyte bei intensivierter Chemotherapie ist bisher nicht belegt. Granocyte soll deshalb nicht verwendet werden, um die Intervalle zwischen den Chemotherapie Zyklen unter die anerkannten Limiten zu verkürzen und/oder die Dosierung der Chemotherapeutika zu erhöhen. In einer Phase II-Studie zur Intensivierung der Chemotherapie mit Granocyte waren toxische (nicht-myeloische) Erscheinungen der Chemotherapie die limitierenden Faktoren.
Spezielle Vorsichtsmassnahmen bei PBPC-Mobilisierung
Wahl der Mobilisierungsmethode:
Klinische Studien bei gleicher Patientenpopulation haben gezeigt, dass die PBPC-Mobilisierung grösser war mit Granocyte nach myelosuppressiver Chemotherapie, als nach alleiniger Verabreichung von Granocyte. Die Messungen wurden im gleichen Labor durchgeführt. Trotzdem soll die Wahl zwischen den zwei Mobilisierungsmethoden in Bezug auf die gesamten Behandlungsziele für jeden Patienten individuell in Betracht gezogen werden.
Vorangehende Behandlung mit zytotoxischen Wirkstoffen und/oder einer Strahlentherapie:
Für Patienten, die sich vorher einer umfangreichen myelosuppressiven Chemotherapie und/oder intensiven Strahlentherapie unterzogen haben, kann es schwierig sein, den empfohlenen Minimalertrag (≥2 x 106 CD34+Zellen/kg) und dementsprechend eine hinreichende hämatologische Wiederherstellung zu erlangen.
Ein PBPC-Transplantationsprogramm sollte bereits in der frühen Phase des Behandlungsschemas eines Patienten festgelegt werden und vor der Verabreichung einer hochdosierten Chemotherapie sollte der Zahl der mobilisierten PBPC besondere Beachtung geschenkt werden. Falls der Ertrag gering ist, sollte das PBPC-Transplantationsprogramm durch andere Behandlungsmöglichkeiten ersetzt werden.
Bestimmung des Ertrags von Vorläuferzellen:
Auf die Methode zur Quantifizierung des Ertrags von Vorläuferzellen soll speziell geachtet werden, da die Resultate der durchflusszytometrischen Bestimmungen der CD34+ Zellzahlen von verschiedenen Labors variieren können.
Die Angabe zum minimalen Ertrag von ≥2,0 x 106 CD34+ Zellen/kg basiert auf publizierten Erfahrungen, bei denen adäquate hämatologische Wiederherstellung erreicht wurde. Der minimale Ertrag an CD34+ Zellen ist jedoch nicht definitiv belegt; Erträge ≥2,0 x 106 CD34+ Zellen/kg stehen im Zusammenhang mit einer schnelleren Wiederherstellung (inkl. Thrombozyten), währenddem bei tieferen Erträgen eine langsamere Wiederherstellung erfolgt.
In den Studien zur PBPC-Mobilisierung bei gesunden Spendern zur allogenen Transplantation wurden Erträge von CD34+ Zellen von ≥3 x 106 /kg Körpergewicht angestrebt.
Bei gesunden Spendern:
Das PBPC-Mobilisierungsverfahren, welches dem gesunden Spender keinen direkten Nutzen bringt, soll nur nach genauer Abklärung und – wenn anwendbar – gemäss den gesetzlichen Bestimmungen (Blut-Kontrollverordnung) in Betracht gezogen werden.
Die Wirksamkeit und Verträglichkeit von Granocyte bei gesunden Spendern im Alter von über 60 Jahren ist nicht untersucht worden. Die Durchführung der PBPC-Mobilisierung bei älteren Spendern wird deshalb nicht empfohlen. Aufgrund von lokalen Bestimmungen und des Fehlens von klinischen Daten ist die Durchführung der PBPC-Mobilisierung bei minderjährigen Spendern nicht in Betracht zu ziehen.
Die Durchführung der PBPC-Mobilisierung soll bei Spendern vorgesehen werden, die die Auswahlkriterien für eine Knochenmarkspende in Bezug auf klinische Befunde und Laborparameter erfüllen und insbesondere normale hämatologische Werte aufweisen.
Eine deutliche Leukozytose (WBC ≥50 x 109/l) wurde bei 24% der untersuchten gesunden Spender beobachtet.
Über Apherese-bedingte Thrombozytopenie (Thrombozytenzahl <100 x 109/l) wurde bei 42% der untersuchten Spender berichtet und Werte von <50 x 109/l wurden gelegentlich nach einer Leukapherese gemessen. Klinisch relevante unerwünschte Wirkungen traten nicht auf und die Werte normalisierten sich wieder.
Aus diesem Grund soll die Leukapherese nicht durchgeführt werden bei Spendern, die antikoaguliert sind oder bei Spendern mit bekannten Störungen der Hämostase. Falls mehr als eine Leukapherese angezeigt ist, soll vor der Apherese den Spendern mit einer Plättchenzahl von <100 x 109/l spezielle Beachtung geschenkt werden; bei einer Plättchenzahl von <75 x 109/l sollte im Allgemeinen keine Apherese durchgeführt werden.
Im Falle der schon eingeleiteten Konditionierung des Empfängers muss abgewogen werden, ob die Apherese dennoch durchgeführt werden soll.
Das Legen eines Zentralvenenkatheters soll, wenn möglich, vermieden werden und die Auswahl der Spender soll unter Berücksichtigung des venösen Zugangs erfolgen.
Bei gesunden Spendern wurden nach Anwendung von G-CSF vorübergehende zytogenetische Veränderungen beobachtet. Die Bedeutung dieser Veränderungen ist unbekannt.
Die Erhebung von Langzeitsicherheitsdaten bei PBPC-Spendern dauert an. Das Risiko einer Stimulation eines malignen myeloischen Klons kann jedoch nicht ausgeschlossen werden. Es wird daher empfohlen, dass die Apherese-Zentren eine systematische Dokumentation und Nachbeobachtung der PBPC-Spender über mindestens 10 Jahre vornehmen, um die Überwachung der Langzeitsicherheit zu gewährleisten.
Bei Empfängern von allogenen peripheren Vorläuferzellen mobilisiert mit Granocyte:
Die allogene Vorläuferzell-Transplantation könnte mit einem erhöhten Risiko einer chronischen «Graft-versus-host»-Reaktion verbunden sein; Langzeitdaten über das Funktionsverhalten des Transplantates sind spärlich.
Bei Patienten mit schwerer aplastischer Anämie:
Eine Behandlung der schweren aplastischen Anämie mit Immuno-Suppression und Granocyte sollte immer an einem Zentrum mit Erfahrung in der Behandlung der schweren aplastischen Anämie und nach sorgfältiger Diagnosestellung, und unter Ausschluss von myelodysplastischem Syndrom und Monosomie 7 (durch zytogenetische Untersuchung mittels Kultur oder FISH-Untersuchung) erfolgen.
Weitere spezielle Vorsichtsmassnahmen:
Bei Patienten mit Chemotherapie-bedingten myelotoxischen Erscheinungen oder nach Knochenmarktransplantationen sollte die Entwicklung der Thrombozytenwerte mit besonderer Sorgfalt überwacht werden, da die mittlere Thrombozytenzahl bei Patienten unter Granocyte im Vergleich zu Placebo leicht vermindert sein kann. Dies führte in den durchgeführten Studien jedoch nicht zu vermehrten, in Verbindung mit dem Blutverlust stehenden unerwünschten Wirkungen, und die durchschnittliche Anzahl der Tage mit Thrombozyten-Infusionen nach der Knochenmarktransplantation war in beiden Gruppen etwa gleich.
Bei Patienten mit schwerer Leber- oder Niereninsuffizienz liegen keine Erfahrungen vor.
Bei Patienten mit beträchtlich reduzierter Anzahl an Vorläuferzellen (z.B. nach extensiver Radio- oder Chemotherapie), kann die Erholung der Neutrophilen vermindert sein. Die Sicherheit von Granocyte wurde in diesen Fällen bisher nicht belegt.
Die Wirksamkeit und Sicherheit von Granocyte sind bei Patienten unter N-Nitrosoharnstoff-Therapie ohne anschliessende Knochenmarktransplantation bisher nicht belegt.
Die Anwendung von Granocyte könnte möglicherweise eine verstärkte schädliche Wirkung auf die Thrombozyten auslösen.
Granocyte enthält 10 mg Phenylalanin pro Ampulle. Dies ist bei Patienten mit Phenylketonurie zu berücksichtigen.
Bei gesunden Spendern und Patienten kam es nach Anwendung von Granulozyten-Wachstumsfaktor (G-CSFs) häufig zu im Allgemeinen asymptomatischen Fällen von Splenomegalie und vereinzelt zu einer Milzruptur. Deshalb sollte die Milzgrösse sorgfältig beobachtet werden (z.B. klinische Untersuchung, Ultraschall). Die Diagnose Milzruptur sollte erwogen werden, wenn über linksseitige Oberbauchbeschwerden oder Schmerzen in der Schulterspitze geklagt wird.
Die Zusammensetzung der Kappe am Ende der Fertigspritze kann Latex-Gummi enthalten (siehe Information auf der Umverpackung), welcher bei empfindlichen Personen schwere allergische Reaktionen verursachen kann.
Es wurde von einem Kapillarlecksyndrom nach der Verabreichung von G-CSF berichtet, das durch Hypotonie, Hypalbuminämie, Ödeme und eine Hämokonzentration gekennzeichnet ist.
Falls Patienten Symptome eines Kapillarlecksyndroms entwickeln, muss die Verabreichung von Lenograstim sofort unterbrochen werden und es muss eine geeignete symptomatische, u. U. intensivmedizinische Therapie eingeleitet werden (siehe Abschnitt «Unerwünschte Wirkungen»).
Bei Patienten, die gesunde Träger der Sichelzellen-Erbanlage sind oder an Sichelzellenanämie leiden, kann die Anwendung von Lenograstim potenziell mit dem Auftreten einer Sichelzellkrise assoziiert sein.
Aus diesem Grund ist Granocyte bei Patienten, die gesunde Träger der Sichelzellen-Erbanlage sind oder an Sichelzellenanämie leiden, nur mit besonderer Vorsicht anzuwenden.
Glomerulonephritis:
Bei Patienten und Spendern, die Lenograsim erhielten, wurde über Fälle von Glomerulonephritis berichtet. Die Glomerulonephritis klang in der Regel nach Dosisreduktion oder Absetzung des G-CSF ab. Eine Urinuntersuchung wird empfohlen.
Aortitis:
Nach Verabreichung von G-CSF an gesunde Probanden und Krebspatienten wurde über Fälle von Aortitis berichtet. Die beobachteten Symptome umfassten Fieber, Bauchschmerzen, Unwohlsein, Rückenschmerzen und erhöhte Entzündungsmarker (z.B. C-reaktives Protein und Leukozytenzahl). In den meisten Fällen wurde die Aortitis in der CT-Untersuchung diagnostiziert und klang nach Absetzen der G-CSF-Therapie ab. Siehe Abschnitt «Unerwünschte Wirkungen».
Interaktionen
Wirksamkeit und Sicherheit einer Verabreichung von Granocyte und einer myelosuppressiven zytotoxischen Chemotherapie am gleichen Tag sind nicht belegt. Angesichts der Empfindlichkeit von sich schnell teilenden myeloischen Zellen gegenüber einer myelosuppressiven zytotoxischen Chemotherapie, wird von einer Anwendung von Granocyte 24 h vor und 24 h nach einer solchen Chemotherapie abgeraten.
Mögliche Interaktionen mit anderen hämatopoetischen Wachstumsfaktoren und Zytokinen sind bisher in klinischen Studien nicht untersucht worden.
Schwangerschaft/Stillzeit
Schwangerschaft
Die Sicherheit von Granocyte wurde bei schwangeren Frauen nicht etabliert. Granocyte hat in Tierversuchen (Ratte, Kaninchen) keine teratogenen Eigenschaften vorgewiesen. Beim Kaninchen wurde aber eine erhöhte Abortrate, nicht jedoch das Auftreten von Missbildungen beobachtet (siehe «Präklinische Daten»). Granocyte sollte in der Schwangerschaft nicht angewendet werden, ausser bei eindeutiger Notwendigkeit.
Stillzeit
Da nicht bekannt ist, ob Granocyte in die Muttermilch übertritt, wird seine Anwendung während der Stillzeit nicht empfohlen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Granocyte hat keinen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Unerwünschte Wirkungen
In den klinischen Studien traten sehr häufig bis häufig folgende unerwünschte Wirkungen auf, die Granocyte zugeordnet wurden:
Knochenschmerzen (13,3%), Reaktionen an der Injektionsstelle (8%), Kopfschmerzen (6,7%), Fieber (5,3%), Schmerzen an der Injektionsstelle (4,7%), Rückenschmerzen (4%), Leucocytosis (4%), Schmerzen (3,3%), Myalgie (3,3%), Splenomegalie und/oder reversible Veränderungen der Milz.
In seltenen Fällen wurden pulmonale Nebenwirkungen, insbesondere Dyspnoe, Hypoxie und Hämoptyse beobachtet. Sehr selten entwickelte sich ein akutes Atemnotsyndrom (ARDS) (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Allergische Reaktionen, die in seltenen Fällen bis zum anaphylaktischen Schock gingen, wurden nach der ersten Verabreichung von Granocyte beobachtet.
Gelegentlich kam es nach der Markteinführung des Medikaments zu einem Kapillarlecksyndrom. Siehe den Abschnitt am Ende dieses Kapitels sowie «Warnhinweise und Vorsichtsmassnahmen».
Folgende unerwünschte Wirkungen traten in klinischen Studien oder nach der Markteinführung auf und wurden Granocyte zugeordnet. Die Häufigkeiten sind folgendermassen definiert: sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1'000, <1/100); selten (≥1/10'000, <1/1'000); sehr selten (<1/10'000).
Erkrankungen des Blutes und des Lymphsystems
Häufig: Leukozytose (4%), Splenomegalie (im Allgemeinen asymptomatisch).
Sehr selten: Milzruptur.
Gefässerkrankungen
Gelegentlich: Kapillarlecksyndrom.
Selten: Aortitis.
Erkrankungen der Nieren und Harnwege
Einzelfälle: Glomerulonephritis.
Erkrankungen des Immunsystems
Sehr selten: allergische Reaktionen, die in Einzelfällen bis zum anaphylaktischen Schock gehen können.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen (6,7%).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Hämoptyse.
Selten: interstitielle Pneumonie. In einigen dieser Fälle entwickelte sich eine respiratorische Insuffizienz oder eine Schocklunge (ARDS), was fatal verlaufen kann. Lungenblutung.
Leber- und Gallenerkrankungen
Sehr häufig: Anstieg der ASAT, ALAT und/oder der alkalischen Phosphatase.
In den meisten Fällen normalisierte sich die Leberfunktion nach dem Absetzen von Granocyte.
Erkrankungen der Haut und des Unterhautzellgewebes
Sehr selten: kutane Vaskulitis (der Mechanismus ist noch nicht geklärt).
Sehr selten: Sweet's Syndrom, Erythema nodosum, Pyoderma gangrenosum, epidermale Nekrolyse, Stevens-Johnson Syndrom, bullöses Exanthem. Beobachtet wurden diese unerwünschten Wirkungen vor allem bei Patienten mit maligner hämatologischer Erkrankung, Krankheiten, die bekanntlich mit neutrophiler Dermatosis assoziiert sind, sowie in einigen Fällen bei Patienten mit nicht-maligner Neutropenie.
Sehr selten: Lyell-Syndrom.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Muskuloskelettale Schmerzen (einschliesslich Knochenschmerzen, Rückenschmerzen, Arthralgie, Myalgie, Gliederschmerzen) (13,3%).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Reaktionen an der Injektionsstelle (8%), Fieber (5,3%), Schmerzen an der Injektionsstelle (4,7%).
Untersuchungen
Sehr häufig: vorübergehende Zunahme der LDH (23%).
Weiterhin wurde unter besonderen Indikationsstellungen über folgende Nebenwirkungen berichtet:
Bei Patienten mit Knochenmarktransplantation:
Bei 15% oder mehr der Patienten wurden folgende unerwünschte Wirkungen festgestellt, ohne dass deren Ursache mit Sicherheit Granocyte zugeordnet werden konnte: Infektionen und Entzündungen der Mundhöhle, Fieber, Diarrhö, Exanthem, Abdominalschmerzen, Erbrechen, Haarausfall, Sepsis, Infektionen. «Graft-versus-host» Reaktionen nach Knochenmarktransplantationen traten unter Placebo oder Granocyte gleich häufig auf.
Bei Patienten mit Chemotherapie-induzierter Neutropenie:
Bei Patienten mit einer Chemotherapie-induzierten Neutropenie wurden Haarausfall, Übelkeit, Erbrechen, Fieber, Kopfschmerzen beobachtet (entsprechend den bei Krebspatienten ganz allgemein unter Chemotherapie auftretenden unerwünschten Wirkungen).
Über Verminderung der durchschnittlichen Plättchenzahl und über Fälle von Thrombozytopenie wurde berichtet bei Patienten, die nach Chemotherapie mit Granocyte behandelt wurden.
Bei PBPC-Mobilisierung bei gesunden Spendern:
Nach Verabreichung von Granocyte an gesunde Spender waren die häufigsten unerwünschten Wirkungen reversibel und von einer leichten bis moderaten Intensität. Es handelte sich um: Kopfschmerzen (30%), Knochenschmerzen (23%), Rückenschmerzen (17,5%), Asthenie (11%), Abdominalschmerzen (6%), andere Schmerzen (6%), Fieber und Übelkeit. Bei Spendern, die hohe Leukozyten-Spitzenwerte aufweisen, insbesondere bei Werten ≥50 x 109/l, ist das Risiko des Auftretens von Schmerzen erhöht.
Leukozytose mit Werten ≥50 x 109/l wurde bei 24% der Spender berichtet und eine Apherese-bedingte Thrombozytopenie (Plättchenzahl <100 x 109/l) bei 42% der Spender.
Ein transienter Anstieg der ASAT und/oder ALAT wurde bei 12% der Spender und der Anstieg der alkalischen Phosphatase bei 16% beobachtet. Es wurde auch über Erhöhungen der Spiegel der alkalischen Phosphatase und der LDH berichtet.
Häufige, aber im Allgemeinen asymptomatische Fälle einer Splenomegalie und sehr seltene Fälle einer Milzruptur wurden berichtet.
Unerwünschte Wirkungen nach Markteinführung:
Seit der Markteinführung wurde vorwiegend bei Krebspatienten unter Chemotherapie nach der Verabreichung von Granulozyten-Kolonien-stimulierenden Faktoren gelegentlich von einem Kapillarlecksyndrom berichtet, das lebensbedrohlich sein kann, wenn die Behandlung nicht rechtzeitig eingeleitet wird. Jedoch wurde auch ein Fall bei einem gesunden Spender beschrieben, der einer Apherese nach PBPC-Mobilisierung unterzogen worden war (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Die Auswirkungen einer Granocyte Überdosierung sind nicht bekannt.
Bei Dosierungen bis zu 40 µg (5,12 Mio. I.E.)/kg/Tag traten keine toxischen Nebenwirkungen ausser Knochen- und Muskelschmerzen auf. Bei einem von 3 Patienten, die diese höchste Dosierung von Granocyte erhielten, beobachtete man am 5. Behandlungstag einen Leukozytenwert von gegen 50 x 109/l.
Bei Absetzen der Granocyte-Behandlung sinkt die Zahl der zirkulierenden Neutrophilen innerhalb von 1-2 Tagen um 50% und erreicht nach 1-7 Tagen normale Werte.
Eigenschaften/Wirkungen
ATC-Code
L03AA10
Lenograstim ist mit dem natürlich vorkommenden humanen Granulozyten-Kolonien-stimulierenden Faktor (G-CSF) in seiner Aminosäuresequenz völlig identisch und wie dieser glykosyliert. Das hochgradig gereinigte glykosylierte Polypeptid, das gentechnologisch unter Verwendung einer Säugetierzelllinie (Chinese hamster ovary (CHO) cells) gewonnen wird, besteht aus einer Kette mit 174 Aminosäuren, die zwei intramolekulare Disulfidbrücken (zwischen 4 Cysteinbasen) aufweist und am Threonin-133 glykosyliert ist.
Wirkungsmechanismus
Lenograstim gehört zu den Zytokinen, einer Gruppe biologisch aktiver Proteine, welche Zelldifferenzierung und Zellwachstum regulieren.
Pharmakodynamik
Es konnte gezeigt werden, dass Lenograstim die Neutrophilen-Vorläuferzellen stimuliert und innerhalb 24 Stunden nach Applikation zu einem deutlichen Anstieg neutrophiler Zellen im peripheren Blut führt. Die Erhöhung der Neutrophilenzahl ist im Dosierungsintervall von 1-10 µg/kg Körpergewicht pro Tag dosisabhängig. Bei der empfohlenen Dosierung von 5 µg/kg/Tag führt eine wiederholte Applikation zu einem verstärkten Ansprechen der Neutrophilen. Die unter der Behandlung mit Granocyte gebildeten neutrophilen Granulozyten zeigen anscheinend normale chemotaktische und phagozytotische Funktionen.
Wie die anderen Wachstumsfaktoren hat Granocyte in vitro eine stimulierende Wirkung auf menschlichen endothelialen Zellen gezeigt.
Klinische Wirksamkeit
Die Anwendung von Granocyte bei Patienten mit vorangegangener Knochenmarktransplantation oder nach wenigen Zyklen einer zytotoxischen Chemotherapie führt zu einer signifikanten Verkürzung der Neutropeniedauer sowie zu einem milderen Verlauf von Infektionen. Ob dieser Effekt auch nach wiederholter Anwendung anhält, ist zurzeit nicht bewiesen.
Die Verwendung von Granocyte allein oder nach einer Chemotherapie mobilisiert die Freisetzung von hämatopoetischen Vorläuferzellen ins periphere Blut. Diese autologen Vorläuferzellen des peripheren Blutes (Peripheral Blood Progenitor Cells = PBPCs) können gewonnen und nach einer hochdosierten zytotoxischen Chemotherapie entweder anstelle von oder zusätzlich zu einer Knochenmarktransplantation wieder infundiert werden.
Bei gesunden Spendern mobilisiert G-CSF Vorläuferzellen für eine allogene Transplantation. Die Mechanismen sind noch nicht bekannt.
Es konnte gezeigt werden, dass die Reinfusion von PBPCs, die nach einer Mobilisierung mit Granocyte gewonnen wurden, die Hämatopoese wiederherstellt und deren Erholung beschleunigt. Die Unabhängigkeit von Thrombozytentransfusionen wird im Vergleich zur autologen Knochenmarktransplantation schneller erreicht.
Die Verwendung von Granocyte bei Patienten, die sich einer Knochenmark-Transplantation unterziehen, oder die mit einer zytotoxischen Chemotherapie behandelt werden, führt zu einer signifikanten Verringerung von Auftreten, Schweregrad und Dauer einer Neutropenie sowie der damit verbundenen Komplikationen.
In einer multizentrischen Phase III Studie wurden 102 Patienten mit de novo schwerer idiopathischer aplastischer Anämie auf zwei Gruppen randomisiert. 53 erhielten zusätzlich zur immunosuppressiven Therapie (Antilymphozytenglobulin und Ciclosporin) Lenograstim; 49 Patienten erhielten Immunsuppression ohne zusätzliches Lenograstim. Lenograstim wurde in den ersten 12 Wochen (im Mittel 98 Tage) täglich subkutan in einer Dosierung von durchschnittlich 5 µg/kg Körpergewicht gegeben. Während der immunosuppressiven Therapie mit Lenograstim stieg im Gegensatz zur Kontrollgruppe die absolute Zahl neutrophiler Zellen, dem Hauptwirksamkeitsparameter, deutlich an. Das Maximum neutrophiler Zellen wurde nach 1 Woche erreicht. Eine vollständige neutrophile Antwort (absolute Zahl neutrophiler Zellen ≥1,5 x 109/l) wurde bei signifikant mehr Patienten in der Lenograstim-Gruppe erreicht als in der Kontrollgruppe (83% vs. 44,9%, p<0,001). Bei Hochrisiko-Patienten mit sehr schwerer idiopathischer aplastischer Anämie wurde ebenfalls in der Lenograstim-Gruppe eine signifikant höhere vollständigere Reaktionsrate gefunden (69,2% versus 31,6% in der Kontrollgruppe, p=0,012). Die sekundären Wirksamkeitsparameter (insbesondere klinische Endpunkte z.B. Infekte) zeigten höchsten trendmässig aber keine signifikanten Unterschiede zwischen den beiden Gruppen.
Pharmakokinetik
Absorption
Bei intravenöser Gabe besteht zwischen der Dosis und AUC resp. Cmax keine lineare Beziehung. Bei subkutaner Verabreichung von Dosen bis zu 20 µg/kg ist diese Beziehung nach Erreichen des steady-state (5. Tag) linear.
Während wiederholter subkutaner Anwendung der empfohlenen Dosierung von 5 µg/kg/Tag liegen die maximalen Serumkonzentrationen von Lenograstim nahe bei 100 pg/ml/kg Körpergewicht. Wiederholte Anwendung von Granocyte führt bei keiner der beiden Applikationsarten zu einer Kumulation.
Die absolute Bioverfügbarkeit verhält sich umgekehrt proportional zur Dosis. Bei der empfohlenen Dosierung von 5 µg/kg beträgt sie 30%.
Distribution
Das scheinbare Verteilungsvolumen (Vdarea) liegt etwa bei 1 l/kg Körpergewicht und die mittlere Verweildauer nach subkutaner Applikation nahe bei 7 Stunden.
Metabolismus
Siehe Elimination.
Elimination
Die scheinbare Serum-Eliminationshalbwertszeit von Lenograstim beträgt etwa 3-4 Stunden im steady-state bei subkutaner Applikation und 1-1,5 Stunden nach wiederholter i.v. Infusion. Die Plasmaclearance von rHuG-CSF erhöht sich um das 3-Fache (von 50 auf 150 ml/Min.) bei wiederholter subkutaner Applikation. Lenograstim wird nur zu einem geringen Teil (weniger als 1% der Dosis) unverändert im Urin ausgeschieden, da es möglicherweise wie endogene Peptide metabolisiert wird.
Die Dosis korreliert positiv mit der Granocyte-Serumkonzentration, ebenso die Bildung von Neutrophilen mit der Gesamtmenge Granocyte im Serum.
Kinetik in speziellen Patientengruppen:
Siehe «Dosierung/Anwendung», «Ältere Patienten», «Kinder».
Präklinische Daten
Tierstudien zur chronischen Toxizität haben bei Ratten gezeigt, dass Granocyte in der Dosierung von 100 µg/kg/Tag eine erhöhte Osteoklastenresorption verursacht.
Mutagenität
Lenograstim zeigte weder in vitro beim Ames-Test (Salmonella typhimurium) noch in vivo beim Micronucleus-Test bei der Maus mutagene Wirkungen. Auch der in vitro Chromosomenaberrationstest (CHL-Zellen) war negativ.
Karzinogenität
Eine karzinogene Wirkung von Granocyte ist weder beim Tier noch beim Menschen bekannt.
Reproduktionstoxizität
Granocyte hat im Tierversuch (in Dosen bis zu 100 µg/kg/Tag i.v. bei der Ratte und bei dem Kaninchen) keine teratogenen Eigenschaften gezeigt. Beim Kaninchen (no-effect level 10 µg/kg/Tag i.v.) wurde aber eine erhöhte Abortrate beobachtet (siehe auch «Schwangerschaft/Stillzeit»).
Sonstige Hinweise
Inkompatibilitäten
Angaben zur Kompatibilität mit Behältermaterialien: siehe «Hinweise für die Handhabung».
Die Zusammensetzung der Kappe am Ende der Fertigspritze kann Latex-Gummi enthalten (siehe Information auf der Umverpackung), welcher bei empfindlichen Personen schwere allergische Reaktionen verursachen kann.
Beeinflussung diagnostischer Methoden
Keine Beeinflussung bekannt.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nach Auflösung mit 1 ml Aqua ad Inject. ist Granocyte während 24 Stunden bei Raumtemperatur (+25 °C) haltbar. Da Granocyte keine Konservierungsmittel enthält, empfiehlt sich jedoch eine Aufbewahrung bei 2-8 °C. Nach Verdünnung bis zu einer Endkonzentration bei Granocyte 13 von nicht weniger als 2 µg/ml (0,26 Mio.I.E./ml) und bei Granocyte 34 von nicht weniger als 2,5 µg/ml (0,32 Mio.I.E./ml) kann die Lösung ohne Aktivitätsverlust während 24 Stunden bei +25 °C oder bei +5 °C aufbewahrt werden.
Arzneimittel sind ausserhalb der Reichweite von Kindern aufzubewahren.
Besondere Lagerungshinweise
Granocyte soll bei +2 °C bis +30 °C aufbewahrt werden. Die Stabilität von Granocyte wurde auch nach Aufbewahrung während 6 Monaten bei 40 °C und während 3 Monaten bei 50 °C gezeigt. Deshalb haben kurze (einigen Wochen) Expositionen bei Temperaturen bis zu 50 °C keinen Einfluss auf die Qualität von Granocyte Stechampullen.
Hinweise für die Handhabung
1 Stechampulle Granocyte wird in 1 ml Aqua ad Inject. gelöst. Zum Lösen Flasche leicht bewegen, nicht schütteln.
Zur i.v. Infusion wird Granocyte mit 0,9% Kochsalzlösung verdünnt. In dieser Form ist Granocyte kompatibel mit Infusionsbehältern aus Glas (NaCl-/Dextroselösung) oder Polyvinylchlorid (NaCl-Lösung). Bis zu einer Endkonzentration von mind. 2,5 µg/ml findet keine signifikante Absorption des Wirkstoffes an Glas oder Kunststoffmaterialien statt. Granocyte 13 soll in höchstens 50 ml und Granocyte 34 in höchstens 100 ml 0,9% NaCl-Lösung verdünnt werden; eine Verdünnung von Granocyte 13 unter eine Konzentration von 2 µg/ml (0,26 Mio.I.E./ml) und Granocyte 34 unter eine Konzentration von 2,5 µg/ml (0,32 Mio.I.E./ml) soll jedoch vermieden werden.
Bei der PBPC-Mobilisierung bei gesunden Spendern wird Granocyte subkutan appliziert.
Zulassungsnummer
52170 (Swissmedic)
Zulassungsinhaberin
sanofi-aventis (schweiz) ag, 1214 Vernier/GE
Stand der Information
April 2020
Praktische Hinweise für medizinisches Fachpersonal zur Zubereitung und Handhabung des Arzneimittels
Die Flaschen mit GRANOCYTE sind zum Einmalgebrauch bestimmt. Wegen der Gefahr mikrobieller Kontamination sind die Fertigspritzen mit Lösungsmittel zum Einmalgebrauch bestimmt.
GRANOCYTE ist zur subkutanen oder intravenösen Verabreichung bestimmt.
GRANOCYTE wird als Pulver plus Lösungsmittel zur Herstellung einer Injektions-/Infusionslösung in einer Fertigspritze vertrieben.
Pulver in der Flasche + 1 ml Lösungsmittel in der Fertigspritze mit 2 Nadeln (die cremefarben markierte grössere Nadel [19G] ist zur Rekonstitution bestimmt, die braun markierte kleinere [26G] zur Verabreichung der Lösung).
Zubereitung der rekonstituierten Lösung:
- Mit der 19G-Nadel unter aseptischen Bedingungen den extrahierbaren Inhalt einer Fertigspritze in eine GRANOCYTE-Flasche geben.
- Die Flasche bis zur vollständigen Auflösung behutsam schwenken.
- Nicht heftig schütteln.
- Die rekonstituierte parenterale Lösung ist farblos und frei von sichtbaren Partikeln. Mit der 19G-Nadel die erforderliche Menge rekonstituierter Lösung aus der Flasche entnehmen.
- Mit der 26G-Nadel die Lösung unverzüglich subkutan verabreichen.
Nicht verwendete(s) Produkt/Lösung oder Abfallmaterial ist entsprechend den geltenden Anforderungen zu entsorgen.
1. Anwendung des Produkts in der Ausführung mit LATEXHALTIGER Kappe der Fertigspritze:
| Abbildung 1 Kunststoffkappe von der Flasche abziehen. |
| Abbildung 7 Mit weiterhin in die Flasche eingeführter Nadel die Flasche über Kopf kippen. Sicherstellen, dass die Nadelspitze in der Lösung liegt. |
| Abbildung 2 Gummistopfen reinigen. |
| Abbildung 8 Kolbenstange langsam zurückziehen und die für die verordnete Dosis erforderliche Menge entnehmen. |
| Abbildung 3 Fertigspritze und beide Nadeln (eine mit cremefarbenem [19G] und eine mit braunem [26G] Konus) aus der Blisterpackung nehmen. |
| Abbildung 9 Die Nadel mit dem cremefarbenen Konus von der Spritze abnehmen und die Nadel mit dem braunen Konus einsetzen. |
| Abbildung 4 Kappe vom Ende der Spritze abziehen und die Nadel mit dem cremefarbenen Konus einsetzen. |
| Abbildung 10 Durch leichtes Klopfen gegen den Zylinder etwaige Luftblasen aus der Lösung aufsteigen lassen, dann die Kolbenstange leicht drücken, um die Luft aus der Spritze zu entfernen. |
| Abbildung 5 Flasche auf einer ebenen Fläche festhalten und mit der Nadel den Gummistopfen durchstechen, dann die Kolbenstange herunterdrücken, um das Lösungsmittel in die Flasche zu spritzen. |
| Abbildung 11 Gegebenenfalls das zu verabreichende Volumen einstellen. GRANOCYTE ist jetzt bereit zur Verabreichung. Die Lösung unverzüglich subkutan injizieren. |
| Abbildung 6 Behutsam schwenken bis zur vollständigen Auflösung (ca. 5 Sekunden). Nicht heftig schütteln. |
| Mögliche Injektionsbereiche für die subkutane Gabe. |
2. Anwendung des Produkts in der Ausführung mit LATEXFREIER Kappe der Fertigspritze:
| A: Kappe (mit innerem Einsatz aus Gummi) B: Gummistopfen am Ende des Kolbens C: Kolben Die Nadeln sind von einer festen Schutzhülle umgeben; beide setzen sich aus folgenden Teilen zusammen: D: Nadelschutzkappe E: Farbcodierte Kappe (cremefarben oder braun) F: Nadelbasis G: Nadelspitze |
| Abbildung 1 Flasche aus dem Blister entnehmen und Kunststoffkappe von der Flasche abziehen. Gummistopfen mit einem mit steriler Alkohollösung getränkten Tuch reinigen. |
| Abbildung 7 Mit weiterhin in die Flasche eingeführter Nadel die Flasche über Kopf kippen. Die Nadel etwas zurückziehen und dabei sicherstellen, dass die Nadelspitze noch in der Lösung liegt. Die Nadelbasis festhalten und den Kolben behutsam zurückziehen, um möglichst viel Lösung in die Spritze aufzuziehen. |
| Abbildung 2 Fertigspritze und beide Nadeln (eine mit cremefarben [19G] und eine mit braun [26G] codierter Kappe) aus der Blisterpackung nehmen. |
| Abbildung 8 Überprüfen, dass der Inhalt der Spritze frei von Luftblasen ist. Befinden sich Luftblasen in der Spritze, Spritze senkrecht halten und leicht gegen den Zylinder klopfen, bis die Luftblasen aus der Lösung aufsteigen. Den Kolben drücken, um die Luft aus der Spritze zu entfernen. |
| Abbildung 3 Kappe von der Spritze abschrauben und abziehen. |
| Abbildung 9 Den Kolben drücken, bis der Gummistopfen am Ende die nächsthöhere Volumenmarkierung über dem von Ihnen benötigten Volumen erreicht hat (in 0,1-ml-Schritten). Wenn Sie z.B. 0,8 ml benötigen, drücken Sie den Kolben bis zur Erreichung der 0,9-ml-Marke. |
| Abbildung 4 Die Nadel mit der cremefarbenen Kappe fest an beiden Enden der Nadelschutzhülle halten. Die cremefarbene Kappe abdrehen (egal in welche Drehrichtung) und abziehen. Die Nadelschutzkappe festhalten und die Nadelbasis auf die Spritze aufschrauben. |
| Abbildung 10 Die Flasche aufrecht hinstellen und die Nadel so tief wie möglich in die Flasche einführen. Die Nadelbasis festhalten und die Spritze abschrauben, sodass die Nadel in der Flasche verbleibt. Die Nadel mit der braunen Kappe fest an beiden Enden der Nadelschutzhülle halten. Die braune Kappe abdrehen (egal in welche Drehrichtung) und abziehen. Die Nadelschutzkappe festhalten und die Nadelbasis auf die Spritze aufschrauben. Die Nadelschutzkappe abziehen. |
| Abbildung 5 Die Nadelschutzkappe abziehen. Flasche auf einer ebenen Fläche festhalten und mit der Nadel den Gummistopfen durchstechen, dann die Kolbenstange langsam herunterdrücken, um das Lösungsmittel in die Flasche zu spritzen. |
| Abbildung 11 Überprüfen, dass der Inhalt der Spritze frei von Luftblasen ist. Befinden sich Luftblasen in der Spritze, Spritze senkrecht halten und leicht gegen den Zylinder klopfen, bis die Luftblasen aus der Lösung aufsteigen. Den Kolben drücken, um die Luft aus der Spritze zu entfernen. Gegebenenfalls das zu verabreichende Volumen einstellen. |
| Abbildung 6 Die Flasche bis zur vollständigen Auflösung des Pulvers behutsam schwenken. Nicht heftig schütteln. |
| GRANOCYTE ist jetzt bereit zur Verabreichung. Die Lösung unverzüglich subkutan injizieren. Mögliche Injektionsbereiche für die subkutane Gabe. |
Composizione
Principi attivi
Lenograstim (rHuG-CSF) (rHuG-CSF significa: fattore umano ricombinante stimolante le colonie di granulociti).
Sostanze ausiliarie
L-arginina 10 mg, L-fenilalanina 10 mg, L-metionina 1 mg, mannitolo 25 mg, polisorbato 20 0,1 mg, acido idrocloridrico q.s. pH 6,5, cloruro di sodio circa 0,6 mg risp. 1,4 mg.
Solvente: acqua per preparati iniettabili 1,0 ml.
Forma farmaceutica e quantità di principio attivo per unità
Fiala di liofilizzato: lenograstim (rHuG-CSF) 13,4 mln U.I.* (105 µg) risp. 33,6 mln U.I.* (263 µg).
* Le unità sono misurate con il metodo biologico in vitro GNFS-60, in confronto allo standard internazionale dell'OMS per il G-CSF umano.
1 µg di rHuG-CSF corrisponde a 0,128 milioni di U.I.
Indicazioni/Possibilità d'impiego
- Riduzione della durata e della gravità delle neutropenie nei pazienti sottoposti a chemioterapia citotossica fortemente mielosoppressiva a causa di una patologia maligna, ad eccezione dei pazienti che presentano una leucemia mieloide cronica o una sindrome mielodisplastica.
- Riduzione della durata delle neutropenie nei pazienti sottoposti a chemioterapia citotossica a forte dosaggio seguita da un trapianto di midollo autologo/allogenico.
- Mobilizzazione di cellule staminali nel sangue periferico (PBPC) per il trapianto autologo da solo o in seguito a chemioterapia mielosoppressiva.
- Mobilizzazione di cellule staminali nel sangue periferico (PBPC) per il trapianto allogenico.
Possibilità d'impiego:
Accorciamento della durata delle neutropenie nei pazienti affetti da anemia aplastica idiopatica grave de novo sotto immunosoppressione con la globulina antilinfocita e la ciclosporina. L'effetto sui criteri clinici (infezioni, mortalità) non è stato dimostrato.
Posologia/Impiego
Il trattamento con Granocyte deve essere eseguito solo in collaborazione con oncologi ed ematologi specializzati nel trattamento con il G-CSF.
Aggiustamenti della posologia/titolazione
Granocyte 13 viene somministrato nei pazienti con una superficie corporea fino a 0,7 m2 e Granocyte 34 per una superficie corporea superiore a 0,7 m2.
La dose raccomandata di Granocyte:
- durante un trapianto di midollo osseo,
- dopo chemioterapia citotossica fortemente mielosoppressiva,
- per la mobilizzazione delle PBPC dopo chemioterapia mielosoppressiva,
- in caso di anemia aplastica idiopatica grave sotto immunosoppressione con la globulina antilinfocita e la ciclosporina (la dose deve essere somministrata quotidianamente per iniezione sottocutanea per al massimo i primi 6 mesi della terapia immunosoppressiva), è di 19,2 mln di U.I. (150 µg) m2/giorno, dose di efficacia equivalente a quella di 0,64 mln U.I. (5 µg) per kg al giorno.
Per la mobilizzazione delle PBPC con Granocyte da solo, la dose raccomandata è di 1,28 mln di U.I. (10 µg) /kg/giorno.
Adulti
Dopo il trapianto di midollo:
la dose raccomandata di 19,2 mln U.I. (150 µg)/m2/giorno, dose di efficacia equivalente a 0,64 mln U.I. (5 µg) per kg al giorno, viene somministrata quotidianamente. Il trattamento comincia il giorno successivo al trapianto, sia in infusione endovenosa di 30 minuti – Granocyte 13 diluito in 50 ml e Granocyte 34 in 100 ml di soluzione isotonica di cloruro di sodio – sia per iniezione sottocutanea (vedere «Indicazioni per la manipolazione»). La somministrazione quotidiana prosegue oltre il nadir atteso (il valore più basso di granulociti neutrofili), fino a quando la conta dei neutrofili non abbia raggiunto ≥1x 109/l per 3 giorni consecutivi. In caso di necessità, Granocyte può essere somministrato per un periodo massimo di 28 giorni consecutivi. L'esperienza mostra che il 14° giorno successivo al trapianto di midollo osseo, il 50% dei pazienti avrà nuovamente un tasso di neutrofili normale.
Nei trattamenti di chemioterapia citotossica fortemente mielosoppressiva:
la dose quotidiana raccomandata di Granocyte viene somministrata per iniezione sottocutanea, a partire dal giorno successivo alla fine del trattamento chemioterapico. La somministrazione quotidiana prosegue oltre il nadir atteso (il valore più basso di granulociti neutrofili), fino a quando la conta dei neutrofili non abbia raggiunto ≥1x 109/l per 3 giorni consecutivi, cosa che generalmente si verifica entro 8-14 giorni dall'inizio del trattamento. Se necessario, Granocyte può essere somministrato per un periodo massimo di 28 giorni consecutivi. Sebbene si osservi un aumento transitorio dei neutrofili nei primi due giorni di trattamento, proseguendolo si verifica di solito una comparsa più precoce del nadir e il numero di neutrofili torna più rapidamente alla normalità.
Per la mobilizzazione delle PBPC dopo chemioterapia mielosoppressiva:
la dose raccomandata di Granocyte di 19,2 mln U.I. (150 µg)/m2/giorno, dose di efficacia equivalente a 0,64 mln U.I. (5 µg) per kg al giorno, viene somministrata quotidianamente, a partire dal giorno successivo alla fine della chemioterapia, per iniezione sottocutanea, fino a quando verrà superata la data del nadir atteso e il numero di neutrofili tornerà a un livello normale compatibile con la sospensione del trattamento con Granocyte.
La leucaferesi dovrà avvenire quando, dopo il nadir, il numero di leucociti sale o dopo la determinazione delle cellule CD34+ nel sangue mediante un metodo convalidato. Nei pazienti che non sono stati pretrattati con chemioterapia intensiva, nella maggior parte dei casi una leucaferesi è sufficiente per raggiungere la soglia minima raccomandata (≥2,0 x 106 cellule CD34+/kg).
Per mobilizzare le PBPC con Granocyte da solo (senza chemioterapia):
la dose raccomandata di Granocyte di 38,4 mln U.I. (300 µg)/m2/giorno, dose di efficacia equivalente a quella di 1,28 mln U.I. (10 µg) per chilo al giorno, viene somministrata quotidianamente per iniezione sottocutanea per una durata di 4-6 giorni. La leucaferesi dovrà avvenire tra il 5° e il 7° giorno. Nei pazienti che non sono stati pretrattati con chemioterapia intensiva, nella maggior parte dei casi una leucaferesi è sufficiente per raggiungere la soglia minima raccomandata (≥2,0 x 106 cellule CD34+/kg).
Mobilizzazione delle PBPC nei donatori sani per il trapianto allogenico:
la dose raccomandata di Granocyte di 38,4 mln U.I. (300 µg)/m2/giorno, dose di efficacia equivalente a quella di 1,28 mln U.I. (10 µg) per chilo al giorno, viene somministrata quotidianamente per iniezione sottocutanea per una durata di 4-6 giorni. La leucaferesi dovrà avvenire tra il 5° e il 7° giorno. Questo procedimento consente di ottenere la raccolta di ≥3 x 106 cellule CD34+ per kg di peso corporeo a partire da una leucaferesi nell'83% dei soggetti, o persino due leucaferesi per il 97% dei soggetti.
Per assicurare la tracciabilità dei medicamenti biotecnologici è necessario documentare per ogni trattamento il nome commerciale e il numero del lotto.
Pazienti anziani
Gli studi clinici con Granocyte hanno dimostrato che nei pazienti anziani non è necessaria una posologia specifica.
Alcuni dati suggeriscono che la mobilizzazione delle PBPC per il trapianto allogenico nei pazienti anziani necessita di dosi più elevate di G-CSF o può rivelarsi più difficile.
Bambini e adolescenti
L'efficacia, l'innocuità e la sicurezza di Granocyte sono state stabilite nei bambini di 2 anni o più che hanno subito un trapianto di midollo osseo.
Controindicazioni
Granocyte è controindicato nei pazienti o nei donatori sani con ipersensibilità nota al prodotto o ad altri componenti del preparato (vedere «Avvertenze e misure precauzionali»).
Granocyte non deve essere utilizzato durante la chemioterapia.
Granocyte non deve essere usato per aumentare l'importanza delle dosi negli schemi di chemioterapia riconosciuti e/o per ridurre gli intervalli di tempo.
L'efficacia e l'innocuità di Granocyte non sono state stabilite nei pazienti che presentano una sindrome mielodisplastica o una leucemia mieloide cronica. In tali casi, quindi, Granocyte non deve essere utilizzato.
Avvertenze e misure precauzionali
Controindicazioni relative
Crescita cellulare maligna:
i fattori di stimolazione delle colonie di granulociti possono promuovere la crescita delle cellule mieloidi in vitro. Si possono anche osservare effetti simili su alcune cellule non mieloidi. Esiste quindi un rischio teorico di stimolare un clone maligno con passaggio a una sindrome mielodisplastica, una leucemia acuta o un'emoglobinuria parossistica notturna in anemia aplastica grave trattata efficacemente.
Nel caso di leucemia acuta mieloide, il beneficio clinico di Granocyte non è stato stabilito chiaramente nei pazienti con età inferiore ai 55 anni.
La differenziazione diagnostica tra una leucemia acuta mieloide e la trasformazione blastica di una leucemia mieloide cronica deve essere oggetto di particolare attenzione.
Gli studi clinici non hanno ancora permesso di stabilire se Granocyte influenzi la progressione delle sindromi mielodisplastiche verso una leucemia mieloide acuta. La prudenza s'impone anche in caso di utilizzo di Granocyte in stati mieloidi pre-maligni. Siccome le cellule di alcuni tumori possono eccezionalmente esprimere dei recettori al G-CSF, è richiesta prudenza in caso di inattesa crescita tumorale, constatata durante il trattamento con rHuG-CSF.
Leucocitosi:
nel quadro degli studi clinici, non è stato osservato alcun tasso di leucociti superiore a 50 x 109/l nei pazienti trattati con Granocyte (0,64 milioni U.I. o 5 µg/kg/giorno) dopo un trapianto di midollo osseo.
Meno del 5% dei pazienti che hanno subito una chemioterapia citotossica e un trattamento con Granocyte alla dose di 0,64 milioni di U.I. (5 µg)/kg/giorno ha presentato delle concentrazioni di globuli bianchi uguali o superiori a 70 x 109/l. Non è stato osservato alcun effetto collaterale direttamente attribuibile a questo grado di leucocitosi. Considerando i rischi potenziali legati a una leucocitosi importante, una conta dei globuli bianchi dovrebbe essere realizzata a intervalli regolari durante un trattamento con Granocyte. Se il tasso di leucociti è superiore a 50 x 109/l dopo il consueto nadir (il tasso più basso di neutrofili granulociti), il trattamento con Granocyte deve essere sospeso immediatamente.
Mobilizzazione delle PBPC nei donatori sani per il trapianto allogenico:
quando il numero di leucociti supera 70 x 109/l, bisogna valutare se la mobilizzazione deve proseguire o essere interrotta poiché non è facile sospenderla se il ricevente è già condizionato.
Sintomi polmonari:
in casi rari (>0,01% e <0,1%) possono manifestarsi effetti collaterali polmonari come polmonite interstiziale, edema polmonare, dispnea, infiltrazioni polmonari o fibrosi polmonare.
La comparsa di sintomi polmonari (quali tosse, febbre e dispnea) associati a segni radiologici (quali infiltrati polmonari) e al peggioramento della funzione polmonare possono essere i prodromi di un futuro arresto respiratorio o di un'insufficienza respiratoria acuta.
È quindi necessario intraprendere un trattamento appropriato e considerare l'interruzione del trattamento con Granocyte.
Nei donatori sani e nei pazienti, sono stati riferiti alcuni effetti collaterali polmonari (emottisi, emorragia polmonare, infiltrati polmonari, dispnea e ipossia) nel corso di studi condotti successivamente all'introduzione sul mercato. In caso di effetto polmonare sospetto o confermato, si deve prendere in considerazione la sospensione del trattamento con Granocyte e predisporre un trattamento medico appropriato.
Durante un trapianto di midollo osseo:
è opportuno prestare particolare attenzione al recupero delle piastrine, poiché nel quadro di uno studio controllato con placebo, condotto in doppio cieco, il tasso medio di trombociti era più basso rispetto al gruppo di confronto con placebo. L'effetto di Granocyte sulla frequenza e la gravità delle reazioni acute e croniche del trapianto contro l'ospite (Graft versus Host Disease) non è stato determinato chiaramente.
Nel corso di una chemioterapia citotossica stabilita:
l'uso di Granocyte non è raccomandato 24 ore prima dell'inizio della chemioterapia e fino a 24 ore dopo la fine della chemioterapia.
Rischi associati all'intensificazione delle dosi di chemioterapia:
l'efficacia e l'innocuità di Granocyte non sono ancora state stabilite nel caso della chemioterapia intensificata. Inoltre, Granocyte non deve essere usato per ridurre gli intervalli tra i cicli di chemioterapia oltre i limiti stabiliti, né per aumentare le dosi degli agenti chemioterapici. Infatti, in uno studio di fase II d'intensificazione della chemioterapia con Granocyte, gli effetti tossici (diversi dai mieloidi) della chemioterapia sono stati fattori limitanti.
Precauzioni particolari nella mobilizzazione delle PBPC
Scelta del metodo di mobilizzazione:
studi clinici effettuati su una stessa popolazione di pazienti hanno dimostrato che, sulla base di misurazioni eseguite nello stesso laboratorio, la somministrazione di Granocyte dopo chemioterapia mielosoppressiva, piuttosto che come monoterapia, comporta una maggiore mobilizzazione delle PBPC. Tuttavia, la scelta tra questi due metodi di mobilizzazione deve prendere in considerazione l'insieme degli obiettivi terapeutici per ciascun paziente.
Trattamento precedente con agenti citotossici e/o radioterapia:
nei pazienti che in precedenza sono stati sottoposti a chemioterapia mielosoppressiva intensiva e/o a radioterapia intensiva, può essere difficile raggiungere la soglia minima raccomandata (≥2,0 x 106 cellule CD34+/kg) e, di conseguenza, un recupero ematologico sufficiente.
Un programma di trapianto delle PBPC dovrà essere pianificato nella fase iniziale dello schema di trattamento dei pazienti e si dovrà prestare particolare attenzione al numero di PBPC mobilizzate prima della somministrazione di una chemioterapia a forte dosaggio. Se i benefici dovessero rivelarsi minimi, il programma di trapianto di PBPC dovrà essere sostituito da altre forme di trattamento.
Determinazione del volume delle raccolte di PBPC:
si dovrà prestare particolare attenzione al metodo di quantificazione delle cellule staminali raccolte, tenuto conto della variabilità dei risultati della determinazione delle cellule CD34+ osservata tra diversi laboratori che utilizzano il metodo di citometria di flusso.
L'indicazione di una soglia minima di ≥2,0 x 106 cellule CD34+/kg è basata su alcuni studi pubblicati nella letteratura, nei quali si è ottenuto un recupero ematologico adeguato. Tuttavia, la soglia minima di cellule CD34+ non è stabilita definitivamente. Raccolte superiori a ≥2,0 x 106 cellule CD34+/kg sono associate a un recupero più rapido (compreso quello delle piastrine), mentre le raccolte inferiori sono associate a un recupero più lento.
Negli studi sulla mobilizzazione delle PBPC per il trapianto allogenico nei donatori sani, le rese sono state di ≥3 x 106 cellule CD34+ per kg di peso corporeo.
Nei donatori sani:
il procedimento di mobilizzazione delle PBPC, che non dà alcun beneficio diretto al donatore sano, deve essere usato solo dopo un'accurata valutazione e, in caso di applicabilità, in conformità con le direttive legali (Ordinanza sul controllo del sangue).
L'efficacia e l'innocuità di Granocyte non sono state stabilite nei donatori sani con più di 60 anni. Per questo motivo, si sconsiglia di procedere alla mobilizzazione delle PBPC nei donatori anziani. Secondo i regolamenti locali e in assenza di dati clinici, la mobilizzazione delle PBPC nei donatori minori non deve essere presa in considerazione.
La mobilizzazione delle PBPC sarà prevista nei donatori che rispondono ai criteri di selezione clinici e biologici ammessi per il trapianto di midollo osseo e in particolare che presentano dei valori ematologici normali.
Una leucocitosi pronunciata (WBC ≥50 x 109/l) è stata osservata nel 24% dei donatori sani esaminati.
Una trombocitopenia causata dall'aferesi (conta piastrinica <100 x 109/l) è stata riportata nel 42% dei donatori esaminati e valori inferiori a 50 x 109/l sono stati misurati occasionalmente dopo una leucaferesi. Non si sono manifestati effetti indesiderati clinicamente rilevanti e i valori si sono normalizzati.
Di conseguenza, la leucaferesi non va effettuata nei donatori che sono sotto trattamento anticoagulante o che presentano disturbi della coagulazione. Quando è necessaria più di una leucaferesi, si deve prestare particolare attenzione ai donatori la cui conta piastrinica è <100 x 109/l prima dell'aferesi; se la conta piastrinica è <75 x 109/l, generalmente si rinuncerà a eseguire l'aferesi.
Se il condizionamento del ricevente è già cominciato, si valuterà se l'aferesi debba comunque essere effettuata.
Si eviterà, nella misura possibile, il posizionamento di un catetere venoso centrale e la scelta dei donatori terrà in conto l'accesso venoso.
Sono state osservate alcune alterazioni citogenetiche transitorie nei donatori sani dopo la somministrazione di G-CSF. Il significato di tali alterazioni resta tuttavia sconosciuto.
Un monitoraggio a lungo termine della sicurezza d'impiego nei donatori di PBPC è in corso. Tuttavia, il rischio d'induzione di un clone mieloide maligno non può essere escluso. Si raccomanda inoltre che i centri di aferesi effettuino una registrazione sistematica e monitorino i donatori di PBPC per almeno 10 anni al fine di assicurare un follow-up a lungo termine della sicurezza.
Nei riceventi di cellule precursori provenienti dal sangue periferico e mobilizzato con Granocyte:
il trapianto di cellule precursori può essere accompagnato da un aumento del rischio di reazione cronica «Graft-versus-host»; i dati a lungo termine sul comportamento funzionale del trapianto sono scarsi.
Nei pazienti con anemia aplastica grave:
un trattamento dell'anemia aplastica grave con immunosoppressione e Granocyte dovrà avvenire sempre in un centro specializzato nel trattamento dell'anemia aplastica grave e dopo una diagnosi accurata, che comprende l'esclusione della sindrome mielodisplastica e della monosomia 7 (attraverso esame citogenetico mediante coltura o esami FISH).
Altre misure precauzionali:
l'evoluzione dei valori delle piastrine deve essere monitorata con particolare attenzione nei pazienti affetti da sindromi indotte da chemioterapia mielotossica o che hanno subito un trapianto di midollo osseo; infatti, il tasso medio di trombociti può essere leggermente più basso nei pazienti che ricevono Granocyte, rispetto a coloro che ricevono un placebo. Tuttavia, negli studi effettuati questo non ha comportato un aumento degli effetti indesiderati correlati alla perdita di sangue e il numero medio di giorni sotto infusione di trombociti, dopo il trapianto di midollo osseo, è stato lo stesso per entrambi i gruppi.
Non esistono studi sull'uso di Granocyte nei pazienti affetti da insufficienza epatica o renale grave.
Nei pazienti che presentano una diminuzione sostanziale del numero di progenitori mieloidi (ad esempio in seguito a un trattamento radioterapico o chemioterapico intensivo), la risposta neutrofila può essere talvolta ridotta; in questi casi la tolleranza di Granocyte non è stata stabilita.
L'efficacia e la tolleranza di Granocyte non sono ancora state determinate nei pazienti che ricevono un trattamento con nitrosuree non seguito da un trapianto di midollo osseo.
L'uso di Granocyte potrebbe persino comportare un aumento della tossicità piastrinica.
Granocyte contiene 10 mg di fenilalanina per fiala. Questo deve essere preso in considerazione nei pazienti che soffrono di fenilcetonuria.
Dopo la somministrazione di fattori di stimolazione granulocitaria (G-CSFs) a donatori sani o a pazienti, sono stati osservati frequenti casi di splenomegalia, generalmente asintomatica, e in casi isolati la rottura della milza. È importante quindi monitorare regolarmente le dimensioni della milza (ad es. mediante esame clinico o ecografia). Una diagnosi di rottura splenica deve essere presa in considerazione nei donatori che presentano dolori alla parte superiore sinistra dell'addome o della spalla.
La composizione del cappuccio all'estremità della siringa preriempita può contenere lattice di gomma (vedere informazioni sulla scatola) che potrebbe provocare reazioni allergiche gravi nelle persone predisposte.
Una sindrome di perdita capillare è stata riportata dopo la somministrazione di G-CSF ed è caratterizzata da ipotensione, ipoalbuminemia, edemi ed emoconcentrazione.
Se i pazienti sviluppano sintomi di sindrome da perdita capillare, si deve sospendere la somministrazione di lenograstim e avviare un trattamento sintomatico adeguato, che può includere il ricorso alla terapia (vedere «Effetti indesiderati»).
L'insorgenza di una crisi drepanocitica può potenzialmente essere associata all'uso di lenograstim nei pazienti portatori sani del tratto drepanocitico o affetti da drepanocitosi.
Di conseguenza, Granocyte deve essere prescritto con cautela nei pazienti portatori sani del tratto drepanocitico o affetti da drepanocitosi.
Glomerulonefrite:
sono stati riportati casi di glomerulonefrite nei pazienti e nei donatori sottoposti al lenograstim. Generalmente le glomerulonefriti scompaiono dopo una riduzione del dosaggio o la sospensione del G-CSF. Si raccomanda l'esecuzione di esami delle urine.
Aortite:
un'aortite è stata segnalata dopo la somministrazione di G-CSF nei soggetti sani e nei pazienti oncologici. I sintomi riportati comprendevano: febbre, dolori addominali, malessere, mal di schiena e aumento dei marcatori infiammatori (ad es. proteina C reattiva e conta dei globuli bianchi). Nella maggior parte dei casi, l'aortite è stata diagnosticata mediante un monitoraggio terapeutico dei farmaci (TDM) e si è risolta dopo la sospensione del trattamento con G-CSF. Vedere anche sezione «Effetti indesiderati».
Interazioni
L'efficacia e la tolleranza di Granocyte somministrato lo stesso giorno di un trattamento chemioterapico citotossico mielosoppressore non sono state stabilite. Considerando la sensibilità alla chemioterapia citotossica mielosoppressiva delle cellule mieloidi in rapida divisione, si sconsiglia l'uso di Granocyte nel periodo che copre il giorno precedente e quello successivo alla chemioterapia.
Le interazioni possibili con altri fattori di crescita ematopoietici e le citochine non sono ancora state analizzate nel corso degli studi clinici.
Gravidanza/Allattamento
Gravidanza
L'innocuità di Granocyte durante la gravidanza non è stata stabilita. Gli studi condotti sugli animali (ratto, coniglio) non hanno messo in luce effetti teratogeni. Tuttavia, è stato osservato un aumento del numero di aborti nel coniglio, ma non è stata constatata alcuna malformazione (vedere «Dati preclinici»). Granocyte dovrebbe essere utilizzato in gravidanza solo in caso di necessità assoluta.
Allattamento
Siccome non è noto se Granocyte viene escreto nel latte materno, il suo utilizzo non è raccomandato nelle donne che allattano.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Granocyte non ha alcuna influenza sulla capacità di condurre veicoli e sull'impiego di macchine.
Effetti indesiderati
Gli effetti indesiderati seguenti si sono manifestati frequentemente o molto frequentemente negli studi clinici e sono stati attribuiti a Granocyte:
Dolori ossei (13,3%), reazioni nel sito d'iniezione (8%), cefalee (6,7%), febbre (5,3%), dolori nel sito d'iniezione (4,7%), dolori dorsali (4%), leucocitosi (4%), dolori (3,3%), mialgie (3,3%), splenomegalia e/o un'alterazione reversibile della milza.
In casi rari, sono apparsi effetti collaterali polmonari, in particolare casi di dispnea, di ipossia o di emottisi. In casi molto rari, si è manifestata una sindrome da distress respiratorio acuto (ARDS) (vedere «Avvertenze e misure precauzionali»).
Sono state riferite reazioni allergiche, compresi rari casi di shock anafilattico, dopo la prima somministrazione di Granocyte.
Occasionalmente, è stata osservata una sindrome da perdita capillare dopo l'introduzione del medicamento sul mercato. Vedere la rubrica alla fine del capitolo e «Avvertenze e misure precauzionali».
Nel corso degli studi clinici o dopo la commercializzazione del prodotto sono stati osservati i seguenti effetti indesiderati, attribuiti a Granocyte, che in base alla frequenza sono definiti come: molto comuni (≥1/10); comuni (≥1/100, <1/10): non comuni (≥1/1'000, <1/100); rari (≥1/10'000, <1/1'000); molto rari (<1/10'000).
Patologie ematologiche e del sistema linfatico:
Comuni: leucocitosi (4%), splenomegalia (generalmente asintomatica).
Molto rari: rotture della milza.
Patologie vascolari:
Non comuni: sindrome della perdita capillare.
Rari: aortite.
Patologie del rene e delle vie urinarie:
Casi isolati: glomerulonefrite.
Patologie del sistema immunitario:
Molto rari: reazioni allergiche che possono raggiungere lo shock anafilattico in casi isolati.
Patologie del sistema nervoso:
Comuni: cefalee (6,7%).
Patologie respiratorie, toraciche e mediastiniche:
Non comuni: emottisi.
Rari: polmonite interstiziale. In alcuni di questi casi è stata riferita insufficienza respiratoria o shock polmonare (ARDS) potenzialmente fatali. Emorragia polmonare.
Patologie epatobiliari:
Molto comuni: aumento del tasso di ASAT, di ALAT e/o della fosfatasi alcalina.
Nella maggior parte dei casi, la funzione epatica è tornata alla normalità dopo la sospensione del trattamento.
Patologie della cute e del tessuto sottocutaneo:
Molto rari: vasculiti cutanee (meccanismo di insorgenza ancora inspiegabile).
Molto rari: sindrome di Sweet, eritema nodoso, pioderma gangrenoso, necrolisi epidermica, sindrome di Stevens-Johnson, esantema bolloso. Casi descritti principalmente in pazienti con emopatie maligne, malattie note per essere associate a dermatosi neutrofile, qualche caso in pazienti con neutropenie di origine non maligna.
Molto rari: sindrome di Lyell.
Patologie muscoloscheletriche e sistemiche:
Molto comuni: dolori muscoloscheletrici (inclusi dolori ossei, dolori dorsali, artralgie, mialgie, dolori alle estremità) (13,3%).
Disturbi generali e alterazioni nel sito di somministrazione:
Comuni: reazioni nel sito di iniezione (8%), febbre (5,3%), dolori nel sito di iniezione (4,7%).
Accertamenti:
Molto comuni: aumento transitorio dei valori di LDH (23%).
Inoltre, gli effetti indesiderati seguenti sono stati riportati in condizioni particolari:
Durante un trapianto di midollo osseo:
Gli effetti indesiderati seguenti sono stati descritti nel 15% o più dei pazienti, senza che si possa attribuirne con certezza la causa a Granocyte: infezioni e infiammazioni del cavo orale, febbre, diarrea, esantema, dolori addominali, vomito, alopecia, setticemia e infezioni. L'incidenza delle reazioni «graft-versus-host» dopo trapianto di midollo osseo è stata la stessa per il gruppo placebo e il gruppo Granocyte.
Durante una neutropenia indotta da chemioterapia:
In caso di neutropenia indotta da chemioterapia, è stato possibile osservare anche la presenza di alopecia, nausea, vomito, febbre e cefalee (identici agli effetti indesiderati osservati generalmente nei pazienti oncologici trattati con chemioterapia).
Sono stati riferiti casi di riduzione del numero medio di piastrine e di trombopenia nei pazienti trattati con Granocyte dopo chemioterapia.
Durante una mobilizzazione delle PBPC nei donatori sani:
Dopo la somministrazione di Granocyte a donatori sani, gli effetti indesiderati più frequenti osservati erano reversibili e di intensità da leggera a moderata. Si trattava di: cefalee (30%), dolori ossei (23%), dolori dorsali (17,5%), astenia (11%), dolori addominali (6%), altri dolori (6%), febbre, nausea. Il rischio di dolori aumenta con la crescita del picco dei valori di globuli bianchi, in particolare quando la conta raggiunge ≥50 x 109/l.
Sono state riportate una leucocitosi con valori ≥50 x 109/l nel 24% dei donatori e una trombocitopenia causata dall'aferesi (conta piastrinica <100 x 109/l) nel 42% dei donatori.
Un aumento transitorio dell'ASAT e/o dell'ALAT è stato osservato nel 12% dei donatori e un aumento delle fosfatasi alcaline nel 16% di essi. Sono stati riportati anche aumenti delle fosfatasi alcaline e dei valori di LDH.
Sono stati osservati casi frequenti, ma generalmente asintomatici, di splenomegalia e casi molto rari di rottura della milza.
Effetti indesiderati dopo l'introduzione sul mercato:
Una sindrome di perdita capillare, potenzialmente pericolosa per la vita se il trattamento non viene avviato in tempo, è stata segnalata occasionalmente dopo l'introduzione sul mercato, principalmente in pazienti oncologici sottoposti a chemioterapia dopo la somministrazione di fattori di crescita della linea dei granulociti. Tuttavia, è stato descritto anche un caso in un donatore sano sottoposto a un'aferesi dopo mobilizzazione delle PBPC (vedere sezione «Avvertenze e misure precauzionali»).
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-beneficio del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Gli effetti di un sovradosaggio di Granocyte non sono stati stabiliti.
Le dosi fino a 40 µg (5,12 milioni d'U.I.)/kg/giorno non hanno provocato effetti tossici, ad eccezione di dolori ossei e muscolari. In un paziente su 3 che avevano ricevuto il dosaggio più forte di Granocyte, è stata osservata una conta leucocitaria di circa 50 x 109/l al 5° giorno di trattamento.
Dopo l'interruzione del trattamento con Granocyte, il numero di neutrofili circolanti diminuisce del 50% in 1-2 giorni e raggiunge valori normali dopo 1-7 giorni.
Proprietà/Effetti
Codice ATC
L03AA10
Il lenograstim possiede una sequenza di amminoacidi perfettamente identica a quella del fattore umano naturale stimolante le colonie di granulociti (G-CSF) ed è glicosilato allo stesso modo. Questo polipeptide glicosilato altamente purificato, ottenuto dall'ingegneria genetica a partire da una linea cellulare di mammifero (Chinese hamster ovary (CHO) cells), è formato da una catena di 174 amminoacidi che contiene due ponti disolfurici (tra 4 basi di cisteine) ed è glicosilata sulla treonina-133.
Meccanismo d'azione
Il lenograstim appartiene alla famiglia delle citochine, un gruppo di proteine biologicamente attive che regolano la differenziazione e la proliferazione cellulare.
Farmacodinamica
Si è potuto dimostrare che il lenograstim stimola le cellule precursori dei neutrofili e induce, nelle 24 ore seguenti la sua applicazione, un aumento pronunciato del tasso dei neutrofili nel sangue periferico. L'aumento del numero di neutrofili dipende dalla dose del lenograstim, compresa tra 1 e 10 µg/kg di peso corporeo al giorno. Alla dose raccomandata di 5 µg/kg/giorno, somministrazioni ripetute comportano un aumento della risposta dei neutrofili. I granulociti neutrofili formati sotto trattamento con Granocyte presentano funzioni chemiotattiche e fagocitarie apparentemente normali.
In vitro, Granocyte ha, come gli altri fattori di crescita, un effetto stimolante sulle cellule endoteliali umane.
Efficacia clinica
L'uso di Granocyte, nei pazienti che hanno subito un trapianto di midollo osseo o che sono stati trattati per alcuni cicli con chemioterapia citotossica, permette una diminuzione significativa della durata della neutropenia e della gravità delle infezioni. Non è ancora stato dimostrato se questo effetto si mantiene anche dopo una somministrazione ripetuta.
La somministrazione di Granocyte da solo o dopo chemioterapia mobilizza le cellule staminali ematopoietiche nel sangue periferico. Queste cellule staminali autologhe del sangue periferico (Peripheral Blood Progenitor Cells = PBPC) possono essere raccolte e reinfuse dopo una chemioterapia citotossica ad alto dosaggio, sia in sostituzione che in associazione a un trapianto di midollo.
Nei donatori sani, il G-CSF mobilizza le cellule precursori per un trapianto allogenico. I meccanismi sono ancora sconosciuti.
Le PBPC reinfuse ottenute dopo mobilizzazione con Granocyte si sono rivelate capaci di ricostituire l'ematopoiesi e di accelerarne il trapianto. L'indipendenza dei pazienti dalle trasfusioni di piastrine viene quindi acquisita più rapidamente rispetto al trapianto autologo di midollo.
L'uso di Granocyte nei pazienti che ricevono un trapianto di midollo o che vengono trattati con chemioterapia citotossica comporta una riduzione significativa della comparsa, della gravità e della durata della neutropenia e delle complicanze associate.
Nell'ambito di uno studio multicentrico in fase III, 102 pazienti affetti da anemia idiopatica aplastica de novo grave sono stati randomizzati in due gruppi. Un totale di 53 pazienti ha ricevuto inoltre una terapia immunosoppressiva (globulina antilinfocita e ciclosporina) e del lenograstim; 49 pazienti hanno ricevuto una immunosoppressione senza lenograstim supplementare. Il lenograstim è stato somministrato quotidianamente durante le prime 12 settimane (in media 98 giorni) per via sottocutanea alla dose di 5 µg/kg di peso corporeo in media. Durante la terapia immunosoppressiva con lenograstim e contrariamente a quanto osservato nel gruppo di controllo, il tasso assoluto di cellule neutrofile, ossia il principale parametro di efficacia, è nettamente aumentato. Il picco di cellule neutrofile è stato raggiunto dopo 1 settimana. Una risposta neutrofila completa (tasso assoluto di cellule neutrofile > 1,5 x 109/l) è stata ottenuta con un numero significativamente più elevato nel gruppo lenograstim piuttosto che nel gruppo di controllo (83% contro 44,9%, p<0,001). Anche nei pazienti ad alto rischio affetti da anemia aplastica idiopatica molto grave, il gruppo trattato con lenograstim ha mostrato un tasso di risposta significativamente più elevato (69,2% contro 31,6% nel gruppo di controllo, p=0,012). I parametri secondari dell'efficacia (in particolare i criteri clinici, ad es. le infezioni) hanno dimostrato al massimo una tendenza a differenziarsi, ma nessuna differenza significativa tra i due gruppi.
Farmacocinetica
Assorbimento
Durante la somministrazione endovenosa di Granocyte, non vi è alcuna correlazione lineare tra la dose e l'AUC o Cmax. Tale relazione è lineare, dopo il raggiungimento dello steady-state (5° giorno), durante la somministrazione sottocutanea di dosi fino a 20 µg/kg.
Nel corso delle somministrazioni sottocutanee ripetute della dose raccomandata di 5 µg/kg/giorno, le concentrazioni sieriche massime del lenograstim si attestano a circa 100 pg/ml/kg di peso corporeo. Le somministrazioni ripetute di Granocyte per entrambe le vie di iniezione non hanno mostrato segni di accumulo del prodotto.
La biodisponibilità assoluta è inversamente proporzionale alla dose. Alla dose raccomandata di 5 µg/kg/giorno, essa ammonta al 30%.
Distribuzione
Il volume apparente di distribuzione (Vdarea) è di circa 1 l/kg di peso corporeo e il tempo medio di permanenza dopo somministrazione sottocutanea è di circa 7 ore.
Metabolismo
Vedere «Eliminazione»
Eliminazione
Allo stato stazionario, l'emivita apparente di eliminazione sierica del lenograstim è di circa 3-4 ore dopo l'iniezione sottocutanea e di 1-1,5 ore dopo l'infusione endovenosa ripetuta. La clearance plasmatica del rHuG-CSF triplica (da 50 a 150 ml/min.) dopo le somministrazioni ripetute per via sottocutanea. Il lenograstim viene escreto solo minimamente in forma immodificata nelle urine (meno dell'1% della dose) poiché probabilmente è metabolizzato in peptidi endogeni.
Esiste una correlazione positiva tra la dose e la concentrazione sierica di Granocyte e tra la risposta neutrofila e la quantità totale di Granocyte ritrovata nel siero.
Cinetica di gruppi di pazienti speciali
Vedere «Posologia/impiego», «Pazienti anziani», «Bambini e adolescenti».
Dati preclinici
Gli studi di tossicità cronica sui ratti hanno dimostrato che Granocyte, a una dose di 100 µg/kg/giorno, provoca un aumento del riassorbimento osteoclastico.
Mutagenicità
Il lenograstim non ha presentato effetti mutageni né in vitro, nel test di Ames (Salmonella typhimurium), né in vivo, nel test del micronucleo nel topo. Anche il test in vitro di aberrazione cromosomica (cellule CHL) si è rivelato negativo.
Cancerogenicità
Non è noto alcun effetto cancerogeno con Granocyte, né sugli animali né sull'uomo.
Tossicità per la riproduzione
Gli studi sugli animali (con dosi fino a 100 µg/kg/giorno e.v. nei ratti e nei conigli) hanno dimostrato che Granocyte non ha effetti teratogeni. Nei conigli (no-effect level 10 µg/kg/giorno e.v.), è stato tuttavia osservato un aumento del tasso di aborto (vedere «Gravidanza/allattamento»).
Altre indicazioni
Incompatibilità
Per quanto concerne la compatibilità con i materiali dei contenitori, vedere «Indicazioni per la manipolazione».
La composizione del cappuccio all'estremità della siringa preriempita può contenere lattice di gomma (vedere informazioni sulla scatola) che potrebbe provocare reazioni allergiche gravi nelle persone predisposte.
Influenza sui metodi diagnostici
Nessuna influenza nota.
Stabilità
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Stabilità dopo l'apertura
Dopo la diluizione in 1 ml di acqua per soluzioni iniettabili, Granocyte si conserva 24 ore a temperatura ambiente (+ 25 °C). Tuttavia, visto che Granocyte non contiene conservanti, si raccomanda di conservarlo tra i 2 °C e gli 8 °C. Dopo la diluizione di Granocyte 13 a una concentrazione finale di minimo 2 µg/ml (0,26 mln U.I./ml) e di Granocyte 34 a una concentrazione finale di minimo 2,5 µg/ml (0,32 mln U.I./ml.), la soluzione può essere conservata per 24 ore a + 25 °C ovvero a + 5 °C senza la perdita dell'attività.
Il medicamento deve essere tenuto al di fuori della portata dei bambini.
Indicazioni particolari concernenti l'immagazzinamento
Granocyte deve essere conservato tra + 2 °C e + 30 °C. La stabilità di Granocyte è stata dimostrata anche dopo una conservazione per 6 mesi a 40 °C e 3 mesi a 50 °C. Pertanto, una breve esposizione (qualche settimana) a temperature che raggiungono i 50 °C non influisce sulla qualità delle fiale di Granocyte.
Indicazioni per la manipolazione
1 flaconcino di Granocyte viene diluito in 1 ml di acqua per preparati iniettabili. Per diluirlo ruotare leggermente il flacone, non agitare.
Per la somministrazione per infusione endovenosa, Granocyte viene diluito in una soluzione isotonica di cloruro di sodio 0,9%. Sotto questa forma, Granocyte è compatibile con i contenitori per infusione in vetro (soluzione di NaCL/destrosio) o in cloruro di polivinile (soluzione di NaCl). Fino a una concentrazione finale di almeno 2,5 g/ml, il vetro o i materiali plastici non assorbono il principio attivo in misura significativa. Granocyte 13 non deve essere diluito in più di 50 ml e Granocyte 34 in più di 100 ml di soluzione di 0,9% NaCl. Tuttavia, è preferibile evitare diluizioni di Granocyte 13 a concentrazioni inferiori a 2 µg/ml (0,26 mln U.I./ml), nonché diluizioni di Granocyte 34 a concentrazioni inferiori a 2,5 µg/ml (0,32 mln U.I./ml).
Per la mobilizzazione delle PBPC nei donatori sani, Granocyte viene somministrato per iniezione sottocutanea.
Numero dell'omologazione
52170 (Swissmedic)
Titolare dell’omologazione
sanofi-aventis (svizzera) sa, 1214 Vernier/GE
Stato dell'informazione
Aprile 2020
Informazioni pratiche sulla preparazione e sulla manipolazione del medicamento destinate ai professionisti sanitari
I flaconcini di GRANOCYTE sono monouso. A causa del possibile rischio di contaminazione batterica, le siringhe di solvente preriempite sono monouso.
GRANOCYTE deve essere utilizzato per iniezione sottocutanea o infusione endovenosa.
GRANOCYTE si presenta sotto forma di polvere e solvente per soluzione iniettabile/infusione in siringa preriempita.
Polvere in flaconcino + 1 ml di solvente in siringa preriempita con 2 aghi (il più grande di colore beige (19G) per la ricostituzione e il più piccolo di colore marrone (26G) per la somministrazione).
Preparazione della soluzione ricostituita:
- operando in asepsi, aggiungere il contenuto estraibile di una siringa preriempita al flaconcino di GRANOCYTE utilizzando l'ago 19G.
- Agitare delicatamente fino a completa dissoluzione.
- Non agitare energicamente.
- La soluzione parenterale ricostituita appare trasparente e priva di particelle. Prelevare il volume necessario di soluzione ricostituita dal flaconcino, utilizzando l'ago 19G.
- Somministrare immediatamente per via sottocutanea, utilizzando l'ago 26G.
Il prodotto o soluzione non utilizzati o i rifiuti derivati vanno smaltiti in conformità alla normativa vigente.
1. Impiego per il prodotto presentato con siringa preriempita con cappuccio in gomma contenente LATTICE:
| Figura 1 Togliere il cappuccio in plastica dal flaconcino. |
| Figura 7 Mantenendo la siringa con l'ago inserito nel flancino, capovolgere quest'ultimo a testa in giù. Assicurarsi che la punta dell'ago sia a contatto con la soluzione. |
| Figura 2 Pulire il cappuccio in gomma. |
| Figura 8 Ritirare lentamente lo stantuffo della siringa e prelevare dal flaconcino il volume necessario corrispondente alla dose prescritta. |
| Figura 3 Togliere dal blister una siringa preriempita e i due aghi (uno con il cono beige (19G) e uno con il cono marrone (26G)). |
| Figura 9 Togliere l'ago con il cono beige dalla siringa e sostituirlo con l'ago con il cono marrone. |
| Figura 4 Togliere il cappuccio dall'estremità della siringa e montare l'ago con il cono beige. |
| Figura 10 Eliminare tutte le bolle d'aria picchiettando delicatamente sul corpo della siringa, poi spingere delicatamente lo stantuffo per eliminare l'aria. |
| Figura 5 Mantenendo il flaconcino su una superficie piana, perforare il cappuccio in gomma con l'ago, poi spingere lo stantuffo per iniettare il solvente nel flaconcino. |
| Figura 11 Se necessario, regolare il volume da somministrare. GRANOCYTE è ora pronto per la somministrazione. Iniettare immediatamente per via sottocutanea. |
| Figura 6 Agitare delicatamente fino a completa dissoluzione (circa 5 secondi). Non agitare energicamente. |
| Individuazione dei siti di iniezione per somministrazione sottocutanea. |
2. Impiego per il prodotto presentato con siringa preriempita con cappuccio in gomma SENZA LATTICE:
| A: cappuccio (comprendente l'inserto interno in gomma) B: punta dello stantuffo in gomma C: stantuffo Gli aghi sono protetti in un contenitore singolo rigido composto da: D: cappuccio di protezione dell'ago E: cappuccio colorato (di colore beige o marrone F: base G: punta dell'ago |
| Figura 1 Estrarre il flaconcino dal blister e togliere il cappuccio in plastica dal flaconcino. Pulire il tappo di gomma con un panno imbevuto d'alcol sterile. |
| Figura 7 Mantenendo la siringa con l'ago inserito nel flancino, capovolgere quest'ultimo a testa in giù. Ritirare parzialmente l'ago, assicurandosi che la punta dello stesso sia sempre a contatto con la soluzione. Tenendo la base dell'ago e la siringa, tirare lo stantuffo delicatamente per aspirare il maggior quantitativo di soluzione nella siringa. |
| Figura 2 Togliere dal blister la siringa preriempita e i due aghi (uno con il cappuccio di colore beige (19G) e l'altro con il cappuccio di colore marrone (26G)). |
| Figura 8 Verificare che non ci siano bolle d'aria nella siringa. Se ci sono bolle d'aria nella siringa, tenerla ben dritta e picchiettare sul corpo della siringa fino a quando le bolle non salgono in superficie. Spingere lo stantuffo per far uscire le bolle d'aria. |
| Figura 3 Svitare il cappuccio della siringa e toglierlo. |
| Figura 9 Spingere lo stantuffo fino a quando l'estremità in gomma sia allineata con la tacca del volume superiore a quello necessario (con incrementi di 0,1 ml). Ad esempio, se si necessitano 0,8 ml, spingere lo stantuffo fino alla tacca che indica 0,9 ml. |
| Figura 4 Tenere saldamente le due estremità del contenitore dell'ago con il cappuccio colore beige. Svitare il cappuccio color beige (in un senso o nell'altro) e toglierlo. Tenendo il cappuccio di protezione dell'ago, avvitare la base dell'ago sulla siringa. |
| Figura 10 Rimettere in piedi il flaconcino e spingere interamente l'ago nel flaconcino. Tenere la base dell'ago, svitare la siringa lasciando l'ago inserito nel flaconcino. Tenere saldamente le due estremità del contenitore dell'ago con il cappuccio color marrone. Svitare il cappuccio color marrone (in un senso o nell'altro) e toglierlo. Tenendo il cappuccio di protezione dell'ago, avvitare la base dell'ago sulla siringa. Togliere il cappuccio di protezione dell'ago. |
| Figura 5 Togliere il cappuccio di protezione dell'ago. Mantenendo il flaconcino su una superficie piana, perforare il cappuccio in gomma servendosi dell'ago, poi spingere lentamente lo stantuffo per iniettare il solvente nel flaconcino. |
| Figura 11 Verificare che non ci siano bolle d'aria nella siringa. Se ci sono bolle d'aria nella siringa, tenerla ben dritta e picchiettare sul corpo della siringa fino a quando le bolle non salgono in superficie. Spingere lo stantuffo per far uscire le bolle d'aria. Se necessario, regolare il volume da somministrare. |
| Figura 6 Agitare delicatamente fino a completa dissoluzione della polvere. Non agitare energicamente. |
| GRANOCYTE è ora pronto per la somministrazione. Iniettare immediatamente per via sottocutanea. Individuazione dei siti di iniezione per somministrazione sottocutanea. |
Composition
Principes actifs
Lénograstim (rHuG-CSF) (rHuG-CSF signifie: facteur humain recombinant stimulant les colonies de granulocytes).
Excipients
L-argininum 10 mg, L-phenylalaninum 10 mg, L-methioninum 1 mg, Mannitolum 25 mg, Polysorbatum 20 0,1 mg, Acidum Hydrochloridum q.s. pH 6,5, Natrii Chloridum env. 0,6 mg resp. 1,4 mg.
Solvant: Eau pour préparations injectables 1,0 ml.
Forme pharmaceutique et quantité de principe actif par unité
Ampoule de lyophilisat: lénograstim (rHuG-CSF) 13,4 Mio.U.I.* (105 µg) resp. 33,6 Mio.U.I.* (263 µg).
* Les unités sont mesurées par la méthode biologique in vitro GNFS-60, par comparaison avec le standard international de l'OMS pour le G-CSF humain.
1 µg de rHuG-CSF correspond à 0,128 million d'U.I.
Indications/Possibilités d’emploi
- Réduction de la durée et de la gravité des neutropénies chez les patients subissant une chimiothérapie cytotoxique fortement myélosuppressive en raison d'une affection maligne, à l'exception des patients présentant une leucémie myéloïde chronique ou un syndrome myélodysplasique.
- Réduction de la durée des neutropénies chez les patients subissant une chimiothérapie cytotoxique à forte dose suivie d'une greffe de moelle autologue/allogénique.
- Mobilisation de cellules souches dans le sang périphérique (PBPCs) pour la transplantation autologue seule ou consécutive à une chimiothérapie myélosuppressive.
- Mobilisation de cellules souches dans le sang périphérique (PBPCs) pour la transplantation allogénique.
Possibilité d'emploi:
Raccourcissement de la durée des neutropénies chez les patients souffrant d'anémie aplasique idiopathique sévère de novo sous immunosuppression avec la globuline anti-lymphocyte et la ciclosporine. L'effet sur des critères cliniques (infections, mortalité) n'a pas été démontré.
Posologie/Mode d’emploi
Le traitement par Granocyte ne doit être réalisé qu'en collaboration avec des oncologues et des hématologues expérimentés dans le traitement avec le G-CSF.
Ajustement de la posologie / titration
Granocyte 13 est administré chez les patients avec une surface corporelle jusqu'à 0,7 m2 et Granocyte 34 pour une surface corporelle supérieure à 0,7 m2.
La dose recommandée de Granocyte:
- lors d'une greffe de moelle osseuse,
- après une chimiothérapie cytotoxique fortement myélosuppressive,
- pour la mobilisation de PBPCs après chimiothérapie myélosuppressive,
- lors d'anémie aplasique idiopathique sévère sous immunosuppression avec la globuline anti-lymphocyte et la ciclosporine (la dose doit être administrée quotidiennement sous forme d'injection sous-cutanée durant les premiers 6 mois au plus de la thérapie immunosuppressive) est de 19,2 Mio U.I (150 µg) m2/jour, dose d'efficacité équivalente à celle de 0,64 Mio U.I. (5 µg) par kg et par jour.
Pour la mobilisation de PBPCs avec Granocyte seul, la dose recommandée est de 1,28 Mio U.I. (10 µg) /kg/jour.
Adultes
Après greffes de moelle:
La dose recommandée de 19,2 Mio U.I (150 µg)/m2/jour, dose d'efficacité équivalente à 0,64 Mio U.I. (5 µg) par kg et par jour, est administrée quotidiennement. Le traitement commence le jour suivant la transplantation, soit en perfusion i.v. de 30 minutes, Granocyte 13 étant dilué dans 50 ml et Granocyte 34 dans 100 ml de solution de NaCl isotonique, soit en injection sous-cutanée (voir «Remarques particulière concernant la manipulation»). L'administration quotidienne est poursuivie au-delà du nadir attendu (valeur la plus basse de granulocytes neutrophiles), jusqu'à ce que le nombre des neutrophiles ait atteint ≥1x 109/l durant 3 jours consécutifs. En cas de nécessité, Granocyte peut être administré durant une période allant jusqu'à 28 jours consécutifs. L'expérience montre qu'au 14ème jour suivant la transplantation de moelle osseuse, 50% des patients auront retrouvé un taux normal de leurs neutrophiles.
Dans les traitements de chimiothérapie cytotoxique fortement myélosuppressive:
La dose quotidienne recommandée de Granocyte est administrée en injection sous-cutanée, à partir du jour suivant la fin du traitement chimiothérapique. L'administration quotidienne est poursuivie au-delà du nadir attendu (valeur la plus basse de granulocytes neutrophiles), jusqu'à ce que le nombre des neutrophiles ait atteint ≥1 x 109/l durant 3 jours consécutifs, ce qui intervient généralement dans les 8-14 jours qui suivent le début du traitement. Si nécessaire, Granocyte peut être administré durant une période pouvant aller jusqu'à 28 jours consécutifs. Même si l'on observe une augmentation transitoire des neutrophiles dans les 2 premiers jours de traitement, ce dernier étant poursuivi, entraîne habituellement une apparition plus précoce du nadir et le nombre des neutrophiles revient plus rapidement à la normale.
Pour la mobilisation de PBPCs après chimiothérapie myélosuppressive:
La dose recommandée de Granocyte de 19,2 Mio U.I (150 µg)/m2/jour, dose d'efficacité équivalente à 0,64 Mio U.I. (5 µg) par kg et par jour, est administrée quotidiennement, dès le jour suivant la fin de la chimiothérapie, en injection sous-cutanée, jusqu'à ce que la date du nadir attendu soit dépassée et que le nombre de neutrophiles soit retourné à un niveau normal compatible avec l'arrêt du traitement par Granocyte.
La leucaphérèse devrait avoir lieu lorsque le nombre des leucocytes, après le nadir, est en augmentation ou après détermination des cellules CD34+ dans le sang par une méthode validée. Chez les patients qui n'ont pas été intensivement prétraités par chimiothérapie, une leucaphérèse est dans la plupart des cas suffisante pour obtenir le seuil minimum recommandé (≥2,0 x 106 cellules CD34+/kg).
Pour mobiliser les PBPCs avec Granocyte seul (sans chimiothérapie):
La dose recommandée de Granocyte de 38,4 Mio U.I. (300 µg)/m2/jour, dose d'efficacité équivalente à celle de 1,28 Mio U.I. (10 µg) par kg et par jour, est administrée quotidiennement en injection sous-cutanée pendant 4 à 6 jours. La leucaphérèse devrait avoir lieu entre les jours 5 et 7. Chez les patients qui n'ont pas été intensivement prétraités par chimiothérapie, une leucaphérèse est dans la plupart des cas suffisante pour obtenir le seuil minimum recommandé (≥2,0 x 106 cellules CD34+/kg).
Mobilisation de PBPCs chez des donneurs sains pour la transplantation allogénique:
La dose recommandée de Granocyte de 38,4 Mio U.I. (300 µg)/m2/jour, dose d'efficacité équivalente à celle de 1,28 Mio U.I. (10 µg) par kg et par jour, est administrée quotidiennement en injection sous-cutanée pendant 4 à 6 jours. La leucaphérèse devrait avoir lieu entre les jours 5 et 7. Ce procédé permet d'obtenir la collecte de ≥3 x 106 cellules CD34+ par kg de poids corporel à partir d'une leucaphérèse chez 83% des sujets, voire de deux leucaphérèses pour 97% des sujets.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Patients âgés
Les essais cliniques avec Granocyte ont démontré qu'une posologie spécifique n'est pas nécessaire chez le patient âgé.
Certaines données suggèrent que la mobilisation des PBPCs pour la transplantation allogénique chez les personnes âgées nécessite des doses plus élevées de G-CSF ou peut s'avérer plus difficile.
Enfants et adolescents
L'efficacité et l'innocuité et la sécurité de Granocyte ont été établies chez des enfants dès l'âge de 2 ans ayant subi une transplantation de moelle osseuse.
Contre-indications
Granocyte est contre-indiqué chez les patients ou chez les donneurs sains ayant une hypersensibilité connue au produit ou à d'autres composants de la préparation (voir «Mises en garde et précautions»).
Granocyte ne doit pas être utilisé en même temps que la chimiothérapie.
Granocyte ne doit pas être utilisé pour augmenter l'importance des doses dans des schémas de chimiothérapie reconnus et/ou pour réduire les intervalles de temps.
L'efficacité et l'innocuité du Granocyte n'ont pas été établies chez les patients présentant un syndrome myélodysplasique ou une leucémie myéloïde chronique. Par conséquent, Granocyte ne doit pas être utilisé dans ces indications.
Mises en garde et précautions
Contre-indications relatives
Croissance cellulaire maligne:
Les facteurs de stimulation des colonies de granulocytes peuvent stimuler la croissance des cellules myéloïdes in vitro. On peut également observer des effets semblables sur certaines cellules non myéloïdes.
Il existe par conséquent un risque théorique de stimulation d'un clone malin avec passage vers un syndrome myélodysplasique ou une leucémie aiguë ou vers une hémoglobinurie paroxysmale nocturne lors d'anémie aplasique sévère traitée efficacement.
Dans le cas de leucémies aiguës myéloïdes, le bénéfice clinique de Granocyte n'a pas été clairement établi chez les patients âgés de moins de 55 ans.
La différenciation diagnostique entre une leucémie aiguë myéloïde et la transformation blastique d'une leucémie myéloïde chronique doit faire l'objet d'une attention particulière.
Les essais cliniques n'ont pas encore permis d'établir si Granocyte influence la progression des syndromes myélodysplasiques vers une leucémie myéloïde aiguë. Aussi la prudence est-elle requise en cas d'utilisation de Granocyte dans les états myéloïdes pré-malins. Comme les cellules de certaines tumeurs peuvent exceptionnellement exprimer des récepteurs au G-CSF, la prudence est requise en cas de croissance tumorale inattendue et constatée lors du traitement par le rHuG-CSF.
Leucocytose:
Dans le cadre des études cliniques, aucun taux de leucocytes supérieur à 50 x 109/l n'a été observé chez les patients traités par Granocyte (0,64 million U.I. ou 5 µg/kg/j.) après une transplantation de moelle osseuse.
Moins de 5% des patients ayant subi une chimiothérapie cytotoxique et un traitement par Granocyte à raison de 0,64 million d'U.I. (5 µg)/kg/jour ont présenté des concentrations de globules blancs égales ou supérieures à 70 x 109/l. Aucun effet secondaire directement attribuable à ce degré de leucocytose n'a été observé. Etant donné les risques potentiels liés à une leucocytose importante, une numération des globules blancs devrait être réalisée à intervalles réguliers durant un traitement par Granocyte. Si le taux des leucocytes est supérieur à 50 x 109/l après le nadir habituel (taux le plus bas de neutrophiles granulocytes), le traitement par Granocyte doit être arrêté immédiatement.
Mobilisation de PBPCs chez des donneurs sains pour la transplantation allogénique:
Lorsque le nombre de leucocytes dépasse 70 x 109/l, il faut évaluer si la mobilisation doit être poursuivie ou interrompue car la mobilisation ne peut pas être interrompue facilement si le receveur est déjà conditionné
Symptômes pulmonaires:
Dans de rares cas (>0,01% et <0,1%), des effets secondaires pulmonaires tels qu'une pneumonie interstitielle, un œdème pulmonaire, une dyspnée, des infiltrations pulmonaires ou une fibrose pulmonaire peuvent se manifester.
L'apparition de symptômes pulmonaires (tels que toux, fièvre et dyspnée) associés à des signes radiologiques (tels qu'infiltrats pulmonaires) et à des aggravations de la fonction pulmonaire peuvent constituer les premiers signes d'un arrêt respiratoire à venir ou d'une insuffisance respiratoire aiguë.
Il faut alors entreprendre un traitement approprié et envisager une interruption du traitement par Granocyte.
Chez les donneurs sains et chez les patients, des effets indésirables pulmonaires (hémoptysie, hémorragie pulmonaire, infiltrats pulmonaires, dyspnée et hypoxie) ont été rapportés au cours des études après commercialisation. En cas d'effet pulmonaire suspecté ou confirmé, l'arrêt du traitement avec Granocyte doit être considéré et un traitement médical approprié doit être mis en place.
Lors d'une greffe de moelle osseuse:
Il convient d'être particulièrement attentif à la récupération plaquettaire, car dans le cadre d'une étude contrôlée par placebo, menée en double aveugle, le taux moyen de thrombocytes était plus faible que dans le groupe de comparaison placebo. L'effet de Granocyte sur la fréquence et la gravité des réactions aiguës et chroniques du greffon versus l'hôte (Graft versus Host Disease) n'a pas été clairement déterminé.
Au cours d'une chimiothérapie cytotoxique établie:
L'emploi de Granocyte n'est pas recommandé 24 heures avant le début de la chimiothérapie et jusqu'à 24 heures après la fin de celle-ci.
Risques associés à l'intensification des doses de chimiothérapie:
L'efficacité et l'innocuité de Granocyte n'ont pas encore été établies dans le cas de chimiothérapie intensifiée. Aussi Granocyte ne doit-il ni être utilisé pour diminuer, au-delà des limites établies, les intervalles entre les cycles de chimiothérapie ni pour augmenter les doses d'agents chimiothérapiques. En effet, dans un essai de phase II d'intensification de chimiothérapie avec Granocyte, des effets toxiques (autres que myéloïdes) de la chimiothérapie ont été des facteurs limitant.
Précautions particulières dans la mobilisation des PBPCs
Choix de la méthode de mobilisation:
Des études cliniques effectuées chez une même population de patients ont montré que, par rapport à l'administration de Granocyte seul, celle faite après une chimiothérapie myélosuppressive entraîne une mobilisation plus élevée de PBPCs, les mesures étant effectuées dans le même laboratoire. Cependant, le choix entre ces deux méthodes de mobilisation doit prendre en considération l'ensemble des objectifs thérapeutiques pour chaque patient.
Traitement antérieur par des agents cytotoxiques et/ou radiothérapie:
Chez des patients ayant été soumis antérieurement à une chimiothérapie myélosuppressive intensive et/ou à une radiothérapie intensive, il peut se révéler difficile d'obtenir le seuil minimum recommandé (≥2,0 x 106 cellules CD34+/kg) et, par conséquent, une récupération hématologique suffisante.
Un programme de transplantation de PBPCs devrait être planifié déjà dans la phase initiale du schéma de traitement des patients et une attention particulière devrait être portée au nombre de PBPCs mobilisés avant l'administration d'une chimiothérapie à forte dose. Si les gains devaient se révéler minimes, le programme de greffe de PBPCs devrait être remplacé par d'autres formes de traitement.
Détermination de la richesse des collections de PBPCs:
Une attention particulière doit être portée à la méthode de quantification des cellules souches collectées, compte tenu de la variabilité des résultats de la détermination des cellules CD34+ observée entre différents laboratoires utilisant la méthode de cytométrie de flux.
L'indication d'un seuil minimum de ≥2,0 x 106 cellules CD34+/kg est basée sur des essais publiés dans la littérature, dans lesquels une récupération hématologique adéquate a été obtenue. Toutefois le seuil minimum de cellules CD34+ n'est pas définitivement établi. Des collections supérieures à ≥2,0 x 106 cellules CD34+/kg sont associées à une récupération plus rapide (y compris celle des plaquettes), alors que des collections inférieures sont associées à une récupération plus lente.
Dans les essais sur la mobilisation des PBPCs pour la transplantation allogénique chez des donneurs sains, les rendements visés ont été de ≥3 x 106 cellules CD34+ par kg de poids corporel.
Chez des donneurs sains:
Le procédé de mobilisation des PBPCs, qui ne procure aucun bénéfice direct au donneur sain, ne doit être utilisé qu'après une évaluation précise et - en cas d'applicabilité - en conformité avec les directives légales (Ordonnance sur le contrôle du sang).
L'efficacité et l'innocuité de Granocyte n'ont pas été établies chez des donneurs sains âgés de plus de 60 ans. Dès lors, il n'est pas recommandé de procéder à la mobilisation des PBPCs chez des donneurs âgés. Selon les réglementations locales et en l'absence de données cliniques, la mobilisation des PBPCs chez des donneurs mineurs ne doit pas être envisagée.
La mobilisation des PBPCs sera envisagée chez des donneurs qui répondent aux critères de sélection cliniques et biologiques retenus pour la transplantation de moelle osseuse et présentent notamment des valeurs hématologiques normales.
Une leucocytose prononcée (WBC ≥50 x 109/l) a été observée chez 24% des donneurs sains examinés.
Une thrombocytopénie causée par l'aphérèse (numération plaquettaire <100 x 109/l) a été rapportée chez 42% des donneurs examinés et des valeurs inférieures à 50 x 109/l ont été mesurées occasionnellement après une leucaphérèse. Il n'est pas apparu d'effets indésirables présentant une importance clinique et les valeurs se sont normalisées.
Il ne faut donc pas faire de leucaphérèse chez des donneurs qui sont sous traitement anticoagulant ou pour qui l'on a une notion de troubles de la coagulation. Lorsque plus d'une leucaphérèse est nécessaire, une attention particulière doit être portée aux donneurs dont la numération plaquettaire est <100 x 109/l avant l'aphérèse; si la numération plaquettaire est <75 x 109/l, on renoncera généralement à effectuer l'aphérèse.
Si le conditionnement du receveur a déjà commencé, on évaluera si l'aphérèse doit tout de même être entreprise.
On évitera, dans la mesure du possible, la pose d'un cathéter veineux central et le choix des donneurs prendra en compte l'accès veineux.
Des modifications cytogénétiques transitoires ont été observées chez des donneurs sains après l'administration de G-CSF. La signification de ces changements reste toutefois inconnue.
Un suivi à long terme de la sécurité d'emploi chez les donneurs de PBPCs est en cours. Néanmoins, le risque d'induction d'un clone myéloïde malin ne peut pas être exclu. Il est ainsi recommandé que les centres d'aphérèse procèdent à un enregistrement systématique et à un suivi des donneurs de PBPCs pendant au moins 10 ans afin d'assurer un suivi à long terme de la sécurité.
Chez les receveurs de cellules précurseurs provenant du sang périphérique et mobilisées avec Granocyte:
La transplantation de cellules précurseurs peut s'accompagner d'un risque augmenté de réaction chronique «Graft-versus-host»; les données à long terme sur le comportement fonctionnel du greffon sont rares.
Chez les patients présentant une anémie plastique sévère:
Un traitement de l'anémie aplasique sévère avec immunosuppression et Granocyte devrait toujours avoir lieu dans un centre expérimenté dans le traitement de l'anémie plastique sévère et après un diagnostic établi avec soin, comprenant l'exclusion du syndrome myélodysplastique et de la monosomie 7 (par examen cytogénétique au moyen d'une culture ou d'examens par FISH).
Autres précautions particulières:
L'évolution des valeurs des plaquettes doit être surveillée avec une attention particulière chez les patients présentant des symptômes induits par une chimiothérapie myélotoxique ou ayant subi une transplantation de moelle osseuse; en effet, le taux moyen de thrombocytes peut être légèrement abaissé chez les patients recevant Granocyte, par comparaison avec ceux qui reçoivent un placebo. Toutefois, dans les études effectuées, cela n'a pas entraîné d'augmentation des effets indésirables liés à la perte de sang et le nombre moyen de jours sous perfusion de thrombocytes, après la greffe de moelle osseuse, a été le même pour les deux groupes.
Il n'existe pas d'études sur l'emploi de Granocyte chez des patients présentant une insuffisance hépatique ou rénale grave.
Chez les patients présentant une diminution substantielle du nombre des progéniteurs myéloïdes (par exemple à la suite d'un traitement radiothérapique ou chimiothérapique intensif), la réponse neutrophile peut parfois être diminuée et la tolérance de Granocyte n'a pas été établie dans ces cas.
L'efficacité et la tolérance de Granocyte n'ont pas encore été établies chez les patients recevant un traitement de nitrosurées non suivi d'une transplantation de moelle osseuse.
L'utilisation de Granocyte pourrait même entraîner notamment une toxicité plaquettaire accrue.
Granocyte contient 10 mg de phénylalanine par ampoule. Ceci doit être pris en considération chez les patients souffrant de phénylcétonurie.
Après administration de facteur de stimulation granulocytaire (G-CSFs) à des donneurs sains ou à des patients, on a observé de fréquents cas de splénomégalie, en général asymptomatique, et la survenue, dans des cas isolés, de ruptures de la rate. Il importe donc de surveiller régulièrement la taille de la rate (par ex. par un examen clinique ou une échographie). Un diagnostic de rupture splénique doit être envisagé chez les donneurs présentant des douleurs de la partie supérieure gauche de l'abdomen ou de l'épaule.
La composition du capuchon de l'extrémité de la seringue préremplie peut contenir du caoutchouc en latex (voir information sur le cartonnage) qui pourrait causer des réactions allergiques sévères chez les personnes prédisposées.
Un syndrome de fuite capillaire a été rapporté après l'administration de G-CSFs et est caractérisé par une hypotension, une hypoalbuminémie, des œdèmes et une hémoconcentration.
Si les patients développent des symptômes de syndrome de fuite capillaire, l'administration de lénograstim doit être interrompue, et un traitement symptomatique approprié, pouvant inclure le recours à des soins intensifs, doit être instauré (voir section «Effets indésirables»).
La survenue de crise drépanocytaire peut potentiellement être associée à l'utilisation du lenograstim chez les patients porteurs sains du trait drépanocytaire ou atteints de drépanocytose.
Par conséquent, Granocyte doit être prescrit avec précaution chez les patients porteurs sains du trait drépanocytaire ou atteints de drépanocytose.
Glomérulonéphrite:
Des cas de glomérulonéphrites ont été rapportés chez les patients et les donneurs recevant du lenograsim. En général, les glomérulonéphrites disparaissent après la réduction de la dose ou l'arrêt du G-CSF. La réalisation d'analyses d'urines est recommandée.
Aortite:
Une aortite a été signalée après administration de G-CSF chez des sujets sains et des patients atteints d'un cancer. Les symptômes ressentis comprenaient: fièvre, douleurs abdominales, malaise, maux de dos et augmentation des marqueurs inflammatoires (p.ex. protéine C-réactive et nombre de globules blancs). Dans la plupart des cas, l'aortite a été diagnostiquée par un examen TDM et a été résolue après l'arrêt du traitement par G-CSF. Voir également rubrique «Effects indesirable».
Interactions
L'efficacité et la tolérance de Granocyte administré le même jour qu'un traitement chimiothérapique cytotoxique myélosuppresseur n'ont pas été établies. Etant donné la sensibilité à la chimiothérapie cytotoxique myélosuppressive des cellules myéloïdes en division rapide, l'utilisation de Granocyte n'est pas recommandée au cours d'une période couvrant le jour précédant et le jour suivant la chimiothérapie.
Les interactions possibles avec d'autres facteurs de croissance hématopoïétiques et des cytokines n'ont pas encore été étudiées au cours d'essais cliniques.
Grossesse/Allaitement
Grossesse
L'innocuité de Granocyte durant la grossesse n'a pas été établie. Les études chez l'animal (rat, lapin) n'ont pas mis en évidence d'effet tératogène. Une augmentation du nombre des avortements a cependant été observée chez le lapin mais aucune malformation n'a été constatée (voir «Données précliniques»). Granocyte ne devrait être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Allaitement
Comme on ne sait pas si Granocyte est excrété dans le lait maternel, son utilisation n'est pas recommandée chez les femmes qui allaitent.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Granocyte n'a aucune influence sur l'aptitude à la conduite et sur l'utilisation de machines.
Effets indésirables
Les effets indésirables suivants se sont manifestés très fréquemment à fréquemment dans les études cliniques et ont été attribués à Granocyte:
Douleurs osseuses (13,3%), réactions au point d'injection (8%), céphalées (6,7%), fièvre (5,3%), douleurs au point d'injection (4,7%), douleurs dorsales (4%), leucocytose (4%), douleurs (3,3%), myalgies (3,3%), splénomégalie et/ou une modification réversible de la rate.
Dans de rares cas, des effets secondaires pulmonaires sont apparus, en particulier des cas de dyspnée, d'hypoxie ou d'hémoptysie. Dans de très rares cas, un syndrome de détresse respiratoire aiguë (ARDS) s'est manifesté (voir «Mises en garde et précautions»).
Des réactions allergiques allant jusqu'à de rares cas de chocs anaphylactiques ont été rapportées après la première administration de Granocyte.
Occasionnellement, un syndrome de fuite capillaire a été observé après la commercialisation du médicament. Voir la rubrique en fin de chapitre ainsi que «Mises en garde et précautions».
Les effets indésirables suivants se sont manifestés dans les études cliniques ou après commercialisation du produit et ont été attribués à Granocyte. Les fréquences sont définies comme suit: très fréquents (≥1/10); fréquents (≥1/100, <1/10): occasionnels (≥1/1'000, <1/100); rares (≥1/10'000, <1/1'000); très rares (<1/10'000).
Affections hématologiques et du système lymphatique:
Fréquent: leucocytose (4%), splénomégalie (généralement asymptomatique).
Très rare: ruptures de la rate.
Affections vasculaires:
Occasionnel: syndrome de fuite capillaire.
Rare: aortite.
Affections du rein et des voies urinaires:
Cas isolés: glomérulonéphrite.
Affections du système immunitaire:
Très rare: réactions allergiques pouvant aller jusqu'au choc anaphylactique dans des cas isolés.
Affections du système nerveux:
Fréquent: céphalées (6,7%).
Affections respiratoires, thoraciques et médiastinales:
Occasionnel: hémoptysie.
Rare: pneumonie interstitielle. Dans quelques-uns de ces cas, une insuffisance respiratoire ou un poumon de choc (ARDS), pouvant être fatals, se sont manifestés. Hémorragie pulmonaire.
Affections hépatobiliaires:
Très fréquent: élévation des taux d'ASAT, d'ALAT et/ou de la phosphatase alcaline.
Dans la plupart des cas, la fonction hépatique est revenue à la normale après l'arrêt du traitement.
Affections de la peau et du tissu sous-cutané:
Très rare: vascularites cutanées (mécanisme de survenue encore inexpliqué).
Très rare: syndrome de Sweet, érythème noueux, pyoderma gangrenosum, nécrolyse épidermale, syndrome de Stevens-Johnson, exanthème bulleux. Cas décrits principalement chez des patients souffrant d'hémopathies malignes, maladies connues pour être associées à des dermatoses neutrophiliques, quelques cas chez des patients souffrant de neutropénies d'origine non maligne.
Très rare: syndrome de Lyell.
Affections musculo-squelettiques et systémiques:
Très fréquent: douleurs musculo-squelettiques (incluant douleurs osseuses, douleurs dorsales, arthralgies, myalgies, douleurs aux extrémités) (13,3%).
Troubles généraux et anomalies au site d'administration:
Fréquent: réactions au point d'injection (8%), fièvre (5,3%), douleurs au point d'injection (4,7%).
Investigations:
Très fréquent: augmentation passagère des taux de LDH (23%).
En outre, les effets secondaires suivants ont été rapportés dans des indications particulières:
Lors d'une transplantation de la moelle osseuse:
Les effets indésirables suivants ont été décrits chez 15% ou davantage de patients sans que l'on puisse attribuer leur cause avec certitude à Granocyte: infections et inflammations de la cavité buccale, fièvre, diarrhée, exanthème, douleurs abdominales, vomissements, alopécie, septicémie et infections. L'incidence des réactions 'graft-versus-host' après transplantation de moelle osseuse a été la même pour le groupe placebo et le groupe Granocyte.
Lors d'une neutropénie induite par chimiothérapie:
En cas de neutropénie induite par chimiothérapie, on a pu observer en outre de l'alopécie, des nausées, des vomissements, de la fièvre et des céphalées (identiques aux effets indésirables observés généralement chez les patients cancéreux traités par chimiothérapie).
Des diminutions du nombre moyen de plaquettes et des cas de thrombopénie ont été rapportées chez les patients traités par Granocyte après chimiothérapie.
Lors d'une mobilisation de PBPCs chez des donneurs sains:
Après administration de Granocyte à des donneurs sains, les effets indésirables les plus fréquemment observés étaient réversibles et d'une intensité légère à modérée. Il s'agissait de: céphalées (30%), douleurs osseuses (23%), douleurs dorsales (17,5%), asthénie (11%), douleurs abdominales (6%), autres douleurs (6%), fièvre, nausées. Le risque de douleurs augmente avec l'élévation du pic des valeurs de globules blancs, particulièrement lorsque la numération atteint ≥50 x 109/l.
Une leucocytose avec des valeurs ≥50 x 109/l a été rapportée chez 24% des donneurs et une thrombocytopénie causée par l'aphérèse (numération plaquettaire <100 x 109/l) chez 42% des donneurs.
Une élévation transitoire de l'ASAT et/ou de l'ALAT a été observée chez 12% des donneurs et une augmentation des phosphatases alcalines chez 16% d'entre eux. Des élévations des phosphatases alcalines et des taux de LDH ont également été rapportées.
Des cas fréquents, mais généralement asymptomatiques, de splénomégalie et de très rares cas de rupture de la rate ont été observés.
Effets indésirables après commercialisation
Un syndrome de fuite capillaire, pouvant engager le pronostic vital si le traitement n'est pas initié à temps, a été rapporté occasionnellement depuis la mise sur le marché, principalement chez des patients atteints de cancer recevant une chimiothérapie après l'administration de facteurs de croissance de la lignée granulocytaire. Toutefois, un cas a aussi été décrits chez un donneur sain ayant subi une aphérèse après mobilisation des PBPC (voir section «Mises en garde et précautions»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Les effets d'un surdosage de Granocyte n'ont pas été établis.
Des doses allant jusqu'à 40 µg (5,12 Millions d'U.I.)/kg/jour n'ont pas provoqué d'effet toxique, à l'exception de douleurs osseuses et musculaires. Chez un patient sur 3 qui avaient reçu la plus forte dose de Granocyte, une numération leucocytaire voisine de 50 x 109/l a été observée au 5ème jour de traitement.
Après interruption du traitement par Granocyte, le nombre des neutrophiles circulant chute de 50% en 1-2 jours et atteint des valeurs normales après 1-7 jours.
Propriétés/Effets
Code ATC
L03AA10
Le lénograstim possède une séquence d'acides aminés parfaitement identique à celle du facteur humain naturel stimulant les colonies de granulocytes (G-CSF) et il est glycosylé de la même façon. Ce polypeptide glycosylé hautement purifié, obtenu par génie génétique à partir d'une lignée cellulaire de mammifère (Chinese hamster ovary (CHO) cells), est constitué d'une chaîne de 174 acides aminés qui contient deux ponts disulfures (entre 4 bases cystéines) et qui est glycosylée sur la thréonine-133.
Mécanisme d'action
Le lénograstim appartient à la famille des cytokines, un groupe de protéines biologiquement actives qui régulent la différenciation et la prolifération cellulaires.
Pharmacodynamique
On a pu démontrer que le lénograstim stimule les cellules précurseurs des neutrophiles et induit, dans les 24 heures qui suivent son application, une augmentation prononcée du taux des neutrophiles dans le sang périphérique. L'augmentation du nombre des neutrophiles dépend de la dose de lénograstim, dans un domaine allant de 1 à 10 µg/kg de poids corporel et par jour. A la dose recommandée de 5 µg/kg/jour, des administrations répétées induisent une augmentation de la réponse des neutrophiles. Les granulocytes neutrophiles formés sous un traitement par Granocyte présentent des fonctions chimiotactiques et phagocytaires apparemment normales.
In vitro, Granocyte a, comme les autres facteurs de croissance, un effet stimulateur sur les cellules endothéliales humaines.
Efficacité clinique
L'utilisation de Granocyte, chez des patients qui ont subi une greffe de moelle osseuse ou qui ont été traités pendant quelques cycles par chimiothérapie cytotoxique, permet une diminution significative de la durée de la neutropénie et de la sévérité des infections. On n'a pas démontré pour l'heure si cet effet se maintient également après une administration répétée.
L'administration de Granocyte seul ou après chimiothérapie mobilise les cellules souches hématopoïétiques dans le sang périphérique. Ces cellules souches autologues du sang périphérique (Peripheral Blood Progenitor Cells = PBPCs) peuvent être recueillies et réinfusées après une chimiothérapie cytotoxique à haute dose, soit à la place soit en association à une greffe de moelle.
Chez des donneurs sains, le G-CSF mobilise des cellules précurseurs pour une transplantation allogénique. Les mécanismes sont encore inconnus.
Les PBPCs réinfusées obtenues par mobilisation avec Granocyte se sont révélées capables de reconstituer l'hématopoïèse et d'en accélérer la greffe. L'indépendance des patients vis-à-vis des transfusions plaquettaires est ainsi acquise plus rapidement par rapport à la greffe autologue de moelle.
L'utilisation de Granocyte chez des patients qui reçoivent une greffe de moelle ou qui sont traités par une chimiothérapie cytotoxique entraîne une réduction significative de l'apparition, de la gravité et de la durée de la neutropénie et de ses complications associées.
Dans le cadre d'une étude multicentrique en phase III, 102 patients souffrant d'anémie idiopathique aplasique de novo sévère ont été randomisés en deux groupes. Un total de 53 patients a reçu en plus une thérapie immunosuppressive (globuline anti-lymphocyte et ciclosporine) et du lénograstim; 49 patients ont reçu une immunosuppression sans lénograstim supplémentaire. Le lénograstim a été administré, durant les 12 premières semaines (98 jours en moyenne) quotidiennement par voie sous-cutanée à la dose de 5 µg/kg de poids corporel en moyenne. Durant la thérapie immunosuppressive au lénograstim et contrairement à ce qui a été observé dans le groupe contrôle, le taux absolu de cellules neutrophiles, soit le principal paramètre d'efficacité, a nettement augmenté. Le pic de cellules neutrophiles a été atteint après 1 semaine. Une réponse neutrophile complète (taux absolu de cellules neutrophiles ≥1,5 x 109/l) a été obtenue avec un nombre significativement plus élevé dans le groupe lénograstim que dans le groupe contrôle (83% contre 44,9%, p<0,001). Chez les patients à haut risque souffrant d'anémie aplasique idiopathique très sévère, un taux de réaction significativement plus élevé a également été trouvé dans le groupe lénograstim (69,2% contre 31,6% dans le groupe contrôle, p=0,012). Les paramètres secondaires de l'efficacité (en particulier les critères cliniques, p.ex. les infections) ont démontré au plus une tendance à une différence, mais aucune différence significative entre les deux groupes.
Pharmacocinétique
Absorption
Lors de l'administration intraveineuse de Granocyte, il n'y a pas de corrélation linéaire entre la dose et l'AUC ou Cmax. Cette relation est linéaire, après établissement du steady-state (5ème jour), lors de l'administration sous-cutanée de doses allant jusqu'à 20 µg/kg.
Au cours d'administrations sous-cutanées répétées de la dose recommandée de 5 µg/kg/jour, les concentrations sériques maximales du lénograstim se situent aux environs de 100 pg/ml/kg de poids corporel. Les administrations répétées de Granocyte par l'une ou l'autre voie d'injection n'ont pas montré de signe d'accumulation du produit.
La biodisponibilité absolue est inversement proportionnelle à la dose. A la dose recommandée de 5 µg/kg/jour, elle s'élève à 30%.
Distribution
Le volume de distribution apparent (Vdarea) est approximativement de 1 l/kg de poids corporel et le temps de résidence moyen après administration sous-cutanée est voisin de 7 heures.
Métabolisme
Voir élimination
Élimination
A l'état d'équilibre, la demi-vie d'élimination sérique apparente du lénograstim est d'environ 3-4 heures après injection sous-cutanée et de 1-1,5 heures après perfusion i.v. répétée. La clairance plasmatique du rHuG-CSF augmente de 3 fois (de 50 à 150 ml/min.) après administrations répétées par voie sous-cutanée. Le lénograstim n'est que faiblement excrété en tant que produit inchangé dans les urines (moins de 1% de la dose) car il est probablement métabolisé comme les peptides endogènes.
Il existe une corrélation positive entre la dose et la concentration sérique de Granocyte et entre la réponse neutrophile et la quantité totale de Granocyte retrouvée dans le sérum.
Cinétique pour certains groupes de patients
Voir «Posologie/Mode d'emploi», Patients âgés, Enfants».
Données précliniques
Les études de toxicité chronique sur des rats ont montré que Granocyte, à une dose de 100 µg/kg/jour, provoque une augmentation de la résorption ostéoclastique.
Mutagénicité
Le lénograstim n'a pas présenté d'effet mutagène, ceci ni in vitro, dans le test d'Ames (Salmonella typhimurium), ni in vivo, dans le test du micronoyau chez la souris. Le test in vitro d'aberration chromosomique (cellules CHL) s'est avéré également négatif.
Carcinogénicité
Aucun effet carcinogène avec Granocyte n'est connu, ni chez l'animal ni chez l'homme.
Toxicité sur la reproduction
Les études sur les animaux (avec des doses allant jusqu'à 100 µg/kg/jour i.v. chez des rats et des lapins) ont montré que Granocyte n'a pas d'effet tératogène. Chez le lapin (no-effect level 10 µg/kg/jour i.v.), on a cependant observé une élévation du taux d'avortement (voir «Grossesse/Allaitement»).
Remarques particulières
Incompatibilités
En ce qui concerne la compatibilité avec les matériaux des récipients, voir «Remarques concernant la manipulation».
La composition du capuchon de l'extrémité de la seringue préremplie peut contenir du caoutchouc en latex (voir information sur le cartonnage) qui pourrait causer des réactions allergiques sévères chez les personnes prédisposées
Influence sur les méthodes de diagnostic
Aucune influence connue.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Stabilité après ouverture
Après dissolution dans 1 ml d'eau pour solutions injectables, Granocyte se conserve 24 heures à température ambiante (+ 25 °C). Cependant, vu que Granocyte ne contient pas d'agent de conservation, une conservation à 2-8 °C est recommandée. Après dilution de Granocyte 13 à une concentration finale de 2 µg/ml (0,26 Mio.U.I./ml) au minimum et de Granocyte 34 à une concentration finale de 2.5 µg/ml (0,32 Mio.U.I./ml.) au minimum, la solution peut être conservée durant 24 heures à + 25 °C ou à + 5 °C sans perte d'activité.
Le médicament doit être tenu hors de la portée des enfants.
Remarques particulières concernant le stockage
Granocyte doit être conservé entre + 2 °C et + 30 °C. La stabilité de Granocyte a également été démontrée après un stockage pendant 6 mois à 40 °C et pendant 3 mois à 50 °C. C'est pourquoi, une exposition courte (quelques semaines) à des températures allant jusqu'à 50 °C n'a pas d'influence sur la qualité des ampoules Granocyte.
Remarques concernant la manipulation
1 flacon de Granocyte est dissout dans 1 ml d'eau pour préparations injectables. Pour dissoudre, tournez le flacon légèrement, ne pas agiter.
Pour administration par perfusion intraveineuse, Granocyte est dilué dans une solution isotonique de chlorure de sodium 0,9%. Sous cette forme, Granocyte est compatible avec les récipients pour perfusion en verre (solution de NaCl/Dextrose) ou en chlorure de polyvinyle (solution de NaCl). Jusqu'à une concentration finale de 2,5 µg/ml au minimum, il ne se produit pas d'adsorption significative du principe actif sur le verre ou les matières plastiques. Granocyte 13 ne doit pas être dilué dans plus de 50 ml et Granocyte 34 dans plus de 100 ml solution de 0,9% NaCl. Il est toutefois préférable d'éviter des dilutions de Granocyte 13 à des concentrations inférieures à 2 µg/ml (0,26 Mio.U.I./ml) ainsi que des dilutions de Granocyte 34 à des concentrations inférieures à 2,5 µg/ml (0,32mio U.I./ml).
Pour la mobilisation des PBPCs chez les donneurs sains, Granocyte est administré en injection sous-cutanée.
Numéro d’autorisation
52170 (Swissmedic)
Titulaire de l’autorisation
sanofi-aventis (suisse) sa, 1214 Vernier/GE
Mise à jour de l’information
Avril 2020
Informations pratiques concernant la préparation et la manipulation du médicament pour les professionnels de santé
Les flacons de GRANOCYTE sont à usage unique. En raison d'un risque possible de contamination microbienne, les seringues préremplies de solvant sont à usage unique.
GRANOCYTE est destiné à une utilisation en voie sous-cutanée ou intraveineuse.
GRANOCYTE se présente sous forme d'une poudre et d'un solvant pour solution injectable / perfusion en seringue préremplie.
Poudre en flacon + 1 ml de solvant en seringue préremplie avec 2 aiguilles (la plus grande de couleur beige (19G) pour la reconstitution et la plus petite de couleur marron (26G) pour l'administration).
Préparation de la solution reconstituée:
- Ajouter de façon aseptique le contenu extractible d'une seringue préremplie au flacon de GRANOCYTE en utilisant l'aiguille 19G.
- Agiter doucement jusqu'à dissolution complète.
- Ne pas agiter vigoureusement.
- La solution parentérale reconstituée est limpide et exempte de particules. Prélever le volume nécessaire de la solution reconstituée du flacon, en utilisant l'aiguille 19G.
- Administrer immédiatement par voie sous-cutanée, en utilisant l'aiguille 26G.
Tout produit ou solution non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
1. Mode d'emploi pour le produit présenté avec une seringue préremplie avec capuchon en caoutchouc contenant du LATEX:
| Schéma 1 Retirez le capuchon en plastique du flacon. |
| Schéma 7 Tout en maintenant la seringue avec l'aiguille insérée dans le flacon, retournez le flacon tête en bas. Assurez-vous que la pointe de l'aiguille soit dans la solution. |
| Schéma 2 Nettoyez le bouchon en caoutchouc. |
| Schéma 8 Retirez lentement la tige du piston et prélevez le volume nécessaire du flacon correspondant à la dose prescrite. |
| Schéma 3 Sortez du blister une seringue préremplie et les deux aiguilles (une avec le cône beige (19G) et une avec le cône marron (26G)). |
| Schéma 9 Retirez l'aiguille à cône beige de la seringue et remplacez-la par l'aiguille à cône marron. |
| Schéma 4 Retirez le capuchon à l'extrémité de la seringue et fixez l'aiguille à cône beige. |
| Schéma 10 Retirez toutes les bulles d'air en tapotant doucement sur le corps de la seringue puis poussez doucement la tige du piston pour éliminer l'air. |
| Schéma 5 Tout en maintenant le flacon sur une surface plane, transpercez le bouchon en caoutchouc avec l'aiguille puis poussez la tige du piston pour injecter le solvant dans le flacon. |
| Schéma 11 Ajustez le volume à administrer si nécessaire. GRANOCYTE est maintenant prêt pour l'administration. Injectez immédiatement par voie sous-cutanée. |
| Schéma 6 Agitez doucement jusqu'à dissolution complète (environ 5 secondes). N'agitez pas vigoureusement. |
| Localisation des sites d'injection pour administration sous-cutanée. |
2. Mode d'emploi pour le produit présenté avec une seringue préremplie avec capuchon en caoutchouc SANS LATEX:
| A: Capuchon (incluant l'insert interne en caoutchouc) B: Extrémité en caoutchouc du piston C: Piston Les aiguilles sont protégées dans un contenant individuel rigide composé de: D: Capuchon protecteur de l'aiguille E: Capuchon coloré (de couleur crème ou de couleur marron) F: Embase G: Pointe de l'aiguille |
| Schéma 1 Retirez le flacon du blister et retirez le capuchon en plastique du flacon. Nettoyez le bouchon en caoutchouc avec un chiffon imbibé d'alcool stérile. |
| Schéma 7 Tout en maintenant la seringue avec l'aiguille insérée dans le flacon, retournez le flacon tête en bas. Retirez partiellement l'aiguille tout en vous assurant que la pointe de l'aiguille est toujours dans la solution. Tenez l'embase de l'aiguille et la seringue, tirez le piston doucement pour aspirer le plus possible de solution dans la seringue. |
| Schéma 2 Retirez du blister la seringue préremplie et les deux aiguilles (l'une avec le capuchon de couleur crème (19G) et l'autre avec le capuchon de couleur marron (26G)). |
| Schéma 8 Vérifiez qu'il n'y a pas de bulles d'air dans la seringue. S'il y a des bulles d'air dans la seringue, tenez la seringue bien droite et tapotez le corps de la seringue jusqu'à ce que les bulles remontent à la surface. Poussez le piston pour faire sortir les bulles d'air. |
| Schéma 3 Dévissez le capuchon de la seringue et retirez-le. |
| Schéma 9 Poussez le piston jusqu'à ce que son extrémité en caoutchouc soit alignée avec le repère du volume supérieur à celui dont vous avez besoin (par palier de 0,1 ml). Par exemple, si vous avez besoin de 0,8 ml, poussez le piston jusqu'au repère 0,9 ml. |
| Schéma 4 Tenez fermement les deux extrémités du contenant de l'aiguille avec le capuchon de couleur crème. Dévissez le capuchon de couleur crème (dans un sens ou dans l'autre) et retirez-le. Tout en tenant le capuchon protecteur de l'aiguille, vissez l'embase de l'aiguille sur la seringue. |
| Schéma 10 Remettez le flacon debout et poussez entièrement l'aiguille dans le flacon. Tenez l'embase de l'aiguille, dévissez la seringue en laissant l'aiguille dans le flacon. Tenez fermement les deux extrémités du contenant de l'aiguille avec le capuchon de couleur marron. Dévissez le capuchon de couleur marron (dans un sens ou dans l'autre) et retirez-le. Tout en tenant le capuchon protecteur de l'aiguille, vissez l'embase de l'aiguille sur la seringue. Retirez le capuchon protecteur de l'aiguille. |
| Schéma 5 Retirez le capuchon protecteur de l'aiguille. Tout en maintenant le flacon sur une surface plane, transpercez le bouchon en caoutchouc à l'aide de l'aiguille, puis poussez lentement la tige du piston pour injecter le solvant dans le flacon. |
| Schéma 11 Vérifiez qu'il n'y a pas de bulles d'air dans la seringue. S'il y a des bulles d'air dans la seringue, tenez la seringue bien droite et tapotez le corps de la seringue jusqu'à ce que les bulles remontent à la surface. Poussez le piston pour faire sortir les bulles d'air. Si nécessaire, ajustez le volume à administrer. |
| Schéma 6 Agitez doucement jusqu'à dissolution complète de la poudre. N'agitez pas vigoureusement. |
| GRANOCYTE est maintenant prêt pour l'administration. Injectez immédiatement par voie sous-cutanée. Localisation des sites d'injection pour administration sous-cutanée. |
Reviews (0)
Related news
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.



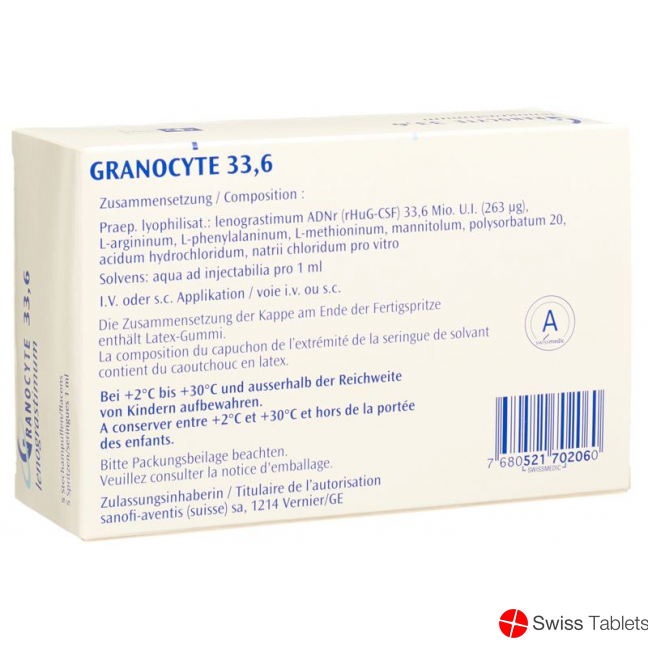
 Deutsch
Deutsch French
French Italian
Italian





















































































