Hiberix Trockensubstanz C Solv Fertigspritze 0.5ml buy online
Hiberix Trockensub mit Solvens Fertspr 0.5 ml
-
74.80 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: GLAXO SMITHKLINE AG
- Product Code: 1931887
- ATC-code J07AG01
- EAN 7680006030015
Ingredients:
Natriumchlorid, Trockensubstanz, Lösungsmittel, Tetanus-Toxoid, Lactose, Haemophilus influenzae b Polysaccharide (PRP) 10 mcg, Haemophilus influenzae B-Saccharid-T-Konjugat-Impfstoff, pro praeparatione.

Description
Zusammensetzung
Wirkstoffe
10 µg gereinigtes Kapsel-Polysaccharid des Hib-Bakteriums, gebunden an ungefähr 25 µg Tetanus-Protein.
Hilfsstoffe
Laktose, Natriumchlorid, Aqua ad iniectabilia.
Darreichungsform und Wirkstoffmenge pro Einheit
Durchstechflasche mit Lyophilisat (10 µg gereinigtes Kapsel-Polysaccharid des Hib-Bakteriums) und 0,5 ml Lösungsmittel in separater Fertigspritze mit 2 separaten Injektionsnadeln.
Indikationen/Anwendungsmöglichkeiten
Hiberix ist indiziert für die aktive Immunisierung aller Kinder ab dem Lebensalter von 2 Monaten gegen Haemophilus influenzae Typ b.
Hiberix schützt weder gegen Krankheiten, die von anderen Typen von Haemophilus influenzae noch gegen Meningitiden, die durch andere Organismen verursacht werden.
Hiberix sollte gemäss den offiziellen Impfempfehlungen angewendet werden.
Dosierung/Anwendung
Übliche Dosierung
Es muss die empfohlene, volle Dosis von 0,5 ml verabreicht werden.
Grundimmunisierung:
Hiberix kann entweder alleine oder simultan mit der DTP-Impfung verabreicht werden (kontralaterale Injektion). Die Grundimmunisierung besteht aus drei (Kinder ab dem 2. Lebensmonat) oder zwei (Kinder ab dem 3. Lebensmonat) Impfungen im Abstand von 2 Monaten.
Bei Erstimpfung ab dem 2. Monat:
1. Dosis im Alter von 2 Monaten.
2. Dosis im Alter von 4 Monaten.
3. Dosis im Alter von 6 Monaten.
Bei Erstimpfung ab dem 3. Monat:
1. Dosis im Alter von 3 oder 4 Monaten.
2. Dosis im Alter von 5 oder 6 Monaten.
Auffrischimpfung:
Um einen langdauernden Schutz sicherzustellen, wird im 2. Lebensjahr eine Auffrischimpfung mit einer Impfdosis Hiberix, gegebenenfalls simultan mit der 4. DTP-Impfung empfohlen.
Die Impfung erfolgt gemäss Schweizer Impfplan im Alter von 15 Monaten.
Art der Anwendung
Der rekonstituierte Impfstoff soll intramuskulär verabreicht werden.
Es ist allgemeine Praxis, dass der Impfstoff bei Patienten mit Thrombozytopenie oder einer Blutungsstörung subkutan verabreicht werden kann (vgl. «Warnhinweise und Vorsichtsmassnahmen»).
Die Impfungen gegen Haemophilus influenzae Typ b sollten vorzugsweise gleichzeitig und kontralateral mit den Impfungen gegen DTP verabreicht werden. Zeitabstände zu weiteren Impfungen sind nicht erforderlich.
Kontraindikationen
Hiberix soll nicht an Personen mit bekannter Überempfindlichkeit auf einen Inhaltsstoff des Impfstoffes (auch gegen das Tetanustoxoid) oder an Personen, die bei einer früheren Hib-Impfung Überempfindlichkeitsreaktionen zeigten, verabreicht werden.
Wie bei anderen Impfstoffen soll die Impfung bei Personen, die an akuter, schwerwiegender und fieberhafter Erkrankung leiden, verschoben werden.
Eine leichte Infektion stellt keine Kontraindikation dar.
Warnhinweise und Vorsichtsmassnahmen
Hiberix darf unter keinen Umständen intravenös injiziert werden!
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmassen begleitet sein. Es ist wichtig, Massnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Wie bei allen injizierbaren Impfstoffen sollte für den Fall einer anaphylaktischen Reaktion nach der Impfung immer eine angemessene medizinische Behandlung zur Verfügung stehen.
Eine HIV-Infektion stellt keine Kontraindikation dar.
Trotz beschränkter Reaktion auf das Tetanus-Toxoid kann eine Hiberix-Impfung allein nicht als Ersatz für routinemässige Tetanus-Impfungen erachtet werden.
Nach Erhalt von Hib-Impfstoffen ist die Ausscheidung von Kapselpolysaccharid Antigenen im Urin beschrieben worden. Der diagnostische Wert einer Antigenbestimmung bei Verdacht auf eine Hib-Infektion kann deshalb innerhalb 1-2 Wochen nach der Impfung in Frage gestellt sein.
Hiberix soll bei Kindern mit Thrombozytopenie oder einer Blutgerinnungsstörung mit Vorsicht angewendet werden. Weil bei diesen Kindern nach einer intramuskulären Injektion eine Blutung auftreten kann, empfiehlt es sich, Hiberix subkutan zu verabreichen.
Das potentielle Risiko von Apnoen und die Notwendigkeit einer Überwachung der Atmung über 48-72 Stunden sollte im Rahmen der Grundimmunisierung von sehr unreifen Frühgeborenen (geboren vor der vollendeten 28. Schwangerschaftswoche) in Betracht gezogen werden. Dies gilt insbesondere für diejenigen, die in der Vorgeschichte Zeichen einer Lungenunreife gezeigt haben. Da der Nutzen der Impfung für diese Säuglingsgruppe hoch ist, sollte sie ihnen weder vorenthalten noch verschoben werden.
Interaktionen
Bei Patienten unter immunsuppressiver Behandlung oder Patienten mit beeinträchtigter Immunantwort kann eine adäquate Immunantwort ausbleiben.
Schwangerschaft/Stillzeit
Da Hiberix nicht zur Anwendung bei Erwachsenen bestimmt ist, sind keine Daten zur Sicherheit des Impfstoffes während der Schwangerschaft und der Stillzeit verfügbar.
Es wurden auch keine Reproduktionsstudien bei Tieren durchgeführt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Nicht zutreffend.
Unerwünschte Wirkungen
Die folgenden Häufigkeitsangaben basieren auf der Analyse der Daten von ca. 3'000 Säuglingen in der Studie Hib-097 und von ca. 1'200 Säuglingen in der Studie DTPa-HBV-IPV-011. Weitere unerwünschte Wirkungen und ihre Häufigkeit basierend auf Meldungen nach Markteinführung sind mit * gekennzeichnet.
Die Häufigkeiten der gemeldeten unerwünschten Wirkungen werden wie folgt angegeben: Sehr häufig: ≥1/10; häufig: ≥1/100 bis <1/10; gelegentlich: ≥1/1'000 bis <1/100; selten: ≥1/10'000 bis <1/1'000; sehr selten: <1/10'000.
Erkrankungen des Immunsystems
Sehr selten: allergische Reaktionen (einschliesslich anaphylaktischer und anaphylaktoider Reaktionen), Angioödem*.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Appetitlosigkeit (27,1% nach Grundimmunisierung, 25,6% nach Boosterimpfung).
Psychiatrische Erkrankungen
Sehr häufig: Schreien (16% nach Grundimmunisierung), Reizbarkeit, Unruhe (67,1% nach Grundimmunisierung, 56,4% nach Boosterimpfung).
Erkrankungen des Nervensystems
Sehr häufig: Schläfrigkeit (52,7% nach Grundimmunisierung, 36,7% nach Boosterimpfung).
Selten: Konvulsionen (einschliesslich Fieberkrämpfe), hypotone-hyporesponsive Episoden, Synkope oder vasovagale Antworten auf die Injektion*.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Sehr selten: Apnoe bei sehr unreifen Frühgeborenen (geboren vor der vollendeten 28. Schwangerschaftswoche), siehe Kap. «Warnhinweise und Vorsichtsmassnahmen».
Über Fälle von Apnoe wurde auch bei älteren Kindern berichtet.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Durchfall (11% nach Grundimmunisierung).
Häufig: Erbrechen.
Erkrankungen der Haut und des Unterhautzellgewebes
Selten: Hautausschlag, Urtikaria.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Fieber (14,7% nach Grundimmunisierung, 12,6% nach Boosterimpfung), Schwellung (15,6% nach Grundimmunisierung, 17,6% nach Boosterimpfung), Schmerzen (45,9% nach Grundimmunisierung, 41,3% nach Boosterimpfung) und Rötung (24,3% nach Grundimmunisierung, 29,6% nach Boosterimpfung) an der Injektionsstelle.
Sehr selten: ausgedehnte Schwellung der Extremität, an der geimpft wurde*, Verhärtung an der Injektionsstelle*.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Im Allgemeinen war das nach einer Überdosierung berichtete Nebenwirkungsprofil mit dem nach Verabreichung der empfohlenen Dosis von Hiberix vergleichbar.
Eigenschaften/Wirkungen
ATC-Code
J07AG01
Hiberix enthält ein gereinigtes und lyophilisiertes Polyribosyl-ribitol-phosphat Kapselpolysaccharid des Hib-Bakteriums, das kovalent an das Tetanustoxoid gebunden ist.
Das Hib-Polysaccharid wird aus dem Stamm 20'752 des Haemophilus influenzae Typ b-Bakteriums gewonnen und an Tetanustoxoid gebunden. Nach der Reinigung wird das Konjugat mit Laktose als Stabilisator lyophilisiert.
Hiberix erfüllt die WHO-Bestimmungen für biologische Produkte und für Hib-Konjugat-Impfstoffe.
Wirkungsmechanismus
Nicht zutreffend.
Pharmakodynamik
Einen Monat nach Abschluss der letzten Dosis der Grundimmunisierung wurde bei 95 - 100% der Kinder ein Titer von mehr als 0,15 µg/ml festgestellt.
Einen Monat nach der Boosterdosis wurde bei 100% der Kinder ein Titer von mehr als 0,15 µg/ml erreicht (bei 94,7% ein Titer von über 1,0 µg/ml).
Bei Kindern ab dem 2. Lebensmonat wird durch die Gabe von 4 x 0,5 ml Hiberix ein zuverlässiger Impfschutz erreicht.
Klinische Wirksamkeit
Siehe unter «Pharmakodynamik».
Pharmakokinetik
Eine Untersuchung der pharmakokinetischen Eigenschaften ist für Impfstoffe nicht erforderlich.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische Daten
Nicht verfügbar.
Sonstige Hinweise
Inkompatibilitäten
Hiberix darf nicht mit anderen Impfstoffen in derselben Spritze gemischt werden, ausser der Hersteller erwähne dies ausdrücklich.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Die Haltbarkeit beträgt ab Herstellung 36 Monate, wenn Hiberix bei +2 °C bis +8 °C gelagert wird.
Besondere Lagerungshinweise
Im Kühlschrank (+2 °C-+8 °C), vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahren. Nicht einfrieren!
Hinweise für die Handhabung
Der lyophilisierte Hib-Impfstoff liegt als weisses Pulver in einer Durchstechflasche vor.
Das Lösungsmittel in der Fertigspritze ist klar und farblos.
Der rekonstituierte Impfstoff ist eine klare bis opaleszierende und farblose Lösung.
Das Lösungsmittel und der rekonstituierte Impfstoff sind vor der Rekonstitution bzw. vor der Verabreichung visuell auf Fremdpartikel und/oder Veränderungen des Aussehens zu untersuchen. Falls irgendwelche Veränderungen beobachtet werden, dürfen das Lösungsmittel bzw. der rekonstituierte Impfstoff nicht verwendet werden.
Hinweise für die Rekonstitution des Impfstoffes mit dem in der Fertigspritze befindlichen Lösungsmittel
Hiberix wird rekonstituiert, indem der gesamte Inhalt der Fertigspritze mit Lösungsmittel in die Durchstechflasche mit dem Pulver gegeben wird.
Für das Befestigen der Nadel an der Spritze folgen Sie der nachstehenden Anleitung. Allerdings kann sich die mit Hiberix mitgelieferte Spritze leicht von der abgebildeten Spritze unterscheiden (d.h. ohne Schraubgewinde). In diesem Fall muss die Nadel ohne zu schrauben angebracht werden.
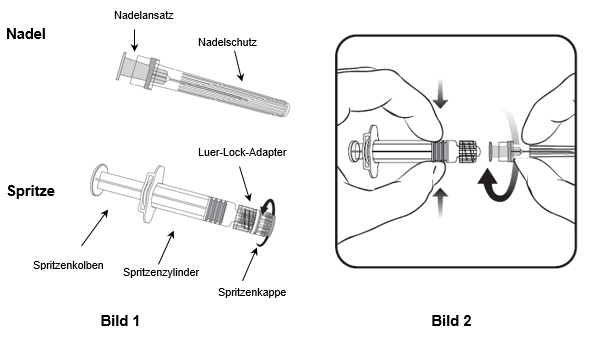
Halten Sie die Spritze immer am Spritzenzylinder fest. Die Spritze nicht am Spritzenkolben oder Luer-Lock-Adapter (LLA) festhalten.
- Halten Sie die Spritze am Spritzenzylinder fest und drehen Sie die Spritzenkappe entgegen dem Uhrzeigersinn ab (wie in Bild 1 gezeigt).
- Um die Nadel an der Spritze anzubringen, führen Sie den Nadelansatz vorsichtig in den LLA und drehen Sie die Nadel im Uhrzeigersinn, bis sie fest sitzt (wie in Bild 2 gezeigt). Achten Sie beim Anbringen darauf, dass sich die Nadel in der Achse der Spritze befindet (wie im Bild 2 gezeigt). Andernfalls könnte sich der LLA verbiegen und undicht werden. Falls sich während des Anbringens der Nadel der LLA löst, ist eine neue Impfstoffdosis (neue Spritze und Durchstechflasche) zu verwenden.
- Entfernen Sie den Nadelschutz, der gelegentlich fest sitzen kann.
- Fügen Sie das Lösungsmittel dem Pulver zu. Schütteln Sie danach die Mischung gründlich, bis sich das Pulver vollständig im Lösungsmittel gelöst hat.
Der rekonstituierte Impfstoff ist eine klare bis opaleszierende und farblose Lösung.
Nach der Rekonstitution sollte der Impfstoff sofort verabreicht werden. - Ziehen Sie den gesamten Inhalt der Durchstechflasche in die Spritze auf.
- Zur Verabreichung des Impfstoffs soll eine neue Nadel verwendet werden. Drehen Sie die Nadel von der Spritze ab und bringen Sie eine Injektionsnadel an, indem Sie Schritt 2 wiederholen.
Nicht verwendeter Impfstoff und Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Zulassungsnummer
00603 (Swissmedic).
Zulassungsinhaberin
GlaxoSmithKline AG, 3053 Münchenbuchsee.
Stand der Information
Mai 2019.
Composition
Principes actifs
10 µg de polysaccharide capsulaire purifié de la bactérie Hib, lié à environ 25 µg de protéine tétanique.
Excipients
Lactose, chlorure de sodium, aqua ad iniectabilia.
Forme pharmaceutique et quantité de principe actif par unité
Flacon-ampoule avec lyophilisat (10 µg de polysaccharide capsulaire purifié de la bactérie Hib) et 0,5 ml de solvant dans une seringue préremplie avec 2 aiguilles séparées.
Indications/Possibilités d’emploi
Hiberix est indiqué pour l'immunisation active de tous les enfants dès l'âge de 2 mois contre l'Haemophilus influenzae de type b.
Hiberix ne protège pas contre les maladies provoquées par d'autres types d'Haemophilus influenzae, ni contre les méningites qui sont causées par d'autres organismes.
Hiberix doit être administré selon les recommandations officielles de vaccination.
Posologie/Mode d’emploi
Posologie usuelle
La dose recommandée de 0,5 ml doit être administrée en totalité.
Immunisation de base:
Hiberix peut être administré individuellement ou simultanément avec la vaccination DTP (injection controlatérale). L'immunisation de base comporte trois vaccinations (enfants dès l'âge de 2 mois) ou deux vaccinations (enfants dès l'âge de 3 mois) administrées à des intervalles de deux mois.
Primovaccination à partir du 2ème mois:
1ère dose à l'âge de 2 mois.
2ème dose à l'âge de 4 mois.
3ème dose à l'âge de 6 mois.
Primovaccination à partir du 3ème mois:
1ère dose à l'âge de 3 ou 4 mois.
2ème dose à l'âge de 5 ou 6 mois.
Vaccination de rappel:
Afin de garantir une protection à long terme, il est recommandé de procéder à une vaccination de rappel avec une dose d'Hiberix au cours de la 2ème année de vie, le cas échéant simultanément avec la 4ème vaccination DTP.
Conformément au plan de vaccination suisse, la vaccination a lieu à l'âge de 15 mois.
Mode d'administration
Le vaccin reconstitué doit être administré par voie intramusculaire.
Il est de pratique courante que le vaccin puisse être administré par voie sous-cutanée chez les patients atteints de thrombocytopénie ou présentant des troubles de la coagulation sanguine (voir «Mises en garde et précautions»).
Les vaccinations contre l'Haemophilus influenzae de type b devraient de préférence être administrées conjointement avec les vaccinations DTP, de manière controlatérale. Il n'est pas nécessaire d'observer un intervalle avec d'autres vaccinations.
Contre-indications
Hiberix ne doit être administré ni aux sujets présentant une hypersensibilité connue à l'un des composants du vaccin (de même qu'au toxoïde de tétanos), ni aux personnes ayant développé des réactions d'hypersensibilité après une vaccination antérieure contre le Hib.
Comme avec d'autres vaccins, la vaccination sera repoussée en cas de maladie aiguë, grave et accompagnée de fièvre.
Une infection légère ne constitue pas une contre-indication.
Mises en garde et précautions
Hiberix ne doit jamais être injecté par voie intraveineuse!
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l'injection. Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Comme avec tous les vaccins injectables, un traitement médical approprié doit être disponible en cas de réaction anaphylactique après la vaccination.
Une infection par le VIH ne constitue pas une contre-indication.
Malgré une réaction limitée au toxoïde de tétanos, une vaccination par Hiberix seul ne peut pas être considérée comme un substitut des vaccinations antitétaniques de routine.
Après l'administration de vaccins Hib, l'excrétion d'antigènes de polysaccharide capsulaire dans les urines a été décrite. La valeur diagnostique d'un dosage des antigènes lors d'une infection Hib présumée peut donc être remise en question pendant une période de 1 à 2 semaines après la vaccination.
Hiberix doit être utilisé avec prudence chez les enfants présentant une thrombocytopénie ou un trouble de la coagulation sanguine. Etant donné que chez ces enfants une hémorragie peut survenir après une injection intramusculaire, il est recommandé d'administrer Hiberix par voie sous-cutanée.
Le risque potentiel d'apnée et la nécessité d'une surveillance respiratoire pendant 48-72 h doivent être soigneusement pris en compte lors de la primovaccination des grands prématurés (nés avant la fin de la 28ème semaine de grossesse) et particulièrement chez ceux qui ont des antécédents d'immaturité pulmonaire. En raison du bénéfice élevé de la vaccination chez ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
Interactions
Il se peut qu'une réponse immunitaire adéquate ne soit pas obtenue chez les patients sous traitement immunosuppresseur ou chez les patients présentant une réponse immunitaire limitée.
Grossesse/Allaitement
Etant donné qu'Hiberix n'est pas destiné à être utilisé chez les adultes, aucune donnée sur la sécurité d'emploi du vaccin pendant la grossesse et l'allaitement n'est disponible.
Il n'a pas non plus été effectué d'études portant sur la reproduction chez l'animal.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Non pertinent.
Effets indésirables
Les données de fréquence suivantes reposent sur l'analyse de données d'environ 3'000 nourrissons dans l'étude Hib-097 et d'environ 1'200 nourrissons dans l'étude DTPa-HBV-IPV-011. D'autres effets indésirables et leur fréquence provenant de rapports après la commercialisation sont signalés par un astérisque*.
Les fréquences des effets indésirables rapportés sont indiquées comme suit: très fréquent: ≥1/10; fréquent: ≥1/100 à <1/10; occasionnel: ≥1/1'000 à <1/100; rare: ≥1/10'000 à <1/1'000; très rare: <1/10'000.
Affections du système immunitaire
Très rares: réactions allergiques (y compris réactions anaphylactiques et anaphylactoïdes), angio-œdème*.
Troubles du métabolisme et de la nutrition
Très fréquents: perte d'appétit (27,1% après la primovaccination, 25,6% après la vaccination de rappel).
Affections psychiatriques
Très fréquents: cris (16% après la primovaccination), irritabilité, agitation (67,1% après la primovaccination, 56,4% après la vaccination de rappel)
Affections du système nerveux
Très fréquents: somnolence (52,7% après la primovaccination, 36,7% après la vaccination de rappel).
Rares: convulsions (y compris convulsions fébriles), épisodes d'hypotonie-hyporéactivité, syncope ou réponses vasovagales à l'injection*.
Affections respiratoires, thoraciques et médiastinales
Très rares: apnée chez les grands prématurés (nés avant la fin de la 28ème semaine de grossesse), voir «Mises en garde et précautions».
Des cas d'apnée ont également été rapportés chez des enfants plus âgés.
Affections gastro-intestinales
Très fréquents: diarrhée (11% après la primovaccination).
Fréquents: vomissements.
Affections de la peau et du tissu sous-cutané
Rares: éruption cutanée, urticaire.
Troubles généraux et anomalies au site d'administration
Très fréquents: fièvre (14,7% après la primovaccination, 12,6% après la vaccination de rappel), gonflement (15,6% après la primovaccination, 17,6% après la vaccination de rappel), douleurs (45,9% après la primovaccination, 41,3% après la vaccination de rappel) et rougeur (24,3% après la primovaccination, 29,6% après la vaccination de rappel) au site d'injection
Très rares: gonflement étendu de l'extrémité du membre ayant reçu le vaccin*, induration au site d'injection*
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
En général, le profil d'effets secondaires rapportés après un surdosage était comparable à celui décrit après l'administration de la dose recommandée d'Hiberix.
Propriétés/Effets
Code ATC
J07AG01
Hiberix contient un polysaccharide capsulaire de phosphate de polyribosyl-ribitol de la bactérie Hib lyophilisé et purifié, lié de manière covalente au toxoïde de tétanos.
Le polysaccharide Hib est obtenu à partir de la souche 20'752 de la bactérie de Haemophilus influenzae de type b et lié au toxoïde de tétanos. Après purification, le conjugué est lyophilisé avec du lactose comme stabilisateur.
Hiberix est conforme aux exigences de l'OMS pour les produits biologiques et pour les vaccins Hib conjugués.
Mécanisme d'action
Non pertinent.
Pharmacodynamique
Un mois après la dernière dose de l'immunisation de base, un titre supérieur à 0,15 µg/ml a été obtenu chez 95 à 100% des enfants.
Un mois après la dose de rappel, un titre supérieur à 0,15 µg/ml a été atteint chez 100% des enfants (chez 94,7% d'entre eux, titre supérieur à 1,0 µg/ml).
Chez les enfants à partir de l'âge de 2 mois révolus, on obtient une protection sûre par l'administration de 4 x 0,5 ml d'Hiberix.
Efficacité clinique
Voir sous «Pharmacodynamique».
Pharmacocinétique
L'évaluation des propriétés pharmacocinétiques n'est pas requise pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniques
Non disponibles.
Remarques particulières
Incompatibilités
Hiberix ne doit pas être mélangé avec d'autres vaccins dans la même seringue, sauf mention particulière du fabricant.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
La stabilité à partir de la date de fabrication est de 36 mois lorsque Hiberix est conservé entre +2 °C et +8 °C.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (+2 °C-+8 °C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants. Ne pas congeler!
Remarques concernant la manipulation
Le vaccin Hib lyophilisé est disponible sous la forme d'une poudre blanche dans un flacon-ampoule.
Le solvant contenu dans la seringue préremplie est limpide et incolore.
Le vaccin reconstitué est une solution limpide à opalescente et incolore.
Le solvant et le vaccin reconstitué doivent être soumis avant la reconstitution ou l'administration à un contrôle visuel pour s'assurer de l'absence de particules étrangères et/ou de modifications de l'aspect physique. Si l'on observe de quelconques modifications, le solvant ou le vaccin reconstitué ne doivent pas être utilisés.
Instructions pour la reconstitution du vaccin avec le solvant contenu dans la seringue préremplie
Hiberix est reconstitué en ajoutant la totalité du contenu de la seringue préremplie de solvant dans le flacon-ampoule contenant la poudre.
Pour fixer l'aiguille à la seringue, suivez les instructions ci-dessous. La seringue fournie avec Hiberix peut toutefois légèrement différer de la seringue illustrée (c.-à-d. sans filetage). Dans ce cas, l'aiguille ne doit pas être vissée pour être connectée à la seringue.
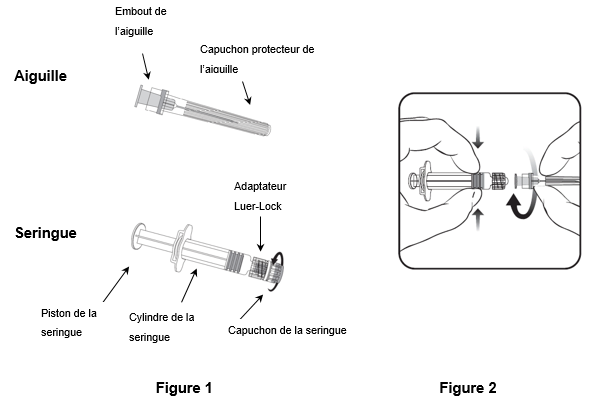
Tenez toujours la seringue par le cylindre. Ne tenez pas la seringue par le piston ou l'adaptateur Luer-Lock (ALL).
- Tenez la seringue par le cylindre et retirez le capuchon de la seringue en le tournant dans le sens inverse des aiguilles d'une montre (comme illustré dans la figure 1).
- Pour fixer l'aiguille à la seringue, introduisez prudemment l'embout de l'aiguille dans l'ALL et tournez l'aiguille dans le sens des aiguilles d'une montre jusqu'à ce qu'elle soit solidement fixée (comme illustré dans la figure 2). Veillez pendant cette opération à ce que l'aiguille soit dans l'axe de la seringue (comme illustré dans la figure 2). L'ALL risquerait sinon de se tordre et de ne plus être étanche. Si l'ALL se détache pendant la fixation de l'aiguille, il faut utiliser une nouvelle dose de vaccin (nouvelle seringue et nouveau flacon-ampoule).
- Retirez le capuchon protecteur de l'aiguille, qui peut parfois résister.
- Ajoutez le solvant à la poudre. Puis agitez soigneusement le mélange jusqu'à ce que la poudre soit entièrement dissoute dans le solvant.
Le vaccin reconstitué est une solution limpide à opalescente et incolore.
Le vaccin doit être administré immédiatement après la reconstitution. - Prélevez la totalité du contenu du flacon-ampoule dans la seringue.
- Une nouvelle aiguille doit être utilisée pour l'administration du vaccin. Retirez l'aiguille de la seringue en la dévissant et fixez une aiguille d'injection en répétant l'étape 2.
Les résidus de vaccin non utilisés et les déchets doivent être éliminés conformément à la règlementation nationale.
Numéro d’autorisation
00603 (Swissmedic)
Titulaire de l’autorisation
GlaxoSmithKline AG, 3053 Münchenbuchsee.
Mise à jour de l’information
Mai 2019.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French