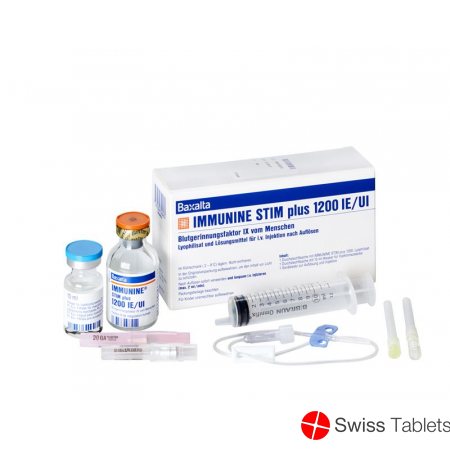
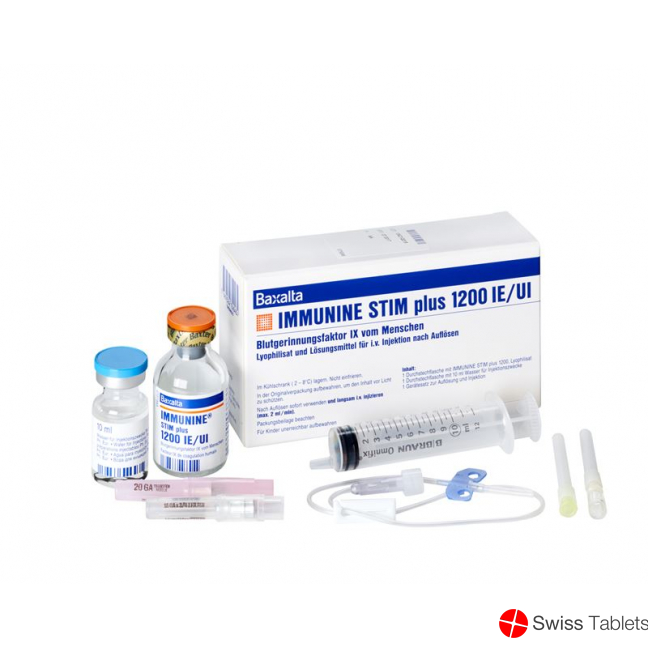
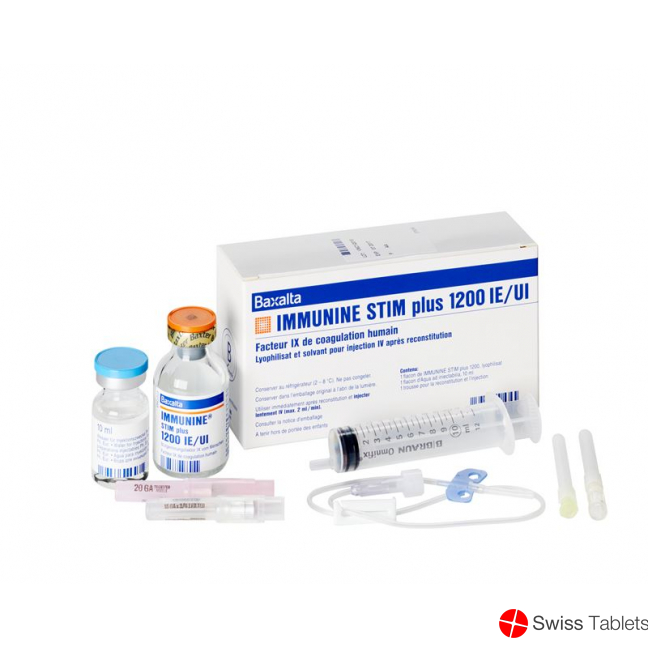
Immunine Stim Plus Trockensubstanz 1200 Ie C S Durchstechflasche buy online
Immunine STIM Plus Trockensub 1200 IE mit Solvens Durchstf
-
1,519.95 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: TAKEDA PHARMA AG
- Product Code: 1874445
- ATC-code B02BD04
- EAN 7680524740434
Ingredients:
Natriumchlorid, Blutgerinnungsfaktor IX human 1200 UI, Trockensubstanz, Lösungsmittel, Plasmaprotein human 6-29 mg, pro vitro, Natriumcitrat-2-Wasser.

Description
Zusammensetzung
Wirkstoff: Factor IX coagulationis humanus
Hilfsstoffe: Natrii citras, Natrii chloridum
Lösungsmittel : Aqua ad iniectabilia
Galenische Form und Wirkstoffmenge pro Einheit
Lyophilisat und Lösungsmittel zur intravenösen Injektion nach Auflösen.
Immunine STIM plus 600
Jede Durchstechflasche Immunine STIM plus 600 enthält nominell 600 I.E. Blutgerinnungsfaktor IX vom Menschen.
Das mit dem mitgelieferten 5 ml Wasser für Injektionszwecke aufgelöste Präparat enthält ca. 120 I.E./ml Blutgerinnungsfaktor IX vom Menschen.
Immunine STIM plus 1200
Jede Durchstechflasche Immunine STIM plus 1200 enthält nominell 1200 I.E. Blutgerinnungsfaktor IX vom Menschen.
Das mit dem mitgelieferten 10 ml Wasser für Injektionszwecke aufgelöste Präparat enthält ca. 120 I.E./ml Blutgerinnungsfaktor IX vom Menschen.
Die Aktivität (I.E.) wird anhand eines Einstufen-Gerinnungstests nach Ph. Eur. bestimmt. Die spezifische Aktivität von Immunine STIM plus, Blutgerinnungsfaktor IX vom Menschen, beträgt mindestens 50 I.E./mg Protein.
Indikationen/Anwendungsmöglichkeiten
Therapie und Prophylaxe von Blutungen aufgrund eines angeborenen oder erworbenen Faktor IX-Mangels (Hämophilie B, Hemmkörperhämophilie mit Faktor IX-Inhibitor, erworbener Faktor IX-Mangel aufgrund eines spontan auftretenden Faktor IX-Inhibitors).
Dosierung/Anwendung
Die Behandlung sollte unter der Aufsicht eines mit der Therapie von Hämophilie erfahrenen Arztes eingeleitet werden.
Dosierung
Dosierung und Dauer der Substitutionstherapie richten sich nach dem Schweregrad des Faktor IX-Mangels, nach Ort und Ausmass der Blutung und dem klinischen Zustand des Patienten.
Eine sorgfältige Kontrolle der Substitutionstherapie ist bei grösseren chirurgischen Eingriffen oder lebensbedrohlichen Blutungen besonders wichtig.
Die verabreichten Faktor IX-Einheiten werden in Internationalen Einheiten (I.E.) angegeben, die vom aktuellen WHO-Standard für Faktor IX-Produkte abgeleitet sind. Die Faktor IX-Aktivität im Plasma wird entweder als Prozentsatz (relativ zum normalen menschlichen Plasma) oder in Internationalen Einheiten (relativ zum internationalen Standard für Faktor IX Produkte) angegeben.
Eine Internationale Einheit (I.E.) Faktor IX-Aktivität entspricht der Menge an Faktor IX in 1 ml normalem menschlichen Plasma.
Bedarfsbehandlung
Die Berechnung der erforderlichen Faktor IX-Dosis basiert auf der Erfahrung, dass 1 I.E. Faktor IX pro kg Körpergewicht (KG) bei Patienten ab 12 Jahren die Faktor IX-Aktivität im Plasma um ca. 1.1% der normalen Aktivität erhöht.
Die benötigte Dosis wird mit folgender Formel berechnet:
Benötigte Einheiten = Körpergewicht (kg) x gewünschter Faktor IX Anstieg (%) (IE/dl)x 0.9
Die Dosis und Häufigkeit sind entsprechend der klinischen Wirksamkeit des Produktes im Einzelfall anzupassen. Faktor IX-Produkte müssen nur selten mehr als 1x pro Tag verabreicht werden.
Bei folgenden hämorrhagischen Ereignissen soll die Faktor IX-Aktivität im entsprechenden Zeitraum nicht unter die angegebenen Plasmaspiegel (in % der Norm oder in I.E./dl) sinken.
Die folgende Tabelle enthält Richtwerte für die Dosierung bei Blutungen und chirurgischen Eingriffen:
Grad der Blutung / Art des chirurgischen Eingriffes | Erforderlicher Faktor IX Plasmaspiegel (% d. Norm) (IE/dl) | Häufigkeit der Dosierung (Stunden) / Behandlungsdauer (Tage) |
Blutung | ||
Gelenkblutung im Frühstadium, Muskelblutungen oder Blutungen im Mund. | 20 – 40 | Alle 24 Stunden für mind. 1 Tag, bis die Blutung – angezeigt durch Schmerzen – gestillt oder Heilung erreicht ist. |
Ausgeprägtere Gelenkblutung, Muskelblutung oder Hämatom. | 30 – 60 | Injektion alle 24 Stunden für 3 – 4 Tage oder länger wiederholen, bis die Schmerzen und die akute Beeinträchtigung beseitigt sind. |
Lebensbedrohliche Blutungen wie Hirnchirurgie, Rachenblutung, schwere Abdominalblutung | 60 - 100 | Injektion alle 8 – 24 Stunden wiederholen bis die Gefahr für den Patienten vorüber ist. |
Chirurgische Eingriffe | ||
Kleinere Eingriffe einschliesslich Zahnextraktion. | 30 – 60 | Alle 24 Stunden für mind. 1 Tag bis die Wundheilung erreicht ist. |
Grössere Eingriffe | 80 – 100 (prä- und postoperativ) | Injektion alle 8 – 24 Stunden bis zu angemessener Wundheilung wiederholen, dann Therapie für noch mind. 7 Tage, um eine Faktor IX Aktivität von 30 – 60% aufrecht zu erhalten. |
Unter bestimmten Umständen, insbesondere zu Behandlungsbeginn, können höhere Dosierungen als berechnet notwendig sein.
Prophylaxe
Zur Langzeitprophylaxe von Blutungen bei Patienten mit schwerer Hämophilie B sollen Dosen zwischen 20 – 40 I.E./kg KG im Abstand von 3 – 4 Tagen gegeben werden.
In manchen Fällen, besonders bei jüngeren Patienten, können kürzere Dosierungsabstände oder höhere Dosen erforderlich sein.
Es wird empfohlen, den Faktor IX-Plasmaspiegel während des Behandlungsverlaufs in geeigneter Weise zu überwachen, damit die zu verabreichende Dosis und die Häufigkeit wiederholter Infusionen festgelegt werden können. Besonders bei grösseren chirurgischen Eingriffen ist eine genaue Überwachung der Substitutionstherapie durch Bestimmung des Blutgerinnungsstatus (Faktor-IX-Aktivität im Plasma) unerlässlich. Patienten können auf die Faktor IX-Gabe unterschiedlich ansprechen. Dies zeigt sich in unterschiedlichen Werten der in-vivo-Recovery und unterschiedlichen Halbwertzeiten.
Kinder und Jugendliche
Es liegen nur unzureichende Daten über die Behandlung von Kindern unter 6 Jahren vor.
Inhibitoren
Patienten sollten regelmässig auf die Bildung von Inhibitoren gegen Faktor IX überwacht werden. Falls die erwarteten Faktor IX-Plasmaaktivitäten nicht erreicht werden oder die Blutung mit einer angemessenen Dosis nicht beherrscht wird, muss ein Test zur Bestimmung von Faktor IX-Inhibitoren durchgeführt werden. Bei Patienten mit hohen Inhibitorwerten, wenn die Faktor IX-Therapie nicht effektiv ist, sollen andere therapeutische Massnahmen erwogen werden. Diese Therapien sollen nur von Ärzten durchgeführt werden, die über Erfahrung in der Behandlung von Patienten mit Hämophilie verfügen. Siehe auch „Warnhinweise und Vorsichtsmassnahmen“.
Bei Inhibitorspiegeln unter 10 Bethesda Einheiten (B.E.) pro ml, kann die Gabe eines zusätzlichen Blutgerinnungsfaktor IX vom Menschen die Inhibitoren neutralisieren. Bei Patienten mit Inhibitorspiegeln über 10 B.E./ml oder mit hoher anamnestischer Antwort, sollte an die Gabe eines (aktivierten) Prothrombinkomplex-Konzentrats (PCC oder aPCC) oder eines rekombinanten aktivierten Faktor VII Präparates (rFVIIa) gedacht werden. Diese Therapie soll nur von Ärzten mit Erfahrung in der Behandlung von Hämophilie durchgeführt werden.
Zur Behandlung von high-responder-Patienten bzw. Patienten mit einem höheren Inhibitortiter wird FEIBA S-TIM 4 empfohlen.
Anwendung
Das Auflösen erfolgt wie im Abschnitt ''Auflösung des Lyophilisates'' beschrieben (Siehe unter ''Hinweise für die Handhabung''). Immunine STIM plus soll langsam intravenös verabreicht werden. Die Verabreichungsgeschwindigkeit sollte nicht mehr als 2 ml/min betragen.
Kontraindikationen
Falls therapeutische Alternativen zu Immunine STIM plus verfügbar sind, darf Immunine STIM plus in den folgenden Situationen nicht verwendet werden:
Überempfindlichkeit gegen den Wirkstoff oder einen der Hilfsstoffe.
Verbrauchskoagulopathie (DIC) und/oder Hyperfibrinolyse.
Bekannte Heparin-Allergie oder Vorgeschichte heparininduzierter Thrombozytopenie.
Nach Unterbrechung dieser Zustände durch entsprechende Behandlung, darf Immunine STIM plus nur bei lebensbedrohlichen Blutungen verabreicht werden.
Warnhinweise und Vorsichtsmassnahmen
Überempfindlichkeitsreaktionen
Unter der Anwendung von Immunine STIM plus können Anaphylaxie und andere Überempfindlichkeitsreaktionen auftreten. Das Präparat enthält ausser Faktor IX noch Spuren anderer menschlicher Plasmaproteine. Die Patienten oder deren Pflegekräfte sollen über die Anzeichen einer Überempfindlichkeitsreaktion wie Juckreiz, generalisierte Urtikaria, Engegefühl in der Brust, Stenoseatmung, Hypotension und Anaphylaxie aufgeklärt sein. Wenn diese Symptome auftreten, sollen die Patienten die Behandlung sofort abbrechen und ihren Arzt kontaktieren. Bei Schock muss die Behandlung den Regeln der modernen Schocktherapie folgen.
In der Literatur wurden einige Fälle berichtet, die einen Zusammenhang zwischen dem Auftreten von Faktor IX-Inhibitoren und allergischen Reaktionen, insbesondere bei Patienten mit einem hohen Genmutations-Risiko, zeigen. Deshalb sollen Patienten mit einer allergischen Reaktion auf Anwesenheit von Faktor IX-Inhibitoren untersucht werden. Es soll bedacht werden, dass Patienten mit Faktor IX-Inhibitoren ein erhöhtes Risiko an schweren Übersensibilitätsreaktion oder Anaphylaxie haben können.
Aufgrund des Risikos allergischer Reaktionen mit Faktor IX Konzentraten sollte die anfängliche Behandlung mit Faktor IX, nach Ermessen des behandelnden Arztes, unter medizinischer Beobachtung erfolgen, um die Möglichkeit einer umgehenden und angemessenen Therapie der schweren allergischen/anaphylaktischen Reaktionen sicherzustellen, insbesondere bei Patienten mit hohem Genmutations-Risiko oder wo die Mutation unbekannt ist .
Inhibitoren
Nach wiederholter Gabe humaner Blutgerinnungsfaktor IX-Präparate sollten die Patienten auf die Bildung neutralisierender Antikörper (Inhibitoren) überwacht werden, die unter Verwendung geeigneter biologischer Tests in Bethesda Einheiten (B.E.) quantifiziert werden.
Beim Auftreten solcher Inhibitoren, zeigt sich der Zustand in einer ungenügenden klinischen Antwort. Falls ein Patient Inhibitoren bildet, sollte ein spezialisiertes Hämophilie-Zentrum kontaktiert werden
Thromboembolie / DIC
Da bei Verwendung von Faktor IX-Konzentraten in der Vergangenheit thromboembolische Komplikationen, das Risiko war bei nicht hochgereinigten Faktor IX Präparaten höher, beobachtet wurden, kann die Gabe für Patienten mit Zeichen einer Fibrinolyse oder einer Verbrauchskoagulopathie eine potentielle Gefährdung darstellen. Wegen dem potentiellen Risiko thromboembolischer Komplikationen ist bei Patienten mit Lebererkrankungen, postoperativen Patienten, Neugeborenen und bei Patienten, bei denen ein Risiko für Thrombose oder einer Verbrauchskoagulopathie besteht, eine klinische Beobachtung mit geeigneten Testverfahren erforderlich, um Frühzeichen einer thromboembolischen Komplikation oder einer Verbrauchskoagulopathie festzustellen. In den genannten Fällen muss der Nutzen der Immunine STIM plus Behandlung gegen das mögliche Risiko der Komplikationen abgewogen werden.
Bei Verdacht auf DIC sollte die Substitutionstherapie mit Faktor IX-Konzentraten unverzüglich abgebrochen werden.
Vorsichtsmassnahmen
Die berechnete Natriummenge in Immunine STIM plus pro Durchstechflasche beträgt für die 1200 IE Dosierung 40.9 mg, bzw. 20.4 mg für die 600 IE Dosierung. Bei der Verabreichung von einer hohen Einzeldose kann die Natriummenge von 250 mg überschritten werden. Dies sollte bei Patienten die unter einer niedrigeren Natriumdiät stehen, in Betracht gezogen werden.
Immunine STIM plus wird aus humanem Plasma hergestellt. Standardmassnahmen zur Verhinderung von Infektionen, die sich durch den Einsatz von Arzneimitteln ergeben, die aus Blut oder Blutplasma hergestellt werden, schliessen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker sowie den Einsatz effektiver Schritte zur Inaktivierung / Entfernung von Viren im Herstellungsverfahren ein. Dennoch kann bei der Verabreichung von Arzneimitteln aus menschlichem Blut oder Blutplasma die Möglichkeit der Übertragung von Krankheitserregern nicht völlig ausgeschlossen werden. Dies gilt auch für bislang unbekannte oder neu aufgetretene Viren und andere Pathogene.
Die ergriffenen Sicherheitsmassnahmen werden als wirksam gegen umhüllte Viren wie z.B. Humanes Immundefizienz-Virus (HIV), Hepatitis-B-Virus (HBV) und Hepatits-C-Virus (HCV) sowie gegen das unbehüllte Hepatitis-A-Virus (HAV) betrachtet. Für nicht-umhüllte Viren wie Parvovirus B19 können die getroffenen Massnahmen von eingeschränktem Wert sein.
Parvovirus B19 Infektionen können schwerwiegende Folgen für schwangere Frauen (fötale Infektion) und für Personen mit Immunmangelkrankheiten oder gesteigerter Erythropoese (z.B. hämolytische Anämie) haben.
Für Patienten, die regelmässig Präparate aus menschlichem Blut oder Plasma erhalten, wird grundsätzlich eine Impfung gegen Hepatitis A und Hepatitis B empfohlen.
Es wird empfohlen, bei jeder Verabreichung von Immunine STIM plus an einen Patienten den Namen und die Chargennummer des Präparates zu dokumentieren, um einen Zusammenhang zwischen Patient und Produktcharge herzustellen.
Interaktionen
Es wurden keine Interaktionsstudien mit Immunine STIM plus durchgeführt.
Schwangerschaft/Stillzeit
Es gibt keine hinreichenden Daten zur Anwendung von Immunine STIM plus bei Schwangeren und während der Stillzeit, und es wurden keine Reproduktionsstudien bei Tieren mit Faktor IX durchgeführt.Deshalb sollte das potentielle Risiko abgewogen werden und Immunine STIM plus in der Schwangerschaft und Stillzeit nur bei eindeutiger Indikationsstellung angewendet werden.
Bezüglich einer Parvovirus B19 Infektion während der Schwangerschaft siehe unter „Warnhinweise und Vorsichtsmassnahmen“.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es gibt keine Information über den Einfluss von Immunine STIM plus auf die Fahrtüchtigkeit und das Bedienen von Maschinen.
Unerwünschte Wirkungen
Patienten mit Hämophilie B können neutralisierende Antikörper (Inhibitoren) gegen Faktor IX entwickeln. Beim Auftreten solcher Inhibitoren kann sich dieser Zustand in einem unzureichenden klinischen Ansprechen manifestieren. In solchen Fällen sollte ein spezialisiertes Hämophilie-Zentrum kontaktiert werden. Zur Zeit liegen nur begrenzte Erfahrungen mit der Behandlung von nicht vorbehandelten Patienten (= previously untreated patients, PUP), mit Immunine STIM plus vor.
Es besteht ein potentielles Risiko für thromboembolische Ereignisse nach der Verabreichung von Faktor-IX-Präparaten, mit einem höheren Risiko für nicht hochgereinigte Produkte. Die Verwendung von nicht hochgereinigten Faktor-IX- Präparaten wurde mit Fällen von Herzinfarkt, Verbrauchskoagulopathie, Venenthrombose, und Lungenembolie. Arterienthrombose und Thrombose der Arteria Cerebri in Verbindung gebracht. Die Verwendung von hochgereinigtem Faktor IX ist selten mit solchen unerwünschten Wirkungen verbunden.
Die nachstehende Aufstellung listet die Häufigkeit der unerwünschten Wirkungen in klinischen Studien und aus Spontanberichten nach der Zulassung von Immunine STIM plus. Die Häufigkeit wurde unter Verwendung der folgenden Kriterien ermittelt: sehr häufig (≥1/10), häufig (≥1/100 bis <1/10), gelegentlich (≥1/1000 bis <1/100), selten (≥1/10'000 bis <1/1000), sehr selten (<1/10'000) und unbekannt (kann aus den verfügbaren Daten nicht eruiert werden).
Blut- und Lymphsystem
Sehr selten: neutralisierende Antikörper (Inhibitoren) gegen Faktor IX, Disseminierte intravaskuläre Gerinnung (DIC)
Immunsystem
Sehr selten: Allergische Reaktionen
Unbekannt: Anaphylaktische/Anaphylaktoide Reaktionen, Serumkrankheit (in Anwesenheit von Inhibitoren), Übersensibilitätsreaktionen, Angioödem
Nervensystem
Sehr selten: Kopfschmerzen, Ruhelosigkeit, Kribbeln
Herz
Sehr selten: Tachykardie, Myokardinfarkt
Gefässe
Sehr selten: Hypotension, thromboembolische Ereignisse (z.B. Lungenembolie, Venenthrombose, Arterienthrombose und Thrombose der Arteria Cerebri)
Unbekannt: Hitzegefühl
Atmungsorgane
Selten: Rachenreizung, Schmerzen im Oropharynx, trockener Husten
Unbekannt: Dyspnoe
Gastrointestinale Störungen
Sehr selten: Übelkeit, Erbrechen
Haut
Selten: Ausschlag, Pruritus
Unbekannt: Urtikaria
Nieren und Harnwege
Sehr selten: nephrotisches Syndrom (nach versuchter Immuntoleranzinduktion)
Allgemeine Störungen und Reaktionen an der Applikationsstelle
Selten: Fieber
Sehr selten: Schüttelfrost, Brennen und Stechen an der Einstichstelle, Überempfindlichkeitsreaktionen, Lethargie, Engegefühl in der Brust.
Überempfindlichkeits- oder allergische Reaktionen (wie anaphylaktischer Schock, Angioödem, Brennen und Stechen an der Einstichstelle, Schüttelfrost, urtikarielles Exanthem, Kopfschmerzen, Urtikaria, Hypotension, Lethargie, Übelkeit, Unruhe, Tachykardie, Engegefühl in der Brust, Kribbeln, Erbrechen, Paresthesie, Giemen und Stridor) wurden selten bei Patienten, die mit Faktor-IX-haltigen Präparaten behandelt wurden, beobachtet. In einigen Fällen führten diese Reaktionen zu einer schweren Anaphylaxie und sie traten in engem zeitlichen Zusammenhang mit der Entwicklung von Faktor-IX-Inhibitoren auf (siehe „Warnhinweise und Vorsichtsmassnahmen“).
Es liegen Berichte über das Auftreten eines nephrotischen Syndroms nach versuchter Immuntoleranzinduktion bei Hämophilie-B-Patienten mit Faktor-IX-Inhibitoren und allergischen Reaktionen in der Anamnese vor.
Für Informationen zur Virussicherheit siehe “Warnhinweise und Vorsichtsmassnahmen”.
Besondere Patientengruppen
IMMUNINE wurde bei Kindern mit Hämophilie B in zwei Beobachtungsstudien untersucht. Das Sicherheitsprofil von IMMUNINE war bei Kindern vergleichbar mit dem bei Erwachsenen (Siehe auch «Dosierung und Anwendung»).
Überdosierung
Wirkungen von höheren Dosierungen von Blutgerinnungsfaktor IX vom Menschen als der empfohlenen wurden nicht beschrieben.
Eigenschaften/Wirkungen
ATC-Code: B02BD04
Faktor IX ist ein einkettiges Glykoprotein mit einem Molekulargewicht von ca. 68000 Dalton. Es ist ein Vitamin K abhängiger Blutgerinnungsfaktor und wird in der Leber synthetisiert. Faktor IX wird durch Faktor XIa über den intrinsischen und über Faktor VII/Tissue Faktor über den extrinsischen Weg der Blutgerinnung aktiviert. Aktivierter Faktor IX aktiviert zusammen mit aktiviertem Faktor VIII Faktor X. Der aktivierte Faktor X wandelt Prothrombin in Thrombin um. Dieses setzt dann Fibrin aus Fibrinogen frei und die Gerinnselbildung kann erfolgen. Hämophilie B ist eine X-chromosomal vererbbare Störung der Blutgerinnung aufgrund erniedrigter Faktor IX Spiegel. Dies führt, entweder spontan oder in Folge unfallbedingter oder chirurgischer Traumata zu starken Blutungen in Gelenken, Muskeln oder inneren Organen. Durch die Substitutionstherapie werden die Faktor IX-Plasmaspiegel erhöht, wodurch eine vorübergehende Korrektur des Faktor IX-Mangels und der Blutungsneigung erfolgt.
Pharmakokinetik
Gemäss den Ergebnissen einer Studie der Phase IV betrug die mittlere stufenweise Recovery (IR) von Faktor IX bei vorbehandelten Patienten (PTPs) ab 12 Jahren (n = 27) 1.1 (± 0.27) I.E./dl pro I.E./kg, mit einem Streubereich von 0.6 bis 1.7 I.E./dl pro I.E./kg. In der gleichen Studie ergab sich bei PTPs bis einschliesslich 11 Jahren (n = 4) eine mittlere IR von 0.9 (± 0.12) mit einem Streubereich von 0.8 bis 1.1.
Eine pharmakokinetische Studie mit 26 Patienten zeigte die unten beschriebenen Ergebnisse:
Parameter | Anzahl | Mittelwert | 95% CI |
Clearance (ml/h/kg) | 26 | 8.39 | 7.53 – 9.25 |
Mittlere Verweilzeit (h) | 26 | 23.66 | 21.07 – 26.25 |
Die biologische Halbwertszeit beträgt ca. 17 Stunden.
Präklinische Daten
Immunine STIM plus ist ein hochgereinigtes Faktor IX-Konzentrat, das nur Spuren von Faktor II, VII und X enthält. Die erfolgreiche Entfernung der für das thrombogene Potential von Standard Prothrombinkomplex-Konzentraten verantwortlichen Komponenten kann mit dem Wessler-Test an Kaninchen, einem venösen Stase-Modell zur Bestimmung des thrombogenen Potentials eines Produktes, nachgewiesen werden. Während bei Standard-Prothrombinkomplex-Präparaten bereits Dosen von 50 I.E./kg KG zur Thrombenbildung führen können, waren nach Verabreichung von Immunine STIM plus in Dosen bis zu 1000 I.E./kg KG keine Anzeichen einer Fibrinbildung nachweisbar. Da Faktor IX ein Protein menschlichen Ursprungs ist, das unter physiologischen Bedingungen im Blutkreislauf zirkuliert, ist keine reproduktionstoxische, mutagene oder kanzerogene Wirkung zu erwarten.
Sonstige Hinweise
Inkompatibilitäten
Immunine STIM plus darf nicht mit anderen Arzneimitteln gemischt und nicht in Infusionslösungen verdünnt werden.
Es darf ausschliesslich der mitgelieferte Gerätesatz benutzt werden, da die Therapie als Folge einer Adsorption des humanem Blutgerinnungsfaktor IX an der Innenoberfläche einiger Infusionssets versagen kann.
Ein gemeinsamer venöser Zugang sollte vor und nach der Verabreichung von Immunine STIM plus mit einer isotonen Kochsalz-Lösung gespült werden.
Haltbarkeit
Das Medikament darf nur bis zu dem auf dem Behälter mit «Exp.» bezeichneten Datum verwendet werden.
Für das rekonstituierte Immunine STIM plus wurde eine chemische und physikalische Stabilität von 6 Stunden bei Raumtemperatur nachgewiesen. Aus mikrobiologischen Gründen sollte das Präparat sofort verwendet werden, es sei denn die Rekonstitution erfolgte unter aseptischen Bedingungen. Wird es nicht sofort verwendet, liegen die Haltbarkeit und die Aufbewahrungsbedingungen in der Verantwortung des Anwenders. Rekonstituierte Lösungen nicht im Kühlschrank lagern.
Besondere Lagerungshinweise
Im Kühlschrank (2 – 8 °C) lagern. Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Innerhalb der Laufzeit darf das Produkt bis zu 3 Monate vor Gebrauch bei Raumtemperatur (15 – 25 °C) gelagert werden. In diesem Falle sollte das Ende dieser 3-Monatsfrist als neues Verfalldatum auf der Verpackung vermerkt werden.
Für Kinder unerreichbar aufbewahren.
Hinweise für die Handhabung
Immunine STIM plus erst unmittelbar vor der Verabreichung auflösen. Die Lösung sollte klar oder leicht opaleszierend sein. Lösungen, die trübe sind oder einen Niederschlag aufweisen, dürfen nicht verwendet werden. Danach ist die Lösung sofort zu verwenden (Die Lösung enthält keine Konservierungsmittel). Nicht verwendete Lösung sachgemäss entsorgen.
Auflösung des Lyophilisates
1.Ungeöffnete Durchstechflasche mit Lösungsmittel (Wasser für Injektionszwecke) auf Raumtemperatur (max. +37 °C) erwärmen.
2.Schutzkappen von Lyophilisat- und Lösungsmittel-Durchstechflaschen entfernen (Fig. A) und die Gummistopfen beider Durchstechflaschen desinfizieren.
3.Ein Ende der Schutzkappe der beigepackten Transfernadel durch Drehen und Ziehen entfernen und mit der Nadel in den Gummistopfen der Lösungsmittel-Durchstechflasche einstechen (Fig. B und C).
4.Schutzkappe vom anderen Ende der Transfernadel entfernen. Freies Nadelende nicht berühren!
5.Lösungsmittel-Durchstechflasche umdrehen und das Ende der aufgesetzten Transfernadel durch das Zentrum des Gummistopfens der Lyophilisat-Durchstechflasche einstechen. (Fig. D). Durch das Vakuum in der Lyophilisat-Durchstechflasche wird das Lösungsmittel angesaugt.
6.Lösungsmittel-Durchstechflasche samt Transfernadel von der Lyophilisat-Durchstechflasche abziehen (Fig. E). Lösungsvorgang durch leichtes Schwenken der Lyophilisat-Durchstechflasche beschleunigen.
7. Nach vollständiger Auflösung des Lyophilisates die beigepackte Belüftungsnadel einstechen (Fig. F), wodurch eventuell entstandener Schaum zusammenfällt. Belüftungsnadel entfernen.
Auf aseptische Arbeitsweise achten!
Injektion
1.Ein Ende der Schutzkappe der beigepackten Filternadel durch Drehen und Ziehen entfernen, die Nadel auf die sterile Einmalspritze setzen und die Lösung in die Spritze aufziehen (Fig. G).
2.Spritze von der Filternadel trennen und die Lösung mit dem beigepackten Infusionsset bzw. der Einmalnadel langsam (maximal 2 ml/min) intravenös injizieren.

Infusion
Das rekonstituierte Lyophilisat darf auf keinen Fall verdünnt werden (siehe „Inkompatibilitäten“). Bei Verabreichung als Infusion ist ein Einmalinfusionsset für kleine Volumina mit entsprechendem Filter zu verwenden.
Zulassungsnummer
52474 (Swissmedic)
Zulassungsinhaberin
Takeda Pharma AG, 8152 Opfikon
Stand der Information
Februar 2017
Composition
Principe actif : Factor IX coagulationis humanus
Excipients: Natrii citras, Natrii chloridum
Solvant: Aqua ad iniectabilia
Forme galénique et quantité de principe actif par unité
Lyophilisat et solvant pour injection intraveineuse après reconstitution.
Immunine STIM plus 600
Chaque flacon perforable d'Immunine STIM plus 600 contient nominalement 600 UI de facteur IX de la coagulation humain.
Une fois reconstituée avec les 5 ml d'eau pour préparations injectables livrée, la solution contient environ 120 UI/ml de facteur IX de la coagulation humain.
Immunine STIM plus 1200
Chaque flacon perforable d'Immunine STIM plus 1200 contient nominalement 1200 UI de facteur IX de la coagulation humain.
Une fois reconstituée avec les 10 ml d'eau pour préparations injectables livrée, la solution contient environ 120 UI/ml de facteur IX de la coagulation humain.
L'activité (UI) est déterminée par l'épreuve de coagulation en une étape conformément à la Pharmacopée Européenne. L'activité spécifique d'Immunine STIM plus, facteur IX de la coagulation humain, s'élève au minimum à 50 UI/mg de protéine.
Indications/Possibilités d’emploi
Traitement et prévention des hémorragies dues à un déficit congénital ou acquis en facteur IX de la coagulation (hémophilie B, hémophilie avec inhibiteur du facteur IX, déficit acquis en facteur IX dû à l'apparition spontanée d'un inhibiteur du facteur IX).
Posologie/Mode d’emploi
Le traitement doit être instauré sous la surveillance d'un médecin expérimenté dans le traitement de l'hémophilie.
Posologie
La posologie et la durée du traitement substitutif dépendent du degré de sévérité du déficit en facteur IX, de la localisation et de l'importance de l'hémorragie et de l'état clinique du patient.
Dans le cas d'interventions chirurgicales majeures ou des hémorragies susceptibles de mettre la vie en danger, il est essentiel de réaliser un contrôle précis du traitement de substitution.
Les unités de facteur IX administrées sont indiquées en unités internationales (UI) lesquelles sont dérivées du standard actuel de l'OMS pour les préparations de facteur IX. L'activité plasmatique du facteur IX est indiquée soit en pourcentage (par rapport au plasma humain normal) soit en unités internationales (par rapport au standard international pour les préparations de facteur IX).
Une unité internationale (UI) d'activité de facteur IX est équivalente à la quantité de facteur IX présente dans 1 ml de plasma humain normal.
Traitement à la demande
Le calcul de la dose nécessaire de facteur IX repose sur l'observation selon laquelle 1 UI de facteur IX par kg de poids corporel chez les patients à partir de 12 ans augmente l'activité plasmatique du facteur IX de 1.1% de l'activité normale.
La dose nécessaire est calculée à l'aide de la formule suivante:
Nombre d'unités à administrer = poids corporel (kg) x augmentation souhaitée en facteur IX (en %)(UI/dl) x 0.9
La dose et la fréquence des injections doivent être ajustées à chaque cas individuel en fonction de l'efficacité clinique observée. Les préparations de facteur IX doivent rarement être injectées plus d'une fois par jour.
Dans le cas des accidents hémorragiques suivants, l'activité du facteur IX ne doit pas chuter au-dessous du pourcentage d'activité plasmatique (en % de la norme ou en UI/dl) donné pendant la période précisée.
Le tableau ci-dessous peut servir de guide pour déterminer la posologie dans les hémorragies et interventions chirurgicales:
Importance de l'hémorragie / Type d'acte chirurgical | Taux nécessaire de facteur IX (% de la norme)(UI/dl) | Fréquence des injections (heures) / Durée du traitement (jours) |
Hémorragie | ||
Hémarthrose précoce, saignements musculaires ou oraux. | 20 – 40 | Toutes les 24 heures pendant au moins 1 jour, jusqu'à l'arrêt de l'hémorragie -indiqué par la disparition de la douleur - ou l'obtention d'une cicatrisation. |
Hémarthrose plus étendue, saignements musculaires ou hématome. | 30 – 60 | Répéter l'injection toutes les 24 heures pendant 3-4 jours ou plus longtemps jusqu'à disparition de la douleur et de l'invalidité aiguë. |
Hémorragie susceptible de mettre la vie en danger, comme chirurgie du cerveau, hémorragie du pharynx, hémorragie abdominale sévère | 60 - 100 | Répéter l'injection toutes les 8 à 24 heures, jusqu'à ce que le danger pour le patient soit écarté. |
Chirurgie | ||
Mineure, dont extraction dentaire | 30 – 60 | Toutes les 24 heures pendant au moins 1 jour, jusqu'à l'obtention d'une cicatrisation. |
Majeure | 80 – 100 (pré- et postopératoire) | Répéter l'injection toutes les 8 à 24 heures jusqu'à cicatrisation satisfaisante de la plaie, puis poursuivre le traitement pendant au moins 7 jours supplémentaires pour maintenir un taux de facteur IX compris entre 30 et 60%. |
Dans certaines circonstances et en particulier au début du traitement, des doses supérieures aux doses calculées peuvent s'avérer nécessaires.
Prophylaxie
Pour la prophylaxie à long terme des hémorragies chez des patients souffrant d'hémophilie B sévère, il faut administrer des doses comprises entre 20 et 40 UI/kg de poids corporel à intervalles de 3 à 4 jours.
Dans certains cas, particulièrement chez les patients jeunes, il peut s'avérer nécessaire de raccourcir l'intervalle entre deux injections ou d'augmenter la posologie.
Il est recommandé de contrôler d'une manière appropriée les concentrations en facteur IX au cours du traitement, afin de déterminer la dose à administrer et la fréquence des injections répétés. Dans le cas d'interventions chirurgicales majeures, une surveillance précise du traitement substitutif par un bilan de la coagulation (activité plasmatique du facteur IX) est indispensable. La réponse à l'administration de facteur IX peut varier selon les patients. Cela se traduit par des valeurs différentes de la récupération in vivo et de la demi-vie.
Enfants et adolescents
Les données disponibles sur le traitement des enfants de moins de 6 ans sont insuffisantes.
Inhibiteurs
L'apparition d'un inhibiteur du facteur IX doit être régulièrement surveillée. Si les activités plasmatiques de facteur IX souhaitées ne peuvent pas être atteintes ou si le saignement n'est pas maîtrisé après l'administration d'une dose appropriée, la présence d'un inhibiteur du facteur IX doit être recherchée par un test biologique. D'autres mesures thérapeutiques doivent être envisagées chez les patients présentant des taux d'inhibiteur élevés, lorsque le traitement par le facteur IX n'est pas efficace. Ces traitements ne doivent être effectués que par des médecins expérimentés dans le traitement des patients hémophiles. Cf. «Mises en garde et précautions».
En cas d'apparition d'un inhibiteur à un taux inférieur à 10 unités Bethesda (UB) par ml, l'augmentation de la dose de facteur IX de coagulation humain injectée peut être suffisante pour neutraliser l'inhibiteur. Chez les patients présentant un taux d'inhibiteur supérieur à 10 UB/ml ou une réponse anamnestique importante, l'emploi d'un concentré de complexe prothrombique (activé) (PCC ou aPCC) ou de facteur VII activé recombinant (rFVIIa) doit être envisagé. Ce traitement ne doit être effectué que par des médecins expérimentés dans le traitement de l'hémophilie.
Pour le traitement de patients fortement répondeurs ou de patients présentant un titre élevé d'inhibiteur, il est recommandé d'utiliser FEIBA S-TIM 4.
Mode d'emploi
Reconstituer le produit comme décrit dans le paragraphe «Dissolution du lyophilisat» (cf. «Remarques concernant la manipulation»). Immunine STIM plus doit être administré lentement par voie intraveineuse. La vitesse d'administration ne doit pas excéder 2 ml/min.
Contre-indications
Si des alternatives thérapeutiques à Immunine STIM plus sont disponibles, Immunine STIM plus ne peut pas être utilisé dans les situations suivantes:
Hypersensibilité au principe actif ou à un des excipients.
Coagulopathie de consommation (CIVD) et/ou hyperfibrinolyse.
Allergie connue à l'héparine ou antécédent de thrombocytopénie par l'héparine.
Une fois ces états jugulés par un traitement adéquat, Immunine STIM plus ne doit être administré que lors d'hémorragies menaçant le pronostic vital.
Mises en garde et précautions
Réactions d'hypersensibilité
Dans le cadre de l'application d'Immunine STIM plus, une anaphylaxie ou autres réactions allergiques d'hypersensibilité peuvent survenir. Outre le facteur IX, la préparation contient encore traces d'autres protéines plasmatiques humaines. Les patients ou leurs soignants doivent être informés des signes de réactions d'hypersensibilité comme démangeaisons, urticaire généralisée, sensation d'oppression dans la poitrine, sibilances, hypotension et anaphylaxie. En cas d'apparition de ces symptômes, les patients doivent immédiatement interrompre le traitement et contacter leur médecin. En cas de choc, le traitement doit obéir aux règles du traitement moderne du choc.
La corrélation entre l'apparition d'un inhibiteur du facteur IX et la survenue de réactions allergiques, en particulier chez les patients avec un risque élevé de mutation du gène, a été rapportée dans la littérature dans quelques cas. C'est pourquoi la présence d'un inhibiteur du facteur IX doit être recherchée chez les patients présentant une réaction allergique. Il faut tenir compte du fait que les patients présentant un inhibiteur du facteur IX peuvent avoir un risque accru de réactions d'hypersensibilité graves ou d'anaphylaxie.
En raison du risque de réactions allergiques avec des concentrés de facteur IX, le traitement par le facteur IX doit être débuté selon l'appréciation du médecin traitant et sous la surveillance de celui-ci, pour assurer la possibilité d'un traitement immédiat et adéquat des réactions allergiques/anaphylactiques graves, en particulier chez les patients avec un risque élevé de mutation du gène ou où la mutation n'est pas connue.
Inhibiteurs
Chez les patients recevant de manière répétée des préparations de facteur IX de coagulation humain, il faut rechercher la présence d'anticorps neutralisants (inhibiteur) par des tests biologiques appropriés avec mesure du titre de l'inhibiteur en unités Bethesda (UB).
Lors de l'apparition d'un tel inhibiteur, cet état peut se manifester par une réponse clinique insuffisante. Dans de tels cas, il faut se mettre en contact avec un centre spécialisé dans le traitement de l'hémophilie.
Thromboembolie / CIVD
Dans le passé, l'utilisation de concentrés de facteur IX a été associée à des complications thromboemboliques, surtout pour les préparations de facteur IX n'étant pas de grande pureté. L'administration de tels produits peut présenter des risques chez les patients présentant des signes de fibrinolyse ou de coagulation de consommation. En raison du risque potentiel de complications thromboemboliques, une surveillance clinique comportant des tests appropriés devra être instaurée pour détecter les signes précoces d'une complication thromboembolique ou d'une coagulopathie de consommation, chez les patients atteints de maladies hépatiques, les patients en période postopératoire, les nouveau-nés et les patients présentant un risque de thrombose ou de coagulopathie de consommation. Dans chacune de ces situations, le bénéfice du traitement par Immunine STIM plus doit être mis en balance avec le risque potentiel de complications.
En cas de suspicion de CIVD, il faut immédiatement interrompre le traitement substitutif.
Précautions
La quantité calculée de sodium dans un flacon perforable d'Immunine STIM plus se monte à 40.9 mg pour la présentation de 1200 UI respectivement à 20.4 mg pour la présentation de 600 UI. Lors de l'administration d'une dose unique élevée, la quantité de sodium de 250 mg peut être dépassée. Ceci devrait être considéré chez les personnes sous régime hyposodé.
Immunine STIM plus est produit à partir de plasma humain. Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection des donneurs, la recherche de marqueurs spécifiques d'infection sur chaque don et sur les pools de plasma et l'inclusion dans le procédé de fabrication d'étapes efficaces pour l'inactivation/élimination virale.
Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou autres types d'agents infectieux.
Les mesures de sécurité prises sont considérées comme efficaces contre les virus enveloppés tels que virus de l'immunodéficience humaine (VIH), virus de l'hépatite B (VHB) et virus de l'hépatite C (VHC) ainsi que contre le virus non enveloppé de l'hépatite A (VHA). Les mesures prises peuvent être d'efficacité limitée vis-à-vis de virus non enveloppés tels que le parvovirus B19.
L'infection par le parvovirus B19 peut être grave chez les femmes enceintes (infection fœtale) et chez les sujets immunodéprimés ou présentant une augmentation de la production de globules rouges (par ex. anémie hémolytique).
Pour les patients qui reçoivent régulièrement des préparations dérivées de sang ou de plasma humain, une vaccination contre l'hépatite A et l'hépatite B est recommandée par principe.
Lors de chaque administration d'Immunine STIM plus à un patient, il est recommandé de documenter le nom et le numéro de lot de la préparation pour pouvoir établir un rapport entre le patient et le lot du produit.
Interactions
Aucune étude d'interaction avec Immunine STIM plus n'a été réalisée.
Grossesse/Allaitement
Il n'existent pas de données suffisantes concernant l'utilisation de Immunine STIM plus chez les femmes enceintes et pendant l'allaitement et aucune étude de reproduction n'a été effectuée avec le facteur IX chez l'animal. Pour cette raison le risque potentiel devrait être considéré et Immunine STIM plus ne devra donc être utilisé pendant la grossesse et l'allaitement qu'en cas d'indication clairement posée.
Concernant des informations sur les infections par le parvovirus B19 pendant la grossesse voir «Mises en garde et précautions».
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune information n'est connue sur l'influence d'Immunine STIM plus sur l'aptitude à la conduite ou à l'utilisation de machines.
Effets indésirables
Les patients atteints d'hémophilie B peuvent développer des anticorps neutralisants (inhibiteurs) contre le facteur IX. Lors de l'apparition d'un tel inhibiteur, cet état peut se manifester par une réponse clinique insuffisante. Dans de tels cas, il faut se mettre en contact avec un centre spécialisé dans le traitement de l'hémophilie. On ne dispose actuellement que d'expériences limitées sur le traitement par Immunine STIM plus de patients non préalablement traités (= previously untreated patients, PUP).
Il existe un risque potentiel d'événements thromboemboliques après l'administration de préparations de facteur IX, surtout pour les produits n'étant pas de grande pureté. L'utilisation de préparations de facteur IX n'étant pas de grande pureté a été mise en relation avec des cas d'infarctus du myocarde, de coagulation intravasculaire disséminée, de thrombose veineuse et d'embolie pulmonaire, thrombose artérielle et thrombose artérielle cérébrale. L'utilisation de facteur IX de grande pureté est rarement reliée à de tels effets indésirables.
Les effets indésirables indiqués ci-dessous sont basés sur des études cliniques et des déclarations spontanées après l'autorisation d'Immunine STIM plus. Leur fréquence a été calculée selon les critères suivants: très fréquent (≥10%), fréquent (≥1% à <10%), occasionnel (≥0,1% à <1%), rare (≥0,01% à <0,1%), très rare (<0.01%) et fréquence indéterminée (ne peut pas être estimée sur la base des données disponibles).
Circulation sanguine et lymphatique
Très rare: anticorps neutralisants (inhibiteurs) contre le facteur IX, coagulation intravasculaire disséminée (CIVD)
Système immunitaire
Très rare: réactions allergiques
Fréquence indéterminée: réactions anaphylactiques/ anaphylactoïdes, maladie sérique (en présence d'inhibiteurs), réactions d'hypersensibilité, angiooedème
Système nerveux
Très rare: céphalées, agitation, picotements
Troubles cardiaques
Très rare: tachycardie, infarctus du myocarde
Troubles vasculaires
Très rare: hypotension, épisodes thromboemboliques (p.ex. embolie pulmonaire, thrombose veineuse, thrombose artérielle et thrombose artérielle cérébrale)
Fréquence inconnue: bouffée congestive
Organes respiratoires
Rare: irritation de la gorge, douleur oro-pharyngée, toux sèche
Fréquence inconnue: dyspnée
Troubles gastro-intestinaux
Très rare: nausées, vomissements
Troubles cutanés
Rare: rash, prurit
Fréquence inconnue: urticaire
Troubles rénaux et urinaires
Très rare: syndrome néphrotique (après un essai d'induction d'immunotolérance)
Troubles généraux et réactions au site d'injection
Rare: fièvre
Très rare: frissons, brûlures et sensation de piqûre au site d'injection, réactions d'hypersensibilité, léthargie, sensation d'oppression dans la poitrine.
Les réactions d'hypersensibilité ou allergiques (telles que choc anaphylactique, angiooedème, brûlures et sensation de piqûre au site d'injection, frissons, exanthème urticarien, céphalées, urticaire, hypotension, léthargie, nausées, impatiences, tachycardie, sensation d'oppression dans la poitrine, picotements, vomissements, paresthésie, sibilances et respiration bruyante) ont rarement été observées chez les patients ayant été traités par des préparations contenant du facteur IX. Dans certaines cas, ces réactions ont entraîné une anaphylaxie sévère et elles sont survenues en relation temporelle étroite avec le développement d'un inhibiteur du facteur IX. (cf. «Mises en garde et précautions»)
La survenue d'un syndrome néphrotique a été rapportée après un essai d'induction d'immunotolérance chez des patients atteints d'hémophilie B et présentant un inhibiteur du facteur IX et des réactions allergiques dans leurs antécédents.
Pour d'informations concernant la sécurité virale voir «Mises en garde et précautions».
Groupes de patients particuliers
IMMUNINE a été étudié chez les enfants atteints d'hémophilie B dans deux études d'observation. Le profil de sécurité d'IMMUNINE chez les enfants était comparable à celui chez les adultes (voir «Posologie/mode d'emploi»).
Surdosage
Aucun effet de doses plus élevées que celles recommandées n'a été rapporté en relation avec le facteur IX de la coagulation humain.
Propriétés/Effets
Code ATC: B02BD04
Le facteur IX est une glycoprotéine monocaténaire d'un poids moléculaire d'environ 68 000 Daltons. Il s'agit d'un facteur de la coagulation vitamine K-dépendant, synthétisé dans le foie. Le facteur IX est activé par le facteur XIa dans la voie endogène de la coagulation et par le complexe facteur VII/facteur tissulaire dans la voie exogène. Le facteur IX activé, associé au facteur VIII activé, active le facteur X. Le facteur X activé convertit la prothrombine en thrombine. La thrombine convertit ensuite la fibrine en fibrinogène, ce qui aboutit à la formation du caillot. L'hémophilie B est un déficit héréditaire en facteur IX de la coagulation, lié au chromosome X, caractérisé par de fortes hémorragies au niveau des articulations, des muscles ou des organes internes. Ces hémorragies peuvent être spontanées, accidentelles ou liées à une intervention chirurgicale. Le traitement substitutif permet d'augmenter les taux plasmatiques de facteur IX, palliant temporairement le déficit en facteur IX et corrigeant la tendance hémorragique.
Pharmacocinétique
Selon les résultats d'une étude de phase IV, la récupération progressive (IR) du facteur IX chez les patients non traités (PTPs) à partir de 12 ans (n = 27) 1,1 (± 0h27) UI / dl par UI / kg, avec un intervalle de 0,6 jusqu'à 1.7 UI/dl par UI / kg. Dans la même étude une moyenne de 0.9 IR (± 0.12) avec un intervalle de 0.8 à 1.1 a résulté chez les PTP jusqu'à et y compris 11 ans (n = 4).
Une étude pharmacocinétique avec 26 patients a montré les résultats décrits ci-dessous:
Paramètre | Valeur | Moyenne | 95% CI |
Clairance (ml/h/kg) | 26 | 8.39 | 7.53 – 9.25 |
Temps de séjour moyen (h) | 26 | 23.66 | 21.07 – 26.25 |
La demi-vie biologique est d'environ 17 heures.
Données précliniques
Immunine STIM plus est un concentré de facteur IX hautement purifié qui ne contient que des traces de facteurs II, VII et X. Le succès de l'élimination des composants responsables du potentiel thrombogène des concentrés standards de complexe prothrombinique peut être mis en évidence par le test de Wessler chez le lapin, un modèle de stase veineuse permettant de déterminer le potentiel thrombogène d'un produit. Alors que les préparations standards de complexe prothrombinique peuvent déjà provoquer la formation de thrombi à des doses de 50 UI/kg de poids corporel, aucun signe de formation de fibrine n'a pu être détecté après l'administration de doses d'Immunine STIM plus allant jusqu'à 1000 UI/kg. Le facteur IX étant une protéine d'origine humaine, qui est présente dans la circulation sanguine dans des conditions physiologiques, il n'y a pas lieu de craindre une action toxique sur la reproduction, ni une action mutagène ou cancérogène.
Remarques particulières
Incompatibilités
Immunine STIM plus ne doit pas être mélangé avec d'autres médicaments, ni dilué dans les solutions pour perfusion.
Il ne peut être utilisé qu'avec l'appareillage fourni car l'adsorption du facteur IX de coagulation humain sur la surface interne de certains sets de perfusion peut être responsable d'un échec du traitement.
Il est conseillé de rincer les abords veineux communs avec une solution adéquate, par ex. une solution saline, avant et après l'application d'Immunine STIM plus.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Une stabilité chimique et physique de 6 heures à température ambiante a été démontrée pour la solution d'Immunine STIM plus reconstituée. Pour des raisons de microbiologie, la préparation doit être utilisée immédiatement, à moins que la reconstitution n'ait été effectuée dans des conditions d'asepsie. Si elle n'est pas immédiatement utilisée, la stabilité et les conditions de conservation sont sous la responsabilité de l'utilisateur. Ne pas conserver les solutions reconstituées au réfrigérateur.
Remarques concernant le stockage
Conserver au réfrigérateur (2 – 8 °C). Ne pas surgeler.
Conserver dans l'emballage original, à l'abri de la lumière.
Pendant la durée de validité, le produit peut être conservé jusqu'à 3 mois à température ambiante (15 - 25 °C) avant d'être utilisé. Dans ce cas, la fin de ce délai de 3 mois doit être inscrite sur l'emballage et constitue la nouvelle date de péremption.
A tenir hors de portée des enfants.
Remarques concernant la manipulation
Ne reconstituer Immunine STIM plus qu'immédiatement avant son administration. La solution doit être limpide ou légèrement opalescente. Ne pas utiliser les solutions troubles ou contenant un dépôt. La solution doit ensuite être utilisée immédiatement (la solution ne contient pas de conservateur). Eliminer toute solution non utilisée conformément aux dispositions.
Dissolution du lyophilisat
1. Réchauffer le solvant (eau pour préparations injectables) dans son flacon à température ambiante (+37 °C au maximum).
2. Retirer les capuchons protecteurs des flacons contenant le lyophilisat et le solvant (Fig. A) et désinfecter les bouchons en caoutchouc des deux flacons.
3. Enlever un des capuchons de l'aiguille de transfert jointe en imprimant un mouvement de rotation. Enfoncer l'aiguille dans le bouchon de caoutchouc du flacon contenant le solvant (Fig. B et C).
4. Enlever l'autre capuchon de l'aiguille de transfert. Ne pas toucher l'extrémité libre de l'aiguille !
5. Renverser le flacon de solvant et enfoncer l'aiguille de transfert au centre du bouchon en caoutchouc du flacon de lyophilisat. (Fig. D). Le vide constitué dans le flacon de lyophilisat aspire le solvant.
6. Retirer le flacon de solvant avec l'aiguille du flacon de lyophilisat (Fig. E). Accélérer le processus de dissolution en agitant légèrement le flacon contenant le lyophilisat.
7. Après la dissolution complète du lyophilisat, enfoncer l'aiguille d'aération jointe (Fig. F), pour faire disparaître la mousse qui s'est éventuellement formée. Retirer l'aiguille d'aération.
Utilisez une technique aseptique !
Injection
1. Enlever en tournant et tirant le capuchon protecteur de l'aiguille-filtre jointe, monter celle-ci sur la seringue à usage unique et aspirer la solution dans la seringue. (Fig. G)
2. Séparer la seringue de l'aiguille-filtre et injecter la solution avec l'aiguille à usage unique jointe (ou le nécessaire de perfusion) par voie intraveineuse lente (2 ml/min au maximum).

Perfusion
Le lyophilisat dissout ne doit être en aucun cas dilué (cf. «Incompatibilités»). Il est donc impératif, en cas d'administration par perfusion, d'employer un dispositif de perfusion pour petits volumes, dispositif à usage unique muni d'un filtre adéquat.
Numéro d’autorisation
52474 (Swissmedic)
Titulaire de l’autorisation
Takeda Pharma AG, 8152 Opfikon
Mise à jour de l’information
Février 2017
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French







