Kytril Infusionskonzentrat 1mg/ml 5 Ampullen 1ml buy online
Kytril Inf Konz 1 mg/ml 5 Amp 1 ml
-
106.69 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: FUTURE HEALTH PHARMA
- Product Code: 1738831
- ATC-code A04AA02
- EAN 7680511980348
Ingredients:
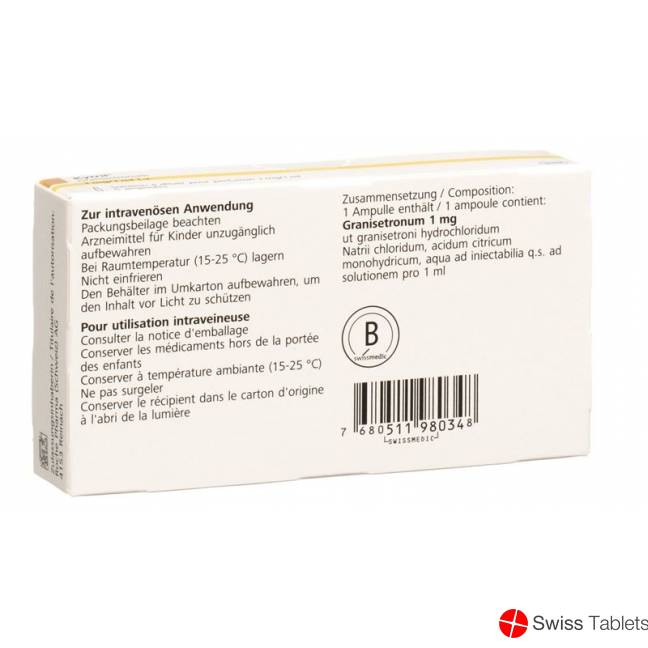
Natriumchlorid, Natriumhydroxid, Salzsäure, konzentriert, Natrium 4.19 mg, Granisetron 1 mg , Granisetron hydrochlorid, Citronensäure-Monohydrat.

Description
Zusammensetzung
Wirkstoffe
Granisetron als Granisetronhydrochlorid
Hilfsstoffe
Filmtablette 1 mg
Carboxymethylstärke-Natrium (Typ A) (5 mg enthalten max. 0.21 mg Natrium), Cellulose mikrokristallin (E 460), Hypromellose, Lactose-Monohydrate (69.38 mg), Macrogol 400 (E 1521), Magnesiumstearate, Polysorbat 80, Titandioxid (E 171), pro Filmtablette
Filmtablette 2 mg
Carboxymethylstärke-Natrium (Typ A) (10 mg enthalten max. 0.42 mg Natrium), Cellulose mikrokristallin (E 460), Hypromellose, Lactose-Monohydrate (138.76 mg), Macrogol 400 (E 1521), Magnesiumstearate, Polysorbat 80, Titandioxid (E 171), pro Filmtablette
Konzentrat zur Herstellung einer Infusionslösung 1 mg pro 1 ml:
Natriumchlorid, Citronensäuremonohydrat (E 330), Salzsäure (E 507), Natriumhydroxid (E 524), aqua ad iniectabilia, pro 1 ml, corresp. Natrium 4.19 mg
Konzentrat zur Herstellung einer Infusionslösung 3 mg pro 3 ml:
Natriumchlorid, Citronensäuremonohydrat (E 330), Salzsäure (E 507), Natriumhydroxid (E 524), aqua ad iniectabilia, pro 3 ml, corresp. Natrium 12.5 mg
Darreichungsform und Wirkstoffmenge pro Einheit
Filmtabletten zu 1 mg:
Jede Filmtablette enthält 1 mg Granisetron als 1.12 mg Granisetronhydrochlorid.
Filmtabletten zu 2 mg:
Jede Filmtablette enthält 2 mg Granisetron als 2.24 mg Granisetronhydrochlorid.
Konzentrat zur Herstellung einer Infusionslösung:
1 mg Granisetron pro 1 ml bzw. 3 mg Granisetron pro 3 ml.
Indikationen/Anwendungsmöglichkeiten
Zytostatische Chemotherapie
Bei Erwachsenen zur Prophylaxe (oral, intravenös) und Therapie (intravenös) von Nausea und Erbrechen, hervorgerufen durch eine zytostatische Chemotherapie.
Bei Kindern ab 2 Jahren zur Prophylaxe (intravenös) und Therapie (intravenös) von Nausea und Erbrechen, hervorgerufen durch eine zytostatische Chemotherapie.
Radiotherapie
Bei Erwachsenen zur Prophylaxe (oral, intravenös) und Therapie (intravenös) von Nausea und Erbrechen, hervorgerufen durch Strahlentherapie.
Postoperative Nausea und Erbrechen
Bei Erwachsenen zur Therapie (intravenös) von postoperativer Nausea und Erbrechen.
Dosierung/Anwendung
Übliche Dosierung bei Erwachsenen
Zytostatische Chemotherapie (Prophylaxe)
Oral:
2-mal täglich 1 Filmtablette zu 1 mg oder 1-mal täglich 1 Filmtablette zu 2 mg Kytril während und bis zu einer Woche nach Ende der zytostatischen Therapie. Die erste Dosis Kytril sollte innerhalb 1 Stunde vor Beginn der zytostatischen Therapie eingenommen werden.
Intravenös:
Patienten über 50 kg Körpergewicht:
1 Ampulle (3 mg Granisetron pro 3 ml) verdünnt in 20-50 ml Infusionslösung, verabreicht über 5 Minuten, vor der zytostatischen Therapie. Diese 3 mg-Dosis Ampulle kann auch als Bolusinjektion über 30 Sekunden verabreicht werden.
Patienten unter 50 kg Körpergewicht:
20-40 μg/kg Körpergewicht; vorzugsweise soll das entsprechende Volumen der Kytril-Lösung verdünnt in 20-50 ml Infusionslösung über 5 Minuten, vor der zytostatischen Therapie, verabreicht werden. Alternativ kann das entsprechende Volumen der Kytril-Lösung auch als Bolusinjektion über 30 Sekunden verabreicht werden. Es stehen dafür Ampullen zu 3 mg/3 ml und 1 mg/1 ml zur Verfügung.
Die Infusion sollte abgeschlossen sein, bevor mit der zytostatischen Therapie begonnen wird.
In klinischen Studien war bei der Mehrzahl der Patienten nur eine einzige Dosis nötig, um Nausea und Erbrechen während 24 Stunden zu unterbinden.
Zytostatische Chemotherapie (Therapie)
Intravenös:
Bei einer kleinen Anzahl von Patienten kann ein Durchbruch von Nausea und Erbrechen vorkommen. Wenn nötig, können innerhalb von 24 Stunden bis zu 2 zusätzliche Infusionen zu maximal 3 mg über je 5 Minuten (im Abstand von mindestens 10 Minuten) verabreicht werden.
Die innerhalb von 24 Stunden verabreichte Dosis sollte 9 mg nicht überschreiten.
Radiotherapie (Prophylaxe)
Oral:
1-mal täglich 1 Filmtablette zu 2 mg. Die erste Dosis sollte innerhalb 1 Stunde vor Beginn der Radiotherapie verabreicht werden.
Intravenös:
Es gelten dieselben Dosierungsempfehlungen wie für die Indikation «Zytostatische Chemotherapie (Prophylaxe)».
Radiotherapie (Therapie)
Intravenös:
Bei einer kleinen Anzahl von Patienten kann ein Durchbruch von Nausea und Erbrechen vorkommen. Wenn nötig, können innerhalb von 24 Stunden bis zu 2 zusätzliche Infusionen zu maximal 3 mg über je 5 Minuten (im Abstand von mindestens 10 Minuten) verabreicht werden.
Die innerhalb von 24 Stunden verabreichte Dosis sollte 9 mg nicht überschreiten.
Postoperative Nausea und Erbrechen (Therapie)
Intravenös:
Zur Therapie von postoperativer Nausea und Erbrechen sollte eine Einzeldosis von 1 mg Kytril i.v. langsam verabreicht werden (über 30 Sekunden).
Es bestehen Erfahrungen mit Dosen bis zu 3 mg Kytril i.v. bei Patienten, die einen geplanten chirurgischen Eingriff unter Anästhesie erhielten.
Spezielle Dosierungsanweisungen
Kinder:
Zytostatische Therapie (Prophylaxe)
Intravenös:
Eine Einzeldosis von 20 μg/kg Körpergewicht soll als intravenöse Infusion, verdünnt in 10-30 ml Infusionslösung, 5 Minuten vor der zytostatischen Therapie verabreicht werden.
Zytostatische Therapie (Therapie)
Intravenös:
Bis zu zwei zusätzliche Infusionen von 20 μg/kg Körpergewicht über je 5 Minuten (im Abstand von mindestens 10 Minuten) können verabreicht werden.
Die innerhalb von 24 Stunden verabreichte Dosis sollte 3-mal 20 μg/kg Körpergewicht nicht überschreiten.
Postoperative Nausea und Erbrechen
Bei Kindern bestehen keine Erfahrungen mit der Anwendung von Kytril i.v. oder oral zur Prävention und Therapie von postoperativer Nausea und Erbrechen.
Geriatrie, Leberinsuffizienz, Niereninsuffizienz
Keine Dosisanpassungen notwendig (siehe «Übliche Dosierung bei Erwachsenen»).
Kontraindikationen
Bekannte Überempfindlichkeit gegenüber Granisetron oder einem der Hilfsstoffe gemäss Zusammensetzung. Es gibt Hinweise auf eine mögliche Überempfindlichkeitsreaktion bei Patienten, welche eine Überempfindlichkeitsreaktion auf andere selektive 5-HT3-Rezeptorantagonisten gezeigt haben.
Warnhinweise und Vorsichtsmassnahmen
Patienten mit Anzeichen von subakuter intestinaler Obstruktion sollten nach der Behandlung mit Kytril gut überwacht werden, da Kytril die Motilität des unteren Darmtraktes vermindern kann.
Für ältere Patienten oder für Patienten mit Nieren- oder Leberfunktionsstörungen sind keine speziellen Vorsichtsmassnahmen zu treffen.
Bei gesunden Probanden wurden keine klinisch relevanten Wirkungen auf das Ruhe-EEG oder auf die Leistung in psychometrischen Tests nach intravenöser Verabreichung bei getesteten Dosen (bis zu 200 μg/kg) beobachtet.
Unter Behandlung mit Kytril sind Fälle von EKG-Veränderungen einschliesslich einer QT-Verlängerung aufgetreten. Diese EKG-Auffälligkeiten bei Anwendung von Kytril waren geringfügig und im Allgemeinen klinisch nicht relevant, da sich insbesondere kein Hinweis auf Proarrhythmie ergab. Bei Patienten mit vorbestehenden Arrhythmien oder kardialen Erregungsleitungsstörungen jedoch könnten sich klinische Komplikationen einstellen. Daher ist bei Patienten mit Begleiterkrankungen des Herzens, bei Patienten, die eine kardiotoxische Chemotherapie erhalten und/oder gleichzeitig Elektrolytanomalien aufweisen, Vorsicht geboten. Bei Patienten unter Kytril Behandlung, denen gleichzeitig Arzneimittel verabreicht werden, die bekanntermassen das QT-Intervall verlängern und/oder arrhythmogen sind, könnten sich klinische Komplikationen einstellen.
Es trat Kreuzreaktivität zwischen 5-HT3-Antagonisten auf.
Die Kytril Filmtabletten enthalten Laktose und daher wird die Einnahme von Kytril-Filmtabletten bei Patienten mit seltenen erblichen Problemen einer Galaktoseunverträglichkeit, eines Laktasemangels oder einer Glukose-Galaktose-Malabsorption nicht empfohlen.
Wie bei anderen 5-HT3-Antagonisten wurden auch nach gleichzeitiger Anwendung von Kytril und anderen serotonergen Wirkstoffen über Fälle eines Serotonin-Syndroms (mit Veränderung des Geisteszustands, autonomer Dysfunktion und neuromuskulären Anomalien) berichtet. Falls die gleichzeitige Behandlung mit Granisetron und anderen serotonergen Wirkstoffen klinisch erforderlich ist, wird zu einer angemessenen Überwachung des betreffenden Patienten geraten.
Natrium
Kytril Filmtabletten enthalten weniger als 1 mmol Natrium (23 mg) pro Filmtablette, d.h. sie sind nahezu «natriumfrei».
Kytril Konzentrat zur Herstellung einer Infusionslösung enthält weniger als 1 mmol Natrium (23 mg) pro Ampulle, d.h. es ist nahezu «natriumfrei».
Lactose
Die Filmtabletten enthalten Lactose.
Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-mangel oder Glucose-Galactose Malabsorption sollten dieses Arzneimittel nicht anwenden.
Interaktionen
Die Wirkung von Kytril kann durch eine Einmaldosis Dexamethason i.v. (8-20 mg), verabreicht vor der Chemotherapie, gesteigert werden. In In-vitro-Studien wurde der Metabolismus von Kytril durch Ketoconazol gehemmt. Dies lässt auf eine Beteiligung eines Isoenzyms aus der Familie Cytochrom P450 3A schliessen. Weitere In-vitro-Studien schliessen eine Beteiligung der Untergruppe Cytochrom P450 3A4 mit Bestimmtheit aus.
Es wurden keine spezifischen Interaktions-Studien bei anästhesierten Patienten durchgeführt, doch ist Kytril bei Personen, welche die üblichen Anästhetika und Analgetika erhielten, ohne besondere Probleme angewendet worden.
In-vitro-Studien haben gezeigt, dass das Cytochrom P450 3A4, welches am Metabolismus der gebräuchlichsten Narkotika beteiligt ist, von Kytril nicht beeinflusst wird.
Eine Induktion der Leberenzyme mit Phenobarbital führte bei Probanden zu einer Erhöhung der totalen Plasmaclearance von Kytril i.v. um ungefähr einen Viertel.
Kytril ist ohne besondere Probleme angewendet worden bei Personen, die Benzodiazepine, Neuroleptika oder Anti-Ulcus-Präparate erhielten, welche oft in Verbindung mit Antiemetika verschrieben werden.
Auch wurden keine Interaktionen mit emetogenen Zytostatika beobachtet.
Wie bei anderen 5-HT3-Antagonisten traten auch nach gleichzeitiger Anwendung von Kytril und anderen serotonergen Wirkstoffen Fälle eines Serotonin-Syndroms auf. Falls die gleichzeitige Behandlung mit Granisetron und anderen serotonergen Wirkstoffen klinisch berechtigt ist, wird zu einer angemessenen Überwachung des betreffenden Patienten geraten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Schwangerschaft/Stillzeit
Schwangerschaft
Tierstudien haben keine teratogenen Effekte gezeigt, doch verfügt man über keine Studien bei schwangeren und stillenden Frauen.
Kytril darf während der Schwangerschaft nicht angewendet werden, es sei denn, dies sei eindeutig erforderlich.
Stillzeit
Es liegen keine Daten zum Übergang von Granisetron in die Muttermilch vor. Während einer Behandlung mit Kytril sollte daher nicht gestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es liegen keine Daten über die Auswirkung von Kytril auf die Fahrtüchtigkeit vor. In klinischen Studien gab es gelegentlich Berichte von Schläfrigkeit und dies sollte berücksichtigt werden. Ein Zusammenhang mit Kytril ist nicht erwiesen.
Unerwünschte Wirkungen
Die im Zusammenhang mit Kytril beobachteten unerwünschten Wirkungen waren in den meisten Fällen nicht schwerer Natur und wurden von den Patienten vertragen, so dass die Behandlung nicht abgebrochen werden musste.
Die häufigsten unerwünschten Wirkungen welche mit Kytril beobachtet wurden waren Kopfschmerzen und Obstipation. Diese können vorübergehend sein. EKG-Veränderungen einschliesslich einer QT Verlängerung wurden ebenfalls mit Kytril beobachtet.
Folgende Nebenwirkungen, welche auf klinischen Studien und Erfahrungen nach der Markteinführung beruhen, wurden in Verbindung mit Kytril beobachtet:
Sehr häufig (≥1/10), häufig (>1/100, <1/10), gelegentlich (>1/1000, <1/100, selten (>1/10'000, <1/1'000) und sehr selten (<1/10'000).
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeitsreaktionen (von denen einzelne schwer waren, z.B. Anaphylaxie, Urtikaria).
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (14%).
Gelegentlich: Serotonin-Syndrom.
Herzerkrankungen
Gelegentlich: QT-Verlängerung.
Über einzelne ernste unerwünschte Wirkungen (Blutdruckabfall, Herzrhythmusstörungen) wurde berichtet. Fälle von EKG-Veränderungen einschliesslich einer QT-Verlängerung sind aufgetreten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Obstipation.
Leber- und Gallenerkrankungen
Häufig: Anstieg der Transaminasen (gleiche Häufigkeit wie unter Placebo).
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Hautausschläge, Ödeme/gesichtsbetonte Ödeme.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Gelegentlich: Grippeartige Symptome mit Fieber und Schüttelfrost.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es gibt kein spezifisches Antidot für Kytril.
Im Falle einer Überdosierung soll eine symptomatische Behandlung vorgenommen werden.
Es sind Überdosierungen mit Einzeldosen von mehr als 38 mg Granisetron i.v. vorgekommen. Dabei traten keine Symptome oder nur leichte Kopfschmerzen auf.
Eigenschaften/Wirkungen
ATC-Code
A04AA02
Wirkungsmechanismus
Kytril ist ein selektiver 5-HT3-Rezeptorantagonist.
Bindungsstudien haben gezeigt, dass Kytril eine unbedeutende Affinität zu anderen Rezeptortypen, einschliesslich 5-HT und Dopamin D2-Bindungsstellen, aufweist.
Pharmakodynamik
Kytril hat keine Auswirkung auf die Plasmaspiegel von Prolaktin oder Aldosteron.
Nausea und Erbrechen, hervorgerufen durch Chemotherapie (CINV)
Erwachsene: Intravenös oder oral verabreichtes Kytril erwies sich bei Erwachsenen als wirksam zur Prävention und/oder Behandlung von Nausea und Erbrechen, die mit einer Krebschemotherapie einhergehen.
Kinder ab 2 Jahren: Intravenös verabreichtes Kytril erwies sich bei Kindern ab 2 Jahren als wirksam zur Prävention und Behandlung von akuter Nausea und Erbrechen, die durch eine Chemotherapie hervorgerufen werden. Es liegen nicht genügend Daten vor, um die orale Anwendung von Kytril zur Prävention und Behandlung von Nausea und Erbrechen, hervorgerufen durch eine Chemotherapie, bei pädiatrischen Patienten zu empfehlen.
Nausea und Erbrechen, hervorgerufen durch Strahlentherapie (RINV)
Kytril erwies sich als wirksam zur Prävention und Behandlung von Nausea und Erbrechen, die mit Ganzkörperbestrahlung oder fraktionierter Bestrahlung des Abdomens bei Erwachsenen in Verbindung stehen. Die Wirksamkeit bei Kindern wurde nicht in kontrollierten klinischen Studien untersucht.
Postoperative Nausea und Erbrechen (PONV)
Intravenös verabreichtes Kytril erwies sich als wirksam zur Behandlung von postoperativer Nausea und Erbrechen bei Erwachsenen.
Klinische Wirksamkeit
Eine prospektive, multizentrische, randomisierte, doppelblinde Parallelgruppenstudie untersuchte eine Einzeldosis Granisetron (20 oder 40 μg/kg) bei 157 Kindern im Alter von 2 bis 16 Jahren, die sich einer elektiven Operation unterzogen. Bei den meisten Patienten wurde eine vollständige Kontrolle von postoperativer Nausea und Erbrechen in den ersten 2 Stunden nach der Operation festgestellt.
Pharmakokinetik
Absorption
Granisetron wird nach oraler Einnahme rasch und vollständig resorbiert. Weil Kytril nach oraler Gabe einem First-Pass-Metabolismus unterliegt, ist die absolute Bioverfügbarkeit auf etwa 60% reduziert. Durch Nahrungsaufnahme wird die orale Bioverfügbarkeit im Allgemeinen nicht beeinträchtigt.
Distribution
Granisetron wird im ganzen Körper mit einem mittleren Verteilungsvolumen von 3 l/kg verteilt.
Die Plasmaproteinbindung beträgt etwa 65%.
Metabolismus
Die Biotransformation erfolgt hauptsächlich über eine N-Demethylierung und Oxidation des
aromatischen Ringes mit anschliessender Konjugation.
In In-vitro-Studien wurde der Metabolismus von Kytril durch Ketoconazol gehemmt. Dies lässt auf eine Beteiligung eines Isoenzyms aus der Familie Cytochrom P450 3A schliessen. Weitere Invitro- Studien schliessen eine Beteiligung der Untergruppe Cytochrom P450 3A4 mit Bestimmtheit aus.
Elimination
Die Ausscheidung geschieht hauptsächlich über eine Metabolisierung in der Leber. Granisetron wird zu durchschnittlich 12% unverändert und zu 47% metabolisiert im Urin ausgeschieden. Die restlichen 41% werden über die Faeces als Metaboliten eliminiert.
Oral und intravenös verabreicht, beträgt die Plasmaeliminationshalbwertszeit bei Patienten 9 Stunden, mit einer grossen interindividuellen Variabilität.
Es besteht keine deutliche Korrelation zwischen der Plasmakonzentration von Granisetron und seiner antiemetischen Wirksamkeit. Die therapeutische Wirkung kann noch vorhanden sein, auch wenn Granisetron nicht mehr im Plasma nachweisbar ist.
Die Pharmakokinetik von oral und intravenös verabreichtem Granisetron ist im Wesentlichen linear bis zu einer Dosis, die oral dem 2,5fachen, parenteral dem 4fachen der empfohlenen klinischen Dosis entspricht.
Kinetik spezieller Patientengruppen
Bei älteren Patienten blieben die pharmakokinetischen Parameter nach einer intravenösen Einzeldosis innerhalb des Bereiches jüngerer Patienten.
Bei Patienten mit schwerer Niereninsuffizienz waren die pharmakokinetischen Parameter nach einer intravenösen Einzeldosis im Allgemeinen ähnlich denjenigen gesunder Patienten.
Patienten mit Leberfunktionsstörungen, verursacht durch neoplastische Veränderungen, wiesen eine totale Plasmaclearance der intravenösen Dosis auf, die etwa halb so gross war wie diejenige von Patienten mit intakter Leberfunktion. Trotz diesen Veränderungen ist keine Dosisanpassung notwendig.
Kinetik bei Kindern: Es gibt keinen klinisch wesentlichen Unterschied in der Pharmakokinetik von Granisetron zwischen Erwachsenen und Kindern, wenn Granisetron auf einer Basis von 20 μg/kg Körpergewicht verabreicht wird.
Präklinische Daten
Präklinische Daten liessen auf der Grundlage konventioneller Studien zur sicherheitsrelevanten Pharmakologie, der Toxizität bei mehrmaliger Dosisgabe, der Reproduktionstoxizität und der Genotoxizität keine besondere Gefahr für den Menschen erkennen. Studien zur Karzinogenität liessen bei Anwendung der für den Menschen empfohlenen Dosis keine besondere Gefährdung des Menschen erkennen. Bei Anwendung in höheren Dosen und über längere Zeiträume hinweg kann das Karzinogenitätsrisiko jedoch nicht ausgeschlossen werden.
Eine Studie an geklonten menschlichen kardialen Ionenkanälen hat gezeigt, dass Granisetron das Potenzial besitzt, die kardiale Repolarisation über die Blockade der HERG-Kaliumkanäle zu beeinflussen. Es wurde nachgewiesen, dass Granisetron sowohl die Natrium- als auch die Kaliumkanäle blockiert, was möglicherweise sowohl die Depolarisation als auch die Repolarisation durch Verlängerung der PR-, QRS- und QT-Intervalle beeinflusst. Diese Daten tragen dazu bei, die molekularen Mechanismen zu verstehen, durch die bestimmte EKG-Veränderungen (insbesondere QT- und QRS-Verlängerung) auftreten, die in Zusammenhang mit dieser Substanzklasse stehen. Es kommt jedoch zu keiner Veränderung der Herzfrequenz, des Blutdrucks oder der EKG-Linie. Wenn Veränderungen auftreten, haben sie im Allgemeinen keine klinische Signifikanz.
Toxizität
Bei Ratten und Hunden, die einmal pro Tag über einen Zeitraum von 12 Monaten oral mit Kytril behandelt worden waren, konnte bei Dosen von 5 mg/kg/Tag keine Toxizität beobachtet werden. Zusammenfassend ist festzustellen, dass Kytril bei Dosen von 5 mg/kg/Tag, verabreicht während 12 Monaten, für Ratten und Hunde unschädlich war.
Mutagenität
Kytril erwies sich in in-vivo- und in-vitro-Testsystemen von Säugern und Nicht-Säugern als nichtmutagen;
auch wurde keine aussergewöhnliche DNA-Synthese beobachtet: Diese Befunde zeigen, dass Kytril nicht genotoxisch wirkt.
Kanzerogenität
In 2-Jahres-Kanzerogenitätsstudien wurde nach oraler Verabreichung von 50 mg Granisetron/kg/Tag an Ratten (reduziert auf 25 mg Granisetron/kg/Tag ab der 59. Woche) und Mäusen bei beiderlei Geschlecht eine signifikante Vermehrung hepatozellulärer Tumoren beobachtet. Bei männlichen Ratten war die Zahl hepatozellulärer Tumoren auch nach 5 mg Granisetron/kg/Tag vermehrt. Nach 1 mg Granisetron/kg/Tag war weder bei Ratten noch bei Mäusen im Vergleich zu Kontrollen ein tumorigener Effekt nachweisbar.
Reproduktionstoxizität
Bei Dosierungen mit toxischem Effekt auf trächtige Versuchstiere fand sich kein nachteiliger Effekt auf Verlauf und Ergebnis der Schwangerschaften bei Ratten und Kaninchen. Ähnliche Ergebnisse zeigten sich bei peri- und postnatalen und allgemeinen Fortpflanzungsstudien bei Ratten.
Sonstige Hinweise
Inkompatibilitäten
Als allgemeine Vorsichtsmassnahme soll die Kytril-Infusionslösung nur mit den unter «Hinweise für die Handhabung» aufgeführten Arzneimitteln gemischt werden. Die prophylaktische Anwendung von Kytril soll vor dem Beginn der zytostatischen Behandlung beendet sein.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Aus mikrobiologischer Sicht sollte das verdünnte Produkt sofort verwendet werden. Kytril Konzentrat zur Herstellung einer Infusionslösung ist 24 Stunden (sofern die Verdünnung unter kontrollierten und geprüften aseptischen Bedingungen durchgeführt worden ist) in folgenden Lösungen bei Raumtemperatur (15-25 °C) und normaler Raumbeleuchtung (Tageslicht plus Fluoreszenzlicht) haltbar: 0,9% NaCl; 0,18% NaCl und 4% Dextrose; 5% Dextrose; Ringer- Laktat-Lösung nach Hartmann; Natriumlaktat; Mannitol.
Besondere Lagerungshinweise
Filmtabletten: Nicht über 30 °C lagern.
Ampullen: Bei 15-30 °C lagern. Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Zubereitung der Infusionslösung
Idealerweise sollte die Infusion von Kytril kurz vor der Anwendung zubereitet werden (maximale Aufbewahrungszeiten siehe «Sonstige Hinweise, Haltbarkeit»).
Erwachsene
Zur Zubereitung einer Infusionslösung zu 1 mg resp. 3 mg Granisetron werden 1 resp. 3 ml Kytril- Lösung aus der Ampulle entnommen und mit 20-50 ml einer der folgenden Infusionslösungen verdünnt: 0,9% NaCl; 0,18% NaCl und 4% Dextrose; 5% Dextrose; Ringer-Laktat-Lösung nach Hartmann; Natriumlaktat; Mannitol.
Kinder
Zur Zubereitung einer Dosis von 20 μg/kg Körpergewicht wird das entsprechende Volumen der Kytril-Lösung der Ampulle (es stehen Ampullen zu 1 mg/1 ml zur Verfügung) entnommen und mit einer Infusionslösung (wie für Erwachsene) bis zu einem Gesamtvolumen von 10 bis zu 30 ml verdünnt.
Zulassungsnummer
52354, 51198 (Swissmedic)
Zulassungsinhaberin
Future Health Pharma GmbH, 8620 Wetzikon
Stand der Information
August 2020
Composizione
Principi attivi
Granisetron in forma di granisetron cloridrato
Sostanze ausiliarie
Compresse rivestite con film da 1 mg
Carbossimetilamido sodico (tipo A) (5 mg contengono al massimo 0.21 mg di sodio), cellulosa microcristallina (E 460), ipromellosa, lattosio monoidrato (69.38 mg), macrogol 400 (E 1521), magnesio stearato, polisorbato 80, titanio biossido (E 171) per compressa rivestita con film.
Compresse rivestite con film da 2 mg
Carbossimetilamido sodico (tipo A) (10 mg contengono al massimo 0.42 mg di sodio), cellulosa microcristallina (E 460), ipromellosa, lattosio monoidrato (138.76 mg), macrogol 400 (E 1521), magnesio stearato, polisorbato 80, titanio biossido (E 171) per compressa rivestita con film.
Concentrato per soluzione per infusione 1 mg per 1 ml
Sodio cloruro, acido citrico monoidrato (E 330), acido cloridrico (E 507), sodio idrossido (E 524), acqua per preparazioni iniettabili, per 1 m, equivalenti a 4.19 mg di sodio.
Concentrato per soluzione per infusione 3 mg per 3 ml
Sodio cloruro, acido citrico monoidrato (E 330), acido cloridrico (E 507), sodio idrossido (E 524), acqua per preparazioni iniettabili, per 3 ml, equivalenti a 12.5 mg di sodio.
Forma farmaceutica e quantità di principio attivo per unità
Compresse rivestite con film da 1 mg:
Ogni compressa rivestita con film contiene 1 mg di granisetron in forma di 1.12 mg di granisetron cloridrato.
Compresse rivestite con film da 2 mg:
Ogni compressa rivestita con film contiene 2 mg di granisetron in forma di 2.24 mg di granisetron cloridrato.
Concentrato per soluzione per infusione:
1 mg di granisetron per 1 ml o 3 mg di granisetron per 3 ml.
Indicazioni/Possibilità d'impiego
Chemioterapia citostatica
Per la prevenzione (per via orale o endovenosa) e il trattamento (per via endovenosa) di nausea e vomito indotti da chemioterapia citostatica negli adulti.
Per la prevenzione (per via endovenosa) e il trattamento (per via endovenosa) di nausea e vomito indotti da chemioterapia citostatica nei bambini dai 2 anni di età.
Radioterapia
Per la prevenzione (per via orale o endovenosa) e il trattamento (per via endovenosa) di nausea e vomito indotti da radioterapia negli adulti.
Nausea e vomito post-operatori
Per il trattamento (per via endovenosa) di nausea e vomito post-operatori negli adulti.
Posologia/Impiego
Posologia abituale negli adulti
Chemioterapia citostatica (prevenzione)
Per via orale:
2-volte al giorno 1 compressa rivestita con film da 1 mg o 1 volta al giorno 1 compressa rivestita con film da 2 mg di Kytril durante e fino a una settimana dopo la conclusione della terapia citostatica. La prima dose di Kytril deve essere assunta entro 1 ora prima dell'inizio della terapia citostatica.
Per via endovenosa:
Pazienti di peso corporeo superiore a 50 kg:
1 fiala (3 mg di granisetron per 3 ml) diluita in 20-50 ml di soluzione per infusione, somministrata nell'arco di 5 minuti, prima della terapia citostatica. Questa dose da 3 mg in fiala può anche essere somministrata come iniezione in bolo in 30 secondi.
Pazienti di peso corporeo inferiore a 50 kg:
20-40 μg/kg di peso corporeo; se possibile, somministrare il volume corrispondente di Kytril soluzione diluito in 20-50 ml di soluzione per infusione nell'arco di 5 minuti, prima della terapia citostatica. In alternativa, è possibile somministrare il volume corrispondente di Kytril soluzione anche come iniezione in bolo nel corso di 30 secondi. A questo scopo sono disponibili fiale da 3 mg/3 ml e da 1 mg/1 ml.
L'infusione deve essere conclusa prima dell'inizio della terapia citostatica.
In studi clinici per la maggior parte dei pazienti è stata necessaria una sola dose per sopprimere nausea e vomito per 24 ore.
Chemioterapia citostatica (trattamento)
Per via endovenosa:
In un piccolo numero di pazienti può verificarsi la comparsa di nausea e vomito. Se necessario, nelle 24 ore, è possibile somministrare fino a 2 infusioni supplementari da 3 mg al massimo, nell'arco di 5 minuti (a distanza di almeno 10 minuti l'una dall'altra).
La dose massima che può essere somministrata in 24 ore non deve superare i 9 mg.
Radioterapia (prevenzione)
Per via orale:
1 compressa rivestita con film da 2 mg 1 volta al giorno. La prima dose deve essere somministrata entro 1 ora prima dell'inizio della radioterapia.
Per via endovenosa:
Si applicano le stesse raccomandazioni posologiche fornite per l'indicazione «Chemioterapia citostatica (prevenzione)»".
Radioterapia (trattamento)
Per via endovenosa:
In un piccolo numero di pazienti può verificarsi la comparsa di nausea e vomito. Se necessario, nelle 24 ore, è possibile somministrare fino a 2 infusioni supplementari da 3 mg al massimo, nell'arco di 5 minuti (a distanza di almeno 10 minuti l'una dall'altra).
La dose massima che può essere somministrata in 24 ore non deve superare i 9 mg.
Nausea e vomito post-operatori (trattamento)
Per via endovenosa:
Per il trattamento di nausea e vomito post-operatori somministrare una dose singola da 1 mg di Kytril come iniezione endovenosa lenta (nell'arco di 30 secondi).
Sono noti casi di somministrazioni di dosi fino a 3 mg di Kytril e.v. in pazienti sottoposti a un intervento chirurgico programmato in anestesia.
Istruzioni posologiche speciali
Bambini:
Terapia citostatica (prevenzione)
Per via endovenosa:
Prima della terapia citostatica, somministrare una dose singola di 20 μg/kg di peso corporeo tramite infusione endovenosa, diluita in 10-30 ml di soluzione per infusione, 5 minuti prima dell'inizio della terapia citostatica.
Terapia citostatica (trattamento)
Per via endovenosa:
Possono essere somministrate fino a due infusioni supplementari di 20 μg/kg di peso corporeo, ognuna nell'arco di 5 minuti (a distanza di almeno 10 minuti l'una dall'altra).
La dose massima che può essere somministrata in 24 ore non deve superare 3 somministrazioni da 20 μg/kg di peso corporeo.
Nausea e vomito post-operatori
Nei bambini non sono noti casi di utilizzo di Kytril e.v. o per via orale per la prevenzione e il trattamento di nausea e vomito post-operatori.
Pazienti anziani, insufficienza epatica, insufficienza renale
Non è necessario alcun aggiustamento della dose (vedere «Posologia abituale negli adulti»).
Controindicazioni
Ipersensibilità nota a granisetron o a una delle sostanze ausiliarie indicate nella composizione. Vi sono indicazioni di una possibile reazione di ipersensibilità in pazienti che hanno mostrato questo tipo di reazione ad altri antagonisti dei recettori 5-HT3 selettivi.
Avvertenze e misure precauzionali
I pazienti con sintomi di ostruzione intestinale subacuta devono essere attentamente monitorati dopo il trattamento con Kytril in quanto questo medicamento può ostacolare la motilità del tratto inferiore dell'intestino.
Non sono necessarie misure precauzionali particolari per i pazienti anziani o per pazienti con disturbi della funzionalità epatica o della funzionalità renale.
Dopo somministrazione endovenosa alle dosi testate (fino a 200 μg/kg) in volontari sani non sono stati osservati effetti clinicamente rilevanti sull'EEG a riposo o sulle prestazioni nei test psicometrici.
Nel trattamento con Kytril sono stati osservati casi di modifiche all'ECG incluso prolungamento dell'intervallo QT. Queste anomalie dell'ECG rilevate in concomitanza con l'uso di Kytril sono state limitate e in generale non rilevanti da un punto di vista clinico, in particolare non è stata osservata proaritmia. In pazienti con aritmie o disturbi della conduzione cardiaca preesistenti, tuttavia, potrebbero insorgere complicazioni cliniche. Occorre pertanto usare cautela in pazienti con comorbidità cardiaca, pazienti che ricevono una chemioterapia cardiotossica e/o con alterazioni elettrolitiche concomitanti. In pazienti trattati con Kytril che vengono trattati in concomitanza con medicamenti noti per prolungare l'intervallo QT e/o che provocano aritmie, si possono manifestare gravi complicazioni cliniche.
È stata segnalata sensibilità crociata tra gli antagonisti di 5-HT3.
Le compresse rivestite con film di Kytril contengono lattosio e di conseguenza ne è sconsigliata l'assunzione a pazienti affetti da rari problemi ereditari di intolleranza al galattosio, deficit di lattasi o malassorbimento di glucosio/galattosio.
Come per altri antagonisti dei recettori 5-HT3, anche dopo l'impiego concomitante di Kytril e altre sostanze serotoninergiche sono stati osservati casi di sindrome da serotonina (con alterazioni dello stato mentale, disfunzione autonomica e anomalie neuromuscolari). Qualora sia necessario da un punto di vista clinico somministrare contemporaneamente granisetron e altre sostanze serotoninergiche, si consiglia di sottoporre il paziente a un adeguato monitoraggio.
Sodio
Kytril compresse rivestite con film contiene meno di 1 mmol di sodio (23 mg) per compressa; questo significa che è sostanzialmente «privo di sodio».
Kytril concentrato per soluzione per infusione contiene meno di 1 mmol di sodio (23 mg) per fiala, questo significa che è sostanzialmente «privo di sodio».
Lattosio
Le compresse rivestite con film contengono lattosio.
I pazienti affetti da rari problemi ereditari di intolleranza al galattosio, da deficit totale di lattasi, o da malassorbimento di glucosio-galattosio, non devono assumere questo medicamento.
Interazioni
L'effetto di Kytril può essere potenziato da una singola dose di desametasone e.v. (8-20 mg), somministrata prima della chemioterapia. In studi in vitro è stato osservato che il metabolismo di Kytril viene rallentato da ketoconazolo. Ciò suggerisce il coinvolgimento di un isoenzima della famiglia del citocromo P450 3A. Altri studi in vitro hanno permesso di escludere con certezza un coinvolgimento del sottogruppo del citocromo P450 3A4.
Non sono stati condotti studi specifici di interazione in pazienti anestetizzati, ma Kytril è stato usato senza particolari problemi nelle persone cui sono stati somministrati gli anestetici e gli analgesici abituali.
Studi in vitro hanno permesso di osservare che il citocromo P450 3A4, coinvolto nel metabolismo dei narcotici più usati, non è influenzato da Kytril.
L'induzione degli enzimi epatici con fenobarbital ha causato in soggetti sani un aumento di circa un quarto della clearance plasmatica totale di Kytril e.v.
Kytril è stato utilizzato senza particolari problemi in persone che assumevano benzodiazepine, neurolettici o preparati antiulcera, spesso prescritti in abbinamento con gli antiemetici.
Non sono inoltre state osservate interazioni con citostatici emetogeni.
Come con altri antagonisti 5-HT3, anche dopo l'impiego concomitante di Kytril e altri principi attivi serotoninergici sono comparsi casi di sindrome da serotonina. Qualora sia giustificato da un punto di vista clinico somministrare contemporaneamente granisetron e altre sostanze serotoninergiche, si consiglia di sottoporre il paziente a un adeguato monitoraggio (vedere «Avvertenze e misure precauzionali»).
Gravidanza/Allattamento
Gravidanza
Gli studi sugli animali non hanno mostrato effetti teratogeni, ma non sono disponibili studi su donne in gravidanza e in allattamento.
Kytril non deve essere usato in gravidanza, tranne quando non sia chiaramente necessario.
Allattamento
Non sono disponibili dati sul passaggio del granisetron nel latte materno. Pertanto, durante il trattamento con Kytril è sconsigliabile allattare al seno.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono disponibili dati sull'effetto di Kytril sulla capacità di guidare veicoli. Negli studi clinici è stata occasionalmente segnalata sonnolenza e di questo va tenuto conto. Non è documentata una correlazione con Kytril.
Effetti indesiderati
Gli effetti indesiderati osservati con Kytril sono risultati per la maggior parte non gravi e sono stati tollerati dai pazienti, per cui non è stato necessario interrompere il trattamento.
Gli effetti indesiderati più comuni osservati con Kytril sono stati mal di testa e stipsi. Questi effetti possono essere transitori. Con Kytril sono inoltre state osservate alterazioni dell'ECG, incluso il prolungamento dell'intervallo QT.
In base agli studi clinici e all'esperienza post-marketing, in correlazione con Kytril sono stati osservati i seguenti effetti collaterali:
molto comune (≥1/10), comune (>1/100, <1/10), non comune (>1/1'000, <1/100), raro (>1/10'000, <1/1'000) e molto raro (<1/10'000).
Patologie del sistema immunitario
Non comune: reazioni di ipersensibilità (di cui alcune severe, es. anafilassi, orticaria).
Patologie del sistema nervoso
Molto comune: mal di testa (14%).
Non comune: sindrome da serotonina.
Patologie cardiache
Non comune: prolungamento dell'intervallo QT.
Sono stati segnalati singoli effetti indesiderati severi (caduta della pressione arteriosa, aritmie cardiache). Sono comparsi casi di alterazioni ECG, tra cui un prolungamento dell'intervallo QT (vedere «Avvertenze e misure precauzionali»).
Patologie gastrointestinali
Molto comune: stipsi.
Patologie del fegato e delle vie biliari
Comune: aumento delle transaminasi (stessa frequenza con il placebo).
Patologie della cute e del tessuto sottocutaneo
Non comune: eruzioni cutanee, edemi/edemi pronunciati sul viso.
Disturbi generici e disturbi nel sito di iniezione
Non comune: sintomi simil-influenzali con febbre e brividi.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-benefico del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Non esistono antidoti specifici per Kytril.
In caso di sovradosaggio, deve essere praticato un trattamento sintomatico.
Sono comparsi sovradosaggi con dosi singole di oltre 38 mg di granisetron e.v. Non sono comparsi sintomi o solo lieve mal di testa.
Proprietà/Effetti
Codice ATC
A04AA02
Meccanismo d'azione
Kytril è un antagonista selettivo dei recettori 5-HT3.
Gli studi di legame hanno dimostrato che Kytril ha un'affinità non significativa con altri tipi di recettori, tra cui 5-HT e dopamina D2.
Farmacodinamica
Kytril non ha alcun effetto sui livelli plasmatici della prolattina o dell'aldosterone.
Nausea e vomito causati dalla chemioterapia (CINV)
Adulti: somministrato per via endovenosa o per via orale, Kytril si è dimostrato efficace negli adulti per la prevenzione e/o il trattamento di nausea e vomito associati alla chemioterapia del cancro.
Bambini dai 2 anni d'età: somministrato per via endovenosa, Kytril si è dimostrato efficace nei bambini dai 2 anni d'età per la prevenzione e il trattamento di nausea e vomito acuti associati alla chemioterapia del cancro. Non sono disponibili dati sufficienti per consigliare l'uso orale di Kytril per la prevenzione e il trattamento di nausea e vomito indotti da chemioterapia in pazienti pediatrici.
Nausea e vomito causati dalla radioterapia (RINV)
Kytril si è dimostrato efficace nella prevenzione e nel trattamento di nausea e vomito associati all'irradiazione di tutto il corpo o all'irradiazione frazionata dell'addome negli adulti. L'efficacia nei bambini non è stata indagata in studi clinici controllati.
Nausea e vomito post-operatori (PONV)
Somministrato per via endovenosa, Kytril si è dimostrato efficace nel trattamento della nausea e del vomito post-operatori negli adulti.
Efficacia clinica
Uno studio prospettico a gruppi paralleli, multicentrico, randomizzato e in doppio cieco ha esaminato una singola dose di granisetron (20 o 40 µg/kg) in 157 bambini di età compresa tra i 2 e i 16 anni sottoposti a chirurgia elettiva. Nella maggior parte dei pazienti, è stato rilevato un controllo completo della nausea e del vomito post-operatori nelle prime 2 ore dopo l'intervento chirurgico.
Farmacocinetica
Assorbimento
Granisetron viene assorbito rapidamente e completamente dopo l'assunzione orale. Poiché, dopo la somministrazione orale, Kytril subisce un metabolismo di primo passaggio, la biodisponibilità assoluta si riduce fino a circa il 60%. La biodisponibilità orale generalmente non viene modificata dall'assunzione di cibo.
Distribuzione
Granisetron si distribuisce in tutto il corpo con un volume medio di distribuzione di 3 l/kg.
Il legame alle proteine plasmatiche è di circa il 65%.
Metabolismo
La biotrasformazione avviene principalmente attraverso una n-demetilazione e ossidazione
dell'anello aromatico con successiva coniugazione.
In studi in vitro è stato osservato che il metabolismo di Kytril viene rallentato da ketoconazolo. Ciò suggerisce il coinvolgimento di un isoenzima della famiglia del citocromo P450 3A. Altri studi in vitro hanno permesso di escludere con certezza un coinvolgimento del sottogruppo del citocromo P450 3A4.
Eliminazione
L'eliminazione avviene principalmente attraverso una metabolizzazione nel fegato. Granisetron viene eliminato in media per il 12% immodificato e per il 47% metabolizzato nelle urine. Il rimanente 41% viene eliminato come metaboliti attraverso le feci.
Somministrato per via orale ed endovenosa, l'emivita di eliminazione plasmatica nei pazienti è di 9 ore, con un'elevata variabilità fra gli individui.
Non esiste alcuna chiara correlazione tra la concentrazione plasmatica di granisetron e la sua efficacia antiemetica. L'effetto terapeutico può essere ancora presente anche quando granisetron non è più rilevabile nel plasma.
La farmacocinetica di granisetron somministrato per via orale ed endovenosa è essenzialmente lineare fino a una dose corrispondente per via orale a 2,5 volte, per via parenterale a 4 volte la dose clinica raccomandata.
Cinetica di gruppi di pazienti speciali
Nei pazienti anziani, i parametri farmacocinetici sono rimasti, dopo una singola dose endovenosa, all'interno dell'ambito dei pazienti più giovani.
Nei pazienti con grave insufficienza renale, i parametri farmacocinetici dopo una singola dose endovenosa erano in generale simili a quelli dei pazienti senza insufficienza renale.
I pazienti con disfunzioni epatiche causate da alterazioni neoplastiche hanno presentato una clearance plasmatica totale della dose endovenosa di circa la metà di quella dei pazienti con funzione epatica integra. Nonostante queste alterazioni, non è necessario alcun aggiustamento della dose.
Cinetica nei bambini: non vi è alcuna differenza clinicamente significativa nella farmacocinetica di granisetron tra adulti e bambini, quando granisetron viene somministrato sulla base di 20 µg/kg di peso corporeo.
Dati preclinici
I dati preclinici non hanno indotto a rilevare particolari rischi per l'uomo, sulla base di studi convenzionali di sicurezza farmacologica, tossicità a dosi ripetute, tossicità riproduttiva e genotossicità. Gli studi di cancerogenicità non hanno identificato particolari rischi per l'uomo, quando granisetron viene usato alla dose raccomandata per l'uomo. Tuttavia, quando somministrato a dosi più elevate e per periodi di tempo prolungati, il rischio di cancerogenicità non può essere escluso.
Uno studio su canali ionici cardiaci umani clonati ha dimostrato che granisetron può influenzare la ripolarizzazione cardiaca attraverso il blocco dei canali del potassio HERG. È stato dimostrato che granisetron può bloccare sia i canali del sodio che quelli del potassio, e questo presumibilmente influenza la depolarizzazione e la ripolarizzazione attraverso il prolungamento degli intervalli PR, QRS e QT. Questi dati contribuiscono a chiarire il meccanismo molecolare attraverso il quale possono comparire determinate alterazioni ECG (in particolare il prolungamento degli intervalli QT e QRS) associate a questa classe di sostanze. In ogni caso, non compaiono alterazioni della frequenza cardiaca, della pressione arteriosa o del tracciato ECG. Se compaiono delle alterazioni, queste sono generalmente prive di significato clinico.
Tossicità
Non si è osservata tossicità a dosi di 5 mg/kg/giorno nel ratto e nel cane trattati per via orale con Kytril una volta al giorno per 12 mesi. In sintesi, Kytril non è risultato dannoso nel ratto e nel cane a dosi di 5 mg/kg/giorno somministrate per 12 mesi.
Mutagenicità
Kytril si è dimostrato non mutageno ai sistemi di test in vivo e in vitro di mammiferi e non mammiferi;
inoltre, non si è osservata sintesi anomala di DNA: questi risultati mostrano che Kytril non ha un effetto genotossico.
Cancerogenicità
In studi di cancerogenicità a 2 anni, si è osservato un aumento significativo dei tumori epatocellulari dopo la somministrazione orale di 50 mg di granisetron/kg/giorno nel ratto (ridotta a 25 mg di granisetron/kg/giorno dalla 59a settimana) e nel topo in entrambi i sessi. Nel ratto maschio, il numero di tumori epatocellulari era aumentato anche dopo 5 mg di granisetron/kg/giorno. Dopo 1 mg di granisetron/kg/giorno, non si è documentato alcun effetto tumorigeno nel ratto o nel topo rispetto ai controlli.
Tossicità riproduttiva
A dosaggi con effetto tossico sugli animali in gravidanza, non si è osservato alcun effetto negativo sul decorso e sull'esito delle gravidanze nel ratto e nel coniglio. Risultati simili sono stati messi in evidenza negli studi peri e post-natali e negli studi sulla riproduzione in generale nel ratto.
Altre indicazioni
Incompatibilità
Come misura di sicurezza generale, la soluzione per infusione Kytril può essere somministrata soltanto in combinazione con i medicamenti riportati alla voce «Indicazioni per la manipolazione». L'uso preventivo di Kytril deve essere interrotto prima dell'inizio del trattamento citostatico.
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Per ragioni microbiologiche, il prodotto diluito deve essere utilizzato immediatamente. Kytril concentrato per preparazione di soluzione per infusione può essere conservato per 24 ore (a condizione che la diluizione sia avvenuta in condizioni controllate e asettiche verificate) nelle soluzioni seguenti a temperatura ambiente (15-25 °C) e in condizioni di illuminazione normale (luce del giorno e luce fluorescente): NaCl allo 0,9%; NaCl allo 0,18% e destrosio al 4%; destrosio al 5%; soluzione di Ringer lattato secondo Hartmann; sodio lattato; mannitolo.
Indicazioni particolari concernenti l'immagazzinamento
Compresse rivestite con film: Non conservare a temperature superiori a 30 °C.
Fiale: Conservare a 15-30 °C. Conservare il contenitore nella scatola originale per proteggere il contenuto dalla luce.
Conservare fuori dalla portata dei bambini.
Indicazioni per la manipolazione
Preparazione dell'infusione
Idealmente, l'infusione di Kytril dovrebbe essere preparata appena prima dell'utilizzo (per la durata massima di conservazione vedere «Altre indicazioni, Stabilità»).
Adulti
Per preparare una soluzione per infusione da 1 mg o da 3 mg di granisetron, prelevare dalla fiala rispettivamente 1 o 3 ml di Kytril soluzione e diluirli con 20-50 ml di una delle soluzioni per infusione seguenti: NaCl allo 0,9%; NaCl allo 0,18% e destrosio al 4%; destrosio al 5%; soluzione di Ringer lattato secondo Hartmann; sodio lattato; mannitolo.
Bambini
Per preparare una dose da 20 μg/kg di peso corporeo, prelevare dalla fiala (sono disponibili fiale da 1 mg/1 ml) il volume corrispondente di Kytril soluzione e diluirlo con una soluzione per infusione (come per gli adulti) fino a raggiungere un volume totale di 10 - 30 ml.
Numero dell'omologazione
52354, 51198 (Swissmedic)
Titolare dell’omologazione
Future Health Pharma GmbH, 8620 Wetzikon
Stato dell'informazione
Agosto 2020
Composition
Principes actifs
Granisétron sous forme de chlorhydrate de granisétron
Excipients
Comprimés pelliculés à 1 mg
Carboxyméthylamidon sodique (type A) (5 mg contenant max. 0.21 mg sodium), cellulose microcristalline (E 460), hypromellose, lactose monohydrate (69.38 mg), macrogol 400 (E 1521), stéarate de magnésium, polysorabte 80, dioxyde de titane (E171), par comprimé pelliculé.
Comprimés pelliculés à 2 mg
Carboxyméthylamidon sodique (type A) (10 mg contenant max. 0.42 mg sodium), cellulose microcristalline (E 460), hypromellose, lactose monohydrate (138.76 mg), macrogol 400 (E 1521), stéarate de magnésium, polysorabte 80, dioxyde de titane (E171), par comprimé pelliculé.
Solution à diluer pour perfusion 1 mg par 1 ml:
Chlorure de sodium, acide citrique monohydraté (E 330), acide chlorhydrique (E 507), hydroxyde de sodium (E 524), eau pour préparations injectables, par 1 ml, correspondant à 4.19 mg de sodium.
Solution à diluer pour perfusion 3 mg par 3 ml:
Chlorure de sodium, acide citrique monohydraté (E 330), acide chlorhydrique (E 507), hydroxyde de sodium (E 524), eau pour préparations injectables, par 3 ml, correspondant à 12.5 mg de sodium.
Forme pharmaceutique et quantité de principe actif par unité
Comprimés pelliculés à 1 mg:
Chaque comprimé pelliculé contient 1 mg granisétron correspondant à 1.12 mg de chlorhydrate de granisétron.
Comprimés pelliculés à 2 mg:
Chaque comprimé pelliculé contient 1 mg granisétron correspondant à 2.24 mg de chlorhydrate de granisétron.
Solution à diluer pour perfusion:
1 mg de granisétron pour 1 ml ou 3 mg de granisétron pour 3 ml.
Indications/Possibilités d’emploi
Chimiothérapie cytostatique
Chez l'adulte, pour la prévention (orale, intraveineuse) et le traitement (intraveineux) des nausées et des vomissements provoqués par une chimiothérapie cytostatique.
Chez l'enfant dès 2 ans, pour la prévention (intraveineuse) et le traitement (intraveineux) des nausées et des vomissements provoqués par une chimiothérapie cytostatique.
Radiothérapie
Chez l'adulte, pour la prévention (orale, intraveineuse) et le traitement (intraveineux) des nausées et des vomissements provoqués par une radiothérapie.
Nausées et vomissements postopératoires
Chez l'adulte, pour le traitement (intraveineux) des nausées et des vomissements postopératoires.
Posologie/Mode d’emploi
Posologie usuelle chez l'adulte
Chimiothérapie cytostatique (prévention)
Voie orale:
1 comprimé pelliculé de Kytril à 1 mg deux fois par jour ou 1 comprimé pelliculé à 2 mg une fois par jour pendant et jusqu'à une semaine après la fin de la chimiothérapie cytostatique. La première dose de Kytril doit être pris dans l'heure précédant le début du traitement anticancéreux.
Voie intraveineuse:
Patients de plus de 50 kg: administrer le contenu d'une ampoule (3 mg de granisétron pour 3 ml) dilué dans 20–50 ml de soluté pour perfusion en l'espace de cinq minutes, avant la chimiothérapie cytostatique. Cette dose de 3 mg en ampoule peut également être administrée en bolus, en 30 secondes.
Patients de moins de 50 kg: 20–40 µg/kg de poids corporel; administrer de préférence le volume correspondant de la solution de Kytril dilué dans 20–50 ml de soluté pour perfusion en l'espace de cinq minutes, avant la chimiothérapie cytostatique. Le volume correspondant de la solution de Kytril peut également être administrée en bolus, en 30 secondes. Il existe à cet effet des ampoules à 3 mg/3 ml et à 1 mg/1 ml.
La perfusion doit être achevée avant le début du traitement cytostatique.
Dans des études cliniques, une seule dose était suffisante pour prévenir les nausées et vomissements pendant 24 heures chez la plupart des patients.
Chimiothérapie cytostatique (traitement)
Voie intraveineuse:
Chez un nombre limité de patients, un épisode de nausées et de vomissements peut malgré tout survenir. Au besoin, il est possible d'administrer, sur une période de 24 heures, jusqu'à 2 perfusions supplémentaires de 3 mg au maximum, à chaque fois en l'espace de 5 minutes (respecter un intervalle d'au moins 10 minutes).
La dose administrée en l'espace de 24 heures ne doit pas dépasser 9 mg.
Radiothérapie (prévention)
Voie orale:
1 comprimé pelliculé à 2 mg une fois par jour. La première dose doit être prise dans l'heure précédant le début de la radiothérapie.
Voie intraveineuse:
Mêmes recommandations posologiques que pour l'indication «Chimiothérapie cytostatique (prévention)».
Radiothérapie (traitement)
Voie intraveineuse:
Chez un nombre limité de patients, un épisode de nausées et de vomissements peut malgré tout survenir. Au besoin, il est possible d'administrer, sur une période de 24 heures, jusqu'à 2 perfusions supplémentaires de 3 mg au maximum, à chaque fois en l'espace de 5 minutes (respecter un intervalle d'au moins 10 minutes).
La dose administrée en l'espace de 24 heures ne doit pas dépasser 9 mg.
Nausées et vomissements postopératoires (traitement)
Voie intraveineuse:
Pour le traitement des nausées et vomissements postopératoires, il convient d'administrer une dose unique de 1 mg de Kytril en injection intraveineuse lente (au moins 30 secondes).
Des doses allant jusqu'à 3 mg de Kytril par voie intraveineuse ont été administrées à des patients devant subir une intervention chirurgicale programmée sous anesthésie.
Instructions posologiques particulières
Enfants
Chimiothérapie cytostatique (prévention)
Voie intraveineuse:
Administrer une dose unique de 20 µg/kg de poids corporel en perfusion intraveineuse cinq minutes avant le traitement cytostatique, après dilution dans 10–30 ml de soluté pour perfusion.
Chimiothérapie cytostatique (traitement)
Voie intraveineuse:
Au besoin, il est possible d'administrer jusqu'à deux perfusions supplémentaires de 20 µg/kg de poids corporel, à chaque fois en l'espace de 5 minutes (respecter un intervalle d'au moins 10 minutes).
La dose administrée en l'espace de 24 heures ne doit pas dépasser trois fois 20 µg/kg de poids corporel.
Nausées et vomissements postopératoires
On ne dispose d'aucune expérience en pédiatrie pour ce qui concerne l'administration de Kytril par voie intraveineuse ou orale dans la prévention et le traitement des nausées et vomissements postopératoires.
Gériatrie, insuffisants hépatiques et rénaux
Une adaptation de la posologie n'est pas nécessaire (voir «Posologie usuelle chez l'adulte»).
Contre-indications
Hypersensibilité connue au granisétron ou à l'un des excipients conformément à la composition.
Il existe des indices évocateurs de réactions d'hypersensibilité chez des patients ayant présenté une hypersensibilité à d'autres antagonistes sélectifs des récepteurs 5-HT3.
Mises en garde et précautions
Les patients présentant des signes d'occlusion intestinale subaiguë doivent être étroitement surveillés après le traitement par Kytril, car Kytril peut diminuer la motilité du tractus intestinal inférieur.
Il n'y a pas de précautions particulières à respecter chez les patients âgés ou présentant des troubles de la fonction rénale ou hépatique.
Chez des sujets sains, l'administration intraveineuse de doses allant jusqu'à 200 µg/kg n'a pas eu d'effets cliniquement significatifs sur l'EEG au repos ou sur les résultats des tests psychométriques.
Des cas de modifications de l'ECG, y compris une prolongation de l'intervalle QT, ont été rapportés sous traitement par Kytril. Les troubles de l'ECG observés lors de l'utilisation de Kytril étaient bénins et en général sans signification clinique, puisqu'aucun signe de pro-arythmie n'a été constaté en particulier. Toutefois, des complications d'ordre clinique pourraient survenir chez les patients ayant des antécédents d'arythmie ou de troubles de la conduction cardiaque. Aussi la prudence est de rigueur chez les patients souffrant de maladies concomitantes cardiaques, chez les patients placés sous chimiothérapie pouvant provoquer des effets cardiotoxiques et/ou qui présentent simultanément des perturbations électrolytiques. Des complications cliniques risquent également d'apparaître chez les patients sous Kytril recevant de façon concomitante un traitement médicamenteux connu pour provoquer une prolongation de l'intervalle QT et/ou des arythmies.
Des cas de sensibilité croisée entre antagonistes des récepteurs 5-HT3 ont été rapportés.
Les comprimés pelliculés Kytril contiennent du lactose, c'est pourquoi ce médicament ne doit pas être administré chez les patients atteints de troubles héréditaires rares tels que l'intolérance au galactose, le déficit en lactase ou le syndrome de malabsorption du glucose-galactase.
Comme avec d'autres antagonistes 5-HT3, des cas de syndrome sérotoninergique (avec altération de l'état mental, dysfonctionnement du système nerveux autonome et anomalies neuromusculaires) ont également été rapportés après l'utilisation concomitante de Kytril et d'autres substances sérotoninergiques. S'il est justifié sur le plan clinique de recourir à un traitement concomitant par granisétron et d'autres substances sérotoninergiques, une surveillance appropriée du patient est conseillée.
Sodium
Kytril compirmés pelliculés contiennent moins de 1 mmol (23 mg) de sodium par comprimé pelliculé, c.-à-d. qu'ils sont essentiellement «sans sodium».
Kytril solution à diluer pour perfusion contient moins de 1 mmol (23 mg) de sodium par ampoule, c.-à-d. qu'il est essentiellement «sans sodium».
Lactose
Les comprimés pelliculés contiennent du lactose.
Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Interactions
L'administration intraveineuse d'une dose unique de dexaméthasone (8–20 mg) avant la chimiothérapie peut renforcer l'effet de Kytril. Dans des études menées in vitro, le kétoconazole a inhibé le métabolisme de Kytril. Cette observation permet de conclure à l'intervention d'une isoenzyme de la famille du cytochrome P450 3A. D'autres études menées in vitro excluent formellement une intervention du sous-groupe que constitue le cytochrome P450 3A4.
Aucune étude spécifique des interactions n'a été menée en ce qui concerne les patients anesthésiés; cela étant, Kytril a été administré sans problèmes particuliers à des personnes sous anesthésiques et analgésiques courants.
Des tests in vitro ont montré que le cytochrome P450 3A4, qui participe au métabolisme des narcotiques les plus employés, ne subit aucune influence de la part de Kytril.
Chez des sujets sains, une induction des enzymes hépatiques par du phénobarbital a entraîné une augmentation d'environ un quart de la clairance plasmatique totale de Kytril administré par voie intraveineuse.
Kytril a été utilisé sans problèmes particuliers chez des patients recevant des benzodiazépines, des neuroleptiques ou des produits antiulcéreux, qui sont souvent prescrits en même temps que des antiémétiques.
Il n'a pas non plus été observé d'interactions avec des cytostatiques émétisants.
Comme avec d'autres antagonistes 5-HT3, des cas de syndrome sérotoninergique ont également été rapportés après l'utilisation concomitante de Kytril et d'autres substances sérotoninergiques. S'il est justifié sur le plan clinique de recourir à un traitement concomitant par granisétron et d'autres substances sérotoninergiques, une surveillance appropriée du patient est conseillée (voir «Mises en garde et précautions»).
Grossesse/Allaitement
Grossesse
Des études chez l'animal n'ont pas montré d'effets tératogènes, mais il n'existe pas d'études menées chez la femme pendant la grossesse et l'allaitement.
À moins que ce ne soit clairement nécessaire, Kytril ne doit donc pas être utilisé pendant la grossesse.
Allaitement
Il n'existe aucune donnée relative au passage du granisétron dans le lait maternel. Pendant un traitement par Kytril, il convient donc de ne pas allaiter.
Effet sur l’aptitude à la conduite et l’utilisation de machines
On ne dispose d'aucune donnée sur les répercussions de Kytril sur l'aptitude à la conduite. Lors des études cliniques, des rapports occasionnels ont fait état de somnolence, ce dont il faut tenir compte. Il n'existe pas de relation attestée avec Kytril.
Effets indésirables
Les effets indésirables observés avec Kytril n'étaient le plus souvent pas sévères et ont été tolérés par les patients, de sorte qu'il n'a pas été nécessaire d'interrompre le traitement.
Les effets indésirables les plus fréquemment rapportés avec Kytril sont les céphalées et la constipation pouvant être transitoires. Des modifications de l'ECG, dont l'allongement du QT, ont été également rapportées avec Kytril.
Les effets indésirables suivants, reposant sur des essais cliniques et des données post-commercialisation, ont été observés en rapport avec Kytril:
Très fréquents (≥1/10), fréquents (>1/100, <1/10), occasionnels (>1/1'000, <1/100, rares (>1/10'000, <1/1000) et très rares (<1/10'000).
Affections du système immunitaire
Occasionnels: réactions d'hypersensibilité (dont certaines étaient sévères, p.ex. choc anaphylactique, urticaire).
Affections du système nerveux
Très fréquents: céphalées (14%).
Occasionnels: syndrome sérotoninergique.
Affections cardiaques
Occasionnels: allongement du QT.
Des effets indésirables sérieux (baisse de la pression artérielle, troubles du rythme cardiaque) ont été signalés dans des cas isolés. On a rapporté des modifications de l'ECG, y compris une prolongation de l'intervalle QT (voir «Mises en garde et précautions»).
Affections gastro-intestinales
Très fréquents: constipation.
Affections hépatobiliaires
Fréquents: élévation passagère des transaminases (même fréquence que sous placebo).
Affections de la peau et du tissu sous-cutané
Occasionnels: éruptions cutanées, œdèmes/œdèmes à prédominance faciale.
Troubles généraux et anomalies au site d'administration
Occasionnels: symptômes pseudo-grippaux avec fièvre et frissons.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Il n'existe pas d'antidote spécifique de Kytril.
En cas de surdosage, mettre en œuvre un traitement symptomatique.
Des cas de surdosage i.v. avec des doses uniques de plus de 38 mg de granisétron se sont produits. Aucun symptôme n'a été observé, hormis de légères céphalées.
Propriétés/Effets
Code ATC
A04AA02
Mécanisme d'action
Kytril est un antagoniste sélectif des récepteurs 5-HT3.
Des études spécifiques ont montré que Kytril n'avait qu'une affinité négligeable pour d'autres types de récepteurs, y compris les autres récepteurs de la sérotonine et les récepteurs D2 de la dopamine.
Pharmacodynamique
Kytril n'influe pas sur les taux plasmatiques de prolactine ou d'aldostérone.
Nausées et vomissements induits par une chimiothérapie (NVIC)
Adultes: Kytril administré par voie intraveineuse ou orale s'est montré efficace dans la prévention et/ou le traitement des nausées et des vomissements associés à une chimiothérapie contre le cancer.
Enfants dès 2 ans: chez les enfants à partir de 2 ans, Kytril administré par voie intraveineuse s'est montré efficace dans la prévention et le traitement des nausées et des vomissements aigus induits par une chimiothérapie. On ne dispose pas de données suffisantes pour recommander l'administration par voie orale de Kytril dans la prévention et le traitement des nausées et des vomissements induits par une chimiothérapie chez les patients pédiatriques.
Nausées et vomissements induits par une radiothérapie (NVIR)
Kytril s'est montré efficace dans la prévention et le traitement des nausées et des vomissements associés à une radiothérapie corporelle totale ou une radiothérapie abdominale fractionnée chez l'adulte. Chez l'enfant, l'efficacité n'a pas été analysée dans le cadre d'études cliniques contrôlées.
Nausées et vomissements postopératoires (NVPO)
Kytril administré par voie intraveineuse s'est montré efficace dans le traitement des nausées et des vomissements postopératoires chez l'adulte.
Efficacité clinique
Une étude multicentrique prospective, randomisée, réalisée en double aveugle sur des groupes parallèles, a évalué une dose unique de granisétron (20 ou 40 µg/kg) chez 157 enfants âgés de 2 à 16 ans devant subir une intervention chirurgicale élective. Les nausées et vomissements postopératoires ont été parfaitement contrôlés pendant les deux premières heures suivant l'intervention chez la plupart des patients.
Pharmacocinétique
Absorption
Après prise orale, le granisétron est rapidement et totalement absorbé. Comme Kytril est soumis à un métabolisme de premier passage après administration orale, sa biodisponibilité absolue est réduite à environ 60%. En général, la biodisponibilité orale n'est pas perturbée par la consommation d'aliments.
Distribution
Le granisétron est distribué dans tout l'organisme, avec un volume de distribution moyen de 3 l/kg.
Son taux de liaison aux protéines plasmatiques est d'environ 65%.
Métabolisme
La biotransformation repose essentiellement sur une N-déméthylation et une oxydation du noyau aromatique, avec conjugaison ultérieure.
Dans des études menées in vitro, le kétoconazole a inhibé le métabolisme de Kytril. Cette observation permet de conclure à l'intervention d'une isoenzyme de la famille du cytochrome P450 3A. D'autres études menées in vitro excluent formellement une intervention du sous-groupe que constitue le cytochrome P450 3A4.
Élimination
L'élimination se fait essentiellement par métabolisme dans le foie. Le granisétron est excrété dans l'urine, sous forme inchangée à hauteur de 12% (en moyenne) et sous forme métabolisée à hauteur de 47%. Les 41% restants sont excrétés dans les selles sous forme de métabolites.
Chez les patients, la demi-vie d'élimination plasmatique est de 9 heures après administration orale ou intraveineuse, avec une importante variabilité interindividuelle.
Il n'y a pas de corrélation nette entre la concentration plasmatique du granisétron et son efficacité antiémétique. L'effet thérapeutique peut persister alors que le granisétron n'est plus décelable dans le plasma.
Après administration orale et intraveineuse, la pharmacocinétique du granisétron est pratiquement linéaire jusqu'à une dose représentant 2,5 fois (par voie orale) et 4 fois (par voie parentérale) la dose recommandée en clinique.
Cinétique pour certains groupes de patients
Chez des patients âgés, les paramètres pharmacocinétiques enregistrés après administration intraveineuse unique ont été comparables à ceux de patients plus jeunes.
Chez des patients atteints d'insuffisance rénale sévère, les paramètres pharmacocinétiques enregistrés après administration intraveineuse unique ont été en général comparables à ceux de patients sains.
Chez des patients présentant des troubles de la fonction hépatique d'origine néoplasique, la clairance plasmatique totale de la dose intraveineuse représentait environ la moitié de celle observée chez des patients dont la fonction hépatique était normale. Malgré ces modifications, un ajustement posologique n'est pas nécessaire.
Pharmacocinétique chez l'enfant: il n'existe pas de différence cliniquement notable entre l'adulte et l'enfant sur le plan de la pharmacocinétique du granisétron lorsque ce dernier est utilisé à raison de 20 µg/kg de poids corporel.
Données précliniques
Les données précliniques n'ont révélé aucun risque particulier pour l'homme, sur la base d'études conventionnelles de sécurité pharmacologique, de toxicité à doses répétées, de toxicité sur la reproduction et de génotoxicité. Les études de carcinogénicité n'ont révélé aucun risque particulier pour l'homme lorsque la dose recommandée chez l'homme est utilisée. Cependant, en cas d'administration de doses supérieures et sur une période prolongée, le risque de carcinogénicité ne peut être exclu.
Une étude sur des canaux ioniques de clones cardiaques humains a montré que le granisétron avait le potentiel d'affecter la repolarisation cardiaque en bloquant les canaux potassiques HERG. Il a été montré que le granisétron bloquait à la fois les canaux sodiques et potassiques, ce qui potentiellement affecte la dépolarisation et repolarisation par allongement des intervalles PR, QRS et QT. Ces données permettent de mieux appréhender les mécanismes moléculaires associés à cette classe pharmacologique entraînant l'apparition de modifications de l'ECG (en particulier allongement du QT et du QRS). Cependant, il n'y a pas de modification de la fréquence cardiaque, de la pression sanguine ou du tracé de l'ECG. Si des modifications apparaissent, elles sont en général sans retentissement clinique.
Toxicité
Chez des rats et des chiens traités pendant douze mois par une dose orale quotidienne de Kytril, il n'a été observé aucun effet toxique à des doses de 5 mg/kg/jour. En résumé, utilisé pendant douze mois à des doses 5 mg/kg/jour, Kytril n'a pas eu d'effets néfastes chez le rat et le chien.
Mutagénicité
Les études de mutagénicité menées in vivo et in vitro sur des mammifères et non-mammifères n'ont pas montré d'effets mutagènes de Kytril et l'on n'a pas non plus observé d'anomalies de la synthèse de l'ADN: ces données montrent que le Kytril n'est pas génotoxique.
Cancérogénicité
Lors d'études de cancérogénicité sur deux ans, une augmentation significative des tumeurs hépatocellulaires a été observée chez des rats et des souris des deux sexes après administration orale de 50 mg de granisétron par kg et par jour (ramenée à 25 mg de granisétron par kg et par jour chez le rat à partir de la 59e semaine). Chez des rats mâles, le nombre de tumeurs hépatocellulaires après administration de 5 mg de granisétron par kg et par jour était également accru. Après administration de 1 mg de granisétron par kg et par jour, il n'a été observé d'effet tumorigène ni chez le rat ni chez la souris par rapport à des animaux témoins.
Toxicité sur la reproduction
À des posologies ayant un effet toxique sur des animaux de laboratoire gravides, il n'a été observé aucun effet néfaste sur le déroulement et l'issue de la gestation chez le rat et le lapin. Des résultats similaires ont été recensés lors d'études de reproduction générales, périnatales et postnatales chez le rat.
Remarques particulières
Incompatibilités
Par mesure générale de précaution, la solution de Kytril pour perfusion ne doit être mélangée qu'aux médicaments mentionnés sous «Remarques concernant la manipulation». L'utilisation préventive de Kytril doit être achevée avant le début du traitement cytostatique.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
D'un point de vue microbiologique, la préparation diluée doit être utilisée immédiatement. La solution de Kytril à diluer pour perfusion se conserve 24 heures (dans la mesure où la dilution a été effectuée dans des conditions aseptiques contrôlées et validées) dans les solutés suivants à température ambiante (15–25 °C) et sous un éclairage normal (lumière du jour plus lumière fluorescente): NaCl à 0,9%; NaCl à 0,18% et dextrose à 4%; dextrose à 5%; soluté de Ringer-lactate de Hartmann; lactate de sodium; mannitol.
Remarques particulières concernant le stockage
Comprimés pelliculés: ne pas conserver au-dessus de 30 °C.
Ampoules: Conserver à 15-30 °C. Conserver le récipient dans son carton pour le protéger de la lumière.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Préparation de la solution pour perfusion
Dans l'idéal, il faudrait préparer la perfusion de Kytril peu avant l'utilisation (pour les durées maximales de conservation, voir «Remarques particulières, Stabilité»).
Adultes
Pour préparer une solution pour perfusion à 1 mg, respectivement 3 mg de granisétron, prélever 1 ml respectivement 3 ml de solution de Kytril de l'ampoule et diluer avec 20–50 ml de l'un des solutés pour perfusion suivants: NaCl à 0,9%; NaCl à 0,18% et dextrose à 4%; dextrose à 5%; soluté de Ringer-lactate de Hartmann; lactate de sodium; mannitol.
Enfants
Pour préparer une dose de 20 µg/kg de poids corporel, prélever de l'ampoule le volume correspondant de solution de Kytril (il existe à cet effet des ampoules de 1 mg/1 ml) et diluer avec un soluté pour perfusion (comme chez l'adulte) jusqu'à obtention d'un volume total de 10 à 30 ml.
Numéro d’autorisation
52354, 51198 (Swissmedic)
Titulaire de l’autorisation
Future Health Pharma GmbH, 8620 Wetzikon
Mise à jour de l’information
Août 2020
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French Italian
Italian








