Adriblastin Rd Trockensubstanz 10mg C Solv Durchstechflasche buy online
Adriblastin RD Trockensub 10 mg mit Solvens Durchstf
-
70.62 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: PFIZER AG
- Product Code: 1383049
- ATC-code L01DB01
- EAN 7680503570151
Ingredients:
Doxorubicin hydrochlorid 10 mg , Natriumchlorid-Lösung 0.9% 5 ml, Lactose-1-Wasser, Methylparaben (E218) 1 mg, Natrium 17.7 mg, Trockensubstanz, Lösungsmittel, Doxorubicin, pro vitro.

Description
Zusammensetzung
Wirkstoffe
Doxorubicini hydrochloridum.
Hilfsstoffe
Adriblastin RD
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Pulver zu 10 mg: Methylis parahydroxybenzoas (E 218) 1 mg, lactosum monohydricum.
Lösungsmittel: Natrii chloridum (corresp. natrium 3.54 mg/ml), aqua ad iniectabilia.
Pulver zur Herstellung einer Injektionslösung
Pulver zu 50 mg: Methylis parahydroxybenzoas (E 218) 5 mg, lactosum monohydricum.
Adriblastin Solution
Injektionslösung zu 10 mg/5 ml: Natrii chloridum (corresp. natrium 17.7 mg), acidum hydrochloridum, aqua ad iniectabilia.
Injektionslösung zu 20 mg/10 ml: Natrii chloridum (corresp. natrium 35.4 mg), acidum hydrochloridum, aqua ad iniectabilia.
Injektionslösung zu 50 mg/25 ml: Natrii chloridum (corresp. natrium 88.5 mg), acidum hydrochloridum, aqua ad iniectabilia.
Darreichungsform und Wirkstoffmenge pro Einheit
Adriblastin RD (Rapid Dissolution)
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung.
Zur intravenösen Anwendung.
Pulver zu 10 mg: 1 Durchstechflasche enthält 10 mg Doxorubicinhydrochlorid.
Roter Pulverkuchen/rotes Pulver.
Lösungsmittel: 1 Ampulle enthält 5 ml 0.9%ige NaCl-Lösung.
1 ml gebrauchsfertige Injektionslösung enthält 2 mg/ml Doxorubicinhydrochlorid (siehe «Sonstige Hinweise/Hinweise für die Handhabung»).
Pulver zur Herstellung einer Injektionslösung.
Zur intravenösen Anwendung.
Pulver zu 50 mg: 1 Durchstechflasche enthält 50 mg Doxorubicinhydrochlorid. Roter Pulverkuchen/rotes Pulver.
1 ml gebrauchsfertige Injektionslösung enthält 2 mg/ml Doxorubicinhydrochlorid (siehe «Sonstige Hinweise/Hinweise für die Handhabung»).
Adriblastin Solution
Injektionslösung.
Zur intravenösen Anwendung.
Injektionslösung zu 10 mg: 1 Durchstechflasche zu 5 ml enthält 10 mg Doxorubicinhydrochlorid, entsprechend 2 mg/ml. Klare, rote Lösung.
Injektionslösung zu 20 mg: 1 Durchstechflasche zu 10 ml enthält 20 mg Doxorubicinhydrochlorid, entsprechend 2 mg/ml. Klare, rote Lösung.
Injektionslösung zu 50 mg: 1 Durchstechflasche zu 25 ml enthält 50 mg Doxorubicinhydrochlorid, entsprechend 2 mg/ml. Klare, rote Lösung.
Indikationen/Anwendungsmöglichkeiten
Behandlung bei Mammakarzinom, Bronchialkarzinom, Weichteil- und Knochensarkomen, gynäkologischen und Blasen-Karzinomen, Hodentumor, Schilddrüsenkarzinom, Synovialom, Ewing-Sarkom, Wilms-Tumor, Neuroblastom, Non-Hodgkin-Lymphom, Morbus Hodgkin, akuter Lymphoblasten- und Myeloblastenleukämie.
Dosierung/Anwendung
Das Arzneimittel soll nur unter Aufsicht von in der Chemotherapie erfahrenen Onkologen/Hämatologen angewendet werden.
Die Verabreichung erfolgt üblicherweise als langsame intravenöse Injektion über 3-10 min, ausnahmsweise als intravenöse Langzeitinfusion über 48-96 h. Zubereitung der Lösungen/Handhabung siehe «Sonstige Hinweise/Hinweise für die Handhabung».
Übliche Dosierung
Doxorubicin wird als Monotherapie oder in etablierten Therapieschemata angewendet (detaillierte Angaben siehe Literatur).
Monotherapie
Intervalltherapie mit 75 mg/m² Körperoberfläche als Einzeldosis jede dritte Woche.
Monotherapie bei vorbehandelten Patienten und Polychemotherapie
Intervalltherapie mit 30-60 mg/m² Körperoberfläche als Einzeldosis jede dritte Woche.
Hämatologische Erkrankungen
Intervalltherapie mit täglich 0.6 mg/kg für die Dauer von 3 Tagen oder täglich 0.8 mg/kg für die Dauer von 2 Tagen, wobei ein injektionsfreies Intervall von 10 Tagen nicht unterschritten werden darf.
Als maximale kumulative Dosis sollten 550 mg/m² Körperoberfläche nicht überschritten werden. Diese Dosierungsbegrenzung sollte auf 400 mg/m² reduziert werden, falls der Behandlung mit Adriblastin eine Bestrahlung im Mediastinalbereich voranging.
Ferner ist die Entscheidung, welche Höchstdosis beim einzelnen Patienten zu vertreten ist, abhängig von vorangegangener oder gleichzeitiger Behandlung mit anderen potentiell kardiotoxischen Substanzen wie andere Anthracycline, Antracendione oder Cyclophosphamid.
Dosisanpassung aufgrund unerwünschter Wirkungen/Interaktionen
Dosisanpassung auf Grund der Toxizität
Hämatotoxizität
Leukozyten/µl | Thrombozyten/µl | Adriblastin-Dosis |
Über 5000 | Über 150'000 | 100% |
4000-5000 | 100'000-150'000 | 75% |
3000-4000 | 75'000-100'000 | 50% |
2000-3000 | 50'000-75'000 | 25% |
unter 2000 | Unter 50'000 | 0% |
Stomatitis
Bei Auftreten einer Stomatitis darf erst dann weiter therapiert werden, wenn die Läsionen vollständig abgeheilt sind. Die nachfolgenden Dosen sollten dann auf die Hälfte reduziert werden.
Spezielle Dosierungsanweisungen
Bei Patienten, die aus medizinischen Gründen (z.B. bei vorliegender Immunsuppression, eingeschränkter Hämopoese, hohem Alter usw.) die jeweilige volle Dosis nicht erhalten können, werden folgende alternative Dosierungsschemata für die Mono- und Polychemotherapie empfohlen:
- Langzeitinfusion über 48-96 h von 60 mg/m² Körperoberfläche.
- Wöchentliche niedrigdosierte Verabreichung von 5-15 mg/m²; die Gesamtdosis pro Einzelbehandlung sollte 20 mg nicht überschreiten.
- Wöchentliche niedrigdosierte Verabreichung von 20 mg/m² Körperoberfläche.
Patienten mit Leberfunktionsstörungen
Bei Patienten mit einer Hyperbilirubinämie bis 51 µmol/l muss die Dosis um 50% reduziert werden und bei einem Bilirubin von 51-81 µmol/l um 75%. Bei schwerer Leberfunktionsstörung ist Doxorubicin kontraindiziert.
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit leichter bis mässiger Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Patienten mit schwerer Nierenfunktionsstörung (Cl Kr <10 ml/min) sollten jedoch nur 75% der Maximaldosis erhalten.
Kinder und Jugendliche
Die Anwendung bei Kindern und Jugendlichen sollte mit besonderer Vorsicht erfolgen.
Kontraindikationen
Überempfindlichkeit gegenüber dem Doxorubicin, anderen Anthracyclinen, Anthracendionen oder einem der Hilfsstoffe (siehe «Zusammensetzung»).
Bestehende Knochenmarksdepression.
Stark eingeschränkte Leberfunktion.
Schwere Herzinsuffizienz.
Kürzlich erfolgter Herzinfarkt.
Akute entzündliche Myokarderkrankungen.
Schwere Arrhythmien.
Behandlung mit maximalen kumulativen Dosen von Doxorubicin und/oder anderen Anthracyclinen bzw. Anthracendionen.
Floride Infektionen.
Schwangerschaft, Stillzeit.
Hämaturie.
Warnhinweise und Vorsichtsmassnahmen
Allgemeines
Die Patienten sollten sich vor Beginn einer Behandlung mit Doxorubicin von der akuten Toxizität einer vorangehenden zytotoxischen Therapie (wie Stomatitis, Neutropenie, Thrombozytopenie und generalisierte Infektionen) erholt haben.
Blutbildendes System
Wegen einer möglichen Knochenmarksdepression sollten die Erythrozyten-, Leukozyten- und Thrombozytenzahlen vor und während jedem Behandlungszyklus bestimmt werden.
Eine Leukopenie ist gewöhnlich vorübergehend. Die tiefsten Leukozytenwerte werden 10-14 Tage nach Behandlung gefunden. Nach etwa 21 Tagen liegen diese wieder im Normbereich.
Eine Sekundärleukämie wurde mit einer Latenzzeit von 1-3 Jahren nach Behandlung mit Anthracyclinen (inklusive Doxorubicin) beobachtet, insbesondere wenn gleichzeitig DNA-schädigende Zytostatika verabreicht wurden. Dieses Risiko kann bei gleichzeitiger Behandlung mit hämatopoetischen Wachstumsfaktoren oder Radiotherapie erhöht sein.
Hepatotoxizität
Vor und während der Behandlung ist eine Kontrolle der Leberfunktion empfehlenswert (SGOT, SGPT, alkalische Phosphatase, Bilirubin); siehe auch «Dosierung/Anwendung».
Herzfunktion
Spezielle Vorsicht ist geboten betreffend der mit Doxorubicin assoziierten Kardiotoxizität, welche sich als Soforttyp oder Spättyp manifestieren kann.
Soforttyp:
Die frühe Form der Kardiotoxizität tritt akut während der Behandlung auf (meist 24-48 h nach Einleitung der Therapie) und manifestiert sich hauptsächlich als Sinustachykardien und/oder EKG-Abweichungen wie unspezifische Änderungen der ST-Strecke. Es wurde über Tachyarrhythmien einschliesslich vorzeitiger ventrikulärer Kontraktionen, Kammertachykardie und Bradykardie wie über AV- und Linksschenkelblock berichtet. Diese sind selten von klinischer Bedeutung und führen nicht generell zum Abbruch der Doxorubicinbehandlung.
Spättyp:
Die verzögerte Form der Kardiotoxizität kann im späteren Verlauf einer Therapie oder 2-3 Monate beziehungsweise sogar erst mehrere Monate oder Jahre nach Abschluss der Therapie in Form einer Kardiomyopathie auftreten. Diese manifestiert sich durch eine Reduktion der LVEF (left ventricular ejection fraction), Niedervoltage und QT-Verlängerung, und/oder als dekompensierte Herzinsuffizienz mit Symptomen wie Dyspnoe, Lungenödem, Stauungsödeme, Kardiomegalie und Hepatomegalie, Oligurie, Ascites, Pleuraerguss und Galopprhythmus. Subakute Effekte wie Perikarditis/Myokarditis wurden ebenfalls beobachtet. Eine lebensbedrohliche Herzinsuffizienz ist die schwerste Form der anthrazyklininduzierten Kardiomyopathie und stellt die kumulative dosislimitierende Toxizität der Substanz dar.
Überwachung der Herzfunktion:
Die Herzfunktion sollte vor Beginn der Behandlung erfasst und während der gesamten Behandlungsdauer überwacht werden, um das Risiko einer schweren Herzschädigung zu verringern. Die Überwachung der Herzfunktion muss besonders strikt bei Patienten durchgeführt werden, die hohe kumulative Dosen erhalten oder bei denen Risikofaktoren vorhanden sind. Jedoch kann die Kardiotoxizität auch bei niedrigen Dosierungen auftreten und unabhängig von dem Vorhandensein von Risikofaktoren.
Die Therapie sollte bei ersten Anzeichen einer Funktionsstörung sofort abgesetzt werden. Eine angemessene quantitative Methode zur wiederholten LVEF-Bestimmung stellt die Multigate Radionuclid-Angiographie (MUGA) oder die Echokardiographie (ECHO) dar.
Kinder und Jugendliche sind besonders gefährdet, eine spätauftretende Kardiotoxizität zu entwickeln. Mädchen scheinen dabei gegenüber Jungen mit einem höheren Risiko behaftet zu sein. In einem Langzeit-Followup über 10 Jahre wurde eine kongestive Herzinsuffizienz bei 5-10% beobachtet. Deshalb müssen pädiatrische Patienten nach Doxorubicinbehandlung periodisch in einem Langzeit-Followup überwacht werden.
Kumulative Gesamtdosis:
Das Risiko für eine dekompensierte Herzinsuffizienz erhöht sich schnell mit steigender kumulativer Gesamtdosis von Doxorubicin. Bei einer kumulativen Dosis von 300 mg/m2 beträgt die Wahrscheinlichkeit für das Auftreten einer schweren Herzinsuffizienz ca. 1-2% und steigt langsam an bis zu einer kumulativen Dosis von 450-550 mg/m2. Danach steigt das Risiko steil an. Es wird deshalb empfohlen, eine kumulative Dosis von 550 mg/m2 nicht zu überschreiten. Bei der Doxorubicin-Dosis sollte eine frühere oder gleichzeitige Therapie mit anderen Anthrazyklinen wie Epirubicin, Idarubicin, Daunorubicin oder Anthracen Derivaten berücksichtigt werden. Es ist anzunehmen, dass sich die Toxizität von Doxorubicin und anderen Anthrazyklinen addiert.
Risikofaktoren:
Risikofaktoren für eine Kardiotoxizität sind manifeste oder latente kardiovaskuläre Erkrankungen, früher oder gleichzeitig erfolgte Bestrahlung der mediastinalen/pericardialen Region, vorausgegangene Therapie mit anderen Anthrazyklinen oder Anthracendionen sowie gleichzeitige Gabe von Arzneimitteln, die die Herzkontraktion herabsetzen können oder deren Anwendung mit einer Kardiotoxizität assoziiert wird (z.B. Trastuzumab).
Anthrazykline, einschliesslich Doxorubicin, sollten nur bei gleichzeitiger engmaschiger Überwachung der Herzfunktion des Patienten mit anderen kardiotoxischen Substanzen verabreicht werden. Das Risiko für eine kardiotoxische Wirkung von Anthrazyklinen könnte auch nach dem Absetzen anderer kardiotoxischer Arzneimittel erhöht sein, insbesondere wenn diese eine lange Halbwertszeit aufweisen. Die Halbwertszeit von Trastuzumab variiert; die Substanz kann bis zu 7 Monate im Blut vorhanden sein. Wenn möglich, sollte daher nach Absetzen von Trastuzumab eine Therapie mit Anthrazyklinen bis zu 7 Monaten vermieden werden. Werden Anthrazykline bereits vor diesem Zeitpunkt eingesetzt, ist die Herzfunktion sorgfältig zu überwachen.
Tumor-Lyse-Syndrom
Doxorubicin kann eine Hyperurikämie hervorrufen. Vor und nach Beginn der Behandlung sollten die Harnsäure-, Kalium-, Calcium-, Phosphat- und Kreatininwerte überprüft werden. Hydratation, Alkalisierung des Urins und prophylaktische Gabe von Allopurinol zur Vermeidung einer Hyperurikämie können das Risiko potentieller Komplikationen der Hyperurikämie senken.
Reaktionen an der Injektionsstelle, Extravasation
Eine Phlebosklerose kann durch Injektion in ein kleines Gefäss oder wiederholte Injektion in dieselbe Vene verursacht werden.
Eine Extravasation von Doxorubicin während der intravenösen Injektion kann lokale Schmerzen, schwere Gewebeschädigung und Nekrose verursachen. Falls während der intravenösen Verabreichung Symptome einer Extravasation auftreten, muss die Behandlung sofort gestoppt werden.
Immunsupprimierender Effekt
Die Verabreichung von Lebend- oder attenuierten Impfstoffen bei durch eine Chemotherapie (einschliesslich Adriblastin) immunsupprimierten Patienten kann schwere oder fatale Infektionen verursachen. Die Immunisierung mit Lebendimpfstoffen sollte bei Patienten unter Adriblastin vermieden werden. Bei Verwendung von inaktiven oder Tot-Impfstoffen ist zu berücksichtigen, dass der Impfschutz vermindert sein kann.
Andere Arzneimittel
Bei gleichzeitiger Gabe von Ciclosporin und Doxorubicin wurden Koma und Krampfanfälle beschrieben (siehe «Interaktionen»).
Hilfsstoffe von besonderem Interesse
Adriblastin RD 10 mg enthält 1 mg, Adriblastin RD 50 mg 5 mg des Hilfsstoffs Methyl-4-hydroxybenzoat (E 218). Methyl-4-hydroxybenzoat (E 218) kann allergische Reaktionen, auch Spätreaktionen, hervorrufen sowie in seltenen Fällen eine Verkrampfung der Atemwege (Bronchospasmus).
Das gebrauchsfertige Arzneimittel enthält 3.54 mg Natrium pro ml. Der Natriumgehalt in 1 ml des gebrauchsfertigen Arzneimittels entspricht 0.18% der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g. Wenn der Patient eine kochsalzarme Diät einhalten muss, sollte dies entsprechend berücksichtigt werden.
Interaktionen
Doxorubicin ist ein Substrat von Cytochrom P450 CYP3A4 und CYP2D6 sowie von P-Glycoprotein (P-gp). Es wurden klinisch relevante Interaktionen mit Inhibitoren von CYP3A4, CYP2D6 und/oder P-gp (z.B. Verapamil) beschrieben, welche zu Erhöhung der Konzentration und der klinischen Wirkung von Doxorubicin führen. Induktoren von CYP3A4 (z.B. Phenobarbital, Phenytoin, Johanniskraut) und P-gp können die Konzentration von Doxorubicin senken.
Die gleichzeitige Gabe von Ciclosporin und Doxorubicin kann zu einer Erhöhung der AUC von Doxorubicin wie auch von Doxorubicinol führen. Literaturberichte weisen darauf hin, dass die gleichzeitige Gabe von Ciclosporin und Doxorubicin zu erhöhter und verlängerter Hämotoxizität führen kann als mit Doxorubicin allein. Ebenfalls wurden bei gleichzeitiger Gabe von Ciclosporin und Doxorubicin Koma und Krampfanfälle beschrieben.
Doxorubicin kann die Toxizität von anderen antineoplastischen Therapien verstärken und umgekehrt.
Doxorubicin hat gemäss Studienberichten eine Cyclophosphamid-induzierte hämorrhagische Zystitis verschlimmert und eine Mercaptopurin-induzierte Hepatotoxizität verstärkt.
Gleichzeitige oder frühere Verabreichung von anderen Anthracyclinen, Anthracendionen oder Cyclophosphamid sowie Bestrahlung der Herzregion kann die kardiotoxische Wirkung von Doxorubicin verstärken. Die maximale kumulative Dosis von Doxorubicin sollte in diesen Fällen reduziert werden (siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Bei gleichzeitiger Anwendung von anderen kardioaktiven Arzneimitteln (z.B. Calcium-Kanal-Blocker) sollte die Herzfunktion während der Behandlung überwacht werden.
Schwangerschaft/Stillzeit
Schwangerschaft
Studien bei Tieren haben eine Schädigung des Fötus gezeigt, bzw. es gibt Hinweise auf fötale Risiken, basierend auf Erfahrungen bei Tieren, wobei die Risiken die möglichen positiven therapeutischen Effekte bei weitem übersteigen. Das Arzneimittel ist bei schwangeren Frauen kontraindiziert (siehe «Kontraindikationen»). Frauen im gebärfähigen Alter sollten, falls eine Behandlung notwendig ist, während der Behandlung und bis zu 6 Monaten danach eine zuverlässige Verhütungsmethode anwenden.
Stillzeit
Da Doxorubicin in die Muttermilch übergeht soll während der Anwendung von Doxorubicin nicht gestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Adriblastin hat wegen des häufigen Auftretens von Übelkeit und Erbrechen einen ausgeprägten Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Unerwünschte Wirkungen
Knochenmarksdepression und Kardiomyopathien sind die schwerwiegendsten unerwünschten Wirkungen.
Die unerwünschten Wirkungen sind nach Organklasse aufgeführt und nach Häufigkeitsgrad gewichtet, unter Berücksichtigung folgender Definitionen: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10'000, <1/1000).
Infektionen und parasitäre Erkrankungen
Sehr häufig: Infektionen (23.9%).
Häufig: Sepsis/Septikämie.
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen)
Gelegentlich: Sekundärleukämie (ALL, AML).
Erkrankungen des Blutes und des Lymphsystems
Sehr häufig: Leukopenie (bei Monotherapie mit 60 mg/m²: 80%, Grad 4: 15%), Neutropenie, Anämie (78%), Thrombozytopenie (73%).
Erkrankungen des Immunsystems
Sehr selten: Anaphylaxie.
Stoffwechsel und Ernährungsstörungen
Sehr häufig: verminderter Appetit (29%), Gewichtszunahme (14.4%; bei Patientinnen mit frühem Brustkrebs bei adjuvanter Behandlung mit Einschluss von Doxorubicin).
Gelegentlich: Anorexie.
Sehr selten: Hyperurikämie.
Häufigkeit unbekannt: Dehydrierung, Hyperurikämie.
Augenerkrankungen
Häufig: Konjunktivitis.
Selten: Keratitis, erhöhte Tränensekretion.
Herzerkrankungen
Sehr häufig: Reduktion der linksventrikulären Ejektionsfraktion (350-450 mg/m²: 38%; >450 mg/m²: 70%), abnormales EKG (15%).
Häufig: kongestive Herzinsuffizienz, Sinustachykardie.
Gelegentlich: Kardiomyopathie (atrioventrikulärer Block, Tachyarrhythmien, Schenkel-Block, Bradykardie, Perikarditis, Myokarditis).
Gefässerkrankungen
Gelegentlich: Embolien (Thromboembolie, Lungenembolie).
Sehr selten: Hämorrhagie, Thrombophlebitis.
Häufigkeit unbekannt: Schock, Phlebitis, Hitzewallungen.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Schleimhautentzündungen/Stomatitis (70%), Erbrechen (45%), Übelkeit (12-21%), Diarrhoe (14%).
Häufig: Oesophagitis, abdominale Schmerzen.
Gelegentlich: Kolitis.
Sehr selten: Ulzerationen und Nekrosen des Dickdarms, erosive Gastritis, Hyperpigmentation/Verfärbung der Mundschleimhaut.
Häufigkeit unbekannt: Gastrointestinale Blutungen.
Leber- und Gallenerkrankungen
Sehr häufig: erhöhte Transaminasen (39-71%).
Erkrankungen der Haut und des Unterhautgewebes
Sehr häufig: Alopezie (90-100%), palmar-plantare Erythrodysästhesie (22-29%).
Häufig: Urtikaria, Exanthem, Hyperpigmentation der Haut und Nägel.
Selten: Photosensitivität, Überempfindlichkeit von vorbestrahlten Hautbezirken («Recall-Phänomen»).
Sehr selten: Juckreiz, Hautveränderungen, akrale Erytheme.
Erkrankungen der Nieren und Harnwege
Häufig: Arzneimittelbedingte Rotfärbung des Urins in den ersten 1-2 Behandlungstagen.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Sehr selten: Amenorrhö, Azoospermie, Oligospermie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Asthenie (57%), Schüttelfrost (15%), Fieber (13%).
Häufig: Reaktionen an Infusionsstelle (Phlebosklerose, Extravasation mit Gewebsnekrose.
Sehr selten: Unwohlsein.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Anzeichen und Symptome
Sehr hohe Einzeldosen von Adriblastin können innerhalb von 24 h zur Degeneration des Myocards führen und innert 10-14 Tagen zu schwerer Knochenmarksdepression.
Behandlung
Die Behandlung sollte unterstützende Massnahmen umfassen und schliesst gegebenenfalls Bluttransfusionen und Isolation ein. Herzinsuffizienz ist bis zu 6 Monate nach Überdosierung mit Anthracyclinderivaten festgestellt worden. Die Patienten müssen daher sorgfältig überwacht werden. Bei Auftreten einer Herzinsuffizienz sollte diese konventionell behandelt werden.
Eigenschaften/Wirkungen
ATC-Code
L01DB01
Wirkungsmechanismus
Doxorubicin ist ein Anthracyclin-Antibiotikum mit antineoplastischer Wirkung, das aus Kulturen von Streptomyces peucetius var. caesius isoliert wird.
Doxorubicin bindet sich an die DNS und hemmt die Synthese der Nukleinsäuren über die Hemmung der Topoisomerase II. Dadurch kommt es zur Hemmung der Mitoseaktivität sowie zum Auftreten von Chromosomen-Aberrationen.
Pharmakodynamik
Siehe «Wirkungsmechanismus».
Klinische Wirksamkeit
Keine Angaben.
Pharmakokinetik
Die Pharmakokinetik von Doxorubicin kann durch ein 2- oder 3- Kompartiment-Modell beschrieben werden.
Absorption
Intravenöse Anwendung.
Distribution
Doxorubicin zeigt eine ausgeprägte Gewebeverteilung mit einem Verteilungsvolumen von 700-1100 l/m2. Die Liquorgängigkeit ist gering. Doxorubicin verteilt sich rasch in Ascites und erreicht dort Konzentrationen über den Plasmaspiegeln. Die Plasmaproteinbindung beträgt 50-85%.
Metabolismus
Doxorubicin wird teilweise metabolisiert. Hauptmetabolit ist das aktive Doxorubicinol (=Adriamycinol=13-OH-Doxorubicin). Der Metabolismus erfolgt sowohl in der Leber als auch extrahepatisch über eine NADPH-abhängige Aldoketoreduktase.
Elimination
Die Elimination erfolgt hauptsächliche über die Galle und Faeces, zu 40-50% unverändert und zu 23% als Doxorubicinol. Die renale Elimination ist gering (5-15% der Dosis) und in unveränderter Form. Die Clearance von Doxorubicin beträgt 400-583 ml/min/m2, die terminale Halbwertszeit 17 h (Metaboliten 30-50 h).
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Bei Patienten mit eingeschränkter Leberfunktion ist die Ausscheidung von Doxorubicin verzögert, was zu einer Akkumulation im Plasma und Gewebe führt.
Nierenfunktionsstörungen
Zur Pharmakokinetik bei Patienten mit eingeschränkter Nierenfunktion und bei geriatrischen Patienten liegen keine Daten vor. Bei stark übergewichtigen Patienten ist die systemische Clearance reduziert.
Kinder und Jugendliche
Die Clearance war bei 52 Kindern im Alter von über 2 Jahren im Vergleich zu Erwachsenen erhöht (1540 ml/min/m2). Die Clearance bei 8 Kindern von 2 Monaten bis 2 Jahren (813 ml/min/m2) war im Vergleich zu älteren Kindern verringert und näherte sich der Clearance der Erwachsenen.
Präklinische Daten
Mutagenität
Doxorubicin ist in vitro und in vivo mutagen.
Karzinogenität
Nach einmaliger intravenöser Gabe an Ratten wurde ein Anstieg der Tumorrate beobachtet.
Reproduktionstoxizität
Die Auswirkungen auf reproduktionstoxikologische Parameter wurden an Ratten und Kaninchen untersucht. An weiblichen Ratten wurde Doxorubicin in Dosierungen von 0.025, 0.050 und 0.2 mg/kg i.v. täglich vom 14. Tag vor der Verpaarung bis zur Laktationsperiode verabreicht. Es wurden keine maternaltoxischen Effekte beobachtet. Der Fertilitätsindex der mittleren und hohen Dosisgruppe war vermindert, allerdings nicht signifikant.
Männliche Ratten, denen Doxorubicin an den Tagen 6, 16, 24 und 45 postnatal verabreicht wurde, zeigten bis zum 16. Tag schwere Beeinträchtigungen der Fortpflanzungsorgane und Fertilität. Ab Tag 24 waren die Effekte auf Reproduktionsorgangewichte und Spermienanzahl reversibel, ab Tag 45 waren keine Effekte erkennbar. Embryotoxische Effekte traten im Dosisbereich von 0.2 mg/kg bei Ratten und Kaninchen auf.
Sonstige Hinweise
Inkompatibilitäten
Adriblastin darf nicht mit Heparin, Dexamethason, Fluorouracil, Hydrocortison- Natriumsuccinat, Aminophyllin oder Cefalotin gemischt werden (z.B. im gleichen Infusionsbeutel oder am Y-Stück des Infusionsschlauchs), da es zu Ausfällungen kommen kann. Falls eine gleichzeitige Behandlung mit diesen Arzneimitteln notwendig ist, sollte der Schlauch zwischen der Verabreichung dieser Substanzen gespült werden.
Bei längerem Kontakt mit alkalischen Lösungen wird der Wirkstoff hydrolisiert. Adriblastin RD und Solution dürfen nur mit den unter «Hinweise für die Handhabung» aufgeführten Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Adriblastin RD
Nach Rekonstitution (siehe unten, «Hinweise für die Handhabung») ist die Lösung während 30 Tagen bei 2-8 °C chemisch und physikalisch stabil, wenn sie vor Licht geschützt wird. Aus mikrobiologischen Gründen sollte sie sofort nach Zubereitung verwendet werden. Falls erforderlich kann sie maximal 24 h im Kühlschrank (2-8 °C) und vor Licht geschützt aufbewahrt werden.
Nach Verdünnung für die Langzeitinfusion (siehe «Hinweise für die Handhabung») wurde die chemisch-physikalische Stabilität des verdünnten, rekonstituierten Pulvers unter Lichtschutz für 24 h gezeigt. Aus mikrobiologischen Gründen sollte es unmittelbar nach der Verdünnung verwendet werden.
Adriblastin Solution
Adriblastin Solution enthält kein Konservierungsmittel. Nach Anbruch der Durchstechflaschen ist die Lösung sofort zu verwenden. Falls erforderlich kann sie maximal 24 h im Kühlschrank (2-8 °C) und vor Licht geschützt aufbewahrt werden.
Nach Verdünnung für die Langzeitinfusion (siehe «Hinweise für die Handhabung») wurde die chemisch-physikalische Stabilität der verdünnten Lösung unter Lichtschutz für 48 h gezeigt. Aus mikrobiologischen Gründen sollte sie unmittelbar nach der Verdünnung verwendet werden.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Adriblastin RD
Bei Raumtemperatur (15-25 °C) aufbewahren.
Adriblastin Solution
Vor Licht geschützt im Kühlschrank (2-8 °C) lagern. Die Lagerung von Adriblastin Solution im Kühlschrank kann zur Bildung eines gelartigen Produkts führen. Dieses bildet sich bei Raumtemperatur (15-25 °C) über 2 bis maximal 4 h wieder in eine leicht visköse bis komplett mobile Lösung zurück.
Bei Raumtemperatur (15-25 °C) darf die Lösung nicht länger als 24 h und vor Licht geschützt aufbewahrt werden.
Hinweise für die Handhabung
Zytostatika-Hinweis
Bei der Handhabung von Adriblastin RD und Solution, der Zubereitung der Injektionslösung und der Entsorgung sind die Richtlinien für Zytostatika zu befolgen.
Zubereitung von Adriblastin RD
Für die Rekonstitution wird das Pulver zu 10 mg mit 5 ml und jenes zu 50 mg mit 25 ml 0.9%iger NaCl-Lösung aufgelöst.
Die Packung der 10 mg-Dosierung enthält das entsprechende Lösungsmittel (0.9%ige NaCl-Lösung). Die 50 mg Dosierung enthält kein Lösungsmittel in der Packung. Zur Rekonstitution kann anstelle von 0.9%iger NaCl-Lösung auch Wasser für Injektionszwecke verwendet werden.
Zubereitung von Adriblastin Solution
Adriblastin Solution ist gebrauchsfertig und kann direkt verwendet werden. Vor Anwendung muss die Lösung jedoch auf Raumtemperatur gebracht werden.
Verabreichung
Die zubereitete resp. gebrauchsfertige Adriblastinlösung wird innerhalb von 3-10 min intravenös injiziert um das Risiko einer Thrombose oder Extravasation zu vermindern. Eine paravenöse Applikation muss unbedingt ausgeschlossen werden. Deshalb sollte man sich durch Vorspritzen von 0.9%iger NaCl-Lösung von der korrekten Lage der Nadel oder des Venenkatheters einer Infusion überzeugen. Die Nadel oder der Venenkatheter wird abschliessend mit 0.9%iger NaCl-Lösung durchgespült.
Adriblastin darf nicht intramuskulär oder intrathekal verabreicht werden.
Langzeitinfusion: Zur Langzeitinfusion wird die für 24 h erforderliche Dosis ausgehend vom rekonstituierten Pulver oder der Adriblastin Solution in 500-1000 ml 0.9%iger NaCl-Lösung aufgenommen. Der Infusionsbeutel und das Infusionsbesteck sind vor Licht geschützt zu verpacken (z.B. in Aluminiumfolie).
Zulassungsnummer
50357, 50358 (Swissmedic).
Zulassungsinhaberin
Pfizer AG, Zürich.
Stand der Information
Mai 2020.
LLD V016
Composizione
Principi attivi
Doxorubicini hydrochloridum.
Sostanze ausiliarie
Adriblastin RD
Polvere e solvente per soluzione iniettabile
Polvere da 10 mg: methylis parahydroxybenzoas (E 218) 1 mg, lactosum monohydricum.
Solvente: natrii chloridum (corresp. natrium 3.54 mg/ml), aqua ad iniectabilia.
Polvere per soluzione iniettabile
Polvere da 50 mg: methylis parahydroxybenzoas (E 218) 5 mg, lactosum monohydricum.
Adriblastin Solution
Soluzione iniettabile da 10 mg/5 ml: natrii chloridum (corresp. natrium 17.7 mg), acidum hydrochloridum, aqua ad iniectabilia.
Soluzione iniettabile da 20 mg/10 ml: natrii chloridum (corresp. natrium 35.4 mg), acidum hydrochloridum, aqua ad iniectabilia.
Soluzione iniettabile da 50 mg/25 ml: natrii chloridum (corresp. natrium 88.5 mg), acidum hydrochloridum, aqua ad iniectabilia.
Forma farmaceutica e quantità di principio attivo per unità
Adriblastin RD (Rapid Dissolution)
Polvere e solvente per soluzione iniettabile.
Per uso endovenoso.
Polvere da 10 mg: 1 flaconcino contiene 10 mg di doxorubicina cloridrato.
Tavoletta liofilizzata di colore rosso/polvere di colore rosso.
Soluzione: 1 fiala contiene 5 ml di soluzione di NaCl allo 0.9%.
1 ml di soluzione iniettabile pronta all'uso contiene 2 mg/ml di doxorubicina cloridrato (cfr. «Altre indicazioni/Indicazioni per la manipolazione»).
Polvere per soluzione iniettabile.
Per uso endovenoso.
Polvere da 50 mg: 1 flaconcino contiene 50 mg di doxorubicina cloridrato. Tavoletta liofilizzata di colore rosso/polvere di colore rosso.
1 ml di soluzione iniettabile pronta all'uso contiene 2 mg/ml di doxorubicina cloridrato (cfr. «Altre indicazioni/Indicazioni per la manipolazione»).
Adriblastin Solution
Soluzione iniettabile.
Per uso endovenoso.
Soluzione iniettabile da 10 mg: 1 flaconcino da 5 ml contiene 10 mg di doxorubicina cloridrato, corrispondenti a 2 mg/ml. Soluzione limpida, di colore rosso.
Soluzione iniettabile da 20 mg: 1 flaconcino da 10 ml contiene 20 mg di doxorubicina cloridrato, corrispondenti a 2 mg/ml. Soluzione limpida, di colore rosso.
Soluzione iniettabile da 50 mg: 1 flaconcino da 25 ml contiene 50 mg di doxorubicina cloridrato, corrispondenti a 2 mg/ml. Soluzione limpida, di colore rosso.
Indicazioni/Possibilità d'impiego
Trattamento del carcinoma mammario, del carcinoma bronchiale, dei sarcomi dei tessuti molli e delle ossa, dei carcinomi ginecologici e della vescica, del cancro testicolare, del carcinoma della tiroide, del sarcoma sinoviale, del sarcoma di Ewing, del tumore di Wilms, del neuroblastoma, del linfoma non-Hodgkin, della malattia di Hodgkin, della leucemia linfoblastica e mieloblastica acuta.
Posologia/Impiego
Il medicamento deve essere utilizzato solo sotto la supervisione di oncologi/ematologi esperti in chemioterapia.
La somministrazione avviene solitamente mediante iniezione endovenosa lenta nell'arco di 3-10 m, in via eccezionale mediante infusione di lunga durata nell'arco di 48-96 h. Per informazioni sulla preparazione/manipolazione delle soluzioni, cfr. «Altre indicazioni/Indicazioni per la manipolazione».
Posologia abituale
La doxorubicina viene utilizzata in monoterapia o in schemi terapeutici consolidati (per informazioni dettagliate, consultare la letteratura).
Monoterapia
Terapia a intervalli con 75 mg/m² di superficie corporea somministrati in dose singola ogni tre settimane.
Monoterapia in caso di pazienti pretrattati e polichemioterapia
Terapia a intervalli con 30-60 mg/m² di superficie corporea somministrati in dose singola ogni tre settimane.
Malattie ematologiche
Terapia a intervalli con 0.6 mg/kg al giorno per 3 giorni o 0.8 mg/kg al giorno per 2 giorni, laddove non deve essere superato un intervallo senza iniezioni di 10 giorni.
Come dose cumulativa massima non si devono superare i 550 mg/m² di superficie corporea. Qualora il trattamento con Adriblastin preceda una radioterapia della regione mediastinica, tale limite posologico deve essere ridotto a 400 mg/m².
Inoltre, la decisione di quale dose massima debba essere somministrata nel singolo paziente dipende da un eventuale trattamento precedente o concomitante con altre sostanze potenzialmente cardiotossiche come altre antracicline, gli antracenedioni o la ciclofosfamide.
Aggiustamento della dose a causa di effetti indesiderati/interazioni
Aggiustamento della dose in base alla tossicità
Ematotossicità
Leucociti/µl | Trombociti/µl | Dose di Adriblastin |
Superiori a 5'000 | Superiori a 150'000 | 100% |
4'000-5'000 | 100'000-150'000 | 75% |
3'000-4'000 | 75'000-100'000 | 50% |
2'000-3'000 | 50'000-75'000 | 25% |
Inferiori a 2'000 | Inferiori a 50'000 | 0% |
Stomatite
In caso di insorgenza di stomatite, si potrà proseguire la terapia solo quando le lesioni si saranno completamente rimarginate. Le dosi successive dovranno quindi essere dimezzate.
Istruzioni posologiche speciali
Nei pazienti che per ragioni mediche (ad es. in presenza di immunosoppressione, compromissione dell'emopoiesi, età avanzata ecc.) non possono ricevere la rispettiva dose intera si raccomandano i seguenti schemi posologici alternativi per la mono- e polichemioterapia:
- Infusione lenta di 60 mg/m² di superficie corporea nell'arco di 48-96 h.
- Somministrazione settimanale a basso dosaggio di 5-15 mg/m²; la dose totale per singolo trattamento non deve superare i 20 mg.
- Somministrazione settimanale a basso dosaggio di 20 mg/m² di superficie corporea.
Pazienti con disturbi della funzionalità epatica
La dose deve essere ridotta del 50% nei pazienti con iperbilirubinemia fino a 51 µmol/l e del 75% con valori di bilirubina di 51-81 µmol/l. La doxorubicina è controindicata in caso di gravi disturbi della funzionalità epatica.
Pazienti con disturbi della funzionalità renale
Nei pazienti con disturbi della funzionalità renale di grado da lieve a moderato non è necessario alcun aggiustamento della dose. Tuttavia, i pazienti con gravi disturbi della funzionalità renale (Cl Cr <10 ml/min) devono ricevere soltanto il 75% della dose massima.
Bambini e adolescenti
Il medicamento dev'essere utilizzato con particolare cautela nei bambini e negli adolescenti.
Controindicazioni
Ipersensibilità alla doxorubicina, ad altre antracicline, agli antracenedioni o a una qualsiasi delle sostanze ausiliarie (cfr. «Composizione»).
Presenza di depressione midollare.
Forte compromissione della funzionalità epatica.
Grave insufficienza cardiaca.
Recente infarto miocardico.
Miocarditi acute.
Gravi aritmie.
Trattamento con dosi cumulative massime di doxorubicina e/o di altre antracicline o antracenedioni.
Infezioni attive.
Gravidanza, allattamento.
Ematuria.
Avvertenze e misure precauzionali
Indicazioni generali
Prima dell'inizio di un trattamento con doxorubicina, i pazienti devono essersi ripresi dagli effetti della tossicità acuta di una precedente terapia citotossica (come stomatite, neutropenia, trombocitopenia e infezioni generalizzate).
Sistema emopoietico
A causa di una possibile depressione midollare, si devono determinare le conte eritrocitarie, leucocitarie e piastriniche prima e durante ogni ciclo di trattamento.
La leucopenia è solitamente temporanea. I valori leucocitari più bassi vengono rilevati 10-14 giorni dopo il trattamento. Dopo circa 21 giorni, tali valori risultano di nuovo nella norma.
È stata osservata una leucemia secondaria con un tempo di latenza di 1-3 anni dopo il trattamento con antracicline (inclusa la doxorubicina), in particolare quando in concomitanza sono stati somministrati citostatici che danneggiano il DNA. Questo rischio può essere maggiore in caso di trattamento concomitante con fattori di crescita ematopoietici o radioterapia.
Epatotossicità
È consigliabile effettuare un controllo della funzionalità epatica prima e durante il trattamento (SGOT, SGPT, fosfatasi alcalina, bilirubina); cfr. anche «Posologia/impiego».
Funzionalità cardiaca
Occorre prestare particolare attenzione alla cardiotossicità associata alla doxorubicina, che può manifestarsi in forma acuta o tardiva.
Forma acuta:
La cardiotossicità precoce insorge in forma acuta durante il trattamento (solitamente 24-48 h dopo l'inizio della terapia) e si manifesta principalmente sotto forma di tachicardia sinusale e/o anomalie dell'ECG, come le alterazioni aspecifiche del tratto ST. Sono stati segnalati casi di tachiaritmia (incluse le contrazioni ventricolari premature), tachicardia ventricolare e bradicardia, nonché blocco AV e blocco di branca sinistra. Questi sono raramente di rilevanza clinica e generalmente non determinano l'interruzione del trattamento con doxorubicina.
Forma tardiva:
La forma tardiva di cardiotossicità può insorgere in una fase avanzata della terapia o 2-3 mesi oppure addirittura diversi mesi o anni dopo la conclusione della terapia sotto forma di cardiomiopatia. Quest'ultima si manifesta con una riduzione della FEVS (frazione di eiezione del ventricolo sinistro), basso voltaggio e prolungamento dell'intervallo QT e/o sotto forma di insufficienza cardiaca scompensata con sintomi quali dispnea, edema polmonare, edemi da stasi, cardiomegalia ed epatomegalia, oliguria, ascite, versamento pleurico e ritmo di galoppo. Sono stati osservati anche effetti subacuti come pericardite/miocardite. L'insufficienza cardiaca potenzialmente fatale è la forma più grave di cardiomiopatia indotta da antracicline e rappresenta la tossicità cumulativa dose-limitante della sostanza.
Monitoraggio della funzionalità cardiaca:
La funzionalità cardiaca deve essere rilevata prima dell'inizio del trattamento e monitorata per tutta la durata della terapia per ridurre il rischio di danno cardiaco grave. Il monitoraggio della funzionalità cardiaca deve essere particolarmente accurato nei pazienti che ricevono dosi cumulative elevate o che presentano fattori di rischio. Tuttavia, è possibile che la cardiotossicità si manifesti anche a bassi dosaggi e indipendentemente dalla presenza di fattori di rischio.
La terapia deve essere interrotta immediatamente ai primi segni di disfunzione. Metodi quantitativi adatti alla determinazione ripetuta della FEVS sono l'angiografia con radionuclidi a gate multipli (MUGA) o l'ecocardiografia (ECO).
I bambini e gli adolescenti sono particolarmente a rischio di sviluppare una cardiotossicità tardiva. Le bambine sembrano essere maggiormente esposte a questo rischio rispetto ai bambini. In un follow-up a lungo termine della durata di 10 anni, l'insufficienza cardiaca congestizia è stata osservata con una frequenza del 5-10%. Pertanto, dopo un trattamento con doxorubicina i pazienti pediatrici devono essere periodicamente monitorati nel quadro di un follow-up a lungo termine.
Dose cumulativa totale:
Il rischio di insufficienza cardiaca scompensata aumenta rapidamente all'aumentare della dose cumulativa totale di doxorubicina. Con una dose cumulativa di 300 mg/m2 la probabilità che si manifesti un'insufficienza cardiaca grave è pari a ca. l'1-2% e aumenta lentamente fino a una dose cumulativa di 450-550 mg/m2, dopodiché il rischio aumenta rapidamente. Pertanto, si raccomanda di non superare una dose cumulativa di 550 mg/m2. Con tale dose di doxorubicina occorre tenere conto di terapie antecedenti o concomitanti con altre antracicline come epirubicina, idarubicina, daunorubicina o derivati dell'antracene. Si presume che la tossicità della doxorubicina e di altre antracicline sia additiva.
Fattori di rischio:
Sono fattori di rischio per la cardiotossicità le malattie cardiovascolari manifeste o latenti, la radioterapia antecedente o concomitante della regione mediastinica/pericardica, il precedente trattamento con altre antracicline o antracenedioni nonché la somministrazione concomitante di medicamenti in grado di ridurre la contrattilità cardiaca o il cui uso è associato a cardiotossicità (ad es. trastuzumab).
Le antracicline, inclusa la doxorubicina, devono essere somministrate in combinazione con altre sostanze cardiotossiche solo sotto attento monitoraggio concomitante della funzionalità cardiaca del paziente. Il rischio di cardiotossicità delle antracicline potrebbe essere maggiore anche dopo l'interruzione di altri medicamenti cardiotossici, specialmente se caratterizzati da una lunga emivita. L'emivita di trastuzumab è variabile; la sostanza può essere presente nel sangue fino a 7 mesi. Se possibile, dopo l'interruzione di trastuzumab occorre quindi evitare una terapia con antracicline per un periodo fino a 7 mesi. Qualora vengano somministrate antracicline già prima che sia trascorso tale periodo, si dovrà monitorare attentamente la funzionalità cardiaca.
Sindrome da lisi tumorale
La doxorubicina può causare iperuricemia. Prima e dopo l'inizio del trattamento si dovranno controllare i valori di acido urico, potassio, calcio, fosfato e creatinina. L'idratazione, l'alcalinizzazione dell'urina e la somministrazione profilattica di allopurinolo per prevenire l'iperuricemia possono ridurre il rischio di potenziali complicanze correlate alla stessa.
Reazioni in sede di iniezione, stravaso
L'iniezione in un piccolo vaso sanguigno o l'iniezione ripetuta nella stessa vena può causare una flebosclerosi.
Uno stravaso di doxorubicina durante l'iniezione endovenosa può causare dolore localizzato, gravi danni tissutali e necrosi. Qualora insorgano sintomi di stravaso durante la somministrazione endovenosa, occorre interrompere immediatamente il trattamento.
Effetto immunosoppressivo
La somministrazione di vaccini vivi o attenuati in pazienti immunodepressi a seguito di una chemioterapia (incluso Adriblastin) può causare infezioni gravi o fatali. Nei pazienti trattati con Adriblastin occorre evitare l'immunizzazione con vaccini vivi. Qualora vengano utilizzati vaccini uccisi o inattivati, occorre tenere presente che la copertura vaccinale potrebbe essere ridotta.
Altri medicamenti
Con la somministrazione concomitante di ciclosporina e doxorubicina sono stati descritti casi di coma e crisi convulsive (cfr. «Interazioni).
Sostanze ausiliari di particolare interesse
Adriblastin RD 10 mg contiene 1 mg della sostanza ausiliaria metil-4-idrossibenzoato (E 218), Adriblastin RD 50 mg ne contiene 5 mg. Il metil-4-idrossibenzoato (E 218) può causare reazioni allergiche (anche ritardate) e, eccezionalmente, broncospasmo.
Il medicamento pronto all'uso contiene 3.54 mg di sodio per ml. Il contenuto di sodio di 1 ml del medicamento pronto all'uso corrisponde a 0.18% dell'assunzione massima giornaliera raccomandata dall'OMS con la dieta di un adulto che è di 2 g. Occorre tenerne debitamente conto se il paziente deve seguire una dieta a basso contenuto di sodio.
Interazioni
La doxorubicina è un substrato del citocromo P450 CYP3A4 e CYP2D6 nonché della glicoproteina P (P-gp). Sono state descritte interazioni clinicamente rilevanti con gli inibitori di CYP3A4, CYP2D6 e/o della P-gp (ad es. verapamil) che hanno determinato un aumento della concentrazione e dell'effetto clinico della doxorubicina. Gli induttori del CYP3A4 (ad es. fenobarbital, fenitoina, erba di San Giovanni) e P-gp possono ridurre la concentrazione della doxorubicina.
La somministrazione concomitante di ciclosporina e doxorubicina può causare un aumento dell'AUC della doxorubicina come pure del doxorubicinolo. I dati in letteratura indicano che la somministrazione concomitante di ciclosporina e doxorubicina può causare un aumento e un prolungamento della tossicità ematologica rispetto a quanto osservato con la sola doxorubicina. Inoltre, con la somministrazione concomitante di ciclosporina e doxorubicina sono stati descritti casi di coma e crisi convulsive.
La doxorubicina può intensificare la tossicità di altre terapie antineoplastiche e viceversa.
Secondo i dati provenienti dagli studi, la doxorubicina ha esacerbato una cistite emorragica indotta da ciclofosfamide e intensificato un'epatotossicità indotta da mercaptopurina.
La somministrazione concomitante o antecedente di altre antracicline, antracenedioni o ciclofosfamide nonché la radioterapia della regione cardiaca possono intensificare l'effetto cardiotossico della doxorubicina. In questi casi occorre ridurre la dose cumulativa massima di doxorubicina (cfr. «Posologia/impiego» e «Avvertenze e misure precauzionali»).
In caso di uso concomitante di altri medicamenti cardioattivi (ad es. calcio-antagonisti), durante il trattamento si dovrà monitorare la funzionalità cardiaca.
Gravidanza/Allattamento
Gravidanza
Studi condotti sugli animali hanno evidenziato danni al feto o le esperienze sugli animali suggeriscono l'esistenza di rischi per il feto, rischi che superano di gran lunga i potenziali benefici terapeutici. Il medicamento è controindicato per l'utilizzo in gravidanza (cfr. «Controindicazioni»). Se il trattamento è necessario, le donne in età fertile devono utilizzare un metodo contraccettivo affidabile per tutta la durata del trattamento e fino a 6 mesi dopo.
Allattamento
Poiché la doxorubicina viene escreta nel latte materno, durante l'utilizzo della doxorubicina non si deve allattare.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Per la frequente insorgenza di nausea e vomito, Adriblastin ha un effetto marcato sulla capacità di guidare veicoli o sulla capacità di utilizzare macchine.
Effetti indesiderati
Gli effetti indesiderati più gravi sono la depressione midollare e le cardiomiopatie.
Gli effetti indesiderati sono elencati secondo la classificazione organica e ponderati per grado di frequenza in base alle seguenti definizioni: molto comune (≥1/10), comune (≥1/100, <1/10), non comune (≥1/1'000, <1/100), raro (≥1/10'000, <1/1'000).
Infezioni ed infestazioni
Molto comune: infezioni (23.9%).
Comune: sepsi/setticemia.
Tumori benigni, maligni e non specificati (cisti e polipi compresi)
Non comune: leucemia secondaria (LLA, LMA).
Patologie del sistema emolinfopoietico
Molto comune: leucopenia (in caso di monoterapia con 60 mg/m2: 80%, grado 4 15%), neutropenia, anemia (78%), trombocitopenia (73%).
Disturbi del sistema immunitario
Molto raro: anafilassi.
Disturbi del metabolismo e della nutrizione
Molto comune: appetito ridotto (29%), aumento ponderale (14.4% nei pazienti con carcinoma mammario in stadio iniziale durante un trattamento adiuvante contenente doxorubicina).
Non comune: anoressia.
Molto raro: iperuricemia.
Frequenza non nota: disidratazione, iperuricemia.
Patologie dell'occhio
Comune: congiuntivite.
Raro: cheratite, aumento della lacrimazione.
Patologie cardiache
Molto comune: riduzione della frazione di eiezione del ventricolo sinistro (350-450 mg/m2: 38%; >450 mg/m2: 70%), ECG anormale (15%).
Comune: insufficienza cardiaca congestizia, tachicardia sinusale.
Non comune: cardiomiopatia (blocco atrioventricolare, tachiaritmie, blocco di branca, bradicardia, pericardite, miocardite).
Patologie vascolari
Non comune: embolie (tromboembolia, embolia polmonare).
Molto raro: emorragia, tromboflebite.
Frequenza non nota: shock, flebite, vampate di calore.
Patologie gastrointestinali
Molto comune: infiammazioni delle mucose/stomatite (70%), vomito (45%), nausea (12-21%), diarrea (14%).
Comune: esofagite, dolori addominali.
Non comune: colite.
Molto raro: ulcerazioni e necrosi dell'intestino crasso, gastrite erosiva, iperpigmentazione/alterazione del colore della mucosa orale.
Frequenza non nota: emorragie gastrointestinali.
Patologie epatobiliari
Molto comune: transaminasi aumentate (39-71%).
Patologie della cute e del tessuto sottocutaneo
Molto comune: alopecia (90-100%), eritrodisestesia palmo-plantare (22-29%).
Comune: orticaria, esantema, iperpigmentazione della cute e delle unghie.
Raro: fotosensibilità, ipersensibilità di distretti cutanei precedentemente irradiati («fenomeno di richiamo»).
Molto raro: prurito, alterazioni della cute, eritema acrale.
Patologie renali e urinarie
Comune: colorazione rossa delle urine dovuta al medicamento nei primi 1-2 giorni di trattamento.
Patologie dell'apparato riproduttivo e della mammella
Molto raro: amenorrea, azoospermia, oligospermia.
Patologie generali e condizioni relative alla sede di somministrazione
Molto comune: astenia (57%), brividi (15%), febbre (13%).
Comune: reazioni in sede di infusione (flebosclerosi, stravaso con necrosi tissutale).
Molto raro: malessere.
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-benefico del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sul sito www.swissmedic.ch.
Posologia eccessiva
Segni e sintomi
Dosi singole molto elevate di Adriblastin possono causare degenerazione del miocardio nell'arco di 24 h e grave depressione midollare nell'arco di 10-14 giorni.
Trattamento
Il trattamento deve prevedere misure di supporto e includere, se necessario, trasfusioni di sangue e isolamento. Con i derivati delle antracicline, l'insufficienza cardiaca è stata riscontrata fino a 6 mesi dopo il sovradosaggio. Pertanto, i pazienti devono essere attentamente monitorati. Se si manifesta un'insufficienza cardiaca, quest'ultima deve essere trattata in modo convenzionale.
Proprietà/Effetti
Codice ATC
L01DB01
Meccanismo d'azione
La doxorubicina è un antibiotico antraciclinico ad azione antineoplastica che viene isolato da colture di Streptomyces peucetius var. caesius.
La doxorubicina si lega al DNA e inibisce la sintesi degli acidi nucleici attraverso l'inibizione della topoisomerasi II. Ciò determina l'inibizione dell'attività mitotica e l'insorgenza di aberrazioni cromosomiche.
Farmacodinamica
Cfr. «Meccanismo d'azione».
Efficacia clinica
Nessuna indicazione.
Farmacocinetica
La farmacocinetica della doxorubicina può essere descritta con un modello bi- o tricompartimentale.
Assorbimento
Uso endovenoso.
Distribuzione
La doxorubicina mostra un'ampia distribuzione nei tessuti con un volume di distribuzione di 700-1'100 l/m2. Il passaggio nel liquor è limitato. La doxorubicina si distribuisce rapidamente nelle asciti, dove raggiunge concentrazioni superiori ai livelli plasmatici. Il legame con le proteine plasmatiche è del 50-85%.
Metabolismo
La doxorubicina viene parzialmente metabolizzata. Il metabolita principale è il doxorubicinolo attivo (=adriamicinolo=13-OH-doxorubicina). La metabolizzazione avviene sia nel fegato sia a livello extraepatico mediante una aldo-cheto reduttasi NADPH-dipendente.
Eliminazione
L'eliminazione avviene principalmente attraverso la bile e le feci, per il 40-50% in forma immodificata e per il 23% sotto forma di doxorubicinolo. L'eliminazione renale è limitata (5-15% della dose) e avviene in forma immodificata. La clearance della doxorubicina è di 400-583 ml/min/m2, l'emivita terminale è di 17 h (metaboliti 30-50 h).
Cinetica di gruppi di pazienti speciali
Disturbi della funzionalità epatica
L'escrezione della doxorubicina risulta rallentata nei pazienti con compromissione della funzionalità epatica, il che determina un accumulo nel plasma e nei tessuti.
Disturbi della funzionalità renale
Non sono disponibili dati sulla farmacocinetica nei pazienti con compromissione della funzionalità renale e nei pazienti geriatrici. La clearance sistemica risulta ridotta nei pazienti fortemente in sovrappeso.
Bambini e adolescenti
In 52 bambini di età superiore ai 2 anni la clearance è risultata aumentata rispetto agli adulti (1'540 ml/min/m2). In 8 bambini di età compresa tra i 2 mesi e i 2 anni la clearance è risultata ridotta (813 ml/min/m2) rispetto a bambini più grandi e si è avvicinata ai valori di clearance degli adulti.
Dati preclinici
Mutagenicità
La doxorubicina risulta mutagena in vitro e in vivo.
Cancerogenicità
Dopo una singola somministrazione endovenosa ai ratti è stato osservato un aumento della frequenza dei tumori.
Tossicità per la riproduzione
Gli effetti sui parametri di tossicità per la riproduzione sono stati esaminati in ratti e conigli. La doxorubicina è stata somministrata a femmine di ratto a dosi pari a 0.025, 0.050 e 0.2 mg/kg per via e.v. ogni giorno a partire dal 14° giorno prima dell'accoppiamento fino al periodo di allattamento. Non sono stati osservati effetti tossici per la madre. L'indice di fertilità del gruppo trattato con dosi medie ed elevate è risultato ridotto, anche se in misura non significativa.
I ratti maschi a cui la doxorubicina è stata somministrata nei giorni 6, 16, 24 e 45 dopo la nascita hanno manifestato compromissioni degli organi riproduttivi e della fertilità fino al 16° giorno. A partire dal giorno 24 gli effetti sugli organi riproduttivi e sulla conta spermatica sono risultati reversibili; a partire dal giorno 45 non è stato riscontrato alcun effetto. Nei ratti e nei conigli si sono manifestati effetti embriotossici alla dose di 0.2 mg/kg.
Altre indicazioni
Incompatibilità
Adriblastin non deve essere somministrato in combinazione con eparina, desametasone, fluorouracile, idrocortisone sodio succinato, aminofillina o cefalotina (ad es. all'interno della stessa sacca di infusione o nel raccordo a Y della linea di infusione), in quanto possono formarsi dei precipitati. Qualora si renda necessario un trattamento concomitante con questi medicamenti, si dovrà sciacquare la linea di infusione tra una somministrazione e l'altra di queste sostanze.
Il contatto prolungato con soluzioni alcaline idrolizza il principio attivo. Adriblastin RD e Solution possono essere somministrati soltanto in combinazione con i medicamenti riportati alla voce «Indicazioni per la manipolazione».
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Stabilità dopo apertura
Adriblastin RD
Dopo la ricostituzione (cfr. di seguito «Indicazioni per la manipolazione»), la soluzione è stabile a livello chimico-fisico per 30 giorni a una temperatura di 2-8 °C, se al riparo dalla luce. Per ragioni microbiologiche, la soluzione deve essere utilizzata immediatamente dopo la preparazione. Se necessario, può essere conservata al massimo per 24 h in frigorifero (2-8 °C) e al riparo dalla luce.
Dopo la diluizione per l'infusione lenta (cfr. «Indicazioni per la manipolazione»), la stabilità chimico-fisica della polvere ricostituita e diluita è stata dimostrata per 24 h al riparo dalla luce. Per ragioni microbiologiche, deve essere utilizzata immediatamente dopo la diluizione.
Adriblastin Solution
Adriblastin Solution non contiene conservanti. La soluzione deve essere utilizzata immediatamente dopo l'apertura dei flaconcini. Se necessario, può essere conservata al massimo per 24 h in frigorifero (2-8 °C) e al riparo dalla luce.
Dopo la diluizione per l'infusione lenta (cfr. «Indicazioni per la manipolazione»), la stabilità chimico-fisica della soluzione diluita è stata dimostrata per 48 h al riparo dalla luce. Per ragioni microbiologiche, deve essere utilizzata immediatamente dopo la diluizione.
Indicazioni particolari concernenti l'immagazzinamento
Conservare fuori dalla portata dei bambini.
Adriblastin RD
Conservare a temperatura ambiente (15-25 °C).
Adriblastin Solution
Conservare in frigorifero (2-8 °C) al riparo dalla luce. La conservazione di Adriblastin Solution in frigorifero può portare alla formazione di un prodotto gelatinoso. A temperatura ambiente (15-25 °C), quest'ultimo torna ad assumere una consistenza da leggermente viscosa a completamente mobile nell'arco di 2-4 h al massimo.
A temperatura ambiente (15-25 °C) la soluzione non deve essere conservata per più di 24 h e deve essere conservata al riparo dalla luce.
Indicazioni per la manipolazione
Indicazioni relative ai citostatici
Per la manipolazione di Adriblastin RD e Solution, la preparazione della soluzione iniettabile e lo smaltimento devono essere seguite le linee guida per l'uso dei citostatici.
Preparazione di Adriblastin RD
Per la ricostituzione, la polvere da 10 mg viene disciolta con 5 ml di NaCl 0.9% e quella da 50 mg con 25 ml di NaCl 0.9%.
La confezione della posologia da 10 mg contiene il relativo solvente (soluzione di NaCl allo 0.9%). La confezione della posologia da 50 mg non contiene alcun solvente. Per la ricostituzione si può utilizzare anche acqua per preparazioni iniettabili al posto della soluzione di NaCl allo 0.9%.
Preparazione di Adriblastin Solution
Adriblastin Solution è pronto all'uso e può essere utilizzato direttamente. Tuttavia, prima dell'uso la soluzione deve essere portata a temperatura ambiente.
Somministrazione
La soluzione di Adriblastin preparata o pronta all'uso deve essere iniettata per via endovenosa entro 3-10 min per ridurre il rischio di trombosi o stravaso. Va assolutamente evitata la somministrazione paravenosa. Pertanto, occorre assicurarsi che l'ago o il catetere venoso di un'infusione siano posizionati correttamente iniettando preventivamente una soluzione di NaCl allo 0.9%. Dopo la somministrazione, l'ago o il catetere venoso vengono quindi sciacquati con una soluzione di NaCl allo 0.9%.
Adriblastin non deve essere somministrato per via intramuscolare o intratecale.
Infusione lenta: per l'infusione lenta, la dose necessaria per 24 h calcolata sulla base della polvere ricostituita o di Adriblastin Solution deve essere inserita in 500-1'000 ml di soluzione NaCl allo 0.9%. La sacca di infusione e la strumentazione per l'infusione devono essere rivestite in modo tale da essere protette dalla luce (ad es. con fogli d'alluminio).
Numero dell'omologazione
50357, 50358 (Swissmedic).
Titolare dell’omologazione
Pfizer AG, Zürich.
Stato dell'informazione
Maggio 2020.
LLD V016
Composition
Principes actifs
Doxorubicini hydrochloridum.
Excipients
Adriblastin RD
Poudre et solvant pour solution injectable
Poudre à 10 mg: methylis parahydroxybenzoas (E 218) 1 mg, lactosum monohydricum.
Solvant: natrii chloridum (corresp. natrium 3.54 mg/ml), aqua ad iniectabilia.
Poudre pour solution injectable
Poudre à 50 mg: methylis parahydroxybenzoas (E 218) 5 mg, lactosum monohydricum.
Adriblastin Solution
Solution injectable à 10 mg/5 ml: natrii chloridum (corresp. natrium 17.7 mg), acidum hydrochloridum, aqua ad iniectabilia.
Solution injectable à 20 mg/10 ml: natrii chloridum (corresp. natrium 35.4 mg), acidum hydrochloridum, aqua ad iniectabilia.
Solution injectable à 50 mg/25 ml: natrii chloridum (corresp. natrium 88.5 mg), acidum hydrochloridum, aqua ad iniectabilia.
Forme pharmaceutique et quantité de principe actif par unité
Adriblastin RD (Rapid Dissolution)
Poudre et solvant pour solution injectable.
Pour injection intraveineuse.
Poudre à 10 mg: 1 flacon contient 10 mg de chlorhydrate de doxorubicine.
Poudre agglomérée rouge/poudre rouge.
Solvant: 1 ampoule contient 5 ml de solution NaCl à 0.9%.
1 ml de solution injectable prête à l'emploi contient 2 mg/ml de chlorhydrate de doxorubicine (voir «Remarques particulières/Remarques concernant la manipulation»).
Poudre pour solution injectable.
Pour injection intraveineuse.
Poudre à 50 mg: 1 flacon contient 50 mg de chlorhydrate de doxorubicine. Poudre agglomérée rouge/poudre rouge.
1 ml de solution injectable prête à l'emploi contient 2 mg/ml de chlorhydrate de doxorubicine (voir «Remarques particulières/Remarques concernant la manipulation»).
Adriblastin Solution
Solution injectable.
Pour injection intraveineuse.
Solution injectable à 10 mg: 1 flacon à 5 ml contient 10 mg de chlorhydrate de doxorubicine, soit 2 mg/ml. Solution limpide rouge.
Solution injectable à 20 mg: 1 flacon à 10 ml contient 20 mg de chlorhydrate de doxorubicine, soit 2 mg/ml. Solution limpide rouge.
Solution injectable à 50 mg: 1 flacon à 25 ml contient 50 mg de chlorhydrate de doxorubicine, soit 2 mg/ml. Solution limpide rouge.
Indications/Possibilités d’emploi
Traitement en cas de cancer du sein, cancer bronchique, sarcome des parties molles et ostéosarcome, cancers gynécologiques et cancer de la vessie, tumeur testiculaire, cancer de la thyroïde, synovialome, sarcome d'Ewing, néphroblastome, neuroblastome, lymphome non hodgkinien, maladie de Hodgkin, leucémies lymphoblastiques et myéloblastiques aiguës.
Posologie/Mode d’emploi
Le médicament ne doit être administré que sous la surveillance d'un oncologue/hématologue expérimenté en chimiothérapie.
Le médicament est généralement administré par injection intraveineuse lente pendant 3-10 min ou, dans certains cas exceptionnels, par perfusion intraveineuse prolongée pendant 48-96 h. Concernant la reconstitution des solutions/la manipulation voir «Remarques particulières/Remarques concernant la manipulation».
Posologie usuelle
La doxorubicine est utilisée en monothérapie ou dans le cadre d'un protocole thérapeutique préétabli (informations détaillées dans la littérature).
Monothérapie
Traitement intermittent à raison d'une dose unitaire de 75 mg/m² de surface corporelle, toutes les 3 semaines.
Monothérapie chez les malades préalablement traités et en polychimiothérapie
Traitement intermittent à raison d'une dose unitaire de 30-60 mg/m² de surface corporelle, toutes les 3 semaines.
Maladies hématologiques
Traitement intermittent à raison de 0.6 mg/kg/jour pendant 3 jours ou de 0.8 mg/kg/jour pendant 2 jours, en respectant un intervalle sans traitement d'au moins 10 jours entre les séries d'injections.
La dose maximale cumulative ne doit pas dépasser 550 mg/m² de surface corporelle. Cette limite posologique doit être réduite à 400 mg/m² lorsque le traitement par Adriblastin est précédé d'une radiothérapie de la région médiastinale.
En outre, la dose maximale sera déterminée individuellement pour chaque patient en fonction du traitement préalable ou simultané par d'autres substances potentiellement cardiotoxiques telles que d'autres anthracyclines, des anthraquinones ou le cyclophosphamide.
Ajustement de la posologie du fait d'effets indésirables/d'interactions
Ajustement du fait de la toxicité
Hématotoxicité
Leucocytes/µl | Thrombocytes/µl | Dose d'Adriblastin |
Plus de 5'000 | Plus de 150'000 | 100% |
4'000-5'000 | 100'000-150'000 | 75% |
3'000-4'000 | 75'000-100'000 | 50% |
2'000-3'000 | 50'000-75'000 | 25% |
Moins de 2'000 | Moins de 50'000 | 0% |
Stomatite
En cas de stomatite, le traitement ne peut reprendre que lorsque les lésions sont complètement guéries. Les doses suivantes doivent alors être réduites de moitié.
Instructions posologiques particulières
Chez les patients ne pouvant recevoir la dose totale pour des raisons médicales (par ex. immunosuppression, hématopoïèse réduite, âge avancé, etc.), les schémas posologiques suivants sont recommandés pour la mono- ou la polychimiothérapie:
- Perfusion prolongée de 60 mg/m² de surface corporelle pendant 48-96 h.
- Administration hebdomadaire d'une dose faible de 5-15 mg/m², sans dépasser une dose totale de 20 mg par traitement unitaire.
- Administration hebdomadaire d'une dose faible de 20 mg/m² de surface corporelle.
Patients présentant des troubles de la fonction hépatique
Chez les patients présentant une hyperbilirubinémie jusqu'à 51 µmol/l, la dose doit être réduite de 50%; elle doit être réduite de 75% lorsque le taux de bilirubine se situe entre 51-81 µmol/l. La doxorubicine est contre-indiquée en cas de trouble sévère de la fonction hépatique.
Patients présentant des troubles de la fonction rénale
Aucun ajustement posologique n'est nécessaire en cas de trouble léger à modéré de la fonction rénale. Toutefois, les patients présentant un trouble sévère de la fonction rénale (ClCr <10 ml/min) ne doivent recevoir que 75% de la dose maximale.
Enfants et adolescents
L'utilisation chez l'enfant et l'adolescent exige une prudence particulière.
Contre-indications
Hypersensibilité à la doxorubicine, aux autres anthracyclines, aux anthraquinones ou à l'un des excipients (voir «Composition»).
Dépression de la moelle osseuse préexistante.
Forte limitation de la fonction hépatique.
Insuffisance cardiaque sévère.
Infarctus du myocarde récent.
Affections aiguës du myocarde d'origine inflammatoire.
Arythmies sévères.
Traitement par des doses cumulatives maximales de doxorubicine et/ou par d'autres anthracyclines ou des anthraquinones.
Infections florides.
Grossesse, allaitement.
Hématurie.
Mises en garde et précautions
Généralités
Avant de débuter un traitement par doxorubicine, les patients doivent être rétablis des suites de la toxicité aiguë d'un traitement cytotoxique précédent (par ex. stomatite, neutropénie, thrombopénie et infections généralisées).
Système hématopoïétique
En raison d'une possible dépression médullaire, le nombre d'érythrocytes, de leucocytes et de thrombocytes doit être déterminé avant et pendant chaque cycle de traitement.
Une leucopénie est généralement temporaire. Les valeurs les plus basses concernant les leucocytes sont atteintes 10-14 jours après le traitement. Après 21 jours environ, elles sont à nouveau dans les limites normales.
Une leucémie secondaire a été observée après un temps de latence de 1-3 ans consécutivement à un traitement par des anthracyclines (y compris la doxorubicine), en particulier lorsque des cytostatiques délétères pour l'ADN étaient administrés simultanément. Ce risque peut être accru en cas de traitement simultané par des facteurs de croissance hématopoïétiques ou en cas de radiothérapie.
Hépatotoxicité
Un contrôle de la fonction hépatique est recommandé avant et pendant le traitement (TGOS, TGPS, phosphatase alcaline, bilirubine); voir aussi «Posologie/Mode d'emploi».
Fonction cardiaque
Une prudence particulière est de rigueur en ce qui concerne la cardiotoxicité associée à la doxorubicine, laquelle peut se manifester sous forme immédiate ou tardive.
Toxicité immédiate:
La cardiotoxicité précoce survient de manière aiguë durant le traitement (le plus souvent 24 à 48 h après l'instauration du traitement) et se manifeste essentiellement par des tachycardies sinusales et/ou des anomalies de l'ECG, telles que des modifications non spécifiques du segment ST. Des cas de tachyarythmies, y compris des contractions ventriculaires prématurées, une tachycardie ventriculaire et une bradycardie, ainsi que des blocs AV ou des blocs de branche gauche ont été rapportés. Ceux-ci sont rarement cliniquement pertinents et ne motivent généralement pas l'arrêt du traitement par la doxorubicine.
Toxicité tardive:
La cardiotoxicité différée peut survenir plus tard au cours du traitement ou 2 à 3 mois, voire plusieurs mois ou années après la fin du traitement, sous la forme d'une cardiomyopathie. Celle-ci se manifeste par une réduction de la FEVG (fraction d'éjection ventriculaire gauche), un sous-voltage et un allongement du segment QT, et/ou sous la forme d'une insuffisance cardiaque décompensée avec des symptômes tels que dyspnée, œdème pulmonaire, œdème congestif, cardiomégalie et hépatomégalie, oligurie, ascite, épanchement pleural et rythme de galop. Des effets subaigus tels que péricardite/myocardite ont également été observés. Une insuffisance cardiaque potentiellement fatale est la forme la plus grave de cardiomyopathie induite par les anthracyclines et représente la toxicité cumulée dose-limitante de la substance.
Surveillance de la fonction cardiaque:
La fonction cardiaque doit être déterminée avant le début du traitement, puis surveillée pendant toute la durée de celui-ci pour diminuer le risque d'atteinte cardiaque sévère. La surveillance de la fonction cardiaque doit être particulièrement stricte chez les patients recevant des doses cumulatives élevées ou présentant des facteurs de risque. Une cardiotoxicité peut néanmoins aussi apparaître avec de faibles doses et indépendamment de la présence ou non de facteurs de risque.
Le traitement doit être immédiatement arrêté dès les premiers signes d'un trouble de la fonction cardiaque. Les méthodes quantitatives adéquates pour des déterminations répétées de la FEVG sont l'angiographie multiplane (multi-gated radionuclide angiography ou MUGA) ou l'échocardiographie (ECHO).
Les enfants et les adolescents sont particulièrement exposés au développement d'une cardiotoxicité tardive. Ce risque semble plus élevé chez les filles que chez les garçons. Au cours d'un suivi à long terme sur 10 ans, une insuffisance cardiaque congestive a été observée dans 5 à 10% des cas. Les patients pédiatriques ayant été traités par la doxorubicine devront donc être régulièrement surveillés dans le cadre d'un suivi à long terme.
Dose cumulée totale:
Le risque d'insuffisance cardiaque décompensée augmente rapidement avec la dose cumulée totale de doxorubicine. Pour une dose cumulée de 300 mg/m2, la probabilité d'apparition d'une insuffisance cardiaque sévère est d'environ 1 à 2% et elle augmente lentement jusqu'à ce qu'une dose cumulée de 450-550 mg/m2 soit atteinte. Au-delà, le risque augmente très fortement. Il est donc recommandé de ne pas dépasser une dose cumulée de 550 mg/m2. Lors du calcul de la dose de doxorubicine, il convient de tenir compte d'un éventuel traitement antérieur ou simultané par d'autres anthracyclines, telles que l'épirubicine, l'idarubicine, la daunorubicine ou des dérivés anthracéniques. Il y a tout lieu de penser que la toxicité de la doxorubicine s'additionne à celle d'autres anthracyclines.
Facteurs de risque:
Les facteurs de risque de cardiotoxicité sont les maladies cardiovasculaires manifestes ou latentes, une irradiation médiastinale/péricardique antérieure ou simultanée, un traitement antérieur par d'autres anthracyclines ou anthraquinones, ainsi que l'administration concomitante de médicaments pouvant diminuer la contractilité cardiaque ou potentiellement cardiotoxiques (par ex. trastuzumab).
Les anthracyclines, y compris la doxorubicine, ne doivent être administrées avec d'autres substances cardiotoxiques que sous surveillance simultanée étroite de la fonction cardiaque du patient. Le risque d'effet cardiotoxique des anthracyclines pourrait être accru même après l'arrêt d'autres médicaments cardiotoxiques, en particulier lorsque ceux-ci présentent une longue demi-vie. La demi-vie du trastuzumab varie; la substance peut être présente dans le sang pendant une durée allant jusqu'à 7 mois. Dans la mesure du possible, il convient donc d'éviter d'administrer un traitement par des anthracyclines pendant 7 mois après l'arrêt du trastuzumab. En cas d'utilisation d'anthracyclines avant la fin de cette période, il convient de surveiller étroitement la fonction cardiaque.
Syndrome de lyse tumorale
La doxorubicine peut entraîner une hyperuricémie. Avant et après le début du traitement, les taux d'acide urique, de potassium, de calcium, de phosphate et de créatinine doivent être contrôlés. Une bonne hydratation, l'alcalinisation de l'urine et l'administration prophylactique d'allopurinol en vue d'éviter une hyperuricémie sont susceptibles de réduire le risque de complications potentielles de l'hyperuricémie.
Réactions au site d'injection, extravasation
L'injection dans un vaisseau de petit calibre ou l'injection répétée dans la même veine peut entraîner une phlébosclérose.
Une extravasation de doxorubicine pendant l'injection intraveineuse peut provoquer des douleurs locales, des lésions tissulaires sévères et une nécrose. Le traitement doit être immédiatement interrompu si des symptômes d'extravasation surviennent pendant l'injection intraveineuse.
Effet immunosuppresseur
L'administration de vaccins vivants ou atténués chez les patients immunosupprimés par une chimiothérapie (y compris Adriblastin) peut provoquer des infections sévères ou fatales. Toute immunisation par des vaccins vivants doit être évitée chez les patients sous Adriblastin. Lors de l'utilisation de vaccins inactivés ou tués, il faut tenir compte de l'éventualité d'une diminution de la protection vaccinale.
Autres médicaments
Un coma et des convulsions ont été décrits lors de l'administration concomitante de ciclosporine et de doxorubicine (voir «Interactions»).
Excipients revêtant un intérêt particulier
Adriblastin RD 10 mg contient 1 mg et Adriblastin RD 50 mg contient 5 mg de l'excipient «4-hydroxybenzoate de méthyle» (E 218). Le 4-hydroxybenzoate de méthyle (E 218) peut provoquer des réactions allergiques (éventuellement retardées), et exceptionnellement, des bronchospasmes.
Le médicament prêt à l'emploi contient 3.54 mg de sodium par ml. La teneur en sodium dans 1 ml du médicament prêt à l'emploi correspond à 0.18% de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte. Il convient d'en tenir compte, notamment chez les patients suivant un régime pauvre en sodium.
Interactions
La doxorubicine est un substrat des cytochromes P450 CYP3A4 et CYP2D6 ainsi que de la glycoprotéine P (P-gp). Des interactions cliniquement significatives avec des inhibiteurs du CYP3A4, du CYP2D6 et/ou de la P-gp (par ex. vérapamil) ont été décrites, lesquelles entraînent une augmentation de la concentration et des effets cliniques de la doxorubicine. Les inducteurs du CYP3A4 (par ex. phénobarbital, phénytoïne, millepertuis) et de la P-gp peuvent diminuer la concentration de doxorubicine.
L'administration concomitante de ciclosporine et de doxorubicine peut entraîner une augmentation de l'AUC de la doxorubicine ainsi que du doxorubicinol. Les rapports publiés dans la littérature indiquent que l'administration concomitante de ciclosporine et de doxorubicine peut provoquer une hématotoxicité accrue et prolongée par rapport à l'administration de la doxorubicine seule. Un coma et des convulsions ont également été décrits lors de l'administration concomitante de ciclosporine et de doxorubicine.
La doxorubicine peut renforcer la toxicité d'autres traitements antinéoplasiques et inversement.
Selon certains rapports d'études, la doxorubicine a aggravé une cystite hémorragique induite par le cyclophosphamide et accentué une hépatotoxicité induite par la mercaptopurine.
Une administration concomitante ou antérieure d'autres anthracyclines, d'anthraquinones ou de cyclophosphamide, ainsi que l'irradiation de la région cardiaque peuvent accentuer la cardiotoxicité de la doxorubicine. Dans ces cas, la dose cumulative maximale de doxorubicine doit être diminuée (voir «Posologie/Mode d'emploi» et «Mises en garde et précautions»).
La fonction cardiaque doit être surveillée au cours du traitement en cas d'administration concomitante d'autres médicaments agissant sur le cœur (par ex. antagonistes des canaux calciques).
Grossesse/Allaitement
Grossesse
L'expérimentation animale a montré des effets néfastes pour le fœtus ou l'expérience acquise chez l'animal indique un risque fœtal, ce qui laisse supposer que les risques liés à l'emploi de ce médicament dépassent largement les bénéfices possibles. Le médicament est contre-indiqué chez la femme enceinte (voir «Contre-indications»). Si un traitement s'avère nécessaire, les femmes en âge de procréer devront recourir à une méthode de contraception fiable pendant le traitement et jusqu'à 6 mois après la fin de traitement.
Allaitement
Étant donné que la doxorubicine passe dans le lait maternel, l'allaitement est contre-indiqué pendant l'utilisation de la doxorubicine.
Effet sur l’aptitude à la conduite et l’utilisation de machines
En raison de la survenue fréquente de nausées et de vomissements, Adriblastin a une influence importante sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirables
Myélodépression et cardiomyopathies sont les effets indésirables les plus graves.
Les effets indésirables sont répertoriés selon les classes d'organes et pondérés en fonction de leur fréquence, en tenant compte des définitions suivantes: très fréquents (≥1/10), fréquents (≥1/100 à <1/10), occasionnels (≥1/1'000 à <1/100), rares (≥1/10'000 à <1/1'000).
Infections et infestations
Très fréquents: infections (23.9%).
Fréquents: sepsis/septicémie.
Tumeurs bénignes, malignes et non précisées (incl. kystes et polypes)
Occasionnels: leucémie secondaire (LLA, LMA).
Affections hématologiques et du système lymphatique
Très fréquents: leucopénie (en monothérapie avec 60 mg/m2: 80%, grade 4: 15%), neutropénie, anémie (78%), thrombopénie (73%).
Affections du système immunitaire
Très rares: anaphylaxie.
Troubles du métabolisme et de la nutrition
Très fréquents: appétit diminué (29%), gain pondéral (14.4%; chez les patientes ayant des antécédents de cancer du sein en cas de traitement adjuvant incluant de la doxorubicine).
Occasionnels: anorexie.
Très rares: hyperuricémie.
Fréquence indéterminée: déshydratation, hyperuricémie.
Affections oculaires
Fréquents: conjonctivite.
Rares: kératite, augmentation de la sécrétion lacrymale.
Affections cardiaques
Très fréquents: réduction de la fraction d'éjection ventriculaire gauche (350-450 mg/m2: 38%; >450 mg/m2: 70%), anomalies à l'ECG (15%).
Fréquents: insuffisance cardiaque congestive, tachycardie sinusale.
Occasionnels: cardiomyopathie (bloc atrio-ventriculaire, tachyarythmies, bloc de branche, bradycardie, péricardite, myocardite).
Affections vasculaires
Occasionnels: embolies (thrombo-embolie, embolie pulmonaire).
Très rares: hémorragie, thrombophlébite.
Fréquence indéterminée: choc, phlébite, bouffées de chaleur.
Affections gastro-intestinales
Très fréquents: inflammations muqueuses/stomatite (70%), vomissement (45%), nausée (12-21%), diarrhée (14%).
Fréquents: œsophagite, douleurs abdominales.
Occasionnels: colite.
Très rares: ulcérations et nécroses du côlon, gastrite érosive, hyperpigmentation/coloration de la muqueuse buccale.
Fréquence indéterminée: saignements gastro-intestinaux.
Affections hépatobiliaires
Très fréquents: transaminases augmentées (39-71%).
Affections de la peau et du tissu sous-cutané
Très fréquents: alopécies (90-100%), érythrodysesthésie palmo-plantaire (22-29%).
Fréquents: urticaire, exanthème, hyperpigmentation de la peau et des ongles.
Rares: photosensibilité, hypersensibilité des zones cutanées préalablement irradiées («phénomène de rappel»).
Très rares: prurit, altérations cutanées, érythèmes acraux.
Affections du rein et des voies urinaires
Fréquents: coloration rouge de l'urine, due au médicament, au cours des 1 à 2 premiers jours du traitement.
Affections des organes de reproduction et du sein
Très rares: aménorrhée, azoospermie, oligospermie.
Troubles généraux et anomalies au site d'administration
Très fréquents: asthénie (57%), frissons (15%), fièvre (13%).
Fréquents: réaction au site de perfusion (phlébosclérose, extravasation avec nécrose tissulaire).
Très rares: malaise.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Signes et symptômes
Des doses unitaires très élevées d'Adriblastin peuvent provoquer une dégénérescence myocardique en l'espace de 24 h et une aplasie médullaire sévère en l'espace de 10 à 14 jours.
Traitement
Le traitement doit comporter des mesures de soutien et éventuellement des transfusions sanguines et un séjour en chambre stérile. Des insuffisances cardiaques ont été observées jusqu'à 6 mois après un surdosage en anthracyclines. En conséquence, les patients doivent être étroitement surveillés. L'apparition d'une insuffisance cardiaque nécessite son traitement selon les méthodes habituelles.
Propriétés/Effets
Code ATC
L01DB01
Mécanisme d'action
Isolée dans des cultures de Streptomyces peucetius var. caesius, la doxorubicine est un antibiotique de type anthracycline doté d'une action antinéoplasique.
La doxorubicine se lie à l'ADN et inhibe la synthèse des acides nucléiques en inhibant la topoisomérase II. Il en résulte une inhibition de l'activité mitotique ainsi que l'apparition d'aberrations chromosomiques.
Pharmacodynamique
Voir «Mécanisme d'action».
Efficacité clinique
Aucune donnée.
Pharmacocinétique
La pharmacocinétique de la doxorubicine peut être décrite par un modèle à 2 ou 3 compartiments.
Absorption
Administration par voie intraveineuse.
Distribution
La doxorubicine présente une distribution tissulaire marquée avec un volume de distribution de 700-1'100 l/m2. Le passage dans le liquide céphalorachidien est minime. La doxorubicine se répartit rapidement dans les ascites et y atteint des concentrations supérieures au taux plasmatique. La liaison aux protéines plasmatiques est de 50-85%.
Métabolisme
La doxorubicine est partiellement métabolisée. Le métabolite principal est le doxorubicinol actif (=adriamycinol=13-OH-doxorubicine). La métabolisation a lieu aussi bien dans le foie que de manière extrahépatique par une réductase aldo-céto NADPH-dépendante.
Élimination
L'élimination se fait principalement par la bile et les selles, à raison de 40-50% sous forme inchangée et de 23% sous forme de doxorubicinol. L'élimination rénale est minime (5-15% de la dose) et sous forme inchangée. La clairance de la doxorubicine est de 400-583 ml/min/m2, la demi-vie terminale est de 17 h (métabolites 30-50 h).
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Chez les patients présentant une insuffisance hépatique, l'élimination de la doxorubicine est retardée, ce qui conduit à une accumulation dans le plasma et les tissus.
Troubles de la fonction rénale
Aucune donnée pharmacocinétique n'est disponible chez les patients présentant une insuffisance rénale et chez les patients gériatriques. La clairance systémique est réduite chez les patients présentant une forte surcharge pondérale.
Enfants et adolescents
Chez 52 enfants âgés de plus de 2 ans, la clairance était plus élevée que chez les adultes (1'540 ml/min/m2). Chez 8 enfants âgés de 2 mois à 2 ans, la clairance était plus basse (813 ml/min/m2) que celle des enfants plus âgés et comparable à celle observée chez l'adulte.
Données précliniques
Mutagénicité
La doxorubicine est mutagène in vitro et in vivo.
Carcinogénicité
Après une administration intraveineuse unique au rat, une augmentation de la fréquence des tumeurs a été observée.
Toxicité sur la reproduction
Les effets sur les paramètres de toxicologie reproductive ont été étudiés chez le rat et le lapin. La doxorubicine a été administrée au rat femelle à raison de 0.025, 0.050 et 0.2 mg/kg i.v. par jour du 14e jour avant l'accouplement jusqu'à la période d'allaitement. Aucun effet maternotoxique n'a été observé. L'indice de fertilité du groupe de posologie moyenne et haute était diminué, mais pas de manière significative.
Les rats mâles ayant reçu de la doxorubicine aux jours 6, 16, 24 et 45 après la naissance ont subi jusqu'au 16e jour des atteintes graves au niveau des organes génitaux et de la fertilité. À partir du 24e jour, les effets sur le poids des organes génitaux et sur le nombre de spermatozoïdes étaient réversibles et aucun effet n'était reconnaissable dès le 45e jour. Chez le rat et le lapin, des effets embryotoxiques sont apparus dans le domaine posologique de 0.2 mg/kg.
Remarques particulières
Incompatibilités
Adriblastin ne doit pas être mélangé aux substances suivantes: héparine, dexaméthasone, fluorouracil, succinate sodique d'hydrocortisone, aminophylline ou céfalotine (par ex. dans la même poche de perfusion ou au niveau du raccord en Y de la tubulure de perfusion), car il y a risque de précipitations. Si un traitement concomitant par ces médicaments s'avère nécessaire, il convient de rincer la tubulure entre l'administration de ces substances.
Le principe actif s'hydrolyse en cas de contact prolongé avec des solutions alcalines. Adriblastin RD et Solution ne doivent être mélangés qu'aux médicaments mentionnés sous «Remarques concernant la manipulation».
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Stabilité après ouverture
Adriblastin RD
Après reconstitution (voir «Remarques concernant la manipulation», ci-dessous), la solution est chimiquement et physiquement stable pendant 30 jours à une température de 2-8 °C si elle est conservée à l'abri de la lumière. Pour des raisons microbiologiques, elle devrait être utilisée immédiatement après sa reconstitution. Si nécessaire, la solution peut être conservée au maximum 24 h au réfrigérateur (2-8 °C) et à l'abri de la lumière.
Après dilution pour l'administration en perfusion prolongée (voir «Remarques concernant la manipulation»), la stabilité chimique et physique de la poudre diluée et reconstituée a été démontrée pendant 24 h à l'abri de la lumière. Pour des raisons microbiologiques, elle devrait être utilisée immédiatement après sa dilution.
Adriblastin Solution
Adriblastin Solution ne contient pas d'agent conservateur. Après ouverture du flacon, la solution doit être utilisée immédiatement. Si nécessaire, la solution peut être conservée au maximum 24 h au réfrigérateur (2-8 °C) et à l'abri de la lumière.
Après dilution pour l'administration en perfusion prolongée (voir «Remarques concernant la manipulation»), la stabilité chimique et physique de la solution diluée a été démontrée pendant 48 h à l'abri de la lumière. Pour des raisons microbiologiques, elle devrait être utilisée immédiatement après sa dilution.
Remarques particulières concernant le stockage
Conserver hors de portée des enfants.
Adriblastin RD
Conserver à température ambiante (15-25 °C).
Adriblastin Solution
Conserver à l'abri de la lumière et au réfrigérateur (2-8 °C). La conservation d'Adriblastin Solution au réfrigérateur peut entraîner la formation d'un produit à consistance gélatineuse. Cet aspect disparaîtra après une exposition à température ambiante (15-25 °C) d'une durée de 2 à 4 h au maximum pour redonner une solution légèrement visqueuse à complètement fluide.
À température ambiante (15-25 °C), la solution ne peut être conservée au-delà de 24 h et uniquement à l'abri de la lumière.
Remarques concernant la manipulation
Remarques concernant les cytostatiques
Lors de la manipulation d'Adriblastin RD et Solution, de la préparation de la solution injectable et de son élimination, il convient de respecter la réglementation concernant les cytostatiques.
Reconstitution d'Adriblastin RD
Pour la reconstitution, la poudre de 10 mg doit être dissoute dans 5 ml et celle de 50 mg dans 25 ml de solution NaCl à 0.9%.
L'emballage du dosage à 10 mg contient le solvant correspondant (solution NaCl à 0.9%). Les emballages du dosage à 50 mg ne contiennent pas de solvant. Au lieu de la solution de NaCl à 0.9%, il est également possible d'utiliser de l'eau pour préparations injectables pour reconstituer la solution.
Reconstitution d'Adriblastin Solution
Adriblastin Solution est prêt à l'emploi et peut être utilisé immédiatement. Toutefois, la solution doit être amenée à température ambiante avant utilisation.
Administration
La solution préparée ou prête à l'emploi est injectée par voie intraveineuse en 3-10 min afin de réduire le risque de thrombose et d'extravasation. Il faut impérativement éviter une application paraveineuse. En conséquence, la position correcte de l'aiguille ou du cathéter veineux de la perfusion sera contrôlée en injectant préalablement une solution de NaCl à 0.9%. L'aiguille ou le cathéter veineux seront rincés avec une solution de NaCl à 0.9% après l'administration.
Adriblastin ne doit pas être administré par voie intramusculaire ou intrathécale.
Perfusion prolongée: pour l'administration en perfusion prolongée, la dose nécessaire pour 24 h sera déterminée à partir de la poudre reconstituée ou d'Adriblastin Solution et diluée dans 500-1'000 ml de solution de NaCl à 0.9%. La poche de perfusion et le set de perfusion doivent être protégés de la lumière (par ex. en les enveloppant dans une feuille d'aluminium).
Numéro d’autorisation
50357, 50358 (Swissmedic).
Titulaire de l’autorisation
Pfizer AG, Zürich.
Mise à jour de l’information
Mai 2020.
LLD V016
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


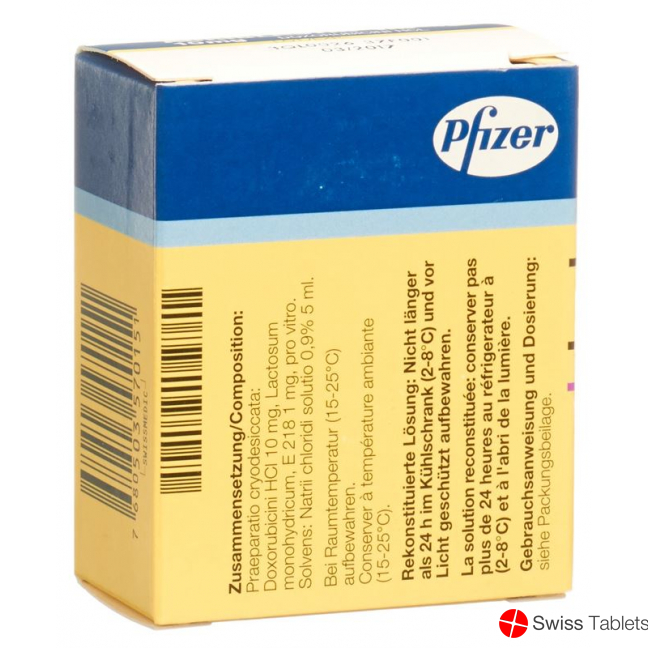
 Deutsch
Deutsch French
French Italian
Italian








