Targocid Trockensubstanz 200mg C Solv i.v./i.m. Ampullen buy online
Targocid Trockensub 200 mg mit Solvens i.v./i.m. Amp
-
99.77 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: SANOFI-AVENTIS
- Product Code: 1401416
- ATC-code J01XA02
- EAN 7680493390388
Ingredients:
Natriumchlorid, Trockensubstanz, Lösungsmittel, Teicoplanin 200 mg , pro vitro.

Description
AMZV
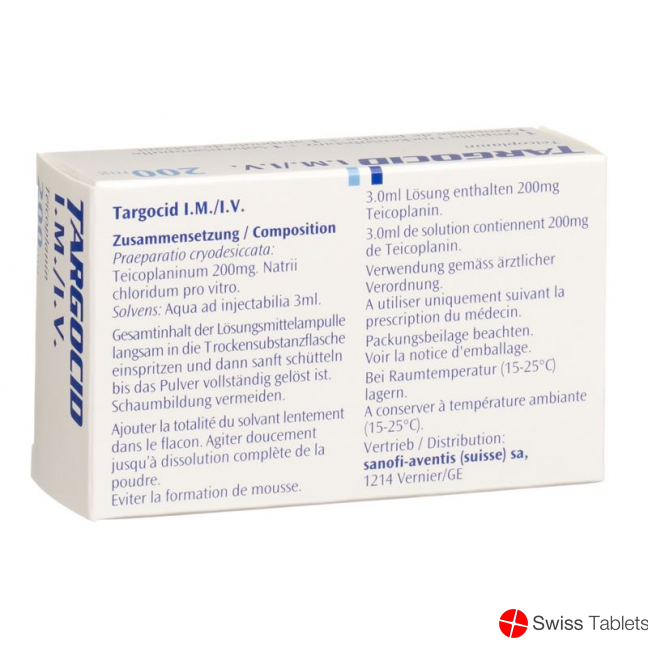
Zusammensetzung
Wirkstoff: Teicoplaninum (Praeparatio cryodesiccata).
Hilfsstoff: Natrii chloridum.
Solvens: Aqua ad injectabilia 3 ml (Solvens).
Galenische Form und Wirkstoffmenge pro Einheit
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung/Infusion oder Trinklösung.
Teicoplaninum (Praeparatio cryodesiccata) 200 mg bzw. 400 mg pro vitro.
Indikationen/Anwendungsmöglichkeiten
Parenterale Behandlung:
Targocid ist bei Erwachsenen und Kindern ab dem Säuglingsalter zur parenteralen Behandlung folgender Infektionen angezeigt:
Zur Therapie von Infektionen bei Methicillin- oder Cephalosporinresistenz, die durch grampositive Erreger verursacht wurden, sowie bei Penicillin-Allergie und bei Patienten, die auf Penicilline und Cephalosporine nicht angesprochen haben.
Zur Initialtherapie bei Verdacht auf Methicillin-resistente Keime (nach Vorliegen des Ergebnisses der Empfindlichkeitstestung sollte die Therapie entsprechend angepasst werden). Gegebenenfalls sind Kulturen anzulegen, um die ursächlichen Erreger und deren Empfindlichkeit gegenüber Teicoplanin festzustellen.
Targocid wird unter den obgenannten Voraussetzungen verwendet bei:
- infektiöser Endokarditis,
- Infektionen der Knochen und Gelenke,
- Infektionen der unteren Atemwege,
- Infektionen der Haut und Weichteile,
- komplizierte Harnwegsinfektionen,
- Peritonitis im Zusammenhang mit einer kontinuierlichen ambulanten Peritonealdialyse (CAPD),
- Septikämie.
Orale Einnahme:
Bei durch Clostridium difficile hervorgerufener pseudomembranöser Enterokolitis.
Anwendungsmöglichkeiten
Das antibakterielle Wirkspektrum von Teicoplanin ist eng (grampositive Erreger) und Teicoplanin muss meist gemeinsam mit anderen Antibiotika verabreicht werden. Eine Monotherapie mit Teicoplanin ist ausser bei bestimmten Infektionen, wenn der Keim bereits ermittelt und empfindlich oder mit hoher Wahrscheinlichkeit empfindlich gegenüber Teicoplainin ist, nicht sinnvoll.
Offizielle Empfehlungen zum angemessenen Gebrauch von Antibiotika sind zu beachten, insbesondere Anwendungsempfehlungen zur Verhinderung der Zunahme der Antibiotikaresistenz. Es wird empfohlen, dass die Diagnose und die Einleitung der Behandlung mit Targocid im Spital unter Überwachung eines Spezialisten stattfinden.
Dosierung/Anwendung
Dosierung bei Erwachsenen und Patienten höheren Alters mit normaler Nierenfunktion
Behandlung von Infektionen mit grampositiven Erregern
Indikationen | Initialdosis | Erhaltungsdosis | ||
Initialdosis | Ziel-Serumkonzentration an Tag 3–5 | Erhaltungsdosis | Ziel-Serumkonzentration in der Erhaltungstherapie | |
| 6 mg/kg Körpergewicht alle 12 Stunden für 3 intravenöse oder intramuskuläre Gaben | >15 mg/l(1) | 6 mg/kg Körpergewicht einmal täglich intravenös oder intramuskulär | >15 mg/l(1) einmal wöchentlich |
| 12 mg/kg Körpergewicht alle 12 Stunden für 3–5 intravenöse oder intramuskuläre Gaben | >20 mg/l(1) | 12 mg/kg Körpergewicht einmal täglich intravenös oder intramuskulär | >20 mg/l(1) |
| 12 mg/kg Körpergewicht alle 12 Stunden für 3–5 intravenöse Gaben | 30–40 mg/l(1) | 12 mg/kg Körpergewicht einmal täglich intravenös oder intramuskulär | >30 mg/l(1) |
(1) Messung mittels FPIA
Bei Patienten jeden Körpergewichts wird die Dosis gemäss dem Körpergewicht ermittelt.
Die Dosierung und Dauer der Behandlung richten sich nach der Art und Schwere der Infektion, dem klinischen Ansprechen des Patienten sowie patientenspezifischen Faktoren wie Lebensalter und Nierenfunktion.
Bestimmung der Serumkonzentration:
Die Teicoplanin-Serumkonzentration ist im Gleichgewichtszustand nach der letzten Initialdosis zu messen, um sicherzustellen, dass die minimale Serumkonzentration erreicht wurde:
- Bei den meisten Infektionen durch grampositive Erreger soll die Teicoplanin-Serumkonzentration stets mindestens 10 mg/l (gemessen mittels Hochleistungsflüssigkeitschromatographie [HPLC]) bzw. mindestens 15 mg/l (gemessen mittels Fluoreszenzpolarisations-Immunoassay [FPIA]).
- Bei Endokarditis oder anderen schweren Infektionen liegen diese Sollgrenzen der Teicoplanin-Serumkonzentration bei 15–30 mg/l (HPLC-Messung) bzw. 30–40 mg/l (FPIA-Messung).
Während der Erhaltungstherapie soll eine Bestimmung der Teicoplanin-Serumkonzentration mindestens einmal wöchentlich erfolgen, um sicherzustellen, dass die Konzentration weiterhin stets im genannten Zielbereich liegt.
Kinder und Jugendliche
Für Jugendliche über 12 Jahre gelten dieselben Dosisempfehlungen wie für Erwachsene.
Neugeborene und Säuglinge bis 2 Monate:
Initialdosis:
Eine Einzeldosis von 16 mg/kg Körpergewicht als intravenöse Infusion am ersten Tag.
Erhaltungsdosis:
Eine Dosis von 8 mg/kg Körpergewicht als intravenöse Infusion einmal täglich über eine Infusionsdauer von 30 Minuten.
Kinder von 2 Monaten bis 12 Jahren:
Initialdosis:
3-mal eine Dosis von 10 mg/kg Körpergewicht intravenös im Abstand von 12 Stunden.
Erhaltungsdosis:
Eine Dosis von 6 mg/kg Körpergewicht einmal täglich intravenös oder intramuskulär.
Bei schweren Infektionen sowie bei Patienten mit Neutropenie beträgt die Erhaltungsdosis 10 mg/kg Körpergewicht intravenös einmal täglich.
Ältere Patienten
Gleiche Dosierung wie unter «Erwachsene» angegeben. Bei eingeschränkter Nierenfunktion siehe «Spezielle Dosierungsanweisungen».
Spezielle Dosierungsanweisungen
Patienten mit kontinuierlicher ambulanter Peritonealdialyse (CAPD)
Nach einer einmaligen intravenösen Initialdosis von 6 mg/kg Körpergewicht werden in der ersten Woche 20 mg/l in jeden Beutel Dialyseflüssigkeit gegeben, in der zweiten Woche 20 mg/l in jeden zweiten Beutel und in der dritten Woche 20 mg/l in den Beutel für die Nacht.
Pseudomembranöse Enterokolitis
Die empfohlene Dosierung beträgt 100–200 mg oral zweimal täglich für 7–14 Tage.
Eingeschränkte Nierenfunktion:
Bis zum vierten Tag der Behandlung ist keine Dosisanpassung erforderlich, danach ist die Dosis so anzupassen, dass stets eine Serumkonzentration von mindestens 10 mg/l (HPLC-Messung) bzw. 15 mg/l (FPIA-Messung) aufrechterhalten wird.
Nach dem vierten Behandlungstag:
Bei leichter bis mittelschwerer Niereninsuffizienz (Kreatinin-Clearance zwischen 40 und 80 ml/min): Die Erhaltungsdosis wird auf die Hälfte herabgesetzt – entweder durch Verabreichung einer regulären Dosis alle zwei Tage oder durch Verabreichung einer halben Dosis einmal täglich.
- Bei schwerer Niereninsuffizienz (Kreatinin-Clearance unter 40 ml/min) und bei Dialysepatienten: Die Dosis wird auf ein Drittel herabgesetzt – entweder durch Verabreichung einer regulären Dosis alle drei Tage oder durch Verabreichung einer Dritteldosis einmal täglich.
Teicoplanin kann nicht durch Hämodialyse entfernt werden.
Kombination mit anderen Antibiotika
Das antibakterielle Wirkspektrum von Teicoplanin ist eng (grampositive Erreger). Bei bestimmten Infektionen kann eine Monotherapie mit Teicoplanin erwogen werden, dies jedoch nur, wenn der Keim bereits ermittelt und empfindlich oder mit hoher Wahrscheinlichkeit empfindlich gegenüber Teicoplainin ist.
Arten der Anwendung
- intravenös:
- intravenöse Injektion als Bolus über 3–5 Minuten (schnelle i.v.-Gabe)
- intravenöse Infusion über 30 Minuten (einzige zulässige Anwendungsart bei Neugeborenen)
- intramuskulär
- oral (zur Behandlung von pseudomembranöser Enterokolitis)
Therapiedauer
Die Behandlungsdauer richtet sich nach Art und Schweregrad der Infektion sowie nach dem klinischen Verlauf. Grundsätzlich sollte die Therapie bis mindestens drei Tage nach Nachlassen des Fiebers und/oder Verschwinden der Symptome dauern.
Bei Endokarditis und Osteomyelitis wird eine Therapiedauer von mindestens 3 Wochen empfohlen.
Die orale Behandlung der durch Clostridium difficile hervorgerufenen pseudomembranösen Enterokolitis sollte über einen Zeitraum von mindestens 7–14 Tagen erfolgen.
Targocid sollte nicht länger als 4 Monate lang verwendet werden.
Kontraindikationen
Bekannte Überempfindlichkeit gegenüber dem Wirkstoff.
Da keine klinischen Daten vorliegen, sollte Targocid aufgrund des Krampfrisikos nicht in den subarachnoidalen Raum injiziert werden.
Warnhinweise und Vorsichtsmassnahmen
Überempfindlichkeitsreaktionen
Bei Teicoplanin wurde über schwere, lebensbedrohliche Überempfindlichkeitsreaktionen, manchmal mit tödlichem Ausgang, berichtet (z.B. anaphylaktischer Schock). Wenn eine allergische Reaktion auftritt, muss die Behandlung mit Teicoplanin sofort abgebrochen und geeignete Notfallmassnahmen eingeleitet werden.
Bei Patienten mit bekannter Überempfindlichkeit gegenüber Vancomycin sollte Teicoplanin mit Vorsicht angewendet werden, da eine allergische Kreuzreaktion einschliesslich eines tödlichen anaphylaktischen Schocks auftreten kann.
Das Auftreten eines «Red-Man-Syndroms» (Roter-Mann-Syndroms) unter Vancomycin in der Vorgeschichte stellt jedoch keine Kontraindikation für Teicoplanin dar.
Infusionsreaktionen
In seltenen Fällen wurde (auch schon bei Erstanwendung) ein «Red-Man-Syndrom» oder Roter-Mann-Syndrom (Symptomenkomplex mit Pruritus, Urtikaria, Hautrötungen, Quincke-Ödem, Tachykardie, Blutdruckabfall, Dyspnoe) beobachtet. Die Reduktion der Infusionsgeschwindigkeit oder der Abbruch der Anwendung kann zur Beendigung dieser Reaktionen führen. Infusionsbedingte Reaktionen können gemindert werden, wenn die Tagesdosis nicht als Bolusinjektion, sondern als Infusion über einen Zeitraum von 30 Minuten gegeben wird.
Schwere bullöse Reaktionen
Bei der Anwendung von Teicoplanin wurde über lebensbedrohliche oder sogar tödliche Fälle von Hautreaktionen wie Stevens-Johnson-Syndrom (SJS) und toxisch-epidermale Nekrolyse (TEN) berichtet. Wenn Anzeichen oder Symptome eines SJS oder einer TEN (z.B. progressive Hautrötungen, häufig mit Blasenbildung oder Schleimhautschädigungen) auftreten, muss die Behandlung mit Teicoplanin sofort abgebrochen werden.
Antibakterielles Wirkspektrum
Das antibakterielle Wirkspektrum von Teicoplanin ist eng (grampositive Erreger) und Teicoplanin muss meist gemeinsam mit anderen Antibiotika verabreicht werden. Eine Monotherapie mit Teicoplanin ist ausser bei bestimmten Infektionen, wenn der Keim bereits ermittelt und empfindlich oder mit hoher Wahrscheinlichkeit empfindlich gegenüber Teicoplainin ist, nicht sinnvoll,
Für eine rationale Therapie mit Teicoplanin sind das antibakterielle Wirkspektrum, das Sicherheitsprofil und die Eignung der antibiotischen Standardtherapie für den einzelnen Patienten bei der Therapieentscheidung zu berücksichtigen. Auf dieser Grundlage wird davon ausgegangen, dass Teicoplanin vorwiegend bei schweren Infektionen von Patienten zur Anwendung kommt, bei denen die antibiotische Standardtherapie als ungeeignet eingestuft wird.
Initialdosis
Da nur begrenzte Daten zur Sicherheit vorliegen, sind Patienten sorgfältig hinsichtlich des Auftretens von Nebenwirkungen zu beobachten, wenn Teicoplanin in der Dosis von 12 mg/kg Körpergewicht zweimal täglich angewendet wird. Unter diesem Therapieschema soll neben den empfohlenen periodischen hämatologischen Untersuchungen auch der Kreatinin-Wert im Serum überwacht werden.
Aufgrund des Krampfrisikos darf Teicoplanin nicht intraventrikulär verabreicht werden.
Thrombopenie
Unter der Anwendung von Teicoplanin wurde über Fälle von Thrombozytopenie berichtet. Während der Behandlung sollten in regelmässigen Abständen hämatologische Untersuchungen (einschliesslich grosses Blutbild) erfolgen.
Nephrotoxizität
Bei Patienten, die Teicoplanin erhielten, wurde über Niereninsuffizienz berichtet (siehe «Unerwünschte Wirkungen»). Patienten mit einer eingeschränkten Nierenfunktion und/oder Patienten, die Teicoplanin in Verbindung mit oder anschliessend an eine Behandlung mit anderen Arzneimitteln mit bekanntem nephrotoxischem Potenzial (Aminoglykoside, Colistin, Amphotericin B, Ciclosporin oder Cisplatin) erhalten, sollten sorgfältig überwacht werden und es sollten Hörtests durchgeführt werden.
Da Teicoplanin vorwiegend über die Nieren ausgeschieden wird, muss die Dosis bei Patienten mit eingeschränkter Nierenfunktion angepasst werden (siehe «Dosierung/Anwendung»).
Ototoxizität
Wie bei anderen Glykopeptiden wurde bei mit Teicoplanin behandelten Patienten über Ototoxizität (Hörverlust und Tinnitus) berichtet (siehe «Unerwünschte Wirkungen»). Patienten, bei denen während der Behandlung mit Teicoplanin Anzeichen und Symptome einer Beeinträchtigung des Hörvermögens oder einer Innenohrstörung auftreten, sollten sorgfältig bewertet und überwacht werden, insbesondere bei längerer Behandlungsdauer und bei Patienten mit eingeschränkter Nierenfunktion. Patienten, die Teicoplanin in Verbindung mit oder anschliessend an eine Behandlung mit anderen Arzneimitteln mit bekanntem neuro-/ototoxischem Potenzial (Aminoglykoside, Ciclosporin, Cisplatin, Furosemid oder Etacrynsäure) erhalten, sollten sorgfältig überwacht werden, und bei Verschlechterung des Hörvermögens sollte eine Nutzenbewertung der Teicoplanin-Behandlung vorgenommen werden.
Besondere Vorsicht ist bei Patienten geboten, die Teicoplanin zusammen mit anderen ototoxischen und/oder neurotoxischen Arzneimitteln erhalten, für die regelmässige Blutuntersuchungen sowie Leber- und Nierenfunktionstests empfohlen werden.
Superinfektion
Wie bei anderen Antibiotika kann insbesondere die längere Anwendung von Teicoplanin zur Vermehrung von anderen, nicht empfindlichen Mikroorganismen führen. Falls während der Behandlung eine Superinfektion auftritt, ist diese entsprechend zu behandeln.
Interaktionen
In klinischen Studien erhielten viele Patienten Targocid gleichzeitig mit anderen Antibiotika, Antihypertensiva, herzwirksamen Präparaten, Antidiabetika und Anästhetika, ohne dass es Hinweise auf Interaktionen gab.
Teicoplanin- und Aminoglykosidlösungen sind inkompatibel und dürfen für die Anwendung als Injektionslösung nicht miteinander gemischt werden. Sie sind aber kompatibel in Dialyseflüssigkeiten und können bei der Behandlung von Peritonitis im Zusammenhang mit einer kontinuierlichen ambulanten Peritonealdialyse (CAPD) uneingeschränkt eingesetzt werden.
Nur mit Vorsicht sollte Teicoplanin zusammen mit oder im Anschluss an Substanzen gegeben werden, von denen bekannt ist, dass sie die Nieren- oder Hörfunktion beeinträchtigen können. Zu diesen Arzneimitteln zählen Aminoglykoside, Colistin, Amphotericin B, Ciclosporin, Cisplatin, Furosemid und Etacrynsäure.
Es gab keine Hinweise auf synergistische Oto- oder Nephrotoxizität bei gleichzeitiger Verabreichung von Aminoglykosiden.
In Tierstudien wurden keine Interaktionen mit Diazepam, Thiopental, Morphin, Halothan oder neuromuskulär blockierenden Substanzen beobachtet.
Schwangerschaft/Stillzeit
Schwangerschaft
Bisher liegen nur begrenzte Daten für die Anwendung von Teicoplanin bei Schwangeren vor. Tierexperimentelle Studien haben bei hohen Dosen eine Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»). Das potenzielle Risiko für Menschen ist nicht bekannt. Deshalb sollte Teicoplanin während der Schwangerschaft nicht verwendet werden, es sei denn, dies ist unbedingt erforderlich. Ein potenzielles Risiko für Schädigungen des Innenohrs und der Nieren des Fötus kann nicht ausgeschlossen werden (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Präklinische Daten»).
Stillzeit
Es ist nicht bekannt, ob Teicoplanin beim Menschen in die Muttermilch übergeht. Bei Tieren ist der Übergang von Teicoplanin in die Muttermilch nicht ausreichend untersucht. Die Entscheidung, abzustillen/weiterzustillen oder die Therapie mit Teicoplanin abzubrechen/fortzusetzen, sollte einerseits die Vorteile der Muttermilch für den Säugling, andererseits den Nutzen von Teicoplanin für die Mutter berücksichtigen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Targocid hat einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Teicoplanin kann Schwindelgefühle und Kopfschmerzen verursachen. Dadurch kann die Fähigkeit, ein Fahrzeug zu führen oder Maschinen zu bedienen, beeinträchtigt sein. Patienten mit entsprechenden Nebenwirkungen sollten nicht am Strassenverkehr teilnehmen oder Maschinen bedienen.
Unerwünschte Wirkungen
Die Häufigkeit der unerwünschten Wirkungen wurde anhand der folgenden Definition klassifiziert: «sehr häufig» (≥1/10), «häufig» (<1/10, ≥1/100), «gelegentlich» (<1/100, ≥1/1'000), «selten» (<1/1000, ≥1/10'000), «sehr selten» (<1/10'000), «Einzelfälle»: (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Infektionen und Infestationen:
Unbekannt: Superinfektion (Verbreitung von nicht empfindlichen Keimen).
Selten: Abszess.
Erkrankungen des Blutes und des Lymphsystems:
Gelegentlich: Eosinophilie 0,8%, Thrombozytopenie 0,3%, Leukopenie 0,4%, Neutropenie, Thrombocytose.
Selten: reversible Agranulozytose.
Erkrankungen des Immunsystems:
Einzelfälle von Rigor, Bronchospasmus, Angioödem und anaphylaktischen Reaktionen/anaphylaktischem Schock (siehe «Erkrankungen der Haut und des Unterhautzellgewebes») Hautausschlag mit Eosinophilie und systemischen Symptomen/Hypersensitivitätsreaktion (DRESS).
Erkrankungen des Nervensystems:
Gelegentlich: Benommenheit 0,5%, Kopfschmerzen 0,3%.
Einzelfälle: Krampfanfälle.
Erkrankungen des Ohrs und des Labyrinths:
Gelegentlich: schwach ausgeprägter Gehörverlust, Tinnitus oder veränderte Vestibularis-Funktion 0,4%.
Erkrankungen des Gastrointestinaltrakts:
Gelegentlich: Nausea oder Erbrechen 0,6%, Diarrhöe 0,5%.
Leber- und Gallenerkrankungen:
Häufig: vorübergehende Erhöhung von Transaminasen und/oder alkalischer Phosphatase 2,0%.
Gelegentlich: cholestatische Hepatitis 0,1%.
Erkrankungen der Haut und des Unterhautzellgewebes:
Häufig: Exanthem, Erythem oder Pruritus 2,4%, Fieber 1,4%, Urtikaria.
Selten: infusionsbedingte Ereignisse wie Erythema oder Flush des Oberkörpers («Red-Man-Syndrom») bei Patienten ohne vorangegangene Teicoplanin-Behandlung. Bei Reexposition mit geringerer Infusionsrate und/oder Teicoplaninkonzentration traten diese Ereignisse nicht wieder auf. Diese Ereignisse waren nicht spezifisch für irgendeine Konzentration oder Infusionsrate.
Einzelfälle: Dermatitis exfoliativa, toxisch epidermale Nekrolyse und Erythema multiforme sowie Stevens-Johnson-Syndrom.
Erkrankungen der Nieren und Harnwege:
Vorübergehend erhöhtes Serumkreatinin 0,3%, sehr selten Nierenversagen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Häufig: Schmerz 1,5%, Fieber.
Gelegentlich: Thrombophlebitis 0,9%, Rötung 0,3%, Abszess an der Injektionsstelle nach i.m.-Verabreichung.
Einzelfälle: Schüttelfrost.
Überdosierung
Symptome:
Zwei Kinder von vier und acht Jahren mit Agranulozytose erhielten versehentlich mehrere Dosen zu 100 mg/kg/Tag. Trotz sehr hoher Plasmakonzentrationen (bis 300 mg/l) traten keine Symptome oder abnormalen Laborwerte auf. In einem Fall kam es bei einem 29 Tage alten Neugeborenen, das 400 mg i.v. (95 mg/kg) erhalten hatte, zu Agitation.
Behandlung:
Die Behandlung einer Überdosierung muss symptomatisch erfolgen.Teicoplanin wird mittels Hämodialyse nicht und mittels Peritonealdialyse nur langsam eliminiert.
Eigenschaften/Wirkungen
ATC-Code: J01XA02
Wirkungsmechanismus/Pharmakodynamik
Teicoplanin ist ein Glykopeptid, das das Wachstum sensibler Bakterien (aerobe und anaerobe grampositive Keime) durch Beeinflussung ihrer Zellwandsynthese an einer Angriffsstelle, die sich von jener der Betalaktame unterscheidet, hemmt. Die Peptidoglycan-Synthese wird durch spezifische Bindung an D-Alanyl-D-Alanin-Reste blockiert.
Mikrobiologie
Teicoplanin wirkt im Allgemeinen bakterizid. In einigen Ausnahmefällen (Enterokokken, Listeria monocytogenes und vereinzelt koagulasenegative Staphylokokken) wirkt Teicoplanin bakteriostatisch.
Teicoplanin wirkt unter anderem gegen Staphylokokken (inklusive derjenigen Stämme, die gegen Methicillin oder andere Betalactam-Antibiotika resistent sind), gegen Streptokokken, Enterokokken, Listeria monocytogenes, Mikrokokken, Corynebakterien der Gruppe J/K und grampositive Anaerobier inklusive Clostridium difficile.
Für die Schweiz können die kritischen Konzentrationen anhand der Daten von EUCAST (European Committee on Antimicrobial Susceptibility Testing) abgeleitet werden. Die Grenzwerte der MHK nach EUCAST, Version 7.1 vom 10. März 2017 (www.eucast.org) sind in der Tabelle unten aufgeführt:
| Mikroorganismen | Sensibel | Resistent |
| Staphylococcus aureusa | ≤2 mg/l | >2 mg/ml |
| Koagulasenegative Staphylokokkena | ≤4 mg/l | >4 mg/ml |
| Enterococcus spp. | ≤2 mg/l | >2 mg/ml |
| Streptococcus spp. (A, B, C, G)b | ≤2 mg/l | >2 mg/ml |
| Streptococcus pneumoniaeb | ≤2 mg/l | >2 mg/ml |
| Streptokokken der Viridans-Gruppeb | ≤2 mg/l | >2 mg/ml |
| Grampositive Anaerobier ausser Clostridium difficile | ||
| PK-/PD-Schwellen (nicht artgebunden)c,d | DU | DU |
a Die Glykopeptid-MHK-Werte sind methodenabhängig und sollten durch Bouillon-Mikrodilution bestimmt werden (Referenz ISO 20776). S. aureus mit Vancomycin-MHK-Werten von 2 mg/ml liegen im Grenzbereich der Wildtyp-MHK-Verteilung und zeigen möglicherweise ein eingeschränktes klinisches Ansprechen. Der Grenzwert für S. aureus wurde auf 2 mg/ml reduziert, um eine Einstufung der Isolate als GISA zu vermeiden, da schwere Infektionen durch GISA-Isolate nicht mit hohen Dosen von Vancomycin oder Teicoplanin behandelbar sind. b Isolate mit MHK-Werten oberhalb des Grenzwertes für Empfindlichkeit sind sehr selten oder noch nicht berichtet worden. Die Tests zur Identifizierung und Empfindlichkeitsbestimmung müssen für jedes solcher Isolate wiederholt werden, und bei Bestätigung muss das Isolat an ein Referenz-Labor geschickt werden. Bis zum Vorliegen von Erkenntnissen zum klinischen Ansprechen dieser Isolate mit bestätigten MHK-Werten oberhalb des derzeitigen Grenzwertes für Resistenz sollten sie als resistent eingestuft werden. c DU bedeutet, dass nur unzureichende Evidenz vorliegt, dass die betreffende Spezies einen geeigneten Zielorganismus für die Behandlung mit diesem Arzneimittel darstellt. d Es kann eine MHK mit einem Kommentar, aber ohne begleitende S-, I- oder R-Einstufung gemeldet worden sein. | ||
Üblicherweise empfindliche Spezies | Inkonstant sensible Spezies | Von Natur aus resistente Bakterien |
Grampositive aerobe BakterienCorynebacterium jeikeiuma Enterococcus faecalis Staphylococcus aureus (darunter Methicillin-resistente Stämme) Streptococcus agalactiae Streptococcus dysgalactiae subsp. equisimilisa (Streptokokken der Gruppen C & G) Streptococcus pneumoniae Streptococcus pyogenes Streptokokken der Viridans-Gruppea,b Grampositive anaerobe BakterienClostridium difficilea Peptostreptococcus spp.a | Grampositive aerobe Bakterien:Enterococcus faecium Staphylococcus epidermidis Staphylococcus haemolyticus Staphylococcus hominis | Alle gramnegativen Bakterien Andere Bakterien:Chlamydia spp. Chlamydophila spp. Legionella pneumophila Mycoplasma spp. |
a Zum Zeitpunkt der Veröffentlichung der Tabellen lagen keine aktuellen Daten vor. Die wichtigsten Daten aus der Literatur, die Grundlagendokumente und die Therapieempfehlungen lassen auf eine Sensibilität schliessen. b Sammelbezeichnung für eine Gruppe heterogener Streptokokkenarten. Der Resistenzgrad kann je nach entsprechender Streptokokkenart schwanken. | ||
Resistenzmechanismus
Eine Teicoplanin-Resistenz kann auf folgenden Mechanismen beruhen:
- Veränderung der Zielstruktur: Diese Form der Resistenz ist insbesondere bei der Spezies Enterococcus faecium aufgetreten. Die Veränderung beruht auf dem Austausch der endständigen D-Alanin-D-Alanin-Funktion der Aminosäureseitenkette einer Mureinvorstufe durch D-Ala-D-Lactat, sodass die Affinität zu Vancomycin vermindert ist. Die hierfür verantwortlichen Enzyme sind eine neu gebildete D-Lactat-Dehydrogenase bzw. Ligase.
- Die verminderte Empfindlichkeit oder Resistenz bei Staphylokokken gegenüber Teicoplanin beruht auf der Überproduktion von Vorstufen des Mureins, an die Teicoplanin gebunden wird.
Eine Kreuzresistenz zwischen Teicoplanin und Vancomycin kann auftreten. Einige Vancomycin-resistente Enterokokken sind gegenüber Teicoplanin empfindlich (Phänotyp Van-B).
Die Prävalenz der Resistenz kann geografisch und im Zeitverlauf für die selektierten Stämme variieren. Lokale Informationen können sich als sehr nützlich erweisen, insbesondere bei der Behandlung schwerer Infektionen, bei denen eine mikrobiologische Diagnostik mit Isolierung des Krankheitserregers und Sensibilitätsnachweis empfohlen wird. Es wird der Beizug eines Spezialisten angeraten, insbesondere, wenn aufgrund einer hohen lokalen Resistenz die Anwendung von Targocid unter bestimmten Umständen fragwürdig ist.
Pharmakokinetik
Absorption und Bioverfügbarkeit
Teicoplanin wird parenteral (intravenös oder intramuskulär) verabreicht. Nach intramuskulärer Gabe ist die Bioverfügbarkeit (verglichen mit der intravenösen Gabe) nahezu vollständig (90%). Nach intramuskulärer Gabe von 200 mg an 6 Tagen liegt die mittlere (SD) maximale Teicoplanin-Serumkonzentration (Cmax) bei 12,1 (0,9) mg/l und wird 2 Stunden nach der Anwendung erreicht.
Bei einer intravenösen Initialdosis von 6 mg/kg alle 12 Stunden liegen die Cmax-Werte nach 3 bis 5 Anwendungen zwischen 60 und 70 mg/l und die minimalen Serumkonzentrationen (Ctrough) üblicherweise bei >10 mg/l. Nach einer intravenösen Initialdosis von 12 mg/kg alle 12 Stunden liegen die mittleren Cmax- und Ctrough-Werte nach 3 Anwendungen bei 100 bzw. 20 mg/l.
Nach Gabe einer einmal täglichen Erhaltungsdosis von 6 mg/kg betragen die Cmax- und Ctrough-Werte ungefähr 70 mg/l bzw. 15 mg/l. Nach einer einmal täglichen Erhaltungsdosis von 12 mg/kg schwanken die Ctrough-Werte zwischen 18 und 30 mg/l.
Bei oraler Gabe wird Teicoplanin nicht aus dem Gastrointestinaltrakt resorbiert. Nach oraler Anwendung einer einmaligen Dosis von 250 oder 500 mg bei gesunden Probanden wird Teicoplanin in unveränderter Form nur in den Faeces wiedergefunden (ungefähr 45% der eingenommenen Dosis), während es weder im Serum noch im Urin nachweisbar ist.
Distribution
Die Bindung von Teicoplanin an menschliche Plasmaproteine liegt bei 87,6 bis 90,8% unabhängig von der Teicoplanin-Konzentration. Teicoplanin wird überwiegend an menschliches Serum-Albumin gebunden. Teicoplanin diffundiert nicht in die Erythrozyten.
Das Verteilungsvolumen im Steady State (VSS) variiert von 0,7 bis 1,4 ml/kg. Die höchsten VSS-Werte wurden in aktuellen Studien beobachtet, in denen die Sammelperiode mehr als 8 Tage betrug.
Teicoplanin wird überwiegend in die Lunge, das Myokard und Knochengewebe verteilt mit einem Verteilungsverhältnis zwischen Gewebe und Serum von grösser als 1. In Blasenflüssigkeit, Gelenkflüssigkeit und Peritonealflüssigkeit liegt das Verteilungsverhältnis zwischen 0,5 und 1. Teicoplanin wird aus der Peritonealflüssigkeit mit der gleichen Eliminationsrate wie aus dem Serum eliminiert. In Pleuraflüssigkeit und subkutanem Fettgewebe liegt das Verteilungsverhältnis zwischen 0,2 und 0,5. Teicoplanin penetriert nicht gut in die Zerebrospinalflüssigkeit (CSF).
Es ist nicht bekannt, ob die Substanz in die Muttermilch übertritt oder ob eine Passage der Placentaschranke stattfindet.
Metabolismus/Elimination
Teicoplanin wird hauptsächlich unverändert renal ausgeschieden (80% innerhalb von 16 Tagen), während 2,7% der verabreichten Dosis innerhalb von 8 Tagen in den Faeces wiedergefunden werden (nach Ausscheidung über die Galle).
Die Eliminationshalbwertzeit von Teicoplanin variierte in den jüngsten Studien zwischen 100 und 170 Stunden bei einer Sammeldauer von 8 bis 35 Tagen.
Teicoplanin besitzt eine niedrige totale Clearance von 10 bis 14 ml/h/kg und eine renale Clearance von 8 bis 12 ml/h/kg, was darauf hindeutet, dass Teicoplanin überwiegend renal ausgeschieden wird.
Die lange Eliminations-Halbwertszeit erlaubt eine einmal tägliche Verabreichung (Ausnahme: Initialdosen).
Linearität
In einem Dosisbereich von 2 bis 25 mg/kg zeigt Teicoplanin eine lineare Pharmakokinetik.
Kinetik spezieller Patientengruppen
Patienten mit Niereninsuffizienz:
Da Teicoplanin über die Nieren ausgeschieden wird, nimmt die Elimination mit zunehmender Niereninsuffizienz ab. Die totale und renale Clearance von Teicoplanin hängt von der Kreatinin-Clearance ab.
Ältere Patienten:
Bei älteren Patienten ist die Pharmakokinetik von Teicoplanin nicht verändert, sofern die Nierenfunktion nicht eingeschränkt ist.
Kinder und Jugendliche:
Im Vergleich zu Erwachsenen werden bei Kindern eine höhere totale Clearance (15,8 ml/h/kg bei Neugeborenen, 14,8 ml/h/kg bei einem Durchschnittsalter von acht Jahren) und eine kürzere Eliminationshalbwertszeit (40 Stunden bei Neugeborenen, 58 Stunden bei Achtjährigen) beobachtet.
Präklinische Daten
Nach wiederholter parenteraler Anwendung traten bei Ratten und Hunden Schädigungen der Niere auf, die dosisabhängig und reversibel waren. Untersuchungsergebnisse zum ototoxischen Potenzial bei Meerschweinchen zeigten, dass eine leichte Beeinträchtigung der kochleären und vestibulären Funktion möglich ist, ohne dass morphologische Schäden beobachtet wurden.
Die Fertilität wurde bei subkutanen Dosen von bis zu 40 mg/kg/Tag weder bei weiblichen noch bei männlichen Ratten beeinflusst. In Studien zur embryo-fötalen Entwicklung wurden nach subkutaner Verabreichung von bis zu 200 mg/kg/Tag bei Ratten und nach intramuskulärer Verabreichung von bis zu 15 mg/kg/Tag beim Kaninchen keine Missbildungen beobachtet. Nach Verabreichung hoher Dosen an Ratten kam es jedoch vermehrt zu Totgeburten (nach 100 mg/kg /Tag und mehr) und neonataler Mortalität (nach 200 mg/kg/Tag). Bei einer Dosis von 50 mg/kg/Tag wurde dieser Effekt nicht beobachtet. In einer peri- und postnatalen Studie an Ratten zeigten sich nach subkutaner Verabreichung von bis zu 40 mg/kg/Tag keine Effekte auf die Fertilität der F1-Generation oder auf das Überleben und die Entwicklung der F2-Generation.
Teicoplanin zeigte keine antigenen (bei Mäusen, Meerschweinchen und Kaninchen) oder genotoxischen Eigenschaften sowie keine Hinweise auf lokale Unverträglichkeit.
Untersuchungsbefunde zur Kanzerogenität liegen nicht vor.
Sonstige Hinweise
Inkompatibilitäten:
Die Lösungen von Teicoplanin und Aminoglycosiden sind inkompatibel und dürfen daher nicht vor der Injektion gemischt werden; hingegen sind die beiden Lösungen in Dialyseflüssigkeiten kompatibel und können zur Behandlung von CAPD-Peritonitis sicher eingesetzt werden.
Das Arzneimittel darf nur mit den unter «Hinweise für die Handhabung» aufgeführten Arzneimitteln gemischt werden.
Haltbarkeit:
Pulver und Lösungsmittel für Injektionslösung:
Vor Hitze schützen.
Bei Zimmertemperatur (15–25 °C) aufbewahren.
Das Medikament darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Zubereitete Lösung:
Aus mikrobiologischer Sicht sollte die zubereitete Lösung sofort verwendet werden (maximale Aufbewahrungszeit von 24 Stunden bei 2-8 °C), ausser die Zubereitung konnte unter kontrollierten und validierten aseptischen Bedingungen erfolgen. Bei nicht sofortigem Gebrauch liegen die Haltbarkeit und die Aufbewahrungsbedingungen in der Verantwortung des Anwenders. Chemische und physikalische «In-use»-Stabilität wurde bis zu 48 Stunden bei Raumtemperatur und für 7 Tage bei 2-8 °C gezeigt.
Orale Anwendung: Die Lösung unmittelbar verbrauchen.
Arzneimittel sorgfältig aufbewahren.
Ausserhalb der Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung:
Herstellung der Injektionslösung
Das gesamte Lösungsmittel langsam in die Durchstechflasche mit dem Pulver injizieren.
Vorsichtig zwischen den Händen rollen, bis das Pulver vollständig gelöst ist. Wenn die Lösung schäumt, etwa 15 Minuten stehen lassen. Nur klare gelbliche Lösungen dürfen eingesetzt werden.
Die rekonstituierte Lösung enthält 200 mg in 3,0 ml bzw. 400 mg in 3,0 ml.
Nominelle Teicoplanin-Menge in der Durchstechflasche | 200 mg | 400 mg |
Volumen der Durchstechflasche | 10 ml | 22 ml |
Entnehmbares Volumen an Lösungsmittel aus der Ampulle zur Zubereitung | 3,14 ml | 3,14 ml |
Volumen, das die nominelle Teicoplanin-Menge enthält (entnommen mit einer 5-ml-Spritze mit einer 23-G-Kanüle) | 3,0 ml | 3,0 ml |
Die rekonstituierte Lösung kann direkt injiziert, nach weiterer Verdünnung infundiert oder oral eingenommen werden.
Herstellung der Infusionslösung
Targocid kann in folgenden Infusionslösungen angewendet werden:
- Natriumchloridlösung 9 mg/ml (0,9%)
- Ringer-Lösung
- Ringer-Laktat-Lösung
- 5% Dextrose-Injektionslösung
- 10% Dextrose-Injektionslösung
- 0,18% Natriumchlorid- und 4% Glukoselösung
- 0,45% Natriumchlorid- und 5% Glukoselösung
- Peritonealdialyselösung mit 1,36% oder 3,86% Glukoselösung.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den geltenden Anforderungen zu beseitigen (nicht länger als 24 Stunden aufbewahren).
Herstellung der Lösung zur peroralen Anwendung
Der Inhalt einer Ampulle zu 200 mg Teicoplanin kann in 30 ml Wasser gelöst, getrunken oder über eine Magensonde zugeführt werden.
Zulassungsnummer
49339 (Swissmedic).
Zulassungsinhaberin
sanofi-aventis (schweiz) ag, 1214 Vernier/GE.
Stand der Information
August 2017.
OEMéd
Composition
Principe actif: Teicoplaninum (Praeparatio cryodesiccata).
Excipient: Natrii chloridum.
Solvens: Aqua ad injectabilia 3 ml (solvant).
Forme galénique et quantité de principe actif par unité
Poudre et solvant pour solution injectable/perfusion ou solution buvable.
Teicoplaninum (Praeparatio cryodesiccata) 200 mg ou 400 mg pro vitro.
Indications/Possibilités d’emploi
Traitement parentéral:
Targocid est indiqué chez les adultes et les enfants dès la naissance pour le traitement parentéral des infections suivantes:
Traitement des infections à gram-positif en cas de résistance à la méticilline ou aux céphalosporines, d'allergie à la pénicilline ou chez des patients n'ayant réagi ni aux pénicillines ni aux céphalosporines.
Traitement de première intention en cas de suspicion de germes résistants à la méticilline (après réception du résultat du test de sensibilité, le traitement sera adapté en conséquence). Il faut parfois effectuer des cultures, pour déterminer les germes en cause et leur sensibilité à la teicoplanine.
Aux conditions ci-dessus, Targocid est indiqué en cas de:
- endocardite infectieuse,
- infection ostéoarticulaire
- infections des voies respiratoires inférieures
- infections de la peau et des parties molles
- infection urinaires compliquées
- péritonite associée à une dialyse péritonéale continue ambulatoire (DPCA),
- septicémie.
Administration par voie orale:
En cas d'une entérocolite pseudomembraneuse due à Clostridium difficile.
Possibilités d'emploi
Le spectre d'activité antibactérienne de la teicoplanine est étroit (Gram positif) et la Teicoplanine doit le plus souvent être administrée en association à d'autres antibiotiques. Un traitement par teicoplanine en monothérapie n'est pas envisageable, sauf dans certaines infections si le germe est déjà identifié, et s'il est sensible à la teicoplanine ou s'il existe une forte probabilité que le germe soit sensible à la teicoplanine.
Veuillez consulter les recommandations officielles pour l'emploi approprié des antibiotiques, en particulier les recommandations visant à réduire l'augmentation de la résistance contre les antibiotiques. Il est recommandé que le diagnostic et le début du traitement par Targocid aient lieu à l'hôpital sous la supervision d'un spécialiste.
Posologie/Mode d’emploi
Posologie pour patients adultes et patients âgés présentant une fonction rénale normale:
Traitement des infections à Gram-positif
Indications | Dose de charge | Dose d'entretien | ||
Dose de charge | Concentrations résiduelles ciblées pour les jours 3 à 5 | Dose d'entretien | Concentrations résiduelles ciblées durant le traitement d'entretien | |
| 6 mg/kg de poids corporel) toutes les 12 heures pour 3 administrations intraveineuses ou intramusculaires | >15 mg/l(1) | 6 mg/kg de poids corporel par voie intraveineuse ou intramusculaire une fois par jour | >15 mg/l(1) une fois par semaine |
| 12 mg/kg de poids corporel) toutes les 12 heures pour 3 à 5 administrations intraveineuses | >20 mg/l(1) | 12 mg/kg de poids corporel par voie intraveineuse ou intramusculaire une fois par jour | >20 mg/l(1) |
| 12 mg/kg de poids corporel) toutes les 12 heures pour 3 à 5 administrations intraveineuses | 30 à 40 mg/l(1) | 12 mg/kg de poids corporel par voie intraveineuse ou intramusculaire une fois par jour | >30 mg/l(1) |
(1) Mesure par méthode FPIA
La dose doit être ajustée selon le poids corporel quel que soit le poids du patient.
La dose et la durée du traitement doivent être adaptées selon le type et la sévérité de l'infection et la réponse clinique du patient, et selon des facteurs liés au patient tels que l'âge et la fonction rénale.
Mesure des concentrations sériques:
Les concentrations sériques résiduelles de teicoplanine doivent être surveillées à l'état d'équilibre après administration de la dernière dose de charge afin de vérifier que la concentration sérique résiduelle minimale a été atteinte:
- Pour la plupart des infections à Gram positif, cette concentration résiduelle de teicoplanine doit être d'au moins 10 mg/L (mesure par chromatographie liquide à haute performance [HPLC]), ou d'au moins 15 mg/L (mesure par méthode de dosage immunologique par polarisation de fluorescence [FPIA]).
- Pour une endocardite ou autres infections sévères, cette concentration résiduelle de teicoplanine doit être de 15 à 30 mg/l (mesure par HPLC) ou de 30 à 40 mg/L (mesure par méthode FPIA).
Durant le traitement d'entretien, les concentrations sériques résiduelles de teicoplanine doivent être mesurées au moins une fois par semaine dans le but de vérifier le maintien de ces concentrations.
Population pédiatrique
Chez les enfants de plus de 12 ans, les recommandations posologiques sont les mêmes que chez les adultes.
Nouveau-nés et nourrissons jusqu'à l'âge de 2 mois:
Dose de charge:
Une dose unique de 16 mg/kg de poids corporel administrée par perfusion intraveineuse le premier jour.
Dose d'entretien:
Une dose de 8 mg/kg de poids corporel administrée par perfusion intraveineuse une fois par jour. La dose doit être perfusée sur 30 minutes.
Enfants (2 mois à 12 ans):
Dose de charge:
Une dose de 10 mg/kg de poids corporel administrée par voie intraveineuse toutes les 12 heures, à répéter 3 fois
Dose d'entretien:
Une dose de 6 mg/kg de poids corporel administrée par voie intraveineuse ou intramusculaire une fois par jour.
Pour les infections sévères ou chez un patient ayant une neutropénie, la dose d'entretien est de 10 mg/kg de poids corporel, en intraveineuse une fois par jour.
Sujets âgés
Même posologie que pour les adultes. En cas d'insuffisance rénale: voir «Posologies spéciales».
Posologies spéciales
Patients sous dialyse péritonéale continue ambulatoire (DPCA)
Après une dose de charge intraveineuse unique de 6 mg/kg de poids corporel, 20 mg/l sont administrés dans chaque poche de solution de dialyse la première semaine, 20 mg/l dans une poche sur deux la seconde semaine, puis 20 mg/l dans la poche de nuit la troisième semaine.
Entérocolite pseudomembraneuse
La dose recommandée est de 100-200 mg par voie orale 2 fois par jour durant 7 à 14 jours
Insuffisance rénale:
Aucune adaptation posologique n'est nécessaire jusqu'au quatrième jour de traitement, moment auquel la dose doit être adaptée pour maintenir une concentration sérique résiduelle d'au moins 10 mg/l (avec la méthode HPLC), ou 15 mg/L (avec la méthode FPIA).
Après 4 jours de traitement:
En cas d'insuffisance rénale légère ou modérée (clairance de la créatinine entre 40 et 80 ml/min): la dose d'entretien doit être diminuée de moitié, soit par l'administration de la dose un jour sur deux, soit par l'administration de la moitié de la dose une fois par jour.
- En cas d'insuffisance rénale sévère (clairance de la créatinine inférieure à 40 ml/min) et chez les patients hémodialysés: la dose doit correspondre à un tiers de la dose habituelle, soit par l'administration de la dose unitaire initiale tous les trois jours, soit par l'administration d'un tiers de la dose une fois par jour.
La teicoplanine n'est pas éliminée par hémodialyse.
Association d'antibiotiques
Le spectre d'activité antibactérienne de la teicoplanine est étroit (Gram positif). Dans certaines infections, un traitement par teicoplanine en monothérapie peut être envisagé uniquement si le germe est déjà identifié, et s'il est sensible ou s'il existe une forte probabilité qu'il le soit.
Administration
- Voie intraveineuse:
- Injection intraveineuse: administrée en bolus en 3 à 5 minutes (i.v. rapide)
- En perfusion pendant 30 min (seule méthode possible chez le nouveau-né);
- Voie intramusculaire;
- Voie orale (dans le traitement de l'entérocolite pseudomembraneuse).
Durée du traitement
La durée du traitement sera fonction de la nature et de la gravité de l'infection, de même que de l'évolution clinique. Après disparition de la fièvre ou atténuation des symptômes, le traitement sera encore poursuivi pendant au moins 3 jours.
En cas d'endocardite et d'ostéomyélite, on recommande un traitement de 3 semaines au minimum.
Le traitement oral des entérocolites pseudomembraneuses provoquées par Clostridium difficile est recommandé pour un minimum de 7 à 14 jours.
Targocid ne doit pas être administré plus de 4 mois.
Contre-indications
Hypersensibilité connue à l'égard du médicament.
En l'absence de données cliniques, Targocid ne doit pas être injecté dans l'espace sous-arachnoïdien en raison du risque de convulsions.
Mises en garde et précautions
Réactions d'hypersensibilité
Des réactions d'hypersensibilité graves, engageant le pronostic vital et parfois fatales ont été rapportées avec la teicoplanine (par ex. choc anaphylactique). En cas de survenue d'une réaction allergique à la teicoplanine, le traitement doit être immédiatement arrêté et des mesures d'urgence adéquates doivent être prises.
La teicoplanine doit être administrée avec prudence chez les patients présentant une hypersensibilité connue à la vancomycine, car des réactions d'hypersensibilité croisée, y compris un choc anaphylactique fatal, peuvent survenir.
Cependant, un antécédent de «syndrome de l'homme rouge» ou aussi appelé «red man syndrome» avec la vancomycine n'est pas une contre-indication à l'utilisation de la teicoplanine.
Réactions liées à la perfusion
Un «syndrome de l'homme rouge» ou «red man syndrome» (ensemble de symptômes comportant prurit, urticaire, érythème, œdème de Quincke, tachycardie, hypotension, dyspnée) a été observé dans de rares cas (et ce, dès la première dose).
Le ralentissement ou l'arrêt de la perfusion peut entraîner la disparition de ces réactions. Les réactions liées à la perfusion peuvent être limitées si la dose quotidienne n'est pas injectée en bolus mais perfusée sur 30 minutes.
Réactions bulleuses sévères
Des réactions cutanées engageant le pronostic vital voire fatales (syndrome de Stevens-Johnson [SSJ] et nécrolyse épidermique toxique [NET]) ont été rapportées lors de l'utilisation de la teicoplanine. Si des symptômes ou signes de SSJ ou de NET (par ex. éruption cutanée progressive, souvent avec des phlyctènes ou des lésions muqueuses) sont présents, le traitement par teicoplanine doit être arrêté immédiatement.
Spectre d'activité antibactérienne
Le spectre d'activité antibactérienne de la teicoplanine est étroit (Gram positif) et la teicoplanine doit le plus souvent être administrée en association à d'autres antibiotiques. Un traitement par teicoplanine en monothérapie n'est pas envisageable, sauf dans certaines infections si le germe est déjà identifié, et s'il est sensible à la teicoplanine ou s'il existe une forte probabilité que le germe soit sensible à la teicoplanine.
L'utilisation rationnelle de la teicoplanine doit tenir compte du spectre d'activité antibactérien, du profil de sécurité et de la pertinence d'un traitement antibactérien standard pour le patient. Sur cette base, il est attendu que la teicoplanine soit le plus souvent administrée pour le traitement d'infections sévères chez des patients pour lesquels un traitement standard est jugé inadéquat.
Dose de charge
Du fait que les données de sécurité sont limitées, lorsque la teicoplanine est administrée à la dose de 12 mg/kg de poids corporel deux fois par jour, les patients doivent être particulièrement surveillés afin de rechercher d'éventuels effets indésirables. Lors de ce traitement, la créatininémie doit être surveillée, en plus du bilan hématologique périodique recommandé.
La teicoplanine ne doit pas être administrée par voie intraventriculaire, en raison du risque de convulsion;
Thrombopénie
Des cas de thrombopénie ont été rapportés avec la teicoplanine. Des bilans hématologiques périodiques sont recommandés durant le traitement, dont une numération-formule sanguine complète.
Néphrotoxicité
Des cas d'insuffisance rénale ont été rapportés chez des patients traités par teicoplanine (voir rubrique «Effets indésirables»). Les patients insuffisants rénaux et/ou recevant la teicoplanine en association ou séquentiellement avec d'autres médicaments présentant un potentiel néphrotoxique connu (aminosides, colistine, amphotéricine B, ciclosporine et cisplatine) doivent être attentivement surveillés, et des tests de l'audition réalisés.
La teicoplanine est principalement excrétée par voie rénale, la posologie doit donc être adaptée chez les patients insuffisants rénaux (voir rubrique «Posologie/Mode d'emploi»).
Ototoxicité
Comme avec les autres glycopeptides, une ototoxicité (surdité et acouphènes) a été rapportée chez des patients traités par teicoplanine (voir rubrique «Effets indésirables»). Les patients chez qui des signes et symptômes d'altération de l'audition ou des troubles de l'oreille interne apparaissent durant un traitement par teicoplanine doivent être attentivement évalués et surveillés, particulièrement en cas de traitement prolongé et d'insuffisance rénale. Les patients recevant la teicoplanine en association ou séquentiellement avec d'autres médicaments présentant un potentiel neurotoxique/ototoxique connu (aminosides, ciclosporine, cisplatine, furosémide et acide étacrynique) doivent être attentivement surveillés, et le bénéfice de la teicoplanine doit être évalué si l'audition se dégrade.
Des précautions particulières doivent être prises lors de l'administration de la teicoplanine à des patients recevant un traitement concomitant ototoxique et/ou néphrotoxique, pour lequel une surveillance régulière hématologique, hépatique et rénale est recommandée.
Surinfection
Comme avec les autres antibiotiques, un traitement par teicoplanine, particulièrement s'il est prolongé, peut induire la prolifération d'autres micro-organismes non sensibles. Des mesures appropriées doivent être prises en cas de surinfection au cours du traitement.
Interactions
Au cours d'études cliniques, de nombreux patients ont reçu Targocid en même temps que d'autres antibiotiques, antihypertenseurs, traitements à visée cardiaque, antidiabétiques et anesthésiques sans aucun indice en faveur d'interactions.
Les solutions de teicoplanine et d'aminoglycoside sont incompatibles et ne doivent pas être mélangées pour injection. Cependant, ils sont compatibles dans le liquide de dialyse et peuvent être utilisés librement dans le traitement de la péritonite liée à une dialyse péritonéale continue ambulatoire (DPCA).
La teicoplanine doit être utilisée avec précaution lorsqu'elle est utilisée en même temps que ou séquentiellement avec des médicaments connus pour leurs effets néphrotoxique ou ototoxique. Par exemple les aminoglycosides, colistine, amphotéricine B, ciclosporine, cisplatine, furosémide et acide étacrynique.
Il n'y pas eu d'indice d'un synergisme oto- ou néphrotoxique chez les patients qui ont reçu simultanément un aminoglycoside.
Dans des études chez l'animal, aucune interaction avec le diazépam, le thiopental, la morphine, l'halothane ou des substances agissant comme blocs neuromusculaires n'a été observée.
Grossesse/Allaitement
Grossesse
Il existe des données limitées sur l'utilisation de la teicoplanine chez la femme enceinte. Les études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction à fortes doses (voir section «Données précliniques»). Le risque potentiel pour l'Homme est inconnu.
La teicoplanine ne doit donc pas être utilisée au cours de la grossesse sauf en cas de nécessité absolue. Un risque potentiel de lésions de l'oreille interne et de lésions rénales chez le fœtus ne peut être exclu (voir sections «Mises en garde et précautions» et «Données précliniques»).
Allaitement
On ne sait pas si la teicoplanine est excrétée dans le lait maternel. Il n'existe pas de données suffisantes sur l'excrétion de la teicoplanine dans le lait animal. La décision de continuer/interrompre l'allaitement ou de continuer/interrompre le traitement par teicoplanine doit être prise en prenant en compte le bénéfice de l'allaitement pour l'enfant au regard du bénéfice du traitement pour la femme.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Targocid a une influence mineure sur l'aptitude à conduire des véhicules et à utiliser des machines.
La teicoplanine peut provoquer des sensations vertigineuses et des céphalées. L'aptitude à conduire des véhicules et à utiliser des machines peut être affectée. Les patients ressentant ces effets indésirables ne doivent pas conduire de véhicule ni utiliser de machine.
Effets indésirables
Pour la classification de la fréquence des effets indésirables, les définitions suivantes sont utilisées: «très fréquents» (≥1/10), «fréquents» (<1/10, ≥1/100), «occasionnels» (<1/100, ≥1/1000), «rares» (<1/1000, ≥1/10'000), «très rares» (<1/10'000), «cas isolés»: (ne peut être estimée sur la base des données disponibles).
Infections et infestation:
Inconnu: surinfection (prolifération de germes non sensibles).
Rare: abcès.
Affections hématologiques et du système lymphatique
Occasionnel: éosinophilie 0,8%, thrombopénie 0,3%, leucopénie 0,4%, neutropénie, thrombocytose.
Rare: agranolocytose réversible.
Affections du système immunitaire:
Cas isolés de rigidité, de bronchospasme, d'angio-œdème et de réactions anaphylactiques/choc anaphylactique(voir «Affections de la peau et du tissu sous-cutané») Drug reaction avec symptome systémique et éosinophilie (DRESS).
Affections du système nerveux:
Occasionnel: confusion 0,5%, céphalées 0,3%.
Cas isolés: convulsions.
Affections de l'oreille et du conduit auditif:
Occasionnel: hypoacousie peu prononcée, surdité, bourdonnements d'oreille ou altération de la fonction vestibulaire 0,4%.
Affections gastro-intestinales:
Occasionnel: nausée ou vomissement 0,6%, diarrhée 0,5%.
Affections hépatobilliaires:
Fréquents: augmentation transitoire des transaminases et/ou de la phosphatase alcaline 2,0%.
Occasionnel: hépatite cholestatique 0,1%.
Affections de la peau et du tissu sous-cutané:
Fréquent: exanthème, érythème ou prurit 2,4%, fièvre 1,4%, urticaire.
Rares: les accidents liés à la perfusion, tels qu'érythème ou flush tronculaire appelés syndrome de l'homme rouge («Red man syndrome»), chez des patients jamais encore traités par la teicoplanine. Lors d'une réexposition avec un débit de perfusion et/ou une concentration en teicoplanine inférieurs, ces accidents ne se sont pas reproduits. Ils n'ont pas été spécifiques d'une concentration ni d'un débit de perfusion quelconques.
Cas isolés: dermatite exfoliatrice, nécrolyse épidermique toxique et érythème polymorphe ainsi que syndrome de Stevens-Johnson.
Affections du rein et des voies urinaires:
Augmentation passagère de la créatininémie 0,3%, très rarement un arrêt rénal.
Troubles généraux et accidents liés au site d'administration:
Fréquents: douleur 1,5%, fièvre.
Occasionnel: thrombophlébite 0,9%, érythème 0.3%, abcès au site d'injection après administration i.m.
Cas isolés: frissons.
Surdosage
Symptômes:
Deux enfants de quatre et huit ans en agranulocytose ont reçu par mégarde plusieurs doses de 100 mg/kg/jour. Malgré de très hautes concentrations plasmatiques (jusqu'à 300 mg/l), aucun symptôme ni examen de laboratoire pathologiques ne sont apparus. Dans un cas, une agitation est apparue chez un nouveau-né âgé de 29 jours qui avait reçu 400 mg par voie intraveineuse (95 mg/kg).
Prise en charge:
Le traitement d'un surdosage de teicoplanine doit être symptomatique.
La teicoplanine n'est pas éliminée par hémodialyse et ne l'est que lentement par dialyse péritonéale.
Propriétés/Effets
Code ATC: J01XA02
Mécanismes d'actions/Pharmacodynamique
La teicoplanine est un glycopeptide qui inhibe la croissance des bactéries sensibles (à gram positif aérobies et anaérobies) en interférant avec la synthèse de leur paroi cellulaire au niveau d'un site différent de celui qui est affecté par les bêta-lactamines. La synthèse du peptidoglycane est bloquée par une liaison spécifique à des résidus D-alanyl-D-alanine.
Microbiologie
En général, l'activité de la teicoplanine est celle d'un bactéricide. Dans certains cas exceptionnels (entérocoques, listeria monocytogènes et staphylocoques à coagulase négatif isolés), la teicoplanine a une action bactériostatique.
La teicoplanine agit entre autres sur les staphylocoques (y compris ceux qui sont résistants à la méticilline ou autres antibiotiques bêta-lactames), streptocoques, entérocoques, listeria monocytogènes, microcoques, corynébactéries du groupe JK et les bactéries anaérobies à gram positif, le Clostridium difficile y compris.
Pour la Suisse, les concentrations critiques peuvent être extrapolées à l'aune des données d' EUCAST (European Committee on Antimicrobial Susceptibility Testing). Les valeurs seuils des CMI selon l'EUCAST, version 7.1, 10 mars 2017 (www.eucast.org), sont présentées dans le tableau suivant:
Microorganismes | Sensible | Résistant |
Staphylococcus aureusa | ≤2 mg/L | >2 mg/mL |
Staphylocoques à coagulase-negativea, b | ≤4 mg/L | >4 mg/mL |
Enterococcus spp. | ≤2 mg/L | >2 mg/mL |
Streptococcus spp. (A, B, C, G) b | ≤2 mg/L | >2 mg/mL |
Streptococcus pneumoniaeb | ≤2 mg/L | >2 mg/mL |
Streptocoques du groupe viridansb | ≤2 mg/L | >2 mg/mL |
Anaérobies à Gram positif sauf Clostridium difficile | DI | DI |
Seuils PK/PD (non liés à l'espèce)c | DI | DI |
a Les CMI des glycopeptides dépendent de la méthode et elles doivent être déterminées par microdilution en bouillon (référence ISO 20776). Les souches de S. aureus ayant une CMI pour la vancomycine de 2 mg/ml sont à la limite de la distribution des CMI pour les souches de phénotype sauvage ce qui peut aboutir à une réponse clinique altérée. Le seuil de résistance pour S. aureus a été abaissé à 2 mg/ml afin d'éviter le classement de souches GISA en intermédiaires, car les infections graves dues aux souches GISA ne peuvent être traitées par des doses accrues de vancomycine ou de teicoplanine. b Les souches ayant des CMI supérieures au seuil de sensibilité ci-dessus sont très rares ou non encore signalées. Les tests d'identification de sensibilité antimicrobienne de ces isolats doivent être répétés, et, si le résultat est confirmé, l'isolat doit être adressé à un laboratoire de référence. Jusqu'à la confirmation de la réponse clinique pour les isolats identifiés avec une CMI supérieure à l'actuelle concentration critique R, ils doivent être considérés comme résistants. c DI indique que les données sont insuffisantes pour montrer que l'espèce en question est une cible adéquate pour le traitement par le médicament. d Une CMI avec un commentaire, mais sans classement S, I ou R associé, peut être signalée. | ||
Espèces habituellement sensibles | Espèces inconstamment sensibles | Bactéries naturellement résistantes |
Bactéries aérobies à Gram positifCorynebacterium jeikeiuma Enterococcus faecalis Staphylococcus aureus (dont souches résistantes à la méticilline) Streptococcus agalactiae Streptococcus dysgalactiae subsp. equisimilisa (streptocoques des groupes C & G) Streptococcus pneumoniae Streptococcus pyogenes Streptocoques du groupe viridansa, b Bactéries anaérobies à Gram positifClostridium difficilea Peptostreptococcus spp.a | Bactéries aérobies à Gram positif:Enterococcus faecium Staphylococcus epidermidis Staphylococcus haemolyticus Staphylococcus hominis | Toutes les bactéries à Gram négatif Autres bactéries:Chlamydia spp. Chlamydophila spp. Legionella pneumophila Mycoplasma spp. |
a Aucune donnée actuelle n'était disponible au moment de la publication des tableaux. Les principales données de la littérature, les documents de base et les recommandations thérapeutiques présument d'une sensibilité. b Terme collectif pour un groupe hétérogène d'espèces streptococciques. Le taux de résistance peut varier selon l'espèce streptococcique en cause. | ||
Mécanisme de résistance
Une résistance à la teicoplanine peut être basée sur les mécanismes suivants:
- Modification de la structure cible: cette forme de résistance est particulièrement apparue chez Enterococcus faecium. La modification concerne le remplacement de la fonction de la chaîne terminale d'acides aminés D-alanyl-D-alanine par un précurseur de muréine D-Ala-D-lactate, ce qui réduit l'affinité pour la vancomycine. Les enzymes responsables sont une D-lactate déshydrogénase ou ligase nouvellement synthétisées.
- La réduction de la sensibilité ou la résistance des staphylocoques à la teicoplanine repose sur la surproduction des précurseurs de muréine auxquels la teicoplanine se lie.
Une résistance croisée entre la teicoplanine et la vancomycine peut apparaître. Certains entérocoques résistants à la vancomycine sont sensibles à la teicoplanine (phénotype Van-B).
La prévalence de la résistance peut varier de manière géographique et au fil du temps pour les souches sélectionnées. Les informations locales peuvent s'avérer très utiles notamment pour traiter des infections sévères où un diagnostic microbiologique avec isolation du pathogène et démonstration de la sensibilité est recommandé. L'avis d'un spécialiste est conseillé, surtout si, du fait d'un niveau de résistance locale élevé, l'utilisation de Targocid est discutable dans certaines indications.
Pharmacocinétique
Absorption et biodisponibilité
La teicoplanine est administrée par voie parentérale (intraveineuse ou intramusculaire). Après une administration intramusculaire, la biodisponibilité de la teicoplanine (comparativement à une administration intraveineuse) est quasi-totale (90%). Après six administrations journalières intramusculaires de 200 mg, la concentration maximale moyenne (écart type) de teicoplanine (Cmax) est de 12,1 (0,9) mg/l et est obtenue 2 heures après administration.
Après une dose de charge de 6 mg/kg administrée par voie intraveineuse toutes les 12 heures pour 3 à 5 administrations, les valeurs de la Cmax sont comprises entre 60 et 70 mg/l et celles de la concentration résiduelle sont habituellement supérieures à 10 mg/l. Après une dose de charge intraveineuse de 12 mg/kg administrée toutes les 12 heures pour 3 administrations, les valeurs moyennes de la Cmax et de la concentration résiduelle sont respectivement estimées à environ 100 mg/l et 20 mg/l.
Après une dose d'entretien de 6 mg/kg administrée une fois par jour, les valeurs de la Cmax et de la concentration résiduelle sont respectivement d'environ 70 mg/L et 15 mg/L. Après une dose d'entretien de 12 mg administrée une fois par jour, les concentrations résiduelles vont de 18 à 30 ml/L.
La teicoplanine administrée par voie orale n'est pas absorbée dans le tractus digestif. À la suite de l'administration par voie orale d'une dose unique de 250 ou 500 mg chez des sujets sains, la teicoplanine n'a pas été détectée dans le sérum ni dans l'urine, mais a été retrouvée uniquement dans les fèces (environ 45% de la dose administrée) sous forme inchangée.
Distribution
La liaison aux protéines plasmatiques humaines varie de 87,6 à 90,8% indépendamment des concentrations de teicoplanine. La teicoplanine est principalement liée à la sérum-albumine humaine. La teicoplanine ne diffuse pas dans les érythrocytes.
Le volume de distribution à l'état d'équilibre (Vss) varie de 0,7 à 1,4 ml/kg. Les valeurs les plus élevées du Vss ont été observées lors d'études récentes, dans lesquelles la durée de la période de prélèvements était supérieure à 8 jours.
La teicoplanine diffuse principalement dans les poumons, le myocarde et les tissus osseux avec des rapports concentration tissulaire/concentration sérique supérieurs à 1. Ces rapports variaient de 0,5 à 1 dans le liquide de phlyctène, le liquide synovial et le liquide péritonéal. Le taux d'élimination de la teicoplanine du liquide péritonéal est identique à celui de son élimination du sérum. Dans le liquide pleural et les tissus adipeux sous-cutanés, les rapports concentration tissulaire/concentration sérique sont compris entre 0,2 et 0,5. La teicoplanine ne pénètre pas facilement dans le liquide céphalorachidien (LCR).
On ne sait pas si la substance passe dans le lait maternel ou traverse la barrière placentaire.
Métabolisme/Elimination
La teicoplanine est principalement excrétée sous forme inchangée par voie urinaire (80% en 16 jours), tandis que 2,7% de la dose administrée sont récupérés dans les fèces (à la suite d'une excrétion biliaire) au cours des 8 jours suivant l'administration.
La demi-vie d'élimination de la teicoplanine a varié de 100 à 170 heures lors des études les plus récentes au cours desquelles la durée des périodes de prélèvements était d'environ 8 à 35 jours.
La clairance totale de la teicoplanine est faible, de 10 à 14 ml/h/kg, et sa clairance rénale est de 8 à 12 ml/h/kg, ce qui indique qu'elle est principalement excrétée par des mécanismes rénaux.
La demi-vie d'élimination prolongée permet une administration une fois par jour (exception: dose de charge).
Linéarité
La pharmacocinétique de la teicoplanine est linéaire pour des doses de 2 à 25 mg/kg.
Cinétique pour certains groupes de patients:
Patients insuffisants rénaux:
La teicoplanine est éliminée par voie rénale, et son élimination diminue donc selon le degré d'insuffisance rénale. Les clairances totale et rénale de la teicoplanine dépendent de la clairance de la créatinine.
Patients âgés:
Les paramètres pharmacocinétiques de la teicoplanine ne sont pas modifiés chez les patients âgés, sauf en cas d'insuffisance rénale.
Population pédiatrique
Comparativement à l'adulte, la clairance totale est plus élevée chez l'enfant (15,8 ml/h/kg pour des nouveau-nés, 14,8 ml/h/kg pour un âge moyen de 8 ans) et la demi-vie d'élimination plus courte (40 heures pour les nouveau-nés; 58 heures pour 8 ans).
Données précliniques
Des effets sur le rein ont été observés à la suite d'administrations parentérales répétées chez le rat et le chien, et ils se sont avérés dose-dépendants et réversibles. Des études visant à explorer le potentiel d'ototoxicité chez le cobaye ont indiqué qu'une légère altération de la fonction cochléaire et vestibulaire était possible en l'absence de lésions morphologiques.
L'administration sous-cutanée de teicoplanine jusqu'à 40 mg/kg/jour n'a pas affecté la fertilité des mâles et des femelles chez le rat. Lors d'études sur le développement embryofœtal, aucune malformation n'a été observée à la suite de l'administration sous-cutanée de doses allant jusqu'à 200 mg/kg/jour chez le rat et de l'administration intramusculaire de doses allant jusqu'à 15 mg/kg/jour chez le lapin. Cependant, chez le rat, l'incidence de la mortinatalité a augmenté aux doses supérieures ou égales à 100 mg/kg/jour, et celle de la mortalité néonatale a augmenté à 200 mg/kg/jour. Cet effet n'a pas été rapporté à 50 mg/kg/jour. Une étude péri- et postnatale chez le rat n'a révélé aucun effet sur la fertilité de la génération F1 ni sur la survie et le développement de la génération F2 à la suite de l'administration sous-cutanée de doses allant jusqu'à 40 mg/kg/jour.
La teicoplanine n'a présenté aucun potentiel d'antigénicité (chez la souris, le cobaye et le lapin), de génotoxicité ou d'irritation locale.
Les résultats des études de carcinogénicité ne sont pas disponibles.
Remarques particulières
Incompatibilités:
Les solutés de teicoplanine et d'aminoglycosides sont incompatibles et ne doivent donc pas être mélangés avant l'injection. Par contre, les deux solutés sont compatibles dans le liquide de dialyse et peuvent être utilisés pour traiter la péritonite secondaire à une dialyse péritonéale chronique ambulatoire.
Le médicament ne doit être mélangé qu'avec les préparations mentionnées sous «Instructions pour la manipulation».
Conservation:
Poudre et solvant pour solution injectable:
Protéger de la chaleur.
Conservation à température ambiante (15-25 °C).
Le médicament ne peut être utilisé au-delà de la date imprimée sur le récipient avec la mention «EXP»:
Solution reconstituée:
Sous l'angle microbiologique, les solutions doivent être utilisées aussitôt après leur préparation (durée de conservation maximale de 24 heures à 2-8 °C), à moins que la reconstitution se soit faite dans des conditions d'asepsie contrôlées et validées. Faute de quoi c'est à l'utilisateur d'assumer la responsabilité du délai et des conditions de conservation. «In-use»; la stabilité chimique et physique a été démontrée pour 48 heures à température ambiante et pour 7 jours à 2-8 °C.
Traitement oral: utiliser la solution immédiatement.
Conserver soigneusement les médicaments.
Tenir hors de la portée des enfants.
Instructions pour la manipulation:
Préparation de la solution pour injection
Injecter lentement la totalité du solvant fourni dans le flacon de poudre.
Faire délicatement tourner le flacon entre les mains jusqu'à la dissolution complète de la poudre. Si la solution devient mousseuse, elle doit être laissée au repos pendant environ 15 minutes. Utiliser uniquement les solutions limpides et jaunâtres.
Les solutions reconstituées contiennent 200 mg dans 3,0 mL et 400 mg dans 3,0 mL.
Quantité nominale de teicoplanine dans le flacon | 200 mg | 400 mg |
Volume du flacon de poudre | 10 mL | 22 mL |
Volume prélevable dans l'ampoule de solvant pour reconstitution | 3,14 mL | 3,14 mL |
Volume contenant une dose nominale de teicoplanine (extrait au moyen d'une seringue de 5 mL et d'une aiguille 23 G) | 3,0 mL | 3,0 mL |
La solution reconstituée peut être injectée directement ou diluée de façon additionnelle, ou encore administrée par voie orale.
Préparation de la solution pour perfusion
Targocid peut être administré dans les solutions pour perfusion suivantes:
- solution de chlorure de sodium 9 mg/ml (0,9%)
- solution de Ringer
- solution de Ringer-lactate
- solution injectable de dextrose à 5%
- solution injectable de dextrose à 10%
- solution de chlorure de sodium à 0,18% et de glucose à 4%
- solution de chlorure de sodium à 0,45% et de glucose à 5%
- Solution pour dialyse péritonéale contenant 1,36% ou 3,86% de solution de glucose.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur (ne pas conserver plus de 24 heures).
Préparation de la solution pour l'administration par voie orale
Le contenu d'un flacon (200 mg) est dilué dans 30 ml d'eau. La solution est administrée en la faisant boire au malade ou au moyen d'une sonde naso-gastrique.
Numéro d’autorisation
49339 (Swissmedic).
Titulaire de l’autorisation
sanofi-aventis (suisse) sa, 1214 Vernier/GE.
Mise à jour de l’information
Août 2017.
Reviews (0)

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.


 Deutsch
Deutsch French
French







