Minirin Injektionslösung 4mcg i.m./i.v. 10 Ampullen 1ml buy online
Minirin Inj Lös 4 mcg i.m./i.v. 10 Amp 1 ml
-
219.78 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: FERRING AG
- Product Code: 1236420
- ATC-code H01BA02
- EAN 7680435850109
Ingredients:
Desmopressin acetat 4 mcg , Natriumchlorid, Salzsäure, konzentriert, Desmopressin 3.56 mcg.

Description
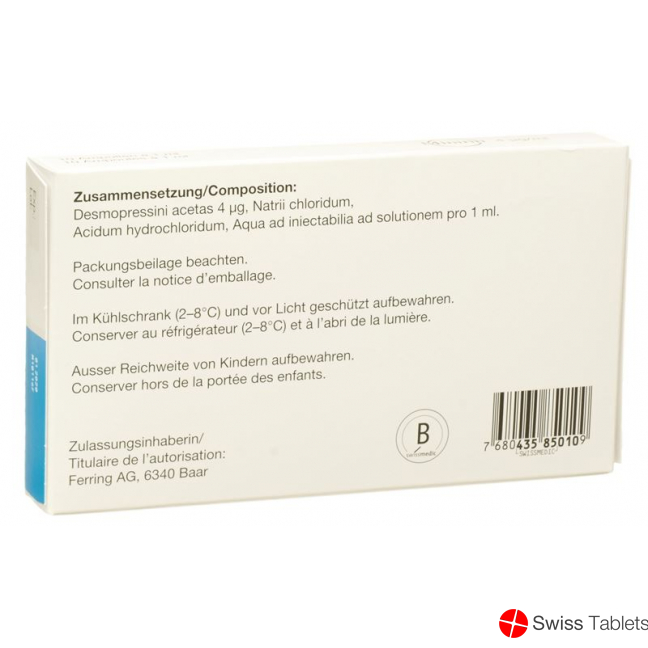
Zusammensetzung
Wirkstoff: Desmopressinacetat
Hilfsstoffe:
Minirin Injektionslösung: Natrii chloridum, Acidum hydrochloridum ad pH 4, Aqua ad iniectabilia q.s. ad solutionem pro 1 ml.
Minirin Nasaltropfen: Natrii chloridum, Acidum hydrochloridum, Conserv.: Chlorbutanolum hemihydricum, Aqua purificata ad 1 ml.
Minirin Nasalspray: Natrii chloridum, Acidum citricum monohydricum, Dinatrii phosphas dihydricus, Conserv.: Benzalkonium chloridum 0,1 mg, Aqua purificata ad 1 ml.
Minirin Tabletten: Lactosum monohydricum, Amylum solani tuberosi, Povidonum K25, Magnesii stearas.
Minirin Melt, Sublingualtabletten: Gelatinum, Mannitolum, Acidum citricum anhydricum.
Galenische Form und Wirkstoffmenge pro Einheit
Minirin Injektionslösung: 4 µg Desmopressinacetat, entsprechend 3,56 µg Desmopressin pro 1 ml.
Minirin Nasaltropfen: 10 µg Desmopressinacetat, entsprechend 8,9 µg Desmopressin pro 0,1 ml.
Minirin Nasalspray: 10 µg Desmopressinacetat, entsprechend 8,9 µg Desmopressin pro Sprühstoss zu 0,1 ml.
Minirin Tabletten: 0,1 resp. 0,2 mg, Desmopressinacetat entsprechend 89 µg resp. 178 µg Desmopressin pro Tablette.
Minirin Melt, Sublingualtabletten: Desmopressin 60 resp. 120 µg.
Indikationen/Anwendungsmöglichkeiten
Diabetes insipidus centralis, Polyurie, Polydipsie nach Hypophysektomie bzw. Operationen im Hypophysenbereich.
Enuresis nocturna im Alter ab 5 Jahren, bei normaler Konzentrationsfähigkeit der Niere, nach Versagen üblicher Massnahmen, nur bei Patienten mit normalem Blutdruck und Ausschluss einer organischen Ursache zur Kurzzeitbehandlung. Die nasalen Formen von Minirin (Nasaltropfen und Nasalspray) dürfen für die Behandlung der Enuresis nocturna nicht verwendet werden.
Untersuchung der Konzentrationsfähigkeit der Nieren (Diagnostik des Diabetes insipidus).
Dosierung/Anwendung
Diabetes insipidus centralis, Polyurie, Polydipsie nach Hypophysektomie bzw. Operationen im Hypophysenbereich
Zu Beginn der Behandlung muss die optimale Dosierung vom Arzt individuell durch Bestimmung der Harnmenge und Harnosmolalität ermittelt werden. Die Therapie sollte sich an zwei Parametern ausrichten: einer adäquaten Schlafdauer und einer ausgewogenen Wasserbilanz.
Parenterale Anwendung
Erwachsene: Tagesdosis 1 - 4 µg, entsprechend 0,25 – 1,0 ml i.v. oder i.m, verteilt auf 1 – 2 Einzeldosen.
Kinder: Tagesdosis 0,4 – 1 µg entsprechend 0,1 – 0,25 ml i.v. oder i.m, verteilt auf 1 – 2 Einzeldosen.
Säuglinge: Vorsichtige Einstellung mit 0,025 ml resp. 0,1 µg beginnend, i.v. oder i.m.
Injektion intravenös oder intramuskulär (1 – 2 mal täglich): | |||
Tagesdosis (Mikrogramm) | Injektionslösung (ml) | Anzahl Ampullen | |
Erwachsene: | 1 – 4 | 0.25 – 1.0 | ¼ - 1 |
Kinder: | 0.4 – 1 | 0.10 – 0.25 | 1/10 – ¼ |
Säuglinge (vorsichtig einstellen) | Mit 0.1 beginnend | mit 0.025 beginnend | mit 1/40 beginnend |
Verdünnungstabelle: Verdünnung mit isotonischer, steriler, pyrogenfreier Natriumchloridlösung: | |||
Zur Verabreichung von: | 1 Ampulle verdünnen mit: | Gesamtmenge Lösung: | Lösungsmenge zur Injektion |
¼ Ampulle | 3 ml NaCl-Lsg. | 4 ml | 1 ml |
1/10 Ampulle | 9 ml NaCl-Lsg. | 10 ml | 1 ml |
1/40 Ampulle | 39 ml NaCl-Lsg. | 40 ml | 1 ml |
Intranasale Anwendung
Erwachsene: Tagesdosis 10–40 µg, entsprechend 0,1–0,4 ml Nasaltropfen resp. 1–4 Sprühstösse Nasalspray, verteilt auf 1-2 Einzeldosen.
Kinder: Tagesdosis 5–20 µg, entsprechend 0,05–0,20 ml Nasaltropfen, resp. 1-2 Sprühstössen Nasalspray, verteilt auf 1-2 Einzeldosen. Minirin Nasalspray ist für die Behandlung von Kindern, welche eine Dosis von 5 µg benötigen, ungeeignet, da Dosierungen unter 10 µg nicht mit dem Nasalspray verabreicht werden können.
Säuglinge: Vorsichtige Einstellung beginnend mit 1 µg Nasaltropfen. Um ein geeignetes Applikationsvolumen zu erreichen, sollte die Nasaltropfen Lösung vorher mit 0.9% iger Kochsalzlösung verdünnt werden (z.B.: 0,1 ml einer 1:10 Verdünnung entsprechen 1 µg Desmopressin). Die verdünnte Lösung muss sofort verwendet werden. Reste müssen verworfen werden.
Perorale Anwendung
Erwachsene, Kinder: Initial 0,1 mg peroral 3× täglich. Die Dosierung wird dem Ansprechen des Patienten individuell angepasst. Die mittlere Tagesdosis liegt zwischen 0,2–1,2 mg. Die Mehrzahl der Patienten ist mit 3× täglich 0,1–0,2 mg optimal eingestellt.
Säuglinge: Keine Anwendung bei Säuglingen.
Sublinguale Anwendung
Erwachsene, Kinder: Initial 60 µg 3× täglich. Die Dosierung wird dem Ansprechen des Patienten individuell angepasst. Die mittlere Tagesdosis liegt zwischen 120 µg – 720 µg. Die Mehrzahl der Patienten ist mit 3× täglich 60–120 µg optimal eingestellt. Die Sublingualtablette soll vor dem Schlucken 10 Sekunden unter der Zunge gehalten werden.
Säuglinge: Keine Anwendung bei Säuglingen.
Nach Operationen im Hypophysenbereich, bei Hypophysenhinterlappeninsuffizienz
Dosierung nach Messung der Osmolalität des Urins festlegen.
Bei Anzeichen von Wasserretention/Hyponatriämie muss die Behandlung unterbrochen und die Dosierung angepasst werden.
Enuresis Nocturna
Die effektive therapeutische Dosis ist individuell verschieden und wird entsprechend der Reaktion angepasst.
Kinder ab 5 Jahren, Jugendliche und Erwachsene
Perorale Anwendung: Initial 0,2 mg. Bei Bedarf schrittweise erhöhen auf 0,4 mg.
Sublinguale Anwendung: Initial 120 µg. Bei Bedarf schrittweise erhöhen auf 240 µg. Die Sublingualtablette soll vor dem Schlucken 10 Sekunden unter der Zunge gehalten werden.
Minirin Tabletten und Minirin Melt Sublingualtabletten sind indiziert zur Behandlung des zentralen Diabetes insipidus und der Enuresis nocturna. Dabei entsprechen 0,2 mg per os 120 µg sublingual.
Bei Anzeichen von Wasserretention/Hyponatriämie muss die Behandlung unterbrochen und die Dosierung angepasst werden.
Es ist ein Behandlungszeitraum von bis zu 3 Monaten vorgesehen. Die Notwendigkeit für eine weitere Behandlung sollte nach einer Unterbrechung der Einnahme von mindestens 1 Woche überprüft werden.
Untersuchung der Konzentrationsfähigkeit der Nieren
Die Untersuchung der Konzentrationsfähigkeit der Nieren mit Minirin bei Kleinkindern unter 1 Jahr sollte nur unter Klinik-Bedingungen durchgeführt werden.
Der Kurztest wird vorzugsweise morgens durchgeführt. Die Trinkmenge sollte während der ersten 12 Stunden nach der Applikation eingeschränkt werden. Kinder unter 5 Jahren und Patienten mit Herzerkrankungen oder Hochdruck sollten die Flüssigkeitsaufnahme auf die Hälfte reduzieren.
Vor Testbeginn sollte die Osmolalität des Urins bestimmt werden. Nach der Desmopressin-Gabe werden 2 Urinproben genommen (vorzugsweise nach etwa 2 und 4 Stunden). Innerhalb der ersten Stunde sollte Urin abgenommen und verworfen werden. In den beiden Urinproben wird die Osmolalität ermittelt. Zur Bestimmung der renalen Konzentrationsfähigkeit wird dann der höhere Wert mit dem Ausgangswert vor Testbeginn oder dem alterspezifischen Referenzwert (Erwachsene 800-1000 mOsm/kg) verglichen. Erniedrigte Werte, ein fehlender oder nur geringer Anstieg der Urinosmolalität deuten auf eine eingeschränkte Nierenkonzentrationsfähigkeit hin. Eine durch zentralen Diabetes insipidus bedingte Polyurie liegt vor, wenn die Urinosmolalität deutlich ansteigt und das Urinvolumen deutlich abnimmt.
Parenterale Anwendung
Erwachsene: 1 ml bzw. 4 µg i.v.
Kinder, 10–16 Jahre: 0,5 ml bzw. 2 µg i.v.
Säuglinge und Kleinkinder: 0,25 ml bzw. 1 µg i.v.
Intranasale Anwendung
Erwachsene: 40 µg (0,4 ml Nasaltropfen oder 4 Sprühstösse Nasalspray).
Kinder, 10–16 Jahre: 20 µg (0,2 ml Nasaltropfen oder 2 Sprühstösse Nasalspray).
Säuglinge und Kleinkinder: 10 µg (0,1 ml Nasaltropfen oder 1 Sprühstoss Nasalspray).
Kontraindikationen
Desmopressin darf nicht angewendet werden bei:
-primärer oder psychogener Polydipsie;
-Herzinsuffizienz und anderen Erkrankungen, die eine Behandlung mit Diuretika erfordern;
-bei Patienten mit Hyponatriämie;
-moderater oder schwerer Niereninsuffizienz (Kreatinin-Clearance unter 50 ml/min);
-Syndrom der inadäquaten ADH-Sekretion (SIADH);
-schwerem klassischem von-Willebrand-Jürgens-Syndrom (Typ IIb), Patienten mit 5% Faktor VIII-Aktivität, Faktor VIII-Antikörpern;
-Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe.
Warnhinweise und Vorsichtsmassnahmen
Bei der Gabe von Minirin Tabletten oder Sublingualtabletten bei Enuresis nocturna soll als Vorsichtsmassnahme die Flüssigkeitsaufnahme 1 Stunde vor bis 8 Stunden nach Verabreichung von Minirin eingeschränkt und auf das Durstlöschen reduziert werden. Eine Behandlung ohne gleichzeitige Reduktion der Flüssigkeitsaufnahme kann zu Wasserretention und/oder Hyponatriämie mit Symptomen wie Kopfschmerzen, Nausea, Erbrechen, Gewichtszunahme und in schweren Fällen zu Hirnödem, Krampfanfällen und Koma führen. Die Sicherheit der Langzeitanwendung bei Enuresis nocturna ist nicht belegt.
Über das Auftreten von Hirnödem und Krampfanfällen wurde wiederholt berichtet bei sonst gesunden Kindern und jungen Erwachsenen, die wegen einer Enuresis nocturna mit Desmopressin behandelt wurden. Dieses Risiko scheint in der ersten Behandlungswoche besonders hoch zu sein.
Ältere Patienten (>65 Jahre) und Patienten mit niedrigen Natriumspiegeln können ein erhöhtes Risiko für eine Hyponatriämie haben.
Die Wirkungsdauer nimmt mit höheren Dosierungen zu, und somit auch das Hyponatriämierisiko. Die Dosierung soll entsprechend von unten nach oben titriert werden.
Desmopressin sollte mit besonderer Vorsicht angewendet werden bei Patienten mit zystischer Fibrose, koronarer Herzkrankheit, Hypertonie, Thromboseneigung, chronischem Nierenleiden, Pre-Eklampsie, erhöhtem intrakraniellen Druck oder mit Störungen des Flüssigkeits- und Elektrolythaushaltes.
Bei Patienten mit Hypertonie und chronischem Nierenleiden können die unter «Unerwünschte Wirkungen» genannten Symptome verstärkt auftreten. Bei sehr jungen und älteren Patienten und beim Bestehen von Risikofaktoren, welche zu einem erhöhten intrakraniellen Druck führen können, muss beim Einsatz von Minirin sorgfältig darauf geachtet werden, dass keine Wasserretention auftritt.
Die Behandlung mit Desmopressin kann ohne gleichzeitige Einschränkung der Flüssigkeitszufuhr zu einer Wasserretention und Hyponatriämie führen.
Patienten, und im Falle von Kindern deren Eltern, sind darauf aufmerksam zu machen, dass eine übermässige Flüssigkeitsaufnahme zu vermeiden ist und dass bei Erbrechen, Durchfall, systemischen Infektionen und Fieber die Anwendung von Desmopressin solange zu unterbrechen ist, bis sich der Flüssigkeitshaushalt wieder normalisiert hat.
Um das Risiko einer Hyponatriämie bzw. Wasserintoxikation zu vermindern, ist eine Reduktion der Flüssigkeitsaufnahme besonders wichtig bei:
-Einsatz von Arzneimitteln, welche bekanntermassen ein SIADH herbeiführen (trizyklische Antidepressiva, selektive Serotonin-Wiederaufnahmehemmer, Chlorpromazin, Chlorpropamide und Carbamazepin);
-gleichzeitiger Behandlung mit NSAID's.
Es ist wichtig, während der Behandlung das Körpergewicht zu überwachen.
Bei Patienten im Alter über 65 Jahren soll das Serum-Natrium vor Beginn der Therapie und 3 Tage nach Therapiebeginn oder Dosiserhöhungen bestimmt werden. Beim Auftreten von Kopfschmerzen und/oder Nausea muss die Behandlung abgebrochen werden.
Organische Ursachen für eine Polyurie oder gesteigerte Miktionsrate oder Nykturie wie benigne Prostatahyperplasie (BPH), Harnwegsinfekte, Blasensteine bzw. –tumore, Störungen des Blasensphinkters, Polydipsie oder unzureichend behandelten Diabetes mellitus sollten ausgeschlossen oder entsprechend behandelt werden. Jede Nebennieren- oder Schilddrüseninsuffizienz muss vor Beginn der Desmopressintherapie behandelt werden.
Bei intranasaler Anwendung können Veränderungen oder Erkrankungen der Nasenschleimhaut zu einer veränderten Absorption führen. In diesen Fällen sollte Desmopressin nicht angewendet werden. Das in Minirin Nasalspray enthaltene Konservierungsmittel (Benzalkoniumchlorid) kann zu Bronchospasmen führen und insbesondere bei längerer Anwendung, eine Schwellung der Nasenschleimhaut hervorrufen. Besteht ein Verdacht auf eine derartige Reaktion (anhaltend verstopfte Nase), sollte – soweit möglich – ein Arzneimittel zur Anwendung in der Nase ohne Konservierungsstoff verwendet werden. Stehen solche Arzneimittel nicht zur Verfügung, so ist eine andere Darreichungsform in Betracht zu ziehen.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Minirin Tabletten nicht einnehmen.
Interaktionen
Bei gleichzeitiger Anwendung von Oxytocin ist eine Erhöhung des antidiuretischen Effektes möglich und mit einer Abschwächung der Uterusdurchblutung zu rechnen. Glibenclamid und Lithium können die antidiuretische Wirkung von Minirin verringern.
Clofibrat, Indomethacin und andere NSARs, Chlorpromazin, Carbamazepin, Antidepressiva, selektive Serotoninwiederaufnahmehemmer sowie alle Arzneimittel mit Wirkung auf den Wasser-Elektrolythaushalt können die antidiuretische Wirkung von Minirin verstärken und damit das Risiko der Wasserretention/Hyponatriämie erhöhen. Bei gleichzeitiger Anwendung der obengenannten Medikamente sollten Blutdruck, Plasma-Natriumspiegel und Harnausscheidung überwacht werden.
Die gleichzeitige Behandlung mit Loperamid kann zu einer bis zu 3-fach höheren Desmopressinplasmakonzentration führen, die wiederum zu einem erhöhten Risiko einer Wasserretention/Hyponatriämie führen kann.
Es ist unwahrscheinlich, dass Desmopressin Wechselwirkungen mit Stoffen, die den Lebermetabolismus beeinflussen, hat, da Desmopressin in in-vitro Studien an humanen Mikrosomen keinen signifikanten Metabolismus in der Leber zeigt. In-vivo Studien zu möglichen Wechselwirkungen wurden bisher nicht durchgeführt.
Eine standardisierte Diät mit 27% Fett verringert die Absorption (Menge und Dauer) von oral verabreichtem Desmopressin signifikant. Hinsichtlich der pharmakodynamischen Eigenschaften (Urinproduktion oder Osmolalität) wurde kein signifikanter Effekt beobachtet, daher kann Desmopressin, wenn gewünscht, zu den Mahlzeiten eingenommen werden. Jedoch kann Nahrungsaufnahme bei einer geringen oralen Dosierung von Desmopressin Intensität und Dauer der antidiuretischen Wirkung verringern.
Schwangerschaft/Stillzeit
Die vorliegenden Daten bei einer begrenzten Anzahl (n=53) schwangerer Frauen mit Diabetes insipidus zeigen, dass Desmopressin keine negativen Auswirkungen auf die Schwangerschaft oder den Gesundheitszustand des Foeten oder Neugeborenen hat. Bis heute liegen keine weiteren relevanten epidemiologischen Daten vor. Tierversuche zeigen keine direkten oder indirekten schädlichen Effekte auf die Schwangerschaft, die embryonale/foetale Entwicklung, die Geburt oder die postnatale Entwicklung.
Bei der Anwendung während der Schwangerschaft ist Vorsicht geboten.
Bei der Behandlung des Diabetes insipidus in der Schwangerschaft ist die Dosis den individuellen Erfordernissen anzupassen, da sie sich während der Schwangerschaft verändern kann. Eine Blutdrucküberwachung wird empfohlen.
Untersuchungen der Muttermilch von Frauen, die eine hohe Dosierung von 300 µg Desmopressin (intranasal) erhalten hatten, zeigten, dass die Mengen an Desmopressin, die auf das Kind übertragen werden könnten, zu gering sind, um die Diurese zu beeinflussen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Die unerwünschten Wirkungen sind nach Organklassen und Häufigkeitsgraden gegliedert unter Berücksichtigung folgender Definition: sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1'000, <1/100); selten (≥1/10'000, <1/1'000); sehr selten (<1/10'000).
Störungen des Immunsystems
Sehr selten: allergische Reaktionen und Überempfindlichkeitsreaktionen (z.B. Juckreiz, Exanthem, Fieber, Bronchospasmus, Anaphylaxie).
Stoffwechselstörungen
Sehr selten: Hyponatriämie, Wasserintoxikation.
Psychiatrische Störungen
Sehr selten: Emotionale Störungen (bei Kindern).
Störungen des Nervensystems
Häufig: Kopfschmerzen.
Selten: Hirnödem, hyponatriämische Krämpfe.
Respiratorische, thorakale und mediastinale Funktionsstörungen
Häufig: (Nasaltropfen, Nasalspray) Nasale Kongestion, Epistaxis, Rhinitis.
Gastrointestinale Störungen
Häufig: Abdominale Schmerzen, Krämpfe, Übelkeit, Durchfall, Erbrechen.
Funktionsstörungen der Gefässe
Häufig: Vorübergehender Blutdruckabfall, erhöhte Pulsfrequenz, Flush-Phänomene.
Unbekannt: thrombotische Komplikationen (Hirn- und Koronararterien).
Allgemeine Störungen und Reaktionen an der Applikationsstelle
Häufig: Müdigkeit.
Bei übermässiger Flüssigkeitszufuhr sowie bei Anwendung von zu hohen Dosierungen können durch Wasserretention Gewichtszunahme, Hyponatriämie, Krämpfe, Hirnödeme und Koma auftreten. Dies gilt besonders für Kinder bis 1 Jahr oder ältere Patienten, abhängig von ihrem Allgemeinzustand. Um eine Wasserintoxikation zu vermeiden, sollte auf eine ausgewogene Wasserbilanz geachtet werden.
Auf Grund der verstärkten Wasserrückresorption kann der Blutdruck steigen, und es kann sich in einigen Fällen eine Hypertonie entwickeln. Bei Patienten mit einer koronaren Herzkrankheit kann es zu Angina pectoris kommen.
Überdosierung
Bei akuter Überdosierung von Minirin treten die oben erwähnten Nebenwirkungen verstärkt auf. Eine Überdosierung kann insbesondere bei der unvorsichtigen Einstellung von Kleinkindern auftreten.
Bei Überdosierung erhöht sich das Risiko einer Flüssigkeitsretention und einer Hyponatriämie. Obwohl die Behandlung der Hyponatriämie individuell gestaltet werden soll, bewährten sich die folgenden allgemeinen Empfehlungen:
Bei asymptomatischer Hyponatriämie wird die Therapie mit Desmopressin abgebrochen und die Flüssigkeitszufuhr eingeschränkt. Bei symptomatischer Hyponatriämie können zusätzlich Infusionen von isotonischer oder hypertonischer Kochsalzlösung gegeben werden. Bei Hirnödem ist eine sofortige Einweisung zur Intensivtherapie notwendig. Krämpfe im Kindesalter bedürfen ebenfalls Intensivmassnahmen.
Eigenschaften/Wirkungen
ATC-Code: H01BA02
Die pharmakologische Wirkung von Minirin ist ungeachtet der verschiedenen Anwendungsarten und galenischen Formen gleich.
Desmopressin ist ein Analogon des menschlichen Hypophysenhinterlappenhormons Arginin-Vasopressin, bei welchem eine Aminogruppe des Cysteins (in Stellung 1 des Peptids) entfernt und L-Arginin (in Position 8) durch D-Arginin ersetzt wurde. Damit wird im Vergleich zum nativen L-Arginin-Vasopressin eine wesentliche Verlängerung der antidiuretischen Wirkung erreicht, während der vasopressorische Effekt bei therapeutischer Dosierung stark verringert wird.
Die antidiuretische Wirkung nach intravenöser oder subkutaner Gabe von 1 µg Desmopressin dauert 5–20 Stunden, nach intranasaler Gabe von 20 µg 8–12 Stunden, und nach peroraler Gabe von 0,1 mg ca. 8 Stunden.
In hohen Dosen besitzt Desmopressin zudem die Eigenschaft, sowohl den Antihämophilie-Faktor (Faktor VIII) als auch den von-Willebrand-Faktor (vWF) zu aktivieren.
Pharmakokinetik
Absorption
Die systemische Verfügbarkeit von intravenös verabreichtem Desmopressin ist nahezu vollständig, jene von subkutan verabreichtem Desmopressin beträgt ca. 90% im Vergleich zur intravenösen Gabe. tmax beträgt weniger als 20 Minuten bei i.v.- und ungefähr 1 Stunde bei subkutaner Injektion.
Minirin, intranasal und oral verabreicht, wird schnell, aber unvollständig resorbiert, wobei die Bioverfügbarkeit im Vergleich zur i.v. Gabe nach intranasaler Gabe etwa 3–5% beträgt. Nach intranasaler Gabe von Desmopressin wird die maximale Plasmakonzentration nach ca. 50 min. erreicht.
Die Plasmahalbwertzeit liegt zwischen 2 und 3 Stunden.
Die absolute Bioverfügbarkeit von Desmopressin nach oraler Gabe liegt zwischen 0,08 und 0,16%. Die mittlere maximale Plasmakonzentration wird nach ca. 2 Stunden erreicht.
Die mittlere systemische Bioverfügbarkeit von sublingual verabreichtem Desmopressin wie Minirin Melt in Dosen von 200, 400 und 800 µg liegt bei 0,25% mit einem 95%igen Vertrauensintervall von 0,21–0,31%. Cmax lag bei 14, 30 bzw. 65 pg/ml nach Verabreichung von 200, 400 bzw. 800 µg. tmax wurde 0,5–2,0 Stunden nach Dosierung beobachtet. Die geometrische mittlere Halbwertzeit ist 2,8 (CV = 24%) Stunden.
Desmopressin verfügt über eine hohe Variabilität der Bioverfügbarkeit sowohl inter- als auch intraindividuell.
Distribution
Das Distributionsvolumen beträgt 0,2–0,3 l/kg. Desmopressin passiert die Blut/Hirn-Schranke nicht. Desmopressin tritt in sehr geringen Mengen in die Muttermilch über.
Metabolismus
Mit humanen Leber-Mikrosomen konnte in vitro gezeigt werden, dass nur ein geringer Teil von Desmopressin in der Leber metabolisiert wird. Demnach ist der Metabolismus von Desmopressin in der Leber in vivo von geringer Bedeutung.
Elimination
Die Elimination von Desmopressin folgt einer Kinetik erster Ordnung, verläuft jedoch etwas langsamer als die Elimination des nativen Vasopressins. Die Plasma-Halbwertszeit von Desmopressin nach parenteraler und intranasaler Gabe liegt zwischen 2,5 und 4,5 Stunden, nach oraler Gabe zwischen 2,0 und 3,2 Stunden. Ca. 65% des nach oraler Gabe resorbierten Desmopressin (nach i.v. Injektion 45%) wird innerhalb von 24 Stunden über den Urin ausgeschieden.
Kinetik spezieller Patientengruppen
Es bestehen keine geschlechtsspezifischen Unterschiede im pharmakokinetischen Verhalten von Desmopressin.
Präklinische Daten
Aus den Untersuchungen zur chronischen Toxizität liegen keine Erkenntnisse vor, dass beim Menschen bisher unbekannte Nebenwirkungen auftreten können.
In einem Ames-Test gab es keinen Hinweis auf mutagenes Potential. Langzeitstudien zum karzinogenen Potential wurden nicht durchgeführt.
Studien zur Embryotoxizität nach subkutaner Gabe von maximal 10 µg/kg Desmopressin an den Tagen 6-18 post conceptionem an Kaninchen ergaben in der hohen Dosisgruppe einen höheren Postimplantationsverlust von 10,6% im Vergleich zu Kontrollen (1,2%) und eine geringere Anzahl lebender Feten. Teratogene Effekte wurden nicht beobachtet.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «Exp» bezeichneten Datum verwendet werden.
Minirin Nasaltropfen: Nach Anbruch sind die Nasaltropfen 2 Monate bei 2 °C - 8 °C haltbar. Für Säuglinge verdünnte Minirin Nasaltropfen müssen sofort verwendet werden, Reste müssen verworfen werden.
Minirin Nasalspray: Nach Anbruch ist der Nasalspray 2 Monate bei max. 25 °C haltbar.
Minirin Injektionslösung: Die Injektionslösung enthält kein Konservierungsmittel. Aus mikrobiologischen Gründen ist die gebrauchsfertige Injektionslösung unmittelbar nach Anbruch zu verwenden. Restmengen sind zu verwerfen.
Besondere Lagerungshinweise
Ausser Reichweite von Kindern aufbewahren.
Minirin Injektionslösung: Im Kühlschrank (2–8 °C) in der Originalverpackung vor Licht geschützt lagern. Nicht einfrieren.
Minirin Nasaltropfen: Im Kühlschrank (2–8 °C) in der Originalverpackung vor Licht geschützt lagern. Nicht einfrieren.
Minirin Nasalspray: Bei Raumtemperatur (15–25 °C) in der Originalverpackung vor Licht geschützt lagern. Nicht einfrieren.
Minirin Tabletten: Nicht über 25 °C in der Originalverpackung vor Licht und Feuchtigkeit geschützt lagern.
Minirin Melt, Sublingualtabletten: Bei Raumtemperatur (15–25 °C) in der Originalverpackung vor Licht und Feuchtigkeit geschützt lagern.
Hinweise für die Handhabung
Minirin Injektionslösung:
Das Volumen einer Ampulle erlaubt die Entnahme und Verabreichung einer Dosis bis zu 1.0 ml (4 µg) Injektionslösung.
Minirin Melt Sublingualtabletten:
Gebrauchsanweisung zum Öffnen der Blister:
1.Blisterstreifen am markierten Ende öffnen.
2.Den ersten Blister entlang der perforierten Linie abtrennen.
Die nicht versiegelte Ecke jedes einzelnen Blisters ist mit einem Pfeil markiert und mit einer kleinen dreieckigen Schutzkappe versehen. Die Schutzkappe entfernen und die Abdeckung des Blisters anheben und entfernen. Die Tablette kann nun entnommen werden.
3.Zur Entnahme der übrigen Tabletten folgen Sie Punkt 2.
4.Falls die Blister-Abdeckung reisst, können die Ränder entlang der perforierten Linie mit einer Schere abgeschnitten werden.
Falls eine Tablette auseinander bricht, können die einzelnen Teile eingenommen werden. Falls eine Tablette in mehr als 3 Teile zerbricht, werden die Teile im Blister belassen und weggeworfen.
Gebrauchsanweisung zur korrekten Anwendung von Minirin Nasaltropfen:
1. Plastikband am Flaschenhals aufreissen und braune Plastik-Kappe entfernen.
2. Den geriffelten Spitzenverschluss der Tropfflasche abdrehen und als späteren Verschluss behalten.
3. Umfassen Sie das mit einem Pfeil markierte Ende der Rhinyle® (Plastikröhrchen) mit einer Hand und mit den Fingern der anderen Hand den zylindrischen Kunststoff-Verschluss der Tropfflasche. Setzen Sie die Spitze der nach unten gerichteten Tropfflasche an das markierte Ende der Rhinyle und drücken Sie vorsichtig auf den Kunststoffverschluss, bis die Lösung die gewünschte Markierung erreicht.
Bei der Entnahme einer Einzeldosis sollte darauf geachtet werden, dass beim Absetzen der Rhinyle vom zylindrischen Kunststoffverschluss der Druck auf den Verschluss erhalten bleibt bis die Rhinyle abgenommen wurde. Ansonsten kommt es aufgrund des entstandenen Unterdrucks zum Rücksaugen der Lösung in die Flasche.
4. Ein Ende der Rhinyle ca. 2 cm in die Nase einführen und das andere in den Mund nehmen. Kurz den Atem anhalten und den Kopf nach hinten neigen. Mittels eines kurzen, kräftigen Luftstosses durch die Rhinyle wird die Lösung auf die Nasenschleimhaut gebracht.
5. Um die Flasche zu verschliessen, wird der geriffelte Spitzenverschluss umgekehrt aufgesetzt. Die Rhinyle wird mit Wasser gründlich ausgewaschen und anschliessend ausgeschüttelt, bis kein Wasser mehr darin enthalten ist. Danach ist die Rhinyle für die nächste Anwendung bereit.
Gebrauchsanweisung zur korrekten Anwendung von Minirin Nasalspray:
1.Schutzkappe entfernen.
2.Die Sprayflasche aufrecht halten. Vor dem erstmaligen Gebrauch oder wenn die Sprayflasche 1 Woche und länger nicht benutzt wurde: Pumpventil drücken (ca. 4x), bis die Pumpe einen gleichmässigen Sprühnebel abgibt. Darauf achten, dass das Ende des Schläuchleins in der Sprayflasche immer in Flüssigkeit eingetaucht bleibt.
3.Den Kopf leicht nach hinten neigen und die Sprühdüse an ein Nasenloch führen (Sprühdüse nicht zu tief in die Nase einführen). Die Atmung anhalten und das Pumpventil einmal drücken.
4.Beträgt die verschriebene Dosis 2 Sprühstösse, ist der Vorgang beim zweiten Nasenloch gemäss Punkt 3 zu wiederholen. Beträgt die verschriebene Dosis mehr als 2 Sprühstösse, muss ca. 5 Min. gewartet werden, bis das erste Nasenloch erneut besprüht werden kann.
5.Schutzkappe aufsetzen. Sprayflasche stehend aufbewahren.
Zulassungsnummer
38088, 43585, 48069, 49002, 57151 (Swissmedic).
Zulassungsinhaberin
Ferring AG, 6340 Baar
Stand der Information
Dezember 2013
Composition
Principe actif: Desmopressine acétate.
Excipients
Minirin solution injectable: Natrii chloridum, Acidum hydrochloridum ad pH 4, Aqua ad iniectabilia q.s. ad solutionem pro 1 ml.
Minirin gouttes nasales: Natrii chloridum, Acidum hydrochloridum, Conserv.: Chlorbutanolum hemihydricum, Aqua purificata ad 1 ml.
Minirin spray nasal: Natrii chloridum, Acidum citricum monohydricum, Dinatrii phosphas dihydricus, Conserv.: Benzalkonium chloridum 0,1 mg, Aqua purificata ad 1 ml.
Minirin comprimés: Lactosum monohydricum, Amylum solani tuberosi, Povidonum K25, Magnesii stearas.
Minirin Melt comprimés sublinguaux: Gelatinum, Mannitolum, Acidum citricum anhydricum.
Forme galénique et quantité de principe actif par unité
Minirin solution injectable: 4 µg de desmopressine acétate correspondant à 3,56 µg de desmopressine par ml.
Minirin gouttes nasales: 10 µg de desmopressine acétate correspondant à 8,9 µg de desmopressine par 0,1 ml.
Minirin spray nasal: 10 µg de desmopressine acétate correspondant à 8,9 µg de desmopressine par bouffée de 0,1 ml.
Minirin comprimés: 0,1 resp. 0,2 mg de desmopressine acétate correspondant à 89 µg resp. 178 µg de desmopressine par comprimé.
Minirin Melt comprimés sublinguaux: desmopressine 60 resp. 120 µg.
Indications/Possibilités d’emploi
Diabète insipide d'origine centrale, polyurie, polydipsie consécutive à une hypophysectomie resp. à une intervention chirurgicale sur l'hypophyse.
Énurésie nocturne dès l'âge de 5 ans en cas de capacité de concentration rénale normale, après échec des mesures habituelles en la matière, uniquement chez les patients ayant une pression artérielle normale et après exclusion d'une cause organique, pour un traitement de durée limitée. Les formes de Minirin pour l'application nasale (gouttes nasales et spray nasal) ne doivent pas être utilisées pour traiter l'énurésie nocturne.
Détermination de la capacité de concentration rénale (diagnostic du diabète insipide).
Posologie/Mode d’emploi
Diabète insipide d'origine centrale, polyurie, polydipsie consécutive à une hypophysectomie resp. à une intervention chirurgicale sur l'hypophyse
Au début du traitement, le médecin déterminera la dose optimale individuellement en fonction de la quantité d'urine et de l'osmolalité urinaire. Le traitement doit être axé sur deux paramètres: une durée de sommeil appropriée et un bilan hydrique équilibré.
Administration parentérale
Adultes: dose quotidienne 1-4 µg, correspondant à 0,25-1,0 ml en i.v. ou en i.m, répartis en 1 – 2 doses unitaires.
Enfants: dose quotidienne 0,4-1 µg, correspondant à 0,1-0,25 ml en i.v.. ou en i.m., répartis en 1 –2 doses unitaires.
Nourrissons: ajuster prudemment la dose en commençant par 0,025 ml resp. 0,1 µg en i.v. ou i.m.
Injection intraveineuse ou intramusculaire (1-2 fois par jour): | ||||
Dose quotidienne (microgramme) | Solution injectable (ml) | Nombre d'ampoules | ||
Adultes: | 1 - 4 | 0,25 – 1,0 | ¼ - 1 | |
Enfants: | 0,4 à 1 | 0,10 – 0,25 | 1/10 – ¼ | |
Nourrissons (ajuster prudemment la dose) | en commençant par 0,1 | en commençant par 0,025 | en commençant par 1/40 | |
Tableau de dilution: Dilution dans une solution de chlorure de sodium isotonique, stérile et apyrogène: | |||
Pour l'administration de | diluer 1 ampoule dans | Quantité totale de solution | Quantité de solution injectable |
¼ ampoule | 3 ml de solut. de NaCl | 4 ml | 1 ml |
1/10 ampoule | 9 ml de solut. de NaCl | 10 ml | 1 ml |
1/40 ampoule | 39 ml de solut. de NaCl | 40 ml | 1 ml |
Administration intranasale
Adultes: dose quotidienne 10-40 µg, correspondant à 0,1-0,4 ml de gouttes nasales, resp. 1-4 bouffées de spray nasal répartis en 1-2 doses unitaires.
Enfants: dose quotidienne 5-20 µg, correspondant à 0,05-0,20 ml de gouttes nasales, resp. 1-2 bouffées de spray nasal répartis en 1-2 doses unitaires. Minirin spray nasal ne convient pas au traitement des enfants qui nécessitent une dose de 5 µg dans la mesure où des doses inférieures à 10 µg ne peuvent être administrées avec le spray nasal.
Nourrissons: Ajuster prudemment la dose en commençant avec 1 µg de gouttes nasales. Afin d'obtenir un volume d'administration adapté, les gouttes nasales doivent être diluées dans une solution de chlorure de sodium (par exemple: 0,1 ml d'une dilution 1:10 correspond à 1 µg de desmopressine). La solution diluée doit être utilisée immédiatement. La solution restante non utilisée doit être éliminée.
Administration per os
Adulte, enfant: Initialement 0,1 mg per os 3 fois par jour. La dose est ajustée en fonction de la réaction du patient individuel. La dose quotidienne moyenne est de 0,2–1,2 mg. Chez la plupart des patients, la dose optimale est de 0,1–0,2 mg 3 fois par jour.
Nourrisson: Ne doit pas être administré au nourrisson.
Administration sublinguale
Adulte, enfant: Initialement 60 µg 3 fois par jour. La dose est ajustée en fonction de la réaction du patient individuel. La dose quotidienne moyenne est de 120 µg–720 µg. Chez la plupart des patients, la dose optimale est de 60–120 µg 3 fois par jour. On gardera le comprimé sublingual 10 secondes sous la langue avant de l'avaler.
Nourrisson: Ne doit pas être administré au nourrisson.
Après intervention chirurgicale sur l'hypophyse, en cas d'insuffisance posthypophysaire
La dose sera déterminée en fonction de l'osmolalité urinaire.
Si des signes à type de rétention d'eau/d'hyponatrémie apparaissent, le traitement doit être interrompu et la dose doit être ajustée.
Énurésie nocturne
La dose thérapeutique efficace diffère individuellement et sera ajustée en fonction de la réaction du patient.
Enfant dès l'âge de 5 ans, adolescent et adulte
Administration per os: Initialement 0,2 mg. En cas de besoin, augmenter progressivement la dose à 0,4 mg.
Administration sublinguale: Initialement 120 µg. En cas de besoin, augmenter progressivement la dose à 240 µg. On gardera le comprimé sublingual 10 secondes sous la langue avant de l'avaler.
Minirin comprimés et Minirin Melt comprimés sublinguaux sont indiqués pour le traitement du diabète insipide d'origine centrale et de l'énurésie nocturne, 0,2 mg per os correspondant à 120 µg en sublingual.
Si des signes à type de rétention d'eau/d'hyponatrémie apparaissent, le traitement doit être interrompu et la dose doit être ajustée.
La durée du traitement ne devra pas dépasser plus de 3 mois. La nécessité de la poursuite du traitement doit être vérifiée par une interruption de l'administration d'au moins 1 semaine.
Détermination de la capacité de concentration rénale
La détermination de la capacité de concentration rénale lors de l'administration de Minirin chez l'enfant en bas âge de moins d'un an ne doit se faire qu'en milieu hospitalier.
Le test rapide sera effectué de préférence le matin. La quantité de liquide absorbée doit être limitée lors des 12 premières heures suivant l'administration. Les enfants âgés de moins de 5 ans et les patients souffrant de pathologies cardiaques ou d'hypertension artérielle doivent réduire l'absorption de liquide de moitié.
L'osmolalité urinaire doit être déterminée avant de commencer le test. Après l'administration de desmopressine, 2 échantillons d'urine sont prélevés (de préférence après environ 2 et 4 heures). Au cours de la première heure un prélèvement d'urine qui sera éliminée doit être effectué. L'osmolalité sera déterminée dans les deux prélèvements d'urine. Pour déterminer la capacité de concentration rénale, la valeur la plus élevée sera comparée à la valeur initiale mesurée avant le début du test ou à la valeur de référence spécifique en fonction de l'âge (adulte 800-1000 mOsm/kg). Des valeurs faibles, une absence ou une faible augmentation de l'osmolalité urinaire indiquent une diminution de la capacité de concentration rénale. Il y a présence d'une polyurie induite par un diabète insipide d'origine centrale, Iorsque l'osmolalité urinaire augmente sensiblement et que le volume urinaire diminue nettement.
Administration parentérale
Adulte: 1 ml resp. 4 µg en i.v.
Enfant et adolescent de 10 à 16 ans: 0,5 ml resp. 2 µg en i.v.
Nourrisson et enfant en bas âge: 0,25 ml resp. 1 µg en i.v.
Administration intranasale
Adulte: 40 µg (0,4 ml de gouttes nasales ou 4 bouffées de spray nasal).
Enfant et adolescent de 10 à 16 ans: 20 µg (0,2 ml de gouttes nasales ou 2 bouffées de spray nasal).
Nourrisson et enfant en bas âge: 10 µg (0,1 ml de gouttes nasales ou 1 bouffée de spray nasal).
Contre-indications
La desmopressine ne doit pas être administrée
-en présence de polydipsie primaire ou psychogène;
-en présence d'insuffisance cardiaque et d'autres pathologies qui nécessitent un traitement diurétique;
-chez les patients présentant une hyponatrémie;
-en présence d'insuffisance rénale modérée ou sévère (clairance de la créatinine inférieure à 50 ml/min);
-en présence d'un syndrome de sécrétion inappropriée d'hormone antidiurétique (SIADH);
-en présence d'un syndrome de von Willebrand-Jürgens sévèr classique (sous-type IIb), chez les patients ayant une activité du facteur VIII de 5%, en présence d'anticorps anti-facteur VIII;
-en cas d'hypersensibilité au principe actif ou à un excipient.
Mises en garde et précautions
Lors de l'administration de Minirin comprimés ou comprimés sublinguaux dans l'énurésie nocturne, on adoptera la mesure de précaution suivante: réduire l'ingestion de boissons à l'étanchement de la soif depuis 1 h avant jusqu'à 8 h après l'administration de Minirin. Un traitement entrepris sans réduction simultanée de l'apport hydrique risque d'entraîner une rétention d'eau et/ou une hyponatrémie accompagnée de symptômes à type de céphalées, de nausées, de vomissements, de prise de poids et dans des cas graves, d'œdème cérébral, de convulsions et de coma. La sécurité d'un traitement à long terme de l'énurésie nocturne n'est pas documentée.
Des cas d'œdème cérébral et de convulsions ont été rapportés à plusieurs reprises, même chez des enfants et des jeunes adultes par ailleurs en bonne santé qui ont été traités par la desmopressine pour une énurésie nocturne. Ce risque semble être particulièrement élevé lors de la première semaine de traitement.
Les patients âgés (>65 ans) et les patients ayant une faible concentration de sodium peuvent présenter un risque accru d'hyponatrémie.
La durée d'action augmente avec les doses élevées, et donc aussi le risque d'hyponatrémie. On augmentera donc progressivement les doses en partant de la plus faible.
La desmopressine doit être administrée avec une prudence particulière chez les patients présentant une fibrose kystique, une pathologie coronaire, une hypertension, une tendance aux thromboses, une néphropathie chronique, une pré-éclampsie, une augmentation de la pression intracrânienne ou des troubles de l'équilibre hydro-électrolytique.
Chez les patients hypertendus souffrant d'une néphropathie chronique, les symptômes décrits sous «Effets indésirables» risquent de se manifester plus fortement. Chez des patients très jeunes ainsi que chez des patients âgés présentant des facteurs de risque pouvant entraîner une augmentation de la pression intracrânienne, on veillera soigneusement à éviter toute rétention d'eau durant le traitement par Minirin.
Le traitement par la desmopressine peut entraîner une rétention d'eau et une hyponatrémie sans limitation simultanée de l'apport liquidien.
Les patients, et s'il s'agit d'enfants leurs parents, doivent être rendus attentifs au fait qu'un apport hydrique excessif doit être évité et que l'administration de desmopressine doit être interrompue lors de vomissements, de diarrhées, d'infections systémiques et de fièvre jusqu'à ce que le bilan hydrique se soit à nouveau normalisé.
Afin de réduire le risque d'hyponatrémie resp. d'une intoxication hydrique, une réduction de l'apport hydrique s'avère particulièrement importante dans les cas suivants:
-Administration de médicaments connus pour entraîner un SIADH (antidépresseurs tricycliques, inhibiteurs sélectifs de la recapture de la sérotonine, chlorpromazine, chlorpropamide et carbamazépine);
-Traitement concomitant par les AINS.
Il est important de surveiller le poids du patient pendant le traitement.
Chez les patients de plus de 65 ans, le sodium sérique sera déterminé avant le début du traitement ainsi que 3 jours après sa mise en route et 3 jours après toute augmentation de la dose. Lors de la survenue de céphalées et/ou de nausées, on arrêtera le traitement.
Les causes organiques d'une polyurie, d'une augmentation de la fréquence des mictions ou d'une nycturie, telles que hyperplasie bénigne de la prostate (HBP), infections urinaires, calculs vésicaux ou tumeurs vésicales, troubles du sphincter vésical, polydipsie ou un diabète sucré insuffisamment contrôlé doivent être exclues ou traitées de façon adéquate. Les insuffisances surrénales ou thyroïdiennes doivent être traitées avant de commencer le traitement par la desmopressine.
Lors de l'administration intranasale de Minirin, l'absorption risque d'être modifiée par une déformation ou un processus pathologique touchant la muqueuse nasale. Dans ces cas, la desmopressine ne doit pas être administrée. Le conservateur contenu dans Minirin spray nasal (chlorure de benzalkonium) peut provoquer des bronchospasmes et, en particulier en cas d'administration pendant une longue période, un œdème de la muqueuse nasale. En cas de suspicion d'une réaction de ce type (nez bouché en permanence), il est recommandé d'utiliser, dans la mesure du possible, un médicament pour administration par voie nasale ne contenant pas de conservateur. S'il n'existe pas de tels médicaments, une autre forme galénique doit être envisagée.
Les patients présentant une intolérance héréditaire au galactose, un déficit en lactase ou une malabsorption du glucose-galactose ne doivent pas prendre Minirin comprimés.
Interactions
L'administration simultanée d'oxytocine peut renforcer l'effet antidiurétique et une diminution de l'irrigation sanguine utérine est à craindre. Le glibenclamide et le lithium peuvent affaiblir l'effet antidiurétique de Minirin.
Le clofibrate, l'indométacine et autres AINS, la chlorpromazine, la carbamazépine, les antidépresseurs, les inhibiteurs sélectifs de la recapture de la sérotonine ainsi que tous les médicaments agissant sur le bilan hydro-électrolytique peuvent renforcer l'effet antidiurétique de Minirin et augmenter ainsi le risque de rétention d'eau/d'hyponatrémie. Il faut surveiller la tension artérielle, la natrémie et le bilan urinaire lors de l'administration simultanée des médicaments mentionnés ci-dessus.
Le traitement concomitant par le lopéramide peut entraîner une augmentation d'un facteur allant jusqu'à 3 de la concentration de desmopressine, qui à son tour, peut entraîner un risque accru de rétention d'eau/d'hyponatrémie.
Il est improbable que la desmopressine ait des interactions avec des substances qui altèrent le métabolisme hépatique, dans la mesure où des études in-vitro réalisées sur des microsomes humains n'ont pas mis en évidence de métabolisme hépatique significatif de la desmopressine. Des études in-vivo portant sur les interactions potentielles de la desmopressine n'ont jusqu'ici pas été réalisées.
Un régime alimentaire standardisé comprenant 27% de lipides diminue de façon significative l'absorption (quantité et durée) de la desmopressine administrée par voie orale. Concernant les propriétés pharmacodynamiques (production d'urine ou osmolalité) aucun effet significatif n'a été observé, la desmopressine peut donc, si on le souhaite, être prise au cours des repas. L'absorption de nourriture peut cependant, en cas d'administration de faibles doses orales de desmopressine, diminuer l'intensité et la durée de l'effet antidiurétique.
Grossesse/Allaitement
Les données disponibles concernant un nombre limité (n = 53) de femmes enceintes présentant un diabète insipide montrent que la desmopressine n'a aucune conséquence négative sur la grossesse, sur l'état de santé du fœtus ou du nouveau-né. On ne dispose, à ce jour, d'aucune autre donnée épidémiologique pertinente. Les expérimentations animales n'ont pas mis en évidence d'effets délétères directs ou indirects de Nimirin sur la gestation, le développement embryonnaire/fœtal, l'accouchement ou le développement postnatal.
La prudence est de rigueur lors de l'administration pendant la grossesse.
Dans le traitement du diabète insipide lors de la grossesse, la dose doit être ajustée en fonction des besoins individuels de chaque patiente, ceux-ci pouvant se modifier durant la grossesse. Il est recommandé de surveiller la tension artérielle.
Des examens effectués sur le lait maternel de femmes à qui on a administré des doses élevées de 300 µg de desmopressine (par voie intranasale) ont mis en évidence que les quantités de desmopressine qui sont susceptibles d'être transmises à l'enfant étaient trop faibles pour altérer la diurèse.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude n'a été réalisée dans ce domaine.
Effets indésirables
Les effets indésirables sont répertoriés par classes d'organes et par fréquence d'apparition selon les définitions suivantes: très fréquents (≥1/10); fréquents (≥1/100, <1/10); occasionnels (≥1/1'000, <1/100); rares (≥1/10'000, <1/1'000); très rares (<1/10'000).
Troubles du système immunitaire
Très rares: réactions allergiques et réactions d'hypersensibilité (p.ex. prurit, exanthème, fièvre, bronchospasme, anaphylaxie).
Troubles métaboliques
Très rares: hyponatrémie, intoxication hydrique.
Troubles psychiatriques
Très rares: troubles émotionnels (chez les enfants).
Troubles du système nerveux
Fréquents: céphalées.
Rares: œdème cérébral, crampes causées par l'hyponatrémie.
Troubles respiratoires, thoraciques et médiastinaux
Fréquents: (gouttes nasales, spray nasal) congestion nasale, épistaxis, rhinite.
Troubles gastro-intestinaux
Fréquents: douleurs abdominales, crampes, nausées, diarrhées, vomissements.
Troubles vasculaires
Fréquents: baisse transitoire de la tension artérielle, élévation de la fréquence du pouls, flushs.
Inconnus: complications d'ordre thrombotique (touchant les artères cérébrales et coronaires).
Troubles généraux et réactions au site d'application
Fréquents: asthénie.
En cas d'apport liquidien excessif ainsi que lors de l'administration de doses trop élevées, la rétention d'eau qui s'ensuit peut entraîner une prise de poids, une hyponatrémie, des convulsions, des œdèmes cérébraux et un coma. Ceci est particulièrement valable pour les enfants de moins d'un an ou chez les patients âgés, en fonction de leur état général de santé. On évitera une intoxication hydrique en veillant à instaurer un bilan hydrique équilibré.
En raison d'une réabsorption accrue d'eau, la pression artérielle peut augmenter et dans certains cas, une hypertonie peut se développer. Chez les patients présentant une pathologie coronarienne, une angine de poitrine peut survenir.
Surdosage
Un surdosage aigu de Minirin renforce les effets indésirables précités. Un surdosage peut survenir en particulier en cas d'ajustement sans précautions de la dose dans le traitement des enfants en bas âge.
Le surdosage accroît le risque de rétention hydrique et d'hyponatrémie. Bien que le traitement de l'hyponatrémie doive s'inspirer des données individuelles du patient, les mesures générales suivantes peuvent être recommandées:
Dans l'hyponatrémie asymptomatique, on arrêtera le traitement par la desmopressine et on réduira l'apport liquidien. Dans l'hyponatrémie symptomatique, on pourra en outre procéder à la perfusion d'une solution iso- ou hypertonique de chlorure de sodium. En cas d'œdème cérébral, l'admission immédiate du patient dans un service de soins intensifs est nécessaire. Des convulsions chez l'enfant nécessitent également des soins intensifs.
Propriétés/Effets
Code ATC: H01BA02
Le mode d'action pharmacologique de Minirin est identique quelles que soient ses voies d'administration et ses formes galéniques.
La desmopressine est un analogue de l'arginine vasopressine, hormone posthypophysaire humaine à laquelle on a soustrait un groupe amine de la cystéine (en position 1 du peptide) en remplaçant la L-arginine (en position 8) par la D-arginine. Cette restructuration a permis d'obtenir une durée d'action antidiurétique sensiblement plus longue que celle de la L-arginine vasopressine naturelle tandis que l'effet vasopresseur est fortement réduit à dose thérapeutique.
Après administration i.v. ou s.c. d'1 µg de desmopressine, l'effet antidiurétique dure entre 5 et 20 h, après administration intranasale de 20 µg 8 à 12 h, après administration per os de 0,1 mg env. 8 h.
À doses élevées, la desmopressine a la propriété d'activer aussi bien le facteur antihémophilique (facteur VIII) que le facteur von Willebrand.
Pharmacocinétique
Absorption
La biodisponibilité systémique de la desmopressine en i.v. est pratiquement totale; elle atteint env. 90% de cette valeur lorsque la desmopressine est administrée en s.c. Le tmax est de moins de 20 min en i.v. et environ d'une heure en s.c.
Minirin administré par voie intranasale et orale est résorbé rapidement mais incomplètement; sa biodisponibilité en administration intranasale est d'environ 3–5% par rapport à la voie i.v. Après la prise intranasale de desmopressine, la concentration plasmatique maximale est atteinte au bout d'env. 50 min.
La demi-vie plasmatique se situe entre 2 et 3 heures.
La biodisponibilité absolue de la desmopressine administrée per os est de 0,08 à 0,16%.La concentration plasmatique maximale moyenne est atteinte au bout d'environ 2 h.
Aux doses de 200, 400 et 800 µg, la biodisponibilité systémique moyenne de la desmopressine administrée par voie sublinguale, tel Minirin Melt, est de 0,25% (intervalle de confiance à 95% de 0,21 à 0,31%). Cmax était de 14, 30 resp. 65 pg/ml après administration de 200, 400 resp. 800 µg. Le tmax a été enregistré env. 0,5 à 2,0 h après prise de la dose. La demi-vie d'élimination géométrique moyenne est de 2,8 (CV = 24%) h.
La desmopressine est caractérisée par une variabilité élevée de la biodisponibilité inter- et intraindividuelle.
Distribution
Le volume de distribution est de 0,2 à 0,3 l/kg. La desmopressine ne passe pas la barrière hémato-encéphalique; elle pénètre en quantités minimes dans le lait maternel.
Métabolisme
On a pu montrer in vitro sur des microsomes hépatiques humains que seule une très faible partie de la desmopressine est métabolisée dans le foie. On peut en déduire que le métabolisme hépatique de la desmopressine a peu d'importance in vivo.
Élimination
L'élimination de la desmopressine se fait selon une cinétique d'ordre 1; toutefois elle est un peu plus lente que celle de la vasopressine native. La demi-vie plasmatique de la desmopressine administrée par voie parentérale et intranasale est de 2,5 à 4,5 h, per os entre 2,0 et 3,2 h. Env. 65% de la desmopressine résorbée après une prise orale (45% après une injection i.v.) sont éliminés dans les 24 h par les urines.
Cinétique pour certains groupes de patients
Il n'y a pas de différence de sexe dans le comportement pharmacocinétique de la desmopressine.
Données précliniques
Les études portant sur la toxicité chronique n'ont pas livré d'informations indiquant que des effets indésirables inconnus jusqu'ici puissent apparaître chez l'homme.
Aucun indice en faveur d'un effet mutagène de la desmopressine n'a été observé dans le test d'Ames. Des études à long terme portant sur le potentiel carcinogène n'ont pas été réalisées.
Des études portant sur l'embryotoxicité menées chez le lapin avec l'administration par voie sous-cutanée d'une dose maximale de 10 µg/kg de desmopressine du jour 6 au jour 18 post-conception ont mis en évidence une perte plus importante post-implantation de 10,6% dans le groupe recevant une dose plus élevée par rapport au groupe témoin (1,2%) et un nombre plus faible de fœtus vivants. Aucun effet tératogène n'a été observé.
Remarques particulières
Conservation
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «Exp» sur l'emballage.
Minirin gouttes nasales: Après ouverture de l'emballage les gouttes nasales peuvent être conservées pendant 2 mois à une température comprise entre 2 °C et 8 °C. En cas d'administration chez le nourrisson, Minirin gouttes nasales doit être immédiatement utilisé après dilution. La solution diluée restante non utilisée doit être éliminée.
Minirin spray nasal: Après ouverture de l'emballage le spray nasal peut être conservé pendant 2 mois à une température ne dépassant pas 25 °C.
Minirin solution injectable: la solution injectable ne contient pas de conservateur. Pour des raisons microbiologiques la solution injectable prête à l'emploi doit être utilisée immédiatement après l'ouverture de l'emballage. La solution injectable restante non utilisée doit être éliminée.
Remarques concernant le stockage
À conserver hors de la portée des enfants.
Minirin solution injectable: à conserver au réfrigérateur (2–8 °C) dans l'emballage original à l'abri de la lumière. Ne pas congeler.
Minirin gouttes nasales: à conserver au réfrigérateur (2–8 °C) dans l'emballage original à l'abri de la lumière. Ne pas congeler.
Minirin spray nasal: à conserver à température ambiante (15–25 °C) dans l'emballage original à l'abri de la lumière. Ne pas congeler.
Minirin comprimés: ne pas conserver au-dessus de 25 °C dans l'emballage original à l'abri de la lumière et de l'humidité.
Minirin Melt comprimés sublinguaux: à conserver à température ambiante (15–25 °C) dans l'emballage original à l'abri de la lumière et de l'humidité.
Remarques concernant la manipulation
Minirin solution injectable:
Le volume contenu dans une ampoule permet le prélèvement et l'administration d'une dose maximale de 1,0 ml (4 µg) de solution injectable.
Minirin Melt comprimés sublinguaux:
Instructions pour l'ouverture du blister:
1.Ouvrir la bande de blister à l'extrémité marquée.
2.Détacher le premier blister le long de la ligne perforée.
Chaque blister a un coin non scellé marqué d'une flèche et pourvu d'une petite gaine protectrice triangulaire. Retirer cette gaine, soulever la coque du blister et l'enlever. On peut maintenant retirer le comprimé.
3.Pour sortir les autres comprimés de l'emballage, procéder comme indiqué sous 2.
4.Au cas où la coque du blister venait à se déchirer, on utilisera des ciseaux pour couper les bords le long de la ligne perforée.
Si un comprimé venait à se casser en deux ou trois, on ingérera les fragments. Si un comprimé venait à s'effriter en plus de 3 fragments, on les laissera dans le blister pour les éliminer par la suite.
Instructions pour l'administration correcte de Mirinin gouttes nasales
1. Détacher le ruban en plastique du goulot puis enlever le capuchon brun en plastique.
2. Tourner le bouchon cannelé recouvrant la pointe du flacon et le garder pour reboucher ce dernier plus tard.
3. Tenir d'une main l'extrémité marquée d'une flèche de la canule nasale (Rhinyle®) et entre les doigts de l'autre main la partie cylindrique du bouchon du flacon compte-gouttes. Appliquer ensuite la pointe du flacon compte-gouttes sur l'extrémité marquée de la canule et presser doucement sur le bouchon en plastique jusqu'à ce que la solution atteigne la graduation désirée.
Lors du prélèvement d'une dose unitaire, il faut veiller à maintenir la pression sur le bouchon jusqu'au terme du retrait de la canule de la partie cylindrique du bouchon du flacon. Sans quoi la solution reflue dans le flacon en raison de la dépression créée dans celui-ci.
4. Introduire une extrémité de la canule environ 2 cm dans le nez et prendre l'autre dans la bouche, puis pencher la tête en arrière. Une expiration courte et profonde à travers la canule amène la solution à l'endroit voulu de la muqueuse nasale.
5. Pour refermer le flacon utiliser le bouchon cannelé placé à l'envers. Veiller à ce que la canule nasale soit bien rincée avec de l'eau puis secouée jusqu'à ne plus contenir d'eau. Ainsi elle est prête pour un nouvel emploi.
Instructions pour l'administration correcte de Minirin spray nasal
1.Enlever le capuchon.
2.Tenir le spray à la verticale. Avant la première utilisation ou si l'appareil n'a pas été utilisé pendant une semaine ou plus, appuyer sur la soupape de la pompe (4 fois env.) jusqu'à ce que celle-ci délivre une nébulisation homogène. Veiller à ce que l'extrémité du petit tube intérieur du flacon reste constamment immergée dans le liquide.
3.Pencher légèrement la tête en arrière et introduire l'embout du spray dans une narine (ne pas introduire l'embout trop profondément). Retenir la respiration et appuyer une fois sur la soupape de la pompe.
4.Si la posologie prescrite est de 2 nébulisations, procéder à la seconde application dans l'autre narine selon les consignes du point 3. Si la prescription est supérieure à 2 nébulisations, attendre environ 5 minutes avant d'appliquer une nouvelle nébulisation dans la première narine.
5.Replacer le capuchon. Conserver le spray en position verticale.
Numéro d’autorisation
38088, 43585, 48069, 49002, 57151 (Swissmedic).
Titulaire de l’autorisation
Ferring AG, 6340 Baar.
Mise à jour de l’information
Décembre 2013.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French










