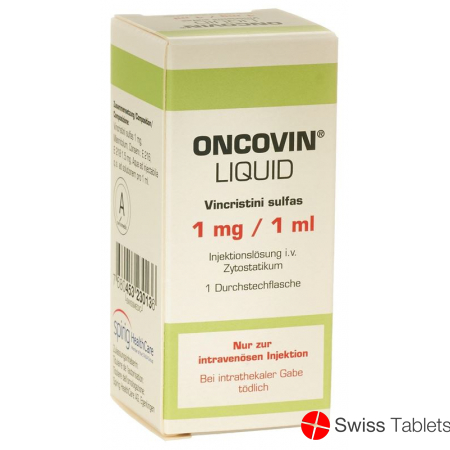
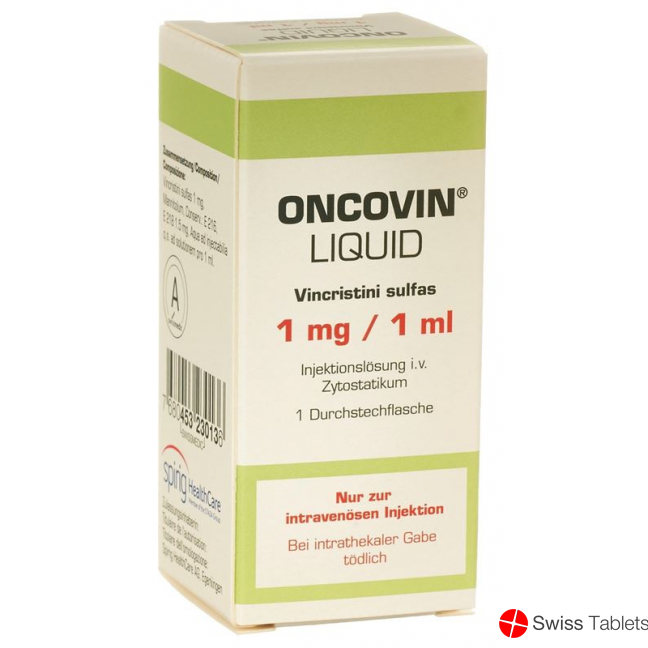
Oncovin Liquid Injektionslösung 1mg/ml i.v. Durchstechflasche 1ml buy online
Oncovin Liquid Inj Lös 1 mg/ml i.v. Durchstf 1 ml
-
67.21 CHF
- Price in reward points: 3131

- Availability: Not available
- Brand: SPIRIG HEALTHCARE AG
- Product Code: 980398
- ATC-code L01CA02
- EAN 7680453230136
Ingredients:
Vincristin, Mannitol, Methylparaben (E218) 1.3 mg, Propylparahydroxybenzoat (E216) 0.2 mg, Natrium acetat, Vincristin sulfat 1 mg , Essigsäure.

Description
Zusammensetzung
Wirkstoff: Vincristini sulfas.
Hilfsstoffe: Mannitolum, Conserv.: E 216, E 218 1,5 mg, Aqua q.s. ad solutionem pro 1 ml.
Galenische Form und Wirkstoffmenge pro Einheit
Stechampullen mit Injektionslösung zu 1 mg/1 ml.
Indikationen/Anwendungsmöglichkeiten
Akute Leukämie.
Kombinationstherapie bei M. Hodgkin, Non-Hodgkin-Lymphom, inklusive Sonderformen, Rhabdomyosarkom, Neuroblastom, Wilms Tumor, osteogenem Sarkom, Ewing Sarkom, malignem Melanom, kleinzelligem Lungenkarzinom, gynäkologischen Tumoren des Kindesalters, Mammakarzinom.
Idiopathische thrombozytopenische Purpura (Morbus Werlhof) bei Patienten, die auf eine Splenektomie und Kurzzeitbehandlung mit Corticosteroiden nicht angesprochen haben.
Dosierung/Anwendung
Die Behandlung mit Oncovin Liquid sollte nur von Ärzten durchgeführt werden, die in der Tumortherapie Erfahrung haben.
Oncovin Liquid wird als intravenöse Injektion verabreicht. Angaben zur Verabreichung siehe unter «Sonstige Hinweise/Hinweise für die Handhabung». Folgendes Dosierungsschema wird empfohlen. Für weitere Schemen, insbesondere in der Kombinationstherapie ist die Fachliteratur zu konsultieren.
Für Erwachsene beträgt die Dosis 1,0–1,4 mg/m² Körperoberfläche in wöchentlichen Abständen.
Bei einer Kombinationstherapie von Vincristin mit L-Asparaginase sollte Oncovin Liquid 12 bis 24 Stunden vor dem Enzym gegeben werden; durch diese Massnahme wird die hepatische Clearance von Vincristin nicht beeinträchtigt.
Bei einigen Patienten mit idiopathischer thrombozytischer Purpurea hat eine 3–4 wöchige Behandlung mit Oncovin Liquid in empfohlener wöchentlicher Dosierung zu Dauerremissionen geführt. Wenn sich nach 3–6 Dosen kein Ansprechen abzeichnet, ist ein Erfolg durch weitere Dosen auch nicht wahrscheinlich.
Spezielle Dosierungsanweisungen
Für Kinder und Jugendliche über 10 kg beträgt die Dosis 2 mg/m² Körperoberfläche einmal pro Woche.
Kinder, die 10 kg oder weniger wiegen, sollten 0,05 mg/kg Körpergewicht einmal pro Woche erhalten, worauf die weiteren Dosen vorsichtig erhöht werden können.
Patienten mit stark eingeschränkter Leberfunktion sollten Anfangsdosen von 0,05 bis 1 mg/m² erhalten. Für Patienten mit einem direkten Serum-Bilirubin-Wert über 3 mg/dl wird initial eine 50%ige Dosisreduktion empfohlen. Anschliessende Dosierungen können je nach Toleranz der Initialdosis hinaufgesetzt werden.
Bei Patienten mit Nierenfunktionsstörungen ist keine Dosisanpassung nötig.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe.
Oncovin Liquid soll Patienten unter Bestrahlungstherapie nicht verabreicht werden.
Charcot-Marie-Tooth-Syndrom.
Schwangerschaft und Stillzeit.
Warnhinweise und Vorsichtsmassnahmen
Dosierung und neurologische Nebenwirkungen erfordern besondere Aufmerksamkeit, wenn Oncovin Liquid an Patienten mit vorbestehender neurologischer Erkrankung verabreicht wird, und ebenso, wenn auch andere Medikamente mit neurotoxischem Potential zur Anwendung kommen.
Bei Leukopenie oder infektiösen Komplikationen ist die nächste Dosis erst nach sorgfältiger Beurteilung des Falles zu verabfolgen.
Patienten mit eingeschränkter Leberfunktion müssen mit Vorsicht behandelt werden und die Dosis ist allenfalls anzupassen (siehe «Dosierung/Anwendung»). Das gleiche gilt, wenn gleichzeitig mit der Chemotherapie bestrahlt wird und das Bestrahlungsfeld die Leber einschliesst. Gegebenenfalls sollte Oncovin Liquid vorsichtshalber so lange nicht verabreicht werden, bis die Strahlentherapie beendet ist.
Akute Kurzatmigkeit (Dyspnoe) und schwerer Bronchospasmus sind nach der Verabreichung von Vinca-Alkaloiden mitgeteilt worden. Diese Reaktionen wurden am häufigsten beobachtet, wenn das Vinca-Alkaloid in Kombination mit Mitomycin-C angewendet wurde, und können eine aggressive Behandlung erfordern, vor allem im Fall einer vorbestehenden Lungenfunktionsstörung. Diese Reaktionen können Minuten bis mehrere Stunden nach der Injektion des Vinca-Alkaloids einsetzen, auch dann, wenn das Vinca-Alkaloid bis zu 2 Wochen nach Mitomycin-C verabreicht wurde. Es kann zu einer progressiven Dyspnoe kommen, die eine chronische Behandlung erfordert. Das Vinca-Alkaloid sollte nicht wieder verabreicht werden.
Oncovin Liquid kann die Fortpflanzungsfähigkeit beeinträchtigen. Bei männlichen Patienten wurde Aspermie beobachtet, die bei Anwendung der Kombination Oncovin Liquid/Procarbazin/alkylierendes Mittel/Prednison – wenn überhaupt – meist erst nach 2 Jahren therapiefreier Remission reversibel war. Die bei einigen Patientinnen unter der genannten Kombinationsbehandlung aufgetretene Amenorrhoe war häufig reversibel.
Wenn Injektionslösung in das paravenöse Gewebe gelangt, kann es zu Nekrosen kommen. Die Injektion ist in einem solchen Fall sofort abzubrechen. Um die in das paravenöse Gewebe eingedrungene Lösung schneller zu verteilen und damit die Beschwerden und das Risiko einer Gewebsreizung zu verringern, kann Hyaluronidase lokal injiziert und mässige Wärme auf die betroffene Stelle angewendet werden.
Oncovin Liquid darf nicht intrathekal verabreicht werden, da dies zu lebensbedrohenden Lähmungen führt. Nach versehentlicher intrathekaler Gabe ist umgehend ein neurochirurgischer Eingriff erforderlich, um eine aufsteigende Lähmung mit Todesfolge zu verhindern (siehe «Sonstige Hinweise/Hinweise für die Handhabung»).
Interaktionen
Bei gleichzeitiger oraler oder intravenöser Verabreichung von Phenytoin und antineoplastischen Chemotherapie-Kombinationen, welche Vincristin einschlossen, wurde über eine Senkung der Phenytoin-Blutspiegel und eine Erhöhung der Krampfaktivität berichtet. Die Interaktion beruht möglicherweise auf einer verminderten Resorption und/oder einer verstärkten Metabolisierung und Elimination von Phenytoin. Bei der Anwendung in Kombination mit Vincristin kann eine Anpassung der Phenytoin-Dosierung auf der Basis regelmässiger Blutspiegelkontrollen notwendig sein.
Da Vincristin über CYP3A4 metabolisiert wird, ist Vorsicht geboten bei gleichzeitiger Behandlung mit Inhibitoren (z.B. Ketoconazol, Itraconazol, Erythromycin), Induktoren (z.B. Hypericum-Präparate) oder Substraten von CYP3A4.
Wenn Vincristin in Kombination mit L-Asparaginase angewendet wird, sollte Vincristin 12–24 Stunden vor der Verabreichung der L-Asparaginase gegeben werden, um die Toxizität zu minimieren. Verabreichung von L-Asparaginase vor Vincristin kann die hepatische Clearance von Vincristin reduzieren.
Schwangerschaft/Stillzeit
Vinca-Alkaloide dürfen während der Schwangerschaft nicht angewendet werden, da diese im Tierversuch teratogene und embryoletale Wirkungen zeigen. Frauen im gebärfähigen Alter müssen vor Beginn und während der Behandlung mit Oncovin Liquid eine sichere Kontrazeption durchführen. Tritt während der Behandlung mit Oncovin Liquid dennoch eine Schwangerschaft ein, so ist die Möglichkeit einer genetischen Beratung zu nutzen. Vincristin ist genotoxisch, daher wird auch bei Kinderwunsch nach einer Therapie eine genetische Beratung empfohlen.
Es ist nicht bekannt, ob Vincristin in die Muttermilch übergeht. Daher soll Oncovin Liquid während der Stillzeit nicht verabreicht werden oder es soll abgestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Die Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen wurde nicht untersucht.
Unerwünschte Wirkungen
Die unerwünschten Wirkungen sind im Allgemeinen reversibel und dosisabhängig. Am häufigsten wird Alopezie beobachtet, am unangenehmsten sind die neuromuskulären Störungen.
Bei Einhaltung des empfohlenen Dosierungsschemas von einer Dosis pro Woche sind im allgemeinen Nebenwirkungen wie Leukopenie, neuritische Schmerzen, Obstipation und Gehbehinderung nur kurzdauernd (weniger als 7–10 Tage).
Manche Erscheinungen, wie Haarausfall, Parästhesien, schleppender Gang, Verlust der tiefen Sehnenreflexe und Muskelschwund, bleiben häufig während der Behandlungszeit bestehen und verschwinden im allgemeinen innerhalb 6 Wochen nach Beendigung der Therapie. Bei einigen Patienten sind die neuromuskulären Beschwerden für längere Zeit bestehen geblieben.
Blut und Lymphsystem
Selten Leukopenie. Oncovin hat gewöhnlich keinen wesentlichen Einfluss auf Erythrozyten und Thrombozyten.
Immunsystem
Es wurde über seltene Fälle von allergischen Reaktionen wie Anaphylaxie, Hautausschlag und Oedeme berichtet, welche in zeitlichem Zusammenhang mit einer Vincristin-Behandlung und der Gabe von anderen Chemotherapeutika auftraten.
Endokrine Störungen
Sehr seltene Störung der Sekretion des antidiuretischen Hormons mit erhöhter Natriumausscheidung und erniedrigten Blutnatriumwerten. Es bestehen dabei keine Erkrankung der Nebennieren oder der Nieren, kein erniedrigter Blutdruck, keine Dehydrierung oder Azotämie und keine klinisch manifesten Ödeme. Einschränkung der Flüssigkeitsaufnahme bessert die Hyponatriämie und den renalen Natriumverlust.
Stoffwechsel- und Ernährungsstörungen
Gewichtsverlust.
Nervensystem
Die unerwünschten neuromuskulären Wirkungen treten häufig in einer bestimmten Reihenfolge auf. Zunächst kommt es zu Sensibilitätsstörungen und Parästhesien. Bei Fortsetzung der Behandlung können dann auch neuritisartige Schmerzen und später motorische Ausfälle auftreten. Eine spezifische Behandlung dieser Beschwerden ist bis jetzt nicht bekannt.
Bei einigen Patienten wurden Krämpfe, häufig verbunden mit Hochdruck verzeichnet. Bei Kindern traten in einigen Fällen komatöse Zustände auf. Ferner wurden Verlust der tiefen Sehnenreflexe, Ataxie, Spitzfuss, Parästhesien und Taubheit der Finger- und Zehenspitzen beobachtet.
Vorbestehende neurologische Beschwerden werden durch die Gabe von Oncovin Liquid oft verschlechtert.
Hirnnervenlähmungen (extraokuläre, laryngeale Muskulatur) können auch ohne motorische Ausfälle anderer Lokalisation auftreten. Schwere Schmerzen im Bereich der Mundhöhle, des Pharynx und der Glandula parotis wurden berichtet.
Kopfschmerz.
Augenleiden
Atrophie des N. opticus mit Blindheit und vorübergehender kortikaler Blindheit.
Ohr und Innenohr
Über das Auftreten von teilweiser und vollständiger Taubheit vorübergehender oder permanenter Natur wurde berichtet.
Herz und Gefässe
Hyper- und Hypotension sind vorgekommen. Chemotherapie-Kombinationen mit Oncovin Liquid waren (vor allem bei Patienten mit vorheriger mediastinaler Bestrahlung) mit koronarer Herzkrankheit und Myokardinfarkt assoziiert. Ein kausaler Zusammenhang wurde nicht nachgewiesen.
Atmungsorgane
Es wurde über schweren Bronchospasmus und über akute Atemnot nach der Verabreichung von Vinca-Alkaloiden berichtet. Diese Reaktionen wurden zumeist bei einer Kombinationsbehandlung mit Mitomycin-C beobachtet, besonders bei vorbestehender Lungenfunktionsstörung (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Gastrointestinale Störungen
Stomatitis
Obstipation und kolikartige Bauchschmerzen, die auf einer Verstopfung im oberen Kolon beruhen, können auftreten. Es können aber auch kolikartige Schmerzen bei leerem Rectum vorliegen. Die Obstipationen sprechen auf hohe Einlaufe und Abführmittel an. Eine routinemässige Obstipationsprophylaxe von Beginn der Behandlung an wird empfohlen.
Vor allem bei kleinen Kindern und älteren Menschen kann es zu einem paralytischen Ileus kommen. Der Ileus, der ein akutes Abdomen vortäuschen kann, bildet sich zurück, wenn Oncovin Liquid vorübergehend abgesetzt und eine symptomatische Behandlung angewendet wird.
Über abdominelle Krämpfe, Erbrechen und Durchfälle, sowie über Perforationen wurde berichtet. Zur Absicherung der Diagnose ist eine Röntgenaufnahme des Abdomens zweckmässig.
Leber und Galle
In seltenen Fällen ist bei Patienten, welche Vincristin als Teil einer Kombinationschemotherapie erhielten, eine Lebervenenverschlusskrankheit mitgeteilt worden. Bei alleiniger Anwendung dieses Wirkstoffs war jedoch kein Zusammenhang mit Vincristin nachweisbar.
Haut
Haarausfall, Dermatitis.
Muskelskelettsystem
Kiefer-, Knochen-, Rücken-, Gliederschmerzen und Myalgien wurden berichtet.
Nieren und Harnwege
Polyurie, Dysurie und Harnverhalten durch Blasenatonie sind vorgekommen. Unter Vincristin kann gelegentlich eine akute Harnsäurenephropathie auftreten. Folgende vorbeugende Massnahmen sind daher zu empfehlen:
Ausreichende Flüssigkeitszufuhr, Alkalisierung des Urins, Kontrolle des Harnsäurespiegels, Verabreichung von Allopurinol.
Allgemeine Störungen und Reaktionen an der Applikationsstelle
Fieber.
Nekrosen bei versehentlicher paravenöser Gabe.
Überdosierung
Die nach Anwendung von Oncovin Liquid auftretenden Nebenwirkungen sind dosisabhängig. Deshalb ist zu erwarten, dass bei einer Überschreitung der empfohlenen Dosis die Nebenwirkungen besonders stark in Erscheinung treten.
Da Oncovin Liquid kaum dialysierbar ist, ist eine Hämodialyse bei Überdosierung nicht angezeigt.
Im Falle einer Überdosierung sind folgende Massnahmen zu erwägen:
Verhütung der Nebenwirkungen, die von einer Störung in der Sekretion des antidiuretischen Hormons herrühren. Dies heisst u.a.: Einschränkung der Flüssigkeitsaufnahme und eventuell die Anwendung eines auf die Henle-Schleife und die Funktion des distalen Tubulus wirkenden Diuretikums;
Verabreichung eines Antikonvulsivums;
Anwendung von Abführmitteln, um einem Ileus vorzubeugen;
Überwachung des Herz-Kreislaufsystems;
Tägliches Blutbild, um den Transfusionsbedarf zu erkennen und das Infektionsrisiko abzuschätzen.
Da man Labortiere mit Folinsäure vor letalen Vincristin-Dosen schützen kann, erscheint es sinnvoll, Patienten, die eine Überdosis von Oncovin Liquid erhalten haben, ebenfalls mit Folinsäure zu behandeln.
Dosierungsvorschlag: 50–100 mg Folinsäure i.v. alle 3 Stunden über 48 Stunden, dann alle 6 Stunden mindestens über weitere 48 Stunden.
Nach theoretischer Berechnung aus pharmakokinetischen Daten müssten die Gewebespiegel von Vincristin mindestens 72 Stunden lang wesentlich erhöht bleiben.
Eine Behandlung mit Folinsäure entbindet nicht von der Notwendigkeit, die oben genannten, unterstützenden Massnahmen zu ergreifen.
Eigenschaften/Wirkungen
ATC-Code: L01CA02
Vincristin gehört zu den Vinca-Alkaloiden und ist ein onkolytischer Wirkstoff. Der Wirkungsmechanismus von Vincristin wird durch die Hemmung der Mikrotubuli-Bildung in der Mitosespindel erklärt, die zu einem Stillstand der Zellteilung im Metaphasestadium führt.
Pharmakokinetik
Die Pharmakokinetik von Vincristin ist triphasisch.
Distribution
Das Verteilungsvolumen von Vincristin beträgt 262 l/m². Zur Plasmaproteinbindung liegen keine Angaben vor.
Die Penetration in die Zerebrospinalflüssigkeit scheint gering zu sein.
Metabolismus
Oncovin Liquid wird grösstenteils in der Leber metabolisiert. Am Metabolismus ist CYP3A4 beteiligt.
Elimination
Die terminale Halbwertszeit von Vincristin beträgt 85 Stunden (Bereich 19–155 Stunden). Die Elimination erfolgt zu etwa 80% mit den Faeces und zu 10–20% mit dem Urin.
Kinetik spezieller Patientengruppen
Zur Pharmakokinetik bei älteren Patienten, Kindern und Jugendlichen sowie Patienten mit Leber- und Niereninsuffizienz liegen keine Daten vor.
Präklinische Daten
Untersuchungen zu Vinca-Alkaloiden haben in akuten und chronischen Tierversuchen dosisabhängige Myelotoxizität gezeigt. Gleichzeitig kann eine Atrophie der Lymph- und Milzfollikel auftreten. Bei hohen Dosierungen kann ein Anstieg der Leberenzyme als Anzeichen einer Hepatotoxizität gewertet werden.
Zur kardiovaskulären Verträglichkeit der Vinca-Alkaloide sind aus der Literatur mit niedriger Inzidenz Ereignisse wie Angina pectoris und Myokardinfarkt bekannt.
Die Interaktion von Vincristin mit dem Spindelapparat während der Zellteilung kann zu einer Fehlverteilung der Chromosomen führen, und die Substanz kann deshalb mutagene Effekte erzeugen. Es ist davon auszugehen, dass Vincristin auch beim Menschen mutagene Wirkungen auslösen kann. Karzinogenitätsstudien liegen keine vor.
Vinca-Alkaloide haben sich im Tierversuch teratogen und embryotoxisch gezeigt.
Sonstige Hinweise
Inkompatibilitäten
Oncovin Liquid darf nur mit den unter «Hinweise für die Handhabung» aufgeführten Arzneimitteln gemischt werden.
Haltbarkeit
Oncovin Liquid darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Nach Anbruch der Stechampulle sollte die Lösung aus mikrobiologischer Sicht sofort verwendet werden; falls erforderlich kann sie maximal 24 Stunden im Kühlschrank (2–8 °C) aufbewahrt werden.
Besondere Lagerungshinweise
Oncovin Liquid muss im Kühlschrank (2–8 °C) vor Licht geschützt in der Originalpackung und ausser Reichweite von Kindern aufbewahrt werden.
Hinweise für die Handhabung
Zytostatika-Hinweis
Bei der Handhabung, Verabreichung und Entsorgung der Injektionslösung sind die Vorschriften für Zytostatika zu befolgen.
Verabreichung der Injektionslösung
Oncovin Liquid muss streng intravenös verabreicht werden; Paravasate können zu Nekrosen führen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Injektion erfolgt entweder direkt intravenös oder in den Schlauch einer laufenden intravenösen Infusion (Natriumchlorid 0,9%, Glucose 5% oder Ringer's Lactatlösung) und sollte in etwa einer Minute abgeschlossen sein.
Oncovin Liquid darf nicht intrathekal verabreicht werden, da dies zu lebensbedrohlichen Lähmungen führt. Nach versehentlicher intrathekaler Gabe ist umgehend ein neurochirurgischer Eingriff erforderlich, um eine aufsteigende Lähmung mit Todesfolge zu verhindern.
Bei einer sehr kleinen Anzahl Patienten wurden eine lebensbedrohliche Lähmung und anschliessender Tod verhindert. Es kam allerdings zu schwerwiegenden neurologischen Folgeerscheinungen und nur begrenzter späterer Erholung.
Aufgrund der veröffentlichten Behandlung dieser überlebenden Fälle sollte nach einer versehentlichen intrathekalen Gabe von Oncovin Liquid sofort mit der folgenden Behandlung begonnen werden:
1. Über einen lumbalen Zugang so viel Rückenmarksflüssigkeit wie risikolos möglich entfernen.
2. Einbringen eines Epiduralketheters in den Subarachnoidalraum über den Intervertebralraum oberhalb des initialen lumbalen Zugangs und Spülung der Cerebrospinalflüssigkeit mit Ringer-Laktat-Lösung. Frischplasma (Fresh frozen plasma) sollte angefordert werden. Sobald es zur Verfügung steht, sollte die Ringer-Laktat-Lösung mit 25 ml Frischplasma (Fresh frozen plasma) pro Liter versetzt werden.
3. Einbringen eines intraventrikulären Drains oder Katheters durch einen Neurochirurgen und Fortsetzung der Spülung der Cerebrospinalflüssigkeit, wobei Flüssigkeit durch den lumbalen Zugang entfernt wird, der mit einem geschlossenen Drainage-System verbunden ist. Ringer-Laktat-Lösung wird kontinuierlich infundiert, 150 ml/Stunde bzw. 75 ml/Stunde, nachdem Frischplasma hinzugefügt wurde.
Die Geschwindigkeit der Infusion sollte so angepasst werden, dass die Protein-Konzentration in der Cerebrospinalflüssigkeit 150 mg/dl beträgt.
Folgende Massnahmen wurden zusätzlich angewandt, ohne dass ihr Nutzen unmittelbar bewiesen ist:
Eine Infusion von 10 g Glutaminsäure über 24 Stunden, gefolgt von einer täglichen oralen Gabe von 3× 500 mg Glutaminsäure für die Dauer von 1 Monat.
100 mg Folinsäure als Bolus-Injektion, gefolgt von einer 24stündigen Infusion von 25 mg Folinsäure/Stunde, anschliessend 4× 25 mg Folinsäure i.v./Tag für eine Woche.
50 mg Pyridoxin wurden alle 8 Stunden über 30 Minuten intravenös infundiert.
Welche Rolle diese Substanzen bei der Verminderung der Neurotoxizität spielten, ist unklar.
Zulassungsnummer
45323 (Swissmedic).
Zulassungsinhaberin
Spirig HealthCare AG, Egerkingen.
Stand der Information
Juli 2019.
Composition
Principe actif: Sulfate de vincristine.
Excipients: Mannitol, conservateurs: E 216, E 218 1,5 mg, eau pour préparations injectables q.s.p 1 ml.
Forme galénique et quantité de principe actif par unité
Flacons perforables de solution injectable à 1 mg/1 ml.
Indications/Possibilités d’emploi
Leucémie aiguë
Traitement en association: maladie de Hodgkin, lymphome non-hodgkinien, y compris les formes particulières, rhabdomyosarcome, neuroblastome, tumeur de Wilms, ostéosarcome, sarcome d'Ewing, mélanome malin, cancer du poumon à petites cellules, tumeurs gynécologiques de l'enfant, cancer du sein.
Purpura thrombopénique idiopathique (maladie de Werlhof), chez les patients qui n'ont pas répondu à une splénectomie et à une corticothérapie de courte durée.
Posologie/Mode d’emploi
Oncovin Liquide doit exclusivement être utilisé par des médecins connaissant bien les traitements anti-tumoraux.
Oncovin Liquide est administré en injection intraveineuse. Pour plus de précisions sur les modalités d'administration, voir «Remarques particulières/Remarques concernant la manipulation». Nous indiquons ci-dessous le schéma recommandé. Pour les autres schémas, en particulier en traitement en association, consulter la littérature.
Chez l'adulte, la dose est de 1,0–1,4 mg/m² de surface corporelle, à des intervalles d'une semaine.
Quand la vincristine est associée à la L-asparaginase, il faut administrer Oncovin Liquide 12 à 24 heures avant l'enzyme, afin d'éviter une perturbation de la clairance hépatique de la vincristine.
Chez certains patients souffrant de purpura thrombocytaire idiopathique, un traitement de 3–4 semaines par Oncovin Liquide à la posologie hebdomadaire recommandée a permis d'obtenir des rémissions prolongées. Si 3 à 6 doses restent inefficaces, il est également peu probable que des doses supplémentaires soient efficaces.
Posologies particulières
Pour les enfants et adolescents de plus de 10 kg, la dose est de 2 mg/m² de surface corporelle une fois par semaine.
Les enfants pesant 10 kg ou moins doivent recevoir 0,05 mg/kg une fois par semaine; ensuite, on peut augmenter prudemment les doses.
En cas de perturbation grave de la fonction hépatique, il faut utiliser des doses initiales de 0,05 à 1 mg/m². Quand le taux sérique de bilirubine directe dépasse 3 mg/dl, il est recommandé de réduire la dose initiale de 50%. Suivant la tolérance de la dose initiale, on peut augmenter les doses ultérieures.
Aucun ajustement de la dose n'est nécessaire en cas de perturbation de la fonction rénale.
Contre-indications
Hypersensibilité au principe actif ou à l'un des excipients.
Ne pas administrer Oncovin Liquide à des patients en cours de radiothérapie.
Syndrome de Charcot-Marie-Tooth.
Grossesse et allaitement.
Mises en garde et précautions
Il faut être particulièrement attentif à la posologie et aux effets indésirables neurologiques quand Oncovin Liquide est administré à des patients présentant une maladie neurologique préexistante, de même que chez les patients qui reçoivent en même temps d'autres médicaments potentiellement neurotoxiques.
En cas de leucopénie ou de complications infectieuses, il ne faut administrer la dose suivante qu'après une évaluation soigneuse du cas.
En cas de perturbation de la fonction hépatique, il faut utiliser le traitement avec prudence et au besoin ajuster la dose (voir «Posologie/Mode d'emploi»). Il en va de même pour les patients qui reçoivent, en même temps que la chimiothérapie, une radiothérapie qui englobe le territoire du foie. Par mesure de prudence, il faut, le cas échéant, ne pas administrer Oncovin Liquide avant la fin de la radiothérapie.
Après l'administration d'alcaloïdes de la vinca, on a signalé une dyspnée aiguë ainsi qu'un bronchospasme sévère. Ces réactions, le plus souvent observées quand l'alcaloïde de la vinca était associé à de la mitomycine C, peuvent exiger un traitement agressif, surtout en cas de perturbation préexistante de la fonction respiratoire. Elles peuvent survenir quelques minutes à plusieurs heures après l'injection de l'alcaloïde de la vinca, même quand ce dernier a été administré jusqu'à deux semaines après la mitomycine C. Il peut survenir une dyspnée progressive qui exige un traitement chronique. Il ne faut pas ré-administrer l'alcaloïde de la vinca.
Oncovin Liquide peut perturber la fertilité. Chez des patients de sexe masculin, on a observé une aspermie. En cas d'utilisation de l'association Oncovin Liquide/procarbazine/alcoylant/prednisone, ce phénomène n'a généralement été réversible – il ne l'est pas toujours – qu'après deux ans de rémission sans traitement. L'aménorrhée survenue chez quelques femmes traitées par la même association a souvent été réversible.
Si de la solution injectable passe dans le tissu paraveineux, des nécroses sont possibles. Dans un tel cas, il faut immédiatement arrêter l'injection. Pour accélérer la distribution de la solution qui a pénétré dans le tissu paraveineux et ainsi atténuer les douleurs et le risque d'irritation tissulaire, on peut injecter de la hyaluronidase localement et appliquer une chaleur modérée à l'endroit atteint.
Ne jamais administrer Oncovin Liquide par voie intrathécale, car cela provoque des paralysies potentiellement mortelles. Après une administration intrathécale accidentelle, une intervention neurochirurgicale est immédiatement nécessaire afin d'éviter une paralysie ascendante d'évolution mortelle (voir «Remarques particulières/Remarques concernant la manipulation».
Interactions
Après l'administration orale ou intraveineuse concomitante de phénytoïne et d'associations chimiothérapiques antinéoplasiques contenant de la vincristine, on a signalé une diminution des taux sanguins de phénytoïne et une augmentation de l'activité épileptique. Cette interaction repose peut-être sur une réduction de la résorption et/ou une augmentation de la transformation métabolique et de l'élimination de la phénytoïne. En cas d'utilisation concomitante de vincristine et de phénytoïne, il peut être nécessaire d'ajuster la posologie de la phénytoïne, à la lumière des contrôles réguliers des taux sanguins.
Comme la vincristine est métabolisée par l'iso-enzyme CYP3A4, la prudence est de mise lors de l'utilisation concomitante d'inhibiteurs (par exemple kétoconazole, itraconazole, érythromycine), d'inducteurs (par exemple produits contenant du millepertuis) ou de substrats de la CYP3A4.
Quand la vincristine est associée à de la L-asparaginase, il faut administrer la vincristine 12–24 heures avant la L-asparaginase afin de réduire la toxicité. L'administration de L-asparaginase avant la vincristine peut réduire la clairance hépatique de cette dernière.
Grossesse/Allaitement
Il ne faut pas utiliser les alcaloïdes de la vinca pendant la grossesse, étant donné que ces derniers font preuve d'effets tératogènes et embryolétaux chez l'animal. Les femmes en âge de procréer doivent utiliser une méthode contraceptive fiable avant le début et pendant le traitement par Oncovin Liquide. Si une grossesse survient néanmoins pendant le traitement par Oncovin Liquide, il faut consulter un généticien. Comme la vincristine est génotoxique, il est également recommandé de consulter un généticien en cas de désir d'enfant après le traitement.
Nous ignorons si la vincristine passe dans le lait maternel. Il ne faut donc pas administrer Oncovin Liquide pendant l'allaitement ou bien il faut arrêter l'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machines
L'effet sur l'aptitude à la conduite automobile et à l'utilisation de machines n'a pas été étudié.
Effets indésirables
Les effets indésirables sont généralement réversibles et dose-dépendants. Le plus fréquent est l'alopécie tandis que les troubles neuromusculaires sont les plus désagréables.
Si le schéma posologique recommandé (une dose par semaine) est bien respecté, les effets indésirables tels que leucopénie, douleurs névritiques, constipation et difficultés pour marcher ne sont généralement que de courte durée (moins de 7–10 jours).
Certains phénomènes tels qu'alopécie, paresthésies, démarche traînante, abolition des réflexes tendineux profonds et fonte musculaire, persistent souvent pendant la durée du traitement et disparaissent généralement dans les 6 semaines suivant la fin du traitement. Chez quelques patients, les troubles neuromusculaires ont persisté plus longtemps.
Effets sur le sang et le système lymphoïde
Rarement, leucopénie. En général, Oncovin n'a pas d'influence notable sur les érythrocytes et les plaquettes.
Anomalies immunitaires
On a signalé, rarement, des réactions allergiques telles qu'anaphylaxie, exanthème cutané et oedèmes survenant en relation chronologique avec un traitement par la vincristine et l'administration d'autres chimiothérapies.
Troubles endocriniens
Très rarement, sécrétion inappropriée d'hormone antidiurétique, avec augmentation de l'excrétion de sodium et diminution de la natrémie. Cette perturbation ne s'accompagne ni de maladie des surrénales ou des reins, ni de diminution de la pression artérielle, ni de déshydratation ou d'hyperazotémie, ni d'oedèmes cliniquement patents. Une restriction de l'apport liquidien permet d'améliorer l'hyponatrémie et la déperdition rénale de sodium.
Troubles métaboliques et nutritionnels
Perte de poids.
Troubles du système nerveux
Les effets indésirables neuromusculaires surviennent souvent dans un ordre précis. Il apparaît d'abord des anomalies de la sensibilité et des paresthésies. Pendant la poursuite du traitement, il peut ensuite aussi survenir des douleurs de type névritique et, plus tard, des déficits moteurs. Pour l'instant, on ne connait pas de traitement spécifique de ces troubles.
Chez quelques patients, on a signalé des crises convulsives, souvent associées à une hypertension artérielle. Chez l'enfant, quelques cas d'états comateux ont été signalés. On a également observé une abolition des réflexes tendineux profonds, une ataxie, un pied équin, des paresthésies et un engourdissement de l'extrémité des doigts et des orteils.
L'administration d'Oncovin Liquide aggrave souvent les troubles neurologiques préexistants.
Des paralysies des nerfs crâniens (musculature extra-oculaire et laryngée) peuvent survenir, même en l'absence de déficits moteurs d'autres localisations. On a signalé de vives douleurs dans la cavité buccale, le pharynx et la glande parotide.
Maux de tête.
Troubles oculaires
Atrophie du nerf optique avec cécité et cécité corticale temporaire.
Effets sur l'oreille et l'oreille interne
On a signalé la survenue d'une surdité partielle et complète, transitoire ou définitive.
Troubles cardiaques et vasculaires
On a signalé une hypertension et une hypotension. On a observé une maladie coronarienne et des infarctus du myocarde chez des patients recevant un protocole de polychimiothérapie contenant Oncovin Liquide (essentiellement chez des patients ayant précédemment reçu une radiothérapie médiastinale). Il n'a pas été établi de lien de causalité.
Troubles respiratoires
On a signalé un bronchospasme sévère et une dyspnée aiguë après l'administration d'alcaloïdes de la vinca. Le plus souvent, ces réactions sont survenues chez des patients recevant aussi de la mitomycine C, surtout en cas de perturbation préexistante de la fonction respiratoire (voir «Mises en garde et précautions»).
Troubles gastro-intestinaux
Stomatite.
Une constipation et des douleurs abdominales à type de coliques, résultant d'une obstruction dans la partie haute du côlon, sont possibles, mais on peut aussi noter des douleurs à type de colique alors que le rectum est vide. La constipation cède sous traitement par des lavements hauts et des laxatifs. Une prophylaxie systématique de la constipation est recommandée dès le début du traitement.
Un iléus paralytique est possible, surtout chez les jeunes enfants et les personnes âgées. Cet iléus, qui peut ressembler à un tableau d'abdomen aigu, régresse après la suspension temporaire du traitement par Oncovin Liquide et l'instauration d'un traitement symptomatique.
On a signalé des crampes abdominales, des vomissements et des diarrhées ainsi que des perforations. Il convient de pratiquer une radiographie de l'abdomen pour confirmer le diagnostic.
Troubles hépatiques et biliaires
Dans de rares cas, on a signalé une maladie oblitérante des veines du foie chez des patients recevant de la vincristine dans le cadre d'une chimiothérapie en association. Toutefois, en cas d'administration isolée de ce principe actif, aucun lien de causalité avec la vincristine n'était décelable.
Effets cutanés
Alopécie, dermatite.
Effets musculo-squelettiques
On a signalé des douleurs maxillaires, osseuses et dorsales, des douleurs des membres et des myalgies.
Troubles rénaux et urinaires
On a observé des cas de polyurie, dysurie et rétention urinaire par suite d'une atonie vésicale. Occasionnellement, une néphropathie urique aiguë est possible sous traitement par la vincristine. Il est donc recommandé d'appliquer les mesures préventives suivantes:
Apport liquidien suffisant, alcalinisation des urines, contrôle du taux d'acide urique, administration d'allopurinol.
Troubles généraux et réactions au site d'injection
Fièvre.
Nécroses en cas d'administration paraveineuse accidentelle.
Surdosage
Les effets indésirables d'Oncovin Liquide sont dose-dépendants. On peut donc s'attendre à ce que les doses dépassant la dose recommandée provoquent des effets indésirables particulièrement marqués.
Etant donné qu'Oncovin Liquide n'est pratiquement pas dialysable, une hémodialyse n'est pas indiquée en cas de surdosage.
En cas de surdosage, il faut envisager les mesures suivantes:
Prévention des effets indésirables résultant d'une sécrétion inappropriée d'hormone antidiurétique, c'est-à-dire, entre autres, restriction de l'apport liquidien et éventuellement utilisation d'un diurétique agissant sur l'anse de Henlé et sur la fonction du tubule distal.
Administration d'un anticonvulsivant.
Traitement à visée laxative, pour éviter un iléus.
Surveillance de l'état cardio-vasculaire.
Contrôle quotidien de la numération-formule sanguine pour identifier les besoins transfusionnels et évaluer le risque infectieux.
Chez les animaux de laboratoire, l'acide folinique peut exercer une protection contre les doses létales de vincristine; il semble donc indiqué de traiter également par l'acide folinique les patients qui ont reçu un surdosage en Oncovin Liquide.
Posologie recommandée: 50–100 mg d'acide folinique par voie intraveineuse toutes les 3 heures pendant 48 heures, puis toutes les 6 heures pendant au moins 48 heures supplémentaires.
D'après un calcul théorique fondé sur des données pharmacocinétiques, les taux tissulaires de vincristine restent fortement augmentés pendant au moins 72 heures.
Un traitement par l'acide folinique ne dispense pas pour autant des mesures de soutien décrites plus haut.
Propriétés/Effets
Code ATC: L01CA02
La vincristine est une substance anticancéreuse qui fait partie du groupe des alcaloïdes de la vinca. Son mécanisme d'action est expliqué par l'inhibition de la formation des microtubules dans le fuseau mitotique, ce qui conduit à un arrêt de la division cellulaire au stade de la métaphase.
Pharmacocinétique
La pharmacocinétique de la vincristine est triphasique.
Distribution
Le volume de distribution de la vincristine est de 262 l/m². Il n'y a pas d'informations sur le taux de liaison aux protéines plasmatiques.
La pénétration dans le liquide céphalo-rachidien semble faible.
Métabolisme
Oncovin Liquide est essentiellement métabolisé dans le foie. L'iso-enzyme CYP3A4 intervient dans son métabolisme.
Elimination
La demi-vie terminale de la vincristine est de 85 heures (entre 19 et 155 heures). L'élimination se déroule à hauteur d'environ 80% dans les selles et de 10–20% dans les urines.
Cinétique dans des populations particulières de patients
Il n'y a pas de données concernant la pharmacocinétique chez les patients âgés, les enfants et adolescents ou les patients souffrant d'insuffisance hépatique et rénale.
Données précliniques
Les expérimentations animales concernant la toxicité aiguë et chronique des alcaloïdes de la vinca ont montré une toxicité médullaire dose-dépendante. Simultanément, il peut se produire une atrophie des follicules lymphoïdes et spléniques. Les doses fortes peuvent provoquer une augmentation du taux des enzymes hépatiques, ce qui traduit une hépatotoxicité.
Pour ce qui est de la tolérance cardio-vasculaire des alcaloïdes de la vinca, la littérature mentionne de rares cas d'événements tels qu'angine de poitrine et infarctus du myocarde.
L'interaction entre la vincristine et l'appareil du fuseau pendant la division cellulaire peut conduire à une mauvaise distribution des chromosomes, si bien que la substance peut avoir des effets mutagènes. Il faut considérer que la vincristine peut aussi avoir des effets mutagènes chez l'Homme. Il n'existe pas d'études de cancérogénicité. Les expérimentations animales montrent que les alcaloïdes de la vinca sont tératogènes et embryotoxiques.
Remarques particulières
Incompatibilités
Oncovin Liquide ne doit être mélangé qu'avec les médicaments mentionnés au paragraphe «Instructions pour la manipulation».
Stabilité
Oncovin Liquide ne doit pas être employé au-delà de la date mentionnée sur l'emballage avec la mention «EXP».
Pour des raisons d'ordre microbiologique, il faut utiliser la solution dès que le flacon perforable a été entamé; au besoin, elle peut être conservée au réfrigérateur (2–8 °C) pendant 24 heures au maximum.
Remarques concernant le stockage
Conserver Oncovin Liquide au réfrigérateur (2–8 °C), à l'abri de la lumière, dans son conditionnement d'origine et hors de portée des enfants.
Remarques concernant la manipulation
Remarque concernant les cytostatiques
Lors de la manipulation de la solution injectable, de son administration et de l'élimination du matériel, il faut respecter les précautions d'usage pour les cytostatiques.
Administration de la solution injectable
Oncovin Liquide doit être utilisé en intraveineuse stricte; les injections paravasculaires peuvent provoquer des nécroses (voir «Mises en garde et précautions»).
Le produit est injecté soit directement dans une veine, soit dans la tubulure d'une perfusion intraveineuse en cours (chlorure de sodium à 0,9%, glucose à 5% ou solution de Ringer-lactate). L'injection doit durer environ une minute.
Ne jamais administrer Oncovin Liquide par voie intrathécale, car cela provoque des paralysies potentiellement mortelles. Après une administration intrathécale accidentelle, une intervention neurochirurgicale immédiate est nécessaire afin d'éviter une paralysie ascendante d'évolution mortelle.
Chez un très petit nombre de patients, les médecins ont réussi à éviter une paralysie engagent le pronostic vital et finalement mortelle. Ces patients ont néanmoins présenté de graves séquelles neurologiques et n'ont que partiellement récupéré par la suite.
A la lumière des publications concernant le traitement de ces patients qui ont survécu, il faut immédiatement entreprendre le traitement suivant en cas d'administration intrathécale accidentelle d'Oncovin Liquide:
1. Retirer par voie lombaire autant de liquide céphalorachidien qu'il est possible sans faire courir de risque au patient.
2. Introduire un cathéter épidural dans l'espace sous-arachnoïdien à travers l'espace intervertébral situé au dessus de l'endroit de la ponction lombaire initiale et rincer le liquide céphalo-rachidien avec de la solution de Ringer-lactate. Commander du plasma frais (plasma frais congelé). Dès réception de ce dernier, ajouter 25 ml de plasma frais congelé par litre à la solution de Ringer-lactate.
3. Faire insérer un drain ou un cathéter intraventriculaire par un neurochirurgien et poursuivre le rinçage du liquide céphalo-rachidien, en retirant le liquide par le cathéter lombaire relié à un système fermé de drainage. Perfuser de la solution de Ringer-lactate en continu à raison de 150 ml/heure ou de 75 ml/heure, après l'adjonction du plasma frais.
Il faut ajuster le débit de la perfusion de façon à ce que la concentration de protéines dans le liquide céphalo-rachidien soit de 150 mg/dl.
On a aussi mis en oeuvre les mesures suivantes, sans que leur effet bénéfique soit directement prouvé:
Perfusion de 10 g d'acide glutamique pendant 24 heures, suivie de l'administration orale quotidienne de 500 mg d'acide glutamique 3 fois par jour pendant un mois.
Injection en bolus de 100 mg d'acide folinique, puis perfusion de 25 mg d'acide folinique/heure pendant 24 heures et ensuite 25 mg d'acide folinique 4 fois par jour par voie intraveineuse pendant une semaine.
50 mg de pyridoxine ont été perfusés par voie intraveineuse toutes les 8 heures, sur une durée de 30 minutes.
Le rôle de ces substances dans la réduction de la neurotoxicité est inconnu.
Numéro d’autorisation
45323 (Swissmedic).
Titulaire de l’autorisation
Spirig HealthCare AG, Egerkingen.
Mise à jour de l’information
Juillet 2019.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.



 Deutsch
Deutsch French
French