Triamcort Depot Kristallsuspension 10mg Ampullen 1ml buy online
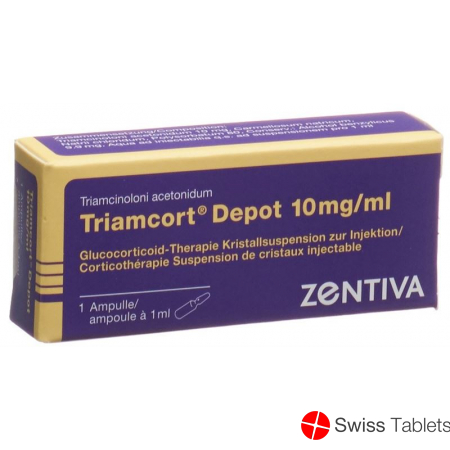
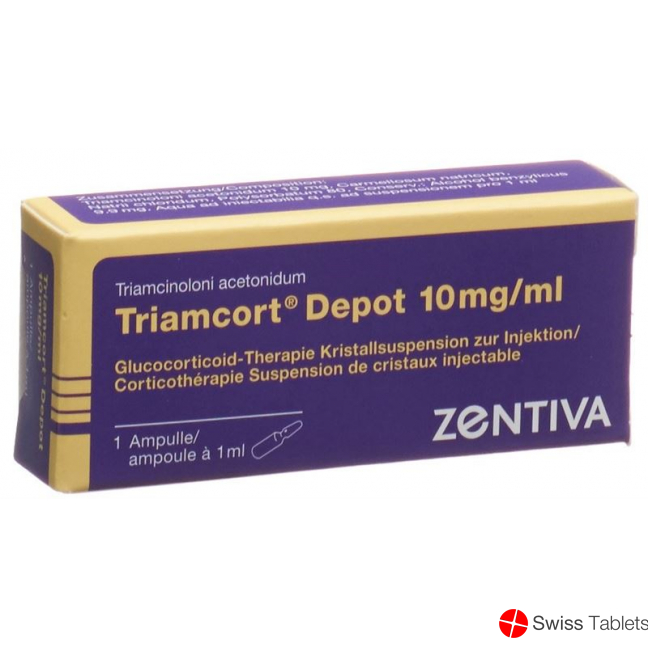
Triamcort Depot Krist Susp 10 mg/ml Amp 1 ml
-
32.25 CHF
- Price in reward points: 3131

- Availability: In stock
- Brand: HELVEPHARM AG
- Product Code: 933996
- ATC-code H02AB08
- EAN 7680411740134
Ingredients:
Benzylalkohol 9.9 mg, Natriumchlorid, Triamcinolon acetonid 10 mg , Carmellose natrium, Polysorbat 80.

Description
AMZV
Zusammensetzung
Wirkstoff: Triamcinoloni acetonidum.
Hilfsstoffe: Carmellosum natricum, Natrii chloridum, Polysorbatum 80, Conserv.: Alcohol benzylicus 9,9 mg Aqua ad iniectabilia q.s ad suspensionem pro 1 ml.
Galenische Form und Wirkstoffmenge pro Einheit
Kristallsuspension zur Injektion: Ampullen zu 10 mg/1 ml, 20 mg/1 ml, 40 mg/1 ml, 80 mg/2 ml.
Indikationen/Anwendungsmöglichkeiten
Systemische Therapie
Intramuskuläre Anwendung
Allergische Erkrankungen: Schwere bzw. invalidisierende allergische Erkrankungen, die auf eine adäquate konventionelle Therapie nicht ansprechen: Asthma, Heufieber und andere Allergien, bestimmte Dermatosen wie Kontaktdermatitiden, Pemphigus vulgaris, Psoriasis, Dermatitis herpetiformis Duhring, atopische, exfoliative, ekzematoide Dermatitis.
Rheumatische Erkrankungen: Als zusätzliche Kurzzeitbehandlung bei akuten Schüben oder Verschlimmerung von Gelenkrheumatismus und anderen Bindegewebserkrankungen.
Lokale Therapie
Intraartikuläre Anwendung
Als zusätzliche Kurzzeitbehandlung bei akuten Schüben oder Verschlimmerung von degenerativen und entzündlichen Gelenkerkrankungen (inkl. exsudativer Arthritis bei Gicht und Pseudogicht, aktiver Arthrose, Hydrops articulorum intermittens, Schulterblockade bei Kapselschrumpfung). Ausserdem als Zusatz zur Synoviorthese mit Radionukliden oder Chemikalien.
Intrafokale Anwendung (nur Triamcort Depot 10)
Als zusätzliche Kurzzeitbehandlung bei akuten Schüben oder Verschlimmerung von Bursitis, Tendinitis, Tendovaginitis, Periostitis, Fibrositis, Schulter-Arm-Syndrom (Periarthropathia humeroscapularis), Tennis-Ellenbogen (Epikondylitis), Ganglien.
Subläsionale Unterspritzung
Psoriasis (lokalisierte, entzündliche und hypertrophische Läsionen), Lichen ruber planus, Lichen simplex chronicus (Neurodermitis circumscripta), Ekzeme (chronische, lichenifizierte, psoriasiforme, nummuläre, dyshidrotische), Alopecia areata, Keloid, Lupus erythematodes chronicus discoides.
Wie bei allen Glukokortikoiden sollte die parenterale Verabreichung von Kortikoiden vom Typ Triamcort Depot Situationen vorbehalten bleiben, in deren eine orale Therapie nicht durchführbar ist. Eine Kortikosteroidtherapie ergänzt in der Regel eine Basistherapie, ersetzt diese aber nicht.
Dosierung/Anwendung
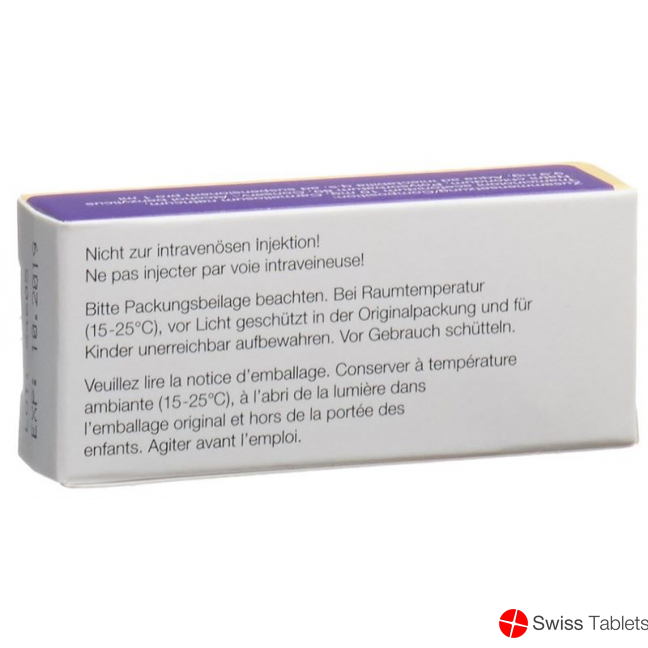
Um eine gleichmässige Suspension zu erhalten, muss die Injektionslösung vor der Anwendung gründlich geschüttelt werden. Sind Agglomerate sichtbar, so soll die Suspension nicht verwendet werden. Solche Agglomerate können durch unsachgemässe Aufbewahrung (z.B. Gefrieren) der Suspension entstehen (siehe «Sonstige Hinweise/Besondere Lagerungshinweise»).
Da es sich um eine Kristallsuspension handelt, darf Triamcort Depot nicht intravenös injiziert werden. Vorsicht auch vor unbeabsichtigten intravasalen Injektionen; das gilt speziell für das Gesicht (oberhalb des Mundes) und für die Kopfhaut, aber auch für die intraglutäale Injektion. Bei versehentlicher Injektion in das subkutane Fettgewebe besteht die Möglichkeit einer reversiblen Atrophie.
Systemische Therapie
Intramuskuläre Injektion
Die Dosierung von Kortikoiden muss stets individuell und nach dem Krankheitsbild und Ansprechen auf die Therapie vorgenommen werden.
Im Allgemeinen werden bei Erwachsenen und Jugendlichen über 16 Jahre 40 mg Triamcinolonacetonid langsam tief intraglutäal injiziert. Bei schweren Erkrankungen können Dosierungen bis zu 80 mg Triamcinolonacetonid erforderlich sein. Mit der tief intraglutäalen Anwendung kann die sonst mögliche Entstehung einer Gewebeatrophie weitestgehend vermieden werden. Nach der Injektion sollte ein steriler Tupfer 1-2 Minuten fest auf die Injektionsstelle gepresst werden, um ein Zurücklaufen der Suspension in den Stichkanal zu vermeiden.
Zur Behandlung des Heufiebers und anderer saisonaler allergischer Erkrankungen genügt im Allgemeinen pro Jahr 1 Injektion von 40 mg Triamcinolonacetonid während des Pollenflugs.
Sind mehrere Injektionen erforderlich, sollte ein Injektionsintervall von mindestens 4 Wochen eingehalten werden.
Lokale Therapie
Intraartikuläre Injektion
Bei der intraartikulären Applikation hängt die Dosierung sowohl vom Schweregrad der Erkrankung als auch von der Grösse des Gelenks ab.
Im Allgemeinen genügen bei Erwachsenen und Kindern über 12 Jahre zur Besserung der Beschwerden für:
- kleine Gelenke (z.B. Finger, Zehen) bis 10 mg Triamcinolonacetonid;
- mittelgrosse Gelenke (z.B. Schulter, Ellenbogen) 20 mg Triamcinolonacetonid;
- grosse Gelenke (z.B. Hüfte, Knie) 20-40 mg Triamcinolonacetonid.
Bei Beteiligung mehrerer Gelenke sind Gesamtmengen bis zu 80 mg möglich.
Bei wiederholter Anwendung sollte ein Injektionsintervall von mindestens 2 Wochen eingehalten werden.
Die Gelenkanatomie soll vor jeder intraartikulären Injektion untersucht werden. Zur Erreichung der vollen entzündungshemmenden Wirkung muss die Injektion in den Synovialspalt erfolgen. Die Kautelen aseptischer Injektionstechnik sind zu beachten.
Falls Aspiration von Gelenkflüssigkeit das Erreichen des Gelenkspaltes bewiesen hat und dennoch ein Behandlungsmisserfolg eintritt, führen auch wiederholte Injektionen kaum zu therapeutischen Ergebnissen.
Bei der Verwendung von Lokalanästhetika sollen die Vorsichtsmassnahmen gemäss der entsprechenden Fachinformation beachtet werden. Zur Mischung mit einem Lokalanästhetikum liegen keine Kompatibilitätsdaten vor.
Intrafokale Anwendung
Bei intrafokaler Behandlung erhalten Erwachsene und Kinder über 12 Jahre je nach Grösse und Lokalisation der zu behandelnden Stelle bis 10 mg Triamcinolonacetonid für kleinere und 10-40 mg Triamcinolonacetonid für grössere Stellen.
Triamcort Depot wird direkt vor Gebrauch mit physiologischer Kochsalzlösung verdünnt und fächerförmig in die Zone der grössten Schmerzhaftigkeit verteilt. Grössere Depots sind zu vermeiden. Triamcort Depot kann auch mit einem Lokalanästhetikum gemischt werden. Zur Mischung mit einem Lokalanästhetikum liegen keine Kompatibilitätsdaten vor.
Zur Behandlung von Ganglien wird Triamcort Depot nach einem Aspirationsversuch mit dicker Kanüle direkt in den Hohlraum der Zyste injiziert.
Bei Behandlung von Sehnen-, Sehnenscheidenentzündungen und verwandter Krankheitsbilder muss darauf geachtet werden, nicht in Sehnen zu injizieren.
Bei wiederholter Anwendung sollte ein Injektionsintervall von mindestens 2 Wochen eingehalten werden.
Subläsionale Unterspritzung dermatologischer Herde
1 ml Triamcort Depot 10 wird ganz flach zwischen Cutis und Subcutis im Sinne einer Infiltrationsanästhesie unterspritzt. Als Richtdosis wird 1 mg Triamcinolonacetonid pro cm2 Hautläsion empfohlen. Bei Behandlung mehrerer Herde in einer Sitzung soll die Tagesdosis bei Erwachsenen 30 mg nicht übersteigen. Zur Mischung mit einem Lokalanästhetikum liegen keine Kompatibilitätsdaten vor.
Bei Keloiden wird Triamcort Depot 10 unverdünnt in das Narbengewebe (nicht subkutan) injiziert.
Bei wiederholter Anwendung sollte ein Injektionsintervall von mindestens 2 Wochen eingehalten werden.
Spezielle Dosierungsanweisungen
Generell sollte im Wachstumsalter eine Anwendung nur bei strenger Indikationsstellung erfolgen.
Bei Kindern unter 12 Jahren sollte bei allen Anwendungen eine Tagesdosis von maximal 10 mg verwendet werden.
Bei Kindern sind im Allgemeinen geringere Dosen als die oben beschriebenen ausreichend, doch sollte die Dosis mehr auf die Schwere der Erkrankung als auf Alter, Körpergewicht oder Körperoberfläche abgestellt werden.
Kontraindikationen
Überempfindlichkeit gegenüber Triamcinolonacetonid oder einem andern Inhaltsstoff; intravenöse Verabreichung; systemische Mykosen.
Triamcort Depot soll bei einer über die Notfalltherapie hinausgehenden länger dauernden systemischen Anwendung nicht angewandt werden, wenn folgende Erkrankungen bestehen: psychiatrische Erkrankungen in der Anamnese, Herpes simplex und Herpes zoster, insbesondere Herpes corneae, Varizellen und frische Vakzinationskomplikationen (besonders Kinder, die unter einer Kortikoidtherapie stehen, müssen vor Ansteckung mit Varizellen und Herpes geschützt werden; siehe «Warnhinweise und Vorsichtsmassnahmen»), etwa 8 Wochen vor bis 2 Wochen nach Schutzimpfungen, Amöbeninfektionen, systemischen Mykosen, Magen-Darm-Ulcera, Poliomyelitis mit Ausnahme der bulbärencephalitischen Form, Lymphome nach BCG-Impfung, Osteoporose, Eng- und Weitwinkelglaukom.
Triamcort Depot 10 Kristallsuspension darf wegen des Gehaltes an Benzylalkohol bei Neugeborenen, insbesondere bei unreifen Frühgeborenen nicht angewendet werden. Triamcort Depot 20, 40 und 80 darf bei Kindern unter 12 Jahren nicht und bei Jugendlichen unter 16 Jahren nicht intramuskulär angewendet werden.
Triamcort Depot darf wegen des Gehaltes an Benzylalkohol nicht intrathekal oder epidural angewendet werden.
Warnhinweise und Vorsichtsmassnahmen
Mögliche Komplikationen unter einer Kortikosteroidtherapie sind von der Höhe der Dosierung und der Dauer der Therapie abhängig. Deshalb sollten für jeden Patienten hinsichtlich Dosierung und Behandlungsdauer Nutzen und Risiko individuell beurteilt werden (siehe «Dosierung/Anwendung»).
Bei Patienten, die während der Kortikosteroidtherapie zusätzlich ungewöhnlichen Belastungen ausgesetzt sind (z.B. Operation, schweres Trauma, schwere Infektion), muss die Kortikosteroiddosis erhöht werden.
Bei postmenopausalen und geriatrischen Patienten sollte wegen des erhöhten Risikos einer Osteoporose eine systemische Behandlung mit Glukokortikoiden nur bei strenger Indikationsstellung und nach sorgfältiger Nutzen-Risiko-Abwägung durchgeführt werden.
Unter gleichzeitiger Anwendung des in der Therapie von HIV-Infektionen eingesetzten Wirkstoffes Cobicistat, einem potenten CYP3A-Inhibitor und Inhibitor mehrerer Transportproteine, zusammen mit Glukokortikoiden wurde über eine vermehrte Steroid-Toxizität bis hin zu Fällen eines Cushing-Syndroms berichtet. Triamcinolon sollte daher nur nach sorgfältiger Nutzen-Risiko-Abwägung zusammen mit Cobicistat angewendet werden. In diesem Fall ist der Patient sorgfältig auf mögliche unerwünschte Steroid-Wirkungen zu überwachen. Die Wahl eines alternativen Steroids mit CYP3A-unabhängigem Metabolismus sollte in Erwägung gezogen werden.
Die Anwendung von Triamcinolon zusammen mit anderen potenten CYP3A4-Inhibitoren sollte ebenfalls unter besonderer Vorsicht erfolgen. Ggf. muss die Steroiddosis angepasst werden.
Bei Kindern erfordert eine Langzeitbehandlung mit Glukokortikoiden wegen des Risikos eines vorzeitigen Epiphysenschlusses eine besonders sorgfältige Nutzen-Risiko-Abwägung.
Kortikosteroide sollen bei folgenden Erkrankungen nur mit Vorsicht gegeben werden: Ulcusanamnese, unspezifische Colitis ulcerosa mit drohender Perforation, Abszesse oder andere eitrige Entzündungen, Divertikulitis, frische Darmanastomosen, Neigung zu thrombotischen bzw. thromboembolischen Erkrankungen, schwere Herzinsuffizienz, metastasierende Karzinome, Myasthenia gravis, Niereninsuffizienz, akute Glomerulonephritis, chronische Nephritis.
Ein bestehender Diabetes mellitus kann sich unter einer Kortikoidtherapie verschlechtern bzw. ein latenter Diabetes kann manifest werden. Daher sollte der Glukosestoffwechsel regelmässig kontrolliert werden.
Bei bestehenden Infektionskrankheiten muss die Behandlung mit Kortikoiden unter ausreichendem antibiotischen Schutz durchgeführt werden.
Patienten unter Kortikosteroidtherapie sollten nicht geimpft werden, um das Risiko neurologischer Komplikationen und eine ungenügende Impfantwort zu vermeiden.
Bei Patienten mit latenter Tuberkulose oder Tuberkulinreaktivität ist bei gesicherter Indikation für eine Therapie mit Kortikosteroiden eine engmaschige Kontrolle erforderlich, da tuberkulöse Erkrankungen unter Kortikosteroiden wieder ausbrechen können. Bei einer Langzeittherapie sollten solche Patienten eine Chemotherapie erhalten. Bei Patienten mit aktiver fulminanter Tuberkulose oder Miliartuberkulose darf Triamcort Depot nur in Kombination mit einer geeigneten tuberkulostatischen Therapie verabreicht werden.
Varizellen, die während einer systemischen Behandlung mit Kortikosteroiden auftreten, können eine schwere Verlaufsform annehmen und insbesondere bei Kindern letal enden. Sie erfordern eine sofortige Behandlung, z.B. mit Aciclovir i. v. Bei Risikopatienten ist eine Prophylaxe mit Aciclovir oder eine passive Immunprophylaxe mit Varizella-Zoster-Immunglobulin angezeigt.
Die folgenden Vorsichtsmassnahmen betreffen die parenterale Verabreichung von Kortikosteroiden
Lokale Injektionen in bereits infizierte Gelenke sind zu vermeiden.
Zur Vermeidung von Infektionen und Kontaminationen ist eine aseptische Arbeitsweise unabdingbar.
Pädiatrie
Das Wachstum von Kindern kann unter Langzeittherapie mit Kortikosteroiden verzögert werden.
Die Anwendung von Triamcort Depot 10 bei Kindern unter 12 Jahren ist nur für die Behandlung von Keloiden angezeigt.
Interaktionen
Mit Triamcort Depot Injektionssuspension wurden keine Interaktionsstudien durchgeführt. Es sollten jedoch die nachfolgend beschriebenen, für Glukokortikoide bekannten Interaktionen berücksichtigt werden.
Es wird empfohlen, ggf. auch die Fachinformation der gleichzeitig verabreichten Arzneimittel zu konsultieren.
Pharmakokinetische Interaktionen
Einfluss anderer Arzneimittel auf die Pharmakokinetik von Triamcinolonacetonid
Triamcinolon wird unter wesentlicher Beteiligung von CYP3A4 metabolisiert. Der Metabolismus kann daher durch Induktoren und Inhibitoren dieses Enzyms in relevanter Weise beeinflusst werden.
Enzyminhibitoren: Bei gleichzeitiger Gabe zusammen mit potenten oder moderaten CYP3A-Inhibitoren ist der Metabolismus von Triamcinolon reduziert, was zu vermehrten unerwünschten Wirkungen bis hin zu Symptomen eines Cushing-Syndroms führen kann. Dies gilt z.B. für Cobicistat (siehe «Warnhinweise und Vorsichtsmassnahmen»), Protease-Inhibitoren (v.a. Ritonavir), Azol-Antimykotika (Itraconazol, Voriconazol, Posaconazol, Fluconazol), Makrolid-Antibiotika (Clarithromycin, Erythromycin), Diltiazem, Isoniazid und Verapamil.
Auch Sexualhormone (z.B. Ethinylestradiol, Norethisteron) können die Clearance von Glukokortikoiden beeinflussen. Insbesondere können Östrogene die Wirkung von Kortikosteroiden verstärken. Bei therapeutischen Dosierungen dieser Hormone (z.B. in hormonalen Kontrazeptiva) ist jedoch eine klinisch relevante Inhibition von CYP-Enzymen durch Sexualhormone unwahrscheinlich.
Enzyminduktoren: Bei gleichzeitiger Gabe zusammen mit CYP3A4-Induktoren wird der Metabolismus von Triamcinolon beschleunigt, wodurch die Wirksamkeit reduziert sein kann. Dies gilt z.B. für Barbiturate, Carbamazepin, Phenytoin, Primidon und Rifampicin sowie für Präparate, welche Johanniskraut (Hypericum perforatum) enthalten. Eine Erhöhung der Triamcinolon-Dosis kann in diesen Fällen erforderlich sein.
CYP3A4-Substrate: Auch durch die gleichzeitige Gabe anderer CYP3A4-Substrate kann die hepatische Clearance von Triamcinolon beeinflusst werden.
Einfluss von Triamcinolon auf die Pharmakokinetik anderer Arzneimittel
Glukokortikoide können CYP3A4 sowohl induzieren als auch inhibieren und dadurch die Plasmakonzentrationen anderer CYP3A4-Substrate erhöhen oder erniedrigen. Beispiele hierfür sind: Aprepitant, Fosaprepitant, Ethinylestradiol, Norethisteron und Protease-Inhibitoren.
Glukokortikoide können bei längerdauernder hoher Dosierung die Elimination von Salicylaten beschleunigen und dadurch deren Wirksamkeit reduzieren. Umgekehrt kann bei Reduktion der Kortikosteroid-Dosis die Toxizität von Salicylaten verstärkt sein.
Gegenseitige Interaktionen
Bei gleichzeitiger Gabe von Triamcinolonacetonid zusammen mit Cyclosporin wird der Metabolismus gegenseitig inhibiert. Deshalb können unerwünschte Wirkungen beider Substanzen verstärkt auftreten. Insbesondere wurden vermehrt Konvulsionen beobachtet.
Pharmakodynamische Interaktionen
Acetylsalicylsäure und nichtsteroidale Entzündungshemmer (NSAID): Die ulzerogenen Wirkungen dieser Substanzen können verstärkt werden.
Immunsuppressiva: Durch den synergistischen Effekt von Immunsuppressiva (wie z.B. Methotrexat) kann eine tiefere Kortikosteroid-Dosis ausreichend sein.
Anticholinergika: Atropin und andere Anticholinergika können einen bereits gesteigerten Augeninnendruck weiter erhöhen.
Sympathomimetika: Kortikosteroide können die erwünschten und unerwünschten Wirkungen von Sympathomimetika wie Salbutamol verstärken.
Neuromuskuläre Blocker: Kortikosteroide können die Wirkung von nicht-depolarisierenden neuromuskulären Blockern (z.B. Pancuronium, Vecuronium) beeinflussen. Berichtet wurde über eine Antagonisierung der neuromuskulären Blockade sowie bei gleichzeitiger Anwendung hoher Dosen über akute Myopathien.
Cholinesterasehemmer: Bei gleichzeitiger Anwendung von Triamcinolon und Cholinesterasehemmern wie Neostigmin oder Pyridostigmin kann eine Myasthenie-Krise auftreten.
Antikoagulantien: Die Wirkung von Heparin oder oralen Antikoagulantien kann erhöht oder vermindert sein. Die Blutgerinnung ist zu kontrollieren, und ggf. ist die Antikoagulantien-Dosis anzupassen.
Herzglykoside: Die Toxizität von Digitalis-Glykosiden wird durch die gleichzeitige Gabe von Triamcinolon potenziert.
Antidiabetika: Aufgrund des diabetogenen Effekts der Glukokortikoide müssen bei Diabetikern die Glukose-Spiegel überwacht werden. Gegebenenfalls ist die Antidiabetika-Dosierung anzupassen.
Antihypertensiva: Die antihypertensive Wirkung wird durch den mineral-kortikoiden Effekt der Kortikoide teilweise reduziert, was zu erhöhten Blutdruckwerten führen kann.
Arzneimittel mit Einfluss auf den Kaliumhaushalt: Bei Verabreichung von Kortikosteroiden zusammen mit Arzneimitteln, welche die Kaliumausscheidung steigern (z.B. Furosemid, Hydrochlorothiazid, Amphotericin B, Betasympathomimetika oder Xanthin-Derivaten), besteht ein erhöhtes Risiko einer Hypokaliämie. Der Kaliumspiegel muss daher überwacht und ggf. Kalium substituiert werden.
Psychopharmaka: Die Wirkung von Anxiolytika und Antipsychotika kann vermindert werden. Gegebenenfalls ist die Dosis der ZNS-aktiven Substanz anzupassen.
Zytostatika: Die Wirksamkeit von Cyclophosphamid kann reduziert sein.
Impfstoffe: Lebendvirus-Impfstoffe, wie z.B. Poliomyelitis-, BCG-, Mumps-, Masern-, Röteln- und Pocken-Impfstoffe, können wegen der immunsupprimierenden Wirkung der Kortikosteroide verstärkt toxisch sein. Disseminierte virale Infektionen können auftreten. Bei Totvirus-Impfstoffen kann die Impfantwort reduziert sein.
Schwangerschaft/Stillzeit
Schwangerschaft: Tierstudien haben unerwünschte Effekte auf den Feten gezeigt (Teratogenität, Embryotoxizität), und es existieren keine kontrollierten Humanstudien.
Bei einer Langzeittherapie während der Schwangerschaft sind deshalb z.B. intrauterine Wachstumsstörungen nicht auszuschliessen, und bei einer Behandlung zum Ende der Schwangerschaft besteht für den Feten die Gefahr einer Nebennierenrindenatrophie. Daher sollte Triamcort Depot, wie alle Glukokortikoide, während der Schwangerschaft - besonders in den ersten drei Monaten nicht angewendet werden, es sei denn, dies ist eindeutig notwendig.
Die Patientin sollte informiert werden, bei einer vermuteten oder eingetretenen Schwangerschaft unverzüglich den Arzt zu verständigen.
Neugeborene, deren Mütter während der Schwangerschaft ein Kortikosteroid in höheren Dosen erhalten haben, sollen sorgfältig auf Zeichen einer Nebennierenrindeninsuffizienz und auf die Notwendigkeit einer ausschleichenden Substitutionstherapie überwacht werden.
Stillzeit: Da Triamcinolonacetonid in die Muttermilch übertritt und u.a. die NNR-Funktion und das Wachstum des Säuglings beeinträchtigen kann, sollte in diesen Fällen abgestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Bei einer kurzfristigen Behandlung ist das Risiko unerwünschter Wirkungen gering. Bei längerdauernder hochdosierter Therapie können die bekannten Nebenwirkungen der Glukokortikoide auftreten.
Die nachfolgend aufgeführten unerwünschten Wirkungen sind typisch für systemisch verabreichte Kortikosteroide und können demzufolge auch unter Triamcort Depot auftreten. Sie sind von Dosis und Behandlungsdauer sowie von Alter, Geschlecht und Grunderkrankung des Patienten abhängig.
Störung des Flüssigkeits- und Elektrolythaushaltes: Natrium- und Flüssigkeitsretention, Kaliumverlust, hypokaliämische Alkalose, Hypertonie, Herzinsuffizienz bei disponierten Patienten.
Muskulatur und Skelett: Steroid-Myopathie, Muskelschwund, starke Arthralgien, Osteoporose, pathologische Frakturen, Wirbelkompressionsfrakturen, aseptische Nekrose.
Gastrointestinale: Peptische Ulzera mit möglicher Blutung und Perforation, Magenblutung, Pankreatitis, Oesophagitis, Darmperforation. Erhöhung der Alanin-Transaminase (ALT, SGPT), Aspartat-Aminotransferase (AST, SGOT) und Alkalin-Phosphatasen wurden nach Kortikosteroid-Behandlungen beobachtet. Diese Veränderungen sind im Allgemeinen gering und nicht mit einem klinischen Syndrom verbunden. Sie sind nach Absetzen der Therapie reversibel.
Dermatologische: Verzögerte und/oder beeinträchtigte Wundheilung, Petechien, Ekchymosen, dünne und empfindliche Haut.
Metabolische: Negative Stickstoffbilanz infolge Eiweisskatabolismus.
Neurologische: Erhöhter intrakranieller Druck mit Papillenödem (Pseudotumor cerebri), Konvulsionen, Schwindelanfälle, Kopfschmerzen, Schlaflosigkeit, psychische Alterationen (Depressionen).
Endokrinologische: Entwicklung eines cushingoiden Zustandes, Suppression der Hypophysen-Nebennierenrinden-Achse (die bis zu einem Jahr und länger andauern kann und für den Patienten in Stress- und Belastungssituationen ein lebensbedrohliches Risiko darstellt), verminderte Kohlehydrattoleranz (Manifestation eines latenten Diabetes mellitus, erhöhter Bedarf an Insulin oder oralen Antidiabetika bei Diabetikern; siehe auch «Interaktionen»), Wachstumshemmung im Kindesalter, Menstruationsstörungen.
Ophthalmologische: Posteriore subkapsuläre Katarakt, erhöhter intraokulärer Druck, Glaukom, Exophthalmus.
Immunsystem: Maskierung von Infektionen, Aktivierung latenter Infektionen, opportunistische Infektionen, Überempfindlichkeitsreaktionen inklusive Anaphylaxie, supprimierte Reaktionen auf Hauttests.
Blut und Blutgefässe: Vaskulitis, Erhöhung des Thromboserisikos.
Die folgenden unerwünschten Wirkungen wurden nach parenteraler Kortikosteroidtherapie beobachtet: Vereinzelte Fälle von Blindheit nach intraläsionaler Applikation im Bereich des Gesichtes und des Kopfes, anaphylaktische oder Überempfindlichkeitsreaktionen, Hyper- oder Hypopigmentation, Atrophien der Haut und Unterhaut, sterile Abszesse, Aufflammen einer Gelenkentzündung nach intrasynovialer Applikation, Infektionen an der Injektionsstelle nach unsteriler Injektionstechnik.
Überdosierung
Die akute Toxizität von Glukokortikoiden ist gering, und eine akute Überdosierung bzw. Intoxikation von Triamcinolonacetonid ist bei vorschriftsmässiger Anwendung wenig wahrscheinlich. Für den Fall einer Überdosierung gibt es kein spezifisches Antidot. Gegebenenfalls ist eine symptomatische Behandlung angezeigt.
Eigenschaften/Wirkungen
ATC-Code: H02AB08
Triamcort Depot Injektionssuspension enthält Triamcinolonacetonid, ein synthetisches Glukokortikoid mit geringer mineralokortikoider Wirkung. Die Wirkung von Triamcinolonacetonid beruht wie die aller Glukokortikoide auf der über den Zellkern verlaufenden Anregung der Synthese spezifischer Proteine in der Zelle. Diese sind für die eigentlichen vielfältigen biologischen Wirkungen verantwortlich, die den physiologischen Anpassungen des Organismus an Stress-Situationen dienen. Einige therapeutisch erwünschte Effekte werden erst bei unphysiologisch hoher (pharmakologischer) Dosierung erreicht. Dazu gehören insbesondere die antiphlogistische und die immunsuppressive (antiallergische) Wirkung. Aufgrund des Wirkmechanismus tritt die volle pharmakologische Wirkung der Glukokortikoide verzögert (mehrere Stunden nach oraler oder parenteraler Verabreichung) ein, und sie hält länger an, als dies der Plasmahalbwertszeit entspricht.
Intraartikulär, intrafokal oder intradermal injiziert, kann lokal eine antiphlogistische Aktivität erreicht werden, wobei die systemische Belastung des Organismus gering bleibt. Intramuskulär appliziert wird eine antiinflammatorische, antiallergische, antiasthmatische Langzeitwirkung erzielt.
Der Kortisol-Eigenrhythmus ist nach intramuskulärer Verabreichung von 40 mg Triamcinolonacetonid während der ersten 48 Stunden völlig aufgehoben. Die Erholung der endogenen Kortisolproduktion beginnt nach 7 Tagen und ist nach 14 Tagen abgeschlossen. Die ACTH-Stimulierbarkeit ist unter Triamcinolonacetonid-Behandlung in den ersten 10 Tagen nach der Injektion deutlich supprimiert, nach 14 Tagen ist eine normale Ansprechbarkeit vorhanden.
Die relative antiphlogistische Äquivalenzdosis von Triamcinolonacetonid im Vergleich zu anderen Glukokortikoiden beträgt: 10 mg Triamcinolonacetonid = 6 mg Betamethason = 8 mg Dexamethason = 32 mg Methylprednisolon = 40 mg Prednison bzw. Prednisolon = 200 mg Cortison.
1 ml Triamcort Depot 40 alle 3-4 Wochen intraglutäal ersetzt: 5-8 mg Prednison/Prednisolon bzw. 4-6 mg Methylprednisolon täglich (per os).
Pharmakokinetik
Absorption
Nach Verabreichung von 40 mg Triamcinolonacetonid intramuskulär wird innerhalb von 4 Stunden eine maximale Plasmakonzentration von ca. 10 ng/ml erreicht (Cmax). Die Werte sinken innerhalb von 24 Stunden auf 4 ng/ml und steigen bis zum nächsten Morgen erneut auf durchschnittlich 6 ng/ml Serum an, die über 24 Stunden erhalten bleiben. Nach ca. 24 Tagen liegen die Werte bei der Bestimmungsgrenze.
Distribution
Triamcinolonacetonid liegt im Plasma zu einem wesentlichen Teil als nicht-proteingebundener und somit aktiver Wirkstoff vor. Der an Plasmaproteine gebundene Anteil kann bis zu 80% betragen.
Triamcinolonacetonid geht in die Muttermilch über, doch ist nicht bekannt, ob es die Placenta- oder die Blut-Hirn-Schranke passiert. Bei anderen Glukokortikoide ist dies der Fall.
Metabolismus
Triamcinolonacetonid wird, überwiegend in der Leber, unter wesentlicher Beteiligung des Cytochrom P450-Isoenzyms CYP3A4 zu seinen Hauptmetaboliten (6β-Hydroxytriamcinolonacetonid sowie die C21-Carbonsäuren von Triamcinolonacetonid und 6β-Hydroxytriamcinolonacetonid) metabolisiert. Diese Metaboliten sind pharmakologisch inaktiv. Eine Hydrolyse zu Triamcinolon spielt kaum eine Rolle.
Elimination
Die Ausscheidung der Metaboliten erfolgt hauptsächlich über die Fäces.
Die mittlere klinische Wirkdauer einer i.m.-Injektion von 40 mg Triamcort Depot beträgt 3 Wochen.
Kinetik spezieller Patientengruppen
Kinder und Jugendliche: Zur Pharmakokinetik von Triamcinolon in der pädiatrischen Population liegen nur limitierte Daten vor. Bei Neugeborenen ist die Triamcinolon-Clearance geringer als bei Kindern und Erwachsenen.
Ältere Patienten: Die Pharmakokinetik von Triamcinolon wurde bei Patienten ≥65 Jahre nicht spezifisch untersucht.
Eingeschränkte Nierenfunktion: Zur Pharmakokinetik von Triamcinolon bei Patienten mit eingeschränkter Nierenfunktion liegen keine Daten vor.
Eingeschränkte Leberfunktion: Bei schwerer Leberinsuffizienz ist die Metabolisierung von Glukokortikoiden verzögert, und erwünschte und unerwünschte Wirkungen von Triamcort Depot können daher verstärkt sein. Zur Pharmakokinetik von Triamcinolon bei leichter bis mässiger Leberinsuffizienz liegen keine Daten vor.
Schwangerschaft: In der Schwangerschaft ist die Eliminationshalbwertszeit von Glukokortikoiden verlängert.
Andere Situationen:
- Bei Hypoalbuminämie und Hyperbilirubinämie kann es zu unerwünscht hohen Konzentrationen an nicht proteingebundenem (d.h. pharmakologisch aktivem) Wirkstoff kommen.
- Bei Vorliegen einer Hypothyreose ist die Metabolisierung von Glukokortikoiden verzögert, und die erwünschten und unerwünschten Wirkungen von Triamcort Depot können daher verstärkt sein.
Präklinische Daten
Mutagenes und tumorerzeugendes Potenzial
Die embryotoxischen Eigenschaften von Triamcinolonacetonid wurden an zwei Nagerspezies (Ratte, Maus), am Kaninchen und an drei nicht-menschlichen Primatenspezies (Rhesus, Pavian, Kapuziner) untersucht. Bei den Nagern und beim Kaninchen traten Gaumenspalten und intrauterine Wachstumsstörungen auf, wobei teratogene Effekte, z.B. bei der Ratte durch Dosen im humantherapeutischen Bereich ausgelöst wurden. Bei den Affenspezies wurde eine Störung der Knorpelbildung des Chondrocraniums beobachtet, die zu Schädelanomalien (Enzephalozele) und Gesichtsdysmorphien führte. Zudem traten Fehlbildungen des Thymus und intrauterine Wachstumsstörungen auf.
Über die Sicherheit einer Anwendung beim Menschen liegen keine Erfahrungen vor.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht im Kühlschrank lagern, da bei Temperaturen unter dem Gefrierpunkt Agglomerate entstehen können. Bei Raumtemperatur (15–25 °C), vor Licht geschützt und für Kinderhand unerreichbar aufbewahren. Nicht einfrieren.
Zulassungsnummer
41174 (Swissmedic).
Zulassungsinhaberin
Helvepharm AG, Frauenfeld.
Stand der Information
September 2017.
OEMéd
Composition
Principe actif: Triamcinoloni acetonidum.
Excipients: Carmellosum natricum, Natrii chloridum, Polysorbatum 80, Conserv.: alcohol benzylicus 9,9 mg, Aqua ad iniectabilia q.s. ad suspensionem pro 1 ml.
Forme galénique et quantité de principe actif par unité
Suspension de cristaux injectable: ampoules à 10 mg/1 ml, 20 mg/1 ml, 40 mg/1 ml, 80 mg/2 ml.
Indications/Possibilités d’emploi
Traitement systémique
Administration intramusculaire
Affections de type allergique: affections de type allergique sévères à invalidantes, qui ne répondent pas à un traitement conventionnel adéquat: asthme, rhume des foins et autres allergies, certaines dermatoses telles que: dermatites de contact, pemphigus vulgaire, psoriasis, dermatite herpétiforme de Duhring, dermatite atopique, exfoliative, eczématiforme.
Affections rhumatismales: comme traitement à court terme supplémentaire lors de poussées aiguës ou d'aggravation de rhumatisme articulaire et d'autres pathologies du tissu conjonctif.
Traitement local
Administration intra-articulaire
Comme traitement à court terme supplémentaire lors de poussées aiguës ou d'aggravation d'affections dégénératives et inflammatoires des articulations (y compris arthrite exsudative en cas de goutte et de pseudogoutte, arthrose active, hydarthrose intermittente, blocage au niveau de l'épaule lors d'une atrophie capsulaire). En outre comme complément à une synoviorthèse par injection de radio-isotopes ou de réactifs chimiques.
Administration intrafocale (uniquement Triamcort Depot 10)
Comme traitement à court terme supplémentaire lors de poussées aiguës ou d'aggravation de bursite, de tendinite, de tendovaginite, de périostite, de fibrosite, de syndrome épaule-bras (périarthrite scapulo-humérale), de tennis-elbow (épicondylite) et d'inflammations ganglionnaires.
Infiltration sous-lésionnelle
Psoriasis (lésions localisées, enflammées et hypertrophiques), Lichen ruber planus, Lichen simplex chronicus (névrodermite circonscrite), eczéma (chronique, infecté par lichen, sous forme de psoriasis, nummulaire, dyshydrosique), alopécie en aires, chéloïdes, Lupus erythematodes chronicus discoides.
Comme pour tous les glucocorticoïdes, l'administration parentérale de corticoïdes comme Triamcort Depot sera réservée à des situations où la thérapie par voie orale est impossible. La corticothérapie complète en général un traitement de fond mais ne le remplace pas.
Posologie/Mode d’emploi
Pour obtenir une suspension homogène, la solution à injecter doit être vivement secouée avant son utilisation. Si des agglomérats sont visibles, la suspension ne devrait pas être utilisée. De tels agglomérats peuvent se former à la suite d'une conservation inadéquate (par ex. congélation) de la suspension (voir «Remarques particulières/Remarques concernant le stockage»).
Etant donné qu'il s'agit d'une suspension cristalline, Triamcort Depot ne doit pas être injecté par voie intraveineuse. La prudence est également de rigueur lors d'une injection intravasculaire non intentionnée, tout particulièrement au visage (au-dessus de la bouche) et dans le cuir chevelu, mais aussi en cas d'injection intraglutéale. La possibilité d'une atrophie réversible existe lors d'une injection par inadvertance dans le tissu adipeux sous-cutané.
Traitement systémique
Injection intramusculaire
La posologie des corticoïdes doit être déterminée au cas par cas et selon le tableau clinique et la réponse au traitement.
En général, 40 mg d'acétonide de triamcinolone sont injectés lentement et par voie intraglutéale profonde aux patients adultes et aux adolescents âgés de plus de 16 ans. Une posologie de jusqu'à 80 mg d'acétonide de triamcinolone peut être nécessaire lors d'une affection sévère. Lors de l'utilisation intraglutéale profonde, l'apparition éventuelle d'une atrophie tissulaire peut être largement évitée. Après l'injection, appliquer une compresse stérile au site d'injection et appuyer fermement pendant une à deux minutes pour éviter un reflux de la suspension dans le canal de ponction.
Pour le traitement du rhume des foins et d'autres allergies saisonnières, une injection de 40 mg d'acétonide de triamcinolone par an au moment de la pollinisation suffit généralement.
Si plusieurs injections sont nécessaires, un intervalle entre les injections d'au moins 4 semaines doit être respecté.
Traitement local
Injection intra-articulaire
Pour l'application intra-articulaire, la posologie dépend aussi bien du degré de sévérité de la pathologie que de la dimension de l'articulation.
Chez les adultes et les enfants de plus de 12 ans, il suffit généralement pour l'amélioration des symptômes:
- petites articulations (par ex. doigt, orteil) jusqu'à 10 mg d'acétonide de triamcinolone;
- articulations de taille moyenne (par ex. épaule, coude) 20 mg d'acétonide de triamcinolone;
- grandes articulations (par ex. hanche, genou) 20–40 mg d'acétonide de triamcinolone.
Lorsque plusieurs articulations sont impliquées, une quantité totale de jusqu'à 80 mg est envisageable.
Lors d'utilisations répétées, un intervalle entre les injections d'au moins 2 semaines doit être respecté.
L'anatomie de l'articulation devrait être examinée avant chaque injection intra-articulaire. Pour atteindre le plein effet anti-inflammatoire, l'injection doit avoir lieu dans la fente synoviale. Les précautions requises lors d'injection aseptique sont à observer.
Si l'aspiration de liquide articulaire a démontré que la cavité articulaire a été atteinte et que le traitement échoue malgré tout, des injections répétées ne conduisent que rarement à des résultats thérapeutiques.
Lors de l'utilisation d'anesthésiques locaux, prenez les mesures de précaution indiquées dans l'information professionnelle. Aucune donnée de compatibilité n'existe concernant un mélange avec un anesthésique local.
Administration intrafocale
Lors d'un traitement intrafocal, les adultes et les enfants de plus de 12 ans reçoivent selon la dimension et la localisation de la région à traiter jusqu'à 10 mg d'acétonide de triamcinolone pour les petites régions et 10–40 mg d'acétonide de triamcinolone pour les régions plus grandes.
Immédiatement avant l'utilisation, Triamcort Depot est dilué dans une solution saline physiologique et réparti en éventail dans la région la plus douloureuse. De grands dépôts sont à éviter. Triamcort Depot peut également être mélangé à un anesthésique local. Aucune donnée de compatibilité n'existe concernant un mélange avec un anesthésique local.
Pour le traitement d'inflammations ganglionnaires, Triamcort Depot est directement injecté, après un essai d'aspiration, à l'aide d'une grosse canule dans la cavité vide du kyste.
Veiller à ne pas injecter dans le tendon lors du traitement de tendinites, de péritendinites et de pathologies apparentées.
Lors d'utilisations répétées, un intervalle entre les injections d'au moins 2 semaines doit être respecté.
Infiltration sous-lésionnelle de plaques dermatologiques
1 ml de Triamcort Depot 10 est infiltré entre l'épiderme et le tissu sous-cutané de manière plane, comme pour une anesthésie par infiltration. La dose indicative recommandée est de 1 mg d'acétonide de triamcinolone par cm2 de lésion cutanée. Lors du traitement de plusieurs plaques en une séance, la dose journalière ne devrait pas dépasser 30 mg chez les adultes. Aucune donnée de compatibilité n'existe concernant un mélange avec un anesthésique local.
En cas de chéloïdes, Triamcort Depot 10 non dilué est injecté dans le tissu cicatriciel (pas sous forme sous-cutanée).
Lors d'utilisations répétées, un intervalle entre les injections d'au moins 2 semaines doit être respecté.
Instructions spéciales pour le dosage
De manière générale, une utilisation durant l'âge de la croissance aura lieu uniquement sur indication stricte.
Chez l'enfant de moins de 12 ans, une dose journalière de 10 mg au plus doit être utilisée dans tous les cas de figure.
Chez les enfants, des doses inférieures aux doses mentionnées ci-dessus sont généralement suffisantes; cependant, la posologie devrait s'orienter davantage à la gravité de la maladie qu'à l'âge, qu'au poids corporel ou qu'à la surface corporelle.
Contre-indications
Hypersensibilité à l'acétonide de triamcinolone ou à un autre composant; administration par voie intraveineuse; mycoses systémiques.
Triamcort Depot ne doit pas être administré par voie systémique à long terme après le traitement d'urgence lors de la présence des maladies suivantes: antécédents de troubles psychiatriques, herpès simplex et herpès zoster, en particulier de la cornée, varicelle et complications fraîches d'une vaccination (il faut en particulier protéger les enfants sous traitement par glucocorticoïdes du danger de contagion par la varicelle et l'herpès; cf. «Mises en garde et précautions»), environ 8 semaines avant jusqu'à 2 semaines après une vaccination prophylactique, infections amibiennes, mycoses systémiques, ulcère gastro-intestinal, poliomyélite à l'exception de la forme encéphalo-bulbaire, lymphome après vaccin BCG, ostéoporose, glaucome à angle fermé et à angle ouvert.
Triamcort Depot 10 suspension injectable ne doit pas être utilisé chez les nouveau-nés, en particulier chez les prématurés immatures, en raison de sa teneur en alcool benzylique. Triamcort Depot 20, 40 et 80 ne doit pas être administré aux enfants de moins de 12 ans et ne doit pas être administré par voie intramusculaire aux adolescents de moins de 16 ans.
Triamcort Depot ne doit pas être administré par voie intrathécale ou épidurale en raison de son contenu en alcool benzylique.
Mises en garde et précautions
Les complications éventuelles apparaissant lors d'un traitement par corticostéroïdes dépendent de la posologie et de la durée du traitement. C'est pourquoi le risque et le bénéfice relatifs à la posologie et à la durée du traitement de chaque patient doivent être appréciés individuellement (voir «Posologie/Mode d'emploi»).
Chez les patients qui sont exposés pendant le traitement par corticostéroïdes à des sollicitations inhabituelles supplémentaires (par ex. opération, traumatisme grave, infection sévère), la dose de corticostéroïde doit être élevée.
Chez les femmes ménopausées et les patients gériatriques, un traitement systémique par glucocorticoïdes ne doit être administré qu'en cas d'indication strictement établie et après une évaluation rigoureuse du rapport bénéfice/risque en raison du risque accru d'ostéoporose.
En cas d'administration concomitante d'une substance utilisée dans le traitement du VIH, le cobicistat, qui est un inhibiteur puissant du CYP3A et de plusieurs protéines de transport, et de glucocorticoïdes, des troubles allant d'une intoxication aux stéroïdes jusqu'au syndrome de Cushing ont été rapportés. La triamcinolone ne doit donc être utilisée avec le cobicistat qu'après évaluation rigoureuse du rapport bénéfice/risque. Dans ce cas, le patient doit être étroitement surveillé pour détecter toute réaction indésirable potentielle aux stéroïdes. Le recours à un stéroïde alternatif dont le métabolisme est indépendant du CYP3A doit être envisagé.
L'utilisation de la triamcinolone en association avec d'autres inhibiteurs puissants du CYP3A4 nécessite également une prudence toute particulière. Le cas échéant, la dose de stéroïde doit être adaptée.
Chez l'enfant, un traitement au long cours par glucocorticoïdes nécessite une évaluation particulièrement attentive du rapport bénéfice/risque en raison du risque de fermeture prématurée de la zone de croissance épiphysaire.
Les corticostéroïdes ne devraient être administrés qu'avec précaution dans les maladies suivantes: antécédents d'ulcère, colite ulcéreuse non spécifique avec perforation imminente, abcès ou autre inflammation purulente, diverticulite, anastomose intestinale récente, tendance aux maladies thrombotiques ou thrombo-emboliques, insuffisance cardiaque grave, carcinomes avec métastases, myasthénie grave, insuffisance rénale, glomérulonéphrite aiguë, néphrite chronique.
Sous corticothérapie, un diabète sucré symptomatique peut s'aggraver et un diabète latent peut se manifester. C'est pourquoi, le métabolisme du glucose doit être régulièrement contrôlé. En présence de maladies infectieuses, le traitement par corticoïdes doit être suivi sous protection antibiotique suffisante.
Les patients traités par corticostéroïdes ne devraient pas être vaccinés, afin d'éviter le risque de complications neurologiques et une réponse insuffisante à la vaccination.
Lors d'une indication impérative pour un traitement par corticostéroïdes chez les patients avec une tuberculose latente ou une réactivité à la tuberculine, des contrôles rapprochés sont nécessaires, puisque des pathologies tuberculeuses pourraient à nouveau se déclarer sous traitement par corticostéroïdes. Lors d'un traitement à long terme, ces patients devraient recevoir une chimiothérapie. Triamcort Depot ne peut être administré aux patients souffrant de tuberculose fulminante active ou de tuberculose miliaire qu'en association avec un traitement tuberculostatique approprié.
Les varicelles qui apparaissent pendant un traitement systémique par corticostéroïdes, peuvent évoluer de manière grave voire létale, en particulier chez les enfants. Elles exigent un traitement immédiat, par ex. par aciclovir i.v. Une prophylaxie par aciclovir ou une immuno-prophylaxie passive par des immunoglobulines contre Varizella Zoster est indiquée chez les patients à risque.
Les mesures de précaution suivantes concernent l'administration parentérale de corticostéroïdes
Les injections locales dans des articulations déjà infectées sont à éviter.
Des conditions de travail aseptiques sont indispensables pour éviter les infections et les contaminations.
Pédiatrie
La croissance des enfants peut être ralentie en cas de traitement à long terme par corticostéroïdes.
L'utilisation de Triamcort Depot 10 chez les enfants de moins de 12 ans est seulement indiquée dans le traitement des chéloïdes.
Interactions
Aucune étude d'interaction n'a été réalisée avec Triamcort Depot suspension injectable. Toutefois, il convient de prendre en compte les interactions connues pour les glucocorticoïdes décrites ci-après.
Il est recommandé de consulter également le cas échéant l'information professionnelle des médicaments administrés en concomitance.
Interactions pharmacocinétiques
Effet d'autres médicaments sur la pharmacocinétique de l'acétonide de triamcinolone
La triamcinolone est métabolisée principalement par la voie du CYP3A4. Son métabolisme peut donc être influencé de manière significative par des inducteurs et des inhibiteurs de cette enzyme.
Inhibiteurs enzymatiques: En cas d'administration concomitante d'inhibiteurs puissants ou modérément puissants du CYP3A, le métabolisme de la triamcinolone est réduit, ce qui peut entraîner des effets indésirables accrus, voire les symptômes d'un syndrome de Cushing. C'est le cas par exemple pour le cobicistat (voir «Mises en garde et précautions»), les inhibiteurs de protéase (surtout le ritonavir), les antifongiques azolés (itraconazole, voriconazole, posaconazole, fluconazole), les antibiotiques de types macrolides (clarithromycine, érythromycine), le diltiazem, l'isoniazide et le vérapamil.
De même, les hormones sexuelles (éthinylœstradiol, noréthistérone) peuvent influer sur la clairance des glucocorticoïdes. Les œstrogènes en particulier peuvent renforcer l'action des corticostéroïdes. À des doses thérapeutiques (par ex. dans hormonal contraceptif), une inhibition clinique significative des enzymes CYP par ces hormones sexuelles est cependant peu probable.
Inducteurs enzymatiques: En cas d'administration concomitante d'inducteurs du CYP3A4, le métabolisme de la triamcinolone est accéléré, ce qui peut réduire son efficacité. C'est le cas notamment pour les barbituriques, la carbamazépine, la phénytoïne, la primidone et la rifampicine, ainsi que pour les préparations à base de millepertuis (Hypericum perforatum). Une augmentation de la dose de triamcinolone peut être nécessaire dans ces cas.
Substrats du CYP3A4: L'administration concomitante d'autres substrats du CYP3A4 peut influer sur la clairance hépatique de la triamcinolone.
Effet de la triamcinolone sur la pharmacocinétique d'autres médicaments
Les glucocorticoïdes peuvent aussi bien être des inducteurs que des inhibiteurs du CYP3A4 et par conséquent augmenter ou abaisser les concentrations plasmatiques d'autres substrats du CYP3A4. C'est le cas notamment de l'aprépitant, du fosaprépitant, de l'éthinylestradiol, de la noréthistérone et des inhibiteurs de protéase.
Administrés plus longtemps à des doses plus élevées, les glucocorticoïdes peuvent accélérer l'élimination des salicylates et réduire ainsi leur efficacité. Inversement, une réduction de la dose de corticostéroïde peut renforcer la toxicité des salicylates.
Interactions
L'administration concomitante d'acétonide de triamcinolone et de cyclosporine entraîne une inhibition métabolique mutuelle. C'est pourquoi les effets indésirables des deux substances peuvent être renforcés. On observe en particulier une augmentation des convulsions.
Interactions pharmacodynamiques
Acide acétylsalicylique et anti-inflammatoires non stéroïdiens (AINS): L'activité ulcérogène de ces substances peut être renforcée.
Immunnosuppresseurs: En raison de l'effet synergique d'autres immunosuppresseurs (tels que le méthotrexate), une dose de corticostéroïde plus faible peut être suffisante.
Anticholinergiques: L'atropine et d'autres anticholinergiques peuvent augmenter une pression intraoculaire déjà élevée.
Sympathomimétiques: Les corticostéroïdes peuvent renforcer les effets désirables et indésirables des sympathomimétiques comme le salbutamol.
Curares: Les corticostéroïdes peuvent influencer l'effet des curares non dépolarisants (pancuronium, vécuronium). Une antagonisation du bloc neuromusculaire a été observée, ainsi que des myopathies aiguës en cas d'administration concomitante de doses élevées.
Inhibiteurs de la cholinestérase: En cas d'administration concomitante de triamcinolone et d'inhibiteurs de la cholinestérase tels que la néostigmine ou le pyridostigmine, une crise de myasthénie peut survenir.
Anticoagulants: L'action de l'héparine ou des anticoagulants oraux peut être augmentée ou réduite. La coagulation sanguine doit être contrôlée et le cas échéant la dose d'anticoagulants adaptée.
Glycosides cardiaques: La toxicité des glycosides digitaliques est potentialisée par l'administration concomitante de triamcinolone.
Antidiabétiques: En raison de l'effet diabétogène des glucocorticoïdes, les taux de glucose doivent être surveillés chez les diabétiques. Le cas échéant, la posologie des antidiabétiques doit être adaptée.
Antihypertenseurs: L'effet antihypertenseur est partiellement diminué par l'activité minéralocorticoïde des corticoïdes, ce qui peut conduire à une pression sanguine élevée.
Médicaments influant sur la kaliémie: En cas d'administration de corticoïdes en association avec des médicaments qui augmentent l'élimination du potassium (p.ex. furosémide, hydrochlorothiazide, amphotéricine B, bêtasympathomimétiques ou dérivés de la xanthine), il existe un risque accru d'hypokaliémie. La kaliémie doit donc être surveillée et le cas échéant une substitution du potassium est indiquée.
Psychotropes: L'effet des anxiolytiques et des antipsychotiques peut être diminué. Le cas échéant, la dose de la substance active sur le SNC doit être adaptée.
Cytostatiques: L'efficacité du cyclophosphamide peut être réduite.
Vaccins: Les vaccins vivants, tels que les vaccins contre la poliomyélite, le BCG, les oreillons, la rougeole, la rubéole et la variole, peuvent avoir une toxicité accrue en raison de l'effet immunodépresseur des corticostéroïdes. Des infections virales disséminées peuvent survenir. Dans le cas des vaccins inactivés, la réponse vaccinale peut être réduite.
Grossesse/Allaitement
Grossesse: Les expérimentations animales ont révélé des effets indésirables sur le fœtus (tératogénicité, embryotoxicité), et aucune étude contrôlée n'a été menée chez l'homme.
En cas de thérapie au long cours pendant la grossesse, on ne peut exclure notamment des troubles du développement intra-utérin, et en cas de traitement à la fin de la grossesse, il existe pour le fœtus un risque d'atrophie des cortico-surrénales. En conséquence, Triamcort Depot, comme tous les glucocorticoïdes, ne sera pas administré pendant la grossesse – en particulier durant le premier trimestre – sauf en cas de nécessité absolue.
La patiente sera informée de la nécessité de contacter immédiatement son médecin en cas de suspicion de grossesse ou de grossesse avérée.
Les nouveau-nés dont les mères ont reçu un corticostéroïde à forte dose pendant la grossesse devraient être examinés attentivement pour rechercher des signes d'insuffisance cortico-surrénale et pour déterminer la nécessité d'un traitement de substitution dégressif.
Allaitement: Parce que l'acétonide de triamcinolone passe dans le lait maternel et qu'il peut influencer entre autres la fonction cortico-surrénale et la croissance du nourrisson, l'allaitement devrait être suspendu dans ces cas.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n'a été effectuée.
Effets indésirables
Le risque d'effets indésirables est faible en cas de traitement à court terme. Lors d'un traitement à long terme et à fortes doses, les effets secondaires connus des glucocorticoïdes peuvent apparaître.
Les effets indésirables suivants sont caractéristiques des corticostéroïdes en administration systémique et peuvent par conséquent survenir également sous Triamcort Depot. Ils dépendent de la dose et de la durée du traitement, ainsi que de l'âge, du sexe et de la maladie sous-jacente du patient.
Troubles de la balance hydrique et électrolytique: Rétention hydrique et sodique, perte de potassium, alcalose hypokaliémique, hypertension, insuffisance cardiaque chez les patients disposés.
Musculature et squelette: Myopathie stéroïdale, atrophie musculaire, arthralgies, ostéoporose, fractures pathologiques, fracture-tassements de vertèbres, nécrose aseptique.
Gastro-intestinaux: Ulcère peptique avec hémorragie et perforation éventuelles, hémorragie gastrique, pancréatite, oesophagite, perforation intestinale. Une élévation des enzymes alanine-transaminase (ALAT, SGPT), aspartate-transaminase (ASAT, SGOT) et phosphatase alcaline a été observée à la suite d'un traitement par corticostéroïdes. Ces effets sont en général faibles et ne sont pas liés à un syndrome clinique. Ils sont réversibles après l'arrêt du traitement.
Dermatologiques: Retardement ou/et empêchement de la cicatrisation, pétéchies, ecchymoses, peau fine et sensible.
Métaboliques: Bilan azotique négatif en raison du catabolisme protéique.
Neurologiques: Pression intracrânienne élevée avec oedèmes papillaires (pseudotumeur cérébrale), convulsions, attaques de vertige, maux de tête, insomnie, altérations psychiques (dépression).
Endocrinologiques: Développement d'un état cushingoïde, blocage de l'axe hypophyso-surrénalien (pouvant persister jusqu'à un an ou plus et représentant un risque mettant en danger la vie du patient en situation de stress ou de surcharge émotionnelle), tolérance glucidique réduite (manifestation d'un diabète sucré latent, besoin élevé en insuline ou en antidiabétiques oraux par les diabétiques; voir aussi sous «Interactions»), inhibition de la croissance à l'âge infantile, troubles de la menstruation.
Ophtalmologiques: Cataracte postérieure souscapsulaire, pression intraoculaire élevée, glaucome, exophtalmie.
Système immunitaire: Masquage d'infections, activation d'infections latentes, infections opportunistes, réactions d'hypersensibilité y compris anaphylaxie, suppression des réactions aux tests cutanés.
Sang et vaisseaux sanguins: Vascularite, élévation du risque de thrombose.
Les effets indésirables suivants ont été observés après un traitement parentéral par corticostéroïdes: Des cas isolés de cécité suite à une application intralésionnelle dans les régions du visage et de la tête, réaction anaphylactique ou d'hypersensibilité, hyperpigmentation ou hypopigmentation, atrophie de l'épiderme et du tissu sous-cutané, abcès stériles, déclaration d'une inflammation articulaire suite à une application intrasynoviale, infection au site d'injection suite à une technique d'injection non stérile.
Surdosage
La toxicité aiguë des glucocorticoïdes est faible, et un surdosage aigu ou une intoxication à l'acétonide de triamcinolone est peu probable en cas d'utilisation conforme aux instructions. Aucun antidote spécifique n'existe en cas de surdosage. Le cas échéant, un traitement symptomatique est indiqué.
Propriétés/Effets
Code ATC: H02AB08
La suspension cristalline Triamcort Depot contient l'acétonide de triamcinolone, un glucocorticoïde synthétique possédant une faible activité minéralocorticoïde. L'activité de l'acétonide de triamcinolone, comme celle de tous les glucocorticoïdes, repose sur la stimulation de la synthèse de protéines spécifiques au niveau du noyau cellulaire. Ces protéines sont en fait responsables des activités biologiques diverses, inhérentes aux adaptations physiologiques de l'organisme à des situations de stress. Certains effets thérapeutiques souhaités ne sont atteints que par des posologies élevées (pharmacologiques) non physiologiques. Parmi ces effets se trouvent en particulier les effets antiphlogistiques et immunosuppresseurs (anti-allergiques). En raison du mécanisme d'action, la pleine activité pharmacologique des glucocorticoïdes est différée (plusieurs heures après l'administration orale ou parentérale) et dure plus longtemps que le laisse prévoir la valeur de la demi-vie plasmatique.
Lors d'une injection par voie intra-articulaire, intrafocale ou intradermique, une activité antiphlogistique peut être obtenue localement, avec une faible surcharge systémique de l'organisme. Lors d'une injection par voie intramusculaire, un effet anti-inflammatoire, anti-allergique et anti-asthmatique de longue durée est obtenu.
Le rythme propre de sécrétion du cortisol est complètement supprimé pendant les premières 48 heures suivant l'administration intramusculaire de 40 mg d'acétonide de triamcinolone. Le rétablissement de la production endogène de cortisol commence après 7 jours et est complet après 14 jours. Lors d'un traitement par l'acétonide de triamcinolone, l'activation par l'ACTH est clairement supprimée pendant les 10 premiers jours, tandis qu'une réactivité normale est rétablie après 14 jours.
La dose équivalente relative antiphlogistique d'acétonide de triamcinolone comparée aux autres glucocorticoïdes est la suivante: 10 mg d'acétonide de triamcinolone = 6 mg de bétaméthasone = 8 mg de dexaméthasone = 32 mg de méthylprednisolone = 40 mg de prednisone ou prednisolone = 200 mg de cortisone.
1 ml de Triamcort Depot 40 toutes les 3 à 4 semaines par voie intraglutéale remplace: 5–8 mg de prednisone/prednisolone ou 4–6 mg de méthylprednisolone par jour (per os).
Pharmacocinétique
Absorption
Après l'administration intramusculaire de 40 mg d'acétonide de triamcinolone, la concentration plasmatique maximale (Cmax) de 10 ng/ml environ est atteinte en l'espace de 4 heures. Les concentrations plasmatiques baissent jusqu'à 4 ng/ml en l'espace de 24 heures et augmentent à nouveau jusqu'au lendemain matin pour atteindre une moyenne de 6 ng/ml de sérum, qui est maintenue pendant 24 heures. Après 24 jours environ, les concentrations plasmatiques se situent à la limite de la détection.
Distribution
Dans le plasma, la majeure partie d'acétonide de triamcinolone se trouve sous forme non liée aux protéines, et est ainsi sous forme active. La proportion liée aux protéines plasmatiques peut s'élever jusqu'à 80%.
L'acétonide de triamcinolone est excrété dans le lait maternel, mais on ne sait pas s'il traverse la barrière placentaire ou la barrière hémato-encéphalique comme c'est le cas pour d'autres glucocorticoïdes.
Métabolisme
L'acétonide de triamcinolone est métabolisé principalement dans le foie, par la voie de l'isoenzyme CYP3A4 du cytochrome P450. Ses métabolites principaux sont le 6ß-hydroxy-triamcinolone-acétonide et les acides carboxyliques C21 de l'acétonide de triamcinolone et du 6ß-hydroxy-triamcinolone-acétonide. Ces métabolites sont pharmacologiquement inactifs. Une hydrolyse de la triamcinolone ne joue quasiment aucun rôle.
Elimination
L'élimination des métabolites a principalement lieu par les fèces.
La durée d'action clinique moyenne d'une injection intramusculaire de 40 mg de Triamcort Depot s'élève à 3 semaines.
Cinétique pour certains groupes de patients
Enfants et adolescents: Les données sur la pharmacocinétique de la triamcinolone dans les populations pédiatriques sont limitées. Chez le nouveau-né, la clairance de la triamcinolone est plus faible que chez l'enfant et l'adulte.
Patients âgés: La pharmacocinétique de la triamcinolone chez les patients ≥65 ans n'a pas été spécifiquement étudiée.
Insuffisance rénale: Aucune donnée n'est disponible sur la pharmacocinétique de la triamcinolone chez les patients souffrant d'insuffisance rénale.
Insuffisance hépatique: En cas d'insuffisance hépatique sévère, le métabolisme des glucocorticoïdes est ralenti, et les effets désirables et indésirables de Triamcort Depot peuvent donc être renforcés. Aucune donnée n'est disponible sur la pharmacocinétique de la triamcinolone dans l'insuffisance hépatique légère à modérée.
Grossesse: Pendant la grossesse, la demi-vie d'élimination des glucocorticoïdes est prolongée.
Autres situations
- En cas d'hypo-albuminémie et d'hyperbilirubinémie, les concentrations de la substance (pharmacologiquement active) non liée aux protéines peuvent être anormalement élevées.
- En présence d'une hypothyréose, le métabolisme des glucocorticoïdes est ralenti, et les effets désirables et indésirables de Triamcort Depot peuvent donc être renforcés.
Données précliniques
Potentiel mutagène et cancérogène
Les propriétés embryotoxiques de l'acétonide de triamcinolone ont été étudiées chez 2 espèces de rongeurs (rat, souris), chez le lapin et chez 3 espèces de primates non humains (singe rhésus, babouin, capucin). Des fentes palatines et des troubles de la croissance intra-utérine sont apparus chez les rongeurs et le lapin, et les effets tératogènes chez le rat par ex. ont été induits à des doses thérapeutiques humaines. Chez les espèces de singes, des troubles de la formation des cartilages du chondrocrâne ont été observés qui ont entraîné des anomalies du crâne (encéphalocèle) et des dysmorphies du visage. De plus, des malformations du thymus et des troubles de la croissance intra-utérine ont été observés.
Aucune expérience n'est disponible sur la sécurité d'emploi chez l'être humain.
Remarques particulières
Stabilité
Ce médicament ne peut être utilisé que jusqu'à la date indiquée par «EXP» sur l'emballage.
Remarques concernant le stockage
Ne pas entreposer au réfrigérateur, en raison de la formation éventuelle d'agglomérats en dessous du point de congélation. Conserver à température ambiante (15–25 °C), à l'abri de la lumière et hors de la portée des enfants. Ne pas congeler.
Numéro d’autorisation
41174 (Swissmedic).
Titulaire de l’autorisation
Helvepharm AG, Frauenfeld.
Mise à jour de l’information
Septembre 2017.
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.

 Deutsch
Deutsch French
French













