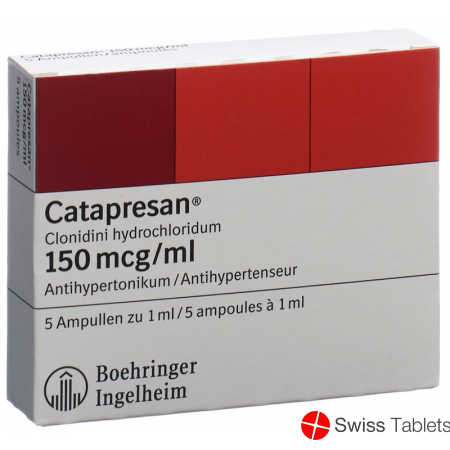
Catapresan Injektionslösung 150mcg/ml 5 Ampullen 1ml buy online
Catapresan Inj Lös 150 mcg/ml 5 Amp 1 ml
-
72.93 CHF
- Price in reward points: 3131

- Availability: Not available
- Product Code: 668353
- ATC-code C02AC01
- EAN 7680386380175
Ingredients:

Description
Zusammensetzung
Wirkstoff:
Clonidini hydrochloridum
Hilfsstoffe:
Catapresan Injektionslösung
Natrii chloridum, Aqua ad iniectabilia
Catapresan Tabletten
Lactosum monohydricum, Excipiens pro compresso
Darreichungsform und Wirkstoffmenge pro Einheit
Catapresan Injektionslösung
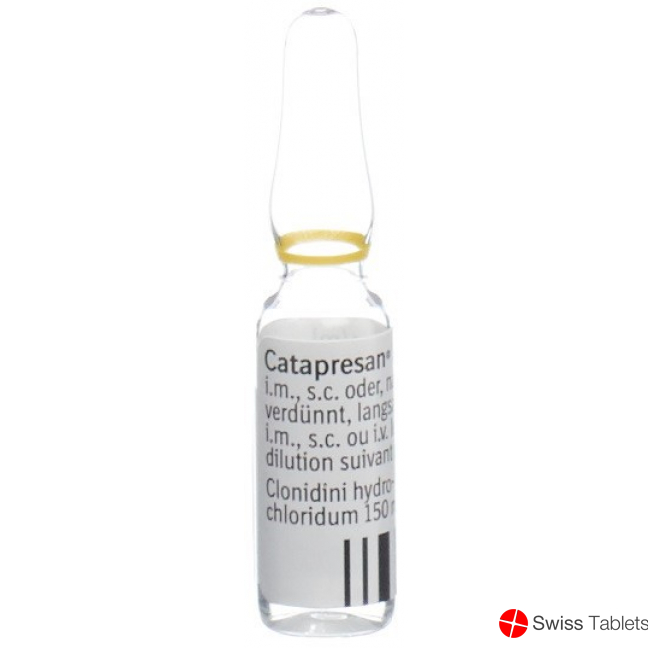
1 Ampulle (1 ml) enthält: Clonidinhydrochlorid 150 mcg.
Catapresan Tabletten
1 Tablette (teilbar) enthält: Clonidinhydrochlorid 150 mcg.
Indikationen/Anwendungsmöglichkeiten
Hypertonie
Für die Behandlung der Hochdruckkrise ist die langsame parenterale Anwendung aufgrund des schnellen Wirkungseintritts zu empfehlen.
Dosierung/Anwendung
Um das Wohlbefinden des Patienten bzw. der Patientin zu erhalten, ist es nicht empfehlenswert, den Blutdruck innerhalb kurzer Zeit rapide zu senken, ausgenommen im Falle einer Hochdruckkrise.
Beim Absetzen von Catapresan sollte die Dosis schrittweise über mehrere Tage reduziert werden (Rebound-Phänomen).
Ampullen zu 150 mcg/ml
Die subkutane, intramuskuläre Injektion bzw. die sehr langsam vorzunehmende intravenöse Gabe von 1 Ampulle mit 150 mcg Catapresan ist nur am liegenden Patienten durchzuführen. Bei intravenöser Verabfolgung ist die Ampulle mit mindestens 10 ml physiologischer Kochsalzlösung zu verdünnen und bei einer Injektionsdauer von mindestens 10 Minuten zu verabreichen. Am besten empfiehlt sich eine intravenöse Infusion in einer Dosis von 0,2 mcg/kg/Min. Die Infusionsgeschwindigkeit von 0,5 mcg/kg/Min. sollte nicht überschritten werden. Bei Überschreitung dieser intravenösen Applikationsdosen und -zeiten kann es initial für wenige Minuten zu einer Erhöhung des systolischen Blutdrucks bis zu 20 mm Hg kommen. Es wird empfohlen, nicht mehr als 150 mcg (= 1 Ampulle) pro Infusion zu verwenden.
Gegebenenfalls kann die parenterale Anwendung von 1 Ampulle bis zu 4-mal täglich erfolgen.
Tabletten zu 150 mcg
Bei oraler Therapieeinleitung sollte mit einer tiefen Dosis von Catapresan begonnen werden (z.B. ½ Tablette vorzugsweise abends). Falls eine Dosiserhöhung erforderlich ist, wird empfohlen, diese frühestens nach 2-4 Wochen vorzunehmen.
Bei leichteren Formen der Hypertonie reicht oft 75-150 mcg pro Tag, d.h. ½ Tablette abends, resp. ½ Tablette morgens und abends. Eine langsame Erhöhung der Tagesdosis über 450 mcg hinaus bewirkt nur ausnahmsweise eine weitere Blutdrucksenkung. Maximale Tagesdosen von 900 mcg verteilt auf 3 Einzeldosen sind schwersten Hypertonien vorbehalten.
Einnahme
Die Tabletten sollen unzerkaut mit reichlich Wasser geschluckt werden.
Spezielle Dosierungsanweisungen
Anwendung bei Kindern und Jugendlichen
Die Anwendung und die Sicherheit von Catapresan bei Kindern und Jugendlichen sind nicht ausreichend durch randomisierte kontrollierte Studien belegt. Die Anwendung von Catapresan bei dieser Patientengruppe wird deshalb nicht empfohlen.
Im Besonderen, wenn Clonidin off-label zusammen mit Methylphenidat bei Kindern mit ADHS eingesetzt wird, wurden schwerwiegende unerwünschte Wirkungen, einschliesslich Todesfällen, beobachtet. Clonidin in dieser Kombination wird deshalb nicht empfohlen.
Niereninsuffizienz
Die Dosierung muss angepasst werden
•entsprechend der individuellen antihypertensiven Reaktion, die bei Patienten mit Niereninsuffizienz stark variieren kann
•entsprechend dem Grad der Beeinträchtigung der Nierenfunktion.
Eine sorgfältige Überwachung ist erforderlich. Da nur eine geringe Menge Clonidin bei routinemässiger Dialyse entfernt wird, ist es nicht notwendig, nach der Dialyse zusätzlich Clonidin zu geben.
Kontraindikationen
Bei bekannter Überempfindlichkeit gegen den Wirkstoff oder andere Bestandteile des Präparates, sowie bei Patientinnen und Patienten mit schwerer Bradyarrhythmie, hervorgerufen entweder durch ein Sick-Sinus-Syndrom oder von einem AV-Block 2. oder 3. Grades, sollte Catapresan nicht angewandt werden.
Warnhinweise und Vorsichtsmassnahmen
Die Behandlung des Bluthochdrucks bedarf regelmässiger ärztlicher Kontrolle.
Bei Patientinnen und Patienten mit leichter bis mittelschwerer Bradyarrhythmie, wie z.B. niedrigem Sinusrhythmus, mit Störungen der zerebralen oder peripheren Perfusion, Raynaud-Syndrom, Thrombangitis obliterans, Depression, Polyneuropathie und Verstopfung sollte Catapresan mit Vorsicht angewendet werden.
Bei Phäochromozytomkrisen ist eine blutdrucksenkende Wirkung nicht zu erwarten, doch wird bei nicht erkanntem Phäochromozytom die Krise durch Catapresan nicht verstärkt.
Die Einstellung und Behandlung des Hochdrucks bei Niereninsuffizienz bedarf besonderer Sorgfalt mit häufigen Blutdruckkontrollen.
Wie auch bei anderen blutdrucksenkenden Präparaten sollte die Behandlung mit Catapresan bei Patientinnen und Patienten mit Herzinsuffizienz oder schwerer koronarer Herzkrankheit sorgfältig überwacht werden.
Die Patientinnen und Patienten sollten angewiesen werden, ohne vorherige ärztliche Beratung die Behandlung nicht abzubrechen. Nach plötzlichem Absetzen von Catapresan nach langfristiger Behandlung mit hohen Dosen wurde über Unruhe, Herzklopfen, raschen Blutdruckanstieg, Nervosität, Zittern, Kopfschmerzen oder Übelkeit berichtet. Falls die Catapresan-Behandlung abgebrochen werden muss, sollte die Dosis stufenweise über 2-4 Tage reduziert werden.
Falls eine Langzeitbehandlung mit einem Beta-Rezeptorenblocker abgebrochen werden muss, sollte zuerst der Beta-Rezeptorenblocker stufenweise abgesetzt werden und danach Clonidin.
Patienten, die Kontaktlinsen tragen, sollten darauf aufmerksam gemacht werden, dass Catapresan die Tränensekretion vermindern kann.
Catapresan Tabletten enthalten 34,25 mg Laktose-Monohydrat pro Tablette, was bei der maximal empfohlenen täglichen Dosierung 205,5 mg Laktose-Monohydrat entspricht. Patienten mit einer seltenen erblichen Galactose-Intoleranz, z.B. einer Galactosämie, sollten dieses Arzneimittel nicht einnehmen.
Interaktionen
Die antihypertensive Wirkung von Catapresan kann durch andere blutdrucksenkende Mittel verstärkt werden. Dies kann bei der Anwendung anderer Antihypertonika wie Diuretika, Vasodilatatoren, Beta-Rezeptorenblockern, Calciumantagonisten und ACE-Inhibitoren von therapeutischem Nutzen sein. Wirkungsminderung von Clonidin unter Prazosin oder keine additive Wirkung. Blutdrucksteigernde oder Natrium- und wasserretinierende Substanzen, wie z.B. nichtsteroidale Antiphlogistika, können die therapeutische Wirkung von Clonidin herabsetzen.
Alpha2-Rezeptorenblocker, wie z.B. Phentolamin oder Tolazolin können dosisabhängig die Alpha2-Rezeptoren bedingten Wirkungen von Clonidin aufheben.
Die gleichzeitige Anwendung von Substanzen mit negativ chronotroper oder dromotroper Wirkung, wie Beta-Rezeptorenblocker oder Digitalisglykoside, kann zu bradykarden Rhythmusstörungen führen oder diese verstärken.
Es ist nicht auszuschliessen, dass die gleichzeitige Gabe von Beta-Rezeptorenblockern periphere vaskuläre Störungen verstärkt.
Die gleichzeitige Anwendung von trizyklischen Antidepressiva oder Neuroleptika mit alpha-rezeptorenblockierender Wirkung kann zu einer Abschwächung oder zur Aufhebung der blutdrucksenkenden Wirkung von Clonidin führen, gleichzeitig kann es zu orthostatischen Regulationsstörungen oder zur Verstärkung solcher Störungen kommen.
Beobachtungen an Patienten im Alkoholdelirium führten zu der Annahme, dass hohe intravenöse Clonidin-Dosen das arrhythmogene Potential (QT-Verlängerung, Kammerflimmern) hoher intravenöser Dosen von Haloperidol verstärken. Ein kausaler Zusammenhang und die Relevanz für die blutdrucksenkende Behandlung wurden nicht nachgewiesen.
Die Wirkungen von zentraldämpfenden Substanzen oder Alkohol können durch Clonidin verstärkt werden.
Schwangerschaft/Stillzeit
Schwangerschaft
Bisher liegen nur sehr begrenzte Erfahrungen mit der Anwendung von Clonidin bei Schwangeren vor. Catapresan sollte deshalb während der Schwangerschaft nicht angewendet werden, es sei denn es ist klar notwendig.
Wenn eine Behandlung erforderlich ist, müssen Mutter und Kind sorgfältig überwacht werden.
Clonidin durchquert die Plazenta und kann beim Fötus zu einer Senkung der Herzfrequenz führen. Bisher liegen keine ausreichenden Erfahrungen im Hinblick auf langfristige Auswirkungen einer pränatalen Exposition vor.
Die oralen Catapresan Darreichungsformen sind zu bevorzugen, und die intravenöse Injektion von Clonidin sollte vermieden werden.
Präklinische Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität (siehe Rubrik «Präklinische Daten»).
Nach der Geburt ist ein vorübergehender Blutdruckanstieg beim Neugeborenen nicht ausgeschlossen.
Stillzeit
Der Wirkstoff geht in die Muttermilch über. Es gibt jedoch nur ungenügende Informationen zu den Auswirkungen auf Neugeborene. Catapresan sollte deshalb während der Stillzeit nicht angewandt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Die Patienten sind jedoch darauf hinzuweisen, dass unerwünschte Effekte, z.B. Schwindel, Sedierung und Akkomodationsstörungen während der Behandlung mit Catapresan auftreten können. Daher ist beim Führen eines Fahrzeugs oder Bedienen von Maschinen Vorsicht angebracht. Wenn die genannten Nebenwirkungen auftreten, sollte der Patient potenziell gefährliche Tätigkeiten wie das Führen eines Fahrzeugs oder das Bedienen von Maschinen meiden.
Unerwünschte Wirkungen
Das Auftreten unerwünschter Wirkungen in Verbindung mit Catapresan ist dosisabhängig. Besonders in der Anfangsphase der Behandlung wurden Mundtrockenheit, Schläfrigkeit und Schwindelgefühle beobachtet, die jedoch beim Fortsetzen der Behandlung oft innert 2-4 Wochen abklingen.
Folgende unerwünschte Wirkungen wurden bei der Anwendung von Catapresan beobachtet:
Definition der verwendeten Häufigkeiten: sehr häufig (>10%), häufig (>1%, <10%), gelegentlich (>0,1%, <1%), selten (<0,1%).
Endokrine Störungen
Selten: Gynäkomastie
Stoffwechsel- und Ernährungsstörungen
Selten: vorübergehende Erhöhung der Blutzuckerwerte
Häufigkeit nicht bekannt: Gewichtszunahme
Psychiatrische Störungen
Häufig: Schlafstörungen, Depression
Gelegentlich: Wahnvorstellungen, Halluzinationen, Alpträume
Häufigkeit nicht bekannt: Verwirrtheitszustände, Unruhe, verminderte Libido, Angstzustände, Delir
Störungen des Nervensystems
Sehr häufig: Sedierung (50%), Schwindel (15%)
Häufig: Kopfschmerzen
Gelegentlich: Parästhesien
Augenleiden
Selten: Verminderte Tränensekretion
Häufigkeit nicht bekannt: Akkommodationsstörungen
Funktionsstörungen des Herzens
Gelegentlich: Sinusbradykardie
Selten: atrioventrikulärer Block
Häufigkeit nicht bekannt: Palpitationen und Tachykardie, Bradykardie, Stauungsherzinsuffizienz
Funktionsstörungen der Gefässe
Sehr häufig: orthostatische Hypotonie (15%)
Gelegentlich: Raynaud-Phänomen
Häufigkeit nicht bekannt: Synkopen
Atmungsorgane
Selten: Trockenheit der Nasenschleimhaut
Gastrointestinale Störungen
Sehr häufig: Mundtrockenheit (44%)
Häufig: Obstipation, Übelkeit und Erbrechen, Schmerzen in den Speicheldrüsen
Selten: Pseudoobstruktion des Dickdarms
Häufigkeit nicht bekannt: Abdominalschmerzen, Anorexie
Leber und Galle
Häufig: leichte vorübergehende Anomalitäten bei Leberfunktionstests (1%)
Funktionsstörungen der Haut und des Unterhautzellgewebes
Gelegentlich: Pruritus, Hautausschlag, Urtikaria
Selten: Alopezie
Häufigkeit nicht bekannt: angioneurotisches Ödem
Muskelskelettsystem
Häufigkeit nicht bekannt: Muskel- oder Gelenkschmerzen, Beinkrämpfe
Reproduktionssystem und Brust
Häufig: erektile Dysfunktion
Allgemeine Störungen
Häufig: Müdigkeit
Gelegentlich: Unwohlsein
Häufigkeit nicht bekannt: Entzugssymptome, Blässe, erhöhte Alkoholempfindlichkeit, Fieber
Untersuchungen
Häufigkeit nicht bekannt: Erhöhung der CPK-Werte, schwach positive Coombs-Testergebnisse
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Symptome
Intoxikationserscheinungen sind auf die allgemeine Suppression des Sympathikus zurückzuführen, dabei kann es zu Blutdruckabfall, paradoxem Bluthochdruck (hervorgerufen durch Stimulierung der peripheren Alpha1-Rezeptoren), Bradykardie, Lethargie, Hypothermie, Herzrhythmusstörungen, Somnolenz bis hin zum Koma, Atemdepression einschliesslich Apnoe, Pupillenverengung, Konvulsionen kommen. Die Symptome treten 30-60 Min. nach Einnahme auf und können 36-48 Std. persistieren.
Massnahmen
Sorgfältige Überwachung und symptomatische Massnahmen. Magenspülung ist nur sinnvoll, wenn ein noch nicht resorbierter Anteil der eingenommenen Dosis entfernt werden kann. Eine Dialyse erhöht die Elimination von Clonidin nicht signifikant.
Eigenschaften/Wirkungen
ATC-Code: C02AC01
Catapresan ist ein Antihypertonikum, das sich durch seine grosse therapeutische Breite und seine individuelle Dosierbarkeit auszeichnet. Es senkt sowohl den systolischen als auch den diastolischen arteriellen Blutdruck.
Clonidin wirkt in erster Linie am Zentralnervensystem (Stimulation der Alpha-Adrenergen-Rezeptoren) und bewirkt dadurch eine Verringerung des Sympathikotonus und eine Herabsetzung des peripheren Widerstandes, des renalen Gefässwiderstandes, der Herzfrequenz und des Blutdruckes. Renaler Blutfluss und die glomeruläre Filtrationsrate bleiben im Wesentlichen unverändert. Die normalen Haltungsreflexe bleiben erhalten, somit sind orthostatische Symptome nur schwach und selten. Bei Langzeitanwendung stellt sich das Herzzeitvolumen gewöhnlich wieder auf die Kontrollwerte ein, während der periphere Widerstand verringert bleibt. Bei den meisten Patienten wurde unter Clonidin ein verlangsamter Puls beobachtet, jedoch verändert das Präparat nicht die normale hämodynamische Reaktion auf körperliche Bewegung.
Die antihypertensiv wirksamen Plasmaspiegel liegen zwischen 0,2 und 1,5 ng/ml bei Patientinnen und Patienten mit normaler Ausscheidungsfunktion. Eine weitere Erhöhung der Plasmaspiegel verstärkt normalerweise den antihypertensiven Effekt kaum noch. Bei Patientinnen und Patienten mit extrem eingeschränkter Nierenfunktion bzw. dialysepflichtigen Patientinnen und Patienten können jedoch Plasmaspiegel bis zu 12 ng/ml für eine Blutdrucksenkung erforderlich werden.
Pharmakokinetik
Absorption
Die Pharmakokinetik von Clonidin ist in einem Bereich von 75-300 mcg proportional der Dosis. Clonidin wird nach oraler Gabe gut resorbiert und unterliegt einem geringen First-Pass-Effekt.
Maximale Plasmakonzentrationen werden innerhalb von 1-3 Std. nach oraler Einnahme erreicht.
Die Absorption von Clonidin wird durch Nahrungsmittel oder die ethnische Zugehörigkeit nicht beeinflusst.
Distribution
Die Verteilung von Clonidin in die Gewebe erfolgt umfangreich und schnell. Die Bluthirnschranke wie auch die Plazentabarriere werden überwunden. Die Plasmaproteinbindung beträgt 30-40%.
Clonidin wird in die Muttermilch ausgeschieden.
Metabolismus/Elimination
Ca. 70% der verabreichten Dosis werden mit dem Harn hauptsächlich in Form der unveränderten Muttersubstanz (40-60% der Dosis) ausgeschieden. Der Hauptmetabolit p-Hydroxy-Clonidin ist pharmakologisch inaktiv.
Der fäkale Anteil der Ausscheidung beträgt ca. 20% der Gesamtmenge.
Die terminale Eliminationshalbwertzeit von Clonidin liegt im Bereich zwischen 5 und 25,5 Stunden.
Die Pharmakokinetik von Clonidin wird weder durch Nahrung noch durch die ethnische Zugehörigkeit des Patienten beeinflusst.
Bei Patienten mit normaler Nierenfunktion wird die antihypertensive Wirkung bei Plasmakonzentrationen zwischen ca. 0,2 und 2,0 ng/ml erreicht.
Bei Plasmakonzentrationen oberhalb von 2,0 ng/ml wird die blutdrucksenkende Wirkung leicht abgeschwächt oder geht zurück.
Kinetik spezieller Patientengruppen
Bei Patienten mit stark eingeschränkter Nierenfunktion kann die Halbwertszeit auf bis zu 41 Stunden verlängert werden.
Präklinische Daten
Toxizitätsstudien nach Einzeldosen mit Clonidin wurden an verschiedenen Tierspezies nach oraler bzw. parenteraler Verabreichung durchgeführt.
Die ungefähren oralen LD50-Werte lagen bei 70 mg/kg (Maus), 190 mg/kg (Ratte), >15 mg/kg (Hund) und 150 mg/kg (Affen).
Die LD50-Werte nach intravenöser Verabreichung betrugen zwischen 6 mg/kg (Hund) und <21 mg/kg (Ratte).
In Toxizitätsstudien bei wiederholter Gabe über 18 Monate wurde Clonidin bei Ratten, Hunden und Affen gut vertragen.
In einer 13 Wochen dauernden Studie an Ratten lag der «No-Observed-Adverse-Effect Level» (NOAEL) nach subkutaner Verabreichung bei 0.05 mg/kg.
Nach intravenöser Applikation tolerierten Kaninchen und Hunde 0,01 mg/kg/Tag über 5 bzw. 4 Wochen. Höhere Dosierungen führten zu Hyperaktivität, Aggression, verringerter Futteraufnahme und Körpergewichtszunahme (Ratte), Sedierung (Kaninchen) oder erhöhten Herz- und Lebergewichten zusammen mit einem Anstieg der Serum-GPT, der alkalischen Phosphatase und des Alpha-Globulinspiegels sowie zu fokalen Lebernekrosen (Hund).
Es bestehen keine Anzeichen eines teratogenen Potenzials nach oraler Verabreichung an Maus, Ratte und Kaninchen sowie nach s. c. (Ratte) und i. v. (Kaninchen) Behandlung. Bei Ratten beobachtete man einen Anstieg der Absorptionsrate bei einer oralen Dosis >0,015 mg/kg/Tag, jedoch abhängig von der Dauer der Verabreichung.
Die Fertilität bei Ratten wurde bei Dosen bis zu 0,15 mg/kg nicht beeinträchtigt. Dosen bis zu 0,075 mg/kg hatten keine Auswirkung auf die peri- und postnatale Entwicklung der Nachkommen.
Es bestand kein mutagenes Potenzial im Ames-Test und im Mikrokerntest an Mäusen. Clonidin hatte in Karzinogenitätsuntersuchungen an Ratten keine neoplastische Wirkung.
Es wurde kein Potenzial lokaler Irritationen bzw. Sensibilisierungen beim Meerschweinchen und Kaninchen nach i.v. und i.a. Verabreichungen festgestellt.
Sonstige Hinweise
Inkompatibilitäten
Keine bekannt. Die Injektionslösung darf nur mit physiologischer Kochsalzlösung gemischt werden (siehe «Dosierung/Anwendung»).
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Die Injektionslösung ist zum sofortigen Gebrauch bestimmt, nicht verwendete Lösung ist zu verwerfen.
Besondere Lagerungshinweise
Die Injektionslösung soll bei Raumtemperatur (15-25 °C) gelagert werden.
Die Tabletten sollen nicht über 30 °C gelagert werden.
Arzneimittel für Kinder unzugänglich aufbewahren.
Hinweise für die Handhabung
Siehe «Dosierung/Anwendung».
Zulassungsnummer
38'638, 33'148 (Swissmedic)
Zulassungsinhaberin
CPS Cito Pharma Services GmbH, 8610 Uster
Stand der Information
Juli 2012
Composizione
Principio attivo:
clonidini hydrochloridum
Sostanze ausiliarie:
Catapresan soluzione iniettabile
Natrii chloridum, aqua ad iniectabilia
Catapresan compresse
Lactosum monohydricum, excipiens pro compresso
Forma farmaceutica e quantità di principio attivo per unità
Catapresan soluzione iniettabile
1 fiala (1 ml) contiene: clonidina cloridrato 150 mcg.
Catapresan compresse
1 compressa (divisibile) contiene: clonidina cloridrato 150 mcg.
Indicazioni/Possibilità d'impiego
Ipertensione
Per il trattamento della crisi ipertensiva, si raccomanda l'applicazione parenterale lenta a causa della rapida insorgenza d'azione.
Posologia/Impiego
Per preservare il benessere del paziente, non è consigliabile abbassare rapidamente la pressione arteriosa nell'arco di un breve periodo di tempo, tranne nel caso di una crisi ipertensiva.
In caso di sospensione di Catapresan, la dose dovrebbe essere nuovamente ridotta gradualmente nel corso di diversi giorni (fenomeno di rimbalzo).
Fiale da 150 mcg/ml
L'iniezione sottocutanea, intramuscolare o la somministrazione endovenosa da effettuarsi molto lentamente di 1 fiala di Catapresan da 150 mcg deve essere eseguita solo con il paziente in posizione supina. Nel caso di somministrazione endovenosa, la fiala deve essere diluita con almeno 10 ml di soluzione salina e somministrata con una durata dell'iniezione di almeno 10 minuti. La raccomandazione prevede sia meglio un'infusione endovenosa di una dose di 0,2 mcg/kg/min. La velocità di infusione di 0,5 mcg/kg/min. non dovrebbe essere superata. Se queste dosi e questi tempi di applicazione endovenosa vengono superati, la pressione sanguigna sistolica può inizialmente aumentare fino a 20 mm Hg per alcuni minuti. Si raccomanda di non utilizzare più di 150 mcg (= 1 fiala) per infusione.
Se necessario, l'applicazione parenterale di 1 fiala può essere effettuata fino a 4 volte al giorno.
Compresse da 150 mcg
In caso di inizio della terapia per via orale, si dovrebbe cominciare con una dose bassa di Catapresan (ad esempio 1/2 compressa, preferibilmente alla sera). Se è necessario un aumento della dose, si raccomanda di farlo dopo 2-4 settimane al più presto.
Con forme più lievi di ipertensione, spesso sono sufficienti 75-150 mcg al giorno, cioè rispettivamente 1/2 compressa alla sera o 1/2 compressa al mattino e alla sera. Un lento aumento della posologia giornaliera oltre 450 mcg provoca solo eccezionalmente un'ulteriore riduzione della pressione sanguigna. Posologie giornaliere massime di 900 mcg distribuite su 3 singole dosi sono riservate alle ipertensioni più gravi.
Assunzione
Le compresse devono essere ingoiate con abbondante acqua e non devono essere masticate.
Istruzioni posologiche speciali
Uso nei bambini e negli adolescenti
L'uso e la sicurezza di Catapresan nei bambini e negli adolescenti non sono sufficientemente dimostrati da studi controllati randomizzati. Pertanto, l'uso di Catapresan non è raccomandato in questo gruppo di pazienti.
In particolare, quando la clonidina viene utilizzata off-label insieme con metilfenidato in bambini con ADHD, sono stati osservati effetti indesiderati gravi, compresi decessi. La clonidina in tale associazione non è quindi raccomandata.
Insufficienza renale
La posologia deve essere aggiustata
•secondo la reazione antipertensiva individuale, che può variare notevolmente nei pazienti con insufficienza renale
•in base al grado di compromissione della funzionalità renale.
È necessaria un'accurata sorveglianza. Poiché solo una modesta quantità di clonidina viene rimossa durante la dialisi di routine, non è necessario somministrare ulteriore clonidina dopo la dialisi.
Controindicazioni
Catapresan non dovrebbe essere utilizzato in caso di ipersensibilità nota al principio attivo o ad altri componenti del preparato, nonché in pazienti con grave bradiaritmia causata dalla sindrome del seno malato o da un blocco atrioventricolare di II o III grado.
Avvertenze e misure precauzionali
Il trattamento dell'ipertensione richiede un regolare controllo medico.
Catapresan dovrebbe essere utilizzato con cautela in pazienti con bradiaritmia da lieve a moderata, come ad esempio il basso ritmo del seno, disturbi della perfusione cerebrale o periferica, sindrome di Raynaud, tromboangioite obliterante, depressione, polineuropatia e costipazione.
Nelle crisi dovute al feocromocitoma, non è previsto un effetto antipertensivo, ma nel caso di feocromocitoma non riconosciuto, la crisi non viene rafforzata da Catapresan.
La regolazione e il trattamento della pressione alta in caso di insufficienza renale richiede particolare attenzione con frequenti controlli della pressione sanguigna.
Come con altri preparati antipertensivi, il trattamento con Catapresan dovrebbe essere attentamente monitorato in pazienti con insufficienza cardiaca o grave coronaropatia.
I pazienti dovrebbero essere istruiti a non interrompere il trattamento senza aver precedentemente consultato un medico. Dopo improvvisa sospensione di Catapresan, dopo trattamento a lungo termine con dosi elevate, sono stati riferiti irrequietezza, palpitazioni, rapido aumento della pressione sanguigna, nervosismo, tremori, cefalea o nausea. Se fosse necessario interrompere il trattamento con Catapresan, la dose dovrebbe essere gradualmente ridotta nel corso di 2-4 giorni.
Se un trattamento a lungo termine con un betabloccante deve essere interrotto, prima dovrebbe essere sospeso gradualmente il betabloccante e poi la clonidina.
I pazienti che indossano lenti a contatto dovrebbero essere informati del fatto che Catapresan può ridurre la secrezione lacrimale.
Le compresse di Catapresan contengono 34,25 mg di lattosio monoidrato per compressa, che corrispondono a 205,5 mg di lattosio monoidrato alla posologia massima giornaliera raccomandata. I pazienti con un'intolleranza ereditaria rara al galattosio, ad esempio con galattosemia, non dovrebbero assumere questo medicamento.
Interazioni
L'effetto antipertensivo di Catapresan può essere rafforzato da altri agenti antipertensivi. Questo può apportare un beneficio terapeutico quando vengono usati altri antipertensivi come diuretici, vasodilatatori, betabloccanti, calcio antagonisti e ACE inibitori. Riduzione dell'effetto della clonidina con prazosina oppure nessun effetto additivo. Sostanze che aumentano la pressione sanguigna o che provocano ritenzione idrica o di sodio, come ad esempio i farmaci antinfiammatori non steroidei, possono ridurre l'effetto terapeutico della clonidina.
I bloccanti dei recettori α2, come ad esempio la fentolamina o la tolazolina, possono annullare in modo dose-dipendente gli effetti correlati ai recettori α2 della clonidina.
L'uso concomitante di sostanze con effetto cronotropo o dromotropo negativo, come i betabloccanti o i glicosidi digitalici, può provocare o rafforzare disturbi del ritmo bradicardico.
Non si può escludere che la somministrazione concomitante di betabloccanti aumenti i disturbi vascolari periferici.
L'uso concomitante di antidepressivi triciclici o di neurolettici con effetto alfabloccante può portare ad un indebolimento o alla neutralizzazione dell'effetto antipertensivo della clonidina, allo stesso tempo possono verificarsi disturbi della regolazione ortostatica o il rafforzamento di tali disturbi.
Osservazioni su pazienti nel delirio alcolico hanno portato all'ipotesi che dosi elevate di clonidina per via endovenosa rafforzano il potenziale aritmogeno (prolungamento del QT, fibrillazione ventricolare) di dosi endovenose elevate di aloperidolo. Una correlazione causale e la rilevanza per il trattamento antipertensivo non sono state dimostrate.
Gli effetti delle sostanze ad azione depressiva per il sistema nervoso centrale o dell'alcol possono essere rafforzati dalla clonidina.
Gravidanza/Allattamento
Gravidanza
Finora, vi sono esperienze molto limitate con l'uso di clonidina nelle donne in gravidanza. Catapresan non dovrebbe pertanto essere usato durante la gravidanza, a meno che non sia chiaramente necessario.
Se è necessario un trattamento, la madre e il bambino devono essere attentamente monitorati.
La clonidina attraversa la placenta e può portare a una riduzione della frequenza cardiaca nel feto. Ad oggi, non vi sono esperienze sufficienti in termini di effetti a lungo termine di un'esposizione prenatale.
Le forme farmaceutiche orali di Catapresan sono preferibili e l'iniezione endovenosa di clonidina dovrebbe essere evitata.
Studi preclinici non hanno evidenziato effetti direttamente o indirettamente dannosi per la salute rispetto alla tossicità per la riproduzione (si veda sezione «Dati preclinici»).
Dopo la nascita, non è escluso un temporaneo aumento della pressione sanguigna nel neonato.
Allattamento
Il principio attivo è escreto nel latte materno. Tuttavia, vi sono solo informazioni insufficienti sugli effetti sui neonati. Catapresan non dovrebbe pertanto essere somministrato durante l'allattamento.
Effetti sulla capacità di condurre veicoli e sull'impiego di macchine
Non sono stati eseguiti studi sugli effetti sulla capacità di condurre veicoli e sull'impiego di macchine.
Tuttavia, i pazienti devono essere informati che effetti indesiderati, ad esempio vertigini, sedazione e disturbi dell'accomodazione, possono insorgere durante il trattamento con Catapresan. Pertanto, è indicata cautela nel condurre un veicolo o nell'impiego di macchine. Se insorgono gli effetti collaterali summenzionati, il paziente dovrebbe evitare attività potenzialmente pericolose come condurre un veicolo o impiegare macchinari.
Effetti indesiderati
L'insorgenza di effetti indesiderati in associazione con Catapresan è dose-dipendente. Soprattutto nella fase iniziale del trattamento, sono stati osservati secchezza delle fauci, sonnolenza e sensi di vertigine, che, tuttavia, spesso scompaiono entro 2-4 settimane con il proseguimento del trattamento.
I seguenti effetti indesiderati sono stati osservati con l'uso di Catapresan:
Definizione delle frequenze utilizzate: molto comune (>10%), comune (>1%, <10%), non comune (>0,1%, <1%), raro (<0,1%).
Disturbi endocrini
Raro: ginecomastia
Disturbi del metabolismo e dell'alimentazione
Raro: aumento temporaneo dei livelli di glicemia
Frequenza non nota: aumento di peso
Disturbi psichiatrici
Comune: disturbi del sonno, depressione
Non comune: deliri, allucinazioni, incubi
Frequenza non nota: stati confusionali, irrequietezza, libido ridotta, stati d'ansia, delirio
Disturbi del sistema nervoso
Molto comune: sedazione (50%), vertigini (15%)
Comune: cefalea
Non comune: parestesie
Affezioni degli occhi
Raro: secrezione lacrimale ridotta
Frequenza non nota: disturbi dell'accomodazione
Disturbi funzionali del cuore
Non comune: bradicardia sinusale
Raro: blocco atrioventricolare
Frequenza non nota: palpitazioni e tachicardia, bradicardia, insufficienza cardiaca congestizia
Disturbi funzionali vascolari
Molto comune: ipotensione ortostatica (15%)
Non comune: fenomeno di Raynaud
Frequenza non nota: sincopi
Apparato respiratorio
Raro: secchezza della mucosa nasale
Disturbi gastrointestinali
Molto comune: secchezza delle fauci (44%)
Comune: stipsi, nausea e vomito, dolore alle ghiandole salivari
Raro: pseudo-ostruzione dell'intestino crasso
Frequenza non nota: dolori addominali, anoressia
Fegato e cistifellea
Comune: lievi anomalie transitorie nei test della funzionalità epatica (1%)
Disturbi funzionali della cute e del tessuto cellulare sottocutaneo
Non comune: prurito, eruzione cutanea, orticaria
Raro: alopecia
Frequenza non nota: edema angioneurotico
Apparato muscolo-scheletrico
Frequenza non nota: dolori muscolari o articolari, crampi alle gambe
Apparato riproduttivo e mammella
Comune: disfunzione erettile
Disturbi generali
Comune: stanchezza
Non comune: malessere
Frequenza non nota: sintomi da astinenza, pallore, aumento della sensibilità all'alcol, febbre
Esami diagnostici
Frequenza non nota: aumento dei valori CPK, debole positività degli esiti del test di Coombs
La notifica di effetti collaterali sospetti dopo l'omologazione del medicamento è molto importante. Consente una sorveglianza continua del rapporto rischio-benefico del medicamento. Chi esercita una professione sanitaria è invitato a segnalare qualsiasi nuovo o grave effetto collaterale sospetto attraverso il portale online ElViS (Electronic Vigilance System). Maggiori informazioni sono disponibili sul sito www.swissmedic.ch.
Posologia eccessiva
Sintomi
I sintomi di intossicazione sono attribuibili alla soppressione generale del simpatico, con conseguente possibile calo della pressione sanguigna, ipertensione paradossale (causata dalla stimolazione dei recettori α1 periferici), bradicardia, letargia, ipotermia, disturbi del ritmo cardiaco, sonnolenza fino al coma, depressione respiratoria compresa apnea, restringimento delle pupille, convulsioni. I sintomi si verificano 30-60 min. dopo l'assunzione e possono persistere per 36-48 ore.
Misure
Attento monitoraggio e misure sintomatiche. La lavanda gastrica è utile solo se può essere rimossa una parte non assorbita della dose assunta. Una dialisi non aumenta significativamente l'eliminazione della clonidina.
Proprietà/Effetti
Codice ATC: C02AC01
Catapresan è un antipertensivo che è caratterizzato dalla sua ampia finestra terapeutica e dalla possibilità di regolare la posologia in modo individuale. Abbassa sia la pressione arteriosa sistolica che quella diastolica.
La clonidina agisce principalmente sul sistema nervoso centrale (stimolazione dei recettori alfa-adrenergici), riducendo così il tono simpatico e abbassando la resistenza periferica, la resistenza vascolare renale, la frequenza cardiaca e la pressione sanguigna. Il flusso sanguigno renale e il tasso di filtrazione glomerulare rimangono sostanzialmente inalterati. I normali riflessi posturali sono mantenuti, quindi i sintomi ortostatici sono solo deboli e rari. Con l'uso a lungo termine, la gittata cardiaca solitamente si adatta ai valori di controllo, mentre la resistenza periferica rimane ridotta. Nella maggior parte dei pazienti, è stato osservato un rallentamento del battito con la clonidina, ma il preparato non altera la normale risposta emodinamica all'attività fisica.
I livelli plasmatici ad azione antipertensiva variano da 0,2 a 1,5 ng/ml in pazienti con normale funzione escretoria. Un ulteriore aumento dei livelli plasmatici di solito difficilmente migliora l'effetto antipertensivo. Tuttavia, nei pazienti con funzionalità renale estremamente ridotta o in pazienti che necessitano di dialisi, possono essere necessari livelli plasmatici fino a 12 ng/ml per un abbassamento della pressione sanguigna.
Farmacocinetica
Assorbimento
La farmacocinetica della clonidina è proporzionale alla dose in un intervallo di 75-300 mcg. La clonidina è ben assorbita dopo la somministrazione orale ed è soggetta a un modesto effetto di primo passaggio.
Le concentrazioni plasmatiche massime sono raggiunte entro 1-3 ore dopo l'assunzione orale.
L'assorbimento della clonidina non è influenzato dal cibo o dall'appartenenza etnica.
Distribuzione
La distribuzione della clonidina nei tessuti è ampia e rapida. La barriera ematoencefalica come pure la barriera placentare vengono superate. Il legame con le proteine plasmatiche è del 30-40%.
La clonidina viene escreta nel latte materno.
Metabolismo/eliminazione
Circa il 70% della dose somministrata viene escreto con l'urina principalmente sotto forma di sostanza madre inalterata (40-60% della dose). Il metabolita principale p-idrossi-clonidina è farmacologicamente inattivo.
La porzione fecale di escrezione è circa il 20% della quantità totale.
L'emivita di eliminazione terminale della clonidina è compresa nell'intervallo tra 5 e 25,5 ore.
La farmacocinetica della clonidina non è influenzata dal cibo o dall'appartenenza etnica del paziente.
Nei pazienti con normale funzionalità renale, l'effetto antipertensivo si ottiene a concentrazioni plasmatiche tra circa 0,2 e 2,0 ng/ml.
A concentrazioni plasmatiche superiori a 2,0 ng/ml, l'effetto antipertensivo è leggermente attenuato o diminuisce.
Cinetica di gruppi di pazienti speciali
Nei pazienti con funzionalità renale gravemente ridotta, l'emivita può essere estesa fino a 41 ore.
Dati preclinici
Studi di tossicità dopo dosi singole con clonidina sono stati condotti in varie specie animali dopo somministrazione orale o parenterale.
I valori approssimativi di LD50 orale erano 70 mg/kg (topo), 190 mg/kg (ratto), >15 mg/kg (cane) e 150 mg/kg (scimmie).
I valori di LD50 dopo somministrazione endovenosa variavano da 6 mg/kg (cane) a <21 mg/kg (ratto).
In studi di tossicità con somministrazione ripetuta per 18 mesi, la clonidina era ben tollerata nei ratti, nei cani e nelle scimmie.
In uno studio di 13 settimane sui ratti, il «No-Observed-Adverse-Effect Level» (NOAEL) dopo somministrazione sottocutanea era di 0,05 mg/kg.
Dopo somministrazione endovenosa, conigli e cani tolleravano 0,01 mg/kg/giorno rispettivamente per 5 e 4 settimane. Dosaggi più elevati hanno provocato iperattività, aggressività, diminuzione dell'assunzione di cibo e aumento di peso corporeo (ratto), sedazione (coniglio) o aumento del peso di cuore e fegato insieme ad un aumento del siero GPT, della fosfatasi alcalina e dei livelli di alfa-globulina nonché necrosi epatica focale (cane).
Non ci sono segni di potenziale teratogeno dopo somministrazione orale a topi, ratti e conigli, nonché dopo trattamento s.c. (ratto) e i.v. (coniglio). Nei ratti, è stato osservato un aumento del tasso di assorbimento ad una dose orale >0,015 mg/kg/giorno, ma a seconda della durata della somministrazione.
La fertilità nei ratti non è stata compromessa a dosi fino a 0,15 mg/kg. Dosi fino a 0,075 mg/kg non hanno avuto alcun effetto sullo sviluppo perinatale e postnatale della prole.
Non vi è stato alcun potenziale mutageno nel test di Ames e nel test del micronucleo sui topi. La clonidina non ha avuto alcun effetto neoplastico negli studi di cancerogenicità sui ratti.
Non è stato riscontrato alcun potenziale per irritazioni o sensibilizzazioni locali in cavie e conigli dopo somministrazioni i.v. e i.a.
Altre indicazioni
Incompatibilità
Non note. La soluzione iniettabile può essere mescolata solo con soluzione salina (si veda «Posologia/impiego»).
Stabilità
Il medicamento non deve essere utilizzato oltre la data indicata con «EXP» sul contenitore.
La soluzione iniettabile è destinata all'uso immediato, la soluzione inutilizzata deve essere scartata.
Indicazioni particolari concernenti l'immagazzinamento
La soluzione iniettabile deve essere conservata a temperatura ambiente (15-25 °C).
Le compresse non devono essere conservate al di sopra dei 30 °C.
Tenere il medicamento fuori della portata dei bambini.
Indicazioni per la manipolazione
Si veda «Posologia/impiego».
Numero dell'omologazione
38638, 33148 (Swissmedic)
Titolare dell’omologazione
CPS Cito Pharma Services GmbH, 8610 Uster
Stato dell'informazione
Luglio 2012
Composition
Principe actif: Clonidini hydrochloridum
Excipients:
Catapresan, solution injectable
Natrii chloridum, Aqua ad iniectabilia
Catapresan comprimés
Lactosum monohydricum, excipiens pro compresso
Forme pharmaceutique et quantité de principe actif par unité
Catapresan, solution injectable
1 ampoule (1 ml) contient: 150 mcg de chlorhydrate de clonidine.
Catapresan comprimés
1 comprimé (sécable) contient 150 mcg de chlorhydrate de clonidine.
Indications/Possibilités d’emploi
Hypertension artérielle
Pour le traitement de la crise hypertensive, il est conseillé de donner le Catapresan par voie parentérale lente en raison de son début d'action rapide.
Posologie/Mode d’emploi
Pour le confort du patient, on évitera toute baisse trop rapide de la pression artérielle en procédant par étapes, excepté en cas de crise hypertensive.
À l'arrêt du Catapresan, on réduira la dose progressivement sur plusieurs jours afin d'éviter tout phénomène de rebond.
Ampoules à 150 mcg/ml
L'administration sous-cutanée, intramusculaire ou intraveineuse (très lente) d'une ampoule de Catapresan à 150 mcg ne doit être pratiquée que sur le patient en décubitus. En i.v., l'ampoule sera diluée dans au moins 10 ml de solution physiologique de chlorure de sodium; l'injection prendra au moins 10 min. En perfusion i.v., la dose conseillée est de 0,2 mcg/kg/min, sans dépasser une vitesse de perfusion de 0,5 mcg/kg/min. Ces différentes limites sont impératives si l'on veut éviter dans les premières minutes de l'injection une montée transitoire de la pression artérielle systolique, qui peut être de l'ordre de 20 mm Hg.
On n'utilisera pas plus de 150 mcg (soit le contenu d'une ampoule) par perfusion.
Le cas échéant, l'administration parentérale d'une ampoule peut être répétée jusqu'à 4 fois par jour.
Comprimés à 150 mcg
Le traitement oral par Catapresan doit être instauré à faible dose, p.ex. ½ comprimé, de préférence le soir. Si une augmentation de la dose est jugée nécessaire, elle aura lieu au plus tôt au bout de 2-4 semaines.
Dans les hypertensions légères, une dose de 75-150 mcg par jour (½ comprimé le soir ou ½ comprimé matin et soir) sera souvent suffisante. Une augmentation progressive de la dose journalière au-delà de 450 mcg n'entraîne qu'exceptionnellement une baisse tensionnelle supplémentaire. Une dose journalière maximale de 900 mcg répartie en 3 prises sera réservée aux formes d'hypertension les plus sévères.
Mode d'emploi
Avaler les comprimés, sans les croquer, avec suffisamment d'eau.
Instructions spéciales pour le dosage
Utilisation chez l'enfant et l'adolescent
L'utilisation et la sécurité du Catapresan chez l'enfant et l'adolescent ne sont pas suffisamment confirmées par des études contrôlées randomisées. Par conséquent, l'emploi du Catapresan n'est pas recommandé chez ce groupe de patients.
Lors d'une utilisation hors AMM de la clonidine en association avec du méthylphénidate chez des enfants avec ADHS, on a en particulier observé la survenue d'effets indésirables graves, dont certains d'évolution fatale. C'est pourquoi l'administration concomitante de méthylphénidate et de clonidine n'est pas conseillée.
Insuffisance rénale
La posologie sera adaptée
•à la réaction antihypertensive individuelle, qui peut fortement varier d'un insuffisant rénal à l'autre
•au degré d'altération de la fonction rénale.
Une surveillance étroite s'impose. Une dialyse de routine n'extrayant qu'une quantité minime de clonidine, un apport de clonidine au terme de la dialyse n'est pas nécessaire.
Contre-indications
On n'utilisera pas de Catapresan en cas d'hypersensibilité connue au principe actif ou à d'autres constituants du médicament, ni chez le patient affecté d'une bradyarythmie sévère due soit à une maladie du nœud sinusal (sick sinus syndrome) ou à un bloc AV du 2e ou du 3e degré.
Mises en garde et précautions
Le traitement de l'hypertension artérielle requiert un suivi médical régulier.
On usera de prudence en administrant le Catapresan à des patients présentant une bradyarythmie légère ou modérée (p.ex. une bradycardie sinusale), des troubles de la circulation cérébrale ou périphérique, un syndrome de Raynaud, une thromboangéite oblitérante, une dépression, une polyneuropathie ou une constipation.
Dans les crises hypertensives dues à un phéochromocytome, on ne s'attendra pas à un effet antihypertenseur; le Catapresan ne renforce pas l'hypertension paroxystique en cas de phéochromocytome non identifié.
Chez l'insuffisant rénal, le traitement de l'hypertension artérielle et la stabilisation tensionnelle nécessitent une prudence particulière et des contrôles fréquents de la pression artérielle.
Comme pour tout antihypertenseur, on soumettra à une surveillance étroite les patients traités par Catapresan et présentant une insuffisance cardiaque ou une maladie coronarienne sévère.
On avertira le patient du risque que comporte un arrêt du traitement sans en être convenu avec le médecin. L'arrêt brusque du Catapresan au terme d'un traitement de longue durée à posologie élevée peut s'accompagner d'agitation, de palpitations, d'une poussée hypertensive, de nervosité, de tremblements, de céphalées ou de nausées. Si un arrêt s'avère nécessaire, on réduira donc progressivement la dose sur 2-4 jours.
S'il est nécessaire d'interrompre un traitement de longue durée par un bêta-bloquant, il est impératif d'arrêter d'abord le bêta-bloquant en diminuant la dose graduellement, puis la clonidine.
Il faut attirer l'attention des patients qui portent des lentilles de contact sur le fait que Catapresan peut diminuer la sécrétion lacrymale.
Les comprimés de Catapresan contiennent 34,25 mg de lactose monohydraté par comprimé, ce qui correspond à 205,5 mg de lactose monohydraté à la dose maximale journalière recommandée. Les patients présentant une intolérance héréditaire rare au galactose, par ex. une galactosémie, ne doivent pas prendre ce médicament.
Interactions
L'effet antihypertenseur du Catapresan peut être potentialisé par d'autres substances antihypertensives, ce qui peut présenter un avantage thérapeutique lors de l'emploi concomitant de telles substances – diurétiques, vasodilatateurs, bêta-bloquants, antagonistes du calcium et inhibiteurs de l'ECA. La prise simultanée de clonidine et de prazosine risque d'affaiblir l'effet de la clonidine ou en tout cas ne le majore pas. Les substances hypertensives et celles qui inhibent la natriurèse, les AINS par exemple, peuvent diminuer l'effet thérapeutique de la clonidine.
Les alpha2-bloquants tels que la phentolamine ou la tolazoline peuvent annuler de manière dose-dépendante les effets de la clonidine médiés par les récepteurs alpha2.
L'utilisation concomitante de substances d'action chronotrope ou dromotrope négative telles que les bêta-bloquants ou les glucosides digitaliques peut provoquer des bradyarythmies ou renforcer des bradyarythmies existantes.
On ne saurait exclure la possibilité que la prise simultanée de bêta-bloquants majore d'éventuels troubles vasculaires périphériques.
L'association de la clonidine et d'antidépresseurs tricycliques ou de neuroleptiques alpha-bloquants peut affaiblir, voire annuler l'effet antihypertenseur de la clonidine et entraîner des troubles de la régulation orthostatique ou même renforcer de tels troubles.
Des observations faites sur des alcooliques en phase de délirium tremens font supposer que des doses i.v. élevées de clonidine renforcent le potentiel arythmogène (allongement de l'espace Q-T, fibrillation ventriculaire) de doses i.v. élevées d'halopéridol. Ni la relation de cause à effet ni la signification clinique de cette supposition pour le traitement antihypertenseur n'ont pu être établies.
La clonidine peut majorer les effets des substances déprimant le système nerveux central et de l'alcool.
Grossesse/Allaitement
Grossesse
L'expérience acquise jusqu'ici concernant l'utilisation de la clonidine chez les femmes enceintes est limitée.
Catapresan ne devrait être pas utilisé pendant la grossesse, sauf en cas de nécessité.
Dans le cas où un traitement s'avère nécessaire, on surveillera attentivement la mère et l'enfant.
La clonidine traverse la barrière placentaire et peut réduire la fréquence cardiaque chez le fœtus. L'expérience acquise jusqu'ici concernant les effets à long terme d'une exposition prénatale est insuffisante. On donnera la préférence au mode d'administration per os du Catapresan en évitant l'administration i.v.
Les études précliniques n'ont pas permis de mettre en évidence des indications directes ou indirectes suggérant des effets négatifs sur la santé en relation avec une toxicité sur la reproduction (voir section «Données précliniques »).
Après la naissance, une augmentation passagère de la tension artérielle chez le nouveau-né n'est pas exclue.
Allaitement
Le principe actif passe dans le lait maternel. Les informations disponibles sur les effets chez le nouveau-né sont cependant insuffisantes. Catapresan ne doit donc pas être administré en période d'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude concernant les effets sur la capacité de conduire un véhicule ou d'utiliser une machine n'a été réalisée.
Il faut cependant informer les patients de la possibilité d'apparition d'effets indésirables comme des étourdissements, une sédation et des troubles de l'accommodation lors du traitement par Catapresan. C'est pourquoi la prudence est de mise lors de la conduite d'un véhicule ou de l'utilisation des machines. Si les effets indésirables mentionnés surviennent, le patient doit éviter toute activité potentiellement dangereuse comme la conduite automobile et l'utilisation de machines.
Effets indésirables
La survenue des effets indésirables relevés lors du traitement par Catapresan est dose-dépendante. Les symptômes suivants ont été observés surtout en début de traitement: sécheresse buccale, somnolence et sensations vertigineuses, qui tendent toutefois à s'estomper avec la durée du traitement en l'espace de 2 à 4 semaines.
Les effets indésirables suivants ont été observés lors de l'utilisation du Catapresan:
Définition des fréquences utilisées: très fréquent (>10%), fréquent (>1%, <10%), occasionnel (>0,1%, <1%), rare (<0,1%).
Troubles endocriniens
Rare: gynécomastie
Circulation sanguine et lymphatique
Rare: thrombocytopénie
Troubles du métabolisme et de la nutrition
Rare: augmentations transitoires de la glycémie
Fréquence non connue: gain de poids
Troubles psychiatriques
Fréquent : troubles du sommeil, dépression
Occasionnel : idées délirantes, hallucinations, cauchemars
Fréquence non connue: confusion, agitation, baisse de la libido, états anxieux, délires
Troubles du système nerveux
Très fréquent : sédation (50%), sensations vertigineuses (15%)
Fréquent: céphalées
Occasionnel: paresthésies
Troubles oculaires
Rare: diminution de la sécrétion lacrymale
Fréquence non connue: troubles de l'accommodation
Troubles cardiaques
Très fréquent: bradycardie sinusale
Rare: bloc auriculoventriculaire.
Fréquence non connue: palpitations et tachycardie, bradycardie, insuffisance cardiaque
Troubles vasculaires
Très fréquent : troubles orthostatiques, hypotension (15%)
Occasionnel : phénomène de Raynaud
Fréquence non connue: syncopes
Organes respiratoires
Rare: sécheresse de la muqueuse nasale
Troubles gastrointestinaux
Très fréquent: sécheresse buccale (44%)
Fréquent: constipation, nausées et vomissements, parotidite
Rare: pseudo-occlusion intestinale
Fréquence non connue: douleurs abdominales, anorexie
Troubles hépatobiliaires
Fréquent : légères anomalies transitoires des tests hépatiques fonctionnels (1%)
Troubles cutanés et du tissu sous-cutané
Occasionnel: prurit, éruptions cutanées, urticaire
Rare: alopécie
Fréquence non connue: œdème de Quincke
Troubles musculosquelettiques
Fréquence non connue: douleurs musculaires ou articulaires, crampes dans les jambes
Organes de reproduction et seins
Fréquent: dysfonction érectile
Troubles généraux
Fréquent: fatigue
Occasionnel: malaise
Fréquence non connue : symptômes de sevrage, pâleur, sensibilité accrue à l'alcool, fièvre
Investigations
Fréquence non connue: augmentation de la créatine kinase, faibles réactions positives au test de Coombs
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch
Surdosage
Symptômes
Les signes d'intoxication dus à la suppression générale de l'activité du système nerveux sympathique peuvent associer les réactions suivantes: chute tensionnelle, hypertension paradoxale (du fait de la stimulation des récepteurs alpha1 périphériques), bradycardie, léthargie, hypothermie, arythmies, somnolence jusqu'au coma, dépression respiratoire y compris apnée, contraction de la pupille, convulsions. Les symptômes se manifestent 30 à 60 min après l'ingestion et peuvent persister sur une durée de 36 à 48 h.
Traitement
Surveillance étroite et mesures d'ordre symptomatique. Un lavage gastrique n'a de sens que s'il sert à éliminer la partie non encore absorbée de la dose ingérée. Une dialyse n'augmente pas significativement l'élimination de la clonidine.
Propriétés/Effets
Code ATC: C02AC01
Catapresan est un antihypertenseur doté d'une large marge thérapeutique, qui se prête parfaitement à l'adaptation posologique individuelle. Catapresan abaisse la pression artérielle tant systolique que diastolique.
De par ses propriétés stimulantes sur les récepteurs alpha-adrénergiques, la clonidine agit essentiellement sur le système nerveux central, d'où une baisse du tonus sympathique et une diminution des résistances périphériques, des résistances vasculaires rénales, de la fréquence cardiaque et de la pression artérielle. Le flux plasmatique rénal et la filtration glomérulaire restent inchangés pour l'essentiel. Les réflexes de posture normaux sont préservés, ce qui fait que des symptômes orthostatiques se manifestent rarement et sont de faible amplitude. Durant un traitement au long cours, le débit cardiaque revient normalement aux paramètres de contrôle alors que les résistances périphériques restent diminuées. Chez la plupart des patients, on a observé un pouls ralenti sous clonidine; toutefois la préparation ne modifie pas la réaction hémodynamique normale aux mouvements du corps.
L'effet antihypertenseur est bien corrélé avec les taux plasmatiques situés entre 0,2 et 1,5 ng/ml chez les patients aux fonctions excrétoires intactes. Passé ce seuil, l'effet antihypertenseur est à peine majoré en règle générale. Chez le patient atteint d'une insuffisance rénale sévère et chez le dialysé, l'obtention d'une baisse tensionnelle peut nécessiter des concentrations plasmatiques allant jusqu'à 12 ng/ml.
Pharmacocinétique
Absorption
La pharmacocinétique de la clonidine est proportionnelle à la dose administrée dans la gamme des 75 à 300 mcg. La clonidine, qui est le principe actif du Catapresan, est bien absorbée après administration orale et soumise à un léger effet de premier passage.
Les concentrations plasmatiques maximales sont obtenues en l'espace de 1 à 3 h après une prise orale.
La prise de nourriture ou l'origine ethnique n'a aucune influence sur l'absorption de la clonidine.
Distribution
La diffusion tissulaire est étendue et rapide. Le Catapresan franchit les barrières hématoencéphalique et placentaire. La liaison aux protéines est de l'ordre de 30 à 40%.
La clonidine passe dans le lait maternel.
Métabolisme / Élimination
Env. 70% de la dose administrée est éliminé par voie urinaire essentiellement sous forme inchangée (40 – 60% de la dose). Le principal métabolite parahydroxy clonidine est pharmacologiquement inactif.
La proportion d'élimination dans les fèces est de l'ordre de 20% du total.
La demi-vie d'élimination terminale de la clonidine est comprise entre 5 et 25,5 h.
La pharmacocinétique de la clonidine n'est influencée ni par la prise de nourriture ni par l'origine ethnique du patient. Chez les patients avec une fonction rénale normale, l'effet antihypertenseur est atteint avec des concentrations plasmatiques entre 0,2 et 2,0 ng/ml environ. À des concentrations plasmatiques supérieures à 2,0 ng/ml, l'effet hypotenseur est légèrement affaibli ou diminué.
Cinétique pour certains groupes de patients
La demi-vie plasmatique peut se prolonger jusqu'à 41 h en cas d'insuffisance rénale sévère.
Données précliniques
Des études de toxicité après administration de doses uniques de clonidine ont été menées chez diffèrentes espèces animales après administration orale ou parentérale.
Les DL50 orales étaient d'env. 70 mg/kg chez la souris, 190 mg/kg chez le rat, > à 15 mg/kg chez le chien et d'env. 150 mg/kg chez le singe. La DL50 après administration i.v. s'est située entre 6 mg/kg chez le chien et <21 mg/kg chez le rat.
Dans des études de toxicité avec des doses orales répétées sur 18 mois, la clonidine a été bien supportée chez le rat, le chien et le singe.
Dans une étude menée sur 13 semaines chez des rats, le « No-Observed-Adverse-Effect Level » (NOAEL) était de 0,05 mg/kg après administration sous-cutanée.
Après administration intraveineuse, les chiens et les lapins ont toléré 0,01 mg/kg/jour pendant 4 et 5 semaines respectivement. Des doses plus élevées ont entraîné hyperactivité, agression, diminution de la prise de nourriture, augmentation du poids corporel (rat), sédation (lapin) ou augmentation pondérale du foie et du cœur avec élévation des SGPT, des phosphatases alcalines et des taux d'alpha-globuline ainsi que nécroses focales du foie (chien).
Aucun signe de potentiel tératogène n'est apparu après application orale chez la souris, le rat et le lapin ainsi qu'après administration s.c. (rat) et i.v. (lapin). Chez le rat, une augmentation du taux d'absorption a été observée à une dose orale >0,015 mg/kg/jour, en fonction de la durée de l'administration.
L'administration de doses allant jusqu'à 0,15 mg/kg n'a eu aucune conséquence sur la fertilité chez le rat. Des doses allant jusqu'à 0,075 mg/kg n'ont eu aucun effet sur le développement péri- et postnatal des descendants. Le test d'Ames et le test du micronucleus chez la souris n'ont mis en évidence aucun potentiel mutagène. Une étude de cancérogénicité chez le rat n'a pas entraîné d'effet néoplasique.
On n'a observé aucun potentiel d'irritations ou de sensibilisation locales chez le cobaye et le lapin après administration i.v. et i.a.
Remarques particulières
Incompatibilités
Aucune connue. La solution injectable ne doit être mélangée qu'avec une solution physiologique de chlorure de sodium (voir «Posologie/Mode d'emploi»).
Stabilité
Le médicament ne doit être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
La solution injectable est destinée à un usage immédiat, une solution non utilisée doit être jetée.
Remarques concernant le stockage
La solution injectable doit être conservée à température ambiante (15-25 °C).
Les comprimés ne doivent pas être conservés au-dessus de 30 °C.
Tenir hors de la portée des enfants.
Remarques concernant la manipulation
Voir «Posologie/Mode d'emploi».
Numéro d’autorisation
38'638, 33'148 (Swissmedic)
Titulaire de l’autorisation
CPS Cito Pharma Services GmbH, 8610 Uster
Mise à jour de l’information
Juillet 2012
Reviews (0)
Recently Viewed

Free consultation with an experienced pharmacist
Describe the symptoms or the right drug - we will help you choose its dosage or analogue, place an order with home delivery or just consult.
We are 14 pharmacists and 0 bots. We will always be in touch with you and will be able to communicate at any time.



 Deutsch
Deutsch French
French Italian
Italian